-
β-N-甲氨基-L-丙氨酸(β-N-methylamino-L-alanine, BMAA)是一种可由多种蓝藻产生[1]、具有慢性神经毒性的毒素. 毒性研究显示,BMAA可能与肌萎缩性侧索硬化症、阿尔茨海默氏病、帕金森综合症等神经系统退行性疾病有关[2]. 人体可以通过各种各样的形式暴露于BMAA,如食用被污染的水或食物、在受污染的水体中游泳、吸入受BMAA污染的气溶胶等. 随着全球日趋严重的水体富营养化现状,人们对藻毒素的研究逐渐增多,但大部分研究关注重点在微囊藻毒素,由于BMAA检测难度较高(包括多种同分异构体难分离、分子量较小易受各类基质影响、环境中多种赋存形态等)、环境浓度较低[3-4],目前对BMAA的研究非常有限. 本文拟通过对BMAA的检测方法、水环境及各类水产食物的检测水平等进行总结概述,以了解当前人群对BMAA的暴露风险.
-
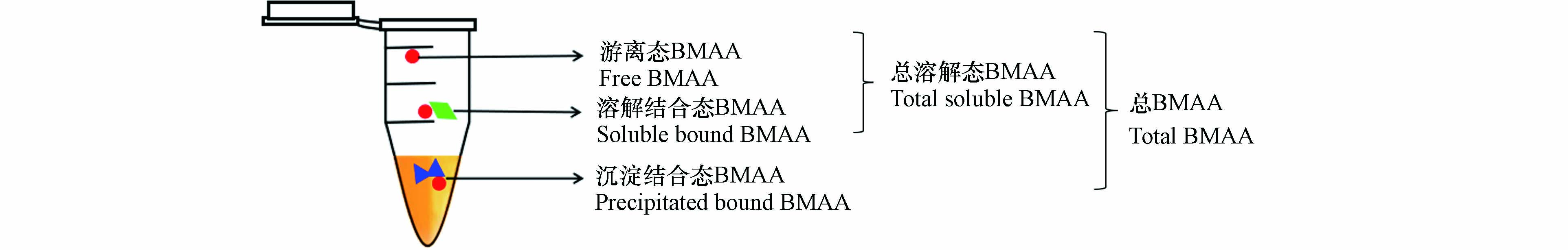
BMAA是一种非蛋白质氨基酸,其分子中含有羧基、一级胺和二级胺基团(图1),结构与人体必需的赖氨酸相似,分子式C4H10N2O2,相对分子质量为118.13 g·mol−1. BMAA极易溶于水,在环境中有明显的生物累积和生物学放大现象[5]. 目前,已在自然界中发现了多种BMAA的同分异构体,常见的有 2,4-二氨基丁酸(2,4-diaminobutyric acid, DAB)、N-2-氨乙基甘氨酸[N-(2-aminoethyl)glycine, AEG]、β-氨基-N-甲基丙氨酸(β-amino-N-methylalanine, BAMA)(图1). 其中,DAB是一种存在于许多原核和真核生物体内具有肝毒性和神经毒性的毒素,在许多生物样品中均与BMAA共存[6],其熔点、沸点及酸度系数均低于BMAA(表1);AEG是BMAA同分异构体中毒性最强的[7],可被肝脏大量吸收[8],具有肝毒性,其沸点和酸度与BMAA相近,但熔点更低;而BAMA的研究数据有限,仅有证据表明其同样具有神经毒性. BMAA在环境中以游离或结合形式存在,具体分为以下3种形态(图2):(1)以游离分子形式存在的游离态BMAA;(2)与短肽链结合存在的溶解结合态BMAA;(3)错误插入蛋白质中的沉淀结合态BMAA(也称为蛋白结合态BMAA).
其中,溶解结合态与游离态又称为总溶解态BMAA[9]. 由于不同形态的BMAA致神经毒性的作用通路存在差异(如游离态BMAA与重碳酸盐结合后是谷氨酸受体激动剂,可介导神经元变性[10-11];而结合态BMAA可能引起蛋白质的错误折叠从而造成蛋白质功能障碍,引起神经系统损害[12]),区分不同形态的BMAA的污染特征对其生态风险或人群健康风险评价都具有重要意义.
-
目前已报道的BMAA检测方法有高效液相色谱法[13](high performance liquid chromatography, HPLC)、气相色谱-质谱联用法[14](gas chromatograph-mass spectrometer, GC-MS)、液相色谱-串联质谱法[15](liquid chromatography tandem mass spectrometer, LC-MS/MS)等. GC-MS法是早期BMAA的检测方法,由于其前处理较为复杂,目前应用较少. HPLC分析法常与荧光检测器(Fluorescence detector, FLD)联用. 由于BMAA本身无荧光活性且是一种极性小分子化合物,因此在测定前需对BMAA进行衍生化处理,最常用的衍生剂是6-氨基喹啉基-N-羟基琥珀酰亚氨基甲酸酯(6-aminoquinolyl-N-hydroxysuccinimidyl carbamate, AQC)[16]. 然而,荧光检测的低特异性及与其他衍生物的共洗脱会造成BMAA的误鉴,可能导致定量结果的假阳性或浓度被高估[17]. 自2012年后,已少有研究采用HPLC法和GC-MS法分析样本中的BMAA,多采用LC-MS/MS法. LC-MS/MS法通过保留时间、前体离子质荷比、产物离子质荷比和产物离子丰度比[17]的4个指标来定性,是目前分析各类样品中BMAA毒素及其同分异构体最常用的方法. 如表2所示,LC-MS/MS法根据是否使用衍生剂可进一步分为AQC衍生法和直接分析法. 其中,AQC衍生法因其能够检测复杂样品基质中的低浓度BMAA及其同分异构体,同时具有较高选择性而应用更为广泛. 基于LC-MS/MS的AQC衍生法的方法检出限一般比直接进样法低3—5倍,比HPLC-FLD等方法低10倍以上[18]. 经AQC衍生的LC-MS/MS法是美国分析化学家协会(Association of Official Analytical Chemists, AOAC)认可的唯一经过验证的方法. BMAA同分异构体与BMAA结构非常类似,因而可以检测BMAA的方法均可同时测定BMAA及其同分异构体. 近年的研究多同时分析BMAA和DAB、AEG、BAMA的3种同分异构体[19-27](表2). 研究发现色谱柱的选择和洗脱梯度的设定对BMAA及其同分异构体的分离度起决定作用:BAMA常与BMAA共洗脱,二者分离难度较高;DAB与AEG能与BMAA实现较好的色谱分离[28],但易产生相互干扰. 值的注意的是,有些早期文献仅检测了BMAA[29-31],不排除存在高估BMAA浓度的可能性.
基于LC-MS/MS仪器方法,目前已有文献报道了水体、藻类、海产品等样品中BMAA的前处理方法[21、32-34]. 在这些文献中,通常采用固相萃取法进行水样的富集或基质的净化. 其中,最常用的固相萃取小柱是Oasis MCX小柱,该小柱对BMAA的回收率接近100%[15];也有采用HLB和PCX小柱的报道,但应用很少[35]. 如前文所述,区分BMAA的不同赋存形态对于了解其污染特征及风险评价具有重要意义,因此,许多研究在相关方面进行了探索. BMAA三种赋存形态的分离主要借助三氯乙酸(Trichloroacetic acid, TCA)提取、盐酸水解实现,主要报道的形态(见图2)包括:(1)游离态BMAA:TCA提取后的上清液,直接进行BMAA测定;(2)总溶解态BMAA:TCA提取液经盐酸水解后的上清液,进行后续测定;(3)沉淀结合态BMAA:TCA提取后的沉淀经盐酸水解进行后续处理;(4)总BMAA:样品直接经盐酸水解后,进行BMAA测定. 经过以上形态分离的样品,后续可采用MCX小柱等固相萃取方法进行进一步净化,并根据仪器方法要求,可直接上机分析或进行AQC衍生后再进行上机分析[36]. 其中,单独测定总溶解态BMAA的研究相对较少[37]. BMAA同分异构体各形态分析的前处理方法与BMAA基本一致.
-
在国外水体中BMAA的报道屡见不鲜:Lage等[29]在瑞典芬妮湖水中检出了2—6 μg·L−1的总BMAA;Combes等[38]在法国塞纳河水样中检测到2—13.5 μg·L−1的游离态BMAA;Al-Sammak等[39]在美国内布拉斯加州的7个水库水中检测到了BMAA和DAB,其中,柯克曼湾水样中的BMAA浓度(游离态和沉淀结合态BMAA)高达25.3 μg·L−1,而柳溪镇水样中DAB浓度高达21.1 μg·L−1. 即使在远离海洋和湖泊的沙漠地区的水样中,BMAA也有检出. Craighead等[40]在蒙古国内戈壁沙漠的饮用水和浅水水洼中检出了BMAA和DAB,其中,DAB(100%)的检出率显著高于BMAA(55.6%). 作为BMAA毒素的主要“生产者”,藻类中BMAA的报道更加广泛. 波罗的海的藻类中游离态和沉淀结合态BMAA的浓度分别为0.0097—0.7025 μg·g−1和0.008—2.58 μg·g−1[30];葡萄牙河口的藻类样本中游离态和沉淀结合态BMAA浓度分别为0.04—8 μg·g−1和2—63 μg·g−1,这是首次在河口处报道BMAA毒素的存在[31]. Faassen等[41]在荷兰21个城市采集的藻类浮渣中,有9个地区的样本中检出了游离态BMAA,浓度为4—42 μg·g−1;2个地区的样品中检出了1 μg·g−1和4 μg·g−1的DAB. 英国1990—2004年间采集的12种藻类样品中BMAA(游离态和沉淀结合态)的检出浓度为8—287 μg·g−1[42];值得注意的是,其中5个检出了BMAA毒素的水体发生了动物接触后死亡事件,虽未证明BMAA是其直接死因,但仍不能忽视BMAA可能带来的健康风险. 此外,Roy-Lachapelle等[43]采集了加拿大5个湖泊中的藻类样品,分别在4个湖泊中检出了BMAA(10—300 μg·g−1),4个湖泊中检出了DAB(8—40 μg·g−1),以及在3个湖泊中检出了AEG(9—80 μg·g−1). 可见,BMAA及其同分异构体在水环境中的污染状况在不同国家和地区不尽相同,但都存在一定程度上的污染.
目前关于我国水环境中BMAA检出情况的报道如表3所示,已有的调查表明我国水环境中BMAA的污染情况并不乐观. 闫博引等[35]在全国14个地区调查了不同水体(海水、湖泊水、水库水)中BMAA的污染情况,其结果显示:水库水样中均未发现BMAA的存在;青岛海域、厦门海域水样中BMAA疑似存在,但无法准确定量(<0.01 μg·g−1);而在观赏性湖泊水样中,BMAA的检出率高达70%,表明我国水环境中存在BMAA污染的风险,且水质较差的景观湖污染风险最大. Cao等[32]在太湖水样中检出了0.23 μg·L−1的BMAA和0.002 μg·L−1左右的DAB. 顾笑笑等[44]在湖州市淡水混和养殖池塘的水体和底泥中分别检测到3.081—3.203 μg·L−1和0.681—0.711 μg·g−1的BMAA,表明在淡水养殖环境中也存在BMAA的污染. Wang等[45]在青岛胶州湾浮游植物中检测到0.03—1.00 μg·g−1的BMAA和0.01—0.48 μg·g−1的DAB,同时发现浮游植物中BMAA的浓度存在季节性变化. 此外,作为藻华无公害处理的产物—蓝藻有机肥中也被检出数量可观的BMAA毒素(游离态BMAA:1.8—16.3 μg·g−1、结合态BMAA:3.43—13.67 μg·g−1)[46].
-
由于水环境中存在广泛的BMAA污染,水产品也无法避免地受到污染. 相较于水体和藻类,水产品中BMAA主要检测游离态和沉淀结合态,检出品种包括滤食性软体动物、甲壳动物和鱼类等. 斯德哥尔摩市售的贻贝、生蚝和虾样品中总BMAA的检出浓度为0.08—0.90 μg·g−1[47];法国肖泻湖的贻贝样品中BMAA(游离态和总BMAA)、AEG、DAB的检出率分别为47%、91.2%、100%[48];波罗的海的贻贝中总BMAA的浓度范围为0.63—1.6 μg·g−1[49];南非水库的鱼类中BMAA(游离态和沉淀结合态BMAA)的检出浓度为1.63—3.055 μg·g−1[50];Christensen[51]在美国东南部地区的螃蟹样品中检出4.7—14.1 μg·g−1的总BMAA. 此外,Field等[52]在调查美国马里兰州安纳波利斯的3名肌萎缩侧索硬化症(Amyotrophic Lateral Sclerosis, ALS)患者的发病原因时,发现3人均食用了当地切萨皮克湾的青蟹,而在切萨皮克湾青蟹的蟹钳样品中均检测到了浓度高达115.2 μg·g−1的总BMAA和72.7 μg·g−1的DAB,提示BMAA毒素及其同分异构体可能是ALS发病的危险因素. 我国的水产品中也有BMAA检出的相关报道(表4):陈咏梅等[53]在武汉官桥湖水华爆发期间检出了鱼体内的BMAA残留,平均含量为(0.32±0.317) μg·g−1;Wu等[54]调查了太湖流域6种淡水养殖产品可食用部分BMAA的浓度范围为0.28—5.47 μg·g−1;顾笑笑等[44]在研究湖州市水华严重的淡水养殖池塘中水产的污染状况时发现软体动物、甲壳动物、鱼类中均可检出BMAA,其含量分别为0.528—1.065 μg·g−1、0.456—0.555 μg·g−1、0.358—0.494 μg·g−1;Li等[55]在中国东海、黄海海域的扁玉螺中检测到0.86—3.97 μg·g−1的BMAA和0.21—0.40 μg·g−1的DAB.
更值得关注的是,BMAA具有生物富集和生物放大的特性,营养级别高的水产品一旦被污染,将大大增加人群对BMAA的食用风险. 王超等[56]在黄海海域比较了不同营养级生物—浮游植物、浮游动物、软体动物和节肢动物体内BMAA的含量,发现BMAA浓度沿食物链:浮游植物(0.1 μg·g−1)—浮游动物(1 μg·g−1)—软体动物(3.5 μg·g−1)—节肢动物(12 μg·g−1)逐级升高,生物富集和生物放大效应明显. Jiao等[5]通过监测太湖贡湖湾不同营养级生物中的BMAA浓度,发现软体动物、甲壳类动物和鱼类的BMAA平均水平分别达到3.21、3.76、6.05 μg·g−1;而含量最高的是营养层次较高的翘嘴红鮊. 多项关于鲨鱼产品的调查结果显示,鲨鱼中BMAA残留极高:太平洋和大西洋鲨鱼鱼鳍和肌肉样本中,总BMAA浓度范围为34—2011 μg·g−1[57];美国南佛罗里达州的7种市售鱼翅中总BMAA检出浓度为144—1836 μg·g−1[58],市售的94%的鲨鱼软骨粉(15/16)中检出了75—352 μg·g−1的总BMAA,16种软骨粉中均检出DAB(69—1483 μg·g−1)和AEG(1298—1729 μg·g−1)[59]. 由此可见,营养级别越高的水产品中BMAA的食用风险越高,应引起人们的高度关注.
-
近年来,藻类相关产品因其广泛的药用价值和丰富的营养价值受到人们的青睐,螺旋藻衍生的一系列保健品已在70多个国家和地区进行销售[61]. 但据研究显示,相关产品的藻类来源可能被BMAA污染:加拿大的4种市售螺旋藻蛋白粉样品中BMAA、DAB和AEG均可检出,浓度分别为0.13—0.74 μg·g−1、9.32—107.06 μg·g−1和0.14—6.48 μg·g−1[26];美国18种市售藻类膳食补充剂中有2种检出0.04 μg·g−1和0.55 μg·g−1的总BMAA[62];德国33种藻类膳食补充剂中有1种检出了0.08 μg·g−1的DAB[63]. 藻类保健品的健康效应数据来源多是体外实验或实验动物,缺乏人体临床试验,不具有普遍性;且藻类保健品生产行业大多是自我管理,存在低估藻类保健品带来健康风险的可能性. 樊华等[64]分析了我国市面上11个较流通品牌的螺旋藻制剂,结果显示均含有0.004—0.02 μg·g−1游离态的DAB,但还未见有关于藻类保健品中BMAA毒素检出的报道,在该方面存在较大的研究空白.
-
相比于微囊藻毒素和贝类毒素,目前关于BMAA的基础研究相对较少,因此,目前仍无官方的健康指导值或限量要求. 世界卫生组织(World Health Organization, WHO)目前仅对蓝藻毒素中的微囊藻毒素等个别毒素提出了限量标准,如MC-LR的每日容许摄入量为0.04 μg·kg−1[65],食用贝类中石房蛤毒素的允许浓度为80 μg·100 g−1新鲜组织[66]. 已有学者试图建立水产品中BMAA的安全摄入标准限值(Guideline Values, GVs). Wu等[54]依据美国环保署(Environmental Protection Agency, EPA)提出的健康风险评价方法,以大鼠幼崽纹状体神经肽系统发生变化作为毒性终点[67],并结合我国藻类污染现状提出了水产品中BMAA的建议GVs限值为7.2 μg·g−1干重(成人)和1.8 μg·g−1干重(儿童). 顾笑笑等[44]则参照美国国家科学院(National Academy of Sciences, NAS)提出的健康风险评价方法,采用猕猴出现皮质神经功能障碍、帕金森特征及行为异常作为毒性终点[2],提出水产品中BMAA的GVs值为12 μg·g−1干重(成人)和3 μg·g−1干重(儿童). 值得注意的是,这两项研究中均采用100 g·d−1干重作为人群对水产品的平均消费量. 通过查阅资料[68]发现,2013—2020年我国居民人均水产品消费量从28.5 g·d−1湿重增加到38.1 g·d−1湿重,平均每年以0.47的速度增长. 考虑水产品中含水量一般为70%—80%,取25%作为干湿重的比值[69],我国居民人均水产品消费量仅为7.1—9.5 g·d−1干重,远低于两篇文献中的取值. 基于此消费数据重新估算水产品中BMAA的GVs值,分别为:成人为75.6—101.1 μg·g−1干重,儿童为18.9—25.3 μg·g−1干重(采用Wu计算方法);成人为126—168.5 μg·g−1干重,儿童为42—56.2 μg·g−1干重(采用顾笑笑计算方法). 考虑到我国不同地区人群对水产品消费的巨大差异,我们进一步采用我国水产品消费量最大的海南省的消费数据进行估算. 2015—2020年海南省人均水产消费量[68]为17.5—21.6 g·d−1干重,则两种方法估算的BMAA的GVs值分别为:成人33.3 μg·g−1干重和55.4 μg·g−1干重,儿童8.3 μg·g−1干重和18.5 μg·g−1干重. 鉴于我国近年来人均水产消费量逐年递增的现象,应根据实际情况,及时修正BMAA的健康指导值.
-
综上所述,作为一种具有慢性神经毒性的蓝藻毒素,BMAA在国内外水环境、水产品以及藻类保健品中被广泛检出;尤其是在营养级别较高的水生生物体内的残留高达mg·g−1级别,严重威胁人群的身体健康. 作为一个湖泊众多、水产业兴旺、且水体富营养化严重的国家,我国目前对于相关环境及产品中BMAA的调查研究还非常有限;在分析检测方法上还有许多的提升空间;对这类物质的毒性异构体的关注不够等等.
在未来,应对BMAA毒素及其同分异构体展开以下两方面的研究,以期全面了解我国BMAA毒素的污染现状:(1)开发更加可靠、具有选择性的分析方法来检测我国环境中BMAA毒素的暴露水平和污染程度,以评估与BMAA暴露相关的公共健康风险,减少对人类健康的潜在影响. (2)全面对BMAA赋存状态进行分析研究,得到所检测物质中准确的BMAA毒素含量,为生态风险评估工作提供基础理论依据.
水环境和水产品中β-N-甲氨基-L-丙氨酸(BMAA)检测方法和检出情况的研究进展
Research progress on detection methods and detection levels of β-N-methylamino-L-alanine (BMAA) in water environment and aquatic samples
-
摘要: 本文对蓝藻毒素β-N-甲氨基-L-丙氨酸(β-N-methylamino-L-alanine, BMAA)的结构形态、检测方法、环境和食物中的检出情况等方面进行系统综述. 研究结果表明,BMAA主要存在3种赋存形态(游离态、溶解结合态、沉淀结合态);环境和食物中的BMAA类目前主要采用经过AQC衍生的LC-MS/MS法检测,样品需经形态分离后、采用MCX固相萃取小柱处理. 水环境、水产品和藻类保健品中BMAA类的污染已被大量报道. 亚洲、北美洲、欧洲的相关环境和食物中均有一定的检出(检出浓度:水样<0.01—25.3 μg·L-1;藻类<0.01—300 μg·g-1;非鲨鱼水产品中0.08—115.3 μg·g-1;藻类保健品中0.04—0.73 μg·g-1). BMAA存在生物积累和生物放大的现象,水产品中营养级别越高的生物检出浓度就越高,如鲨鱼类产品中检出浓度高达34—2011 μg·g-1,需要引起重视. 我国目前对BMAA的相关研究还很有限,未来应加强检测方法、现场调查、风险评估等相关方面的研究,以全面了解我国人群对BMAA类物质的暴露风险.
-
关键词:
- β-N-甲氨基-L-丙氨酸(BMAA) /
- LC-MS/MS /
- 水环境 /
- 水产品 /
- 藻类产品.
Abstract: This paper systematically reviewed the structure, morphology, detection methods, environment and the level of β-N-methylamino-L-alanine (BMAA) in environment and food samples. The results show that BMAA mainly exists in three forms, including free BMAA, soluble bound BMAA, and precipitated bound BMAA. Currently, BMAAs in the environment and food are mainly detected by the AQC-derived LC-MS/MS method. The samples need to be morphologically separated and processed with MCX solid phase extraction cartridges. The contamination of BMAA has been reported in the water environment, aquatic products and algae health products in Asia, North America and Europe, with the detectable concentrations of < 0.01—25.3 μg·L-1 in water samples , < 0.01—300 μg·g-1 in algae samples, 0.08—115.3 μg·g-1 in non-shark aquatic products and 0.04—0.73 μg·g-1 in algal health products. Due to the bioaccumulation and biomagnification of BMAA, the aquatic products with higher nutrient levels showed higher concentrations. For example, the BMAA levels reported in the shark products were up to 34—2011 μg·g-1. Therefore, more attentions should be paid to these animals. At present, the relevant researches on BMAA in our country are very limited. More efforts should be made in analytical method development, on-site investigation and risk assessments to comprehensively assess the exposure risk of Chinese population to BMAAs. -
大气环境颗粒物中的铬(Cr)主要以三价铬(Cr(Ⅲ))和六价铬(Cr(Ⅵ))2种价态存在。Cr(Ⅲ)是人体进行糖类和脂类等代谢活动必不可少的微量物质;Cr(Ⅵ)则是剧毒物质,具有致癌性。1990年,美国的《清洁空气法》将Cr(Ⅵ)化合物列入188种有害空气污染物,美国环境保护局也将其列入18种核心污染物[1]。我国的《环境空气质量标准》规定其年平均浓度限值为25 pg·m−3[2]。近年来,相关学者围绕Cr这种环境颗粒物中重要的有害过渡金属[3-5],展开了Cr的污染特征和来源解析、潜在生物危害和健康风险评估以及在环境中可能存在的化学作用等[6-9]方面的研究。
大气颗粒物产生化学过程往往只持续较短时间(大约几个小时)。切实模拟和研究其产生、传输、消耗的动态过程,需要在该时间精度内进行分析测定[10-11]。在高时空分辨率背景下,研究大气化学过程中过渡金属的污染特征,可为探索此类气溶胶的理化特性、并控制其潜在毒性提供重要见解。建立灵敏而可靠的测量方法需要解决3个问题:1)如何提高测量的灵敏度(达到更低的检测限);2)如何降低测量过程中的潜在干扰;3)如何在处理和测量过程中降低样品中待测物质的损失。目前,多数研究者倾向于使用原子吸收光谱技术测定样品中的总Cr,包括火焰原子吸收光谱法(FAAS)、石墨炉原子吸收光谱法、电热原子吸收光谱法(ET-AAS)等[12-13]。但是,此类方法的样品前处理较为繁琐,所需仪器设备造价昂贵。紫外/可见光分光光度法(UV/Vis)灵敏度很高,通过适当的显色试剂进行络合反应可在高吸收率条件下测量水溶性金属,常被用于溶液中金属浓度的高精度测量[14-15]。以此为基础,可通过配备长光液体波导毛细管来实现UV/Vis定量测定环境样品中的水溶性金属[16-17],结合测量系统的开发,还能有序测量环境颗粒物样品中的金属浓度[18-19]。
结合采样和前处理操作,设计并评估了一种基于分光光度法连续测量大气环境细颗粒物(PM2.5)中铬浓度的系统,以便于精确了解大气颗粒物中铬的污染水平及其来源,提供一种测量环境大气中水溶性痕量金属的思路,以期为开发实际监测技术奠定基础。
1. 材料与方法
1.1 试剂标准
实验所需化学药品纯度至少为光谱纯,配制的试剂和溶液使用由纯水机(Smart-DUV(F) SAIDE)生产(电阻率不低于18.2 MΩ)的超纯水和去离子水。用于试剂配制的实验器材和试剂保存的聚丙烯瓶在使用前均先用浓度为4 mol·L−1的HCl进行清洗,然后用超纯水反复冲洗干净后烘干置于干净环境中备用。
用于标定和校准的Cr(Ⅵ)标准溶液通过用重铬酸钾(K2Cr2O7,纯度为99.9%)和去离子水制备的100 μg·m−3母液稀释获得,在使用前取母液用去离子水稀释到需要的浓度梯度(0.5~8 ng·mL−1)。制备4 mol·L−1的HNO3和3 mol·L−1的NaOH用于酸化和调整溶液pH。用于前处理过程的0.1%的H2O2试剂通过用0.1 mol·L−1的NaOH溶液将0.044 mL 30%的H2O2水溶液定容稀释至1 L制备。将167 mg的二苯碳酰二肼(diphenylcarbazide,DPC)溶解于100 mL的丙酮(C3H6O,纯度为99.9%)中,再与1.67%的H2SO4溶液按照1∶1的体积比混合,制备用于光度法检测前络合反应的DPC试剂[16]。除Cr(Ⅵ)标准溶液,所有的试剂均不含铬。
1.2 样品采集与预处理
用中流量颗粒物采样器(XY-2200,青岛旭宇)通过石英膜(QMA-Whatman,20.3 cm
× 25.4 cm,Φ90 mm)采集环境大气细颗粒物(PM2.5),采样流速100 L·min−1。为降低膜上Cr的本底浓度并减少其在采样中的损失,在采样前将待采样的空白石英膜通过450 ℃高温烘烤6 h,再用2 g·L−1的NaHCO3溶液浸泡后置于清洁恒温箱内晾干密封。采样口距离地面150 cm,用除湿装置保证过程中采样器的环境干燥。样品膜用密封的聚丙烯袋封装并且在-10 ℃下低温保存。所有的样品在采样完成1 d内取回,在3 d内完成前处理和分析测定,以此减少采样过程中Cr的损失,减少测量误差。1.3 分光光度法检测系统及误差避免方法
分光光度检测系统由容量为112 μL、光程为50 cm的长光程流通池(liquid waveguide capillary cell,LWCC,LWCC-3050, World Precision Instruments, Inc., Sarasota, FL),钨灯光源(HL-2000-FHSA-LL,Ocean Optics, Inc., Dunedin, FL),光缆(QP450-1-XSR, Ocean Optics, Inc., Dunedin, FL)和光谱范围为200~900 nm的小型光谱仪(USB4000-UV-VIS,Ocean Optics, Inc., Dunedin, FL)组成。
分析过程中,Cr浓度由Cr(Ⅵ)与DPC反应产生的络合物在540 nm的吸光度进行测算。尽管DPC与大气环境中部分金属离子(Fe3+、Hg2+、Mo6+、Cu2+和V5+)会发生类似络合反应,但这些金属络合物的最大光吸收波长范围均不含540 nm,且相差较大[6]。因此,检测前加入DPC可保证结果基本不受其他金属离子干扰。设定光谱的积分时间为8 ms,每个样品平均次数为20次,光吸收谱图上800 nm处吸光度信号用于设定基线(即设定系统背景信号)。为去除检测仪器自身产生的背景吸光度,通过断开光源测得仪器的暗光谱,并在光谱分析软件中设定扣除暗光谱得到实测光谱数据,以便对系统进行自吸收校正。
1.4 系统运行流程
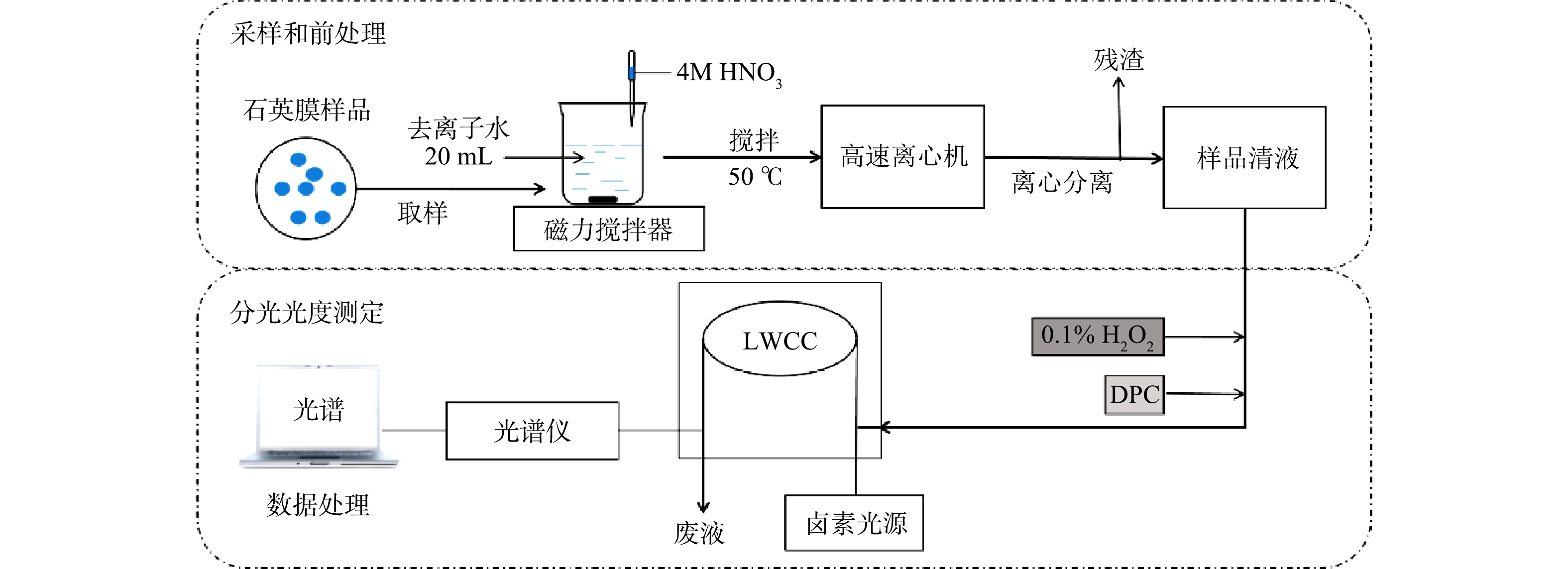
系统分为2个部分(见图1):石英膜采样和前处理操作的样品采集模块;以分光光度检测为基础的浓度分析模块。将采样后的石英膜用清洁陶瓷剪刀取样、剪碎,放入烧杯后加入20 mL的去离子水和1 mL浓度为4 mol·L−1的HNO3溶液。为尽可能溶解石英膜上采集的环境颗粒物,用磁力搅拌机将石英膜制成的酸化浆液加热(温度为50 ℃)搅拌40 min,分离出10 mL样品清液,装入棕色聚丙烯瓶中避光储存。每次测量后,用4 mol·L−1的HCl溶液清洗所有样品管路,再用超纯水洗净。
分光光度方法测定样品中的Cr浓度:1)络合反应。向样品溶液中加入0.1 mL 0.1%的H2O2试剂将样品溶液中的Cr(Ⅲ)转化为Cr(Ⅵ),同时加入0.1 mL的DPC试剂,静置10 min,待Cr络合物形成并稳定;2)样品注入。用带0.22 μm微孔滤膜(聚四氟乙烯,PTFE)的聚丙烯注射器将1 mL样品注入LWCC中;3)测定浓度。通入样品2~3 min后,待光谱稳定,得到光吸收谱图上540 nm处Cr络合物的最大吸收峰值,将该值扣减设定的800 nm基线值得出净峰高,并通过与标定结果的对比计算得出总Cr浓度。
1.5 采样点
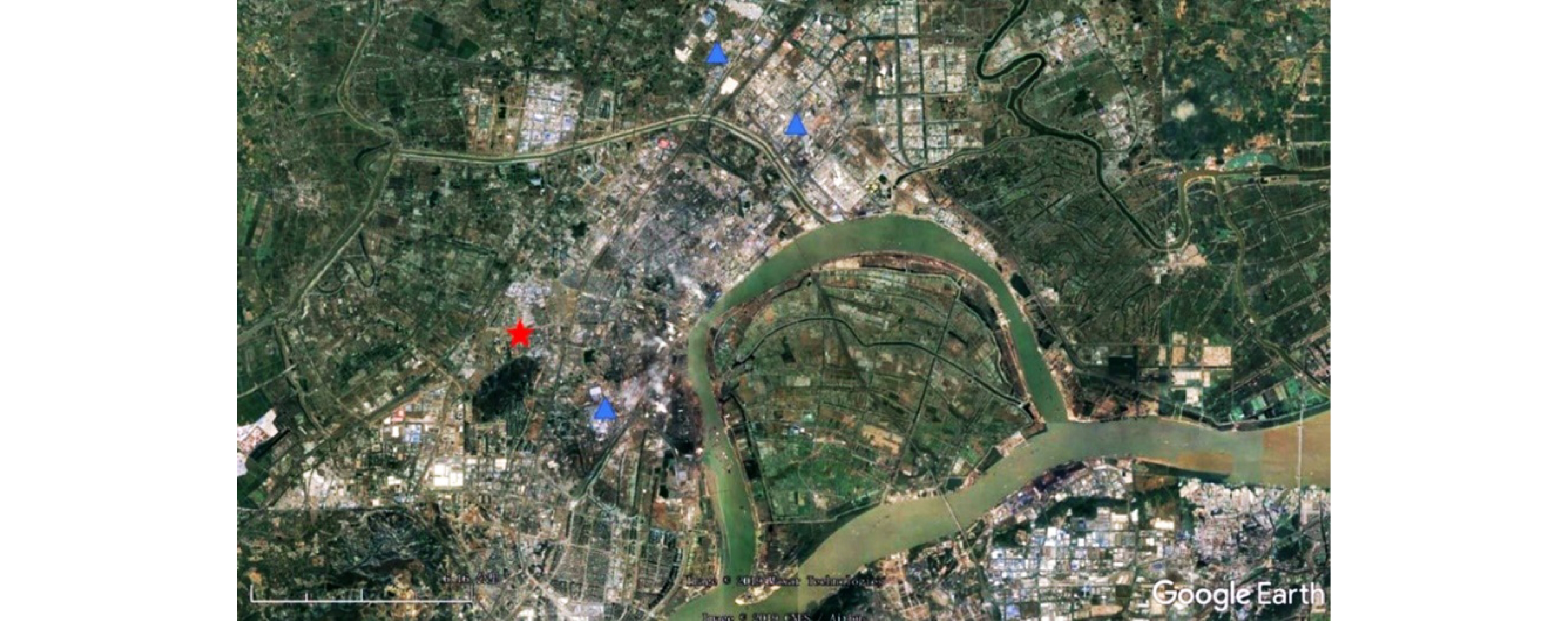
采样点设在南京信息工程大学气象观测场内,按12 h的时间间隔采集南京北郊大气颗粒物样品。设定样品采集的起始时间为每日6:30和18:30。采样点(红色星标)位于南京市中心以北大约15 km处,大型工业区(蓝色三角标)以西,靠近城区日常交通干道(见图2)。该地的PM2.5质量浓度数据由Met One Instruments公司的PM2.5在线监测仪进行实时在线监测,时间分辨率为1 h。
2. 结果与讨论
2.1 最佳样品测定条件的设定
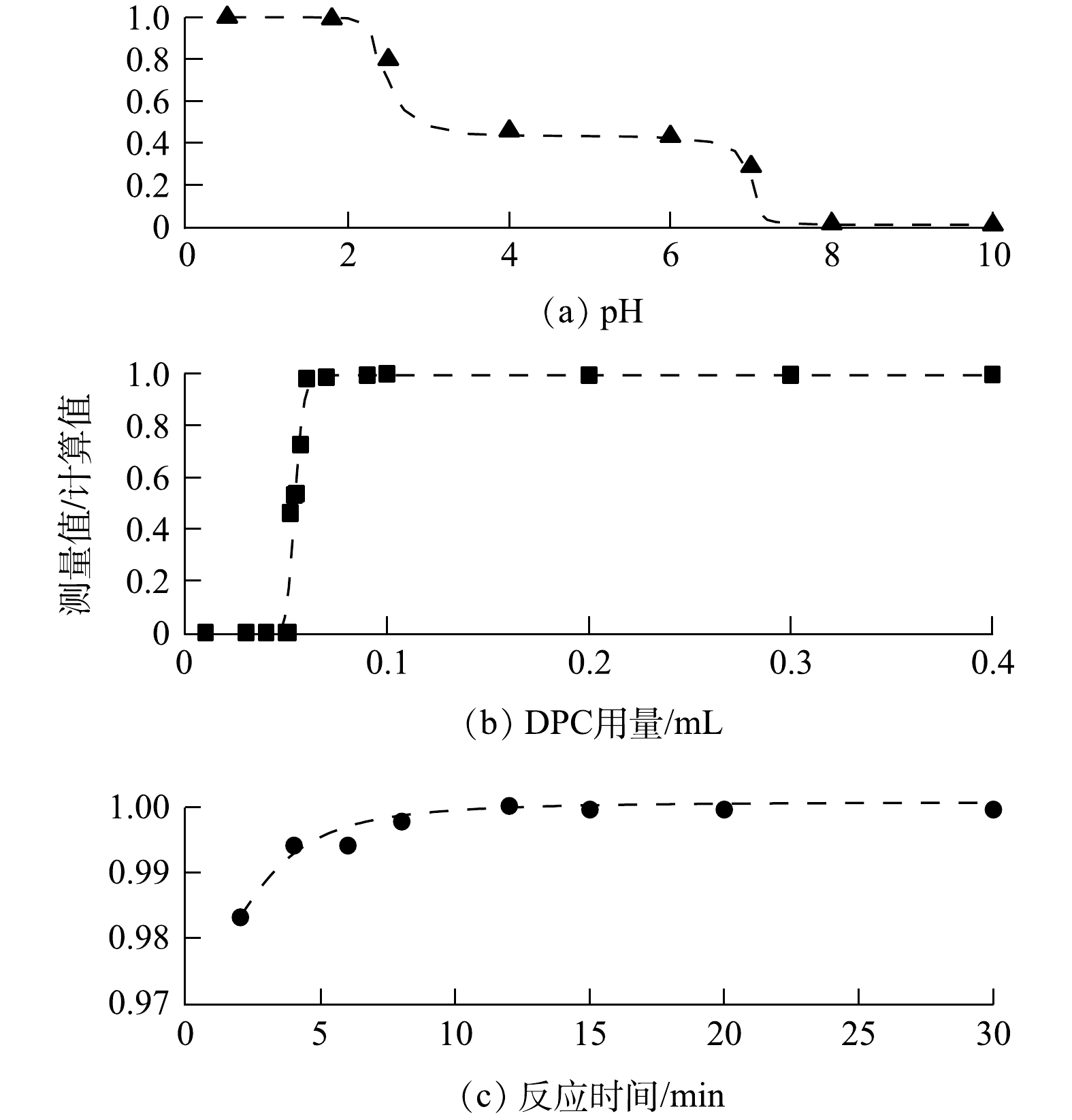
由于大气本底Cr浓度较低,每次取用10 mL浓度为5 ng·mL−1的Cr(Ⅵ)标准溶液进行条件实验。通过改变溶液的pH、DPC试剂的用量及预留的络合反应时间,根据条件实验结果来确定前述各项参数的最佳值或阈值。将仪器的测量值与标准样品浓度的计算值之比作为判别标准,比值越接近1,则结果对应的条件和参数更优。
在酸性环境下,Cr(Ⅵ)与DPC络合的效率随溶液pH的升高而降低,导致测定结果偏低;在碱性环境下,Cr(Ⅵ)无法发生络合反应。因此,需要对溶液体系进行酸化。按体积比加入去离子水和HNO3溶液,得到混合浆液的pH约为0.5。用3 mol·L−1 NaOH溶液调节混合浆液pH,结果如图3(a)所示。加入DPC的Cr络合物反应后溶液的最佳pH为0.5~1,故在前处理中无需调节溶液pH。溶液中过量的氧化剂H2O2将Cr(Ⅲ)氧化成Cr(Ⅵ)后,会优先和DPC发生反应,干扰Cr络合物的生成。DPC试剂的用量为0.1 mL时,可去除过量H2O2的干扰(见图3(b))。同时,所有试剂加入后静置10 min以保证溶液中的Cr络合物完全产生(见图3(c))。
2.2 标定曲线和检测限
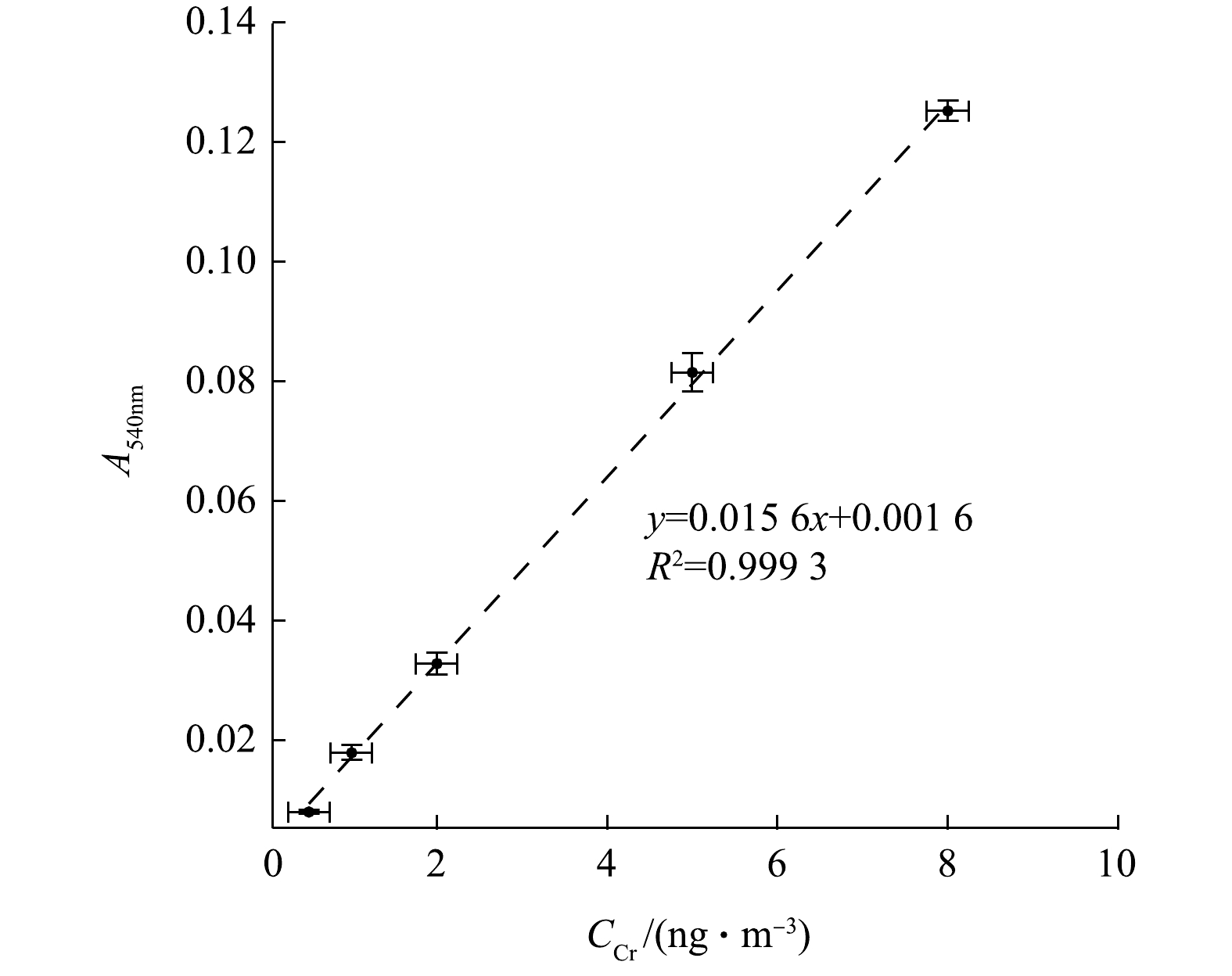
根据实际环境大气颗粒物中总Cr浓度,选择合适浓度梯度(0.5、1、2、5、8 ng·mL−1)的Cr(Ⅵ)标准溶液确定标准曲线。每次标定使用相同Cr(Ⅵ)母液,用去离子水稀释至所需浓度。图4为14 d内不同时间进行的5次标定结果的平均值,相同浓度的多次测定值范围以error bar形式在图中标出。几次标定得到的线性方程斜率在(0.015 6±0.000 2)mL·ng−1范围变化,并且所有标定曲线的R2均能达到0.99。系统分光光度测量的标定范围涵盖了一般环境大气颗粒物中Cr浓度范围。Cr浓度与其络合物的吸光度峰值呈稳定线性关系,多次标定反映出该结果重现性好。
根据空白样品吸光度峰值标准偏差的3倍来测算系统的检测限(limit of detection,LOD)。空白样品由空白石英膜按照样品的前处理过程制得。将加入DPC的空白样品通入LWCC测量吸光度峰值,LOD约为0.158 ng·mL−1,对应采样空气体积约为12 m−3。经过计算对应的环境颗粒物中Cr浓度为0.133 ng·m−3,大气颗粒物中Cr浓度至少比该LOD高一个数量级,故检测系统对Cr浓度的测定灵敏度较高,可满足大气监测需求。从上述空白样品的测定结果还表明,石英膜上Cr本底浓度极低,为(0.971±0.087)ng·g−1,不会干扰实际测量。
2.3 回收率实验
检测系统的回收率实验包括空白加标回收和样品加标回收两部分。空白样品的加标回收通过在空白石英膜上加入10 ng Cr(Ⅵ),再按照样品前处理步骤进行处理和分析测定,测定结果与理论值之比即空白加标回收率。用微升注射器(HAMILTON-7000)取用1 μL由相同Cr(Ⅵ)母液稀释所得浓度为10 μg·mL−1的Cr(Ⅵ)标液,直接加注在石英膜表面进行样品加标,以相同浓度的Cr(Ⅲ)标液(由纯度为99.99%的CrCI3·6H2O和去离子水制得)进行加标实验,通过加入0.1%的H2O2氧化Cr(Ⅲ)后,检测Cr(Ⅳ)浓度并与配置的Cr(Ⅲ)标液比较得到转化率。样品的加标回收则选用NIST商品化的城市颗粒物标准物质(NIST 1648 PM)作为样品。用清洁研钵将NIST样品磨碎,取2份(各5 mg)分别涂抹在空白石英膜上,其中1份加入10 ng Cr(Ⅵ)。将2份样品通过检测系统进行分析,2份样品测量的差值与加入标准Cr(Ⅵ)物质的理论值之比即加标回收率。上述实验均重复进行多次以减少偶然性误差。
由于使用高纯度的药品且系统测量受到干扰误差很小,Cr(Ⅵ) 空白加标回收率均值可达98%,标准偏差为2.4%(样品数为10);Cr(Ⅲ)的转化率为(95±2.6)%(样品数为10)。样品加标回收实验结果显示:在15个加标的标准环境样品中Cr(Ⅵ)回收率为(90.3±8.1)%;而对不加标的NIST标准样品中Cr浓度测定的误差范围为(9.6±3.3)%。ERG使用相同样品加标,通过碳酸盐缓冲液提取与离子色谱(IC)测得的回收率为((89.8±10)%, N=10)[20]。2组样品加标回收率经中位数检验并不存在统计上的显著差异,故该系统具有较好的采集和测量精度。
2.4 与ICP-MS方法的对比测试
ICP-MS是目前颗粒物中痕量金属的热门测定方法之一[21-22]。2014年,我国环境保护部将其确定为测量环境水样中多种痕量元素的标准方法(HJ 700-2014)。近年来,ICP-MS与各种分离技术联用已常见于Cr的相关研究中[23-25]。
将2016-12-17—2016-12-27在福州三中地区(PM2.5>80 μg·m−3)采集的高浓度大气颗粒物石英膜样品(膜规格:QMA-Whatman, 1851-050, Φ50 mm;采样时长3 h;采样流速16.7 L·min−1),分别通过本系统和ICP-MS测量总Cr浓度。
在进行ICP-MS测定前,将膜样品做密闭微波消解前处理。取用与本系统分析等量样品置于Teflon-TFM消解罐中,再加入10 mL HNO3和HCl的混合液(体积比为1:1),摇匀浸湿样品膜后放入微波消解仪(XT-9900A,上海新拓)中消解8 h。待消解罐冷却至室温,将其中的混合物用0.45 μm的醋酸纤维素滤膜进行过滤。将得到滤液用去离子水稀释至50 mL,用ICP-MS(X-Series2, US Thermo fisher)进行分析。
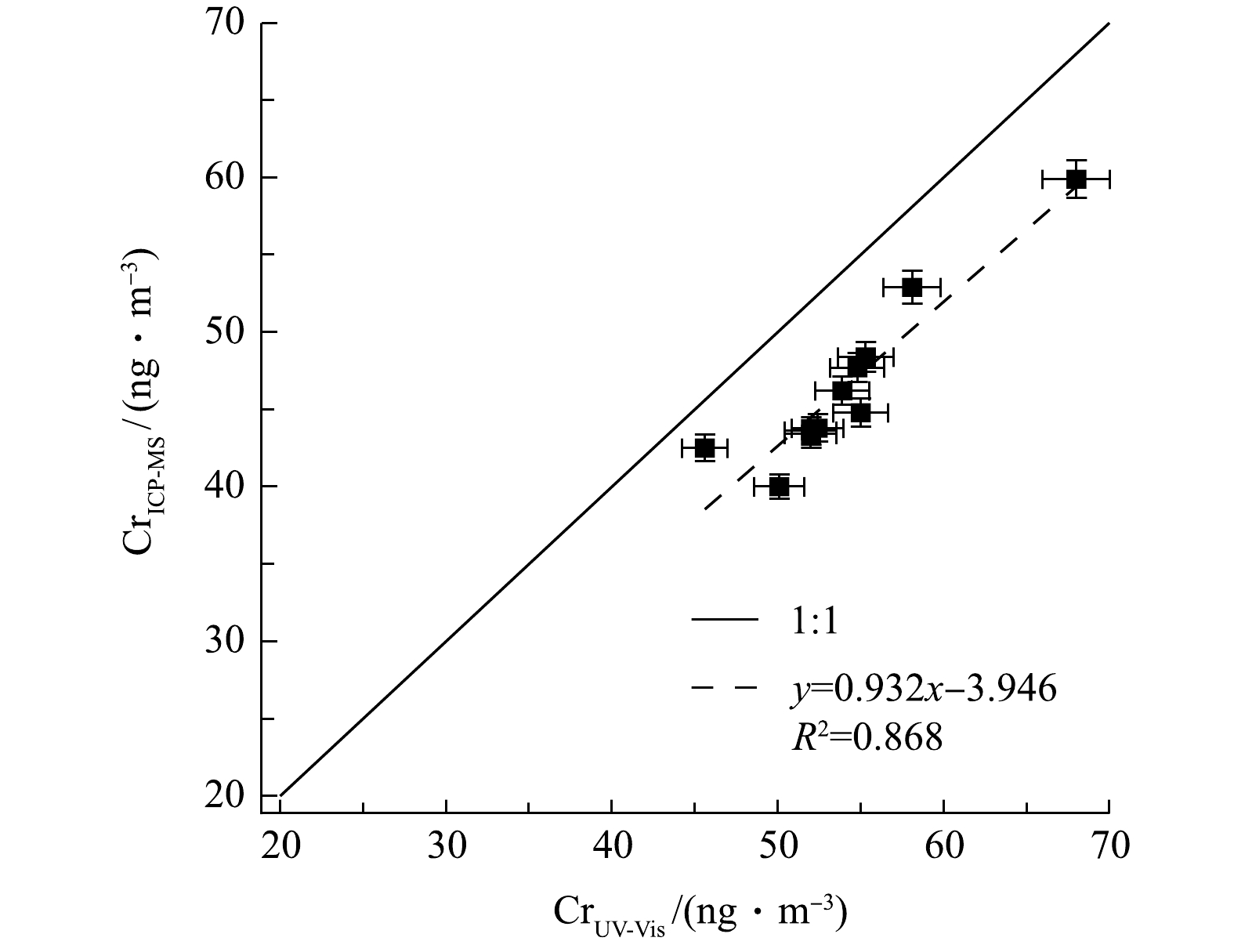
2种方法测量结果的相关性如图5所示,表明结果呈线性关系(斜率为0.932,R2为0.868)。该结果表明本系统对环境颗粒物中总Cr浓度测定的准确性与稳定性较好,也进一步证明本系统的前处理操作(包括酸化、加热搅拌等)能基本确保样品中所有含铬组分充分溶解,以得到可靠的测量结果。同时也表明若颗粒物样品含Cr组分中耐酸且难溶物质较多,会影响系统测量结果。
2.5 大气PM2.5中Cr浓度的外场实测
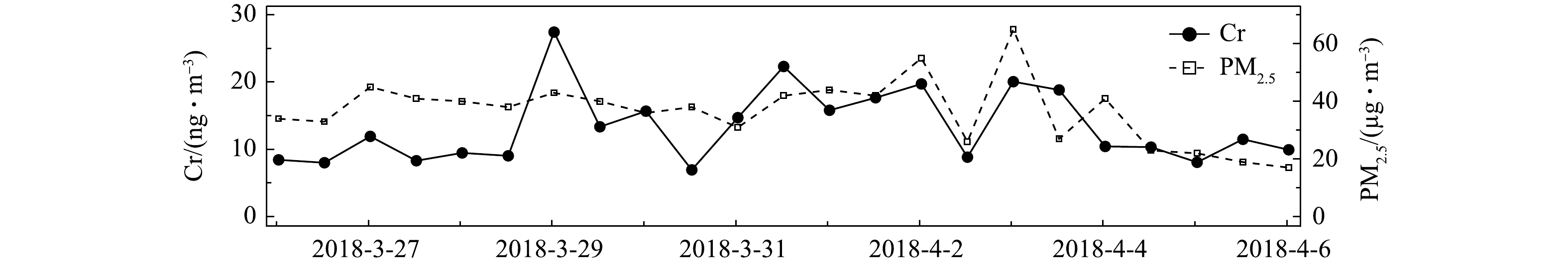
在2018-03-26—2018-04-06对环境大气PM2.5进行样品采集,每12 h采集1次,得到1周多的连续数据如图6所示。测得Cr浓度在采样期间出现了明显的变化,浓度为6.9~27.4 ng·m−3。该浓度水平与其他观测结果相似[27-28],Cr浓度的变化趋势与PM2.5的变化趋势基本一致。整个采样期间,Cr的日平均浓度为13.4 ng·m−3。而这段时间Cr浓度变化较大,这是由于春季空气污染过程频发,且受风向风速变化的影响较大。
分析Cr浓度的变化可发现,2018-03-28夜间到2018-03-29凌晨、2018-03-31白天、2018-04-01夜间到2018-04-02凌晨,以及2018-04-02夜间到2018-04-03凌晨这几个时段达到观测期间的峰值,平均值比日平均浓度高50%~67%;2018-03-30全天、2018-04-02白天Cr浓度降至观测期间日平均浓度的52%~60%;2018-04-04下午到2018-04-06凌晨,Cr浓度基本与采样期间的Cr日平均浓度持平。由于Cr被广泛用于工业生产,如冶金、铬镁耐火材料制造和电镀工艺等[29-31],交通工具的尾气排放和机械磨损[32]也会使环境大气颗粒物中含有这类过渡金属,Cr是地壳中的金属物质之一,故土壤粉尘和地面扬尘也为大气颗粒物中贡献了Cr[33-34]。结合采样点的地理位置分析可推断,大气颗粒物中的Cr主要来自早晚期间强烈的交通活动导致的直接排放和扬尘排放,以及偏东风带来的工业园区排放的污染气团。上述结果表明,本系统可对PM2.5中Cr浓度进行准确连续的测量。
3. 结语
1)设计并评估了一种基于分光光度法测量环境PM2.5中微量Cr的系统。系统通过膜采样经过前处理制成待测样品,再基于分光光度法测量样品中总Cr浓度。系统具有很好的灵敏度和重现性,采集效率较高,测量精度较好。用相同样品与ICP-MS测量结果的对比表明,系统可靠性和准确性均较好。外场采样观测的结果显示,系统具有足够的可靠性,在较少人工监管的情况下能够对环境细颗粒物中Cr进行较快速的连续测量。
2)设计中用到的通过替换金属络合试剂及对前处理步骤进行的优化方法,不仅能测定Cr的价态,还能帮助测定大气环境中部分金属浓度,为实现连续快捷地分析大气环境中水溶性金属离子的污染特征提供了参考。同时,根据大气颗粒物中Cr的来源可以判断,还应进一步研究不同季节大气中Cr的来源和日变化特征。
-
表 1 BMAA及其同分异构体的理化性质
Table 1. Physicochemical properties of BMAA and its isomers
物质名称Substance 熔点Melting point 沸点Boiling point 酸度系数pKa 水溶性Water-solubility 稳定性Stability BMAA 177℃ 284.2℃ 2.1 易溶于水 稳定,不易分解 DAB 144℃ 220.7℃ 1.8 AEG 140-143℃ 290℃ 2.2 表 2 2018-2022年LC-MS/MS法在不同介质中BMAA及其同分异构体的检出限
Table 2. Detection limits of BMAA and its isomers in different matrixes from 2018 to 2022 by LC-MS/MS
样本类型Type of matrix 是否衍生Derivatization 检测物质Type of toxin 检出限/(μg·L−1)Detection of limit 参考文献References BMAA BAMA DAB AEG 水 水库水 直接进样 总BMAA、总DAB、总AEG 0.015 NR 0.0091 0.0061 [19] 地表水 FMOCa衍生 游离态BMAA、游离态BAMA、游离态DAB、游离态AEG 0.005 0.005 0.003 0.002 [20] 藻类 淡水及海洋藻类 AQC衍生 总BMAA、总DAB、总AEG 0.01 NR 0.01 0.01 [21] 水华藻类 EZ:faast衍生b 游离态BMAA、游离态DAB 0.02 NR 0.04 NR [22] 生物结皮c AQC衍生 总BMAA、总BAMA、总DAB、总AEG 0.01 0.037 0.01 0.01 [23] 生物基质 藻类、贝类、血浆、脑脊液 AQC衍生 总BMAA、总DAB、总AEG 0.01 NR 0.01 0.01 [24] 贝类 AQC衍生 总溶解态BMAA、总溶解态DAB 0.31d NR 0.013d NR [25] 藻类相关产品 螺旋藻天然保健品 AQC衍生 总BMAA、总DAB、总AEG 0.187 NR 0.187 0.187 [26] 螺旋藻粉 AQC衍生 总BMAA、总DAB、总AEG 0.01 NR 0.02 0.01 [27] 注:NR:Not Report, 未报道;aFMOC(9-fluorenylmethyl chlorofor mate):9-芴基甲基氯甲酸酯;b一种游离氨基酸衍生试剂盒;c一种沙漠地表覆被类型;d检出限单位为μg·g−1. 表 3 BMAA在我国部分水环境中的检出情况
Table 3. Detection of BMAA in some water environments in China
样品类别Species 检测地点Location 检出浓度Concentration 存在形态Existence 前处理Pretreatment 参考文献References 水体(湖泊水+海水+水库水) 太湖无锡流域 0.129/0.105 游离态/沉淀结合态BMAA 直接分析法 [35] 南京玄武湖 0.628/0.072 豫园景观湖 0.697/0.116 南昌孔目湖 1.648/0.19 南山景观湖 0.486/0.215 云南滇池 1.493/0.359 安徽巢湖 0.108/0.099 武汉东湖 <0.01 洞庭湖 <0.01 杭州西湖 <0.01 大连海域 <0.01 滨海流域 <0.01 青岛流域 <0.01 厦门海域 <0.01 密云水库 <0.01 深圳水库 <0.01 太湖 0.23a 总BMAA 直接分析法 [32] 蓝藻有机肥 太湖 1.8—16.3/3.43—13.67 游离态/沉淀结合态BMAA AQC-衍生法 [46] 水体 湖州市淡水养殖池塘 3.081—3.203a 总BMAA AQC-衍生法 [44] 底泥 0.681—0.711 浮游植物 青岛胶州湾 0.03—1.00 总溶解态BMAA 直接分析法 [45] 注:a检出浓度单位为μg·L−1,未带上标的检出浓度单位为μg·g−1. 表 4 BMAA在我国水产品中的检出情况
Table 4. Detection of BMAA in Chinese aquatic products
样品类别Species 样品名称Samples 检测地点Location 检出浓度/(μg·g−1)Concentration 存在形态Existence 前处理Pretreatment 参考文献References 软体动物 扁玉螺 黄海海域 3.54/20.92 游离态/总溶解态BMAA 直接分析法 [9] 脉红螺 0.64 栉江珧 2.57 菲律宾蛤仔 0.86 扁玉螺 1.76/4.07 AQC-衍生法 脉红螺 0.40 栉江珧 1.17 菲律宾蛤仔 0.51 背角无齿蚌 太湖贡湖湾 0.147—0.173/3.26—3.78 游离态/沉淀结合态BMAA AQC-衍生法 [60] 铜锈环棱螺 0.09—0.141/3.154—3.786 厚壳贻贝 舟山市 0.45 游离态BMAA 直接分析法 [55] 长竹蛏 荣成市 0.66 软体动物 扁玉螺 荣成市 2.15 游离态BMAA 直接分析法 [55] 大连市 3.97 连云港市 0.99 莱州市 0.86 青岛市 1.43 河蚬 湖州市淡水养殖池塘 0.528—0.540 总BMAA AQC-衍生法 [44] 铜锈环棱螺 1.015—1.065 贻贝 太湖贡湖湾 2.437—4.663 游离态BMAA+沉淀结合态BMAA AQC-衍生法 [5] 淡水蜗牛 0.63—3.85 亚洲蛤 0.80—6.72 河蚬 太湖 1.27—4.01 游离态BMAA+沉淀结合态BMAA AQC-衍生法 [54] 无齿蚌 0.28—4.92 甲壳动物 日本沼虾 湖州市淡水养殖池塘 0.456—0.468 总BMAA AQC-衍生法 [44] 中华绒螯蟹 0.543—0.555 日本沼虾 太湖贡湖湾 0.044—0.076/0.888—1.132 游离态/沉淀结合态BMAA AQC-衍生法 [60] 太湖秀丽白虾 ND/0.078—0.162 淡水蟹 太湖贡湖湾 5.727—11.793 游离态BMAA+沉淀结合态BMAA AQC-衍生法 [5] 螃蟹 6.479—6.481 淡水虾 0.177—1.903 西伯利亚对虾 0.104—0.136 对虾 3.141—7.099 日本沼虾 太湖 0.65—3.45 游离态BMAA+沉淀结合态BMAA AQC-衍生法 [54] 中华绒螯蟹 1.82—4.16 鱼类 草鱼 太湖 1.78—3.10 游离态BMAA+沉淀结合态BMAA AQC-衍生法 [54] 青鱼 2.95—5.47 青鱼 湖州市淡水养殖池塘 0.358—0.370 总BMAA AQC-衍生法 [44] 鲫 0.482—0.494 麦穗鱼 太湖贡湖湾 0.038—0.102/0.07—0.13 游离态/沉淀结合态BMAA AQC-衍生法 [60] 梅鲚鱼 ND/6.96—7.72 鲢鱼 0.121—0.159/10.27—11.31 黄颡鱼 0.52—0.60/8.67—9.45 鳑鲏 武汉官桥湖 0.038—0.448/ND 游离态/沉淀结合态BMAA AQC-衍生法 [53] 鲫 0.086—0.166/ND 鲤 0.1—0.5/0.233—0.393 鲢 0.01—0.046/ND 鳙 0.018—0.06/ND 鳊 0.631—1.121/0.001—0.003 鱼类 太湖贡湖湾 0.049—49.31 游离态BMAA+沉淀结合态BMAA AQC-衍生法 [5] 注:ND:Not Detected, 未检测到. -
[1] COX P A, BANACK S A, MURCH S J, et al. Diverse taxa of cyanobacteria produce β-N-methylamino-L-alanine, a neurotoxic amino acid [J]. Proceedings of the National Academy of Sciences of the United States of America, 2005, 102(14): 5074-5078. doi: 10.1073/pnas.0501526102 [2] SPENCER P S, NUNN P B, HUGON J, et al. Guam amyotrophic lateral sclerosis-parkinsonism-dementia linked to a plant excitant neurotoxin [J]. Science, 1987, 237(4814): 517-522. doi: 10.1126/science.3603037 [3] CHERNOFF N, HILL D J, DIGGS D L, et al. A critical review of the postulated role of the non-essential amino acid, β-N-methylamino-L-alanine, in neurodegenerative disease in humans [J]. Journal of Toxicology and Environmental Health. Part B, Critical Reviews, 2017, 20(4): 1-47. [4] MANOLIDI K, TRIANTIS T M, KALOUDIS T, et al. Neurotoxin BMAA and its isomeric amino acids in cyanobacteria and cyanobacteria-based food supplements [J]. Journal of Hazardous Materials, 2019, 365: 346-365. doi: 10.1016/j.jhazmat.2018.10.084 [5] JIAO Y Y, CHEN Q K, CHEN X, et al. Occurrence and transfer of a cyanobacterial neurotoxin β-methylamino-L-alanine within the aquatic food webs of Gonghu Bay (Lake Taihu, China) to evaluate the potential human health risk [J]. Science of the Total Environment, 2014, 468/469: 457-463. doi: 10.1016/j.scitotenv.2013.08.064 [6] RÉVEILLON D, SÉCHET V, HESS P, et al. Systematic detection of BMAA (β-N-methylamino-L-alanine) and DAB (2,4-diaminobutyric acid) in mollusks collected in shellfish production areas along the French coasts [J]. Toxicon, 2016, 110: 35-46. doi: 10.1016/j.toxicon.2015.11.011 [7] SCHNEIDER T, SIMPSON C, DESAI P, et al. Neurotoxicity of isomers of the environmental toxin L-BMAA [J]. Toxicon, 2020, 184: 175-179. doi: 10.1016/j.toxicon.2020.06.014 [8] GALLO-TORRES H E, HEIMER E, SCHEIDL F, et al. The gastrointestinal absorption, tissue distribution, urinary excretion and metabolism of N-(2-aminoethyl)-Glycine (AEG) in the rat [J]. Life Sciences, 1980, 27(24): 2347-2357. doi: 10.1016/0024-3205(80)90504-4 [9] 王超, 邱江兵, 宋甲亮, 等. 不同液相色谱-质谱联用法分析贝类样品中神经毒素β-N-甲氨基-L-丙氨酸的比较 [J]. 中国渔业质量与标准, 2021, 11(1): 34-45. WANG C, QIU J B, SONG J L, et al. A comparative study on the analytical performance of different liquid chromatography coupled with tandem mass spectrometry for neurotoxin β-N-methylamino-L-alanine in mollusks [J]. Chinese Fishery Quality and Standards, 2021, 11(1): 34-45(in Chinese).
[10] HOEFFER C A, KLANN E. mTOR signaling: At the crossroads of plasticity, memory and disease [J]. Trends in Neurosciences, 2010, 33(2): 67-75. doi: 10.1016/j.tins.2009.11.003 [11] CHONG Z Z, SHANG Y C, WANG S H, et al. A critical kinase cascade in neurological disorders: PI 3-K, Akt, and mTOR [J]. Future Neurology, 2012, 7(6): 733-748. doi: 10.2217/fnl.12.72 [12] PAPAPETROPOULOS S. Is there a role for naturally occurring cyanobacterial toxins in neurodegeneration? The beta-N-methylamino-L-alanine (BMAA) paradigm [J]. Neurochemistry International, 2007, 50(7/8): 998-1003. [13] EMMONS R V, KARAJ E, CUDJOE E, et al. Leveraging multi-mode microextraction and liquid chromatography stationary phases for quantitative analysis of neurotoxin β-N-methylamino-L-alanine and other non-proteinogenic amino acids [J]. Journal Of Chromatography A, 2022, 1685: 463636. doi: 10.1016/j.chroma.2022.463636 [14] PAGLIARA P, DE BENEDETTO G E, FRANCAVILLA M, et al. Bioactive potential of two marine picocyanobacteria belonging to cyanobium and synechococcus genera[J]. Microorganisms, 2021, 9(10):2048. [15] ZHAO P, QIU J B, LI A F, et al. Matrix effect of diverse biological samples extracted with different extraction ratios on the detection of β-N-methylamino-L-alanine by two common LC-MS/MS analysis methods [J]. Toxins, 2022, 14(6): 387. doi: 10.3390/toxins14060387 [16] ROSÉN J, WESTERBERG E, HELLENÄS K E, et al. A new method for analysis of underivatized free β-methylamino-alanine: Validation and method comparison [J]. Toxicon, 2016, 121: 105-108. doi: 10.1016/j.toxicon.2016.08.021 [17] FAASSEN E J, GILLISSEN F, LÜRLING M. A comparative study on three analytical methods for the determination of the neurotoxin BMAA in cyanobacteria [J]. PLoS One, 2012, 7(5): e36667. doi: 10.1371/journal.pone.0036667 [18] BISHOP S L, MURCH S J. A systematic review of analytical methods for the detection and quantification of β-N-methylamino-L-alanine (BMAA) [J]. Analyst, 2019, 145(1): 13-28. [19] APARICIO-MURIANA M M, CARMONA-MOLERO R, LARA F J, et al. Multiclass cyanotoxin analysis in reservoir waters: Tandem solid-phase extraction followed by zwitterionic hydrophilic interaction liquid chromatography-mass spectrometry [J]. Talanta, 2022, 237: 122929. doi: 10.1016/j.talanta.2021.122929 [20] VO DUY S, MUNOZ G, DINH Q T, et al. Analysis of the neurotoxin β-N-methylamino-L-alanine (BMAA) and isomers in surface water by FMOC derivatization liquid chromatography high resolution mass spectrometry [J]. PLoS One, 2019, 14(8): e0220698. doi: 10.1371/journal.pone.0220698 [21] METCALF J S, BANACK S A, WESSEL R A, et al. Toxin analysis of freshwater cyanobacterial and marine harmful algal blooms on the west coast of Florida and implications for estuarine environments [J]. Neurotoxicity Research, 2021, 39(1): 27-35. doi: 10.1007/s12640-020-00248-3 [22] MAIN B J, BOWLING L C, PADULA M P, et al. Detection of the suspected neurotoxin β-methylamino-L-alanine (BMAA) in cyanobacterial blooms from multiple water bodies in Eastern Australia [J]. Harmful Algae, 2018, 74: 10-18. doi: 10.1016/j.hal.2018.03.004 [23] CHATZIEFTHIMIOU A D, BANACK S A, COX P A. Biocrust-produced cyanotoxins are found vertically in the desert soil profile [J]. Neurotoxicity Research, 2021, 39(1): 42-48. doi: 10.1007/s12640-020-00224-x [24] BANACK S A. Second laboratory validation of β-N-methylamino-L-alanine, N-(2-aminoethyl)glycine, and 2, 4-diaminobuytric acid by ultra-performance liquid chromatography and tandem mass spectrometry [J]. Neurotoxicity Research, 2021, 39(1): 107-116. doi: 10.1007/s12640-020-00208-x [25] LI A, HU Y, SONG J, et al. Ubiquity of the neurotoxin β-N-methylamino-L-alanine and its isomers confirmed by two different mass spectrometric methods in diverse marine mollusks [J]. Toxicon, 2018, 151: 129-136. doi: 10.1016/j.toxicon.2018.07.004 [26] GLOVER W B, BAKER T C, MURCH S J, et al. Determination of β-N-methylamino-L-alanine, N-(2-aminoethyl)glycine, and 2,4-diaminobutyric acid in food products containing cyanobacteria by ultra-performance liquid chromatography and tandem mass spectrometry: Single-laboratory validation [J]. Journal of AOAC International, 2015, 98(6): 1559-1565. doi: 10.5740/jaoacint.15-084 [27] BAKER T C, TYMM F J M, MURCH S J. Assessing environmental exposure to β-N-methylamino-L-alanine (BMAA) in complex sample matrices: A comparison of the three most popular LC-MS/MS methods [J]. Neurotoxicity Research, 2018, 33(1): 43-54. doi: 10.1007/s12640-017-9764-3 [28] TYMM F J M, BISHOP S L, MURCH S J. A single laboratory validation for the analysis of underivatized β-N-methylamino-L-alanine (BMAA) [J]. Neurotoxicity Research, 2021, 39(1): 49-71. doi: 10.1007/s12640-019-00137-4 [29] LAGE S, ANNADOTTER H, RASMUSSEN U, et al. Biotransfer of β-N-methylamino-L-alanine (BMAA) in a eutrophicated freshwater lake [J]. Marine Drugs, 2015, 13(3): 1185-1201. doi: 10.3390/md13031185 [30] LAGE S, BURIAN A, RASMUSSEN U, et al. BMAA extraction of cyanobacteria samples: Which method to choose? [J]. Environmental Science and Pollution Research International, 2016, 23(1): 338-350. doi: 10.1007/s11356-015-5266-0 [31] CERVANTES CIANCA R C, BAPTISTA M S, LOPES V R, et al. The non-protein amino acid β-N-methylamino-L-alanine in portuguese cyanobacterial isolates [J]. Amino Acids, 2012, 42(6): 2473-2479. doi: 10.1007/s00726-011-1057-1 [32] CAO Y, HU S Y, GONG T T, et al. Decomposition of β-N-methylamino-L-alanine (BMAA) and 2,4-diaminobutyric acid (DAB) during chlorination and consequent disinfection byproducts formation [J]. Water Research, 2019, 159: 365-374. doi: 10.1016/j.watres.2019.05.007 [33] VIOLI J P, MITROVIC S M, COLVILLE A, et al. Prevalence of β-methylamino-L-alanine (BMAA) and its isomers in freshwater cyanobacteria isolated from eastern Australia [J]. Ecotoxicology and Environmental Safety, 2019, 172: 72-81. doi: 10.1016/j.ecoenv.2019.01.046 [34] CHATZIEFTHIMIOU A D, DEITCH E J, GLOVER W B, et al. Analysis of neurotoxic amino acids from marine waters, microbial mats, and seafood destined for human consumption in the Arabian Gulf [J]. Neurotoxicity Research, 2018, 33(1): 143-152. doi: 10.1007/s12640-017-9772-3 [35] 闫博引. 蓝藻神经毒素BMAA在水中赋存状态及氧化降解机制[D]. 哈尔滨: 哈尔滨工业大学, 2020. YAN B Y. Occurrence state and oxidative degragation mechanism of cyanobacterial neurotoxin BMAA in water[D]. Harbin: Harbin Institute of Technology, 2020(in Chinese).
[36] FAASSEN E J, ANTONIOU M G, BEEKMAN-LUKASSEN W, et al. A collaborative evaluation of LC-MS/MS based methods for BMAA analysis: Soluble bound BMAA found to be an important fraction [J]. Marine Drugs, 2016, 14(3): 45. doi: 10.3390/md14030045 [37] LANCE E, ARNICH N, MAIGNIEN T, et al. Occurrence of β-N-methylamino-L-alanine (BMAA) and isomers in aquatic environments and aquatic food sources for humans [J]. Toxins, 2018, 10(2): 83. doi: 10.3390/toxins10020083 [38] COMBES A, EL ABDELLAOUI S, SARAZIN C, et al. Validation of the analytical procedure for the determination of the neurotoxin β-N-methylamino-L-alanine in complex environmental samples [J]. Analytica Chimica Acta, 2013, 771: 42-49. doi: 10.1016/j.aca.2013.02.016 [39] AL-SAMMAK M A, HOAGLAND K D, CASSADA D, et al. Co-occurrence of the cyanotoxins BMAA, DABA and Anatoxin-a in Nebraska reservoirs, fish, and aquatic plants [J]. Toxins, 2014, 6(2): 488-508. doi: 10.3390/toxins6020488 [40] CRAIGHEAD D, METCALF J S, BANACK S A, et al. Presence of the neurotoxic amino acids β-N-methylamino-L-alanine (BMAA) and 2, 4-diaminobutyric acid (DAB) in shallow springs from the Gobi Desert [J]. Amyotrophic Lateral Sclerosis, 2009, 10(sup2): 96-100. doi: 10.3109/17482960903278469 [41] FAASSEN E J, GILLISSEN F, ZWEERS H A J, et al. Determination of the neurotoxins BMAA (β-N-methylamino-L-alanine) and DAB (α-, γ-diaminobutyric acid) by LC-MSMS in Dutch urban waters with cyanobacterial blooms [J]. Amyotrophic Lateral Sclerosis, 2009, 10(sup2): 79-84. doi: 10.3109/17482960903272967 [42] METCALF J S, BANACK S A, LINDSAY J, et al. Co-occurrence of β-N-methylamino-L-alanine, a neurotoxic amino acid with other cyanobacterial toxins in British waterbodies, 1990-2004 [J]. Environmental Microbiology, 2008, 10(3): 702-708. doi: 10.1111/j.1462-2920.2007.01492.x [43] ROY-LACHAPELLE A, SOLLIEC M, SAUVÉ S. Determination of BMAA and three alkaloid cyanotoxins in lake water using dansyl chloride derivatization and high-resolution mass spectrometry [J]. Analytical and Bioanalytical Chemistry, 2015, 407(18): 5487-5501. doi: 10.1007/s00216-015-8722-2 [44] 顾笑笑, 吴湘, 张爱, 等. 神经毒素BMAA在淡水池塘水体中的健康风险及调控技术 [J]. 水生生物学报, 2022, 46(2): 176-183. doi: 10.7541/2021.2021.012 GU X X, WU X, ZHANG A, et al. Health risk of neurotoxin β-N-methylamino-L-alanine(BMAA) in freshwater aquaculture ponds and its control technology [J]. Acta Hydrobiologica Sinica, 2022, 46(2): 176-183(in Chinese). doi: 10.7541/2021.2021.012
[45] WANG C, YAN C, QIU J B, et al. Food web biomagnification of the neurotoxin β-N-methylamino-L-alanine in a diatom-dominated marine ecosystem in China [J]. Journal of Hazardous Materials, 2021, 404: 124217. doi: 10.1016/j.jhazmat.2020.124217 [46] 李博. 藻毒素BMAA在土壤与作物间的迁移累积及其对秀丽隐杆线虫的影响[D]. 南京: 南京农业大学, 2019. LI B. Transfer and bioaccumulation of A cyanobacterial neurotoxin BMAA between soil and crop and its effects on Caenorhabditis elegans[D]. Nanjing: Nanjing Agricultural University, 2019(in Chinese).
[47] JIANG L Y, KISELOVA N, ROSÉN J, et al. Quantification of neurotoxin BMAA (β-N-methylamino-L-alanine) in seafood from Swedish markets [J]. Scientific Reports, 2014, 4: 6931. doi: 10.1038/srep06931 [48] RÉVEILLON D, ABADIE E, SÉCHET V, et al. β-N-methylamino-L-alanine (BMAA) and isomers: Distribution in different food web compartments of Thau lagoon, French Mediterranean Sea [J]. Marine Environmental Research, 2015, 110: 8-18. doi: 10.1016/j.marenvres.2015.07.015 [49] LAMPINEN SALOMONSSON M, HANSSON A, BONDESSON U. Development and in-house validation of a method for quantification of BMAA in mussels using dansyl chloride derivatization and ultra performance liquid chromatography tandem mass spectrometry [J]. Analytical Methods, 2013, 5(18): 4865. doi: 10.1039/c3ay40657a [50] SCOTT L L, DOWNING S, DOWNING T. Potential for dietary exposure to β-N-methylamino-L-alanine and microcystin from a freshwater system [J]. Toxicon, 2018, 150: 261-266. doi: 10.1016/j.toxicon.2018.06.076 [51] CHRISTENSEN S J, HEMSCHEIDT T K, TRAPIDO-ROSENTHAL H, et al. Detection and quantification of β-methylamino-L-alanine in aquatic invertebrates [J]. Limnology and Oceanography:Methods, 2012, 10(11): 891-898. doi: 10.4319/lom.2012.10.891 [52] FIELD N C, METCALF J S, CALLER T A, et al. Linking β-methylamino-L-alanine exposure to sporadic amyotrophic lateral sclerosis in Annapolis, MD [J]. Toxicon, 2013, 70: 179-183. doi: 10.1016/j.toxicon.2013.04.010 [53] 陈咏梅, 赵以军, 陈默, 等. 武汉官桥湖蓝藻毒素BMAA的生物累积与健康风险评估 [J]. 水生态学杂志, 2019, 40(4): 22-29. doi: 10.15928/j.1674-3075.2019.04.004 CHEN Y M, ZHAO Y J, CHEN M, et al. Bioaccumulation and health risk assessment of the cyanobacterial neurotoxin BMAA in Guanqiao Lake, Wuhan [J]. Journal of Hydroecology, 2019, 40(4): 22-29(in Chinese). doi: 10.15928/j.1674-3075.2019.04.004
[54] WU X, WU H, GU X X, et al. Biomagnification characteristics and health risk assessment of the neurotoxin BMAA in freshwater aquaculture products of Taihu Lake Basin, China [J]. Chemosphere, 2019, 229: 332-340. doi: 10.1016/j.chemosphere.2019.04.210 [55] LI A F, SONG J L, HU Y, et al. New typical vector of neurotoxin β-N-methylamino-L-alanine (BMAA) in the marine benthic ecosystem [J]. Marine Drugs, 2016, 14(11): 202. doi: 10.3390/md14110202 [56] 王超, 邱江兵, 柳超, 等. 神经毒素BMAA沿海洋食物链的迁移转化行为研究[C]. 第十四届生物毒素毒理学术大会暨第一届生物毒素——从生存适应到转化医学专题学术会议会刊, 2019. WANG C, QIU J B, LIU C, et al. Migration and transformation behavior of neurotoxin BMAA along the Marine food chain[C]. Proceedings of the 14th Biotoxin Toxicology Conference and the 1st Biotoxin: From Survival Adaptation to Translational Medicine Symposium, 2019(in Chinese).
[57] HAMMERSCHLAG N, DAVIS D A, MONDO K, et al. Cyanobacterial neurotoxin BMAA and mercury in sharks [J]. Toxins, 2016, 8(8): 238. doi: 10.3390/toxins8080238 [58] MONDO K, HAMMERSCHLAG N, BASILE M, et al. Cyanobacterial neurotoxin β-N-methylamino-L-alanine (BMAA) in shark fins [J]. Marine Drugs, 2012, 10(2): 509-520. [59] MONDO K, BROC GLOVER W, MURCH S J, et al. Environmental neurotoxins β-N-methylamino-L-alanine (BMAA) and mercury in shark cartilage dietary supplements [J]. Food Chem Toxicol, 2014, 70: 26-32. doi: 10.1016/j.fct.2014.04.015 [60] 焦一滢. 蓝藻神经毒素β-N-甲氨基-L-丙氨酸在太湖食物链中赋存与环境行为研究[D]. 南京: 南京大学, 2014. JIAO Y Y. Occurrence of the cyanobacterial neurotoxin β-N-methylamino-L-alanine in foodchains of lake Tai and the study of environmental fates[D]. Nanjing: Nanjing University, 2014(in Chinese).
[61] GANTAR M, SVIRČEV Z. Microalgae and cyanobacteria: Food for thought(1) [J]. Journal of Phycology, 2008, 44(2): 260-268. doi: 10.1111/j.1529-8817.2008.00469.x [62] ROY-LACHAPELLE A, SOLLIEC M, BOUCHARD M F, et al. Detection of cyanotoxins in algae dietary supplements [J]. Toxins, 2017, 9(3): 76. doi: 10.3390/toxins9030076 [63] KRÜGER T, MÖNCH B, OPPENHÄUSER S, et al. LC-MS/MS determination of the isomeric neurotoxins BMAA (β-N-methylamino-L-alanine) and DAB (2, 4-diaminobutyric acid) in cyanobacteria and seeds of Cycas revoluta and Lathyrus latifolius [J]. Toxicon, 2010, 55(2/3): 547-557. [64] 樊华. 淡水蓝藻产生神经毒素BMAA和DAB的潜力及其环境影响因子研究[D]. 青岛: 中国海洋大学, 2013. FAN H. Potential production of neurotoxins BMAA and DAB in freshwater cyanobacteria and effects environmental factors[D]. Qingdao: Ocean University of China, 2013(in Chinese).
[65] DROBAC D, TOKODI N, SIMEUNOVIĆ J, et al. Human exposure to cyanotoxins and their effects on health [J]. Arhiv Za Higijenu Rada i Toksikologiju, 2013, 64(2): 119-130. [66] FALCONER I R, HUMPAGE A R. Health risk assessment of cyanobacterial (blue-green algal) toxins in drinking water [J]. International Journal of Environmental Research and Public Health, 2005, 2(1): 43-50. doi: 10.3390/ijerph2005010043 [67] KARLSSON O, KULTIMA K, WADENSTEN H, et al. Neurotoxin-induced neuropeptide perturbations in striatum of neonatal rats [J]. Journal of Proteome Research, 2013, 12(4): 1678-1690. doi: 10.1021/pr3010265 [68] 全国居民主要食品消费量[EB/OL]. 国家统计局, 2013-2020. National consumption of major food products[EB/OL]. National Bureau of Statistics, 2013-2020.
[69] 闫云君, 梁彦龄. 水生大型无脊椎动物的干湿重比的研究 [J]. 华中理工大学学报, 1999, 27(9): 61-63. YAN Y J, LIANG Y L. A study of dry to wet weight ratio of aquatic macroinvertebrates [J]. Journal of Huazhong University of Science and Technology, 1999, 27(9): 61-63(in Chinese).
-






 下载:
下载: