-
近年来,由于药品和个人护理产品已成为一种新兴污染物,对人类健康和生态系统存在巨大潜在危害,越来越多的人开始关注此问题[1]。在其中,抗生素因其优良的抗细菌感染特性而被广泛应用于临床医疗。据世界卫生组织调查,我国抗生素人均消耗量是英国和北欧等大部分地区的近6倍[2]。由于人体无法完全代谢和吸收,消耗的大部分抗生素被大量排放至水体环境中。抗生素的滥用不仅会对环境造成污染,而且会促使细菌群体产生抗性导致“超级细菌”的产生[3]。氯霉素作为第一种人工全合成的抗生素类药品,由于对革兰氏阳性菌的作用性较强,曾经被广泛用于各种敏感菌感染的治疗。然而,氯霉素被人体摄入后,有30%~90%的氯霉素被随尿液或粪便排出体外,进入城市污水处理厂[4]。随着使用量的不断增加,氯霉素在土壤、地表水和地下水中均被检测到,甚至在动物体内也含有一定浓度的氯霉素[5]。有研究表明,氯霉素会对人体的消化系统和神经系统产生严重的毒副作用,过量的情况下可引发障碍性贫血和骨髓抑制等致命性疾病[6]。传统污水处理工艺很难将氯霉素完全降解,其中的氯化消毒过程中氯霉素的残留会导致具有“三致”效应消毒副产物的生成,其毒性远远超过母体物质,严重影响饮用水安全[7]。故而寻找一种稳定高效的氯霉素去除方法迫在眉睫。
高级氧化工艺在难降解有机污染物降解方面显示出明显的优势[8-9]。其中,电化学氧化工艺是一种极具吸引力的高级氧化工艺技术,其拥有环境友好、操作简单、可靠性高、适应性广等诸多优点,在新兴污染物如药品和个人护理产品的去除方面展示了优异的性能[10]。电化学氧化技术主要依靠阳极直接或间接氧化污染物的原理进行反应,因此,阳极的选择成为该技术的关键。不同的阳极材料将导致氧化反应的产物、机理以及电流效率的差异[11]。亚氧化钛电极由于具有较高的析氧电位(oxygen evolution potential, OEP)、良好的导电能力、电化学活性以及稳定性等特点,成为了近年来研究较多的电化学阳极材料[12-13]。有研究表明,以Ti4O7为阳极的电化学氧化工艺能够有效地降解氯霉素[14]。相比传统不具备活性的阳极材料(BDD、掺杂SnO2和PbO2等),Ti4O7阳极材料兼具原料储量丰富、低成本和易于制备的优点。尽管如此,原始的Ti4O7具有较低的界面电荷转移率,这将导致其无法提供足够的羟基自由基(·OH)[15-17]。因此,开发一种基于界面改性策略的新型Ti4O7阳极以提高其电催化活性是必要的。
目前,Ti4O7电极主要分为涂层电极和一体式电极。Ti4O7涂层电极主要通过在基体上沉积或是涂覆Ti4O7涂层而制得;Ti4O7一体式电极主要是通过Ti4O7粉末压制后再烧结成型而制备[18]。包括大部分对Ti4O7电极改性的研究也是基于此2种制备方式进行探索。Ti4O7电极较为成功的改性包括WANG等[19]采用等离子喷涂法,将熔化的Ti4O7粉末喷涂在钛板表面制备了Ti/Ti4O7电极,其具有较高的析氧电位,显示出良好的氧化降解能力;NAYAK等[20]在0.5 g Ti4O7粉末中加入2%~3%的石蜡油黏结剂,制备了整体电极,该电极对邻苯二甲酸和对苯二甲酸具有较高的去除率。这些制备Ti4O7电极及改性的方法虽能很好的提高Ti4O7电极的电催化能力,但存在制备方法复杂,稳定性较差的缺点。因此,需要寻找一种可以解决这些问题的改性策略,使得制备工艺简便,得到的电极稳定性优异的同时还可以提高Ti4O7电极电催化能力。
氯霉素通常在污水厂中的检测质量浓度级别为ng·L−1或μg·L−1[21],但在实验室中,为了凸显电催化性能的降解能力,通常选用mg·L−1的质量浓度作为模拟氯霉素废水,如杨志伟等[22]用超声强化Ti4O7电极,在最佳反应条件下,对初始质量浓度为20 mg·L−1的氯霉素去除率为82.11%。本研究选用20 mg·L−1的氯霉素模拟废水作为目标污染物,采用缺陷工程方法制备Zr、钇(yttrium, Y)和锰(manganese, Mn)不同过渡金属元素掺杂的Ti4O7电极,探讨这些改性Ti4O7电极对于氯霉素的去除效能,重点比较Zr/Ti4O7阳极和纯Ti4O7阳极对氯霉素的电化学降解性能,通过微观结构、元素分析和电化学测试等对Zr元素掺杂亚氧化钛(Zr/Ti4O7)阳极的电极性能进行表征并通过循环实验测试了Zr/Ti4O7阳极的稳定性。重点优化研究初始电流密度、初始pH,常见阴离子等因素影响下Zr/Ti4O7阳极对氯霉素的降解并分析氯霉素的降解机理,此外,还将进一步探究Zr/Ti4O7作为阳极的电化学氧化工艺对不同抗生素的降解能力,以期为改性Zr/Ti4O7电极对氯霉素的降解提供参考。
-
高纯度(>95%)Ti4O7粉购自山东联盟化工集团有限公司;氯霉素,纯度大于97%,购自阿拉丁生化科技股份有限公司;硝酸锆,纯度大于99%,购自上海麦克林化学试剂有限公司;其余实验药品均为分析纯,购自上海麦克林化学试剂有限公司,使用前未做进一步纯化处理;实验用水是经纯水机(Millipore)制备的超纯水,电阻率为18 MΩ·cm。
-
取2 g Ti4O7粉末,将粉末放入直径为2 cm的圆柱形石墨模具内,置于真空等离子烧结炉中烧制,得到直径为2 cm的Ti4O7电极片[23]。将Ti4O7电极进行真空等离子体处理,真空等离子处理放电功率为100 W,处理气体为氩(argon, Ar)气,处理时间为30 min,得到缺陷Ti4O7电极。将缺陷Ti4O7电极片浸入50 mL去离子水中室温超声1 h。而后在去离子水中加入0.4 g Zr(NO3)4粉末,搅拌12 h使缺陷Ti4O7电极充分吸附Zr离子,随后取出电极用去离子水清洗,冷冻干燥24 h。将干燥后的电极在5%H2/Ar混合气氛中,以5 ℃·min−1升温速率在200 ℃热处理2 h,得到电极片命名为Zr/Ti4O7。该相同改性方法下,将Zr(NO3)4粉末分别换成Y(NO3)3和Mn(NO3)2,其余条件如处理时间、处理温度等都相同,分别得到Y/Ti4O7和Mn/Ti4O7阳极。
-
电极形貌结构和表面元素组成采用捷克TESCAN MIRA LMS扫描电子显微镜(scanning electron microscope, SEM)进行分析,电极表面晶型和强度用日本Ultima IV公司的EMPYREAN衍射仪进行X射线衍射(X-ray diffractometer, XRD)表征。对制备的Zr/Ti4O7阳极和纯Ti4O7阳极进行线性伏安扫描(linear sweep voltammetry, LSV)和循环伏安扫描(cyclic voltammetry, CV),测试采用电化学工作站(Auto Lab M204型,上海辰华三电极体系:参比电极为 Ag/AgCl(饱和KCl)),对电极为铂片,工作电极为制备的电极。
-
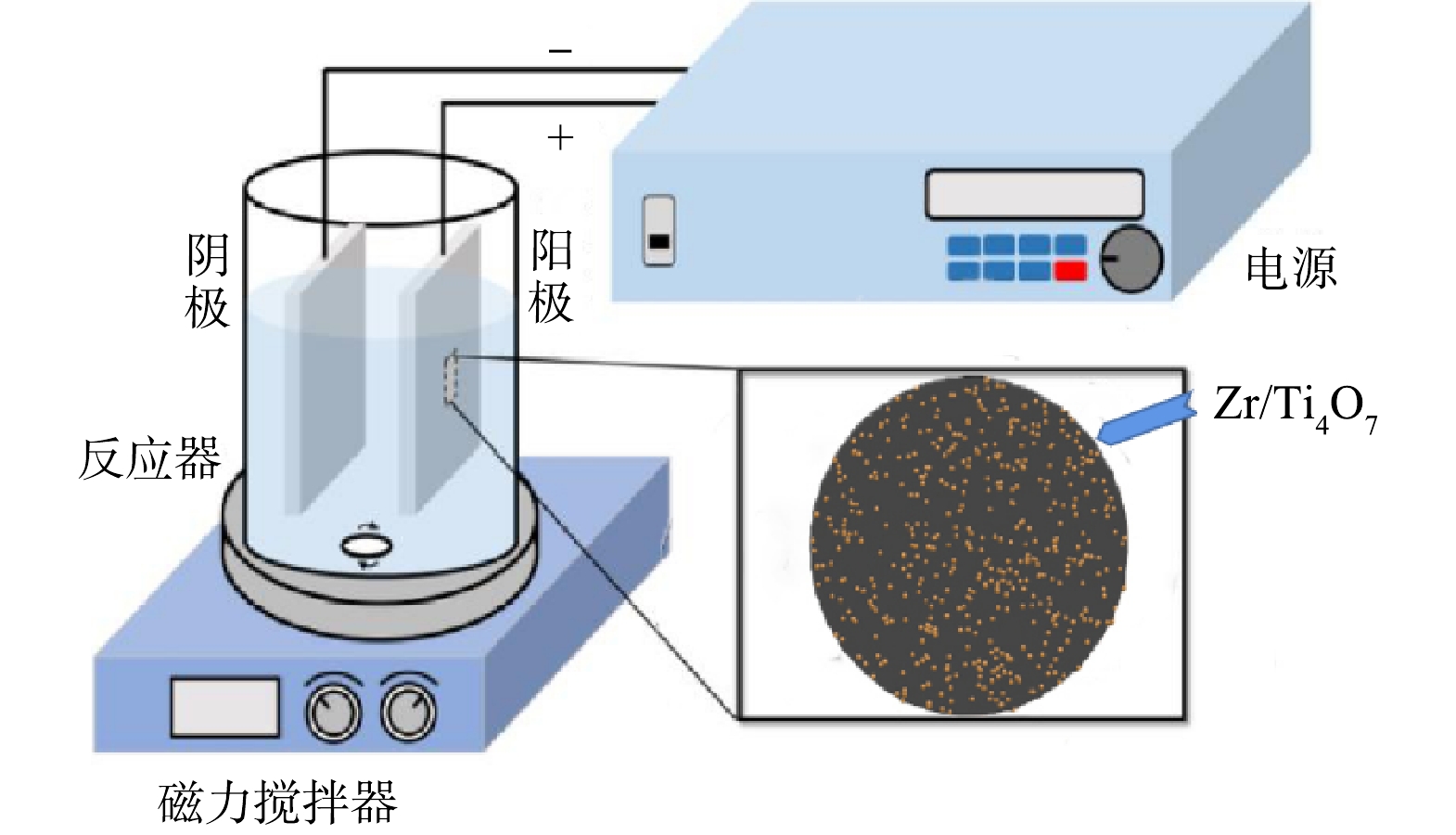
电化学降解过程,在室温下进行,装置见图1。Zr/Ti4O7或Ti4O7作为阳极,钛板作为阴极,电源采用直流稳压电源(大华无线,中国)。电化学催化氧化反应过程中,电极垂直浸入氯霉素水溶液中,阳极和阴极板之间的电极间距保持在1 cm。实验在100 mL的玻璃烧杯中进行,室温(298±1) K,磁力搅拌器转速为200 r·min−1。电解液体积为100 mL, 电解质Na2SO4浓度为100 mmol·L−1, 氯霉素质量浓度为20 mg·L−1。除非另有规定,否则不调整氯霉素反应溶液的pH。将电极插入反应溶液中,并连接到直流电源以调节功率。浸泡在溶液中的平板总面积为3.14 cm2, 接通直流电源立即启动反应。在整个反应过程中,在预定的时间间隔内,用注射器抽出样品,并立即在0.45 μm聚四氟乙烯膜上过滤。用高效液相色谱进行分析,所有样品至少测量2次。
-
实验采用高效液相色谱法(Agilent USA)测定氯霉素浓度。具体检测条件为:采用G1 365MWD紫外检测器;色谱柱为Eclipse XDB C18(5 μm,4.6 mm×250 mm);设置高效液相色谱仪检测波长为275 nm;柱温为30 ℃;流动相采用的是水∶甲醇=45∶55;流速为0.8 m L·min−1;进样量为10 μL。
不同实验参数下的每阶电能(electric energy per order, EEO)由式(1)计算得出。
式中:EEO为每阶电能,kWh·m−3;P为电催化氧化体系中电流产生的实际功率,kW;t为反应时间,min;C0和Ct为0和t时氯霉素的质量浓度,g·L−1;V为反应液体积,L。
-
1)图2为Ti4O7阳极和Zr/Ti4O7阳极在10 000倍下的SEM图。由图2中可以很明显的看出Ti4O7粉末颗粒在真空等离子烧结后颗粒熔融并且聚集在一起形成整体,纯Ti4O7阳极表面呈现出由熔融颗粒组成的致密结构(图2(a))。由图2(b)可以看出,纯Ti4O7电极在经过Ar气等离子体处理及Zr元素掺杂后,Ti4O7电极表面出现了明显的蚀刻现象。根据目前的研究报道,等离子体处理可以在Ti4O7电极表面产生氧空位,为后续掺杂Zr元素奠定基础[24]。由元素分布图可以看出(图2(c)),Zr/Ti4O7阳极表面主要组成元素是Zr、Ti和O元素,并且这些元素在Zr/Ti4O7阳极表面分布均匀,其原子质量占比分别为0.2%、64.4%和32.5%。
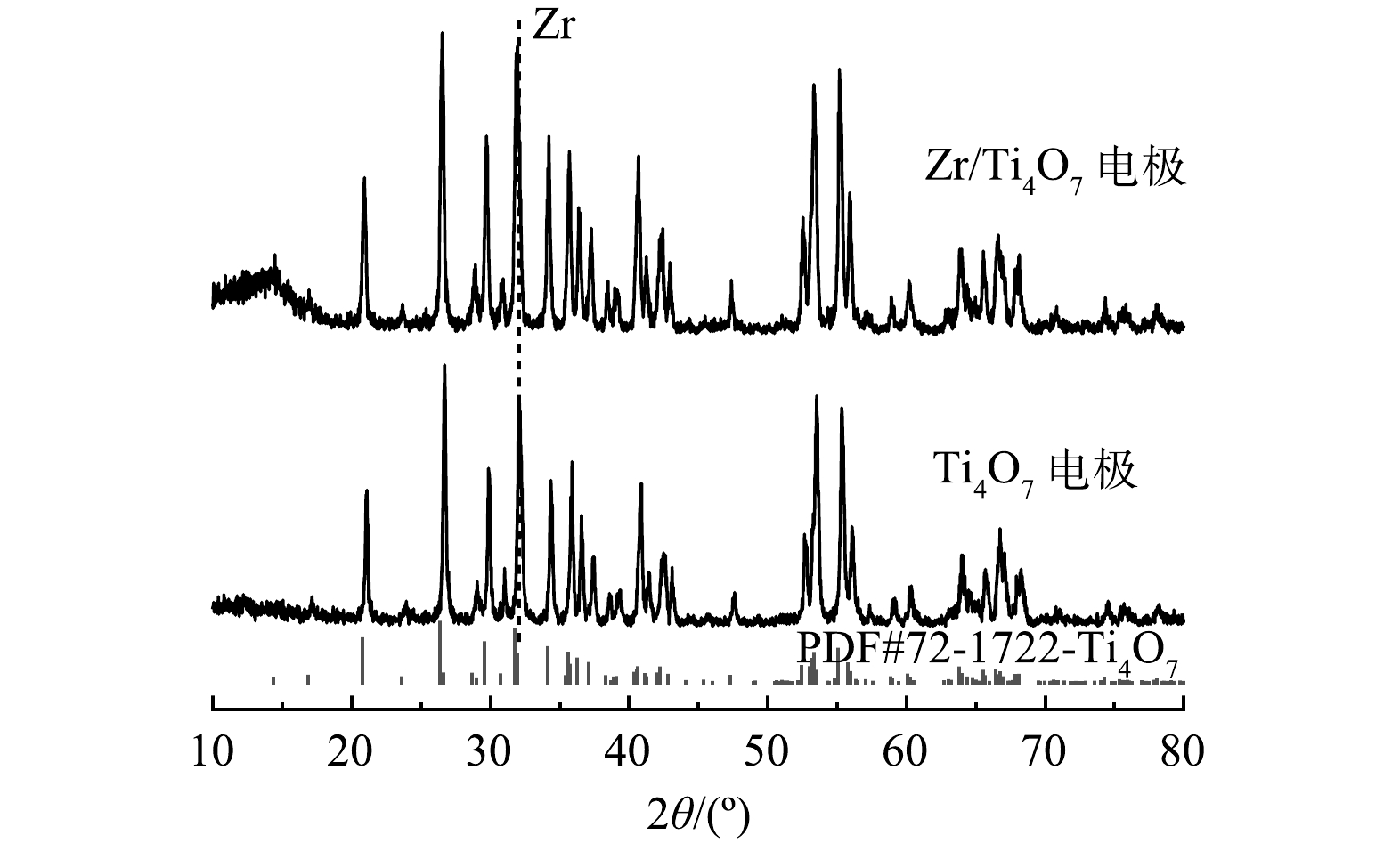
2)由XRD图谱(图3)可以看出,所制备的纯Ti4O7在2θ分别为20.78°、26.38°、29.59°、31.77°、34.10°、53.36°和55.08°等衍射角处均出现明显的特征衍射峰,符合XRD标准卡片谱图(JCPDS 72-1722)中Ti4O7的特征衍射峰;经过Zr掺杂改性后的Ti4O7电极表面的衍射峰在2θ≈31.7°处由于出峰位置出现了重叠,因而未出现新的峰,但峰强度明显有所增大,这证实了在Ti4O7表面成功掺杂了少量Zr元素。此外,通过比较改性前后的Ti4O7的XRD图谱,发现没有新峰出现,且改性前后峰没有明显的移位。这说明除了少量Zr元素掺杂外,其结构和组成基本没有变化。
-
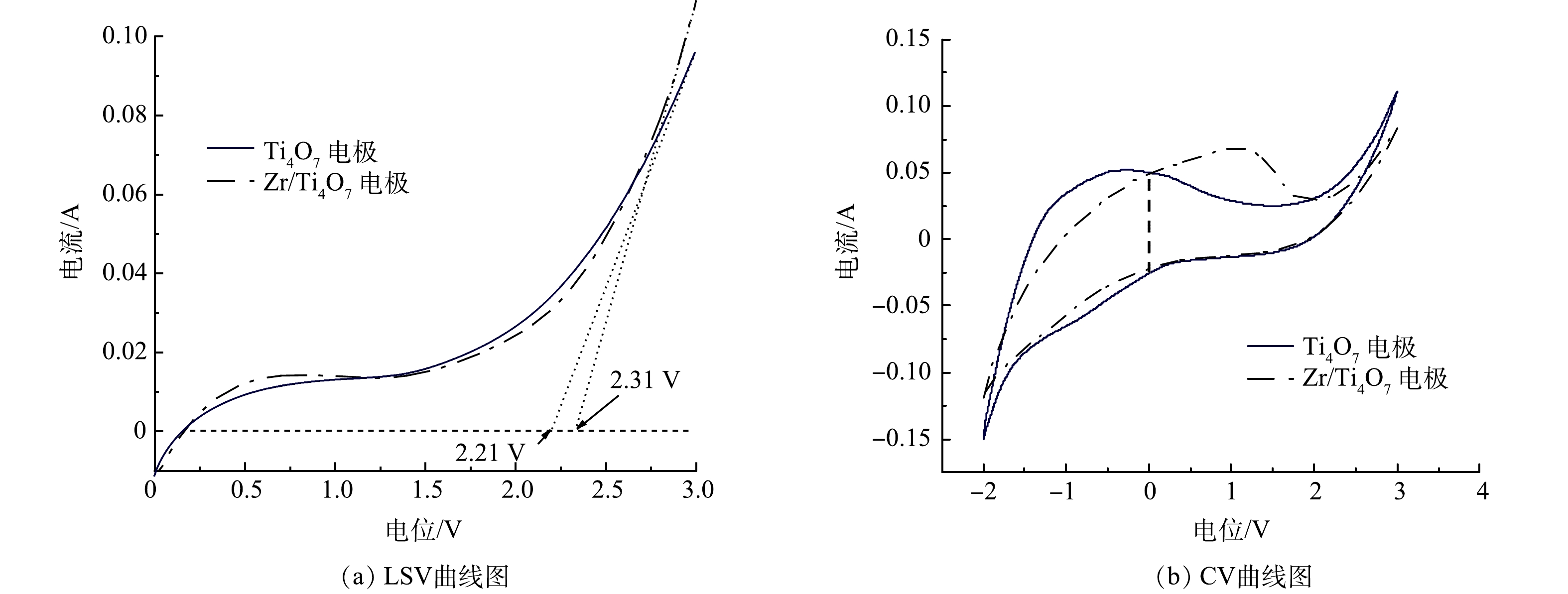
在0.1 mol·L−1 Na2SO4溶液中原始Ti4O7和Zr/Ti4O7电极的LSV光谱如图4(a)所示。结果表明,原始Ti4O7电极和Zr/Ti4O7电极的OEP分别为2.21 V和2.31 V,均接近BDD电极。LSV曲线能反映极板OEP值的变化规律,OEP值越高,电化学析氧副反应越难发生,因而电化学氧化有机物的电流效率越高[25]。Zr/Ti4O7电极的OEP高于纯Ti4O7电极,表明Zr/Ti4O7电极具有更高的水分解电子转移活性和更高的·OH生成速率[26]。图4(b)为纯Ti4O7电极和Zr/Ti4O7电极的CV扫描结果。如图4(b)所示,Zr/Ti4O7电极零电势的虚线与CV测试曲线所构成的闭合曲线代表的电流面积明显大于纯Ti4O7电极CV测试的电流面积,表明改性电极的电子转移活性较原电极增强。由CV测试结果来看,Zr/Ti4O7电极比原Ti4O7电极具有更大的电活性面积,这说明等离子体处理和Zr元素掺杂产生的氧空位在Ti4O7表面可提供额外的反应位点。
-
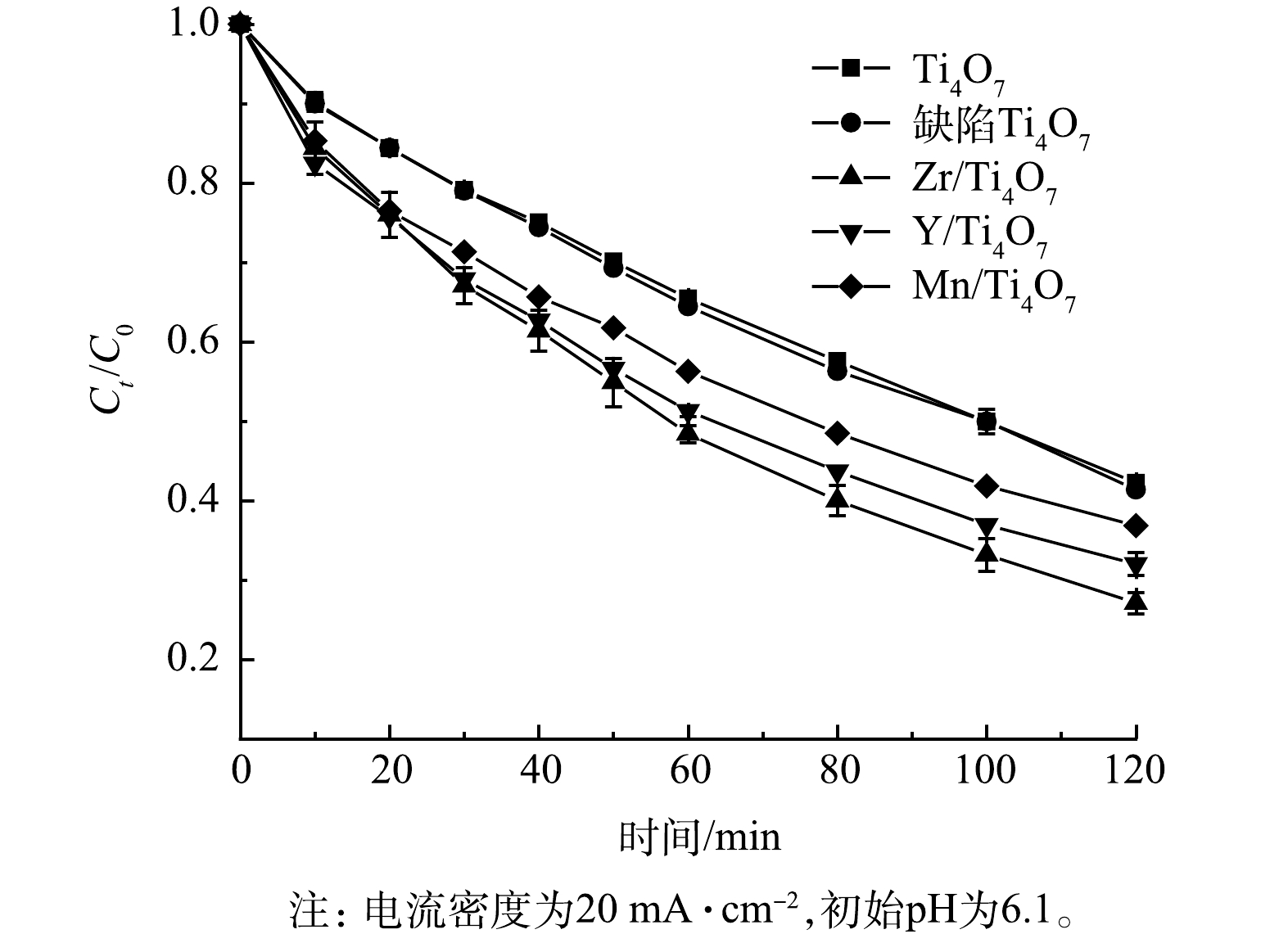
为了评价纯Ti4O7阳极、仅等离子体处理的缺陷Ti4O7阳极及不同过渡金属元素掺杂下的改性Ti4O7阳极在电化学体系下的催化活性,实验在制备Zr/Ti4O7阳极的同时,随机选取了2种过渡金属元素Y和Mn元素,制备了Y/Ti4O7和Mn/Ti4O7阳极。在初始电流密度为20 mA·cm−2、不改变溶液pH(pH=6.1)的条件下,降解2 h,2种电极对于氯霉素的去除率变化情况如图5所示。由图5可以看出,缺陷Ti4O7阳极对于氯霉素的最终去除率为58.6%,与纯Ti4O7阳极的去除效果几乎相同,因而,仅仅等离子体处理并没有实质性提高Ti4O7阳极的电催化性能。而Zr/Ti4O7、Y/Ti4O7、Mn/Ti4O7改性阳极在经过2 h的电氧化反应后,氯霉素的降解率分别为73.8%、69%和63%,优于纯Ti4O7阳极的降解率(57%)。此外,Zr掺杂改性后的阳极对氯霉素的降解率也是优于Y和Mn元素掺杂的Ti4O7阳极。可以发现,Ti4O7阳极在经过等离子体处理及过渡金属元素掺杂后的电催化活性均得到提升,同时,相同条件下的Zr/Ti4O7阳极比纯Ti4O7阳极的降解率提高了接近17%。这说明Zr元素的掺杂使得Ti4O7阳极对污染物的降解能力得到明显提高。该结果也与前面在电化学测量中所提到的Zr/Ti4O7电极相较于纯Ti4O7电极具有更高的析氧电位和更大的电活性面积这一结果相吻合。
有研究[24]表明,等离子体处理和过渡金属元素掺杂可以有效增加Ti4O7电极表面氧空位,从而大大增加·OH等自由基的生成概率,进而可促进污染物的降解。结果表明,Zr过渡金属元素相较于Y和Mn对于Ti4O7阳极具有更好的改性效果。这可能是因为Zr元素可以更好的调整O元素的电子结构从而更容易与O形成化学键,在形成化学键的同时会诱导Ti4O7表面产生氧空位,进而有效提高Ti4O7阳极的电催化活性[27]。
-
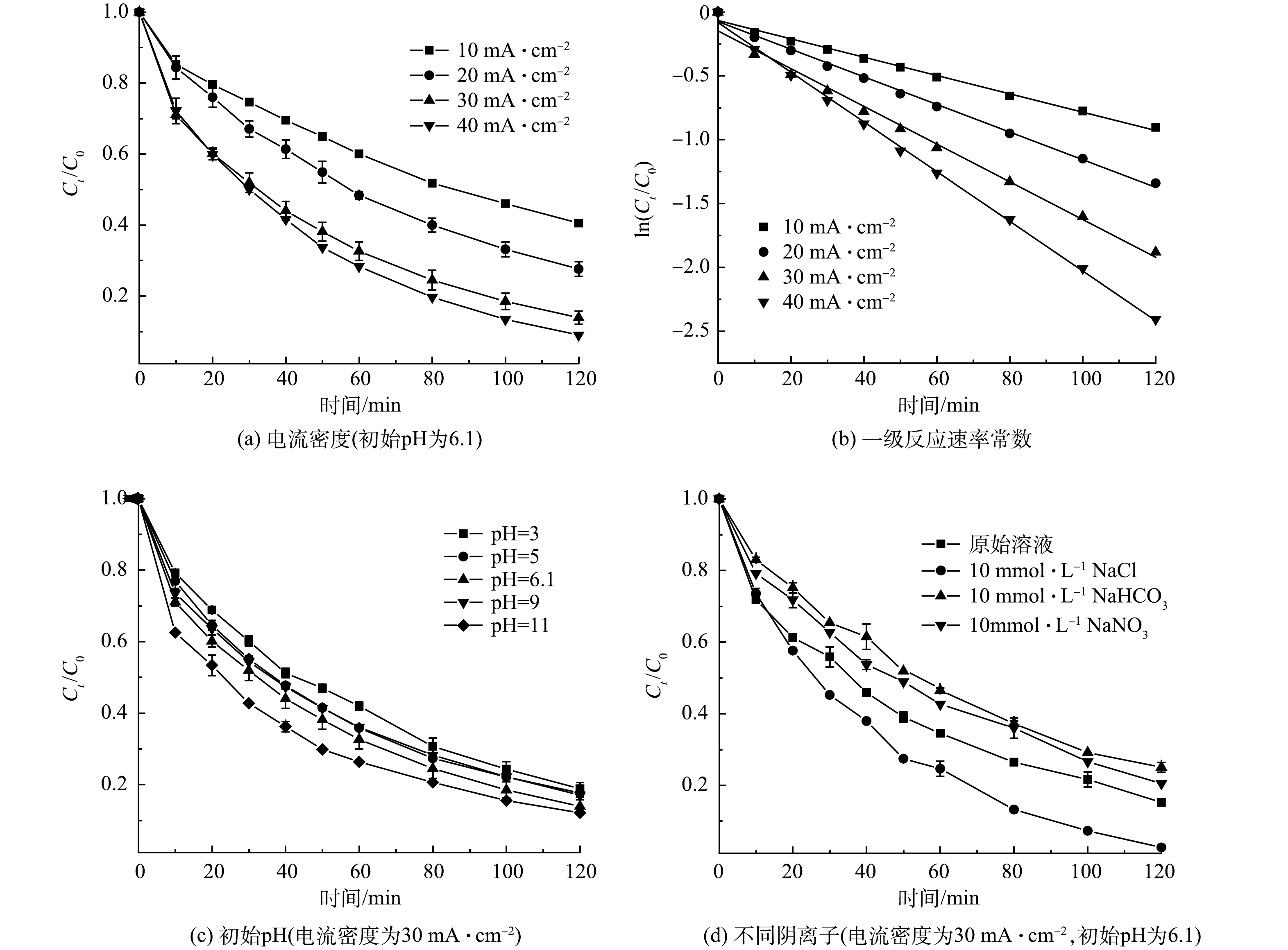
在Zr/Ti4O7阳极电化学降解氯霉素实验中,通过测定不同电流密度、溶液初始pH、溶液中共存阴离子等参数来验证反应过程中氯霉素质量浓度的变化,从而分析氯霉素的去除率变化规律。
本研究考察了当溶液初始pH=6.1,电流密度对氯霉素的降解影响。由图6(a)可以看到,氯霉素的降解率随电流密度的增大而增大。当电流密度由10 mA·cm−2增至40 mA·cm−2时,氯霉素降解率由59.5%增至91%,反应速率常数k由0.007 19 min−1增至0.019 48 min−1(表1)。可见,随着电流密度的增大,氯霉素电化学降解速率加快,并且反应符合一级反应动力学规律(图6(b))。有研究表明,在电化学氧化过程中,·OH的生成速率主要取决于施加的电流密度,电流密度越大,生成的·OH速率越快,从而加速了氯霉素的降解[28]。虽然氯霉素的降解效率随着电流密度的增加而提高,但随之而带来的能耗也有所上升,当电流密度由30 mA·cm−2增至40 mA·cm−2时,降解率增加了6.2%,能耗却增大了3.34 kWh·m−3,相比较下电流密度由20 mA·cm−2增至30 mA·cm−2时的降解率增大11%,能耗仅仅只增大了2.39 kWh·m−3。因此,综合考虑降解效率和能耗问题,后续实验选30 mA·cm−2最佳电流密度。
溶液的初始pH是电化学降解污染物的重要影响因素,也对自由基的产生起重要作用。在电流密度为30 mA·cm−2的条件下,用1mol·L−1的硫酸和氢氧化钠溶液将反应溶液初始pH调整为3、5、9和11,反应2 h后氯霉素的降解情况如图6(c)所示。在溶液初始pH为3~11时,氯霉素的降解率为81.1%~87.9%。可以明显的发现,以改性Ti4O7为阳极、电化学体系在较宽的pH范围内对ATL具有良好的降解效果。同时,由图6(c)中可以看到,酸性条件和弱碱性条件下抑制了氯霉素降解,但在强碱性溶液中,氯霉素的降解率相较于未调节pH之前又有所提高。这可能是溶液在较高的pH下,氯霉素分子容易失去2个可电离的氢原子,以促进亲电·OH的氧化。此外,氯霉素以阴离子的形式存在,更容易吸附在电极表面,有利于电迁移和传质[29]。考虑到调整溶液pH的额外成本以及污染物的最终去除率差异较小,后续研究选择不调节溶液pH。
电化学氧化降解实际废水时,大多数废水中会存在Cl−、HCO3−和NO3−等常见的阴离子,这些阴离子的存在或多或少会对污染物的降解起到影响作用。实验在电流密度为30 mA·cm−2,初始pH为6.1的条件下探究了不同无机阴离子对氯霉素降解的影响。不同无机阴离子的浓度均为10 mmol·L−1,结果如图6(d)所示。反应2 h后,加入Cl−的溶液中氯霉素的去除率达到了97.4%,Cl−的存在有效的增强Zr/Ti4O7阳极对氯霉素的降解能力。这可能是因为,在电化学体系中Cl−容易被氧化成活性氯自由基,从而与·OH一起加速了有机物的阳极氧化分解[30]。相反,HCO3−和NO3−的存在抑制了氯霉素的降解,其中HCO3−的抑制较为明显,这可能是因为HCO3−易与·OH反应生成活性较低的碳酸根自由基,与污染物竞争从而降低了氯霉素的降解率[31]。因此,在以Zr/Ti4O7为阳极的电化学氧化对污染物降解时,可以适当加入氯化钠作为一种合适且有效的辅助电解质。
-
经过检测发现,未通电的情况下,在Zr/Ti4O7阳极加入反应溶液前后,污染物浓度几乎没有变化,说明阳极对该污染物没有显著的吸附作用。因此,电催化降解体系中氯霉素的降解主要通过自由基的氧化和电极的直接电子转移实现。众所周知,叔丁醇是·OH的清除剂,对苯醌是超氧自由基(O2·−)的清除剂,而甲醇是大多数自由基的清除剂[32]。本实验采用叔丁醇、对苯醌和甲醇淬灭电催化体系降解氯霉素,探索反应体系中主要的自由基。在不添加清除剂的情况下,反应2 h后,氯霉素的降解率为86.1%。而加入0.05 mol·L−1叔丁醇后,反应2 h降解率降低至46%。同样,当添加5.4 g对苯醌时,氯霉素的降解率降低至68%。最后,当添加0.05 mol·L−1甲醇时,氯霉素的降解率被强烈抑制,仅为12%左右。从淬灭实验结果可以看出,·OH和O2·−对氯霉素的降解起主要作用,反应2 h后,·OH和O2·−对氯霉素降解的贡献率分别约为40%和18%。直接电子转移贡献率约占12%,而剩下约16%的降解率可能是存在·OH和O2·−的协同作用或其他未知自由基贡献的(图7)。
-
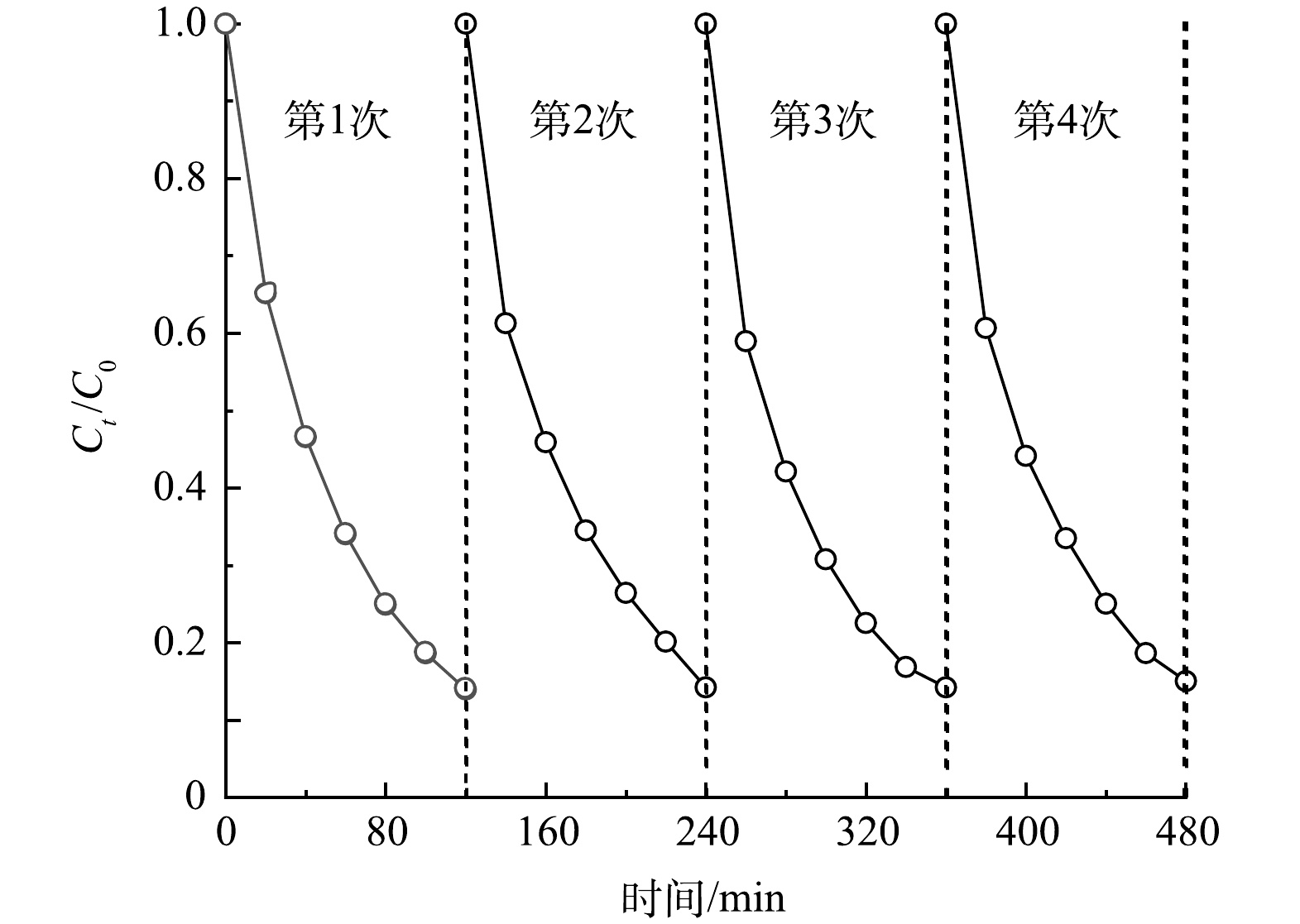
在电催化降解体系中进一步考察了Zr/Ti4O7阳极的稳定性。由图8可知,在电流密度为30 mA·cm−2、初始溶液pH为6.1的条件下,反应2 h后,氯霉素去除率达到86.1%左右。在相同的实验条件下对反应洗净后的Zr/Ti4O7阳极进行了4次循环实验。由图8可以看出,在4次循环实验中,Zr/Ti4O7阳极对氯霉素的降解率分别约为86%、85.8%、85.8%和85%。由此可见,改性电极对氯霉素的去除率几乎没有变化,在简便制备工艺下得到的改性电极稳定性优异,具有大规模工业应用的潜力。
-
上述结果证明利用Zr/Ti4O7阳极的电催化氧化可以实现对模拟氯霉素废水的快速降解。为进一步评估Zr/Ti4O7阳极对药物类废水降解的通用性,另外选取了一种抗生素类药物氟苯尼考和一种解热镇痛的抗炎药双氯芬酸钠,在最优反应参数条件下考察了他们的降解效能(图9)。反应2 h后,氟苯尼考和双氯芬酸钠的降解率分别达到93.4%和85.5%,这说明以Zr/Ti4O7作为阳极的电氧化同样可以高效降解氟苯尼考和双氯芬酸钠。可见,Zr/Ti4O7阳极用于电化学降解药品和个人护理产品这一类新兴污染物具有实用性。
综上所述,Zr/Ti4O7阳极对于药物类污染物具有优异的电氧化活性,尤其是在最优条件下对于氯霉素可以达到97.4%的降解率。相比较之下,使用载铁活性炭颗粒电极作为阳极降解氯霉素,在反应2 h候氯霉素的去除率仅有74.17%(表2)。另一种使用Ti/SnO2-Sb-Ni电极电氧化氯霉素虽然降解率可超过99%,但反应时间却需要300 min。同样还包括新型Al掺杂PbO2电极,其对于氯霉素的去除率也低于Zr/Ti4O7阳极。表2还反映了不同电极电氧化氟苯尼考和双氯芬酸钠的降解率。综合来看,Zr/Ti4O7阳极的电化学氧化性能较好。
-
1) Zr、Y、Mn元素掺杂的改性Ti4O7阳极对氯霉素的降解率分别为73.8%、69%和63%。与纯Ti4O7阳极(57%)相比可以发现,该改性工艺制备下的过渡金属元素掺杂的Ti4O7电极具有比原电极更优异的电催化性能。2)与纯Ti4O7阳极相比,采用过渡金属元素Zr掺杂制备的Zr/Ti4O7阳极对水中氯霉素的去除效果最佳。在电流密度为30 mA·cm−2,初始pH为6.1,电解质为Na2SO4(100 mmol·L−1)和少量NaCl (10 mmol·L−1)时,Zr/Ti4O7阳极对氯霉素降解率最高,为97.4%。通过对其进行SEM、XRD及电化学性能的表征可知,该电极表面具有丰富的氧空位,具备较高的析氧过电位和优异的电化学活性等优点。3) Zr/Ti4O7阳极对氯霉素具有良好的降解效果得益于自身的电子转移以及溶液中·OH和O2·−对于污染物的氧化,电氧化阳极产生的·OH是氯霉素去除的主要氧化自由基。4)改性电极具有优异的稳定性,同时该阳极对氟苯尼考和双氯芬酸钠等药物模拟废水同样具有优异的降解性能,在最佳条件下其降解率分别能达到93.4%和85.5%。
改性Ti4O7阳极对氯霉素的高效电氧化降解
Highly efficient electrooxidation degradation of chloramphenicol by modified Ti4O7 anode
-
摘要: 针对传统电化学氧化中阳极是污染物催化氧化的核心,寻找一种具有高析氧电位,高反应活性面积,优良催化活性的阳极是当下亟待解决的问题。为此,选取了亚氧化钛(Ti4O7)电极作为基础电极且对其进行过渡金属元素掺杂改性。通过各种表征及降解性能研究发现,所制备改性电极相对于纯Ti4O7电极催化性能有所提高。其中,锆(zirconium, Zr)元素掺杂后使得改性电极具有更高的析氧电位和更好的电催化活性。在电流密度为30 mA·cm−2,初始pH为6.1,电解质为100 mmol·L−1 Na2SO4和10 mmol·L−1 NaCl的最优条件下,氯霉素的去除率为97.4%。并且该电极具有很好的抗干扰性和稳定性,在不同pH干扰下对氯霉素依然具有较高的降解率(均高于81.1%)。此外,Zr元素掺杂的Ti4O7改性电极对氟苯尼考和双氯芬酸钠等药物也具有很好的降解效果,降解率分别为93.4%和85.5%,本研究结果可为电化学去除污染物阳极改性研究提供参考。
-
关键词:
- 电化学氧化 /
- Zr/Ti4O7阳极 /
- 掺杂 /
- 氧空位 /
- 氯霉素
Abstract: Considering that anode is the core of catalytic oxidation of pollutants in traditional electrochemical oxidation, it is urgent to find an anode with high oxygen evolution potential, high reactivity area and excellent catalytic activity. In this study, titanium oxide (Ti4O7) electrode was selected as the base electrode and modified by doping the transition metal element. Various characterization and degradation experiments showed that the catalytic ability of the modified electrode increased compared with that of pure Ti4O7 electrode. Of which, Zirconium (Zr) doping increased the oxygen evolution potential and electrocatalytic activity. Under the optimal conditions: current density of 30 mA·cm−2, initial pH 6.1, electrolyte of 100 mmol·L−1 Na2SO4 and 10 mmol·L−1 NaCl, the removal rate of chloromycin was 97.4%. Moreover, the electrode had a good anti-interference and stability, and still had excellent degradation rates of chloromycin under different pH interference (all higher than 81.1%). At the same time, zirconium-doped Ti4O7 modified electrode also had a good degradation ability to flufenicol or diclofenac sodium, their degradation rate reached 93.4% and 85.5%, respectively. This study provides a reference for the electrochemical removal of pollutants and anode modification research.-
Key words:
- electrochemical oxidation /
- Zr/Ti4O7 anode /
- doping /
- oxygen vacancy /
- chloramphenicol
-
近些年,我国城市规模不断发展扩大,城市机动车保有量逐年增加,地上空间不断缩小. 地下车库作为城市重要的停车场所,其使用频率不断上升. 然而,地下车库在解决停车需求、缓解城市空间紧张度的同时,也带来了一系列环境污染问题. 汽车尾气排放是造成城市空气污染的重要污染源,而地下车库中汽车来往频繁,且地下车库空间结构普遍为封闭半封闭性,加剧了地下车库空气污染的风险. 汽车尾气主要排放一氧化碳、氮氧化物、挥发性有机物、颗粒物等污染物质,其中细颗粒物(fine particulate matter,PM2.5)可在空气中漂浮多天,长期暴露于高水平PM2.5会增加罹患癌症的风险;同时,其中附着的一些重金属元素,具有难降解、高生物亲和力、高毒性等特点,被人体吸入、摄食后会对呼吸系统、心血管系统造成影响[1 − 2]. 细颗粒物污染不仅会影响空气质量,还会对水体、土壤等生态系统造成严重影响,破坏生态环境[3].
目前,国内外针对地下车库PM2.5及重金属污染展开了一定的研究. Li等[4]在2011年研究了武汉某地下车库的颗粒物污染情况,并检测PM10颗粒物样品中的Fe、Mn、Zn、Pb、Cu等元素,结果发现车库出口相比入口,PM10和PM2.5污染更严重,且PM10颗粒物中最丰富的元素是Fe. Liu等[5]于2019年以保定市8个居民区为研究对象,定量评价了自然通风地下车库工作日颗粒物(PM2.5和PM10)、CO2和TVOC浓度及其与交通量的关系. 结果表明,地下车库中PM2.5和PM10浓度分别略高于和显著高于周边环境;地下车库中PM10和TVOC浓度与交通流量均呈极显著相关(P < 0.01),PM2.5浓度与环境浓度普遍呈极显著相关(P < 0.01). 2013年,Obaidullah等[6]比较了比利时3个不同的封闭式停车场和两条街道的颗粒物污染情况,发现车库中的颗粒物浓度总体上显著高于街道浓度,同时PM2.5 浓度超过世卫组织(WHO)和美国环保署(US EPA)推荐的24 h参考值,PM10浓度也超过了 WHO 和欧盟(EU)准则.
另一方面,国内外也展开了很多针对颗粒物中重金属的风险评价研究,其中大部分采用了US EPA颁布的风险评价模型[7 − 10]; 但目前鲜有针对地下车库这一特定环境颗粒物重金属健康风险的研究. 鉴于此,本研究旨在监测地下车库微环境空间的颗粒物污染状况,了解车库空气颗粒物的时空分布特性及重金属组成成分的特征,同时参考US EPA颁布的健康风险评价模型,针对地下车库工作人员和停车用户确定不同的污染物暴露模型参数并进行健康风险评价,以期为地下车库空间的大气污染控制提供科学依据和理论支持.
1. 材料与方法(Materials and methods)
1.1 样品采集
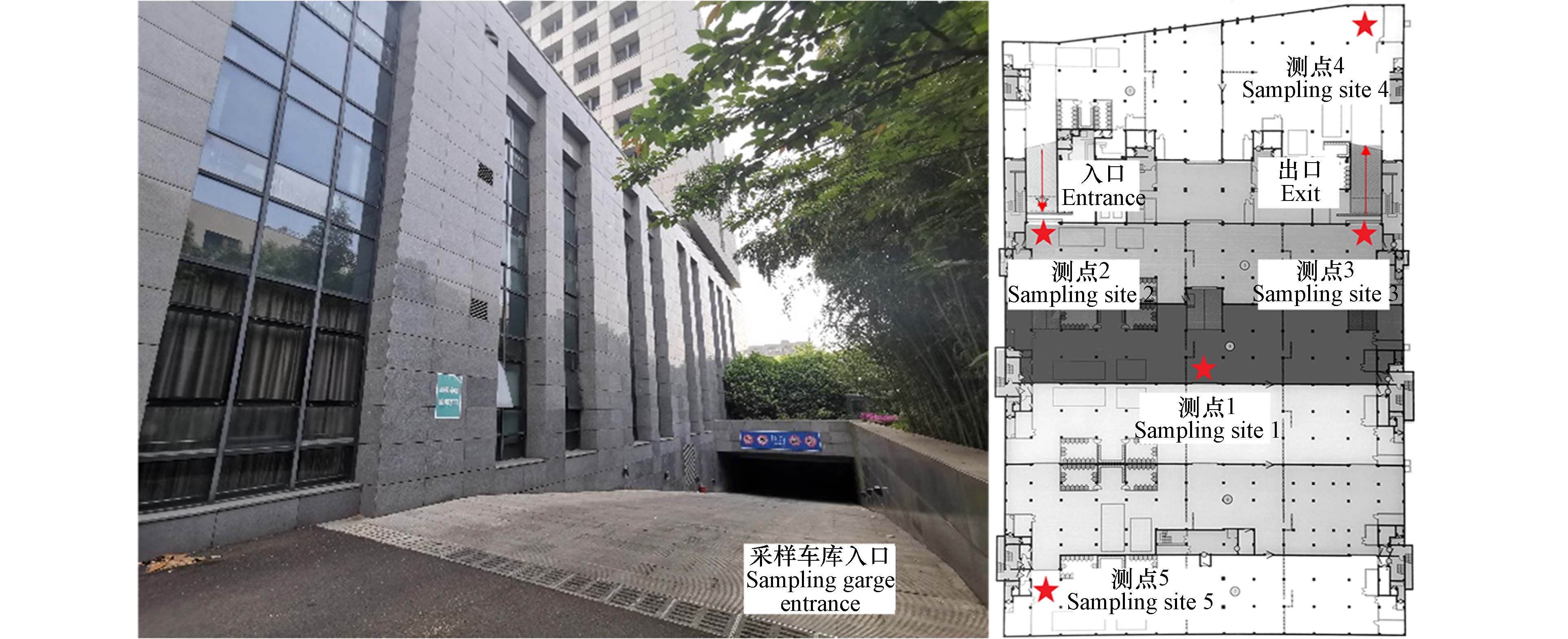
本研究采样点位于南京大学仙林校区扬州楼北楼停车场,地下车库占地
13574 m2,设计停车位249个. 车库设有1个车辆入口、1个车辆出口和8个战时人防通道,车库内机械通风系统未运行. 车库主要为校内教职工通勤所使用;车库内有6个工作岗位,分别位于车库出入口、车库西南角及东北角及车库中心两侧,工作人员会经常性地在不同岗位交替站岗工作,工作日每日工作8 h,且岗亭中设有办公及休息区域,可以认为工作人员8 h均处在车库环境中. 本研究采样点布设原则参考《环境空气质量监测点位布设技术规范(试行)》(HJ 664—2013)[11],水平方向上选择车库出入口、车库离入口较远的内部(通风死角)、车库中部(核心区)等位置;垂直方向上在人体呼吸区高度(距离地面1.5 m高度)采样,以供后续健康风险评价使用. 采样车库位置及具体采样点如图1所示.本研究采样时间为2023年3月—2023年5月,采样质量保证及控制方法参照《环境空气质量手工监测技术规范》(HJ 194—2017)[12]中滤膜采样法的相关要求进行. 采样期间每组采样2次,其中4组分别在工作日(周一至周五)和休息日(周六至周日)各采样1次;另有两组对五一节假日及进行特别监测,节假日按休息日计、调休周末按工作日计. 通过12次采样,得到共60份有效实验样本. 使用搭载PM2.5大气颗粒物切割器(崂应)的中流量智能TSP采样器(崂应2030A型)及90 mm玻璃纤维滤膜(崂应)采集颗粒物样品,每次采样采集5个点位,设置采样流量为100 L·min−1,采样时间24 h.颗粒物采样时的气温、大气压数据来自颗粒物采样器;用于对比分析的环境背景PM2.5浓度来自中国空气质量在线监测分析平台的南京空气质量指数日历史数据[13].
1.2 样品处理与分析
试样制备方法参考《空气和废气 颗粒物中金属元素的测定 电感耦合等离子体发射光谱法》(HJ 777—2015)[14]进行. 本实验使用PQ9000电感耦合等离子体发射光谱仪(ICP-OES,德国Analytik Jena公司)测定PM2.5样品中8种重金属(Pb、Cr、Cu、As、Ni、Cd、Co、Mn)的质量浓度.
1.3 健康风险评价
以US EPA发布的人体健康风险评估模型为基本框架,研究Pb、Cr、Cu、As、Ni、Cd、Co和Mn共8种重金属对人体的健康风险.
(1)暴露模型计算方法
本研究评估使用采样车库的不同人群(工作人员、停车用户)通过PM2.5吸入的颗粒物重金属的健康风险,使用以下公式计算每日经呼吸系统进入人体的重金属剂量:
stringUtils.convertMath(!{formula.content}) (1) 式中,ADD为非致癌物质日均暴露剂量,mg·(kg·d)−1;LADD为致癌物质终身日均暴露剂量, mg·(kg·d)−1;C为颗粒物重金属质量浓度,mg·m−3. 其它参数意义及单位见表1.
表 1 健康风险评估模型参数Table 1. Parameters used in health risk assessment model表1给出了基于国内现有研究及US EPA总结的各参数具体取值. 其中,根据车库所在单位的使用性质、工作要求等情况,使用车库工作人员每日工作8 h,停车用户每日使用车库0.5 h为模型参数;所有人群均假设为成年人且不分性别.
(2)健康风险表征
根据US EPA综合风险信息系统(IRIS)和国际癌症研究机构(IARC)的分类标准,将被认为具有致癌效应的As、Cd、Ni、Co和Cr分为第一组,将非致癌性金属Cu、Pb、Mn分为第二组. 第一组元素同时计算致癌/非致癌风险,第二组元素只计算非致癌风险.
单个元素的非致癌风险以危害系数(hazard quotient, HQ)衡量,计算公式为:
stringUtils.convertMath(!{formula.content}) (2) 式中,RfD为日参考摄入剂量(reference doses),mg·(kg·d)−1.
采用危害指数(hazard index, HI)计算元素的总体非致癌风险,HI>1表明可能产生非致癌风险,数值越大,风险越高. HI计算公式为:
stringUtils.convertMath(!{formula.content}) (3) 致癌物质被认为不存在阈值,使用增量终身致癌风险值(incremental lifetime cancer risk, ILCR)定量形容污染物的致癌风险,计算公式为:
stringUtils.convertMath(!{formula.content}) (4) 式中,SF为斜率因子(slope factor, SF),[mg·(kg·d)−1]−1.
ILCR的容许极限值为10−6—10−4.ILCR值低于10−6表明致癌风险可忽略;ILCR值在10−6—10−5之间表明存在较小概率的致癌风险;ILCR值在10−5—10−4之间表明存在较大概率的致癌风险;ILCR值高于10−4表明有确定的致癌风险.8种元素的RfD及SF值列于表2.
表 2 重金属元素的参考剂量和致癌斜率因子Table 2. Reference doses and slope factors of heavy metals元素Element 参考剂量/[mg·(kg·d)−1]RfD 致癌斜率因子/[mg·(kg·d)−1]−1SF As 3.00×10−4 15.1 Cd 1.00×10−3 6.10 Co 5.71×10−6 9.8 Ni 2.06×10−2 0.84 Cr 2.86×10−5 41 Cu 4.02×10−2 — Mn 1.43×10−5 — Pb 3.52×10−3 — 2. 结果与讨论 (Results and discussion)
2.1 PM2.5污染特征
图2(a)反映了采样点平均PM2.5浓度与对应时间的南京市PM2.5浓度变化. 结果表明,整个采样期间内,采样点平均PM2.5质量浓度为(42.12±13.64) μg·m−3,浓度变化范围为26.62—66.70 μg·m−3. 同时可以看出,所有采样时间段中,采样所在地下车库的PM2.5质量浓度均明显高于南京市区平均PM2.5浓度,与其变化趋势基本一致. 从图2还可以看出,采样时间段内车库PM2.5平均浓度最低的时间集中在五一黄金周附近,推测为五一期间:(1)学校放假,车库中车流量很低,空气中的颗粒物稳定沉降,使得PM2.5浓度不断降低;(2)南京市空气质量较好,由外部环境带入的空气颗粒物浓度较低;(3)栖霞街道区域发生了强度较高的降雨,由于高强度降雨对PM2.5的清除作用[17],导致PM2.5浓度有所降低.
 图 2 PM2.5浓度变化及时空分布特征Figure 2. PM2.5 concentration changes and its spatiotemporal distribution characteristics(a)采样车库与南京市PM2.5浓度变化;(b)不同时间PM2.5浓度;(c)不同采样点PM2.5浓度变化;(d)不同采样点PM2.5平均浓度(a) Changes of PM2.5 concentration from sampling garage and Nanjing city; (b) PM2.5 concentration at different times; (c) Changes of PM2.5 concentration at different sampling points; (d) Average concentration of PM2.5 at different sampling sites
图 2 PM2.5浓度变化及时空分布特征Figure 2. PM2.5 concentration changes and its spatiotemporal distribution characteristics(a)采样车库与南京市PM2.5浓度变化;(b)不同时间PM2.5浓度;(c)不同采样点PM2.5浓度变化;(d)不同采样点PM2.5平均浓度(a) Changes of PM2.5 concentration from sampling garage and Nanjing city; (b) PM2.5 concentration at different times; (c) Changes of PM2.5 concentration at different sampling points; (d) Average concentration of PM2.5 at different sampling sites以工作日和休息日区分各采样时间段,得到不同时间采样点PM2.5平均质量浓度对比如图2(b)所示. 由图2(b)可知,采样期间工作日PM2.5平均质量浓度略高于休息日,分别为43.17 μg·m−3和41.06 μg·m−3,且工作日存在异常偏高值(82.12 μg·m−3). 工作日期间,行政楼来往车辆较多,汽车尾气排放产生的颗粒物较多,且车流量、人流量大,扬起沉降到地面的颗粒物,并且进入车库的过程中也会携带外界的灰尘. 但总体来说,工作日和休息日的PM2.5浓度区别不大,可以认为车流量对地下车库颗粒物浓度的影响程度相对外界环境颗粒物污染对车库PM2.5浓度的直接影响程度较小.
采样方案确定的各采样点中,5个采样点分别代表车库几何中心(采样点1)、车库入口(采样点2)、车库出口(采样点3)、车库通风死角(采样点4)和正对入口的车库拐角(采样点5). 分别考察采样时间段内不同采样点位PM2.5质量浓度变化和平均PM2.5质量浓度对比,结果分别如图2(c)和2(d)所示. 由图可知,采样期间5个采样点位的PM2.5质量浓度变化趋势基本一致,平均PM2.5质量浓度分别为42.59 μg·m−3、47.62 μg·m−3、43.66 μg·m−3、39.51 μg·m−3和37.21 μg·m−3,平均浓度由高到低排序依次为:采样点2>采样点3>采样点1>采样点4>采样点5.采样点2为车库入口,汽车进入车库的过程中,由于带入外界颗粒物、扬起地面上的降尘、怠速阶段汽车颗粒物排放量增加[18]等因素,导致该点的颗粒物浓度最大. 采样点3为车库出口,同样存在扬起降尘、汽车颗粒物排放等问题,此外,汽车在冷启动过程中,由于发动机和催化器还没有达到最佳工作温度,也可能导致更多的颗粒物排放[19]. 采样点1作为采样车库结构的几何中心,由于该车库采用自然通风,空间相对封闭,空气流通较差,颗粒物在车库中难以扩散,加上中心汽车流量大,容易产生较大的颗粒物污染. 采样点4为车库通风死角,颗粒物扩散难度更大,但由于车库死角的车流量很小,此处受到汽车尾气排放和扬起降尘的影响小,导致其PM2.5污染相对较低. 而采样点5作为正对车库入口的拐角处,由于通风效果相对较好、车流量相对车库中心更小等因素,使得其PM2.5污染最低.
总之,可以认为汽车排放及扬尘对采样期间所测车库PM2.5污染的影响相比车库结构导致的较差通风性对车库PM2.5污染的影响更大. 事实上,车辆出入口的人员活动相对密集,其造成的健康风险应得到重点关注.
2.2 PM2.5中重金属污染特征及健康风险评价
PM2.5中Pb、Cr、Cu、As、Ni、Cd、Co和Mn共8种重金属的平均浓度如图3(a)所示. 采样时间段内,测样车库PM2.5中测定重金属的平均总质量浓度为0.082 μg·m−3,在PM2.5平均质量浓度中占比约0.21%. 车库PM2.5中所测重金属元素的质量浓度从大到小排序依次为:Cu>Mn>Pb>As>Cr>Ni>Co>Cd,其中Cu元素平均质量浓度最高,达到了31 ng·m−3.
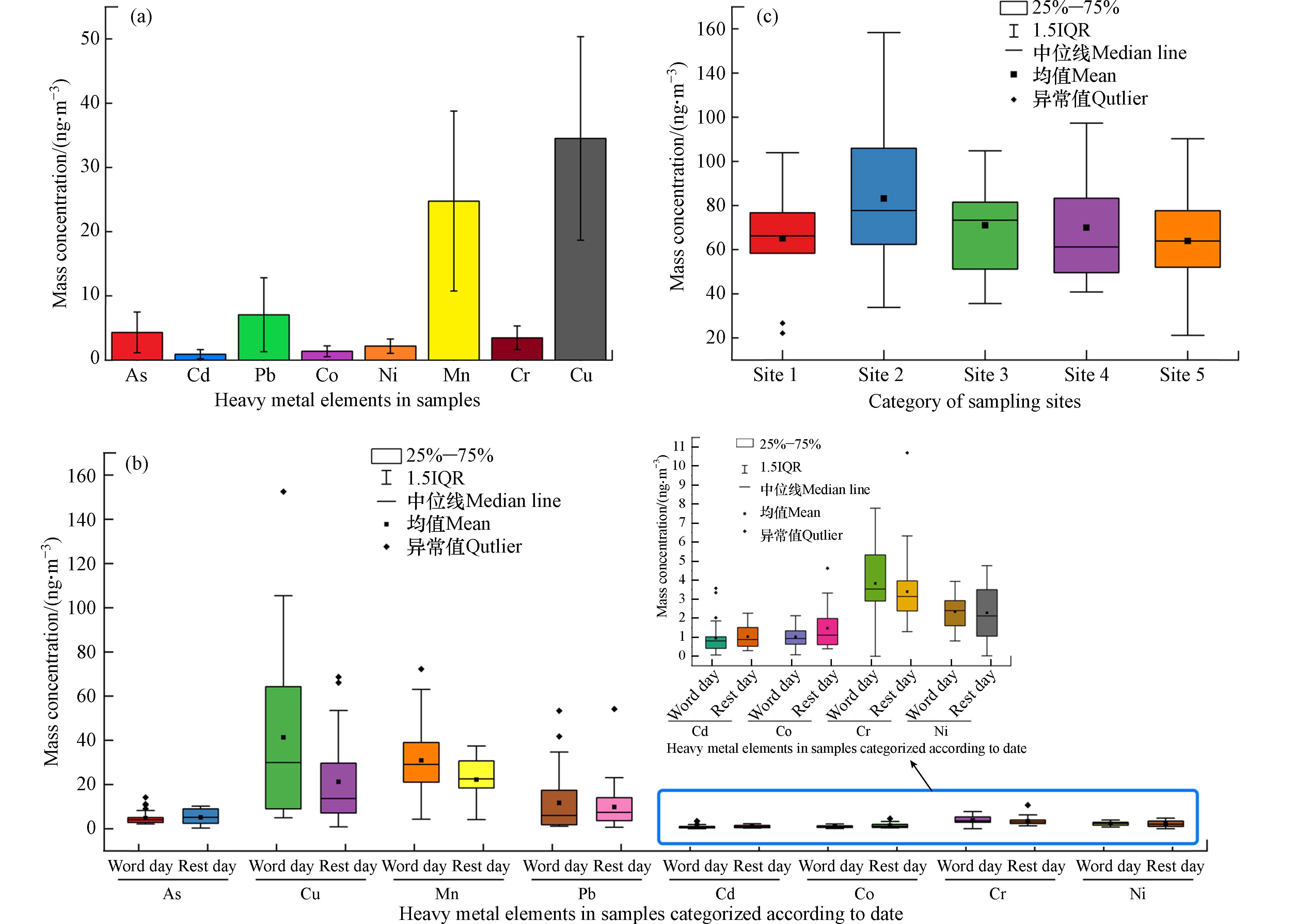 图 3 PM2.5中重金属污染特征Figure 3. Characteristics of heavy metal pollution in PM2.5(a) PM2.5中各重金属平均浓度;(b)不同采样点PM2.5中各重金属浓度对比;(c)不同采样点PM2.5中重金属平均浓度(a) Average concentration of each heavy metal in PM2.5; (b) Concentration comparison of heavy metals in PM2.5 at different sampling sites; (c) Average concentration of heavy metals in PM2.5 at different sampling sites
图 3 PM2.5中重金属污染特征Figure 3. Characteristics of heavy metal pollution in PM2.5(a) PM2.5中各重金属平均浓度;(b)不同采样点PM2.5中各重金属浓度对比;(c)不同采样点PM2.5中重金属平均浓度(a) Average concentration of each heavy metal in PM2.5; (b) Concentration comparison of heavy metals in PM2.5 at different sampling sites; (c) Average concentration of heavy metals in PM2.5 at different sampling sites类比PM2.5质量浓度分析方法,以工作日和休息日区分各采样时间段,得到不同时间采样点PM2.5中各重金属平均质量浓度对比如图3(b)所示. 可以发现,所测重金属中Cu、Mn、Pb、Cr、Ni 等5种重金属元素平均质量浓度遵循工作日>休息日的规律,推测为汽车尾气排放、机器磨损等过程中进入空气的颗粒物重金属含量高于环境空气中的颗粒物重金属含量,因而相比于外界环境颗粒物污染的直接影响,车流量对地下车库颗粒物浓度的影响程度更大;而As、Cd、Co 的3种重金属元素不符合此规律,考虑到颗粒物污染来源广泛,质量浓度较小的重金属元素受到外界环境污染源中相应元素含量的影响可能更大. 考察采样期间不同采样点PM2.5中重金属的平均浓度,结果如图3(c)所示. 采样期间各采样点平均PM2.5中重金属质量浓度分别为65 ng·m−3、83 ng·m−3、71 ng·m−3、70 ng·m−3及64 ng·m−3,平均浓度由高到低排序依次为:采样点2>采样点3>采样点4>采样点1>采样点5,与PM2.5浓度空间分布规律基本一致.
利用上述重金属暴露模型,分别计算采样期间内测样地下车库工作人员、停车用户吸入PM2.5颗粒物中8种重金属元素的非致癌及致癌暴露量,结果见表3. 鉴于采样车库的工作及使用情况,重金属质量浓度采用所有工作日浓度的平均值同时代表工作人员和停车用户的呼吸情况. 由表3可知,8种重金属中,Cu的非致癌日均暴露量最高,分别为ADD工作人员=2.64×10−6 mg·(kg·d)−1和ADD停车用户=1.65×10−7 mg·(kg·d)−1;As的致癌终身暴露量最高,分别为LADD工作人员=3.01×10−7 mg·(kg·d)−1 和LADD停车用户=1.88×10−8 mg·(kg·d)−1.
表 3 PM2.5中重金属的吸入暴露量Table 3. Inhalation exposure of heavy metals in PM2.5重金属Heavy metal ADD/mg·(kg·d)−1 LADD/mg·(kg·d)−1 工作人员Worker 停车用户User 工作人员Worker 停车用户User As 4.22×10−7 2.64×10−8 3.01×10−7 1.88×10−8 Cd 8.37×10−8 5.23×10−9 5.98×10−8 3.74×10−9 Co 1.06×10−7 6.61×10−9 7.55×10−8 4.72×10−9 Ni 1.95×10−7 1.22×10−8 1.40×10−7 8.72×10−9 Cr 3.05×10−7 1.91×10−8 2.18×10−7 1.36×10−8 Cu 2.64×10−6 1.65×10−7 — — Mn 2.24×10−6 1.40×10−7 — — Pb 9.11×10−7 5.69×10−8 — — 利用上述健康风险效应模型,分别计算采样地下车库工作人员、停车用户通过空气吸入PM2.5颗粒物中8种重金属元素的非致癌风险和5种致癌重金属元素的致癌风险,结果如表4所示.
表 4 PM2.5中重金属的非致癌风险及致癌风险Table 4. Non-carcinogenic and carcinogenic risks of heavy metals in PM2.5重金属Heavy metal HQ ILCR 工作人员Worker 停车用户User 工作人员Worker 停车用户User As 1.41×10−3 8.79×10−5 4.55×10−6 2.84×10−7 Cd 8.37×10−5 5.23×10−6 3.65×10−7 2.28×10−8 Co 1.85×10−2 1.16×10−3 7.40×10−7 4.62×10−8 Ni 9.48×10−6 5.93×10−7 1.17×10−7 7.32×10−9 Cr 1.07×10−2 6.66×10−4 8.93×10−6 5.58×10−7 Cu 6.57×10−5 4.11×10−6 — — Mn 1.57×10−1 9.81×10−3 — — Pb 2.59×10−4 1.62×10−5 — — 合计(HI/ILCRtotal) 0.1879 0.0117 1.47×10−5 9.19×10−7 针对非致癌风险,工作人员和停车用户的危害指数HI分别为
0.1879 和0.0117 ,均处于安全范围内,说明其对人体健康影响较小. 对于工作人员和停车用户,各重金属元素非致癌风险危害系数由高到低排序都依次为:Mn>Co>Cr>As>Pb>Cu>Cd>Ni,其中Mn的非致癌风险HQ值最高,工作人员和停车用户分别为0.157和9.81×10−3,占非致癌风险的绝大部分.针对致癌风险,工作人员和停车用户的增量终身致癌风险总值ILCRtotal分别为1.47×10−5和9.19×10−7,对工作人员存在较高概率的致癌风险,对停车用户的致癌风险可以忽略. 对于工作人员而言,Co、Cd、Ni 3种元素的致癌风险可以忽略,而As和Cr的致癌风险达到了低概率致癌水平,分别为4.55×10−6和8.93×10−6;对于停车用户而言,所有5种元素的致癌风险都可忽略. 对于工作人员和停车用户,各重金属元素非致癌风险危害系数由高到低排序依次为:Cr>As>Co>Cd>Ni,其中Cr的致癌风险ILCR值最高,分别为8.93×10−6和5.58×10−7. 可以发现,对于地下车库工作人员,PM2.5中重金属元素导致的癌症风险已不容忽视,虽然在可接受范围内,但可能在暴露个体的整个生命周期中存在较高的潜在性致癌健康风险. 尽管Cr在测样PM2.5颗粒物中的质量浓度相对较低,而由于其较高的毒性,在采样车库中可能产生了最为明显的致癌健康风险.
以每个采样组中的工作日平均浓度作为衡量不同人群在车库中的重金属暴露情况,分析不同时间重金属的非致癌风险及致癌风险变化,结果如表5所示. 可以发现,不论对工作人员还是停车用户,致癌风险和非致癌风险随时间的变化趋势都有所不同,其中非致癌风险(HI值)最高分别为0.352和
0.0220 ,最低分别为0.082和0.0052 ;致癌风险(总ILCR值)最高分别为2.13×10−5和1.33×10−6,最低分别为5.76×10−6和3.60×10−7. 本次测试中,决定非致癌风险和致癌风险的重金属元素分别为Mn和Cr,二者的浓度变化趋势不同导致了非致癌风险值和致癌风险值变化趋势的不一致.表 5 不同时间工作人员和停车用户的非致癌风险及致癌风险Table 5. Non-carcinogenic and carcinogenic risks to workers and users at different times日期Date HI ILCRtotal 工作人员Worker 停车用户User 工作人员Worker 停车用户User 3.9—3.10 0.280 0.0175 2.13×10−5 1.33×10−6 4.17—4.18 0.352 0.0220 1.33×10−5 8.29×10−7 4.27—4.28 0.153 0.0096 1.45×10−5 9.05×10−7 5.5—5.6 0.082 0.0052 5.76×10−6 3.60×10−7 5.8—5.9 0.216 0.0135 1.82×10−5 1.14×10−6 5.11—5.12 0.182 0.0114 1.64×10−5 1.03×10−6 同时值得注意的是,在致癌重金属浓度较高的几个测试时间段内,不论是工作人员还是停车用户,都产生了不容忽略的致癌风险,这意味着对于停车用户而言,车库内PM2.5中重金属的致癌风险不应完全忽略.
3. 结论(Conclusion)
(1)观测期间,地下车库总平均PM2.5质量浓度为(42.12±13.64) μg·m−3,浓度变化范围为26.62—66.70 μg·m−3;平均PM2.5质量浓度未超标,但均明显高于市区平均PM2.5质量浓度,两者浓度变化趋势基本一致. 工作日和休息日的平均PM2.5质量浓度区别不大,分别为43.17 μg·m−3和41.06 μg·m−3,说明车流量对地下车库颗粒物浓度的影响程度相对外界环境颗粒物污染对车库PM2.5浓度的直接影响程度较小.
(2)选取了5个代表不同使用频率和通风情况的采样点位,测得其PM2.5质量浓度变化趋势基本一致,平均PM2.5质量浓度分别为42.59 μg·m−3、47.62 μg·m−3、43.66 μg·m−3、39.51 μg·m−3和37.21 μg·m−3,车库出入口及车辆频繁通过的几何中心相比车库角落污染更高,说明汽车排放及扬尘等对地下车库PM2.5污染的影响程度相对于车库结构导致的较差通风性对PM2.5污染的影响程度更大.
(3)车库PM2.5中测定重金属(Pb、Cr、Cu、As、Ni、Cd、Co和Mn)的平均总质量浓度为0.082 μg·m−3,在PM2.5平均质量浓度中占比约为0.21%;重金属元素的质量浓度从大到小排序依次为:Cu>Mn>Pb>As>Cr>Ni>Co>Cd,其中Cu元素平均质量浓度最高,达到了31 ng·m−3.Cu、Mn、Pb、Cr、Ni等5种元素平均质量浓度遵循工作日>休息日的规律,表明其受车流量影响更大;而As、Cd、Co等3种重金属元素不符合此规律,表明其受外界环境背景的影响更大.
(4)健康风险评价表明,决定非致癌和致癌风险的重金属分别为Mn和Cr.车库重金属非致癌风险处于安全水平(HI<1),致癌风险对工作人员达到高概率水平(ILCRtotal=1.47×10−5,主要由As和Cr贡献),对停车用户根据不同时间污染情况不同,也存在不能忽略的情况(ILCRtotal>10−6).
-
表 1 在不同电流密度下Zr/Ti4O7阳极降解氯霉素的反应动力学常数及能耗
Table 1. Kinetic constants and energy consumption of chloramphenicol degradation by Zr/Ti4O7 anode at different current densities
电流密度/ (mA·cm−2) 降解率/% k/min−1 R2 EEO/ (kWh·m−3) 10 59.5 0.0071 9±0.000 2 0.991 7.25 20 73.8 0.0108 3±0.000 2 0.995 10.6 30 86.1 0.0147 9±0.000 5 0.990 12.99 40 91.0 0.0194 8±0.000 3 0.998 16.33 表 2 不同电氧化处理工艺对药物类有机物降解率的比较
Table 2. Comparison of degradation rates of medicated organic compounds by different electrooxidation processes
-
[1] KUMAR A, KHAN M, HE J, et al. Recent developments and challenges in practical application of visible–light–driven TiO2–based heterojunctions for PPCP degradation: A critical review[J]. Water Research, 2020, 170: 115356. doi: 10.1016/j.watres.2019.115356 [2] QIAO M, YING G-G, SINGER A C, et al. Review of antibiotic resistance in China and its environment[J]. Environment International, 2018, 110: 160-172. doi: 10.1016/j.envint.2017.10.016 [3] BAILóN-PéREZ M I, GARCíA-CAMPAñA A M, CRUCES-BLANCO C, et al. Trace determination of β-lactam antibiotics in environmental aqueous samples using off-line and on-line preconcentration in capillary electrophoresis[J]. Journal of Chromatography A, 2008, 1185(2): 273-280. doi: 10.1016/j.chroma.2007.12.088 [4] HEBERER T. Occurrence, fate, and removal of pharmaceutical residues in the aquatic environment: a review of recent research data[J]. Toxicology Letters, 2002, 131(1-2): 5-17. doi: 10.1016/S0378-4274(02)00041-3 [5] LIN Y C, YU T H, LIN C F. Pharmaceutical contamination in residential, industrial, and agricultural waste streams: Risk to aqueous environments in Taiwan[J]. Chemosphere, 2009, 74(1): 131-141. [6] 唐玉霖, 曲鑫璐, 刘倩宏, 等. 紫外联用高级氧化技术降解氯霉素试验研究[J]. 同济大学学报(自然科学版), 2021, 49(09): 1249-1256. [7] CHU T, YANG D, CHU W, et al. Increased formation of halomethanes during chlorination of chloramphenicol in drinking water by UV irradiation, persulfate oxidation, and combined UV/persulfate pre-treatments[J]. Ecotoxicology and Environmental Safety, 2016, 124: 147-154. doi: 10.1016/j.ecoenv.2015.10.016 [8] WANG A, GUO S, ZHENG Z, et al. Highly dispersed Ag and g-C3N4 quantum dots co-decorated 3D hierarchical Fe3O4 hollow microspheres for solar-light-driven pharmaceutical pollutants degradation in natural water matrix[J]. Journal of hazardous materials, 2022, 434: 128905. doi: 10.1016/j.jhazmat.2022.128905 [9] WANG A, CHEN Y, ZHENG Z, et al. In situ N-doped carbon-coated mulberry-like cobalt manganese oxide boosting for visible light driving photocatalytic degradation of pharmaceutical pollutants[J]. Chemical Engineering Journal, 2021, 411: 128497. doi: 10.1016/j.cej.2021.128497 [10] 赵瑞. 电化学法降解抗生素类有机物的研究[D]. 济南: 齐鲁工业大学, 2019. [11] 张思韬, 韩严和, 张晓飞, 等. 用于处理工业废水的电极材料研究进展[J]. 工业水处理, 2019, 3 9(11): 1-6. [12] 智丹, 王建兵, 王维一, 等. Ti/Ti4O7阳极电化学氧化降解水中的美托洛尔[J]. 环境科学学报, 2018, 38(5): 1858-1867. [13] 韩金名. NF/CN-TF/Ti4O7电化学体系对磺胺甲基嘧啶降解机制研究[D]. 哈尔滨: 哈尔滨工业大学, 2019. [14] 王愚. 亚氧化钛电化学阳极氧化降解印染废水研究[D]. 哈尔滨: 哈尔滨工业大学, 2016. [15] XIE J, MA J, ZHANG C, et al. Effect of the Presence of Carbon in Ti4O7 Electrodes on Anodic Oxidation of Contaminants[J]. Environmental Science and Technology, 2020, 54(8): 5227-5236. doi: 10.1021/acs.est.9b07398 [16] BEJAN D, GUINEA E, BUNCE N J. On the nature of the hydroxyl radicals produced at boron-doped diamond and Ebonex anodes[J]. Electrochimica Acta, 2012, 69: 275-281. doi: 10.1016/j.electacta.2012.02.097 [17] GAYEN P, CHEN C, ABIADE J T, et al. Electrochemical oxidation of atrazine and clothianidin on Bi-doped SnO2-TinO2n-1 electrocatalytic reactive electrochemical membranes[J]. Environmental Science and Technology, 2018, 52(21): 12675-12684. doi: 10.1021/acs.est.8b04103 [18] 杨泽坤, 刘永, 杨海涛等. 亚氧化钛电极的制备及其在废水处理中的应用[J]. 工业水处理, 2022, 42(11): 56-64. doi: 10.19965/j.cnki.iwt.2021-1118 [19] WANG H, LI Z, ZHANG F, et al. Comparison of Ti/Ti4O7, Ti/Ti4O7-PbO2-Ce, and Ti/Ti4O7 nanotube array anodes for electro-oxidation of p-nitrophenol and real wastewater[J]. Separation and Purification Technology, 2021, 266: 118600. doi: 10.1016/j.seppur.2021.118600 [20] NAYAK S, CHAPLIN B P. Fabrication and characterization of porous, conductive, monolithic Ti4O7 electrodes[J]. Electrochimica Acta, 2018, 263: 299-310. doi: 10.1016/j.electacta.2018.01.034 [21] 张立宝. Ti/SnO2-Sb-Ni电极制备及对CAP废水的降解机理研究[D]. 沈阳: 沈阳工业大学, 2020. [22] 杨志伟. 超声强化亚氧化钛阳极电化学氧化处理氯霉素废水的研究[D]. 哈尔滨: 哈尔滨工业大学, 2019. [23] LIN H, NIU J, LIANG S, et al. Development of macroporous Magnéli phase Ti4O7 ceramic materials: as an efficient anode for mineralization of poly- and perfluoroalkyl substances[J]. Chemical Engineering Journal, 2018, 354: 1058-1067. doi: 10.1016/j.cej.2018.07.210 [24] ZHU K, SHI F, ZHU X, et al. The roles of oxygen vacancies in electrocatalytic oxygen evolution reaction[J]. Nano Energy, 2020, 73: 104761. doi: 10.1016/j.nanoen.2020.104761 [25] LI D, TANG J, ZHOU X, et al. Electrochemical degradation of pyridine by Ti/SnO2–Sb tubular porous electrode[J]. Chemosphere, 2016, 149: 49-56. doi: 10.1016/j.chemosphere.2016.01.078 [26] SäRKKä H, BHATNAGAR A, SILLANPää M. Recent developments of electro-oxidation in water treatment: A review[J]. Journal of Electroanalytical Chemistry, 2015, 754: 46-56. doi: 10.1016/j.jelechem.2015.06.016 [27] JIAO T, LU C, ZHANG D, et al. Bi-functional Fe2ZrO5 modified hematite photoanode for efficient solar water splitting[J]. Applied Catalysis B:Environmental, 2020, 269: 118768. doi: 10.1016/j.apcatb.2020.118768 [28] 于丽花, 薛娟琴, 张立华, 等. 操作条件对电氧化去除废水中有机污染物的影响研究[J]. 环境工程, 2017, 35(5): 6-10. [29] URANO Y, HIGUCHI T, HIROBE M. Substrate-dependent changes of the oxidative O-dealkylation mechanism of several chemical and biological oxidizing systems[J]. Journal of the Chemical Society Perkin Transactions, 1996, 6(6): 1169-1173. [30] 陈安妮, 童展梁, 姚佳超, 等. 电氧化处理印染行业膜后浓水的研究[J]. 工业水处理, 2021, 41(11): 51-55. [31] LUO C, MA J, JIANG J, et al. Simulation and comparative study on the oxidation kinetics of atrazine by UV/H2O2, UV/HSO5− and UV/S2O82−[J]. Water Research, 2015, 80: 99-108. doi: 10.1016/j.watres.2015.05.019 [32] FANG G-D, DIONYSIOU D D, AL-ABED S R, et al. Superoxide radical driving the activation of persulfate by magnetite nanoparticles: Implications for the degradation of PCBs[J]. Applied Catalysis B:Environmental, 2013, 129: 325-332. doi: 10.1016/j.apcatb.2012.09.042 [33] 李靖宇, 王宪森, 王晓林, 等. 载铁活性炭颗粒电极降解氯霉素污染废水性能研究[J]. 江西化工, 2021, 37(5): 56-58. [34] CHEN J, XIA Y, DAI Q. Electrochemical degradation of chloramphenicol with a novel Al doped PbO2 electrode: Performance, kinetics and degradation mechanism[J]. Electrochimica Acta, 2015, 165: 277-287. doi: 10.1016/j.electacta.2015.02.029 [35] XU J, LIU Y, LI D, et al. Insights into the electrooxidation of florfenicol by a highly active La-doped Ti4O7 anode[J]. Separation and Purification Technology, 2022, 291: 120904. doi: 10.1016/j.seppur.2022.120904 [36] 滕刚刚. PbO2-ZrO2复合电极电催化氧化降解典型PPCPs类污染物的研究[D]. 天津: 河北工业大学, 2020. -




 下载:
下载: