-
我国是全球最大的锰资源消耗和进口国,截至2020年,我国约有矿床230座,锰矿石探明储量约2.1×109 t[1]。自2017年以来,诸多中小锰矿区纷纷停产、停业,遗留了大量锰尾矿渣[2],经侵蚀、风化和自然雨水淋溶后,尾矿渣中所含重金属元素进入周边的地表水、地下水、土壤等,造成大范围的植被破坏和水土流失,对矿区周边的生态环境和人畜健康造成严重的危害[3-4]。植物修复作为一种绿色原位土壤修复技术,通过植物根系吸收、挥发、转化、固定或降解重金属和有机污染物,具有成本低、效果好、生态学价值高等特点,已逐步成为修复重金属污染场地的重要手段之一[5-6]。
锰矿植物修复研究主要涉及两类植物,一类是以草本居多的超富集植物:如商陆(Phytolacca americana)[7]、莎草(Cyperus rotundus)[8]和铁杆蒿(Artemisia sacrorum)[9]等,另一类是以木本为主的耐性或抗性植物,这类植物对重金属的富集虽不及超富集植物,但对污染物具有很强的耐受性或抗性,代表植物有夹竹桃(Nerium oleander)、栾树(Koelreuteria paniculata)和泡桐(Paulownia tomentosa)等[10]。目前发现的锰的超富集植物大多数是草本植物,存在个体矮小、生物量小和生长周期短等缺陷,重金属富集的总量少,对水土的保持能力弱,在大规模工程应用中有较大的局限性。木本植物生物量大、生长速度快、生长周期长,并且具有发达的根系网络,能快速、高效地恢复地表的植被覆盖,减少水土流失,在吸收、积累重金属的同时还能在一定程度上钝化、固定重金属,尤其适用于较大矿区的重金属污染治理与生态恢复工程[11-12]。
锰矿渣颗粒较细、结构松散、透气性和持水性能差,养分也极易流失,普通植物很难在尾矿中生存[13-14]。本实验室前期进行了大量木本植物和改良剂的筛选工作,发现栾树和凹凸棒+蘑菇渣复合改良剂用于修复锰尾矿重金属污染具有明显优势[15]。目前,对栾树等耐性植物的相关研究主要集中在植物自身对重金属的生理响应机制[16-18],而对根际环境的影响机制研究很少。根际是植物-土壤-微生物进行物质交换和信息传递的热区,根际土壤性质和微生物是影响植物修复效果的2个重要因素[19]。土壤肥力和其他理化性质对于植物的生长起到决定性的作用,土壤微生物可通过自身的解毒机制降低重金属的毒性,一方面促进根系分泌物对重金属的生物固化,改善土壤微环境、优化植物根际并提高重金属的可利用度,另一方面微生物通过分泌铁载体、有机酸等物质促进植株的生长发育,提高金属耐受性和吸收量[20-21]。
鉴此,本研究以湖南省某锰尾矿区矿渣作为基质,以栾树(Koelreuteria paniculata)为供试植物,以有机蘑菇渣(spent mushroom compost, SMC)与无机凹凸棒粉(attapulgite, ATP)为改良材料,构建中试模拟矿山实验装置,探究改良矿渣下栾树对锰矿渣的植物修复效果和根际微环境响应,旨在为锰尾矿区的生态修复提供科学数据和技术经验。
-
栾树(Koelreuteria paniculata)购自浏阳柏加苗木基地,均为高约80 cm的1 a生苗。蘑菇渣(金针菇)购自湖南省某农业基地,主要成分有米糠、麦麸和玉米芯,实验前测得其基本化学特征(表1)。凹凸棒矿粉购自甘肃省某凹凸棒矿区,主要成分为含水镁铝硅酸盐,pH在8左右。锰矿渣取自湘潭市某锰矿尾矿库,Mn、Pb、Zn、Cu、Cd含量较高,均值分别为10 425、3 324、5 861、135、38.21 mg·kg−1。
-
模拟矿山玻璃中试装置定制于长沙市红星百货市场,内部长、宽、高为100、100和80 cm,上下均设置导流管,用以引导降雨后形成的表流和潜流,防止雨水在装置内的累积。将锰矿渣或其与改良剂充分混匀后,于2021年1月下旬加入装置,使基质高度达到80 cm。各装置均添加自来水30 L,用塑料薄膜掩盖,活化2个月后测得各装置中基质基本理化性质。设置1个对照组和2个实验组,CK:100%尾矿,无植物;S0:90%尾矿+5%蘑菇渣+5%凹凸棒,无植物;S1:90%尾矿+5%蘑菇渣+5%凹凸棒,选取长势一致的栾树幼苗于21年3月下旬进行种植,每个装置6株。设置3个平行。
各装置模拟野外环境,只接受自然雨水,定期除草,不额外添加肥料。植物种植前定义为实验前期,前3个月为植物生长稳定期,第6个月定义为中期,第9个月定义为末期。在植物生长各周期,对土壤理化性质和植物生长指标等进行动态监测,实验末期收集植物和土壤基质,处理后进行数据的收集整理与分析。该中试实验于2021年1月至2021年12月在中南林业科技大学苗圃内开展,实验区属亚热带季风气候,气候温和,年平均降雨量约1 500 mm。实验期间,S1组各装置中栾树均正常存活和生长,其根系几乎深入了整个装置的各个土层,尤其是土壤中、上层中的根系十分发达。
-
1)土壤理化性质及重金属测定。采用重铬酸钾氧化-分光光度法测定有机质含量;采用pH酸度计测定土壤pH;采用三氯化六氨合钴浸提-分光光度法测定阳离子交换量;土壤基质含水率和容重分别采用烘干法和环刀法测得。土壤全氮采用凯氏法测定,速效氮采用扩散皿法;土壤总磷采用碱溶-钼锑抗分光光度法,有效磷采用碳酸氢钠浸提-钼锑抗分光光度法;土壤总钾采用氢氧化钠熔融-火焰原子吸收分光光度法,速效钾采用浸提比色法。参照关松荫的方法[22],采用3、5-二硝基水杨酸比色法测定土壤蔗糖酶活性,脲酶通过苯酚-次氯酸钠比色法测得;碱性磷酸酶使用试剂盒进行测定(索莱宝生物科技有限公司);采用欧共体BCR四步法测定土壤重金属形态。
2)植物生长指标测定。用卷尺测量从土壤表面到植株顶端的距离;栾树根系生长状况用根系扫描仪测定(Win RHIZO PRO 2013, Canada);采收的植物分为根、茎和叶3部分,在105 ℃下干燥30 min,然后在75 ℃下干燥至恒重,测定其生物量干重。
3)土壤微生物多样性测定。在实验末期采集各装置中土壤,土壤微生物多样性检测委托上海欧易生物医学科技有限公司进行。使用Trimmomatic软件进行去杂。采用Vsearch软件,根据序列相似性将其归为多个OTU,序列相似度大于或等于97%被归为一个OTU单元。使用QIIME软件包挑选出各个OTU的代表序列,并将所有代表序列与数据库进行比对注释。16S使用Silva(version138)数据库比对,ITS使用Unite数据库比对。物种比对注释使用BLAST软件。
-
一般实验数据运用Excel 2021进行处理;数据方差分析和显著性检验利用SPSS 22.0软件完成,数据均为3次重复实验的平均值±标准差(n=3);一般制图采用Origin 2019b软件完成,微生物数据绘图运用欧易云平台完成。
-
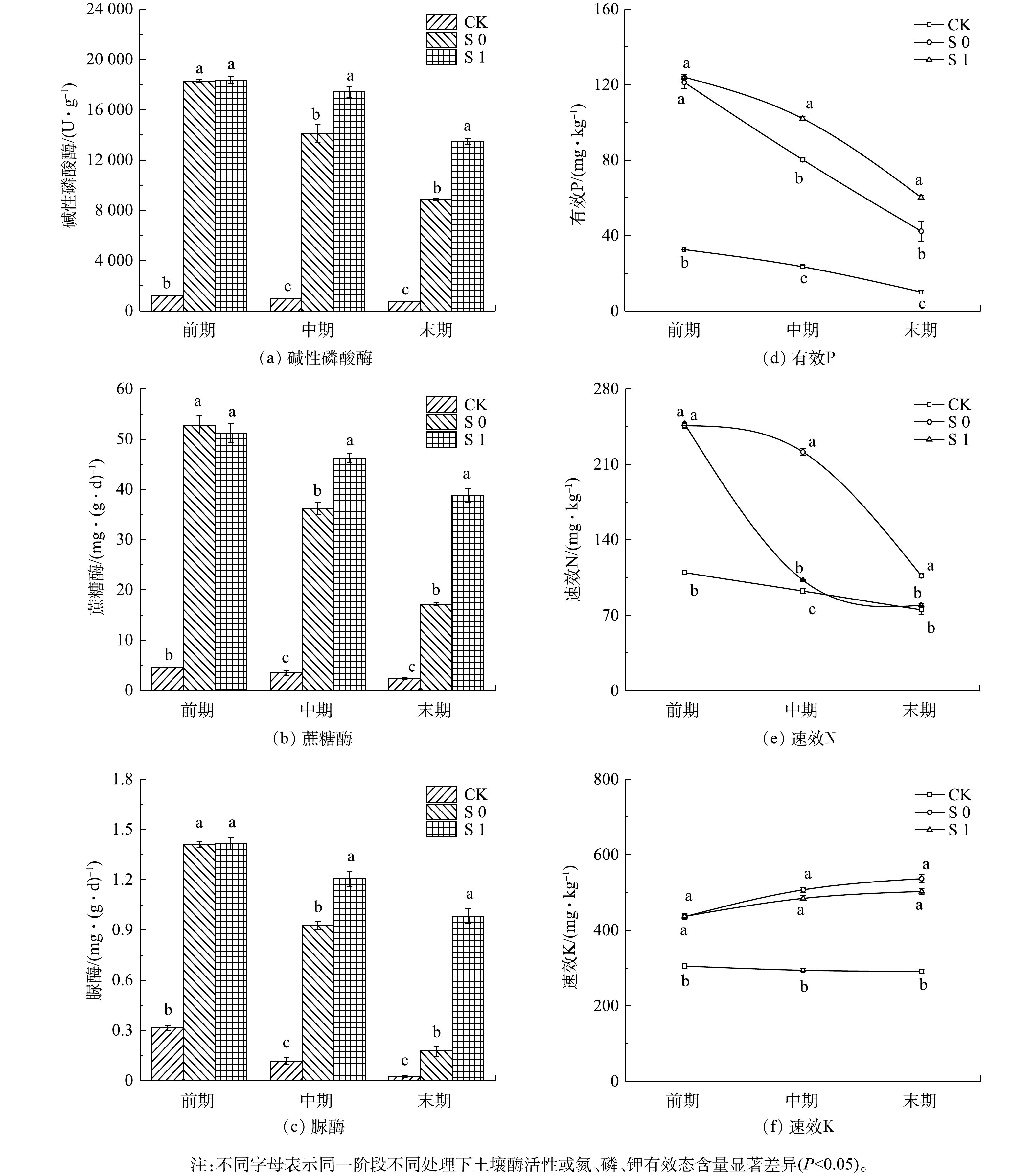
从各基质基本理化性质差异(表2)来看,改良剂加入后锰矿渣pH从7.46显著提升到了7.62(P<0.05)。改良矿渣含水率比原矿渣高出约10%,孔隙度高出约9%,同时总氮、总磷、有机质含量和阳离子交换量均有提升,增幅分别为190%、36%、2.5%和43%。矿渣中总钾的含量较高,达到了10.07 g·kg−1,改良剂的加入略微降低了其含量。从各处理间基质主要营养元素有效态含量(图1)比较来看,改良剂的加入对基质有效磷、速效氮和速效钾提升较大,分别比CK提升了124.5%、271.2%和43.1%。从各处理间的基质酶活性(图1)来看,相较于CK组,S0和S1土壤蔗糖酶、脲酶和碱性磷酸酶的活性得到了极显著的提升(P<0.01)。实验的前期、中期和末期3个阶段中CK组3种土壤酶活性始终处于最低水平,显著低于S1组和S0组(P<0.05),实验中期和末期呈现S1处理显著高于S0处理的变化趋势(P<0.05)。在3个实验阶段中,S1组和S0组土壤有效磷、速效氮和速效钾含量均在不同程度上高于CK处理组。由此可以看出,添加改良剂后锰矿渣理化性质与肥力条件得到优化。同时,栾树的生长一定程度增强了改良矿渣的水土保持能力,使得营养元素不易随径流流失,增强了其保肥和持水能力。
-
比较实验前、后各基质中重金属含量变化(表3)可以发现,改良剂的加入使得单位质量的矿渣中Mn、Pb、Zn、Cu和Cd等重金属的含量呈不同程度的下降,同时各处理在实验后基质中Mn、Pb、Zn、Cu和Cd的含量均显著下降(P<0.05),但不同处理组之间的下降幅度有所差异。S1处理基质中Mn、Pb、Zn、Cu和Cd含量下降幅度要显著低于S0处理(P<0.05),同时,S1处理在实验前基质中Mn、Pb和Zn含量均低于CK处理的情况下,在实验后Mn、Pb和Zn的含量仍不同程度高于CK处理。
在实验后对栾树根、茎、叶各组织干样中重金属含量进行检测(表4),可以发现栾树各组织中Mn和Zn的含量较高,在230~1 100 mg·kg−1,说明栾树对其有一定的富集能力,但远未达到超富集植物的标准。而栾树各组织中Pb、Cu和Cd含量较低,在0.5~160 mg·kg−1,表明栾树对这几种重金属的富集能力一般。
通过各处理基质中重金属的去向(表5)可以发现,栾树对基质中Mn、Pb、Zn、Cu和Cd的吸收总量占比非常小,在0.001%~0.026%,而不同处理中几种重金属随径流的流失量比例差异明显,普遍在6%~23%,大量的重金属会随雨水径流流失。S1处理中Mn、Pb、Zn 3种重金属的径流流失量比例显著低于(P<0.05)锰矿渣(CK)和改良锰矿渣(S0),较CK处理分别下降约6%、11%和13%,较S0处理分别下降约4%、13%和10%。各处理基质中Cu的径流流失量比例均无显著差异(P>0.05)。另外值得注意的是,改良剂的加入使得S0处理中Cd的径流流失量比例显著高于CK处理(P<0.05)。
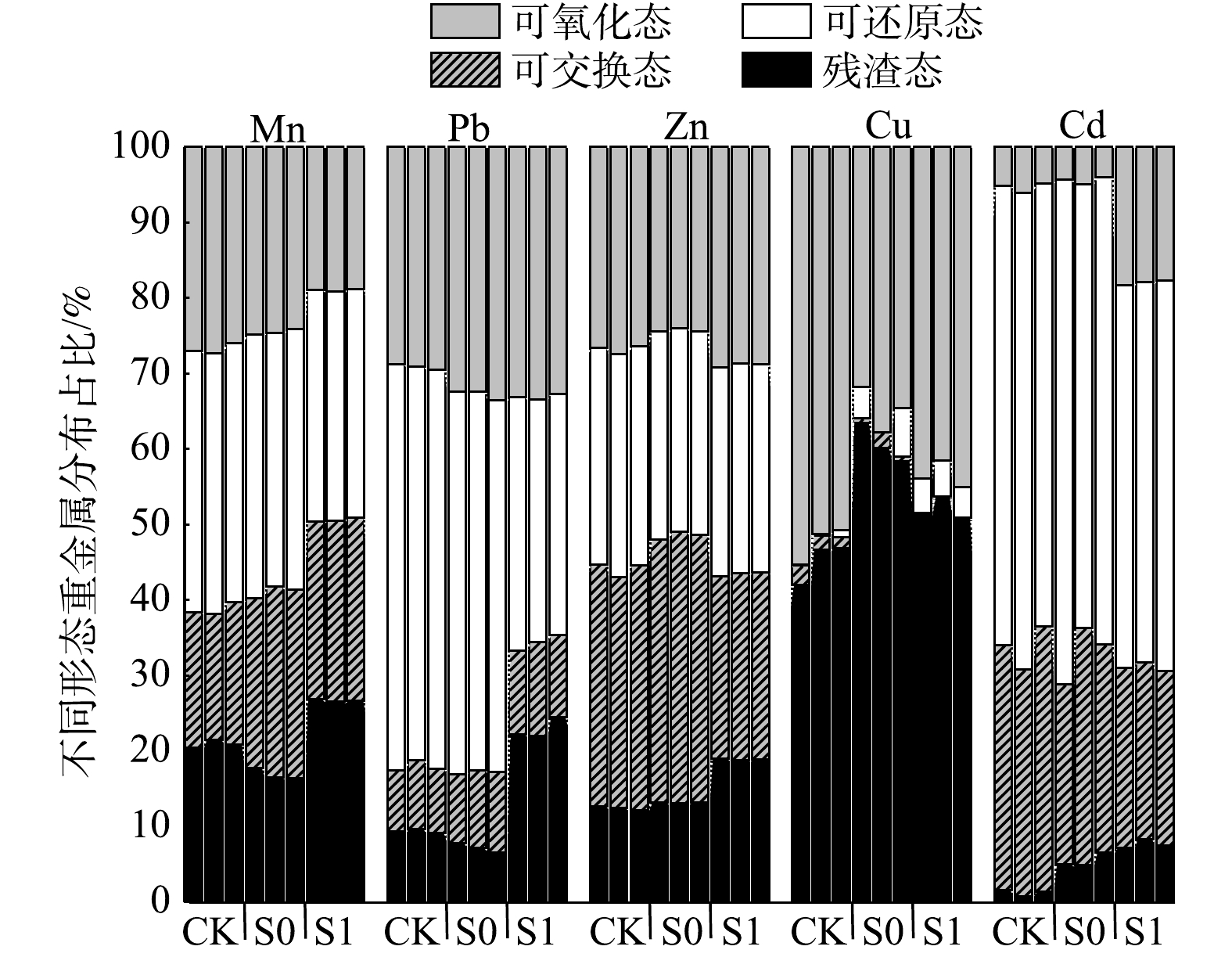
在实验后对各处理基质中重金属形态进行分析(图2),可以直观地看出,CK和S0处理之间Mn、Pb、Zn3种重金属各形态分布占比总体差异较小。S1处理与CK和S0处理对比,最显著的差异反映在重金属残渣态比例的提高上,S1处理中Mn、Pb、Zn重金属残渣态的比例比S0处理分别高出5.73%、13.52%和6.47%,比CK处理分别高出4.98%、12.81%和6.01%。同时可以发现,S1处理中Cd的残渣态和可还原态较CK处理均显著升高(P<0.05)。各基质中Cu绝大部分以残渣态和可氧化态存在,可交换态和可还原态比例不足5%。上述结果表明,栾树的种植和改良剂的添加在实验后可以显著提高锰矿渣中Mn、Pb、Zn、Cu和Cd的残渣态比例(P<0.05),减少矿渣中这几种重金属随雨水径流的流失量,对矿渣中重金属的流失达到了较好的拦截效果。
-
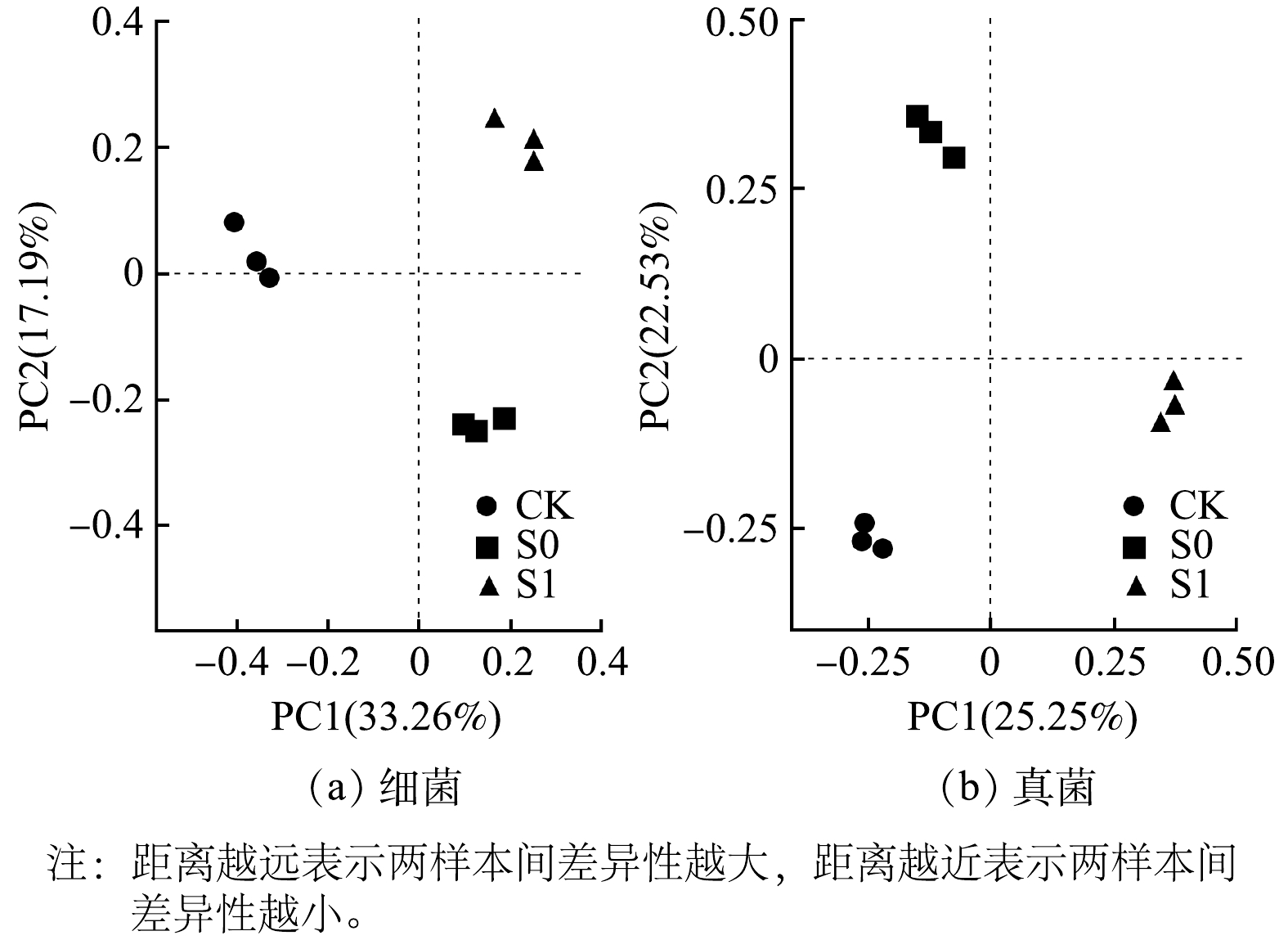
3个处理组的9个土壤样本细菌和真菌分别注释得到了17 543个和1 563个可操作单元(OTUs),样本生物覆盖率均在96%以上,测试结果能够反映样本真实情况,测序合理。主坐标轴分析(PC0A)(图3)中同组土壤样本均很好地聚类在一起,各样本组内相似性好,组间区分度高。各处理组基质细菌群落结构在门水平上差异不大,主要优势种群有变形菌门(Proteobacteria)、拟杆菌门(Bacteroidota)、放线菌门(Actinobacteriota)、单芽孢菌门(Gemmatimonadota)和酸杆菌门(Acidobacteriota)。各处理组基质中真菌门水平群落结构差异非常明显,3组土壤真菌主要由担子菌门(Basidiomycota)、子囊菌门(Ascomycota)、接合菌门(Zygomycota)、罗兹菌门(Rozellomycota)和壶菌门(Chytridiomycota)组成。其中,担子菌门在3组间存在显著差异(P<0.01),在CK、S0和S1处理中占比分别为9.06%、76.18%和51.66%。另外2个分布差异较大的是子囊菌门和接合菌门,子囊菌门在3组中占比分别为60.13%、18.71%和28.21%,接合菌门占比分别为23.10%、3.11%和2.00%。土壤微生物群落α多样性指数分析结果(表6)表明,细菌方面:对于chao1指数和observed-species指数,S0和S1处理群落物种数量无显著差异(P>0.05),均显著多于CK处理(P<0.05)。由simpson指数可以看出,各处理间物种丰富度无显著差异(P>0.05);真菌方面:CK和S1处理群落物种数量无显著差异(P>0.05),均显著多于S0组(P<0.05),且S0组物种丰富度显著低于其他2个处理(P<0.05)。S0和S1处理细菌群落α多样性无显著差异(P>0.05),在真菌群落上差异显著(P<0.05)。
-
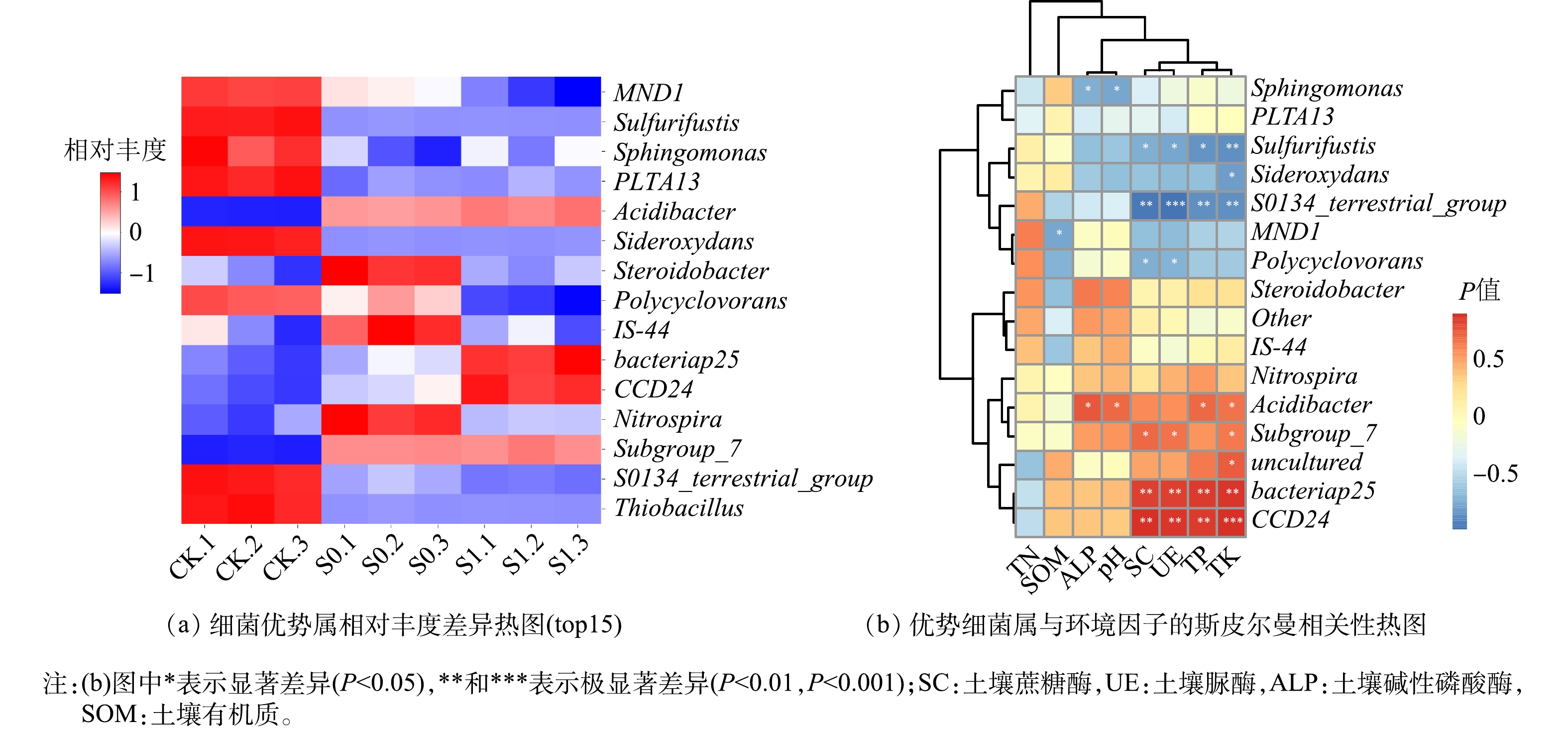
由细菌优势属丰度热图(图4(a))可以看出,各处理间优势属差异较为明显。S1处理丰富度较高的属有变形菌门下的CCD24、Bacteriap25和Acidibacter属以及酸杆菌门下的Subgroup_7属。斯皮尔曼相关性分析((图4(b))显示,S1处理独有的优势属CCD24与bacteriap25聚类,与基质蔗糖酶、脲酶、碱性磷酸酶和pH存在极显著正相关关系(P<0.01)。Acidibacter和Subgroup_7在S0与S1组中均为优势属。Subgroup_7与基质蔗糖酶、脲酶和pH显著正相关(P<0.05),有研究表明,酸杆菌门下subgroup_7属丰度往往与土壤pH呈正相关关系[23],这与本研究的结果是一致的。Acidibacter属被认为是具有分解蛋白质和摄取环境周围酸性物质的有益菌菌属[24],其与基质碱性磷酸酶、有机质、总氮和pH呈显著正相关性(P<0.05),Nitrospira(硝化螺旋菌属)是土壤中的潜在有益菌,可促进土壤化学循环,保持土壤肥力[25],其与图中所有环境因子均呈正相关性,但不显著(P>0.05)。此外,CK处理中独有的优势属Sulfurifustis和S0134_terrestrial_group与基质酶活性和pH呈不同程度显著(P<0.05)或极显著负相关(P<0.01)。
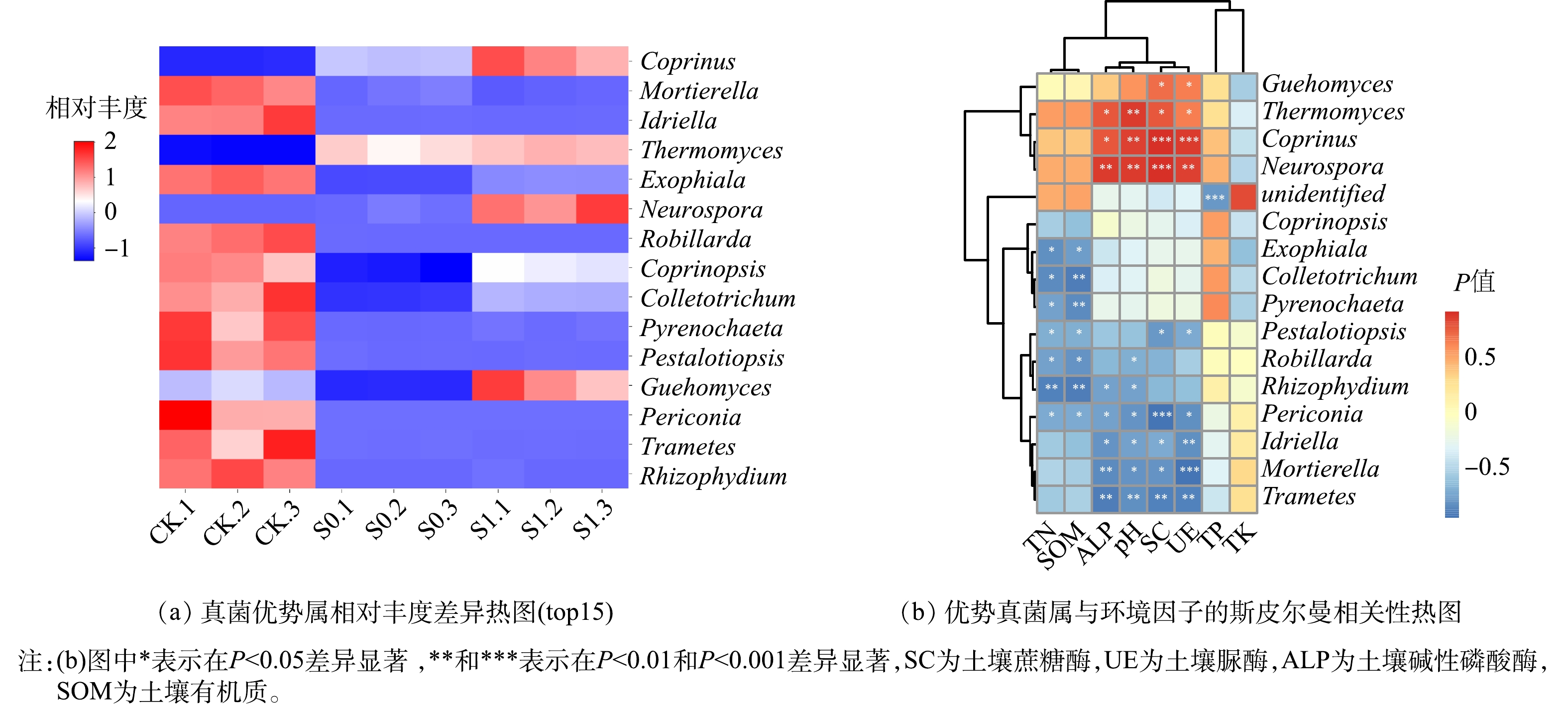
在真菌 top15 优势属中(图5(a)),各处理间的差异十分明显,CK 处理中丰度较高的达到了 11 个,S0 处理丰富度较高的仅有子囊菌门下的 Thermomyces (嗜热真菌属)。斯伯尔曼相关性分析结果表明(图5(b)),S1组中丰富度较高的优势属分别为子囊菌门下 Neurospora (脉孢菌属)和 Thermomyces (嗜热真菌属)以及担子菌门下的 Guehomyces (低温酵母属)和 Coprinus (鬼伞属),这 4 个优势属聚类在一起,与基质蔗糖酶、脲酶、碱性碱性和 pH 在 P<0.01 或P<0.05 水平上呈显著正相关,与基质总氮、总磷和有机质含量呈不同程度的正相关关系(P>0.05)。
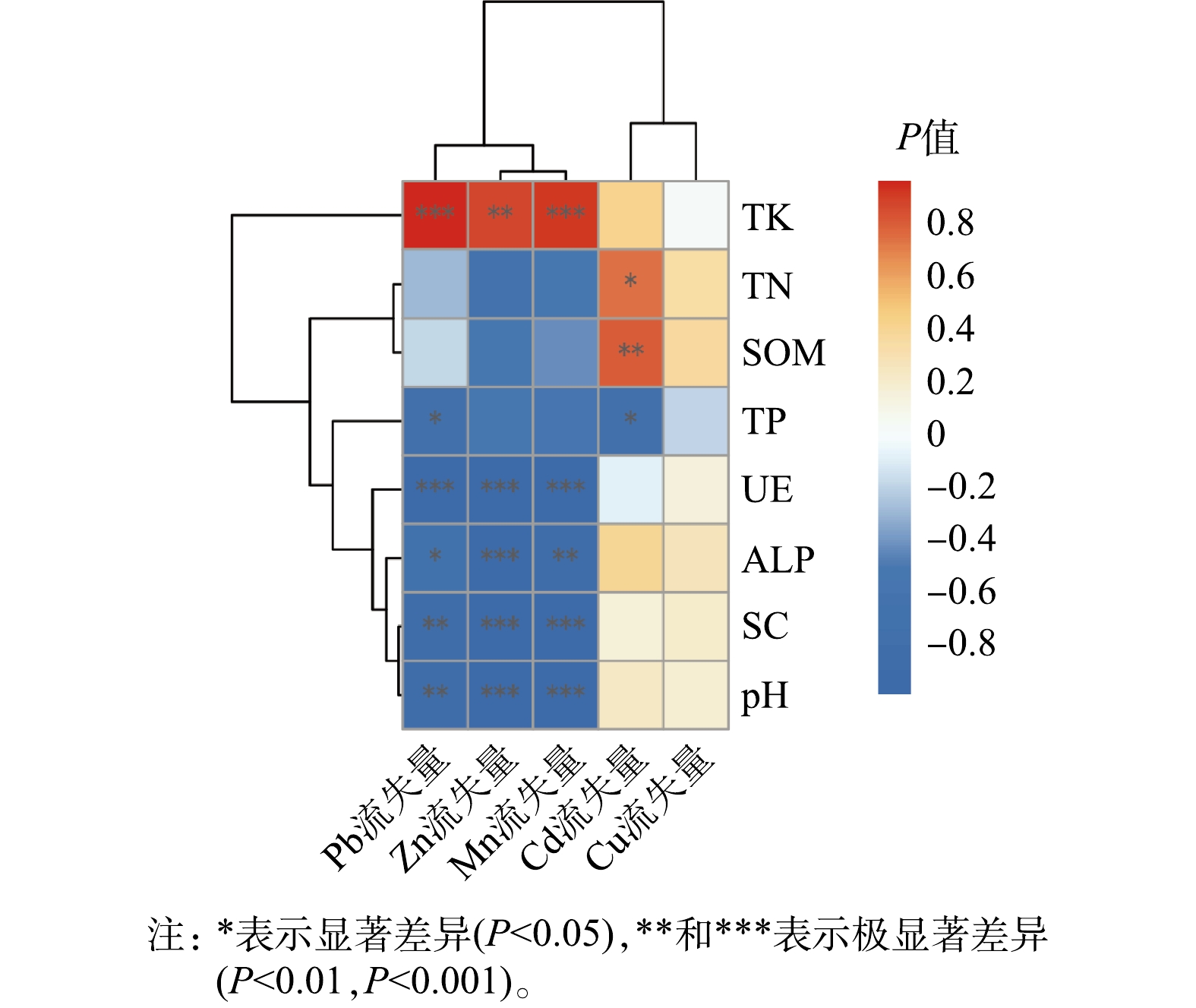
为了进一步探究导致不同处理下装置系统对重金属的拦截效果产生差异的因素,我们对各处理下基质中 Mn、Pb、Zn、Cu、Cd 流失量的百分比与基质理化性质进行了皮尔逊(Pearson)相关性分析,结果如图6 所示。可以发现,Mn、Pb、Zn 随雨水径流的流失量与基质 pH、蔗糖酶、脲酶、碱性磷酸酶活性呈不同程度显著负相关(P<0.05)和极显著负相关关系(P<0.01,P<0.001),与基质总氮、总磷和有机质含量等呈负相关关系(P>0.05)。同时可以发现,Cu 的流失量与图中所有环境因子均无显著相关性(P>0.05)。Cd 的流失量与基质总氮显著正相关(P<0.05),与有机质含量极显著正相关(P<0.01),但与基质总磷量含量表现出显著的负相关性(P<0.05)。上述数据表明,pH 和土壤酶活性的提升能够显著减少锰矿渣中 Mn、Pb、Zn 随雨水径流的流失、Cd 的流失与基质不同营养元素含量表现出不同程度的正、负显著相关性,而基质理化性质的改变对 Cu的流失量影响不大。
-
锰尾矿渣中Mn、Pb、Zn、Cu和Cd等重金属含量均远超背景值,土壤易板结,保水能力差,可供植物利用的有效态的氮、磷、钾含量低,是限制植物在锰尾矿渣中正常生长的主要因素[26]。实验前,蘑菇渣和凹凸棒改良剂的加入使得矿渣的氮、磷、钾总量及其有效态含量、有机质、土壤阳离子交换量和含水率均得到不同程度的提升。本研究中蘑菇渣和凹凸棒改良剂的加入可改善锰矿渣的土壤结构和肥力。这与前人的研究结果一致[27-28]。土壤中蔗糖酶、脲酶和碱性磷酸酶的活性能够很好地反映土壤肥力和质量[29],在实验的中期和末期,各处理下基质中3种土壤酶活性差异显著,表现出S1>S0>CK的趋势。同时,S1和S0处理的土壤氮、磷、钾有效态均能保持在明显高于CK处理的水平。不难看出,改良剂的加入和栾树的生长在整个实验阶段较好地维持了矿渣的肥力,提高了其持水能力。
值得注意的还有2点:第一,相较于有栾树生长的S1处理,实验过程中S0处理(改良锰矿渣)中氮、磷、钾元素和有机质的流失量偏大,表明单纯改良剂的加入能在短时间内提升矿渣肥力,但植物的生长是维系土壤肥力的重要因素,而栾树地下部发达的根系和地上部植被的覆盖能对矿渣水土的保持产生了积极作用,进而减少矿渣中水分和营养元素的流失;第二,锰矿渣和改良锰矿渣中的K元素极易流失,在长期的修复过程要注意钾肥的补充。
-
凹凸棒是一种镁铝硅酸盐矿物,作为土壤修复改良剂被广泛使用[30],有研究表明,其能显著提高土壤pH,降低Pb、Cd、Cr等重金属的生物有效性,减少植物对重金属的吸收[31]。有机菌肥在为植物提供养分外,还能通过固定、吸附、络合、氧化等作用降低植物根际环境中重金属的毒性[32]。重金属在土壤中的形态包括可交换态、可还原态、可氧化态和残渣态。可交换态和可还原态的重金属较易被植物吸收,具有生物有效性。可氧化态和残渣态相对更稳定,难以被植物吸收和利用[33]。栾树对锰矿渣中重金属的吸收量极为有限,相较于随雨水径流流失的量几乎可以忽略不计,而锰矿渣中Mn、Pb、Zn等重金属随径流的流失量非常高,单纯改良剂的加入在实验周期内无法有效抑制重金属的流失,甚至显著增加了改良矿渣中Cd的流失量比例。但栾树的种植能明显增加矿渣中重金属的可氧化态和残渣态比例,显著减少矿渣中Mn、Pb、Zn等重金属的流失,这与MUTHANNA[34]等的研究结果相似,说明短时间内植物对基质重金属的吸收量非常有限,通过减少矿渣中重金属的流失来治理矿渣中重金属的扩散和污染将更为有效。凹凸棒和蘑菇渣改良剂的加入在实验前显著提升了锰矿渣的pH,但实验后S0处理中pH有所下降,而S1处理pH显著提升。S0处理在实验后Mn、Pb、Zn等重金属的形态较CK处理无显著的变化,而S1处理中Mn、Pb、Zn重金属残渣态的比例显著高于CK和S0处理。相关性分析结果表明,基质pH、蔗糖酶、脲酶和碱性磷酸酶的升高能够显著降低矿渣中Mn、Pb和Zn的流失。这是由于提升锰矿渣的pH会增强土壤对重金属离子的吸附能力,有助于降低重金属在土壤和植物中的迁移能力[35]。土壤中蔗糖酶、脲酶和碱性磷酸酶的活性能够很好地反映土壤肥力和质量[29],土壤酶活性的升高反映了改良矿渣肥力和土壤质量的提升,为栾树的生长提供了有利条件,栾树的生长所带来的水土保持作用进一步减少了矿渣中重金属随雨水的流失。
-
土壤微生物对外界环境(植物种类、土壤结构、肥力、温度、湿度、酸碱度)的变化高度敏感。长期受重金属污染的土壤,根际微生物群落结构及多样性和丰度都会受到显著的影响[36-38]。不论是改良剂的加入还是栾树生长对锰矿渣微生物群落结构都有一定影响。改良剂的加入对锰矿渣中门水平下细菌物种群落结构的影响较小,但显著提升了细菌物种数量。在本研究中,纯矿渣和改良矿渣中变形菌门都是绝对的优势种群,这与BOUSKILL[39]等的研究结果一致。变形菌门是土壤中分布最广,最普遍的一个细菌门,在矿山径流、被重金属污染的水体及其沉积物和重金属污染土壤中都有丰富的存在[40],改良剂加入后,细菌门水平上,拟杆菌门和酸杆菌门等腐生型细菌相对丰度也大大提升,拟杆菌门为富营养菌,相对丰度在高有机质水平下增加,且具有溶磷作用[41],酸杆菌门被证明能够适应重金属污染等极端生存条件[42]。细菌属水平上,S1处理独有的优势属CCD24和bacteriap25与基质蔗糖酶、脲酶、碱性磷酸酶和pH存在极显著正相关关系(P<0.01),与总氮、总磷以及有机质含量等土壤肥力指标也存在正相关关系。这表明,改良剂的加入带来的丰富营养元素和对土壤结构的改善为上述细菌种群的生长提供了有利条件,促进了他们的生长和繁殖,增强它们的活动水平。
土壤真菌参与土壤有机矿化,分解土壤中植物残体和有机质,但多数真菌也能引起植物的病变[43]。改良剂加入后对锰矿渣真菌群落结构的影响巨大,门水平上锰矿渣(CK)中真菌群落绝对优势种群为子囊菌门,而改良矿渣(S0、S1)为担子菌门,子囊菌和担子菌是土壤中重要的分解者,子囊菌多营腐生,而担子菌对植物残体中的复杂的木质素和纤维素具有较强的分解能力[44]。蘑菇渣中主要成分米糠和麦麸等富含纤维素和木质素,充足的营养源使得担子菌门取代子囊菌门成为改良矿渣中绝对的优势种群。过多的子囊菌会引起植物根和茎的腐烂[43],改良剂的加入显著降低了其在矿渣中的丰度从而减轻其对栾树根系的威胁。同时,无植物下的改良矿渣(S0)在实验后真菌丰富度和多样性显著降低,子囊菌门下Thermomyces(嗜热真菌属)大量繁殖,成为唯一的优势属,其在堆肥过程中对半纤维素的降解起到非常关键的作用,是堆肥中常见的真菌属[45]。这直接导致了改良锰矿渣中真菌群落结构平衡的破坏,营养元素在真菌的分解作用和雨水冲刷下大量流失。而栾树的生长有效避免了这一极端情形的发生,同时使得S1处理中子囊菌门丰度显著低于CK处理,并提高了如担子菌门和接合菌门(接合菌门对土壤中腐殖质分解起到重要作用[46])等有益菌的占比,有利于改良矿渣中有机质和营养元素的缓释,保持锰矿渣的肥力。
土壤微生物在维持土壤肥力、驱动土壤养分循环、稳定生态系统功能等方面发挥着重要作用,是维持土壤生产力的重要部分[47]。植物通过根系的分泌物影响微生物群落结构的组成,同时,土壤微生物群落的结构和多样性也影响了土壤生态系统的结构和功能[47]。总体来看,锰矿渣中Mn、Pb、Zn、Cu、Cd等重金属浓度非常高,且缺乏营养物质,改良剂的加入带来了丰富的营养物质,同时提升了矿渣的土壤质量。而土壤肥力和土壤质量的提升给原本处于弱势的微生物群落的生长和繁殖创造了条件,这是导致矿渣中微生物结构发生转变的主要原因。根际土壤中微生物群落结构的改变和栾树根系的作用使得矿渣的肥力达到了一种缓释的状态,栾树生长过程中植被和根系对矿渣水土的庇护和保持可巩固这一状况,从而形成一种良性循环。
-
1)蘑菇渣和凹凸棒改良剂的加入显著增强了锰矿渣的肥力和持水性,促进了改良锰矿渣肥力的保持和缓释,增强了栾树的抗逆性。2)栾树地下部发达的根系和地上部植被的覆盖对锰矿渣水土的保持具有积极作用,改良剂的加入和栾树的生长能显著提升锰矿渣中Mn、Pb和Zn的残渣态比例,显著降低这3种重金属在锰矿渣中的流失,提高了修复效率。3)改良剂的加入提高了锰矿渣中微生物多样性,门水平和属水平上腐生和富养菌等有益菌丰度和多样性均显著提升,微生物群落结构的这种改变改善了土壤质量,促进了栾树生长,对植物修复效率的提升具有重要意义。
施用改良剂和种植栾树对锰矿渣微生物群落的影响
Effects of modifier application and Koelreuteria Paniculata planting on the microbial community of a manganese slag
-
摘要: 施用改良剂可降低矿区重金属污染对植物的胁迫,但其对根际环境的影响机制尚不明晰。以栾树(Koelreuteria paniculata)为供试植物、以某锰尾矿区矿渣为基质,比较CK(100%矿渣)、S0(90%矿渣+5%蘑菇渣+5%凹凸棒)和S1(90%矿渣+5%蘑菇渣+5%凹凸棒,种植栾树)等3个处理重金属赋存状态和微生物多样性等的差异,探究施用改良剂和种植栾树等对矿渣中重金属拦截效果的影响。结果表明,施用改良剂(即蘑菇渣和凹凸棒)提高了矿渣pH,增强了其肥力和持水性;而种植栾树可降低重金属的生物有效性,Mn、Pb、Zn的残渣态比例显著提升,较S0分别提升了5.73%、13.5%和6.47%,较CK分别提升了4.98%、12.8%和6.01%。实验前、后各基质中Mn、Pb、Zn随雨水径流的流失量差异显著,表现为S1<S0<CK。种植栾树和施用改良剂对矿渣微生物群落结构影响巨大,其中S0和S1处理细菌α多样性差异较小,而真菌差异显著。与CK和S0相比,S1处理拟杆菌门(Bacteroidota)、酸杆菌门(Acidobacteriota)、担子菌门(Basidiomycota)和子囊菌门(Ascomycota)的相对丰富显著增加,腐生和富养菌等有益菌的相对丰度和多样性提升明显,有利于保持土壤肥力和促进栾树生长,提高其抗逆性和修复效率。Abstract: The application of amendments can reduce the stress of heavy metal pollution on plants in mining areas, but the mechanism of its impact on the rhizosphere environment is still unclear. In this study, Koelreuteria paniculata was taken as the test plant and a manganese tailings slag was taken as the substrate, the differences in the occurrence status and microbial diversity of heavy metals in CK (100% slag), S0 (90% slag+5% spent mushroom slag+5% attapulgite), and S1 (90% slag+5% mushroom slag+5% attapulgite, planting Koelreuteria paniculata trees) were compared, and the effects of application of modifiers and planting Luan tree on the interception of heavy metals in slag were explored. The results showed that the application of modifiers (i.e. mushroom residue and attapulgite) increased the pH of the slag, enhanced its fertility and water holding capacity. Planting Koelreuteria paniculata trees could reduce the bioavailability of heavy metals, and significantly increased the residual proportions of Mn, Pb, and Zn, which were 5.73%, 13.5%, and 6.47% higher than S0, and 4.98%, 12.8%, and 6.01% higher than CK, respectively. A significant difference occurred in the amount of Mn, Pb, and Zn loss with rainwater runoff in each substrate before and after the experiment, and the corresponding order was S1<S0<CK. PlantingKoelreuteria paniculata trees and applying amendments had a significant impact on the microbial community structure of slag, and slight difference occurred in bacteria between S0 and S1 treatments, while the significant differences appeared in fungal α diversity. Compared with CK and S0, S1 treatment significantly increased the relative abundance of Bacteroidota, Acidobacteria, Basidiomycota and Ascomycota, as well as the relative abundance and diversity of beneficial bacteria such as saprophytic and eutrophic bacteria, which was conducive to maintaining soil fertility and promoting the growth of Koelreuteria paniculata trees, improving their stress resistance and repair efficiency.
-
Key words:
- woody plants /
- phytoremediation /
- modifiers /
- Mn slag /
- microbial diversity
-
生物炭(biochar,BC)是生物质在限氧条件下热解(<700 ℃)形成的固态的、难熔的、高度芳香化的富含碳的材料[1],被广泛用于固碳[1-2]、土壤改良[3-4]、水体和土壤污染修复[5]等领域. 溶解性黑碳(dissolved black carbon,DBC)是BC中可溶于水的具有稠环芳烃结构的组分[6]. BC的大规模施用导致DBC释放[7],并通过灌溉、渗透、地表径流在环境中迁移[8]. 相比于BC,DBC具有较小的芳香微域结构和更多的羧基和羟基官能团[8-9],有更高的反应活性和更强的环境迁移能力[9]. 据估计,DBC全球河流通量每年可达2650万t,占河流进入海洋溶解有机碳通量的10%,是陆地BC输入海洋的一个重要来源[6, 10]. DBC的芳香微域结构是有机物和重金属吸附/络合的高能位点[9],会影响污染物的吸附、迁移、转化等关键环境过程[8]. DBC富含的羧基和羟基官能团是其在氧化-还原反应中的重要电子来源[8],参与有机污染物的光化学转化过程[10-11]. 原料和热解温度(heating temperature,HTT)是影响BC性质和用途的关键因素,也必然决定了DBC的结构特征和环境行为[12]. 研究发现,木质素含量较高的稻壳制备的BC芳香性和产量显著高于低木质素含量的甘蔗所制备的BC[3]. 另外,相比于低温(<500 ℃)制备的BC,高温(>500 ℃)BC往往具有更高的芳香性、灰分和pH[5]. 因此,深入理解水环境中不同原料和HTT的DBC与有机污染物的相互作用,有助于更好地预测BC施用环境中污染物的环境行为和评估污染物的生态风险.
光化学转化是影响水环境中有机污染物环境归趋的重要过程[13]. 水环境中光敏剂的分子结构(芳香性结构和分子大小)和环境条件(pH和盐离子)等是影响光降解的重要因素[14]. 与水环境中天然溶解有机质(natural organic matter,NOM)相比,人工来源的DBC稠环度高,芳香性强,分子量较小,这使其具有更高的光电转化效率[8, 15],更易产生羟基自由基(·OH)、单线态氧(1O2)和激发三重态DBC(3DBC*)等活性中间体(reactive intermediates,RIS)[10]. DBC的这些特性导致其对水环境中有机污染物的光降解过程的影响较NOM更为复杂[16]. 研究发现,DBC促进了塑化剂(如邻苯二甲酸二乙酯)[16]、杀虫剂(如吡虫啉)[12]、个人护理品(如阿替洛尔)[15]和性激素(如17-β雌二醇)[10]等多种有机污染物的光降解. 然而,腐殖酸(humic acid, HA)(DBC的重要组成部分)也可能会因遮光效应抑制有机物的光降解[13]. 可见,DBC参与的水环境中有机污染物的降解过程仍然存在不确定性.
新污染物是指由人类活动造成的,但尚无法律法规和标准规定或规定不完善的,危害人体健康和生态环境的污染物,主要包括环境内分泌干扰物、全氟化合物、微塑料和抗生素(antibiotics, ATs)四大类[17],而我国对于新污染物的毒理学风险评估、替代技术开发的方面还有局限性. ATs是一类由微生物分泌、化学合成或半合成的化合物,因其对微生物生长代谢的抑制而被广泛应用于医疗、畜牧业、水产养殖等领域[18]. 四环素(tetracycline, TC)因其广谱抗菌性和低廉的价格成为使用量最大的ATs之一. 2015年,全球TC使用量达6万t[19],这也导致TC在地表水、地下水和饮用水等水环境中被广泛检出,含量为ng·L−1—μg·L−1[20-21]. TC对水生动物(水生植物、浮游动物和鱼类)具有较强的生物急性毒性,能够抑制藻类和水生植物叶绿素的合成[22-23]、促进氧化应激反应的产生,影响浮游动物和鱼类的生长发育[22],同时TC还能够破坏水体微生物群落结构[21],损害水生生态系统的结构和功能[24]. 另外,ATs的长期暴露能够促进抗生素抗性基因的传播扩散,增加人体对ATs的抗药性[25],对人体健康产生极大的威胁[18, 26]. ATs在水环境中的光降解过程引起了广泛关注[13]. ATs的光降解主要受ATs种类[15]、环境条件(pH、盐离子)[27]、光敏剂(NOM、DBC)[10]等影响. 目前,水环境中DBC存在时,ATs的光降解研究以往主要集中在单一HTT制备的DBC对ATs光降解的影响上[13, 28],很少涉及不同原料和HTT的DBC对TC光降解的影响.
本研究以不同HTT(300—600 ºC)制备的湿地植物芦苇(Phragmites australis)和芦竹(Arundo donax)BC为原料提取DBC,探究HTT对DBC理化性质及结构特征的影响,系统研究了不同HTT的DBC对水环境中典型ATs TC的光降解的影响,并探讨了水中常见离子和pH对TC光降解过程的影响,以期阐明DBC影响TC光降解的主要机制. 研究结果将为评估DBC的环境行为及其对共存有机污染物的环境归趋的预测和生态风险的评估提供理论依据.
1. 材料与方法(Materials and methods)
1.1 实验材料
本研究所用BC均是实验室前期以湿地植物芦苇和芦竹为原料,利用限氧慢速热解法在300—600 ℃条件下制备[29]. DBC的提取步骤如下[10, 13]:将0.2 g BC置于20 mL超纯水中,室温条件下130 r·min−1振荡12 h,过0.45 μm醋酸纤维膜,收集滤液. 将滤膜上的BC重新分散在20 mL超纯水中,用水浴超声仪(KQ-500DE,昆山舒美,中国)在40 kHz频率下水浴超声30 min,过0.45 μm醋酸纤维膜后再次收集滤液. 重复上述超声提取过程两次,合并收集到的滤液,即为DBC溶液[10, 15]. 芦苇DBC标记为LW300、LW400和LW500,芦竹DBC标记为LZ300、LZ400、LZ500和LZ600,数字代表BC的HTT. 将DBC置于4 ℃冰箱中避光保存. TC(纯度>99%)购于生工生物工程(上海)股份有限公司,理化性质见表1.
CAS 分子式Molecular formula 溶解度Solubility pKa 结构式Structural formula 64-75-5 C22H25ClN2O8 19.7 g·L−1(25 ℃) pKa1=3.30pKa2=7.68pKa3=9.68 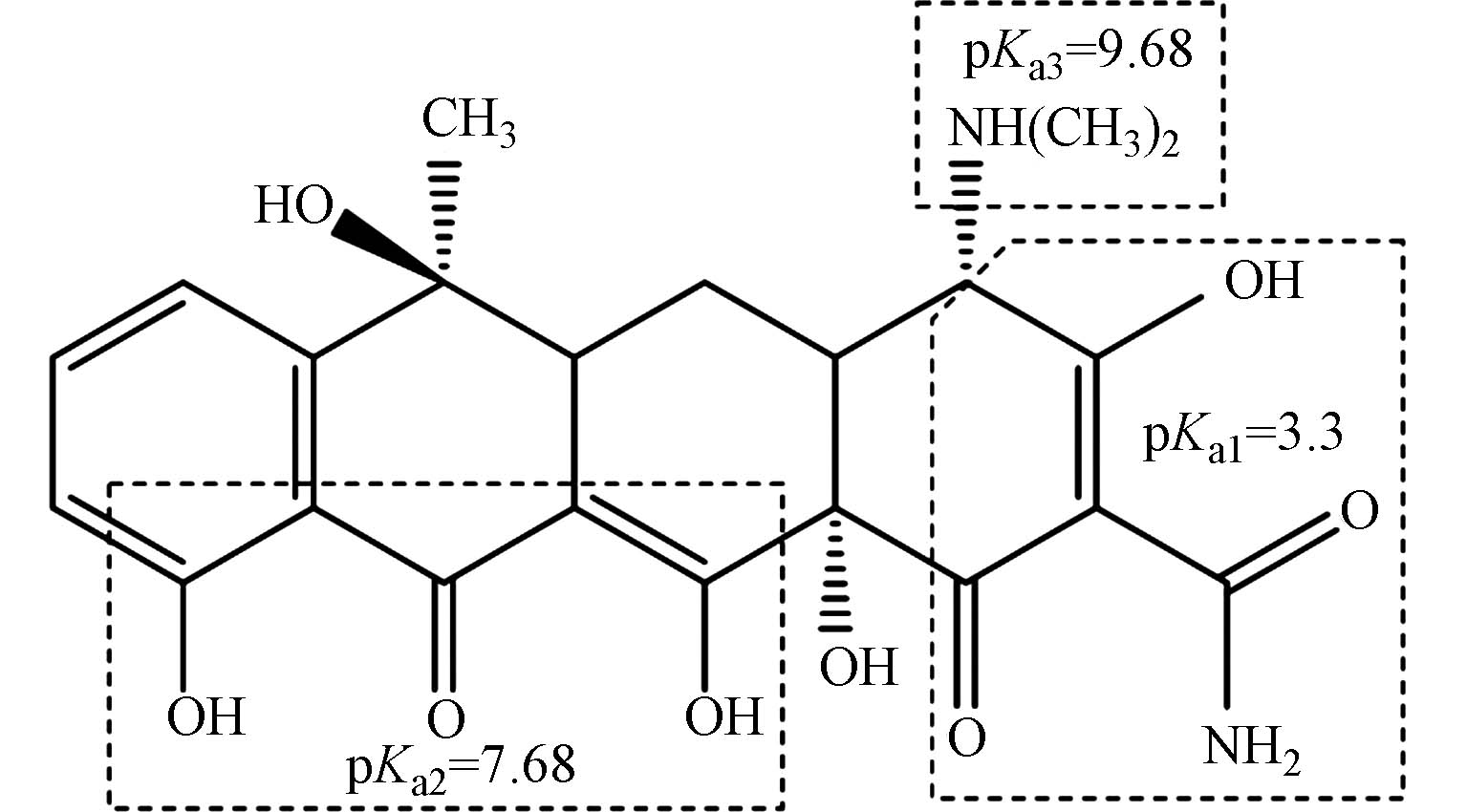
1.2 DBC的表征
总有机碳分析仪(TOC-Vcpn,Shimadzu,日本)和pH计(AB150,Thermo Fisher Scientific,美国)测定DBC的总有机碳(TOC)含量和pH. 紫外可见分光光度计(UV-9000S,上海元析,中国)测定DBC紫外-可见吸收光谱,扫描波长为100—900 nm. 荧光分光光度计(F-4600,日立,日本)分析DBC的荧光特性,测定发射波长(Em)为200—550 nm,激发波长(Ex)为220—450 nm. 傅里叶变换红外光谱仪(FTIR,Spectrum Two,PerkinElmer,英国)测定DBC的官能团,扫描区域为4000—500 cm−1,分辨率 4 cm−1 .
1.3 DBC对TC的光降解实验
1.3.1 不同种类DBC对TC光降解影响
在模拟太阳光照射下,于100 mL石英管(含20 mL溶液)中进行DBC暴露下的TC光解实验[27]. 以测得TOC作为DBC原始质量浓度(表2),配置100 mg·L−1(以C的质量计)的DBC储备液. 向石英管中分别加入0.02、0.2、2 mL的DBC储备液和1 mL的TC储备液(400 mg·L−1),用超纯水定容至20 mL. 将石英管放在于以汞灯为光源的光化学反应仪(BL-GHX-V,上海比朗,中国)中,波长为290—400 nm,光功率密度为30 W·m−2,石英管以25 r·min−1匀速旋转. 反应启动后,分别在0、10、20、40、60 min时取600 µL反应溶液,过0.22 µm聚醚砜滤膜后用高效液相色谱仪(HPLC 1260,安捷伦,美国)对TC定量分析. HPLC的检测条件为:C18反向色谱柱(3.5 μm,4.6 mm×250 mm),紫外检测器,波长设为355 nm,柱温为30 ℃,流动相为1:3的乙腈和草酸(0.01 mol·L−1)溶液,流速为 1 mL·min−1,进样量为20 μL.
表 2 DBC的基本物理化学性质Table 2. Basic physicochemical properties of DBCDBC TOC/(mg·L−1) pH SUVA254/L·(mgC·m-1)−1 E2/E3 E4/E6 LW300 123 4.25 0.18 3.92 7.17 LW400 152 4.74 0.12 5.01 5.82 LW500 98.9 5.96 0.16 3.67 3.88 LZ300 520 5.66 0.06 6.23 5.48 LZ400 832 5.77 0.02 7.28 15.8 LZ500 451 7.75 0.17 3.81 5.09 LZ600 101 10.2 0.27 4.61 2.00 注:SUVA254为100倍的254 nm处的吸光度和DBC TOC的比值,E4/E6为465 nm处吸光度和665 nm处吸光度的比值,E2/E3为254 nm处吸光度和365 nm处吸光度的比值. Note: SUVA254 is the ratio of 100 times the absorbance at 254 nm to DBC TOC, E4/E6 is the ratio of the absorbance at 465 nm to 665 nm, E2/E3 is the ratio of the absorbance at 254 nm to 365 nm. 1.3.2 TC初始浓度对光解的影响
向含有2 mL DBC储备液的石英管中分别加入0、0.25、0.5、1、2 mL的TC储备液,用超纯水定容至20 mL,按照1.3.1节中条件光解、检测.
1.3.3 常见离子对TC降解影响
选择水环境中常见的阴离子(NO3−、HCO3−、SO42-、Cl−)和阳离子(Fe3+、Ca2+)进行光解实验[27]. 向含有2 mL DBC储备液和1 mL TC储备液的石英管中分别加入0、0.002、0.02、0.2、2 mL的离子储备液(100 mg·L−1),用超纯水定容至20 mL,按照1.3.1节中条件光解、检测.
1.3.4 初始pH对TC光解的影响
使用0.1 mol·L−1的HCl和NaOH将含有DBC(10 mg·L−1)和TC(20 mg·L−1)混合溶液的pH分别调整为3、5、7、9和11. 按照1.3.1节中条件光解、检测.
1.4 活性中间体对TC光解的影响
为确定DBC产生的不同RIS在TC光降解中的作用,选择常用的猝灭剂异丙醇(IPA)、2,4,6-三甲基酚(TMP)和叠氮化钠(NaN3)分别验证·OH、3DBC*以及·OH和1O2在光降解过程中的作用[10, 12]. 向含有2 mL DBC储备液和1 mL TC储备液的石英管中分别添加20 μL IPA、2 mL 80 mg·L−1的NaN3和2 mL 0.545 g·L−1的TMP,用超纯水定容至20 mL,按照1.3.1节中条件光解、检测.
1.5 数据分析
采用Excel 2016和Origin 2018进行实验结果的处理分析及图表绘制. 使用SPSS 22.0进行单因素方差分析(ANOVA),结合Duncan 检验(P < 0.05)进行显著性差异分析. 利用Origin 2018绘制三维荧光光谱图并对荧光区域积分进行定量分析. 用二级动力学模型(1/C-1/C0=kt)模拟TC光降解动力学[13],其中C和C0分别是t时刻和0时刻的TC浓度,k是二级速率常数.
2. 结果与讨论(Results and discussion)
2.1 DBC的理化性质及结构特征
DBC的物理化学性质如表2所示. 随着HTT升高,芦苇和芦竹DBC的TOC含量均呈先升高后降低的趋势. 这是由于在较低HTT下(300—400 ℃),BC炭化程度低,溶解性物质含量较高[3, 30];当HTT升至500 ℃时,纤维素和木质素进一步分解聚合,产生更多稳定性较强的芳烃类物质[3]. 另外,芦竹DBC的TOC含量(101—832 mg·L−1)高于芦苇DBC(98.9—152 mg·L−1),这可能是芦竹生物质较芦苇含有更多的纤维素和半纤维素[31],导致相同HTT的芦竹BC稳定性较低,含有更多的可溶性物质. 随着HTT升高,芦苇和芦竹DBC的pH分别由4.25和5.66上升至5.96和10.2,这是因为HTT升高导致BC中矿物质富集,且矿物质的溶解使得DBC的溶液的pH增加[3]. E4/E6是有机质的芳香性指标,与芳香性呈反比[12]. 随着HTT的升高,芦苇和芦竹DBC的E4/E6由7.17和5.48降低至3.88和2.00(除LZ400外),说明高HTT的DBC芳香性更高. 这是因为BC形成时,生物质发生脱水和裂解反应导致不稳定有机物分解,而聚合反应增加了芳香性物质的含量[5]. 值得注意的是,LZ400的E4/E6大幅升高,这可能是因为纤维素分解为酸醛等可溶性高的物质[32],导致芳香性组分在水相总有机质中占比下降. SUVA254是有机质的芳香性指标,与芳香性呈正比[12]. 随着HTT升高SUVA254先降低后升高,这表明芳香性在400 ℃时降低,但高温DBC芳香性更高这与E4/E6的结果一致. 相同HTT下,芦苇DBC(0.12—0.18 L·(mg·C·m-1)−1)比芦竹DBC(0.02—0.17 L·(mg·C·m-1)−1)的芳香性更强,这可能是由于芦苇生物质的木质素含量高,产生的BC芳香性物质更多[31]. E2/E3是有机质分子量大小的指标,与其分子量呈反比[12]. 两类DBC的E2/E3随HTT增加先升高后降低,表明DBC分子量先降低后上升,这与芦苇和芦竹热解形成BC的过程中脂肪烃分解和芳香烃的形成有关[30]. 另外,相同HTT下,芦竹DBC的E2/E3比值(3.81—7.28)高于芦苇DBC(3.67—5.01),表明芦竹DBC平均分子量更小,这与TOC的含量变化规律一致,表明小分子量物质可能更易从BC溶出,形成DBC[33].
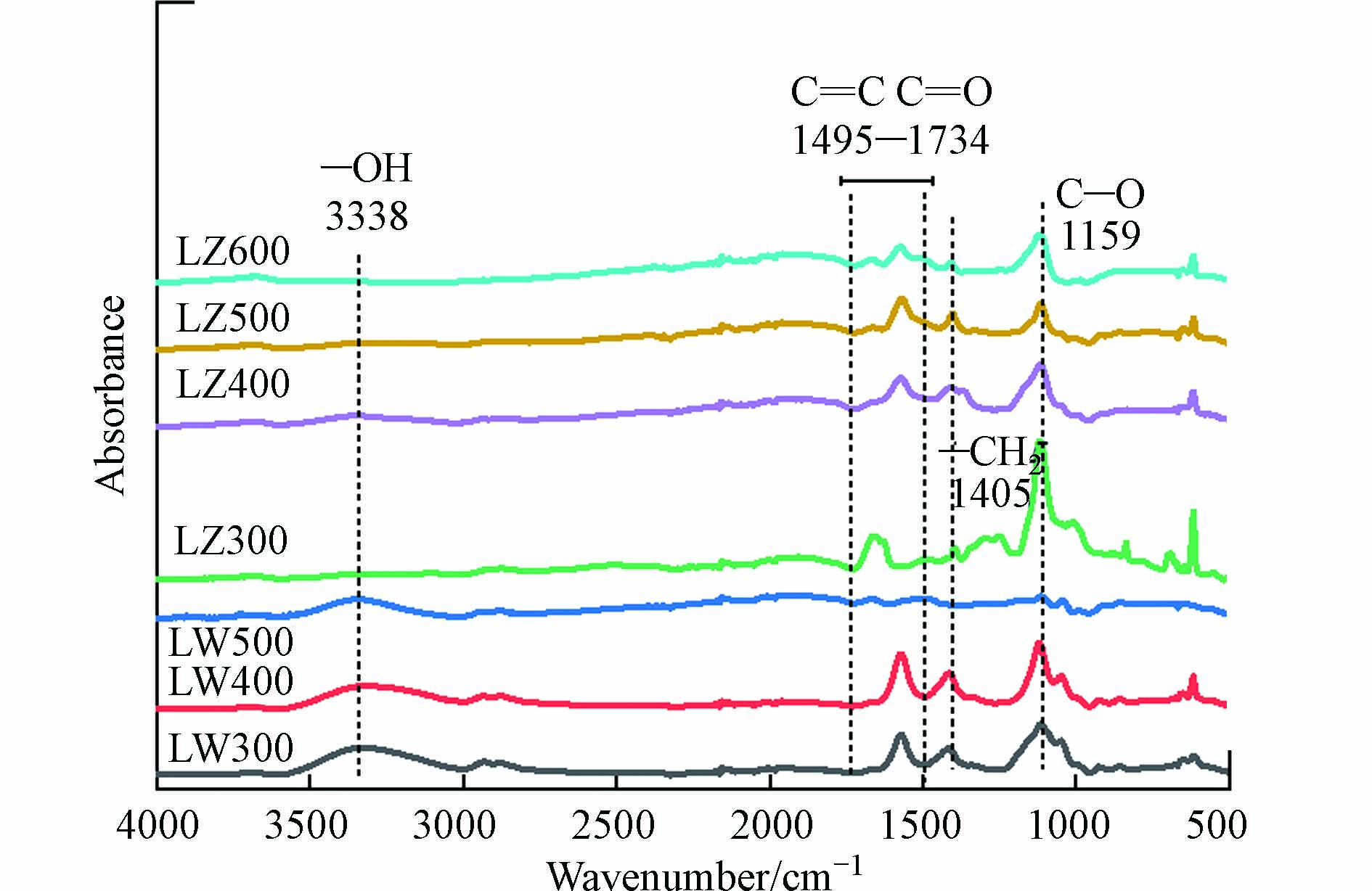
DBC的FTIR图谱如图1所示. 对于芦竹DBC,其在1495—1734 cm−1(C=C、C=O)、1405 cm−1(—CH2—)和1159 cm−1(C—O)处有明显的吸收峰[34].
随着HTT的升高,C—O的峰大幅度降低,—CH2—的峰也变小,表明不稳定的脂肪族化合物逐渐被分解,而C=C和C=O虽有小幅度降低,但仍有较大的振动峰存在,表明芦竹DBC仍具有较高的芳香性组分[34]. 对于芦苇DBC,在3338 cm−1(酚羟基,—OH)[29, 35]、1495—1734 cm−1(C=C、C=O)、1405 cm−1(—CH2—)和1159 cm−1(C—O)处有明显的吸收峰. 随着HTT升高,—CH2—和C—O的峰逐渐消失,表明不稳定的脂肪烃逐渐分解,C=C和C=O的峰虽也消失,但酚—OH的峰却无明显变化,说明芦苇DBC中的芳香性组分虽有分解,但仍有较高含量的芳香性组分存在. 总体来说,随着HTT的升高,DBC中脂肪族化合物的含量降低,芳香性组分含量增加,这与DBC的芳香性增加的结果一致(表2).
DBC发色基团的含量对于其光化学反应的发生至关重要[36]. 因此对DBC进行了三维荧光光谱(3D-EEM)分析(图2).
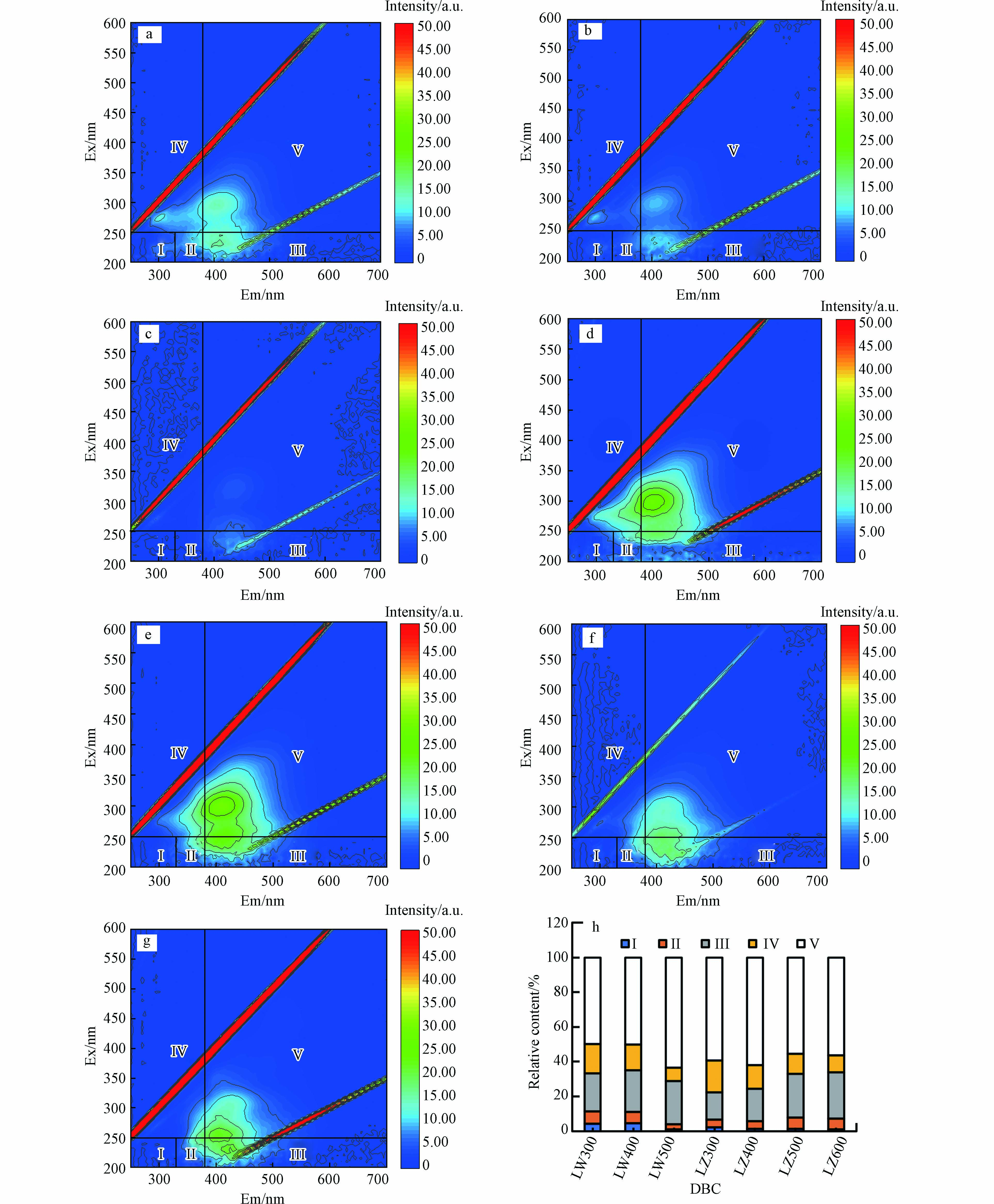 图 2 DBC的荧光组分及相对含量Figure 2. Fluorescence components and their relative contents in DBC(a)LW300、(b)LW400、(c)LW500、(d)LZ300、(e)LZ400、(f)LZ500和(g)LZ600三维荧光谱图;(h)DBC的5种组分的相对含量3D-EEM of (a) LW300, (b) LW400, (c) LW500, (d) LZ300, (e) LZ400, (f) LZ500 and (g) LZ600; (h) The relative contents of DBC five components
图 2 DBC的荧光组分及相对含量Figure 2. Fluorescence components and their relative contents in DBC(a)LW300、(b)LW400、(c)LW500、(d)LZ300、(e)LZ400、(f)LZ500和(g)LZ600三维荧光谱图;(h)DBC的5种组分的相对含量3D-EEM of (a) LW300, (b) LW400, (c) LW500, (d) LZ300, (e) LZ400, (f) LZ500 and (g) LZ600; (h) The relative contents of DBC five componentsLW300、LW400、LZ300、LZ400和LZ500在Ⅲ(Ex:200—250 nm和Em:380—550 nm)、Ⅳ(Ex: 200—250 nm和Em: 330—380 nm)和Ⅴ(Ex: 250—400 nm和Em: 380—550 nm)处有明显的荧光峰,它们分别代表富里酸(fulvic acid, FA)类、溶解性微生物代谢产物和HA类物质. LW500和LZ600仅在Ⅲ和Ⅴ处有荧光峰,表明存在FA类和HA类物质. 所有DBC在Ⅰ(Ex:200—250 nm和Em:280—330 nm)和Ⅱ(Ex:200—250 nm和Em:330—380 nm)区域的荧光峰不明显,表明存在芳香性类蛋白质物质. 这些结果表明FA类和HA类物质是DBC的主要组分. 随HTT升高,芦苇DBC FA和HA相对含量分别由21.9%和49.7%增加至24.9%和63.6%,溶解性微生物代谢产物含量由17.1%降至7.5%,芦竹DBCFA类含量由15.6%增加到26.6%,溶解性微生物代谢产物和HA的含量分别由59.3%和18.2%减少到56.4%和9.7%. FA类和HA类物质的总含量随HTT升高呈上升趋势(71.6%—88.5%). NOM中的类FA和HA类物质是重要的光敏剂,吸收光子后会生成激发三重态HA(3HA*)和FA(3FA*),可通过能量转换或者电子转移降解有机污染物[37]. 因此,含有FA类和HA类组分的DBC也可能促进水体中ATs等有机污染物的光降解,这需要进一步的研究.
2.2 DBC对TC光降解的影响
不同种类DBC对TC光降解的影响如图3所示. 黑暗条件下,DBC对TC浓度无明显影响(图3a),表明非光化学过程对TC降解作用不明显. 光照条件下,DBC不存在时,TC的直接光降解率较低(6.2%),但DBC的存在显著增加了TC的光解率(16.3%—97.0%)(图3b). 用二级动力学方程拟合光解速率k,在不添加DBC时,k为8.3×10−5,添加DBC后,k分别升高为1.7×10−4、1.8×10−4、2.6×10−4、8.3×10−4、8.4×10−4、9.0×10−4和8.8×10−2(图3c),表明DBC促进了TC的光解速率,且高温DBC促进效果更强. 相同HTT条件下,芦竹DBC对k的促进效果高于芦苇DBC. 7种DBC中,LZ600对TC的光解的促进最显著,且LZ600在10 mg·L−1的添加量下,TC光解率最高(图3d). 另外,当TC的初始浓度从5 mg·L−1增加至40 mg·L−1时,TC的光解速率从0.32 L·(mg·min)−1升高至1.45 L·(mg·min)−1,然后降低至0.15 L·(mg·min)−1(R2>0.91). 其中,TC浓度为20 mg·L−1时,其光解速率最快. 因此,选用10 mg·L−1 LZ600和20 mg·L−1的TC进行后续实验. ZHOU等[10]也发现竹子DBC能够将17-β雌二醇的一阶速率常数提高1个数量级,这与上述DBC增加k值的结果一致,说明DBC能够作为一种高效的光敏剂促进TC的光降解.
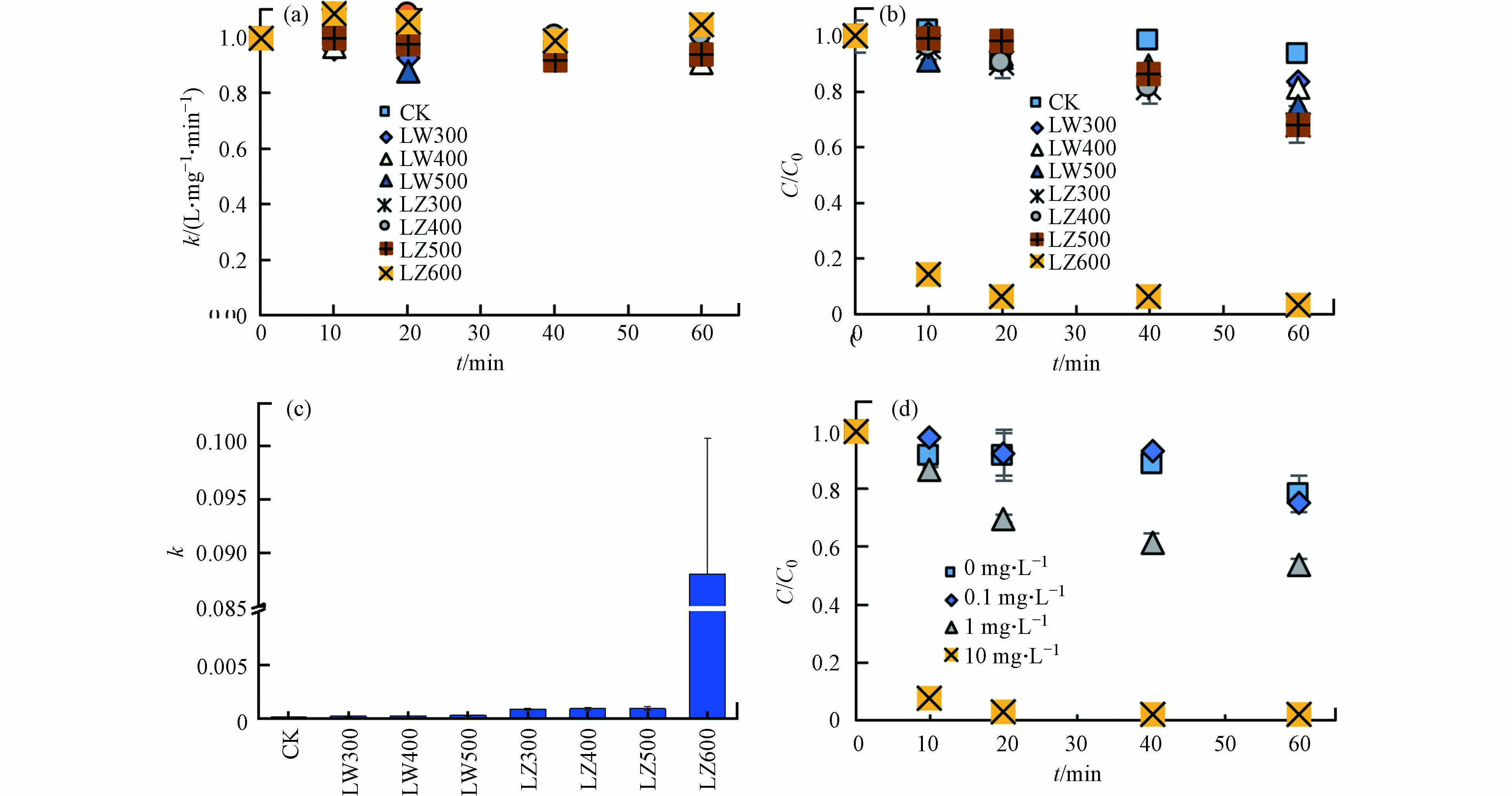 图 3 光照和黑暗条件下不同DBC和不同浓度的LZ600对TC降解的影响Figure 3. Effects of DBC and LZ600 concentrations on TC photodegradation under light and dark conditions光照(a)和黑暗(b)条件下不同DBC对TC降解的影响;(c)不同DBC条件下的TC光解的二阶速率常数(R2>0.93);(d)不同浓度LZ600对TC光解的影响Effect of different DBC on TC degradation under light (a) and dark (b) conditions; (c) Second-order rate constant of TC photolysis under different DBC conditions (R2 > 0.93); (d) Effects of different concentrations of LZ600 on TC photolysis
图 3 光照和黑暗条件下不同DBC和不同浓度的LZ600对TC降解的影响Figure 3. Effects of DBC and LZ600 concentrations on TC photodegradation under light and dark conditions光照(a)和黑暗(b)条件下不同DBC对TC降解的影响;(c)不同DBC条件下的TC光解的二阶速率常数(R2>0.93);(d)不同浓度LZ600对TC光解的影响Effect of different DBC on TC degradation under light (a) and dark (b) conditions; (c) Second-order rate constant of TC photolysis under different DBC conditions (R2 > 0.93); (d) Effects of different concentrations of LZ600 on TC photolysis2.3 环境条件对LZ600介导的TC光降解的影响
实际水环境中存在多种阴离子(如NO3−、HCO3−、SO42−、Cl−)和阳离子(如Fe3+、Ca2+),可能影响DBC的光敏性及污染物的光转化过程[38-43]. LZ600存在的条件下,与不添加离子的对照组相比(99.6%),当溶液中存在NO3−、HCO3−、SO42−、Cl−、Fe3+和Ca2+时,TC的光降解率降为76.0%—80.0%、76.3%—81.0%、71.5%—77.4%、66.8%—69.0%、16.0%—97.3%和1.2%—54.8%(图4a—g).
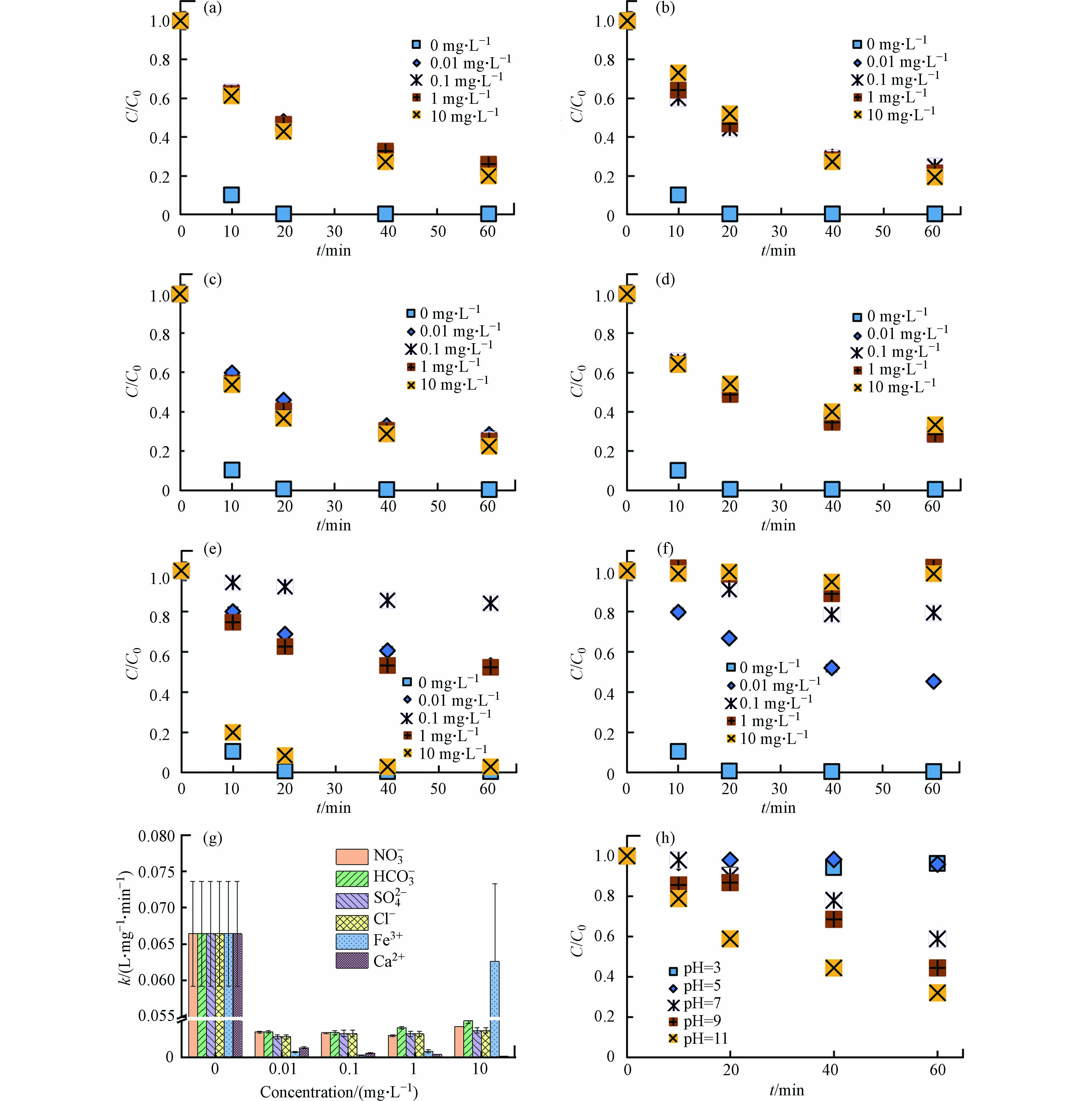 图 4 不同离子和pH条件下LZ600对TC光降解的影响Figure 4. Effect of LZ600 on TC photodegradation under different ambient ions and pH(a)NO3-、(b)HCO3-、(c)SO42-、(d)Cl-、(e)Fe3+和(f)Ca2+的不同浓度梯度下DBC对TC的光降解的影响;(g)不同离子条件下TC光解的二阶速率常数(R2>0.94);(h)LZ600存在下,不同pH对TC光降解的影响The effect of DBC on TC photodegradation under different concentration gradients of (a) NO3- (b) HCO3- (c) SO42- (d) Cl- (e) Fe3+ and (f) Ca2+; (g) Second-order rate constant of TC photolysis under different ionic conditions (R2 > 0.94); (h) Effect of different pH on TC photodegradation in the presence of LZ600
图 4 不同离子和pH条件下LZ600对TC光降解的影响Figure 4. Effect of LZ600 on TC photodegradation under different ambient ions and pH(a)NO3-、(b)HCO3-、(c)SO42-、(d)Cl-、(e)Fe3+和(f)Ca2+的不同浓度梯度下DBC对TC的光降解的影响;(g)不同离子条件下TC光解的二阶速率常数(R2>0.94);(h)LZ600存在下,不同pH对TC光降解的影响The effect of DBC on TC photodegradation under different concentration gradients of (a) NO3- (b) HCO3- (c) SO42- (d) Cl- (e) Fe3+ and (f) Ca2+; (g) Second-order rate constant of TC photolysis under different ionic conditions (R2 > 0.94); (h) Effect of different pH on TC photodegradation in the presence of LZ600另外,不添加离子时,k为6.6×10−2 L·(mg·min)−1,添加离子后,k降为3.4×10−3—3.9×10−3、3.4×10−3—4.2×10−3、3.5×10−3—3.7×10−3、2.2×10−3—2.7×10−3、2.5×10−4—2.6×10−2和9.8×10−4—1.3×10−3 L·(mg·min)−1 (图4g). 结果表明,环境中常见的离子对DBC介导的TC光降解有一定抑制效果,抑制效果受离子种类和浓度的影响. ZHANG等[27]研究表明HCO3−和Cl−能够与DBC产生的RIS反应,生成活性小于RIS的次级活性中间体,抑制抗生素抗性基因的光解. MACK和ZHOU等[40-41]发现,NO3−和SO42−可以抑制DBC对光子的吸收而抑制DBC光解. OU等[42]发现,Ca2+能够与DBC形成内球配合体,促进DBC沉降进而抑制其光反应. Fe3+在0.01—0.1 mg·L−1添加量下显著抑制DBC的光解,这是由于Fe3+与DBC竞争光子抑制了RIS的生成[43]. 但当添加量为1—10 mg·L−1时,Fe3+对DBC光解的抑制效果被缓解,这可能是因为Fe3+与水分子和DBC产生了光敏剂Fe(OH)2+和Fe-DBC剂促进了RIS的产生[43-44]. 简而言之,离子通过影响DBC对光子的吸收以及RIS的活性影响TC的光降解.
pH会影响DBC的表面活性和TC的电子密度[42, 45],因此pH可能会对TC的降解产生影响. 不同pH(3、5、7、9和11)对DBC影响的TC光降解如图4h. 随着pH增加,TC光解率从3.7%增加到67.9%,k从5.0×10−5增加到2.3×10−3 L·(mg·min)−1. 这表明碱性条件下,LZ600更有助于促进TC的光降解. 这与李聪鹤等[46]研究一致,在pH为11的条件下,溶解性有机质对磺胺甲恶唑的降解效果最显著. 这可能是由于pH的增加有助于增加DBC的稳定性[42]及促进RIS的产生[46],同时高pH条件下,TC去质子化程度增大,电子密度增加,更易受到RIS的攻击[46-47].
2.4 DBC影响TC降解的可能机制
DBC是水环境重要的光敏剂,会在光照下发生化学转化[15]. 为探究光解前后LZ600结构组成的变化,测定了光降解后LZ600组成及含量(图5a). 与原始LZ600相比(图2g),光照后LZ600组分Ⅰ—Ⅴ的荧光强度显著降低(14.1%—35.0%),其中FA类和HA类对荧光强度变化的贡献最大(27.1%和54.2%),表明HA类和FA类物质在光照下发生了明显的转化. 先前的研究表明,FA和HA的添加能够产生大量的RIS,将ATs的降解速率提高34%[13]. 因此,DBC导致的TC光解的增强可能归因于FA类和HA类物质的光转化而产生的强氧化性的RIS [15].
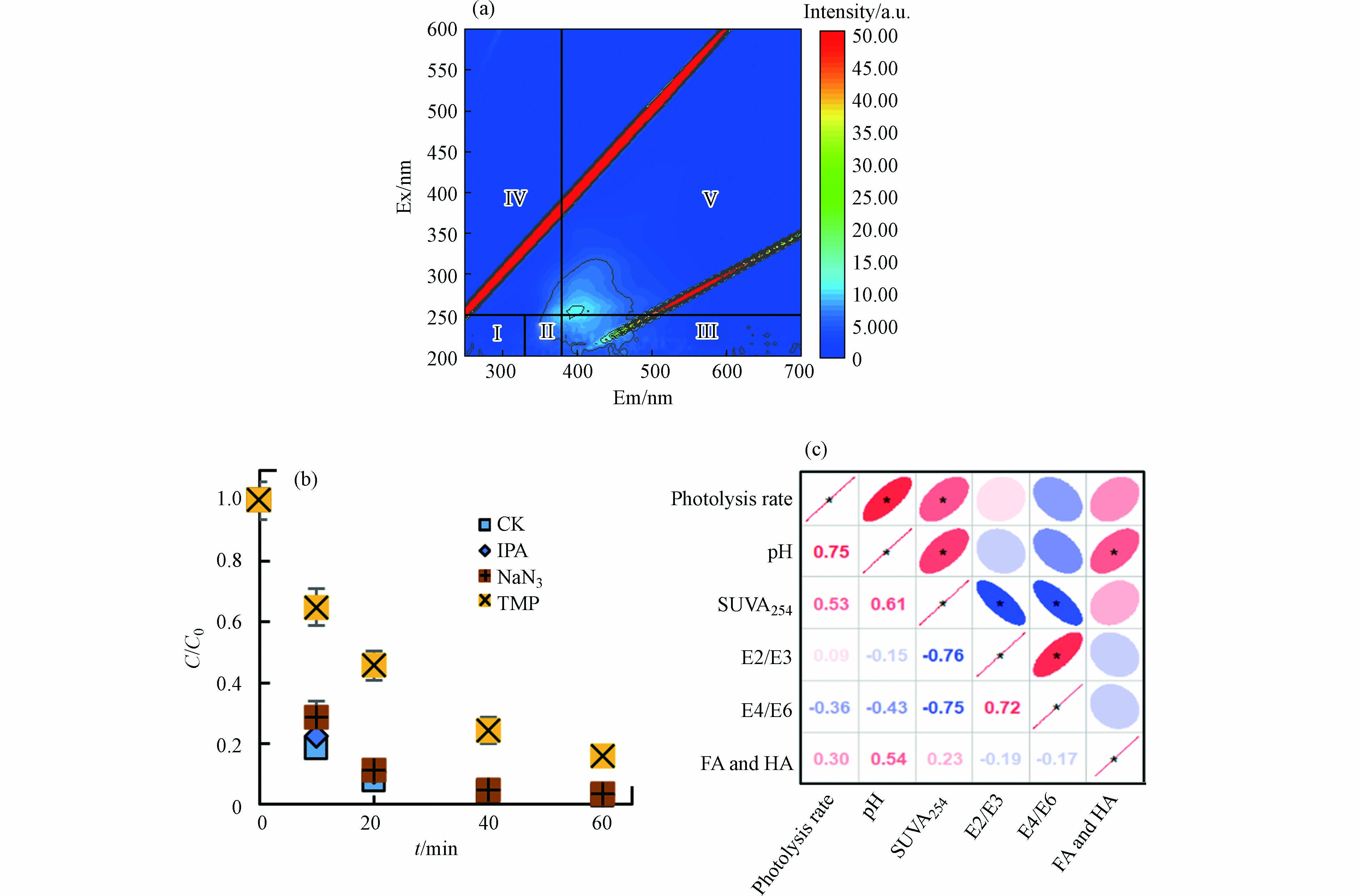 图 5 光降解对DBC性质及猝灭剂对TC光解的影响Figure 5. Effect of photolysis on LZ600 and quenching experiment(a)LZ600光降解后的三维荧光光谱;(b)活性中间体猝灭剂存在下DBC对TC光降解的影响;(c)TC光降解率的相关性分析(红色为正相关,蓝色为负相关)(a) 3D-EEM of LZ600 after photodegradation; (b) The effect of DBC on TC photodegradation in the presence of active intermediate quencher; (c) Correlation analysis of TC photodegradation rate (red is positive correlation, blue is negative correlation)
图 5 光降解对DBC性质及猝灭剂对TC光解的影响Figure 5. Effect of photolysis on LZ600 and quenching experiment(a)LZ600光降解后的三维荧光光谱;(b)活性中间体猝灭剂存在下DBC对TC光降解的影响;(c)TC光降解率的相关性分析(红色为正相关,蓝色为负相关)(a) 3D-EEM of LZ600 after photodegradation; (b) The effect of DBC on TC photodegradation in the presence of active intermediate quencher; (c) Correlation analysis of TC photodegradation rate (red is positive correlation, blue is negative correlation)为了进一步探究DBC在光照下产生的不同RIS(·OH、1O2和3DBC*)在光解中的作用,进行了RIS猝灭实验. 如图5b所示,添加TMP(3DBC*猝灭剂)后,DBC对TC的光解率从97.0%降至84.0%,NaN3(·OH和1O2猝灭剂)和IPA(·OH猝灭剂)的加入对TC光解影响较小. 这说明TC的光降解的增强主要归因于3DBC*. 另外,TMP使得k从1.1×10−2 L·( mg·min) −1降至1.1×10−3 L·(mg·min)−1,IPA使k从1.1×10−2 L·( mg·min) −1降至8.9×103 L·(mg·min)−1,NaN3使k从1.1×10−2 L·( mg·min) −1降至6.8×103 L·(mg·min)−1,NaN3与IPA的k差值为2.1×10−3 L·(mg·min)−1. 这进一步说明DBC对TC的降解由3DBC*起主导作用,·OH和1O2也促进了光解,但贡献较小[10].
不同HTT下DBC的芳香性、分子量及FA和HA类物质的总含量均不同,为探究这些性质是否会影响DBC对TC光解的效果,进行了TC光解率与DBC的SUVA254、E2/E3、E4/E6、pH和HA和FA总含量的相关性分析(图5c). 结果表明TC光解率与pH呈显著正相关,说明pH很大程度上影响了DBC对TC的光解,可能是因为低pH时,DBC表面会形成致密的层,不易发生光反应[42];高pH时,DBC中HA和FA产生的小分子酸更容易被消耗,使化学平衡不断向RIS生成方向进行,增加了RIS含量[48]. 除pH外,DBC的芳香性(SUV254)也与TC的光解率呈显著正相关,这是因为芳香性物质是DBC吸收光子的主要组分,芳香性的升高会增加DBC光子的吸收进而促进RIS的产生[15]. 除pH和芳香性外,HA和FA含量与TC的光解率也呈正相关,也可能会影响DBC对TC的光解效果,但不是主要原因,DBC的分子量与光解率的相关性较低,对TC的光降解影响较小. 结果进一步说明,DBC促进TC的光降解主要是由于DBC具有的稠环芳烃类结构导致的RIS(3DBC*)的产生引起的(图6).
3. 结论(Conclusion)
本研究针对不同热解温度和生物质类型的DBC对水环境中ATs光降解影响效果不明确的问题,重点评估了不同原料和热解温度条件下制备的DBC的理化性质及结构特征,探究了不同制备条件的DBC对ATs光降解的影响和机制及关键水环境条件对ATs光降解的影响. 研究发现:
(1)随着热解温度升高,DBC的TOC先上升后下降,分子量先降低后上升,芳香性逐渐增强,类FA和类HA相对含量增加.
(2)DBC对TC的光降解均有促进作用. 随着热解温度升高,芦苇和芦竹DBC对TC光降解的促进作用增加,在相同热解温度下,芦竹DBC对TC光降解的促进效果较芦苇DBC更高.
(3)水中常见阴离子(NO3−、HCO3−、SO42−、Cl−)和阳离子(Fe3+、Ca2+)均对TC的光降解有抑制作用,抑制效果受离子种类和浓度的影响. DBC在碱性条件下对TC光降解的促进作用较酸性条件更高.
(4)TC的光降解主要由DBC中的富里酸和腐殖酸类物质光转化产生的·OH、1O2和3DBC*等活性中间体诱发,其中TC的光降解由3DBC*主导,·OH、1O2对TC光降解的贡献较小.
-
表 1 蘑菇渣的化学特征
Table 1. Chemical characteristics of spent mushroom compost
pH 有机质/% TN/(g·kg−1) TP/(g·kg−1) TK/(g·kg−1) 重金属质量分数/(mg·kg−1) Mn Pb Zn Cu Cd 7.25±0.01 52.32±0.25 6.36±0.02 3.05±0.03 8.36±0.01 532±6.22 29±0.61 169±2.42 25±0.28 0.41±0.01 表 2 实验前后各基质的基本理化性质差异
Table 2. Basic physicochemical properties of each substrate
处理组 pH 含水率/% 容重/(g·cm−3) 孔隙率/% TP/(g·kg−1) TN/(g·kg−1) TK/(g·kg−1) 有机质/% CEC/(cmol·kg−1) CKb 7.46±0.02a 25.33±1.22a 1.57±0.04a 40.82±1.26b 0.33±0.003a 0.16±0.01a 10.07±0.02a 2.03±0.01a 17.99±0.69a CKa 7.38±0.02b 15.55±0.54b 1.50±0.02b 43.23±0.49a 0.32±0.001a 0.14±0.01b 8.47±0.06b 1.99±0.01b 17.65±0.30a S0b 7.62±0.02a 35.02±1.23a 1.34±0.04a 49.66±1.49a 0.45±0.003a 0.47±0.01a 9.82±0.09a 4.58±0.06a 25.69±0.28a S0a 7.55±0.01b 21.06±1.14b 1.27±0.02a 52.00±0.66a 0.25±0.010b 0.33±0.01b 8.60±0.08b 4.33±0.07b 22.43±0.36b S1b 7.62±0.03b 34.68±1.15a 1.34±0.01a 49.33±0.34b 0.44±0.010a 0.47±0.01a 9.82±0.05a 4.52±0.03a 25.67±0.15b S1a 7.74±0.01a 28.40±1.32b 1.22±0.02b 54.01±0.60a 0.35±0.006b 0.30±0.01b 8.00±0.10b 3.87±0.07b 26.45±0.44a 表 3 各基质重金属质量分数
Table 3. Content of heavy metal of each substrate
重金属 项目 重金属质量分数/(mg·kg−1) CK S0 S1 Mn 实验前 10 910±194.7a 9 448±34.2a 9 453±28.0a 实验后 8 422±12.1b 7 528±20.1b 8 849±34.0b Pb 实验前 3 340±39.2a 3 029±21.4a 3 053±28.5a 实验后 2 612±4.5b 2 320±5.0b 2 738±24.0b Zn 实验前 4 239±13.1a 3 822±6.8a 3 830±13.6a 实验后 3 247±35.6b 3 050±21.2b 3 428±33.4b Cu 实验前 143±3.2a 134±2.1a 135±1.1a 实验后 134±2.2b 124±1.4b 125±2.4b Cd 实验前 34.27±0.40a 30.07±0.15a 29.60±0.26a 实验后 30.50±1.28b 22.93±0.06b 25.27±0.04b 注:同种重金属实验前后不同字母表示不同处理下基质重金属质量分数显著差异(P<0.05)。 表 4 栾树根、茎、叶中的重金属含量
Table 4. Heavy metal content in roots stems, and leaves of Koelreuteria Paniculata
重金属 重金属质量分数/(mg·kg−1) 根 茎 叶 Mn 922.3±16.8 357.5±33.7 1 116.5±2.8 Pb 10.3±0.1 1.3±0.1 163.4±9.8 Zn 295.7±20.2 237.5±6.5 234.6±0.6 Cu 27.0±1.5 7.4±0.4 16.9±0.3 Cd 0.55±0.13 0.61±0.04 0.81±0.03 表 5 各处理基质中重金属占比
Table 5. Distribution of heavy metal of each substrate
重金属 处理组 重金属占比/% 基质留存量 植物吸收量 径流流失量 Mn CK 77.216±1.50c — 22.784±1.50a S0 79.686±0.50b — 20.314±0.50b S1 93.608±0.60a 0.004±0.00 16.495±0.59c Pb CK 78.213±1.01b — 21.786±1.01a S0 76.589±0.40b — 23.411±0.40a S1 89.691±1.62a 0.001±0.00 10.308±1.62b Zn CK 76.586±1.02c — 23.414±1.02a S0 79.814±0.69b — 20.186±0.69b S1 89.487±0.73a 0.003±0.00 10.510±0.73c Cu CK 93.503±1.35a — 6.497±1.35a S0 92.324±1.76a — 7.676±1.76a S1 92.809±1.93a 0.006±0.00 7.394±1.93a Cd CK 88.949±3.05a — 11.051±3.05b S0 76.331±0.60b — 23.669±0.60a S1 85.372±2.07a 0.026±0.00 14.625±2.07b 注:同列不同字母表示不同处理下该种重金属总量显著差异(P<0.05);利用实验前、后各基质中Mn、Pb、Zn、Cu和Cd的含量和基质容重分别求得实验前、后重金属的总量,相减得到各装置中损失的重金属的量(主要包括植物吸收量和径流流失量),实验后装置中重金属总量记为基质留存量。S1处理中栾树对不同重金属的吸收总量由根、茎、叶各部分的干重及其重金属含量求得,径流流失量(重金属随表流和潜流雨水的流失总量)利用实验前基质重金属总量减去植物吸收量和基质留存量求得,所有数据均利用百分比进行归一化处理。 表 6 土壤微生物群落α多样性指数
Table 6. α diversity index of soil bacterial community
微生物 处理组 chao1指数 goods_coverage指数 observed_species指数 Simpson指数 细菌 CK 3 890.44±561.08b 0.982 0±0.002 4a 2 860.30±468.34b 0.967±0.034 8a S0 6 353.55±458.40a 0.969 9±0.002 4b 4 816.40±387.44a 0.995±0.000 2a S1 6 845.26±372.30a 0.966 7±0.001 2b 5 057.53±486.56a 0.995±0.000 8a 真菌 CK 380.34±30.25b 0.999 39±0.000 22a 338.30±41.05a 0.88±0.06a S0 326.59±59.23b 0.998 84±0.000 23b 224.27±39.14b 0.67±0.12b S1 477.47±31.41a 0.99859±0.000 01b 392.03±37.15a 0.77±0.07a -
[1] 任辉, 刘敏, 王自国, 等. 我国锰矿资源及产业链安全保障问题研究[J]. 中国工程科学, 2022, 24(3): 20-28. [2] 张雅静. 中国锰矿行业安全环保新政下优劣势分析与发展路径研究[J]. 中国锰业, 2022, 40(6): 21-25. [3] WANG J, CHENG Q, XUE S, et al. Pollution characteristics of surface runoff under different restoration types in manganese tailing wasteland[J]. Environmental Science and Pollution Research, 2018, 25: 9998-10005. doi: 10.1007/s11356-018-1338-2 [4] LI Z, MA Z, KUIJP T J V D, et al. A review of soil heavy metal pollution from mines in China: Pollution and health risk assessment[J]. Science of the Total Environment, 2014, 468-469: 843-853. doi: 10.1016/j.scitotenv.2013.08.090 [5] 王庆仁, 崔岩山, 董艺婷. 植物修复-重金属污染土壤整治有效途径[J]. 生态学报, 2001, 21(2): 326-331. doi: 10.3321/j.issn:1000-0933.2001.02.024 [6] CHANEY R L, LI Y M, BROWN S L, et al. Improving metal hyperaccumulator wild plants to develop commercial phytoextraction systems: approaches and progress[J]. Phytoremediation of Contaminated Soil and Water. CRC Press, 1999: 129-158. [7] 张慧智, 刘云国, 黄宝荣, 等. 锰矿尾渣污染土壤上植物受重金属污染状况调查[J]. 生态学杂志, 2004, 23(1): 111-113. [8] 李有志, 罗佳, 张灿明, 等. 湘潭锰矿区植物资源调查及超富集植物筛选[J]. 生态学杂志, 2012, 31(1): 16-22. [9] 李礼, 刘灿, 徐龙君. 重庆秀山锰矿废弃地优势种植物调查分析[J]. 湖南生态科学学报, 2017, 4(3): 19-25. doi: 10.3969/j.issn.2095-7300.2017.03-019 [10] 何蔚. 锰矿渣基质改良下木本植物修复效果研究[D]. 长沙: 中南林业科技大学, 2018. [11] 潘淑桢, 唐敏, 谭欣蕊, 等. 2种常见园林灌木对Zn的富集及耐性机制研究[J]. 环境科学与技术, 2022, 45(4): 154-163. [12] 商侃侃, 张国威, 蒋云. 54种木本植物对土壤Cu、Pb、Zn的提取能力[J]. 生态学杂志, 2019, 38(12): 3723-3730. doi: 10.13292/j.1000-4890.201912.006 [13] 周连碧. 铜尾矿废弃地重金属污染特征与生态修复研究[D]. 北京: 中国矿业大学(北京), 2012. [14] LI M S. Ecological restoration of mineland with particular reference to the metalliferous mine wasteland in China: A review of research and practice[J]. Science of the Total Environment, 2006, 357(1): 38-53. [15] 何蔚, 陈永华, 梁希, 等. 改良锰矿渣中木本植物筛选及锰的亚细胞分布和化学形态[J]. 环境工程, 2018, 36(9): 154-160. [16] ZHANG M Y, CHEN Y H, DU L, et al. The potential of Paulownia fortunei seedlings for the phytoremediation of manganese slag amended with spent mushroom compost[J]. Ecotoxicology and Environmental Safety, 2020, 196: 110538. doi: 10.1016/j.ecoenv.2020.110538 [17] TANG C F, CHEN Y H, ZHANG Q N, et al. Effects of peat on plant growth and lead and zinc phytostabilization from lead-zinc mine tailing in southern China: Screening plant species resisting and accumulating metals[J]. Ecotoxicology and Environmental Safety, 2019, 176: 42-49. doi: 10.1016/j.ecoenv.2019.03.078 [18] 谢天志, 陈永华, 苏荣葵, 等. 改良铅锌矿渣对栾树幼苗铅锌富集与耐性机制[J]. 环境科学, 2022, 43(10): 4687-4696. [19] HENAO S-G, GHNEIM-HERRERA T. Heavy metals in soils and the remediation potential of bacteria associated with the plant microbiome[J]. Frontiers in Environmental Science, 2021, 9: 604216. doi: 10.3389/fenvs.2021.604216 [20] YIN K, WANG Q, LV M, et al. Microorganism remediation strategies towards heavy metals[J]. Chemical Engineering Journal, 2019, 360: 1553-1563. doi: 10.1016/j.cej.2018.10.226 [21] ABDU N, ABDULLAHI A A, ABDULKADIR A. Heavy metals and soil microbes[J]. Environmental chemistry letters, 2017, 15: 65-84. doi: 10.1007/s10311-016-0587-x [22] 关松荫, 张德生, 张志明, 等. 土壤酶及其研究法[M]. 北京: 中国农业出版社, 1986. [23] SWATHI A T, RAKESH M, PREMSAI S B, et al. Chronic N -amended soils exhibit an altered bacterial community structure in harvard forest, Ma, Usa[J]. FEMS Microbiology Ecology, 2013, 83(2): 478-493. doi: 10.1111/1574-6941.12009 [24] 周柳婷, 李建鹃, 赵艳琳, 等. 基于高通量测序的连栽木麻黄根际土壤细菌群落变化研究[J]. 生态学报, 2020, 40(8): 2670-2679. [25] 宋秀丽, 黄瑞龙, 柯彩杰, 等. 不同种植方式对连作土壤细菌群落结构和多样性的影响[J]. 生态环境学报, 2022, 31(3): 487-496. [26] 欧阳林男. 锰矿污染区植物群落模式修复效应研究[D]. 长沙: 中南林业科技大学, 2017 [27] HAN J, XU Y, LIANG X, et al. Sorption stability and mechanism exploration of palygorskite as immobilization agent for Cd in polluted soil[J]. Water, Air and Soil Pollution, 2014, 225(10): 1-13. [28] 吴瑾. 锰矿渣的改良剂筛选与改良效果研究[D]. 长沙: 中南林业科技大学, 2019 [29] 解雪峰, 濮励杰, 朱明, 等. 基于MDS与TOPSIS模型的滨海滩涂围垦区土壤质量评价[J]. 环境科学, 2019, 40(12): 5484-5492. [30] 陶玲, 马奔, 李中兴, 等. 污泥-凹凸棒石共热解生物炭对矿区重金属污染土壤的钝化修复效果研究[J]. 农业环境科学学报, 2022, 41(6): 1251-1260. [31] XU C, QI J, YANG W, et al. Immobilization of heavy metals in vegetable-growing soils using nano zero-valent iron modified attapulgite clay[J]. Science of the Total Environment, 2019, 686: 476-483. doi: 10.1016/j.scitotenv.2019.05.330 [32] 欧阳林男, 吴晓芙, 李芸, 等. 锰矿修复区泡桐与栾树生长与重金属积累特性[J]. 中国环境科学, 2016, 36(3): 908-916. [33] 林淑芬, 李辉信, 胡锋. 蚓粪对黑麦草吸收污染土壤重金属铜的影响[J]. 土壤学报, 2006, 43(6): 911-918. [34] MUTHANNA T M, VIKLANDER M, GJESDAHL N, et al. Heavy metal removal in cold climate bioretention[J]. Water, Air, and Soil Pollution, 2007, 183(1): 391-402. [35] NAIDU R, BOLAN N S, KOOKANA R S, et al. Ionic‐strength and pH effects on the sorption of cadmium and the surface charge of soils[J]. European journal of soil science, 1994, 45(4): 419-429. doi: 10.1111/j.1365-2389.1994.tb00527.x [36] YUANPENG W, JIYAN S, HUI W, et al. The influence of soil heavy metals pollution on soil microbial biomass, enzyme activity, and community composition near a copper smelter.[J]. Ecotoxicology and Environmental Safety, 2007, 67(1): 75-81. doi: 10.1016/j.ecoenv.2006.03.007 [37] KANDELER F, KAMPICHLER C, HORAK O. Influence of heavy metals on the functional diversity of soil microbial communities[J]. Biology and Fertility of Soils, 1996, 23(3): 299-306. doi: 10.1007/BF00335958 [38] 张秀, 尚艺婕, 王海波, 等. 重金属污染条件下生物质炭对土壤微生物群落结构及多样性影响的研究进展[J]. 中国农学通报, 2016, 32(25): 147-152. doi: 10.11924/j.issn.1000-6850.casb16010082 [39] BOUSKILL N J, BARKER-FINKEL J, GALLOWAY T S, et al. Temporal bacterial diversity associated with metal-contaminated river sediments[J]. Ecotoxicology, 2010, 19: 317-328. doi: 10.1007/s10646-009-0414-2 [40] MARCIN G, EDYTA D, MARCIN C, et al. 16S rDNA pyrosequencing analysis of bacterial community in heavy metals polluted soils.[J]. Microbial Ecology, 2014, 67(3): 635-647. doi: 10.1007/s00248-013-0344-7 [41] SHEN C, XIONG J, ZHANG H, et al. Soil pH drives the spatial distribution of bacterial communities along elevation on Changbai Mountain[J]. Soil Biology and Biochemistry, 2013, 57: 204-211. doi: 10.1016/j.soilbio.2012.07.013 [42] BARNS S M, CAIN E C, Sommerville L, et al. Acidobacteria phylum sequences in uranium-contaminated subsurface sediments greatly expand the known diversity within the phylum[J]. Applied & Environmental Microbiology, 2007, 73(9): 3113-3116. [43] 陈丹梅, 段玉琪, 杨宇虹, 等. 轮作模式对植烟土壤酶活性及真菌群落的影响[J]. 生态学报, 2016, 36(8): 2373-2381. [44] FREY S D, KNORR M, PARRENT J L, et al. Chronic nitrogen enrichment affects the structure and function of the soil microbial community in temperate hardwood and pine forests[J]. Forest Ecology and Management, 2004, 196(1): 159-171. doi: 10.1016/j.foreco.2004.03.018 [45] 葛勉慎, 周海宾, 沈玉君, 等. 添加剂对牛粪堆肥不同阶段真菌群落演替的影响[J]. 中国环境科学, 2019, 39(12): 5173-5181. doi: 10.19674/j.cnki.issn1000-6923.2019.0601 [46] 徐一兰, 唐海明, 李益锋, 等. 长期施肥大麦生育期双季稻田土壤微生物和酶活性动态变化特征[J]. 中国农学通报, 2017, 33(13): 12-20. [47] 张薇, 魏海雷, 高洪文, 等. 土壤微生物多样性及其环境影响因子研究进展[J]. 生态学杂志, 2005, 24(1): 48-52. doi: 10.13292/j.1000-4890.2005.0208 -




 DownLoad:
DownLoad: