-
随着畜禽养殖数量的激增,畜禽养殖场对抗生素的需求大幅增加。VAN BOECKEL等[1]调查发现大量抗生素在畜牧行业中被使用,比例约为73%。2013年,我国畜牧行业共使用了162 000 t抗生素。其中,84 240 t用于动物饲养活动。然而,抗生素进入动物体内后只能少部分吸收代谢,仍有大量抗生素通过排泄物进入环境中。通过长期的积累与环境选择性压力的不断诱导,畜禽养殖场中会产生大量抗生素抗性基因 (ARGs) 及耐药性细菌 (ARB,antibiotic resistance bacteria) [2],导致养殖场成为了ARGs携带菌的热点场所。
猪粪和鸡粪中均存在大量的ARGs产生和传播[3-5],而粪便中的ARGs还可通过气溶胶化进入空气中[6]。空气中的微生物气溶胶和细颗粒物是携带ARGs的耐药菌从牲畜向人类传播的主要途径之一[7-8]。一旦空气中携带ARGs的致病菌被人体吸入,将对人群健康产生影响。ARGs可通过包括质粒、整合子、转座子和噬菌体在内的可移动遗传元件 (mobile genetic elements,MGEs) 在同种属或不同种属之间进行水平转移 (horizontal gene transfer,HGT) ,并且可能转移到致病菌 (如肺炎链球菌、金黄色葡萄球菌和铜绿假单胞菌) 中,进而严重威胁人群健康[9]。因此,HGT可能会对整体抗性情况产生深远影响。ARGs可通过生物气溶胶进入环境中并进行远距离传播[10]。荷兰科学家研究发现,来自养殖场的ARB可能导致周围半径3 km内的居民暴露[11]。目前,ARGs在地表水和土壤2种常见介质中的传播已被充分研究[10, 12-13],而极少有研究关注畜禽养殖场空气中的ARGs分布特征。
本课题组选取陕西省渭南市规模化养殖的养鸡场和养猪场为研究对象,探究畜禽养殖场中气载ARGs的分布情况、不同类型 (鸡场和猪场) 的养殖场中气载ARGs的污染特征、养殖场中气载ARGs的季节性 (冬季和夏季) 变化,从而分析养殖场中气载ARGs与环境因素的相关性,以期为控制我国畜禽养殖场中气载ARGs污染的传播与防控提供参考,为空气环境生态风险评估提供依据。
-
选取陕西省渭南市猪场和鸡场为研究对象。这2个养殖场采用集约化养殖方式,均未设置机械净化系统。样品信息如表1所示。在夏季养殖场内通过工业风扇通风,在冬季采用加热设备调节温度。鸡舍的占地面积为20 m×11 m,高3 m;猪舍的占地面积为26 m×7 m,高3 m。
养殖场内空气样品使用中流量采样器 (TH-150F,武汉天虹仪器有限公司) 。采样流量为100 L·min−1,采集时间为6 h,采样器距离地面1.5 m。玻璃纤维滤膜经121 ℃灭菌20 min。鸡舍内每天进行2~3次机械清粪,猪舍每天2次人工清粪。在鸡舍和猪舍内通过四点采样法采集未经任何处理的新鲜的鸡粪和猪粪,在鸡舍或猪舍内随机布置4个采样点,采样后迅速搅拌混匀作为均一样本。分别在冬季 (2月) 和夏季 (8月) 对养猪场和养鸡场的空气和粪便连续采样3 d,将测得的平行样本数据取平均值进行分析。在采样同时,使用温湿度计监测养殖厂内的温度和湿度,使用风速仪监测风速。PM2.5使用重量法进行测定。
-
使用FastDNA® Spin Kit for Soil 试剂盒( MP Biomedicals,美国)提取DNA。将含有气体样品的玻璃纤维滤膜的1/8剪碎并进行超声处理,以保证最佳提取效率[14]。称取粪便样本 (约0.5 g) 添加到试剂盒中的 Lysing Matrix E tube,按照生产商提供的方法提取DNA。使用紫外-可见分光光度计 (Q5000; Quawell, USA) 测定DNA浓度。将提取的DNA样品置于−20 ℃冰箱保存。
-
本实验采用Wafergen SmartChip Real-time PCR系统进行HT-qPCR (High Throughput-qPCR) 。共使用296种引物对提取的DNA进行扩增,这些引物包括283个ARGs引物,12个MGEs引物和16S rRNA引物[15]。每种引物包括1个阴性对照。HT-qPCR反应条件为:95 ℃预变性10 min;95 ℃变性30 s,60 ℃退火30 s,共进行40个循环[16]。熔解曲线由Wafergen软件自动生成。
-
HT-qPCR的基因拷贝数 (gene copies number,后文缩写为GCN) 的计算方法参照Looft等[17]的方法,用公式 (1) 进行计算.
式中:CT为HT-qPCR数据,31为样品检测限。 HT-qPCR数据采用Excel 2019与SPSS 27进行计算与分析,并采用Origin 2023制图。
-
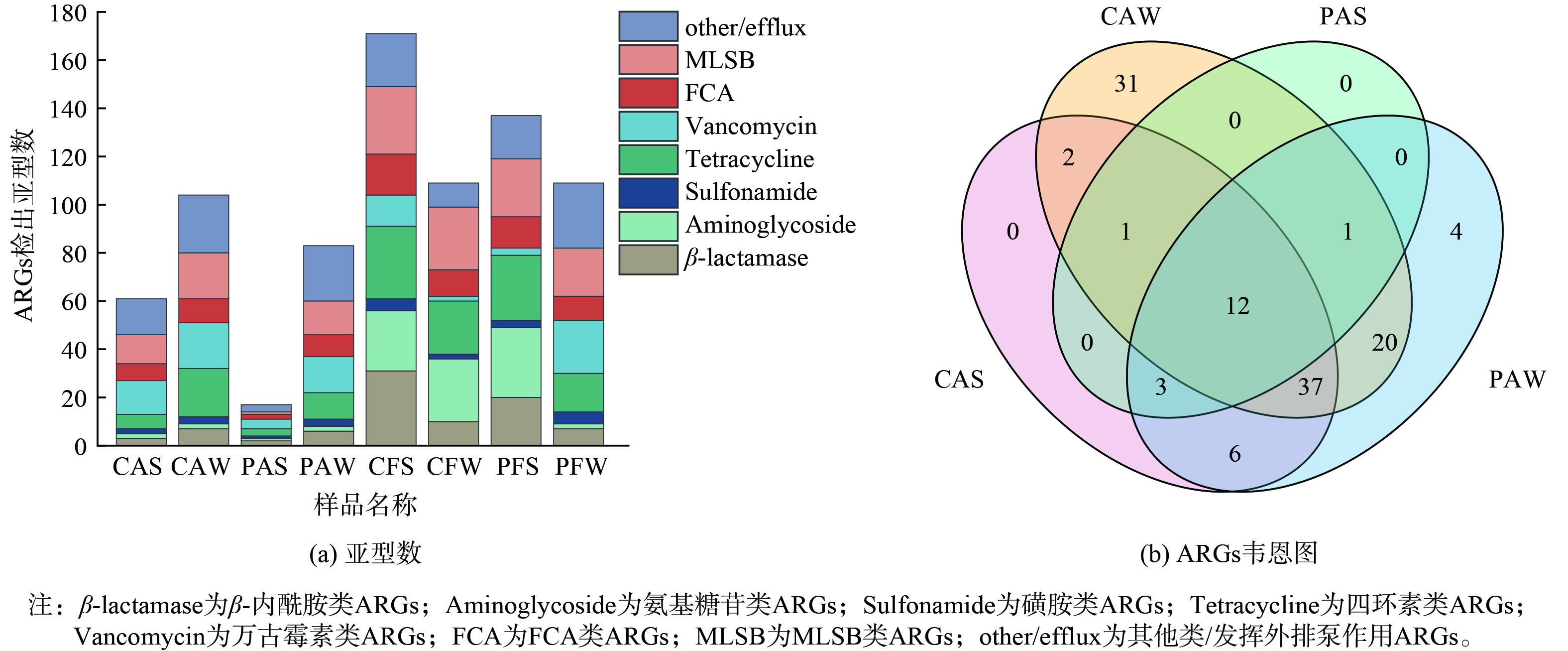
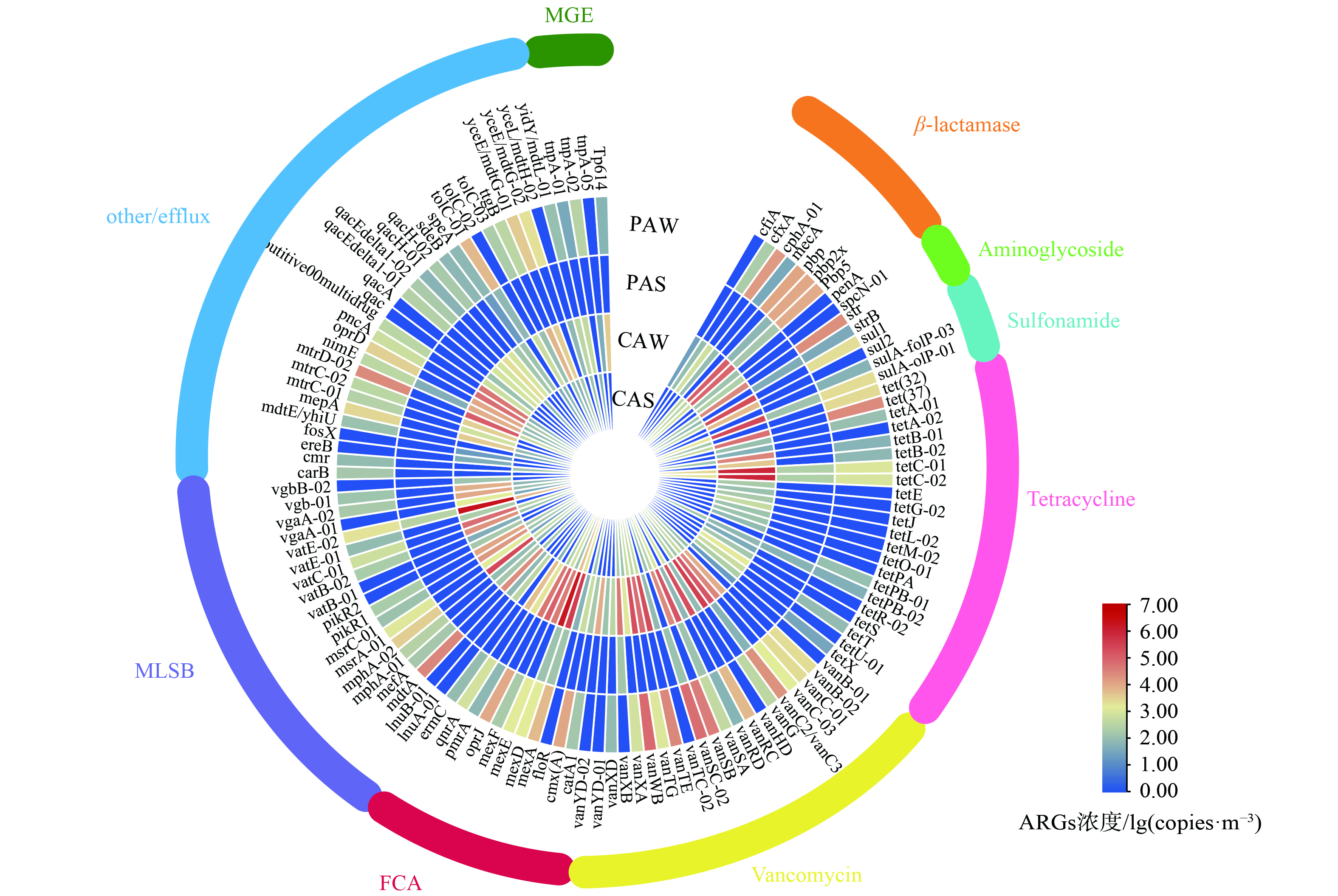
使用HT-qPCR对畜禽养殖场空气及粪便样品中的283种ARGs进行检测。将ARGs根据耐抗生素的类型分为8类:β-内酰胺类ARGs (β-lactamase) 52个;氨基糖苷类ARGs (Aminoglycoside) 36个;磺胺类ARGs (Sulfonamide) 7个;四环素类ARGs (Tetracycline) 39个;万古霉素类ARGs (Vancomycin) 32个、氟喹诺酮类-氯霉素类-胺酰醇类ARGs (FCA) 24个;大环内酯类-林肯酰胺类-链阳性菌素B类ARGs (MLSB) 44个;其他类/发挥外排泵作用ARGs (other/efflux) 49个。通过分析畜禽养殖场环境中检出ARGs亚型数发现四环素类抗性基因、万古霉素类抗性基因和MLSB类抗性基因是养殖场环境中的主要检出类型,分别占总检出类型的16.51%、14.33%、17.10% (图1 (a) )。此外,通过Venn图进一步分析了ARGs在畜禽养殖场空气中的相互关系 (图1 (b) ) ,结果表明有12种ARGs在所有空气样品中均有检出,其中主要的是四环素类抗性基因。这可能是由于四环素为广谱抗生素,且价格低廉,被广泛应用于养殖行业中[18]。
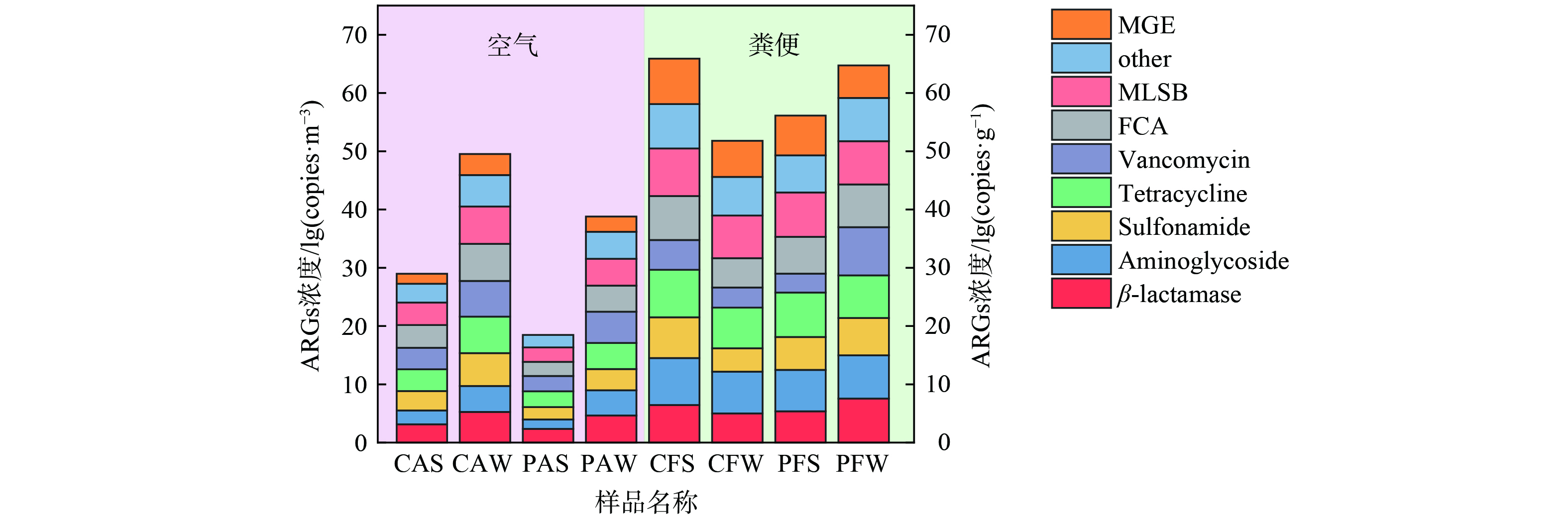
图2展示了所有样品中每种ARGs的浓度。在畜禽养殖场空气样品中的每种ARGs浓度可达到103~106 copies·m−³,在粪便样品中浓度可达到107~108 copies·g−1,空气中的ARGs浓度以万古霉素类、MLSB类、四环素类、FCA类ARGs为主,分别占总浓度的 (25.88%±17.52%) (5.28×102~1.85×106 copies·m−3) 、 (19.06%±8.88%) (2.59×102~2.24×106 copies·m−3) 、 (17.64%±8.06%) (1.32×102~4.25×105 copies·m−3) 、 (17.50%±9.73%) (4.23×102~1.35×106 copies·m−3) 。粪便中的ARGs浓度以四环素类、MLSB类和氨基糖苷类ARGs为主,分别占总浓度的 (22.12%±13.93%) (9.46×106~1.38×108 copies·g−1)、 (28.40%±15.22%) (2.14×107~1.44×108 copies·g−1)、 (17.28%±9.63%) (1.26×107~1.18×108 copies·g−1) 。畜禽养殖场内的动物粪便是养殖场内空气中微生物的主要来源[19],由于不同的ARGs的潜在宿主菌存在差异[20],而不同种类ARB的气溶胶化能力亦有差别,故空气样品中的主要ARGs种类与粪便样品中的亦存在差异。
-
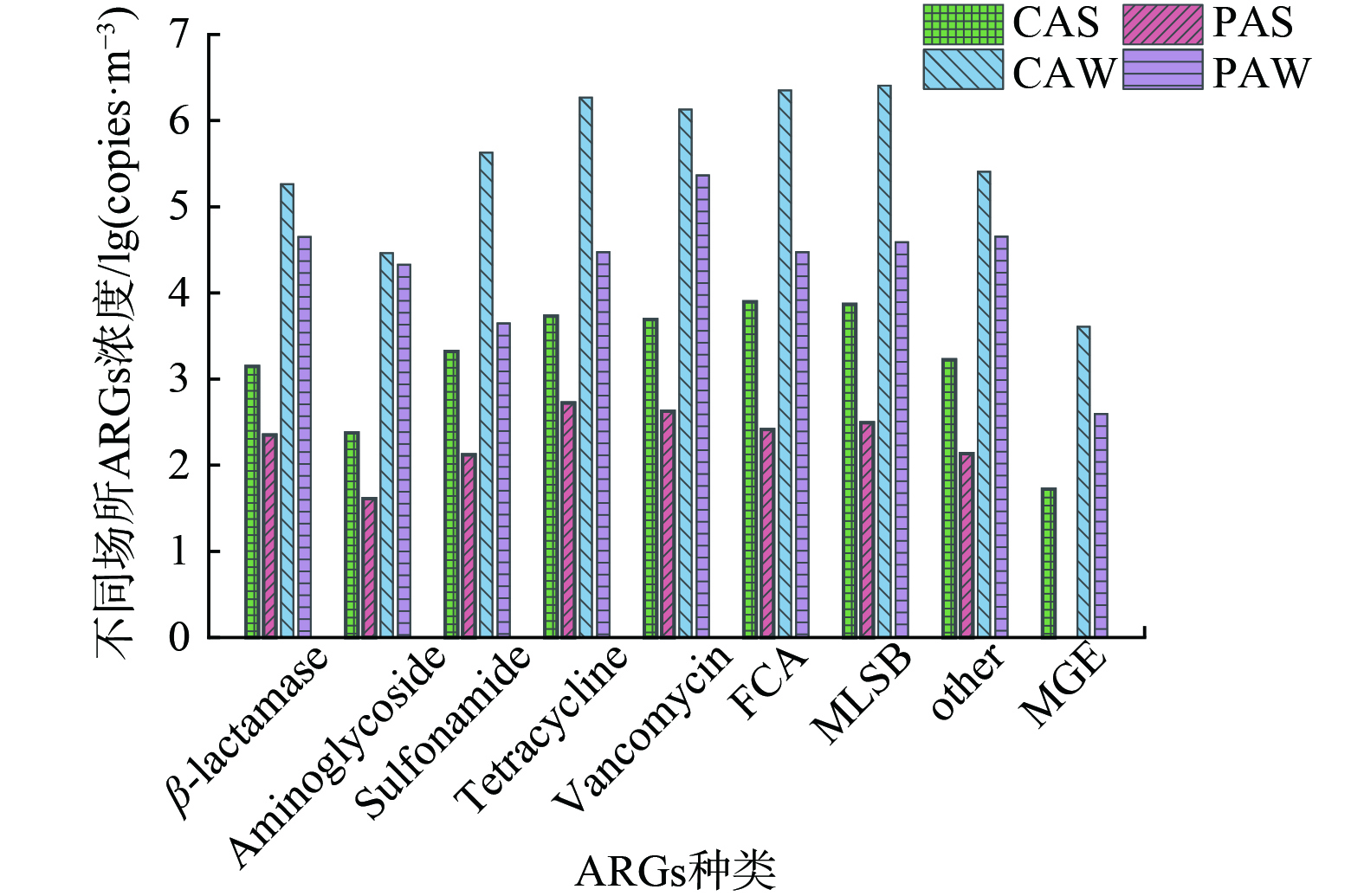
分析养鸡场和养猪场ARGs种类和各亚型浓度分别如图3和图4所示。结果表明,不同养殖场中气载ARGs的污染特征存在差异,气载ARGs的平均浓度趋势为:养鸡场>养猪场。在检出亚型方面,养鸡场总检出亚型数比猪场多33种。养鸡场空气样品中总体浓度比养猪场高约1个数量级。其中,FCA类、MLSB类、磺胺类抗性基因在养鸡场空气中的平均浓度为1.12×106 copies·m−3、1.27×106 copies·m−3、2.13×105 copies·m−3,比养猪场 (1.51×104 copies·m−3、1.96×104 copies·m−3、2.29×103 copies·m−3) 高约2个数量级。因此养鸡场中ARGs对环境产生威胁的可能性更大。
值得注意的是,在猪场和鸡场检出的万古霉素类抗性基因、β-内酰胺类抗性基因、氨基糖苷类抗性基因浓度均相近。其中,万古霉素类抗性基因的浓度高达105 copies·m−3,万古霉素 (C66H75Cl2N9O24) 属于糖肽类抗生素,万古霉素类抗性基因的高浓度检出暗示养殖场环境中存在较高的生态健康风险及人体健康暴露风险。因此,应加强对畜禽养殖行业相关糖肽类抗生素的添加及使用管理,以控制畜禽养殖场内空气环境中相关ARGs的污染情况。
-
通过分析畜禽养殖场中冬季和夏季ARGs种类(图4)和亚型(图5),结果发现冬季空气样品中各ARGs种类及亚型的检出数量及平均浓度均显著高于夏季空气样品。其中,冬季畜禽养殖场中的空气样品检出的亚型数比夏季空气样本多55种。冬季样品中的四环素类、万古霉素类、MLSB类抗性基因分别比夏季空气样本多11种、8种、10种,而氨基糖苷类和磺胺类ARGs在夏季于冬季空气样本中检出亚型数几乎相同。这说明四环素类和MLSB类抗性基因的检出类型受季节影响较大。通过对比冬季和夏季空气样本中ARGs的浓度发现冬季样本中的总ARGs浓度 (4.67×106 copies·m−3) 高于夏季 (1.65×104 copies·m−3) 约2个数量级,且每种ARGs在冬季均高于夏季2~3个数量级。
在冬季,为了保持畜禽养殖场内的温度而减少通风,因此使得室内空气中的ARGs不断富集;而在夏季,养殖场内通常使用机械通风等方式进行降温,养殖场内空气流动性高于冬季,这可能导致了气载ARGs的稀释。其次,冬季畜禽养殖场中PM2.5的平均质量浓度为513.3 μg·m−3,夏季为105.68 μg·m−3,存在较大差异。又由于PM2.5可作为细菌和ARGs的载体[21],故可能会对ARGs的检出类型和浓度产生影响。另一方面,耐药细菌作为ARGs的宿主也会受到季节性变化的影响,冬季气溶胶中具有抗生素耐药性的细菌数量远多于夏季[22],进而影响到ARGs的种类和浓度。这亦证明了畜禽养殖场气溶胶中ARGs对人群健康的危害不应被忽视。
-
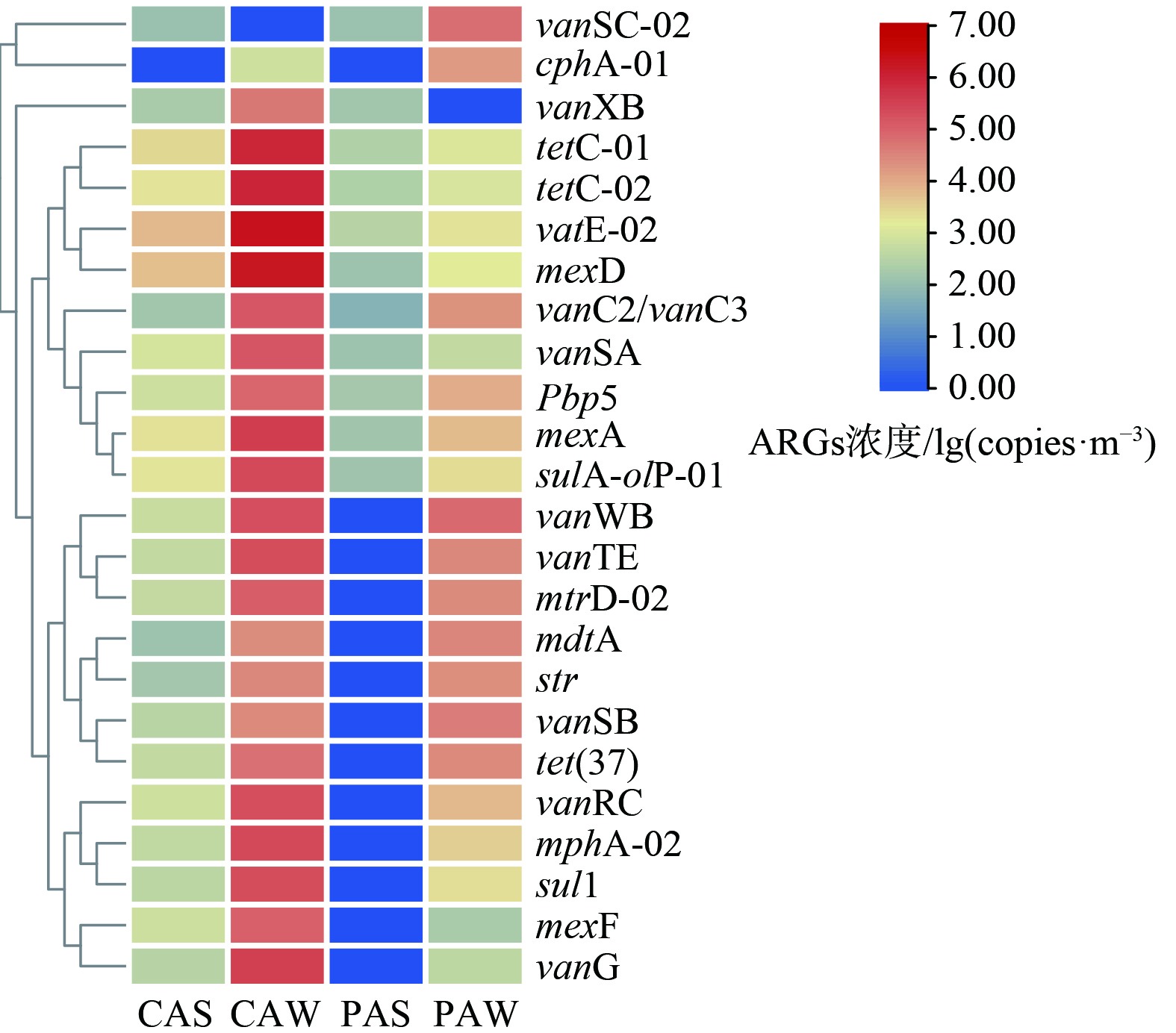
畜禽养殖场采集样品的环境监测数据如表2所示,冬季和夏季的温度与PM2.5相差较大,而湿度和风速相差不大。图6展示了代表性ARGs亚型浓度、总MGE浓度、总ARGs浓度以及环境因子的Pearson相关性。选取每个样品中的Top10 ARGs亚型,且为了避免偶然性,选取在每个样品中均有检出的ARGs作为代表性ARGs亚型。图6表明,总ARGs及多种ARGs亚型与PM2.5呈显著相关关系,与温度呈正相关,与其他环境因素几乎没有相关性。这表明PM2.5可能是影响畜禽养殖场中气载ARGs的重要因素。Pbp5、mexA与总MGEs浓度具有显著相关性 (p<0.05) 。这表明这些ARGs亚型在畜禽养殖场空气环境中通过MGEs的水平转移可能性较大。Pbp5、VanC2/VanC3与总ARGs具有显著相关性,故这2种ARGs可作为养鸡场和养猪场中检测气载ARGs的指示型ARGs (表3) 。然而,由于一些清粪频率、抗生素或其他药物的的投加量等人为行为及粪便中微生物的气溶胶化水平、养殖场动物呼出气中微生物群落特征等生物物理过程均可能会引起畜禽养殖场中气载ARGs的产生、传播和转移的改变,因此应对各种因素间的互作关系展开进一步研究。
-
1) 鸡场中的气载ARGs亚型数比猪场多33种,其中主要为MLSB、Vancomycin类ARGs;在畜禽养殖场中,冬季气载ARGs的亚型数比夏季多55种其中主要为Tetracycline类ARGs。
2) 鸡场中的气载ARGs浓度均高于猪场,尤其是鸡场中FCA及MLSB类ARGs的浓度高于猪场约2个数量级;在畜禽养殖场中,冬季气载ARGs的浓度均高于夏季约2~3个数量级。
3) PM2.5与畜禽养殖场中气载ARGs浓度呈显著正相关,Pbp5、VanC2/VanC3可以作为长期监测畜禽养殖场中气载ARGs的指示型ARGs。
不同畜禽养殖场中气载抗生素抗性基因的污染特征与季节性变化
Pollution characteristics and seasonal variation of airborne antibiotic resistance genes in different livestock farms
-
摘要: 由于大量的抗生素被用于畜禽养殖行业,畜禽养殖场中的抗生素抗性基因 (ARGs,Antibiotic resistance genes) 问题正逐渐变得严重。为调查畜禽养殖场中气载ARGs的污染特征及季节性变化,分别在冬季和夏季采集陕西省渭南市养猪场和养鸡场的空气和粪便样品,分析不同种类气载ARGs的污染水平及ARGs与环境因子的相关性。结果表明:畜禽养殖场空气中主要检出的ARGs类型为万古霉素类抗性基因、MLSB类抗性基因、四环素类抗性基因、FCA类抗性基因;在不同类型养殖场中气载ARGs总浓度趋势为养鸡场>养猪场,且养鸡场中每种ARGs浓度比养猪场中高约2个数量级;在不同季节养殖场中,气载ARGs总浓度趋势为冬季>夏季,且每种ARGs在冬季均高于夏季2~3个数量级。Pearson相关性分析结果表明,养殖场中气载ARGs总浓度与PM2.5呈显著相关 (P<0.05) ,与其他环境因子无显著相关性。本研究成果可为控制畜禽养殖场中气载ARGs污染的传播及防控提供参考。Abstract: In recent years, antibiotic resistance genes (ARGs) in livestock farms have attracted widespread attention due to the massive use of antibiotics. In this study, in order to investigate the pollution characteristics and seasonal changes of airborne ARGs in livestock farms, air and fecal samples were collected from pig farms and chicken farms in Weinan, Shaanxi Province in winter and summer, respectively. The pollution levels of airborne ARGs and the correlation between ARGs and environmental factors in all samples were analyzed. The results showed that the main types of airborne ARGs detected in livestock farms were vancomycin resistance genes, MLSB resistance genes, tetracycline resistance genes and FCA resistance genes. The total concentration of airborne ARGs in different types of farms was higher in chicken farms than in pig farms, and the concentration of ARGs in chicken farms was about 2 orders of magnitude higher than that in pig farms. The total concentration trend of airborne ARGs in different seasons was: winter > summer, and the concentration of ARGs in winter was 2~3 orders of magnitude higher than that in summer. In addition, pearson correlation analysis showed that the total concentration of ARGs in air was positive correlated with PM2.5 (P<0.05), but had no significant correlation with other environmental factors.
-
随着城市化进程的加快,城市绿化也因其在提高城市环境质量、维持城市生态平衡等方面的重要作用得以迅速发展。我国城市园林绿化产生的落叶、剪草、枯枝等绿色废弃物,年产量已增加到3.5×108 t左右[1]。堆肥化处理由于可以将废弃物转化为对植物生长和土壤改良有促进效果的堆肥产品,已成为高效处理并实现废弃物再利用的重要途径。绿化废弃物含有丰富的有机物质,这一特点使其腐熟后更容易获得高养分的肥料;但另一方面,绿化废弃物中大量结构紧密的木质纤维素成分使他们不易被微生物分解[2],而且处理不当会造成腐熟缓慢,产生气味污染以及堆肥产品降解不完全等问题。
由于堆肥是以微生物为主导的有机废弃物降解过程,因此,可以通过添加微生物菌剂来加快木质纤维素降解。杭怡琼等[3]研究发现,白腐真菌能够有效且有选择性地降解植物纤维原料中的木质素。黄丹莲[4]发现,木霉菌等真菌不仅能分泌胞外酶,还可以利用菌丝穿插破坏纤维素结构,实现对纤维素的高效分解。此外,纤维素酶作为一种可以促进木质纤维素糖化的酶制剂,在动物饲料和纸浆生产等领域已被广泛应用[5-6]并显示出良好的降解效果,但是在堆肥领域却鲜有关于纤维素酶的应用研究。同时,有研究[2,7-9]表明,适宜的粒径可以提高堆肥期间的微生物活性,从而加快大分子物质的降解速度。过大的粒径会导致通风过度,热量散失;过小的粒径会使持水量过高,通氧量不足,这些都不利于微生物进行代谢活动。已有研究[10]提出的最佳堆肥粒径为5~30 mm,没有统一的标准;而且大部分研究[11-12]缺少对微生物指标的分析或是采用传统的DGGE技术进行微生物检测,无法准确地反映粒径与微生物群落结构和堆肥腐熟效果的关系。因此,初始粒径对绿化废弃物堆肥的影响仍需进一步研究,这也影响着外源添加剂的作用效果。
本研究采用由白腐真菌和木霉菌组成的微生物菌剂,结合纤维素酶制成外源添加剂,进行不同粒径的绿化废弃物堆肥,通过分析堆肥的理化性质和细菌群落结构,探究不同初始粒径和外源添加剂对绿化废弃物堆肥腐熟度的促进效果,并提出最优参数组合,为提高绿化废弃物堆肥质量提供了参考。
1. 材料与方法
1.1 实验材料和仪器
实验材料:作为堆肥原材料的绿化废弃物主要来自于北京市城市景观维护过程中产生的枯枝落叶和修剪的枝条(多为柳树、槐树、杨树等),分别粉碎至2 mm和5 mm;微生物菌剂包括木霉菌和白腐真菌,推荐接种量(g/g)为3%~5%;纤维素酶的酶活为2×104 U·g−1;干羊粪用于调整原料的C/N至28左右;发芽实验选择白菜种子进行。供试材料和堆肥初始性质如表1所示。
表 1 供试原料基本性质Table 1. Basic properties of raw materials for compost供试材料 pH 有机碳/(g·kg−1) 全氮/(g·kg−1) 碳氮比 绿化废弃物 6.76 480.2 8.9 54 干羊粪 7.41 261.2 13.9 18.8 2 mm绿化废弃物堆肥 7.75 336.4 11.6 29 5 mm绿化废弃物堆肥 7.66 340.2 12.6 27 实验仪器:恒温培养箱(RXZ-500A,宁波江南仪器有限公司);精密pH/EC仪(MP522,上海精密科学仪器有限公司);TOC分析仪(TOC-5000A,日本岛津公司);紫外可见分光光度计(TU-1810DS,北京普析通用仪器有限责任公司)。
1.2 实验设计和取样
实验共有8个处理(T1~T8)(表2),设计2 mm和5 mm 2种粒径,纤维素酶和菌剂的接种量(g/g)分别设置为物料干质量的0、2%和0、2%、4%,按表2所示的比例混配后作为外源添加剂。所有处理重复3次。每个处理按设计参数混配1 000 g(干质量)混合物,放入塑料长方体(35 cm×22 cm×10 cm)发酵容器中,添加蒸馏水,将每个处理的水分含量统一调节至65%,最后将发酵容器密封,并置于恒温培养箱中,于50 ℃下发酵22 d。每3 d进行翻堆和补水,以保证每个容器中的堆肥有适宜的氧气和水分。堆肥结束后,于每个处理的顶部、中部和底部共取样200 g,混合均匀。一部分样品作风干处理用于有机碳、全氮、pH、电导率(EC)和腐殖指标的测定;剩余新鲜样品与去离子水按1∶10(g∶mL)混合,振荡2 h浸提后过滤,在25 ℃恒温的培养箱内培养白菜种子,放置48 h后,取出记录发芽种子个数和根长,计算发芽指数[13]。实验第2天、12天、22天,对T1~T8实验组取样进行细菌高通量分析,分别标注为T1D2~T8D2、T1D12~T8D12和T1D22~T8D22,代表初期堆肥、中期堆肥和末期堆肥。
表 2 实验因素水平设计Table 2. Standard parameters of composting处理组 粒径/mm 纤维素酶∶菌剂 T1 2 0∶0 T2 2 0∶4 T3 2 2∶2 T4 2 2∶4 T5 5 0∶0 T6 5 0∶4 T7 5 2∶2 T8 5 2∶4 1.3 检测和分析方法
有机碳、全氮、pH和EC值参照文献的方法[14]测定:有机碳采用外加热法测定;全氮采用凯氏定氮法测定;使用pH/EC仪测定pH和EC值。微生物指标参照MAO等[15]的方法测定,并在门水平注释其群落的物种信息。根据鲍士旦[16]的方法提取腐殖质和胡敏酸,提取液使用TOC分析仪分别测定得腐殖质和胡敏酸含量[17];腐殖质提取液采用紫外可见分光光度计测定吸光度比值(E4/E6)[14]。
腐殖质系数[12]按式(1)计算,发芽指数[18]按式(2)计算。
FHI=CHACT×100% (1) FGI=ST⋅LTSC⋅LC×100% (2) 式中:FHI为腐殖质系数;CHA为胡敏酸含量,g·kg−1,CT为总有机碳含量,g·kg−1;FGI为发芽指数;ST为处理组平均发芽数量;LT为处理组平均根长,mm;SC为对照组平均发芽数量;LC为对照组平均根长,mm。
使用CANOCO 5软件进行RDA分析,采用SPSS 23软件进行方差分析和主成分提取,依据参考文献的方法[19]进行主成分分析。
2. 结果与讨论
2.1 初始粒径和外源添加剂对碳氮比的影响
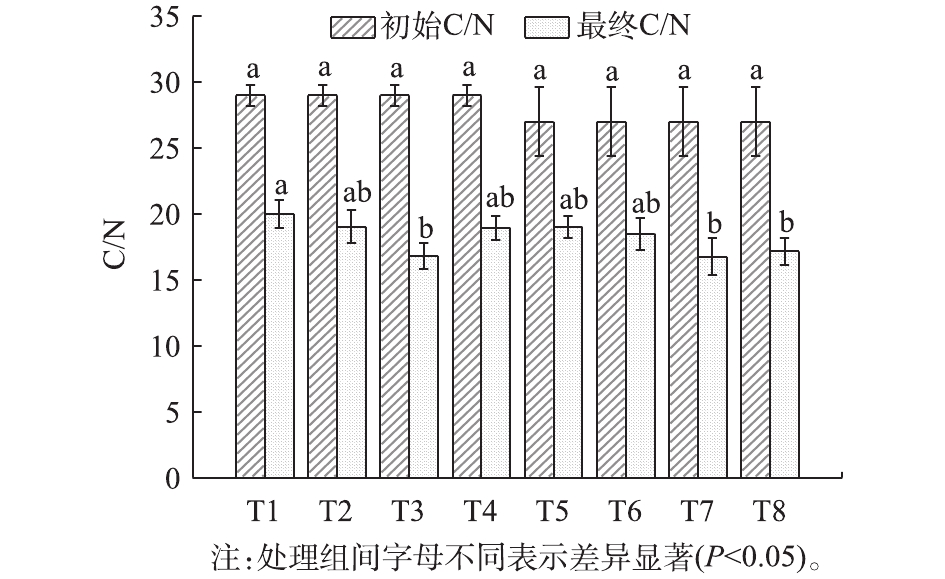
在堆肥过程中,微生物不断分解利用有机物质进行繁殖和代谢,作为其主要能量来源的碳素以远大于氮素的速度被消耗,C/N整体呈下降趋势,与堆肥产品的腐熟程度密切相关。由图1可知,堆肥结束后,除对照组T1外的所有处理C/N均低于20,满足腐熟要求[20]。各处理C/N降幅排序为T3>T7>T4>T2>T8>T1>T6>T5。2 mm粒径组平均降幅较5 mm处理组提高12.7%,说明2 mm粒径更有利于有机质降解活动的进行;同时,添加纤维素酶和菌剂的处理T3和T7在各自粒径组中降幅最大,这是因为菌剂可以直接扩大微生物数量;另外,纤维素酶可以有针对性地提高纤维素的水解效率,生成更利于被微生物分解的单糖[21],进而提高微生物活性,在二者共同作用下,对促进腐熟起到协同效果。
2.2 初始粒径和外源添加剂对pH和EC的影响
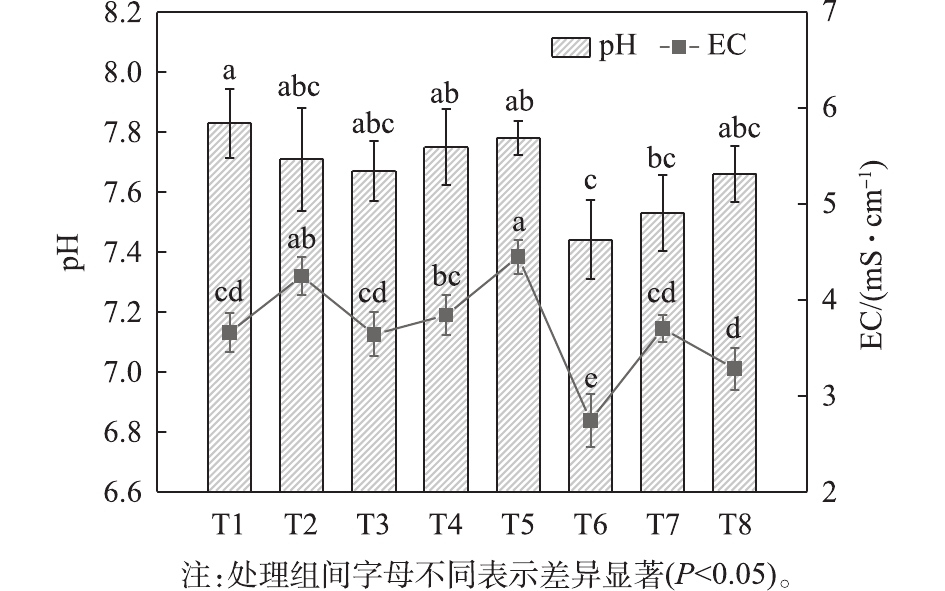
pH与堆肥微生物的活性关系密切。有研究[22-23]指出,pH为7~8.5时,堆肥常见微生物的活性和繁殖力最强。如图2所示,堆肥结束后,所有处理的pH都呈弱碱性,从大到小顺序为T1>T5>T4>T2>T3>T8>T7>T6,2种粒径组对照处理的pH均高于同组其他处理。这说明添加剂对降低pH有一定影响。原因是,当有机化合物被分解时,具有外源添加剂的处理可促使微生物生成有机酸[24]。从粒径对pH的影响来看,2 mm处理组pH更高。这可能是由于2 mm处理的绿化废弃物在堆肥过程中,有利于能促进有机酸分解的微生物的生长,从而影响了发酵环境酸碱度。
EC反映了堆肥产品中总盐的含量,可用作有机物分解动力学的判定指标[15]。在本研究中,堆肥末期各处理的EC值排序依次为T5>T2>T4>T7>T1>T3>T8>T6,2 mm粒径组的平均EC较5 mm粒径组高8.6%。这表明具有较小粒径的堆肥含有较多的盐和小分子物质[25]。这一结果可能是因为小粒径堆肥的较高比表面积增加了离子交换能力造成的[26]。
2.3 初始粒径和外源添加剂对发芽指数的影响
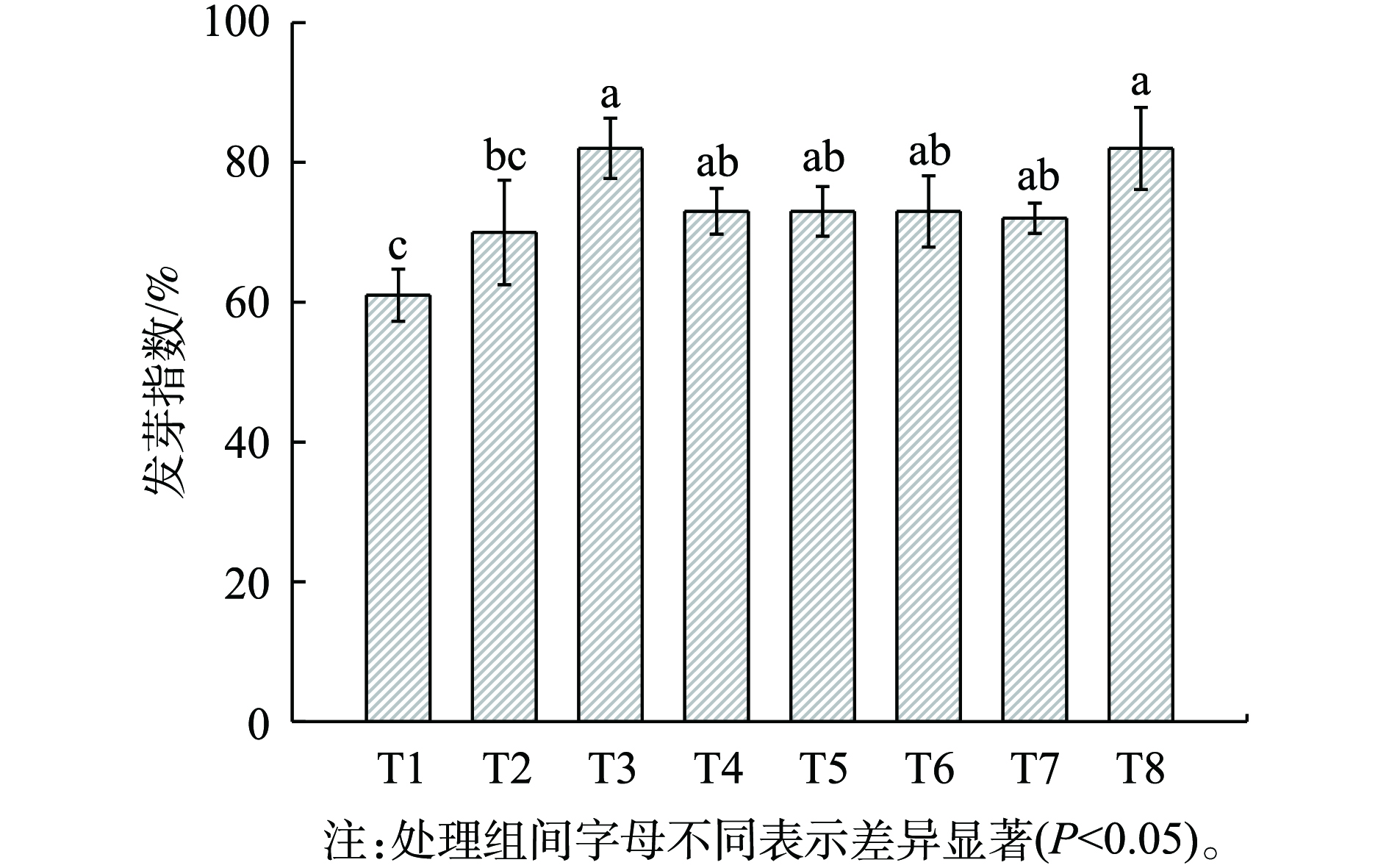
未腐熟堆肥中的毒性物质会抑制植物的生长,因此,堆肥浸提液对植物生长的影响可用于评价堆肥的植物毒性,用发芽指数[27](GI)表示。图3显示,GI值从大到小依次为T3>T8>T4>T6>T5>T7>T2>T1,所有堆肥的GI均大于60%,高于腐熟标准要求的50%的阈值[28]。在2 mm粒径处理中,具有外源添加剂的处理组GI值较对照组增加了15%~36%;在5 mm粒径处理中,增加了2%~16%。这表明纤维素酶和菌剂的添加对有机毒物的降解产生了积极影响,能有效改善GI,2 mm粒径更有利于增强添加剂的作用效果。
2.4 初始粒径和外源添加剂对吸光度比值的影响
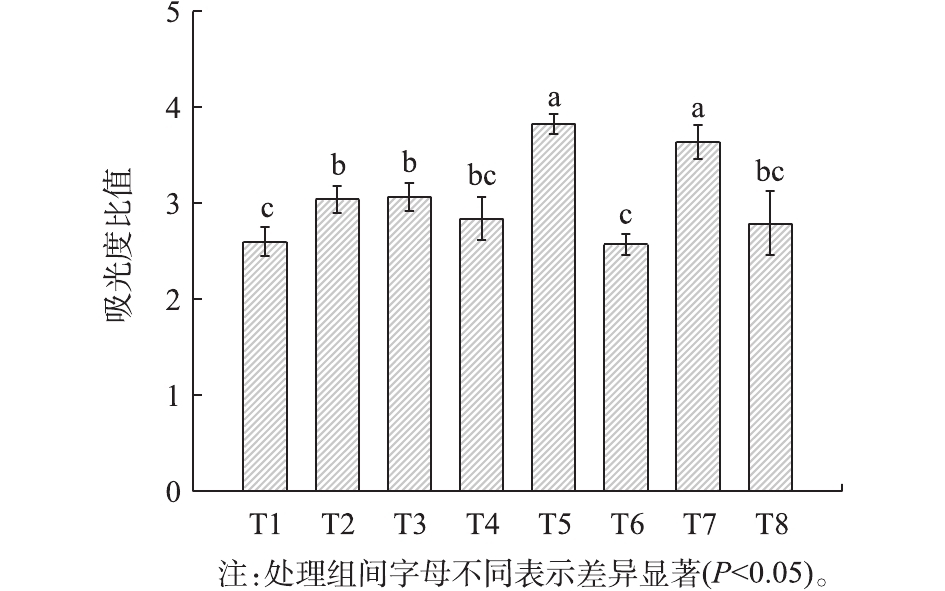
腐殖酸在波长465 nm和665 nm处具有特异吸收峰值。在堆肥过程中,2个波长处的吸光度比值(E4/E6)随着腐殖酸分子缩合度的增大而减小[29],成为评价堆肥结构稳定性的重要参数之一。如图4所示,堆肥结束时,各处理堆肥的E4/E6排序为T5>T7>T3>T2>T4>T8>T1>T6,在5 mm处理组中获得相对较高的E4/E6比值,较2 mm组高11.1%。这说明2 mm处理可使堆肥中的腐殖酸有更高的聚合度和稳定性,品质更佳。
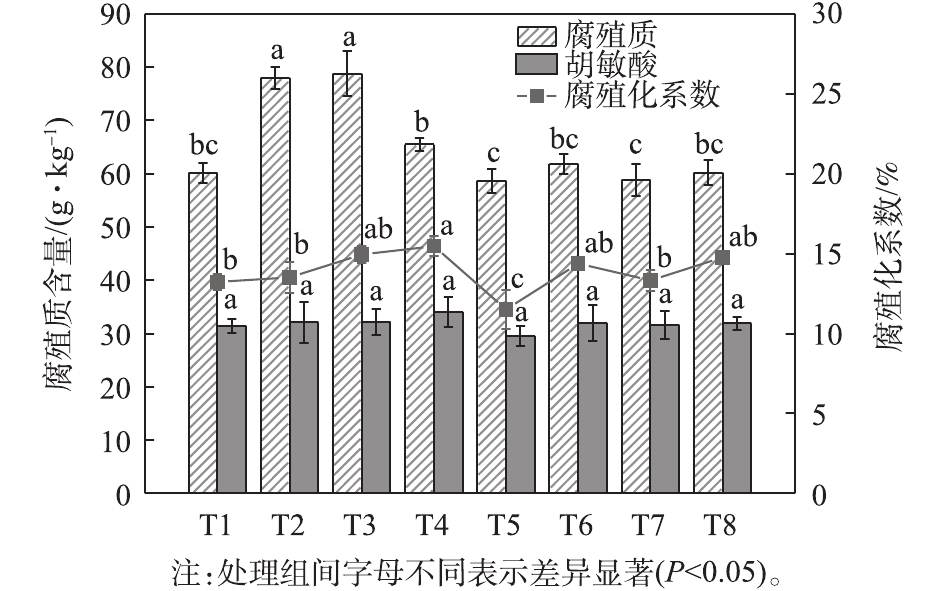
2.5 初始粒径和外源添加剂对腐殖化指标的影响
堆肥是大分子碳水化合物通过微生物转化为腐殖质的过程。图5显示,堆肥末期,2 mm处理的腐殖质和胡敏酸的平均含量分别比5 mm处理高17.9%和3.7%。这可能是由于小粒径处理中的纤维素材料更容易被分解,为氧化和芳香结构的形成提供了丰富的底物。在相同的粒度组中,对照组的腐殖质和胡敏酸含量最小,这归因于添加纤维素酶和菌剂能增加相关功能菌的数量,促进腐殖质的形成。除了腐殖质含量的变化,腐殖化系数(HI)被认为可以更准确地反映腐殖化程度[30]。在堆肥过程中,腐殖化系数呈上升趋势,分子质量较低的富里酸在矿化过程中降解,并浓缩成结构更复杂的大分子胡敏酸,使腐殖质更加稳定。在堆肥结束时,腐殖化系数排序为T4>T3>T8>T6>T2>T7>T1>T5,纤维素酶和菌剂对腐殖化系数有显著影响(P=0.001<0.05),说明二者的添加对提高堆肥腐熟程度有重要作用。
2.6 初始粒径和外源添加剂对微生物的影响
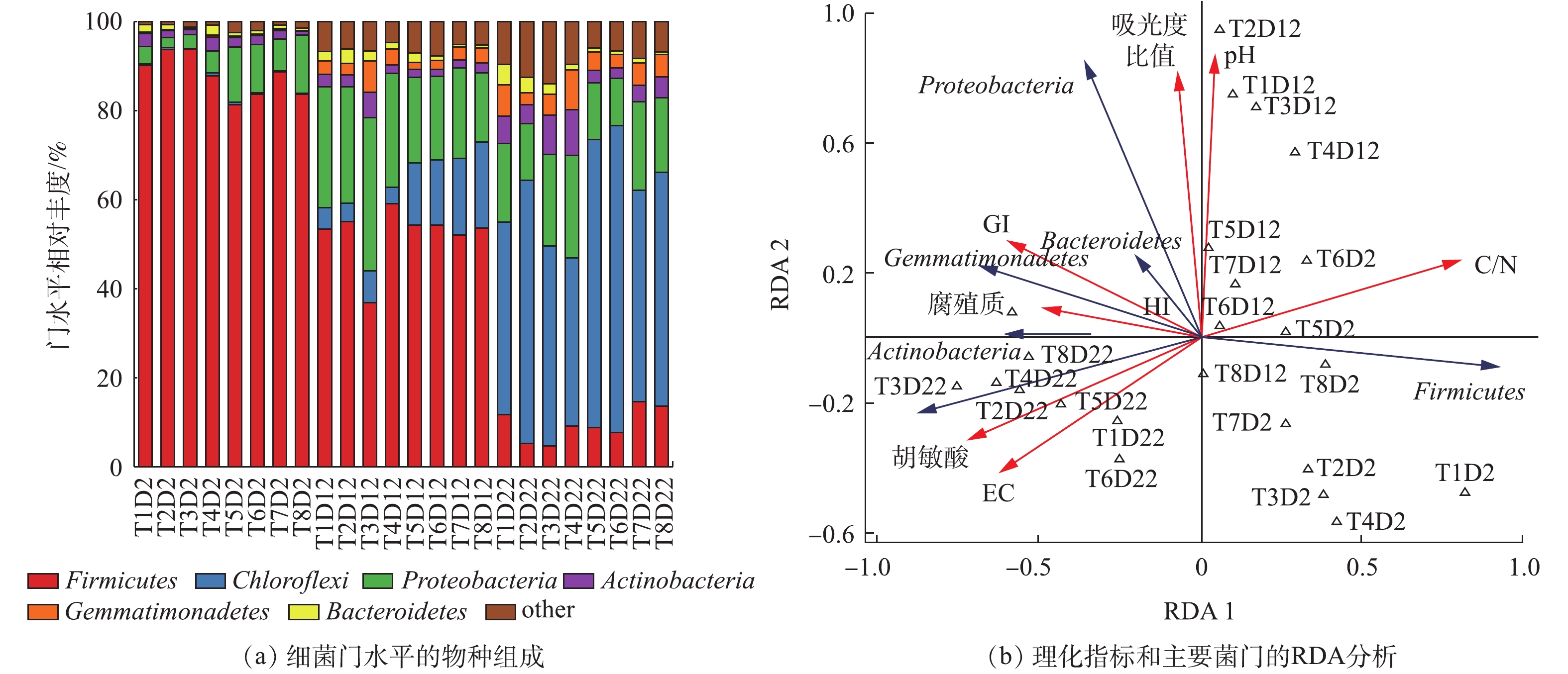
堆肥理化指标的分析表明,2 mm粒径和外源添加剂处理组对改善堆肥理化性质有积极作用。为了从微生物角度解释粒径和添加剂对理化性质的影响,对粒径和添加剂对微生物群落组成以及特定功能微生物的影响进行了分析。好氧堆肥中的细菌被公认是堆腐基质中数量最大、分布最广泛的微生物类群,不仅分解单糖效率高,也兼具了真菌和放线菌分解木质纤维素的能力[31]。由图6(a)可知,整个堆肥过程的优势菌门的排序为厚壁菌门(Firmicutes)>绿弯菌门(Chloroflexi)>变形菌门(Proteobacteria)>放线菌门(Actinobacteria)>芽单胞菌门(Gemmatimonadetes)。堆肥初期,能有效地利用碳水化合物的厚壁菌门是优势菌种,平均丰度高达87.8%;堆肥中期,随着碳水化合物的减少,厚壁菌门丰度下降,变形菌门丰度增加至23.4%;堆肥末期,绿弯菌门平均丰度迅速增加到52.5%,放线菌门和芽单胞菌门也成为主要菌种。在堆肥过程中,具有降解纤维素功能的放线菌[32]的相对丰度持续上升,各个处理放线菌的增长比例排序为T3>T4>T8>T1>T2>T7>T5>T6,2 mm处理是5 mm处理的3.15倍。可见,2 mm更适合具有分解纤维素能力的细菌生长繁殖。在同粒径组中,只添加菌剂的处理表现不佳。其原因可能是,外源菌的介入对原生菌群的演替有一定影响,而同时具有纤维素酶和菌剂的外源添加剂处理与对照处理相比,放线菌数量有明显提升。这说明纤维素酶对降解功能菌的繁殖代谢有积极作用,从而有效优化堆肥性质。
为进一步研究细菌群落组成与理化性质之间的关系,对堆肥理化性质与堆肥样品的主要菌门进行了RDA分析(图6(b))。结果显示,C/N、pH、GI和胡敏酸与细菌群落呈显著相关(P<0.05)。C/N和pH分别与厚壁菌门和变形菌门呈正相关,发芽指数和胡敏酸与成熟阶段的主要细菌活性相关。通过分析不同堆肥时期的主导菌群发现,在堆肥初期和中期,与5 mm相比,2 mm处理组中主导菌群(厚壁菌门和变形菌门)数量更多。这表明2 mm粒径能为这些微生物提供更适合生长繁殖的环境,加快堆肥进程。在腐熟阶段,2个粒径组与能促进腐殖化的末期主导细菌(放线菌门、芽单胞菌门)[28]的相关性分别为T3>T4>T2>T1和T7>T8>T5>T6。在同粒径组中,同时添加纤维素酶和菌剂的处理与腐殖功能菌相关性更大,对其生长繁殖有积极作用,从而提高了GI、腐殖质和胡敏酸含量。这说明添加纤维素酶和菌剂能促进堆肥后期熟化,与腐殖化分析所得结论一致。因此,粒径和添加剂可以通过影响细菌群落来优化理化性质,2 mm处理组和同时具有纤维素酶与菌剂的处理组能有效促进相关功能菌增长,改善堆肥质量。
2.7 堆肥产品腐熟效果的综合评价
为避免单个指标评价的偏差和片面性,本研究采用主成分分析法,综合8项理化指标对所有处理进行综合量化评价,以更全面客观地评估不同处理的堆肥质量。分析共提取3个主成分,方差贡献率累计达85.676%,满足大于85%的要求[19]。主成分提取结果见表3,各处理的主成分综合评分见表4。
表 3 堆肥指标主成分提取Table 3. Principal component extraction of compost index主成分 分析指标 特征根 贡献率/% 累计贡献率/% 第1主成分 pH、EC、腐殖化系数、胡敏酸含量 3.204 40.055 40.055 第2主成分 C/N、GI、E4/E6 2.054 25.673 65.728 第3主成分 腐殖质含量 1.596 19.948 85.676 表 4 堆肥主成分综合评分Table 4. Principal component comprehensive score of composts处理组 F1得分 F2得分 F3得分 F得分 F排名 T1 −1.476 −1.244 −0.666 −1.174 8 T2 −0.734 −0.155 1.500 0.080 4 T3 1.460 0.519 1.527 1.178 1 T4 1.029 −0.880 1.145 0.452 3 T5 −3.352 1.574 −0.209 −0.893 7 T6 1.803 −0.698 −1.938 −0.049 5 T7 −0.152 0.699 −0.911 −0.094 6 T8 1.421 0.210 −0.448 0.508 2 由表4可知,所有处理从优至劣依次是T3>T8>T4>T2>T6>T7>T5>T1,表现最好的是处理T3,即2 mm粒径添加由2%纤维素酶和2%菌剂组成的外源添加剂,综合分数为1.178分;表现最差的是2 mm粒径不加外源添加剂的处理T1,综合分数为−1.174分。2 mm粒径组平均得分高于5 mm粒径组,2 mm粒径组内排序为T3>T4>T2>T1,5 mm粒径组内排序为T8>T6>T7>T5。2种粒径组中有外源添加剂的处理表现均好于对照处理。其中,2 mm的最优处理是T3,纤维素酶和菌剂比例为2∶2;5 mm的最优处理是T8,纤维素酶和菌剂比例为2∶4。
主成分分析结果表明,2 mm处理组的表现整体优于5 mm处理组。究其原因可能包括2个方面:一是绿化废弃物含有大量结构紧密的纤维素和半纤维素,粒径决定了酶与这些大分子物质的接触面积和降解效率,2 mm粒径处理可以增加堆料表面积,提升酶解效果和速率;二是在孔隙率、温度和湿度等方面,2 mm粒径组为微生物提供了更好的生长代谢环境。张璐[14]曾提出,适当的粒径可以提高绿化废弃物堆料的通气透水性,并减少水从表面蒸发,改善微生物活动的物理微环境。
在同样添加4%菌剂的条件下,混配纤维素酶的外源添加剂效果优于只具有菌剂的外源添加剂。具体表现在:添加2%纤维素酶的T4组和T8组较不添加纤维素酶的T2组和T6组分别高0.372分和0.557分,表明纤维素酶对促进堆肥腐熟有至关重要的作用。其原因可能是,外源酶可以补充堆料中纤维素酶数量的不足,提升胞外纤维素酶的活力;同时,针对无法直接利用纤维素的微生物,纤维素酶作为中间介质将纤维素分解成微生物易利用的单糖,能有效提高生物质的水解。
在同样添加2%纤维素酶的条件下,分别混配2%和4%的菌剂,在不同粒径条件下的堆肥效果有明显差异。在2 mm粒径组中,添加2%菌剂的T3组效果优于添加4%菌剂的T4组,而5 mm粒径条件下则刚好相反。这可能归因于2 mm较5 mm粒径条件更适合高温堆肥细菌群落,并促进具有降解纤维素能力的细菌的生长和繁殖,添加过多菌剂导致微生物数量过多,发酵过程中的微生物环境平衡被破坏,微生物活性受到抑制[33];相反,5 mm条件下接种更多菌剂可以在合理范围内增加微生物数量,促进堆肥的腐熟。这也说明粒径对添加剂的作用效果有重要影响,相似观点是ZHANG等[34]的研究,在不同堆肥粒径下,添加鼠李糖脂,堆肥性质表现出显著差异。
3. 结论
1) 2 mm粒径的堆肥处理较5 mm能促进C/N和E4/E6值下降,提高腐殖质含量、胡敏酸含量和腐殖化系数,有利于堆肥腐殖化和稳定化;外源纤维素酶和菌剂可以降低C/N,提高发芽指数和各项腐殖化指标,促进了有机质降解,提高了堆肥质量。
2)厚壁菌门、绿弯菌门、变形菌门、放线菌门和芽单胞菌门是堆肥的主要菌门。2 mm处理组和同时具有纤维素酶与菌剂的处理组能通过促进功能菌增长,优化堆肥理化性质。
3)采用主成分分析法进行综合评价可得:纤维素酶和菌剂混配的促腐效果好于单一成分的外源添加剂,2 mm粒径可以增强添加剂的作用效果;T3组(2 mm粒径添加配比为2∶2的外源添加剂)综合评分最高,是最优堆肥处理。
-
表 1 样品信息
Table 1. Information of the samples
样品编号 季节 养殖场类型 样品类型 WPA 冬季 猪场 空气 SPA 夏季 猪场 空气 WCA 冬季 鸡场 空气 SCA 夏季 鸡场 空气 WPF 冬季 猪场 粪便 SPF 夏季 猪场 粪便 WCF 冬季 鸡场 粪便 SCF 夏季 鸡场 粪便 表 2 鸡场和猪场在冬、夏季环境监测数据
Table 2. Environmental monitoring data of chicken farm and pig farm in winter and summer
样品编号 温度/ ℃ 湿度 风速/(m·s−1) PM2.5/(μg·m−3) CAS 29.97±1.57 98.07%±3.45% 0.01±0.01 99.16±39.05 CAW 7.70±1.25 94.83%±4.10% 0.00±0.00 588.93±160.72 PAS 31.16±1.27 86.07%±19.56% 0.01±0.01 112.20±29.49 PAW 6.2±0.95 87.50%±18.54% 0.00±0.00 437.67±170.46 表 3 ARGs与MGEs线性拟合方程
Table 3. Linear fitting equation of ARGs and MGEs
y x 相关系数 线性方程 ΣMGEs Pbp5 0.991* y=0.05x−9.58 (R2=0.999 8) ΣMGEs mexA 0.987* y=0.01x+1.20×102 (R2=0.994 1) ΣARGs Pbp5 0.996* y=113.33x−1.84×105 (R2=0.997 1) ΣARGs VanC2/VanC3 0.998* y=66.27x−2.55×105 (R2=0.990 7) -
[1] VAN BOECKEL T, PIRES J, SILVESTER R, et al. Global trends in antimicrobial resistance in animals in low-and middle-income countries[J]. Science, 2019, 365(6459): eaaw1944. doi: 10.1126/science.aaw1944 [2] ZHAN N, XIAO N. LivestockWaste 2016-International Conference on Recent Advances In Pollution Control and Resource Recovery for the Livestock Sector[J]. Frontiers of Environmental Science & Engeering, 2017, 11(3): 16. [3] LI W L, YANG J S, ZHANG D Z, et al. Concentration and community of airborne bacteria in response to cyclical haze events during the fall and midwinter in Beijing, China [J]. Frontiers in Microbiology, 2018, 9.https://doi.org/10.3389/fmicb.2018.01741. [4] HEUER H, SCHMITT H, SMALLA K. Antibiotic resistance gene spread due to manure application on agricultural fields[J]. Current Opinion in Microbiology, 2011, 14(3): 236-243. doi: 10.1016/j.mib.2011.04.009 [5] 董子琨. 鸡粪施用土壤中抗生素抗性基因在土壤-植物系统的迁移与阻控研究 [D]. 泰安: 山东农业大学, 2022. [6] MCEACHRAN A D, BLACKWELL B R, HANSON J D, et al. Antibiotics, bacteria, and antibiotic resistance genes: Aerial transport from cattle feed yards via particulate matter[J]. Environmental Health Perspectives, 2015, 123(4): 337-343. doi: 10.1289/ehp.1408555 [7] LI J, CAO J J, ZHU Y G, et al. Global survey of antibiotic resistance genes in air[J]. Environmental Science & Technology, 2018, 52(19): 10975-10984. [8] MBARECHE H, VEILLETTE M, PILOTE J, et al. Bioaerosols play a major role in the nasopharyngeal microbiota content in agricultural environment[J]. International Journal of Environmental Research and Public Health, 2019, 16(8): 1375. doi: 10.3390/ijerph16081375 [9] MONROE S, POLK R. Antimicrobial use and bacterial resistance[J]. Current Opinion in Microbiology, 2000, 3(5): 496-501. doi: 10.1016/S1369-5274(00)00129-6 [10] HE L Y, HE L K, LIU Y S, et al. Microbial diversity and antibiotic resistome in swine farm environments[J]. Science of the Total Environment, 2019, 685: 197-207. doi: 10.1016/j.scitotenv.2019.05.369 [11] DE ROOIJ M M T, HOEK G, SCHMITT H, et al. Insights into livestock-related microbial concentrations in air at residential level in a livestock dense area[J]. Environmental Science & Technology, 2019, 53(13): 7746-7758. [12] WANG J, QIN X, GUO J B, et al. Evidence of selective enrichment of bacterial assemblages and antibiotic resistant genes by microplastics in urban rivers[J]. Water Research, 2020, 183: 116113. doi: 10.1016/j.watres.2020.116113 [13] AMARASIRI M, SANO D, SUZUKI S. Understanding human health risks caused by antibiotic resistant bacteria (ARB) and antibiotic resistance genes (ARG) in water environments: Current knowledge and questions to be answered[J]. Critical Reviews in Environmental Science and Technology, 2020, 50(19): 2016-2059. doi: 10.1080/10643389.2019.1692611 [14] SONG L, WANG C, WANG Y Z. Optimized determination of airborne tetracycline resistance genes in laboratory atmosphere[J]. Frontiers of Environmental Science & Engineering, 2020, 14(6): 39-49. [15] ZHU Y G, JOHNSON T A, SU J Q, et al. Diverse and abundant antibiotic resistance genes in Chinese swine farms[J]. Proceedings of the National Academy of Sciences of the United States of America, 2013, 110(9): 3435-3440. doi: 10.1073/pnas.1222743110 [16] WANG F H, QIAO M, SU J Q, et al. High throughput profiling of antibiotic resistance genes in urban park soils with reclaimed water irrigation[J]. Environmental Science & Technology, 2014, 48(16): 9079-9085. [17] LOOFT T, JOHNSON T A, ALLEN H K, et al. In-feed antibiotic effects on the swine intestinal microbiome[J]. Proceedings of the National Academy of Sciences of the United States of America, 2012, 109(5): 1691-1696. doi: 10.1073/pnas.1120238109 [18] ZHANG Q Q, YING G G, PAN C G, et al. Comprehensive evaluation of antibiotics emission and fate in the river basins of China: Source analysis, multimedia modeling, and linkage to bacterial resistance[J]. Environmental Science & Technology, 2015, 49(11): 6772-6782. [19] CAMBRA-LOPEZ M, TORRES A G, AARNINK A J A, et al. Source analysis of fine and coarse particulate matter from livestock houses[J]. Atmospheric Environment, 2011, 45(3): 694-707. doi: 10.1016/j.atmosenv.2010.10.018 [20] SONG L, WANG C, JIANG G Y, et al. Bioaerosol is an important transmission route of antibiotic resistance genes in pig farms[J]. Environment International, 2021, 154: 106559. doi: 10.1016/j.envint.2021.106559 [21] 刘菲. 肉鸡饲养场PM2.5、粪便和土壤中抗生素抗性基因污染特征及抗生素耐药菌的分布 [D]. 常州: 常州大学, 2019. [22] 贾世杰, 王娇, 王钦, 等. 青岛冬春季大气气溶胶中抗生素抗性基因组成及影响因子[J]. 中国海洋大学学报(自然科学版), 2022, 52(8): 60-70. doi: 10.16441/j.cnki.hdxb.20210121 -




 DownLoad:
DownLoad: