-
20世纪50年代美国食品与药物管理局首次批准抗生素用作饲料添加剂,世界各国相继将抗生素应用于畜牧生产,提高了畜牧业的经济效益. 但是,抗生素在养殖业和畜牧业中的广泛使用对环境和人体健康造成了很大危害[1]. 抗生素会加剧细菌的变异,使细菌产生耐药性,甚至可能产生超级细菌[2]. 抗生素还可能使人体发生“二重感染”,对人体的多个器官均有损害,导致过敏反应和药物性耳聋发生[3].
有研究显示,奶牛在饲养过程中用到的抗生素类药物,主要用于预防乳头发炎和细菌感染,并防止奶制品的细菌污染[4]. 奶牛体内无法被吸收的抗生素会有部分随着乳汁排出体外,并制成液态奶和奶粉等乳制品[5]. 这些奶粉中的抗生素可能会对于易感人群产生一定的危害. 其中婴幼儿因为对奶粉的需求量大、自身免疫力较弱、身体器官尚未发育成熟等原因,可能受到的影响较大. 因此,对于婴幼儿奶粉中抗生素残留的检测值得特别关注.
目前关于液态奶中抗生素残留的研究较多[6-8]. Zhang等[9]检测了中国市场上的巴氏奶和高温灭菌奶中四环素类、磺胺类和喹诺酮类药物的含量,Wang等[10]检测了牛奶中20种大环内酯、磺胺类和喹诺酮类抗生素残留量,均表明牛奶中含有一定的抗生素残留(μg·L−1). 另一方面,由于奶粉中抗生素残留低,并且含有大量蛋白质和脂肪,基体复杂,可能会干扰抗生素的检测[11],因此关于奶粉尤其是婴幼儿奶粉中的污染特征的研究较少. 张律[12]采用高效液相色谱-串联质谱法进行环丙沙星、氧氟沙星等11种喹诺酮类抗生素的检测,结果在深圳市110份奶粉样品中均未检出. Tian等[13]采用超高效液相色谱-串联质谱法应用于50个市售牛奶和奶粉样品中抗生素的检测,并在部分品牌样品中检出头孢噻呋和环丙沙星残留(μg·kg−1). 陆峥[14]和周显凤等[15]分别采用纸片扩散法对分离自婴幼儿配方奶粉的阪崎肠杆菌进行药敏实验,结果显示该细菌对头孢噻吩100%耐药,对环丙沙星等抗生素高度敏感[14-15],表明婴幼儿配方奶粉中存在抗生素污染. 因此,对常见市售奶粉中抗生素的含量进行检测,并根据检测结果主要对婴幼儿的暴露情况进行研究,这对于保障婴幼儿的健康具有很强的现实意义.
本研究建立了同时检测22种喹诺酮类、磺胺类和大环内酯类抗生素的分析方法,并用该方法对市面上常见的婴幼儿奶粉进行检测,根据其检测结果分析婴幼儿奶粉中抗生素的污染水平和分布规律. 通过计算抗生素对婴幼儿的暴露水平,评估奶粉中抗生素的含量对婴幼儿的生长发育的风险.
-
大环内酯类(macrolides,MCs):红霉素(ERY,99.1%)、罗红霉素(ROX,90%)、交沙霉素(JOS,98%)、泰乐菌素(TYL,82.4%)、螺旋霉素(SPI,88.9%)(美国Sigma-Aldrich公司).
磺胺类(sulfonamides,SAs):磺胺噻唑(ST,98%)、磺胺吡啶(SPD,98%)、磺胺甲基异恶唑(SMX,98%)(日本东京化成工业株式会社);磺胺二甲基嘧啶(SMX,99%)(美国Acros Organics公司);磺胺嘧啶(SD,99.7%)、磺胺甲基嘧啶(SMR,99.9%)、磺胺间二甲氧嘧啶(SDM,99.4%)、磺胺二甲基异恶唑(SIA,99.0%)、磺胺间甲氧嘧啶(SMM,98%)(美国Sigma-Aldrich公司).
喹诺酮类(quinolones,QNs):诺氟沙星(NOR,99.9%)、恩诺沙星(ENR,99.9%)、环丙沙星(CIP,99.9%)、氧氟沙星(OFL,99.9%)、沙拉沙星(SAR,95.0%)、氟罗沙星(FLE,99.5%)、洛美沙星(LOM,98%)、双氟沙星(DIF,98.0%)(美国Sigma-Aldrich公司).
替代物标准品:磺胺甲基异恶唑-d4(SMX-d4,99.0%)、磺胺二甲基嘧啶-d4(SMX-d4,99.0%),红霉素-13C, d3(ERY-13C, d3,98.0 %)和螺旋霉素I-d3(SPI I-d3,98.0 %)(购于加拿大Toronto Research Chemicals公司);氧氟沙星-d3(OFL-d3,99.5 %)、诺氟沙星-d5(NOR-d5,99%)、沙拉沙星-d8(SAR-d8,99.5 %)(美国Sigma-Aldrich公司);
色谱纯甲醇和乙腈(美国Fisher公司),氨水(50%,V/V)和甲酸铵(99%,美国Alfa Aesar公司),甲酸(98%,美国Fluka公司),乙二胺四乙酸二钠盐(Na2EDTA)(分析纯,国药集团化学试剂有限公司).
-
质谱:API3200三重四极杆串联质谱检测系统(美国AB公司),配有电喷雾离子源(ESI)和Analyst 1.4.1工作软件.
色谱:UltiMate3000液相色谱仪(美国Dionex公司); XTerra MS C18型色谱柱(2.1 mm×100 mm,3.5 μm,美国Waters公司).
其他:AutoTrace 280全自动固相萃取仪(美国Dionex公司);Milli-Q超纯水仪(美国Millipore公司);氮吹仪(天津市恒奥科技发展有限公司);Oasis HLB(6 mL,200 mg)(美国Waters公司);3-15高速离心机(北京松源华兴科技发展有限公司).
-
采集23个常见品牌的市售婴幼儿奶粉共41份样品(表1). 样品采集后在4 ℃ 冰箱中冷藏,为了防止其中抗生素的分解造成的损失,在1周内进行处理分析.
-
优化后抗生素前处理方法如下:称取1.0 g奶粉样品于聚四氟乙烯离心管中,加入10 mL甲醇/乙腈(V/V=8:2)的萃取液,以及20 ng替代物内标(NOR-d5、OFL-d3、SAR-d8、SMX-d4、SMX-d4、ERY-13C, d3 和SPI I-d3)和1.0 g氯化钠,涡旋振荡2 min,于摇床中振荡12 h(转速:350 r·min−1、温度:35 ℃). 之后在5000 r·min−1的条件下离心10 min,取上清液,用5 mL甲醇-乙腈(V/V=8:2)混合溶液清洗,合并上清液. 重复上述步骤2次.
在35 ℃的条件下氮吹至溶液体积约5 mL,加入3 mL正己烷,涡旋振荡1 min,5000 r·min−1的条件下离心10 min,取上清液继续氮吹至2—3 mL. 转移溶液至100 mL PET小瓶中并加入超纯水稀释溶液至100 mL,使用自动固相萃取技术进行富集净化(5 mL甲醇、5 mL超纯水活化,6 mL氨水-甲醇(V/V=5:95)溶液洗脱). 洗脱液在35 ℃的条件下再次进行氮吹,至小于0.5 mL,定容至1 mL. 转移到1 mL离心管中,冷冻12 h,之后在漩涡振荡后以14500 r·min−1离心5 min,取上层清液经过0.22 μm尼龙滤膜转移到棕色色谱瓶中以备仪器分析.
-
采用电喷雾离子源(ESI),分析物在正离子扫描下以多反应监测(MRM)模式,分别进行母离子Q1和子离子Q3扫描,选择丰度最强的2个子离子与分子离子组成离子对作为目标物的监测离子. 信号最强的离子对可以为定量提供高灵敏度,另一个离子对则可提供辅助定性信息. 之后优化质谱参数和色谱条件,使仪器信号稳定且灵敏度最高. 优化的质谱分析条件:气帘气压力0.14 MPa,碰撞气压力0.02 MPa,电喷雾电压5000 V,雾化气温度600 ℃,雾化气:0.38 MPa,加热气及辅助雾化气: 0.45 MPa. 优化的色谱条件:流动相A:0.3%甲酸水溶液(含0.1%(体积分数)甲酸铵,pH=2.9),流动相B:甲醇-乙腈(V/V=1:1);流速:0.2 mL·min−1;进样量:15 μL;梯度洗脱条件:0—2 min,10%B;2—12 min,10%—70% B;12—16 min,70%—100% B,保持3 min;19—19.1 min,100%—10% B;19.1—33 min,10% B.
-
在选定的最佳质谱和色谱条件下,进样15 μL,对一系列浓度的混合标准样品(20 ng NOR-d5、OFL-d3、SAR-d8、SMX-d4、SMZ-d4、 ERY-13C, d3和SPI I-d3内标)进行分析,以各分析物和内标离子对的峰面积之比进行定量. 每批样品都要做一个程序空白样品,以保证检测结果的可靠性. 实验中设置方法空白、空白加标、基质加标对数据进行质量控制. 22种抗生素的加标回收率为72.8%—123%,相对标准偏差(RSD)为1.6%—11.2%. 结果表明,22种化合物均在较宽的范围内具有良好的线性,方法检出限(LODs)为0.01—0.10 μg·kg−1 (见表2).
-
根据婴幼儿奶粉建议用量计算婴幼儿每天奶粉的实际摄入量,再根据奶粉中抗生素的检测结果,换算出婴幼儿经口对奶粉中抗生素的日平均暴露剂量(Average daily dose, ADD),公式(EPA,2011)[16]如下:
其中,ADD:抗生素的日平均暴露量,μg (kg d)−1; C:奶粉中抗生素的浓度,μg·kg−1;IR:饮食摄入量,kg d−1;EF:暴露频率,d a−1;ED:暴露持续时间,a;BW:体重,kg;AT:平均暴露时间,d.
-
本研究中∑QNs、∑SAs和∑MCs分别代表9种喹诺酮、8种磺胺和5种大环内酯抗生素的浓度之和. 所有数据均使用IBM PASW Statistics 20软件进行分析. 如奶粉样品中抗生素浓度低于分析方法检出限,则该检测数据赋予0值参加平均值统计计算. Kolmogorov–Smirnov检验用来验证数据是否呈正态分布,Kruskal–Wallis非参数检验用来比较抗生素的浓度差异. 一般认为当P< 0.05时该检验具有显著性差异.
-
婴幼儿配方奶粉中抗生素浓度见表3. 样品共检出19种抗生素,包括8种喹诺酮(NOR、CIP、DIF、ENR、FLE、OFL、LOM和SAR),6种磺胺(SMX、SPD、SMZ、SDZ、SIA和SDM)和3大环内酯(TYL、ROX和ERY). 其他1种磺胺(SPD)和2种大环内酯(SPI和JOS)在所有样品中浓度均低于检测限,可能是这3种抗生素主要应用于人体感染性疾病的治疗,在动物的生长过程中很少使用[1].
三类抗生素中,喹诺酮类抗生素浓度最高,平均浓度可达2.92 μg·kg−1(0.49—20.1 μg·kg−1),比磺胺(平均浓度0.39 μg·kg−1,0.03—2.93 μg·kg−1)和大环内酯类(平均浓度0.16 μg·kg−1,<LOD—1.14 μg·kg−1)抗生素浓度高1个数量级. 这是因为奶牛在生长过程中喹诺酮类抗生素的使用量远大于磺胺和大环内酯的使用量(见表4),并且喹诺酮类抗生素具有更高的稳定性和生物富集能力[17-19]. 在所有抗生素中,CIP、NOR和ENR的检出率较高(90.2%—100%),浓度分别为0.87、0.68、0.48 μg·kg−1,而其他抗生素检出率(<60%)和浓度均较低(<0.2 μg·kg−1). 有研究报道[1],CIP、NOR和ENR均可作为兽用抗生素使用,并在养殖业中大量使用(表4),因此可在奶粉样品中较多检出.
-
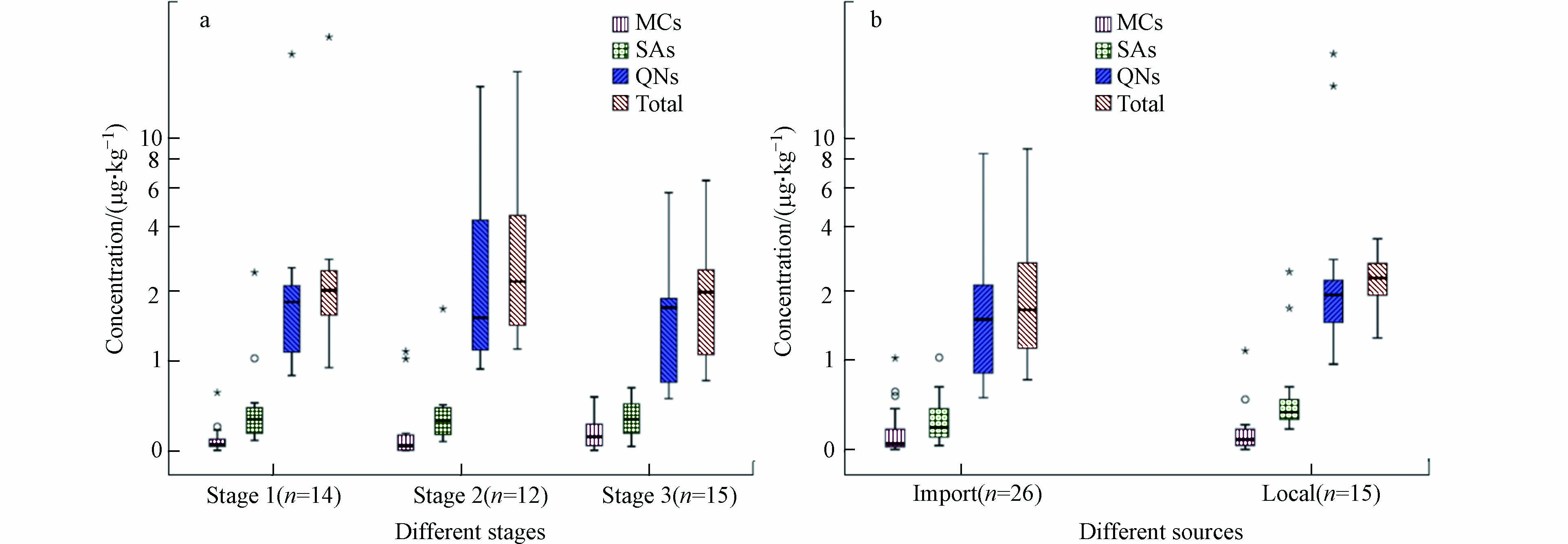
不同阶段婴幼儿配方奶粉中∑QNs、∑SAs和∑MCs的浓度如图1(a)所示. 单因素方差(见表5)结果表明,这三类抗生素浓度在不同阶段的奶粉中无显著差异(P>0.05). 2段奶粉中抗生素残留水平的总体平均值为4.48 μg·kg−1(浓度范围1.18—17.4 μg·kg−1),略高于1段(平均3.77 μg·kg−1,0.89—23.1 μg·kg−1)和3段(平均2.36 μg·kg−1,0.71—6.98 μg·kg−1)奶粉中抗生素的残留水平.
国内外不同奶源奶粉中∑QNs、∑SAs和∑MCs的污染水平如图1(b)所示. 通过对比发现,国内奶源的奶粉的污染水平(平均值3.88 μg·kg−1,1.36—23.1 μg·kg−1)略高于进口奶源(平均值2.41 μg·kg−1,0.71—9.15 μg·kg−1),但并没有显著性差异(P>0.05). 需要指出的是,个别国产奶源的奶粉中抗生素含量较高,可达23.1 μg·kg−1,需要值得关注.
-
目前,国内还尚未出台关于奶粉中抗生素残留限量的相关规定,因此本研究参考农业部于2019年修订发布了最新的《动物源性食品中兽药最高残留限量》(GB 31650-2019)中的最高残留限量(maximum residue limit,MRL)和日允许摄入量(acceptable daily intake, ADI)对婴幼儿的暴露风险进行研究[20-22]. 通过比较发现,抗生素在婴幼儿奶粉中的检出浓度均较低,41个婴幼儿奶粉中抗生素的含量比国家规定的动物性食品中兽药最高残留限量低1—3个数量级,符合食品安全(见表6).
进一步根据奶粉中抗生素的检测结果换算婴幼儿经口对奶粉中抗生素的日平均暴露剂量. 婴幼儿暴露水平计算公式中婴幼儿体重参照《中国7岁以下儿童生长发育参照标准》[23]. 其中0—2周男孩体重为3.6 kg、女孩为2.7 kg,2—4周男孩体重为5.0 kg、女孩为3.6 kg,2个月男孩体重为5.2 kg、女孩为4.0 kg,3—4月男孩体重为6.3 kg、女孩为5.1 kg,5—6月男孩体重为7.6 kg、女孩为6.7 kg,7—12月男孩体重为10.6 kg、女孩为9.9 kg,13—24月男孩体重为12.7 kg、女孩为12.0 kg,25—36月男孩体重为15.3 kg、女孩为14.7 kg. 婴幼儿对奶粉的吸收率约为94%[24]. 0—6个月,7—12个月以及13—36个月月龄段婴幼儿配方奶粉消费量,按照样品标签上的推荐量求平均值计算,分别为102、109和 91 g d−1 [25].
婴幼儿对抗生素的日暴露水平如表7所示,结果表明婴幼儿对于喹诺酮类抗生素的暴露水平相对最高,其最大暴露浓度达到了430 ng·kg−1·d−1·bw,均值在3.40—13.2 ng·kg−1·d−1·bw. 对于大环内酯类抗生素的暴露水平较低,其最高暴露浓度为31.2 ng·kg−1·d−1·bw,均值在1.07—4.14 ng·kg−1·d−1·bw. 对于磺胺类抗生素的暴露水平最低,最高值也仅为是57.3 ng·kg−1·d−1·bw,均值在1.04—4.05 ng·kg−1·d−1·bw.
对于这41个婴幼儿配方奶粉来说,婴幼儿对喹诺酮类、磺胺类和大环内酯类抗生素的的暴露水平比《动物性食品中兽药最高残留限量》中ADI值低2—3个数量级(见表6). 因此,婴幼儿奶粉中抗生素残留对儿童的暴露水平均处在较低的水平,不会对婴幼儿的成长发育造成明显的危害. 需要注意的是,本研究参考的《动物源性食品中兽药最高残留限量》(GB 31650-2019)仅对部分抗生素的最高残留限量和日允许摄入量做了限定,因此也仅对部分抗生素进行了风险评估,其评估结果可能会低于实际风险值. 考虑到不同抗生素之间的毒性协同作用,奶粉中低水平抗生素长期暴露对人体健康造成潜在的危害不能忽视.
-
本文研究了婴幼儿配方奶粉样品中抗生素的污染特征和暴露水平. 研究表明奶粉中存在抗生素残留,其中主要组分是喹诺酮,其次是磺胺和大环内酯. 研究表明不同阶段和不同奶源婴幼儿配方奶粉中抗生素残留水平无显著性差异. 三类抗生素的日暴露水平均低于《动物性食品中兽药最高残留限量》中ADI值. 总体来看,婴幼儿的暴露水平均处在较低的水平. 因此,婴幼儿配方奶粉中所残留的抗生素尚不会对婴幼儿的成长发育造成明显的危害.
婴幼儿配方奶粉中22种抗生素污染特征及暴露风险
Study on pollution characteristics and human exposure of 22 antibiotic in infant milk powder
-
摘要: 作为一类新污染物,抗生素的环境污染及其潜在的健康风险受到国内外的广泛关注. 作为主要的抗菌药物和生长促进剂,抗生素在养殖业和畜牧业中的广泛使用可能会使其在奶粉等农副产品中有一定水平的残留,对人体尤其婴幼儿等易感人群造成潜在的危害. 本研究以婴幼儿奶粉为研究对象,采集41个国内外常见市售婴幼儿品牌奶粉,利用液相色谱串联质谱仪(LC-MS/MS)测定奶粉中22种抗生素的含量,并评价婴幼儿奶粉中抗生素对婴幼儿等易感人群的健康风险. 研究表明,抗生素在婴幼儿配方奶粉普遍存在,但残留水平较低(μg·kg−1). 其中喹诺酮类抗生素含量略高(∑QNs平均值2.92 μg·kg−1,浓度范围0.49—20.1 μg·kg−1),而磺胺(∑SAs平均浓度0.39 μg·kg−1,0.03—2.93 μg·kg−1)和大环内酯类(∑MCs平均浓度0.16 μg·kg−1,低于检出限(LOD)—1.14 μg·kg−1)抗生素浓度普遍较低. 统计分析表明不同阶段和不同奶源婴幼儿配方奶粉中抗生素残留水平无显著性差异(P>0.05). 总体来看,婴幼儿的暴露水平均处在较低的水平. 其中喹诺酮类抗生素的日暴露水平较高(均值范围3.40—13.2 ng·kg−1·d−1·bw),最高可达430 ng·kg−1·d−1·bw,而磺胺(1.04—4.05 ng·kg−1·d−1·bw)和大环内酯类(1.07—4.14 ng·kg−1·d−1·bw)抗生素的日暴露水平最低,均低于《动物性食品中兽药最高残留限量》中日允许摄入量(ADI). 因此,婴幼儿配方奶粉中所残留有抗生素,但尚不会对婴幼儿的成长发育造成明显的危害.Abstract: Antibiotics, an emerging group of environmental contaminant, have attracted wide attention due to their potential risks on human health and ecosystems. As a class of antibacterial drugs and growth promoters, antibiotics are widely used in livestock farming, which may cause a certain level of antibiotic residues in infant milk powder and pose a potential threat to infants and young children. In the present study, 41 common brands of infant milk powder were collected from domestic and foreign markets, and the levels of 22 antibiotics in the milk powder were determined by liquid chromatography tandem mass spectrometry (LC-MS/MS), and the health risks of antibiotics in infant milk powder to susceptible people such as infants and young children were evaluated. The results revealed that antibiotics were widely distributed in the infant milk powder. Quinolones were the predominant compounds with mean concentrations of 2.92 μg·kg−1 (0.49—20.1 μg·kg−1), which were one order of magnitude higher than those of sulfonamides (mean: 0.39 μg·kg−1, 0.03—2.93 μg·kg−1) and macrolides (mean: 0.16 μg·kg−1,<limits of detection (LODs)—1.14 μg·kg−1). Statistical analysis showed that there was no significant difference in antibiotic residues in infant milk powder at different stages and from different milk sources(P>0.05).The results showed that the average daily dose (ADD) of quinolone in infant milk powder was high (max: 430 ng·kg−1·d−1·bw; mean 3.40—13.2 ng·kg−1·d−1·bw), while the ADD of sulfonamide (1.04—4.05 ng·kg−1·d−1·bw) and macrolides (1.07—4.14 ng·kg−1·d−1·bw) were relatively low. Overall, the exposure of antibiotics in the milk powder to infants was at a low level, which were lower than acceptable daily intake (ADI) values. Therefore, the antibiotic residues in infant milk powder will not cause significant harm to the growth and development of infants.
-
Key words:
- antibiotics /
- infant milk powder /
- pollution characteristics /
- risk assessment
-
作为地表水最小的单位部分和最基本的生态细胞,小微水体在行洪排涝、灌溉供水、养殖及人居生态环境质量保障等方面发挥着重要的基础性功能和作用[1]。然而,由于城镇小微水体污染源的多样性、居民环保意识不足以及治理体系不够完善,加之小微水体自身具有流动性差、自净能力弱、封闭性强等特点,城镇小微水体极易出现富营养化和水体黑臭现象,严重影响居民生活健康与水生态安全[2]。因此,城镇小微水体微污染水治理已成为我国“十四五”水环境治理重点。
在现有的湖泊、河流治理修复技术中,物理技术见效较快,但存在治标不治本的特点;化学技术需要添加外源试剂,容易造成二次污染;生态工程及生物技术具有应用范围广、环境友好、可持续修复性强、运行投资相对较省等优点[3]。其中,生物膜技术可形成紧密与多样化的微生物膜结构,容易聚集较高浓度的生物量,可有效减少处理工艺占地面积、增加处理负荷,在受污染水体治理修复中的应用研究日趋增多。薛同站等[4]采用改性中空纤维膜曝气生物膜(membrane aeration bioreactor,MABR)进行了为期78 d的中试实验,结果表明,MABR技术对河水主要污染物具有较好的去除效果,有助于小型河流生态功能的修复,可用于低流速河流和黑臭水体的污染治理。杨垒等[3]利用外源菌剂构建了强化耦合生物膜系统(enhanced hybrid biofilm reactor,EHBR)治理城市明渠污染水体,结果表明,通过增氧曝气及EHBR膜处理,COD值、NH4+-N及总氮 (total nitrogen,TN)浓度分别下降了55%、93%和94%。王荣昌等[5]将自主设计的悬浮载体生物膜反应器(suspended carrier biofilm reactor,SCBR)应用于清华大学万泉河的修复,当水力停留时间控制在1.0 h左右时,SCBR对COD和NH4+-N的平均去除率可分别达到57%和76%。总之,生物膜技术在城镇小微水体原位修复中具有一定的技术优势和应用前景,但由于自然环境的复杂性和对生物膜净化机理(特别是污染物去除的微生物学机制)的研究还不够深入透彻,其大规模实际应用依然任重而道远。
微生物是生物膜发挥污染物降解功能的核心部件。目前,填料表面微生物的附着挂膜过程分为自然成膜和人工接种强化成膜2种方式。自然挂膜方式所形成的生物膜主要为土著微生物,不存在与外源微生物的竞争和生态风险问题,然而该方式成膜周期长且存在生物膜不易形成等弊端;人工接种强化成膜方式可快速形成具有降解功能的生物膜,但外源微生物可能与土著微生物存在竞争关系而不能稳定存在甚至被演替,导致生物膜处理性能降低甚至失效[6]。事实上,天然生物膜(周丛生物)广泛存在于自然水体中,如水生植物根叶表面、消落带砾石表面、河道混凝土岸坡表面等[7-8]。笔者认为,这些原生生物膜可能是生物技术应用过程中更为理想的接种源,在强化水体污染物降解的同时,还可以有效防范生态环境风险、提高系统运行效率。因此,本实验以小微水体混凝土岸坡表面生物膜为研究对象,重点考察光照强度、污染物(氮、磷)浓度对复合生物膜强化微污染水处理效能的影响,解析复合生物膜多路径脱氮除磷机理及微生物群落结构特征,为城镇小微水体微污染水的有效治理提供理论依据。
1. 材料与方法
1.1 实验材料与试剂
实验所用水样以南京林业大学校内紫湖溪(N: 32.07°;E: 118.82°)溪水为基底进行调配,紫湖溪溪水原始水质如下:51~60 mg·L−1 COD,0.08~0.29 mg·L−1 NH4+-N,0.11~0.32 mg·L−1 NO3−-N,0.03~0.04 mg·L−1 NO2−-N,0.21~0.65 mg·L−1 TN,0.003~0.010 mg·L−1 PO43--P,6.65~8.36 mg·L−1 O2,pH为7.71~8.03。为考察光照强度、NH4+-N及PO43--P浓度对复合生物膜去除污染物的影响,将光照强度分别设置为4 000、6 000、8 000 Lux,利用NH4Cl和K2HPO4将原水NH4+-N及PO43--P质量浓度分别调节至2、6、10 mg·L−1和0.5、1、2 mg·L−1,并以此设计正交实验(表1)。实验所用其他试剂均为分析纯,实验用水为超纯水。
表 1 正交实验表Table 1. Orthogonal experimental table组别 光照强度/Lux NH4+-N浓度/(mg·L−1) PO43--P浓度/(mg·L−1) T1 8 000 2 0.5 T2 8 000 6 1 T3 8 000 10 2 T4 6 000 2 1 T5 6 000 6 2 T6 6 000 10 0.5 T7 4 000 2 2 T8 4 000 6 0.5 T9 4 000 10 1 1.2 实验装置及方法
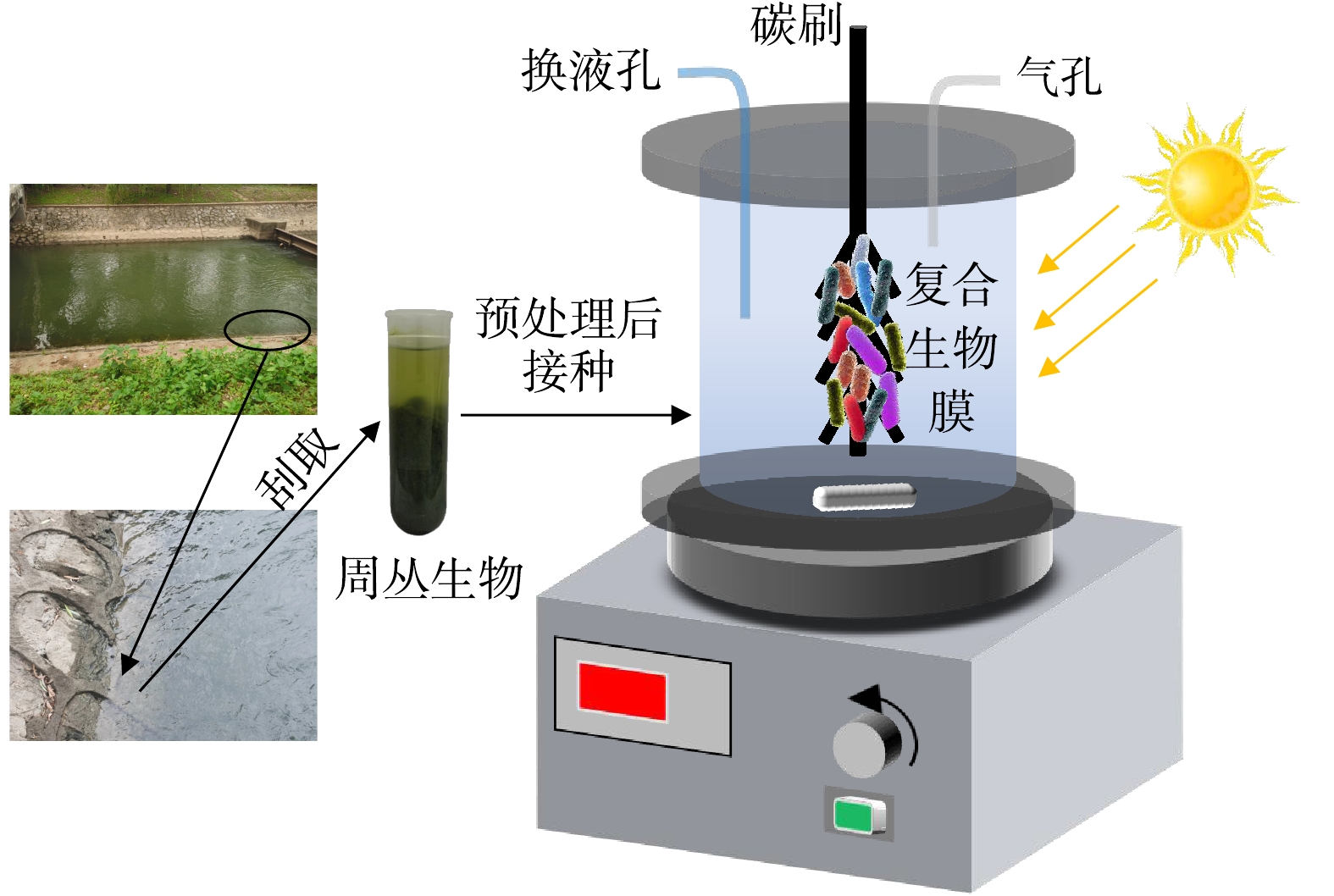
如图1所示,圆柱体实验装置由有机玻璃制成,其高为10 cm,直径为8 cm,有效容积为500 mL,反应装置顶部设置盖板,盖板设置换液孔、气孔及载体安装孔道。周丛生物膜载体为碳纤维刷,刷毛直径为3 cm,刷毛长度为5 cm,总长度为15 cm,碳纤维刷在使用之前先用1 mol·L−1 HCl溶液浸泡12 h,然后用超纯水彻底冲洗,接着再用1 mol·L−1 NaOH溶液浸泡12 h,之后用超纯水彻底冲洗,然后用95%乙醇溶液浸泡12 h,随后在超纯水中浸泡12 h,最后将碳纤维刷置于60 ℃鼓风干燥箱内烘干备用。实验装置接种所用的周丛生物膜取自紫湖溪混凝土岸坡(图1),将周丛生物膜置于摇床中振荡分散,将分散后的周丛生物悬浊液过100目筛,以去除水生植物凋落物和较大的无机碎屑等,然后在4 ℃下以8 000 r·min−1将过筛后的周丛生物悬浊液离心10 min,弃去上清液后向离心管中加入超纯水再次将周丛生物重悬,最后取15 mL重悬污泥接种于实验组反应器(即复合生物膜体系)。此外,另取实验室培养的好氧活性污泥15 mL构建对照组反应器(即单一异养生物膜体系)。重悬污泥和好氧活性污泥的污泥浓度值(mixed liquid suspended solids,MLSS)均为3 000 mg·L−1。
在挂膜启动期间采用LED灯对实验组反应器进行补光照明,光照强度设置为10 000 Lux,连续照明;对照组反应器用锡纸包裹进行遮光并进行曝气,溶解氧(dissolved oxygen,DO)控制在4.0 mg·L−1左右。挂膜期间实验组和对照组反应器进水均为紫湖溪原水,采用磁力搅拌器对反应溶液进行搅拌混匀以免出现短流,每隔48 h换水一次,在至少连续3个换水周期反应器出水均能达到相似污染物去除率时,认为系统挂膜成功。系统挂膜成功后,将紫湖溪原水NH4+-N及PO43--P质量浓度分别调节至5. 0和1.5 mg·L−1,实验组和对照组其他运行条件保持不变,反应器连续运行5个换水周期(48 h),以此考察单一异养生物膜和复合生物膜污染物处理效能的差异性。
之后按照表1所示正交实验表考察光照强度、污染物(氮、磷)浓度对复合生物膜除污性能的影响,实验阶段反应器采用续批式模式运行,换水周期为48 h,每个工况下反应器均运行9个周期(3个适应周期+6个稳定周期),参考自然条件光照变化规律光暗比设置为12 h:12 h。在典型周期污染物去除过程分析中,作为反应器进水,紫湖溪原水NH4+-N及PO43--P质量浓度分别调节至10.0和2.0 mg·L−1,分别在0、12、24、36、48 h对实验组反应器出水进行采样,测定NH4+-N、NO3−-N、NO2−-N、PO43--P、DO质量浓度及pH。为解析复合生物膜的多路径脱氮除磷过程,在主体实验结束后,裁取一部分附着生物膜的碳纤维进行批次活性实验测试,包括硝化(Ⅰ)、反硝化(Ⅱ)、厌氧氨氧化(Ⅲ)、微藻/光合细菌同化及微生物诱导磷酸盐沉淀(Ⅳ),该部分实验采用模拟废水,其主要成分浓度见表2。在第Ⅰ组实验过程中,DO控制在4.0~4.5 mg·L−1,其3#和4#阶段均投加0.1 g·L−1自养硝化抑制剂烯丙基硫脲(allylthiourea,ATU);在第Ⅱ组实验中,1#和2#阶段DO控制在4.0~4.5 mg·L−1,且在1#阶段另投加1 mmol·L−1氯酸盐(NO2−—N抗氧化剂),3#和4#阶段则控制为缺氧条件;第Ⅲ组实验在厌氧条件下进行;在第Ⅳ组实验过程中,光照强度控制在8 000 Lux,在3#阶段另投加20 μmol·L−1二氯苯基二甲脲(光合抑制剂)。如无特殊说明,上述所有实验均在(25±1) ℃的室温下进行。
表 2 复合生物膜脱氮除磷路径探究实验模拟废水水质Table 2. Simulated wastewater quality used in the exploration experiment of nitrogen and phosphorus removal pathways through composite biofilm实验组别 实验阶段 NH4+-N/(mg·L−1) NO2−-N/(mg·L−1) NO3−-N/(mg·L−1) PO43--P/(mg·L−1) NaHCO3/(g·L−1) 乙酸钠/(g·L−1) Ca2+/(mmol·L−1) Ⅰ 1# 5.0 — — — 0.2 — — 2# 5.0 — — — — 0.2 — 3# 5.0 — — — — 0.2 — 4# 5.0 — — — — — — Ⅱ 1# — 5.0 — — — 0.2 — 2# — — 5.0 — — 0.2 — 3# — 5.0 — — — 0.2 — 4# — — 5.0 — — 0.2 — Ⅲ 1# 5.0 6.6 — — 0.2 — — Ⅳ 1# 5.0 — — 1.5 0.2 — — 2# 5.0 — — 1.5 0.2 — 1.0 3# 5.0 — — 1.5 0.2 — 1.0 注:“—”表示无数据。 1.3 检测指标及方法
实验相关水质指标的检测与分析过程参照《水和废水监测分析方法》(第4版)中规定的标准方法,主要的测试分析指标包括COD、NH4+-N、NO2−-N、NO3−-N、TN、PO43--P、pH、DO、Ca2+、总铁(total ferrum, TFe)等。正交实验结果采用SPSS 22.0进行分析。实验结束后,将周丛生物接种污泥与实验组生物膜样品在4 °C下以10 000 r·min−1的转速离心10 min,然后将离心后的样品保存在-80 °C冰箱12 h。微生物DNA提取和PCR扩增过程均交由武汉贝纳科技有限公司完成。本研究利用16S rDNA/ITS/18S rDNA扩增子高通量测序分析复合生物膜的微生物群落组成,其中细菌引物组为338F(ACTCCTACGGGAGGCAGCA)和806R(GGACTACNVGGGTWTCTAAT),真菌引物组为ITS3(GCATCGATGAAGAACGCAGC)和ITS4(TCCTCCGCTTATTGATATGC),真核生物(微藻)引物组为547F(CCAGCASCYGCGGTAATTCC)和V4R(ACTTTCGTTCTTGATYRA)。测序完成后,原始数据经过数据拆分后得到各样本原始序列数据,各样本原始序列数据经过Reads拼接、tags过滤、去嵌合体等步骤得到有效数据(Clean reads),Clean reads在利用DADA2算法降噪后通过UPARSE 软件进行序列分析,以100%相似度进行ASV(Amplicon Sequence Variants)聚类,然后计算样本α和β多样性,评估样本间多样性差异,最后根据NCBI本地BLAST数据库进行物种注释,得到样品在门和属分类水平下的微生物组成及其相对丰度。原始序列数据已上传至CNCB数据库,登录号为CRA019389。实验数据采用Origin 9.0软件进行绘图。
2. 结果与讨论
2.1 单一异养生物膜和复合生物膜污染物处理效能分析
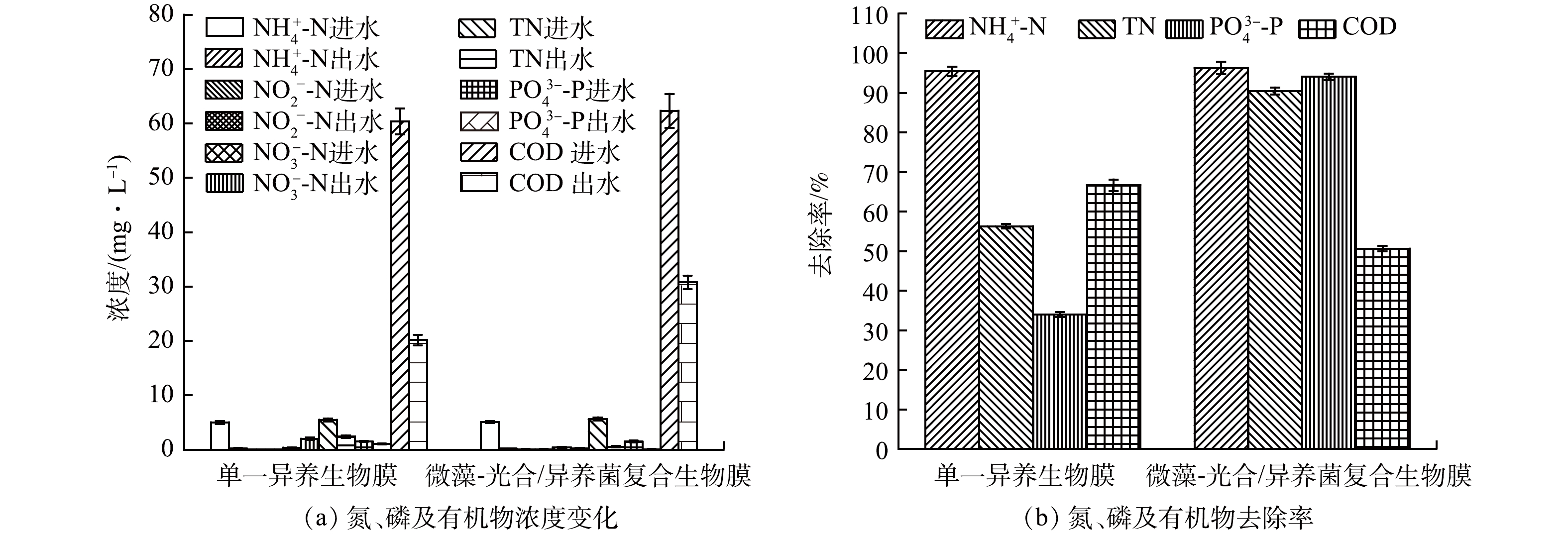
由图2(a)可知,当单一异养生物膜与微藻-光合/异养菌-真菌复合生物膜用于城乡小微水体微污染水处理时,NH4+-N质量浓度分别可从5.02 mg·L−1和5.09 mg·L−1降低至0.23 mg·L−1和0.19 mg·L−1,其相应去除率分别可达95.42%和96.27%(图2(b))。NO2−-N质量浓度基本保持不变,维持在0.06~0.08 mg·L−1,NO3−-N质量浓度分别从进水的0.36 mg·L−1 (单一异养生物膜)和0.39 mg·L−1 (复合生物膜)变化为出水的2.01 mg·L−1和0.21 mg·L−1 (图2(a))。由于NO3−—N的积累,单一异养生物膜体系出水TN质量浓度为2.40 mg·L−1,而复合生物膜体系出水TN质量浓度仅为0.54 mg·L−1 (图2(a)),其相应去除率分别为56.28%和90.43%(图2(b))。在磷去除方面,单一异养生物膜体系和复合生物膜体系PO43--P质量浓度分别从1.53 mg·L−1和1.51 mg·L−1降低至1.01 mg·L−1和0.09 mg·L−1 (图2(a)),其相应去除率分别为33.99%和94.04%(图2(b))。单一异养生物膜体系和复合生物膜体系出水COD值分别为20.16 mg·L−1和30.79 mg·L−1 (图2(a)),去除率分别为66.60%和50.60%。总体来讲,相比于单一异养生物膜体系,复合生物膜对TN和PO43--P的去除效率分别提高了34.15%和60.05%。
上述研究结果表明,在复合生物膜体系中NH4+-N和NO2−-N的转化去除并非小微水体微污染水生物处理的限速步骤,其原因在于自养硝化细菌、异养硝化细菌、异养硝化真菌、厌氧氨氧化菌及光合微生物可能共存于复合生物膜中,进而有效驱动了NH4+-N和NO2−-N的转化去除[9]。此外,通过对比单一异养生物膜和复合生物膜的NH4+-N去除情况,推测微生物硝化过程可能在复合生物膜氮转化中发挥了核心作用。单一异养生物膜体系NO3−-N的积累可能缘于电子供体不足。虽然进水理论碳氮比(COD/TN)约为12左右,但由于进水碳源多为难降解有机物[10],加之异养硝化、好氧异养等过程对碳源的竞争[11],因此造成反硝化不充分及NO3−-N的积累。微污染水中的铁、硫等元素可以驱动NO3−-N的还原[12],然而由于单一异养生物膜体系的高DO(4.0 mg·L−1)环境,铁、硫元素基本处于氧化状态,此时自养反硝化作用可能极为微弱。相比于单一异养生物膜,复合生物膜的高效脱氮主要得益于额外碳源的补充。先前的研究表明,真核微藻等光合微生物可以将CO2转化为有机物,并将其作为碳源提供给反硝化菌[13]。与此同时,光合作用驱动的有机物合成可能造成了复合生物膜COD去除效率的降低。
单一异养生物膜体系较低的PO43--P去除效率表明聚磷菌的同化作用在贫营养条件下较弱。而在复合生物膜中,光合微生物的同化以及微生物诱导磷酸盐沉淀(biologically induced phosphate precipitation, BIPP)过程可能极大地促进了磷的去除。ZHANG等[9]研究表明,微藻的光合作用不仅实现了磷的同化去除,而且有效提升了反应体系溶液的pH,在钙离子存在情况下,PO43--P同时以羟基磷灰石的形式被沉淀去除,微藻同化与BIPP最终承担了大约63.8~70.9%的磷去除量。本研究进水TFe浓度和Ca2+质量浓度分别为10.7 μmol·L−1和600 μmol·L−1左右,据此推测CaP可能是BIPP的主要产物。此外,磷除了可以通过构建细胞有机成分(如磷脂)而被微藻等光合微生物正常吸收外,还可以通过多聚磷酸盐颗粒的形式被光合微生物超量吸收[14],这可能进一步促进磷的高效去除。综上所述,周丛生物可以作为城乡小微水体微污染水生态修复的良好接种源。相比于外源接种物,原生周丛生物可在强化水体污染物降解的同时,达成有效防范生态环境风险发生的目的,这对于城乡水生态环境的可持续保护具有重要的现实意义。
2.2 复合生物膜系统正交实验结果分析
由表3可知,在不同光照强度、NH4+-N及 PO43--P浓度条件下,复合生物膜对NH4+-N、TN、PO43--P及COD的去除率分别为83.1%~98.2%、69.9%~94.1%、77.3%~98.2%及37.9%~53.3%。正交实验的极差分析结果表明(表4),对于城乡小微水体微污染水中NH4+-N、TN、PO43--P及COD去除效果的影响程度而言,光照强度> NH4+-N浓度> PO43--P浓度,此结果表明光照强度对复合生物膜处理性能影响最大;从方差分析结果来看(表4),P(光照强度)均小于0.05,对各项污染物的去除影响显著,而NH4+-N和PO43--P浓度对复合生物膜的处理性能无显著影响。去除NH4+-N和TN对应的最佳光照强度水平为6 000 Lux,去除PO43--P和COD对应的最佳光照强度水平分别为8 000 Lux和6 000 Lux。一方面,光照可影响微藻及光合菌的生长代谢,对氮、磷的吸收产生直接影响;另一方面,光合微生物产生的O2可用于硝化、好氧异养代谢过程,强化NH4+-N的转化与有机物的降解[15]。但光照强度过高,有可能对硝化细菌产生抑制作用并造成有机物的部分累积[9]。再者,过高的DO浓度可能会对反硝化过程产生不良影响,造成TN去除率的降低。随着光照强度的提升,磷的去除率不断提高,这可能是由于光合作用对溶液pH的推升及泌氧极大地促进了BIPP及聚磷菌的好氧磷吸收过程[9, 16]。
表 3 正交实验结果Table 3. Orthogonal experimental results组别 光照强度/Lux NH4+-N /(mg·L−1) PO43--P /(mg·L−1) NH4+-N去除率/% TN去除率/% PO43--P去除率/% COD去除率/% T1 8 000 2 0.5 83.14 69.94 96.93 43.49 T2 8 000 6 1 84.63 71.85 98.23 44.71 T3 8 000 10 2 84.63 72.56 97.22 46.16 T4 6 000 2 1 94.59 87.84 86.96 51.07 T5 6 000 6 2 96.23 91.51 89.45 51.51 T6 6 000 10 0.5 98.24 94.13 86.19 53.27 T7 4 000 2 2 89.63 79.62 78.83 37.88 T8 4 000 6 0.5 90.57 81.79 80.45 40.75 T9 4 000 10 1 92.42 82.34 77.33 41.26 表 4 正交实验极差与方差分析Table 4. Orthogonal range and variance analysis项目 因素 K1 K2 K3 RK F P NH4+-N去除率 光照强度 252.4 273.48 243.75 36.66 170.750 0.006 NH4+-N浓度 267.36 245.15 249.03 7.93 7.963 0.112 PO43--P浓度 271.95 242.03 243.69 1.46 0.300 0.769 TN去除率 光照强度 214.35 273.48 243.75 59.13 300.305 0.003 NH4+-N浓度 237.4 245.15 249.03 11.63 12.046 0.077 PO43--P浓度 245.86 242.03 243.69 2.17 1.267 0.441 PO43--P去除率 光照强度 292.38 262.6 236.61 55.77 1 577.309 0.001 NH4+—N浓度 262.72 268.13 260.74 7.39 29.638 0.033 PO43-—P浓度 263.57 262.52 265.5 2.98 4.627 0.178 COD去除率 光照强度 134.36 155.85 119.89 35.96 258.029 0.004 NH4+-N浓度 132.44 136.97 140.69 8.25 13.454 0.069 PO43--P浓度 137.51 137.04 135.55 1.96 0.825 0.548 2.3 典型周期复合生物膜污染物去除过程分析
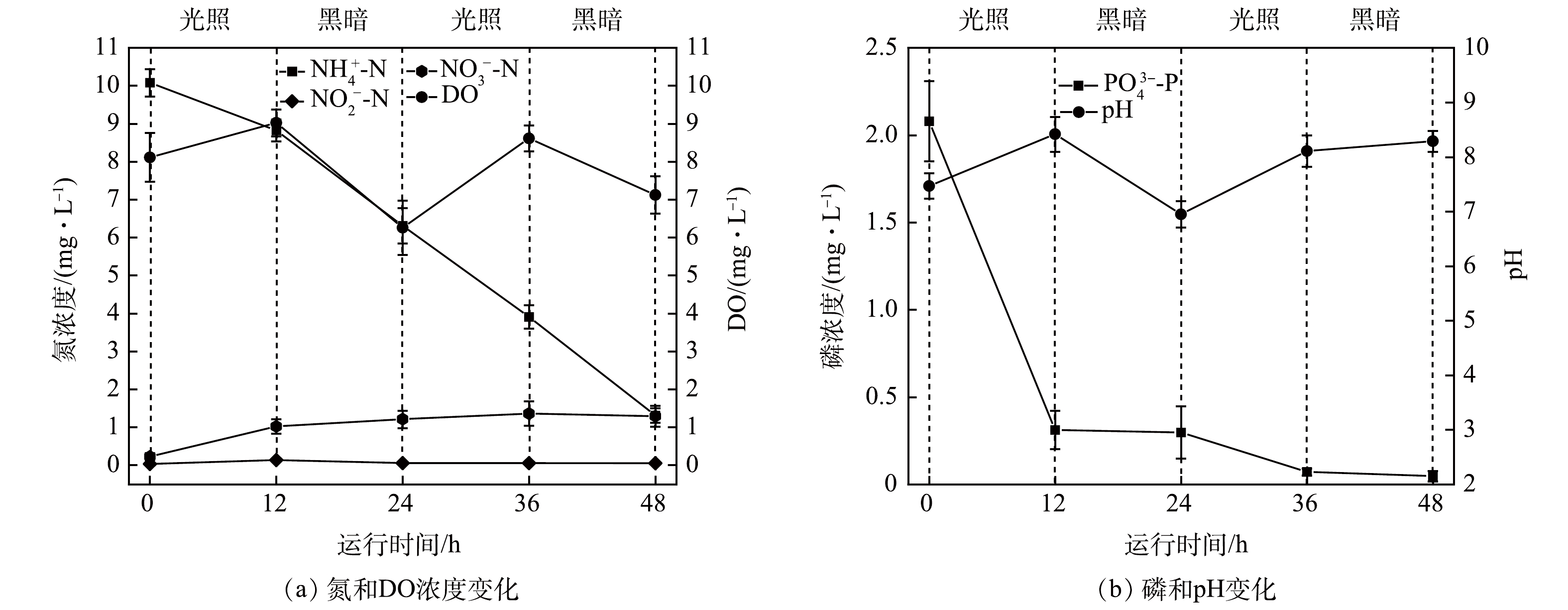
如图3(a)所示,NH4+-N在黑暗和光照条件下的去除速率差异极小,在12~24 h和24~36 h内,NH4+-N去除速率分别为0.21 mg·(L·h)−1和0.20 mg·(L·h)−1。NO2−-N未出现累积,其质量浓度在0.04~0.14 mg·L−1。NO3−-N随着运行时间的延长出现一定程度的积累,在运行末期其累积量为1.29 mg·L−1。DO随着光照/黑暗的切换呈现出波动变化趋势,但其最低浓度维持在6.0 mg·L−1以上。上述结果进一步表明,相比于光合微生物的同化去除,微生物硝化可能在NH4+-N转化过程中发挥了更为关键的作用,特别是异养硝化[9]。NO3−-N的累积一方面可能是因为较高的DO浓度抑制了反硝化相关酶的活性[17],另一方面可能是由于碳源供应不足而引起。虽然微藻光合作用可以合成一定量的有机物用于反硝化过程,但硝化和反硝化步骤可能存在一定程度的错位(即非完全同步硝化反硝化),进而导致异养硝化、好氧异养过程同反硝化过程竞争碳源,造成NO3−-N还原所需电子供体阶段性不足。此外,复合生物膜系统的厌氧氨氧化过程也可能促进了NO3−-N的积累。
如图3(b)所示,复合生物膜在最初的12 h内去除了85.1%的PO43--P,PO43--P去除速率可达0.15 mg·(L·h)−1,随后PO43--P浓度在12~48 h内缓慢下降,最终出水质量浓度为0.05 mg·L−1。pH随着光照/黑暗状态的切换也呈现出波动变化趋势,光照状态下pH可维持在8.0以上。上述结果表明,不同于硝化-反硝化菌主导的生物脱氮过程,磷可能更多是通过沉淀过程及光合微生物的同化吸收被去除[9, 18]。如在黑暗状态下(12~24 h),随着溶液pH的下降及光合微生物代谢活性的减弱,PO43--P去除速率变得极为缓慢(0.000 8 mg·(L·h)−1),也间接表明聚磷菌对磷的去除贡献较小。溶液pH的变化主要由以下过程主导:光合微生物的光合作用、硝化、反硝化及有机物氧化。研究表明,光合微生物代谢过程会消耗部分CO2,导致溶液pH的上升[9],反硝化也会产生一定量的碱度进而推高pH;而硝化和有机物氧化过程均会消耗部分碱度,造成pH的降低。在光照期间,光合微生物的代谢可能较为强烈(由图3(a)所示的DO浓度可推知),其消耗的CO2量超过了硝化及有机物氧化产生的CO2量,由此导致溶液pH不断上升。溶液pH的上升有利于CaP等沉淀的形成,进一步促进磷的去除。而在黑暗状态下,除了硝化及有机物氧化外,微藻等光合微生物的呼吸作用也会产生CO2,造成溶液pH整体呈下降趋势,在光合微生物同化吸收及磷沉淀过程几乎停滞的情况下,磷的去除势必变得缓慢。
2.4 复合生物膜脱氮除磷潜在路径分析
如图4(a)所示,在无光照条件下,当进水不含有机碳源时,无论有无ATU的存在,系统NH4+-N去除率均较低,分别为22.5%(对照组)和22.0%(存在ATU组),相应的NH4+-N去除速率分别为
0.0313 和0.0311 mg·(L·h)−1。结果表明,在复合生物膜系统中,细菌自养硝化和古菌自养硝化反应较为微弱,可能对氮素的转化去除贡献不大。当进水含有有机碳源时,系统对NH4+-N的去除率分别为97.6%(不存在ATU组)和93.8%(存在ATU组),相应的NH4+-N去除速率分别为0.14 mg·(L·h)−1和0.13 mg·(L·h)−1,表明异养硝化可能主导了复合生物膜中NH4+-N的转化过程[11]。如图4(b)所示,在无光照、缺氧及有机碳源存在条件下,复合生物膜系统中NO2−-N和NO3−-N去除率分别为92.0%和99.2%,去除速率分别为0.20 mg·(L·h)−1和0.21 mg·(L·h)−1;而在无光照、曝气及有机碳源存在条件下,复合生物膜系统依然可以实现良好的反硝化性能,其NO2−-N和NO3−-N去除速率分别可达0.16和0.21 mg·(L·h)−1。结果表明,好氧反硝化可能在复合生物膜系统脱氮过程中发挥了重要作用[9]。如图4(c)所示,在黑暗无有机碳源存在条件下,复合生物膜系统中NO2−-N和NH4+-N同步降低被消耗,其化学反应计量比约为1.26~1.32,同时生成了部分NO3−-N,表明厌氧氨氧化过程可能有助于小微水体贫营养条件下氮的去除[19]。如图4(d)所示,在无光合抑制剂存在且Ca2+供应充足的情况下,NH4+-N去除速率为0.11 mg·(L·h)−1,PO43--P去除率高达99.3%,NO2−-N和NO3−-N无明显积累;而当光合抑制剂和Ca2+同时存在时,NH4+-N去除速率仅为0.04 mg·(L·h)−1,PO43--P去除率低至10.7%;无光合抑制剂和Ca2+存在时,PO43--P去除率仅提升至33.1%。上述结果进一步表明,微藻/光合细菌对氮、磷的同化去除作用可能较为有限,然而微生物硝化强烈依赖于光合产氧过程,进而对系统氮去除产生重要影响,CaP沉淀是复合生物膜系统的主要磷汇,但该沉淀过程可能由微藻/光合细菌及钙离子共同驱动,尤其是光合作用营造的碱性溶液环境可能极大地促进了羟基磷灰石的形成[20]。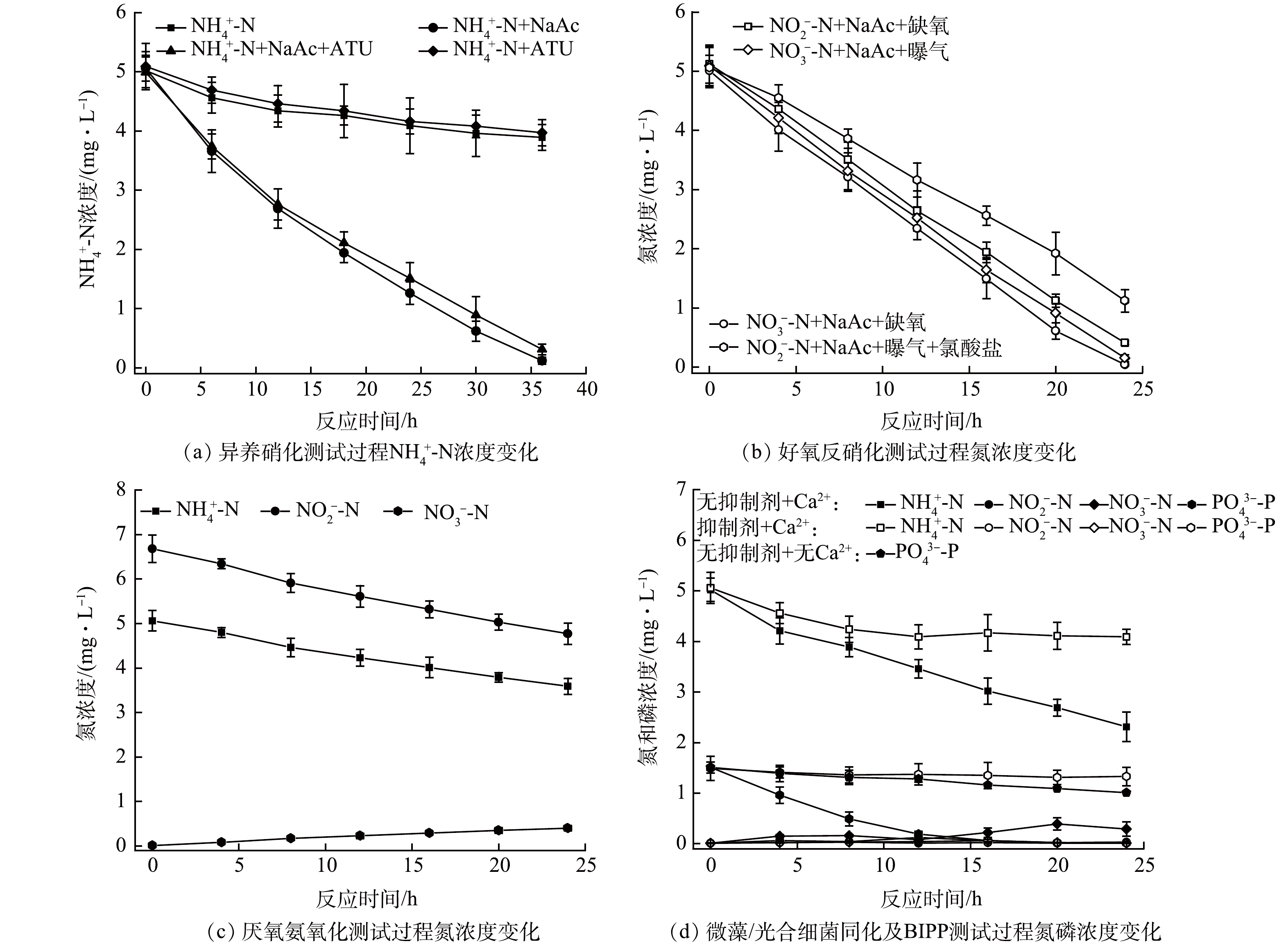 图 4 异养硝化、好氧反硝化、厌氧氨氧化、微藻/光合细菌同化及微生物诱导磷酸盐沉淀验证实验中氮和磷浓度变化Figure 4. Variations of nitrogen and phosphorus concentration in validation experiments of heterotrophic nitrification, aerobic denitrification, anaerobic ammonia oxidation, and microalgae/photosynthetic bacteria assimilation and biologically induced phosphate precipitation
图 4 异养硝化、好氧反硝化、厌氧氨氧化、微藻/光合细菌同化及微生物诱导磷酸盐沉淀验证实验中氮和磷浓度变化Figure 4. Variations of nitrogen and phosphorus concentration in validation experiments of heterotrophic nitrification, aerobic denitrification, anaerobic ammonia oxidation, and microalgae/photosynthetic bacteria assimilation and biologically induced phosphate precipitation2.5 微生物群落结构分析
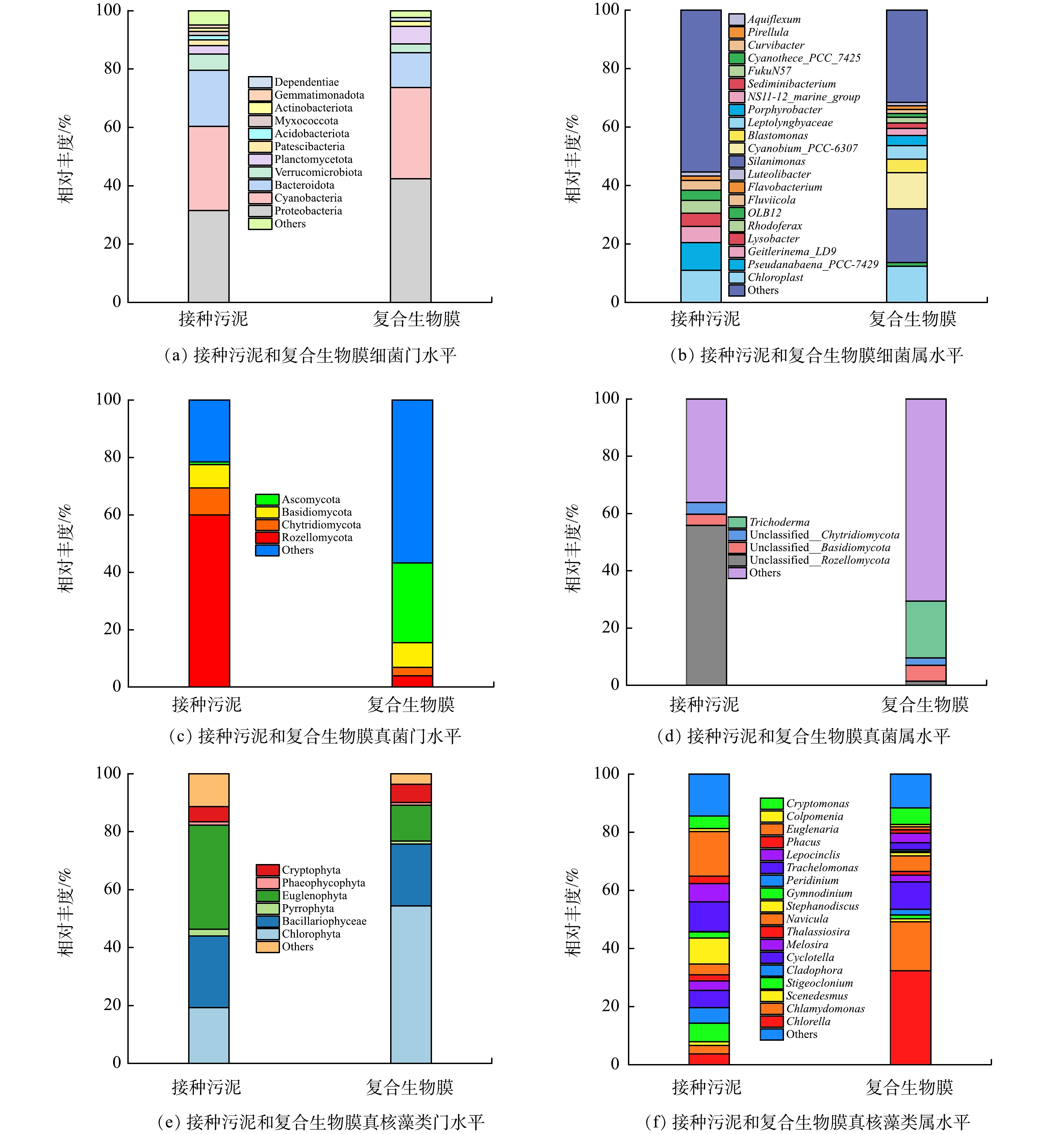
如表5所示,接种污泥(周丛生物)中细菌的ACE和Chao1指数均远大于复合生物膜,表明接种污泥的细菌群落丰富度要远高于复合生物膜;接种污泥细菌的Shannon和Simpson指数分别为8.429和0.988,也大于复合生物膜的6.507和0.97,说明接种污泥的细菌群落多样性要高于复合生物膜。反观真菌、真核藻类的α多样性指数(ACE、Chao1、Shannon和Simpson指数)变化情况(表5),显示其群落丰富度和多样性保持相对稳定。造成这一变化的原因可能是:相比于紫湖溪原水水质,实验用水氮、磷浓度显著提高,而细菌在污染物去除过程中处于核心地位,尤其是氮的转化去除,因此复合生物膜中不适于“较高”污染物浓度的某些原生细菌可能会被淘洗,细菌种属将趋于集中化。此外,从α多样性指数来看,复合生物膜细菌群落的物种丰富度和多样性明显高于真菌和真核生物群落(P<0.05),再次证明了复合生物膜中细菌群落的主体作用[21]。
表 5 接种污泥和复合生物膜的微生物多样性分析Table 5. Microbial diversity analysis of inoculated sludge and composite biofilm物种类别 样品名称 Feature ACE Chao1 Shannon Simpson Faith_pd 细菌 接种污泥 1 742 1 742 1 742 8.429 0.988 101.323 复合生物膜 896 896 896 6.507 0.97 60.694 真菌 接种污泥 347 347 347 4.003 0.749 84.233 复合生物膜 356 356 356 6.122 0.964 66.264 真核藻类 接种污泥 426 427 429 3.365 0.816 81.262 复合生物膜 454 454 456 3.796 0.895 94.367 如图5(a)所示,接种污泥(周丛生物)的主要细菌门为Proteobacteria(31.5%)、Cyanobacteria(28.9%)、Bacteroidota(19.2%)、Verrucomicrobiota(5.5%)、Planctomycetota(2.9%)、Patescibacteria(2.0%)等,复合生物膜的主要细菌门为Proteobacteria(42.4%)、Cyanobacteria(31.2%)、Bacteroidota(11.9%)、Planctomycetota(6.0%)、Verrucomicrobiota(3.1%)、Actinobacteriota(1.8%)等。显然,驯化前后细菌群落的优势菌门并未发生明显变化,而Planctomycetota相对丰度的提高则表明厌氧氨氧化菌可能在复合生物膜中得到了进一步发育[22]。如图5(b)所示,接种污泥(周丛生物)中相对丰度大于1.0%的细菌属包括Chloroplast(11.0%)、Pseudanabaena_PCC-
7429 (9.5%)、Geitlerinema_LD9(5.5%)、Lysobacter(4.5%)、Rhodoferax(4.4%)、OLB12(3.5%)、Fluviicola(3.3%)、Flavobacterium(1.5%)和Luteolibacter(1.4%)。Chloroplast、Pseudanabaena_PCC-7429、Geitlerinema_LD9是常见的光合细菌,属于Cyanobacteria菌门[9, 23-24];Lysobacter常见于沉积物与农田土壤,是一种捕食性细菌,能够驱动天然微生物群落的演化过程[25];Rhodoferax是地表水环境中常见的菌属,可能驱动了有机物的氧化及铁(Ⅲ)的还原过程[26];OLB12、Flavobacterium具有异养硝化-好氧反硝化功能[27-28],可能在自然水体氮循环中发挥了关键作用。总之,在寡营养条件下,接种污泥形成了以光合细菌(蓝细菌)为主体,以捕食性细菌为辅的微生物群落体系。复合生物膜中主要的细菌属包括Silanimonas(18.4%)、Chloroplast(12.4%)、Cyanobium_PCC-6307 (12.3%)、Blastomonas(4.7%)、Leptolyngbyaceae(4.6%)、Porphyrobacter(3.5%)、NS11-12_marine_group(2.4%)、Sediminibacterium(1.9%)、FukuN57(1.9%)、Cyanothece_PCC_7425 (1.4%)、Curvibacter(1.3%)、OLB12(1.3%)、Pirellula(1.2%)、Aquiflexum(1.2%)。Silanimonas是一种典型的兼性好氧异养菌属,其既可以利用有机物进行异养反硝化[29],又可以利用氢气等进行自养反硝化[30]。Chloroplast、Cyanobium_PCC-6307 、Cyanothece_PCC_7425 、Leptolyngbyaceae为Cyanobacteria菌门,其中Cyanobium_PCC-6307 在代谢过程中可能产生释放蓝藻毒素[31]。Blastomonas和Porphyrobacter作为好氧不产氧光合异养细菌,具有降解藻毒素的功能[32-33]。尽管如此,在后续研究中依然要重点关注复合生物膜处理出水的藻毒素生态风险评估与控制。NS11-12_marine_group、Sediminibacterium、Curvibacter、OLB12均已被证实具有反硝化功能[34-36]。作为典型的厌氧氨氧化菌,Pirellula可能有助于贫营养条件下氮的去除[37]。除了归属于Cyanobacteria菌门的Chloroplast、Cyanobium等菌属可以承担除磷功能以外,OLB12也具有聚磷能力[38]。值得注意的是,复合生物膜中与自养硝化过程相关的菌属相对丰度很低,如氨氧化菌Bryobacter[39](0.5%)、完全氨氧化菌Reyranella[40](0.2%)、SM1A02[41](0.09%)、NS9_marine_group[42](0.05%)、Devosia[43](0.04%),因此推测Silanimonas、NS11-12_marine_group、Sediminibacterium除了承担反硝化功能外,还担负了异养硝化任务,即异养硝化-好氧反硝化菌属在氮去除过程发挥了核心作用。如图5(c)所示,Rozellomycota、Chytridiomycota、Basidiomycota、Ascomycota是接种污泥中的优势真菌门,其相对丰度分别为60.0%、9.3%、8.1%和1.0%。复合生物膜优势真菌门为Ascomycota(27.7%)、Basidiomycota(8.7%)和Chytridiomycota(2.9%)。在自然水体中,Rozellomycota和Chytridiomycota常作为捕食者侵染真核藻类[44]。Ascomycota和Basidiomycota被证实具有反硝化功能,并且可以同真核藻类建立协作关系以驱动废水处理[45-46]。如图5(d)所示,Trichoderma是复合生物膜中唯一可被识别的真菌属,其具有异养硝化-好氧反硝化功能,已被发现在土壤氮循环过程发挥了重要作用[47]。
如图5(e)所示,Euglenophyta、Bacillariophyceae、Chlorophyta、Cryptophyta是接种污泥中的优势微藻门,其总相对丰度高达85.2%。复合生物膜的优势微藻门则为Chlorophyta(54.4%)、Bacillariophyceae(21.4%)和Euglenophyta(12.4%)。Chlorophyta、Euglenophyta、Bacillariophyceae、Cryptophyta均是淡水环境中常见的真核藻类[48]。有研究[49]表明,高营养条件有利于Chlorophyta的生长繁殖,这可能是复合生物膜中该微藻门相对丰度能够高占比的主要原因。如图5(f)所示,接种污泥中的优势微藻属为Euglenaria(15.4%)、Trachelomonas(10.2%)、Stephanodiscus(9.0%)、Stigeoclonium(6.3%)、Lepocinclis(6.3%)、Cyclotella(5.9%)、Cladophora(5.4%)、Cryptomonas(4.3%)等。Euglenaria和Trachelomonas是小型水体(如鱼塘、农村池塘等)最常见的微藻属,可能在小微水体物质循环过程中发挥了重要作用[50]。而在复合生物膜,Chlorella(32.4%)、Chlamydomonas(16.8%)、Cyclotella(9.4%)、Cryptomonas(5.7%)、Navicula(5.4%)成为优势属。已有研究表明,在藻菌共生系统中,Chlorella和Chlamydomonas可以协同细菌实现废水处理及能源同步回收[51]。总之,复合生物膜体系中异养硝化-好氧反硝细菌、厌氧氨氧化细菌、自养硝化细菌、反硝化聚磷菌、光合细菌、异养硝化-好氧反硝真菌、真核微藻等功能菌群的富集为多路径脱氮除磷过程的实现奠定了坚实基础。
3. 结论
1)利用周丛生物作为接种源,可以在小试条件下成功构建微藻-光合/异养菌-真菌复合生物膜,并用于小微水体微污染水处理。
2)在最佳运行条件下,复合生物膜对TN和PO43--P的最大去除率分别为94.1%和98.2%。
3)光照强度是影响复合生物膜处理性能最为关键的因素;异养硝化-好氧反硝化、厌氧氨氧化、微藻/光合细菌同化、微生物诱导磷酸盐沉淀等过程共同驱动了复合生物膜中氮、磷的高效稳定去除。
4) Silanimonas、Chloroplast、Blastomonas、Pirellula、OLB12、Bryobacter、Trichoderma、Chlorella等代表性功能菌属的富集为复合生物膜多路径脱氮除磷过程奠定了坚实基础。
-
表 1 奶粉样品相关信息
Table 1. Information about infant milk powder samples
序号No. 奶粉品牌Brand 是否进口Import/Local 阶段Stage 序号No. 奶粉品牌Brand 是否进口Import/Local 阶段Stage 1 A1 是 1段 22 J1 否 2段 2 A2 是 2段 23 K 否 1段 3 B1 否 1段 24 L 是 3段 4 C1 是 1段 25 M1 是 2段 5 C2 否 3段 26 M2 是 2段 6 C3 是 3段 27 M3 是 2段 7 C4 是 3段 28 M4 是 1段 8 C5 是 3段 29 N1 是 1段 9 C6 是 2段 30 O1 是 2段 10 D1 是 2段 31 O3 是 3段 11 E1 否 1段 32 P1 否 2段 12 E2 否 3段 33 Q1 否 2段 13 E3 否 1段 34 Q2 否 3段 14 E4 否 3段 35 R1 是 1段 15 F1 是 1段 36 S1 是 1段 16 F2 是 3段 37 T1 是 3段 17 F3 是 1段 38 T2 是 3段 18 G1 是 2段 39 X1 否 2段 19 H1 是 3段 40 X1 否 1段 20 I1 否 1段 41 Y1 是 3段 21 A1 是 2段 表 2 22种抗生素的回收率、线性范围和检出限(S/N=3)
Table 2. Recoveries (%),linear range, and limits of detection (LODs,S/N=3) of 22 antibiotics
抗生素Antibiotics 替代物Surrogate 相关系数r Correlation 线性范围/(μg·kg−1)Linear range 回收率/%(加标10 μg·kg−1)Recovery LODs/ (μg·kg−1) NOR NOR-d5 0.9974 0.1—500 87.5±7.4 0.09 CIP NOR-d5 0.9987 0.05—500 82.7±11.4 0.08 DIF OFL-d3 0.9985 0.05—500 74.3±10.3 0.08 ENR OFL-d3 0.9990 0.05—500 97.4±8..9 0.08 FLE OFL-d3 0.9984 0.1—500 97.6±6.8 0.04 OFL OFL-d3 0.9988 0.1—500 104.0±8.5 0.06 LOM OFL-d3 0.9967 0.05—500 72.4±3.3 0.05 SAR SAR-d8 0.9992 0.05—200 95.9±4.6 0.09 STZ SMX-d4 0.9974 0.01—500 84.2±5.9 0.04 SMX SMX-d4 0.9991 0.1—500 101.0±4.3 0.06 SIA SMX-d4 0.9987 0.02—500 88.3±2.7 0.06 SPD SMZ-d4 0.9985 0.02—500 98.0±5.3 0.04 SDM SMZ-d4 0.9996 0.01—500 121.0±5.6 0.04 SMZ SMZ-d4 0.9993 0.01—500 102.0±3.7 0.04 SDZ SMZ-d4 0.9986 0.05—500 101.0±3.5 0.04 SMR SMZ-d4 0.9977 0.02—500 107.0±7.1 0.04 SMM SMZ-d4 0.9985 0.02—500 112.0±7.3 0.01 SPI SPI I-d3 0.9980 0.1—500 104.0±5.2 0.08 JOS SPI I-d3 0.9934 0.05—200 84.4±5.6 0.04 TYL SPI I-d3 0.9934 0.05—200 90.0±7.1 0.10 ROX SPI I-d3 0.9905 0.05—500 101.0±6.1 0.04 ERY ERY-13C,d3 0.9992 0.1—500 109.0±5.3 0.04 表 3 婴幼儿配方奶粉中抗生素的浓度(n=41, μg·kg−1)
Table 3. Concentrations of antibiotics in infant milk power
抗生素Antibiotics 最小值Minimum 中位数Median 最大值Maximum 平均值Mean 检出率/%Detection rate NOR <LOD 0.44 5.78 0.68 90.2 CIP 0.15 0.47 9.95 0.87 100 DIF <LOD <LOD 0.54 0.04 12.2 ENR <LOD 0.16 3.76 0.48 90.2 FLE <LOD <LOD 0.68 0.06 26.8 OFL <LOD 0.08 1.55 0.16 58.5 LOM <LOD <LOD 0.84 0.07 39.0 SAR <LOD <LOD 0.92 0.08 36.6 STZ <LOD <LOD 0.30 0.02 17.1 SMX <LOD <LOD 0.50 0.05 39.0 SIA <LOD 0.06 0.77 0.07 51.2 SPD <LOD <LOD <LOD <LOD <LOD SDM <LOD <LOD 0.54 0.03 7.32 SMZ <LOD 0.04 0.43 0.07 58.5 SDZ <LOD <LOD 0.24 0.01 7.32 SMR <LOD 0.04 0.30 0.05 58.5 SMM <LOD <LOD 0.53 0.05 41.5 SPI <LOD <LOD <LOD <LOD <LOD JOS <LOD <LOD <LOD <LOD <LOD TYL <LOD <LOD 0.24 0.01 7.32 ROX <LOD <LOD 1.08 0.06 17.1 ERY <LOD 0.04 0.51 0.08 53.7 ∑QNs 0.49 1.96 20.1 2.92 100 ∑SAs 0.03 0.27 2.93 0.39 100 ∑MCs <LOD 0.05 1.14 0.16 83.0 Total 0.71 2.39 23.1 3.46 100 大类Group 抗生素Antibiotics 简写Abbreviation 主要用途Application 使用量/tUsage amount 人Human 猪Pig 鸡Chicken 其他Other 汇总Summary QNs 诺氟沙星 NOR 医用,兽用 1013 2820 961 644 5440 环丙沙星 CIP 医用,兽用 455 3110 1060 712 5340 双氟沙星 DIF 兽用 0 378 172 117 667 恩诺沙星 ENR 兽用 0 3090 1150 940 5180 氟罗沙星 FLE 医用,兽用 119 60.6 21.6 15.1 216 氧氟沙星 OFL 医用,兽用 1286 2440 832 557 5110 洛美沙星 LOM 医用,兽用 228 650 222 149 1250 沙拉沙星 SAR n.a. n.a. n.a. n.a. n.a. n.a. Total 3101 12549 4419 3134 23203 SAs 磺胺噻唑 STZ 兽用 0.66 40.2 13.7 9.18 63.7 磺胺甲基异恶唑 SMX 医用,兽用 2.0 198 67.6 45.3 313 磺胺二甲基异恶唑 SIA 医用 n.a. n.a. n.a. n.a. n.a. 磺胺吡啶 SPD n.a. n.a. n.a. n.a. n.a. n.a. 磺胺间二甲氧嘧啶 SDM 兽用 n.a. n.a. n.a. n.a. n.a. 磺胺二甲基嘧啶 SMZ 医用,兽用 68.4 388 132 88.7 677 磺胺嘧啶 SDZ 医用,兽用 238 648 221 148 1260 磺胺甲基嘧啶 SMR 医用 n.a. n.a. n.a. n.a. n.a. 磺胺间甲氧嘧啶 SMM 兽用 9.93 1400 477 320 2210 Total 319 2674 911 611 4524 MCs 螺旋霉素 SPI 医用 n.a. n.a. n.a. n.a. n.a. 交沙霉素 JOS n.a. n.a. n.a. n.a. n.a. n.a. 泰乐菌素 TYL 兽用 0 3090 1050 706 4850 红霉素 ERY 医用,兽用 1244 1580 565 377 3770 罗红霉素 ROX 医用,兽用 184 112 67.3 22.5 386 Total 1428 4782 1682 1106 9006 n.a.: 没有数据来源;其他:包括除猪和鸡之外的牛、羊等其他家畜. 表 5 不同阶段奶粉∑QNs、∑SAS和∑MCs浓度的单因素方差分析
Table 5. One-way ANOVA of ∑QNs, ∑SAS and ∑MCs of milk powder at different stages
P 1段 vs 2段 1段 vs 3段 2段 vs 3段 ∑QNs 0.648 0.380 0.195 ∑SAs 0.611 0.309 0.642 ∑MCs 0.263 0.483 0.638 Total 0.678 0.381 0.210 表 6 动物性食品中部分兽药最大残留限量(μg·kg−1) [22]
Table 6. Maximum residue limits of some veterinary drugs in animal foods (μg·kg−1) [22]
抗生素 Antibiotics 标志残留物 Marker residue 动物种类 Animal species 靶组织 Target tissue MRL ADI DIF DIF 所有食品动物 肌肉脂肪 300100 0—10 ENR ENR与CIP总量 所有食品动物 肌肉脂肪 100100 0—2 SAR SAR 鸡 肌肉脂肪 1020 0—0.3 ERY ERY A 所有食品动物 奶 40 0—5 TYL TYL A 牛 奶 50 0—6 SPI SPI总量 牛 奶 100 0—6 SAs SAs总量 牛/羊 奶 100 0—50 MRL:最高残留限量,μg·kg−1;ADI: 日允许摄入量,ng·kg−1·d−1·bw. 表 7 奶粉中抗生素对婴幼儿的日暴露水平(ng·kg−1·d−1·bw)
Table 7. Daily exposure to antibiotics in powdered milk for infants(ng·kg−1·d−1·bw )
抗生素Antibiotics 年龄Age 男Male 女Female 最小值Minimum 最大值Maximum 均值Mean 最小值Minimum 最大值Maximum 均值Mean 喹诺酮类 0—2周 0.00 143 8.22 0.00 190 10.9 2—4周 0.00 137 7.88 0.00 182 10.4 2月 0.00 331 10.2 0.00 430 13.2 3—4月 0.00 139 7.98 0.00 139 7.98 5—6月 0.00 112 7.24 0.00 127 8.21 7—12月 0.00 165 5.96 0.00 177 6.38 13—24月 0.00 47.9 3.94 0.00 50.8 4.17 25—36月 0.00 39.8 3.27 0.00 41.4 3.40 磺胺类 0—2周 0.00 19.0 2.52 0.00 25.3 3.36 2—4周 0.00 18.2 2.42 0.00 24.2 3.21 2月 0.00 44.1 3.12 0.00 57.3 4.05 3—4月 0.00 18.6 2.45 0.00 18.6 2.45 5—6月 0.00 15.0 2.22 0.00 17.0 2.52 7—12月 0.00 8.34 1.83 0.00 8.93 1.96 13—24月 0.00 5.73 1.21 0.00 6.06 1.28 25—36月 0.00 4.76 1.00 0.00 4.95 1.04 大环内酯类 0—2周 0.00 10.4 2.58 0.00 13.8 3.44 2—4周 0.00 9.95 2.47 0.00 13.2 2.39 2月 0.00 24.1 3.19 0.00 31.2 4.14 3—4月 0.00 10.2 2.50 0.00 10.1 2.50 5—6月 0.00 8.18 2.27 0.00 9.28 2.57 7—12月 0.00 18.0 1.87 0.00 19.3 2.00 13—24月 0.00 6.79 1.23 0.00 7.19 1.31 25—36月 0.00 5.64 1.02 0.00 5.87 1.07 -
[1] SUN J T, ZENG Q T, TSANG D C W, et al. Antibiotics in the agricultural soils from the Yangtze River Delta, China [J]. Chemosphere, 2017, 189: 301-308. doi: 10.1016/j.chemosphere.2017.09.040 [2] LIU X H, LU S Y, GUO W, et al. Antibiotics in the aquatic environments: A review of lakes, China [J]. Science of the Total Environment, 2018, 627: 1195-1208. doi: 10.1016/j.scitotenv.2018.01.271 [3] ZHANG Q Q, YING G G, PAN C G, et al. Comprehensive evaluation of antibiotics emission and fate in the river basins of China: Source analysis, multimedia modeling, and linkage to bacterial resistance [J]. Environmental Science & Technology, 2015, 49(11): 6772-6782. [4] 蒋波. 奶及奶制品安全问题及抗生素残留检测技术概述 [J]. 中兽医学杂志, 2018(7): 70-71. JIANG B. Summary of safety problems of milk and dairy products and detection technology of antibiotic residues [J]. Chinese Journal of Traditional Veterinary Science, 2018(7): 70-71(in Chinese).
[5] HUANG R C, GUO Z T, GAO S T, et al. Assessment of veterinary antibiotics from animal manure-amended soil to growing alfalfa, alfalfa silage, and milk [J]. Ecotoxicology and Environmental Safety, 2021, 224: 112699. doi: 10.1016/j.ecoenv.2021.112699 [6] LU G Y, CHEN Q, LI Y P, et al. Status of antibiotic residues and detection techniques used in Chinese milk: A systematic review based on cross-sectional surveillance data [J]. Food Research International, 2021, 147: 110450. doi: 10.1016/j.foodres.2021.110450 [7] KARAMI-OSBOO R, MIRI R, JAVIDNIA K, et al. Extraction and determination of sulfadiazine and sulfathiazole in milk using magnetic solid phase extraction-HPLC-UV [J]. Analytical Methods, 2015, 7(4): 1586-1589. doi: 10.1039/C4AY02503B [8] MORETTI S, CRUCIANI G, ROMANELLI S, et al. Multiclass method for the determination of 62 antibiotics in milk [J]. Journal of Mass Spectrometry, 2016, 51(9): 792-804. doi: 10.1002/jms.3834 [9] ZHANG Y D, ZHENG N, HAN R W, et al. Occurrence of tetracyclines, sulfonamides, sulfamethazine and quinolones in pasteurized milk and UHT milk in China’s market [J]. Food Control, 2014, 36(1): 238-242. doi: 10.1016/j.foodcont.2013.08.012 [10] WANG H X, REN L S, YU X, et al. Antibiotic residues in meat, milk and aquatic products in Shanghai and human exposure assessment [J]. Food Control, 2017, 80: 217-225. doi: 10.1016/j.foodcont.2017.04.034 [11] 马娅, 马丽娜, 史俊杰, 等. 牛奶中抗生素残留检测的研究现状 [J]. 山东化工, 2020, 49(17): 83-84. doi: 10.3969/j.issn.1008-021X.2020.17.031 MA Y, MA L N, SHI J J, et al. Research status of antibiotic residue detection in milk [J]. Shandong Chemical Industry, 2020, 49(17): 83-84(in Chinese). doi: 10.3969/j.issn.1008-021X.2020.17.031
[12] 张律, 卓菲, 岳亚军. 深圳市售奶粉中11种喹诺酮类抗生素含量检测分析 [J]. 食品安全质量检测学报, 2020, 11(11): 3665-3671. doi: 10.19812/j.cnki.jfsq11-5956/ts.2020.11.053 ZHANG L, ZHUO F, YUE Y J. Detection and analysis on 11 kinds of quinolones antibiotics in Shenzhen market milk powder [J]. Journal of Food Safety & Quality, 2020, 11(11): 3665-3671(in Chinese). doi: 10.19812/j.cnki.jfsq11-5956/ts.2020.11.053
[13] TIAN H, WANG J Q, ZHANG Y D, et al. Quantitative multiresidue analysis of antibiotics in milk and milk powder by ultra-performance liquid chromatography coupled to tandem quadrupole mass spectrometry [J]. Journal of Chromatography B, 2016, 1033/1034: 172-179. doi: 10.1016/j.jchromb.2016.08.023 [14] 陆峥, 王丽丽, 王迪, 等. 国产婴幼儿配方奶粉及婴幼儿米粉中阪崎肠杆菌分离株的药敏分析 [J]. 中国卫生检验杂志, 2008, 18(11): 2301-2302,2310. doi: 10.3969/j.issn.1004-8685.2008.11.049 LU Z, WANG L L, WANG D, et al. Antibiotic susceptibility of Enterobacter sakazakii isolated from milk powder and rice powder for infant and young children [J]. Chinese Journal of Health Laboratory Technology, 2008, 18(11): 2301-2302,2310(in Chinese). doi: 10.3969/j.issn.1004-8685.2008.11.049
[15] 周显凤, 高建新, 龙慧, 等. 婴幼儿配方奶粉中肺炎克雷伯菌与阪崎肠杆菌分离株的药敏分析 [J]. 现代预防医学, 2012, 39(6): 1511-1513. ZHOU X F, GAO J X, LONG H, et al. Antibiotic susceptibility of Klebsiella pneumoniae and Enterobacter sakazakii isolated from powdered infant formula [J]. Modern Preventive Medicine, 2012, 39(6): 1511-1513(in Chinese).
[16] EPA. Exposure factors handbook: 2011edition [EB/OL]. U.S.Environmental Protection Agency, Washington, DC, USA, 2011[2023-2-27].https://www.epa.gov/expobox/exposure-factors-handbook-2011-edition [17] LI W H, SHI Y L, GAO L H, et al. Occurrence of antibiotics in water, sediments, aquatic plants, and animals from Baiyangdian Lake in North China [J]. Chemosphere, 2012, 89(11): 1307-1315. doi: 10.1016/j.chemosphere.2012.05.079 [18] KÜMMERER K. Antibiotics in the aquatic environment–A review–Part I [J]. Chemosphere, 2009, 75(4): 417-434. doi: 10.1016/j.chemosphere.2008.11.086 [19] KUMAR K, GUPTA S C, BAIDOO S K, et al. Antibiotic uptake by plants from soil fertilized with animal manure [J]. Journal of Environmental Quality, 2005, 34(6): 2082-2085. doi: 10.2134/jeq2005.0026 [20] 程兆康. 典型抗生素在土壤-生菜系统和市售牛奶中的残留及其风险评价[D]. 南京: 南京信息工程大学, 2022. CHENG Z K. Residues and risk assessment of typical antibiotics in soil-lettuce system and milk on the market[D]. Nanjing: Nanjing University of Information Science & Technology, 2022 (in Chinese).
[21] 吴小莲, 莫测辉, 李彦文, 等. 蔬菜中喹诺酮类抗生素污染探查与风险评价: 以广州市超市蔬菜为例 [J]. 环境科学, 2011, 32(6): 1703-1709. WU X L, MO C H, LI Y W, et al. Investigation and heath risk assessment of quinolone antibiotics in vegetables: Taking supermarket vegetables of Guangzhou city for an exemple [J]. Environmental Science, 2011, 32(6): 1703-1709(in Chinese).
[22] 农业部. 动物性食品中兽药最高残留限量[EB/OL]. [2023-2-27]. http://www.moa.gov.cn/gk/tzgg_1/gg/200302/P020050610333735313696.doc [23] 卫生部. 中国7岁以下儿童生长发育参照标准 [EB/OL]. [2023-2-27]. http://www.nhc.gov.cn/cmsresources/mohfybjysqwss/cmsrsdocument/doc6260.doc [24] 谢跃杰, 王仲明, 熊政委, 等. 配方奶粉和母乳中结构脂质差异及其对婴幼儿生理功能的影响研究进展[J]. 食品科学, 2018, 39(21) : 293-298. XIE Y J, WANG Z M, XIONG Z W, et al. Differences in structural lipids between infant formula and breast milk and their effects on physiological functions of infants. Journal of Food Science, 2018, 39(21) : 293-298 (in Chinese)
[25] 袁蕊, 崔霞, 刘平, 等. 2021年北京市售婴幼儿配方奶粉中氯丙醇酯和缩水甘油酯污染状况及暴露风险初步评估 [J]. 卫生研究, 2022, 51(4): 645-649,679. doi: 10.19813/j.cnki.weishengyanjiu.2022.04.024 YUAN R, CUI X, LIU P, et al. Contamination characteristics and preliminaery exposure risk assessment of chloropropanol esters and glycidyl esters in infant formula sold in Beijing in 2021 [J]. Journal of Hygiene Research, 2022, 51(4): 645-649,679(in Chinese). doi: 10.19813/j.cnki.weishengyanjiu.2022.04.024
-




 DownLoad:
DownLoad: