-
多环芳烃(polycyclic aromatic hydrocarbons, PAHs)是一类环境中广泛存在的有机污染物,主要来自于人为源,如石油泄漏、汽车排放、化石燃料和生物质燃烧、工业过程以及化学制造,也有部分来自火山活动、森林火灾和成岩作用等自然源[1-2]. 这类污染物因其分布广、生物累积性和对人类的潜在生态风险[3]而受到广泛关注. 16种PAHs被美国环境保护署(USEPA)列为优先控制的污染物[4]. 其中,含有2—3个苯环的低分子量PAHs被认为是非致癌物,而含有4—6个环的7个高分子量PAHs被列为致癌物[5]. PAHs一旦释放到环境中,能够通过水和空气进行长距离的迁移,扩散到全球范围的土壤[6-7]、沉积物[8-9]、水[10]和大气[11-12]中. PAHs不易降解,容易被土壤颗粒吸附[13-14],因此土壤埋藏了环境中90%以上的PAHs,是一个重要的汇[15].
尽管存在一些自然来源,造成全球范围内PAHs污染的主要原因仍是与城市化密切相关的人为排放[16]. 许多发展中国家,尤其是中国,正处于城市化兴起与快速发展的过渡时期. 由于大规模的城市化和工业化,我国城市地区大量人口密集,随之出现工业活动加剧、汽车使用激增等现象,从而导致大量PAHs通过大气沉降进入城市土壤[17-18]. 此外,PAHs在城市土壤中的分布主要归因于其释放源的类型和位置[19-20]. 因此,加剧的人类活动可能会改变城市土壤环境中PAHs的组成和分布. 基于不同PAH毒性的差异性,组成的改变也可能会引起暴露人群健康风险的变化. 然而,这个问题迄今为止较少引起关注[21].
研究表明,城市化可能是影响城市土壤中PAHs环境行为的关键因素. Wang等[22]通过分析土壤PAHs浓度、城市化指标以及土壤理化性质之间的相关性,提出人口密度是影响南京城市土壤PAHs含量的关键因素之一. Cao等[21]基于苏南一个快速发展的城镇土壤中2009年和2014年PAHs的浓度,将其含量、组成和来源的变化归因于城市化进程. Jensen等[23]发现挪威南部邻近奥斯陆的地区,因其人口较多和城市化程度较高,土壤中PAHs浓度高于位于挪威北部,人口较少的地区. 此外,也有一些学者[19, 24-26]利用湖泊和水库中的柱状沉积物,以及不同城市化阶段或不同深度的土壤样品,探讨PAHs的环境行为与城市化过程之间的关系. 然而,深入探讨某个特定时期城市化进程对城市土壤中PAHs浓度、来源和暴露风险影响的研究却很少.
2008年至2012年,天津市处在城市化最快的时期[27],且2012年以前,全市生产总值(GDP)增速均保持在16%以上,为近15年来最高水平[28]. 本研究基于天津市近郊地区(包括西青区、津南区、北辰区和东丽区)土壤中的16种优先控制PAHs的浓度数据,利用正定矩阵因子分解(positive matrix factorization, PMF)模型和终身累积癌症风险(incremental lifetime cancer risk, ILCR)模型定量解析出2008年和2012年天津市近郊地区土壤中PAHs的来源组成以及人体暴露风险,并将两个年份的解析结果进行对比分析. 旨在通过定点定期的监测结果,探讨在经济高速发展的背景下,快速城市化过程中区域土壤中PAHs排放源的变化及其引起的浓度、组成和生态风险的改变,进而揭示人类活动对城市环境的影响.
-
2008年8月[29]和2012年10月[30]在天津市近郊地区(西青区、津南区、北辰区和东丽区)使用不锈钢勺分别采集获得83个和60个土壤样品(表层0—10 cm,各1 kg),并储存在聚乙烯密封袋中. 每1个样品由10—20个采自于站位点周边10×10 m2范围内的子样品混合而成. 每次采样之前使用丙酮冲洗不锈钢勺防止沾污. 所有土壤样品均放置在暗处,并尽快运送到实验室,经风干、研磨、过筛(50目)之后,于−20 ℃环境下保存.
-
采用加速溶剂萃取法(accelerated solvent extraction, ASE)对土壤样品进行萃取. 取16 g冻干土壤样品和5 g二氧化硅混匀后倒入34 mL ASE样品瓶,以丙酮与二氯甲烷(1:1体积比)混合溶液为萃取溶剂,将样品在温度和压力分别为120 °C和1500 psi的条件下萃取2次,每次5分钟,所得的提取液蒸发至近干,加入9 mL环己烷与丙酮(1:1体积比)的混合溶液. 替换溶剂之后的提取液依次使用凝胶色谱(LCTech Geremany)和弗罗里硅固相萃取柱进行纯化,所得洗脱液经氮吹浓缩至1 mL转入棕色安捷伦进样瓶中上机分析. 采用GC-MS方法对PAHs进行定量分析,仪器参数和分析方法的质量控制见文献[29]. 16种PAHs包括萘(NAP)、苊(ACE)、芴(FLO)、二氢苊(ACY)、菲(PHE)、蒽(ANT)、荧蒽(FLA)、芘(PYR)、䓛(CHR)、苯并(a)蒽(BaA)、苯并(b)荧蒽(BbF)、苯并(k)荧蒽(BkF)、苯并(a)芘(BaP)、二苯并(a,h)蒽(DahA)、苯并(g,h,i)苝(BghiP)和茚苯(1,2,3-cd)芘(IcdP). PAHs加标回收率和指示物回收率分别为62.2%—116.7%和70.6%—119.1%.
-
PMF是由Paatero和Tapper[31]开发的,基于主成分分析的非负约束受体模型,常用于环境中PAHs的源解析[32]. 该模型的矩阵方程式为:
式中,X代表由n个样品的m种化合物的浓度组成的样品浓度数据矩阵;G代表主要源的贡献率矩阵(n×p,p为源的个数);F代表主要源的成分谱矩阵(p×m);E代表残差矩阵(n×m),定义为:
式中,eij、xij、gik和fkj分别为E、X、G和F中的对应元素. 在对F和G进行非负约束的同时,对每个数据点的不确定性进行加权. Q是模型的判据之一,当其收敛时才可进一步分析,且多次运行选Q较小的值来继续分析. Q的计算公式为:
式中σij为第i个样品中第j种化合物的不确定性,其他项含义如前文所述.
本研究利用USEPA开发的PMF模型软件5.0,基于83(样品)×16(PAHs)数据集和60(样品)×16(PAHs)数据集,分别对2008年和2012年天津市近郊地区土壤中PAHs来源进行识别. 模型解析目标设置为计算出3到6个因子,且每次运行都用不同的起始点进行初始化. 对于每次运行,正定矩阵因子分解模型的样品数符合模型对最少样本量的需求,即样本数大于物种数的3倍[33].
-
利用ILCR模型可定量评估城市居民通过摄入、皮肤接触和吸入3种方式暴露于土壤PAHs的潜在健康风险[34-35]. 基于USEPA标准模型计算潜在癌症风险的方程式[36-37]如下.
其中,CS是土壤中PAHs基于BaP的毒性当量[1](toxic equivalency factor, TEF)计算的转换浓度之和(mg·kg−1);CSF是致癌物斜率因子(mg·kg−1·d−1)−1, 根据BaP的致癌能力进行测定;BW是体重;IRingestion和IRinhalation人体土壤摄入效率和吸入效率;EF代表暴露频率;ED是暴露时长;SA是皮肤表面积;AF是真皮粘附因子;ABS为真皮吸附因子;AT为平均寿命;PEF为颗粒释放因子(见表1). BaP的CSFingestion、CSFdermal和CSFinhalation分别为7.3、25、3.85(mg·kg−1·d−1)-1[38].
1991年USEPA发布的指南指出[37],百万分之一的癌症发病几率(ILCR = 10−6)是可接受的阈值. 因此,依据ILCR的判断标准如下:ILCR ≤ 10−6时代表可忽略风险;10−6 < ILCR < 10−4表示低风险;ILCR ≥ 10−4表示癌症高风险,需要特别关注. 在本研究中,依据年龄将居民分为儿童(0—10岁)、青少年(11—18岁)和成人(19—70岁)的3个群体进行癌症风险评估.
-
利用Origin2019软件进行数据记录、数据处理以及表格制作;利用USEPA PMF 5.0软件进行PAHs来源识别及贡献计算. 天津市及其区县社会经济发展的数据分别引自2009年、2013年、2014年和2015年天津统计年鉴[28].
-
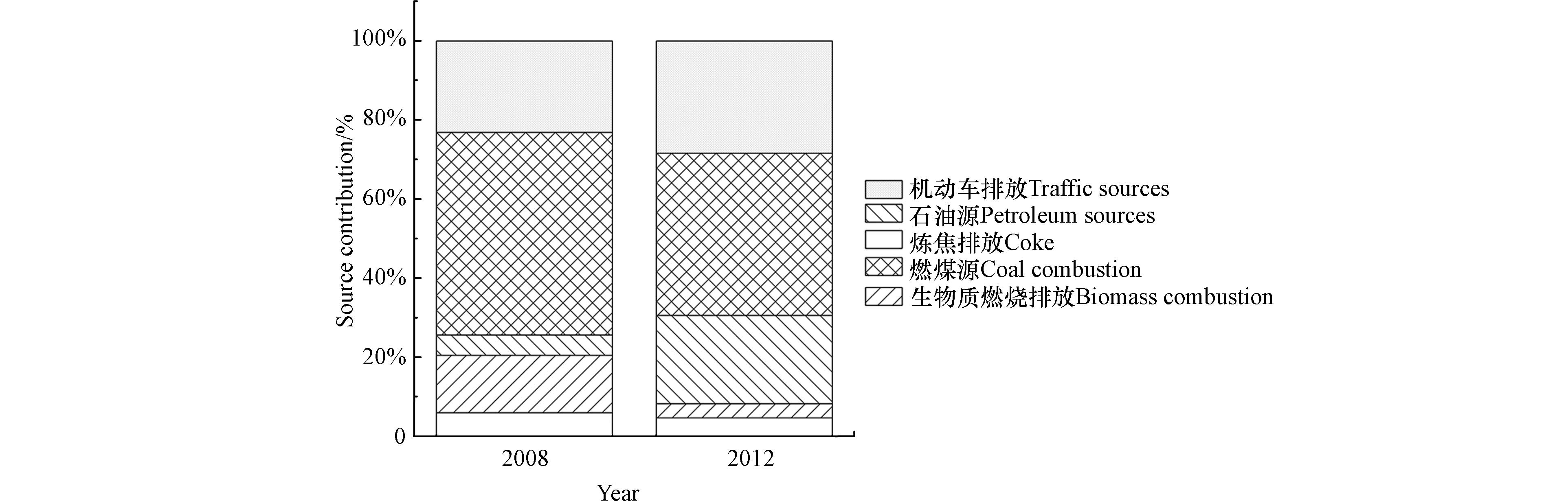
2008年至2012年,天津市近郊地区表层土壤中16种PAHs浓度呈倍数增长,7种致癌PAHs浓度也呈上升趋势. 如表2所示,五环化合物的浓度占比大幅度下降,而二环和四环化合物的占比均显著增加, 低分子量组分的比例由28.6%上升到34.8%. 优势化合物由苯并(b)荧蒽、荧蒽和苯并(g, h, i)苝转变为菲、萘和荧蒽. 萘、二氢苊、菲等低分子量PAHs的浓度明显增加. 虽然PAHs被认为是持久性有机污染物能长期存在于环境中,但其仍可通过光化学降解、生物降解和挥发作用从土壤中去除[40]. 以往的研究发现[21, 41],PAHs在土壤中长期埋藏后,浓度会显著下降. 另外,具有不同个数苯环的PAHs在土壤中表现出不同的环境行为[15]. 高分子量的PAHs通常能在土壤中埋藏较长时间,其降解速率随着分子量的增加而降低[42],而低分子量的更容易被光降解或生物降解. 因此,总浓度以及低分子量组分占比的增加,表明土壤环境中存在持续不断的PAHs输入,且污染状况趋于严重,这与该地区5年内经济高速发展,城市化进程加快有着密切的关系. 2008年西青区、津南区、北辰区和东丽区的常住人口总计228.59万,区县生产总值(GDP)共计1336.66亿元[28]. 2012年,4个区的常住人口增加到283.03万,区县生产总值(GDP)增加了近一倍,达到2552.27亿元[28]. 通常来说,人为源是环境中PAHs急剧增加的主要原因. 城市土壤中的PAHs主要来源于工业活动、机动车排放以及居民烹饪和取暖,因此,其受到区域经济发展水平、人口和工业化程度的影响[22, 43].
-
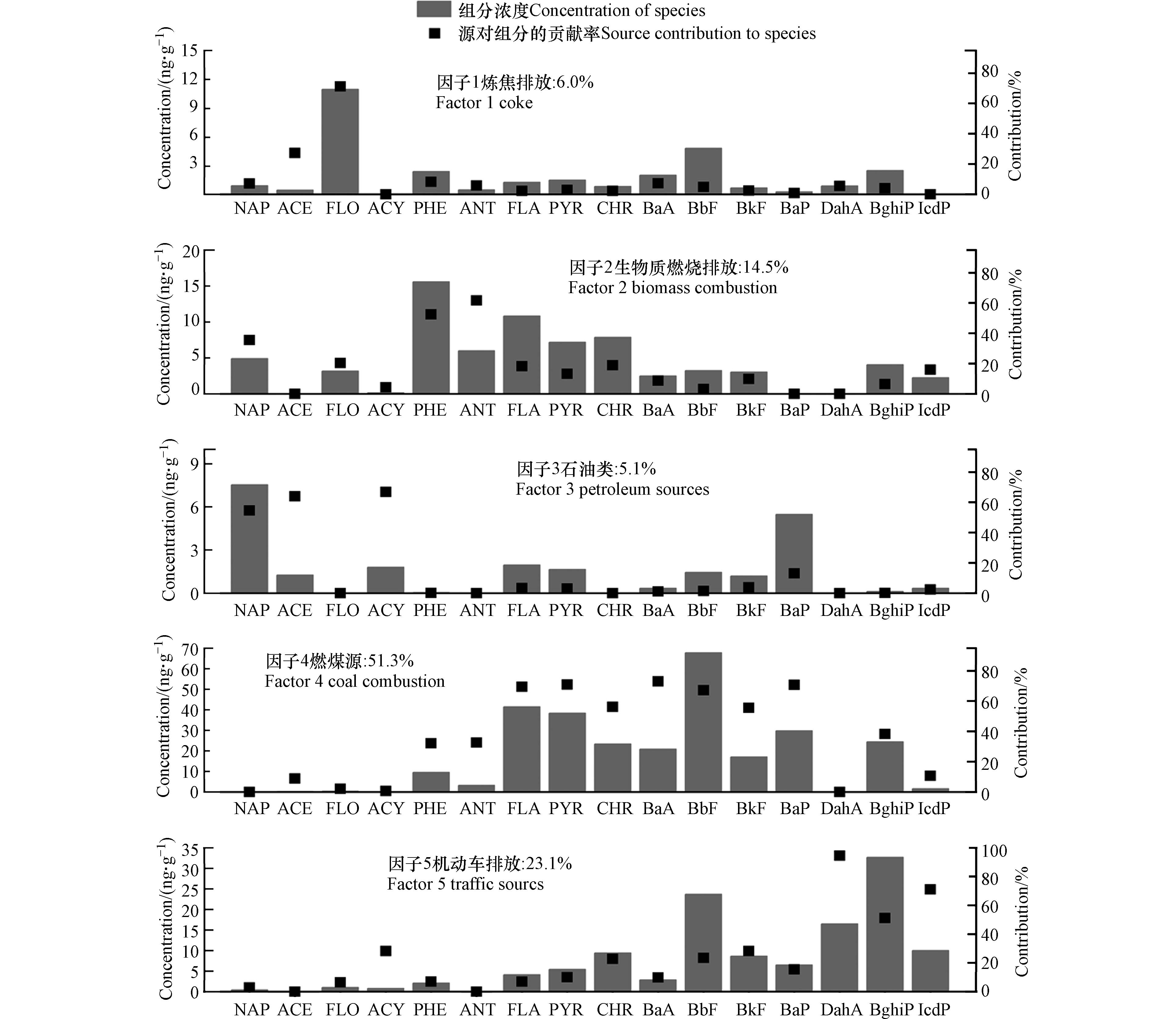
2008年PAHs来源成分谱如图1所示,模型筛选出5个因子. 因子1中表征炼焦生产的芴[44]占比达到71.2%,推断该因子代表炼焦排放,其贡献为6.0%. 因子2中蒽和菲的占比较高,分别为61.6%和52.5%,符合生物质燃烧的排放特征[16, 45],推断因子2为生物质燃烧排放,其贡献为14.5%. 因子3中优势组分为萘、苊和二氢苊,占比分别为54.6%、63.9%和66.9%. 萘是原油和石油产品的重要组成部分[46-48],并且二环和三环PAHs多与石油类来源有关[49-51]. 因此,因子3表示石油源,其贡献为5.1%. 因子4中荧蒽(69.5%)、芘(70.8%)、䓛(56.2%)、苯并(a)蒽(72.9%)、苯并(b)荧蒽(67.1%)、苯并(k)荧蒽(55.6%)和苯并(a)芘(70.7%)占比较高,符合煤燃烧排放特征[16, 52-55]. 因此,因子4表示燃煤源,其贡献为51.3%. 因子5中表征汽车尾气[16, 56-57]的二苯并(a,h)蒽、茚苯(1,2,3-cd)芘和苯并(g,h,i)苝占比较高,分别为94.6%、51.2%和71.0%,推断该因子代表机动车排放,其贡献为23.1%.
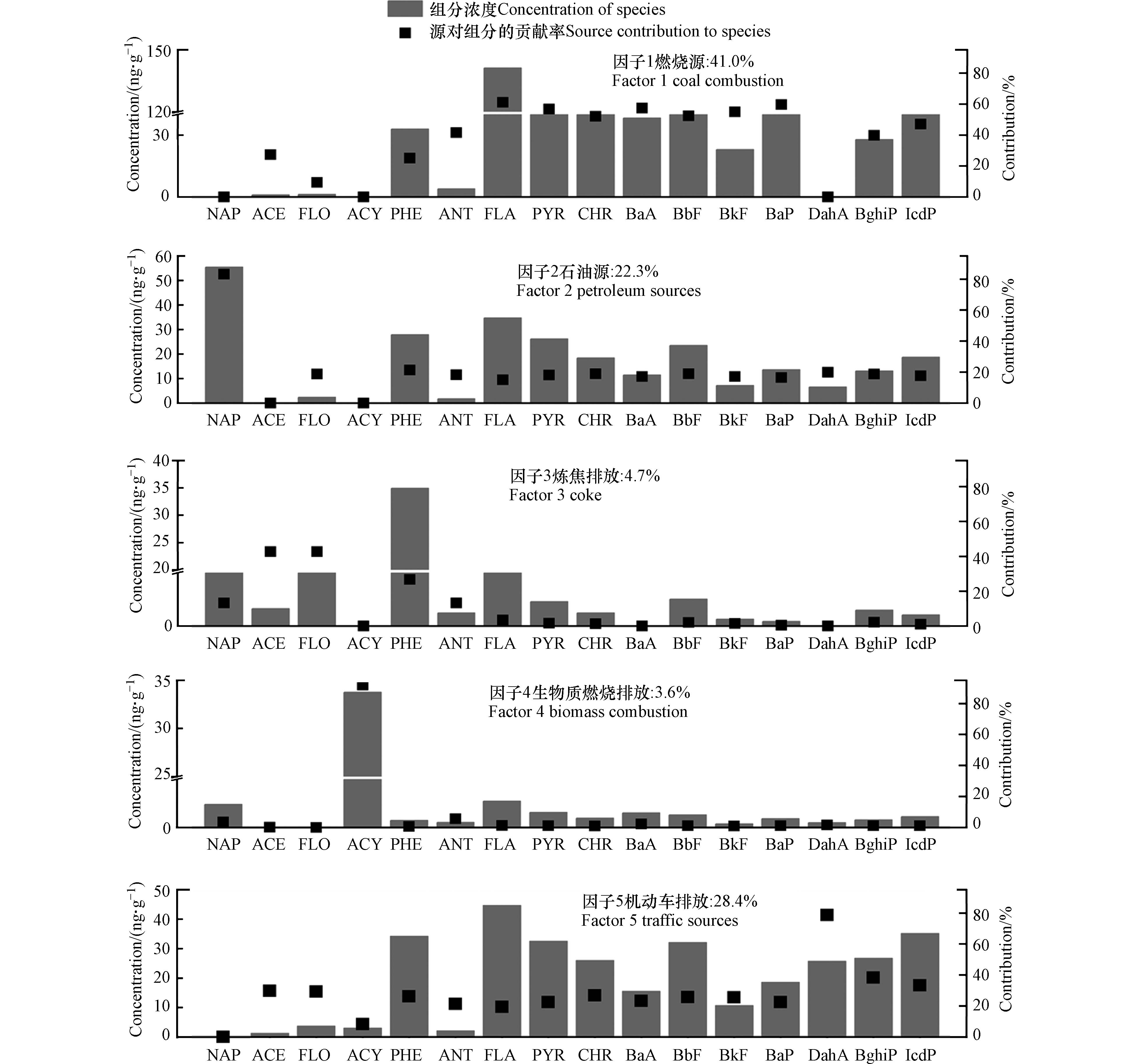
2012年PAHs来源成分谱如图2所示,模型也筛选出5个因子. 因子1中荧蒽、芘、䓛、苯并(a)蒽、苯并(b)荧蒽、苯并(k)荧蒽和苯并(a)芘占比较高,分别为61.1%、56.8%、52.0%、57.5%、52.4%、55.0%和59.6%,符合煤燃烧排放特征[16, 52-55]. 因此,因子1表示燃煤源,其贡献为41.0%. 因子2中表征原油和石油产品的萘[46-48]占比达83.2%,推断该因子为石油源,其贡献为22.3%. 因子3中苊、芴和菲占比相对较高,其中芴和菲的占比分别为42.6%和26.8%,是炼焦生产的表征化合物[44, 55]. 因此,因子3应该与焦炭的生产密切相关,其贡献为4.7%. 因子4中生物质燃烧过程排放的优势化合物二氢苊[44-45]占比高达91.8%,推断该因子代表生物质燃烧排放,其贡献为3.6%. 因子5中的优势组分为二苯并(a,h)蒽、茚苯(1,2,3-cd)芘和苯并(g,h,i)苝,占比分别为78.7%、38.3%和33.2%,符合汽车尾气排放特征[16, 56-57]. 因此,推断该因子代表机动车排放,其贡献为28.4%.
基于上述PMF的解析结果发现,天津市近郊区域土壤中PAHs来源贡献率变化较大的是燃煤源、生物质燃烧排放和石油源. 其中,燃煤源和生物质燃烧排放的贡献率分别由2008年的51.3%和14.5%下降到2012年的41.0%和3.6%(图3). 虽然煤炭是天津市工业的主要能源,但是燃煤源的贡献率在5年内下降了10.3%. 此外,根据地理位置和居民的生活习惯,调查区域的生物质燃烧应与露天焚烧秸秆和居民烹饪有关. 2008年天津市启动生态城市建设行动计划,包括生态区县建设,改善水、空气、生态环境质量,提升固体废物综合利用水平,加强农村环境污染防治,发展循环经济等7个方面. 为了实现节能减排、改善城市环境质量,很多企业在生产过程中使用电力、天然气等清洁能源取代了煤炭,到2012年,天津市单位工业增加值能耗由2008年的1.16吨标准煤每万元下降到0.95吨标准煤每万元. 因此,燃煤源贡献率的下降可能与该区域工业化发展过程中能源结构的变化、装备和技术的不断发展有关. 另一方面,生物质燃烧排放贡献率的下降则可能与禁止露天生物质燃烧,以及电力和液化石油气取代了生物质作为烹饪燃料有关.
但是,5年内石油源的贡献率却由5.1%上升到22.3%. 天津作为我国北部重要的工业城市,石油化工是其优势产业之一. 2008年天津市石油化工联合其他五大优势产业完成工业总产值8323.89亿元,而到2012年仅石油化工这一项优势产业就完成产值3626.63亿元. 2017年发布的天津市石油和化学工业发展“十三五”规划纲要指出,2015年全市拥有石化企业711家,资产总额3756.57亿元,全年实现产值4024.32亿元,约占全市规模以上工业的15%. 到2020年,石油化工产业总产值将超过6000亿元. 同时,天津市也因天津港成为我国北部最重要的国际航运物流中心之一. 2020年天津港口货物吞吐量突破5亿吨,集装箱吞吐量突破1800万标准箱,均在全国港口中居第六位,“十三五”时期集装箱吞吐量年均增长5.4%,稳居全球集装箱港口十强. 因此,石油化工产业和航运物流产业的快速扩张与发展可能是石油源贡献率迅速增长的一个重要原因.
-
ILCR模型解析结果表明,2008年和2012年天津市近郊地区居民土壤PAHs暴露风险值ILCRsinhalation的数量级在10-14—10-10之间,远低于10−6. 因此,居民通过吸入方式接触到土壤中PAHs而导致的健康风险可以忽略.
如表3所示,2008年近郊地区居民土壤PAHs暴露风险值ILCRsingestion和ILCRsdermal的范围分别为1.19 × 10−9—5.89 × 10−6和2.84 × 10−9—1.00 × 10−5,它们最大值分别出现在儿童和成人. 根据不同年龄段暴露人群的统计结果,分别有32.5%、24.1%和36.1%的土壤样品的儿童、青少年和成人暴露总风险值ILCRstotal处于低风险判定区间内. 2012年居民各暴露途径的风险值ILCRs均高于2008年,ILCRsingestion的范围为2.84 × 10−9—9.51 × 10−6,ILCRsdermal的范围为6.79 × 10−9—1.62 × 10−5,两者最大值出现的年龄段和2008年一致. 儿童、青少年和成人暴露总风险值ILCRstotal大于10−6的土壤样品比例分别为41.7%、36.7%和45.0%,较2008年均有不同程度的增长. 值得注意的是,2008年和2012年居民土壤PAHs暴露风险值ILCRsdermal均高于ILCRsingestion,并且2012年青少年和成人暴露风险值ILCRsdermal的均值较2008年增长了一个数量级. 上述结果表明,2008年到2012年,天津市近郊地区居民土壤PAHs暴露风险在不断增加,且皮肤接触是主要的暴露途径;儿童因其对致癌物的高敏感性应归为最敏感的亚群体. 人群暴露风险的增加可能与机动车排放源贡献率增加有关. 根据PMF解析结果,虽然2012年机动车排放贡献率较2008年仅增加了5.3%,但是其估算排放量是2008年的2.6倍. 机动车排放量大幅度的增加导致更多的具有强致癌效力的特征组分[1, 56-57],如苯并(a)芘、二苯并(a, h)蒽和茚苯(1, 2, 3-cd)芘进入到土壤中,增加暴露人群的健康风险. 另一方面,石油源的贡献率和估算排放量的增幅虽然最大,但其排放至环境中的组分主要是致癌效力较低的低分子量PAHs.
-
2008年至2012年,天津市近郊地区城市化发展在一定程度上改变了土壤中PAHs的来源、含量和组成.
(1) 土壤中16种PAHs的总含量均值增加了1倍,菲、萘和荧蒽取代苯并(b)荧蒽、荧蒽和苯并(g, h, i)苝成为优势组分,萘、二氢苊、菲等低分子量PAHs的浓度明显增加.
(2) 五环化合物占比大幅度下降,而二环和四环化合物占比均显著增加.
(3) PMF解析结果表明,燃煤源和生物质燃烧排放的贡献率均减少10%以上,石油源的贡献率增加17.2%.
(4) 当地居民土壤PAHs暴露风险在不断增加,儿童作为最敏感的亚群体应受到关注,皮肤接触是主要的暴露途径. 机动车排放源贡献率的增加可能的导致暴露风险上升的重要原因.
城市化进程中天津市近郊区土壤多环芳烃的污染特征变化及健康风险
Urbanization-driven changes in contamination and human health risks of pahs in soils from suburban Tianjin, China
-
摘要: 多环芳烃(PAHs)是城市主要污染物之一,对居民健康构成了巨大的威胁. 然而,探讨城市化与区域PAHs污染特征及其健康风险的关系的研究却很少. 基于正定矩阵因子分解(PMF)模型和终身累积癌症风险(ILCR)模型,本文对比了2008年和2012年天津市近郊地区土壤中PAHs的含量、组成、来源及其导致的生态风险. 结果表明,土壤中PAHs的浓度增加了1倍,低分子量组分的比例由28.6%上升到34.8%,优势化合物由苯并(b)荧蒽、荧蒽和苯并(g,h,i)苝转变为菲、萘和荧蒽. 土壤PAHs主要来源由2008年的燃煤源(51.3%)、机动车排放(23.1%)和生物质燃烧排放(14.5%)转变为2012年的燃煤源(41.0%)、机动车排放(28.4%)和石油源(22.3%),排放源的变化与区域工业能源结构调整以及居民日常生活习惯改变有着密切的关联. 机动车排放源贡献率增加导致当地居民的土壤PAHs暴露风险上升,皮肤接触是主要的暴露途径,儿童是对暴露风险最敏感的亚群体.
-
关键词:
- 城市化 /
- 多环芳烃 /
- 土壤 /
- 终身累积癌症风险模型 /
- 正定矩阵因子分解模型 /
- 健康风险评价 /
- 天津
Abstract: Polycyclic aromatic hydrocarbons (PAHs), one of the key pollutants in urban areas, have presented a great risk to the resident health. However, few studies have explored the linkage between urbanization and regional PAH pollution and incurred health risks. Based on results calculated by the positive matrix factorization (PMF) and lifetime cumulative cancer risk (ILCR) model, we compared the levels, composition, sources and ecological risks of soil PAHs in suburban Tianjin between 2008 and 2012 to investigate their changes related to urbanizations. The concentrations of soil PAHs increased remarkably, with the proportion of low molecular weight components increasing from 28.6% to 34.8%. Phenanthrene, naphthalene and fluoranthene became the dominated compounds, which was related to changes of the PAH sources. Results of the PMF model suggest that the major PAH sources change from coal combustion (51.3%), traffic sources (23.1%), and biomass combustion (14.5%) in 2008 to coal combustion (41.0%), traffic sources (28.4%) and petroleum sources (22.3%) in 2012. This change should be closely related to the optimization and adjustment of energy structure and changes of human lifestyle. According to the ILCR model, dermal contact was the prevailing pathway of PAH exposure, and children were classified as the most sensitive subpopulation. The increased contribution of traffic sources led to the increase in human cancer risks. -
2015年4月,国务院颁布《水污染防治行动计划》(水十条),确定我国水污染防治目标[1]:即2017年底前,直辖市、省会城市、计划单列市建成区基本消除黑臭水体;到2020年,地级及以上城市建成区的黑臭水体均控制在10%以内;到2030年,城市建成区黑臭水体总体消除。2015年9月,住建部发布《城市黑臭水体整治工作指南》(“工作指南”),提出“控源截污、内源治理;活水循环、清水补给;水质净化、生态修复”是城市黑臭水体整治的基本技术路线[2-3]。
暴雨径流产生的城市面源污染是城市水体重要污染源,污染负荷可占10%以上[4]。暴雨初期雨水流量大,且往往含有大量污染物[5-6]。城市排水管网建设和改造滞后,许多老城区排水管网难以进行分流制改造,使得许多城市将长期面临城市面源导致的水体污染问题。以黑臭水体治理为目标,开发针对城市面源初期雨水的快速高效一体化设备,尽可能削减入河污染负荷,对于维持城市河湖水体水质安全和水生态功能具有重要意义。
超磁分离即在污水中投加磁性物质,使不带磁性的污染物被赋予磁性,再通过磁性设备实现固液分离,达到水体净化的目的。笔者团队基于超磁技术,自主研发了超磁分离水体净化技术和成套设备,在国内多个黑臭水体治理工程中得到成功应用。本文介绍超磁分离装备的技术原理和设备概况,通过梳理其在黑臭水体治理各环节的应用工程,总结了其停留时间短、净化效率高、容积负荷高、高度集成化等工艺特点。该技术在实际工程应用中可因地制宜设计、快速投产应用,可为河湖水体质量改善、功能恢复和水生态健康提供参考。
1. 超磁分离技术的工艺原理及流程
1.1 工艺原理
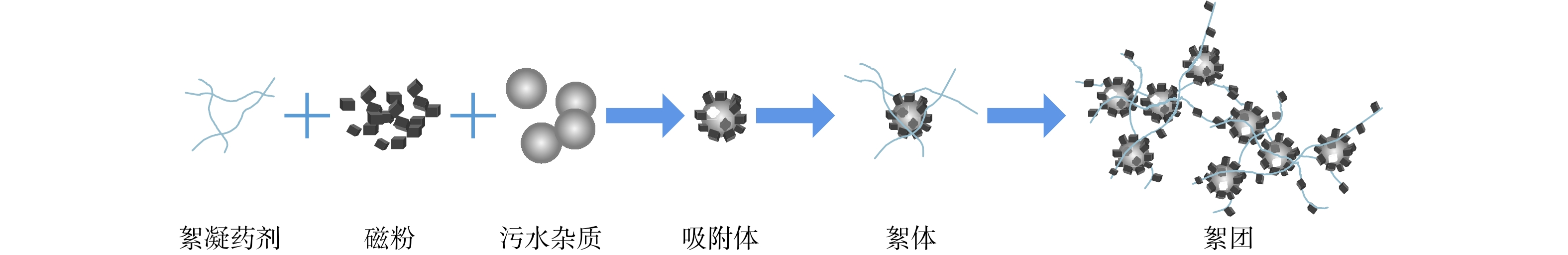
污水中存在大量质量较轻的胶体和细小悬浮物颗粒。这些微小物质在水中受水分子热运动的碰撞而做无规则布朗运动。其中,悬浮颗粒都带有同性电荷,颗粒间的静电斥力阻止其彼此接近,而不能聚合成较大颗粒;胶体中带电荷的胶粒和反离子易与周围水分子发生水化作用,在其外层产生水化壳,阻碍胶体间的聚合。胶体的胶粒带电越多,其电位就越大;扩散层中反离子越多,水化作用也越大,水化层也越厚,因此扩散层也越厚,稳定性越强[7]。
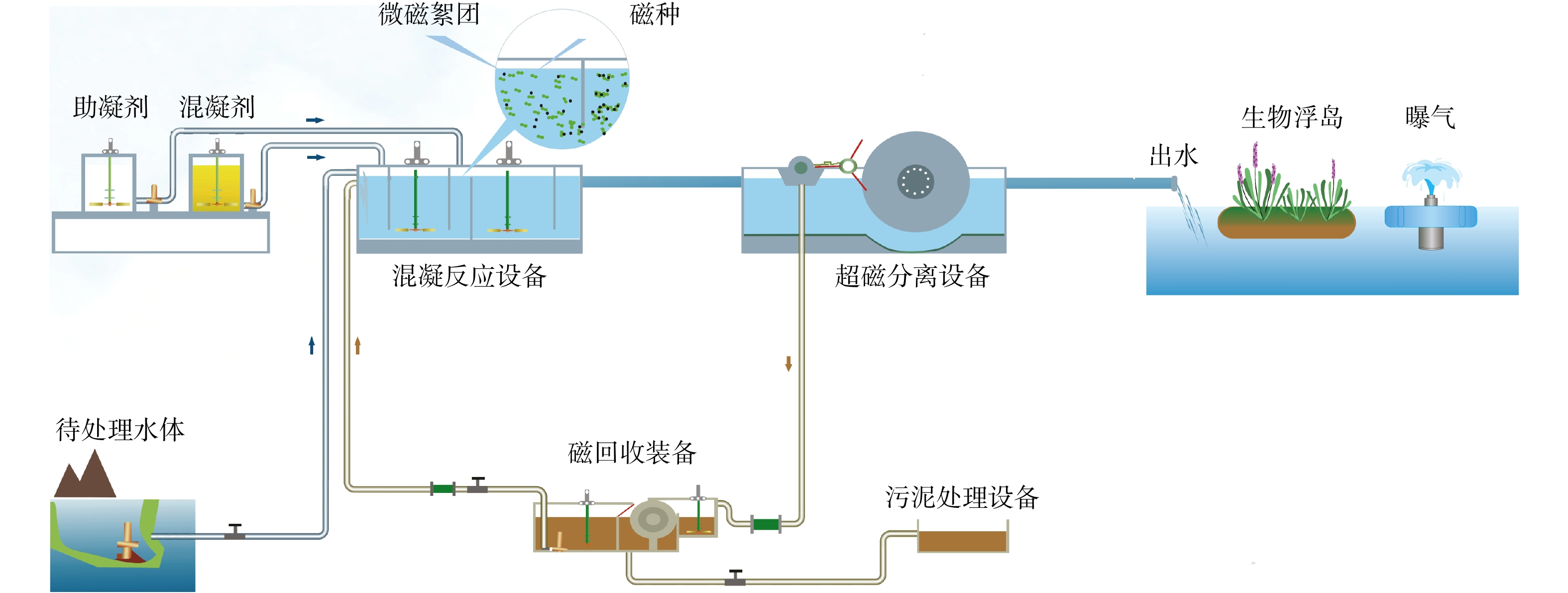
超磁分离水体净化技术即向污水中投入磁粉和混凝剂,降低或破坏污水中胶体的电位降,从而破坏颗粒稳定态(即脱稳);脱稳的颗粒聚集成为较大颗粒,形成以磁粉为核心的微絮团;再通过高强磁场力作用至微絮团中的磁粉,使微絮团克服流体阻力和自身重力,快速定向运动并吸附至磁盘表面;然后用设备的卸渣装置将泥渣与水体分离,实现水质的净化;最后,再将磁性污泥送至磁粉回收设备中,以实现磁粉与污泥的分离。分离出来的磁粉可返回前端循环利用,参与下一次水质净化过程;分离出的非磁性污泥因其含水量较低,无需浓缩即可送至脱水系统处理,脱水后的干泥外运处置。超磁分离技术的基本原理如图1所示。
1.2 工艺流程
超磁分离技术工艺流程(见图2)有4步:1)污水经提升或自流进入混凝反应器,并投加一定浓度的磁粉充分混合;2)在混凝剂和助凝剂作用下,水体中的磁粉与非磁性悬浮物相结合形成微磁絮团;3)混凝反应后的污水自流入超磁分离设备,通过高强度磁场的作用,形成磁性微絮团,再从磁盘打捞出水,使微磁絮团与水体分离开,出水可排放或进入下一步工艺;4)从磁盘分离出来的微磁絮团通过磁回收系统处理,将磁粉和非磁性污泥分离开,磁粉可循环再利用,污泥则进入下一步的污泥处理系统。
1.3 技术优势
笔者团队经过多年实践,开发的集成处理设备在污水处理工程中展现了较好的应用效果,呈现5个方面的技术优势:1)磁粉加入后形成的带磁核的高密度均匀微絮团,提高了混絮凝反应的效率。该技术的分离效率为重力沉淀法的数百倍,在4~6 min内即可实现较好的处理效果;而反应时间仅为高密度沉淀及加砂沉淀技术的5%~10%;2)集成处理设备结构紧凑,占地面积小,为传统工艺的1/6~1/8。设备可用卡车装载,便于整体移动,应用灵活(见图3);3)系统的耐负荷和抗水量波动冲击的能力强,出水水质较好,SS去除率能达到90%~95%,藻类去除率≥95%,TP去除率为80%~90%,COD去除率为40%~60%;4)集成设备的自动化程度高,运行费用低,磁种回收率可达98%以上。系统装机容量小,耗电量低,低碳节能;5)从污泥处理的角度来说,工艺的排泥浓度高,含水率≤95%,在无需浓缩的前提下即可直接进入脱水机处理[7]。
2. 超磁分离技术在黑臭水体治理中的应用案例
根据住建部“工作指南”指导意见,结合超磁分离技术和装备自身优势,提出黑臭水体治理的基本思路以及因地制宜、“一水一策”的应用策略,具体分为“控源截污”“内源治理”“活水循环”“清水补给”“水质净化、生态修复”等方面。
2.1 控源截污典型应用案例
针对排污口的直排污水、泵站(污水厂)溢流水、初期雨水及其他需应急治理的污水问题,采取截污净化的方式,从源头上控制污染物进入水体,实现清水入河。控源截污和内源治理是消除黑臭水体的基础与前提[2]。其中,“控源”的对象包括未纳管直排污水、初期雨水、泵站(污水厂)溢流水以及应急排污等,以下为应用案例。
2.1.1 未纳管直排污水处理的应用案例
北京清河沿岸有多个污水直排口(如图4),未经处理的污水直排入清河导致河水发黑发臭。水体质量差不仅使周围居民的生活环境变差,还进一步污染河道周边的土壤及地下水。经调研,清河沿岸的污水直排现象有:城中村污水直排、管网未覆盖地区的雨污合流排污、采沙场洗砂废水直排等。结合项目实际情况,采取建设临时治污工程措施来治理因直排导致的黑臭问题。
根据调研情况,最终确定沿岸建设3个应急治理站:河北村应急治理站,处理规模为2 000 m3·d−1;外环跌水闸应急治理站,处理规模为20 000 m3·d−1;沙总排排污口应急治理站,处理规模为15 000 m3·d−1。工程以去除黑臭、提升感官效果为目标,设计采用流程简单、占地面积小、工程建设周期短、启动迅速、去除效率较高的超磁净化处理工艺,达到了初步改善城区段清河水环境质量的目的。建成后,每年可削减2 210 t悬浮物、1 530 t有机污染物(以COD为指标)和18 t含磷污染物(以TP为指标)。治理后出水效果如图5所示。
对于类似情况的未纳管直排污水,可以采用一体化超磁分离设备临时应急处理的方式,即能快速响应、应急治理,待管网完善、污水纳管处理后,设备还可以挪至其他地方继续使用。
2.1.2 初期雨水处理的应用案例
江西省萍乡市中心城区人口密集,部分排水管为合流制,存在排水管径较小,管材严重老化且排水系统不全的情况。由于城区排水不畅,部分地区常受内涝之灾。为解决城区现状积水较严重的路段排水及近几年即将实施的道路排水问题,对萍乡市西门内涝区进行综合整治。
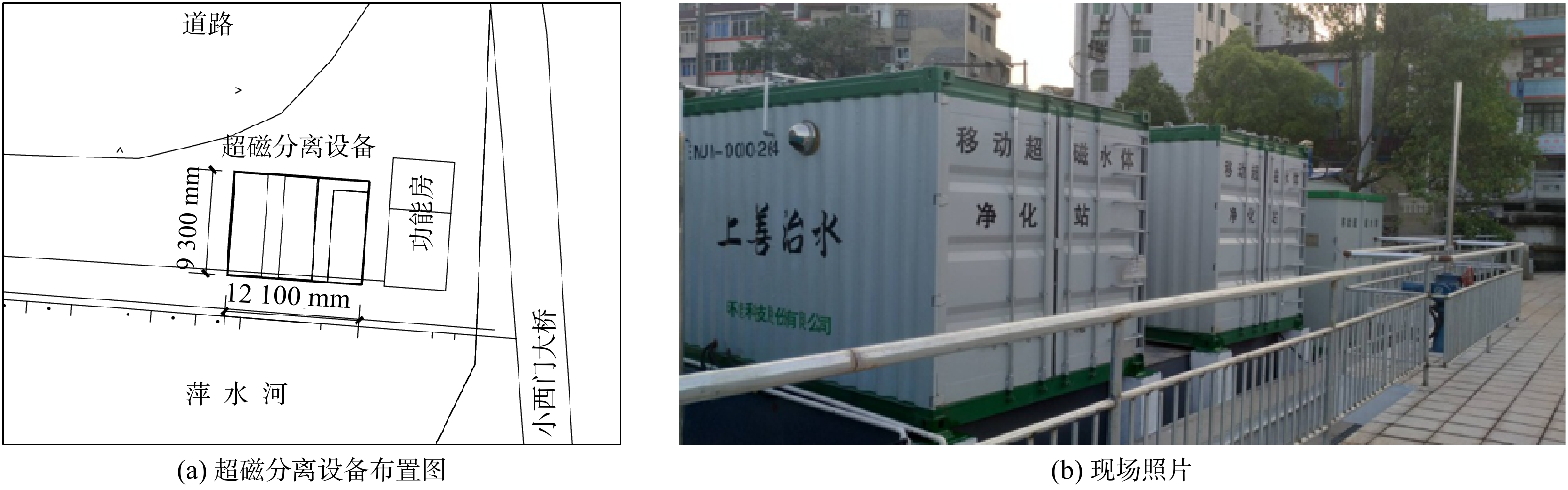
综合整治工程内容包括在萍乡市公交西站内修建3#和4#调蓄池储存初期雨水。由于在降雨初期,雨水溶解了空气中大量的污染性气体,降落地面时,又冲刷屋面、道路等固化面,所以初期的雨水中含有大量污染物。晴天经雨污合流制管道外排时又混入大量生活污水,使得调蓄池储水中混入大量污染物。若未经处理直接外排,会给水环境造成严重污染。由于此次整治为老城区改造,可用地面积极其有限。故将初雨净化站点设置在小西门桥头处三角地带,实际可用地面积仅260 m2。
经比选,最终采用处理能力10 000 m3·d−1,占地面积仅有113 m2的集成式超磁分离设备(见图6)。设备运行至今,已实现对调蓄池排水的长期处理。设备长期进水水质指标平均值:SS为180 mg·L−1,COD为100 mg·L−1,TP为2 mg·L−1。出水水质指标平均值:SS小于20 mg·L−1,COD小于50 mg·L−1,TP小于0.5 mg·L−1。水中污染物被大幅削减,就近排入河道,亦可对其进行补水,以改善河道水环境。
对于海绵城市的“渗、滞、蓄、净、用、排”,超磁分离可利用自身占地面积小、处理效率高的优势,配套调蓄池,针对海绵城市的“蓄、净”2个环节有效结合,对初期雨水收集净化处理后外排。
2.1.3 泵站(污水厂)溢流水处理的应用案例
杭州市余杭区及临平副城污水处理系统的污水输送泵站长期高水位运行,致使地势低洼地段经常发生污水满溢现象。溢流污水通过雨水管排入河道,导致河道水质变差。余杭区政府拟对区域内管网进行升级改造。管网建成前,需采用应急处理的方式将各泵站超量污水中的污染物进行快速削减,然后再外排。为避免污水溢流对河道造成污染,应急处理设施需赶在汛期来临前建设完成,并通水运行。
为节省投资、保证项目工期,拟将应急处理设备布置在各泵站旁,故需选用建设周期短、占地面积小、可移动式的工艺设备。经比选后,最终选用集成式超磁分离设备,对溢流污水中的污染物进行快速削减。污泥采用吸粪车定期送至污水厂集中脱水处理。该项目共建设6个站点,总规模9.5×104 m3·d−1。项目在30 d内(含土建)即建成通水,体现了超磁分离设备建设周期短、占地面积小、出水效果稳定的优势。近年来,浙江省提出“五水共治,治污先行”的水环境改善路线。余杭区的污水量也逐年增加。为提高区域内各污水应急治理点的处理能力,并确保达标排放,决定通过改造和新建应急处理点,使外排水质达到《城镇污水处理厂污染物排放标准》一级B标准。
在对乔司永玄路站点进行提标改造中,系统出水主要考核指标有COD、NH3-N、SS、TP。现有超磁分离工艺为物化处理方法,主要去除水中SS、TP及悬浮性COD。因此,为进一步去除水中COD、NH3-N等污染物,需增加二级生物处理段。经工艺比选,最终选用“超磁分离技术(现有)+无堵塞曝气生物滤池”。无堵塞曝气生物滤池采用独创的气水分布滤砖技术,克服了传统曝气生物滤池滤头易堵塞的问题,是一种新型生物膜法污水处理滤池系统。
系统处理规模为2×104 m3·d−1。由于项目性质为应急治理,工期紧,滤池主体结构采用钢材焊接而成(设计效果图见图7),45 d实现通水调试。系统正常运行后,出水优于《城镇污水处理厂污染物排放标准》一级B标准(TN指标除外),系统进、出水水质见表1。
表 1 乔司永玄路站点进、出水水质的月均值Table 1. Influent and effluent quality of the Josi Yongxuan Road station mg·L−1项目 COD SS TP NH3-N 进水 200 218 4.6 60 出水 55 10 0.5 7 超负荷的泵站(污水厂)溢流水,在污水厂扩容工程建成前,可采用超磁分离设备进行临时应急处理;或采用“超磁分离+生化处理系统”,进行全指标处理。
2.2 内源治理典型应用案例
黑臭水体的内源治理即垃圾清理、清淤疏浚等处理措施。清淤疏浚主要清理底泥中的污染物。通过清除底泥,可实现黑臭水体内源污染负荷的迅速降低,减少底泥污染物向水体中的释放。底泥清理方式有机械清淤、水力清淤等。机械清淤产生的污泥经脱水后外运处置,滤液回灌至水体。由于滤液依然存在浊度、总磷等污染指标较高的问题,为避免滤液对水体造成二次污染,需同时配套滤液净化设备,对滤液净化处理后再排入水体。
四川省绵阳市木龙河流域中污染物超标严重。对该流域水环境特点和水质污染现状进行调研后发现,河道受到农田废水污染、村庄生活污水污染、沉积淤泥内源污染、缺乏生态基流等的影响。针对以上具体问题,采用“控源截污—内源清淤—超磁透析净化—原位生态修复”的技术路线。其中,需对2 km河段进行机械清淤,清淤厚度为0.2~0.3 m,淤泥量约为8 000 m3。清淤产生的污泥经脱水后用于绿化种植。滤液经净化处理后再回灌至河道。由于脱水后的滤液浓度高,且河边可用地面积小,故采用集成度高、处理效率高的车载移动式超磁分离设备。净化后滤液的SS低于20 mg·L−1、TP低于0.5 mg·L−1。清淤工作完成后,超磁分离设备可运至其他站点继续使用。
2.3 活水循环典型应用案例
对于断头河、胡泊等封闭水体,水体流动性差,易发生富营养化现象,变得浑浊不堪。严重时水体甚至变绿、变臭、发黑,影响水景观赏效果和周边生活环境。采取循环透析的方式,以快速削减水中污染物,提高水体流动性,从而实现水质长效保持。
北京总装航天城的人工湖湖区总面积有2×104 m2,湖区平均水深1.05 m,水体的总库容量为2.1 ×104 m3。由于水体流动性差,湖区水体浑浊不堪,透明度低(30~40 cm),亟需整治[4]。为提高水体流动性,采用超磁循环透析技术,从湖体一端取水,经超磁分离净化后,出水排至湖体另一端,以实现对湖水进行透析式循环处理,将湖水快速净化,并达到长效保持的目的。配合湖区生态修复技术,系统正常运行后,水质保持在《地表水环境质量标准》IV类水标准以上。项目现场照片如图8所示。
2.4 清水补给典型应用案例
针对景观用水、功能性用水等需要引水补给的情况,首先需要确保引水水源的水质达标,避免污染物进入后续用水段。
苏州市同里古镇家家临水、户户通舟。古镇里因水成街、因水成路、因水成市、因水成园。古镇景区内的水源为同里湖引水补给而入。近年来,由于古镇周围工业和生活污水部分排入同里湖,湖区内累积了大量污染物。同里湖水体的自净能力已不能保证湖区水质,导致水体发生富营养化,产生臭异味,导致景区内水体透明度和感官效果日益下降。春夏季水体中蓝藻滋生,影响到景区水环境观感。
为改善水质现状,恢复、保持水乡特色,通过大量调研、试验和技术论证,最终选用单套处理能力大(3.6×104 m3·d−1)、后期运行成本低(每吨水0.18元)、占地面积小(336 m2)、出水效果稳定的超磁分离水体净化成套工艺技术来改善景区河道水质。现场设备将同里湖西侧河口水经由提升泵提升至超磁分离净化站,净化后的水通过出水口至景区饮马桥闸口流出。随着此处清水源源不断的补给,实现了景区内水活、水清的目标。景区内水质感观发生明显变化,浊度由进水的29.8,降至出水5.3;透明度由0.35 m提升至1.6 m;TP由0.127 mg·L−1降至0.031 mg·L−1;COD由14.9 mg·L−1降至9.4 mg·L−1;SS由69 mg·L−1降至12 mg·L−1;治理前后效果对比如图9。项目的实施有效控制住了高温期河道中藻类、浮萍的生长及爆发。
对于此类引水工程,超磁分离单套处理能力大、占地面积小、可有效去除SS、TP,提高透明度,可作为河道、景观水“引清给清,生态补水”的重要手段。
2.5 “水质净化、生态修复”典型应用案例
针对流域治理,需要在做好控源截污、内源治理等多项措施的前提下,在水质净化的同时,结合生态修复、曝气复氧等手段进行综合治理。
安徽省淮北市共有8条河道。经现场踏勘,跃进河、西向阳沟、西流河、东向阳沟、宁王沟河道水污染严重,水质均处于劣五类。基于超磁分离技术,运用“超磁循环透析+生态修复+曝气复氧”的治理思路(工艺流程见图10),进行淮北市城市河道综合整治工程。对河水进行循环透析,以快速削减水中COD、SS、TP等污染物,提升水体透明度,提高河水感官效果。结合河道清淤、生态修复和曝气复氧等措施,可进一步去除水中N、P等指标,打造完整水生态系统,丰富河道生物的多样性,并达到长效保持水体水质的目的。
该项目于2017年6月动工。先进行河道清淤和驳岸建设,之后在西向阳沟、西流河、东向阳沟等地建设3座超磁分离净化站,于2017年底建成并通水。生态修复及曝气设施陆续施工,并于2018年6月前完成该综合治理项目的整体建设(现场照片见图11)。长期监测显示,河道水质指标DO大于3 mg·L−1、TP小于0.3 mg·L−1、NH3-N小于1.5 mg·L−1、透明度大于100 cm。
3. 结语
超磁分离技术具备处理效率高、占地面积小、施工周期短、运行维护简单等优点,但也存在出水可生化性差、某些水质指标(如氨氮、总氮、溶解性有机物等)去除能力有限等不足[7]。围绕城市水体“控源”、黑臭水体治理等需求,超磁分离技术可为多种场景灵活提供方案,尤其是在未纳管污水直排、泵站(污水厂)溢流排污、初期雨水净化、河道清淤脱水滤液净化、活水循环、河道及景观补给水净化等场景的应用。对于更高的水质维持和水生态保护目标,超磁分离技术可与其他物化、生化和生态等单元工艺和工程措施结合,实现河湖水环境综合治理与改善。
-
暴露参数Exposure parameter 单位Unit 儿童Child 青少年Adolescent 成人Adult BW kg 13.95 46.75 58.78 IRingestion mg·d−1 200 100 100 IRinhalation m3·d−1 10.9 17.7 17.5 EF d·a−1 350 350 350 ED a 6 14 30 SA cm2 2800 2800 5700 AF mg·cm−2 0.2 0.2 0.07 ABS — 0.13 0.13 0.13 AT d 25550 25550 25550 PEF m3·kg−1 1.36×109 1.36×109 1.36E×109 表 2 天津市近郊区土壤中PAHs毒性当量因子、含量及组成
Table 2. Toxic equivalent factors, composition, and concentrations of PAHs in surface soils from suburban Tianjin in 2008 and 2012
PAHs 环数Aromatic ring 毒性当量因子TEF 2008(n = 83) 2012(n = 60) 均值/(ng·g−1)Mean 范围/(ng·g−1)Range 组成占比/%Proportion 均值/(ng·g−1)Mean 范围/(ng·g−1)Range 组成占比/%Proportion 萘 2 0.001 18.7 2.72—133 6.0 68.2 ND—441 10.8 二氢苊 3 0.001 3.96 ND—42.6 1.0 35.2 ND—697 4.1 苊 3 0.001 3.10 ND—19.2 1.3 4.44 ND—31.0 0.5 芴 3 0.001 17.0 1.23—86.5 8.4 12.8 ND—78.0 2.0 菲 3 0.001 36.5 1.98—336 8.4 131 7.45—1091 16.4 蒽 3 0.01 16.6 0.502—306 3.6 11.6 0.450—107 1.0 荧蒽 4 0.001 63.4 2.39—792 9.4 255 ND—3278 15.6 芘 4 0.001 56.9 1.17—728 8.0 154 1.00—1977 9.0 苯并(a)蒽* 4 0.1 33.1 0.225—386 5.2 68.7 0.470—841 3.9 䓛* 4 0.01 46.1 0.717—506 6.4 97.9 0.850—1210 6.7 苯并(b)荧蒽* 5 0.1 103 ND—1010 13.6 118 1.38—1362 8.1 苯并(k)荧蒽* 5 0.1 43.6 ND—669 5.5 43.3 0.230—549 2.6 苯并(a)芘* 5 1 52.2 ND—728 6.8 86.6 0.370—1118 4.8 二苯并(a, h)蒽* 5 1 22.9 ND—252 4.0 33.4 ND—348 2.4 茚苯(1, 2, 3-cd)芘* 6 0.1 23.3 ND—244 3.1 106 2.37—1237 7.1 苯并(g, h, i)苝 6 0.01 66.3 ND—886 9.2 70.0 1.23—775 4.9 二环化合物 — — 18.7 2.72—133 6.0 68.2 ND—441 10.8 三环化合物 — — 77.2 6.34—701 22.6 195 7.90—1586 24.0 四环化合物 — — 199 8.53—2413 29.1 575 2.32—7306 35.2 五环化合物 — — 221 ND—2445 30.0 281 1.98—3377 17.9 六环化合物 — — 89.6 ND—1129 12.3 176 4.90—2012 12.0 Σ7-carPAHs — — 324 5.03—3582 44.7 554 7.98—6666 35.6 Σ16PAHs — — 606 29.7—6705 100 1296 22.9—14722 100 注:“*”代表7种具有致癌作用的PAHs;“ND”代表未检出;“Σ7-carPAHs”代表7种具有致癌作用PAHs总含量;“Σ16PAHs”代表16种PAHs总含量. * stands for 7 carcinogenic PAHs, ND stands for not detected, Σ7-carPAHs stands for total concentrations of 7 carcinogenic PAHs, Σ16PAHs stands for total concentrations of 16 PAHs. 表 3 不同群体暴露于土壤PAHs的潜在癌症风险
Table 3. Age-specific potential cancer risk via exposure to soil PAHs in 2008 and 2012
2008 2012 人群Population 均值Mean 最小值Min 最大值Max 均值Mean 最小值Min 最大值Max 儿童Child ILCRingestion 4.87 × 10−7 2.28 × 10−9 5.89 × 10−6 7.84 × 10−7 5.45 × 10−9 9.51 × 10−6 ILCRdermal 6.07 × 10−7 2.84 × 10−9 7.34 × 10−6 9.78 × 10−7 6.79 × 10−9 1.19 × 10−5 ILCRtotal 1.09 × 10−6 5.12 × 10−9 1.32 × 10−5 1.76 × 10−6 1.22 × 10−8 2.14 × 10−5 青少年Adolescent ILCRingestion 2.53 × 10−7 1.19 × 10−9 3.07 × 10−6 4.09 × 10−7 2.84 × 10−9 4.95 × 10−6 ILCRdermal 6.32 × 10−7 2.96 × 10−9 7.65 × 10−6 1.02 × 10−6 7.08 × 10−9 1.24 × 10−5 ILCRtotal 8.85 × 10−7 4.14 × 10−9 1.07 × 10−5 1.43 × 10−6 9.92 × 10−9 1.73 × 10−5 成人Adult ILCRingestion 4.66 × 10−7 2.18 × 10−9 5.65 × 10−6 7.52 × 10−7 5.22 × 10−9 9.11 × 10−6 ILCRdermal 8.28 × 10−7 3.88 × 10−9 1.00 × 10−5 1.34 × 10−6 9.28 × 10−9 1.62 × 10−5 ILCRtotal 1.29 × 10−6 6.06 × 10−9 1.57 × 10−5 2.09 × 10−6 1.45 × 10−8 2.53 × 10−5 注:ILCRtotal = ILCRingestion + ILCRdermal -
[1] NISBET I C T, LAGOY P K. Toxic equivalency factors (TEFs) for polycyclic aromatic hydrocarbons (PAHs) [J]. Regulatory Toxicology and Pharmacology, 1992, 16(3): 290-300. doi: 10.1016/0273-2300(92)90009-X [2] ZHANG Y, PENG C, GUO Z H, et al. Polycyclic aromatic hydrocarbons in urban soils of China: Distribution, influencing factors, health risk and regression prediction [J]. Environmental Pollution, 2019, 254: 112930. doi: 10.1016/j.envpol.2019.07.098 [3] YU H Y, LI T J, LIU Y, et al. Spatial distribution of polycyclic aromatic hydrocarbon contamination in urban soil of China [J]. Chemosphere, 2019, 230: 498-509. doi: 10.1016/j.chemosphere.2019.05.006 [4] HAN J, LIANG Y S, ZHAO B, et al. Polycyclic aromatic hydrocarbon (PAHs) geographical distribution in China and their source, risk assessment analysis [J]. Environmental Pollution, 2019, 251: 312-327. doi: 10.1016/j.envpol.2019.05.022 [5] WAQAS M, KHAN S, CHAO C, et al. Quantification of PAHs and health risk via ingestion of vegetable in Khyber Pakhtunkhwa Province, Pakistan [J]. Science of the Total Environment, 2014, 497/498: 448-458. doi: 10.1016/j.scitotenv.2014.07.128 [6] DREIJ K, LUNDIN L, LE BIHANIC F, et al. Polycyclic aromatic compounds in urban soils of Stockholm City: Occurrence, sources and human health risk assessment [J]. Environmental Research, 2020, 182: 108989. doi: 10.1016/j.envres.2019.108989 [7] 曹云者, 柳晓娟, 谢云峰, 等. 我国主要地区表层土壤中多环芳烃组成及含量特征分析 [J]. 环境科学学报, 2012, 32(1): 197-203. CAO Y Z, LIU X J, XIE Y F, et al. Patterns of PAHs concentrations and components in surface soils of main areas in China [J]. Acta Scientiae Circumstantiae, 2012, 32(1): 197-203(in Chinese).
[8] 黄亮, 张经, 吴莹. 长江流域表层沉积物中多环芳烃分布特征及来源解析 [J]. 生态毒理学报, 2016, 11(2): 566-572. HUANG L, ZHANG J, WU Y. Distribution and sources of polycyclic aromatic hydrocarbons in surface sediments from the Yangtze River [J]. Asian Journal of Ecotoxicology, 2016, 11(2): 566-572(in Chinese).
[9] LV M, LUAN X L, LIAO C Y, et al. Human impacts on polycyclic aromatic hydrocarbon distribution in Chinese intertidal zones [J]. Nature Sustainability, 2020, 3(10): 878-884. doi: 10.1038/s41893-020-0565-y [10] 范博, 王晓南, 黄云, 等. 我国七大流域水体多环芳烃的分布特征及风险评价 [J]. 环境科学, 2019, 40(5): 2101-2114. FAN B, WANG X N, HUANG Y, et al. Distribution and risk assessment of polycyclic aromatic hydrocarbons in water bodies in seven basins of China [J]. Environmental Science, 2019, 40(5): 2101-2114(in Chinese).
[11] SULONG N A, LATIF M T, SAHANI M, et al. Distribution, sources and potential health risks of polycyclic aromatic hydrocarbons (PAHs) in PM2.5 collected during different monsoon seasons and haze episode in Kuala Lumpur [J]. Chemosphere, 2019, 219: 1-14. doi: 10.1016/j.chemosphere.2018.11.195 [12] 张莉, 张原, 祁士华, 等. 武汉市洪山区春季PM2.5浓度及多环芳烃组成特征 [J]. 中国环境科学, 2015, 35(8): 2319-2325. doi: 10.3969/j.issn.1000-6923.2015.08.009 ZHANG L, ZHANG Y, QI S H, et al. Characteristics of atmospheric PM2.5 and the variation of PAHs in PM2.5 during spring in Hongshan district, Wuhan [J]. China Environmental Science, 2015, 35(8): 2319-2325(in Chinese). doi: 10.3969/j.issn.1000-6923.2015.08.009
[13] WANG C H, WU S H, ZHOU S L, et al. Characteristics and source identification of polycyclic aromatic hydrocarbons (PAHs) in urban soils: A review [J]. Pedosphere, 2017, 27(1): 17-26. doi: 10.1016/S1002-0160(17)60293-5 [14] WILCKE W. Global patterns of polycyclic aromatic hydrocarbons (PAHs) in soil [J]. Geoderma, 2007, 141(3/4): 157-166. [15] WILD S R, JONES K C. Polynuclear aromatic hydrocarbons in the United Kingdom environment: A preliminary source inventory and budget [J]. Environmental Pollution, 1995, 88(1): 91-108. doi: 10.1016/0269-7491(95)91052-M [16] HARRISON R M, SMITH D J T, LUHANA L. Source apportionment of atmospheric polycyclic aromatic hydrocarbons collected from an urban location in Birmingham, U. K [J]. Environmental Science & Technology, 1996, 30(3): 825-832. [17] BOZLAKER A, MUEZZINOGLU A, ODABASI M. Atmospheric concentrations, dry deposition and air-soil exchange of polycyclic aromatic hydrocarbons (PAHs) in an industrial region in Turkey [J]. Journal of Hazardous Materials, 2008, 153(3): 1093-1102. doi: 10.1016/j.jhazmat.2007.09.064 [18] 张俊叶, 俞菲, 俞元春. 中国主要地区表层土壤多环芳烃含量及来源解析 [J]. 生态环境学报, 2017, 26(6): 1059-1067. ZHANG J Y, YU F, YU Y C. Content and source apportionment of polycyclic aromatic hydrocarbons in surface soil in major areas of China [J]. Ecology and Environmental Sciences, 2017, 26(6): 1059-1067(in Chinese).
[19] LIU S D, XIA X H, YANG L Y, et al. Polycyclic aromatic hydrocarbons in urban soils of different land uses in Beijing, China: Distribution, sources and their correlation with the city's urbanization history [J]. Journal of Hazardous Materials, 2010, 177(1/2/3): 1085-1092. [20] PENG C, WANG M E, ZHAO Y, et al. Distribution and risks of polycyclic aromatic hydrocarbons in suburban and rural soils of Beijing with various land uses [J]. Environmental Monitoring and Assessment, 2016, 188(3): 162. doi: 10.1007/s10661-016-5156-z [21] CAO H B, CHAO S H, QIAO L, et al. Urbanization-related changes in soil PAHs and potential health risks of emission sources in a township in Southern Jiangsu, China [J]. Science of the Total Environment, 2017, 575: 692-700. doi: 10.1016/j.scitotenv.2016.09.106 [22] WANG C H, ZHOU S L, SONG J, et al. Human health risks of polycyclic aromatic hydrocarbons in the urban soils of Nanjing, China [J]. Science of the Total Environment, 2018, 612: 750-757. doi: 10.1016/j.scitotenv.2017.08.269 [23] JENSEN H, REIMANN C, FINNE T E, et al. PAH-concentrations and compositions in the top 2 cm of forest soils along a 120 km long transect through agricultural areas, forests and the city of Oslo, Norway [J]. Environmental Pollution, 2007, 145(3): 829-838. doi: 10.1016/j.envpol.2006.05.008 [24] NI H G, QIN P H, CAO S P, et al. Fate estimation of polycyclic aromatic hydrocarbons in soils in a rapid urbanization region, Shenzhen of China [J]. Journal of Environmental Monitoring, 2011, 13(2): 313-318. doi: 10.1039/C0EM00470G [25] CHANG J, ZHANG E L, LIU E F, et al. A 60-year historical record of polycyclic aromatic hydrocarbons (PAHs) pollution in lake sediment from Guangxi Province, Southern China [J]. Anthropocene, 2018, 24: 51-60. doi: 10.1016/j.ancene.2018.11.003 [26] 韩玲, 高照琴, 白军红, 等. 城市化背景下珠江三角洲典型湿地土壤多环芳烃(PAHs)的含量、来源与污染风险评价 [J]. 农业环境科学学报, 2019, 38(3): 609-617. doi: 10.11654/jaes.2018-1535 HAN L, GAO Z Q, BAI J H, et al. PAHs in surface wetland soils of the Pearl River Delta affected by urbanization: Levels, sources, and toxic risks [J]. Journal of Agro-Environment Science, 2019, 38(3): 609-617(in Chinese). doi: 10.11654/jaes.2018-1535
[27] 吴怡, 高源, 张鑫. 2006—2015年天津城市化进程与土地利用变化的关系分析 [J]. 环境科学导刊, 2018, 37(5): 1-6. doi: 10.13623/j.cnki.hkdk.2018.05.002 WU Y, GAO Y, ZHANG X. Analysis of the relationship between urbanization process and land utilization in Tianjin from 2006 to 2015 [J]. Environmental Science Survey, 2018, 37(5): 1-6(in Chinese). doi: 10.13623/j.cnki.hkdk.2018.05.002
[28] 天津市统计局. 天津统计年鉴[M]. 天津; 中国统计出版社. 2009, 2013, 2014, 2015. Tianjin Municipal Bureau of Statistics. Tianjin statistical yearbook[M]. Tianjin; China Statistics Press. 2009, 2013, 2014, 2015(in Chinese).
[29] LV J G, SHI R G, CAI Y M, et al. Assessment of polycyclic aromatic hydrocarbons (PAHs) pollution in soil of suburban areas in Tianjin, China [J]. Bulletin of Environmental Contamination and Toxicology, 2010, 85(1): 5-9. doi: 10.1007/s00128-010-9993-0 [30] SHAO X L, XU Y P, ZHANG W, et al. Polycyclic aromatic hydrocarbons (PAHs) pollution in agricultural soil in Tianjin, China [J]. Soil and Sediment Contamination:an International Journal, 2015, 24(3): 343-351. doi: 10.1080/15320383.2015.958212 [31] PAATERO P, TAPPER U. Positive matrix factorization: A non-negative factor model with optimal utilization of error estimates of data values [J]. Environmetrics, 1994, 5(2): 111-126. doi: 10.1002/env.3170050203 [32] 孙海峰, 张勇, 解静芳. 正定矩阵因子分解模型在环境中多环芳烃源解析方面的应用 [J]. 生态毒理学报, 2015, 10(4): 25-33. SUN H F, ZHANG Y, XIE J F. Applications of positive matrix factorization(PMF) for source apportionment of PAHs in the environment [J]. Asian Journal of Ecotoxicology, 2015, 10(4): 25-33(in Chinese).
[33] REFF A, EBERLY S I, BHAVE P V. Receptor modeling of ambient particulate matter data using positive matrix factorization: Review of existing methods [J]. Journal of the Air & Waste Management Association, 2007, 57(2): 146-154. [34] 蓝家程, 孙玉川, 胡宁, 等. 岩溶槽谷区土壤多环芳烃健康风险评价 [J]. 环境化学, 2019, 38(9): 1973-1981. doi: 10.7524/j.issn.0254-6108.2019030601 LAN J C, SUN Y C, HU N, et al. Health risk assessment of polycyclic aromatic hydrocarbons in soils of Karst trough valley in Chongqing [J]. Environmental Chemistry, 2019, 38(9): 1973-1981(in Chinese). doi: 10.7524/j.issn.0254-6108.2019030601
[35] 黄应平, 金蕾, 朱灿, 等. 三峡库区香溪河库湾土壤多环芳烃时空分布特征及风险评价 [J]. 环境科学, 2021, 42(8): 3808-3819. doi: 10.13227/j.hjkx.202012149 HUANG Y P, JIN L, ZHU C, et al. Temporal-spatial distribution and risk assessment of polycyclic aromatic hydrocarbons in soil of Xiangxi Bay in Three Gorges reservoir area [J]. Environmental Science, 2021, 42(8): 3808-3819(in Chinese). doi: 10.13227/j.hjkx.202012149
[36] JIA J P, BI C J, GUO X, et al. Characteristics, identification, and potential risk of polycyclic aromatic hydrocarbons in road dusts and agricultural soils from industrial sites in Shanghai, China [J]. Environmental Science and Pollution Research, 2017, 24(1): 605-615. doi: 10.1007/s11356-016-7818-3 [37] Risk Assessment Guidance for Superfund, Volume 1, Human Health Evaluation Manual[M]//USEPA. Washington DC. 1991. [38] KNAFLA A, PHILLIPPS K A, BRECHER R W, et al. Development of a dermal cancer slope factor for benzo[a]Pyrene [J]. Regulatory Toxicology and Pharmacology, 2006, 45(2): 159-168. doi: 10.1016/j.yrtph.2006.02.008 [39] CHEN Y N, ZHANG J Q, ZHANG F, et al. Contamination and health risk assessment of PAHs in farmland soils of the Yinma River Basin, China [J]. Ecotoxicology and Environmental Safety, 2018, 156: 383-390. doi: 10.1016/j.ecoenv.2018.03.020 [40] HARITASH A K, KAUSHIK C P. Biodegradation aspects of Polycyclic Aromatic Hydrocarbons (PAHs): A review [J]. Journal of Hazardous Materials, 2009, 169(1/2/3): 1-15. [41] CHOI S D. Time trends in the levels and patterns of polycyclic aromatic hydrocarbons (PAHs) in pine bark, litter, and soil after a forest fire [J]. Science of the Total Environment, 2014, 470/471: 1441-1449. doi: 10.1016/j.scitotenv.2013.07.100 [42] SUN G D, JIN J H, XU Y, et al. Isolation of a high molecular weight polycyclic aromatic hydrocarbon-degrading strain and its enhancing the removal of HMW-PAHs from heavily contaminated soil [J]. International Biodeterioration & Biodegradation, 2014, 90: 23-28. [43] PENG C, OUYANG Z Y, WANG M E, et al. Assessing the combined risks of PAHs and metals in urban soils by urbanization indicators [J]. Environmental Pollution, 2013, 178: 426-432. doi: 10.1016/j.envpol.2013.03.058 [44] KHALILI N R, SCHEFF P A, HOLSEN T M. PAH source fingerprints for coke ovens, diesel and, gasoline engines, highway tunnels, and wood combustion emissions [J]. Atmospheric Environment, 1995, 29(4): 533-542. doi: 10.1016/1352-2310(94)00275-P [45] JENKINS B M, JONES A D, TURN S Q, et al. Emission factors for polycyclic aromatic hydrocarbons from biomass burning [J]. Environmental Science & Technology, 1996, 30(8): 2462-2469. [46] CHEN M, HUANG P, CHEN L. Polycyclic aromatic hydrocarbons in soils from Urumqi, China: Distribution, source contributions, and potential health risks [J]. Environmental Monitoring and Assessment, 2013, 185(7): 5639-5651. doi: 10.1007/s10661-012-2973-6 [47] DAHLE S, SAVINOV V M, MATISHOV G G, et al. Polycyclic aromatic hydrocarbons (PAHs) in bottom sediments of the Kara Sea shelf, Gulf of Ob and Yenisei Bay [J]. Science of the Total Environment, 2003, 306(1/2/3): 57-71. [48] SAHA M H, TOGO A, MIZUKAWA K, et al. Sources of sedimentary PAHs in tropical Asian waters: Differentiation between pyrogenic and petrogenic sources by alkyl homolog abundance [J]. Marine Pollution Bulletin, 2009, 58(2): 189-200. doi: 10.1016/j.marpolbul.2008.04.049 [49] HU N J, HUANG P, LIU J H, et al. Source apportionment of polycyclic aromatic hydrocarbons in surface sediments of the Bohai Sea, China [J]. Environmental Science and Pollution Research International, 2013, 20(2): 1031-1040. doi: 10.1007/s11356-012-1098-3 [50] OLAJIRE A A, ALTENBURGER R, KÜSTER E, et al. Chemical and ecotoxicological assessment of polycyclic aromatic hydrocarbon—contaminated sediments of the Niger Delta, Southern Nigeria [J]. Science of the Total Environment, 2005, 340(1/2/3): 123-136. [51] WANG X T, MIAO Y, ZHANG Y, et al. Polycyclic aromatic hydrocarbons (PAHs) in urban soils of the megacity Shanghai: Occurrence, source apportionment and potential human health risk [J]. Science of the Total Environment, 2013, 447: 80-89. doi: 10.1016/j.scitotenv.2012.12.086 [52] LI W H, TIAN Y Z, SHI G L, et al. Concentrations and sources of PAHs in surface sediments of the Fenhe reservoir and watershed, China [J]. Ecotoxicology and Environmental Safety, 2012, 75: 198-206. doi: 10.1016/j.ecoenv.2011.08.021 [53] QU Y J, GONG Y W, MA J, et al. Potential sources, influencing factors, and health risks of polycyclic aromatic hydrocarbons (PAHs) in the surface soil of urban parks in Beijing, China [J]. Environmental Pollution, 2020, 260: 114016. doi: 10.1016/j.envpol.2020.114016 [54] LARSEN R K 3rd, BAKER J E. Source apportionment of polycyclic aromatic hydrocarbons in the urban atmosphere: A comparison of three methods [J]. Environmental Science & Technology, 2003, 37(9): 1873-1881. [55] SIMCIK M F, EISENREICH S J, LIOY P J. Source apportionment and source/sink relationships of PAHs in the coastal atmosphere of Chicago and Lake Michigan [J]. Atmospheric Environment, 1999, 33(30): 5071-5079. doi: 10.1016/S1352-2310(99)00233-2 [56] FRASER M P, CASS G R, SIMONEIT B R T, et al. Air quality model evaluation data for organics. 4. C2−C36 Non-Aromatic Hydrocarbons [J]. Environmental Science & Technology, 1997, 31(8): 2356-2367. [57] MOTELAY-MASSEI A, HARNER T, SHOEIB M, et al. Using passive air samplers to assess urban-rural trends for persistent organic pollutants and polycyclic aromatic hydrocarbons. 2. Seasonal trends for PAHs, PCBs, and organochlorine pesticides [J]. Environmental Science & Technology, 2005, 39(15): 5763-5773. -




 下载:
下载: