-
随着我国食品行业的发展,食品生产过程中产生的废水排放量也与日俱增. 在2018年的时候,不同行业的废水排放总量是2045794万t,其中食品加工行业的废水排放量占据比例是8.46%,在排放量上位列第6位[1]. 食品加工行业废水普遍具有含盐、高有机质、高油等共同特征,污染物总体浓度较大. 曾有报道指出食品加工行业的废水含
SO2−4 浓度高达1.5%以上[2],其中所含的有机物含量也较高,COD范围在5000—13000 mg·L−1波动[3]. 目前,国内外对于高盐有机废水处理普遍的观点是:先对废水中的有机物进行有效去除,减少废水中的有机质,然后再对盐分进行回收,最终实现高盐有机废水的资源化利用[4-5].目前对高盐废水中高浓度有机物的去除办法主要有厌氧和好氧生物处理. 由于废水中含有高浓度的硫酸盐,在厌氧条件下会产生H2S或S2−等有毒有害物质对厌氧微生物有毒害作用[6— 7],故厌氧生物技术不适合处理高硫酸盐有机废水. 而传统的好氧工艺存在污泥浓度不高、微生物流失、处理负荷低的问题,不易于驯化耐盐嗜盐微生物. 好氧膜生物反应器(aerobic membrane bioreactor,MBR)技术相较于传统好氧工艺,可以很好的将污泥截留在系统中,提高系统微生物量,有效降解高盐废水中的有机物. 此外,在MBR中能将污泥停留时间(sludge retention time, SRT)和水力停留时间(hydraulic retention time, HRT)分开控制,更好的运行管理,近几年在高盐废水处理行业中受到普遍关注[8]. 目前MBR技术应用于高盐废水中有一定研究,如刘传伟[9]在利用MBR工艺处理含不同比例高盐废水时,生物系统去除有机物的耐盐浓度在17 g·L−1;当系统中盐度在22.75 g·L−1时,系统处理效果严重恶化,去除率下降到75%. 张哲等[10]采用MBR工艺处理含50%海水的污水,通过合理调整运行参数,如控制COD为700—800 mg·L−1,氨氮为80—100 mg·L−1,HRT为12 h,反应器内污泥浓度为7—8 g·L−1及好氧区DO为1—2 mg·L−1,取得了较好的污染物去除效果,COD和氨氮的平均去除率分别达到91.91%和91.44%. Hong等[11]对比研究了MBR和传统活性污泥法处理高盐水产养殖废水的有机物去除效率,发现当含盐量增加35 g·L−1时,MBR系统的COD去除率仍保持在96%以上,而传统活性污泥法却随着含盐量升高去除率不断下降,当升高至30 g·L−1时,去除率就已降至68%. 这说明在处理高盐废水时采用MBR工艺较传统活性污泥法具有更好的有机物去除效率,且能适应更高的盐度.
目前高盐废水的生物处理的研究发现,由于高浓度无机盐对微生物的毒害和抑制作用,高盐废水在生物处理过程中普遍存在处理负荷不高,去除效率不稳定等问题[9,11]. 为了探究MBR系统能否在高盐环境下建立稳定高效的去除污染物体系,本研究针对连云港某营养食品加工企业生产的两种SO42-浓度分别为1.6%和2.6%的废水,采用两套中试规模好氧膜生物反应器(MBR)进行处理. 通过对出水的COD、氨氮、TN以及TP等定期监测,研究不同SO42-浓度下两套装置的盐度驯化以及负荷提升时期的污染物降解规律,以期为MBR处理高盐高浓度有机废水提供理论基础和应用指导.
-
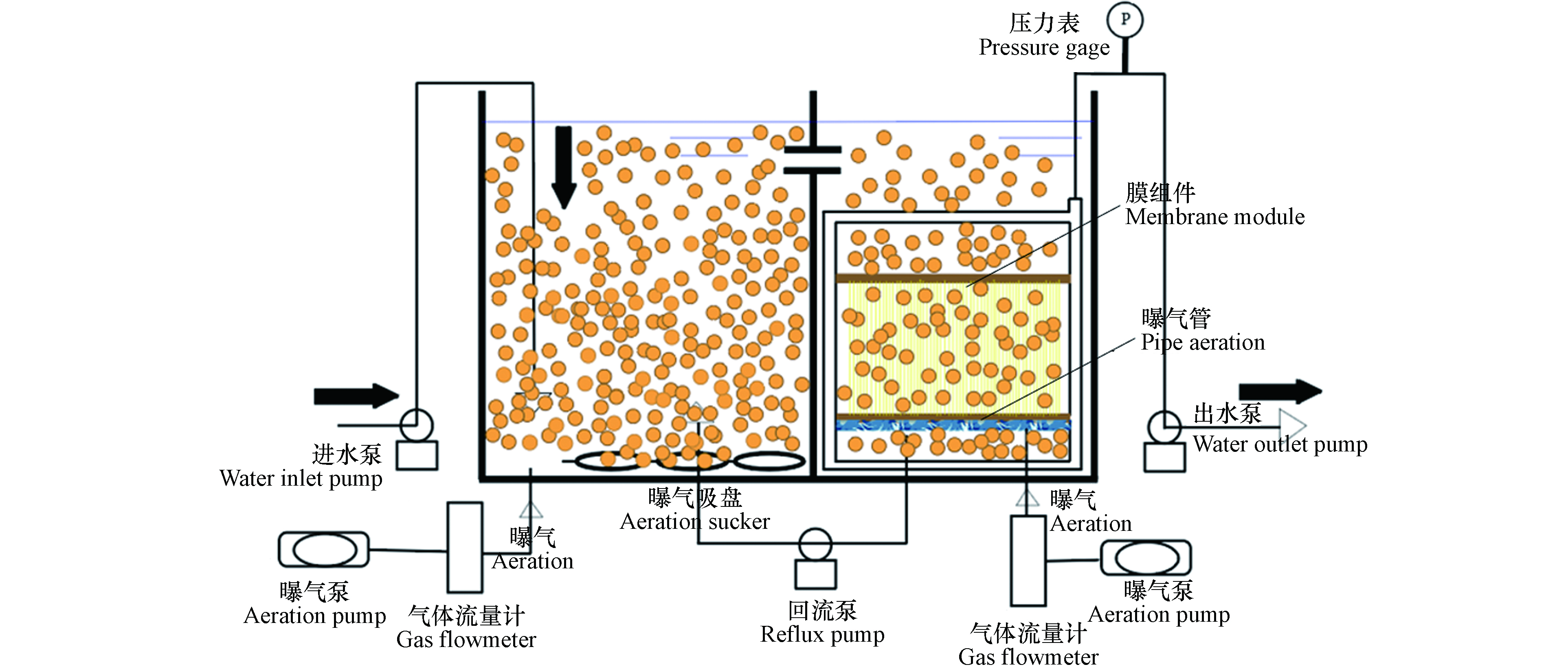
本研究采用MBR工艺,装置如图1所示. MBR主要由硝化池(O池)和膜池组成,两池的有效容积都为44 L,整套反应器的总有效容积为88 L. 在O池和膜池底部装有纳米吸盘曝气装置,曝气装置分别用空气流量计控制,用以保持池内的溶解氧在2—4 mg·L−1,同时可以使池内的污泥混合液充分混合,防止污泥沉底堆积.
膜池的硝化液通过蠕动泵控制回流至O池,以控制两池污泥浓度相同,防止膜池污泥经浓缩后浓度过高,影响两池的硝化性能. 污泥停留时间(sludge retention time,SRT)为44 d.
实验所用膜组件为聚偏氟乙烯(PVDF,江苏诺莱智慧水务装备有限公司)的中空纤维膜,有效膜面积为0.43 m2,过滤方式采用负压抽吸.
膜组件底部设有射流曝气装置,在提供溶解氧的同时可以冲刷膜表面,缓解膜污染. 反应器的进出水均采用蠕动泵控制,出水的抽停比为9 min:1 min,跨膜压差(transmembrane pressure,TMP)采用压力表测定,当TMP超过30 kPa时,对膜组件进行清洗.
-
本实验接种的污泥取自无锡市某餐厨废水处理厂的好氧生化污泥,所用废水为连云港某营养食品加工企业产生的废水,因生产工艺的不同,会产生不同
SO2−4 浓度的废水,故本实验采用两种SO42-浓度的废水进行实验研究. 其详细水质如表1所示.两股废水中原水有机物较高,而TN较低,使得C/N过高,在运行了25 d后,
SO2−4 浓度为1.6%的反应器,因有机物降解效率不佳,尝试通过调整进水C/N,控制C/N在25左右. 进水SO2−4 浓度为2.6%的反应器在运行了40 d后,添加尿素补充氮源同样控制C/N为25左右. 且其进水SO2−4 在第50 d有所降低,在2.2%—2.3%范围内波动. -
同时运行两组实验MBR装置,一组进水
SO2−4 浓度保持为1.6%,另一组初始进水SO2−4 浓度为2.6%,运行50 d后由于进水水质变化调整为2.3%. 有机负荷根据出水COD值来判断,若出水COD稳定于200 mg·L−1以下则提升负荷. 进水SO2−4 浓度为1.6%的MBR装置运行时期分两个时期,第一个时期为提盐驯化期(1—20 d),第二个时期为负荷提升期(21—110 d),其中负荷提升期又分为3个阶段(按COD 计算):0.6 kg·(m3·d)−1 (21—40 d),0.72 kg·(m3·d)−1 (41—80 d),1.0 kg·(m3·d)−1 (81—110 d). 因SO2−4 浓度为2.6%的MBR装置出水COD一直高于200 mg·L−1,故此套装置运行阶段分两个时期,分别为提盐驯化期(1—36 d)和负荷稳定期(37—110 d,其容积负荷一直稳定在0.5 kg·(m3·d)−1). 两反应器的运行参数如表2所示. 运行期间室内温度控制在25℃左右. -
COD采用重铬酸钾法测定,用硫酸汞掩蔽Cl−;氨氮、总氮、总磷采用国家环保总局规定的检测方法[12];SO42-浓度采用离子色谱仪测定;电导率采用雷磁DDBJ-350便携式电导率仪测定[13].
-
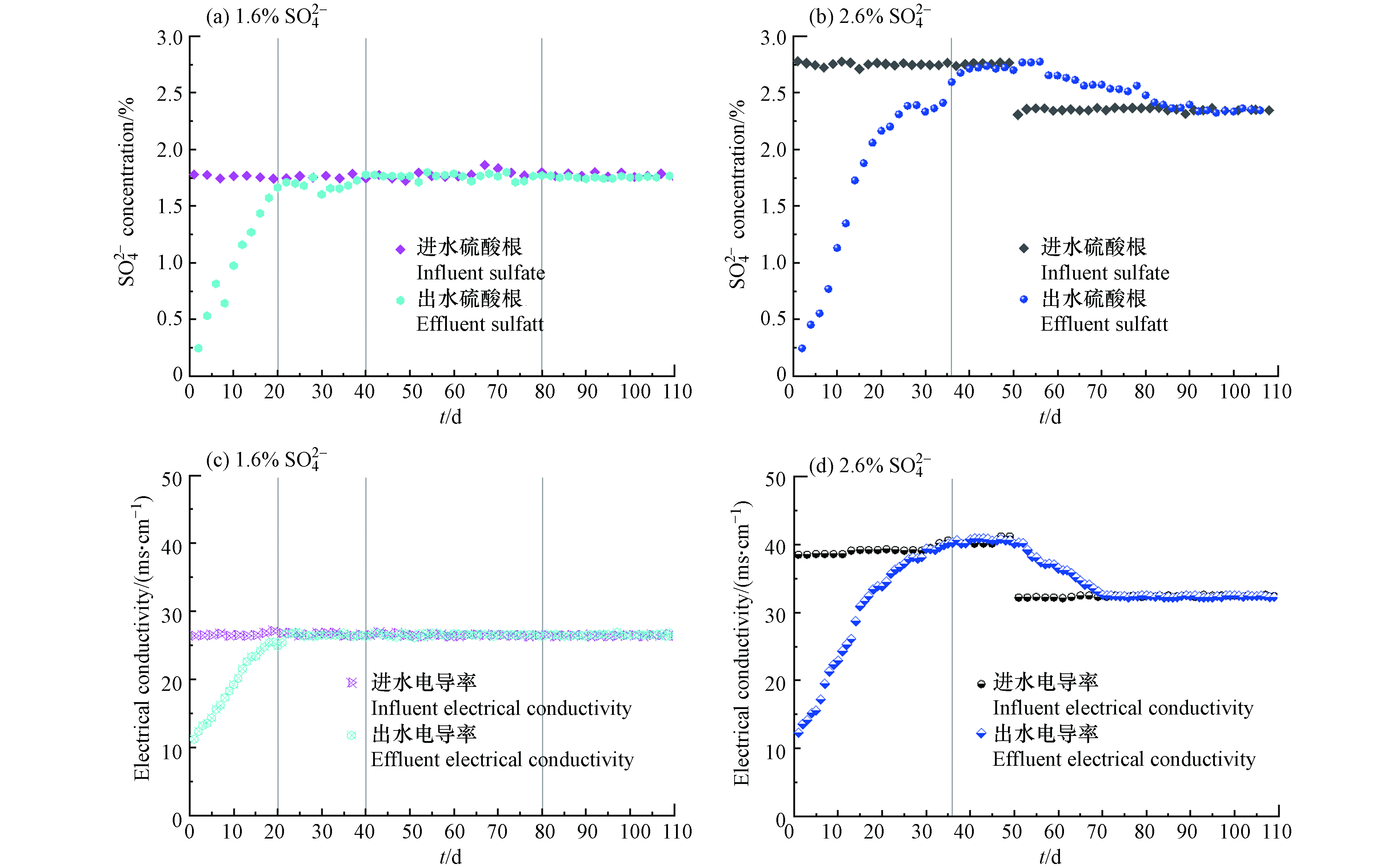
两个反应器的进出水
SO2−4 浓度变化如图2所示. 由于接种污泥为餐厨废水好氧生化污泥,初始两反应器内SO2−4 浓度较低. 随着反应器运行,出水SO2−4 浓度逐渐升高. 如图2(a)所示,进水SO2−4 浓度为1.6%的反应器在运行的第20 d,其出水的SO2−4 已达到1.7%,接近进水SO2−4 浓度,表明1.6%的系统提盐驯化阶段完成. 进水SO2−4 浓度为2.6%的反应器运行至第36 d,其出水SO2−4 从0.2%增加到2.7%1(图2(b)所示),接近进水SO2−4 浓度,从而完成了提盐驯化阶段. 由于HRT较长,两系统中上清液完全置换时间均较长,而2.6%系统进水SO2−4 浓度较高,系统置换期比1.6%系统多了16 d. 在进水SO2−4 浓度为2.6%的反应器运行至第51 d时,进水SO2−4 调整为约2.3%. 改变进水后,出水SO2−4 在逐渐降低,运行至93 d左右和进水相接近.此外,对两个反应器内的电导率也进行了监测,结果如图2所示. 在提盐驯化阶(0—20 d)进水
SO2−4 浓度为1.6%反应器的进水电导率一直保持在26.5 ms·cm−1左右,随着反应器的运行,出水的电导率不断上升,从初始的11.2 ms·cm−1逐渐上升至26.4 ms·cm−1 (图2c),随后在负荷提升期(20—110 d)一直稳定在26.5 ms·cm−1左右. 进水SO2−4 浓度为2.6%反应器的进水电导率约为38—41 ms·cm−1,出水的电导率由最初的12.3 ms·cm−1上升至40.3 ms·cm−1 (第36 d),进入负荷稳定期后其值稳定在40.5 ms·cm−1左右(第36—51 天). 在第51 天进水水质调整后,进水电导率在32—33 ms·cm−1之间. 反应器出水从电导率逐步下降,最终稳定在32 ms·cm−1左右. 可以看出,电导率的变化情况和出水SO2−4 浓度的变化规律相似. 从出水电导率和SO2−4 浓度的变化可以看出,1.6%的系统完成混合液中上清液的置换时间更短,其能更快完成提盐驯化. -
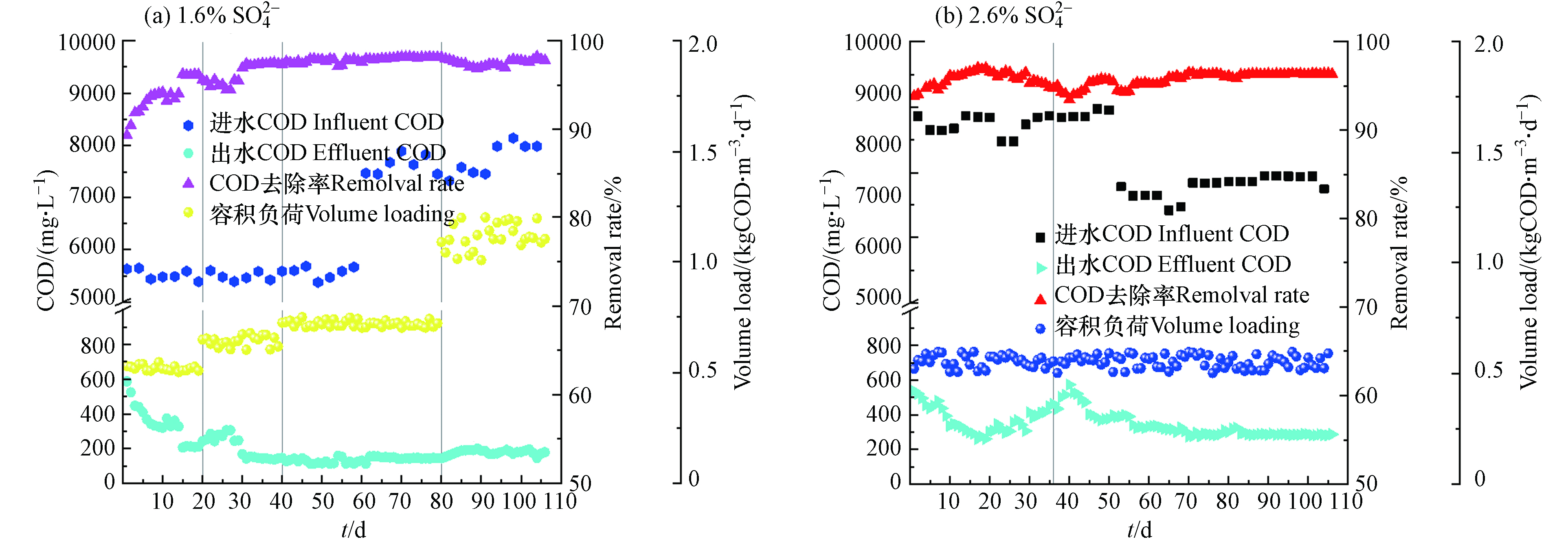
两反应器对COD的去除效果如图3所示,在提盐驯化阶段初期,两种盐浓度的出水COD均呈现下降趋势. 其中进水
SO2−4 浓度为1.6%(图3(a))的反应器进水COD约5500 mg·L−1左右,出水COD从初始的587 mg·L−1逐渐下降至第10 d的320 mg·L−1,去除率为94.18%. 进水SO2−4 浓度为2.6%的反应器(图3(b))进水COD在8000—8900 mg·L−1左右,出水COD从初始的537.6 mg·L−1下降至第19 天的260.8 mg·L−1,去除率为97.03%. 两反应器出水COD去除率在刚开始运行的初期均较高,可能是接种污泥中上清液的无机盐含量较低,在提盐驯化初期两系统内盐浓度均较低,此时微生物能很快适应环境,对有机物有较高的去除效率[14]. 随着反应器内盐度的提升,微生物活性受到影响,两反应器的出水COD逐渐升高. 在提盐驯化阶段中期(第11—13 天)1.6%的系统出水的COD从320 mg·L−1上升至361.6 mg·L−1,去除率下降至93.4%. 而2.6%的系统在提盐驯化阶段末期(第20—36 天),第36 天其出水COD升高至462.4 mg·L−1,去除率下降至94.7%. 两系统去除率的下降主要是由于系统内盐度的不断升高,微生物活性受到抑制,部分微生物无法适应高渗透压的环境,脱水死亡. 同时无机盐的增多,使得系统中溶解氧传递效率降低,微生物活性受到影响[15]. 随着系统的逐渐稳定,进水SO2−4 浓度为1.6%的反应器在提盐驯化阶段末期(第14—20 天)出水COD开始逐渐下降,到第20 天时COD下降至208.3 mg·L−1,去除率达到了96.2%. 说明通过低负荷的驯化方式,微生物能够逐渐适应高盐环境,反应器可以实现快速启动. 而2.6%系统COD一直升高且持续到提盐驯化阶段末期(第20—36 天),且仍有上升趋势. 说明在盐度更高的环境下,微生物受到的抑制影响更显著,需要更长的适应周期.在1.6%系统的负荷提升阶段(第21 天至第40 天),将负荷提升至0.6 kg·(m3·d)−1COD,出水COD开始逐渐上升,在第26 天上升至305.6 mg·L−1,去除率为94.4%. 第26 天开始,通过添加尿素调整系统进水的C/N在25,出水的COD不断下降,最终稳定在140 mg·L−1左右,平均去除率为97.5%. 在负荷提升阶段的第41 天至第80天,控制负荷在0.75 kg·(m3·d)−1COD,尽管在第61 天后,进水COD浓度有所提升,在7500—8000 mg·L−1范围波动,出水COD仍然稳定在150 mg·L−1以下,平均去除率在97.5%以上. 在负荷提升的第三阶段,进水负荷提高至1.0 kg·(m3·d)−1COD时,初期出水COD逐渐上升,最终出水COD稳定在175 mg·L−1左右,平均去除率在97.2%左右(第100—110 天). 随着负荷的提高,该盐度系统下的有机物去除率尽管有所下降,但仍保持较高的有机物去除水平. 说明系统微生物能逐渐适应高盐环境,保持稳定的有机物去除效率[16].
在进水
SO2−4 浓度为2.6%反应器中,经过36 d的提盐驯化后,COD去除效率仍未上升. 从负荷稳定阶段的第40 d起,投加尿素调整2.6%系统进水的C/N在25左右,出水的COD逐渐下降,在第50 天下降至377.6 mg·L−1,去除率为95.71%. 从第51 天后,进水水质有所变化,SO2−4 浓度在2.3%左右,进水COD在7500—8000 mg·L−1. 降低进水盐度的前几 天(51—55 d),反应器的出水COD值出现短暂的上升现象,最高达到了390.4 mg·L−1. 可能是由于进水盐度的变化,导致微生物环境的渗透压发生变化,从而使得微生物降解污染物性能受到影响,COD出现升高[7]. 接下来随着系统的逐渐稳定,在第78 天,出水COD降低至288 mg·L−1,去除率为96.3%. 最终出水COD在280—295 mg·L−1的范围波动,平均去除率为96.4%.从上面分析可知,相较于进水
SO2−4 浓度为2.6%的系统,进水SO2−4 浓度为1.6%的系统在较高负荷下也能对有机物进行去除,说明在较低盐度下,微生物具有更出色的有机物降解能力. 有研究表明,更高的盐度会抑制微生物相关功能基因的转录过程,从而影响碳水化合物的降解[17]. 侯飞飞等[18]研究发现,经过耐盐驯化后的污泥在较低盐浓度的变化对系统CODCr去除率影响不大;而进水氯化钠浓度较高时,系统CODCr去除率随着氯化钠浓度的升高而降低. -
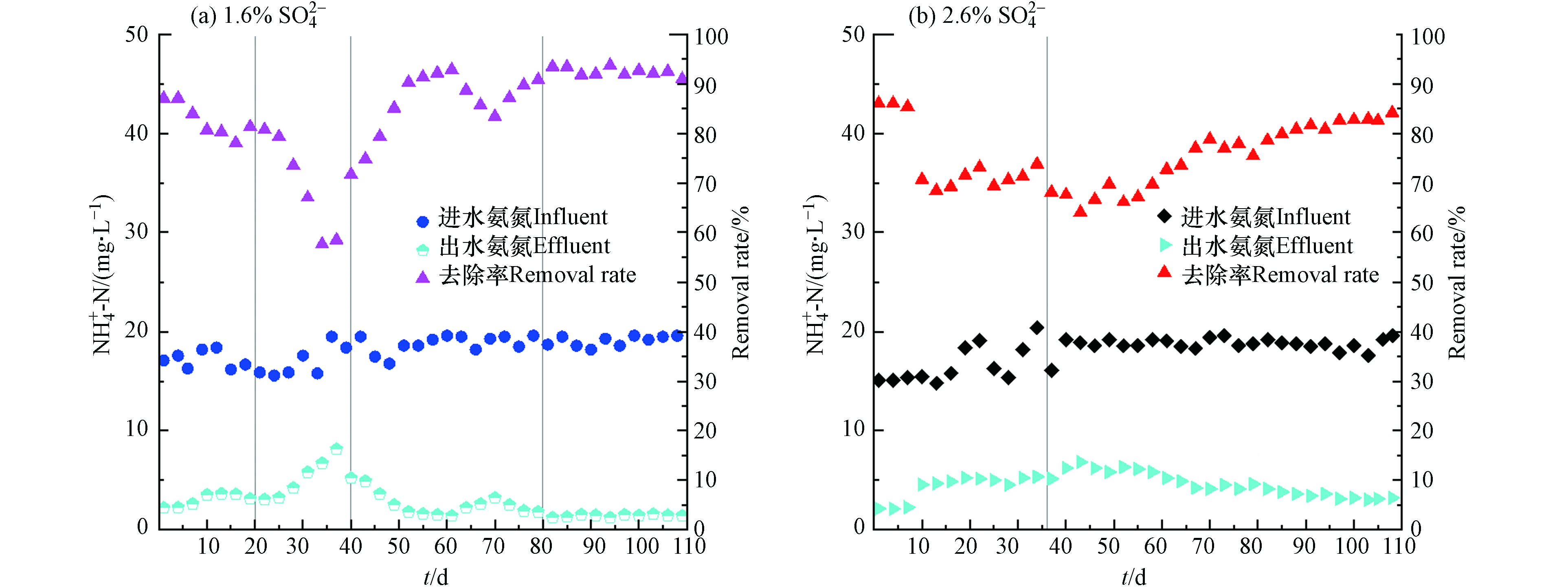
两反应器的氨氮及总氮去除率变化如图4所示. 在启动初期,进水SO42-浓度为1.6%的反应器进水氨氮浓度在15—20 mg·L−1之间(图4(a)),在提盐驯化期(第1—20 天),其出水的氨氮由2.2 mg·L−1上升至3.11 mg·L−1,去除率由87.1%下降至81.4%. 而进水SO42-浓度为2.6%的反应器(图4(b))进水氨氮浓度为15—20 mg·L−1,其在提盐驯化期(第1—40天),由2.12 mg·L−1上升至6.21 mg·L−1,去除率由86.0%下降至67.6%. 启动初期两个系统的氨氮去除率均呈现下降趋势,其主要原因可能为:硝化细菌有较长的世代周期,在高盐环境下更容易受到抑制[19];另一方面较高的无机盐环境会使得污泥混合液的粘性增加,降低溶解氧的传递效率,不利于硝化细菌的增殖[20- 21]. 此外,运行初期2.6%系统进水的有机物浓度远远高于1.6%系统,高浓度有机物的存在会抑制自养型硝化细菌的生长,使得接种污泥中的硝化细菌受到严重抑制,这可能也是2.6%系统氨氮去除率更低的原因[22].
在进水
SO2−4 浓度为1.6%的反应器负荷提升第一阶段(容积负荷为0.6 kgCOD·(m3·d)−1)初期(第21—26 天),氨氮的去除效果为80%. 考虑到可能是过高的C/N不利于硝化细菌的繁殖以及好氧体系的稳定,随后通过添加尿素控制进水系统C/N为25左右,氨氮保持在15—20 mg·L−1. 在负荷提升第一阶段的中期(第27—36天),出水氨氮值有所上升,上升至8.1mg·L−1,去除率下降至58%左右. 其原因可能是进水中投加了大量尿素,虽然大部分有机氮被微生物生长增殖做利用,但仍有一部分有机氮因氨化作用转化为氨态氮,使得体系内的氨氮有所增加,随后在硝化作用下,氨氮又呈现降低的趋势. 在负荷提升的第二阶段((容积负荷为0.72 kgCOD·(m3·d)−1)第41—80 天),反应器的出水氨氮进一步下降,最终稳定在1.5 mg·L−1左右(第68—80天). 尽管在第61天因进水COD浓度有所提升从而增加尿素投加量以继续控制C/N为25,使得第62—68 天内氨氮去除率稍有影响,然而经过稳定运行后氨氮去除率又恢复正常. 在负荷提升的第三阶段(第81—110 天),氨氮去除率仍保持在91%以上. 1.6%系统经过长期驯化,在高盐环境下能对氨氮进行有效去除,说明通过添加氮源调整合适的C/N,能有利于硝化细菌在高盐环境下的繁殖[23]. 2.6%系统的反应器在负荷稳定初期(第40 天)添加有机氮源使得C/N为25后,出水氨氮在第48 天上升至7.2 mg·L−1,去除率为61.3%. 随后氨氮又逐渐下降,但在负荷稳定期(第51 天),该反应器进水SO2−4 浓度下降至2.3%. 因体系内盐度的改变,短期内硝化细菌受到渗透压力的影响,出水氨氮第60天上升至5.2 mg·L−1,去除率为72.8%. 但是在负荷稳定中后期(第61—110 天),经过长期的驯化,出水氨氮逐步下降,最终稳定在3.5 mg·L−1以下,去除率在82%以上.从以上分析可以看出,同在C/N为25条件下,相较于2.6%的系统,1.6%系统的反应器对氨氮更高的去除率,说明通过耐盐驯化,系统中的硝化细菌能够适应高盐环境,发挥作用. 但是随着盐度的提升,硝化细菌会受到抑制,更高的盐度下,系统的硝化性能会下降[9]. 于德爽等[10, 24]开展了盐分对硝化反应的影响研究,结果表明,当进水无机盐浓度小于14 g·L−1,系统硝化反应未受影响,氨氮去除率稳定在95%以上,而继续提高进水含盐量至21 g·L−1时,氨氮去除率下降至91.1%
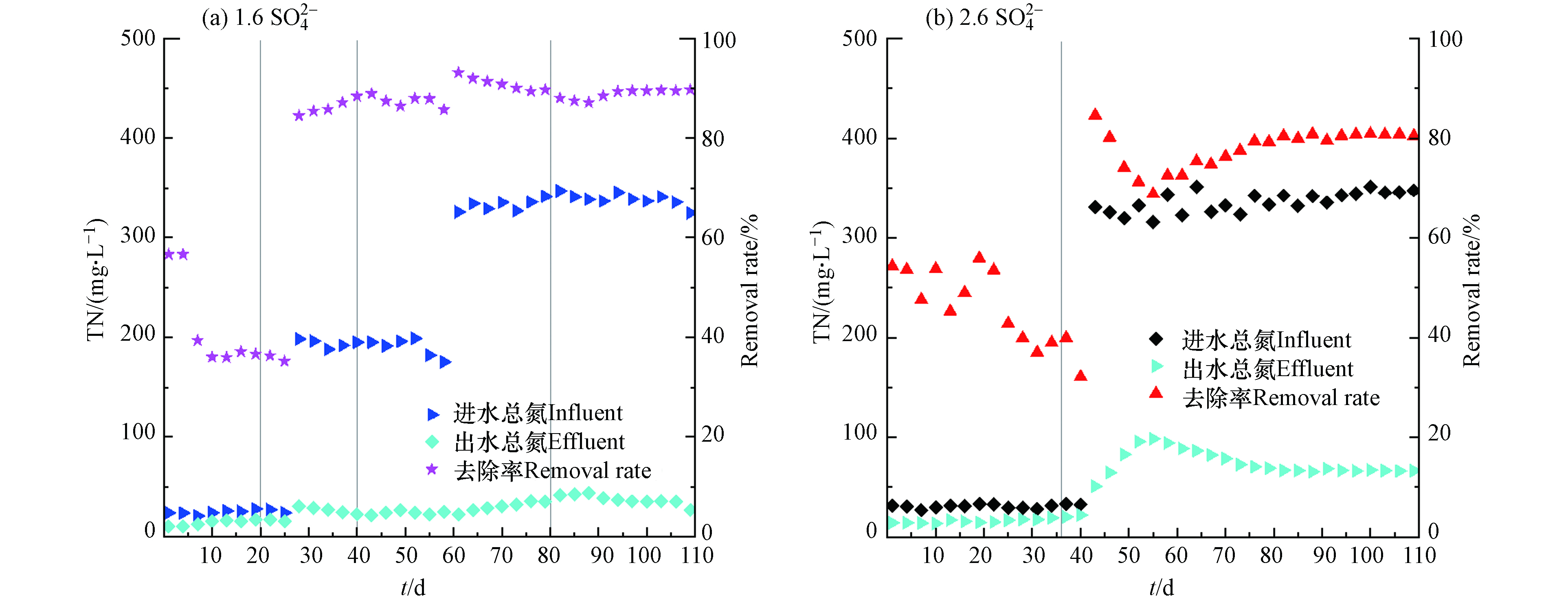
有研究表明[21],MBR体系因能有效截留系统中的微生物,同时能保持较高的污泥浓度,系统中会形成局部缺氧或厌氧的环境,为反硝化细菌的增殖创造条件. 因此MBR工艺能在集成式的反应装置中做到同步的硝化反硝化,进而达到去除TN的效果. 为了验证两套反应装置对TN是否有去除效果,对系统进出水的TN进行了跟踪监测. 两种进水
SO2−4 浓度反应器的总氮及去除率变化如图5所示,运行初期,两种进水SO2−4 浓度下的出水总氮均较低,但都呈上升趋势,去除率也一直降低. 如图5(a),在提盐驯化期(第1—20 天)进水SO2−4 浓度为1.6%的反应器进水总氮为20—25 mg·L−1,出水从10.3 mg·L−1上升至15.6 mg·L−1,去除率从56%下降至35.2%. 同样是在提盐驯化期(第1—36 天)进水SO2−4 浓度为2.6%的反应器进水总氮浓度为28—30 mg·L−1,出水总氮从14.3 mg·L−1上升至22.1 mg·L−1,去除率下降至32.2%. 两种进水SO2−4 浓度的反应器前期的总氮去除效率均很低. 其原因可能是过高的C/N不利于脱氮体系的建立,同时硝化细菌受到高浓度无机盐的影响,不能有效的将氨氮转化为硝态氮,使得反硝化作用受到影响[14].进水
SO2−4 浓度为1.6%反应器在负荷提升初期(第26天)为了控制进水C/N为25左右,进水中添加了尿素补充有机氮源,总氮在180—200 mg·L−1. 出水总氮在24—26 mg·L−1波动(第26—61天),其平均去除率在86%左右. 在负荷提升第二阶段中期(第61天)增加了尿素的投加量,TN在320—350 mg·L−1,出水TN有所上升,最终在35—40 mg·L−1内波动,其去除率在88%以上. 在负荷提升第三阶段初期(第81—88 d),出水TN小幅度上升至43.5 mg·L−1,最终稳定在35 mg·L−1左右(第89—110 天),平均去除率为89.5%.SO2−4 浓度为2.6%的反应器在提盐驯化结束后(第36天),其对总氮的去除效果仍较低. 在负荷稳定初期(第40天)补充了有机氮源,进水总氮控制在320—350 mg·L−1,其出水总氮不断上升,在负荷稳定期(第55天),上升至98.4 mg·L−1,去除率下降至68.8%. 随后经过稳定运行,2.6%系统的出水总氮浓度稳定在66.5 mg·L−1左右,平均去除率为80.7%.在本研究中,两套系统的进水有机物含量很高C/N严重失衡,为了建立稳定的好氧体系,同时在两套装置中添加尿素作为有机氮源,控制两系统的C/N为25左右,经过长期运行发现,两种进水
SO2−4 浓度的反应器对总氮均有一定的去除效率,但去除效果有所差异. 有研究表明,MBR系内TN的去除依赖于同步硝化反硝化的脱氮体系的建立,在本研究的装置中盐浓度和污泥浓度较高,溶解氧传递效率受到影响[25],反应器内存在局部缺氧的环境,再经过长期的稳定运行,建立了同步硝化反硝化的脱氮体系,对TN具有一定的去除效果. 研究发现1.6%系统具有很好的脱氮性能,总氮去除率能控制在89%以上,然而2.6%系统的出水总氮仍很高. 原因可能是:本研究中TN以有机氮为主,好氧体系中有机氮的去除依赖于微生物增殖代谢对氮源的利用,同时还有一部分有机氮因氨化作用转化为氨氮,最后通过硝化反硝化作用去除. 在2.6%系统内由于盐浓度较高,微生物增殖受到影响,同时由于硝化细菌对无机盐更加敏感,硝化作用受损,脱氮效率降低;此外溶解氧对MBR的脱氮性能有着重要影响,两系统的溶解氧虽然控制在相同范围,但2.6%系统的更高的无机盐使得系统中的溶解氧传递受到影响,从而影响系统的同步硝化反硝化的性能[26]. -
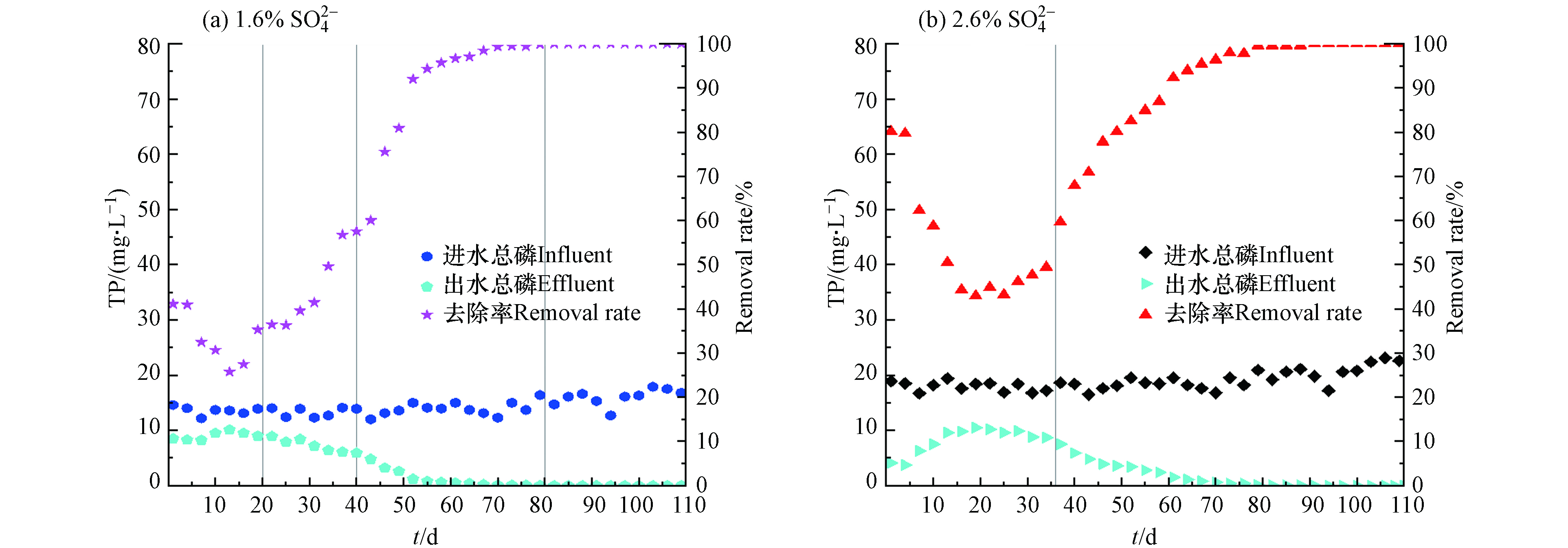
为了探究高盐环境下MBR装置能否有效去除水中的磷,对进出水的总磷进行了检测,图6所示为总磷去除效果变化情况. 如图6(a),1.6%系统的进水总磷较低,为13—15 mg·L−1. 其出水在提盐驯化初期(第1—13天)总磷上升从8.27 mg·L−1至10.1 mg·L−1,去除率从40.9%下降至25.7%左右. 进水
SO2−4 浓度为2.6%的反应器的进水总磷质量浓度较高(图5b),在18—20 mg·L−1左右,同样在提盐驯化初期(第1—22天),其出水总磷由3.75 mg·L−1逐渐升高至10.5 mg·L−1,去除率从79%下降到44.8%左右. 两种不同进水SO2−4 浓度的反应器在运行初期,出水总磷的含量均呈现升高现象,一方面可能是由于启动初期,体系内的无机盐浓度不断升高,部分微生物细胞裂解死亡,细胞内的磷逐渐释放而出;另一方面由于环境盐度的提升,系统中的聚磷菌受到一定抑制,致使出水总磷不断升高.但随着运行时间的延长,两系统的总磷去除率逐渐恢复正常. 1.6%系统的出水总磷在提盐驯化末期(第15 天)从9.5 mg·L−1开始降低,在负荷提升初期(第26 d)降低至7.9 mg·L−1,去除率为36.3%. 随后1.6%系统开始排泥,控制SRT为44 d,出水的总磷进一步下降,在第51天降低至2 mg·L−1以下,最终低于检测限. 2.6%系统的出水总磷在提盐驯化中期(第22 d)从10.2 mg·L−1开始逐渐降低,提盐驯化末期(第35天)时出水总磷降低至8.7 mg·L−1,去除率达到了72.4%. 第35天,2.6%系统开始排泥,同样控制SRT为44 d,而后出水的总磷进一步降低. 在负荷稳定期(第61天)出水总磷降低至2 mg·L−1以下,最终出水总磷低于检测限.
关于磷的去除目前有学者提出了多种理论,多数人认为:磷的去除依赖于微生物在厌氧/好氧的交替的环境下进行“厌氧释磷,好氧过量吸磷”. 但也有学者指出在单级好氧条件中,活性污泥中的聚磷菌能将环境中的磷酸盐存储于体内,通过“好氧吸磷”的作用将磷去除[27]. 例如,王东波[28]认为生物除磷的本质是强化活性污泥中聚磷微生物对磷的富集,并转化为体内的聚磷酸盐的作用. 在好氧+间歇缺氧条件下驯化出能对多聚物水解产生的能量进行利用增殖的聚磷菌,也能对磷起到很好的去除效果,其去除率能达90%以上. 还有人指出在生物除磷过程中胞外聚合物(extracellular polymeric substances, EPS)也会储存相当数量的磷,对水中的磷进行有效去除[29]. 例如,Long[30]研究表明,EPS的除磷量占系统除磷量的60%—62%,细菌细胞的除磷量占系统除磷量的30%—38%. 在本研究中一部分磷的去除可能依赖于微生物对高盐环境的逐渐适应,将磷用作自身增殖,同时产生大量的EPS储存了部分磷. 还有一部分磷的去除可能由于活性污泥经过驯化,繁殖出能在缺氧和好氧环境下利用多聚物进行增殖的聚磷微生物,对系统中的磷进行吸收,而系统排泥后将磷进一步去除[28].
-
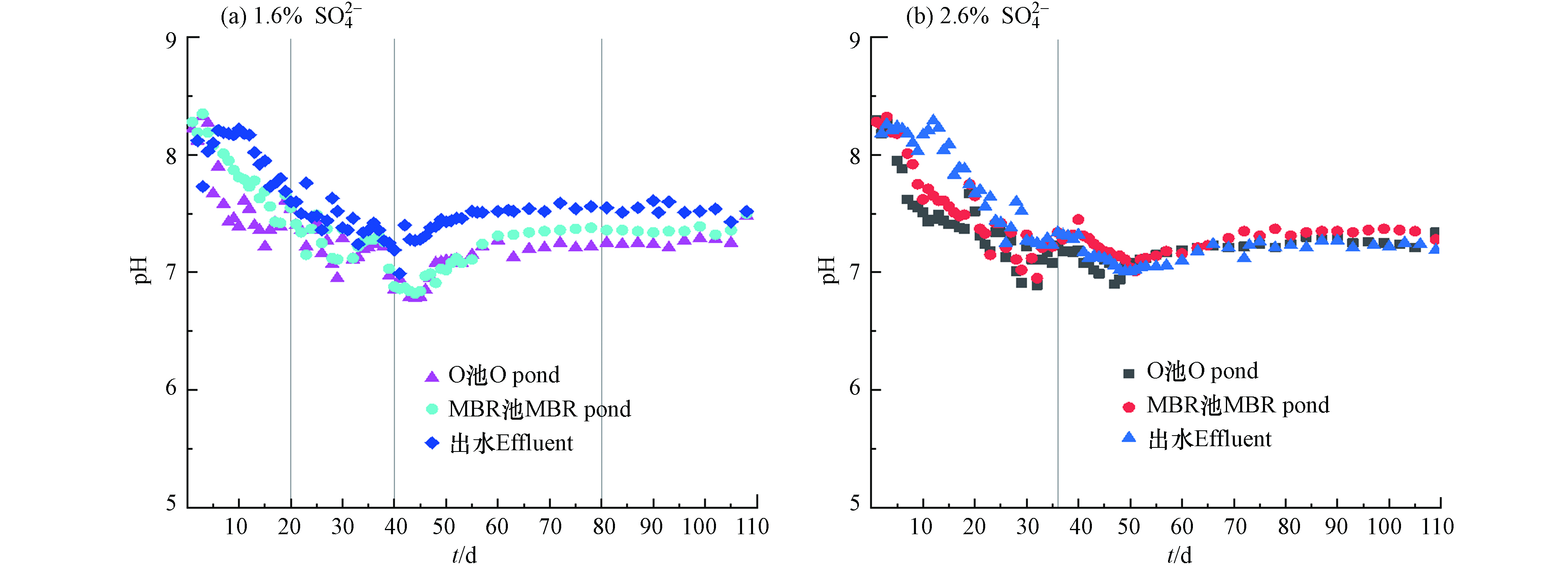
pH对MBR体系中生物作用有着显著的影响,为了监测两反应器装置内微生物体系是否稳定,对反应装置的O池、MBR池和出水的pH进行了跟踪检测. 两反应器进水pH在3.8—4.2之间,接种污泥初始pH在8.2—8.3左右. 其中进水
SO2−4 浓度为1.6%的反应器在提盐驯化期(第0—20 天)由于进水的置换作用,O池、MBR池和出水的pH一直呈现下降的趋势,分别从8.22、8.28和8.12下降至7.54、7.55和7.6(图7(a)). 同样进水SO42-浓度为2.6%的反应器在提盐驯化期(第0—40天) 其O池、MBR池和出水的pH分别从8.3、8.28和8.18下降至7.19、7.45和7.32(图7(b)).在负荷提升期第一阶段(第21—40天),进水
SO2−4 浓度为1.6%的反应器O池、MBR池和出水的pH仍是在不断降低,在第40 d降低至6.85、6.88和7.19. 考虑到可能是由于进水低pH的冲击,进水量的增加使得体系内pH进一步下降,过低的pH环境不利于MBR体系建立硝化与反硝化作用相对稳定的动态平衡体系. 在负荷提升期第二阶段初期(第43天)调节该系统的进水pH为7.0—7.2,随后体系内的pH逐渐上升,最终O池pH、MBR和出水pH分别稳定在7.2—7.3、7.3—7.4和7.5左右.同样进水
SO2−4 浓度为2.6%的反应器O池、MBR池和出水的pH第47 d下降至6.9、7.13和7.06,随后开始调节该进水的pH为7.0—7.2左右,其体系内pH逐渐上升并趋于稳定,最终(第69—110天)分别稳定在7.2—7.3、 7.3—7.4和7.2—7.3. 有研究表表明,生物反应器的硝化作用会导致体系内的pH降低,需要补充进水碱度以维持生物系统的硝化性能. 当投加NaOH保持pH接近7.5时,系统的硝化作用会显著增强[31]. 本研究在运行中期通过补充两种SO2−4 浓度反应器的进水pH使得两系统的硝化处于稳定状态[32],最终达到良好的运行环境. -
(1)
SO2−4 浓度对MBR运行效果影响较大,盐度越高对微生物的抑制作用更明显,进水SO2−4 浓度为1.6%的系统比2.6%的能获得更高的有机负荷和COD去除率. 其中1.6%系统在容积负荷为1.0 kg·(m3·d)−1 COD的条件下,出水COD始终在200 mg·L−1以下,去除率高达97.7%,而进水SO2−4 浓度为2.6%的系统对有机物的降解受到明显抑制,在负荷为0.5 kg·(m3·d)−1COD的条件下,出水COD终在200 mg·L−1以上,去除率为96.4%.(2)通过耐盐驯化,系统中的硝化细菌能够适应高盐环境. 但是随着盐度的提升,硝化细菌会受到抑制,更高的盐度下,系统的硝化性能会下降.
(3)通过长时间的运行,两套MBR装置均建立了同步硝化反硝化的脱氮体系,对总氮具有一定的去除效率. 但由于硝化细菌对高盐环境的敏感性,在不同盐浓度下表现出不同的硝化性能,同时系统中的溶解氧传递受到无机盐浓度的影响,致使进水
SO2−4 浓度为1.6%系统总氮的去除率要优于进水SO2−4 浓度为2.6%系统.(4)体系内微生物能很快适应高盐环境利用磷进行增殖,同时还有一部分能在好氧或缺氧条件下利用多聚物水解进行增殖的聚磷菌,有效“吸磷”,两套MBR装置对总磷均能达到全部去除的效果.
MBR处理不同浓度高硫酸盐有机废水效能比较
Performance comparison of MBRs in treating organic wastewater with different concentrations of sulfate
-
摘要: 针对食品加工过程中产生的高
SO2−4 有机物废水,采用MBR工艺对其进行处理研究,分别考察了1.6%和2.6%SO2−4 浓度下反应器容积负荷和污染物去除情况. 经过110天的运行时间发现,进水SO2−4 浓度为1.6%的系统能获得更高的容积负荷和污染物去除效率,其最大容积负荷为1.0 kg·(m3·d)−1 COD, COD去除率为97.7%;而另一方面较高的无机盐环境进水SO2−4 浓度为2.6%SO2−4 系统下,获得的最大容积负荷仅为0.5 kg·(m3·d)−1 (按COD算),COD去除率为96.4%. 在2.6%SO2−4 浓度下,微生物受到的抑制更强,有机物降解效果低于1.6%SO2−4 的系统. 此外,氨氮的去除效果也受盐度的影响,1.6%SO2−4 系统的氨氮去除率可达91%以上,而2.6%SO2−4 系统的氨氮去除率在82%左右. 通过长时间的运行,两套MBR装置均建立了同步硝化反硝化的脱氮体系,对总氮具有一定的去除效率. 其中1.6%SO2−4 系统中总氮的去除率为89.5%,而2.6%SO2−4 系统中总氮的去除效率为80.7%. 两套反应器装置对总磷均能达到100%的去除效果. 综上,不同盐度对MBR体系容积负荷和有机物去除率具有显著影响. 相比于2.6%SO2−4 ,1.6%SO2−4 浓度条件下能获得更高的容积负荷和更好的污染物去除效果. 本研究可为MBR应用于高盐高浓度有机物废水的处理提供理论基础和实践指导.Abstract: The membrane bioreactor (MBR) was used to treat the organic wastewater with highSO2−4 produced in the food processing process, and the reactor volume load rate (VLR) and organic pollutant removal efficiency were compared with differentSO2−4 concentration at 1.6% and 2.6% respectively. the reactors operated for 110 d, and it was found that the reactor with influent of 1.6%SO2−4 could obtain higher VLR of 1.0 kg· (m3· d)−1 COD and better COD removal efficiency of 97.7%. However, for the influent of 2.6%SO2−4 , the maximum VLR and COD removal efficiency were only 0.5 kg· (m3· d)−1 COD and 96.4% respectively. With the concentration of 2.6%SO2−4 , the inhibition effect of the salinity on the microorganisms was stronger than that of 1.6%SO2−4 , thus the degradation efficiency of organic matter was lower at 2.6%SO2−4 . In addition, the removal efficiency of ammonia nitrogen was also affected by salinity, which was verified by the fact that ammonia nitrogen removal efficiencies were 91% and 82% at concentrations of 1.6%SO2−4 and 2.6%SO2−4 respectively. After a long-term operation period, two sets of MBR units had established simultaneous nitrification and denitrification systems. The removal efficiency of total nitrogen was 89.5% in 1.6%SO2−4 system, while that was 80.7% in 2.6%SO2−4 system. Moreover, 100% removal efficiencies for total phosphorus in two reactors were obtained. In conclusion, different salinity presented significant influence on the VLR and organic matter removal in the MBR system. Compared with the reactor of 2.6%SO2−4 , the reactor of 1.6%SO2−4 could obtain higher VLR and better pollutant removal efficiency. This study can provide theoretical basis and practical guidance for the application of MBR in the treatment of high-salt and high-concentration organic wastewater. -
高氯酸盐化学性质稳定,水溶性高,吸附性低,广泛存在于环境介质中。由于高氯酸盐具有与碘离子相似的离子半径和相同的电荷数,可以与碘离子竞争钠/碘同向转运体(NIS)的结合位点,从而抑制碘的吸收,干扰甲状腺激素的合成,引起机体代谢的紊乱[1-2]。欧洲食品安全局(EFSA)评估人体暴露高氯酸盐的风险,结果表明长期摄入高氯酸存在潜在风险,尤其是孕妇、胚胎、婴儿及碘缺乏的年轻群体最容易受到危害[3]。
我国是世界上最大的茶叶种植国,也是第二大茶叶出口国。2016年初中国出口欧盟的茶叶中频繁检出高含量的高氯酸盐,对中国茶叶出口产生极大负面影响。此前,美国环保局(US EPA)将高氯酸的参考剂量设定为0.0007 mg·(kg ·d)−1[4],欧盟建议成员国的干茶中
ClO−4 ClO−4 在茶叶样品前处理方面,由于高氯酸盐属于无机阴离子,在水中溶解度高,因此选用高纯水提取茶叶中高氯酸盐。茶叶基质复杂,往往含有多种有机化合物和无机矿物元素,高纯水在提取高氯酸盐时也导致许多水溶性物质溶解在提取液中。因此,为了防止其它共存物质干扰检测结果,本研究首先用OnGuard Ⅱ RP柱处理,去除提取液中有机物,以达到离子色谱的进样要求,减少样品对色谱柱耐受的影响。然后选用对高氯酸盐专属性较好的离子色谱柱进行分离,良好的色谱分离极大减少了共存离子的干扰,提高了测定准确度。另外,用纯水直接对高氯酸盐进行提取亦可很好地模拟泡茶的过程,更能体现人体通过饮用茶水摄入高氯酸盐的真实水平。通过实验条件优化,建立了快速准确的茶叶样品中高氯酸盐的离子色谱-串联质谱分析方法,为茶叶检测分析提供方法学参考。
1. 材料与方法(Material and method)
1.1 仪器与设备
ICS2000型离子色谱仪(美国,Thermo Fisher),免化学试剂淋洗液自动发生器(美国,Thermo Fisher),AS自动进样器(美国,Thermo Fisher);IonPacAS19型阴离子分析柱(250 mm×2 mm)(美国,Thermo Fisher),IonPacAG19型保护柱(50 mm× 2mm)(美国,Thermo Fisher);IonPacAS20型阴离子分析柱(250 mm×2mm)(美国,Thermo Fisher),IonPacAG20型保护柱(50 mm×2 mm)(美国,Thermo Fisher);ASRS 3000 2 mm阴离子抑制器(美国,Thermo Fisher)。API 32000三重四极杆LC-MS/MS 系统(美国,Applied Biosystems)。METTLER TOLEDO 电子天平(美国,METTLER TOLEDO ),A11基本型研磨机(德国,IKA),KS4000 i control 温控摇床(德国,IKA),3-18k高速冷冻离心机(德国,Sigma),QL-901旋涡混合器(中国,其林贝尔)。
1.2 试剂与材料
0.45 μm尼龙针头过滤器(中国,卅克),一次性无菌注射器(5 mL,江苏治宇医疗器械有限公司),OnGuard Ⅱ RP-1cc前处理柱(美国,Thermo Fisher)。超纯水为Milli-Q Advantage A10系统(美国,Millipore)于电阻率为18.2 MΩ·cm下提供,1000 mg·L−1的高氯酸盐标准品溶液(美国,Sigma,色谱纯),500 μg·L−1的18O4—高氯酸盐内标储备液(美国,Cambridge Isotope Laboratories,4 ℃冰箱保存),甲醇(美国,Thermo Fisher Scientific,色谱级)。
1.3 色谱与质谱条件
色谱系统:进样量为100 μL,流速为0.25 mL·min−1,采用EGC淋洗液(KOH)自动发生器控制淋洗液梯度,抑制器采用外接水模式,抑制电流25 mA。AS19和AS20色谱柱采用不同淋洗程序,柱温均为30 ℃。
AS19梯度淋洗程序:0—15 min,10 mmol·L−1;15—25 min,10—40 mmol·L−1;25—30 min,40 mmol·L−1;30.1—38 min,10 mmol·L−1。
AS20等度淋洗程序:0—22 min,35 mmol·L−1。
质谱条件:离子源为ESI源,在负离子模式下以MRM模式进行监测。气帘气(curtain gas):20 psi;碰撞气(collision gas):5 psi;离子喷雾电压(IonSpray Voltage):−4500 V。离子源温度(Temperature):500 ℃;雾化气(Gas 1):55 psi;加热气(Gas 2):55 psi。
检测的离子对及其对应质谱参数见表1。
表 1 质谱检测条件Table 1. Experimental conditions of electrospray tandem mass spectrometry化合物Compound 离子对Q1/Q3 Q1/ Q3 解簇电压/V DP 入口电压/V EP 碰撞入口电压/V CE 碰撞出口电压/V CXP ClO4− 98.8/82.8* −45 −8.8 −35 −9 100.8/84.9 −45 −8.5 −35 −9 Cl18O4− 106.9/88.8* −50 −10 −35 −5 注:*定量离子对.*quantitative ion pair 1.4 标准溶液配制
高氯酸盐储备液:将高氯酸盐标准品溶液1000 mg·L−1用超纯水稀释至500 μg·L−1储存于4 ℃冰箱中保存备用。
高氯酸盐标准溶液的配制:用高氯酸盐储备液与18O4标记的高氯酸盐内标储备液配制高氯酸盐标准溶液,将高氯酸盐储备液用高纯水稀释至0.05、0.1、0.2、0.5、1、2、5、10、20、50 μg·L−1获得高氯酸盐标准溶液,其中18O4标记的高氯酸盐内标浓度均为5 μg·L−1。
1.5 茶叶样品的前处理
首先将茶叶放入研磨机进行研磨,得到均匀粉末状的茶叶样品。称量0.5 g茶叶样品放入50 mL离心管中,加入超纯水浸泡茶叶数次,以萃取样品中的高氯酸盐。每次浸泡使用超纯水20 mL,浸泡一定时间后,以10000 r·min−1的速度离心5 min,取出上清液,最后将3次浸泡得到的上清液合并,得到高氯酸盐萃取液。取5 mL萃取液用0.45 μm尼龙滤膜过滤,再用OnGuard Ⅱ RP-1cc进行有机物的去除,弃掉前3—4 mL萃取液,收集1 mL萃取液为上机测试样品。OnGuard Ⅱ RP-1cc柱在使用前须用4 mL甲醇和10 mL超纯水进行活化。
1.6 回收率实验
准备28份茶叶样品,以每组7份平行样品分为4组,分别为原茶叶样品及低、中、高加标茶叶样品,其中低、中、高加标茶叶样品加入的高氯酸盐浓度为100、300、600 μg·kg−1。将4组样品同时进行上述“1.5”节前处理后进样分析,计算回收率。
2. 结果与讨论(Results and discussion)
2.1 前处理条件的优化
高氯酸盐在水中稳定且溶解度高,同时考虑到饮茶的实际情况,因此选用高纯水浸泡茶叶以提取其中高氯酸盐。高纯水提取茶叶中的高氯酸盐也成功避免了溶剂峰对分析结果的干扰。本研究对不同浸泡条件(包括浸泡次数、浸泡时间、水的温度及是否振荡浸泡)进行优化,确定茶叶中高氯酸盐最佳萃取条件。
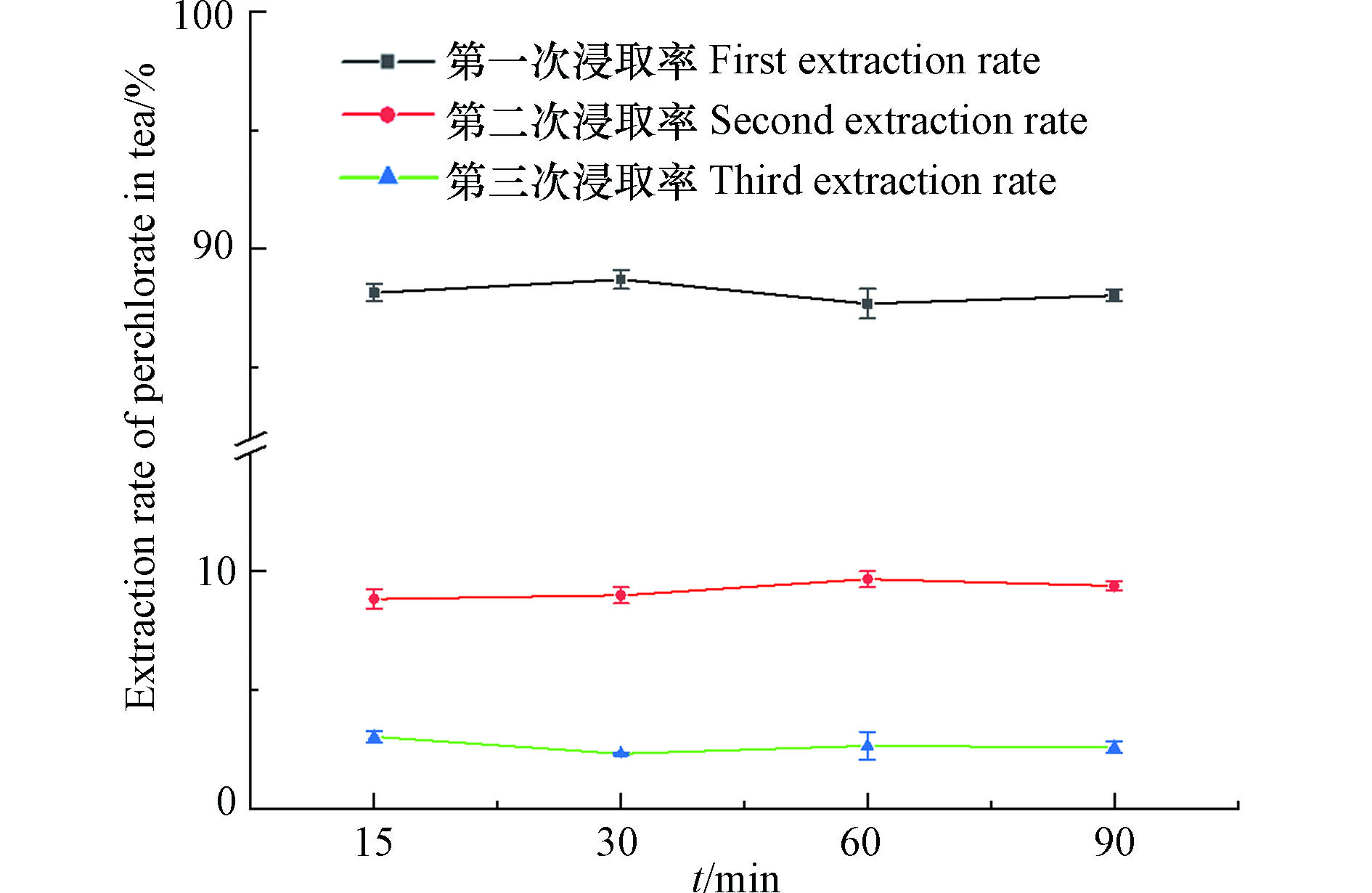
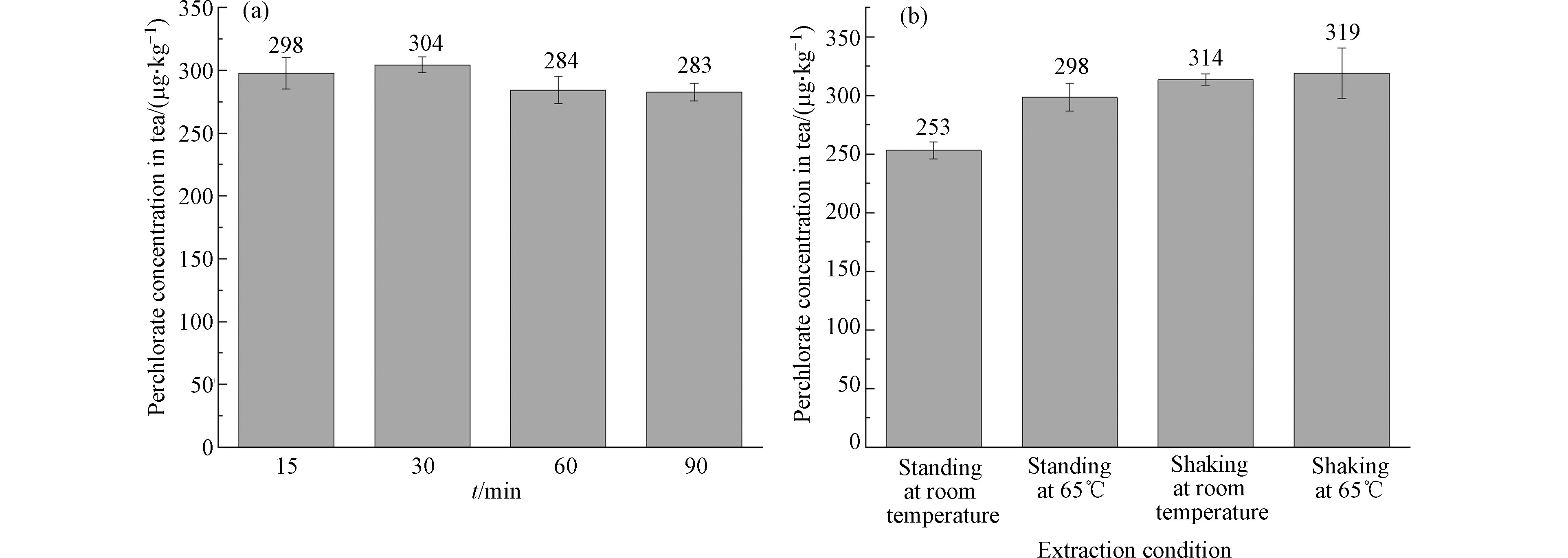
首先对茶叶浸泡次数和时间进行优化,将茶叶样品按上述“1.5节”方法进行前处理,每次使用20 mL高纯水,浸泡时间分为15、30、60、90 min,共浸泡3次,将每次浸泡的上清液进行处理后检测,根据3次提取量之和计算每次提取的效率。如图1所示,随着浸泡次数的增加,高氯酸盐的浸出量不断减少,第1次最高,浸出量占总浸出量的88%—89%,第3次浸泡提取时高氯酸盐浸出量仅为总浸出量的2.3%—3.0%,因此可认为茶叶经3次浸提后高氯酸盐浸出接近完全。不同浸泡时间下的高氯酸盐浸出量如图2(a)所示,这4组茶叶的高氯酸盐总浸出量范围为283—304 μg·kg−1,相对标准偏差为4.3%。上述结果表明浸泡时间对茶叶中高氯酸盐的萃取效率影响较小,最终选取15 min为提取时间。
最后考察水温和振荡浸泡对茶叶中高氯酸盐浸出量的影响,设置4组茶叶反复浸泡3次,4组茶叶分别选取室温振荡浸泡、室温静置浸泡、65 ℃振荡浸泡及65 ℃静置浸泡的方式,得到各自提取量结果,如图2(b)所示。由图2可知,静置条件下水温对高氯酸盐的浸出量有较大影响。振荡条件下,室温和65 ℃浸出的高氯酸盐量相差不大,但均优于静置提取的效率。因此,本研究最终选择在室温下振荡提取高氯酸盐。

2.2 色谱柱的选择
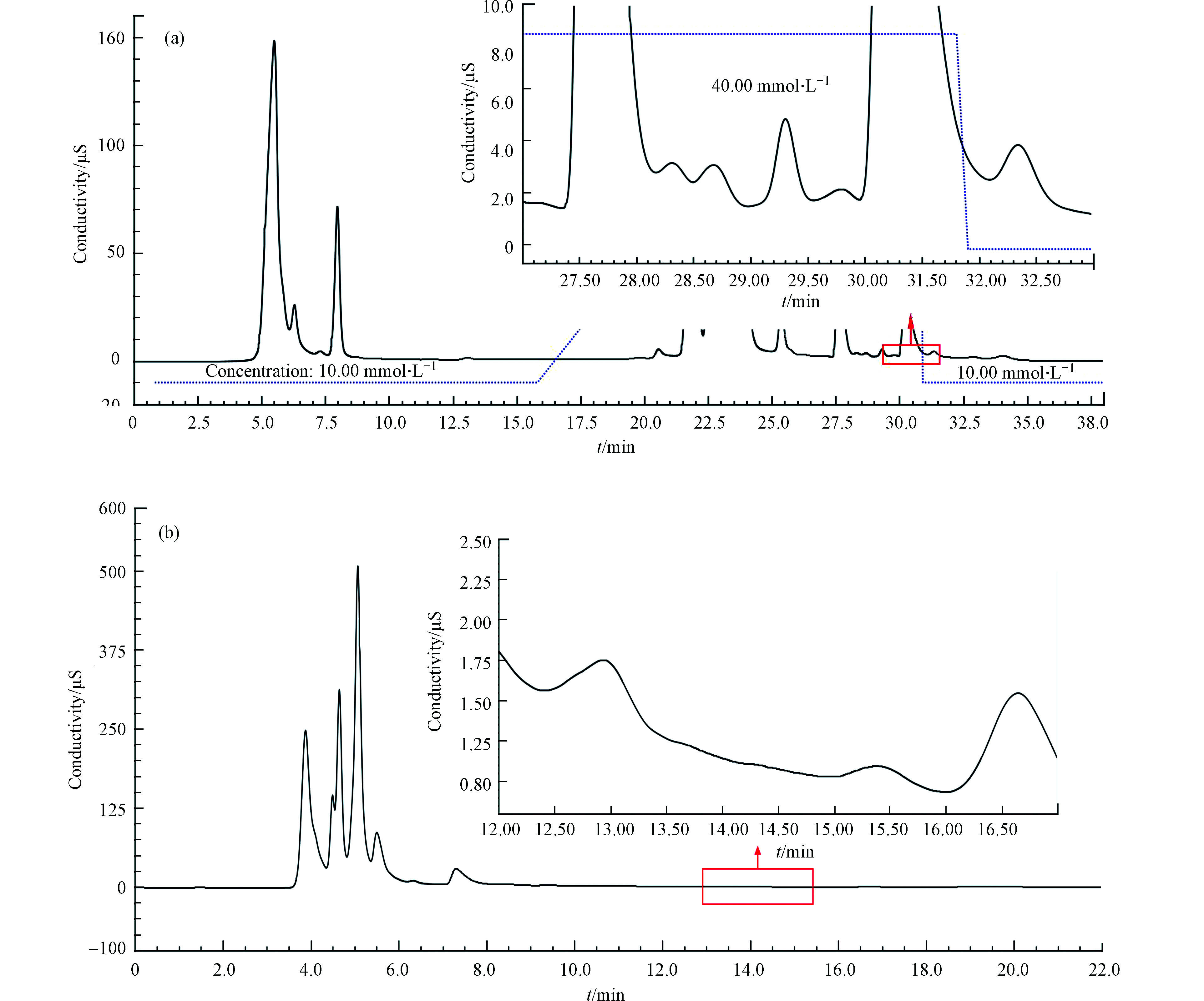
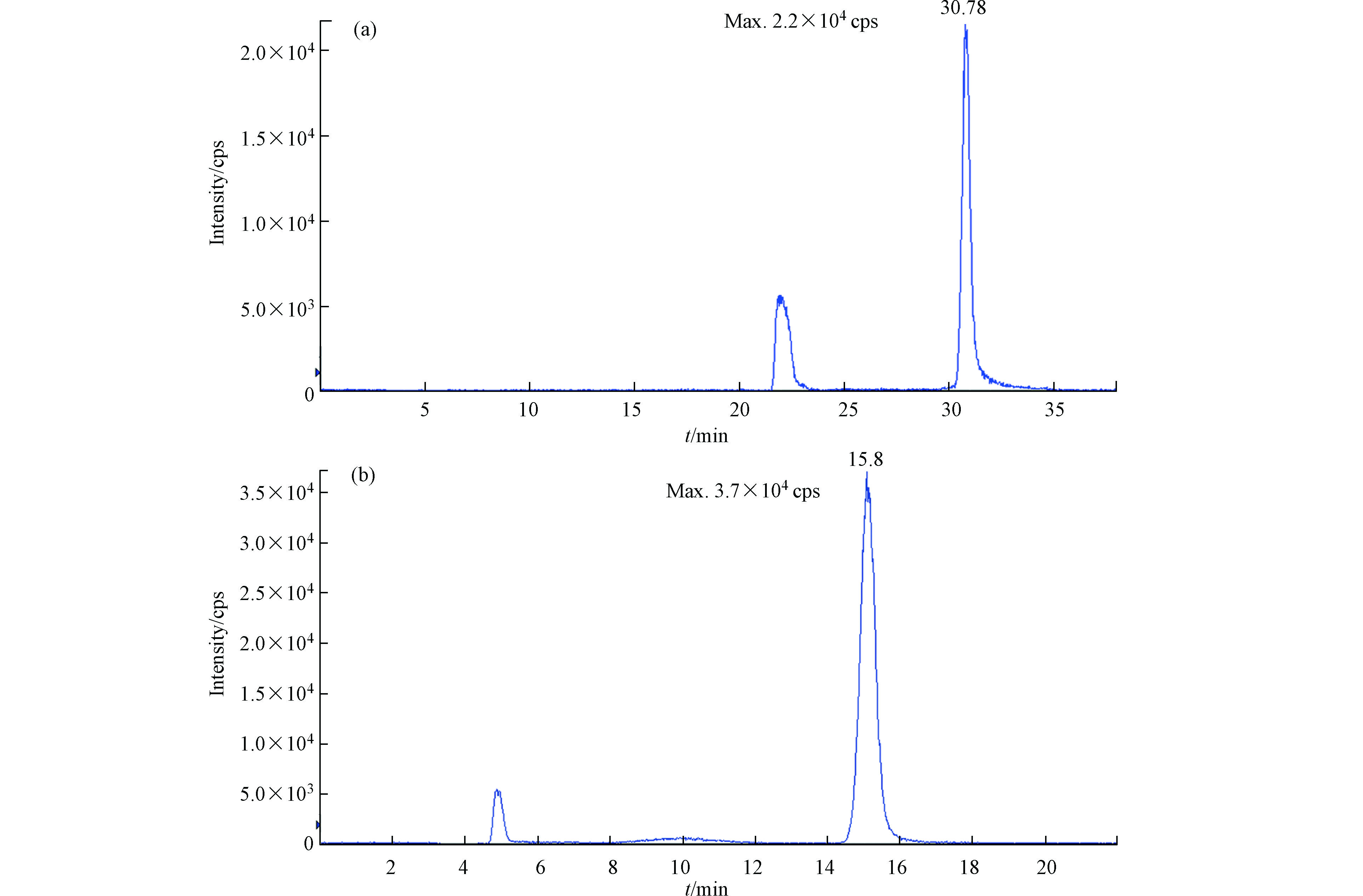
高氯酸根为疏水性强易极化的阴离子,本研究对AS19色谱柱和AS20色谱柱分离茶叶中高氯酸盐的效果进行比较,其中AS20色谱柱的亲水性较强,AS19色谱柱亲水性适中。图3为离子色谱电导检测时的色谱图,可以看出茶叶基质复杂,干扰较多。AS19分离时,高氯酸出峰的位置(30.78 min)有明显的干扰峰,而在AS20色谱柱中高氯酸盐(保留时间:15.08 min)和干扰离子却能实现很好的分离。另外,在AS20色谱柱中高氯酸盐的保留时间(15.08 min)是AS19色谱柱(30.78 min)的一半,意味着AS20对高氯酸盐的分离效率更高。从质谱检测的色谱图可知(图4),茶叶经AS19色谱柱分离的高氯酸盐响应(2.2×104 cps)明显低于AS20色谱柱(3.7×104 cps),进一步说明AS19色谱柱在分离茶叶样品时与高氯酸盐共淋洗的物质使质谱检测产生较明显的基体抑制效应。而AS20作为分离柱时,茶叶中与高氯酸盐共存的基质阴离子均可与高氯酸盐实现较好的分离,质谱的基质效应较小,高氯酸盐在质谱检测中响应较高。因此考虑到相较于AS19色谱柱,AS20色谱柱具有对高氯酸盐的分离效果更好,用时更短,效率更高的优点,最终选用AS20作为高氯酸盐的色谱分离柱。
2.3 方法性能
2.3.1 线性范围与检出限
将配制的一系列浓度(0.05—50 μg·L−1)高氯酸盐标准溶液进样分析后,以高氯酸盐的浓度为X轴,对应的高氯酸盐(98.8/82.8)与同位素标记的高氯酸盐(106.9/88.8)峰面积的比值为Y轴,绘制标准曲线为Y=0.0223X+0.000513,所得线性相关系数为R2=0.9998。以3倍和10倍信噪比确定仪器的检出限和定量限分别为0.014 μg·L−1和0.05 μg·L−1,转化成实际样品中高氯酸盐的检出限和定量限分别为1.7 µg·kg−1和6 µg·kg−1。
2.3.2 重复性与回收率
根据上述方法进行回收率实验,结果如表2所示。其中未加标茶叶样品中高氯酸盐浓度的相对标准偏差(RSD)为1.7%。3个加标水平的高氯酸盐回收率分别在94.6%—133%、101%—118%和101%—109%之间,说明该方法可用于茶叶中高氯酸盐的准确测定。
表 2 精密度与回收率实验结果Table 2. Experimental results of precision and recovery序号 Number 未加标茶叶中高氯酸盐浓度 /(μg·kg−1) Perchlorate concentration in unspiked tea 回收率/% Recovery 加标浓度100 μg·kg−1 Spiked concentration at 100 μg·kg−1 加标浓度300 μg·kg−1 Spiked concentration at 300 μg·kg−1 加标浓度600 μg·kg−1 Spiked concentration at 600 μg·kg−1 1 285 96.8 101 101 2 276 133 118 103 3 287 100 103 108 4 280 95.9 107 104 5 273 95.7 102 107 6 283 94.6 101 109 7 282 97.9 102 103 平均 281 102 104 105 RSD 1.7% 14% 5.7% 2.9% 2.4 实际样品测定
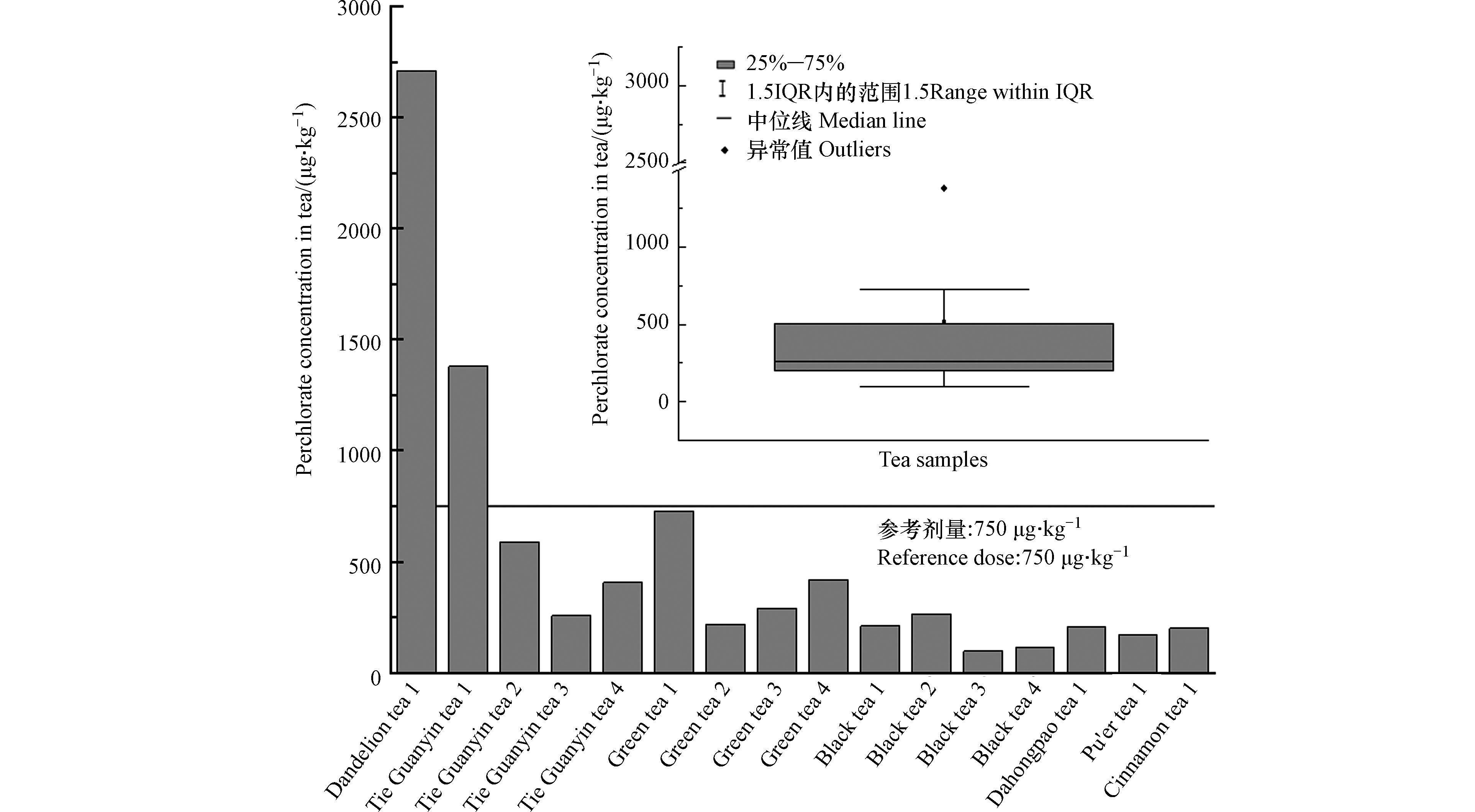
在超市随机选购16个品牌的茶叶样品,包括蒲公英茶(1种)、铁观音(4种)、绿茶(4种)、大红袍(1种)、普洱茶(1种)、肉桂茶(1种)。经上述前处理过程和检测后,发现所有样品中均检出高氯酸盐,浓度范围为97.0—2.71×103 μg·kg−1,如图5所示,其中4个样品浓度>500 μg·kg−1,2个样品浓度在300—500 μg·kg−1,10个茶叶样品高氯酸盐浓度<300 μg·kg−1。本研究购买的茶叶中,蒲公英茶所含高氯酸盐浓度最高,为2.71×103 μg·kg−1,其次为铁观音1样品,其中高氯酸盐浓度为1.38×103 μg·kg−1,这2个样品中高氯酸浓度超过了欧盟建议的干茶中
ClO−4 根据《中国人群暴露参数手册》[17],人体中高氯酸盐的日均暴露量计算公式ADD=C×IR×EF×ED/(BW×AT),各参数意义及取值见表3。高氯酸盐是非致癌物质,用危害商(HQ)评价其健康风险。危害商的公式为HQ=ADD/RfD,其中RfD为高氯酸盐参考剂量。由于目前中国还没有与人体健康相关的高氯酸盐剂量的政策出台,本研究选取欧洲食品安全局(EFSA)建议的人体每日容许
ClO−4 表 3 日均暴露量相关参数的意义及取值Table 3. Meaning and values of related parameters of average daily dose表 4 购买的16种茶叶中高氯酸盐对人体的日均暴露量(ADD)及危害商(HQ)Table 4. The average daily dose (ADD) and hazard quotient (HQ) of perchlorate in 16 kinds of tea purchased样品名称Samples name 茶叶中高氯酸盐浓度/(mg·kg−1) Perchlorate concentration in tea 日均暴露量/(mg·(kg·d)−1)Average daily dose (ADD) 危害商Hazard quotient (HQ) 蒲公英茶1 2.71 6.71×10−4 2.24 铁观音1 1.38 3.41×10−4 1.14 铁观音2 0.590 1.46×10−4 0.487 铁观音3 0.257 6.35×10−5 0.212 铁观音4 0.405 1.00×10−4 0.334 绿茶1 0.728 1.80×10−4 0.600 绿茶2 0.217 5.37×10−5 0.179 绿茶3 0.290 7.19×10−5 0.240 绿茶4 0.420 1.04×10−4 0.346 红茶1 0.210 5.20×10−5 0.173 红茶2 0.265 6.56×10−5 0.219 红茶3 0.970 2.40×10−5 0.0800 红茶4 0.115 2.85×10−5 0.0951 大红袍1 0.207 5.13×10−5 0.171 普洱茶1 0.169 4.19×10−5 0.140 肉桂茶1 0.200 4.96×10−5 0.165 3. 结论(Conclusion)
本研究考察了不同浸提条件对茶叶中高氯酸盐的提取效率的影响,最终建立了去离子水振荡提取结合离子色谱-串联质谱联用分析茶叶中高氯酸盐的方法。对于茶叶中高氯酸盐的提取,最终选择以纯水在室温下振荡提取3次,每次浸泡15 min达到最佳提取效率。并且选用AS20色谱柱用于茶叶中高氯酸盐的分离。本研究建立的分析方法,操作简单、灵敏度高,可准确地测定茶叶中高氯酸盐的含量。方法应用于实际样品中高氯酸盐的分析得到了良好的结果,在分析的16个品牌茶叶样品中均检出了高氯酸盐的存在,并且发现长期饮用某些茶叶可能对人体健康存在一定的风险。
-
表 1 不同
SO2−4 Table 1. The influent quality of
SO2−4 第1 天—第25 天Day 1 — Day 25 第26 天—第60 天Day 26 — Day 60 第61 天—第110 天Day 61 — Day 110 1.6% SO2−4 pH 3.8—4.2 3.8—4.2 3.8—4.2 硫酸根/% 1.6—1.7 1.7—1.8 1.7—1.8 COD/(mg·L−1) 5400—5600 5400—5600 7500—8100 TDS/(g·L−1) 27—30 27—30 27—30 电导率/(ms·cm−1) 25—30 28—30 28—30 TN/(mg·L−1) 20—25 180—200 320—350 TP/(mg·L−1) 5—10 8—10 8—10 氨氮/(mg·L−1) 15—20 15—20 15—20 Ca/(mg·L−1) 25—35 25—35 25—35 Mg/(mg·L−1) 5—15 5—15 5—15 Fe/(mg·L−1) 0.1—0.6 0.1—0.6 0.1—0.6 pH 3.7—3.9 3.5—4.1 3.6—4.2 2.6% SO2−4 硫酸根/(mg·L−1) 2.6—2.8 2.6—2.8 2.2—2.3 COD/(mg·L−1) 8000—8900 7000—7800 7500—8000 TDS/(g·L−1) 42—45 45—55 50—54 电导率/(ms·cm−1) 38—40 38—40 38—40 TN/(mg·L−1) 28—30 320—350 320—350 TP/(mg·L−1) 10—15 10—15 15—20 氨氮/(mg·L−1) 15—20 15—20 15—20 Ca/(mg·L−1) 35—45 35—45 35—45 Mg/(mg·L−1) 10—20 10—20 10—20 Fe/(mg·L−1) 0.2—0.8 0.2—0.8 0.2—0.8 表 2 MBR反应器运行策略
Table 2. Operating strategy of MBR reactor
SO2−4 SO2−4 阶段 Stage 天数/d Days 容积负荷/(kg·(m3·d)−1)VLR HRT/d SRT/d 1.6% 提盐驯化阶 1—20 0.5 10 不排泥 负荷提升阶段Ⅰ 21—40 0.6 8.5 44 负荷提升阶段Ⅱ 41—80 0.72 8.5—10.2 44 负荷提升阶段Ⅲ 81—110 1.0 7 44 2.6% 提盐驯化阶段 1—36 0.5 16 不排泥 负荷稳定阶段 37—110 0.5 16—22 44 注:进水 SO2−4 SO2−4 -
[1] 陆爱军. 农副食品加工行业废水污染现状及对策研究 [J]. 资源节约与环保, 2021(3): 92-93. LU A J. Study on the present situation and countermeasures of wastewater pollution in agricultural and sideline food processing industry [J]. Resources Economization & Environmental Protection 2021(3): 92-93(in Chinese).
[2] 杨重. 硫酸盐废水的资源化回收及功能菌群解析 [D]. 大连: 大连理工大学, 2021. YANG C. Resource recovery from sulfate wastewater and analysis of functional microbial community [D]. Dalian: Dalian University of Technology, 2021(in Chinese).
[3] 张磊, 赵婷婷, 何虎. 食品加工废水处理技术研究进展 [J]. 水处理技术, 2018, 44(12): 7-13. doi: 10.16796/j.cnki.1000-3770.2018.12.002 ZHANG L, ZHAO T T, HE H. Research progress of food industry wastewater treatment technology [J]. Technology of Water Treatment, 2018, 44(12): 7-13(in Chinese). doi: 10.16796/j.cnki.1000-3770.2018.12.002
[4] 李丹丹, 韩建秋. 高盐废水生态处理技术研究进展及展望 [J]. 应用技术学报, 2018, 18(4): 340-345. doi: 10.3969/j.issn.2096-3424.2018.04.009 LI D D, HAN J Q. Research progress and prospects of high-salt wastewater ecological treatment technology [J]. Journal of Applied Technology, 2018, 18(4): 340-345(in Chinese). doi: 10.3969/j.issn.2096-3424.2018.04.009
[5] 刘展, 郭瑞亚, 李娜, 等. 高含盐废水资源化利用技术的研究进展 [J]. 应用化工, 2020, 49(10): 2657-2661. doi: 10.3969/j.issn.1671-3206.2020.10.055 LIU Z, GUO R Y, LI N, et al. Development of resource utilization technology for highly saline wastewater [J]. Applied Chemical Industry, 2020, 49(10): 2657-2661(in Chinese). doi: 10.3969/j.issn.1671-3206.2020.10.055
[6] 陈燚. 高pH值对含硫酸盐有机废水厌氧处理系统的影响研究 [D]. 徐州: 中国矿业大学, 2019. CHEN Y. Effect of pH on the anaerobic treatment of sulfate organic wastewater [D]. XUzhou: China University of Mining and Technology, 2019(in Chinese).
[7] 孔殿超, 赵明, 张强, 等. 废水中硫酸盐含量对有机物生化降解的影响研究 [J]. 广西节能, 2021(2): 30-32. doi: 10.3969/j.issn.1004-1230.2021.02.018 KONG D C, ZHAO M, ZHANG Q, et al. Effect of Sulfate Content in Wastewater on Biodegradation of Organic Compounds [J]. Guangxi Energy Conservation, 2021(2): 30-32(in Chinese). doi: 10.3969/j.issn.1004-1230.2021.02.018
[8] 曹美玲, 李海, 刘佛财, 等. 高盐有机废水的处理与研究进展 [J]. 有色金属科学与工程, 2019, 10(3): 92-98. CAO M L, LI H, LIU F C, et al. Recent development in the treatment process for high salt organic wastewater [J]. Nonferrous Metals Science and Engineering, 2019, 10(3): 92-98(in Chinese).
[9] 刘传伟. 高盐废水生物处理的研究 [D]; 合肥: 合肥工业大学, 2012. LIU C W. Research on the biological treatmeat of high salinity wasteater [D]; Hefei: Hefei University of Technology, 2012(in Chinese).
[10] 张哲, 于德爽, 张业静. MBR工艺处理高盐度废水试验 [J]. 环境工程, 2009, 27(5): 22-24. ZHANG Z, YU D S, ZHANG Y J. Experiment on the treatment of wastewater containing high salt by mbr process [J]. Environmental Engineering, 2009, 27(5): 22-24(in Chinese).
[11] HONG J M, LI W B, LIN B, et al. Deciphering the effect of salinity on the performance of submerged membrane bioreactor for aquaculture of bacterial community [J]. Desalination, 2013, 316: 23-30. doi: 10.1016/j.desal.2013.01.015 [12] 国家环保局本书编委会. 水和废水监测分析方法 [M]. 水和废水监测分析方法, 1989. Editorial Board of the State Environmental Protection Agency. Monitoring and Analysis Methods of Water and Wastewater [M]. Monitoring and Analysis Methods of Water and Wastewater, 1989(in Chinese).
[13] 肖小兰, 亓金鹏, 刘皓, 等. AOA-MBR处理高盐榨菜废水厌氧膜生物反应器出水的效能 [J]. 环境工程学报, 2021, 15(9): 3057-3066. doi: 10.12030/j.cjee.202105095 XIAO X L, QI J P, LIU H, et al. Operation performance of an AOA-MBR treating the effluent from an anaerobic membrane bioreactor dealing with high-salt mustard tuber wastewater [J]. Chinese Journal of Environmental Engineering, 2021, 15(9): 3057-3066(in Chinese). doi: 10.12030/j.cjee.202105095
[14] LUO L, ZHOU W W, YUAN Y, et al. Effects of salinity shock on simultaneous nitrification and denitrification by a membrane bioreactor: Performance, sludge activity, and functional microflora [J]. Science of the Total Environment, 2021, 801: 149748. doi: 10.1016/j.scitotenv.2021.149748 [15] 周颖. 纯氧曝气条件下活性污泥有机物降解及耐盐性研究 [D]. 南京: 南京师范大学, 2017. ZHOU Y. Degradation and salt tolerance of activated sludge under pure oxygen aeration [D]. Nanjing: Nanjing Normal University, 2017(in Chinese).
[16] HE H J, CHEN Y J, LI X, et al. Influence of salinity on microorganisms in activated sludge processes: A review [J]. International Biodeterioration & Biodegradation, 2017, 119: 520-527. [17] WANG J F, LIU Q J, WU B, et al. Effect of salinity on mature wastewater treatment biofilm microbial community assembly and metabolite characteristics [J]. Science of the Total Environment, 2020, 711: 134437. doi: 10.1016/j.scitotenv.2019.134437 [18] 侯飞飞. MABR去除高盐废水中COD和氨氮的基础研究 [D]. 天津: 天津大学, 2013. HOU F F. Basic research of COD and ammonia nitrogen removals in high salinity wastewater by MABR [D]. Tianjin: Tianjin University, 2013(in Chinese).
[19] 简陈生. 高盐氨氮废水MBR处理效能及微生物特性研究 [D]. 赣州: 江西理工大学, 2016. JIAN C S. Study on MBR treatment efficiency and microbial characteristics of high salt ammonia nitrogen wastewater [D]. Ganzhou: Jiangxi University of Science and Technology, 2016(in Chinese).
[20] 陈杰云, 余薇薇, 杜邦昊, 等. HRT对多级A/O+悬浮填料组合工艺脱氮除磷的影响 [J]. 中国给水排水, 2017, 33(09): 31-34. doi: 10.19853/j.zgjsps.1000-4602.2017.09.006 CHEN J Y, YU W W, DU B H, et al. Effect of hydraulic retention time on nitrogen and phosphorus removal in multistage A/O + suspended carrier combined process [J]. China Water & Wastewater, 2017, 33(09): 31-34(in Chinese). doi: 10.19853/j.zgjsps.1000-4602.2017.09.006
[21] 李绍峰, 崔崇威, 黄君礼, 等. DO和HRT对MBR同步硝化反硝化影响研究 [J]. 哈尔滨工业大学学报, 2007, 39(6): 887-890. doi: 10.3321/j.issn:0367-6234.2007.06.012 LI S F, CUI C W, HUANG J L, et al. Influence of DO and HRT on simultaneous nitrification and denitrification in MBR [J]. Journal of Harbin Institute of Technology, 2007, 39(6): 887-890(in Chinese). doi: 10.3321/j.issn:0367-6234.2007.06.012
[22] 叶芳凝, 石先阳. 盐度对MBR处理高氨氮废水的运行及微生物群落影响研究 [J]. 膜科学与技术, 2018, 38(05): 77-83. doi: 10.16159/j.cnki.issn1007-8924.2018.05.011 YE F N, SHI X Y. Study on the effect of salinity on the operation and microbial community of MBR for treatment of high ammonia nitrogen wastewater [J]. Membrane Science and Technology, 2018, 38(05): 77-83(in Chinese). doi: 10.16159/j.cnki.issn1007-8924.2018.05.011
[23] SHI X B, LI J, WANG X C, et al. Effect of the gradual increase of Na2SO4 on performance and microbial diversity of aerobic granular sludge [J]. Journal of Environmental Management, 2021, 292: 112696. doi: 10.1016/j.jenvman.2021.112696 [24] 于德爽, 李津, 陆婕. MBR工艺处理含盐污水的试验研究 [J]. 中国给水排水, 2008, 24(3): 5-8. doi: 10.3321/j.issn:1000-4602.2008.03.002 YU D S, LI J, LU J. Experimental study on treatment of wastewater containing salt by MBR process [J]. China Water & Wastewater, 2008, 24(3): 5-8(in Chinese). doi: 10.3321/j.issn:1000-4602.2008.03.002
[25] OU D, LI H, LI W, et al. Salt-tolerance aerobic granular sludge: Formation and microbial community characteristics [J]. Bioresource Technology, 2018, 249: 132-138. doi: 10.1016/j.biortech.2017.07.154 [26] LAY W C L, LIU Y, FANE A G. Impacts of salinity on the performance of high retention membrane bioreactors for water reclamation: A review [J]. Water Research, 2010, 44(1): 21-40. doi: 10.1016/j.watres.2009.09.026 [27] 杨帆. 单级好氧除磷工艺与A/O除磷工艺的对比研究 [D]. 长沙: 湖南大学, 2012. YANG F. Comparison study on phosphorus removal between single-stage oxic process and anaerobic/aerobic process [D]; Changsha: Hunan University, 2012(in Chinese).
[28] CHEN H B, WANG D B, LI X M et al. Biological phosphorus removal from real wastewater in a sequencing batch reactor operated as aerobic/extended-idle regime [J]. Biochemical Engineering Journal, 2013, 77: 147-153. doi: 10.1016/j.bej.2013.06.005 [29] CLOETE T E, OOSTHUIZEN D J. The role of extracellular exopolymers in the removal of phosphorus from activated sludge [J]. Water Research, 2001, 35(15): 3595-3598. doi: 10.1016/S0043-1354(01)00093-8 [30] LONG X, FANG Z, TANG R, et al. Roles of extracellular polymer substances in biological dephosphorization [J]. Acta Scientiae Circumstantiae, 2012, 32(4): 784-789. [31] SHANAHAN J W, SEMMENS M J. Alkalinity and pH effects on nitrification in a membrane aerated bioreactor: an experimental and model analysis [J]. Water Research, 2015, 74: 10-22. doi: 10.1016/j.watres.2014.12.055 [32] YURTSEVER A, ÇıNAR Ö, SAHINKAYA E. Treatment of textile wastewater using sequential sulfate-reducing anaerobic and sulfide-oxidizing aerobic membrane bioreactors [J]. Journal of Membrane Science, 2016, 511: 228-237. doi: 10.1016/j.memsci.2016.03.044 -


































 DownLoad:
DownLoad: