-
难降解有机物是废水中难以在自然条件下被生物逐级降解的有机污染物. 由于其难降解性,在水环境中的大量滞留,大部分难降解有机物具有高毒性,不仅对水环境造成了严重的危害,甚至威胁到了人类的健康. 随着工业化和经济的迅速增长,近年来难降解有机物在废水中的浓度越来越高,高浓度有机废水中难降解有机物的浓度甚至已经达到了2000—20000 mg·L−1[1]. 我国难降解有机物主要来源于工业废水,如印染废水、造纸废水、食品行业废水、农药废水和制药工业废水[2]. CWAO和CWPO被认为是目前处理难降解有机污染物最有效的方法. 本文综述了CWAO和CWPO降解有机物的原理和进展,分析了催化剂对常规湿式氧化反应过程的加速和降解效率的影响,并提出了未来难降解有机物可能的发展方向.
-
催化湿式氧化/过氧化法是指液相中的有机物在高温高压以及催化剂存在的环境下被氧化处理的方法,是目前处理难降解有机物运用最广泛的方法之一. 高于临界温度和临界压力的状态是超临界状态[3],而催化湿式氧化/过氧化法的温度和压力低于超临界状态,被称为亚临界状态. 亚临界状态的性质介于超临界水和常温水之间. 如表1所示常温水和超临界水的性质差距很大.
催化湿式氧化/过氧化法分为CWAO和CWPO,这两种方法工作条件和氧化效果几乎相同,但有各自不同的适用环境,CWAO适用于治理焦化、染料、农药、印染、石化、皮革等工业中含高化学需氧量(COD)的(如氨氮、多环芳烃、致癌物质BPA等)工业有机废水;CWPO适用于各种工业废水和医疗废水,尤其适用于难降解的复杂的有机污染物. 这两者的主要区别在于CWAO的氧化剂为O2或空气,而CWPO的氧化剂通常为H2O2,所以导致两者的氧化机理略有不同.
当氧化剂为O2时:
当氧化剂为H2O2时:
CWAO和CWPO均可在氧化有机物过程中分为三个阶段:热分解阶段、局部氧化阶段和完全氧化阶段[4].
在热分解阶段,大分子量的有机物在液相中溶解和水解(但没有被氧化),其溶解和水解速度随温度升高而加快,有机物在液相中溶解和水解越完全,氧化就会越彻底[5];在局部氧化阶段,大分子量的有机物未被完全氧化,氧化分解成为分子量较低的中间产物,如甲酸、乙酸、甲醛等[6];在最后的完全氧化阶段,中间有机产物进一步氧化成二氧化碳和水[7].
-
CWAO在一定的温度、压力和催化剂的作用下,经空气氧化,使污水中的有机物及氨分别氧化分解成CO2、H2O及N2等无害物质,达到降解有机物的目的[8]. CWAO具有以下特点[9]:
(1) 在传统的湿式氧化处理体系中加入催化剂,降低反应的活化能,从而在不降低处理效果的情况下,降低反应的温度和压力,提高氧化分解的能力,缩短反应的时间,提高反应效率,并减少了设备的腐蚀,降低了成本;
(2) 具有净化效率高、无二次污染、流程简单和占地面积小等优点;
(3) 催化剂有选择性,并且污水中含有许多种类和结构不同的有机物,需要对催化剂进行筛选.
-
CWPO是在一定的温度、压力和催化剂的作用下,在液相中加入过氧化氢,作为氧化剂,使污水中的有机物及氨分别氧化分解成CO2、H2O及N2等无害物质,从而达到降解的效果[10]. CWPO的特点如下[11]:
(1) 与催化湿式氧化法相比,以过氧化氢代替空气或氧气,过氧化氢的氧化性高于氧气,可使有机物氧化更加彻底,但对设备质量的要求更高,提高了运行的成本和操作难度;
(2) 具有净化效率高、无二次污染、流程简单、占地面积小等优点;
(3) 过氧化氢无毒无害,且分解生成水和氧气,可安全排放.
-
用于催化湿式氧化/过氧化反应的催化剂众多,如非稀有金属催化剂、稀有金属催化剂和非金属催化剂等,本文主要综述了非稀有金属催化剂、稀有金属催化剂和非金属催化剂的3种催化剂在催化湿式氧化/过氧化领域的研究进展.
-
铁基催化剂是在催化剂中负载金属铁、铁的氧化物或者以铁和铁的氧化物负载其他金属,以此来增强催化剂的活性和催化效果[12]. 铁基催化剂多用于Fenton反应中[13],Fenton法反应机理如下 [14]:
如今大多数的铁基催化剂为非均相催化剂,在催化湿式氧化/过氧化反应中展现出了优异的活性和催化效果. Yan等制备了Fe-ZSM-5催化剂,其在固定床反应器中对苯酚的降解效率高达99.2%[15];Yang等利用金属有机化学气相沉积(MOCVD)法制备的Fe2O3-ZSM-5催化剂,间甲苯酚转化率在0.5—2.5 h内可达到99%,在60 ℃、400 r·min−1条件下,3 h后TOC去除率可高达80.5%[16];Qin等采用简单的溶剂热法制备了磁性核壳结构Fe3O4@CeO2催化剂,苯甲酸的去除率可达到80%[17]. 表2对比了近年来铁基催化剂处理难降解有机污染物的研究,可以看出铁基催化剂在降解有机物这一方面,效果好,降解效率高,具有广阔前景.
铁基催化剂在催化湿式氧化/过氧化反应中会浸出一部分铁离子,对反应会造成一定的影响[30]. 有研究发现反应溶液中的铁离子浓度随着过氧化氢浓度的增加而增加,这是因为过氧化氢可以电离出H+,加大过氧化氢的浓度相当于加大了H+的浓度,从而促进了铁离子的浸出[26]. 同时中间产物有机酸如苹果酸、草酸、琥珀酸、甲酸和醋酸等,这些小分子量羧酸的形成会降低溶液的pH,也会促进铁离子的浸出[18, 31]. 除了pH和过氧化氢效应外,中间体与铁离子的络合反应也会促进铁离子的浸出[32].
铁离子的浸出是使用铁基催化剂的一大难题,许多学者在降低铁浸出做了大量工作,如:有学者通过增大催化剂与水的接触角,降低催化剂表面湿润性,使铁不易与水相互作用;或者降低pHPZC值,增加催化剂内部的吸附能力,可以将铁在催化剂表面固定化,从而阻止铁的浸出[25, 33],相比通过3D打印技术制造出的铁催化剂[18],铁浸出率要低得多. 但铁离子的浸出在催化湿式氧化/过氧化反应中,在一定程度上可以起到促进有机物降解的作用,因为浸出的铁离子会与溶液中的氧气或过氧化氢发生反应,生成具有强氧化性的羟基自由基,羟基自由基可以快速氧化有机物,增加有机物的矿化程度. 所以合理利用铁离子浸出的同时有效控制溶液中铁离子的含量,或许是铁基催化剂应用在催化湿式氧化/过氧化领域中一个重要的方向.
-
铜基催化剂多以氧化铜为活性组分,采用不同的助剂、不同载体以及不同的制备工艺,制得的复合型催化剂来满足催化湿式氧化/过氧化法的需要[34]. 近年来,铜被认为是比铁还优异的催化剂,这是由于铜基催化剂拥有较宽的pH值以及稳定的结构和催化性能,在催化湿式氧化/过氧化反应中,铜基催化剂不会与铁离子一样与溶液中的有机酸发生络合反应生成配合物,因此,它不会阻断羟基自由基的生成,从而可以提供高矿化作用[35]. 在反应过程中,铜基催化剂会浸出一部分铜离子,铜离子会与溶液中的过氧化氢反应生成具有强氧化性的羟基自由基,从而增强有机物的降解能力,反应机理如下[36]:
金属铜适用于许多催化剂的合成,如铜铁催化剂[37]、铜镍催化剂[38]、铜铈催化剂[39]和铜活性炭催化剂[40]等,表3对比了近年来铜基催化剂处理难降解有机污染物的研究,铜基催化剂表现出突出的催化性能. 不同催化剂,其结构和性能会有很大的差异,相同的催化剂,如果制作方法不同,其结构也是有较大差异,有学者研究了水离子交换法(CuYAIE)、湿浸渍法(CuYIMP)和沉淀法(CuYPI)的3种方法制备的催化剂进行了比较. 如图1所示,CuYPI对过氧化氢转化的活性最高,但对污染物的降解活性最低,表明过氧化氢转化率并非与污染物去除率呈现正相关性. 过氧化氢与活性组分相结合的速率是更重要的参数. CuYPI催化剂的比表面积大于CuYAIE和CuYIMP催化剂,但CuYAIE和CuYIMP催化剂比CuYPI催化剂更有活性. 说明高表面积并不是CWPO获得高催化活性的必要参数,与前人研究结果一致[29],活性相的位置和电子状态比结构性质起着更重要的作用.
铜基催化剂通常会与其他活性物质协同催化降解有机物,如氧化铈[42]和氧化铝[43]等. 有学者研究发现,氧化铜和氧化铈之间的强相互作用会削弱Cu—O和Ce—O的化学键,从而促进化学键在适当的反应条件下分裂形成活性氧化物. 同时氧化铜和氧化铈之间的强相互作用会增加Cu2+/Cu+与Ce4+/Ce3+之间电子转移速率,从而提高过氧化氢与活性组分的反应速率,加快反应进程[45].
铜的负载率是影响催化剂活性的显著性能之一,有研究表明有机物的去除效率随着铜含量的增加而提高,但当铜增加到25%时,催化剂活性开始下降[47]. 这是由于铜具有显著的催化活性,活性组分含量越高,对有机物的降解效率越强. 但将过量的铜负载在催化剂上,可能会占据催化剂的活性位点,从而减弱了催化剂的活性,降低催化剂的降解效果. 催化剂的活性是铜基催化剂最关键的问题,取决于金属负载量、活性铜、酸性位点、晶格氧和铜离子交换度. 较高分散的氧化铜物种和Cu+使催化剂具有更好的氧化还原性;低离子交换浓度有利于提高催化剂的活性,离子交换浓度越高,溶液中的低分子量有机酸使铜浸出越严重[46];催化剂的酸位点含量越高,越有利于有机污染物的吸附和活化,有机物就越容易降解[44].
-
非稀有金属除了铁和铜以外,还有锌、铝和锰等. 这几种金属及其氧化物很少单独作为催化剂出现,大多数以双金属或多金属用于CWAO和CWPO中,且催化剂能表现出较好的催化性能. 有学者通过原位合成法和浸渍法制备了CuO/ZnO-A12O3水滑石衍生催化材料,当苯酚初始浓度500 mg ∙L−1时,COD去除率能达到95.3%[49];杨韶平通过浸渍法制备的MnO2/A12O3催化剂,降解糖蜜酒精废水,处理水均能达到《污水综合排放标准GB9878—1996》的三级排放标准[50];许银采用浸渍法制备的Mo-Zn-Al-O催化剂对阳离子红GTL的脱色率和TOC去除率高达90.9%和65.8%[51];Sanabria使用Al-Ce-Fe膨润土催化剂处理咖啡加工废水,总酚类化合物矿化率可达70%,化学需氧量(COD)降低了66%[52].
本文将膨润土、沸石等矿物制备的催化剂归为了其他非稀有金属催化剂一类,此类催化剂通常具有较大的比表面积、活性点位多以及简单易得等优点,得到广大学者的喜爱,目前用此类催化剂用于降解有机物的研究在逐渐增多. Balci通过硫酸活化膨润土制得降解苯酚的催化剂,苯酚去除率约为96%[53];Ramírez通过水热法将粉煤灰制成沸石催化剂,可将酸性橙完全降解,矿化率达到45%[32]. 这类催化剂虽然能达到较好的催化效果,但会浸出较多的金属如铁、铝和钠等,可能会对水环境造成二次污染. 减少金属离子的浸出或对浸出的金属离子进行处理与回收,是目前这类催化剂的研究重点.
-
稀有金属是在地壳中含量较少、分布稀散或难以从原料中提取的金属,因稀有金属催化剂多活性组分之间的协同作用,有利于催化剂酸性位点增加、氧化物流动性增加以及催化活性增强,因而表现出较好的催化性能[54]. 表4列举了稀有金属催化剂降解有机污染物的研究.
湿润性是催化剂的表面性质之一,对催化剂在催化湿式氧化/过氧化反应途径具有主导影响,当使用钌时,RuO2能从水相中吸附苯酚和O2这两种反应物;然而,当使用铂时,Pt0活性位点可以直接从水相吸附苯酚和从气相吸附O2,因此在载体的活性位点或周围具有大量的疏水性和局部的亲水性会更有效[62]. 有研究发现,CeO2不仅可以增加催化剂的储氧能力,而且还可以对Pt/SiC或Ru/Al2O3之间的界面上形成固溶体[63]. 这种固溶体将在金属支撑界面上提供亲水性和额外的吸附位点,从而提高有机物从液相到Pt或Ru表面的传质速率. 催化剂的湿润性或成为未来的研究重点.
协同效应是影响稀有金属催化剂催化效果的主要因素之一,有学者通过溶胶-凝胶柠檬酸法制备的LaNiO3催化剂表现出了优异的催化活性,在La和Ni的协同作用下,活性黑5的降解效率和脱色效率分别可达到65.4%和89.6%[55]. 虽然稀有金属之间存在着协同效应,但协同作用效果皆有所不同. 有研究将稀有金属Ru、Pb和Pt分别负载在TiO2和ZrO2上降解有机物,如图2所示,催化效果都有不同程度的提升,其中Ru/ZrO2是最活跃的催化剂,催化效果最好,这是因为Ru在ZrO2中良好的分散,产生了强烈的Ru-O-Zr相互作用.
不仅稀有金属之间存在协同效应,稀有金属与铁和铜这种非稀有金属之间也存在协同效应. 有研究表明氧化铜纳米棒(CuONRs)可负载单金属或双金属金和钯纳米颗粒,制备的4种催化剂CuONRs、CuONRs@Au6NPs、CuONRs@Pd6NPs和CuONRs@Au3Pd3NPs,其中CuONRs@Au3Pd3NPs表现出更高的催化强度,其次是CuONRs@Pd6NPs,这表明金和钯与铜之间的协同效应,以及金与钯之间的协同效应是可以叠加的[64],这为催化剂的多元化研究提供了更多的可能性.
同属一系的稀有金属具有相似的性质,但催化性能有一定的差别. 有学者通过制备掺杂镧系金属La、Gd和Dy的钴铁酸体探究了罗丹胺6G-(Rh6G)的降解效果,研究发现通过掺杂稀土阳离子,均显著提高了钴铁氧体在CWPO中的催化性能和Rh6G的矿化作用. 如表5所示,同属一系的金属催化性能也有所差别,这是因为其不同的晶粒尺寸与各异的晶径比和尖晶石相纯度相互作用,使得掺杂钴铁氧体的催化剂表现出不同的催化性能.
稀有金属催化剂由于特异的结构性质,其降解机理与其他金属催化剂有所不同. 稀有金属催化剂氧化有机物的降解机理,本文总结了以下四步[56]:(1)有机物通过静电吸附和化学吸附吸附在催化剂表面;(2)第一步形成的羟基自由基,即活性氧[65],直接氧化有机物,导致表面氧种类减少;(3)晶格氧转化为表面氧,维持催化剂表面电荷的平衡,形成氧空位;(4)外部O2或H2O2填充氧空位,将电子转移到还原的催化剂上.
-
在催化湿式氧化/过氧化反应的研究中,非金属催化剂主要为活性炭和石墨烯,因为两者都是碳结构,具有良好的催化性能,被众多学者广泛用于降解有机物的研究[66-67].
活性炭具有微晶结构,微晶排列不规则,晶体中有微孔(半径10—20 nm)、中孔(半径20—1000 nm)、大孔(半径1000—100000 nm),使它具有很大的内表面,比表面积为500—1700 m2∙g−1,这决定了活性炭具有良好的吸附性[68-69]. 石墨烯是一种以 sp² 杂化连接的碳原子紧密堆积成单层二维蜂窝状晶格结构的新材料. 石墨烯具有优异的光学、电学、力学特性,在材料学、催化、微纳加工、能源、生物医学和药物传递等方面具有重要的应用前景,被认为是一种未来具有革命性的材料[70-71]. 表6列举了近些年非金属催化剂降解有机污染物的研究.
活性炭是一种内表面积很大的催化材料,在其内表面上存在许多活性位点,这一点既促进了反应的进行,也抑制了有机物的降解. 这是因为活性炭的活性位点大多在内表面上,而活性炭的孔径大多为微中孔,在短时间内,氧化剂难以进入活性炭的内表面,就很难与内表面的活性位点相结合产生强氧化性的羟基自由基. 在多数情况下,氧化剂和有机物会同时竞争活性炭表面上的活性位点. 如果有机物浓度过高,会对活性位点产生阻碍,氧化剂的分解速率将减慢[75]. 增加氧化剂的量,可以提高氧化剂在活性位点上的竞争力,但添加过量的过氧化氢会形成比羟基自由基氧化性弱的过羟基自由基,导致催化效率下降. 因此,增强过氧化氢分解成羟基和氢过氧自由基的转化率,并使其更有效地消耗有机物是研究的重点.
众所周知高浓度的盐会抑制废水中过氧化氢分子的活性,温度的升高可以降低盐的抑制作用,加速过氧化氢的氧化速率[77-78]. 这是因为高盐和高浓度的有机物会阻塞活性炭内孔,升高温度可以打开活性炭的孔径,促进过氧化氢和有机物扩散到AC的内孔中,使内表面的活性位点得到利用,增加过氧化氢的转化率以及有机物的降解率[79].
温度的升高可以增强活性炭的活性,但同时也增加了能耗,为避免这一问题,有学者通过增加活性炭表面的活性位点,以此增强活性炭的活性[80]. 有研究表明将铁负载在活性炭上制作的铁碳复合催化剂,大大提高了活性炭的表面催化活性,铁作为异相芬顿反应的高效催化剂,催化活性较高,极大提高了活性炭的催化效率[81]. 后续的研究发现单活性组分材料已经很难满足现有的有机物降解,所以出现了多种活性组分共同负载在活性炭上,如在活性炭表面掺入Fe-S作为活性位点,可以促进氧化剂和相界面氧化铁之间的电子转移[82, 83],或是将N引入到Fe/C的表面,导致了Fe-NX配位活性位点的形成,从而形成Fe3C与Fe3N之间的协同效应[84]. 有研究表明N、S、铁三掺杂碳催化剂(NSFe-Cs)与唯一的铁掺杂催化剂(Fe/AC)相比较催化效果更好,这是因为S的掺入,与铁形成了二硫化铁,二硫化铁为催化剂表面提供了大量的Fe2+,同时N的加入,使催化剂表面更具亲水性[85]. 活性炭由于其巨大的比表面积、优异的内孔结构和优秀的催化性能,成为了最受欢迎的载体之一.
石墨烯是一种高效稳定的催化剂,Yoo等制备了石墨烯薄膜来降解苯酚,石墨烯表现出较强的催化效率(苯酚转化率高达92%)[86]. Liu等采用化学气相沉积(CVD)技术在三维网结构的纸状烧结不锈钢纤维(PSSF)上合成了单层石墨烯薄膜(Gr)催化剂,结果表明,在最佳条件下连续运行72 h后,苯酚完全氧化,TOC显著去除(值在80.7%—91.0%之间)[73]. 石墨烯优异的催化性能,证明了石墨烯在催化湿式氧化/过氧化领域的巨大潜力.
-
目前催化湿式氧化/过氧化技术发展迅速,能非常有效地处理难降解有机物,但依旧存在一些问题,如金属离子浸出、非金属催化剂失活以及有机物降解的资源化利用. 根据对现状的分析,提出如下催化湿式氧化/过氧化研究的建议:
(1)金属与非金属催化剂普遍拥有较理想的催化活性,但金属催化剂在反应过程中会浸出部分金属离子,不利于重复利用;而活性炭易被有机物或其他杂质堵塞孔径,导致内表面的活性组分不能被充分利用而导致催化剂逐渐失活,这是催化剂领域的两大难题. 石墨烯作为一种高效稳定的催化剂,有利于活性组分分散和降低反应壁垒,将成为催化湿式氧化/过氧化领域潜力最大的催化剂之一.
(2)目前的研究多停留在氧化降解有机物,降解过程中可能形成新的污染物,所以精准调控降解程度和目标产物,实现资源化回收,将成为未来处理难降解有机物的方向之一.
催化湿式氧化/过氧化法处理难降解有机物的研究进展
Research progress of catalytic wet oxidation/peroxidation treatment of refractory organics
-
摘要: 常规的水处理工艺成熟,运行成本低,但其对难降解有机物的处理效果差,难以满足日益严格的排放标准. 本文将催化湿式氧化法(CWAO)与催化湿式过氧化氢氧化法(CWPO)合称为催化湿式氧化/过氧化法,两者都具有效率高、占地少的显著特征,可以直接把难降解有机物分解为二氧化碳和水,已成为新的研究热点. 本文综述了催化湿式氧化/过氧化法降解有机物的原理和进展,分析了催化剂对常规湿式氧化/过氧化反应过程的加速和降解效率的影响,讨论了催化湿式氧化/过氧化技术存在的主要制约瓶颈,提出了有机物的定向调控转化和资源化是今后减污降碳的主要方向.
-
关键词:
- 催化湿式氧化 /
- 催化湿式过氧化氢氧化 /
- 难降解有机物 /
- 催化剂
Abstract: The conventional water treatment process is mature with low operating cost, but its treatment effect on refractory organics are poor, and it is difficult to meet the increasingly stringent emission standards. In this review, catalytic wet oxidation (CWAO) and catalytic wet hydrogen peroxide oxidation (CWPO) are collectively referred to as catalytic wet oxidation/peroxidation, both of which have the remarkable features of high efficiency and small land occupation, and refractory organics are directly decomposed into carbon dioxide and water by catalytic wet oxidation/peroxidation. Then the method has become a new research hotspot. The principles and progress of catalytic wet oxidation/peroxidation for degradation organic pollutants are reviewed, the effect of catalysts on the acceleration and degradation efficiency of common wet oxidation/peroxidation reaction processes are analyzed, and the main restrictive bottlenecks of catalytic wet oxidation/peroxidation technology are discussed. It is proposed that the directional regulation, transformation and resource utilization of organics will be the main directions of pollution reduction and carbon reduction in the future. -
近年来,越来越多的沿海地区采用海水淡化或海水直接利用技术作为缓解淡水紧缺危机的方法[1],而海水冲厕技术即为海水直接利用技术之一。使用海水冲厕可有效缓解我国沿海城市生活用淡水资源的供需矛盾[2],但采用此技术会产生大量的高含盐生活污水,给污水处理带来了巨大挑战[3]。有研究[4]表明,膜生物反应器(membrane bioreactor, MBR)对于处理高盐废水有较为显著的效果,MBR中的活性微生物经培养驯化后,能适应不同盐度的废水。ZHANG等[5]运用MBR工艺处理海水养殖废水时,当盐度由0 g·L−1增加到30 g·L−1时,MBR对COD和NH4+-N的去除率均保持在90%以上。然而MBR运行过程中产生的膜污染仍是影响MBR工艺稳定运行及阻碍其进一步商业化应用的主要因素[6]。
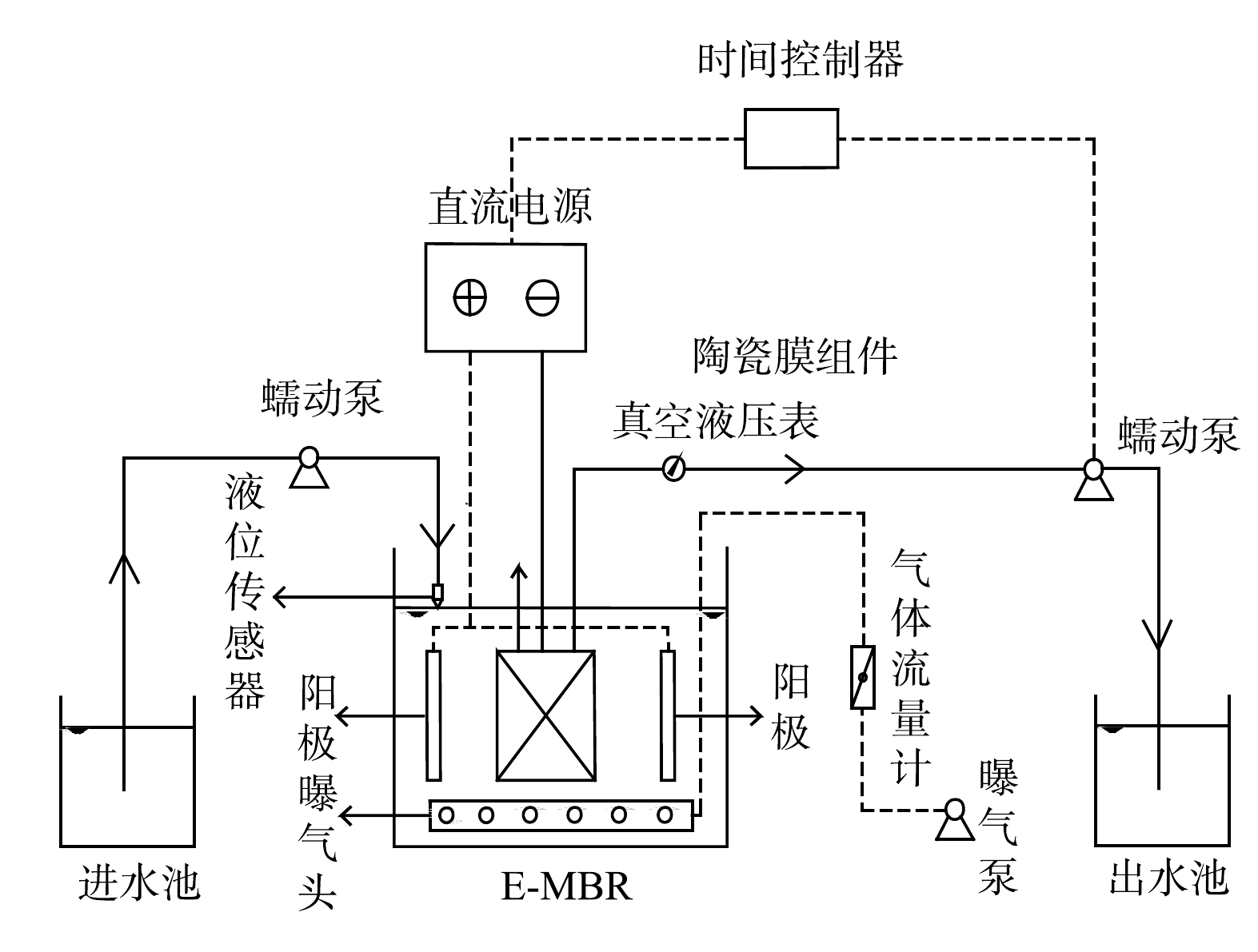
电化学MBR是近年来发展起来的新型污水处理技术[7],有研究表明,电场是缓解膜污染、提高出水水质的有效清洁的途径之一[8],其属于使用物化法控制膜污染的范畴,具有清洗效果好、过程稳定、无需外加化学药剂、没有二次污染、成本低等特点,可为拓展MBR的工程化应用提供技术支撑[9]。DUDCHENKO等[10]采用改性导电膜,建立了膜阴极MBR,发现在-3 V和-5 V下运行100 min时,TMP分别降低了33%和51%,外加电场可有效缓解膜污染。但外加电场的MBR系统应用于处理高盐废水的研究较少。本研究采用电强化的陶瓷膜MBR(E-MBR)处理模拟的海水冲厕水,通过与传统MBR(C-MBR)进行对比,考察了在不同电流密度下外加电场MBR系统运行性能、体系内活性污泥特性以及系统运行过程中膜污染行为的变化规律,以期为外加电场MBR处理含盐污水的实际应用提供参考。
1. 材料与方法
1.1 实验装置和进水水质
E-MBR装置如图1所示。反应器采用有机玻璃材料,有效容积为12 L(20 cm×15 cm×40 cm)。膜孔径为0.1 μm的平板陶瓷膜置于反应器中央,采用双侧过滤,有效过滤面积为0.05 m2。钛丝插入膜组件中与直流电源的负极相连,作为E-MBR的阴极。2片石墨板阳极置于膜组件两侧距膜表面3.5 cm处,2块阳极板的有效面积均为0.025 m2。电极夹为铁质电极夹。进水由液位传感器控制,反应器液面低于设定的界面时自动进水。蠕动泵控制出水,保持恒定通量为20 L·(m2·h)−1,工作10 min,停止2 min,电场在出水停止时施加。另一个相同大小但是不施加电场的C-MBR与E-MBR平行运行,作为对照组。
本实验中1、2、3阶段设置的电流密度分别为2、2.6、3.2 A·m−2,对应的电流分别为0.1、0.13和0.16 A,每个阶段运行过程中保持电流恒定。反应器内接种污泥为驯化后适应10‰盐度污水的活性污泥,反应器内初始MLSS约为3 g·L−1,第2和第3阶段开始前会对E-MBR和C-MBR进行排泥,使得施加新的电流密度前2个反应器内的MLSS保持在3 g·L−1左右。进水为模拟海水冲厕水,组分为500 mg·L−1无水乙酸钠,400 mg·L−1 NH4Cl,30 mg·L−1 KH2PO4,pH为7.5~8(投加NaHCO3),10 000 mg·L−1海水晶,盐度和微量元素均由海水晶提供。模拟废水通过蠕动泵进入MBR中,经过膜组件过滤出水,出水采用蠕动泵抽吸方式,在恒定通量条件下运行。利用数字压力表记录TMP的变化,当TMP上升到40 kPa,取出膜组件,用海绵球擦洗并用去离子水冲洗膜表面滤饼层,如膜通量仍不稳定,用0.3%(体积分数)的NaClO溶液浸泡2 h,再用去离子水冲洗浸泡2 h并反冲洗5 min。
1.2 测试方法
COD、NH4+-N、TP和MLSS均采用国家规定的标准方法测定,比氨氧化速率(SAOR)的测定方法参考文献[11]。采用激光粒度分析仪测定污泥粒径分布(particle size distribution,PSD),污泥混合液的Zeta电位采用Zeta电位分析仪(Zetasizer Nano Z,Malvern Instruments,UK)测定。SMP(soluble microbial product)和EPS(extracellular polymeric substance)是影响膜污染的重要因素。采用离心过滤法提取SMP,采用热提取法提取EPS[12]。上述提取物均经0.45 μm滤膜过滤,采用蒽酮比色法测定多糖含量,采用Folin-酚分光光度法测定蛋白质。通过膜污染过程中阻力分布分析,可以得出造成膜污染增加的主要因素。根据达西(Darcy’s law)定律公式可以得到膜总阻力RT,膜固有阻力Rm,膜浓差极化阻力Rcp,膜面滤饼层阻力Rc以及膜孔阻力Rb。
2. 实验结果与讨论
2.1 电流密度对污染物去除的影响
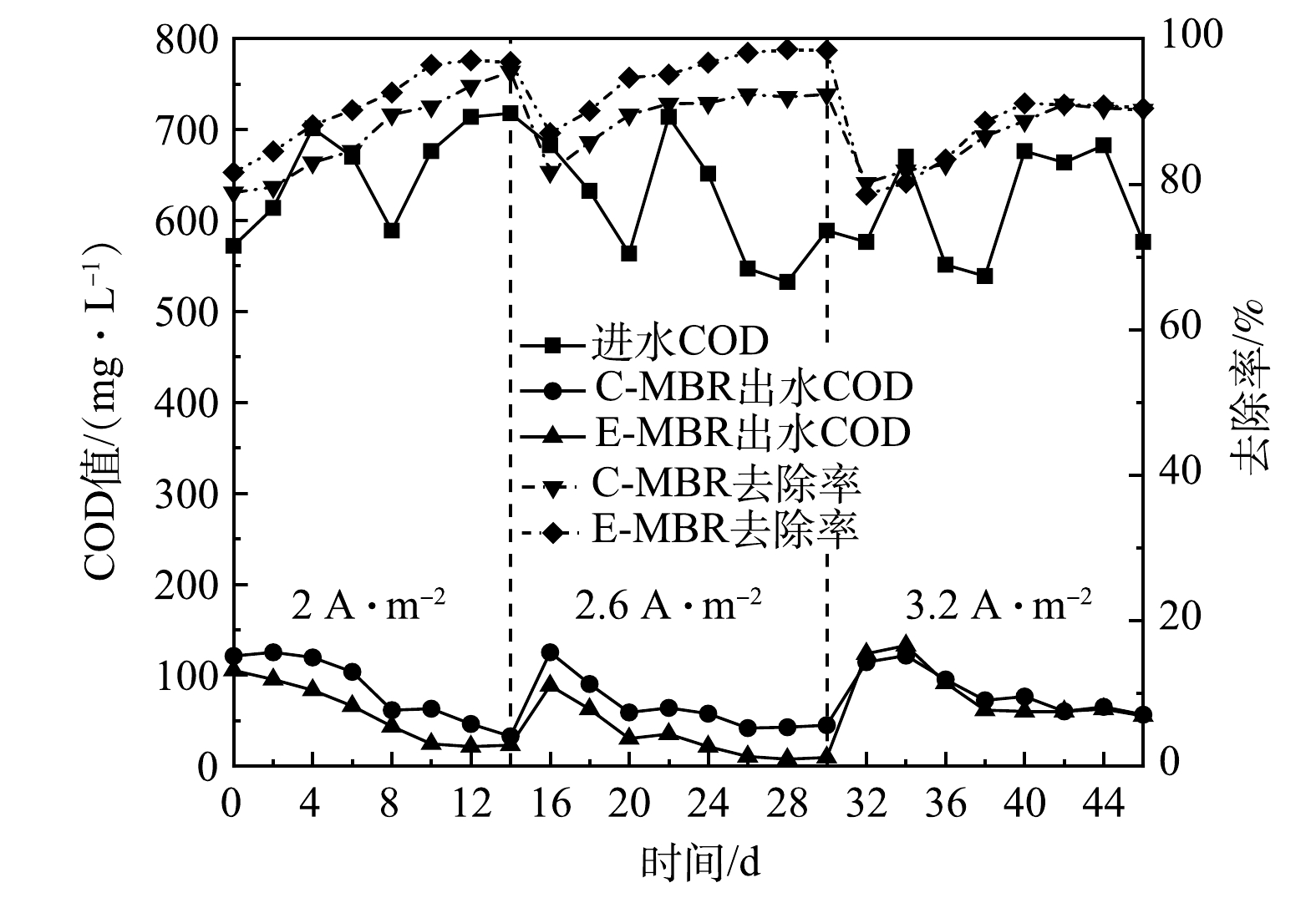
1)对COD去除效果的影响。如图2所示,当电流密度为2 A·m−2时,E-MBR系统运行初期COD的去除率为81.6%,略高于C-MBR的COD去除率(78.83%),经过一定的适应时间,E-MBR和C-MBR系统中COD去除率均可达到95%以上。但由图2可以看出,此运行期间,E-MBR系统COD的去除率均高于C-MBR。电流密度为2.6 A·m−2时E-MBR和C-MBR的运行效果与电流密度为2 A·m−2时的效果类似,E-MBR对COD的去除效果优于C-MBR,但在此阶段E-MBR中COD去除率达到90%需要的时间(2 d)短于电流密度为2 A·m−2阶段需要的时间(6 d)。由图2可知,在同样适应时间内,电流密度为2.6 A·m−2阶段的COD去除率要明显高于电流密度为2 A·m−2的阶段。第2阶段系统运行末期,E-MBR中COD去除率稳定在98%以上,略高于第1阶段末96%的去除率。其原因可能归为以下2点:适宜的弱电场对细胞代谢产生电刺激,提高微生物活性,促进了有机物的降解[13];随着电流密度的增大,体系中产生的具有氧化活性的物质浓度提高,进一步将有机物污染物降解为小分子有机物甚至矿化为二氧化碳和水[14]。继续提高电流密度至3.2 A·m−2,此阶段运行末期系统达到稳定状态,E-MBR系统COD的去除率稳定在90%左右,相较于前2个阶段有所降低。不同于前2个阶段中E-MBR对COD去除效果均优于C-MBR,此阶段E-MBR中COD去除率没有显著提高,与C-MBR对COD的去除效果相近。这是因为系统中污泥的活性在过大的电场作用下被抑制,从而导致系统中COD的去除率下降[15]。
2)对NH4+-N去除效果的影响。如图3(a)所示,在电流密度为2 A·m−2时,经过一段时间的适应,E-MBR和C-MBR中NH4+-N的去除率均可达到98%以上;当电流密度为2.6 A·m−2时,E-MBR系统在此阶段运行末期对NH4+-N的去除率达到了99%,高于此阶段下C-MBR系统95%的NH4+-N去除率。前2个阶段末期,E-MBR出水中NH4+-N的质量浓度均保持在1.5 mg·L−1左右,符合我国《城镇污水处理厂污染物排放标准》(GB 18918-2002)一级A标准[16],出水水质良好。第3阶段(电流密度为3.2 A·m−2),C-MBR对NH4+-N的去除率依旧良好,可达95%,但E-MBR对NH4+-N的去除率明显降低,平均去除率仅为88.33%,显著低于上一阶段96.37%的平均去除率。这是因为MBR中污泥的活性在过高的电流密度下被抑制,NH4+-N的去除率也随之降低[17]。
图3(b)为电流密度对微生物SAOR的影响结果。可见,随着电流密度的增大,E-MBR系统中SAOR呈先升高后降低趋势,当电流密度由2 A·m−2增加至2.6 A·m−2时,SAOR由(3.86±0.18) mg·(h·g)−1(以MLSS计)增加至(4.88±0.12) mg·(h·g)−1,升高了26.42%。电流密度升至3.2 A·m−2时,SAOR降低为(3.06±0.15) mg·(h·g)−1,相比于第2阶段降低了37.30%。上述结果表明,在适宜的电场强度范围内,增大电流密度可以显著提高系统中氨氧化菌活性,电流密度过大则会对氨氧化菌活性产生抑制作用。此结果与电流密度为2 A·m−2和2.6 A·m−2下NH4+-N去除效果显著高于3.2 A·m−2条件下NH4+-N去除效果的结果一致。
体系中氨氮的去除依赖于生物作用下的氧化作用和外加电场后产生的电氧化作用。膜的高效截留作用使世代周期较长的硝化菌和亚硝化菌在反应器内呈现出优先生长繁殖的趋势,并且避免了硝化菌的流失,硝化过程更完全,从而使膜出水的氨氮浓度逐渐降低[18];另一方面,在适宜范围内,随着电流密度的增大,电氧化作用相应增强,体系中产生的H2O2可以将NH4+-N氧化为氮气和水,促使污染物浓度降低[19]。
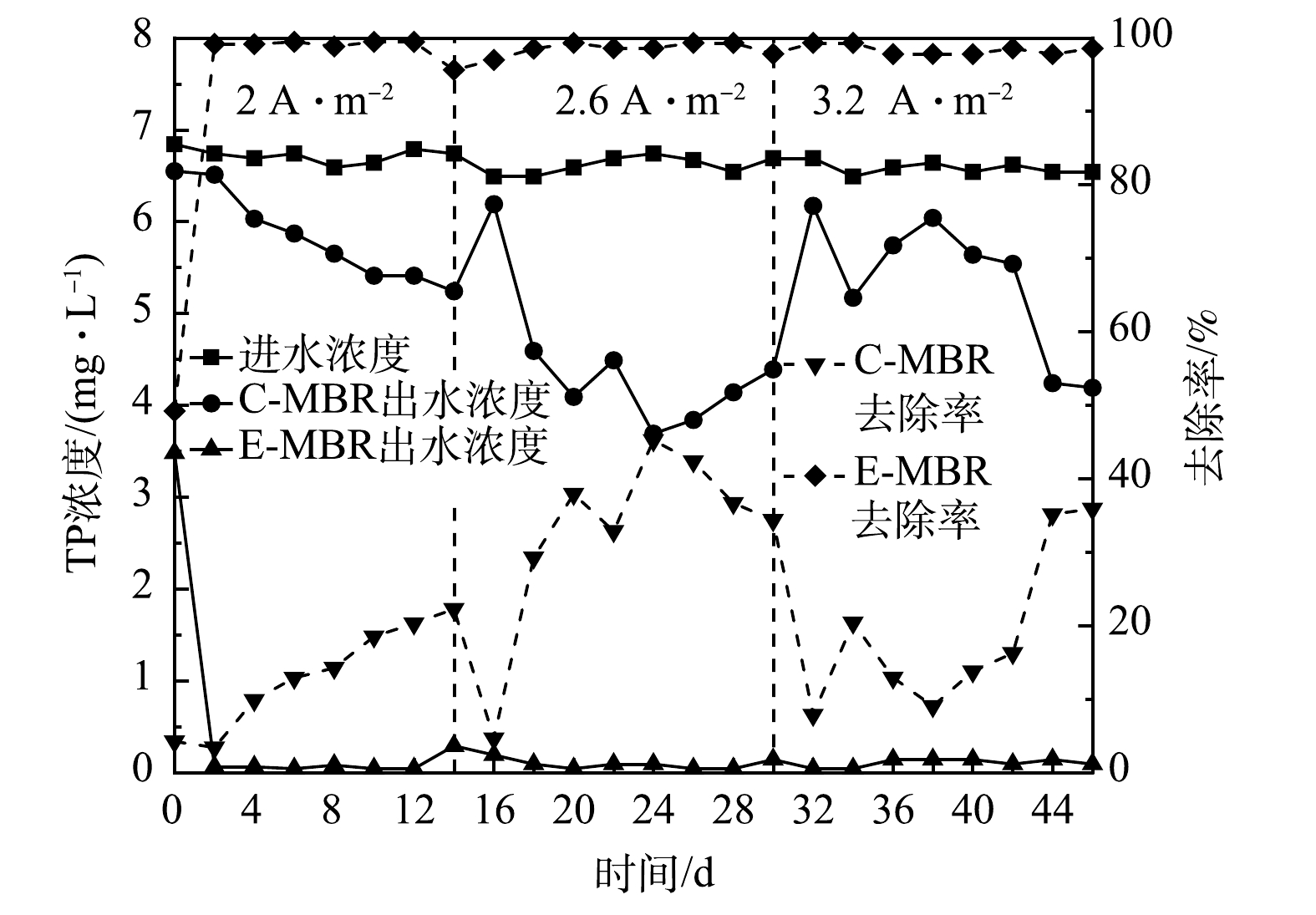
3)对总磷去除效果的影响。如图4所示,运行第1天时,E-MBR系统TP的去除率为49.22%,显著高于C-MBR对TP的去除率(4.22%)。第2天,E-MBR系统TP的去除率升至99.17%,此后TP的去除率一直稳定在99%以上。第2阶段和第3阶段E-MBR的TP去除率也一直维持在98%左右,远远高于C-MBR系统中TP的去除率。在第1、2、3阶段,随着反应器的运行,每一阶段末期C-MBR的TP去除率均稳定在35%左右。导致2个体系TP去除率差异如此大的原因可能归为以下2点:一是电场对聚磷菌生长的影响,电场作用下聚磷菌的活性增强——体系中产生的H2O2进入细胞体内分解产生大量O2,促进细胞的呼吸及氧化还原作用,减缓了对水分的吸收速率,与能量代谢有关的酶活性迅速提高,从而提高对TP的去除[20];二是电场作用下,阳极铁电极夹释放出的亚铁离子与混合液中的磷发生反应生成了不溶沉淀[21]。由图4可见,E-MBR系统电流密度增大至3.2 A·m−2时,TP的去除率并没有与上述COD和NH4+-N去除率在此阶段呈下降趋势相一致。这可能是由于菌种对电场的耐受差异决定的:去除磷的微生物与去除COD和NH4+-N的微生物对电场的响应情况、耐受程度不同,即在较高的电场强度下,去除COD和NH4+-N的微生物活性首先受到抑制,而去除磷的微生物活性依旧保持。
2.2 电流密度对污泥特性的影响
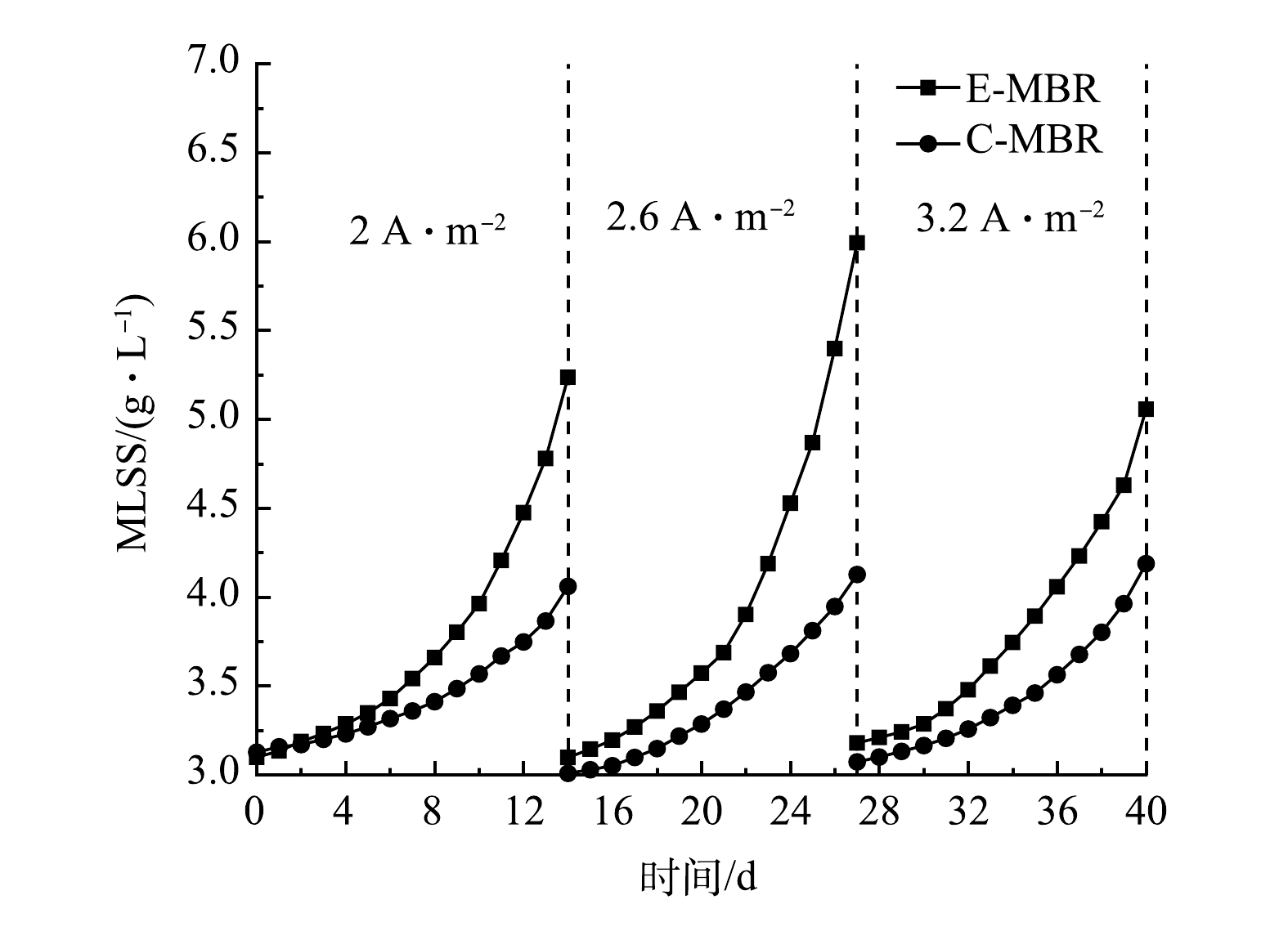
1)电流密度对污泥浓度的影响。考察了不同电流密度下2个系统MLSS的变化,结果如图5所示。电流密度为2 A·m−2时,C-MBR中MLSS由最初的3.13 g·L−1升至最终的4.06 g·L−1,增长了30%,此阶段E-MBR中MLSS阶段末比阶段初增长了69%。电流密度为2.6 A·m−2时,C-MBR阶段末比阶段初增长了37%,E-MBR阶段末比阶段初增长了93%。电流密度为3.2 A·m−2时,C-MBR阶段末比阶段初增长了36%,E-MBR阶段末比阶段初增长了59%。以上结果表明,施加适当的电场可促进MLSS的升高,电流密度为2.6 A·m−2时MLSS增长最快,电流密度为3.2 A·m−2时MLSS增长最缓慢。电场对污泥浓度的影响主要体现在电场对微生物活性的影响,适宜的电场强度作用下,体系中某些酶(脱氢酶、氨单加氧酶、亚硝酸盐还原酶、硝酸盐还原酶等)的活性增强甚至被激活,从而促进酶的生物活性反应[22]。适宜的微电场也可调节微生物代谢,使微生物细胞膜的通透性得以增强,营养基质离子的定向迁移在电场作用下被强化[23]。
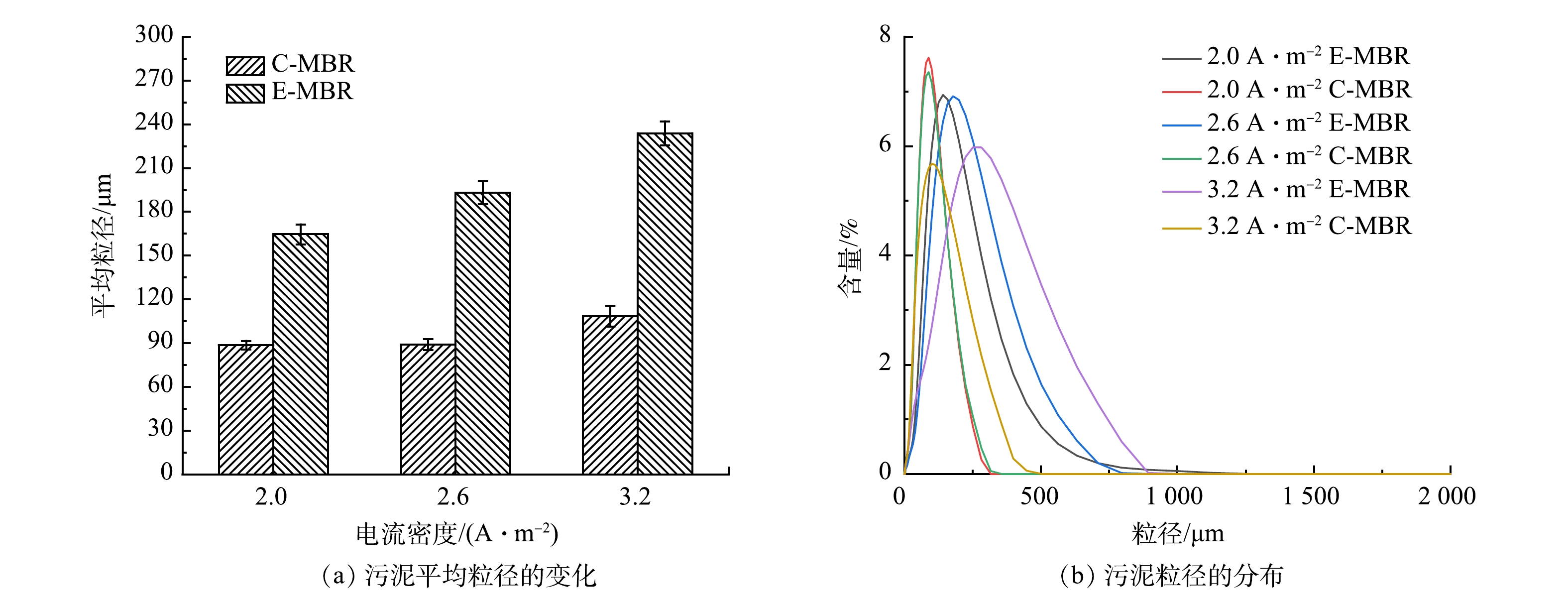
2)电流密度对污泥粒径的影响。电场作用下污泥粒径的变化见图6。由图6(a)可以看出,各阶段E-MBR系统中污泥的平均粒径均显著大于C-MBR系统中的污泥粒径。施加的电场产生的电絮凝作用对污泥颗粒的最大影响之一就是促进污泥颗粒团聚[24]。在第1阶段,外加电场后污泥的平均粒径由对照反应器的89 μm增加至165 μm;第2阶段由89 μm增加至193 μm;第3阶段由108 μm增加至234 μm。进一步考察了各阶段2个系统中污泥粒径分布情况。由图6(b)可知,E-MBR中污泥粒径的分布更加集中,污泥粒径的分布可能更加均匀。均匀性可以通过污泥分散性指数(DSI)表征,DSI值越小,污泥分布越均匀。进一步计算两系统各阶段DSI值可得:电流密度为2 A·m−2时,C-MBR系统的DSI为0.931,E-MBR系统的DSI为0.815;电流密度为2.6 A·m−2时,C-MBR系统的DSI为0.908,比E-MBR系统大了0.062;电流密度为3.2 A·m−2时,C-MBR系统的DSI为1.08,E-MBR系统的DSI为1.072。这说明,外加电场后,DSI值降低,体系中污泥粒径的均匀性得到了有效提高。滤饼层阻力的大小是膜污染总阻力大小的决定性因素之一,滤饼层的形成与系统DSI的大小有一定关系,DSI降低,表明附着在膜表面的滤饼层阻力越小,形成的滤饼层越松散[25]。由此可知,外加电场后,较大粒径的活性污泥可以减少膜孔的堵塞,减缓膜污染的程度[26],同时污泥絮体均匀性的提高同样减缓了膜污染速度。
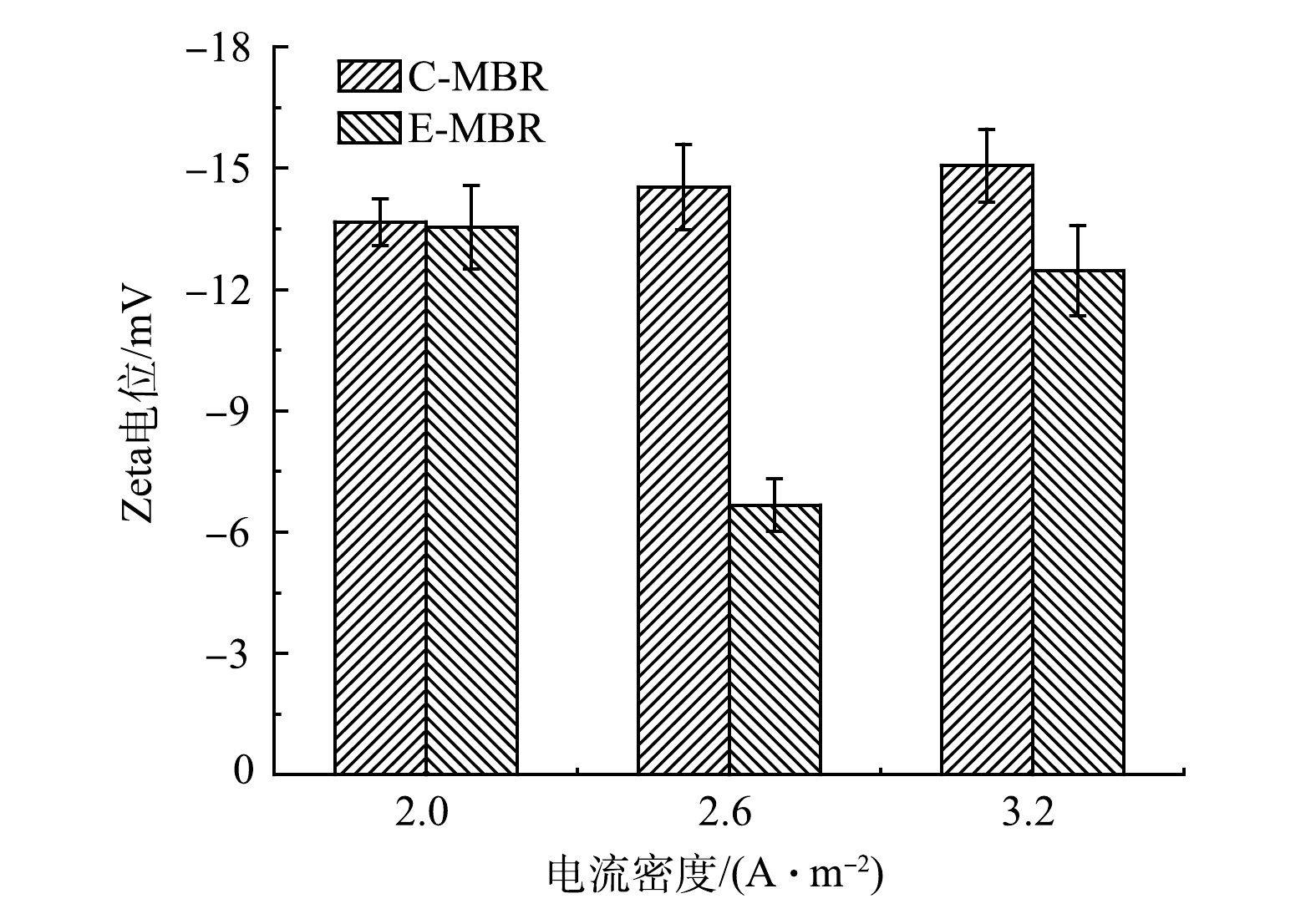
3)电流密度对污泥Zeta电位的影响。如图7所示,电流密度为2 A·m−2时,E-MBR系统的Zeta电位(绝对值13.53 mV)略小于C-MBR系统(13.67 mV)。电流密度增大至2.6 A·m−2时,2个系统Zeta电位的差值显著变大,C-MBR系统的Zeta电位为14.53 mV,E-MBR的Zeta电位为6.67 mV,下降了7.86 mV。电流密度为3.2 A·m−2时,C-MBR的Zeta电位为15.07 mV,E-MBR的Zeta电位为12.47 mV,下降了2.6 mV。电场降低污泥的Zeta电位表明电场的施加降低了污泥颗粒之间的排斥力,使得污泥颗粒更易团聚,较大的污泥颗粒更不易引起膜污染[27],这与前述电流密度对污泥粒径影响的结果是一致的。
2.3 不同电流密度下膜污染分析
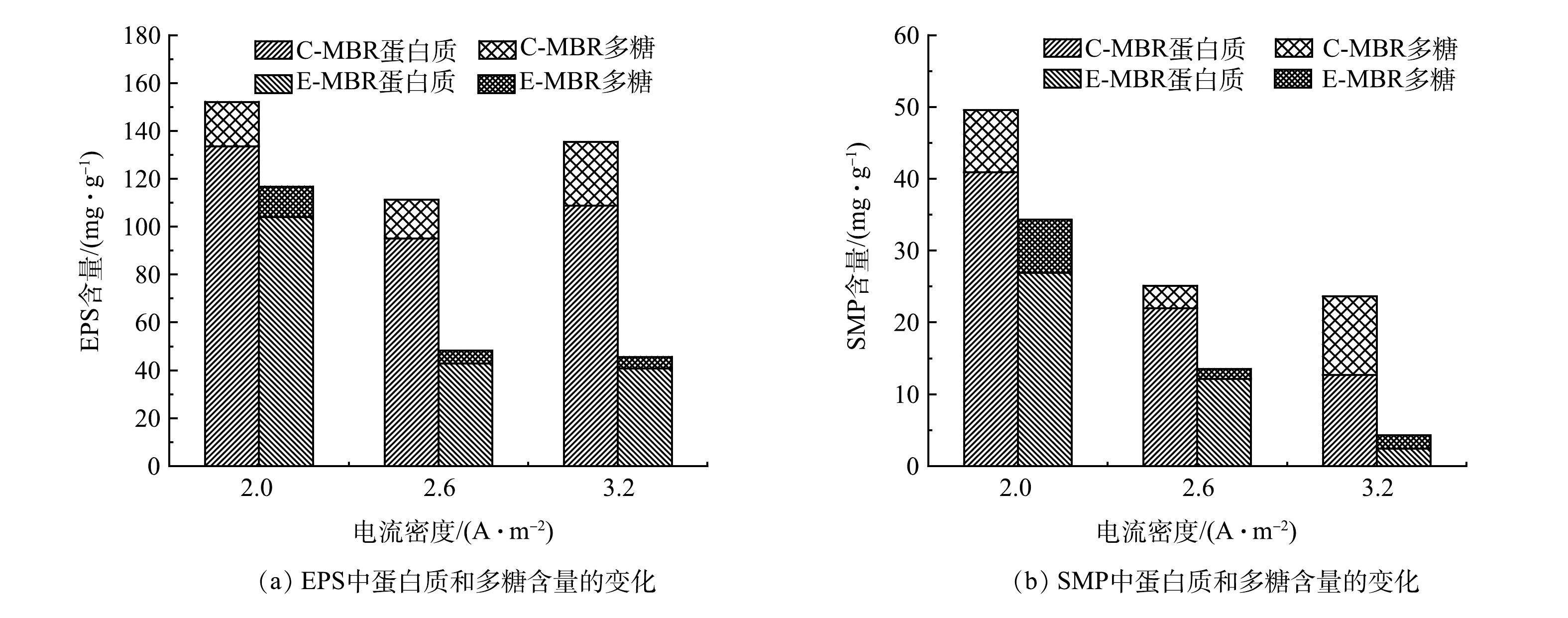
1)电流密度对膜污染物质的影响。SMP和EPS是影响膜污染的重要因素。图8反映了不同电流密度下EPS、SMP中蛋白质和多糖含量变化的情况。两系统混合液EPS中蛋白质和多糖含量如图8(a)所示。电流密度为2 A·m−2时,C-MBR中蛋白质含量为133.62 mg·g−1(以MLSS计),多糖含量为18.48 mg·g−1;相较于C-MBR,E-MBR中蛋白质含量降低了22.16%(104.01 mg·g−1),多糖含量降低了31.01%(12.75 mg·g−1)。第2阶段,C-MBR中蛋白质含量为95.08 mg·g−1,多糖含量为16.08 mg·g−1;相较于C-MBR,E-MBR中蛋白质含量降低了54.94%(42.84 mg·g−1),多糖含量降低了66.54%(5.38 mg·g−1)。第3阶段,C-MBR中蛋白质含量为108.8 mg·g−1,多糖含量为26.61 mg·g−1;相较于C-MBR,E-MBR中蛋白质含量降低了62.63%(40.66 mg·g−1),多糖含量降低了81.47%(4.93 mg·g−1)。从各阶段2个体系EPS中蛋白质和多糖含量的对比结果来看,随着电场强度的增大,EPS中蛋白质和多糖含量显著减少,从而在一定程度上缓解膜污染。产生此现象的原因可能有以下2点:一是电场作用可以刺激微生物活性,增强微生物的代谢能力,使得微生物不需要再分泌更多的EPS来改变生存环境,因此抑制了EPS的生成[28]; 二是电场作用下体系中产生的具有高氧化作用的H2O2和·OH可以致使EPS的含量降低[29]。
系统中另一主要膜污染物质SMP中蛋白质和多糖含量的变化与EPS一致,E-MBR系统SMP中蛋白质和多糖含量随着电流密度的增大而降低。这可能是由于系统中施加了适当的电场,具有较高的有机污染物处理效率,减少了系统中活性污泥的有机负荷,从而降低了SMP中蛋白质和多糖的含量。
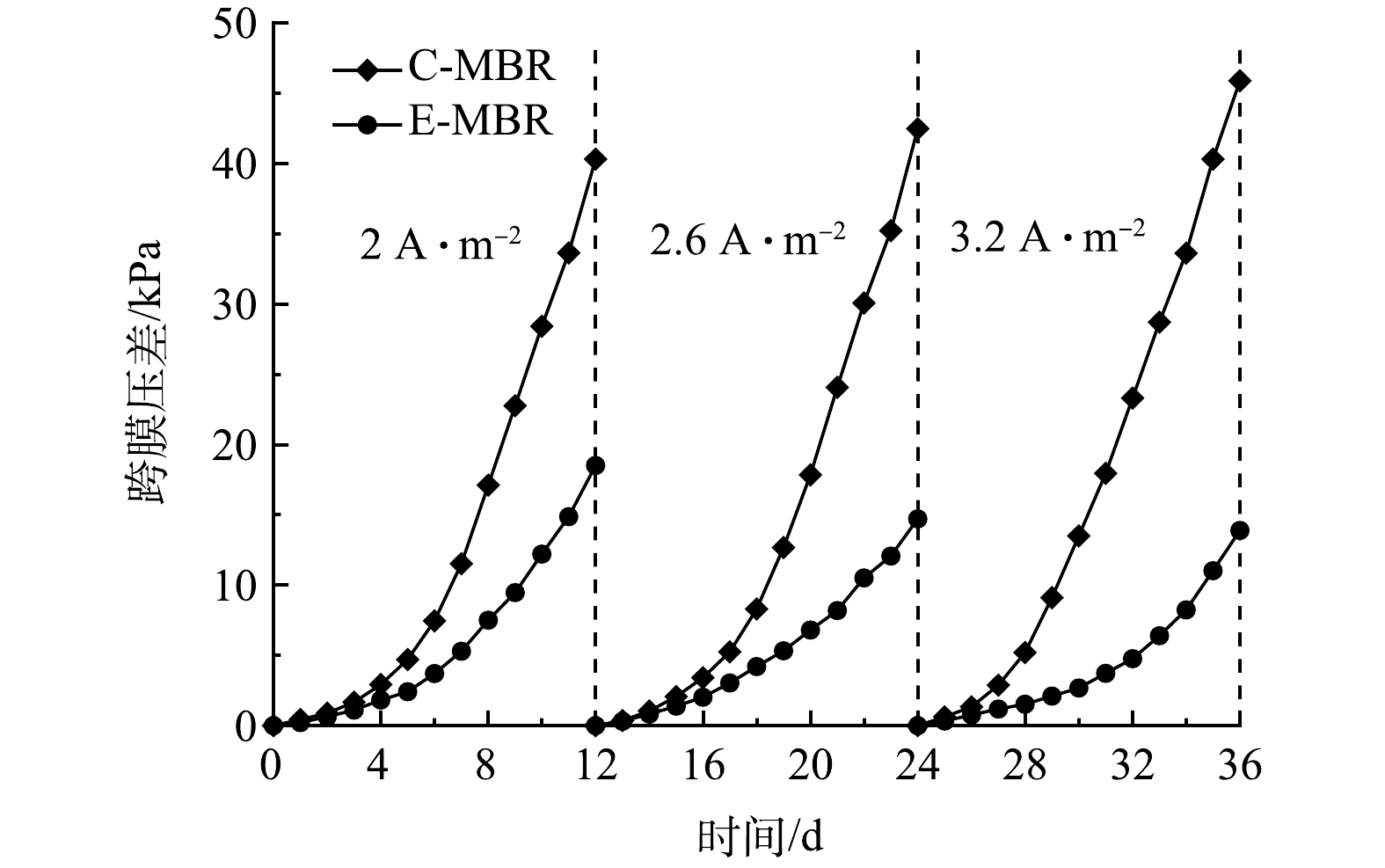
2)电流密度对系统TMP的影响。跨膜压差是反应膜污染程度的重要指标之一,跨膜压差越高膜污染越严重[30]。理论上,本研究E-MBR系统存在的电场作用会缓解膜污染情况,保持膜出水通量恒定。每个阶段TMP随时间的变化情况如图9所示。可见,每个阶段2个反应器TMP的变化均是由最初的平稳增长变为快速增长。在C-MBR中,TMP在运行前期略有增加,从第4天开始TMP迅速增加直至40 kPa。E-MBR中,从第6~8天开始,TMP的增长速率开始加快。每个阶段末期,C-MBR的TMP值分别为40.3、42.5、45.9 kPa,相对应时间下E-MBR的TMP值为18.5、14.7、13.9 kPa,分别比C-MBR降低了54.09%、65.37%和69.74%。对比3个阶段E-MBR系统TMP的增长,可以看出,电流密度越大,TMP增长越缓慢,膜污染缓解程度越明显。以上结果可以归因于以下3点:一是电场作用下,膜组件表面带负电,混合液中带负电的污泥絮体、大分子有机物或胶体在电场排斥力的作用下,向远离膜面的方向移动[31];二是附着在膜表面的污染物质会被混合液中电场作用下产生的H2O2和·OH等强氧化剂原位降解,膜污染从而得到缓解[32];三是电场作用下污泥性质发生改变,例如污泥Zeta电位变小,污泥粒径增大,这些均可以缓解膜污染。
3)电流密度对膜污染阻力分布的影响。根据Darcy公式算出不同电流密度下E-MBR和C-MBR体系中RT,Rm,Rcp,Rc以及Rb,表1为两系统中的膜污染阻力分布值。
表 1 3个阶段E-MBR和C-MBR中膜阻力分布表Table 1. Distribution of membrane resistance in E-MBR and C-MBR at three stages 1011 m−1阶段 实验组 RT Rm Rcp Rc Rb 第1阶段 E-MBR 3.24 0.091 1.54 0.673 0.929 第1阶段 C-MBR 4.36 0.090 1.28 1.88 1.11 第2阶段 E-MBR 2.51 0.089 1.04 0.46 0.92 第2阶段 C-MBR 3.62 0.094 0.596 1.57 1.23 第3阶段 E-MBR 2.77 0.094 1.16 0.496 1.02 第3阶段 C-MBR 5.75 0.09 1.92 2.4 1.29 由表1可知,在第1、2、3阶段中,C-MBR的膜总阻力分别为E-MBR的1.35、1.44和2.07倍。这表明外加电场可有效减少膜阻力,缓解膜污染,延长膜的使用期限。对于膜的特定阻力(Rm、Rcp、Rc、Rb),Rc为每个阶段下2个系统中数值差异较大的指标,第1阶段,相较于C-MBR的Rc值,E-MBR减少64.2%,第2阶段降低了70.7%,第3阶段减少了79.33%。以上结果表明E-MBR中膜污染得到有效控制的决定性因素为微电场作用,并且外加电场是通过有效控制膜表面的滤饼层阻力来缓解膜污染。
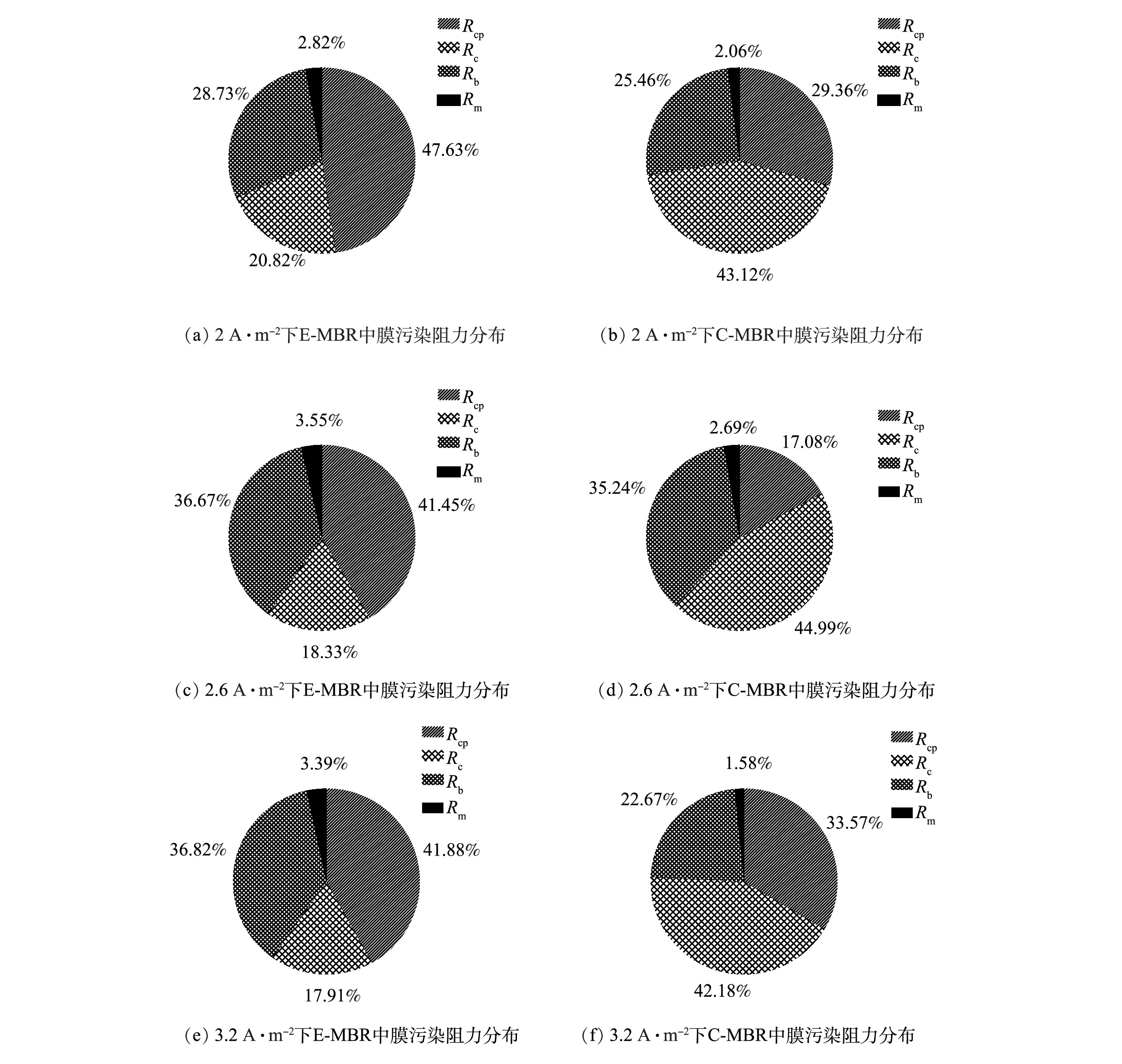
根据Rm,Rcp,Rc以及Rb所占的百分比绘制饼状图,结果如图10所示。电流密度为2 A·m−2时,E-MBR膜面滤饼层阻力占总阻力的20.82%,相比之下C-MBR中Rc占比显著增高,增加至43.12%。电流密度为2.6 A·m−2和3.2 A·m−2时,E-MBR中Rc占比均显著低于C-MBR。这主要是因为:在电场力的作用下,带负电的污泥颗粒和污染物会远离膜面,从而粘附在膜组件表面的污染物质所形成的滤饼层便会少于对照组[33]。同时,对于已经粘附在膜面的污染物质,外加电场会对其产生排斥力,在与C-MBR同等的曝气条件下,E-MBR膜组件表面的污染物质更容易在曝气产生的剪切力作用下脱离膜面。
通过对比3个阶段E-MBR中Rc所占百分比可以看出,随着电流密度的增加,Rc在系统总阻力中所占比例逐渐减少。这与2.3中的2)得到的“电流密度越大,TMP增长越缓慢,膜污染缓解程度越明显”结论一致。
由图10可见,每个电流密度阶段下C-MBR和E-MBR中Rm和Rb占比相当,Rm均保持在2%左右,Rb均保持在30%左右,但是每个阶段下Rcp在2个反应器中的占比相差较大,且均为E-MBR中的Rcp占比大于C-MBR的Rcp占比。有研究表明[34],造成此差异的原因可能为,外加电场可能会引起反应器内混合液中有机物质的增加,从而导致浓差极化阻力在膜污染中所占比例增大。
3. 结论
1)构建了外加电场E-MBR体系,在适宜范围内,当电流密度增大时,依赖于生物降解作用和电氧化作用,COD和NH4+-N的去除效果提升。电流密度进一步增大至3.2 A·m−2时,COD和NH4+-N的去除率降低,这是因为电流密度过大会对MBR中活性污泥的活性产生抑制作用;系统对于TP的去除由于菌种对电场的耐受差异,电流密度增大至3.2 A·m−2时去除磷的微生物活性依旧保持,所以不会降低TP的去除率。
2)对比C-MBR系统,外加电场促进MLSS的升高,且在电流密度为2.6 A·m−2时MLSS增长最快;E-MBR中,污泥粒径更大,且污泥絮体的均匀性提高;E-MBR中污泥的Zeta电位绝对值降低,有利于缓解膜污染。
3)随着电流密度的增大,EPS和SMP中蛋白质和多糖含量显著减少,且始终低于C-MBR系统中的含量。以TMP为判据,电流密度越大,TMP增长越缓慢,膜污染缓解程度越明显。具体分析膜污染阻力的分布可以看出,膜面滤饼层阻力的占比随着电流密度的增大逐渐减少,且E-MBR中Rc占比始终显著低于C-MBR。E-MBR与C-MBR相比能有效缓解膜污染。
-
图 2 双酚A转换随时间的函数[57]
Figure 2. Bisphenol A conversion as a function of time
表 1 常温水和超临界水的性质比较
Table 1. Comparison of properties between constant temperature water and supercritical water
性质 Property 常温水 Constant temperature water 超临界水 Supercritical water 温度/℃ 25 450 压力/MPa 0.1 27 密度/(g·cm−3) 0.998 0.128 介电常数 78.5 1.8 黏度/cp 0.890 0.0298 扩散系数/(cm2·s−1) 7.74×10−6 7.76×10−4 离子积 10-14 10-22 表 2 铁基催化剂用于降解有机污染物研究
Table 2. Research on iron-based catalyst for degradation of organic pollutants
难降解有机物Refractory organic matter 催化剂Catalyst 制备方法Preparation 比表面积/(m2∙g−1)Specific surface area 氧化剂Oxidizer COD去除率/%COD removal rate TOC去除率/%TOD removal rate 铁浸出浓度/(mg ∙L−1)Iron leaching concentration 底物浓度/(mg ∙L−1)Substrate concentration 参考文献References 苯酚 Fe-ZSM-5 湿浸渍法 225.5 H2O2 99.2 77.7 1.9 1000 [15] 间甲苯酚 Fe2O3-ZSM-5 气相沉积法 251.7 H2O2 99 80.5 1.1 1000 [16] 苯甲酸 Fe3O4@CeO2 溶剂热法 104.9 H2O2 80 48 4.2 50 [17] 苯酚 3D Fe/SiC 3D打印法 23.5 H2O2 100 60 8.3 1000 [18] 苯酚 Al/Fe-PILCs 超声浸渍法 200 O2 100 80 0.7 1000 [19] 2,4,6-三氯酚 铁基碳氧凝胶 浸渍法 510 O2 74.49 24.31 0.091 1600 [20] 草甘膦 Fe-SBA(20) 凝胶法 705 O2 80 N/A N/A 15 [21] 香草酸 Fe/TS-1 湿浸渍法 N/A H2O2 100 N/A N/A 10000 [22] 苯酚 Fe3C@NCNT/PSSF 气相沉积法 15 H2O2 92 41 N/A 1000 [23] 甲酚 Fe/ZSM 浸渍法 574.9 H2O2 90.7 24 0.12 100 [24] 甲硝唑 Fe/Al2O3 微波浸渍法 0.11 H2O2 73 N/A 0.1 0.1 [25] 磺胺甲恶唑 Fe/SiC 微波浸渍法 0.23 H2O2 83 N/A 0.27 0.1 [25] 卡马西平 Fe/ZrO2 微波浸渍法 0.35 H2O2 90 N/A 0.35 0.1 [25] P-4B染料 Al/Fe-PILCs 气相沉积法 201 H2O2 99.24 58.13 0.24 100 [26] 扑热息痛 铁碳干凝胶(RFFeC) 熔融-凝胶法 263 H2O2 99 60 0.2 50 [27] 苯酚 Al-Ce-Fe NaOH激活+热处理 121.8 H2O2 100 54 0.25 1000 [28] 乙二胺四乙酸 Fe-MCM-41 浸渍法 937 H2O2 100 50 0.2 5845 [29] N/A,无法获得的. N/A,Not available. 表 3 铜基催化剂用于降解有机污染物研究
Table 3. study on copper based catalyst for degradation of organic pollutants
难降解有机物Refractory organic matter 催化剂Catalyst 制备方法Preparation BET比表面积/(m2∙g−1)Specific surface area 铜负载率/%Copper load rate 氧化剂Oxidizer COD去除率/%COD removal rate TOC去除率/%TOD removal rate 铜浸出浓度/(mg ∙L−1)Copper leaching concentration 底物浓度/(mg ∙L−1)Substrate concentration 参考文献References 喹啉 Cu/沸石Y 水离子交换法、湿浸渍法 909 5.03 H2O2 100 65.4 6 1100 [41] 制药污泥 Cu/Ce 共沉淀法 N/A N/A O2 80 N/A 5 18000 [42] ETBE和TAME CuO/γ-Al2O3 溶胶凝胶法 449 16.9 O2 100 74 0 N/A [43] 苯酚 Cu3-Al-500 共沉淀法 22.8 O2 99 N/A 10.3 2100 [44] 氯酚 CeCu 湿浸渍法 63.4 4.46 H2O2 99.5 82 2.46 50 [45] 苯酚 Cu-ZSM-5 离子交换法 165 1.91 H2O2 98 78 7.2 1000 [46] 4-氯苯酚 Zn-CNTs-Cu 渗透熔融化学置换法 N/A N/A H2O2 100 68 N/A 1000 [47] 咖啡因 CuNi-YC 湿浸渍法 57.81 N/A H2O2 86.16 68.85 2.05 40 [48] N/A,无法获得的. N/A,Not available. 表 4 稀有金属催化剂用于降解有机污染物研究
Table 4. Research on rare metal catalysts for degradation of organic pollutants
难降解有机物Refractory organic matter 催化剂Catalyst 制备方法Preparation 比表面积/(m2∙g−1)Specific surface area 金属负载率/%Metal loading rate 氧化剂Oxidizer COD去除率/%COD removal rate TOC去除率/%TOD removal rate 底物浓度/(mg ∙L−1)Substrate concentration 参考文献References 活性黑5 LaNiO3 溶胶-凝胶柠檬酸法 N/A 1 O2 65.4 33 100 [55] 腐殖质 NiCo2O4 溶剂热法 66.88 Ni/Co=1:2.06 O2 100 90 25000 [56] 双酚A Ru/ZrO2 溶胶-凝胶和浸渍法 80 3 O2 97 N/A 10 [57] 腐殖酸 Mo/Al2O3 原位水热法、煅烧法 N/A 1.39 O2 100 60 20 [58] 罗丹明6G La/CoFe2O4 溶胶自燃法 3.38 1.15 H2O2 91.6 40 10 [59] Gd/CoFe2O4 2.69 1.08 92.8 27 10 Dy/CoFe2O4 2.51 1.07 91.7 35 10 苯酚 Mn/Ce 共沉淀法 160 Mn/Ce=6/4 O2 100 94 1000 [60] 偶氮染料 Ce2O3-Fe2O3/-Al2O3 浸渍法 193.6 0.39 H2O2 88.77 81.44 500 [61] N/A,无法获得的. N/A,Not available. 表 5 Rh6G染料CWPO降解的颜色/TOC去除数据和动力学参数[59]
Table 5. Color/TOC removal data and kinetic parameters of Rh6G dye CWPO degradation[59]
催化剂 Catalyst 颜色去除率/% Color removal rate TOC去除率/% TOC removal rate C 35.7 17 C-La 91.6 40 C-Gd 92.8 27 C-Dy 91.7 35 表 6 非金属催化剂用于降解有机污染物的研究
Table 6. research on non-metallic catalysts for degradation of organic pollutants
难降解有机物Refractory organic matter 催化剂Catalyst 制备方法Preparation 比表面积/(m2∙g−1)Specific surface area 催化剂含量/%Catalyst content 氧化剂Oxidizer COD去除率/%COD removal rate TOC去除率/%TOD removal rate 底物浓度/(mg∙L−1)Substrate concentration 参考文献References 布洛芬 石墨粉 商用 12 97.2 H2O2 100 53 20 μmol∙L−1 [72] 双氯芬酸 100 74 20 μmol∙L−1 苯酚 单层石墨烯薄膜 化学气相沉积法 0.6685 N/A H2O2 100 91 1000 [73] 氮掺杂炭 高温氨化 1305 87.1 O2 100 N/A 1000 [74] 活性炭 商用 1019 89.3 H2O2 97 70 5000 [75] 扑热息痛 椰子壳活性炭 炭化法 1180 92.3 O2 95 60 2000 [76] 木材活性炭 1860 71.1 89 41 2000 木麻黄活性炭 1230 86.5 98 62 2000 N/A,无法获得的. N/A,Not available. -
[1] ZHANG H H, LIN H, LI Q, et al. Removal of refractory organics in wastewater by coagulation/flocculation with green chlorine-free coagulants [J]. Science of the Total Environment, 2021, 787: 147654. doi: 10.1016/j.scitotenv.2021.147654 [2] LIU Y Y, SUN Y Q, WAN Z H, et al. Tailored design of food waste hydrochar for efficient adsorption and catalytic degradation of refractory organic contaminant [J]. Journal of Cleaner Production, 2021, 310: 127482. doi: 10.1016/j.jclepro.2021.127482 [3] SAVAGE P E. Organic chemical reactions in supercritical water [J]. Chemical Reviews, 1999, 99(2): 603-622. doi: 10.1021/cr9700989 [4] TOPP A, SCHMIEDEL K, SCHAEFFER G. Wet oxidation[M]. US, US4145283 A[P]. [5] FOG K. The effect of added nitrogen on the rate of decomposition of organic matter [J]. Biological Reviews, 1988, 63(3): 433-462. doi: 10.1111/j.1469-185X.1988.tb00725.x [6] JOCHIMSEN J C, JEKEL M R. Partial oxidation effects during the combined oxidative and biological treatment of separated streams of tannery wastewater [J]. Water Science and Technology, 1997, 35(4): 337-345. doi: 10.2166/wst.1997.0149 [7] WARD C P, CORY R M. Complete and partial photo-oxidation of dissolved organic matter draining permafrost soils [J]. Environmental Science & Technology, 2016, 50(7): 3545-3553. [8] KIM K H, IHM S K. Heterogeneous catalytic wet air oxidation of refractory organic pollutants in industrial wastewaters: A review [J]. Journal of Hazardous Materials, 2011, 186(1): 16-34. doi: 10.1016/j.jhazmat.2010.11.011 [9] 杨少霞, 冯玉杰, 万家峰, 等. 湿式催化氧化技术的研究与发展概况 [J]. 哈尔滨工业大学学报, 2002, 34(4): 540-544. doi: 10.3321/j.issn:0367-6234.2002.04.024 YANG S X, FENG Y J, WAN J F, et al. Catalytic wet air oxidation [J]. Journal of Harbin Institute of Technology, 2002, 34(4): 540-544(in Chinese). doi: 10.3321/j.issn:0367-6234.2002.04.024
[10] CATRINESCU C, TEODOSIU C, MACOVEANU M, et al. Catalytic wet peroxide oxidation of phenol over Fe-exchanged pillared beidellite [J]. Water Research, 2003, 37(5): 1154-1160. doi: 10.1016/S0043-1354(02)00449-9 [11] TEHRANI-BAGHA A R, BALCHI T. Catalytic wet peroxide oxidation[M]//Advanced Oxidation Processes for Waste Water Treatment. Amsterdam: Elsevier, 2018: 375-402. [12] LEFÈVRE M, PROIETTI E, JAOUEN F, et al. Iron-based catalysts with improved oxygen reduction activity in polymer electrolyte fuel cells [J]. Science, 2009, 324(5923): 71-74. doi: 10.1126/science.1170051 [13] LI X, WANG J K, ZHANG X, et al. A high-efficient carbon-coated iron-based Fenton-like catalyst with enhanced cycle stability and regenerative performance [J]. Catalysts, 2020, 10(12): 1486. doi: 10.3390/catal10121486 [14] RUPPERT G, BAUER R, HEISLER G. The photo-Fenton reaction—an effective photochemical wastewater treatment process [J]. Journal of Photochemistry and Photobiology A:Chemistry, 1993, 73(1): 75-78. doi: 10.1016/1010-6030(93)80035-8 [15] YAN Y, JIANG S S, ZHANG H P. Efficient catalytic wet peroxide oxidation of phenol over Fe-ZSM-5 catalyst in a fixed bed reactor [J]. Separation and Purification Technology, 2014, 133: 365-374. doi: 10.1016/j.seppur.2014.07.014 [16] YANG Y, ZHANG H P, YAN Y. The preparation of Fe2 O3-ZSM-5 catalysts by metal-organic chemical vapour deposition method for catalytic wet peroxide oxidation of m-cresol [J]. Royal Society Open Science, 2018, 5(3): 171731. doi: 10.1098/rsos.171731 [17] QIN H D, XIAO R, SHI W, et al. Magnetic core–shell-structured Fe3O4@CeO2 as an efficient catalyst for catalytic wet peroxide oxidation of benzoic acid [J]. RSC Advances, 2018, 8(59): 33972-33979. doi: 10.1039/C8RA07144F [18] QUINTANILLA A, CASAS J A, MIRANZO P, et al. 3D-Printed Fe-doped silicon carbide monolithic catalysts for wet peroxide oxidation processes [J]. Applied Catalysis B:Environmental, 2018, 235: 246-255. doi: 10.1016/j.apcatb.2018.04.066 [19] MOMA J, BALOYI J, NTHO T. Synthesis and characterization of an efficient and stable Al/Fe pillared clay catalyst for the catalytic wet air oxidation of phenol [J]. RSC Advances, 2018, 8(53): 30115-30124. doi: 10.1039/C8RA05825C [20] KUMARI M, SAROHA A K. Synthesis and characterization of carbon xerogel based iron catalyst for use in wet air oxidation of aqueous solution containing 2, 4, 6-trichlorophenol [J]. Journal of Environmental Chemical Engineering, 2019, 7(3): 103121. doi: 10.1016/j.jece.2019.103121 [21] VASCHETTO E G, SICARDI M I, ELÍAS V R, et al. Metal modified silica for catalytic wet air oxidation (CWAO) of glyphosate under atmospheric conditions [J]. Adsorption, 2019, 25(7): 1299-1306. doi: 10.1007/s10450-019-00090-w [22] VEGA-AGUILAR C A, BARREIRO M F, RODRIGUES A E. Catalytic wet peroxide oxidation of vanillic acid as a lignin model compound towards the renewable production of dicarboxylic acids [J]. Chemical Engineering Research and Design, 2020, 159: 115-124. doi: 10.1016/j.cherd.2020.04.021 [23] HUANG H X, ZHANG H P, YAN Y. Preparation of novel catalyst-free Fe3C nanocrystals encapsulated NCNT structured catalyst for continuous catalytic wet peroxide oxidation of phenol [J]. Journal of Hazardous Materials, 2021, 407: 124371. doi: 10.1016/j.jhazmat.2020.124371 [24] CHEN L L, SUN W J, WEI H Z, et al. Developing Fe/zeolite catalysts for efficient catalytic wet peroxidation of three isomeric cresols [J]. Environmental Science and Pollution Research International, 2021, 28(31): 42622-42636. doi: 10.1007/s11356-021-13336-4 [25] NIETO-SANDOVAL J, di LUCA C, GOMEZ-HERRERO E, et al. Innovative iron oxide foams for the removal of micropollutants by Catalytic Wet Peroxide Oxidation: Assessment of long-term operation under continuous mode [J]. Journal of Environmental Chemical Engineering, 2021, 9(5): 105914. doi: 10.1016/j.jece.2021.105914 [26] KıPÇAK İ, KURTARAN ERSAL E. Catalytic wet peroxide oxidation of a real textile azo dye Cibacron Red P-4B over Al/Fe pillared bentonite catalysts: Kinetic and thermodynamic studies [J]. Reaction Kinetics, Mechanisms and Catalysis, 2021, 132(2): 1003-1023. doi: 10.1007/s11144-021-01962-5 [27] CARRASCO-DÍAZ M R, CASTILLEJOS-LÓPEZ E, CERPA-NARANJO A, et al. On the textural and crystalline properties of Fe-carbon xerogels. Application as Fenton-like catalysts in the oxidation of paracetamol by H2O2 [J]. Microporous and Mesoporous Materials, 2017, 237: 282-293. doi: 10.1016/j.micromeso.2016.09.035 [28] CARRIAZO J, GUÉLOU E, BARRAULT J, et al. Catalytic wet peroxide oxidation of phenol by pillared clays containing Al-Ce-Fe [J]. Water Research, 2005, 39(16): 3891-3899. doi: 10.1016/j.watres.2005.06.034 [29] GOKULAKRISHNAN N, PANDURANGAN A, SINHA P K. Catalytic wet peroxide oxidation technique for the removal of decontaminating agents ethylenediaminetetraacetic acid and oxalic acid from aqueous solution using efficient Fenton type Fe-MCM-41 mesoporous materials [J]. Industrial & Engineering Chemistry Research, 2009, 48(3): 1556-1561. [30] SCHERES FIRAK D, ROCHA RIBEIRO R, LIZ M V, et al. Investigations on iron leaching from oxides and its relevance for radical generation during Fenton-like catalysis [J]. Environmental Earth Sciences, 2018, 77(4): 1-9. [31] 周维华, 李振溱, 段猛, 等. 钒渣浸出液中络合除铁的研究 [J]. 钢铁钒钛, 2016, 37(5): 20-24,34. doi: 10.7513/j.issn.1004-7638.2016.05.004 ZHOU W H, LI Z Q, DUAN M, et al. Removal of iron from acid leaching solution of vanadium slag by complexation [J]. Iron Steel Vanadium Titanium, 2016, 37(5): 20-24,34(in Chinese). doi: 10.7513/j.issn.1004-7638.2016.05.004
[32] RAMÍREZ H, NÚÑEZ M, BOGOYA A B, et al. Synthesis of coal fly ash zeolite for the catalytic wet peroxide oxidation of Orange II [J]. Environmental Science and Pollution Research International, 2019, 26(5): 4277-4287. doi: 10.1007/s11356-018-3315-1 [33] BERKÜN OLGUN Ö, PALAS B, ATALAY S, et al. Photocatalytic oxidation and catalytic wet air oxidation of real pharmaceutical wastewater in the presence of Fe and LaFeO3 doped activated carbon catalysts [J]. Chemical Engineering Research and Design, 2021, 171: 421-432. doi: 10.1016/j.cherd.2021.05.017 [34] HU B S, YAMAGUCHI Y, FUJIMOTO K. Low temperature methanol synthesis in alcohol solvent over copper-based catalyst [J]. Catalysis Communications, 2009, 10(12): 1620-1624. doi: 10.1016/j.catcom.2009.02.016 [35] BOKARE A D, CHOI W. Review of iron-free Fenton-like systems for activating H2O2 in advanced oxidation processes [J]. Journal of Hazardous Materials, 2014, 275: 121-135. doi: 10.1016/j.jhazmat.2014.04.054 [36] HU B S, FUJIMOTO K. Promoting behaviors of alkali compounds in low temperature methanol synthesis over copper-based catalyst [J]. Applied Catalysis B:Environmental, 2010, 95(3/4): 208-216. [37] 黄园英, 刘菲, 汤鸣皋, 等. 纳米镍/铁对四氯乙烯快速脱氯试验 [J]. 岩矿测试, 2005, 24(2): 93-96,101. doi: 10.3969/j.issn.0254-5357.2005.02.003 HUANG Y Y, LIU F, TANG M G, et al. Rapid reduction of tetrachloroethene using nano-scale Ni/Fe bimetallic particles [J]. Rock and Mineral Analysis, 2005, 24(2): 93-96,101(in Chinese). doi: 10.3969/j.issn.0254-5357.2005.02.003
[38] MARIÑO F, BOVERI M, BARONETTI G, et al. Hydrogen production from steam reforming of bioethanol using Cu/Ni/K/γ-Al2O3 catalysts. Effect of Ni [J]. International Journal of Hydrogen Energy, 2001, 26(7): 665-668. doi: 10.1016/S0360-3199(01)00002-7 [39] QU Z P, WANG Z, ZHANG X Y, et al. Role of different coordinated Cu and reactive oxygen species on the highly active Cu–Ce–Zr mixed oxides in NH3-SCO: A combined in situ EPR and O2-TPD approach [J]. Catalysis Science & Technology, 2016, 6(12): 4491-4502. [40] CHUANG K H, SHIH K, WEY M Y. The influences of microwave irradiation and polyol precursor pH on Cu/AC catalyst and its CO oxidation performance [J]. Journal of Nanoparticle Research, 2012, 14(10): 1-8. [41] SINGH L, REKHA P, CHAND S. Comparative evaluation of synthesis routes of Cu/zeolite Y catalysts for catalytic wet peroxide oxidation of quinoline in fixed-bed reactor [J]. Journal of Environmental Management, 2018, 215: 1-12. [42] ZENG X, LIU J, ZHAO J F. Catalytic wet oxidation of pharmaceutical sludge by molecular sieve loaded with Cu/Ce [J]. Catalysts, 2018, 8(2): 67. doi: 10.3390/catal8020067 [43] SÁNCHEZ-TRINIDAD C, DEL ANGEL G, TORRES-TORRES G, et al. Effect of the CuAl2O4 and CuAlO2 phases in catalytic wet air oxidation of ETBE and TAME using CuO/γ-Al2O3 catalysts [J]. ChemistryOpen, 2019, 8(8): 1143-1150. doi: 10.1002/open.201900080 [44] LAI C J, HE T Q, LI X W, et al. Catalytic wet air oxidation of phenols over porous plate Cu-based catalysts [J]. Applied Clay Science, 2019, 181: 105253. doi: 10.1016/j.clay.2019.105253 [45] XIE H M, ZENG J, ZHOU G L. CeCu composite oxide for chlorophenol effective removal by heterogeneous catalytic wet peroxide oxidation [J]. Environmental Science and Pollution Research International, 2020, 27(1): 846-860. doi: 10.1007/s11356-019-07042-5 [46] WU Y J, ZHANG H P, YAN Y. Effect of copper ion-exchange on catalytic wet peroxide oxidation of phenol over ZSM-5 membrane [J]. Journal of Environmental Management, 2020, 270: 110907. doi: 10.1016/j.jenvman.2020.110907 [47] FU T, GONG X B, GUO J R, et al. Zn-CNTs-Cu catalytic in situ generation of H2O2 for efficient catalytic wet peroxide oxidation of high-concentration 4-chlorophenol [J]. Journal of Hazardous Materials, 2021, 401: 123392. doi: 10.1016/j.jhazmat.2020.123392 [48] ASSILA O, ZOUHEIR M, TANJI K, et al. Copper nickel co-impregnation of Moroccan yellow clay as promising catalysts for the catalytic wet peroxide oxidation of caffeine [J]. Heliyon, 2021, 7(1): e06069. doi: 10.1016/j.heliyon.2021.e06069 [49] 白金, 丁力, 刘鑫尧, 等. 原位合成CuO/ZnO-Al2O3水滑石衍生催化剂催化湿式空气氧化苯酚 [J]. 环境科学学报, 2018, 38(6): 2360-2366. BAI J, DING L, LIU X Y, et al. In-situ systhesis of CuO/ZnO-Al2O3 catalysts derived from hydrotalcite precursor for catalytic wet air oxidation of phenolic [J]. Acta Scientiae Circumstantiae, 2018, 38(6): 2360-2366(in Chinese).
[50] 杨韶平. 湿式氧化催化剂的研制及其在糖蜜酒精废水处理中的应用[D]. 桂林: 广西师范大学, 2005. YANG S P. Study on catalyst of catalytic wet air oxidation and on the treatment of molasses alcohol wastewater[D]. Guilin: Guangxi Normal University, 2005(in Chinese).
[51] 许银. Mo-Zn-Al-O催化剂研制和和湿式氧化处理染料废水[D]. 北京: 北京林业大学, 2012. XU Y. Preparation of Mo-Zn-Al-O catalyst and wet air oxidation of dye wasterwater[D]. Beijing: Beijing Forestry University, 2012(in Chinese).
[52] SANABRIA N R, PERALTA Y M, MONTAÑEZ M K, et al. Catalytic oxidation with Al–Ce–Fe–PILC as a post-treatment system for coffee wet processing wastewater [J]. Water Science and Technology, 2012, 66(8): 1663-1668. doi: 10.2166/wst.2012.410 [53] BALCI S. Structural property improvements of bentonite with sulfuric acid activation and a test in catalytic wet peroxide oxidation of phenol [J]. International Journal of Chemical Reactor Engineering, 2019, 17(6): 167. [54] ZHANG Z, JIANG Y, ZHANG K, et al. DMAO-activated rare-earth metal catalysts for styrene and its derivative polymerization [J]. Chinese Journal of Polymer Science, 2021, 39(9): 1185-1190. doi: 10.1007/s10118-021-2583-2 [55] PALAS B, ERSÖZ G, ATALAY S. Catalytic wet air oxidation of Reactive Black 5 in the presence of LaNiO3 perovskite catalyst as a green process for azo dye removal [J]. Chemosphere, 2018, 209: 823-830. doi: 10.1016/j.chemosphere.2018.06.151 [56] JING Q, LI H. Hierarchical nickel cobalt oxide spinel microspheres catalyze mineralization of humic substances during wet air oxidation at atmospheric pressure [J]. Applied Catalysis B:Environmental, 2019, 256: 117858. doi: 10.1016/j.apcatb.2019.117858 [57] BENSOUILAH R, HAMMEDI T, OUAKOUAK A, et al. Comparative study of the efficiency of different noble metals supported on zirconium oxide in the catalytic wet air oxidation of bisphenol-A solution [J]. Chemical Physics Letters, 2020, 761: 138022. doi: 10.1016/j.cplett.2020.138022 [58] BAO Y P, LEE W J, WANG P H, et al. A novel molybdenum-based nanocrystal decorated ceramic membrane for organics degradation via catalytic wet air oxidation (CWAO) at ambient conditions [J]. Catalysis Today, 2021, 364: 276-284. doi: 10.1016/j.cattod.2020.02.008 [59] SAMOILA P, COJOCARU C, MAHU E, et al. Boosting catalytic wet-peroxide-oxidation performances of cobalt ferrite by doping with lanthanides for organic pollutants degradation [J]. Journal of Environmental Chemical Engineering, 2021, 9(1): 104961. doi: 10.1016/j.jece.2020.104961 [60] CHEN H Y, SAYARI A, ADNOT A, et al. Composition-activity effects of Mn-Ce-O composites on phenol catalytic wet oxidation [J]. Applied Catalysis B:Environmental, 2001, 32(3): 195-204. doi: 10.1016/S0926-3373(01)00136-9 [61] LIU Y, SUN D Z. Effect of CeO2 doping on catalytic activity of Fe2O3/γ-Al2O3 catalyst for catalytic wet peroxide oxidation of azo dyes [J]. Journal of Hazardous Materials, 2007, 143(1/2): 448-454. [62] DAVIES D, GOLUNSKI S, JOHNSTON P, et al. Dominant effect of support wettability on the reaction pathway for catalytic wet air oxidation over Pt and Ru nanoparticle catalysts [J]. ACS Catalysis, 2018, 8(4): 2730-2734. doi: 10.1021/acscatal.7b04039 [63] ACERBI N, GOLUNSKI S, TSANG S C, et al. Promotion of ceria catalysts by precious metals: Changes in nature of the interaction under reducing and oxidizing conditions [J]. The Journal of Physical Chemistry C, 2012, 116(25): 13569-13583. doi: 10.1021/jp212233u [64] SICWETSHA S, ADENIYI O, MASHAZI P. Bimetallic gold and palladium nanoparticles supported on copper oxide nanorods for enhanced H2O2 catalytic reduction and sensing [J]. RSC Advances, 2021, 11(46): 28818-28828. doi: 10.1039/D1RA05247K [65] YAO Y J, CAI Y M, WU G D, et al. Sulfate radicals induced from peroxymonosulfate by cobalt manganese oxides (CoxMn3−xO4) for Fenton-Like reaction in water [J]. Journal of Hazardous Materials, 2015, 296: 128-137. doi: 10.1016/j.jhazmat.2015.04.014 [66] WU Q, HU X J, YUE P L. Kinetics study on heterogeneous catalytic wet air oxidation of phenol using copper/activated carbon catalyst [J]. International Journal of Chemical Reactor Engineering, 2005, 3(1): 1-13. [67] BARGE A S, VAIDYA P D. Wet air oxidation of cresylic spent caustic - A model compound study over graphene oxide (GO) and ruthenium/GO catalysts [J]. Journal of Environmental Management, 2018, 212: 479-489. doi: 10.1016/j.jenvman.2018.01.066 [68] DHAOUADI A, ADHOUM N. Heterogeneous catalytic wet peroxide oxidation of paraquat in the presence of modified activated carbon [J]. Applied Catalysis B:Environmental, 2010, 97(1/2): 227-235. [69] TARAN O, POLYANSKAYA E, OGORODNIKOVA O, et al. Influence of the morphology and the surface chemistry of carbons on their catalytic performances in the catalytic wet peroxide oxidation of organic contaminants [J]. Applied Catalysis A:General, 2010, 387(1/2): 55-66. [70] LÜCKING F, KÖSER H, JANK M, et al. Iron powder, graphite and activated carbon as catalysts for the oxidation of 4-chlorophenol with hydrogen peroxide in aqueous solution [J]. Water Research, 1998, 32(9): 2607-2614. doi: 10.1016/S0043-1354(98)00016-5 [71] MASSA P, DAFINOV A, CABELLO F M, et al. Catalytic wet peroxide oxidation of phenolic solutions over Fe2O3/CeO2 and WO3/CeO2 catalyst systems [J]. Catalysis Communications, 2008, 9(7): 1533-1538. doi: 10.1016/j.catcom.2007.12.025 [72] GARCIA-COSTA A L, SILVEIRA J E, ZAZO J A, et al. Graphite as catalyst for UV-A LED assisted catalytic wet peroxide oxidation of ibuprofen and diclofenac [J]. Chemical Engineering Journal Advances, 2021, 6: 100090. doi: 10.1016/j.ceja.2021.100090 [73] LIU F Y, ZHANG H P, YAN Y, et al. Graphene as efficient and robust catalysts for catalytic wet peroxide oxidation of phenol in a continuous fixed-bed reactor [J]. Science of the Total Environment, 2020, 701: 134772. doi: 10.1016/j.scitotenv.2019.134772 [74] TEWS I, GARCIA A, AYIANIA M, et al. Nitrogen-doped char as a catalyst for wet oxidation of phenol-contaminated water [J]. Biomass Conversion and Biorefinery, 2021: 1-15. [75] DOMÍNGUEZ C M, OCÓN P, QUINTANILLA A, et al. Highly efficient application of activated carbon as catalyst for wet peroxide oxidation [J]. Applied Catalysis B:Environmental, 2013, 140/141: 663-670. doi: 10.1016/j.apcatb.2013.04.068 [76] QUESADA-PEÑATE I, JULCOUR-LEBIGUE C, JÁUREGUI-HAZA U J, et al. Degradation of paracetamol by catalytic wet air oxidation and sequential adsorption - Catalytic wet air oxidation on activated carbons [J]. Journal of Hazardous Materials, 2012, 221/222: 131-138. doi: 10.1016/j.jhazmat.2012.04.021 [77] ZHANG S Y, HAN Y Z, WANG L, et al. Treatment of hypersaline industrial wastewater from salicylaldehyde production by heterogeneous catalytic wet peroxide oxidation on commercial activated carbon [J]. Chemical Engineering Journal, 2014, 252: 141-149. doi: 10.1016/j.cej.2014.04.084 [78] BACARDIT J, STÖTZNER J, CHAMARRO E, et al. Effect of salinity on the photo-Fenton process [J]. Industrial & Engineering Chemistry Research, 2007, 46(23): 7615-7619. [79] KAN E, HULING S G. Effects of temperature and acidic pre-treatment on Fenton-driven oxidation of MTBE-spent granular activated carbon [J]. Environmental Science & Technology, 2009, 43(5): 1493-1499. [80] YADAV A, TEJA A K, VERMA N. Removal of phenol from water by catalytic wet air oxidation using carbon bead - supported iron nanoparticle - containing carbon nanofibers in an especially configured reactor [J]. Journal of Environmental Chemical Engineering, 2016, 4(2): 1504-1513. doi: 10.1016/j.jece.2016.02.021 [81] GUPTA P, VERMA N. Evaluation of degradation and mineralization of glyphosate pollutant in wastewater using catalytic wet air oxidation over Fe-dispersed carbon nanofibrous beads [J]. Chemical Engineering Journal, 2021, 417: 128029. doi: 10.1016/j.cej.2020.128029 [82] CHENG X, GUO H G, ZHANG Y L, et al. Oxidation of 2, 4-dichlorophenol by non-radical mechanism using persulfate activated by Fe/S modified carbon nanotubes [J]. Journal of Colloid and Interface Science, 2016, 469: 277-286. doi: 10.1016/j.jcis.2016.01.067 [83] DU J K, BAO J G, FU X Y, et al. Mesoporous sulfur-modified iron oxide as an effective Fenton-like catalyst for degradation of bisphenol A [J]. Applied Catalysis B:Environmental, 2016, 184: 132-141. doi: 10.1016/j.apcatb.2015.11.015 [84] WANG C, YANG Q Q, LI Z H, et al. A novel carbon-coated Fe-C/N composite as a highly active heterogeneous catalyst for the degradation of Acid Red 73 by persulfate [J]. Separation and Purification Technology, 2019, 213: 447-455. doi: 10.1016/j.seppur.2018.12.072 [85] YANG G, MO S, XING B, et al. Effective degradation of phenol via catalytic wet peroxide oxidation over N, S, and Fe-tridoped activated carbon [J]. Environmental Pollution, 2020, 258: 113687. doi: 10.1016/j.envpol.2019.113687 [86] YOO J M, PARK B, KIM S J, et al. Catalytic degradation of phenols by recyclable CVD graphene films [J]. Nanoscale, 2018, 10(13): 5840-5844. doi: 10.1039/C8NR00045J -




 下载:
下载: