-
人工湿地(CWs)作为一种经济、高效且可持续的废水处理技术,常被用作生态安全缓冲区设立在污水处理厂与受纳水体间[1]. 在人工湿地中,湿地基质(即填料)、植物与微生物三者共同作用,影响着水质净化效果[2-3]. 基质作为构建人工湿地的主体,已被证实在这个“黑箱系统”中起着核心作用[4-5]. 不同的基质在实际废水处理中会显示出明显差异,进而影响人工湿地的运行性能[5]. 随着现代工业的迅速发展,越来越多的污染物被释放到水生环境. 人工湿地基质材料开发面临着许多新的要求与挑战. 然而,以天然产物(砾石、沸石等)和工业/农业副产物(钢渣、秸秆等)为代表的传统基质材料对抗生素等新污染物的去除存在一定局限性[6]. 学者们针对特定的需求,对基质吸附能力、过滤能力、孔隙结构与生物相容性等改性以增强处理功能,开发了一系列改性功能材料以实现更强的处理能力与更具针对性的应用效果[7-8]. 其中,铁碳微电解(IC-ME)基质凭借高效且经济的特点在人工湿地领域初露头角[9-10].
IC-ME基质通常由活性炭(AC)、生物碳(BC)等碳基材料与纳米零价铁(nZVI)、氧化铁(例如Fe2O3、Fe3O4和FeOOH和硫化亚铁)等铁基材料[11],通过热解、球磨、沉淀与热还原等方式复合改性而成[12]. IC-ME基质在结合了碳材料与铁基材料优点的同时,还具有原电池效应. 在IC-ME体系中,氧化还原电位为负的铁能与碳形成微原电池[13-14],产生Fe(Ⅱ)、H2O2和[H]等具有高反应性的产物,提高污染物的去除效率. 同时,铁碳之间形成的许多微电流电场[15],增强了吸附、还原、微生物降解等作用的发挥. 研究表明,铁碳微电解基质不仅能有效去除氮、磷、重金属等常规污染物,并能提升抗生素等新污染物的削减效果[16]. IC-ME基质在人工湿地废水修复中具有巨大的发展潜力.
迄今,国内外已有较多学者开发了不同类型的IC-ME材料,并有了一定的实际应用案例[17]. 目前关于IC-ME基质的综述主要围绕两个方面,一是从铁碳微电解材料制备角度出发,总结制备方法及其影响因素,二是总结了铁碳复合材料去除常规污染物的应用现状,评价其处理效果. 如段浩楠等[12]综述了生物炭/铁复合材料的制备及其在环境修复中的应用,Li等[18]和苏志敏等[19]综述了铁碳微电解材料的制备方法并简单介绍了铁碳微电解技术在不同领域中的应用现状. 然而,目前对人工湿地IC-ME基质的废水净化机理缺乏系统的归纳和总结. 同时,对铁碳微电解材料的生态安全性评价存在空白.
本文系统总结了铁碳微电解材料在人工湿地领域应用的最新进展,旨在:(1)阐明铁碳微电解基质在人工湿地中去除污染物的作用机制;(2)总结其对不同污染物的去除效果,并突出其对新污染物的去除研究;(3)对铁碳微电解基质的生态效应进行评价;(4)对未来的研究提出展望.
-
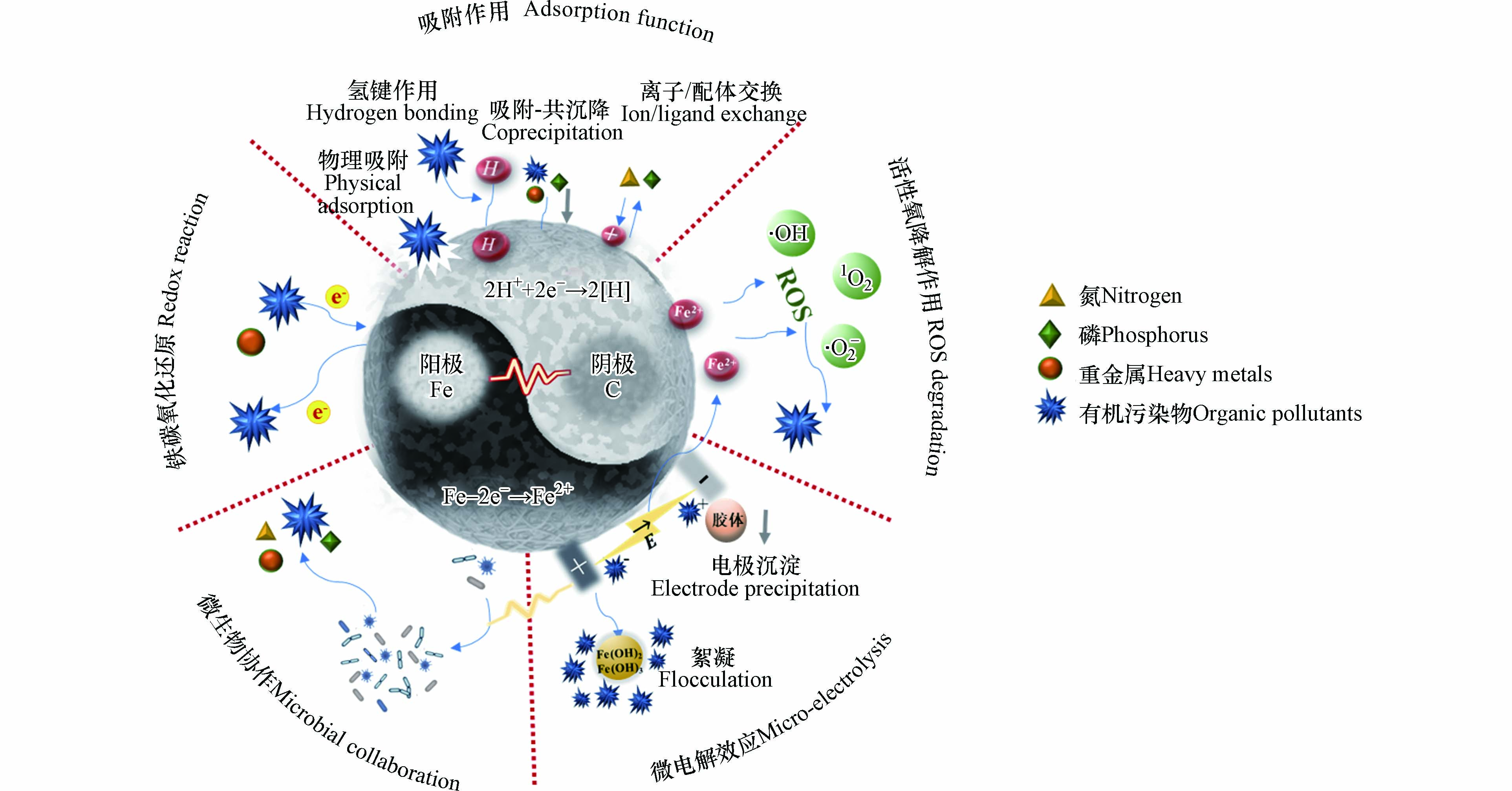
人工湿地IC-ME基质去除污染物的机理主要包括:吸附作用、铁碳氧化还原作用、活性氧降解作用、微电解作用和微生物协同作用,如图1所示.
-
吸附是人工湿地IC-ME基质去除污染物的一个重要过程,包括物理吸附、吸附-共沉降、氢键作用与离子交换作用,这些作用共同影响基质对污染物的处理效果.
物理吸附在IC-ME基质去除污染物前期起着重要作用,IC-ME丰富的孔隙结构显著增强了其对污染物的物理吸附作用,使得污染物快速从液相转移到液-固界面,再进行一系列复杂的化学吸附过程[20-22]. 另一方面,吸附-共沉降也是IC-ME基质去除污染物的一大重要机制. 铁作为高效的共沉淀前体物,可促进IC-ME基质结合目标污染物沉积在表面或形成稳定的化学沉淀. 例如对磷(P)的去除主要是依靠吸附-共沉降作用[23],IC-ME体系中的Fe3O4水解并与磷酸根离子反应形成FePO4·2H2O沉淀(式1). 同时,由于碳材料丰富的孔隙结构和能够附着大量的金属及金属氧化物的表面活性官能团,可与水溶液中的磷酸盐等污染物通过氢键(弱键)形成表面沉积或通过化学反应形成稳定无机沉淀,进一步强化吸附-共沉降效应[24-25]. 除此之外,IC-ME基质上的离子交换基团与水中污染物发生离子交换作用,也会影响基质吸附性能[26],从而影响氨氮、磷酸盐、重金属和农药等污染物的去除[27-28]. 然而,在实际废水中通常存在多种共存离子和有机污染物,可能会与目标污染物竞争IC-ME基质的吸附点位,导致脱附降低污染物去除率[27]. 因此对共存离子的研究具有重要意义,有助于研究者们根据实际水体环境优选IC-ME基质的设计参数与制备方法.
-
由于Fe与C自身具有的氧化还原特性,IC-ME基质可以与污染物直接发生氧化还原反应[29]. 与单一Fe0相比,IC-ME基质起到了电子转移介质的作用,使得氧化还原转化效率显著增强[30]. 铁碳氧化还原作用可将可溶性金属还原为不溶性金属后去除,或将其转化为毒性较低的价态,以实现人工湿地对污染物的无害化处理[18,31-32].
-
除了上述修复水溶液中污染物的机理外,活性氧降解作用也是一个非常关键的反应机理. IC-ME体系激活氧化剂产生的·OH、·O2-和1O2等活性氧[33],可有效降解多种有机污染物[34-35]. 主要机制为材料中的Fe被氧化为Fe3+,Fe3+被还原为Fe2+,最终生成·OH,将污染物氧化降解为小分子. 已有许多研究探索了IC-ME去除污染物时活性氧降解作用的贡献率[35-37],证实了活性氧降解作用是IC-ME基质降解难降解有机污染物的重要途径.
-
与传统基质不同,在IC-ME系统中,由于Fe与C同时存在,无需额外的能量源就可以形成大量的微原电池,并伴随着一系列物理和化学反应. Fe-C微电解系统的电子转移反应如方程(2—6)所示.
阳极:
阴极:
酸性有氧条件下:
碱性或中性有氧条件下:
在微电解过程中,碳与铁分别作为阴阳两级发生微电解反应,铁和碳之间的电位差有效促进了电子传递,显著促进了氧化还原反应[16,21,38]. 与此同时,微电解过程产生的[H]、Fe(Ⅱ)和H2O2等具有高反应性的电解产物易与大多数污染物发生二次反应,从而对污染物的去除有所贡献[18,30].
在IC-ME系统中,伴随电子转移同时发生的还有絮凝吸附和沉淀机制[39]. IC-ME基质中的Fe在好氧条件下通过氧化还原反应生成Fe(OH)2和Fe(OH)3等絮凝剂[18]. 同时,在铁碳微电解体系中,由于阴阳两级形成了微电场,废水中的带电粒子、胶体粒子以及部分粒径较小的污染物会向与之电荷相反的电极移动,附集在电极上进行沉淀,从而被去除[19].
-
除了以上的自身作用外,IC-ME基质还能对微生物群落产生影响从而达到对污染物的协同去除. 包括:(1)为微生物群落反硝化过程直接提供电子供体. (2)促进功能微生物群落丰度的提升与相关功能酶的增加.
反硝化被认为是人工湿地脱氮的主要过程,但该过程会受到缺乏电子供体的限制. 研究表明,人工湿地自养反硝化过程常依赖于无机物(例如Fe、S、H2)作为电子供体,而在异养反硝化过程中,反硝化菌需要额外的有机碳源为新陈代谢和反硝化提供营养和电子[40]. 而IC-ME基质中的Fe与C都可以作为电子供体并促进脱氮. 且当利用有机碳作为碳基时,不仅能为微生物提供更多的外部碳源以增强反硝化作用,且能为氨态氮提供特定的吸附作用[41].
除此之外,IC-ME基质使得人工湿地微生物对污染物的降解能力显著提升. Huang等[42]分别构建了Fe0-C填料(CW-Fe)和陶粒填料(CW-C)的人工湿地,高通量测序表明,Fe0-C填料CWs中拟杆菌属、厚壁菌门、绿藻和放线菌的微生物丰度显著高于陶粒填料湿地,且两种CWs微生物的种间相互作用关系存在显著差异. 同时,在铁碳填料湿地中氮循环相关关键酶丰度显著增加,硝酸盐向亚硝酸盐转化过程中硝酸盐还原酶(EC1.7.99.4)的相对丰度高达CW-C体系的两倍. 除此之外,IC-ME过程中的电子转移可以有效刺激微生物的生长和代谢酶的活性[17],进一步提高微生物的生物降解能力[10, 42-43].
由此可见,在环境应用中,IC-ME基质与各种污染物间存在着多种类型作用机理. 然而,由于不同污染物会对应不同的作用机制,需要通过更具针对性的实验研究来了解IC-ME基质对不同污染物的作用机理.
-
由于不同污染物去除的主要机制不同(表1),因此阐明IC-ME基质对不同污染物的作用机理,有利于在实际应用中针对目标污染物的特性对IC-ME基质进行改性开发. 例如还原作用是去除重金属的重要机制之一,而球磨法与水热碳化法相比,可提高铁碳的有效接触,强化了还原作用,显著促进对重金属的去除[44]. 研究者们可针对目标污染物的类型,优选制备工艺,强化主要作用机制的发挥.
-
人工湿地系统作为常见的深度处理技术,可有效净化水体中的常规污染物,碳微电解基质已被广泛应用于人工湿地对各种废水中N、P等常规污染物的深度去除,以保护受纳水体环境[52].
-
废水中普遍存在的氮会导致有害藻类大量繁殖和水体富营养化,是水生生态系统恶化的关键因素. 在人工湿地中,微生物通过硝化与反硝化作用,将N转化为N2或N2O达到去除的效果. 砂石等传统基质对N的吸附能力较低且极易解吸,并且能为微生物附着提供的点位不足[6]. IC-ME基质对N的高效去除.除了吸附作用,主要还是依赖微生物的协同作用. IC-ME基质复杂的孔隙结构为微生物提供了更多的附着空间,可有效改善以上不足,增强N的去除.
由于人工湿地长期淹水,硝化过程会受低溶解氧(DO)的影响,反硝化过程的硝酸盐还原也常受电子供体不足的限制[53]. IC-ME基质中的铁碳成分都可作为电子供体,微电解过程加速了大分子有机物向小分子有机物的转化,提供了可作为微生物反硝化的碳源[42]. 同时,铁碳微电解过程也刺激了微生物生长功能的发挥[43, 46],Ma等[54]构建了一种铁碳微电解人工湿地,与对照组相比,Fe-C基质湿地系统的总氮去除率提高了20%—30%. 其中,与硝化作用相关的变形菌门、拟杆菌门和蓝细菌门,与反硝化有关的放线菌丰度均显著高于对照组. 同时,相关功能酶活性和基因丰度显著提高. 硝化、反硝化和厌氧氨氧化都参与了人工湿地的脱氮途径,铁碳微电解使厌氧氨氧化细菌的关键酶肼脱氢酶(HDH)具有更高的活性,加速了厌氧氨氧化过程. 同时,铁碳微电解人工湿地中反硝化酶的活性与其相关的nirk、nirS、qnorB、nosZ功能基因丰度显著增加,这与Yin等[55]和Zhang等[56]关于电场可刺激酶活性的研究结果一致,铁碳微电解基质可刺激功能酶活性和基因丰度的提高,从而强化氮的脱除.
正因此,铁碳微电解基质可以应对较复杂的水质情况. Jia等[10]探索了不同C/N时铁碳微电解基质的脱氮效果. 他们利用盐酸活化竹制生物碳后负载FeCl3·6H2O制备了一种铁碳微电解基质(FeB),搭建了一种铁碳微电解基质(FeB -HSCW). 在不同水力停留时间(HRT)与N浓度的条件下,FeB-HSCW都表现出高效的脱氮效率. 这也是由于铁碳微电解基质显著增加了微生物氮脱除相关基因的丰度. 在FeB-HSCW中,微生物16SrRNA和基因amxA、nirS、nirK、nosZ-Ⅰ、nosZ-Ⅱ和hzsA的拷贝数比其他两种对照湿地高1.3—27.8倍. 可见,铁碳微电解效应对低C/N比废水也有较好的处理效果,在人工湿地这个生态系统中具有广阔的前景. 未来可进一步研究低温条件下IC-ME基质与微生物脱氮的协同效果.
-
富营养化是当今最严重的水环境问题之一,而磷是造成水体富营养化的重要原因. 在人工湿地中,除磷能力主要取决于基质的物理化学性质[57],然而,当基质达到磷吸附饱和点时,去除效率会下降. 此外,传统基质对磷的去除效率非常有限,无法长时间保持除磷能力,而其他新型除磷材料成本较高[10]. 因此,如何提高效率与降低成本是人工湿地除磷基质开发研究的重点.
IC-ME基质与传统基质相比,不仅有优良的吸附能力,更能通过共沉淀机制与离子/配体交换实现高效除磷. IC-ME基质中的铁可与磷酸根结合形成共沉淀,同时微电解过程释放的Fe2+与Fe3+水解生成 Fe(OH)3胶体絮凝剂可以吸附沉淀含磷化合物,提高磷的去除效率[57]. 基于此原理,在一定范围内,随着IC-ME基质中Fe含量的增加,总磷去除率呈上升趋势. 表明通过调节铁碳配比可显著改变基质除磷能力.
目前,许多学者将废物资源化用于制备IC-ME基质用于人工湿地除磷以降低成本. Gao等[45]利用饮用水厂处理污泥与零价铁制备了一种IC-ME填料,可通过吸附共沉降与络合反应实现对P的高效去除. 此种材料所含的Ca、Al氧化物与配位水结合形成水合金属氧化物或氢氧化物,在其界面会生成大量羟基. 这些基团可以单独存在,也可以相互结合形成羟基化界面,并且磷酸基团可以与离子配体交换,导致磷从水环境中去除. 张博文等[58]使用FeSO4·7H2O和Fe(NO3)3·9H2O改性花生壳生物炭进行了对磷的吸附研究,得到的两种铁碳复合材料(FS-BC和FN-BC)在较宽的pH范围(3.0—10.0)内都能保持最大吸附容量,其结果证实了铁碳复合材料具有良好的pH适应性,应对复杂的水体环境时也具有较高的除磷性能.
-
据报道,IC-ME基质有助于去除包括Pb(Ⅱ)、Cd(Ⅱ)、Cr(Ⅵ)和Cu(Ⅱ)在内的多种重金属[47, 51]. IC-ME复合材料对重金属的去除机制主要包括材料自身的吸附作用和还原作用,以及材料与重金属降解菌的协同作用[59].
以一种典型的重金属Cr为例,Feng等[47]将木炭(BM)放入FeCl3与FeSO4溶液浸泡,干燥后利用热解法分别于300 ℃、600 ℃与900 ℃下制备了多组铁碳微电解基质FeCl3BM. 发现不同预处理铁剂与不同热解温度组合会显著影响基质中的Fe的价态与空间分布格局,从而影响Cr的还原. 900 ℃热解制备的FeCl3BM对Cr(Ⅵ)的去除率高达99.9%. 这说明未来研究者们可通过探究适宜的预处理方式与制备参数来获得经济高效的基质材料. 同时,XRD和XPS结果表明,IC-ME基质的丰富活性点位也促进了吸附作用的发挥.
此外,铁碳微电解基质可有效刺激微生物群落功能的发挥. Kang等[38]从IC-ME基质与微生物协作的角度研究了其降解重金属的机理. 他们以砾石/生物炭/磁铁矿(FeRB)为填料搭建了人工湿地,与对照组相比,铁碳微电解湿地对总Cr(49%)和Cr(Ⅵ)(65%)的有效去除率分别提高了37.7%和34%. 这是因为IC-ME基质本身不仅具有较高的还原性,它还刺激了脱硫弧菌、假单胞菌和地杆菌等Cr(Ⅵ)还原相关微生物丰度的增加. 在此过程中,Cr还原酶、Cr转化酶、负责电子穿梭合成和重金属生物去除的过氧化氢酶以及谷胱甘肽过氧化物酶的活性都明显增加,Cr还原功能基因(nemA和sdhA)和Cr转化功能基因(mtrC和chrA)的丰度也显著上调,这些因素共同促进了微生物群落对Cr(Ⅵ)的还原. 同时,功能微生物间的电子转移又加速了IC-ME基质和Cr污染物之间的电子交换,达到了协同去除的作用. 然而,考虑到环境水质的复杂性,应进一步考虑IC-ME基质介导的人工湿地处理实际废水时上述机制能否有效发挥作用,并验证该工艺在实际运行中的稳健性.
-
新污染物指的是具有新污染物指的是具有生物毒性、环境持久性、生物累积性等特征的有毒有害化学物质. 它们通常以微量浓度存在于环境中. 但由于其毒性,它们对生态系统和人类健康构成重大风险[60]. IC-ME基质可通过吸附、活性氧降解与微生物协同等作用实现对新污染物的深度处理.
-
抗生素是由微生物通过二次代谢自然合成或者从工业中人工合成的有机物质,由于其在水体被高频检出而引起广泛关注[61]. 随着水体中抗生素污染的日益严重,使用IC-ME材料修复人工湿地抗生素污染的研究逐渐增加.
IC-ME材料从水环境中去除抗生素的主要机制之一便是吸附作用[62-63]. 与传统基质相比,Shan等[41]利用铁粉、三氧化二铁(α-Fe2O3)和磁铁矿(Fe3O4)分别制备的3种IC-ME材料对抗生素都有显著的吸附效果,但它们间仍存在一定差异. 其中Fe3O4/生物炭复合材料对卡马西平(63 mg·g−1)和四环素(94 mg·g−1)的吸附能力最高. 这表明在制备IC-ME材料时,铁的存在形式显著影响吸附效果. 在未来可开展更多关于Fe赋存形式对吸附性能影响的研究,以开发更高效的抗生素特异性吸附材料.
除此之外,自由基降解作用也是IC-ME基质去除抗生素的一大机制. 具有羟基(—OH)给电子基团的抗生素(如四环素、环丙沙星)和具有酰胺基(—NH2)给电子基团的抗生素(如卡马西平)通常具有较低的电离能量,更倾向于被催化氧化[64]. Fe-C复合材料克服了单一的生物炭或碳纳米管材料自由基降解作用不显著的问题,以及单一铁基催化材料易聚集和钝化的缺点[34],通过自由基降解显著提高对抗生素的去除. Liu等[34]通过热还原法成功合成一种IC-ME材料(Fe3C@Fe0@BC)来处理四环素(TH)废水. 他们根据高效液相色谱-质谱(HPLC-MS)和密度泛函理论(DFT)分析,探索了TH的降解途径,主要是因·OH攻击了氯原子而发生羟基化反应. 自由基淬灭实验和电子顺磁共振波谱法分析表明,铁碳微电解反应中产生的·OH和·O2-等自由基对四环素的降解起着主要作用. 此种材料比单独使用nZVI或生物炭表现出了更高的TH去除能力、以及更好的稳定性与可回收利用性. 同时,大型溞实验也验证了其具有更好的生态效应. 这表明IC-ME材料是一种高效、有前途的绿色去除抗生素材料,具有良好的实际应用潜力. 该研究也为对Fe/C复合材料的生态效应评价做出了参考.
-
持久性有机污染物(POPs)具有高毒性,进入环境后难降解,可生物积累、易残留的特点[65]. 毒死蜱(CP)、阿特拉津等作为典型的持久性有机污染物,现已成为水体中检测率极高的污染物之一[51]. 砂石等传统基质的人工湿地对其去除效果十分有限[36],IC-ME材料已被证实具有消除水体中难降解持久性有机污染物的潜力.
Zhang等[51]以沸石为载体,将铁粉、秸秆生物炭按体积比2∶1以可溶性淀粉粘合,于高温热解造粒,制备了沸石基铁碳微电解(ZB-ICME)基质,用于人工湿地去除CP. 此基质与单一生物炭基质相比,对CP的去除率显著提高,可达99.55%. 通过SEM分析可见,反应后的ZB-ICME填料表面增加了一层氧化物覆盖层,这是由于铁碳微电解反应促进了氧化还原反应. 同时,与传统沸石填料相比,负载了铁碳微电解填料的湿地,其香农指数由8.17升至9.01,微生物群落多样性显著提高,这表明IC-ME基质可以促进微生物生长,有助于提高污染物去除效率. 基于以上结论,Tao等[66]将阿特拉津降解菌DNS32负载到了铁改性生物炭(FeMBC)上,发现该铁碳复合材料能有效增强降解菌的处理效果. 与未添加此种材料相比,阿特拉津最大去除速率由8.56 mg·L−1·h−1提升至9.71 mg·L−1·h−1. 通过TEM、XRD、XPS和FTIR分析发现,FeMBC丰富的孔隙结构为阿特拉津与DNS32降解菌提供了丰富的附着点位. 同时,FeMBC可促进细菌生物膜的形成,细菌胞外聚合物表面的亚氨基官能团(—NH)和FeMBC通过氢键与阿特拉津的芳香环相互作用,促进了微生物对阿特拉津的捕获与降解.
Zhang等[51]还探究了持久性有机污染物与其他污染物共存时IC-ME基质的性能. 结果表明,IC-ME基质对CP的降解和Cd的去除是相互促进的. CP降解过程中,溶液pH值升高,微电解过程生成的[H]和铁离子可以促进Cd和Fe离子生成CdxFe(1-x)(OH)2,通过吸附和共沉淀作用实现Cd的去除. 同时,由于提高了CP降解菌厚壁杆菌(firmicutes)等菌群的相对丰度[67],促进了CP降解. CP降解释放的碳源可与IC-ME基质一同提供电子,从而促进反硝化细菌的富集,可实现同步脱氮. 这证明了IC-ME填料是同步去除持久性有机污染物与其他常规污染物的理想材料,未来可加强IC-ME材料对多种污染物协同去除的研究,进行材料结构优化、功能菌负载等开发,以适应现实复杂的水质情况.
-
内分泌干扰物(EDCs)指环境中存在的能干扰人类或动物内分泌系统诸环节并导致异常效应的物质,包括天然雌激素(如雌酮,雌二醇,雌三醇),合成雌激素(如乙炔雌二醇)和农药(如百菌清,硫丹)等. 这类污染物容易受到活性氧的攻击,发生羟基化、脱羧等反应而被快速降解[68]. IC-ME基质去除EDCs主要通过吸附、氧化还原与活性氧降解作用实现,铁碳微电解促进了活性氧的产生,从而加速吸附的污染物的非生物降解作用[69].
以α-硫丹、β-硫丹,溴氰菊酯等为代表的农药类EDCs在水环境中常有检出,而它们构造稳定,被生物吸收后不易为体内酶降解,在人工湿地领域被广泛关注. 田开放等[70]以高岭土为骨架胶结体,利用铁碳与碳粉高温焙烧成一种铁碳填料,以强化人工湿地对以上几种混合农药的去除. 研究者深入探究了铁碳填料对混合农药废水的去除机理,发现铁碳填料对混合农药的吸附效果有限. 但由于铁碳微电解形成的原电池效应,产生了具有强烈的化学活性的反应产物,即使吸附饱和后,仍可继续去除污染物. 铁碳微电解耦合人工湿地系统对百菌清、α-硫丹、β-硫丹,溴氰菊酯的去除率分别比传统人工湿地系统高9.38%、6.32%、8.77%、11.88%,并且促进了湿地植物对污染物的吸收. 铁碳微电解基质实现了CWs对农药类EDCs高效稳定的处理,抗冲击能力更强,系统的恢复性更好.
双酚A(BPA)是一种典型的环境内分泌干扰物,因其会紊乱人体新陈代谢与生殖机能而引起广泛关注. Gan等[50]通过高温热解负载Fe2O3制备了一种新型Fe3C-多孔碳复合材料 (Fe3C-C),该复合材料具有优异的吸附性能与自由基降解效应,可高效去除BPA,在1000 ℃下获得的Fe3C-C1000表现出最佳的降解能力,0.1 mmol·L−1 BPA在被基质吸附富集后,可在10 min内完全去除. 通过自由基淬灭实验、电子自旋共振分析、电化学分析,结合中间产物鉴定,分析了BPA的降解途径. 结果表明,Fe3C-C1000中的多孔碳成分不仅能为BPA的富集贡献高空隙率,并能防止Fe3C聚集,有效提高了Fe的利用率. 同时,此材料发挥了Fe3C与多孔碳的协同效应. C1000骨架内的含氧官能团可以通过非自由基途径产生1O2并转移电子. 结合以Fe3C成分主导的自由基降解途径实现对BPA的快速降解. 此种IC-ME体系即使在高浓度BPA负荷下也有出色的表现,具有广泛的pH应用范围(2.45—11.13)和长期稳定性,为去除高浓度EDCs的基质设计开发提供了新思路. Li等[71]将通过热解还原法利用零价铁与改性棉制备了一种Fe0/石墨化碳(Fe-TC)复合材料,也证明了Fe-C复合材料在降解双酚A等难降解有毒有机物的高效性与稳定性. 目前未见人工湿地IC-ME基质对雌二醇等天然雌激素的研究,在未来可结合内分泌效应变化对其进行处理效果的探索.
总而言之,与传统基质相比,IC-ME基质对各种污染物都有显著的处理效果(表2). 对IC-CWs中的常规污染物而言,它能有效弥补脱氮过程反硝化不足的问题,并促进了基质对磷吸附-共沉降等基质的发挥,为重金属提供了更多的吸附点位增强其去除. 对于传统填料无法有效去除的新污染物,IC-ME基质有良好的去除效果,铁碳微电解过程促进的自由基降解作用是其去除难降解污染物的最重要途径之一. 其对高浓度负荷、高pH波动范围等复杂的水体条件有着良好的适应性,可为人工湿地的稳定运行提供重要保障. 除了基质自身固有属性的发挥,微生物对污染物降解潜力巨大,铁碳微电流显著增强了微生物群落功能,未来可加强功能性微生物负载铁碳微电解材料的开发.
-
人工湿地作为一种用于水污染处理的近自然系统生态工程,通过湿地生态系统中物理、化学、生物等协同作用提升水的生态品质,不宜采用投加药剂等措施处理污染. 又因其近自然的特殊性质,对基质应用的生态安全性提出了较高的要求[72]. 目前,学者们对IC-ME基质的生态效应也已开展了一些研究. 主要集中在对植物生长和温室气体排放的影响.
-
植物作为人工湿地的重要组成部分,是考察湿地基质生态安全性的重要一环. 基质对植物生长的影响主要体现在植物长度、重量和抗氧化酶活性上[41, 43]. 与单一生物炭基质湿地相比,单一铁基质湿地(CWFe)抑制了植物的生长,植物株高下降29.5% ± 0.5%,干重下降64.9% ± 3.2% [29]. 这是由于引起了直接添加Fe引起了植物的氧化应激反应,由于当植物处于应激状态时,·O2-等自由基会引起质膜过氧化,破坏植物细胞的正常生理功能. 这时,植物的保护酶(主要是超氧化物歧化酶SOD)系统会开始去除·O2-,来降低植物的损伤程度[73]. 因此,可以通过植物叶片中不同抗氧化酶的活性来衡量植物的氧化应激反应. 在铁碳微电解体系中,酶活性显著上升,在保障去除污染物效果的同时,有效缓解了Fe诱导的植物氧化应激反应. 同时,铁碳微电解过程增加了植物根部附近的生物有效Fe2+含量,增加了叶绿素含量,最终促进了植物的生长.
此外,一些研究发现[52],如以生物炭作为IC-ME基质的碳基时,可以减轻重金属对植物的生物胁迫,并减轻其在植物体内的积累,这是因为生物炭的强结合能力降低了金属的生物利用度[74],削减了金属的植物毒性并促进了植物的生长. 同时,人工湿地采用铁改性生物炭基质可以减少湿地植物对毒死蜱、DDT等杀虫剂的吸收[75],这也一定程度上提高了湿地植物作为副产品在食物链中传递时的生态安全性. 由此可见,IC-ME基质不仅可以高效降解污染物,还可以有效减缓污染物对植物损伤.
-
随着湿地面积在全球范围内的扩大,来自湿地系统的温室气体排放引起了越来越多的关注,据估计,来自湿地的CH4和N2O排放量约占其全球总排放量的20%[76]. 其中,人工湿地释放的温室气体通量是天然湿地的2—10倍[77-79]. 在各种温室气体中,CH4和N2O的全球变暖潜能值(GWP)分别为等量CO2的28倍和265倍[52],因而需要特别关注. 多项研究证明,选择合适的基质可以调节人工湿地的GWP[80-81].
在铁碳微电解人工湿地中,尽管由于COD处理效率提高,CO2排放量有所增加. 但GWP更高的CH4和N2O显著减少,人工湿地温室气体排放总量有效减少. Kong等[78]利用生物炭促进了nZVI的硫化,制备了一种S-nZVI/BC材料,研究了其对人工湿地3种温室气体CO2、CH4和N2O排放的影响,证明了上述结论. 在NO3-N去除率达100%的基础上,反硝化功能基因(narG、nirk、nirS和nosZ)显著提高,N2O排放通量降低了24.17%—36.63%. 此外,IC-ME基质可以为产甲烷菌提供电子受体,并使得甲烷氧化菌(pmoA)和产甲烷菌(mcrA)基因丰度随着S-nZVI/BC的添加显著提高,减少了CH 4排放. Zhao等[82]则深入探究了IC-ME基质与其他基质组合应用时的温室效应. 他们将铁碳微电解基质与沸石组合构建了人工湿地,由于化学和生物过程的共同作用,Fe-C基质显著降低了湿地N2O排放,并通过限制CH4的产生和促进CH4的氧化来减少CH4的排放. 同时沸石基底对CH4的吸附和储存进一步减少其排放. 铁碳微电解基质与沸石填料联合使用时的较佳效果也为铁碳微电解人工湿地的工艺设计提供了新思路.
由此可见,IC-ME材料可作为缓解温室气体产生的有效基质,它可通过电子传递提高反应效率与调节微生物菌群实现对典型温室气体CH4与N2O的调控[83]. 未来可进一步研究铁碳微电解基质促进人工湿地减少温室气体排放的机制,并评估其应用在大规模人工湿地时的生态效益.
-
本文全面综述了铁碳微电解材料在人工湿地中去除污染物的作用机理,对其在常规污染物与各种新污染物去除中的研究现状进行了总结,并深入考察了其生态效应影响,证明了IC-ME基质是一种高效、环保、可持续的环境功能材料,可用于解决多种环境污染问题. 与传统基质相比,IC-ME基质具有作为吸附材料、还原剂和催化剂的多重作用,可以显著提高人工湿地对常规污染物与新污染物的去除效率,Fe-C相互促进产生的微电解等作用更是促进了人工湿地微生物群落功能的发挥. 同时,它可以改善湿地植物生长并减轻人工湿地的温室效应,为未来人工湿地应用领域的拓展提供了更多的可能性. 然而,尽管国内外对人工湿地IC-ME基质去除污染物的研究很多,但目前的研究仍存在一些空白需要填补:
(1)目前关于IC-ME基质的研究大多数局限于实验室规模,水样多为模拟废水,且模拟装置运行时间较短. 因此,有必要进行对人工湿地装置处理实际废水的长期观测,以为未来进行大尺度、长时间的实地应用研究奠定基础.
(2)在制备IC-ME材料作为人工湿地基质时,应考虑实地净水效果与生产能耗,综合考虑铁碳比、制备方法、投加量及原材料种类等因素,以探索环境效益与经济效益的平衡.
(3)目前关于IC-ME基质的研究多关注的是其对污染物去除效果,关于污染物降解机理的研究多停留在微生物群落演替的分析. 铁碳微电解促进污染物降解的活性物质、污染物的降解中间体及其可能的降解途径仍有待进一步探索.
(4)IC-ME基质与人工湿地功能微生物具有良好的协同效果,在未来可进行IC-ME基质负载功能菌的研究,以期强化人工湿地生态系统整体功能的发挥.
铁碳微电解基质在人工湿地中的作用机理及研究现状
Iron-carbon micro-electrolysis substrate for constructed wetland: Interaction mechanisms, performance and Ecological effects
-
摘要: 人工湿地是污水生态处理的有效手段之一,湿地基质作为人工湿地的主要成分,显著影响其处理效果. 随着社会经济的发展,越来越多的污染物被排放至水体中. 而传统基质对抗生素等新污染物的去除存在一定局限性,铁碳微电解基质可有效弥补其不足. 本文全面综述了铁碳微电解材料在人工湿地中去除污染物的作用机理,总结了其对常规污染物与新污染物去除的研究现状. 此外,本文还考察了铁碳微电解基质的生态效应,并对该领域未来的研究提出展望,以期为未来开展相关研究工作与工程应用提供一定的理论指导.Abstract: Constructed wetlands (CWs) are widely recognized as one of the cost-effective eco-technologies for wastewater treatment. As a critical component in CWs, the substrate significantly influences the performance of CWs. Nowadays, rapid industrialization is producing a lot of emerging pollutants in water, which cannot be ignored. Traditional substrates struggle to handle emerging pollutants such as antibiotics. Iron-carbon micro-electrolysis (IC-ME) substrate can effectively make up for the deficiency. In this paper, the mechanism of IC-ME substrate for pollutant removal in constructed wetlands is comprehensively reviewed, and the research status of the removal of conventional pollutants and emerging pollutants is summarized. In addition, the ecological effects of IC-ME substrate are investigated. The future research in this field was prospected, aiming to provide a reference for further scientific research and engineering applications.
-
地热资源作为一种集水、矿和热为一体的清洁能源,还兼具医疗和旅游价值,是极具开发潜力的一种新型能源. 在经过补给后进入深部的地热水其赋存环境、运移规律和反应过程相当复杂,同时受到热力、水力以及化学等多种因素的影响;地热水复杂的形成过程也导致了难以对地热系统进行全面系统的了解,而开展地热系统成因模式、水岩相互作用过程研究对推进地热系统的了解有极大帮助[1]. 海南岛的地热资源呈现出以中低温为主、出露点多、储量大的特点,开发利用潜力巨大,具有代表性的琼海官新地热田、儋州兰洋温泉、保亭七仙岭温泉都得到了不同程度的开发利用. 随着地热资源的大面积开发,地热水高氟的特点而导致的氟污染问题受到越来越多的关注[2].
氟作为自然界中常见的元素,主要来源于深部地壳和地幔,以吸附态氟离子、固体氟化物以及氟矿石颗粒等赋存形态广泛分布于岩石圈、水圈、土壤圈中[3]. 氟是人体生长发育过程中必不可少的微量元素,在人体微量元素含量的第三位,摄入适量的氟能够预防龋齿和骨质疏松,但是人体对氟的最佳摄入量的范围十分小[4]. 当氟浓度的摄入量过大时,会导致矿化过度或异位矿化的病理现象,即地方性氟中毒. 地方性氟中毒广泛分布于中国各个地区,患病人数超过1亿,为降低患病人数国家政府投入了大量的人力物力,但效果并不是很理想. 过量的氟对土壤中各类微生物和植物的生长会造成一定程度的危害,同时也会造成人体肾上腺素功能紊乱[5].
地下热水的含氟量通常高于同地区的地表水和地下水,含量通常介于3—10 mg·L−1,远高于中国饮用水标准中规定的1 mg·L−1. 在地热资源当前大规模应用的情况下,高氟含量尾水的排放对于水、土壤环境中氟含量的影响将成为一个不容忽视的问题. 20世纪以来,有关于水环境中氟的研究日益增多,吕晓立[6]对新疆塔城盆地的含氟地下水的分布特征和富集规律进行了分析,李成城[7]总结了运城盆地的高氟地下水的成因机制,但地下热水中氟的研究却比较少. 琼北地区温泉出露点多,地热水中氟含量高,在开发过程中对环境的潜在威胁大. 针对这一问题,本文通过对琼北地区的地质资料、水化学数据、同位素数据进行分析,探究地热水的富集规律和分布特征. 探究内容可以为研究区防治地热水污染提供参考,同时对地热资源合理开发具有重要的指导意义.
1. 材料与方法(Materials and Methods)
1.1 研究区域
如图1(a)所示,研究区位于中国海南岛的中北部,四面环海,与雷州半岛相隔琼州海峡,是中国第二大海岛. 地理位置坐标为东经109°23′31″—110°41′17″,北纬19°6′48″—20°03′52″,包括琼海市、屯昌县、儋州市、昌江黎族自治县、澄迈县、琼中黎族苗族自治县、海口市和文昌市. 研究区地处热带,属于热带季风性气候,夏季长冬季短,平均气温约为25℃. 海南岛降雨充足,雨季一般分布于5—10月,降水量约占全年的80%. 整个海南岛地势呈现出中部高、四周低平的特点,地势以中部五指山、七仙岭为代表的高点向海岛四周逐渐降低. 地表水含量丰富,水库、河流和湖泊众多,其中河流大多起源于中部山区或者丘陵区,呈放射状分流入海. 琼北地区地下水大多分布于厚度大、岩性稳定的第三系海相碎屑砂、砂砾层,地下水类型丰富,含水层厚度约为30—100 m,距离顶板埋深一般大于100 m[8].
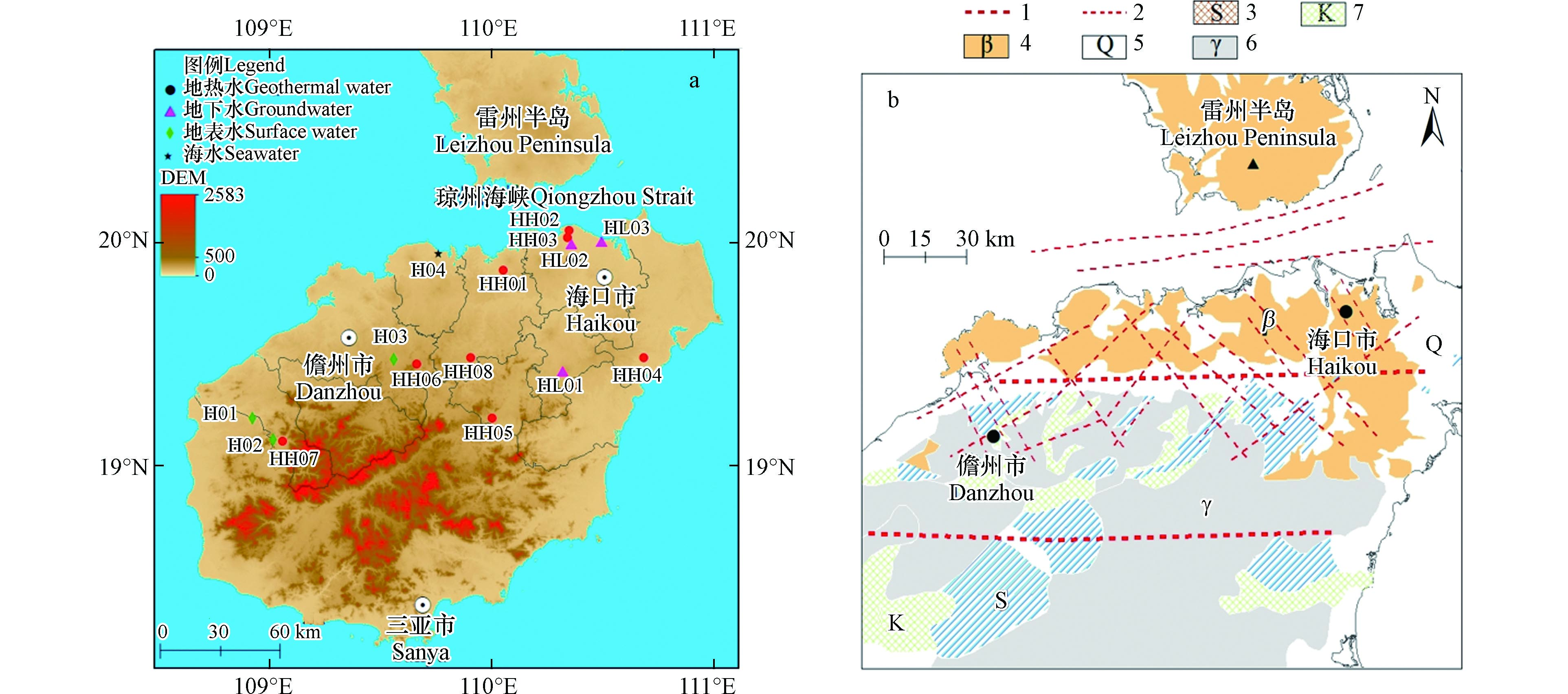 图 1 研究区采样分布图(a),地质构造图(b)Figure 1. Sampling distribution map of the study area (a), Geological structure map (b)1-大断裂,2-小断裂,S-志留系,Q-第四系砂土、粘土,γ-中生代花岗岩,K-白垩系石英碎屑岩,β-新生代玄武岩1-large fault, 2-small fault, S-Silurian, Q-quaternary sand, clay, γ-Mesozoic granite, K-Cretaceous quartz clastic rock, β-Cenozoic basalt
图 1 研究区采样分布图(a),地质构造图(b)Figure 1. Sampling distribution map of the study area (a), Geological structure map (b)1-大断裂,2-小断裂,S-志留系,Q-第四系砂土、粘土,γ-中生代花岗岩,K-白垩系石英碎屑岩,β-新生代玄武岩1-large fault, 2-small fault, S-Silurian, Q-quaternary sand, clay, γ-Mesozoic granite, K-Cretaceous quartz clastic rock, β-Cenozoic basalt琼北地区是指海南岛中北部昌江-琼海大断裂以北的陆域部分,从大地构造上分析属于雷琼凹陷. 自新生代以来区内出现了强烈、频繁的火山活动,北部地区地表覆盖有相当厚度的新生代玄武岩[8]. 图1(b)中表明,研究区中部广泛出露花岗岩,其中以中生代为主,基底为元古代的变质火山岩系,花岗岩良好的透水性特点更有利于地下水补给和出露. 沿海地带主要发育第四系的砂岩、粘土和亚砂土,呈带状环岛分布,泥盆系、三叠系碎屑岩广泛分布于儋州市、琼海市境内.
区域内构造发育良好,基本可以将断裂分为近东西向、南北向、北东向和北西向四组,近东西向类断裂规模最大、数量最多,以区内的昌江-琼海大断裂和王五-文教大断裂为代表[9]. 王五-文教大断裂地理坐标约为19°45′,全长达到210 km,横跨临高县、澄迈县、儋州市、海口市等地,沿该断裂带热泉大量出露. 昌江-琼海大断裂约位于19°15′,沿着断裂分布着大量的山脉与河流,横跨昌江、白沙、东方等地,全长达90 km. 在研究区内北部各向断裂相互交叉,产生汇水汇热效应更有利于热水出露于地表[10].
1.2 样品的采集与测试
为了探究琼北地区地热水中氟的富集规律,在2019年7月前往海南岛进行实地勘探和地热水、河水和地下水等的采集. 采样点的具体分布见图1(a),总共采集15个水样,其中海水由于测试仪器无法承受高浓度的氯离子,因此将其稀释10倍. 样品的采集均采用50 mL的聚乙烯瓶,采样前用目标水样清洗3次再进行采样. 采样过程中利用0.45 μm的醋酸纤维脂膜与注射器过滤水样,过滤后的水样为了防止其产生变化,用注射器装满水样品,防止产生气泡. 阳离子和微量元素的样品,加入浓硫酸酸化至pH<2对其进行保护. 在现场使用精度为0.1℃的温度计测量温度,使用德国WTW Multi 3400i多参数水质分析仪器测定其pH值、TDS.
采集样品的测试工作于2019年9月在国土资源部岩溶地质资源检测中心进行. 阴阳离子的测试工作于26℃、湿度69%的条件下采用Seven Multi pH/电导率/离子综合测试仪、883 离子色谱仪、FP6410 火焰分光光度计和Thermo iCE 3500 原子吸收光谱仪等仪器进行;δ2H、δ18O同位素的测试工作则于24.2℃、湿度48.9的环境下采用MAT253型稳定同位素质谱仪进行.
2. 结果与讨论 (Results and discussion)
2.1 地热水水环境特征
琼北地区所采集的样品的水化学组分如表1所示,地热水pH含量变化范围为7.59—9.07,平均值为8.31,呈弱碱性;温度变化范围为35.1—83.5℃,依据《地热资源地质勘探规范》(GB/T1615-2010)的分类属于典型的中低温型热水. TDS的波动范围较大,均值为962.25 mg·L−1,最高值HH04兰洋温泉可达到3096.00 mg·L−1. 主要阳离子Na+、Ca2+变化范围分别为110.50—960.00 mg·L−1和2.39—293.42 mg·L−1,主要阴离子为Cl-和HCO3-, 平均值分别为376.31 mg·L−1和472.04 mg·L−1. 地下水和地表水的水化学组分极为相似,pH值为6.85—7.85,呈中性且波动范围小,温度平均值为27.11℃. TDS除HL03样品外均值为403.80 mg·L−1,明显小于地热水的TDS;这可能是由于地热水在高温下经历了更长时间的循环过程,导致出露的热泉水含有更多的溶解性物质[11]. HL03位于琼州市境内,地层中含有的盐岩层,使得地热水在循环过程中有更高的TDS含量[12]. 相对于地热水的主要离子,地下水和地表水的离子含量显著更小,Na+和Ca2+含量平均值分别为6.90 mg·L−1和10.06 mg·L−1,Cl-和HCO3-含量变化范围为2.99—12.97 mg·L−1和32.74—102.77 mg·L−1.
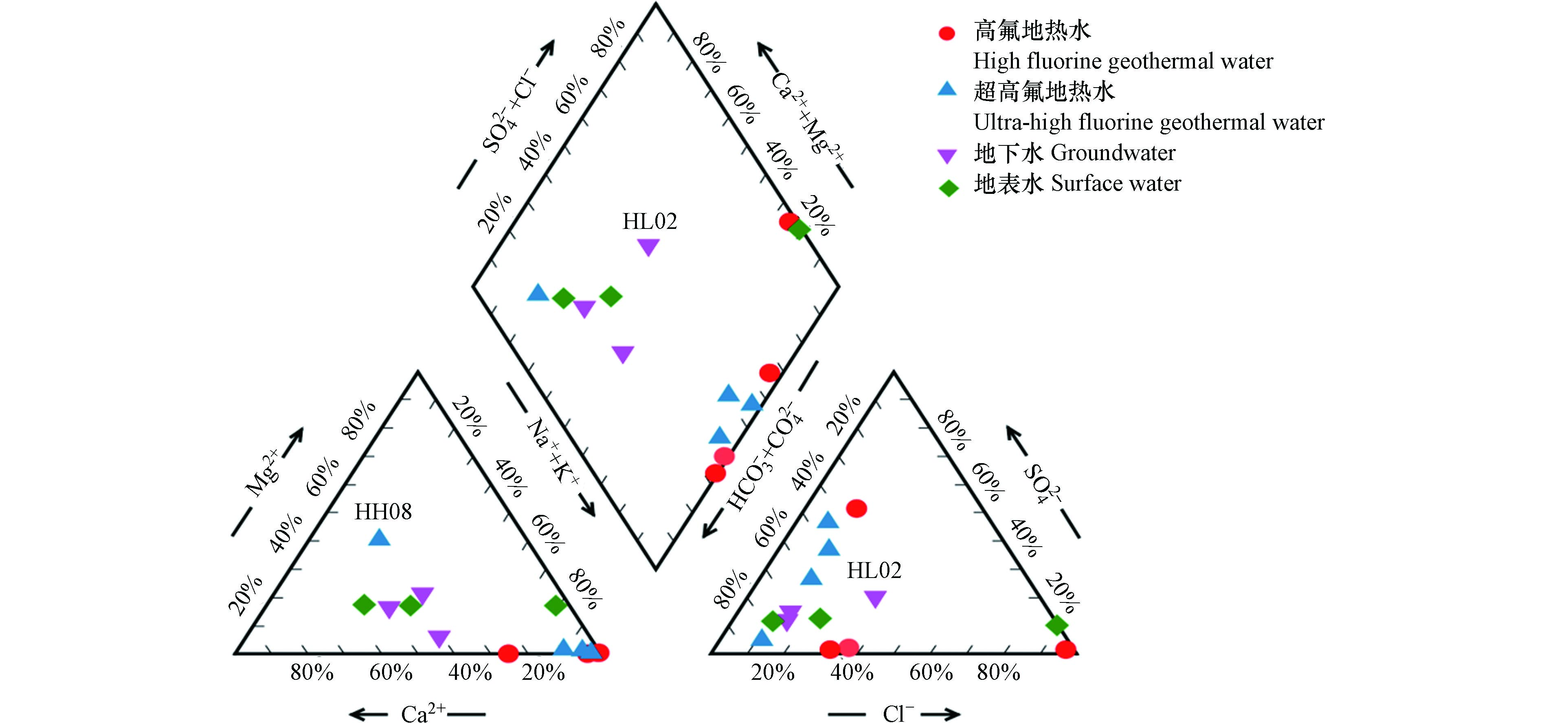
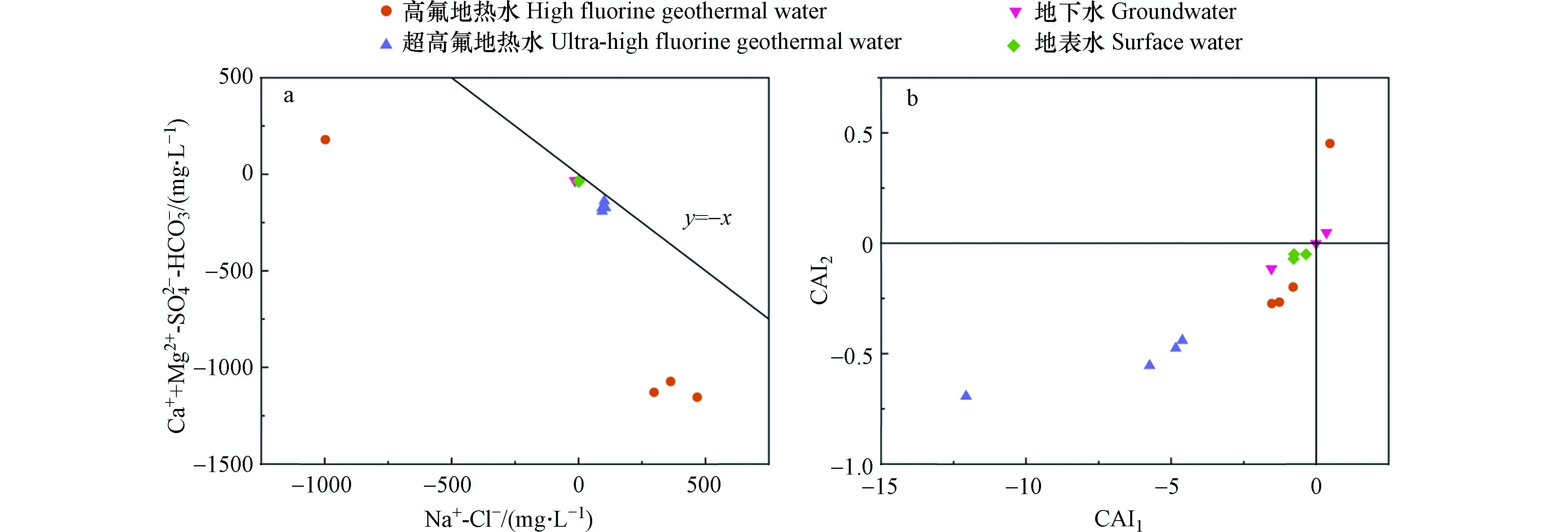
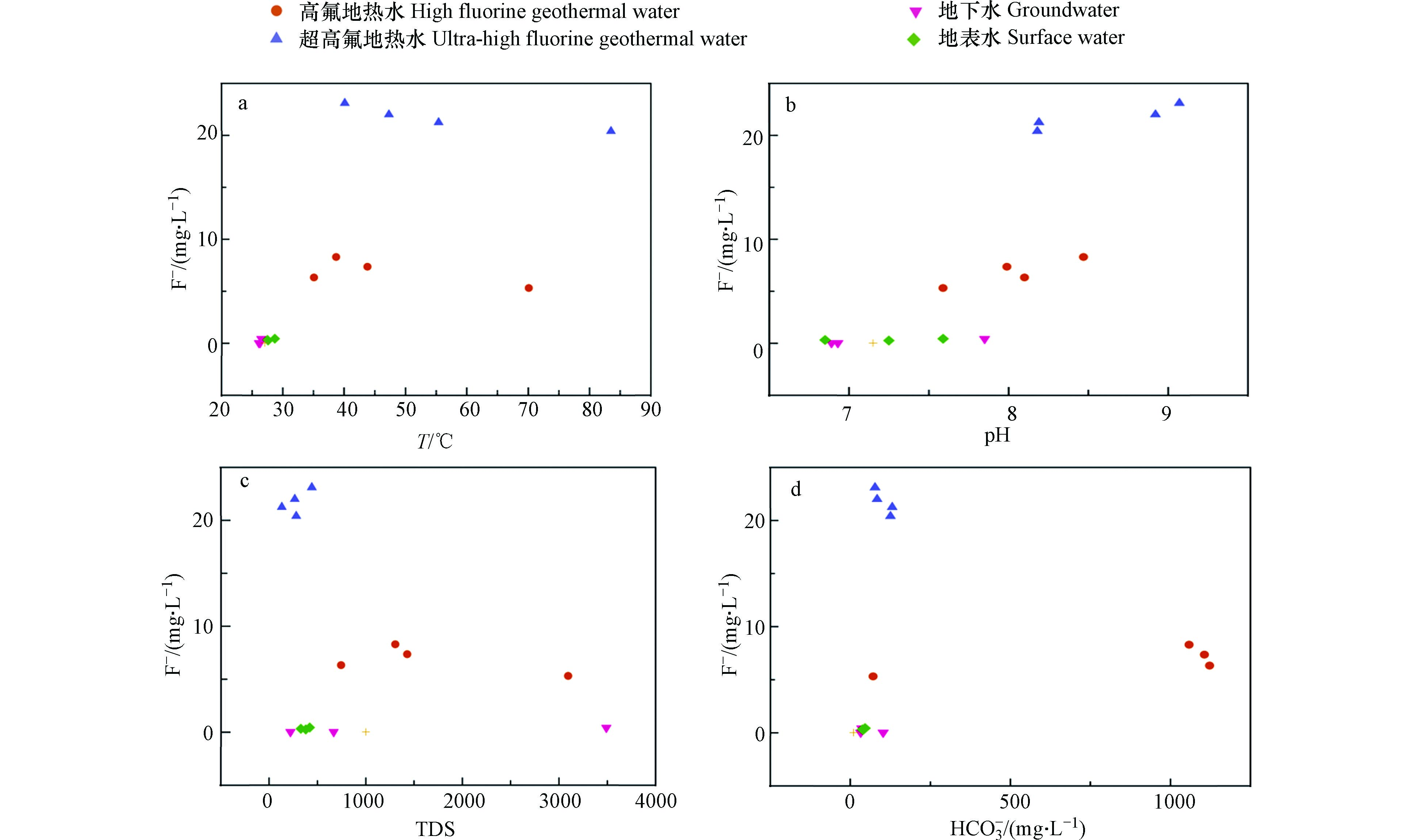
表 1 研究区水样水化学组分特征Table 1. Water chemical composition characteristics of water samples in the study area采样点Sample 类型Type pH T/℃ TDS/(mg·L−1) K+/(mg·L−1) Na+/(mg·L−1) Ca2+/(mg·L−1) Mg2+/(mg·L−1) Cl−/(mg·L−1) SO42−/(mg·L−1) HCO3−/(mg·L−1) F−/(mg·L−1) δ2H/‰ δ18O/‰ HH01 高氟地热水 8.10 35.1 746 5.1 778.1 4.8 1.5 310.3 38.6 1122.3 6.32 −49.4 −6.53 HH02 高氟地热水 7.99 43.8 1430 6.0 681.3 4.2 2.2 383.4 30.1 1106.0 7.36 −43.6 −6.48 HH03 高氟地热水 8.47 38.7 1306 4.9 653.8 3.0 1.1 290.6 19.2 1058.7 8.29 −42.7 −6.37 HH04 高氟地热水 7.59 70.1 3096 63.3 960.0 293.4 0.1 1957.3 42.6 71.9 5.30 −46.9 −6.18 HH05 超高氟地热水 8.92 47.3 266 3.1 125.5 4.2 0.1 19.1 94.5 83.7 22.00 −52.8 −7.38 HH06 超高氟地热水 8.18 83.5 281 5.8 114.8 10.8 1.1 21.5 78.0 125.5 20.40 −54.8 −6.98 HH07 超高氟地热水 9.07 40.1 442 2.6 110.5 2.4 0.4 8.7 63.6 77.3 23.10 −65.5 −8.92 HH08 超高氟地热水 8.19 55.4 131 3.0 112.0 4.8 0.7 19.7 49.6 131.0 21.25 −55.3 −7.41 HL01 地下水 6.89 26.1 221 1.0 9.2 17.9 10.9 8.1 5.0 102.8 0.02 −44.9 −6.7 HL02 地下水 6.93 26.3 668 3.6 4.0 4.2 0.4 3.0 4.2 32.7 0.02 −23.5 −3.42 HL03 地下水 7.85 26.5 3490 3.5 9.5 9.6 3.3 13.0 10.3 36.4 0.42 −36.5 −5.1 H01 地表水 7.59 28.7 421 2.7 6.9 10.8 2.2 5.4 5.7 46.4 0.44 −39.2 −5.45 H02 地表水 7.25 27.6 380 0.1 4.7 9.6 1.8 3.2 4.5 40.0 0.26 −38.8 −5.51 H03 地表水 6.85 27.5 329 2.6 7.2 8.4 2.0 7.2 5.3 38.2 0.32 −34.4 −4.97 H04 海水 7.15 27.1 1001 14.1 488.8 19.7 57.3 857.8 131.0 10.9 0.02 − − 研究区地下热水的氟含量变化范围为5.30—23.10 mg·L−1,平均值为14.25 mg·L−1,F−含量远高于《生活饮用水卫生标准》(GB5749-2006)规定的1 mg·L−1. 将研究区地下热水的含氟量分为两个等级,20 mg·L−1>F−>1mg·L−1为高氟地热水,F−>20 mg·L−1为超高氟地热水. HH05-HH08地热水水样位于海南岛内陆地区,其F−含量均超过20 mg·L−1,而其余沿海地区的地热水F−含量均值为6.82 mg·L−1,说明研究区从沿海向内陆地区地热水的F−含量呈增大趋势. 地下水和地表水的F−含量较低,变化范围为0.02—0.44 mg·L−1,均值为0.25 mg·L−1,含量能够达到《生活饮用水卫生标准》(GB5749-2006)的要求. 地热水水化学类型有HCO3-Na、SO4-Na、HCO3-Mg、Cl-Na,其中HCO3-Na是主要的水化学类型;地下水和地表水的水化学类型主要以重碳酸根型为主(图2).
2.2 地热水氢氧同位素特征
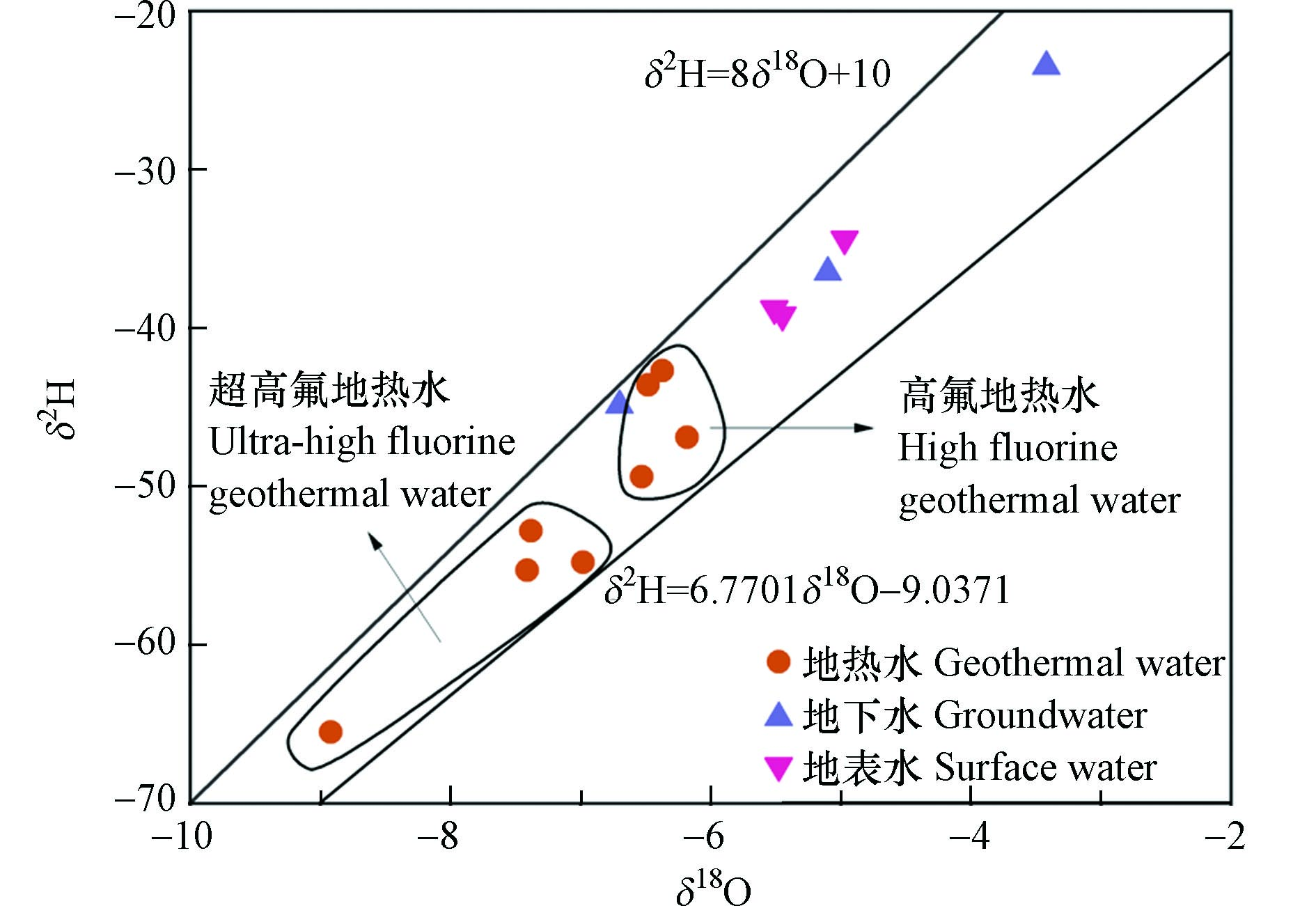
研究区地下热水的δ2H、δ18O含量分别为−65.5‰—−42.7‰和−8.92‰—−6.37‰,平均值分别为−51.38‰和−7.03‰; 而地下水与河水的δ2H、δ18O含量则相对较低,平均值分别为−36.22‰和−5.19‰. 高氟和超高氟地下热水的δ2H、δ18O平均含量分别为−45.65‰、−57.10‰和−6.39‰、−7.67‰,可以发现高氟地热水的δ2H、δ18O含量显著高于超高氟地热水.
将采集样点的数据投影在全球大气降水线GMWL:δ2H=8δ18O+10和当地大气降水线LMWL:δ2H=8δ18O+10[12]上. 由图3可以发现,所有地热水、地下水和地表水样点均偏离大气降雨曲线,表明研究区地热水存在轻微的“氧漂移”现象,这可能是由于地下热水受到了不同程度的蒸发及浓缩作用. 一方面,地表水受到强烈蒸发的影响导致δ2H和δ18O增加;另一方面,当地热水沿断层上升至地表时,围岩中的含氧矿物与地下水发生同位素交换反应,导致δ18O同位素消耗[13]. “氧漂移”现象表明地热水不是直接来源于大气降水,而是大气降水降落到高海拔地区后经过长时间的径流后形成的地热水. 高氟地热水的氢氧同位素值显著高于超高氟地热水主要可能存在两方面原因:一方面沿断裂带出露的地热水,氢氧同位素的值与循环深度大致成反比,因此可以推断超高氟地热水的循环深度更大,与围岩作用更充分导致更高的氟含量;另一方面高氟地热水位于滨海地带,含水层主要包括海相和河流相交互沉积层,地热水形成过程可能受到高δ2H、δ18O含量的地下水和海水影响,导致氢氧同位素含量高[14].
不同地区的大气降雨在形成的过程中的水气来源和周围环境的差异,导致了气、液同位素分馏的差异性,这种差异性被量化为氘过量参数. 1984年Dansgaard首次提出氘过量参数的概念,并且定义其公式为 d =δ2H−8δ18O [15]. 对于地热水的d值,其变化主要受到停留时间、围岩和水体的物理化学特征等的影响,一般d值越小,说明水文地质环境越封闭,地下水径流速度越慢,水岩相互作用程度更高. 研究区地热水的d值介于8.26‰和1.04‰之间,平均值为4.88‰,略低于地下水和地表水平均值5.32‰,表明地热水均是由当前气候条件下的大气降雨补给形成的. 地热水相对于地下水和地表水径流速度更慢,停留时间更长,与围岩中的含氟矿物相互作用程度更高,因此地热水的氟含量远高于地下水和地表水[16].
2.3 氟的富集过程
2.3.1 溶解沉淀作用
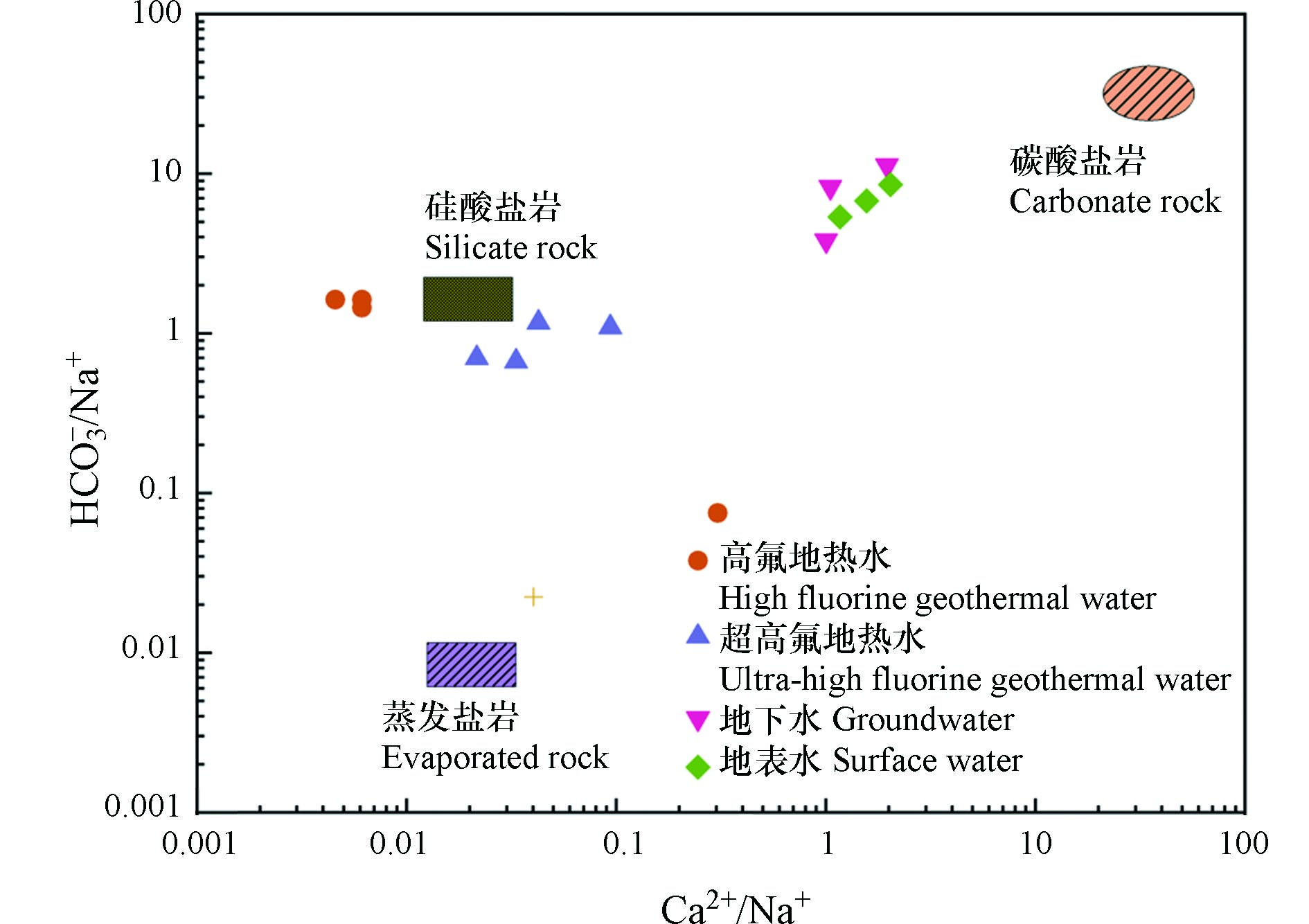
研究区地热水的补给主要为现代大气降水,补给后的水体经过沿断裂下渗至深部地热源进行加热,被加热后的热水向上渗流在盖层薄弱处出露地表[17]. 在地热水下渗、渗流、径流过程中,围岩矿物在水体中发生溶滤作用,围岩矿物中的氟多以难溶化合物的形式存在,主要包括萤石、氟磷灰石和黑云母[18]. 地热水中Ca2+/Na+、HCO
−3 萤石作为硅酸盐矿物中最主要的含氟矿物,含氟量高达48%[19];运用PHREEQC对地下热水中涉及氟富集矿物的矿物饱和指数(SI)计算,结果表明地热水中萤石、方解石、白云石均处于饱和状态,部分地下水中萤石处于非饱和状态. 涉及的相关反应为:
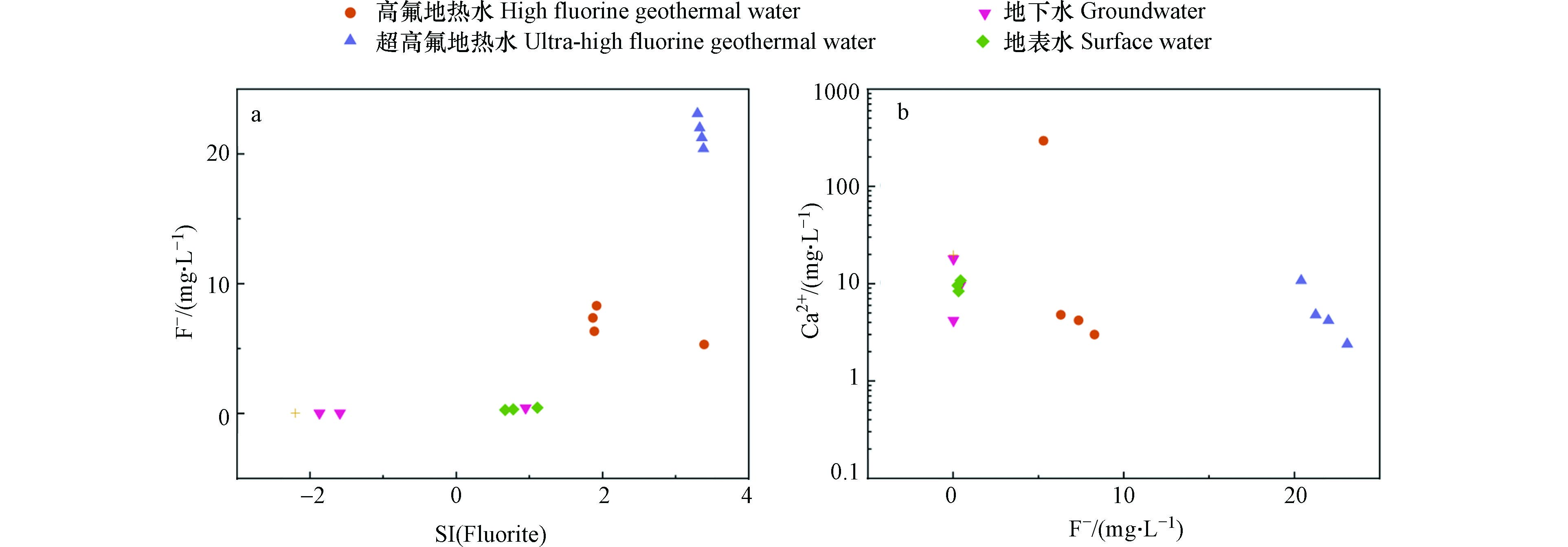
CaF2(萤石)=Ca2++2F− (1) Ca2++Mg2++2HCO3−+2OH−=CaMg(CO3)2↓(文石)+H2O (2) Ca2++HCO−3+OH−=CaCO3↓(方解石)+H2O (3) 一般情况下萤石十分稳定,当外部环境的条件发生变化时,含氟矿物的稳定性随之发生变化,矿物中的氟溶解进入水体中,这也是研究区地热水中氟浓度变化的主要影响因素[20]. 如图5所示,Ca2+和F−呈现出明显的负相关关系,而萤石的矿物饱和指数随F−浓度增加而增加. 地热水中的白云石、方解石的矿物饱和指数均大于0,水体中钙离子不断发生沉淀反应形成这两类矿物;进而Ca2+浓度降低,促进萤石发生溶解反应,水体中F−含量增加. 文石、方解石的沉淀促进了萤石的溶解,当萤石在水中溶解达到饱和状态时,固液两相之间的物质与能量交换处于平衡,并且共存于溶液中,达到动态平衡状态.
2.3.2 络合解离作用
在地下围岩矿物中,氟离子是一种非常活泼的离子,在一定条件下能够与矿物中的Al3+、Fe3+等一些金属水合离子发生配位体反应[21]. Al3+在研究区地热水中含量丰富,含量为3.60—133.00 μg·L−1, 均值为24.45 μg·L−1. 氟离子是除氢氧根之外和铝离子结合能力最强的离子,尤其是在酸性和中性条件下,能够形成大量的AlF、AlF2+、AlF4−等络合物. 在研究区弱碱性地热水的条件下,原有的络合-解离平衡会破坏,氟离子和Al-F络合物以及氢离子缔合的氟进行转化,进而导致地热水的氟浓度发生改变. 氟离子不仅能够和金属离子形成络合物,还能和土壤中的一些有机配位体形成各种络合物,包括氨基酸、碳水化合物和酚类物质等. 络合反应形成的络合物在流体中是具有可溶性和迁移性,并且能够增强研究区的含氟矿物溶解作用,导致氟浓度的增加.
2.3.3 离子交换作用
离子交换作用是影响地热水水化学组分的主要水文地球化学特征之一,离子比值法常用来判断地热水是否盛行离子交换作用. 当离子交换作用强烈时,Ca2++Mg2+-HCO
−3 2−4 CAI1=Cl−−Na+−K+Cl (4) CAI2=Cl−−Na+−K+HCO−3+SO2−4+CO2−3+NO−3 (5) 图6(b)表明研究区钠碱指数大多为负数,矿物中的Ca2+、Mg2+被Na+、K+置换出. 在离子交换作用的影响下导致研究区的Na+大量富集,Ca2+含量降低. Ca2+含量的降低促进了萤石的溶解,进而导致氟浓度的增加.
2.4 影响氟富集的因素
地下水中氟主要来源于围岩的矿物,而围岩矿物中氟进入地下水的过程受到多种因素的影响,对这类影响因素的分析能够进一步探究氟的富集规律. 在前人研究的基础上已经证实地下水中的氟含量和温度成正比关系,高温条件更有利于围岩中的含氟矿物的溶解,同时岩石、土壤表面大量吸附态的氟解吸进入地下水中,进而导致氟含量增加[23-24]. 图7(a)中表明温度更高的地热水的含氟量显著高于地下水和地表水,而地热水的含氟量和温度并未有明显相关性,这可能还和循环深度、水文地质封闭程度有关.
研究区地热水呈弱碱性,pH集中分布在8.5附近,该弱碱性环境更有利于F−的富集,而地下水和地表水约呈中性. 在弱碱条件下氟的赋存形态主要是氟离子,水体中大量的氢氧根离子和氟离子拥有相似的化学半径和电荷数,将取代围岩含氟矿物中的氟离子而使其进入水体,使水体中的氟含量增加. 如图7(b)所示,地热水中的氟含量随pH的增大而增大,而地下水中的氟含量几乎不受pH的影响;表明在地热水中pH是氟含量变化的控制因子,这与大部分地区的结果相一致[7,24]. 高氟地热水位于滨海地区,地层中存在相当厚度的盐岩层,导致高氟地热水的TDS含量显著高于超高氟地热水,其平均值分别为1644 mg·L−1和280 mg·L−1. 地热水氟含量和TDS相关性不大,表明蒸发浓缩等作用造成的TDS变化对琼北地区地热水氟含量影响不大. F−的化学性质相当活泼,能和诸多金属、非金属类元素作用形成化合物,因此地热水中的离子组分是影响氟含量变化的重要因素. HCO
−3 −3 −3 地热水中的氟主要来源于地下围岩中的含氟矿物中,地层的岩性是影响氟含量的分布重要因素. 高氟地热水分布于沿海地区,主要出露第四系砂岩、粉砂岩和粘土这类沉积岩. 沉积岩含氟量通常低于其它类型的岩石,其主要的含氟矿物为萤石、氟磷灰石,一般含氟量为220—940 mg·L−1 [26]. 超高氟地热水主要分布于内陆地区,岩性较为复杂,其主要出露年代较为古老的玄武岩、花岗岩等岩浆岩和变质岩,这类岩石的氟含量一般远高于沉积岩. 研究区北部大量出露的玄武岩中富含萤石、黑云母、角闪石和氟磷灰石等富氟矿物,变质岩广泛出露中部,出露的地热水具有更高的氟含量[20].
3. 结论(Conclusion)
(1)琼北地区地热水中的F−含量均超标,平均值高达14.25 mg·L−1;而地下水和地表水的F−含量未超标,变化范围为0.02—0.44 mg·L−1. 在空间分布上,由沿海地区到内陆地区F−含量呈现逐渐增大的趋势,尤其是内陆地区,平均含量为21.69 mg·L−1,远高于沿海地区地热水.
(2)研究区地热水水化学类型有HCO3-Na、SO4-Na、HCO3-Mg、Cl-Na,其中HCO3-Na是主要的水化学类型. pH、温度和地层中的含氟矿物类型对地热水中的氟富集过程有重要的影响.
(3)氢氧同位素数据表明研究区地下热水补给来源为现代大气降水,并且存在轻微的“氧漂移”现象,受到一定程度的蒸发浓缩的影响. 高氟地热水的氢氧同位素值显著高于超高氟地热水,可能是由于超高氟地热水的循环深度更大,与围岩作用更充分. 高氟地热水形成过程可能受到高含量的δ2H、δ18O地下水和海水影响,进而导致氢氧同为素含量更高.
(4)溶解沉淀作用、络合解离作用、离子交换作用是影响研究区F−富集的主要水文地球化学过程. 文石、方解石的沉淀反应、络合反应形成的络合物以及Na+、K+置换出Ca2+、Mg2+的离子交换反应,使得地热水中氟含量增加.
-
表 1 人工湿地对不同污染物的主要去除机制
Table 1. Main removal mechanisms of different pollutants in CWs
表 2 铁碳微电解基质的应用
Table 2. Application of iron carbon micro-electrolysis substrate
处理物Treatment 碳类型Carbon type 铁类型Iron type 骨架Support 进水类型Sample type 去除率/%Removal rate 参考文献References 总氮 活性炭 Fe0 砾石 实际水样 63.40 ± 12.11 [57] 总磷 生物炭 Fe 生物炭 实际水样 98 [43] 镉 秸秆生物炭 Fe0 沸石 模拟水样 98.59 [51] 六价铬 活性炭 nZVI AC/nZVI 模拟水样 68 [21] 六价铬 生物炭 Fe3O4 砾石 模拟水样 65 [38] 2,4-二硝基甲苯 秸秆生物炭 nZVI 生物炭 模拟水样 >97 [72] 对硝基酚 橡木锯屑 FeSO4 生物炭 模拟水样 >97 [30] 甲硝唑 葡萄糖 Fe0 生物炭 模拟水样 94.20 [30] 氯霉素 桉木生物炭 nZVI 生物炭 模拟水样 100 [20] 双酚A 生物炭 Fe2O3 生物炭 模拟水样 100 [50] 毒死蜱 秸秆生物炭 Fe0 沸石 模拟水样 99.55 [51] 四环素 生物炭 Fe0 生物炭 实际水样 99.1 [34] 环丙沙星 木炭 Fe0 生物炭 模拟水样 95.5 [36] 磷酸三甲酚酯 秸秆生物炭 FeSO4 生物炭 模拟水样 >90 [30] -
[1] ARDEN S, MA X. Constructed wetlands for greywater recycle and reuse: A review [J]. Science of the Total Environment, 2018, 630: 587-599. doi: 10.1016/j.scitotenv.2018.02.218 [2] PARDE D, PATWA A, SHUKLA A, et al. A review of constructed wetland on type, treatment and technology of wastewater [J]. Environmental Technology & Innovation, 2021, 21: 101261. [3] VYMAZAL J, ZHAO Y Q, MANDER Ü. Recent research challenges in constructed wetlands for wastewater treatment: A review [J]. Ecological Engineering, 2021, 169: 106318. doi: 10.1016/j.ecoleng.2021.106318 [4] GARGALLO S, MARTÍN M, OLIVER N, et al. Sedimentation and resuspension modelling in free water surface constructed wetlands [J]. Ecological Engineering, 2017, 98: 318-329. doi: 10.1016/j.ecoleng.2016.09.014 [5] WANG H X, XU J L, SHENG L X, et al. A review of research on substrate materials for constructed wetlands [J]. Materials Science Forum, 2018, 913: 917-929. doi: 10.4028/www.scientific.net/MSF.913.917 [6] VYMAZAL J. Constructed wetlands for treatment of industrial wastewaters: A review [J]. Ecological Engineering, 2014, 73: 724-751. doi: 10.1016/j.ecoleng.2014.09.034 [7] 蒋宗宏, 陈淼, 李心清, 等. 改性生物炭对水体中抗生素的去除研究进展 [J]. 环境化学, 2021, 40(12): 3846-3860. doi: 10.7524/j.issn.0254-6108.2020080202 JIANG Z H, CHEN M, LI X Q, et al. Research progress on the removal of antibiotics in water by modified biochar [J]. Environmental Chemistry, 2021, 40(12): 3846-3860(in Chinese). doi: 10.7524/j.issn.0254-6108.2020080202
[8] 赵倩, 庄林岚, 盛芹, 等. 潜流人工湿地中基质在污水净化中的作用机制与选择原理 [J]. 环境工程, 2021, 39(9): 14-22. doi: 10.13205/j.hjgc.202109003 ZHAO Q, ZHUANG L L, SHENG Q, et al. Role and design principles of substrate for wastewater purification in subsurface flow constructed wetland [J]. Environmental Engineering, 2021, 39(9): 14-22(in Chinese). doi: 10.13205/j.hjgc.202109003
[9] CHEN L, QUAN X C, GAO Z Q, et al. A composite Fe-C/layered double oxides (Fe-C/LDO) carrier fabrication and application for enhanced removal of nitrate and phosphate from polluted water with a low carbon/nitrogen ratio [J]. Journal of Cleaner Production, 2022, 352: 131628. doi: 10.1016/j.jclepro.2022.131628 [10] JIA W, SUN X, GAO Y, et al. Fe-modified biochar enhances microbial nitrogen removal capability of constructed wetland [J]. Science of the Total Environment, 2020, 740: 139534. doi: 10.1016/j.scitotenv.2020.139534 [11] LUO J H, SONG G Y, LIU J Y, et al. Mechanism of enhanced nitrate reduction via micro-electrolysis at the powdered zero-valent iron/activated carbon interface [J]. Journal of Colloid and Interface Science, 2014, 435: 21-25. doi: 10.1016/j.jcis.2014.08.043 [12] 段浩楠, 吕宏虹, 王夫美, 等. 生物炭/铁复合材料的制备及其在环境修复中的应用研究进展 [J]. 环境化学, 2020, 39(3): 774-790. doi: 10.7524/j.issn.0254-6108.2019103109 DUAN H N, LYU H H, WANG F M, et al. Preparation of biochar/iron composite and its application in environmental remediation [J]. Environmental Chemistry, 2020, 39(3): 774-790(in Chinese). doi: 10.7524/j.issn.0254-6108.2019103109
[13] XIAO J N, GAO B Y, YUE Q Y, et al. Characterization of nanoscale zero-valent iron supported on granular activated carbon and its application in removal of acrylonitrile from aqueous solution [J]. Journal of the Taiwan Institute of Chemical Engineers, 2015, 55: 152-158. doi: 10.1016/j.jtice.2015.04.010 [14] WANG X Q, GONG X K, ZHANG Q X, et al. Degradation mechanism of Direct Pink 12B treated by iron-carbon micro-electrolysis and Fenton reaction [J]. Journal of Environmental Sciences, 2013, 25: S63-S68. doi: 10.1016/S1001-0742(14)60628-8 [15] MA Z F, YANG Y, JIANG Y H, et al. Enhanced degradation of 2, 4-dinitrotoluene in groundwater by persulfate activated using iron-carbon micro-electrolysis [J]. Chemical Engineering Journal, 2017, 311: 183-190. doi: 10.1016/j.cej.2016.11.083 [16] CHE J G, WAN J B, HUANG X P, et al. Pretreatment of piggery digestate wastewater by ferric-carbon micro-electrolysis under alkalescence condition [J]. Korean Journal of Chemical Engineering, 2017, 34(9): 2397-2405. doi: 10.1007/s11814-017-0144-8 [17] MA T, ZHANG L Y, XI B D, et al. Treatment of farmer household tourism wastewater using iron-carbon micro-electrolysis and horizontal subsurface flow constructed wetlands: A full-scale study [J]. Ecological Engineering, 2018, 110: 192-203. doi: 10.1016/j.ecoleng.2017.08.029 [18] LI X, JIA Y, QIN Y, et al. Iron-carbon microelectrolysis for wastewater remediation: Preparation, performance and interaction mechanisms [J]. Chemosphere, 2021, 278: 130483. doi: 10.1016/j.chemosphere.2021.130483 [19] 苏志敏, 韩严和, 刘立娜. 铁碳微电解填料改性的研究进展 [J]. 现代化工, 2022, 42(5): 35-39. SU Z M, HAN Y H, LIU L N. Advances on modification of iron-carbon micro-electrolytic fillers [J]. Modern Chemical Industry, 2022, 42(5): 35-39(in Chinese).
[20] WU Y W, YUE Q Y, REN Z F, et al. Immobilization of nanoscale zero-valent iron particles (nZVI) with synthesized activated carbon for the adsorption and degradation of Chloramphenicol (CAP) [J]. Journal of Molecular Liquids, 2018, 262: 19-28. doi: 10.1016/j.molliq.2018.04.032 [21] MORTAZAVIAN S, AN H, CHUN D, et al. Activated carbon impregnated by zero-valent iron nanoparticles (AC/nZVI) optimized for simultaneous adsorption and reduction of aqueous hexavalent chromium: Material characterizations and kinetic studies [J]. Chemical Engineering Journal, 2018, 353: 781-795. doi: 10.1016/j.cej.2018.07.170 [22] ABEDI T, MOJIRI A. Constructed wetland modified by biochar/zeolite addition for enhanced wastewater treatment [J]. Environmental Technology & Innovation, 2019, 16: 100472. [23] VOHLA C, KÕIV M, BAVOR H J, et al. Filter materials for phosphorus removal from wastewater in treatment wetlands—a review [J]. Ecological Engineering, 2011, 37(1): 70-89. doi: 10.1016/j.ecoleng.2009.08.003 [24] ALLER M F. Biochar properties: Transport, fate, and impact [J]. Critical Reviews in Environmental Science and Technology, 2016, 46(14/15): 1183-1296. [25] DONG H R, DENG J M, XIE Y K, et al. Stabilization of nanoscale zero-valent iron (nZVI) with modified biochar for Cr(Ⅵ) removal from aqueous solution [J]. Journal of Hazardous Materials, 2017, 332: 79-86. doi: 10.1016/j.jhazmat.2017.03.002 [26] di LUCA G A, MAINE M A, MUFARREGE M M, et al. Phosphorus distribution pattern in sediments of natural and constructed wetlands [J]. Ecological Engineering, 2017, 108: 227-233. doi: 10.1016/j.ecoleng.2017.08.038 [27] SONG N F, XU J, CAO Y P, et al. Chemical removal and selectivity reduction of nitrate from water by (nano) zero-valent iron/activated carbon micro-electrolysis [J]. Chemosphere, 2020, 248: 125986. doi: 10.1016/j.chemosphere.2020.125986 [28] GIKAS G D, VRYZAS Z, TSIHRINTZIS V A. S-metolachlor herbicide removal in pilot-scale horizontal subsurface flow constructed wetlands [J]. Chemical Engineering Journal, 2018, 339: 108-116. doi: 10.1016/j.cej.2018.01.056 [29] LATIF A, SHENG D, SUN K, et al. Remediation of heavy metals polluted environment using Fe-based nanoparticles: Mechanisms, influencing factors, and environmental implications [J]. Environmental Pollution, 2020, 264: 114728. doi: 10.1016/j.envpol.2020.114728 [30] AHMAD S, LIU X M, TANG J C, et al. Biochar-supported nanosized zero-valent iron (nZVI/BC) composites for removal of nitro and chlorinated contaminants [J]. Chemical Engineering Journal, 2022, 431: 133187. doi: 10.1016/j.cej.2021.133187 [31] ZHU S S, HUANG X C, WANG D W, et al. Enhanced hexavalent chromium removal performance and stabilization by magnetic iron nanoparticles assisted biochar in aqueous solution: Mechanisms and application potential [J]. Chemosphere, 2018, 207: 50-59. doi: 10.1016/j.chemosphere.2018.05.046 [32] LU J, ZHANG C, WU J. One-pot synthesis of magnetic algal carbon/sulfidated nanoscale zerovalent iron composites for removal of bromated disinfection by-product [J]. Chemosphere, 2020, 250: 126257. doi: 10.1016/j.chemosphere.2020.126257 [33] WANG R Z, HUANG D L, LIU Y G, et al. Recent advances in biochar-based catalysts: Properties, applications and mechanisms for pollution remediation [J]. Chemical Engineering Journal, 2019, 371: 380-403. doi: 10.1016/j.cej.2019.04.071 [34] LIU K Y, ZHENG F D, XIAO Y, et al. High Fe utilization efficiency and low toxicity of Fe3C@Fe0 loaded biochar for removing of tetracycline hydrochloride in wastewater [J]. Journal of Cleaner Production, 2022, 353(2): 131630. [35] YANG S Z, SUN H N, SU S P, et al. Fabrication, characterizations and performance of a high-efficiency micro-electrolysis filler for isobutyl xanthate (IBX) degradation [J]. Journal of Hazardous Materials, 2021, 403: 123640. doi: 10.1016/j.jhazmat.2020.123640 [36] MAHDIZADEH H, MALAKOOTIAN M. Optimization of ciprofloxacin removal from aqueous solutions by a novel semi-fluid Fe/charcoal micro-electrolysis reactor using response surface methodology [J]. Process Safety and Environmental Protection, 2019, 123: 299-308. doi: 10.1016/j.psep.2019.01.024 [37] YI X Z, TRAN N H, YIN T R, et al. Removal of selected PPCPs, EDCs, and antibiotic resistance genes in landfill leachate by a full-scale constructed wetlands system [J]. Water Research, 2017, 121: 46-60. doi: 10.1016/j.watres.2017.05.008 [38] KANG Y, SUN H L, GAO B L, et al. Enhanced reduction of Cr(VI) in iron-carbon micro-electrolysis constructed wetlands: Mechanisms of iron cycle and microbial interactions [J]. Chemical Engineering Journal, 2022, 439: 135742. doi: 10.1016/j.cej.2022.135742 [39] JI Z H, TANG W Z, PEI Y S. Constructed wetland substrates: A review on development, function mechanisms, and application in contaminants removal [J]. Chemosphere, 2022, 286: 131564. doi: 10.1016/j.chemosphere.2021.131564 [40] WANG J, XIA L, CHEN J Y, et al. Synergistic simultaneous nitrification-endogenous denitrification and EBPR for advanced nitrogen and phosphorus removal in constructed wetlands [J]. Chemical Engineering Journal, 2021, 420: 127605. doi: 10.1016/j.cej.2020.127605 [41] CHEN H B, GAO Y R, LI J H, et al. Engineered biochar for environmental decontamination in aquatic and soil systems: A review [J]. Carbon Research, 2022, 1(1): 4. doi: 10.1007/s44246-022-00005-5 [42] HUANG X, YANG X M, ZHU J, et al. Microbial interspecific interaction and nitrogen metabolism pathway for the treatment of municipal wastewater by iron carbon based constructed wetland [J]. Bioresource Technology, 2020, 315: 123814. doi: 10.1016/j.biortech.2020.123814 [43] LI X Z, ZHOU L L, ZHUANG L L, et al. High-efficient nitrogen and phosphorus removal and its mechanism in a partially unsaturated constructed wetland with Fe-C micro-electrolysis substrate [J]. Chemical Engineering Journal, 2022, 431: 133252. doi: 10.1016/j.cej.2021.133252 [44] WANG X D, XU J, LIU J, et al. Mechanism of Cr(Ⅵ) removal by magnetic greigite/biochar composites [J]. Science of the Total Environment, 2020, 700: 134414. doi: 10.1016/j.scitotenv.2019.134414 [45] GAO J Q, ZHAO J, ZHANG J S, et al. Preparation of a new low-cost substrate prepared from drinking water treatment sludge (DWTS)/bentonite/zeolite/fly ash for rapid phosphorus removal in constructed wetlands [J]. Journal of Cleaner Production, 2020, 261: 121110. doi: 10.1016/j.jclepro.2020.121110 [46] JIA L X, LIU H, KONG Q, et al. Interactions of high-rate nitrate reduction and heavy metal mitigation in iron-carbon-based constructed wetlands for purifying contaminated groundwater [J]. Water Research, 2020, 169: 115285. doi: 10.1016/j.watres.2019.115285 [47] FENG Y, LIU P, WANG Y X, et al. Distribution and speciation of iron in Fe-modified biochars and its application in removal of As(V), As(III), Cr(VI), and Hg(II): An X-ray absorption study [J]. Journal of Hazardous Materials, 2020, 384: 121342. doi: 10.1016/j.jhazmat.2019.121342 [48] ZHU S S, HO S H, HUANG X C, et al. Magnetic nanoscale zerovalent iron assisted biochar: Interfacial chemical behaviors and heavy metals remediation performance [J]. ACS Sustainable Chemistry & Engineering, 2017, 5(11): 9673-9682. [49] TSENG H H, SU J G, LIANG C J. Synthesis of granular activated carbon/zero valent iron composites for simultaneous adsorption/dechlorination of trichloroethylene [J]. Journal of Hazardous Materials, 2011, 192(2): 500-506. doi: 10.1016/j.jhazmat.2011.05.047 [50] GAN L, WANG L J, XU L J, et al. Fe3C-porous carbon derived from Fe2O3 loaded MOF-74(Zn) for the removal of high concentration BPA: The integrations of adsorptive/catalytic synergies and radical/non-radical mechanisms [J]. Journal of Hazardous Materials, 2021, 413: 125305. doi: 10.1016/j.jhazmat.2021.125305 [51] ZHANG Y, LI Y, WANG J R, et al. Interactions of chlorpyrifos degradation and Cd removal in iron-carbon-based constructed wetlands for treating synthetic farmland wastewater [J]. Journal of Environmental Management, 2021, 299: 113559. doi: 10.1016/j.jenvman.2021.113559 [52] DENG S J, CHEN J Q, CHANG J J. Application of biochar as an innovative substrate in constructed wetlands/biofilters for wastewater treatment: Performance and ecological benefits [J]. Journal of Cleaner Production, 2021, 293: 126156. doi: 10.1016/j.jclepro.2021.126156 [53] YANG X Y, HE Q, LIU T, et al. Impact of microplastics on the treatment performance of constructed wetlands: Based on substrate characteristics and microbial activities [J]. Water Research, 2022, 217: 118430. doi: 10.1016/j.watres.2022.118430 [54] MA X N, LI X, LI J, et al. Iron-carbon could enhance nitrogen removal in Sesuvium portulacastrum constructed wetlands for treating mariculture effluents [J]. Bioresource Technology, 2021, 325: 124602. doi: 10.1016/j.biortech.2020.124602 [55] YIN X, QIAO S, ZHOU J T. Using electric field to enhance the activity of anammox bacteria [J]. Applied Microbiology and Biotechnology, 2015, 99(16): 6921-6930. doi: 10.1007/s00253-015-6631-0 [56] ZHANG J X, ZHANG Y B, LI Y, et al. Enhancement of nitrogen removal in a novel anammox reactor packed with Fe electrode [J]. Bioresource Technology, 2012, 114: 102-108. doi: 10.1016/j.biortech.2012.03.018 [57] 陈欣, 祝惠, 阎百兴, 等. 铁碳微电解基质强化人工湿地污染物去除率的室内模拟实验 [J]. 湿地科学, 2018, 16(5): 684-689. doi: 10.13248/j.cnki.wetlandsci.2018.05.016 CHEN X, ZHU H, YAN B X, et al. Indoor simulation experiment on pollutant removal rates by micro-electrolysis material intensified constructed wetland [J]. Wetland Science, 2018, 16(5): 684-689(in Chinese). doi: 10.13248/j.cnki.wetlandsci.2018.05.016
[58] 张博文. 铁改性花生壳生物炭吸附除磷性能及机理研究[D]. 北京: 中国地质大学(北京), 2018. ZHANG B W. Performance and mechanism on the phosphorus adsorption by iron modified peanut shell biochar[D]. Beijing: China University of Geosciences(Beijing) , 2018 (in Chinese).
[59] BATOOL A, SALEH T A. Removal of toxic metals from wastewater in constructed wetlands as a green technology;catalyst role of substrates and chelators [J]. Ecotoxicology and Environmental Safety, 2020, 189: 109924. doi: 10.1016/j.ecoenv.2019.109924 [60] KUJAWSKA A, KIEŁKOWSKA U, ATISHA A, et al. Comparative analysis of separation methods used for the elimination of pharmaceuticals and personal care products (PPCPs) from water - A critical review [J]. Separation and Purification Technology, 2022, 290: 120797. doi: 10.1016/j.seppur.2022.120797 [61] BAYATI M, HO T L, VU D C, et al. Assessing the efficiency of constructed wetlands in removing PPCPs from treated wastewater and mitigating the ecotoxicological impacts [J]. International Journal of Hygiene and Environmental Health, 2021, 231: 113664. doi: 10.1016/j.ijheh.2020.113664 [62] AL-BALDAWI I A, MOHAMMED A A, MUTAR Z H, et al. Application of phytotechnology in alleviating pharmaceuticals and personal care products (PPCPs) in wastewater: Source, impacts, treatment, mechanisms, fate, and SWOT analysis [J]. Journal of Cleaner Production, 2021, 319: 128584. doi: 10.1016/j.jclepro.2021.128584 [63] EBELE A J, ABOU-ELWAFA ABDALLAH M, HARRAD S. Pharmaceuticals and personal care products (PPCPs) in the freshwater aquatic environment [J]. Emerging Contaminants, 2017, 3(1): 1-16. doi: 10.1016/j.emcon.2016.12.004 [64] LIN A Y C, LIN C A, TUNG H H, et al. Potential for biodegradation and sorption of acetaminophen, caffeine, propranolol and acebutolol in lab-scale aqueous environments [J]. Journal of Hazardous Materials, 2010, 183(1/2/3): 242-250. [65] 李莎, 王文奇, 范梦婕, 等. 环境持久性有机污染物治理技术进展 [J]. 现代化工, 2022, 42(6): 43-47. doi: 10.12361/2661-3689-04-06-93249 LI S, WANG W Q, FAN M J, et al. Progress in treatment technology for environmental persistent organic pollutants [J]. Modern Chemical Industry, 2022, 42(6): 43-47(in Chinese). doi: 10.12361/2661-3689-04-06-93249
[66] TAO Y, HU S B, HAN S Y, et al. Efficient removal of atrazine by iron-modified biochar loaded Acinetobacter lwoffii DNS32 [J]. Science of the Total Environment, 2019, 682: 59-69. doi: 10.1016/j.scitotenv.2019.05.134 [67] KUMAR M, YADAV A N, SAXENA R, et al. Biodiversity of pesticides degrading microbial communities and their environmental impact [J]. Biocatalysis and Agricultural Biotechnology, 2021, 31: 101883. doi: 10.1016/j.bcab.2020.101883 [68] ISMANTO A, HADIBARATA T, KRISTANTI R A, et al. Endocrine disrupting chemicals (EDCs) in environmental matrices: Occurrence, fate, health impact, physio-chemical and bioremediation technology [J]. Environmental Pollution, 2022, 302: 119061. doi: 10.1016/j.envpol.2022.119061 [69] ZHANG P, TAN X F, LIU S B, et al. Catalytic degradation of estrogen by persulfate activated with iron-doped graphitic biochar: Process variables effects and matrix effects [J]. Chemical Engineering Journal, 2019, 378: 122141. doi: 10.1016/j.cej.2019.122141 [70] 田开放, 张漓杉, 张静, 等. 铁碳微电解耦合人工湿地系统处理硫丹废水研究 [J]. 工业水处理, 2020, 40(2): 28-31. TIAN K F, ZHANG L S, ZHANG J, et al. Study on the treatment of endosulfan wastewater by iron-carbon micro-electrolysis coupled constructed wetland system [J]. Industrial Water Treatment, 2020, 40(2): 28-31(in Chinese).
[71] LI M Q, LUO R, WANG C H, et al. Iron-tannic modified cotton derived Fe0/graphitized carbon with enhanced catalytic activity for bisphenol A degradation [J]. Chemical Engineering Journal, 2019, 372: 774-784. doi: 10.1016/j.cej.2019.04.187 [72] WANG R G, ZHAO X, WANG T C, et al. Can we use mine waste as substrate in constructed wetlands to intensify nutrient removal?A critical assessment of key removal mechanisms and long-term environmental risks [J]. Water Research, 2022, 210: 118009. doi: 10.1016/j.watres.2021.118009 [73] SHAMEER S, PRASAD T N V K V. Plant growth promoting rhizobacteria for sustainable agricultural practices with special reference to biotic and abiotic stresses [J]. Plant Growth Regulation, 2018, 84(3): 603-615. doi: 10.1007/s10725-017-0365-1 [74] ALI M, ROUSSEAU D P L, AHMED S. A full-scale comparison of two hybrid constructed wetlands treating domestic wastewater in Pakistan [J]. Journal of Environmental Management, 2018, 210: 349-358. [75] TANG X Y, YANG Y, TAO R, et al. Fate of mixed pesticides in an integrated recirculating constructed wetland (IRCW) [J]. Science of the Total Environment, 2016, 571: 935-942. doi: 10.1016/j.scitotenv.2016.07.079 [76] 张骁栋, 朱建华, 康晓明, 等. 中国湿地温室气体清单编制研究进展 [J]. 生态学报, 2022, 42(23): 1-14. ZHANG X D, ZHU J H, KANG X M, et al. An overview of greenhouse gas inventory in the Chinese wetlands [J]. Acta Ecologica Sinica, 2022, 42(23): 1-14(in Chinese).
[77] MALTAIS-LANDRY G, MARANGER R, BRISSON J, et al. Greenhouse gas production and efficiency of planted and artificially aerated constructed wetlands [J]. Environmental Pollution, 2009, 157(3): 748-754. doi: 10.1016/j.envpol.2008.11.019 [78] KONG F L, WANG J R, HOU W H, et al. Influence of modified biochar supported sulfidation of nano-zero-valent-iron (S-nZVI/BC) on nitrate removal and greenhouse gas emission in constructed wetland [J]. Journal of Environmental Sciences, 2023, 125: 568-581. doi: 10.1016/j.jes.2022.02.040 [79] SØVIK A K, KLØVE B. Emission of N2O and CH4 from a constructed wetland in southeastern Norway [J]. The Science of the Total Environment, 2007, 380(1/2/3): 28-37. [80] ZHOU T T, LIU J G, LIE Z Y, et al. Effects of applying different carbon substrates on nutrient removal and greenhouse gas emissions by constructed wetlands treating carbon-depleted hydroponic wastewater [J]. Bioresource Technology, 2022, 357: 127312. doi: 10.1016/j.biortech.2022.127312 [81] QIN C Y, XU X Y, PECK E. Sink or source?Insights into the behavior of copper and zinc in the sediment porewater of a constructed wetland by peepers [J]. The Science of the Total Environment, 2022, 821: 153127. doi: 10.1016/j.scitotenv.2022.153127 [82] ZHAO Z J, HAO Q J, MA R Z, et al. Ferric-carbon micro-electrolysis and zeolite reduce CH4 and N2O emissions from the aerated constructed wetland [J]. Journal of Cleaner Production, 2022, 342: 130946. doi: 10.1016/j.jclepro.2022.130946 [83] JI B H, JIANG M, YANG Y, et al. High treatment effectiveness for secondary effluent in Fe-C microelectrolysis constructed wetlands with electron donor supplementation [J]. Journal of Cleaner Production, 2022, 342: 130934. doi: 10.1016/j.jclepro.2022.130934 -




 下载:
下载: