-
铬(chromium, Cr)是一种广泛存在于自然环境中的过渡金属元素,同时也是一种毒性较强的重金属污染物,可通过物质循环过程进入食物链后在人体内蓄积,从而导致人体机能出现功能性障碍和不可逆转性损伤,对人体健康构成潜在威胁[1-2]. 随着工业的快速发展,重金属Cr及其化合物作为重要的基础原料被广泛应用于电镀、印染、鞣革、化工等行业,但由于生产过程中大量含Cr废弃物的随意排放,造成土壤Cr污染问题日益严重[3]. 污染土壤中Cr元素进入人体的途径包括无意口部摄入、饮食摄入、呼吸和皮肤接触等,其中通过食物链传递作用形成的饮食摄入常被认为是土壤Cr进入人体的主要途径[4]. 作为人们日常饮食中重要的组成部分,蔬菜在为人体提供多种维生素和矿物质的同时,也成为土壤Cr元素迁移与生物富集过程中重要的载体. 长期摄入受重金属Cr污染的蔬菜会导致Cr元素积累在肺、肝、肾和分泌腺中,对人体肝、肾等器官和DNA造成损伤,甚至可能会产生致癌效应[5-6]. 因此,开展蔬菜中重金属Cr的人体健康风险的科学评估具有重要意义.
近年来,体外试验(食物基质中污染物溶解于胃肠消化液中且能被人体所吸收最大部分,即生物可给性)被国内外学者广泛应用于食物中重金属的人体健康风险研究中[7]. 因体外试验(in vitro)具有较强的可控性和重复性,且试验周期短和实际应用中不受限制等优点,在国际上已逐步形成了一套较为完善的人体健康风险评估体系[8]. 但目前大多数应用in vitro开展的健康风险评估主要基于胃和小肠阶段中重金属生物可给性,未考虑到结肠阶段. 通常认为,小肠作为人体的主要吸收器官,食物基质中重金属溶出后基本被小肠中的肠壁细胞吸收[9];但食物基质中未溶出的重金属可随食糜进入人体的大肠,即人体结肠阶段. 人体结肠中存在大量的肠道微生物(至少约1000种不同类型的微生物,菌落总数达到1×1014),这些微生物具有较强的代谢能力,在人体消化过程中对于食物残渣中重金属元素的代谢具有影响[10]. 由此可见,未考虑结肠阶段食物中重金属生物可给性的人体健康风险评估方法是不够全面的. SHIME模型是一种体外条件下动态模拟人体胃肠环境及微生物生态系统[11]. 目前,国内外学者利用该体外模型报道了肠道微生物对土壤和稻米中Cr的代谢影响[12-13],但有关利用SHIME模型研究肠道微生物对于矿区常见蔬菜中重金属Cr的生物可给性及人体健康风险的影响鲜有报道.
本文的主要研究内容为:(1)以铅锌矿区4种蔬菜为研究对象,分析蔬菜样品在生和煮熟两种不同条件下重金属Cr的含量;(2)采用体外方法(PBET[14]联合SHIME模型)测定蔬菜中Cr在胃、小肠和结肠阶段的生物可给性,并分析两名不同宿主肠道微生物对Cr的代谢影响;(3)运用人体健康风险评估模型评估当地居民膳食暴露风险,并对比基于Cr总量和生物可给性的人体健康风险. 研究结果将对更全面地进行膳食重金属暴露的健康风险评估起到推动作用,也对今后开展基于肠道微生物的人群健康效应研究提供参考.
-
供试蔬菜样品于2020年9月采自贵州某铅锌矿区内周边居民蔬菜种植地(104º 13′—105º 1′E,26º 47′—27º 27′ N). 在设置的采样区内采用五点取样法,通过连根拔起的采摘方式随机采集点位上的大小均匀的蔬菜植株(5—10 株)并避开遭受病虫害的样本,现场混合均匀后取1 kg作为该采样点的1个蔬菜样本并贴上标签,装入便携式冷藏箱中. 采集的样品包含辣椒(Capsicum annuum L.)(n=14)、芥菜(Brassica juncea(L.)Czern. et Coss)(n=10)、小白菜(Brassica chinensis L.)(n=7)和甘蓝(Brassica oleracea var. capitata L.)(n=4)4种当地居民常见种植和经常食用的蔬菜,共计35个蔬菜样品.
当日运回的新鲜蔬菜样品在实验室用去离子水清洗掉表面土壤和浮尘后,分取可食用部分后再用去离子水清洗3次,室温沥干表面附着水份,然后称取蔬菜可食用部分于100 ℃纯水中煮沸5 min,作为熟蔬菜样品[15];同时将生鲜蔬菜样品可食用部分置于100 ℃烘箱中杀青15 min,随后将生熟两种蔬菜样品分别置于70 ℃烘箱中低温烘干、切碎、研磨、过100目筛网后装入密封保存袋备用[16].
蔬菜样品的消解方法根据国家标准(GB 5009.123—2014),经HNO3-HClO4(9:1, V:V,优级纯)溶液消解,并采用电感耦合等离子体发射光谱(inductively coupled plasma optical emission spectrometer,ICP-OES)(ICAP 7400,Thermo Scientific公司,美国)测定样品中Cr含量. 为确保实验数据的准确可靠性,同一批次消解过程中加入国家标准物质(GBW10036,中国计量科学研究院,Cr:0.105 mg·kg−1)、空白样品和平行样品进行质量控制,标准物质的平均回收率为98.9%(92.3%—102.8%),其结果符合质控要求.
-
本研究使用的in vitro实验方法为PBET法(胃和小肠阶段)结合SHIME模型(结肠阶段),其中结肠阶段中肠道微生物样本来源于两名健康宿主(1名6岁儿童与1名24岁成人)的新鲜粪便样品(两名自愿者在本实验开始前6个月均未服用抗生素等药物). 将含有大量结肠微生物的新鲜粪便菌液分别接种于SHIME模型的结肠阶段,并利用智能溶出仪(RC-6)进行培养. 培养期间,每天定时向溶出罐中输入食物营养液,同时实时调节pH和搅拌速率,恒温水浴槽维持37 ℃恒温状态. 每6 小时向溶出罐中通入氮气以保证定植过程中的厌氧环境. 经过3周至4周的培养,结肠阶段肠道微生物的发酵活性(乙酸(1748.10±51.11) mg∙L−1,丙酸(530.60±22.07) mg∙L−1)和群落组成(包含(8.69±0.12) lg CFU∙mL−1总好氧菌、(7.62±0.09) lg CFU∙mL−1总厌氧菌)符合后续开展的实验要求[17-18]. 实验具体步骤如下:
(1)胃阶段:准确称取3 g蔬菜样品于灭菌离心管中,加入模拟胃消化液(内含柠檬酸、苹果酸、乳酸、冰乙酸和氯化钠)与胃蛋白酶,并使用盐酸(优级纯)调节pH至1.5. 每个蔬菜样品设置3个平行,置于37 ℃恒温水浴振荡箱中匀速振荡1 h,胃模拟消化结束后吸取反应液,并使用0.22 μm无机微孔滤膜过滤,4 ℃保存待测.
(2)小肠阶段:向胃模拟阶段结束后的消化液中加入模拟小肠消化液(内含胰蛋白酶和胆汁盐),并使用饱和的NaHCO3溶液调节反应液的pH值至7.0,继续置于37 ℃恒温水浴振荡箱中匀速振荡,4 h后吸取小肠反应液,过0.22 μm无机微孔滤膜,4 ℃保存待测.
(3)结肠阶段:将小肠模拟阶段结束后的消化液和蔬菜残渣迅速转移至无菌厌氧血清瓶内,分别从成人和儿童SHIME模型的结肠阶段中吸取含有人体肠道微生物的结肠液加入,并立即通入氮气冲洗,以保证厌氧条件;继续置于37 ℃恒温水浴振荡箱中匀速振荡,48 h后吸取结肠消化液,过0.22 μm无机微孔滤膜,4 ℃保存待测.
模拟胃、小肠和结肠阶段反应液中的重金属Cr含量采用ICP-OES进行测定,每个消化阶段设置空白样品和平行样品进行质量控制,同时在分析过程中为确保仪器的稳定性,重复测量标准样品(BY400032,Cr:1.80 mg∙L−1)24次,平均回收率为(103.52%±0.57%),结果符合质控要求.
蔬菜中重金属Cr在模拟胃、小肠与结肠阶段的生物可给性(BA)由公式(1)计算[19]:
式中,C1为胃、小肠和结肠阶段中重金属Cr浓度(mg·L−1),V为各阶段消化液的总体积(L),C2为蔬菜样品总Cr浓度(mg·kg−1),M为蔬菜样品称取质量(kg).
-
为了评估蔬菜中Cr的膳食健康风险,采用美国环境保护署开发的健康风险评估模型(USEPA),并根据蔬菜中重金属Cr的生物可给性对评估计算方法进行修正,基于每日摄入量(EDI)和危害商指数(HQ),对不同暴露人群(成人和儿童)的健康风险进行评估. 同时,考虑到评估过程中所选用的暴露参数的区域特性和人种特征会造成评估结果具有不确定性,因此,引入蒙特卡罗(Monte Carlo)随机模拟,即将风险评估过程与概率模型相联系,以降低风险评估结果的不确定性[20].
蔬菜中Cr的估计每日摄入量(EDI)由公式(2)计算[21-22]:
式中,Ci为蔬菜中重金属Cr含量(mg·kg−1);BA为蔬菜中Cr的生物可给性(%);IR为蔬菜人均摄入量(kg);EF为暴露频率(d·a−1);ED为暴露周期(a);BW为人群平均体重(kg);AT为平均暴露时间(d),具体参数取值见表1.
蔬菜中Cr的危害商指数(HQ)由公式(3)计算[21, 23]:
式中,EDI取值为公式(2)中计算结果,RfD为蔬菜中Cr每日参考剂量3.0×10−3 mg·kg−1[24],当HQ>1时,认为食用该蔬菜存在健康风险. 由于熟蔬菜更能反映人的真实饮食摄入情况,因而选用熟蔬菜中Cr的含量与生物可给性来进行健康风险评估.
-
本研究使用Microsoft Excel 2010和SPSS20(IBM)对数据进行统计分析;图制作由Origin2017和SigmaPlot(16.0)软件完成. 为了最大限度地减少健康风险评估过程中暴露参数的不确定性,运用Crystal Ball(11.1,Oracle)软件中的蒙特卡罗模拟进行迭代计算.
-
从铅锌矿区采集到的4种蔬菜样品中Cr含量(干重)如表2所示,表现为小白菜(13.86±7.33)mg·kg−1>芥菜(9.84±1.79)mg·kg−1>甘蓝(9.53±1.60)mg·kg−1>辣椒(5.28±2.48)mg·kg−1,不同种类蔬菜间Cr的吸收积累量存在差异(P<0.05),其中叶类蔬菜表现出较强的富集能力,这与前人的研究结果相似[30]. 这可能是归因于叶片不仅是叶菜类蔬菜重要的可食部分,同时也是植物器官中具有较为吸收敏感的一个器官,叶面的蒸腾作用能有效促进蔬菜根部对土壤Cr的吸收并转运至地上部分[4];同时叶类蔬菜对大气颗粒物中Cr具有较强的捕获率,来源于大气降尘和土壤扬尘中的这类元素沉降到叶片表面后,部分会通过气孔进入叶菜中富集[31]. 通过对比国家食品污染物限量标准(GB2762—2017)发现,4种蔬菜Cr含量均远超国家限定阈值(0.5 mg·kg−1). 此外,蔬菜采用高温水煮方式进行处理后的Cr含量范围为(1.93±0.76)—(5.07±0.61)mg·kg−1,与生蔬菜中Cr含量对比分析发现,高温水煮方式可以显著降低各类蔬菜Cr的平均含量水平(P < 0.05). 其中,辣椒和小白菜经高温水煮后的平均下降比例较高,约为63.44%,其次为芥菜和甘蓝,平均下降比例分别约为60.90%和54.98%. Zhuang等[32]和Xu等[15]的研究也发现,高温水煮方式对蔬菜中重金属的含量水平影响较大,其主要原因是由于高温水煮过程可以使植物组织软化,导致水煮过程中Cr可以从蔬菜中析出至烹饪水中,从而降低了蔬菜中Cr含量.
-
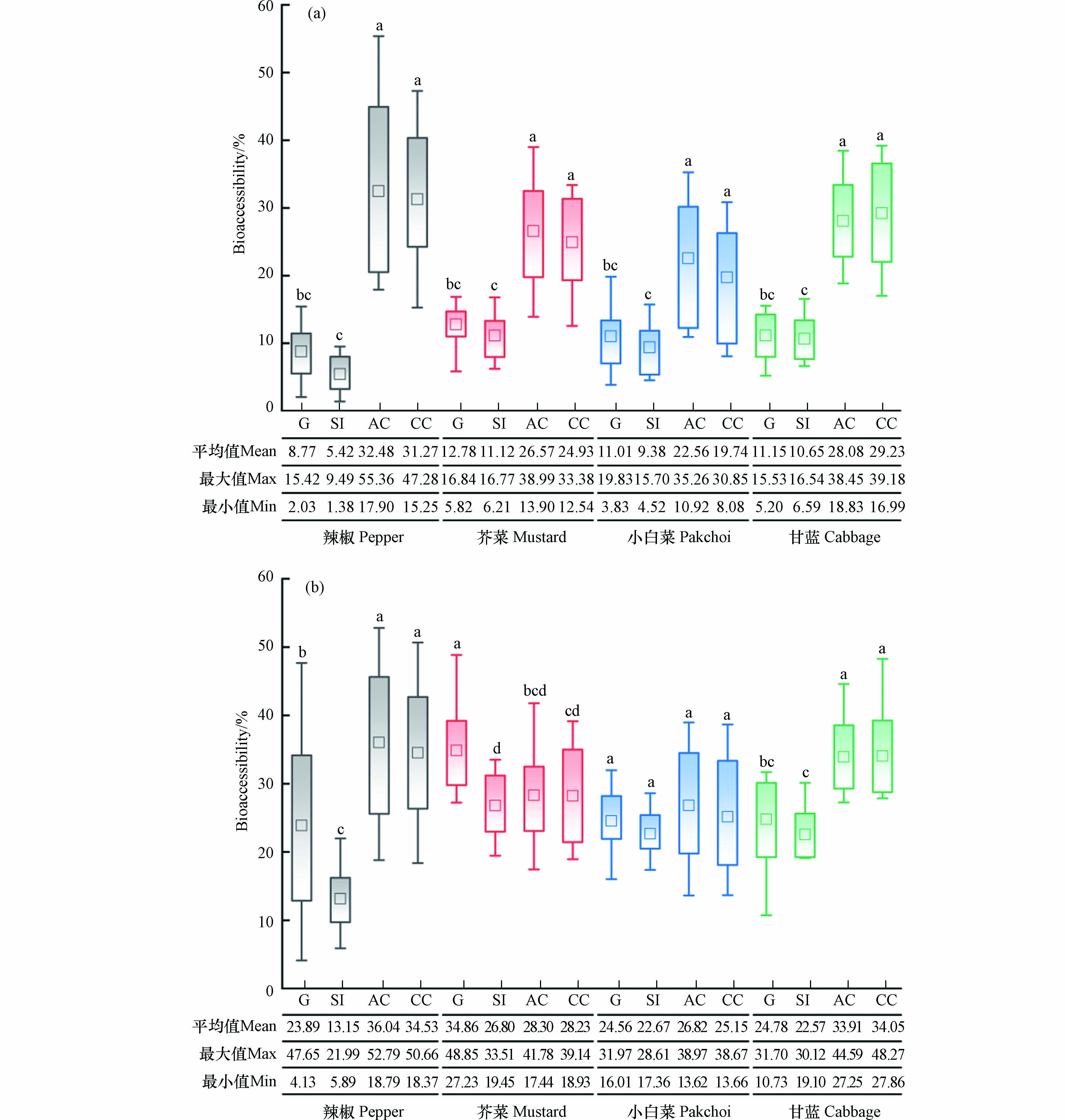
通过PBET法结合SHIME模型对4种蔬菜中重金属Cr的生物可给性进行研究发现(图1),胃阶段中生蔬菜中Cr生物可给性的平均值(8.77%±4.07%)—(12.78%±2.56%)略高于小肠阶段(5.42%±2.60%)—(11.12%±3.23%). 这一结果与前人的研究结果相似[5]. 多项研究结果表明,胃肠的消化环境特征是影响重金属生物可给性的重要因素,胃液的酸性环境有助于提高重金属Cr的溶解性[33-34];但从胃转移至小肠阶段,添加的NaHCO3使消化液pH值从1.5升至7.0,同时伴随CO2- 3的增加,导致肠液中溶解的Cr容易在弱碱性环境中发生共沉淀或再吸附反应,降低了Cr的移动性,Cr生物可给性出现降低的趋势[35]. 同时,胃肠消化液中的消化酶对重金属的生物可给性也具有重要影响[36]. 胃蛋白酶作为一种蛋白质能够释放H+,使其表面带负电荷后能够通过络合作用与胃液中带正电荷的金属Cr离子形成复合物,这有助于Cr保持溶解状态[37],特别是胃液的酸性环境有利于提高胃蛋白酶活性,在一定程度上能够促进胃液中络合物的形成,从而可以进一步提高蔬菜中Cr的溶解度及其生物可给性;胰蛋白酶也是一种蛋白质,对Cr离子的作用与胃蛋白酶相同[38],但肠液的弱碱性环境并不利于金属离子络合物的形成,且依靠电荷吸附在胃蛋白酶表面的Cr离子进入肠液后容易发生水解生成沉淀,从而使其溶解度和生物可给性降低. 通过与生蔬菜中Cr的生物可给性对比发现,经高温水煮后蔬菜中Cr在胃阶段(23.89%±13.35%—34.86%±6.44%)和小肠阶段(13.15%±4.23%—26.80%±4.88%)生物可给性的平均值整体高于生蔬菜,平均升高比例范围分别约为55.17%—63.33%和52.81%—58.78%,这可能归因于高温水煮过程会造成植物细胞壁膨胀、果胶溶解/解聚和细胞分离,导致食物基质遭到破坏[39-40],因此可以进一步促进蔬菜中Cr在胃肠消化过程的溶出释放,提高其生物可给性.
-
由小肠至结肠阶段,生熟两种处理蔬菜样品中Cr生物可给性的平均值范围分别为成人:(22.56%±9.23%)—(36.04%±11.45%);儿童:(19.74%±8.26%)—(34.53%±10.82%)(图1),分别是小肠阶段的1.10—6.00倍和1.05—5.77倍,结果表明结肠阶段中肠道微生物作用下显著增加了蔬菜中重金属Cr的生物可给性(P<0.05),且蔬菜高温处理后也增加了结肠阶段Cr的生物可给性(6.11%—21.51%). 对比小肠阶段,结肠中含有丰富的肠道微生物,这些肠道微生物具有较强的代谢能力,食糜中未被胃肠道消化酶所消化完全的蛋白质和碳水化合物可被肠道微生物所代谢利用[41]. 因此,肠道微生物在代谢蔬菜残渣中有机质时,也可将吸附在残渣中的重金属Cr释放进入消化液中,增加结肠阶段中Cr的生物可给性,从而导致结肠阶段高于小肠阶段. 此外,蔬菜中重金属Cr在消化阶段中的生物可给性还取决于不同的化学形态[42],且受到人体肠道微生物的影响. 例如人体肠道中的硫酸盐还原菌(SRB)、铁还原菌(IRB)和乳酸杆菌等可诱导Cr(Ⅵ)还原为Cr(Ⅲ)形式[43-45]. Cr(Ⅲ)能够以溶解态在酸性溶液中稳定存在[46],而肠道微生物在代谢过程中所产生的代谢产物(如短链脂肪酸、支链脂肪酸和氨类等)会影响人体肠道环境,其中短链脂肪酸(SCAFs)主要包括乙酸、丙酸、丁酸等有机酸可降低肠道的pH值[41,47],从而可能促使Cr(Ⅲ)的溶解,导致结肠阶段中Cr的生物可给性高于小肠阶段. 对比两名自愿者(成人和儿童)结肠阶段中Cr的生物可给性发现,在大多数蔬菜样品中,成人结肠阶段Cr的生物可给性高于儿童,这可能是由于宿主肠道微生物的代谢差异所致. Yin等[48]研究也报道了两个健康的不同宿主(成人和儿童)肠道微生物对土壤中As的代谢具有差异. 综上,结肠阶段中肠道微生物可增加蔬菜中重金属Cr的生物可给性,且受宿主肠道微生物代谢差异的影响.
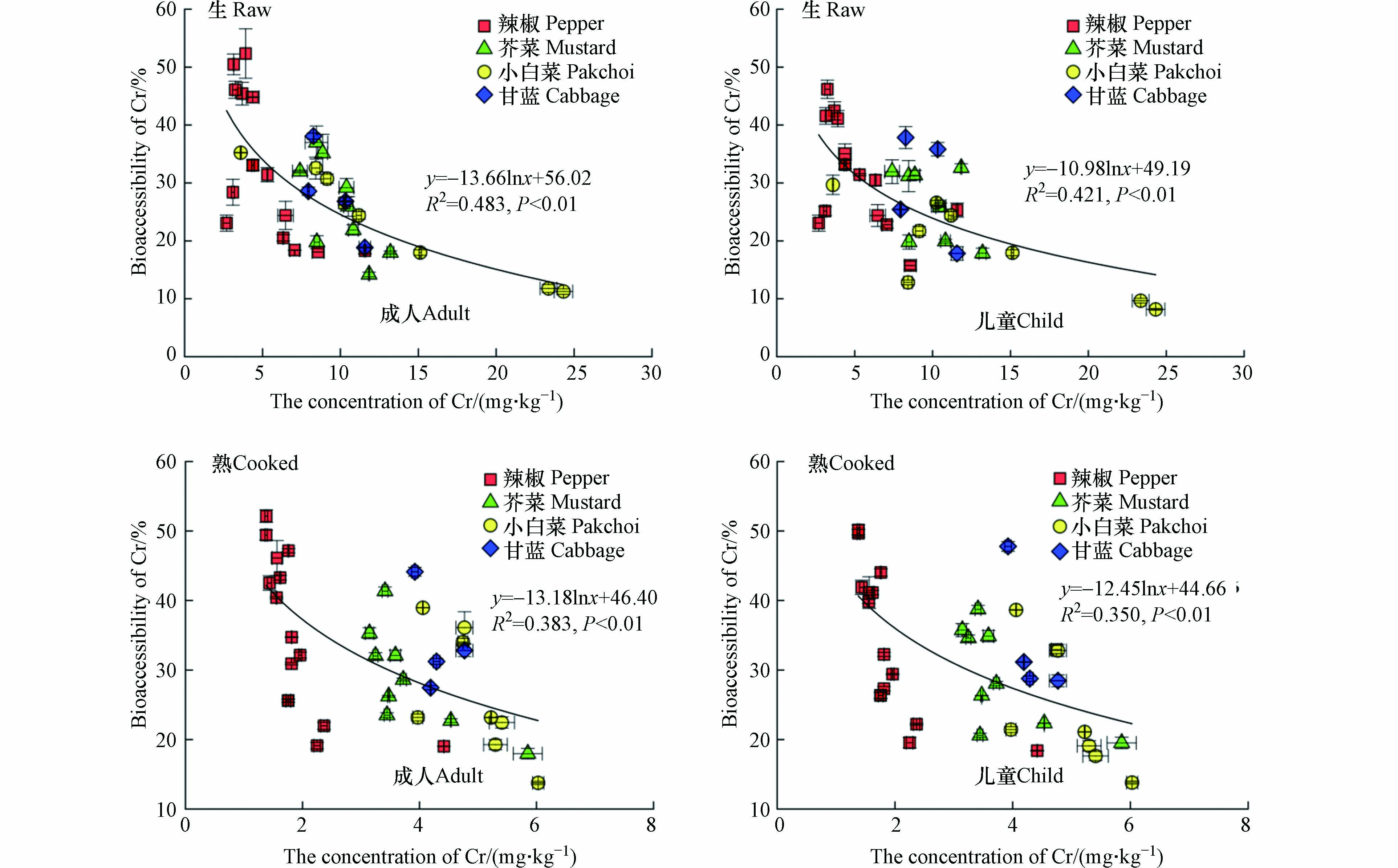
食物基质中的污染物水平被认为是影响生物可给性的主要因素之一,前人研究中报道了大量食物中重金属全量与胃和小肠阶段生物可给性之间的剂量比例关系[23,49],但未考虑到结肠阶段中肠道微生物对于重金属生物可给性的影响. 本研究发现,生熟不同处理蔬菜样品中重金属Cr含量与结肠阶段生物可给性呈显著负相关(P<0.01),相关系数R2:0.383—0.483,即高Cr含量蔬菜在结肠阶段未表现出较高的生物可给性(图2),这可能是由于结肠阶段肠道微生物的作用影响了蔬菜中重金属Cr的溶出释放. Yin等[12]研究结果也展示了土壤Cr含量与结肠阶段(成人和儿童)生物可给性呈负相关. 同样,Wang等[50]使用小鼠模型发现小白菜、空心菜和苋菜中重金属镉全量与生物有效性之间存在显著的负相关关系(R2=0.430,P<0.05). 表明在考虑结肠阶段中肠道微生物作用下高Cr含量蔬菜不会表现出较高的生物可给性.
-
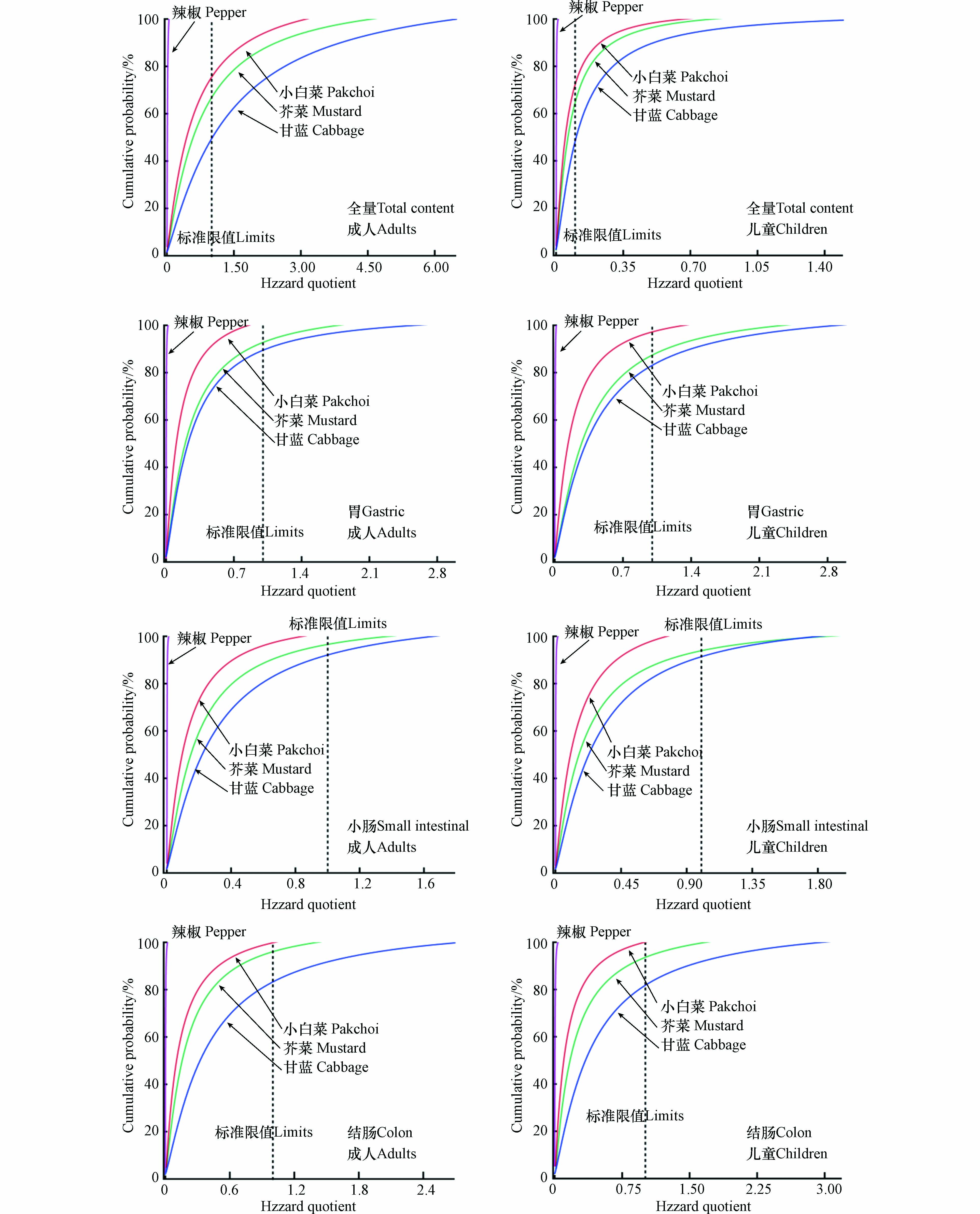
利用USEPA的风险评估模型,并借助蒙特卡罗模型迭代模拟降低风险评估模型中各参数的不确定性[20],以计算出基于熟蔬菜中Cr总量和3个消化阶段中Cr生物可给性的HQ和HQ的累积概率,结果见表3、图3. 当只考虑4种蔬菜中重金属Cr总量而不考虑生物可给性时,成人的HQ指数范围为(1.17×10−2±2.68×10−7)—(1.45×100±3.95×10−5),儿童为(1.25×10−2±5.50×10−6)—(2.27×100±1.21×10−3). 结果表明,除甘蓝外其余3种蔬菜的平均HQ值均未超过安全阈值1,但根据累计概率发现所有HQ值中分别约有36.19%(成人)和37.83%(儿童)超过了1,且儿童的危险商指数整体高于成人. 当用生物可给性修正风险评估结果后,基于成人和儿童胃阶段(23.89%±13.35%)—(34.86%±6.44%)、小肠阶段(13.15%±4.23%)—(26.80%±4.88%)与结肠阶段(25.15%±9.48%)—(36.04%±11.45%)4种熟蔬菜的平均生物可给性(图1b)计算出的平均HQ值(1.53×10−3±3.90×10−8)—(5.19×10−1±1.52×10−5)整体降低至安全阈值内,但累计概率统计发现所有HQ值中仍有3.96%—16.68%(成人)和2.81%—18.37%(儿童)超过了风险阈值1,表明生物可给性修正后可降低蔬菜中Cr的健康风险,但食用所引起的健康风险仍然不可忽视. 此外,对比小肠和结肠阶段的数据发现,基于结肠阶段计算的暴露风险指数和累计概率较高,相比小肠阶段提高了约6.17%—62.12%. 这一结果与本文中蔬菜Cr在消化阶段中生物可性的变化规律相同,即结肠阶段大于小肠阶段. 尹乃毅等[51]研究也得到类似的结果,他们发现土壤中重金属镉(Cd)、铬(Cr)和镍(Ni)在结肠阶段的健康风险高于小肠阶段. 表明结肠阶段中肠道微生物可增加蔬菜中Cr的生物可给性和提高人体健康风险. 综上,在蔬菜Cr暴露所引起的人体健康风险中,人体肠道微生物对Cr的代谢起着重要作用.
-
(1)从贵州省某铅锌矿区采集的4种蔬菜样品,在生和熟不同条件下样品中Cr含量均超过了我国国家食品卫生标准中的标准限值(GB 2762—2017,0.5 mg·kg−1),虽然煮熟处理显著降低了蔬菜样品中Cr含量(P<0.05),但却明显增加了各消化阶段中Cr的生物可给性.
(2)结肠阶段,4种蔬菜中重金属Cr的生物可给性高于胃和小肠阶段,且两名宿主(成人和儿童)结肠阶段中Cr的生物可给性具有差异. 表明肠道微生物可促进蔬菜中Cr的溶出释放,且受宿主肠道微生物代谢差异的影响.
(3)人体健康风险评价中,对比了各消化阶段的膳食暴露风险发现,基于结肠阶段生物可给性计算的健康风险较高. 表明在蔬菜Cr暴露所引起的人体健康风险中,肠道微生物对Cr的代谢起着重要作用. 因此,在未来开展人体健康风险评估时,考虑食物中重金属在结肠阶段生物可给性的健康风险评估结果将可能更加科学和准确.
肠道微生物对蔬菜中铬生物可给性的影响及人体健康风险评价
Effect of gut microbiota on bioaccessibility of chromium in vegetables and human health risk assessment
-
摘要: 为更加全面、准确评估蔬菜中重金属铬(Cr)生物可给性及对人体健康风险的影响,本文利用生物原理提取法(physiologically based extraction test,PBET)联合微生物生态系统(simulator of human intestinal microbial ecosystem,SHIME)模拟实验,系统分析了贵州某铅锌矿区4种常见蔬菜(辣椒、芥菜、小白菜和甘蓝)在不同食用条件(生和熟)下Cr的含量变化,探究在肠道微生物影响下蔬菜Cr在不同消化吸收阶段(胃、小肠和结肠)中生物可给性差异,并对比了各消化阶段的膳食暴露风险. 结果表明,4种蔬菜样品中Cr的含量(干重)表现为小白菜(13.86±7.33)mg·kg−1>芥菜(9.84±1.79)mg·kg−1>甘蓝(9.53±1.60)mg·kg−1>辣椒(5.28±2.48)mg·kg−1;虽煮熟处理可显著降低4种蔬菜样品中的Cr含量(降低范围54.98%—63.44%,P<0.05),但生熟蔬菜样品中Cr含量仍超过国家食品卫生标准中的标准限值(GB 2762—2017:0.5 mg∙kg−1). 此外,研究发现结肠阶段中Cr的生物可给性最高,分别为成人:(22.56%±9.23%)—(36.04%±11.45%);儿童:(19.74%±8.26%)—(34.53%±10.82%),分别是小肠阶段的1.10—6.00 倍和1.05—5.77 倍,且蔬菜高温处理后增加了结肠阶段Cr的生物可给性(6.11%—21.51%). 对比各消化阶段的危害商指数(HQ)发现,基于结肠阶段生物可给性计算的HQ累计概率较高,相比小肠阶段提高了约6.17%—62.12%,表明结肠阶段中肠道微生物作用下可增加蔬菜中Cr的生物可给性和提高人体健康风险. 因此,在未来开展人体健康风险评估时,需综合评估不同食用条件下食物中重金属在结肠阶段中生物可给性的健康风险,以期为我国膳食重金属暴露的人体健康风险评估提供更多科学参考.Abstract: To more comprehensively and accurately assess the bioaccessibility of Chromium (Cr) in vegetables and its human health risk, the PBET method combined with SHIME model was used to determine the vegetable concentration of Cr in different treatments (raw and cooked) and the effects of gut microbiota on Cr bioaccessibility. Four common vegetables (pepper, mustard, pakchoi and cabbage) were collected from Lead-Zinc mining region in Guizhou Province. The results showed that the contents (dry weight) of Cr in the four varieties of vegetables were pakchoi (13.86±7.33) mg·kg−1 >mustard (9.84±1.79) mg·kg−1 >cabbage (9.53±1.60) mg·kg−1 >pepper (5.28±2.48) mg·kg−1. Although the cooking process could significantly reduce the contents of Cr in vegetables (range of 54.98%—63.44%, P<0.05), the contents of Cr both in raw and cooked vegetable samples were still exceeds limit standard of Cr stipulated in the National Food Hygiene Standard (GB 2762—2017: 0.5 mg·kg−1). In addition, the study found that the highest bioaccessibility of Cr in the colon phase, adult: (22.56% ± 9.23%)—(36.04% ± 11.45%); child: (19.74% ± 8.26%)—(34.53% ± 10.82%), which was 1.10—6.00 times and 1.05—5.77 times higher than those in the small intestine phase, respectively. And the cooking process significantly increased the bioaccessibility of Cr in the colon phase (6.11%—21.51%). Compared with the hazard quotient (HQ) in different digestion phases, the cumulative probability of HQ calculated based on the bioaccessibility of Cr in the colon phase showed higher health risk, which was about 6.17%—62.12% higher than in the small intestinal phase. The result indicated that the gut microbiota in the colon phase could increase the bioaccessibility of Cr in vegetables and improve human health risk. Therefore, it was necessary to comprehensively evaluate the bioaccessibility of heavy metals in foods in the colon phase under different edible conditions in future research, to provide more scientific reference for human health risk assessment of dietary heavy metal exposure.
-
Key words:
- vegetables /
- chromium /
- bioaccessibility /
- gut microbiota /
- health risk.
-
硝酸盐(NO3−)是一种在水体中广泛存在的无机污染物。近几十年来,由于人类的工业和农业活动,水体中的NO3−浓度不断升高,已逐渐成为世界各国密切关注的问题[1-2]。我国30个省71条主要河流样品的硝酸盐数据表明,这些样品中有约7.83%的硝酸盐含量超过45 mg·L−1[1]。一般而言,污水厂二沉池出水中的硝酸盐浓度在10 mg·L−1,约占我国污水厂一级A标准中规定出水总氮浓度要求(15 mg·L−1)的67%左右,而一些水环境敏感地区(如滇池、太湖等)的污水厂出水总氮浓度的内控指标低至5 mg·L−1(以氮计),硝态氮去除对污水厂总氮控制造成极大压力。污水厂出水中硝酸盐氮浓度过高导致的总氮超标是城镇污水处理厂中最常见的问题之一[3]。目前,污水中的NO3−主要通过生物反硝化去除,需要外加碳源、延长反硝化停留时间或增大回流比强化脱氮,能耗和药耗高。化学还原法具有还原效率高、操作简单、成本低等优点,如果能利用化学还原方法强化NO3−脱除,将有助于降低厌氧生物脱氮负荷,进一步提高污水中的总氮去除效率。
近年来,基于二氧化碳阴离子自由基 (CO2·−)的高级还原技术逐步引起人们关注。CO2·−分子结构中存在一个未成对的电子,具有很强的还原特性,还原电位E0(CO2/CO2·−)为−1.9 V[4]。CO2·−作为电子供体,通过电子传递、亲核攻击等途径还原降解污染物[5-6]。研究表明,CO2·−能有效去除水中卤代有机物、全氟化合物、溴酸盐和六价铬等污染物[7-10]。近期研究发现,基于CO2·−的高级还原技术能将NO3−定向还原为气态氮,并且水中共存的溶解性有机物对CO2·−驱动的NO3−还原去除影响很小,仅在有机物浓度30 mg·L−1时的NO3−还原去除略有下降[11-12]。但是,目前基于污水体系的CO2·−的高级还原研究较少,其实际应用仍存在诸多挑战[11]。
紫外消毒已在污水处理中广泛应用,截至2016年我国已建成使用的5 000多座城镇污水厂中超过50%采用了中压紫外消毒。硝酸盐在波长250~400 nm具有吸光性,特别是在302 nm处具有特征吸收峰,摩尔吸光系数为7.2 L·(mol·cm)−1。同时,甲酸盐(HCOO−)可作为一种新型绿色碳源被投入到二级生物反应池中促进生物脱氮过程[13-14],未被生物利用的甲酸盐则进入紫外消毒阶段。污水中NO3−在紫外辐照下光解产生含氮活性物种(RNS)(式(1))和羟基自由基(HO·)(式(2))[15],HO·与甲酸盐或者甲酸反应生成CO2·−(式(3)~(4))。CO2·−的还原性可以促进进一步硝酸盐还原(式(5))。
NO−3hv→NO⋅2+O⋅− (1) O⋅−+H2O↔HO⋅+HO−pKa=11.9 (2) HO⋅+HCOO−→H2O+CO⋅−2k″HO⋅−HCOO−=3.2×109L⋅(mol⋅s)−1 (3) HO⋅+HCOOH→H++H2O+CO⋅−2k″HO⋅−HCOOH=1.3×108L⋅(mol⋅s)−1 (4) CO⋅−2+NO−3→products (5) 基于此,本研究将围绕污水处理的紫外消毒环节构建中压紫外/甲酸盐反应体系,解析此体系中的NO3−还原效果和关键影响因素;围绕硝酸盐光解以及CO2·−与硝酸盐的反应活性揭示硝酸盐降解原理,并进一步探索硝酸盐强化脱除方法。研究结果将深化CO2·−高级还原体系的基础数据和反应机制,为污水的深度脱氮提供新思路。
1. 材料及方法
1.1 实验药剂
硝酸钠、甲酸钠、甲酸均为分析纯,采购于上海安谱璀世有限公司;过氧化氢为纯度30%,购于广州牌药剂公司。95%~98%浓硫酸(H2SO4)为分析纯,购于福晨(天津)化学试剂有限公司;氢氧化钠(NaOH)为分析纯,购于国药集团化学试剂有限公司。所有试剂在使用前均未经过纯化或其他处理步骤,实验用水均来自Merck-Millipore系统产生的超纯水。
1.2 实验装置及实验过程
硝酸盐的光还原降解实验在平行光紫外辐照装置中进行,由中压紫外光源(500 W,PLS-LAM500,Beijing PerfectLight)、反应石英皿和磁力搅拌装置组成。中压汞灯在225~425 nm的发射光谱,主波长在320 nm和360 nm,与污水处理厂的中压汞灯消毒的特征波长一致,所有实验未采用滤光手段控制光源辐照的波长。由于中压汞灯的特征波长的复杂性,本研究以254 nm处的紫外光强作为指示光强,其值为0.5 mW·cm−2。在研究紫外光强影响时,通过改变中压紫外灯与水样的间距,将光强划分为低、中、高3个水平,其在254 nm处的光强值分别为0.04、0.5和1.3 mW·cm−2。
实验水样中初始NO3−浓度为0.1 mmol·L−1,甲酸或者甲酸盐为0~10 mmol·L−1。此实验中初始硝酸盐浓度低于实际污水中的硝酸盐存在水平,其原因是为了与实验中较低光强的紫外光源相匹配。除研究pH影响的实验外,水样初始pH为7.0±0.2,不另加pH缓冲溶液。在研究pH影响时,水样中加入10 mmol·L−1磷酸盐缓冲溶液,采用硫酸或氢氧化钠调节初始pH。石英皿置于紫外装置下,以加入甲酸/甲酸盐(0~10 mmol·L−1)为反应起始点,反应过程中采用磁力搅拌器搅拌,确保溶液和试剂混合均匀。在一定时间间隔下取样测定硝酸盐及产物浓度。
1.3 CO2·−与硝酸盐的二级反应速率常数测定
采用激光闪光光解技术测定CO2·−与硝酸盐的二级反应速率常数。激光闪光光解系统(LKS80,Applied Photophysics Ltd., United Kingdom)的激发波长为266 nm,激光束截面为0.5 cm2,脉冲激光能量为(25±5) mJ,脉冲持续时间为4~6 ns;使用150 W氙灯作为检测光源。实验水样中含H2O2(50 mmol·L−1),HCOO−(500 mmol·L−1),竞争参考物甲基紫精(MV2+)浓度为100 μmol·L−1,向溶液中投加不同浓度的硝酸盐(0~100 mmol·L−1)。激光实验前,水样由氩气吹脱30 min (溶解氧<0.2 mg·L−1)并调节pH为7.0。测定MV2+反应产物MV·+在600 nm特征吸收峰信号。
1.4 分析与检测方法
硝酸盐、亚硝酸盐、甲酸盐浓度利用离子色谱仪(ThermoFisher, ICS-600)进行测定。离子色谱仪的主要组成部分为:RFC-30淋洗液自动发生器,ChromeLeon色谱工作站,Dionex IonPacTM AG-19保护柱(4 mm×50 mm),Dionex IonPacTM AS-19分析柱(4 mm×250 mm)。KOH淋洗液由RFC-30淋洗液自动发生器在线自动产生,流速为1.0 mL·min−1。样品检测前需经过0.22 μm滤膜过滤。采用纳氏试剂分光光度法测定氨氮的浓度。pH采用pH计(S400,Mettler Toledo)测定。反应溶液所受的中压汞灯辐照光强通过UV254光强测定仪UVC-254A(Lutron electronic enterprise Co; LTD)初步量化,以确定辐照光强的相对大小。
2. 结果与讨论
2.1 MPUV/HCOO−体系对硝酸盐的降解效能
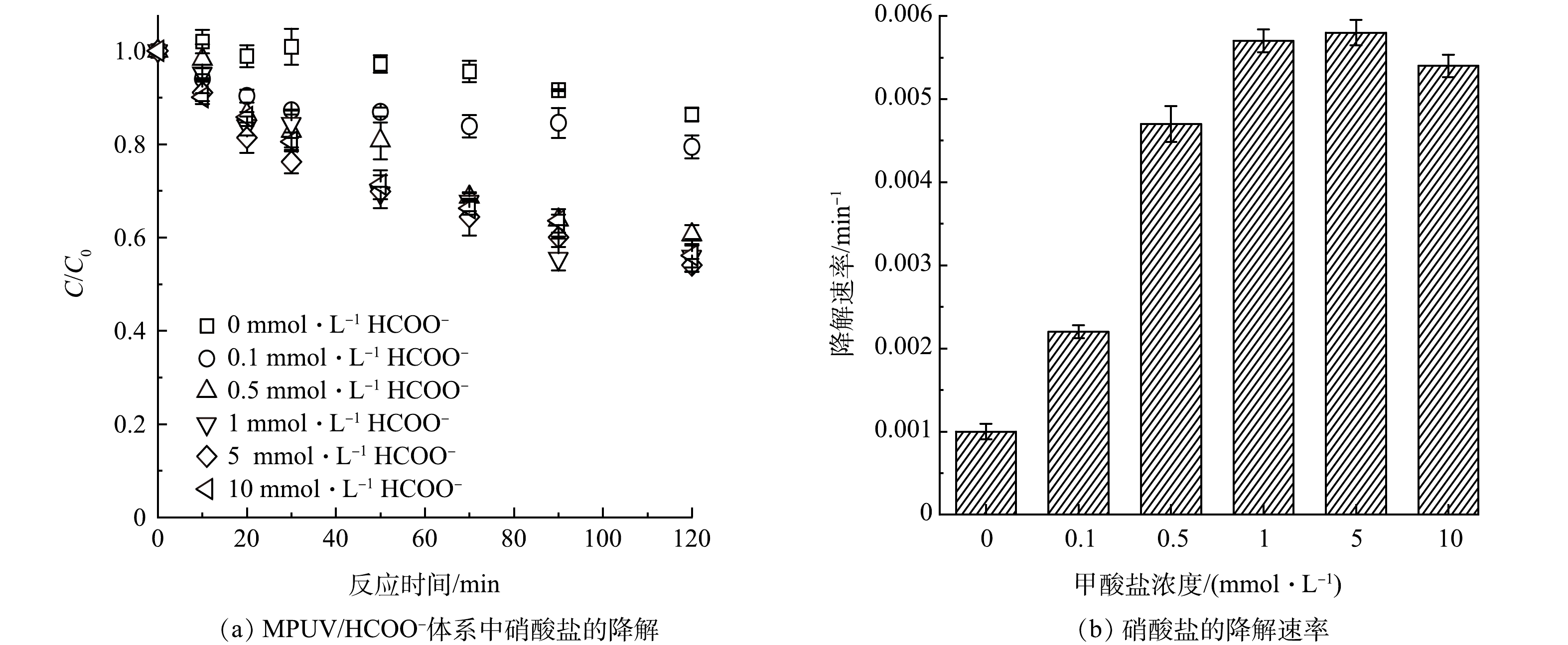
1)甲酸盐浓度对硝酸盐光还原降解的影响。图1所示为不同HCOO−投加量(0~10 mmol·L−1)条件下硝酸盐的光还原降解速率。当体系中不存在甲酸盐时,紫外辐照120分钟后硝酸盐去除率仅为13.7%,NO3−拟一级降解速率kobs为1.0×10−3 min−1。HCOO−投加量为0.1、0.5、1、5和10 mmol·L−1时,反应120min的硝酸盐去除率分别为20.6%、39.4%、44.1%、45.9%和43.9%。由此可见,甲酸盐在0.1~1 mmol·L−1条件下,硝酸盐降解速率kobs由2.41×10−3 min−1逐步增大到5.98×10−3 min−1。随着甲酸浓度继续增大(1~10 mmol·L−1),NO3−的一级降解速率趋于稳定。可见,硝酸盐紫外光解产生的HO·可以促进甲酸盐转化为CO2·−,进而强化硝酸盐的还原降解(式(1)~式(4))。然而,受到硝酸盐光解的HO·生成量限制,高浓度的甲酸盐(大于1 mmol·L−1)不能形成更多的CO2·−,使得硝酸盐不能进一步降解。因此,硝酸盐和甲酸盐的摩尔浓度比在1:5~1:10的促进效果较好。
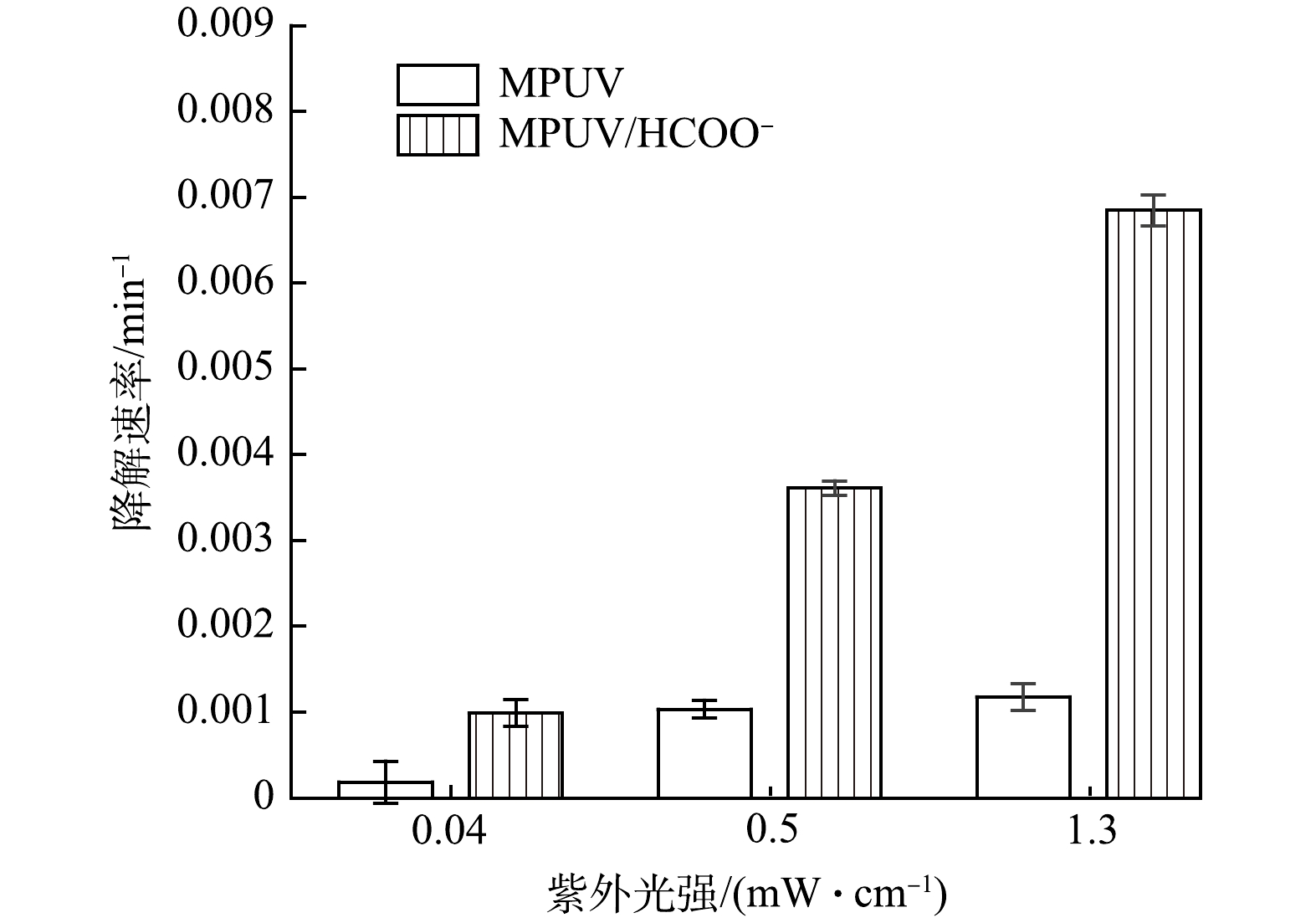
2)紫外光强对硝酸盐光还原降解的影响。图2为紫外光强对MPUV/HCOO−体系降解硝酸盐的影响结果。将甲酸盐投加浓度设为2 mmol·L−1,以防止高光强导致的甲酸盐快速消耗而影响实验结果。通过调节紫外灯与水样间距选定3种光强,其在254 nm处指示的低、中、高光强分别为0.04、0.5和1.3 mW·cm−2。单独紫外光解(无甲酸盐)时,硝酸盐降解速率随着紫外光强增大而缓慢增大,在低、中、高光强条件下,kobs分别为1.8×10−4、1.0×10−3 和1.2×10−3 min−1,表明紫外光强增大能促进硝酸盐光解。当2 mmol·L−1甲酸盐存在时,MPUV/HCOO−体系中硝酸盐降解速率随紫外光强的增加而显著增加,kobs分别为9.9×10−4、3.6×10−3和6.9×10−3 min−1。MPUV/HCOO−体系对紫外强化的依赖性更高,说明增加紫外光强不仅促进了硝酸盐分解,也增大了硝酸盐光解介导的CO2·−生成,从2个途径加速了硝酸盐的光还原降解。因此,紫外光强是重要的硝酸盐光还原影响因素。
3)pH对硝酸盐光还原降解的影响。图3反映了pH对MPUV/HCOO−体系降解硝酸盐的影响。甲酸盐投加量设为0.5 mmol·L−1,以规避硝酸盐去除能力上限造成的干扰。溶液pH的增大可促进硝酸盐光降解。在pH为2.5、5.0和8.0条件下,MPUV/HCOO−体系中硝酸盐降解的kobs分别1.5×10−3、2.6×10−3和3.6×10−3 min−1。可见,碱性条件更利于MPUV/HCOO−体系的硝酸盐降解。溶液的pH对硝酸盐和甲酸盐的存在形态以及还原性自由基与硝酸盐的反应速率均存在影响。对于甲酸的存在形态,HCOOH/HCOO−的pKa为3.8,pH=2.5时的kobs最低,说明HCOO−形式更助于硝酸盐的光还原降解。对于硝态氮,硝酸盐光敏化生成一种吸光度极高的中间体过氧亚硝酸盐(ONOO−),ONOOH/ONOO−的pKa为6.6,pH=8.0时的kobs高于pH=5.0,意味着以ONOO−形式存在更助于硝酸盐的光解,并促进自由基还原降解途径。以上多重因素叠加下,MPUV/HCOO−体系以去质子化形式存在的CO2·−、HCOO−和ONOO−相比于其质子化形式的HCO2·、HCOOH和HOONO,更有助于硝酸盐的降解,碱性条件下MPUV/HCOO−体系降解硝酸盐效果更佳。
2.2 MPUV/HCOO−体系对硝酸盐的降解机制
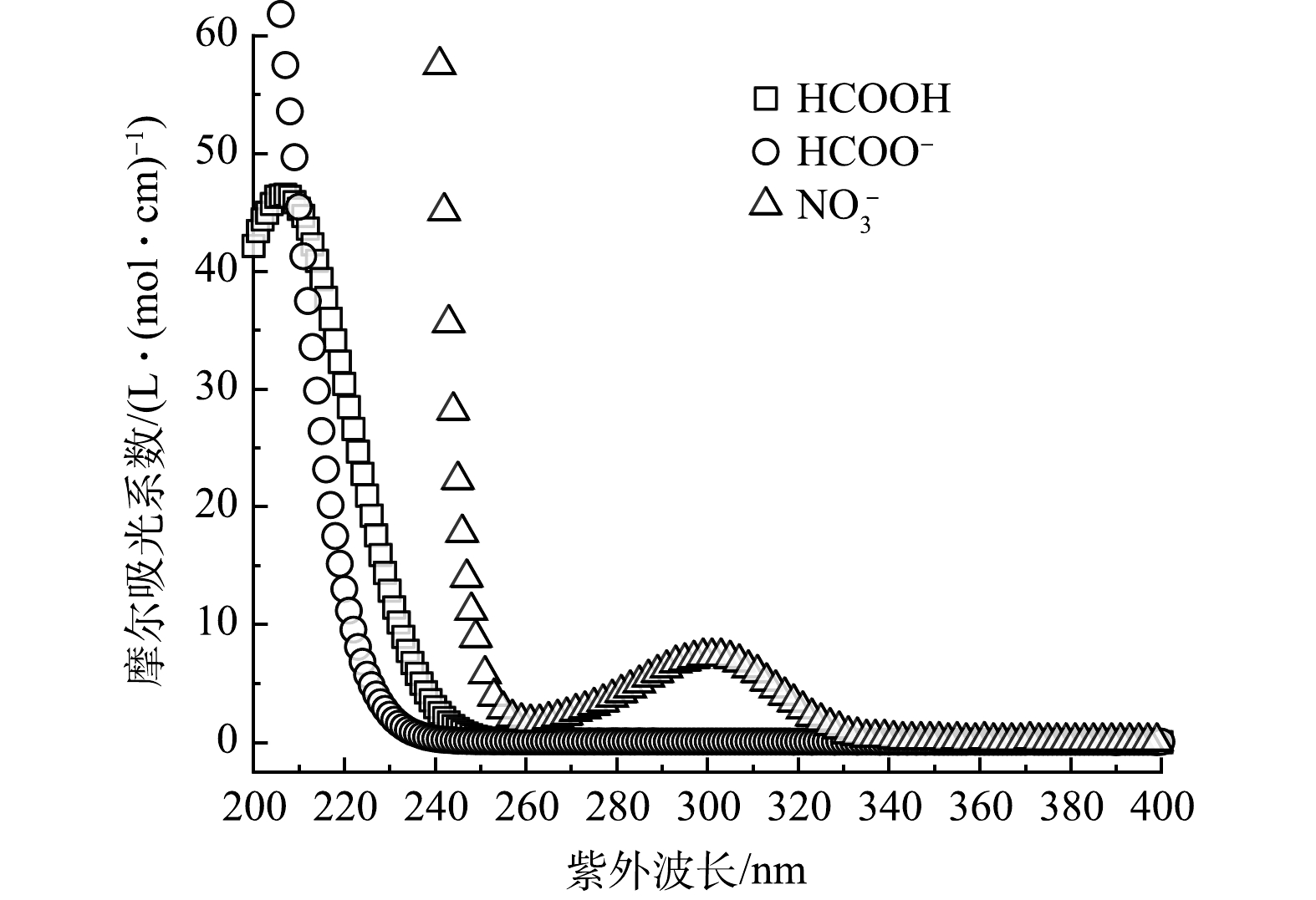
1)硝酸盐的紫外光解。图4为硝酸盐、甲酸和甲酸盐的紫外吸收光谱。可见硝酸盐在300 nm处存在特征吸收峰,而甲酸和甲酸盐不能直接光解。辐照波长(λ)>280 nm条件下,硝酸盐光解主要产生自由基(·NO2和HO·)(式(1)和式(2))。在波长<280 nm的区间内,NO3−异构化形成过氧亚硝酸盐(ONOO−)。并且,·NO2和HO·也可以重组形成过氧亚硝酸(HOONO)通过去质子化生成ONOO− [16]。过氧亚硝酸(盐)被认为是硝酸盐光还原降解过程中的重要活性中间体[17],ONOO−在300 nm处存在强吸收峰,摩尔吸光系数约为1 600 L·(mol·cm)−1。但ONOO−的反应活性极高,在pH<6.6时迅速异构化为硝酸盐(ONOOH→NO3−+H+, k=0.9 s−1),而在pH>6.6时分解为一氧化氮和超氧阴离子(ONOO−→·NO+O2·−, k=0.023 s−1)[18],导致ONOO−仅为一种瞬态反应活性中间体,可能参与了硝酸盐降解,但反应过程难以捕捉。
2)CO2·−与硝酸盐的二级反应动力学常数。基于激光闪光光解技术,建立了以MV2+为竞争参考物的CO2·−与硝酸盐二级反应速率常数(
k″CO⋅−2−NO−3 k″CO⋅−2−NO−3 k″CO⋅−2−NO−3 CO⋅−2+MV2+→CO2+MV⋅+kS1=6.4×109L⋅(mol⋅s)−1 (6) CO⋅−2+NO−3→products (7) CO⋅−2+H2O2→CO2+HO⋅+OH−kS2=7.0×105L⋅(mol⋅s)−1 (8) Y=AA0=k″CO⋅−2−NO−3[NO−3]+kS1[MV2+]+kS2⋅[H2O2]kS1[MV2+]+kS2[H2O2]=k″CO⋅−2−NO−3[NO−3]kS1[MV2+]+kS2[H2O2]+1=k″CO⋅−2−NO−3⋅X+1 (9) 式中
:A0 kS1 kS2 图5(a)反映了在不同NO3−浓度(0~100 mmol·L−1)下,0~2 500 ns内竞争物与CO2·−反应生成的中间体自由基MV·+在600 nm的吸光信号值。可见,随着硝酸盐浓度的逐渐升高,MV·+的信号逐渐减弱,证明了一部分CO2·−被硝酸盐反应消耗,使MV·+生成速率降低。图5(b)为基于式(9)的线性拟合方程,通过拟合曲线得到斜率值
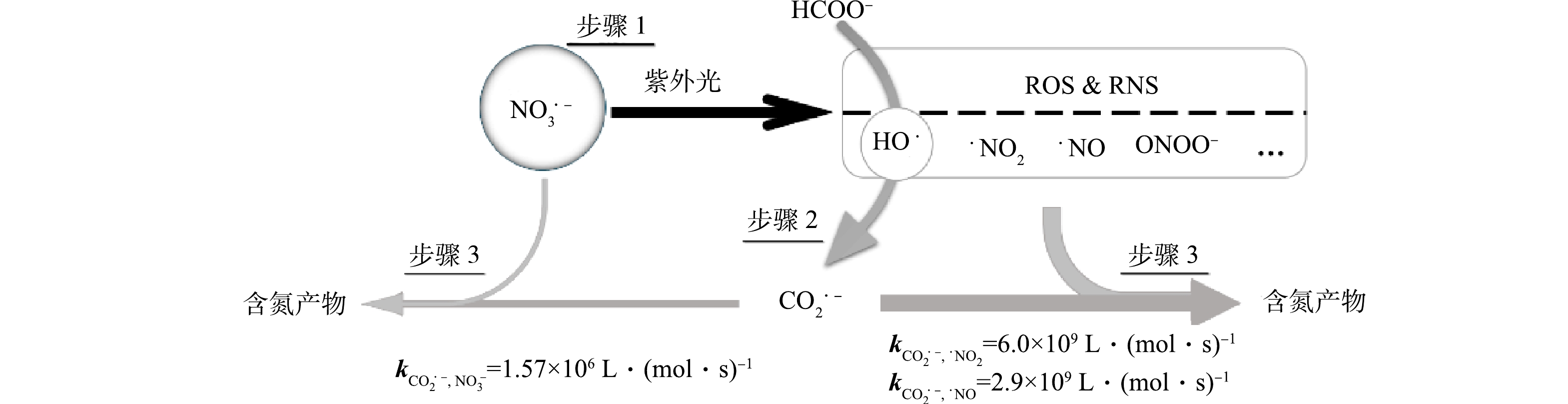
k''CO·−2−NO−3 CO⋅−2+⋅NO2→NO−2+CO2k″CO⋅−2−⋅NO2=6.0×109L⋅(mol⋅s)−1 (10) CO⋅−2+⋅NO→NOCO−2k″CO⋅−2−⋅NO=2.9×109L⋅(mol⋅s)−1 (11) CO⋅−2+NH2OH−+H2O→NH3+2OH−+CO2k″CO⋅−2−NH2OH−=1.0×109L⋅(mol⋅s)−1 (12) 3)还原产物及反应机理分析。进一步分析了MPUV/HCOO−体系降解硝酸盐的主要产物。由图6可见,在初始HCOO−浓度0.5 mmol·L−1时,在pH为2.5、5.0、8.0的条件下,硝酸盐减少量与亚硝酸盐增加量的比值接近1:1,并且未检测到氨氮的生成,说明MPUV/HCOO−体系主要将硝酸盐转化为亚硝酸盐。由二级反应速率常数可知,如果体系中CO2·−充足,可以实现亚硝酸盐的进一步还原。图7为MPUV/HCOO−体系促进硝酸盐的降解过程:步骤1,紫外光解硝酸盐生成含氮活性物种和羟基自由基;步骤2,羟基自由基与甲酸盐反应生成CO2·−;步骤3,CO2·−促进了活性氮中间体还原(主要过程)且其可与硝酸盐直接发生还原反应(次要过程)。因此,硝酸盐的紫外光解及CO2·−主导的高级还原过程共同促进了硝酸盐还原降解。
2.3 H2O2对MPUV/HCOO−体系降解硝酸盐的强化作用
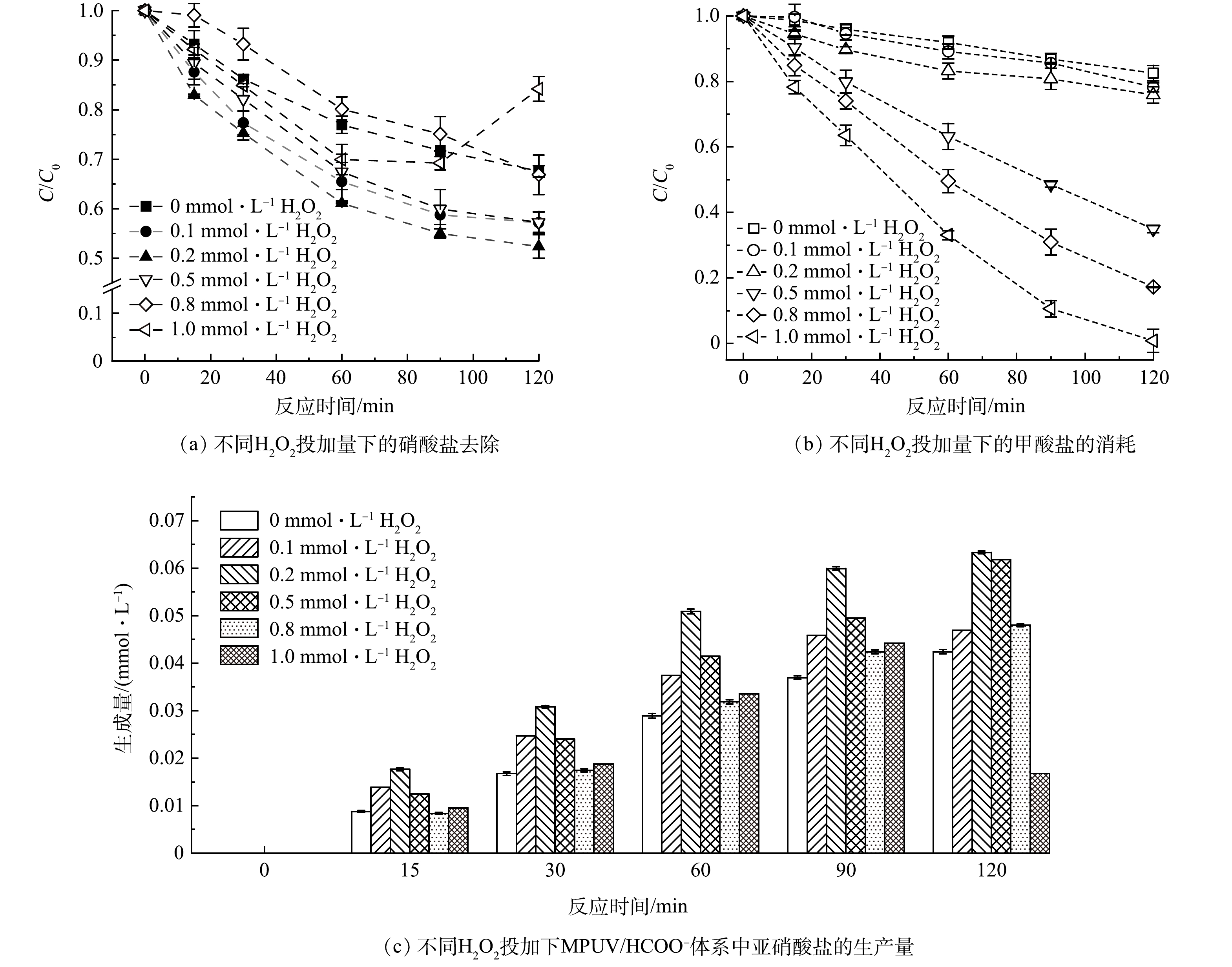
由于硝酸盐光解的HO·生成量较低,限制了CO2·−的转化生成和硝酸盐的CO2·−还原路径。因此,向MPUV/HCOO−体系中投加过氧化氢(H2O2)提升HO·生成量,从而进一步强化生成CO2·−以促进硝酸盐的脱除。如图8(a)所示,在HCOO−浓度为2 mmol·L−1、光照反应120 min后,H2O2投量为0、0.1、0.2、0.5、0.8和1 mmol·L−1时的硝酸盐去除率分别为32.5%、42.8%、47.7%、42.8%、33.2%和15.8%,在H2O2投量为0.2 mmol·L−1时硝酸盐去除率最高,而H2O2投量增大到1 mmol·L−1反而抑制了硝酸盐降解。相比不加H2O2的MPUV/HCOO−体系降解硝酸盐(k=3.6×10−3 min−1),投加0.2 mmol·L−1的H2O2使硝酸盐降解速率(k=6.2×10−3 min−1)提高了1.7倍。在H2O2投加量为0.2 mmol·L−1时,通过紫外光解H2O2促进HO·产生,进而提升了体系中CO2·−浓度水平并强化了硝酸盐还原。由图8(b)可见,甲酸盐消耗量随着H2O2投量的增大而增大,证明了在中压汞灯/甲酸盐体系中补充H2O2会促进甲酸盐向CO2·−的转化。并且,当体系中存在剩余甲酸盐时可以通过适量投加H2O2淬灭,如1 mmol·L−1 H2O2反应120 min后的甲酸盐基本全部去除。图8(c)显示了H2O2投加量为0.2 mmol·L−1时反应120 min后的硝酸盐向亚硝酸盐的转化率为63.3%且无氨氮被检出,说明36.7%的硝态氮转化为气态氮(如氧化亚氮、氮气等)排出,与CHEN等[21]的研究结果一致。而紫外光解过量的H2O2 (1.0 mmol·L−1)形成了以HO·主导的氧化体系,导致硝酸盐光解产生的活性氮中间体被重新氧化为硝态氮,使硝酸盐浓度在90~120 min反而增加(图8(a))。在本研究紫外条件下,甲酸盐和H2O2的摩尔比为10:1时,硝酸盐还原降解效果最佳。
3. 结论
1)相较于单独中压紫外(MPUV)光解,MPUV/HCOO−体系促进了硝酸盐的还原降解,CO2·−对促进硝酸盐降解具有重要的贡献。
2)在MPUV/HCOO−体系中,甲酸盐与硝酸盐摩尔浓度比在5:1~10:1条件下的硝酸盐去除效果最好。增大紫外光强和弱碱性(pH=8.0)环境能可有效促进硝酸盐的还原降解。
3)利用激光闪光光解技术量化了CO2·−与NO3−和NO2−反应的二级反应速率常数,分别为1.57×106 L·(mol·s)−1和9.12×107 L·(mol·s)−1。虽然CO2·−与硝酸盐反应活性较低,但可以促进硝酸盐光解产生的活性氮中间体的还原,中压紫外光解和CO2·−的介导还原共同促进了硝酸盐还原效能。
4)在MPUV/HCOO−体系中投加H2O2能进一步促进硝酸盐降解,投加0.2 mmol·L−1的H2O2使硝酸盐降解速率提高了1.7倍,并将36.7%的硝态氮转化为气态氮排出。
-
表 1 风险暴露计算参数及其分布类型
Table 1. Parameters used in the risk calculation and distribution pattern
变量 Variable 定义 Define 参考值 Reference value 分布类型 Distribution pattern 数据来源 Data sources 成人 (> 18岁) 儿童 (2—18岁) IR/ (g·d−1) 摄入率Uptake rate 辣椒 Pepper 2.88 1.44 对数正态分布 Yang等[25];吴永宁等[26] 芥菜 Mustard 200.00 100.00 小白菜Pakchoi 111.60 55.80 甘蓝Cabbage 300.0 150.00 ED/a 暴露周期Exposure cycle 0—24 0—6 均匀分布 环境保护部[27-28] BW/kg 体重质量Weight quality 0.00, 60.61, 3.19 9.52, 29.14, 28.97 对数正态分布 AT/d 平均暴露时间Mean exposure time ED×365 单点分布 EF/(d·a−1) 暴露频率Exposure frequency 180, 350, 365 三角分布 Huang等[29] C/(mg·kg−1) 重金属含量Heavy metal content 本研究 对数正态分布 本研究 BA/% 生物可给性Bioaccessibility 本研究 表 2 4种蔬菜中重金属Cr含量(干重)
Table 2. Total concentrations of Cr in the four vegetables (dry weight)
蔬菜名称 Vegetable name 含量 /(mg·kg−1)Contents 生Raw 熟Cooked 辣椒 Pepper 5.28±2.48Ad 1.93±0.76Bd 芥菜 Mustard 9.84±1.79Ab 3.84±0.79Bc 小白菜 Pakchoi 13.86±7.33Aa 5.07±0.61Ba 甘蓝 Cabbage 9.53±1.60Ac 4.29±0.33Bb 标准限值 Limits 0.5 mg·kg−1 (GB 2762−2017) 注: 表中数据为样本均值±标准偏差; 不同大写字母表示蔬菜样品Cr含量在生熟处理间差异性显著(P<0.05), 不同小写字母表示不同蔬菜样品Cr含量差异性显著(P<0.05). Note: The data were expressed as sample mean±standard deviation; Different capital letters indicate that the significant difference of contents of Cr between the raw and cooked treatments of vegetable samples (P<0.05); Different lowercase letters that indicate significant differences of contents of Cr between the different vegetables (P<0.05). 表 3 蔬菜中重金属Cr的健康风险评估
Table 3. Health risk assessment of Cr in vegetables
蔬菜名称 Vegetable name HQ 总量 Total contents (胃) 生物可给性 (Gastric) Bioaccessibility (小肠) 生物可给性 (Small intestine) Bioaccessibility (结肠) 生物可给性 (Colon) Bioaccessibility 成人Adults 儿童Children 成人Adults 儿童Children 成人Adults 儿童Children 成人Adults 儿童Children 辣椒Pepper 1.17×10−2±2.68×10−7 1.25×10−2±5.50×10−6 2.83×10−3±8.74×10−8 3.85×10−3±8.09×10−8 1.53×10−3±3.90×10−8 1.89×10−3±1.45×10−7 2.25×10−3±7.90×10−8 4.99×10−3±5.31×10−7 芥菜Mustard 8.79×10−1±2.51×10−5 9.93×10−1±6.66×10−5 3.01×10−1±8.98×10−6 4.09×10−1±1.19×10−5 2.28×10−1±6.76×10−6 2.82×10−1±1.70×10−5 2.43×10−1±7.37×10−6 3.08×10−1±2.87×10−5 小白菜Pakchoi 6.48×10−1±1.80×10−5 7.89×10−1±6.83×10−5 1.57×10−1±4.52×10−6 2.10×10−1±6.26×10−6 1.44×10−1±4.13×10−6 1.51×10−1±4.27×10−6 1.64×10−1±5.11×10−6 1.69×10−1±5.28×10−6 甘蓝Cabbage 1.45×100±3.93×10−5 2.27×100±1.21×10−3 3.59×10−1±1.12×10−5 4.90×10−1±1.45×10−5 3.28×10−1±9.39×10−6 3.38×10−1±9.59×10−6 4.85×10−1±1.40×10−6 5.19×10−1±1.52×10−5 注: 图中数据为样本均值±标准偏差. Note: The data in the figure are the ± standard deviation of the sample mean. -
[1] YANG Z H, ZHANG X M, JIANG Z, et al. Reductive materials for remediation of hexavalent chromium contaminated soil - A review [J]. Science of the Total Environment, 2021, 773: 145654. doi: 10.1016/j.scitotenv.2021.145654 [2] 骆和东, 吴雨然, 姜艳芳. 我国食品中铬污染现状及健康风险 [J]. 中国食品卫生杂志, 2015, 27(6): 717-721. LUO H D, WU Y R, JIANG Y F. The contamination situation of chromium in food and risk assessment in China [J]. Chinese Journal of Food Hygiene, 2015, 27(6): 717-721(in Chinese).
[3] COETZEE J J, BANSAL N, CHIRWA E M N. Chromium in environment, its toxic effect from chromite-mining and ferrochrome industries, and its possible bioremediation [J]. Exposure and Health, 2020, 12(1): 51-62. doi: 10.1007/s12403-018-0284-z [4] CHEN H L, AROCENA J M, LI J B, et al. Assessments of chromium (and other metals) in vegetables and potential bio-accumulations in humans living in areas affected by tannery wastes [J]. Chemosphere, 2014, 112: 412-419. doi: 10.1016/j.chemosphere.2014.04.091 [5] WANG P F, YIN N Y, CAI X L, et al. Variability of chromium bioaccessibility and speciation in vegetables: The influence of in vitro methods, gut microbiota and vegetable species [J]. Food Chemistry, 2019, 277: 347-352. doi: 10.1016/j.foodchem.2018.10.120 [6] 李君, 柳晓琳, 吴鹏. 铬污染地区蔬菜铬含量状况分析 [J]. 现代预防医学, 2014, 41(21): 3876-3878. LI J, LIU X L, WU P. Assessment of content of Cr on vegetables from polluted area [J]. Modern Preventive Medicine, 2014, 41(21): 3876-3878(in Chinese).
[7] 徐笠, 陆安祥, 王纪华, 等. 食物中重金属的生物可给性和生物有效性的研究方法和应用进展 [J]. 生态毒理学报, 2017, 12(1): 89-97. XU L, LU A X, WANG J H, et al. Research methods and applications of bioaccessibility and bioavailability of heavy metals in food [J]. Asian Journal of Ecotoxicology, 2017, 12(1): 89-97(in Chinese).
[8] 郑顺安, 韩允垒, 刘代丽, 等. 土壤汞生物可给性的影响因素研究: 基于体外模拟(in vitro)法 [J]. 环境化学, 2019, 38(12): 2665-2671. ZHENG S A, HAN Y L, LIU D L, et al. Influence of soil properties on the Hg bioaccessibility in polluted soils investigated by in vitro digestion approachaes [J]. Environmental Chemistry, 2019, 38(12): 2665-2671(in Chinese).
[9] IN J G, FOULKE-ABEL J, ESTES M K, et al. Human mini-guts: New insights into intestinal physiology and host–pathogen interactions [J]. Nature Reviews Gastroenterology & Hepatology, 2016, 13(11): 633-642. [10] 高渊, 陆晨希, 袁鹏, 等. 肠道微生物与环境健康关系的研究进展与展望 [J]. 环境化学, 2021, 40(1): 1-10. doi: 10.1002/etc.4760 GAO Y, LU C X, YUAN P, et al. Research progress and prospect of relationship between gut microbiota and environmental health [J]. Environmental Chemistry, 2021, 40(1): 1-10(in Chinese). doi: 10.1002/etc.4760
[11] van de WIELE T, BOON N, POSSEMIERS S, et al. Prebiotic effects of chicory inulin in the simulator of the human intestinal microbial ecosystem [J]. FEMS Microbiology Ecology, 2004, 51(1): 143-153. doi: 10.1016/j.femsec.2004.07.014 [12] YIN N Y, ZHAO Y L, WANG P F, et al. Effect of gut microbiota on in vitro bioaccessibility of heavy metals and human health risk assessment from ingestion of contaminated soils [J]. Environmental Pollution, 2021, 279: 116943. doi: 10.1016/j.envpol.2021.116943 [13] 耿紫琪, 王鹏飞, 付雅祺, 等. 稻米中铬的生物可给性及其对人体的健康风险评价 [J]. 生态毒理学报, 2020, 15(6): 205-211. GENG Z Q, WANG P F, FU Y Q, et al. Bioaccessibility of chromium in rice and its human health risk assessment [J]. Asian Journal of Ecotoxicology, 2020, 15(6): 205-211(in Chinese).
[14] INTAWONGSE M, DEAN J R. Use of the physiologically-based extraction test to assess the oral bioaccessibility of metals in vegetable plants grown in contaminated soil [J]. Environmental Pollution, 2008, 152(1): 60-72. doi: 10.1016/j.envpol.2007.05.022 [15] XU F F, SONG J, LI Y Q, et al. Bioaccessibility and bioavailability adjusted dietary exposure of cadmium for local residents from a high-level environmental cadmium region [J]. Journal of Hazardous Materials, 2021, 420: 126550. doi: 10.1016/j.jhazmat.2021.126550 [16] 侯胜男, 汤琳, 郑娜, 等. 典型锌冶金区蔬菜重金属的生物可给性及健康风险评价 [J]. 环境科学学报, 2018, 38(1): 343-349. HOU S N, TANG L, ZHENG N, et al. Bioaccessibility and health risk assessment of heavy metals in vegetables of typical mining area [J]. Acta Scientiae Circumstantiae, 2018, 38(1): 343-349(in Chinese).
[17] CHI H F, ZHANG Y C, WILLIAMS P N, et al. In vitro model to assess arsenic bioaccessibility and speciation in cooked shrimp [J]. Journal of Agricultural and Food Chemistry, 2018, 66(18): 4710-4715. doi: 10.1021/acs.jafc.7b06149 [18] YIN N Y, ZHANG Z N, CAI X L, et al. In vitro method to assess soil arsenic metabolism by human gut microbiota: Arsenic speciation and distribution [J]. Environmental Science & Technology, 2015, 49(17): 10675-10681. [19] 崔岩山, 陈晓晨. 土壤中镉的生物可给性及其对人体的健康风险评估 [J]. 环境科学, 2010, 31(2): 403-408. CUI Y S, CHEN X C. Bioaccessibility of soil cadmium and its health risk assessment [J]. Environmental Science, 2010, 31(2): 403-408(in Chinese).
[20] 方晴, 冼萍, 蒙政成. 基于蒙特卡罗模拟的农用地土壤健康风险评价 [J]. 环境工程, 2021, 39(2): 147-152. FANG Q, XIAN P, MENG Z C. Environmental health risk assessment model of agricultural land based on Monte Carlo simulation and its application [J]. Environmental Engineering, 2021, 39(2): 147-152(in Chinese).
[21] 徐笠, 刘洋, 杨婧婧, 等. 利用体外实验方法评估稻米中镉的生物可给性和健康风险 [J]. 生态毒理学报, 2017, 12(5): 219-226. XU L, LIU Y, YANG J J, et al. Bioaccessiblity of cadmium in rice and its health risk assessment by in vitro method [J]. Asian Journal of Ecotoxicology, 2017, 12(5): 219-226(in Chinese).
[22] 林承奇, 蔡宇豪, 胡恭任, 等. 闽西南土壤-水稻系统重金属生物可给性及健康风险 [J]. 环境科学, 2021, 42(1): 359-367. LIN C Q, CAI Y H, HU G R, et al. Bioaccessibility and health risks of the heavy metals in soil-rice system of southwest Fujian Province [J]. Environmental Science, 2021, 42(1): 359-367(in Chinese).
[23] LUO Y, DUAN Z B, WU Y G. Risk assessment for oral bioaccessibility of lead and cadmium in the potato growing in smelter-impacted soil [J]. Bulletin of Environmental Contamination and Toxicology, 2021, 106(2): 363-369. doi: 10.1007/s00128-020-03099-y [24] MNISI R L, NDIBEWU P P, MAFU L D, et al. Bioaccessibility and risk assessment of essential and non-essential elements in vegetables commonly consumed in Swaziland [J]. Ecotoxicology and Environmental Safety, 2017, 144: 396-401. doi: 10.1016/j.ecoenv.2017.06.033 [25] YANG Y G, LI F L, BI X Y, et al. Lead, zinc, and cadmium in vegetable/crops in a zinc smelting region and its potential human toxicity [J]. Bulletin of Environmental Contamination and Toxicology, 2011, 87(5): 586. doi: 10.1007/s00128-011-0388-7 [26] 吴永宁, 赵云峰, 李敬光. 第五次中国总膳食研究[M]. 北京: 科学出版社, 2018: 64-112. WU Y N, ZHAO Y F, LI J G. The fifth China total diet study[M]. Beijing: Science Press, 2018: 64-112(in Chinese).
[27] 环境保护部. 中国人群暴露参数手册(成人卷)[M]. 北京: 中国环境出版社, 2013: 219-258. Ministry of Environmental Protection of the People's Republic of China. Exposure factors handbook of Chinese population (Adult Volume)[M]. Beijing: China Environmental Science Press, 2013: 219-258(in Chinese).
[28] 环境保护部. 中国人群暴露参数手册(儿童卷)[M]. 北京: 中国环境出版社, 2013: 55-81. Ministry of Environmental Protection of the People's Republic of China. Exposure factors handbook of Chinese population (Child Volume)[M]. Beijing: China Environmental Science Press, 2013: 55-81(in Chinese).
[29] HUANG J L, WU Y Y, SUN J X, et al. Health risk assessment of heavy metal(loid)s in park soils of the largest megacity in China by using Monte Carlo simulation coupled with Positive matrix factorization model [J]. Journal of Hazardous Materials, 2021, 415: 125629. doi: 10.1016/j.jhazmat.2021.125629 [30] 陈志良, 黄玲, 周存宇, 等. 广州市蔬菜中重金属污染特征研究与评价 [J]. 环境科学, 2017, 38(1): 389-398. doi: 10.21608/jes.2017.19594 CHEN Z L, HUANG L, ZHOU C Y, et al. Characteristics and evaluation of heavy metal pollution in vegetables in Guangzhou [J]. Environmental Science, 2017, 38(1): 389-398(in Chinese). doi: 10.21608/jes.2017.19594
[31] 查燕, 汤婕, 牛天新. 叶菜类蔬菜对重金属富集特征研究 [J]. 江西农业大学学报, 2022, 44(3): 773-782. ZHA Y, TANG J, NIU T X. Study on enrichment characteristics of heavy metals in leafy vegetables [J]. Acta Agriculturae Universitatis Jiangxiensis, 2022, 44(3): 773-782(in Chinese).
[32] ZHUANG P, ZHANG C S, LI Y W, et al. Assessment of influences of cooking on cadmium and arsenic bioaccessibility in rice, using an in vitro physiologically-based extraction test [J]. Food Chemistry, 2016, 213: 206-214. doi: 10.1016/j.foodchem.2016.06.066 [33] HU J L, WU F Y, WU S C, et al. Bioaccessibility, dietary exposure and human risk assessment of heavy metals from market vegetables in Hong Kong revealed with an in vitro gastrointestinal model [J]. Chemosphere, 2013, 91(4): 455-461. doi: 10.1016/j.chemosphere.2012.11.066 [34] OOMEN A G, HACK A, MINEKUS M, et al. Comparison of five in vitro digestion models to study the bioaccessibility of soil contaminants [J]. Environmental Science & Technology, 2002, 36(15): 3326-3334. [35] JOBBÁGY M, BLESA M A, REGAZZONI A E. Homogeneous precipitation of layered Ni(II)-Cr(III) double hydroxides [J]. Journal of Colloid and Interface Science, 2007, 309(1): 72-77. doi: 10.1016/j.jcis.2007.01.010 [36] LI Y, ZHANG M K. A comparison of physiologically based extraction test (PBET) and single-extraction methods for release of Cu, Zn, and Pb from mildly acidic and alkali soils [J]. Environmental Science and Pollution Research, 2013, 20(5): 3140-3148. doi: 10.1007/s11356-012-1234-0 [37] FRAGA C G. Relevance, essentiality and toxicity of trace elements in human health [J]. Molecular Aspects of Medicine, 2005, 26(4/5): 235-244. [38] 郭莹莹, 张弛, 段志鹏, 等. 基于形态与in vitro方法的铬污染土壤生物可给性研究 [J]. 环境科学学报, 2022, 42(10): 430-440. GUO Y Y, ZHANG C, DUAN Z P, et al. Bioaccessibility of chromium contaminated soil based on speciation and in vitro methods [J]. Acta Scientiae Circumstantiae, 2022, 42(10): 430-440(in Chinese).
[39] PELFRÊNE A, WATERLOT C, GUERIN A, et al. Use of an in vitro digestion method to estimate human bioaccessibility of Cd in vegetables grown in smelter-impacted soils: The influence of cooking [J]. Environmental Geochemistry and Health, 2015, 37(4): 767-778. doi: 10.1007/s10653-015-9684-1 [40] 徐飞飞, 李跃麒, 林珺, 等. 典型环境高镉地区常见蔬菜中镉的生物可及性及健康风险评估 [J]. 食品工业科技, 2022, 43(14): 293-300. XU F F, LI Y Q, LIN J, et al. Bioaccessibility of cadmium in common vegetables in typical environmental high cadmium region and the health risk assessment [J]. Science and Technology of Food Industry, 2022, 43(14): 293-300(in Chinese).
[41] 孙长豹, 刘志静, 刘飞, 等. 食物成分对肠道菌群结构的影响 [J]. 食品研究与开发, 2018, 39(9): 178-182. SUN C B, LIU Z J, LIU F, et al. Impact of dietary components on gut microbiota structure [J]. Food Research and Development, 2018, 39(9): 178-182(in Chinese).
[42] KAZI T G, MEMON N S, SHAIKH S A, et al. Speciation and separation of trace quantities of hexavalent and trivalent chromium species in aqueous extract of wild leafy vegetables using multistep pre-concentration method [J]. Food Analytical Methods, 2019, 12(9): 1964-1972. doi: 10.1007/s12161-019-01544-1 [43] YOUNAN S, SAKITA G Z, ALBUQUERQUE T R, et al. Chromium(Ⅵ) bioremediation by probiotics [J]. Journal of the Science of Food and Agriculture, 2016, 96(12): 3977-3982. doi: 10.1002/jsfa.7725 [44] DUAN H, YU L L, TIAN F W, et al. Gut microbiota: A target for heavy metal toxicity and a probiotic protective strategy [J]. Science of the Total Environment, 2020, 742: 140429. doi: 10.1016/j.scitotenv.2020.140429 [45] PENG L, LIU Y W, GAO S H, et al. Assessing chromate reduction by dissimilatory iron reducing bacteria using mathematical modeling [J]. Chemosphere, 2015, 139: 334-339. doi: 10.1016/j.chemosphere.2015.06.090 [46] ERTANI A, MIETTO A, BORIN M, et al. Chromium in agricultural soils and crops: A review [J]. Water, Air, & Soil Pollution, 2017, 228(5): 190. [47] SALONEN A, de VOS W M. Impact of diet on human intestinal microbiota and health [J]. Annual Review of Food Science and Technology, 2014, 5: 239-262. doi: 10.1146/annurev-food-030212-182554 [48] YIN N Y, DU H L, WANG P F, et al. Interindividual variability of soil arsenic metabolism by human gut microbiota using SHIME model [J]. Chemosphere, 2017, 184: 460-466. doi: 10.1016/j.chemosphere.2017.06.018 [49] DUAN Z B, ZHENG Y, LUO Y, et al. Evaluation of cadmium transfer from soil to the human body through maize consumption in a cadmium anomaly area of southwestern China [J]. Environmental Toxicology and Chemistry, 2021, 40(10): 2923-2934. doi: 10.1002/etc.5171 [50] WANG M Y, LI M Y, NING H, et al. Cadmium oral bioavailability is affected by calcium and phytate contents in food: Evidence from leafy vegetables in mice [J]. Journal of Hazardous Materials, 2022, 424: 127373. doi: 10.1016/j.jhazmat.2021.127373 [51] 尹乃毅, 都慧丽, 张震南, 等. 应用SHIME模型研究肠道微生物对土壤中镉、铬、镍生物可给性的影响 [J]. 环境科学, 2016, 37(6): 2353-2358. YIN N Y, DU H L, ZHANG Z N, et al. Effects of human gut microbiota on bioaccessibility of soil Cd, Cr and Ni using SHIME model [J]. Environmental Science, 2016, 37(6): 2353-2358(in Chinese).
期刊类型引用(0)
其他类型引用(2)
-






 下载:
下载: