-
重金属是指相对密度大于4.5 g·cm−3的金属,其对环境的污染主要来自化石燃料的燃烧、城市垃圾、污水灌溉、农药化肥的施用、矿山开采、金属冶炼等[1-2]。《全国土壤污染状况调查公报》表明,我国土壤环境质量状况不容乐观,土壤重金属污染突出[3]。其中,镉、汞、砷、铜、铅、铬、锌、镍的点位超标率分别为7%、1.6%、2.7%、2.1%、1.5%、1.1%、0.9%、4.8%。土壤重金属含量超标势必会影响粮食安全[4],威胁经济的可持续发展。重金属毒性高、具有不可降解性[5],会沿食物链传递并最后进入人体,威胁人群健康[6]。因此,迫切需要具有成本效益、高效、环保的重金属污染土壤治理方法。
生物炭 (Biochar, BC) 是含碳生物质在相对低温、有限氧或无氧环境下热解产生的材料[7],具有比表面积大、含氧官能团丰富、孔隙结构发达、导电性良好等特点[8-9]。作为一种土壤改良剂[10],生物炭既能改善土壤性质,影响土壤微生物的丰度和活性[11-12],又能降低包括重金属在内的多种污染物的生物有效性,近年来常用于治理土壤中的有机和无机污染物[13-16]。随着研究的深入,生物炭的一些弊端逐渐显现。如生物炭对重金属的吸附效率比活性炭低[17],表面官能团种类少、粒径大、力学性能较差等限制了其实际应用[18-19],对于一些阴离子污染物 (如砷等) 的固定达不到预期效果[20-21]。因此,一些学者通过表面改性来优化生物炭的性能,提高钝化重金属效果。
由铁基化合物或混合物和生物炭制备的铁改性生物炭,在重金属污染治理上受到了国内外学者的广泛关注[22-26],比表面积大、机械性能强、能提供铁离子、官能团丰富等优点使得其对重金属表现出优异的吸附和固定能力[27-31]。生物炭可有效地降低纳米铁颗粒的团聚性和对土壤微生态的毒性[32-33],同时具备组分材料的优异特性,在重金属的固定化方面发挥出了两者的协同性能。本文综述铁改性生物炭的制备方法,以及该材料对重金属污染土壤修复的研究进展,并梳理制备及修复过程中的主要影响因素,从而阐明铁改性生物炭对重金属的固定化机制,分析施用铁改性生物炭对土壤微生态的影响,以期为铁改性生物炭在重金属污染土壤修复中的应用提供参考。
-
1) 液相还原法。液相还原法是指利用还原剂还原溶液中的铁离子进而负载到生物炭上的方法[34-35]。QIAN等[36]先限氧热解稻草,再用盐酸酸化制备生物炭,然后在50 mL蒸馏水加入1.0 g FeSO4·7H2O和0.2 g生物炭,25 ℃下振荡24 h后转至三颈烧瓶中,N2吹扫1 h,并持续进行剧烈搅拌,以排除溶解氧,然后以5 mL·min−1的滴速将100 mL KBH4 (0.5 mol·L−1) 滴加至溶液中。反应完全后,用磁铁将样品从液相中分离、乙醇洗涤,最后真空干燥得到铁改性生物炭。SU等[37]也通过液相还原法制备了nZVI与BC理论质量比为1:1的零价铁改性生物炭。该法合成的零价铁改性生物炭在修复过程中避免了铁的过度释放。液相还原法在实验室里被广泛采用。该法制备的纳米铁颗粒粒径小、活性高,能在生物炭表面均匀分布[38],但成本高、还原剂毒性大、二次污染严重,不适合大规模生产。
2) 炭热还原法。一步炭热还原法利用生物质作为还原剂和铁盐的载体,在石墨化组分、热解产生的还原性气体等作用下,将铁盐进行原位还原[39]。LIU等[29]采用一步炭热还原法,在稻壳生物炭上原位生成了nZVI颗粒,研究表明即使在氧化条件下,该法合成的铁改性生物炭对重金属污染土壤也具有良好的修复性能。首先将5 g稻壳与50 mL的Fe2(SO4)3溶液 (217.38 g·L−1) 混合,200 r·min−1振荡2.5 h后真空抽滤并洗涤,以除去多余的铁盐。将所得混合物在105 ℃下干燥12 h,整个过程通氮气作为保护气体,然后以5 ℃·min−1的速率升温到600、800和1 000 ℃后热解30 min。SEM和XRD表征显示通过该方法生成了平均尺寸约为100 nm、形状良好的零价铁粒子。炭热还原法是简单、经济的一步还原法,适合大规模工业推广,生物炭的形成和纳米铁颗粒的合成在此过程中同时发生,生成的纳米颗粒尺寸可控性好、质量高,产物结晶度高,但受热解温度影响较大[40-41]。
3) 水热炭化法。水热炭化法是一种以亚临界水作为反应介质,在150~350 ℃下将干湿生物质转化为碳产物的热化学转化技术[42]。WEI等[43]以污泥为生物质原料,通过水热炭化法制备了铁改性生物炭。首先将污泥离心以降低其水分含量,将获得的污泥放入1 L高压釜中,然后加入铁盐 (NH4)2Fe(SO4)2·6H2O) 反应制备铁改性污泥生物炭,实验证明水热温度180 ℃、反应3 h是最佳制备条件。水热炭化法的优点是炭固定效率高,能得到分散性好、纯度高的纳米颗粒,该法善于处理含水率高、较分散的原料,反应环境密闭可有效防止有毒害物质的挥发,是一种相对环境友好的反应方法,但反应釜在高温高压下的安全性能有待关注[44]。
4) 浸渍法/浸渍热解法。采用铁盐溶液作为改性剂,对生物质进行浸渍/浸渍热解从而制备铁改性生物炭材料[45]。LYU等[27]采用浸渍法将纳米FeS成功负载到了稻壳生物炭。SHIN等[40]以废弃咖啡渣为原材料,经三氯化铁溶液浸渍后,在氮气氛围下于管式炉中热解制备了铁改性生物炭。ZHANG等[46]用三氯化铁预处理的棉白杨生物质为原料,通过热解制备了γ-Fe2O3/BC复合材料,合成步骤是首先称取40 g FeCl3·6H2O溶于60 mL去离子水中,然后将生物质放入配制好的FeCl3溶液中浸渍2 h,浸渍结束后在80 ℃下干燥2 h,最后将预处理好的生物质在氮气保护下600 ℃热解1 h。该方法易操作、产量大,合成的铁改性生物炭是很有前景的原位修复重金属污染的材料,缺点是热解过程会产生污染性气体。
5) 化学共沉淀法。是在N2等惰性气体氛围和碱性条件下 (氨水等) ,通过Fe2+/Fe3+的盐溶液反应生成纳米铁颗粒,并负载到生物炭上的方法[41]。LI等[47]将FeCl3和FeCl2 (质量比2:1) 溶于80 ℃的150 mL脱氧去离子水中,在98~100 ℃水浴锅中加热混匀,而后加入生物炭,用NaOH调节溶液pH为10,固化30 min后过滤沉淀物,于105 ℃烘干最终得到Fe3O4/BC,即使在酸雨淋溶条件下,该法合成的铁改性生物炭也可有效固定土壤中的铅。PHILIPPOU等[48]也通过化学共沉淀法制备了质量比为3:1的磁性生物炭。此方法较为简单、易操作、适合批量生产,但是该方法受pH、温度等因素影响较大,得到的纳米铁颗粒粒径通常较大[49]、结晶性差、团聚严重[44]。
6) 球磨法。球磨法是利用球磨仪器的不断转动和搅拌实现材料尺寸细化的方法,材料颗粒的尺寸和形状受转速、时间、球磨介质、球磨珠大小、球磨珠与材料的质量比的影响[50]。WANG等[51]以玉米秸秆为原材料利用行星球磨机制备纳米零价铁改性生物炭。在真空不锈钢研磨罐中加入1.2 g玉米秸秆生物炭和1.8 g铁粉,然后放入150 g氧化锆球 (3、5、15 mm直径的球以3:5:2的质量比混合) ,氮气吹扫20 min后进行球磨。该方法环保经济、可重复破碎、制备的颗粒粒径小、反应活性高[52],但机械球磨消耗能量较大、摩擦损耗大,运作时会放出大量的热能,温度升高可能会导致一些金属材料的氧化。
7) 绿色合成法。绿色合成法的基础是植物还原剂的提取,利用植物 (如谷物、绿茶等) 提取液负责将金属化合物还原成合适的纳米颗粒,然后通过共沉淀技术等将其浸渍到基质上[53]。ZHANG等[54]用香蕉皮提取物和硫酸亚铁对香蕉皮生物炭进行超声改性,制备FexOy改性生物炭。首先进行香蕉皮中还原剂的提取,将风干的香蕉皮加入到去离子水 (60 g·L−1) 中,在353 K下保持1.5 h,真空过滤分离浸提液和香蕉皮。然后,将过滤后的香蕉皮放入马弗炉,在氮气保护下873 K热解1 h,制备生物炭。在室温下将1.2 g香蕉皮生物炭加入到200 mL香蕉皮提取液中先超声15 min,然后在连续超声作用下滴加200 mL 0.1 mol·L−1的FeSO4溶液,继续超声1.5 h后离心出固体物质,分散到去离子水中进行烘干。硫酸亚铁被香蕉皮提取剂还原,先形成的是零价铁改性生物炭,然后,零价铁在水中溶解氧的作用下,被氧化水解形成FexOy/BC。MANDAL等[55]用绿茶提取剂还原FeCl2,对绿茶生物炭进行改性,并制备了纳米零价铁改性生物炭。第一步,将烘干好的绿茶按不同比例加入到100 mL去离子水中,85 ℃下搅拌0.5 h,然后过滤分离提取液和绿茶生物质。第二步,将配制的100 mL 0.3 mol·L−1 FeCl2溶液转移到三颈烧瓶中,在50 ℃、氮气吹扫下边搅拌边逐滴加入绿茶提取液。第三步,加入绿茶生物质继续搅拌0.5 h,反应结束后先烘干,然后在氮气保护下热解2 h最终得到nZVI/BC,胶体稳定性和流动性研究证实了该法合成的铁改性生物炭的稳定性,并有利于土壤中重金属的长期固定。绿色合成法打破了传统合成方法的局限性,使用绿色材料、在合成过程中消耗更少的能源和资源,避免了二次污染,被认为是目前较为环保的制备方法[56]。
-
1) 元素分析。元素分析仪可分析样品中元素的种类和含量。WANG等[57]利用天然赤铁矿改性松木生物炭制备了磁性生物炭,通过元素分析发现,改性后磁性生物炭中铁的含量是原始生物炭的118倍;此外,由于赤铁矿中还含有铝和镁,磁性生物炭中铝和镁的含量也略有增加,而砷则倾向于积聚在含有铁、锰、铝、铜和钴的金属氢氧化物的表面。
2) N2-BET吸附。利用N2-BET吸附法可测定材料的比表面积和孔径分布。ZHANG等[25]通过化学共沉淀法制备了Fe3O4/BC,用于修复镉污染土壤。对制备的材料进行BET表征,结果表明,铁改性生物炭的比表面积为101.9 m2·g−1,为原始生物炭的50倍,改性后总孔体积增加了60.5倍,微孔比表面积和体积分别增加了7.4倍和6倍。负载纳米铁颗粒后复合材料比表面积、孔体积和微孔比例的增加,增大了铁改性生物炭和重金属污染物间的接触面积,对重金属镉的吸附而言具有积极作用。
3) SEM/EDS及TEM表征。利用扫描电子显微镜 (SEM) -能量色散X射线能谱 (EDS) 或透射电子显微镜 (TEM) 对样品微观形貌特征进行观察,可得到材料表观形貌及元素分布。WANG等[58]制备FeCl3改性生物炭,对砷镉共污染土壤进行了修复。SEM图片表明原始生物炭呈多孔、片状结构,铁改性之后生物炭微孔和中孔中出现了颗粒,表面变得粗糙。同时,EDS能谱中出现了Fe显著峰,生物炭表面负载的铁量调节了土壤中Cd(II)和As(V)的固定化,并提高了土壤中有效态铁的含量,有利于土壤中重金属与铁氧化物和氢氧化物的结合。FAN等[59]以木屑为原料,通过一步碳热还原法制备了nZVI/BC,并将其用于修复两个受砷污染的矿山土壤。与原始生物炭相比,nZVI/BC的SEM图像呈典型的多孔结构,且在生物炭的表面和多孔中分散着白色颗粒,颗粒直径约为200 nm,EDS数据初步证明了这些白色颗粒是由Fe组成。此外,该学者还采用了双聚焦离子束 (FIB) 垂直于生物炭表面进行了切割,然后通过SEM和EDS表征生物炭内部与表面nZVI转变的差别,发现砷主要被固定在生物炭表面的氧化铁中。ZHU等[60]以芦苇生物炭为原料,制备了nZVI-BC,SEM图显示原始生物炭表面光滑,孔道清晰,改性后BC表面出现了大量的零价铁颗粒,并主要分布于大孔中 (见图1) 。
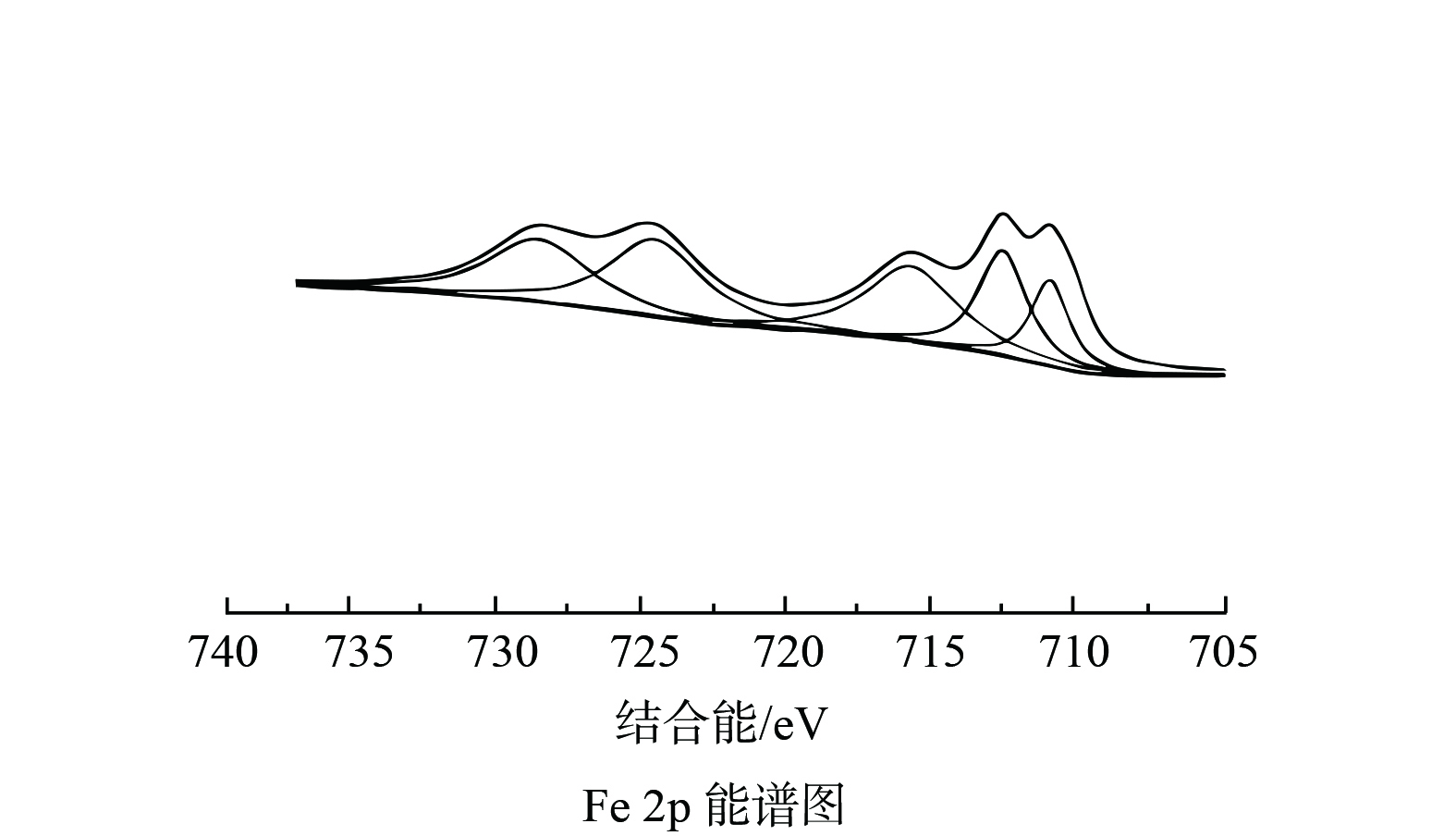
4) X射线衍射分析。X射线分析方法包括X射线光电子能谱 (XPS) 和X射线衍射 (XRD) 。XPS能测定材料表面的元素价态,XRD可分析材料的物相和晶体结构。WANG等[57]制备了γ-Fe2O3/BC,通过XRD图谱初步推断出现的衍射峰可能归属于γ-Fe2O3或者Fe3O4。通过XPS能谱显示Fe2p1/2和Fe2p3/2的结合能分别为724.48 eV和710.85 eV,这与Fe(III)化合物的结合能接近。XRD和XPS分析结果共同证明了生物炭上的氧化铁颗粒是γ-Fe2O3。LIU等[29]对制备的稻壳生物炭负载纳米零价铁材料 (Fe-RBC-800) 进行XPS分析,C1s图谱中284.8 eV和286.2 eV的衍射峰分别归属于C—C和C—OH,O1s图谱中530.3 eV处的峰归因于Fe3O4中的O2-,531.7 eV和532.7 eV处的峰值对应于—OH和C==O中的O。这表明铁改性生物炭表面官能团丰富,从而为重金属离子提供了较多的吸附位点,Fe2p图谱中724.6 eV的峰值属于Fe0,Fe0的存在证明零价铁成功负载于生物炭表面,并在后续反应中参与铬的还原。曹媛等[61]通过浸渍热解法制备FeCl3改性生物 (MBC300) ,如Fe2p图谱所示,在711.0和724.4 eV处观察到Fe(III)的2p3/2和2p1/2峰 (见图2) 。
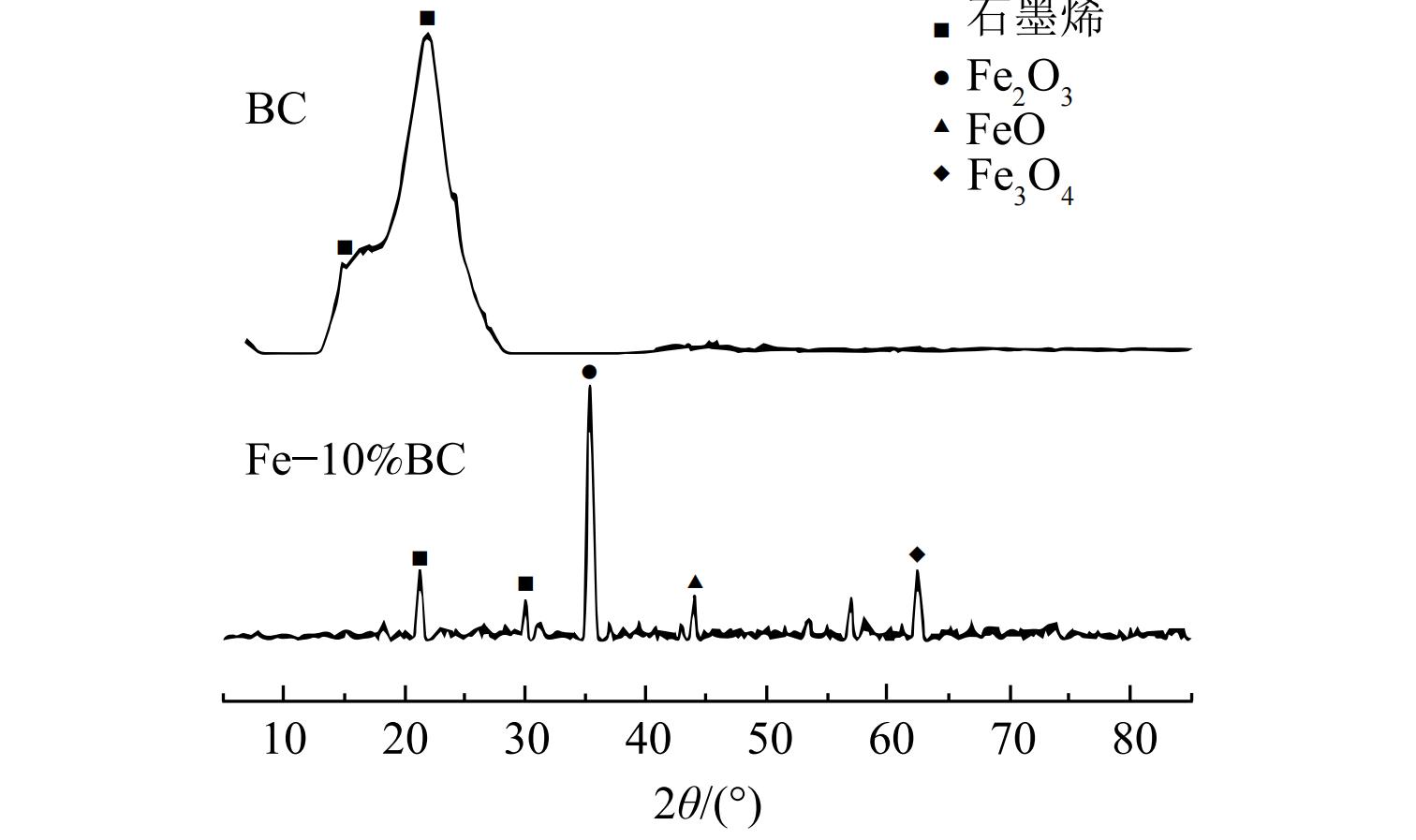
利用X射线衍射 (XRD) 亦可对材料结晶度进行分析。WU等[62]制备了不同铁材料改性的生物炭用于土壤中砷的固定化,XRD图谱显示不同材料的矿物结构组成之间存在明显差异,BC—FeCl3无结晶峰,BC—Fe中只存在一个Fe(0)的峰,BC—FeOS中出现的KFe3(SO4)2(OH)6峰与材料的合成途径有关,而KFe3(SO4)2(OH)6中的SO42-能与AsO43-发生置换反应从而实现对As的固定。LI等[47]通过XRD证明了Fe3O4和nZVI对生物炭的改性是成功的。分析XRD图谱可发现,在37.12°、43.12°、57°和62.56°处出现了强衍射峰,证实了Fe3O4颗粒的存在。而nZVI颗粒在衍射角44.7°处有明显特征峰,对比标准图谱也发现了相应晶面衍射。这表明nZVI/BC制备成功,相比之下,由于nZVI具有较强的吸附性和还原性,故nZVI/BC对土壤中铅的固定效果较好。QIN等[63]采用XRD对原始生物炭表征,在13°和22°处观察到明显的石墨衍射峰;铁改性生物炭XRD图谱在22°和42°处也观察到了石墨衍射峰。另外,在35.2°、43.8°和62.6°处出现了Fe2O3、FeO和Fe3O4衍射峰,Fe2O3衍射峰强度较大,这表明Fe2O3是铁存在的主要形式 (见图3) 。
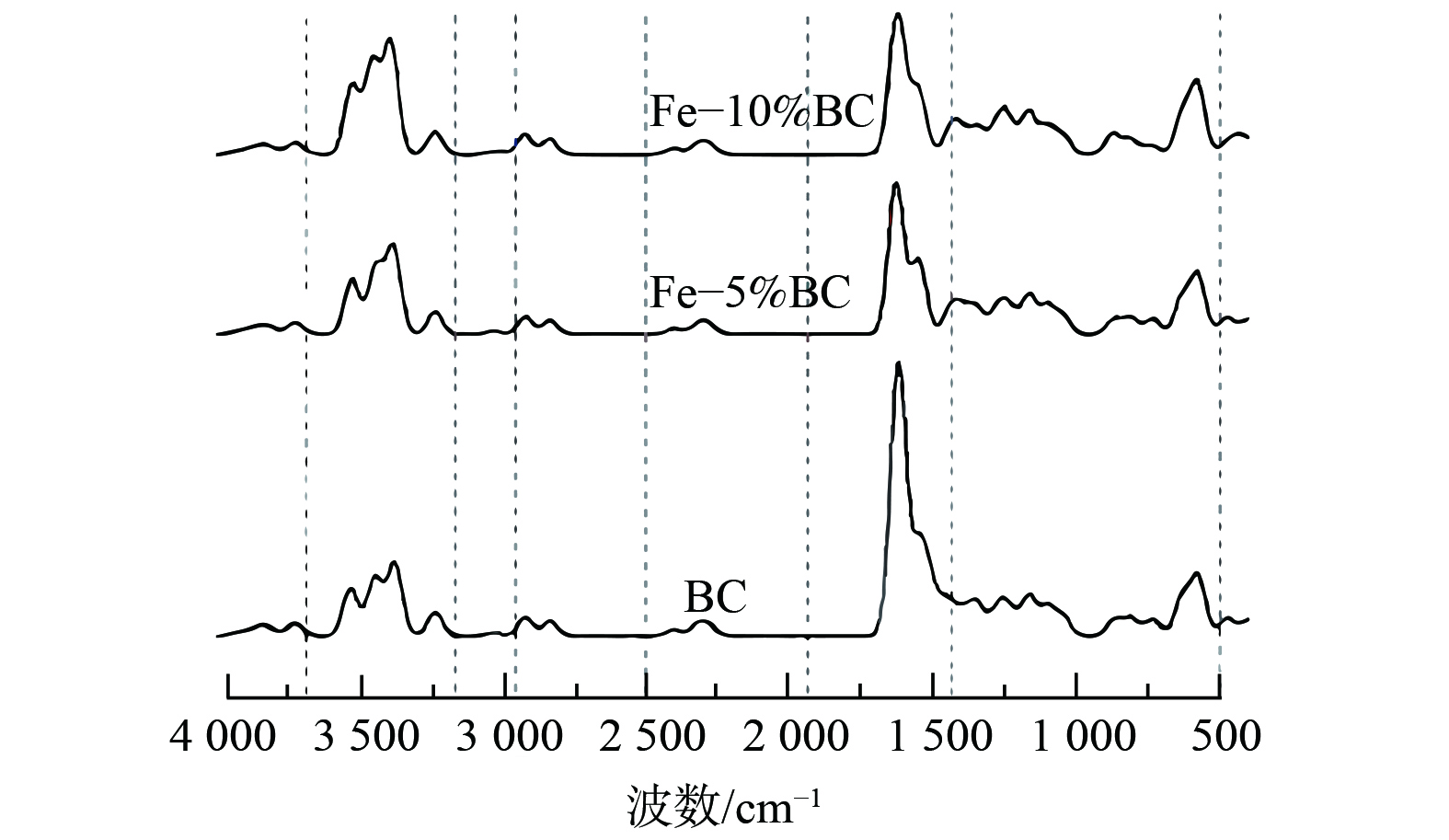
5) 傅立叶变换红外光谱 (FTIR) 。FTIR可用于材料表面官能团的测定。ZHANG等[54]利用FTIR对原始香蕉皮生物炭和FexOy/BC进行了对比分析,结果表明,在原始生物炭表面存在含氧官能团,羟基 (—OH) 伸缩振动产生了位于3 368~3 429 cm−1处的光谱,1 386、1 049 cm−1处的特征峰归因于C=O、C—O的拉伸振动。FexOy/BC在586 cm−1处出现了Fe—O的特征峰,说明FexOy的改性是成功的,但同时C—O、C—H的特征峰被抑制,可能是表面改性掩盖了这部分功能。ZHANG等[25]对制备的Fe3O4/BC进行FTIR分析,发现与原始生物炭相比,铁改性生物炭具有更高的峰强度,在532 cm−1处出现的典型Fe—O特征峰意味着纳米氧化铁颗粒的负载。铁改性的同时也增加了—OH、C=O、—COOH的数量,而土壤中镉通过络合、沉淀作用被固定,主要取决于这些含氧官能团。QIN等[63]制备了不同炭铁质量比例的铁改性生物炭,发现BC的FTIR光谱主要分为4个区域:—OH振动区 (3 700~3 200 cm−1) 、C—H/N—H伸缩振动区 (2 900~2 500 cm−1) 、双键振动区 (1 900~1 400 cm−1) 、指纹区 (1 400~500 cm−1) ;与BC相比,铁改性后生物炭表面含氧官能团种类变化不大,但复合材料中铁含量越高,含氧官能团伸缩振动越强 (见图4) 。
-
1) 磁性。PHILIPPOU等[48]制备的Fe3O4/BC能被外部磁铁棒强烈吸引,证明了磁性生物炭的成功制备。ZHANG等[46]为了研究γ-Fe2O3/BC的磁性,在室温下通过超导量子干涉仪磁力计记录了γ-Fe2O3/BC的磁滞曲线,结果表明γ-Fe2O3/BC的饱和磁化强度为69.2 emu·g−1,在测量基础上得到复合材料中γ-Fe2O3粒子的饱和磁化强度应为93.2 emu·g−1,高于纯γ-Fe2O3材料的饱和磁化强度 (76.0 emu·g−1) 。这说明复合材料中含有其他磁性材料,如Fe0可能是铁氧化物被碳或者还原性气体还原得到的,复合材料优良的铁磁特性,使其具有较强的砷吸附能力。
2) 热稳定性。热重分析 (TGA) 能考察材料的热稳定性。WANG等[57]通过TGA分析发现,改性后的磁性生物炭热稳定性略高于原始松木生物炭。由于热不活跃的赤铁矿用作稀释剂,磁性生物炭在较高温度下才开始分解;MANDAL等[64]通过TGA证实了nZVI与生物炭的结合有利于生物炭热稳定性的提高。在土壤的实际应用处理中可能受益于复合材料的热稳定性,这通常被认为是一种有效的固碳方法。复合材料热稳定性的增强也为土壤中更好的碳汇提供了机会。
3) 迁移性。SU等[65]通过石英砂柱迁移实验比较了纳米零价铁颗粒和nZVI/BC材料的迁移性差异。按一定的时间间隔收集材料悬浮液通过石英砂玻璃柱后的流出液,测定总铁浓度,结果表明,纯纳米零价铁颗粒的迁移性低于nZVI/BC。纯nZVI的团聚作用导致大部分颗粒都被保留在进水端。而生物炭的存在促进了nZVI的迁移,这是由于nZVI与BC的结合降低了磁吸引力,使得nZVI/BC能顺利穿过石英砂。nZVI@BC比纯nZVI具有更好的迁移性,有利于与土壤中重金属的接触,可有效固定土壤中的铬。
4) 稳定性。通过沉降实验可分析铁改性材料的稳定性[66-67]。MANDAL等[55]通过沉降实验探究了纳米零价铁铁改性生物炭的稳定性,利用紫外可见分光光度计测定了nZVI颗粒、nZVI/BC材料悬浮液的吸光度,比较了其沉降速率。沉降曲线显示,随着时间的增加,nZVI的吸光度下降幅度明显大于nZVI/BC,这说明nZVI/BC的稳定性要优于nZVI。纯nZVI沉降速度最快是由于纳米颗粒的迅速团聚导致的,而nZVI与BC的结合抑制了零价铁的团聚性,提高了材料的稳定性。这是由于生物炭表面的含氧官能团固定了nZVI,或者零价铁颗粒之间的静电吸引受到了BC表面的电荷性质影响。沉降实验证实了nZVI在绿茶基质中的稳定性,在固定土壤铅的长期有效性方面发挥了作用。
-
1) 原材料。重金属的固定效率因生物炭原材料而异。WANG等[58]以稻草 (RB) 、小麦秸秆 (WB) 和玉米秸秆 (CB) 为原材料制备原始生物炭,然后经FeCl3改性得到铁改性生物炭FRB、FWB和FCB,将其应用于修复砷镉复合污染土壤。与FWB和FRB相比,FCB的pH值和含铁量是最高的,这与原材料本身的理化性质和实验过程有关。生物炭的pH值受表面官能团和阳离子交换量的影响,3种生物炭在含氧官能团、表面电荷组成等方面的差异,决定了它们对重金属的吸附能力。同时,生物炭表面负载的Fe含量对土壤中Cd(II)和As(V)的固定起调节作用。结果表明,在10%最佳投加量下,铁改性玉米秸秆 (FCB) 对Cd(II)和As(V)的固定效率最高,此时土壤中铁铝结合态砷含量最高,镉主要以有机结合态存在。
2) 热解温度。热解温度对铁改性生物炭的产率和性能有着重要影响,不同的温度会影响材料的比表面积、孔径、官能团等理化性质[68]。一般情况下,热解温度升高,氢氧元素含量降低,—COOH、—OH等含氧官能团减少,不利于与重金属的结合;但随着热解温度的提高,材料比表面积增大,重金属吸附点位也会增多[69]。MANDAL等[55]通过绿色合成法,在150、250、350、450、550和650 ℃下热解制备了磁性绿茶生物炭,对合成的材料进行了表征。结果表明,热解温度显著影响与BC相关联的nZVI颗粒的稳定性。在450 ℃下制备的nZVI/BC在粒径、比表面积和表面电荷方面具有优良的特性。该温度下制备的复合材料官能团含量明显高于其他材料,表面含氧官能团是重金属吸附络合的主要结合位点。LIU等[29]于600、800、1 000 ℃热解稻壳,通过一步炭热还原法制备了铁改性生物炭材料。表征显示,随着温度的升高,生物炭虽然保持着非晶态碳形态,但石墨化程度增强。600 ℃炭热还原的主要铁产物是Fe3O4;在800 ℃下生成了形状良好、平均尺寸约为100 nm的nZVI。nZVI支撑着生物炭的孔结构,提高了复合材料的力学性能。当还原温度提高到1 000 ℃时,材料表面含氧官能团受损,剥离的氧原子与nZVI结合,导致nZVI的氧化腐蚀。同时,生物炭孔结构发生崩塌,比表面积下降且不利于纳米颗粒的负载和形成。结果表明,在800 ℃下制备的铁改性生物炭对Cr(VI)污染土壤具有良好的修复效果,污染土壤中酸溶态Cr消失,Cr不仅以不易利用的形式存在于土壤中,而且渗滤液中的Cr(VI)也被完全去除。
3) 炭铁质量比。通过优化炭铁质量的配比获得最大的钝化效益。SU等[65]以甘蔗渣为生物质原料,合成了nZVI与BC质量比为1:0.5、1:1和1:2的复合材料。对nZVI/BC材料性能进行研究发现,质量比为1:1的nZVI/BC,零价铁在生物炭表面负载分散情况最好。通过沉降实验和柱实验发现,与纯nZVI颗粒相比,在nZVI与BC的质量比为1:1时,材料的稳定性和迁移性更好。该配比下对Cr(VI)和总铬的固定效率分别达到了100%和92.9%。QIAO等[70]制备了4种含0.5%、1.0%、2.5%、5.0% Fe的零价铁改性生物炭材料。通过盆栽试验,探讨零价铁改性生物炭材料对Cd和As生物有效性的影响。结果表明,铁含量与材料的复合效应成正相关。5.0%铁含量处理组促进了铁斑的形成,增加了铁斑块中Cd和As的积累。不同水稻组织中Cd和As含量为0.5 Fe-C > 1.0 Fe-C > 2.5 Fe-C > 5.0 Fe-C。这说明5.0%铁含量的复合材料能显著降低Cd和As的生物有效性。
4) 投加量。修复材料的用量是实际重金属土壤应用中应考虑的一个重要因素,通过铁改性生物炭的合理投加,使其发挥到最大的吸附能力,又避免对土壤性质产生危害。LYU等[27]通过液相反应制备硫化铁改性生物炭材料来修复Cr(VI)污染土壤。结果表明,2.5、5、10 mg·g−1硫化铁改性生物炭处理下TCLP可提取的Cr(VI)浓度分别降低94.7%、96.5%、96.6%,降低了Cr(VI)的迁移率和生物有效性。林昌华等[71]针对华南地区镉污染酸性菜田红壤,通过小白菜室内盆栽实验,研究了在镉胁迫条件下,施加不同比例 (0.1%、0.3%、0.5%、1%) 硫酸亚铁改性生物炭对土壤中有效态镉和小白菜品质的影响。结果表明,改性生物炭在0.5%最佳添加量下,小白菜根际土壤水溶态镉含量最低,仅为未加生物炭对照组的58.55%。同时小白菜地上部分镉含量降低了,小白菜的总生物量亦有提高。
5) 反应时间。铁改性生物炭对重金属污染土壤的修复效果随着时间而变化。WU等[72]针对冶炼厂附近农田镉污染土壤,通过土培实验,分别在第7、15、30、45、60、90天取样,探讨了随着时间的变化,硫铁改性生物炭对土壤Cd的固定效果。研究表明,硫铁改性生物炭处理组土壤中有效态Cd在第7、15、30、45、60、90天分别下降67.56%、11.47%、40.91%、59.63%、8.82%、4.03%。并不是随着时间的延长,土壤有效态Cd含量越低,而是呈现先降低后升高的趋势。在45 d内,有效Cd含量较对照组显著降低。MANDAL等[73]制备了纳米零价铁改性生物炭用于固定土壤中的Se。在第1、7、15、30天分别取土样进行分析,结果发现,纳米零价铁改性生物炭对Se的固定效率随着时间的增加而提高。在土培30 d后对Se固定效率达到了60.61%,有效态Se含量从58.49 mg·kg−1降至27.57 mg·kg−1。
6) 土壤pH。施用到土壤中的钝化剂会引起土壤pH的变化。pH是影响土壤中重金属形态和有效性的重要因素[74]。YAO等[75]通过盆栽实验研究了Fe3O4改性生物炭对土壤As生物有效性的影响,发现施用Fe3O4改性生物炭降低了土壤的pH值。这可能是由于制备材料时进行了硝酸改性,同时铁离子的水解产生了大量H+。热解温度和灰分含量也会对材料pH产生影响,灰分的多次洗脱也导致材料pH的降低。同时,铁改性后增加了酸性官能团。相关性分析表明,经CaCl2提取的As含量与土壤pH呈显著负相关。土壤中的砷主要以阴离子形式存在,较低的土壤pH促进了As与修复剂表面的静电作用,导致As的迁移能力减弱,降低了As的生物有效性。熊静等[76]利用FeCl3改性生物炭修复Cd-As复合污染土壤,结果表明,受钝化剂自身pH值的影响,施用铁改性生物炭降低了土壤的pH,促进了As向残渣态转化。然而,pH降低导致土壤胶体和修复剂表面正电荷增加,与Cd2+形成静电斥力,影响了对镉的吸附能力。
7) 土壤有机质。添加铁改性生物炭会对土壤有机质含量产生影响。土壤中的有机物质具有大量的官能团,如羟基、羧基和氨基等,可有效吸附重金属离子。更重要的是,有机质分解形成的小分子有机酸、腐殖酸等可与重金属结合后形成稳定的络合物,从而降低重金属的有效性。WU等[72]探讨了硫铁改性生物炭对污染土壤中Cd的固定效果,表明有机质含量是影响Cd有效性的重要土壤因素。与对照组相比,硫铁改性生物炭的施加提高了土壤10.12%~21.32%有机质含量,线性回归分析得到土壤有效态镉的含量与有机质含量呈显著负相关。因为硫铁改性生物炭吸附了土壤中的有机分子,并通过表面催化作用合成了有机分子,同时生物炭富含碳,增加了土壤的储碳量,经过缓慢分解形成了腐殖质,提高了土壤有机质浓度,从而通过吸附作用和络合作用固定Cd,降低Cd的迁移性。
8) 土壤阳离子交换量。阳离子交换量 (Cation Exchange Capacity, CEC) 也是影响重金属固定的因素之一,修复剂的使用会导致土壤CEC的变化,可通过离子交换作用提高对重金属的吸附能力[77]。ZHANG等[25]发现除了土壤pH外,CEC也是影响Cd有效性的重要因素。随着Fe3O4改性生物炭的施加,土壤CEC显著提高,在0.2%、0.4%和1.6%投加量下,分别提高了164.1%、110.0%和72.2%,使土壤具有较高的离子交换能力,Cd2+通过与Ca2+、Mg2+、K+、Na+的离子交换而被固定,有效态Cd的含量显著降低。
-
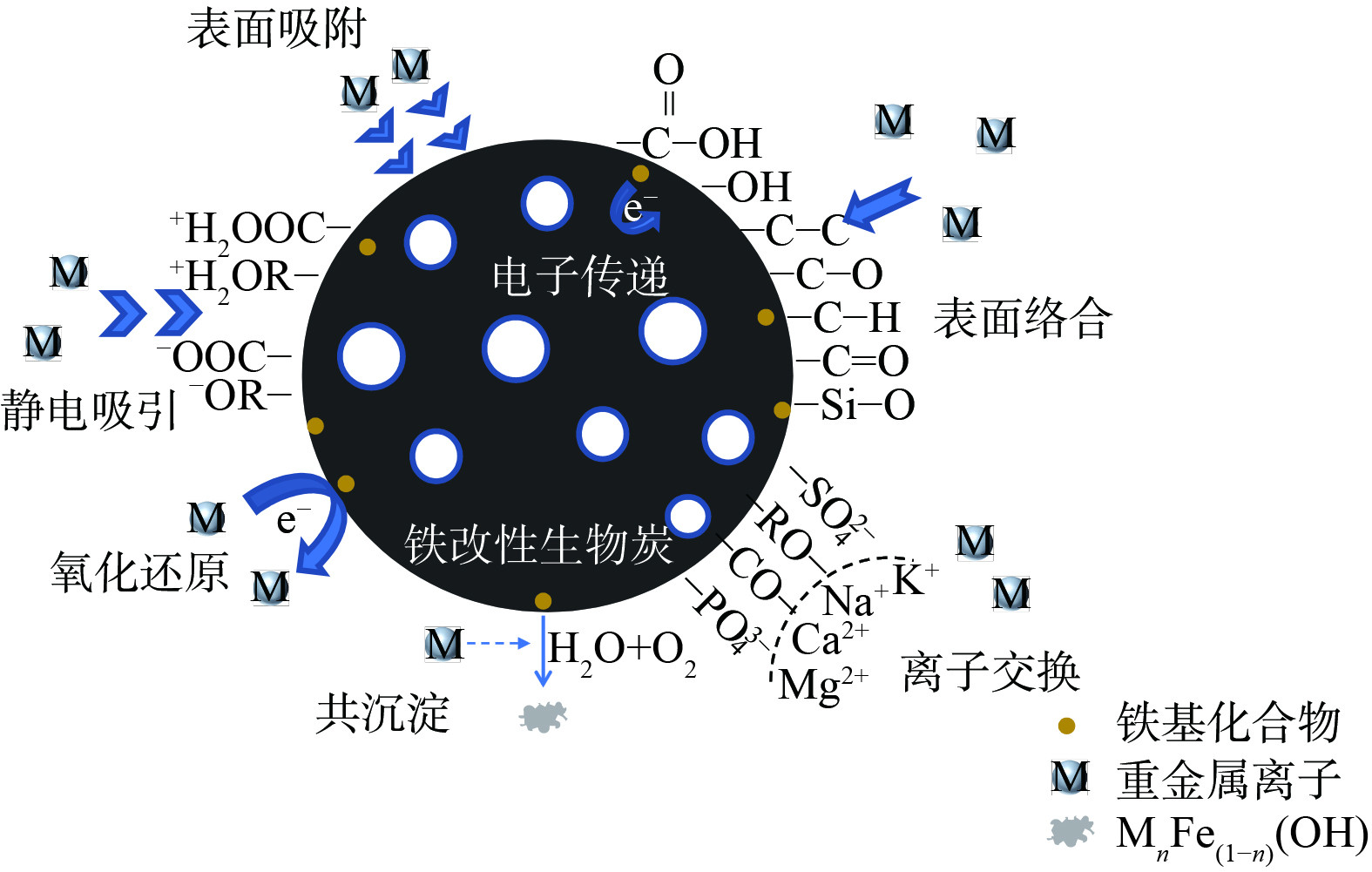
铁改性生物炭对重金属污染土壤的修复机制较为复杂,通常是多个机制共同作用 (如图5) 。其中,主要的反应有表面吸附作用、静电作用、离子交换、络合作用、氧化还原、共沉淀作用等[35, 49, 78]。
1) 对重金属的固定化机制。铁改性生物炭通过表面吸附、静电作用、沉淀作用固化土壤重金属。由于铁改性生物炭比表面积大、孔隙度高,可通过表面吸附将重金属离子固定。LI等[47]发现生物炭作为载体支撑着纳米零价铁颗粒,在进入土壤后增大了与Pb的接触面积。同时,由于nZVI的强吸附性,土壤中的Pb首先被吸附固定在铁改性生物炭表面。生物炭表面带负电荷[18],可通过静电吸引作用于重金属阳离子,而对一些阴离子污染物如As(V)等,吸附效果不理想。铁改性后生物炭表面电荷和pHzpc会发生变化,对阴离子污染物的静电吸附作用增强[79]。WU等[72]发现,硫铁改性生物炭提高了土壤pH,从而不仅增加了土壤胶体负电荷量,也增加了铁改性生物炭表面负电荷量,通过静电作用阻止了Cd的迁移,降低了有效态Cd的含量。WANG等[58]针对砷镉复合污染土壤的修复结果。这表明铁改性生物炭在吸附Cd2+后表面电荷可能发生反转现象,并影响其对As的吸附。某些重金属离子会通过沉淀作用,以氢氧化物、碳酸盐或磷酸盐形式被结合固定[80]。施加硫铁改性生物炭提高了土壤pH,Cd与CO32-和PO43-结合形成沉淀被固定[72],显著降低了土壤可交换态Cd的含量。LI等[81]发现与原始生物炭相比,经Fe2O3改性后的生物炭比表面积增大,具有了更多的吸附点位。土壤中游离的As被吸附后可通过沉淀作用形成Fe(As)—OH,实现As的固定化,降低土壤As的迁移性。
2) 离子交换/络合作用机制。铁改性生物炭通过离子交换作用、络合作用降低土壤重金属的迁移率。ZHANG等[25]研究表明Fe3O4改性生物炭可提高土壤阳离子交换量,使土壤具有较高的离子交换能力。Cd2+可通过与Ca2+、Mg2+、K+、Na+间的离子交换作用而被吸附固定。MANDAL等[55]发现随着土壤pH和表面电荷密度的变化,铁改性生物炭中的官能团会在土壤中发生解离,多酚基团和腐植酸可通过螯合作用形成高度稳定的金属络合物。随着作用时间的延长,铁与铅、碳的结合也倾向于形成络合物,从而固定土壤中的铅。MANDAL等[73]利用花生壳制备低成本的铁改性生物炭用于硒污染土壤修复。结果表明,铁改性生物炭促进了水溶态和交换态硒向有机结合态和残渣态硒转化,Se通过与铁改性生物炭表面Fe2O3间的络合被固定。As可通过络合作用与—COOH和—OH等官能团结合,Fe—O—As络合物的形成也是As(V)在铁改性生物炭上吸附的原因[82]。
3) 氧化还原/共沉淀作用机制。铁改性生物炭还可以通过氧化还原作用、共沉淀作用降低重金属的有效性。LIU等[29]利用铁改性生物炭修复Cr(VI)污染土壤,在整个固液修复体系中,Cr的生物利用度明显降低。随着铁离子的氧化,Cr(VI)被还原为Cr(III),同时Fe0被氧化成Fe2+和Fe3+,Cr(VI)与nZVI氧化还原反应的主要产物为FeCr2O4、Cr(OH)3和Cr2O3,溶解有机碳也可将部分Cr(VI)还原。FAN等[59]利用nZVI改性生物炭修复As污染矿山土壤,nZVI/BC对As表现出良好的钝化效果,在5%投加量下,广西壮族自治区 (GX) 和江西省 (JX) 矿山土壤中弱吸附态砷的含量分别降低了93.7%、97.7%。从修复后的GX和JX矿山土壤里收集nZVI/BC,发现随着铁离子的氧化,As(V)被还原为As(III)。XPS分析得到As(III)含量分别占66.7%、69.7%。同时,该学者还发现修复剂处理后土壤非晶态铁含量显著增加。XRD结果表明,Fe0被腐蚀后形成了FeOOH,As和FeOOH通过共沉淀作用形成了Fe(As)OOH,实现了As的固定化,同时由于GX、JX土壤中分别富含Ca、Al,也同时被FeOOH吸附,As与Fe—O—Ca、Fe—O—Al共沉淀。刘书四[83]针对镉砷超标的农田土壤,以棕榈为原料制备铁改性生物炭,研究发现纳米铁颗粒促进了铁膜的形成,添加改性生物炭的实验组水稻根表面铁膜砷含量相比对照组增加了46.3%。砷在铁膜中存在共沉淀作用,从而减少了水稻对砷的吸收。熊静等[76]也发现FeCl3改性生物炭的添加有效降低了有效态砷的含量,促进其向残渣态转化,对As的钝化效果比原始生物炭高出了43.68%。这可能是由于As易与Fe离子结合,形成了移动性较低的非晶态砷酸铁 (FeAsO4·H2O) 。
4) 电子转移机制。铁改性生物炭固化土壤重金属还涉生物炭的电子转移功能。生物炭的电子容量高达2 mmol·kg−1[84],生物炭表面的芳香族、醌、对苯二酚等结构[85-86]是电子传递的主要贡献者,使其具有了导电性。这个功能加速了纳米铁颗粒与生物炭之间的电子传递[87],加快了铁颗粒的腐蚀作用[88],最终氧化成非晶态铁氧化物来吸附固定重金属。同时,腐蚀过程刽消耗质子提高土壤pH[89],某些金属离子在高pH下的溶解度较低,这也有利于一些重金属的固定化。LIU等[29]发现,生物炭作为Fe0和Cr(VI)之间的电荷转移通道来维持氧化还原反应,从而使Cr(VI)仍然可以缓慢而连续地被去除。热解制备的Fe-RBC-800降低了生物炭的含氧量,增加了芳香族结构,而芳香族结构在生物炭的电子传递中起主要作用。同时,在Fe-RBC-800合成过程中,nZVI的存在加速了生物炭的石墨化过程,石墨化区域也能起到传递电子的作用[90]。FAN等[59]发现nZVI改性生物炭和BC+nZVI物理混合处理组对As的钝化都比单一nZVI效果好。这是由于在生物炭电子转移功能的作用下,BC协同nZVI促进了对As的吸附。该学者还发现,nZVI直接负载于生物炭表面,更有利于电子转移,nZVI的快速腐蚀致使材料吸附点位增多。另外,nZVI/BC在土壤中的迁移性更强,这不同于BC和nZVI的简单物理混合。因此,nZVI/BC对土壤中弱吸附态砷含量的降低程度远远大于BC+nZVI物理混合处理。
-
生物炭和纳米铁颗粒的协同作用可以有效提高复合材料对污染物的去除能力,铁改性生物炭具有良好的反应性和稳定性,在重金属污染土壤修复中的应用也越来越广泛,但由于生物炭材料来源不同、铁改性方法不同、重金属种类不同,相应的环境功能和产生的效应也不同 (如表1) 。
1) 对镉 (Cd) 污染土壤的修复。镉是我国土壤中污染最严重的重金属,分别占农田和城市土壤污染33.54%和44.65%[91]。由于其不可生物降解、毒性和持久性,随着食物链的摄入可能导致肾和肝损害,甚至癌症。
杨兰等[92]利用浸渍热解法制备了FeCl3改性生物炭,通过恒温静态培养实验探讨了复合材料对Cd污染土壤的修复作用。FeCl3改性后的生物炭平均孔径扩大了1.52倍,同时表面酸性官能团数量增加。当土培90 d后,在10%投加量下铁改性生物炭处理组土壤有效态Cd含量降低了22.5%~32.3%。ZHANG等[25]通过化学共沉淀法制备了Fe3O4改性生物炭,研究了铁改性生物炭对土壤镉生物有效性的影响。结果表明,施用0.05%~1.6%铁改性生物炭可使土壤有效Cd降低6.81%~25.0%,添加浓度大于0.4%时显著降低土壤有效Cd含量。Fe3O4改性生物炭对土壤Cd产生了激活和钝化两种效应,但钝化效应更加显著。尽管Fe3O4改性增加了生物炭表面酸性官能团的含量,同时纳米铁水解产生了氢离子,降低了土壤pH,提高了Cd的生物有效性,但Fe3O4改性生物炭释放的铁水解产物会与Cd形成配合物。另外,复合材料具有较高的离子交换能力,提高土壤CEC的同时通过离子交换作用吸附Cd2+,Cd2+还与生物炭表面CO32-和PO43-结合形成沉淀而被固定。
2) 对砷 (As) 污染土壤的修复。近30年来,农业土壤中砷污染呈逐渐增加的趋势。中国中部、南部和西南地区的砷含量高于其他地区。许多人类疾病,如癌症、心血管疾病、神经系统疾病和糖尿病等,都受到砷暴露的影响[93]。
LI等[81]通过化学共沉淀法合成了Fe2O3改性生物炭并将其应用于土壤-油菜系统中砷的固定化研究。Fe2O3改性生物炭施用后改善了土壤质量,降低了土壤中As的迁移率。土壤水溶态砷含量减少了89.74%,与对照组相比,增加了油菜生物量,地上部和根系对As的吸收分别下降44.55%和45.40%,地上部As的转移系数下降了43.91%,As的生物有效性降低。铁改性后生物炭的比表面积由4.12 m2·g−1增加到了107.62 m2·g−1,并通过吸附和共沉淀作用固定As,形成了Fe(As)-氢氧化物,从而降低了土壤中有效态As含量。YAO等[75]以稻壳为原材料,采用化学共沉淀法制得Fe3O4改性生物炭,通过盆栽试验探讨其对土壤中As迁移率和生物有效性的影响。结果表明,1.6%投加量处理下,水稻各组织中As含量最低,0.4%处理下非专性吸附态、专性吸附态和无定形铁铝氧化物结合态砷浓度分别降低42.4%、9.7%和19.8%,提高了残渣态砷含量。对钝化机理进行分析,发现施用铁改性生物炭降低了土壤pH,促进了As与吸附剂表面的静电结合。材料表面形成的氧化铁对As也具有很强的吸附能力,复合材料具有较大的比表面积、较高的孔隙率和丰富的官能团,再通过离子交换、与-COOH/-OH络合、π电子吸引、沉淀作用固定土壤砷离子。施用铁改性生物炭还促进了水稻根系表面铁斑的形成,通过Fe-O-As的形成将As吸附在水稻根系表面,从而降低As的生物有效性。
3) 对铬 (Cr) 污染土壤的修复。在过去50年里,全球释放到环境中的铬量超3×104 t。我国农田中铬的浓度范围为1.48~820.24 mg·kg−1,其中Cr(VI)生物毒性更高,会引起皮肤损伤、耳膜穿孔、肺癌等疾病,对人类健康构成巨大威胁[94]。
SU等[37]制备了纳米零价铁改性生物炭用于铬土壤修复,土培15 d之后,铁改性生物炭对Cr(VI)的固定效率为100%,对总Cr的固定效率为92.9%。LIU等[29]以稻壳生物炭负载纳米零价铁作为修复土壤中Cr(VI)的材料,发现在800 ℃一步热解法制备的铁改性生物炭材料 (Fe-RBC-800) 具有较高的热稳定性和抗氧化性。当Fe-RBC-800的投加量为8%和12%的时候,可在30 min和120 min完全去除土壤渗滤液中的Cr(VI),并且连续6 d未检测到Cr(VI),证明了Fe-RBC-800对Cr(VI)污染土壤的长期修复能力。这种长期修复作用可能与生物炭的电子转移功能有关。同时,经Fe-RBC-800处理后的铬污染土壤中的酸溶态完全消失,表明该修复材料对Cr(VI)污染土壤具有良好的修复效果。ZHU等[95]以柳渣为原材料,通过液相还原法也制备了纳米零价铁改性生物炭 (nZVI-HBC) ,研究其在低中高三种不同铬污染水平下对土壤中六价铬的去除作用。结果发现,在250 mg·kg−1 Cr(VI)污染水平下,nZVI-HBC处理组玉米生物量显著提高了31%,施用nZVI-HBC降低了土壤中Cr(VI)的含量,降低了Cr(VI)对玉米的毒性效应。
4) 对铅 (Pb) 污染土壤的修复。作为农业大国,我国土壤Pb污染比例为1.5%,土壤中累积的铅不仅会抑制植物生长,还会被作物吸收,通过食物链对人类健康构成威胁[96],铅摄入或吸入会导致高血压,严重的情况下还会导致基因突变和致癌,其损害是不可逆转的。
MANDAL等[55]以绿茶为原材料,通过绿色合成法制得纳米零价铁复合绿茶生物炭材料 (nZVI@GTBC) ,研究了在不同pH土壤条件下其对铅的固定化。结果表明,土壤pH条件影响Pb的固定效率,nZVI@GTBC在实际土壤 (pH=6.8) 条件下的固定效果优于酸碱土壤条件,并且固定效率随着时间的延长呈升高的趋势,在第30天达到98.33%,此时Pb的生物有效性达到最低。土壤Pb的固定是一个涉及表面吸附、静电吸引、氧化还原、离子交换、表面络合、共沉淀的复杂过程。LI等[47]通过液相还原法和化学共沉淀法分别制备了生物炭负载零价铁 (BC-nZVI) 和生物炭负载纳米氧化铁 (BC-nFe3O4) 材料,研究了它们对污染土壤中铅的固定效果。相关性分析表明,土壤pH值、可交换态铅含量、固定化效率与材料投加量之间呈正相关关系。在8 g·kg−1投加量下,BC-nZVI和BC-nFe3O4处理组下土壤可交换态铅含量分别降低了77%和55%。同时,采用土柱淋溶实验模拟酸雨条件下添加固化剂对Pb迁移的影响。结果表明,酸雨活化了土壤中的铅,增加了铅的迁移,添加铁改性生物炭后可减少土壤中弱酸可提取态铅的含量。其中,BC-nZVI对土壤中Pb的固定效果最显著。首先,BC-nZVI的加入提高了土壤pH,降低了Pb的溶解度。nZVI具有较强的吸附性和还原性,Pb先被BC-nZVI吸附,表面Fe0与铅发生反应。nZVI改性后的生物炭在土壤中易分散、孔隙度高、比表面积大、反应活性高,并通过离子交换、沉淀作用、络合作用固定Pb。
5) 对复合重金属污染土壤的修复。土壤重金属污染呈复杂和多样化,通常会以多金属复合污染的形式存在。潘亚男等[97]以凤眼莲为原材料制备铁改性生物炭,研究了其对复合污染土壤中砷、汞、镉的固定化。与原始生物炭相比,铁改性生物炭的加入降低了土壤砷、汞、镉可交换态和碳酸盐结合态的含量,修复机制可能涉及表面吸附、配位基交换作用、表面官能团络合作用等。PAN等[98]以悬铃木和死猪尸体为原材料制备绿色悬铃木生物炭 (GWB) 和猪生物炭 (PB) ,并对其进行三氯化铁改性,施用于砷铅复合污染土壤。结果表明,与对照组相比,Fe-GWB和Fe-PB处理后土壤中有效态As含量分别降低了32.8%和35.9%,铁改性生物炭的添加降低了土壤pH值,导致土壤颗粒正电荷的增加,增强了对阴离子As的静电吸附作用,铁改性生物炭上的官能团,包括—NH、—OH和—COOH等与As离子形成稳定络合物。同时,由铁改性生物炭产生的铁氧化物可通过共沉淀作用固定土壤砷,所以生物炭经铁改性后固砷能力得到了提高。而与铁改性生物炭相比,原始生物炭在固定铅方面更有效。Fe-GWB和Fe-PB降低了土壤pH,提高了Pb在土壤中的溶解度,增加了Pb的迁移率,并且该研究中原始生物炭比铁改性生物炭阳离子交换量更高,通过离子交换固定铅的能力更强,与从原始生物炭上释放出来的磷酸根离子形成沉淀也是Pb固定化的主要原因。WANG等[58]以稻草、小麦秸秆和玉米秸秆为生物炭原材料制备了三氯化铁改性生物炭,对As(V)和Cd(II)复合污染土壤进行了修复试验。铁改性生物炭对镉砷的固定效率因原料类型、培养时间、投加量而异,与单一重金属污染不同,As(V)和Cd(II)在生物炭改性土壤上的拮抗和协同作用更复杂。结果表明,土培第10天,铁改性玉米秸秆在10%投加量下对Cd(II)和As(V)固定化效果最好,固定效率分别达到63.21%和95.1%。铁改性生物炭改良后土壤的pH值和有效态铁含量均高于原始生物炭处理组,有效态铁能促进重金属在铁氧化物和氢氧化物上的分布,土壤性质的改变间接影响重金属的固定。固定化效率动态结果表明,重金属与活性中心之间的吸附竞争、表面络合和沉淀作用是一个复杂的动态过程。As(V)的存在可能会提高铁改性生物炭对Cd(II)的去除率,负电荷的静电吸引作用和Fe-As-Cd络合物的形成都有助于Cd(II)的去除。生物炭表面负载的铁量为重金属固定提供了更多的活性中心和表面电荷,调节了Cd(II)和As(V)的固定化,铁改性生物炭在吸附Cd(II)后会发生表面电荷反转现象。随着铁改性生物炭对Cd(II)的吸附,表面对As(V)的吸附减少。
-
土壤微生态不仅能反映土壤的功能和肥力,更是反应土壤环境中重金属毒性的重要指标。铁改性生物炭已被广泛应用于重金属污染土壤环境的修复。但同时,铁基纳米颗粒对土壤微生态的毒性也逐渐引起人们的关注。学者们在探究铁改性生物炭钝化土壤重金属潜力的同时,也考察了对土壤微生态的影响。然而,目前关于铁改性生物炭通过作用于土壤微生态进而间接影响重金属固定的研究还较少,因此,微生物在铁改性生物炭对重金属污染的修复过程中所扮演的角色尚不明确。
-
WEN等[104]探究了铁改性悬铃木生物炭对水稻土中砷、镉、铅生物有效性及土壤酶的影响。结果表明,原始生物炭的多孔结构为微生物提供了更好的生长环境,提高了土壤脲酶和过氧化氢酶的活性。同时,原始生物炭处理组提高了土壤pH,也可能是促进土壤脲酶和过氧化氢酶的活性的原因。铁改性生物炭处理组土壤pH减小,高浓度的Cl−增加了土壤离子浓度,抑制了土壤脲酶和过氧化氢酶的活性。殷西婷[105]制备铁改性松木生物炭,探究了其对砷污染土壤中赋存形态和酶活的影响。结果表明,施用松木生物炭和铁改性生物炭均促进了土壤中脲酶、碱性磷酸酶和过氧化氢酶的活性。生物炭可增加土壤pH和有机质含量,为微生物的生存提供营养物质,同时增强土壤通气和持水能力,有利于土壤微生物的生长和代谢,缓解砷对土壤酶活的抑制。PENG等[99]制备了纳米零价铁改性生物炭 (nZVI@BC) 、硫化亚铁改性生物炭 (FeS-NPs@BC) 、四氧化三铁改性生物炭 (Fe3O4-NPs@BC) 材料用于铅污染土壤的修复,并探究了铁改性生物炭材料对土壤酶的影响。结果表明,所有处理组均提高了转化酶活性,但是FeS-NPs@BC显著降低了土壤脱氢酶、脲酶、FDA水解酶活性,nZVI@BC显著降低了土壤脲酶活性,Fe3O4-NPs@BC显著提高了土壤脱氢酶、脲酶、蔗糖酶、FDA水解酶活性,提高了重金属污染土壤的质量。
-
1) 对微生物量的影响。WU等[41]以桉树木屑和猪粪为原料制备磁性生物炭,实验证明原始生物炭能增加土壤养分的有效性,并为微生物提供栖息地,从而增加了土壤微生物生物量。然而,磁性生物炭降低了真菌和细菌的生物量,细菌生物量下降尤其显著。这是由于与真菌相比,细菌对铁氧化物更为敏感。PENG等[99]发现硫化亚铁改性生物炭 (FeS-NPs@BC) 增加了土壤细菌数量,促进了微生物的生长。纳米零价铁改性生物炭 (nZVI@BC) 和四氧化三铁 (Fe3O4-NPs@BC) 改性生物炭具有一定的微生物毒性,降低了土壤细菌数量。Fe3O4对土壤微生物的影响较小,nZVI产生的Fe2+/Fe3+和活性氧会导致微生物的细胞膜破坏和氧化应激损伤,对土壤微生物量不利。FeS中硫元素的氧化能提供更富营养的土壤环境,同时也会降低Fe2+/Fe3+对土壤微生物的影响,促进微生物的生长。ZHANG等[106]研究了在砷污染土壤中,Fe3O4改性生物炭对土壤理化性质和微生物量的影响,发现铁改性生物炭影响土壤微生物的生物量是通过改变土壤C:N,而不是改变土壤pH来实现的。同时,土壤有机碳与土壤微生物总量呈显著负相关,Fe3O4改性生物炭显著降低了土壤微生物总生物量和土壤细菌、真菌、放线菌和原生动物的生物量。这表明铁改性生物炭对土壤微生物量和土壤理化性质的影响不同于单独使用生物炭和Fe3O4的叠加效应。
2) 对微生物群落的影响。WU等[72]探究了硫铁改性生物炭 (SF-BC) 在镉污染土壤中的固定化效果及对微生物群落的影响。与对照组相比,铁改性生物炭处理组增加了微生物物种的丰富度和多样性,显著提高了微生物Chao1、observed、Shannon和Simpson多样性指数。同时,变形菌门、拟杆菌门、放线菌门的相对丰度增加,而酸杆菌门和芽单胞菌门的相对丰度减少。PENG等[99]发现,与对照组相比,只有nZVI处理组对变形菌门的相对丰度有不利影响。但nZVI@BC处理组实验结果表明,生物炭的存在可削弱这种不利影响。其余处理组土壤变形菌的相对丰度都高于对照,这是由于修复后土壤环境中营养物质含量较高,有效重金属含量较低的原因;除nZVI处理组的放线菌和FeS-NPs处理组的糖化菌外,其余各组放线菌和糖化菌的相对丰度均降低。除Fe3O4-NPs处理组外,其他土壤样品中拟杆菌门的相对丰度均有所增加。其中,nZVI和FeS-NPs处理组较对照组显著增加,说明nZVI和FeS能促进拟杆菌门的生长与土壤中铁含量的增加有关。同时,FeS-NPs和FeS-NPs@BC(T5)处理组中酸杆菌门的百分比明显升高,而绿弯菌门的百分比下降。WU等[41]发现,与未改性生物炭相比,磁性生物炭中氧化铁的存在提高了土壤团聚体的稳定性,但降低了氧的有效扩散,不利于需氧细菌的增殖,降低了需氧菌的丰度。LIU等[107]制备纳米零价铁改性氨基生物炭 (ABC/NZVI) 应用于砷污染水稻土的修复,同时研究了水稻全生育期根际微生物群落的动态变化,发现ABC/NZVI对根际微生物群落有显著影响。在分蘖期,ABC/NZVI处理组土壤中细菌比例提高了175%,ABC/NZVI处理组土壤中地杆菌的相对丰度是对照组的两倍。由于地杆菌具有使用氧化铁作为电子受体的能力,而ABC/NZVI中的纳米零价铁氧化导致土壤氧化铁含量升高,导致地杆菌的增加。在分蘖期和成熟期,施用ABC/NZVI后抑制了与氮素转化相关的亚硝化球菌的丰度,亚硝化球菌的比例分别减少了61%和20%。土壤氮素流失减少,提高了水稻氮素利用率。
-
1) 总结了铁改性生物炭材料的制备方法,但关于影响制备参数的信息还相对有限。其中,优化合成条件尤为重要,这决定了铁改性生物炭的性能及其去除土壤中重金属的能力。同时,铁改性生物炭材料产量偏低,仍需开发适用于大规模应用的绿色合成方法,避免造成环境污染。
2) 与单一重金属污染土壤相比,复合重金属污染土壤具有特殊性、复杂性。铁改性生物炭在影响复合污染土壤中重金属迁移率方面的作用尚不清楚。例如,在As(V)的存在下对铁改性生物炭固定Pb没有显著影响,但As(V)的存在有助于铁改性生物炭对Cd的去除。铁改性生物炭修复重金属复合污染土壤过程中的协同和拮抗作用规律有待进一步探究。
3) 铁改性生物炭对土壤酶、土壤微生物的生物量、活性、群落结构,以及对参与碳氮等循环的功能基因研究有待深入。相关铁改性生物炭通过作用土壤微生态间接影响土壤中重金属固定的研究甚少,且微生物在修复过程中所扮演的角色尚不明确。同时,可考虑采用宏基因组学等手段,获取高分辨率功能代谢谱和物种组成谱,在组成和功能水平上深入挖掘铁改性生物炭修复重金属污染土壤过程中的微生物学机制。
4) 现阶段所开展的修复实验,大都基于实验室进行异位修复,铁改性生物炭实际的原位修复应用案例还较少。铁改性生物炭在不同环境条件下可能出现不同行为。由于土壤污染修复是一个长期动态过程,铁改性生物炭材料在修复过程中可能出现稳定性降低、短期固定化后释放固定化成分的风险。后续应考虑铁改性生物炭对污染土壤的长期修复效果及环境效应,以确保土壤环境质量稳定安全。
5) 联合修复不仅能提高修复的效率和速率,还能打破单一修复方法的局限,是研究土壤修复技术的新方向。目前,铁改性生物炭与植物联合修复重金属污染土壤的案例较为少见,还有待进一步深入探索,以期完善不同类型重金属超积累植物与铁改性生物炭联合修复的研究。
铁改性生物炭的制备及其在重金属污染土壤修复技术中的应用进展
Preparation of iron-modified biochar and its application in heavy metal contaminated soils
-
摘要: 生物炭已被广泛应用于修复重金属污染土壤,但粒径大、力学性能差、吸附点位较少等缺点限制了其应用。由铁基化合物和生物炭制备的铁改性生物炭,可优化生物炭的性能,弥补生物炭修复能力的不足,表现出良好的重金属钝化效果。综述了铁改性生物炭的制备方法,以及该材料对重金属污染土壤修复的研究进展:介绍了铁改性生物炭的制备方法和常用表征手段;总结了制备及修复过程中的主要影响因素 (原材料、温度、投加量、修复时间等) ;从静电作用、离子交换、络合、氧化还原、共沉淀作用等方面阐明了铁改性生物炭对重金属的固定化机制;分析了施用铁改性生物炭对土壤微生态的影响;最后指出了铁改性生物炭材料在应用中可能存在的问题。以期为铁改性生物炭在重金属污染土壤修复中的应用提供理论依据。Abstract: At present, biochar has been widely used in the remediation of heavy metal contaminated soil, but its practical application is limited due to the shortcomings of large particle size, poor mechanical properties, and less adsorption sites. It was found that iron-modified biochar prepared by iron-based compounds and biochar could optimize the performance of biochar, make up for the lack of biochar repair ability, and show excellent heavy metal passivation effect. In this paper, the preparation and remediation of iron-modified biochar for heavy metal contaminated soil were reviewed. Firstly, the preparation and characterization methods of iron-modified biochar were introduced, and the main influencing factors (raw materials, temperature, dosage, time, etc.) in the process of preparation and remediation were summarized. Then, the immobilization mechanism of iron-modified biochar for heavy metals was elucidated from the aspects of electrostatic interaction, ion exchange, complexation, oxidation-reduction, and coprecipitation. The effects of iron-modified biochar on soil microecology were analyzed. Finally, the possible problems in the application of iron-modified biochar materials were pointed out, in order to provide theoretical basis for the application of iron-modified biochar in remediation of heavy metal contaminated soil.
-
Key words:
- iron-modified biochar /
- heavy metal /
- soil remediation /
- mechanism of immobilization /
- microecology
-
酚类化合物是一类常见的化学工业原料,广泛应用于与人类生活紧密相关的各行各业,但是酚类污染物的不合理排放易对人类和环境造成伤害。很多酚类污染物都是典型的内分泌干扰物质,即使在较低浓度下都可能对人体造成伤害[1]。我国原国家环境保护局选择出排放量大、毒性高、水中难降解的污染物,将其列入中国水环境优先控制污染“黑名单”,其中酚类污染物多达6种[2]。因此,检测痕量的酚类污染物是重要的环境分析工作。
酚类污染物的常用检测方法有分光光度法[3]、色谱法[4]、质谱法[5]、化学发光法[6]和电化学方法[7-8]等。在这些方法中,电化学方法具有简单快捷、灵敏准确、成本低廉的显著优势。然而,未经修饰的裸电极在检测低浓度和多组分酚类污染物时可能存在峰电位重叠、稳定性差、线性范围窄等不足[9]。利用性能优异且绿色环保的材料修饰裸电极是解决上述问题的有效途径之一。目前,有大量新型材料用于电化学传感器的构建[7,10-11],其中,MOFs由于比表面积大、孔隙率高、表面性质可调控,在气体贮存[12]、吸附[13]、催化[14]和电化学传感[15]等方面有成功的应用案例。
近年来,MOFs电化学传感器在酚类污染物的检测中表现出检测限低、选择性高、线性范围宽等优势[16-18]。本文综述了一些基于MOFs、MOFs复合物、MOFs衍生物表面修饰的电化学传感器在检测酚类污染物的应用案例;总结了MOFs基材料制备方法对酚类污染物检测性能的影响;并展望MOFs基电化学传感器在酚类检测中的发展趋势。
1. MOFs基电化学传感器(MOFs-based materials for electrochemical sensing)
1.1 MOFs简介
MOFs是由无机金属中心与桥连的有机配体通过自组装相互连接,形成的一类具有网络结构的晶态多孔材料。一般包括网状金属和有机骨架材料(IRMOFs)、类沸石咪唑骨架材料(ZIFs)、莱瓦希尔骨架材料(MILs)和孔、通道式骨架材料(PCNs)四类。
1.2 电化学分析方法
当施加电压时,酚类污染物发生氧化还原反应,从而产生可以反映待测物浓度的电流信号,进而实现检测的目的。电化学分析方法主要包含以下几种[19]:(1)循环伏安法(CV),主要用于评价修饰电极的质量,能够定性分析检测物并通过改变扫速判断反应的机制;(2)差分脉冲伏安法(DPV),与CV相比,灵敏度更高,背景电流更小,能够用于定量研究,在酚类污染物的检测中最为常见;(3)方波伏安法(SWV),检测线可低至10−8 mol·L−1,选择性高且检测时间短;(4)电流-时间曲线法(AMP),一般只进行定量检测,选择性较差,常与其他方法联用;(5)电化学阻抗(EIS),用于判断不同修饰电极的活性,但选择性差限制了其定量检测。
1.3 MOFs基电化学传感器的构建及意义
MOFs基电化学传感器的构建及应用主要包括以下步骤:(1)根据待测物的结构和性质,设计MOFs基材料的组成和形态;(2)使用水热法[20]、超声法[21]、微波加热法[22]、电化学合成法[23]等技术制备MOFs基材料;(3)用SEM、TEM、XRD等手段对MOFs基材料进行表征,确定材料是否成功合成;(4)使用电化学沉积法[24]、滴铸法[25]等技术构建电化学传感器;(5)测试电化学传感器的电化学性能;(6)将电化学传感器用于痕量检测。
与其他修饰物相比,MOFs材料的特殊结构有利于痕量酚类检测[17]:(1)孔隙率高,可以使分析物快速富集;(2)比表面积大,有效放大信号响应;(3)可调节尺寸和孔道直径,有利于其他材料的镶嵌或负载以发挥协同效应;(4)金属离子和有机配体赋予MOFs优异的电催化性能,有利于待测物的氧化还原。但由于MOFs的导电性弱、电化学活性低,在水中难以保持结构稳定,进而导致它们在电化学传感器中难以达到应用水平。通过和其它物质复合、结构重塑、高温碳化、磷酸化等方式合成的MOFs复合物和衍生物,能在很大程度上解决这些问题。
2. MOFs基电化学传感器在痕量酚类检测中的应用(Application of MOFs-based electrochemical sensors for the detection of trace phenolic)
2.1 单纯MOFs
单纯MOFs的合成过程相对简单,不需要考虑其它成分与其之间的相互作用和结构关系。对于单纯MOFs修饰物的研究(见表1)主要包括改变中心金属离子、有机配体和优化制备方法,为研制MOFs基电化学传感器提供材料。
表 1 单纯MOFs构建的电化学传感器在检测痕量酚类污染物中的应用Table 1. Applications of electrochemical sensors constructed by pristine MOFs materials for the detection of trace phenolic pollutants检测电极Electrode 目标检测物Analyte 检测方法Method 线性范围/(μmol·L−1)Linear range 检测限度/(μmol·L−1)LOD MOF-235(10%)/GE[11] 邻苯二酚 DPV 12.79—514 12.79 MOF-801-CPE[26] 对苯二酚 DPV 50—1000 0.57 UiO-67-CPE[27] 对苯二酚 DPV 5—300 0.0036 Cu-Ni-BTC-CPE[28] 邻苯二酚 DPV 0.5—330 0.2 对苯二酚 0.3—390 0.08 UiO-66/CPE[29] 2,4,6−三氯苯酚 DPV 0.01—0.5 0.00646 Cu-BTC films/GCE[30] 双酚A DPV 0.005—2 0.00072 Cu-MOF-CPE[31] 邻苯二酚 SWV 0.8—32 0.1 Batista等[11]以对苯二甲酸和氯化铁为原料通过水热法制备了呈八面体型的MOF-235,以10%的MOF-235修饰的碳糊电极用于邻苯二酚检测,其检测限为13 μmol·L−1,电活性面积为未修饰电极几何面积的13倍。MOF-235对邻苯二酚的检测效果虽然并不能达到让人相当满意的程度,但它的合成成本低、合成路线简单,可以替代一部分昂贵改性材料。
Zhang等[26]采用反应过程温和且反应时间短的电化学合成法,分别以富马酸和4,4-联苯二甲酸为有机配体,以Zr4+为中心离子,合成了呈正八面体的MOF-801和呈正十四面体的UiO-67用于检测对苯二酚。结果显示,MOF-801-CPE和UiO-67-CPE对对苯二酚的检测限分别为0.57 μmol·L−1和3.6 nmol·L−1。Zhang等[27]认为UiO-67-CPE检测效果更胜一筹的原因主要有以下两点:一是UiO-67的比表面积和平均孔径更大;二是UiO-67的有机配体中含有苯环,可以与对苯二酚结构中的苯环形成π-π共轭体系,而MOF-801的有机配体富马酸中不含有苯环,与对苯二酚的结合力相对较小。
除了单一金属成分的原始MOFs以外,还有一些双金属MOFs也可以用于检测酚类污染物。双金属MOFs是指由两种不同的金属与同一种有机配体反应制备的MOFs材料,是同一制备过程形成的纯净物,而不是由两个不同的制备过程所得产物的混合物[32]。与单一金属MOFs相比,通过改变双金属MOFs中两种金属的种类和比率等,能让材料在作为电极修饰物时有更高的稳定性、选择性和灵敏性。Huang等[33]以Ce(NO3)3·6H2O、Ni(NO3)2·6H2O为金属离子源,H3BTC为有机配体,合成了Ce-Ni-MOF并掺入碳纳米管构成电化学传感器用于检测双酚A。在检测含相同浓度的双酚A溶液时,Ce-Ni-MOF/MWCNTs/GCE与单金属MOFs和SWCNTs的复合材料修饰电极相比,峰值电流显著增加,这说明双金属MOFs材料的电催化位点增加,加快了电子转移速率,有效增强了电催化作用。
2.2 MOFs复合物
MOFs复合物是指在单纯MOFs的基础上,掺杂或负载其它材料,构建不同组成和尺寸的新材料,以达到弥补原始MOFs材料缺陷的目的(见表2)。常见的二元复合材料有MOFs/碳[20]、MOFs/金属及金属氧化物[34]、MOFs/聚合物[35]等,还有一些在二元复合物基础上再加入其它组分的三元复合物[36]。
表 2 MOFs复合物构建的电化学传感器在检测痕量酚类污染物中的应用Table 2. Applications of electrochemical sensors constructed by MOFs composites for the detection of trace phenolic pollutants检测电极Electrode 目标检测物Analyte 检测方法Method 线性范围/(μmol·L−1)Linear range 检测限度/(μmol·L−1)LOD MIL-101(Cr)-rGO-2-CPE[20] 邻苯二酚 DPV 10—1400 4.1 对苯二酚 4—1000 0.66 RGO@Ce-MOF[25] 二氯酚 DPV 0.02—10 0.007 Ce-Ni-MOF/MWCNTs/GCE[29] 双酚A DPV 0.1—100 0.0078 Cu-MOF/ZnTeNRs/AuNPs/GCE[36] 邻苯二酚 DPV 0.25—300 0.016 Ni-MOF@CNTs/GCE[37] 双酚A DPV 0.001—1.0 0.00035 Fe-CuMOF/rGO/GCE[38] 邻苯二酚 AMP 0.1—800 0.016 间苯二酚 0.1—720 0.02 Cu-MOF-GN/GCE[39] 邻苯二酚 DPV 1—1000 0.33 对苯二酚 1—1000 0.59 M@Pt@M-rGO/GCE[40] 邻苯二酚 DPV 0.1—160 0.032 对苯二酚 0.05—20;20—200 0.015 间苯二酚 0.4—30;30—300 0.133 MOF-ERGO-5/GCE[41] 邻苯二酚 DPV 0.1—566 0.1 对苯二酚 0.1—476 0.1 Cu3(btc)2/CS-ERGO/GCE[42] 邻苯二酚 DPV 2—200 0.41 对苯二酚 5.0—400 0.44 间苯二酚 1—200 0.33 PPy@ZIF−8/GAs/GCE[43] 4−氯酚 SWV 0.0003—0.01 0.0001 Ce-MOF-ERGO/GCE (with 0.1 mmol·L−1 CTAB)[44] 双酚A DPV 0.003—10 0.0019 MIP-Eu-MOF-CNTs/GCE[45] 双酚S DPV 0.05—50 0.025 CuMOF-Tyr-CS/GCE[46] 双酚A AMP 0.05—3 0.013 Hemin/Cu-MOF-74/GCE[47] 2,4,6-三氯苯酚 DPV 0.01—9 0.005 FxGnP-Ni-MOF[48] 双酚A AMP 0.002—10 0.000184 Ag@MOF-5(Zn)/GCE[49] 2−甲基−4−硝基苯酚 DPV 0.1—10;50—1000 0.056 4−亚硝基苯酚 0.1—10;50—500 0.057 2−亚硝基苯酚 0.1—10;50—200 0.09 NiMOF/rGO paper/GCE[50] 邻苯二酚 AMP 0.02—760 0.0018 2.2.1 MOFs/碳
MOFs/碳是在众多MOFs复合物中最为常见的一类,一是因为MOFs的稳定性和导电性较差,不利于直接应用于电化学检测,而碳材料结构稳定、导电性强、成本低,二者结合有互补效果;二是因为碳材料的存在形式多种多样,可以分为一维碳材料,如碳纳米管和碳纳米纤维,二维碳材料,如石墨烯纳米片,三维碳材料,如石墨烯气凝胶等,它们与MOFs材料结合表现出不同的检测优势。
对于一维碳材料,2015年,Zhou等[24]将单壁碳纳米管滴铸在电极上,再通过电化学沉积法负载Cu-MOF-199以构建电化学传感器。单壁碳纳米管在电极表面形成三维网络结构,增大了Cu-MOF-199的比表面积和稳定性,形成了导电互连网络,有利于电荷转移,弥补了MOFs材料电导率低的缺陷。修饰电极在同时检测对苯二酚和邻苯二酚时表现出较高的选择性,在循环伏安曲线中两氧化峰电位分离可达105 mV,能够明显地分辨邻苯二酚和对苯二酚。与传统的三维晶体MOFs相比,二维MOFs具有较大的表面积和利用性更高的活性位点,从而提高了传感器的响应灵敏度[51],但缺点是容易团聚重叠。2020年,Xu等[37]在碳纳米管悬浮液中加入金属粒子,通过物理吸附作用结合,再以Ni2+为成核位点加入有机配体,原位合成二维Ni-MOF@CNT用于检测痕量的双酚A。碳纳米管可以防止二维Ni-MOF的重构团聚问题,更加有利于电子输运,增强MOFs的稳定性,进而实现对污染物的高效检测。
除了一维碳材料外,二维碳材料包括氧化石墨烯(GO)、化学还原GO(rGO)、电化学还原GO(ERGO)和石墨烯纳米带等,它们具有优越的柔韧性、较高的机械和电子性能[38]。合成二维碳和MOFs复合物以制备修饰电极的方法多种多样,如电化学沉积法[50]、超声分散法[39]、原位生长法[20]等等。Kader Dağcı Kıranşan[50]采用电化学沉积法在rGO表面沉积Ni-MOF,形成了直径为200 nm的粗糙花状结构,这种结构的活性面积大,催化性能好。Li等[39]分别制备Cu-MOF和氧化石墨烯片(GN),将二者的粉末在去离子水中超声分散,分散液滴铸在玻碳电极表面后进行电化学还原,制备成Cu-MOF-GN/GCE以检测4-壬基酚。这种方法简单快捷,但二者之间的结合力弱,容易脱落。为解决这一问题,Wang等[20]采用水热法在MIL-101(Cr)表面复合rGO,并用于检测邻苯二酚和对苯二酚,复合材料的表面活性、稳定性和重现性得到了优化。
与二维石墨烯材料相比,三维石墨烯结构能够有效防止MOFs材料的团聚[52],而且它的孔隙度更高、比表面积更大,十分有利于检测物在三维腔中的富集,因此在污染物的检测和吸附领域备受关注[53]。2019年,Lu等[54]在石墨烯气凝胶(GA)上原位生长UiO-66-NH2以构建电化学传感器,用于检测重金属离子。UiO-66-NH2/GA复合材料的大比表面积和分层多孔结构赋予了其更多可用的活性位点和质量/电子转移通道,因此选择性和灵敏性都得到提升,可以同时检测含多种重金属离子的水体。类似的,Luo等[55]通过水热法原位合成ZIF-67@三维还原氧化石墨烯气凝胶纳米复合材料用于检测芦丁,最低检测限可达到0.028 μmol·L−1。三维碳材料和MOFs材料的结合表现出协同效应,在未来可应用于酚类污染物的检测,其原因主要可以概括为以下几点[53-57]:(1)与碳材料结合的MOFs通常尺寸相对较小,可以有效生长在石墨烯气凝胶表面或孔隙中;(2)碳材料可以增强MOFs的导电性和机械稳定性;(3)三维碳材料密度极小,孔隙率高,比表面积大;(4)待测物和MOFs或三维碳的结构之间通常存在相互吸引和结合的力,使痕量污染物富集以达到灵敏检测的目的。
2.2.2 MOFs/金属及金属氧化物
金属纳米粒子的粒径小,一些功能性贵金属纳米粒子的催化性能和导电性能优异,但其最显著的缺点就是容易团聚[58-59],将微小粒子锚定或镶嵌在MOFs的孔道内部可以解决团聚问题,使其更均匀地分布在MOFs表面或内部,增大与待测物的接触面积。
2019年,Ye等[40]成功合成了一种特殊的“三明治”结构的M@Pt@M-rGO复合物并用于酚类污染物的检测。这种夹层结构是指将Pt纳米粒子封装在MOFs的层或孔道中,以确保其活性位点的有效性。除了解决团聚问题以外,经过修饰的金属材料还可能与污染物形成某种“连接”,从而使检测效果更好。2020年,Mollarasouli等[36]不仅在MOFs之中掺入贵金属粒子,还加入了EDTA官能化的ZnTe纳米棒,合成了一种三元复合物用于邻苯二酚的痕量检测。Cu-MOF/ZnTeNRs/AuNPs/GCE在检测邻苯二酚时表现优异有两个重要原因,一是Au纳米颗粒和ZnTe纳米棒均匀分散使复合物催化性能提高,二是邻苯二酚中的羟基能够与EDTA化的ZnTe纳米棒中的羧基相互作用,使得邻苯二酚和电极表面有更高的亲和力。
金属及金属氧化物与MOFs复合的形式是多种多样的,例如,Liu等[17]将二者的复合方式分为表面负载、全包围式和半包围式。Li等[41]提出了4种不同的合成策略,分别是在MOFs外部自组装金属纳米粒子、在分散的金属纳米粒子周围建造MOFs外壳、MOFs和金属纳米粒子的夹层结构、MOFs和金属纳米粒子的同步合成。这些新颖的结构和巧妙的设计为酚类污染物的灵敏检测提供了思路。
2.2.3 MOFs/聚合物
聚合物是一种在功能上可以和MOFs互补的常用材料,在一定程度上可以弥补MOFs导电性和稳定性差的劣势。在电化学检测领域,有一些导电聚合物是经常作为粘连剂或者支撑剂加入到MOFs中,除此之外,在MOFs外围合成分子印迹聚合物,制备具有优良性能的分子印迹材料作为电化学信号放大元件,是有效提高传感器灵敏性的方法。接下来以导电聚合物和分子印迹聚合物为例,介绍MOFs/聚合物在酚类的电化学检测中的应用。
壳聚糖是一种无毒、易制膜、渗透性高、有稳定共价键且成本低的聚合物[60],它的加入能够增强材料的机械稳定性。2016年,Yang等[42]以壳聚糖(CS)作为支撑剂和氧化石墨烯(GO)生长在一起,滴铸在电极上再在Cu3(btc)2悬浮液中混合得到Cu3(btc)2/CS-ERGO,Cu3(btc)2在保持自身完整结构的同时表面被CS-ERGO覆盖。这样得到的修饰电极能够区分邻苯二酚、对苯二酚、间苯二酚,三者的峰值电位差明显,同时,CS-ERGO矩阵的高电导率大大提高了二羟基苯的电化学信号强度,有更高的灵敏度。
GA是一种性能优异的碳材料,但表面几乎不存在官能团,在与其它物质复合时可能会出现易分离、易脱落的问题。2019年,Xie等[43]在GO表面负载聚吡咯(PPy)后采用水热法合成PPy/GA,在此基础上原位合成ZIF-8,最终得到PPy@ZIF-8/GA用于检测二氯酚。引入聚吡咯作为粘合剂,聚吡咯链中的氨基基团和金属离子之间有很强的配位作用,可以和MOFs的中心离子紧密地连接,能够保证MOFs不会轻易脱离GA。由于聚吡咯是无毒的导电聚合物,在增强复合物稳定性和导电性的同时不会对环境造成污染。
分子印迹聚合物(MIP)的结构可变,能够特异性识别物质,具有高选择性、高稳定性和可重复性,将其与MOFs材料复合并用于电化学传感器的表面修饰能够优化其检测性能[61]。2020年,Wang等[44]在支持电解质溶液中加入不同浓度的分子印迹聚合物十六烷基三甲基溴化铵(CTAB),并用表面由Ce-MOF-ERGO修饰的电化学传感器检测双酚A。研究表明,在支持电解质中添加CTAB有利于减少双酚A的电氧化钝化,使双酚A在修饰电极上的氧化峰值电流增大到原来的1.8倍。该课题组在进一步的研究中,以Eu-MOF-CNTs复合材料作为支撑材料,在支撑材料表面电化学合成聚吡咯以检测双酚S(BPS)[45]。在模板分子BPS的浓度、聚合扫速和聚合圈数都符合最佳条件时,基于MIP-Eu-MOF-CNTs/GCE构建的电化学传感器检测限低至25 nmol·L−1,稳定性、抗干扰性和回收率良好。
2.2.4 MOFs/生物复合材料
近年来,在生物科学、材料科学和信息科学等新兴学科发展的推动下,作为交叉学科产物的电化学生物传感器在电化学检测领域引起了广泛关注。在这一类传感器中,许多纳米材料被用作电极修饰物和载体来固定生物分子,以提高分析性能[62]。传感装置界面上固定化生物分子的数量直接影响到传感器的准确度和灵敏度,具有大比表面积和多孔结构以及可调结构和功能的MOFs被认为是固定生物分子最有前途的材料之一[63]。MOFs/生物复合材料可以作为传感器的信号识别元件、信号传导元件、信号放大元件等应用于环境污染物检测领域,如MOFs/酶生物复合材料用于检测痕量酚类污染物。在这种复合材料中,酶一般被固定在MOFs的表面或孔道,能够更加高效地与待测物接触,提高检测电极的灵敏性。2015年,Wang等[46]选择酪氨酸酶(Tyr)作为模拟酶,Cu-MOF作为固定基质,并加入CS滴铸在玻碳电极表面,最终得到Cu-MOF-Tyr-CS/GCE。与未固定化的Tyr相比,加入的Cu-MOF中含有苯二羧酸盐有机配体能够和待检测物双酚A之间产生π-π堆叠作用,促进了双酚A在电极表面的预富集,从而增加了酶基质的可用浓度。与此同时,Cu-MOF表面并未被Tyr完全覆盖,能在固定酶的同时充分发挥其优势。复合材料在电极表面构建的膜吸水后会发生膨胀形成多孔结构,为酶催化底物或待测物提供通道,保证其快速扩散,进而缩短响应时间。Cu-MOF-Tyr-CS/GCE检测双酚A的灵敏度可达到0.2242 mA·L·mol−1,大于亲水性石墨烯和Tyr及CS的复合物修饰电极的灵敏度,证明MOFs材料作为固定化矩阵能够有效优化检测效果。
但是,周围环境对酶活性的影响较大,将酶暴露在表面可能会导致复合物寿命较短,不利于长期使用。因此,构造笼式结构的MOFs并封装酶活性分子或是在酶活性分子外部原位生长MOFs可以较好地解决这一问题。2017年,Zhang等[47]以2,5-二羟基对苯二甲酸为有机配体,合成了孔结构清晰的Cu-MOF-74,并加入到血红素(Hemin)溶液中,经过搅拌、离心和干燥,得到Hemin被封装在Cu-MOF-74内部的Hemin/Cu-MOF-74。将该复合材料负载在GCE表面,用于检测2,4,6-三氯苯酚时检测限可低至0.005 μmol·L−1,MOFs的结构刚性和约束力可以抑制嵌入的酶蛋白水解和螯合,并增强酶在水介质中的稳定性。
总的来说,MOFs能够利用自身的结构优势,将生物分子封装进它们孔内,在保持生物分子活性的同时防止它们的聚集。此外,MOFs可以选择性地积累靶分子,以增强生物传感器的特异性。考虑到蛋白质分子的尺寸可能大于多数MOFs材料的孔径,进行完整的封装仍存在一些阻碍,需要进一步的研究加以解决。
2.3 MOFs衍生物
针对MOFs稳定性和导电性差的缺陷,有人认为将MOFs与其他导电材料直接复合会使MOFs在导电基质中不均匀分散而导致自身性能下降[64]。有人提出将MOFs转化成杂氮多孔碳材料、功能性金属氧化物和金属磷化物等高活性的电催化衍生物。电化学传感器的可重复性、可重现性和稳定性在经过MOFs衍生物进行表面修饰后得到提高,因此逐渐走进大众视野(见表3)。
表 3 MOFs衍生物构建的电化学传感器在检测痕量酚类污染物中的应用Table 3. Applications of electrochemical sensors constructed by MOFs derivatives for the detection of trace phenolic pollutants检测电极Electrode 目标检测物Analyte 检测方法Method 线性范围/(μmol·L−1)Linear range 检测限度/(μmol·L−1)LOD ZIF-67-1000/GCE[64] 邻苯二酚 DPV 1—300 0.267 对苯二酚 1—200 0.348 C-ZIF-67/PAN-800/GCE[65] 邻苯二酚 DPV 1—200 1 对苯二酚 1—120 1 NPC-FJU-40-H/GCE[66] 邻苯二酚 DPV 1—100 0.31 对苯二酚 1—70 0.18 ZIF-8@rGO-0.02/GCE[67] 邻苯二酚 DPV 0.5—10;10—70 0.076 对苯二酚 0.5—10;10—70 0.073 Alk-Ti3C2/N-PC/GCE[68] 邻苯二酚 DPV 0.5—150 0.0031 对苯二酚 0.5—150 0.0048 FeOx/TiO2@mC700/GCE[69] 4−亚硝基甲苯 DPV 5—310 0.183 CoxP/NC/GCE[70] 4−亚硝基苯酚 DPC 0.05—1.0;1.0—4.0 0.002 CoPx@NCNTs/GCE[71] 对硝基苯酚 DPV 0.0025—1;1—1000 0.00079 2.3.1 MOFs衍生碳
在过去的几十年里,碳材料在环境和能源[72]等领域大放异彩,尤其是各种形式的多孔碳材料对污染物的吸附[73]和催化[74]都有很好的效果。而在电化学领域,有序孔隙结构和高度石墨化的碳材料更有益于检测灵敏度的提高,与其他材料形成新颖的结构也是研究的热点[75-76]。
MOFs衍生碳检测效果通常取决于碳化程度和孔结构[66],为了达到更佳的检测效果,一般选择碳含量高、稳定性好且活性位点多的MOFs材料,在惰性气体保护下热解获得。在热解过程中,热解温度是一个对材料性能影响较大的因素[74]。因此,Xu等[64]以ZIF-8为前驱体,探究热解温度对痕量检测酚类污染物效果的影响。碳化前,80 °C阶段去除自由水,150 °C阶段去除结合水,然后在不同温度下氩气保护中碳化。1000 °C时,ZIF-8的中心金属逃逸,经过高温碳化形成多层石墨烯结构,原子层距离为0.348 nm,对应石墨烯的(002)平面,证明石墨烯的存在。而其他温度碳化的衍生物不存在该结构,因此Z-1000这种高度石墨化且孔结构高度有序的衍生物能够灵敏地检测尿素、邻苯二酚和对苯二酚。利用10个Z-1000改性电极对0.1 mmol·L−1的尿酸进行平行检测,其电流的相对标准偏差等于1.04%,表明传感器具有良好的再现性。
MOFs直接碳化得到的MOFs衍生碳可能会出现电子转移中断的问题,为了进一步提高其导电性,一些研究者将MOFs衍生碳与适当的导电基质结合以达到更好的检测效果。2019年,Chen等[67]制备ZIF-8,使之原位生长在氧化石墨上,再进行碳化和还原,合成了ZIF-8C@rGO。ZIF-8C和rGO之间存在协同效应,复合物既具有杂氮多孔碳比表面积大、孔隙度高和电活性位点丰富的特点,又发挥了石墨烯基底电导率高的优势。除此之外,MOFs衍生碳和二维纳米材料结合还能起到防止重构的作用。Ti3C2是一种新型二维碳化物,具有优越的传感性能,碱化的Ti3C2可以提供丰富的羟基,与邻苯二酚之间形成氢键[77]。但是这种二维材料容易重构,导致活性表面积和电导率急剧降低,限制其电化学性能。2020年,Huang等[68]将MOF-5-NH2碳化,插入到碱化Ti3C2(alk-Ti3C2)的片状结构之间得到alk-Ti3C2/N-PC。一方面,N-PC可以阻止片层的重叠,另一方面,MOFs衍生碳提供了多孔结构、较大的表面积和更多活性催化位点,C—N键的存在有利于邻苯二酚和对苯二酚的检测。并且该修饰电极的重复性令人满意,在同一传感器的5次平行测试中,检测邻苯二酚和对苯二酚的相对标准偏差分别为1.1%和0.9%。
2.3.2 MOFs衍生的金属氧化物
一些金属和金属氧化物纳米粒子如Pt、Ag、Au、Fe3O4和TiO2都具有尺寸小、电导率高和电催化性能良好的显著优点[40,58-59],但纳米材料的高表面能导致它们很容易团聚。以碳作为纳米材料的载体通常需要多个步骤,操作繁琐,因此,把它们固定在MOFs框架内再进行碳化,是发挥其性能并提高稳定性的有效策略[78-79]。
在选择合成衍生物的前驱体时,中心金属的毒性、合成成本、电导率和电催化性能都是需要综合考虑的因素。一般来说,更倾向于选择高自然丰度、低毒性、高电子转移率、无污染的前驱体,如Fe-MOFs、Ti-MOFs、Co-MOFs等[69,80-81]。2019年,Wang等[69]选择含有氨基的双金属MOFs材料Fe/Ti-MOF-NH2作为前躯体,调节热解温度,最终确定在700°C下热解,合成FeOx/TiO2@mC700。FeOx和TiO2纳米颗粒被同步嵌入到MOFs衍生碳的孔隙中,TiO2丰富的活性位点、FeOx的催化活性和多孔碳良好的电荷转移能力具有协同效应,使得FeOx/TiO2@mC700/GCE检测4-亚硝基苯酚的检测限低至0.183 μmol·L−1,在2—310 μmol·L−1范围内呈线性关系,构建的5个传感器,其相对标准偏差在4%左右,可重现性良好。
2.3.3 MOFs衍生的金属磷化物
过渡金属磷酸盐被视为是一种有效的电催化剂[82-83],它的分层纳米结构和导电框架对于物质扩散和电子转移非常重要,是提高催化性能的关键[84-85]。受到过渡金属磷酸盐析氢反应和析氧反应的启发[86],有人尝试将MOFs材料进行碳化和磷酸化以合成MOFs衍生的金属磷化物用于电化学检测污染物领域[70-71]。
磷化钴的导电性强,催化活性高,因此在众多金属磷化物中倍受关注[87-88]。Xiao等[70]以Zn(PO4)x作为纳米尺寸ZIF-67原位生长的模板,用一步法合成磷化钴,再在900 °C下热解并用HCl清洗,最终得到CoxP/NC用于构建电化学传感器以检测4-亚硝基苯酚。关于CoxP的形成过程,Liang等[89]提出,ZIF-67的中心金属钴在碳化后可以催化还原磷酸盐为单质磷,而磷又可以和钴生成磷化钴。这样得到的磷化钴成本低,性能好,表面积高达826 m2·g−1,表面粗糙且孔隙率高,含有丰富的活性位点,对4-亚硝基苯酚的检测限低至2 nmol·L−1,CoxP/NC/GCE在存放一周后的峰值电流仍能达到最初的95%以上。
Wang等[71]以ZIF-67为前驱体,先在相同的温度下以不同的升温速度进行碳化热解,再在较低温度下磷酸化。碳化温度均为800 °C,升温速度为1 oC·min−1时得到Co@NCNTs多面体,升温速度为5 °C·min−1时得到Co@NC多面体,这说明碳化热解的温度对材料的形态产生一定的影响。在对CoPx@NC和CoPx@NCNTs(x=0, 1/2, 1)进行电化学行为分析时发现,后者在铁氰化钾溶液中的CV曲线有更高的氧化还原峰,并且在EIS图中低频区的斜率更大,这些都说明铁氰化钾在CoPx@NCNTs内部的扩散更高效。CoPx@NC/GCE和CoPx@NCNTs/GCE的电化学活性表面积分别为7.36 cm2和11.84 cm2,CoPx@NCNTs/GCE的法拉第电流密度是CoPx@NC/GCE的1.8倍,CoPx@NCNTs具有更高的电导率、表面积和活性位点,用它构建传感器来检测痕量的对硝基苯酚,检测限可低至0.79 nmol·L−1.
以上研究得到的磷化物是Co2P和CoP的混合物,具体在什么阶段生成何种产物并无定论,二者对整体催化性能的提高分别有何贡献也无从知晓。有人认为,富P的CoP2的催化性能比同类型富Co的CoP和Co2P更高[90-91]。因此,Wu等[92]以一种简单的同时碳化和磷化的方法,调节钴源和磷源的比例,取50 mg ZIF-67和500 mg NaH2PO2合成CoP2-N-C,取50 mg ZIF-67和250 mg NaH2PO2合成CoP-N-C,用于检测痕量氯霉素。结果表明在相同条件下,CoP2-N-C的峰值电流显著高于CoP-N-C,这说明前者的催化活性更高。研究者认为主要原因是CoP2包含更多电负性较高的P原子,带负电荷的P更容易富集待测物,并有利于电化学还原。这对于后续MOFs衍生金属磷化物对酚类污染物的检测有一定的启发作用。
3. 展望(Prospect)
本文综述了基于单纯MOFs、MOFs复合物、MOFs衍生物表面修饰的电化学传感器在酚类污染物检测中的应用,重点介绍了这些材料的合成策略和检测效果之间的关系。与裸电极相比,这些修饰后的电极具有更宽的线性范围和更低的检测限,稳定性和重现性也得到了提高。
目前,相关研究仍处于探索阶段,构建实用效能最大化,环境污染最小化的电化学传感器并能广泛应用于实际是未来的目标。MOFs材料发达的孔隙结构和优越的比表面积能够加快待测物富集的速度,提高检测的效率;可调节的孔道和多样的配位模式能够有效增强对相似结构污染物的选择性;MOFs材料形成复合物和衍生物一定程度上放大了MOFs的优点并弥补了一些缺陷。但是,MOFs基电化学传感器由实验探究走向实际应用还需要继续完善和优化。一方面,延长传感器的使用寿命,降低构建成本是需要优先考量的问题。另一方面,在追求经济效益的同时,以可持续绿色发展的理念提高环境效益,也是在经济迅猛发展的今天应该被重视的问题。研发人员应不断优化技术路线,企业和政府部门贯彻环保理念,设备生产商完善应用缺陷,三方共同努力,积极将新型MOFs基材料应用于电化学领域,寻找综合性能更好的MOFs材料检测痕量污染物,具有十分重要的现实意义。
-
表 1 铁改性生物炭在重金属污染土壤中的应用
Table 1. Application of iron-modified biochar in heavy metal contaminated soil
原材料 改性方法 热解温度 投加量 重金属 修复效果 参考文献 油菜秸秆 FeCl3改性 600 ℃ 2.5%~10% Cd 土培90 d,土壤有效态Cd含量降低了22.5%~32.3% [92] 玉米秸秆 FeCl3改性 450 ℃ 10 g·kg−1 Cd/As 对As的去除效果比未改性时提高了43.68%,但降低了对Cd的吸附 [76] 稻草、小麦秸秆、玉米秸秆 FeCl3改性 400 ℃ 1%~10% Cd/As 10%的投加量下,铁改性玉米秸秆生物炭对As和Cd的固定效率分别为63.21%和95.1% [58] 悬铃木、猪 FeCl3改性 650 ℃ 3% As/Pb 铁改性悬铃木和铁改性猪生物炭使土壤有效态Pb含量降低了12.1%和15.5%,使土壤有效态As含量降低了32.8%和35.9% [98] 柳渣 FeCl3/nZVI改性 700 ℃ 1% Cr nZVI改性生物炭处理降低了Cr(VI)含量,玉米生物量提高了31% [95] 麦秸 FeS改性 ─ 2.5~10 mg·g−1 Cr 2.5、5、10 mg·g−1铁改性生物炭处理下TCLP可提取的Cr(VI)浓度分别降低94.7%、96.5%和96.6% [27] 果壳 FeS/nZVI/Fe3O4改性 600 ℃ 3% Pb nZVI/BC对Pb的固定效率高达54.68%,修复效果最好 [99] 小麦秸秆 Fe2O3改性 500 ℃ 4% As 土壤水溶态砷含量降低了89.74%,As的生物有效性降低 [81] 桉树木屑/猪粪 Fe3O4改性 400 ℃ 2% Cd/Zn/Pb 磁性生物炭显著降低了土壤有效态重金属含量,抑制芦苇对重金属的吸收 [41] 稻壳 Fe3O4改性 400 ℃ 0.05%~1.6% Cd 0.2%~0.4%铁改性生物炭处理下有效态Cd含量下降了6.81%~25% [25] 稻壳 Fe3O4改性 400 ℃ 0.05%~1.6% As 0.05%~1.6%铁改性生物炭处理下土壤非专性吸附态砷含量降低了29.9%~62.3% [75] 雪松木屑 Fe3O4改性 300 ℃ 10% As/Cd/Pb 磁分离回收铁改性生物炭后,土壤砷、镉、铅总浓度分别下降了28%、25%和32% [28] 核桃壳 Fe3O4改性 ─ 0.25% Cr 处理组土壤中TCLP可提取态总Cr和Cr(VI)含量分别降低了38.99%~98.21%,46.99%~92.35% [100] 麦秸 FeOOH改性 600 ℃ 0.5%~1.5% Cd 1.5%投加量下,铁改性生物炭处理组土壤残渣态镉含量从20.8%变为46.6% [101] ─ nFe3O4/nZVI改性 ─ 2~16 g·kg−1 Pb 8 g·kg−1投加量下,nFe3O4-BC和nZVI-BC的固定化率分别为23%和42% [47] 稻草 nZVI改性 500 ℃ 2%~8% Cd 8%nZVI/BC处理下土壤弱酸可提取态Cd含量从70%降低为54% [102] 花生壳 nZVI改性 450 ℃ 10 g·kg−1 Se 处理30 d后对Se固定效率为60.61% [73] 甘蔗渣 nZVI改性 600 ℃ 8 g·kg−1 Cr Cr(VI)和总铬的固定效率达到了100%、92.9% [65] 棕榈 nZVI改性 500 ℃ 0.1% As/Cd 水稻生长拔节期和成熟期,土壤弱酸可提取态镉含量降低51.2%和23.6%,水稻茎叶部砷含量降低了47.8% [83] 柳枝 nZVI改性 400 ℃ 5% Cr 有效促进了Cr的固定,铁改性生物炭处理下残渣态铬含量提高了11.58% [103] 绿茶 nZVI改性 150~650 ℃ 10 g·kg−1 Pb 与原始nZVI相比,nZVI改性生物炭固定化效率提高了19.38%,与生物炭相比,固定化效率提高了57.14% [55] 稻壳 nZVI改性 600~1 000 ℃ 4%~12% Cr Fe-RBC-800处理后不仅污染土壤中Cr的酸溶态消失,渗滤液中Cr(VI)也被完全去除 [29] -
[1] YANG Q Q, LI Z Y, LU X N, et al. A review of soil heavy metal pollution from industrial and agricultural regions in China: Pollution and risk assessment[J]. Science of the Total Environment, 2018, 642: 690-700. doi: 10.1016/j.scitotenv.2018.06.068 [2] HU B F, ZHAO R Y, CHEN S C, et al. Heavy metal pollution delineation based on uncertainty in a coastal industrial city in the yangtze river delta, China[J]. International Journal of Environmental Research and Public Health, 2018, 15(4): 710. doi: 10.3390/ijerph15040710 [3] 环境保护部, 国土资源部. 全国土壤污染状况调查公报[J]. 国土资源通讯, 2014(8): 26-29. [4] 陈能场, 郑煜基, 何晓峰, 等. 《全国土壤污染状况调查公报》探析[J]. 农业环境科学学报, 2017, 36(9): 1689-1692. doi: 10.11654/jaes.2017-1220 [5] JIA X L, FU T T, HU B F, et al. Identification of the potential risk areas for soil heavy metal pollution based on the source-sink theory[J]. Journal of Hazardous Materials, 2020, 393: 122424. doi: 10.1016/j.jhazmat.2020.122424 [6] QIN G W, NIU Z D, YU J D, et al. Soil heavy metal pollution and food safety in China: Effects, sources and removing technology[J]. Chemosphere, 2021, 267: 129205. doi: 10.1016/j.chemosphere.2020.129205 [7] HAMID Y, TANG L, SOHAIL M I, et al. An explanation of soil amendments to reduce cadmium phytoavailability and transfer to food chain[J]. Science of the Total Environment, 2019, 660: 80-96. doi: 10.1016/j.scitotenv.2018.12.419 [8] YAASHIKAA P R, KUMAR P S, VARJANI S, et al. A critical review on the biochar production techniques, characterization, stability and applications for circular bioeconomy[J]. Biotechnology Reports, 2020, 28: e00570. doi: 10.1016/j.btre.2020.e00570 [9] LIU Z G, ZHANG F S. Removal of lead from water using biochars prepared from hydrothermal liquefaction of biomass[J]. Journal of Hazardous Materials, 2009, 167(1): 933-939. [10] SAIFULLAH, DAHLAWI S, NAEEM A, et al. Biochar application for the remediation of salt-affected soils: Challenges and opportunities[J]. Science of the Total Environment, 2018, 625: 320-335. doi: 10.1016/j.scitotenv.2017.12.257 [11] ZHENG H, WANG X, CHEN L, et al. Enhanced growth of halophyte plants in biochar-amended coastal soil: roles of nutrient availability and rhizosphere microbial modulation[J]. Plant Cell and Environment, 2018, 41(3): 517-532. doi: 10.1111/pce.12944 [12] WU S W, ZHANG Y, TAN Q L, et al. Biochar is superior to lime in improving acidic soil properties and fruit quality of Satsuma mandarin[J]. Science of the Total Environment, 2020, 714: 136722. doi: 10.1016/j.scitotenv.2020.136722 [13] NIE C R, YANG X, NIAZI N K, et al. Impact of sugarcane bagasse-derived biochar on heavy metal availability and microbial activity: A field study[J]. Chemosphere, 2018, 200: 274-282. doi: 10.1016/j.chemosphere.2018.02.134 [14] ZHAN F D, ZENG W Z, YUAN X C, et al. Field experiment on the effects of sepiolite and biochar on the remediation of Cd- and Pb-polluted farmlands around a Pb-Zn mine in Yunnan Province, China[J]. Environmental Science and Pollution Research, 2019, 26(8): 7743-7751. doi: 10.1007/s11356-018-04079-w [15] RAJAPAKSHA A U, CHEN S S, TSANG D C W, et al. Engineered/designer biochar for contaminant removal/immobilization from soil and water: Potential and implication of biochar modification[J]. Chemosphere, 2016, 148: 276-291. doi: 10.1016/j.chemosphere.2016.01.043 [16] 李伟亚, 刘希灵, 李志贤, 等. 生物炭对湘潭锰矿区土壤重金属的固化效应[J]. 生态环境学报, 2018, 27(7): 1306-1312. doi: 10.16258/j.cnki.1674-5906.2018.07.015 [17] WANG L, WANG Y J, MA F, et al. Mechanisms and reutilization of modified biochar used for removal of heavy metals from wastewater: A review[J]. Science of the Total Environment, 2019, 668: 1298-1309. doi: 10.1016/j.scitotenv.2019.03.011 [18] VITHANAGE M, HERATH I, JOSEPH S, et al. Interaction of arsenic with biochar in soil and water: A critical review[J]. Carbon, 2017, 113: 219-230. doi: 10.1016/j.carbon.2016.11.032 [19] LIU W J, ZENG F X, JIANG H, et al. Preparation of high adsorption capacity bio-chars from waste biomass[J]. Bioresource Technology, 2011, 102(17): 8247-8252. doi: 10.1016/j.biortech.2011.06.014 [20] 王重庆, 王晖, 江小燕, 等. 生物炭吸附重金属离子的研究进展[J]. 化工进展, 2019, 38(1): 692-706. doi: 10.16085/j.issn.1000-6613.2018-0993 [21] BEESLEY L, INNEH O S, NORTON G J, et al. Assessing the influence of compost and biochar amendments on the mobility and toxicity of metals and arsenic in a naturally contaminated mine soil[J]. Environmental Pollution, 2014, 186: 195-202. doi: 10.1016/j.envpol.2013.11.026 [22] YIN D X, WANG X, PENG B, et al. Effect of biochar and Fe-biochar on Cd and As mobility and transfer in soil-rice system[J]. Chemosphere, 2017, 186: 928-937. doi: 10.1016/j.chemosphere.2017.07.126 [23] 黄开友, 申英杰, 王晓岩, 等. 生物炭负载纳米零价铁制备及修复六价铬污染土壤技术研究进展[J]. 环境工程, 2020, 38(11): 9. doi: 10.13205/j.hjgc.202011033 [24] 周嗣江, 刘针延, 熊双莲, 等. 同步钝化土壤Cd和As材料的筛选[J]. 环境科学, 2021, 42(7): 3527-3534. doi: 10.13227/j.hjkx.202010022 [25] ZHANG J Y, ZHOU H, GU J F, et al. Effects of nano-Fe3O4-modified biochar on iron plaque formation and Cd accumulation in rice (Oryza sativa L. )[J]. Environmental Pollution, 2020, 260: 113970. doi: 10.1016/j.envpol.2020.113970 [26] ISLAM M S, CHEN Y L, WENG L P, et al. Watering techniques and zero-valent iron biochar pH effects on As and Cd concentrations in rice rhizosphere soils, tissues and yield[J]. Journal of Environmental Sciences, 2021, 100: 144-157. doi: 10.1016/j.jes.2020.07.002 [27] LYU H H, ZHAO H, TANG J C, et al. Immobilization of hexavalent chromium in contaminated soils using biochar supported nanoscale iron sulfide composite[J]. Chemosphere, 2018, 194: 360-369. doi: 10.1016/j.chemosphere.2017.11.182 [28] WAN X M, LI C Y, PARIKH S J. Simultaneous removal of arsenic, cadmium, and lead from soil by iron-modified magnetic biochar[J]. Environmental Pollution, 2020, 261: 114157. doi: 10.1016/j.envpol.2020.114157 [29] LIU X Y, YANG L, ZHAO H T, et al. Pyrolytic production of zerovalent iron nanoparticles supported on rice husk-derived biochar: simple, in situ synthesis and use for remediation of Cr(VI)-polluted soils[J]. Science of the Total Environment, 2020, 708: 134479. doi: 10.1016/j.scitotenv.2019.134479 [30] WANG S S, ZHAO M Y, ZHOU M, et al. Biochar-supported nZVI (nZVI/BC) for contaminant removal from soil and water: A critical review[J]. Journal of Hazardous Materials, 2019, 373: 820-834. doi: 10.1016/j.jhazmat.2019.03.080 [31] LOPES R P, ASTRUC D. Biochar as a support for nanocatalysts and other reagents: Recent advances and applications[J]. Coordination Chemistry Reviews, 2021, 426: 213585. doi: 10.1016/j.ccr.2020.213585 [32] GUAN X H, SUN Y K, QIN H J, et al. The limitations of applying zero-valent iron technology in contaminants sequestration and the corresponding countermeasures: The development in zero-valent iron technology in the last two decades (1994-2014)[J]. Water Research, 2015, 75: 224-248. doi: 10.1016/j.watres.2015.02.034 [33] XIE Y K, DONG H R, ZENG G M, et al. The interactions between nanoscale zero-valent iron and microbes in the subsurface environment: A review[J]. Journal of Hazardous Materials, 2017, 321: 390-407. doi: 10.1016/j.jhazmat.2016.09.028 [34] ZAND A D, TABRIZI A M, HEIR A V. Incorporation of biochar and nanomaterials to assist remediation of heavy metals in soil using plant species[J]. Environmental Technology & Innovation, 2020, 20: 101134. [35] YAN J C, HAN L, GAO W G, et al. Biochar supported nanoscale zerovalent iron composite used as persulfate activator for removing trichloroethylene[J]. Bioresource Technology, 2015, 175: 269-274. doi: 10.1016/j.biortech.2014.10.103 [36] QIAN L B, ZHANG W Y, YAN J C, et al. Nanoscale zero-valent iron supported by biochars produced at different temperatures: Synthesis mechanism and effect on Cr(VI) removal[J]. Environmental Pollution, 2017, 223: 153-160. doi: 10.1016/j.envpol.2016.12.077 [37] SU H J, FANG Z Q, TSANG P E, et al. Remediation of hexavalent chromium contaminated soil by biochar-supported zero-valent iron nanoparticles[J]. Journal of Hazardous Materials, 2016, 318: 533-540. doi: 10.1016/j.jhazmat.2016.07.039 [38] 邓俊敏. 生物炭负载纳米零价铁在还原及氧化体系下对污染物的去除研究[D]. 长沙: 湖南大学, 2018. [39] 朱庆涛, 吴晓毅, 郭启慧, 等. 生物炭负载纳米零价铁的制备及其去除水中污染物的研究进展[J]. 能源化工, 2018, 39(4): 73-77. doi: 10.3969/j.issn.1006-7906.2018.04.015 [40] SHIN J, LEE Y G, KWAK J, et al. Adsorption of radioactive strontium by pristine and magnetic biochars derived from spent coffee grounds[J]. Journal of Environmental Chemical Engineering, 2021, 9(1): 105119. [41] WU J T, HUANG R, ZHOU Q Q, et al. Magnetic biochar reduces phosphorus uptake by Phragmites australis during heavy metal remediation[J]. Science of the Total Environment, 2021, 758: 143643. doi: 10.1016/j.scitotenv.2020.143643 [42] 韩闯. 污泥生物炭水热制备及其对染料脱色研究[D]. 上海: 东华大学, 2017. [43] WEI J, LIU Y T, LI J, et al. Adsorption and co-adsorption of tetracycline and doxycycline by one-step synthesized iron loaded sludge biochar[J]. Chemosphere, 2019, 236: 124254. doi: 10.1016/j.chemosphere.2019.06.224 [44] 王凯. 四氧化三铁基复合纳米颗粒的制备及其生物应用研究[D]. 北京: 北京科技大学, 2019. [45] 李飞. 农林废弃物生物炭的制备、改性及在Cd污染治理中的应用[D]. 南京: 东南大学, 2018. [46] ZHANG M, GAO B, VARNOOSFADERANI S, et al. Preparation and characterization of a novel magnetic biochar for arsenic removal[J]. Bioresource Technology, 2013, 130: 457-462. doi: 10.1016/j.biortech.2012.11.132 [47] LI P R, YU J, HUANGFU Z X, et al. Applying modified biochar with nZVI/nFe3O4 to immobilize Pb in contaminated soil[J]. Environmental Science and Pollution Research, 2020, 27(19): 24495-24506. doi: 10.1007/s11356-020-08458-0 [48] PHILIPPOU K, ANASTOPOULOS I, DOSCHE C, et al. Synthesis and characterization of a novel Fe3O4-loaded oxidized biochar from pine needles and its application for uranium removal. Kinetic, thermodynamic, and mechanistic analysis[J]. Journal of Environmental Management, 2019, 252: 109677. doi: 10.1016/j.jenvman.2019.109677 [49] 段浩楠, 吕宏虹, 王夫美, 等. 生物炭/铁复合材料的制备及其在环境修复中的应用研究进展[J]. 环境化学, 2020, 39(3): 774-790. doi: 10.7524/j.issn.0254-6108.2019103109 [50] 朱浩. 新型磁性纳米材料的设计合成及固定化脂肪酶研究[D]. 兰州: 兰州大学, 2013. [51] WANG K, SUN Y B, TANG J C, et al. Aqueous Cr(VI) removal by a novel ball milled Fe0-biochar composite: Role of biochar electron transfer capacity under high pyrolysis temperature[J]. Chemosphere, 2020, 241: 125044. doi: 10.1016/j.chemosphere.2019.125044 [52] LYU H H, GAO B, HE F, et al. Ball-milled carbon nanomaterials for energy and environmental applications[J]. Acs Sustainable Chemistry & Engineering, 2017, 5(11): 9568-9585. [53] 杜毅, 王向宇. 新型纳米零价铁的绿色合成和改性工艺研究进展[J]. 环境化学, 2016, 35(2): 337-347. doi: 10.7524/j.issn.0254-6108.2016.02.2015081702 [54] ZHANG P, O'CONNOR D, WANG Y N, et al. A green biochar/iron oxide composite for methylene blue removal[J]. Journal of Hazardous Materials, 2020, 384: 121286. doi: 10.1016/j.jhazmat.2019.121286 [55] MANDAL S, PU S Y, SHANGGUAN L X, et al. Synergistic construction of green tea biochar supported nZVI for immobilization of lead in soil: A mechanistic investigation[J]. Environment International, 2020, 135: 105374. doi: 10.1016/j.envint.2019.105374 [56] 祝方, 刘涛, 石建惠. 绿色合成纳米零价铁铜淋洗修复Cr(Ⅵ)污染土壤[J]. 环境工程, 2019, 37(4): 172-176. doi: 10.13205/j.hjgc.201904033 [57] WANG S S, GAO B, ZIMMERMAN A R, et al. Removal of arsenic by magnetic biochar prepared from pinewood and natural hematite[J]. Bioresource Technology, 2015, 175: 391-395. doi: 10.1016/j.biortech.2014.10.104 [58] WANG Y M, WANG S W, WANG C Q, et al. Simultaneous Immobilization of Soil Cd(II) and As(V) by Fe-Modified Biochar[J]. International Journal of Environmental Research and Public Health, 2020, 17(3): 827. doi: 10.3390/ijerph17030827 [59] FAN J, CHEN X, XU Z B, et al. One-pot synthesis of nZVI-embedded biochar for remediation of two mining arsenic-contaminated soils: Arsenic immobilization associated with iron transformation[J]. Journal of Hazardous Materials, 2020, 398: 122901. doi: 10.1016/j.jhazmat.2020.122901 [60] ZHU S S, HO S H, HUANG X C, et al. Magnetic Nanoscale zerovalent iron assisted biochar: interfacial chemical behaviors and heavy metals remediation performance[J]. ACS Sustainable Chemistry & Engineering, 2017, 5: 9673-9682. [61] 曹媛, 李晓东, 彭昌盛, 等. 浸渍热解法制备铁改性生物炭活化过硫酸盐去除2, 4-二硝基甲苯, 环境工程, 2021, 39(11): 135-142. [62] WU C, CUI M Q, XUE S G, et al. Remediation of arsenic-contaminated paddy soil by iron-modified biochar[J]. Environmental Science and Pollution Research, 2018, 25(21): 20792-20801. doi: 10.1007/s11356-018-2268-8 [63] QIN S N, FAN H D, JIA L, et al. Molecular structure analysis and mercury adsorption mechanism of iron-based modified biochar[J]. Energy Fuels, 2022, 36: 3184-3200. doi: 10.1021/acs.energyfuels.1c03832 [64] MANDAL S, PU S Y, HE L L, et al. Biochar induced modification of graphene oxide & nZVI and its impact on immobilization of toxic copper in soil[J]. Environmental Pollution, 2020, 259: 113851. doi: 10.1016/j.envpol.2019.113851 [65] SU H J, FANG Z Q, TSANG P E, et al. Stabilisation of nanoscale zero-valent iron with biochar for enhanced transport and in-situ remediation of hexavalent chromium in soil[J]. Environmental Pollution, 2016, 214: 94-100. doi: 10.1016/j.envpol.2016.03.072 [66] PEI G P, ZHU Y, WEN J G, et al. Vinegar residue supported nanoscale zero-valent iron: Remediation of hexavalent chromium in soil[J]. Environmental Pollution, 2020, 256: 113407. doi: 10.1016/j.envpol.2019.113407 [67] LIU J, LIU A R, ZHANG W X. The influence of polyelectrolyte modification on nanoscale zero-valent iron (nZVI): Aggregation, sedimentation, and reactivity with Ni(II) in water[J]. Chemical Engineering Journal, 2016, 303: 268-274. doi: 10.1016/j.cej.2016.05.132 [68] ZHAO L, CAO X D, MASEK O, et al. Heterogeneity of biochar properties as a function of feedstock sources and production temperatures[J]. Journal of Hazardous Materials, 2013, 256: 1-9. [69] 王向前, 胡学玉, 陈窈君, 等. 生物炭及改性生物炭对水环境中重金属的吸附固定作用[J]. 环境工程, 2016, 34(12): 32-37. doi: 10.13205/j.hjgc.201612007 [70] QIAO J T, LIU T X, WANG X Q, et al. Simultaneous alleviation of cadmium and arsenic accumulation in rice by applying zero-valent iron and biochar to contaminated paddy soils[J]. Chemosphere, 2018, 195: 260-271. doi: 10.1016/j.chemosphere.2017.12.081 [71] 林昌华, 马崇坚, 丘勇飞. 铁改性生物质炭对镉污染土壤中小白菜镉吸收及产量和品质的影响[J]. 广东农业科学, 2019, 46(9): 70-76. doi: 10.16768/j.issn.1004-874X.2019.09.010 [72] WU C, SHI L Z, XUE S G, et al. Effect of sulfur-iron modified biochar on the available cadmium and bacterial community structure in contaminated soils[J]. Science of the Total Environment, 2019, 647: 1158-1168. doi: 10.1016/j.scitotenv.2018.08.087 [73] MANDAL S, PU S Y, WANG X K, et al. Hierarchical porous structured polysulfide supported nZVI/biochar and efficient immobilization of selenium in the soil[J]. Science of the Total Environment, 2020, 708: 134831. doi: 10.1016/j.scitotenv.2019.134831 [74] ZHU H H, CHEN C, XU C, et al. Effects of soil acidification and liming on the phytoavailability of cadmium in paddy soils of central subtropical China[J]. Environmental Pollution, 2016, 219: 99-106. doi: 10.1016/j.envpol.2016.10.043 [75] YAO Y, ZHOU H, YAN X L, et al. The Fe3O4-modified biochar reduces arsenic availability in soil and arsenic accumulation in indica rice (Oryza sativa L. )[J]. Environmental Science and Pollution Research, 2021, 28(14): 18050-18061. doi: 10.1007/s11356-020-11812-x [76] 熊静, 郭丽莉, 李书鹏, 等. 镉砷污染土壤钝化剂配方优化及效果研究[J]. 农业环境科学学报, 2019, 38(8): 1909-1918. doi: 10.11654/jaes.2019-0629 [77] ATA-UL-KARIM S T, CANG L, WANG Y J, et al. Effects of soil properties, nitrogen application, plant phenology, and their interactions on plant uptake of cadmium in wheat[J]. Journal of Hazardous Materials, 2020, 384: 121452. doi: 10.1016/j.jhazmat.2019.121452 [78] YANG Z H, ZHANG X M, JIANG Z, et al. Reductive materials for remediation of hexavalent chromium contaminated soil-A review[J]. Science of the Total Environment, 2021, 773: 145654. doi: 10.1016/j.scitotenv.2021.145654 [79] ZHANG Y C, FAN J J, FU M L, et al. Adsorption antagonism and synergy of arsenate(V) and cadmium(II) onto Fe-modified rice straw biochars[J]. Environmental Geochemistry and Health, 2019, 41(4): 1755-1766. doi: 10.1007/s10653-017-9984-8 [80] 李江遐, 吴林春, 张军, 等. 生物炭修复土壤重金属污染的研究进展[J]. 生态环境学报, 2015, 24(12): 2075-2081. doi: 10.16258/j.cnki.1674-5906.2015.12.024 [81] LI L F, ZHU C X, LIU X S, et al. Biochar amendment immobilizes arsenic in farmland and reduces its bioavailability[J]. Environmental Science and Pollution Research, 2018, 25(34): 34091-34102. doi: 10.1007/s11356-018-3021-z [82] XUE Q, RAN Y, TAN Y Z, et al. Arsenite and arsenate binding to ferrihydrite organo-mineral coprecipitate: Implications for arsenic mobility and fate in natural environments[J]. Chemosphere, 2019, 224: 103-110. doi: 10.1016/j.chemosphere.2019.02.118 [83] 刘书四. 改性生物炭对水稻土壤中镉和砷生物有效性以及根际微生态的影响[D]. 广州: 华南理工大学, 2017. [84] KLUEPFEL L, KEILUWEIT M, KLEBER M, et al. Redox properties of plant biomass-derived black carbon (biochar)[J]. Environmental Science & Technology, 2014, 48(10): 5601-5611. [85] XU H J, WANG X H, LI H, et al. Biochar impacts soil microbial community composition and nitrogen cycling in an acidic soil planted with rape[J]. Environmental Science & Technology, 2014, 48(16): 9391-9399. [86] CHEN S S, AMELIA-ELENA R, MALLA S P, et al. Promoting interspecies electron transfer with biochar[J]. Scientific reports, 2014, 4: 5019. [87] ZHENG C J, YANG Z H, SI M Y, et al. Application of biochars in the remediation of chromium contamination: Fabrication, mechanisms, and interfering species[J]. Journal of Hazardous Materials, 2021, 407: 124376. doi: 10.1016/j.jhazmat.2020.124376 [88] DOU X, LI R, ZHAO B, et al. Arsenate removal from water by zero-valent iron/activated carbon galvanic couples[J]. Journal of Hazardous Materials, 2010, 182(1): 108-114. [89] KUMPIENE J, ORE S, RENELLA G, et al. Assessment of zerovalent iron for stabilization of chromium, copper, and arsenic in soil[J]. Environmental Pollution, 2006, 144(1): 62-69. doi: 10.1016/j.envpol.2006.01.010 [90] LIU Z G, ZHANG F, HOEKMAN S K, et al. Homogeneously dispersed zerovalent iron nanoparticles supported on hydrochar-derived porous carbon: simple, in situ synthesis and use for dechlorination of PCBs[J]. ACS Sustainable Chemistry & Engineering, 2016, 4(6): 3261-3267. [91] YUAN X H, XUE N D, HAN Z G. A meta-analysis of heavy metals pollution in farmland and urban soils in China over the past 20 years[J]. Journal of Environmental Sciences, 2021, 101(3): 217-226. [92] 杨兰, 李冰, 王昌全, 等. 改性生物炭材料对稻田原状和外源镉污染土钝化效应[J]. 环境科学, 2016, 37(9): 3562-3574. doi: 10.13227/j.hjkx.2016.09.039 [93] GONG Y W, QU Y J, YANG S H, et al. Status of arsenic accumulation in agricultural soils across China (1985-2016)[J]. Environmental Research, 2020, 186: 109525. doi: 10.1016/j.envres.2020.109525 [94] LI X Y, ZHANG J R, MA J, et al. Status of chromium accumulation in agricultural soils across China (1989-2016)[J]. Chemosphere, 2020, 256: 127036. doi: 10.1016/j.chemosphere.2020.127036 [95] ZHU Y E, LI H, WU Y, et al. Effects of surface-modified biochars and activated carbon on the transformation of soil inorganic nitrogen and growth of maize under chromium stress[J]. Chemosphere, 2019, 227: 124-132. doi: 10.1016/j.chemosphere.2019.04.042 [96] 厉有为, 梁婵娟. 三种油料作物对土壤Pb污染的耐受性与积累[J]. 环境化学, 2021, 40(5): 1602-1610. doi: 10.7524/j.issn.0254-6108.2020010601 [97] 潘亚男, 陈灿, 王欣, 等. 凤眼莲源生物炭对土壤As、Hg、Cd溶出特性与化学形态的影响[J]. 环境科学学报, 2017, 37(6): 2342-2350. doi: 10.13671/j.hjkxxb.2016.0476 [98] PAN H, YANG X, CHEN H B, et al. Pristine and iron-engineered animal and plant-derived biochars enhanced bacterial abundance and immobilized arsenic and lead in a contaminated soil[J]. Science of the Total Environment, 2021, 763: 144218. doi: 10.1016/j.scitotenv.2020.144218 [99] PENG D H, WU B, TAN H, et al. Effect of multiple iron-based nanoparticles on availability of lead and iron, and micro-ecology in lead contaminated soil[J]. Chemosphere, 2019, 228: 44-53. doi: 10.1016/j.chemosphere.2019.04.106 [100] WANG C, TAN H, LI H, et al. Mechanism study of Chromium influenced soil remediated by an uptake-detoxification system using hyperaccumulator, resistant microbe consortium, and nano iron complex[J]. Environmental Pollution, 2020, 257: 113558. doi: 10.1016/j.envpol.2019.113558 [101] IRSHAD M K, CHEN C, NOMAN A, et al. Goethite-modified biochar restricts the mobility and transfer of cadmium in soil-rice system[J]. Chemosphere, 2020, 242: 125152. doi: 10.1016/j.chemosphere.2019.125152 [102] LIU Q Q, SHENG Y Q, WANG W J, et al. Efficacy and microbial responses of biochar-nanoscale zero-valent during in-situ remediation of Cd-contaminated sediment[J]. Journal of Cleaner Production, 2021, 287: 125076. doi: 10.1016/j.jclepro.2020.125076 [103] 孟繁健, 朱宇恩, 李华, 等. 改性生物炭负载nZVI对土壤Cr(VI)的修复差异研究[J]. 环境科学学报, 2017, 37(12): 4715-4723. doi: 10.13671/j.hjkxxb.2017.0240 [104] WEN E G, YANG X, CHEN H B, et al. Iron-modified biochar and water management regime-induced changes in plant growth, enzyme activities, and phytoavailability of arsenic, cadmium and lead in a paddy soil[J]. Journal of Hazardous Materials, 2021, 407: 124344. doi: 10.1016/j.jhazmat.2020.124344 [105] 殷西婷. 添加改性生物炭对砷污染土壤中砷形态及土壤酶活性的影响研究[D]. 泰安: 山东农业大学, 2018. [106] ZHANG Y, ZHAO C C, CHEN G L, et al. Response of soil microbial communities to additions of straw biochar, iron oxide, and iron oxide–modified straw biochar in an arsenic-contaminated soil[J]. Environmental Science and Pollution Research, 2020, 27(19): 23761-23768. doi: 10.1007/s11356-020-08829-7 [107] LIU S S, LU Y X, YANG C, et al. Effects of modified biochar on rhizosphere microecology of rice (Oryza sativa L. ) grown in As-contaminated soil[J]. Environmental Science and Pollution Research International, 2017, 24(30): 23815-23823. doi: 10.1007/s11356-017-9994-1 -





 DownLoad:
DownLoad: