-
土壤重金属污染是影响人类健康和生态环境质量的世界性问题[1-2]. 固定/稳定化和直接去除是重金属污染土壤修复的两种主要方法[1,3]. 修复技术主要有固定化、玻璃化、电动修复、植物修复和化学淋洗修复[1-3]. 土壤淋洗修复技术可以将重金属转移至液相以达到永久去除土壤中重金属的目的,是一种高效、低成本的方法,尤其适用于重度污染土壤[2,4-5]. 尽管淋洗剂(乙二胺四乙酸(EDTA)、谷氨酸N, N-二乙酸(GLDA)、乙二胺二琥珀酸(EDDS)和柠檬酸)对土壤中重金属去除效率高,但产生大量的淋洗废液中重金属主要以稳定的络合物形式存在,在较宽的pH范围内均有较高的稳定性,易造成二次污染问题[6]. 去除络合态重金属常用的方法有化学沉淀法、化学氧化法和离子交换法,但普遍存在产泥量大、处理条件复杂、费用较高等问题[6-8]. 与传统的化学处理方法相比,生物处理具有微生物来源广泛、适应性强、成本低、效率高、对环境友好等优点而有广阔应用前景[9].
近年来,学者们对硫酸盐还原菌(SRB)处理重金属污染废水进行了广泛的研究[9-11]. 研究表明,SRB可以去除传统废水中90%以上的Zn2+、Cu2+、Cd2+、Pb2+、Ni2+和Cr6+[9-11]. 一般来说,SRB去除废水中重金属离子主要通过硫化物沉淀和死菌体吸附[11-12]. 硫化物沉淀的形成过程分为两个阶段:(1)SRB利用硫酸盐作为电子受体氧化简单有机化合物生成碳酸氢根离子和硫化氢;(2)生物生成的硫化氢与游离重金属阳离子反应生成金属硫化物沉淀[9]. 此外,死菌体通过细胞壁上的官能团直接吸附重金属,有利于废水中重金属的去除[12].
虽然SRB对传统废水中的重金属离子具有很高的去除效率,但淋洗废液中的重金属主要以络合态形式存在[7],有研究报道SRB可以通过还原反应机理有效地去除Fe(Ⅲ)和Cr(Ⅵ)的络合形态[13-14],与高价态重金属相比,对于二价态重金属络合物去除的报道较少. Hakansson等[15]利用SRB产生的H2S处理络合态Pb和Cu的沉淀率达98%. 然而,据我们所知,二价重金属络合物的去除机理还不清楚. 不同络合剂如何影响SRB对络合态重金属的去除率,除形成金属硫化物沉淀外,细菌对络合态重金属的吸附效率几乎没有报道.
为了深入了解SRB对二价态重金属络合物的去除机理,利用不同络合剂形成Cu(Ⅱ)络合物,研究了分离SRB (Shewanella sp. JN01)对不同络合态Cu的去除效果及不同途径对菌株去除Cu(Ⅱ)络合物的贡献及其机理,以期达到淋洗废液的资源化再生和无害化处理提供科学依据.
-
采集自山西省山阴县大营村(39°22′20.12″ N, 112°52′54.69″ E)地下井挖掘过程中21 m深的土柱. 将土柱置于手套箱(Whitley DG250,英国Don Whitley Scientific)中30 ℃下厌氧培养1周. 将土柱中央的土样置于无菌水中,用稀释涂布法富集培养菌株1周. 然后用富集培养基进一步的扩大培养. 每周更换新鲜培养基,连续培养4周后获得实验菌株. 将培养基(表1)调至pH=7.2,121 ℃高压灭菌30 min. 在富集培养基中加入2%的琼脂(W/V)制备固体培养基. 将纯化后的菌株JN01按平板划线法接种在固体培养基上. 使用DNA提取试剂盒(Sangon Biotech,生工生物工程(上海)股份有限公司)提取总DNA. 采用热循环仪(Bio-Rad,C1000 Touch,美国Bio-Rad公司)进行聚合酶链反应(PCR). 用细菌通用引物从总DNA中扩增16S rRNA基因. 采用上游引物(27F 5'TACGGYTACCTTGTTACGACTT3')和下游引物(1492R 5'AGAGTTTGATCCTGGCTCAG3')扩增菌株16S rRNA基因. PCR反应体系:2×Taq PCR Master 12.5 μL,DNA模板1 μL,上游引物2 µL,下游引物2 µL,dd H2O 7.5 μL. 扩增条件:95 ℃保持5 min;95 ℃保持1 min;54 ℃保持1 min;72 ℃保持2 min;72 ℃保持10 min;30次循环. 将16S rRNA基因序列在ClustalX 2.0[16]和GenBank核酸数据库中比对. 用Mega 6.0进行邻接法(NJ)、最大似然法(ML)和最大简约法(MP)分析.
-
所用试剂参照之前的研究[17]. 以5% V/V将SRB菌液分别接种至初始pH值为7.0的培养基中,加入高浓度Cu2+、EDTA、GLDA、CA和MC储备溶液. Cu2+浓度为50 mg·L−1. n (Cu2+): n (EDTA)分别为1:0、1:1、1:5、1:10和1:25. 当物质的量比超过1:25,混合溶液将会出现体积变化较大或EDTA溶解度较低. n (Cu2+): n (GLDA、CA或MC)分别为1:0、1:1、1:5、1:10、1:25、1:50、1:75和1:100. 处理1、3、5、7 d后,测定溶液中Cu2+浓度. 所有处理设置3组平行,并做空白对照.
死菌体吸附实验将厌氧培养24 h后的SRB悬浮液在121 ℃下灭菌30 min,然后混匀分装至装有不同络合态Cu溶液(C (Cu2+)=50 mg·L−1;n (Cu2+):n (络合剂)=1:10)的锥形瓶中,pH调至5.5. 于0、0.17、0.5、1、2、4、8、20 h后取样,测定溶液中Cu2+浓度. 所有处理设置3组平行,并做空白对照.
-
采用火焰原子吸收光谱仪(AAS,Z-2300,日本Hitachi)测定样品中Cu浓度;扫描电子显微镜(SEM-EDS,S-3400 N,日本Hitachi)和X射线衍射仪(XRD,Empyrean,荷兰PANalytical)对Shewanella sp. JN01处理不同络合态Cu的沉淀物进行表征.
-
采用Excel、SPSS 22.0和Origin 2018进行数据整理、统计分析及作图. 采用Duncan检验确定各处理之间的统计学差异(α = 0.05).
-
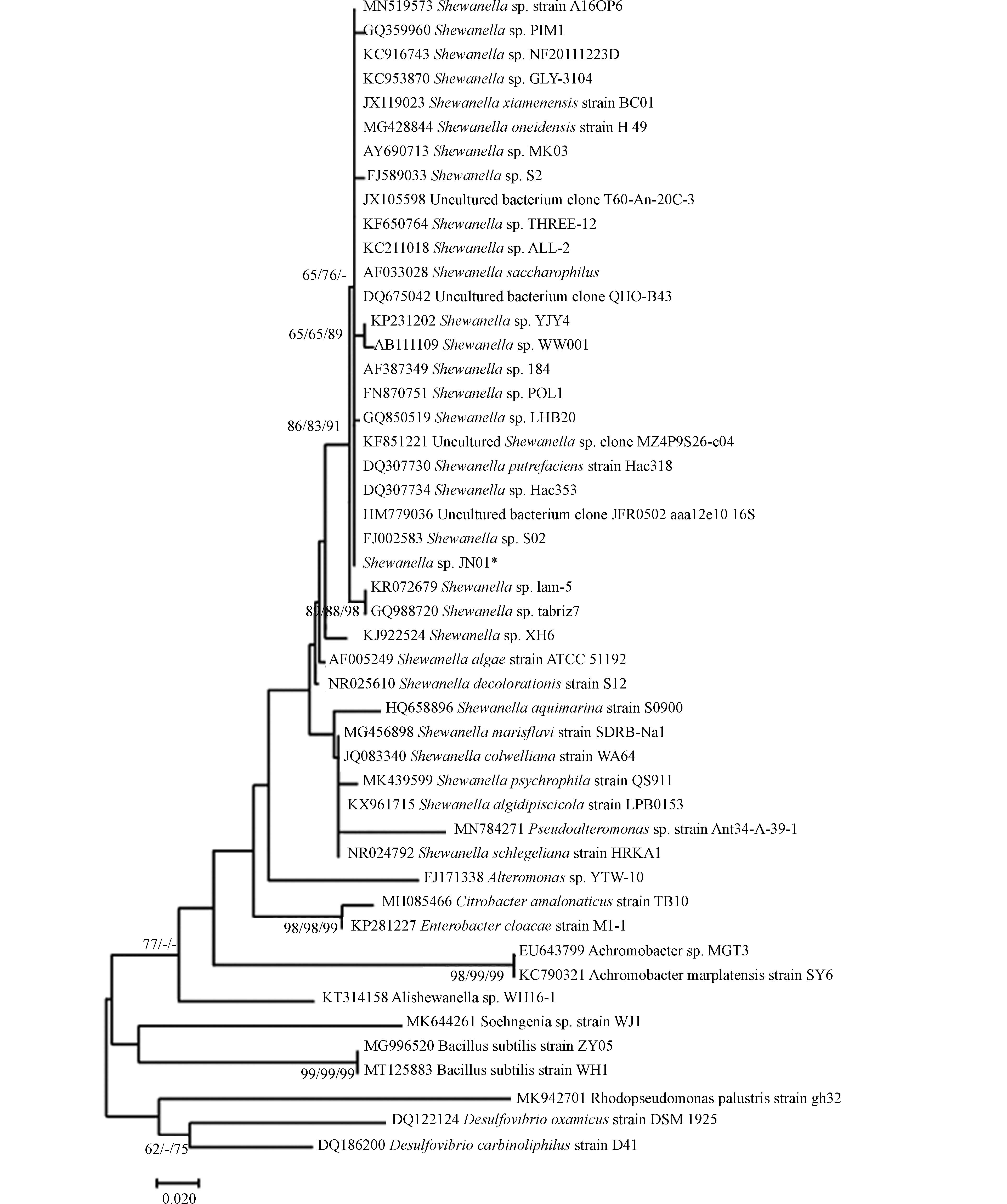
SRB与希瓦氏菌16S rDNA基因序列同源性达99%,构建系统发育树如图1所示,因此,分离菌株命名为Shewanella sp. JN01. Shewanella sp. JN01菌落形态在固体培养基上边缘规则,光滑圆润,中间呈凸起的黑色菌落(图2). Shewanella sp. JN01的SEM图表明,菌体为杆状、质地略光滑,聚集较多,宽×长约为0.5 μm×(2—5) μm(图2).
-
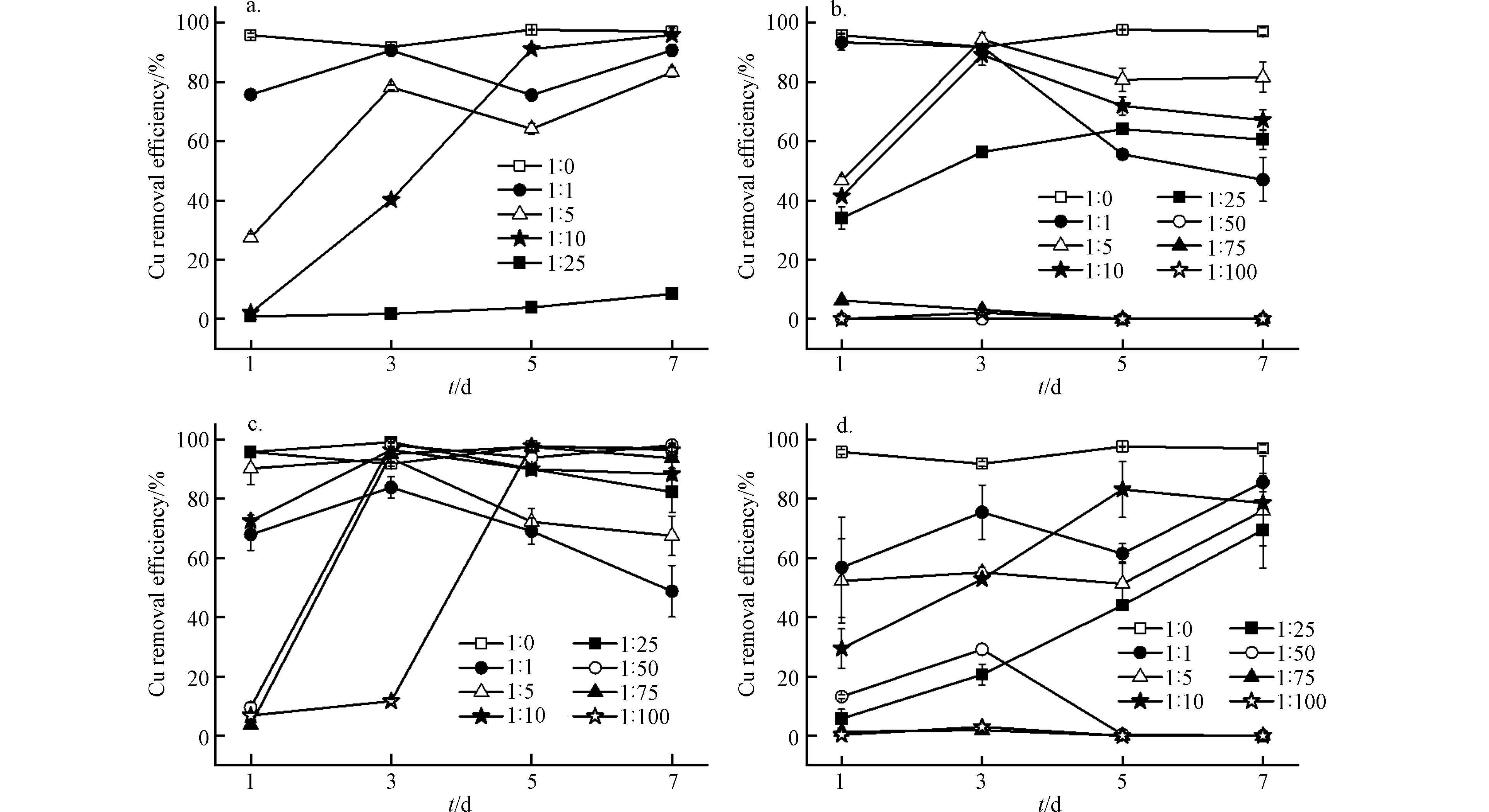
Shewanella sp. JN01对水溶液中不同络合态Cu (Cu-EDTA、Cu-GLDA、Cu-CA和Cu-MC)的去除率与反应时间、络合剂类型和Cu与络合剂的物质的量比有关(图3). 不同物质的量比下,Shewanella sp. JN01对Cu-EDTA和Cu-GLDA的去除率均低于Cu2+ (1:0)的去除率(图3). 与 Cu-EDTA 和 Cu-GLDA相比,游离Cu2+更易与H2S反应形成金属硫化物沉淀,并被细菌细胞活性成分吸附[18]. 在物质的量比较低的情况下(n (Cu2+): n (EDTA/GLDA)=1:1—1:10),Shewanella sp. JN01对Cu-EDTA和Cu-GLDA的最佳去除率一般在90%以上. 但是,随着EDTA与GLDA物质的量比增加(除n (Cu2+): n (GLDA)=1:25外),Shewanella sp. JN01对Cu-EDTA和Cu-GLDA的去除率显著降低至10%以下. 溶液中大量游离的EDTA和GLDA对Shewanella sp. JN01的毒性大于其络合形态,因为络合剂可通过抑制酶活性和改变细胞膜渗透压导致细胞死亡[19]. 此外,在Cu-EDTA和Cu-GLDA溶液中,EDTA和GLDA能抑制硫化物沉淀的形成,降低Cu2+的去除率[19-20]. 当n (Cu2+): n (EDTA/GLDA)=1:25时,Shewanella sp. JN01对Cu-GLDA的去除率为64.07%,而对Cu-EDTA的去除率小于10%,这可能是由于GLDA对微生物的毒性小于EDTA[5,21]. 同时,Cu-GLDA的稳定性(lg KCu-GLDA=13.03)低于Cu-EDTA(lg KCu-EDTA=18.80),表明Shewanella sp. JN01更易破络Cu-GLDA生成CuS沉淀[6,21].
Cu-CA的去除率随CA物质的量比的增加而变化,与Cu-EDTA和Cu-GLDA的去除率差异显著. 当n (Cu2+):n (CA)为1:1—1:25时,Cu-CA的最佳去除率由83.83%提高到99.11%. 随着CA物质的量比的进一步增加,Cu-CA的去除率由不足10%显著提高到97%以上,并保持相对稳定. 在CA的高物质的量比条件下,Shewanella sp. JN01对Cu-CA的高去除效率的延迟可能是由于CA浓度过高,Shewanella sp. JN01需要时间来适应其环境[18]. 与EDTA和GLDA不同,过量的CA并不会对Cu-CA的去除产生负面影响. 这很可能是由于Shewanella sp. JN01以CA为碳源,促进Shewanella sp. JN01的生长,从而去除Cu-CA[13].
Shewanella sp. JN01对Cu-MC的最佳去除率明显低于其他络合态Cu. 当n (Cu2+): n (MC)= 1:1—1:25时,Shewanella sp. JN01对Cu-MC的最佳去除率由85.50%降至69.40%. 当n (Cu2+): n (MC)= 1:50时,络合态Cu的去除率先显著升高后降低,5 d后Cu-MC的去除率为0. 这可能与Shewanella sp. JN01死后释放Cu有关. 尽管CA对Shewanella sp. JN01的生长没有明显抑制作用,但MC中的EDTA和GLDA会破坏其细胞结构的完整性[19]. Cu-CA在物质的量比为1:25和1:50时的去除率高于Cu-EDTA和Cu-GLDA,这说明MC对Shewanella sp. JN01的毒性作用低于EDTA和GLDA.
Cu与络合剂物质的量比较低时,Cu-GLDA和Cu-CA在3 d后的去除率下降,主要是受Cu和络合剂的胁迫所致. Shewanella sp. JN01细胞表面活性成分受损,导致累积的Cu再次释放[22]. 此外,细胞表面附着的硫化物沉淀,由于传质阻力增加,对菌株的代谢产生不利影响[23].
在一定的Cu与络合剂的物质的量比下,第7天的去除率基本稳定,Shewanella sp. JN01对不同络合态Cu的去除率为Cu-CA > Cu-MC > Cu-GLDA > Cu-EDTA. 这主要与他们的稳定常数有关,其稳定性为lg KCu-EDTA(18.80) > lg KCu-GLDA(13.03) > lg KCu-CA(5.95)[6,21,24]. 络合态Cu稳定越高,Shewanella sp. JN01破络难度越大,去除效果越差[15,18]. 结果表明,Cu-CA的去除率最高,尤其是在络合剂的物质的量比较高时. 与GLDA和EDTA相比,CA对菌株生长代谢和硫酸盐还原途径的抑制作用较小[13-14]. 此外,CA是小分子、可降解的络合剂,为微生物生长提供碳源[13,18]. 这进一步说明,MC对Shewanella sp. JN01的毒性较EDTA和GLDA温和,是因为MC中减少了EDTA和GLDA的用量,CA所占比例较大.
-
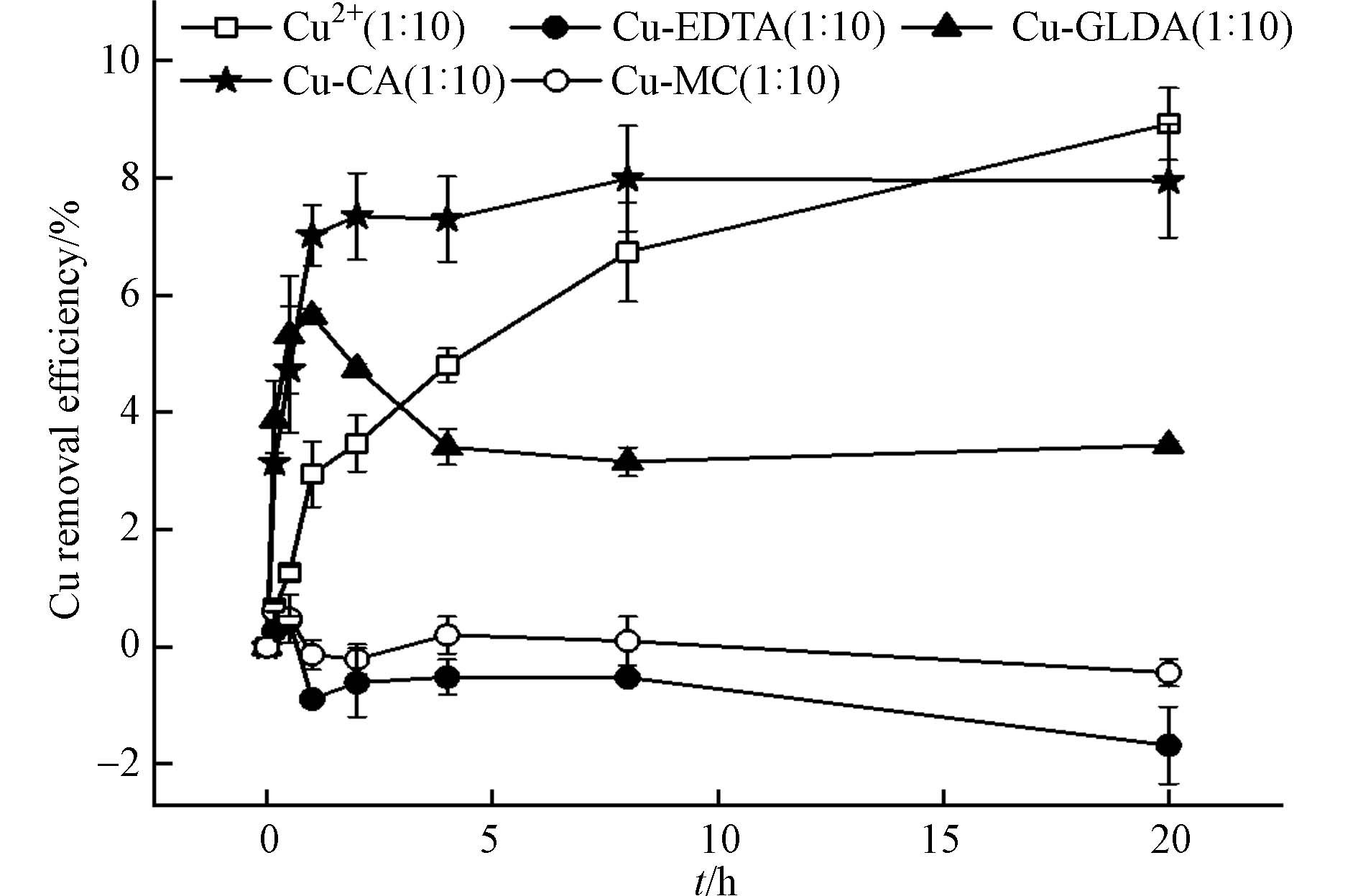
死菌体对络合态Cu的最佳去除率低于游离Cu2+ (图4). 死菌体对Cu2+的吸附率缓慢增加,20 h后达到8.92%. 死菌体对Cu2+的去除主要是由于Cu2+直接吸附在细胞壁上[18]. 高压灭菌后,许多带负电荷的官能团(如羟基、氨基或羧基)暴露在菌体表面,增加了对带正电荷离子如Cu2+的结合位点[22].
死Shewanella sp. JN01对络合态Cu的吸附去除率趋势与Cu2+明显不同(图4). 对于络合态Cu,死Shewanella sp. JN01对Cu-CA的吸附率在1 h内迅速增加,之后基本保持不变. 死菌体对Cu-CA的吸附去除率高达7.99%,与Cu2+的吸附率相当(P > 0.05). 这是因为CA是易降解的有机物,对细菌表面损害较小[13,18]. Cu-CA主要以CuL− (H3L代表柠檬酸)的形式存在,通过静电吸引与氨基结合[24-25]. 死菌体对Cu-GLDA的吸附率在1 h内达到最佳值(5.65%),随后逐渐下降后平稳;对Cu-EDTA的吸附率仅为0.44%;对Cu-MC的吸附率介于两者之间. Cu-EDTA的吸附去除率较差,这是由于Cu-EDTA在pH=5.5时主要以CuEDTA2-形式存在[6],CuEDTA2-络合物为六配位八面体结构,Cu2+被包裹于络合物内部,无法与吸附位点接触[26-27]. Cu-GLDA的吸附去除率高于Cu-EDTA,这是因为Cu-GLDA对死菌细胞的结合亲和力强[28].
Cu-EDTA和Cu-GLDA的吸附去除率达到最佳后下降,很可能是EDTA和GLDA的毒性作用使细胞壁破坏,导致吸附的络合态铜又释放回水溶液中[19,22]. 相比而言,络合态Cu经过破络后形成硫化物沉淀的途径去除率高(> 80%,图3),死菌体对络合态Cu的吸附去除率只占Shewanella sp. JN01对络合态Cu总去除率的一小部分(< 8%,图4).
-
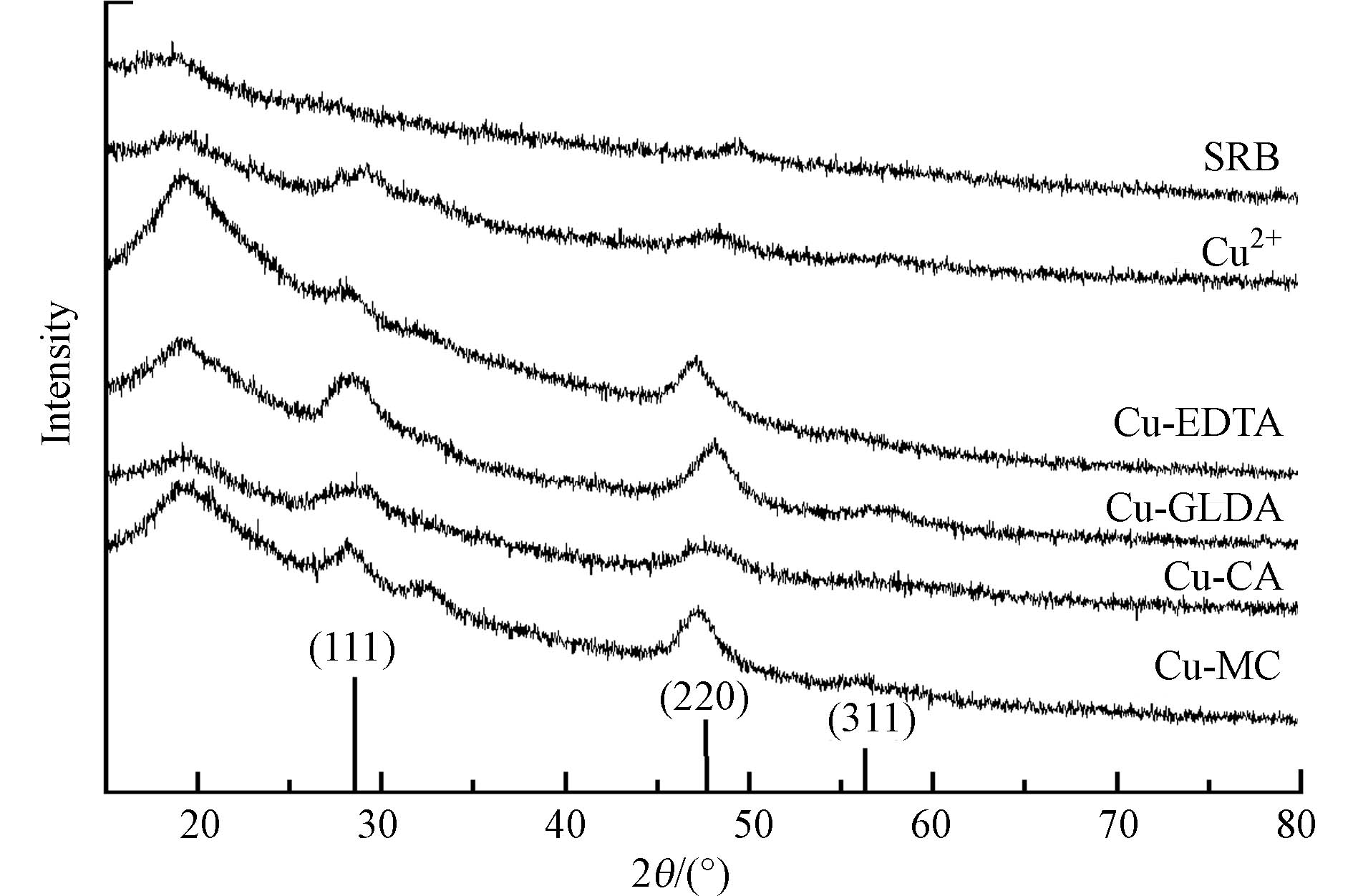
考虑到Shewanella sp. JN01去除络合态Cu的主要途径是先破络进而形成硫化物沉淀,实验收集并表征了Shewanella sp. JN01处理含Cu络合物水溶液后的沉淀. XRD衍射仪分析了所得沉淀物的晶体结构(图5). 沉淀物的无定型(2θ值为20°)很可能是由于菌体细胞中多糖、蛋白质和脂质的存在[12]. 在2θ值为28.68°、47.71°和56.62°处有较强的衍射峰,对照CuS标准图谱(PDF No.89-2073)中的(111)、(220)和(311)晶面. Shewanella sp. JN01只在47.71°处有微弱的峰. 然而,Cu2+处理后的沉淀物在28.68°和47.71°处的峰强度低于络合态铜,这可能是细菌在Cu2+处理过程中产生的硫化铜颗粒较小[15]. 此外,在金属离子的胁迫下,菌株分泌的代谢物能吸附铜离子并与铜离子络合,阻碍了结晶度高的硫化铜的形成[29]. 尽管培养基中存在磷酸盐,但对Cu的沉淀影响较小. 一方面,每个处理组接菌量均为5%,因此,每个实验组的磷酸盐含量相同;另一方面,磷酸根的浓度远远低于硫酸根(表1). 在XRD衍射图中也未检出Cu的磷酸盐沉淀物. 因此,培养基中磷酸盐对不同处理组Cu沉淀差异的影响很小.
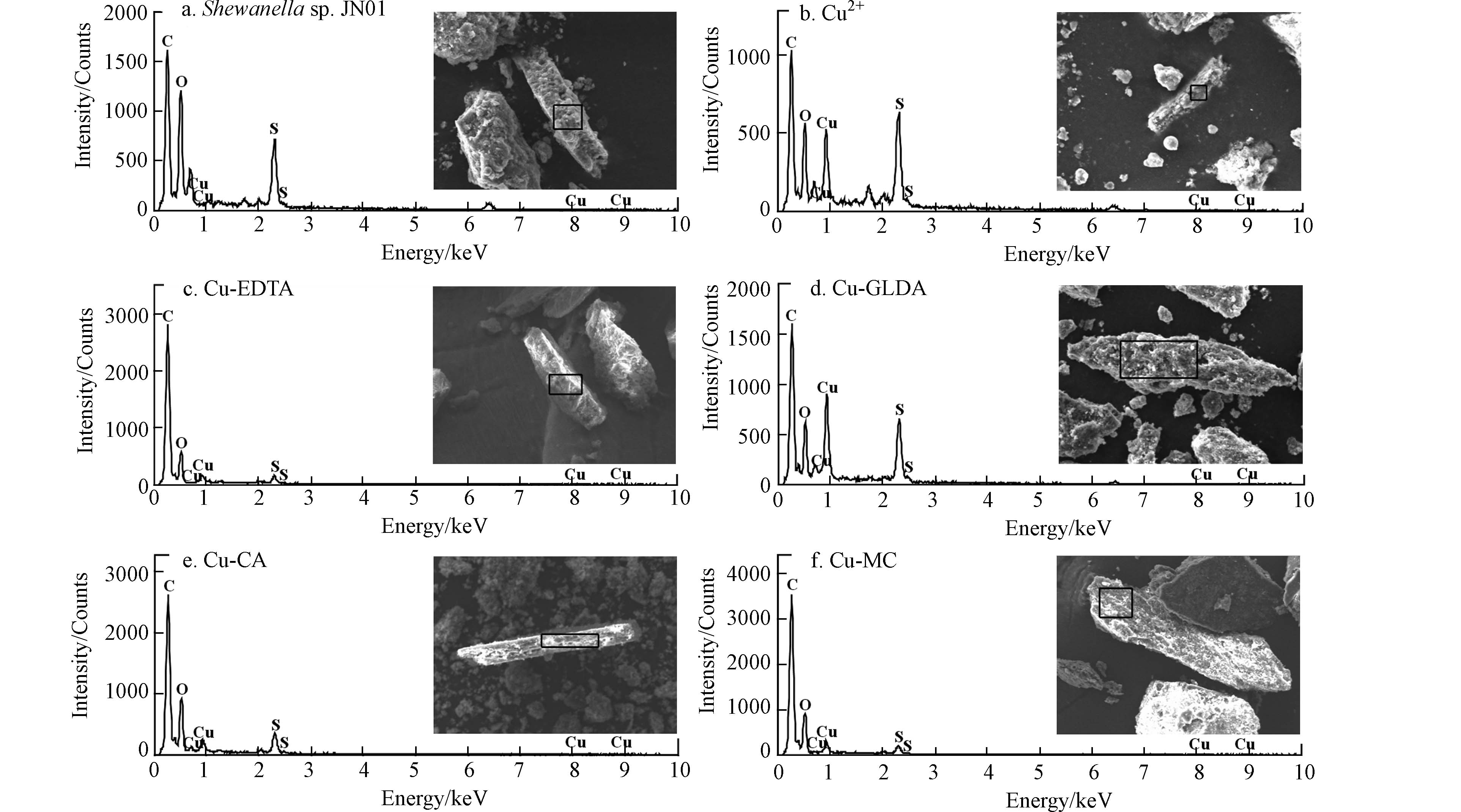
SEM图像进一步证实了Shewanella sp. JN01处理不同络合态Cu溶液后存在沉淀颗粒[12]. EDS结果表明,沉淀物中存在Cu和S,不同处理的Cu和S的含量变化较大(图6).
Shewanella sp. JN01沉淀物中O和S的原子比分别为29.85%和6.85%,其中未检测到Cu的含量. 加Cu2+处理后的沉淀物中O的原子比降低到19.45%,S和Cu的含量增加到9.07%和4.34%. 其中O的原子比下降很可能是由于Cu2+抑制了Shewanella sp. JN01的生长,因为沉淀物中O主要来自菌株的生长. S和Cu原子比的增加是由于加入CuSO4后,Shewanella sp. JN01在氧化还原反应中生成了CuS. 不同络合态Cu处理后的沉淀物中O、S和Cu的原子比分别为16.13%—23.28%、1.57%—6.64%和1.07%—5.38% (表2). O的含量与细菌活性密切相关,这在一定程度上可以解释菌株对Cu的去除效率随细菌活性的降低而降低[18]. 与其他Cu络合物相比,Cu-CA处理后的沉淀物中O原子比最高,说明柠檬酸可以作为碳源,提高细菌的代谢活性,从而产生更多的H2S,对Cu络合物去除率更高. 由于Cu和S的化学计量比为1:1,但S的原子比略高于Cu,这一结果很可能是由于Shewanella sp. JN01通过硫酸盐还原产生大量的硫化氢,使溶液中的Cu几乎都生成硫化铜沉淀被去除[30](图3). 不同络合态Cu处理后沉淀物中Cu和S的强峰表明,沉淀物中CuS是主要产物,这与XRD结果一致. 此外,无论溶液的pH值如何,CuS (Ksp=6.3×10−36)的溶解度低且稳定性高[31]. 实验结果表明,模拟淋洗废液中Cu络合物的去除机理主要是经Shewanella sp. JN01破络后生成硫化物沉淀.
-
SRB (Shewanella sp. JN01)对水溶液中的Cu络合物具有较高的去除效率,主要通过先破络后形成硫化物沉淀. Shewanella sp. JN01对不同Cu络合物的最佳去除率为Cu-CA (99.11%) > Cu2+ (97.69%) > Cu-EDTA (95.90%) > Cu-GLDA (94.22%) > Cu-MC (85.5%). 络合剂对Shewanella sp. JN01的抑制作用为EDTA > MC > GLDA > CA. 本研究的结果为从水溶液中去除Cu络合物提供了一种有效、节约成本和环境友好的方法. 然而,由于实际淋洗废液中所含物质比模拟淋洗废液更为复杂,因此有必要进一步探索SRB (Shewanella sp. JN01)对实际淋洗废液中多种重金属络合物的最佳去除效率.
Shewanella sp. JN01对水体系不同络合态Cu的去除效果及机理
Removal efficiency and mechanism of different kinds of copper complexes from aqueous system by Shewanella sp. JN01
-
摘要: 土壤淋洗废液处理难点在于废水中含有高浓度的稳定重金属络合物. 本研究分离了一株硫酸盐还原菌(Shewanella sp. JN01),探讨了其对模拟淋洗废液中不同络合态Cu (Cu-乙二胺四乙酸(Cu-EDTA)、Cu-谷氨酸N,N-二乙酸(Cu-GLDA)、Cu-柠檬酸(Cu-CA)和Cu-混合淋洗剂(Cu-MC))的去除效果及机理. 结果表明,活菌体和死菌体对不同络合态Cu的去除率分别大于80%和小于8%. 显然,死菌体细胞表面吸附作用对络合态Cu去除效率的贡献十分有限. 因此,Shewanella sp. JN01去除络合态Cu的主要机制是先破络,再形成CuS沉淀. Shewanella sp. JN01对不同络合态Cu的去除率为Cu-CA >Cu-MC >Cu-GLDA >Cu-EDTA,这一变化趋势与它们的稳定性常数和毒性的变化趋势相反,结果进一步证实了破络是微生物去除络合态重金属的限制性步骤. Shewanella sp. JN01能够有效去除土壤淋洗废液中重金属络合物,在淋洗废液再生利用方面具有潜在应用前景.
-
关键词:
- 土壤淋洗废液 /
- 络合态Cu /
- Shewanella sp. JN01 /
- 硫化物 /
- 沉淀.
Abstract: The difficulty in the treatment of soil washing effluent lies in its high concentrations of stable heavy metal complexes. This study isolated a strain of sulfate-reducing bacteria (Shewanella sp. JN01) to explore the removal efficiency and mechanism of different heavy metal complexes [Cu-ethylenediaminetetraacetic acid (Cu-EDTA), Cu-N, N-bis(carboxymethyl) glutamic acid (Cu-GLDA), Cu-citrate (Cu-CA) and Cu-mixed chelator (Cu-MC)] from the simulated soil washing effluent by Shewanella sp. JN01. The results showed that removal efficiencies of different Cu complexes by the alive and dead Shewanella sp. JN01 were above 80% and below 8%, respectively. Evidently, the contribution of sorption of Cu complexes by cell surface of the dead strain to its total removal efficiency was limited. Therefore, the dominant removal mechanism of Cu complexes by Shewanella sp. JN01 was related to dechelation first and then formation of CuS precipitation. The removal efficiencies of different Cu complexes by Shewanella sp. JN01 varied as the trend of Cu-CA > Cu-MC > Cu-GLDA > Cu-EDTA, which was opposite to the trend of their stability constants and toxicity. This finding further confirmed that the dechelation was a limiting step to remove heavy metal complexes by microorganisms. Collectively, the results of this study indicate that Shewanella sp. JN01 can effectively remove the heavy metal complexes from soil washing effluent, which has potential application prospects for recycling use of soil washing effluent.-
Key words:
- soil washing effluent /
- copper complexes /
- Shewanella sp. JN01 /
- sulfide /
- precipitation.
-
非法药物的滥用影响着人类健康、社会安定与国家经济,如今有170多个国家和地区存在着非法药物滥用的问题,全球非法药物的制造、贩卖和滥用问题日趋严重[1]. 因此,预防非法药物的使用,及时掌握区域非法药物的种类及消费量,精准追踪溯源,压缩违法犯罪活动空间,已经成为各国需要面临的共同问题. 最初关于非法药物的滥用情况是通过问卷调查、犯罪统计等传统社会调查方法获得的,但是这些调查方法具有一定的主观性与滞后性,可能导致非法药物消费情况的不正确评估. 2001年Daughton[2]提出一种污水流行病学的概念来评估非法药物的消费情况,即通过收集污水管道、泵站或者污水处理厂(WWTPs)进水处废水样品,测定污水中药物残留及其代谢物的浓度,结合WWTPs日处理量、服务区人口及药物排泄率等参数推算出WWTPs服务区域内非法药物的消费量. 与传统社会调查方法相比,污水流行病学能够在一定程度上克服主观因素影响,实时、客观地量化不同时间和地区的药物消费情况和人群使用趋势.
2005年Zuccato等[3]首次将这种概念应用于实际,通过收集意大利河流和WWTPs的水样以测定可卡因的含量. 结果发现, 1000名年轻人平均每天使用至少(27±5)剂的可卡因,远超官方报道的数字,随后基于污水流行病学的污水分析法作为一种客观、准确、有效的监测方法,在各国得到了广泛的运用[3-7]. 非法药物进入人体后以母体原型或者代谢产物的形式排泄,这些非法药物具有难降解特性,可以通过排水管网汇入WWTPs,但是污水中成分复杂,会对非法药物及其代谢物的测定产生干扰,且污水中大部分目标药物残留物(drug target residues,DTRs)的浓度极低,因此,污水样品的前处理显得尤为重要. 绝大部分报道都采用固相萃取(solid-phase-extraction,SPE)作为污水的前处理方式[8-9],如果SPE条件不同,对非法药物的萃取回收率也会不同,所以选定合适的SPE条件对污水中非法药物的测定至关重要.
国外的一些研究发现,重大节日如音乐节等期间污水中非法药物的负荷量较正常周呈现出增加的趋势[9-10]. Jiang等[11]发现,中国台湾垦丁地区青年节期间非法药物的浓度明显高于旅游淡季,而关于内地典型旅游城市重大节假日期间非法药物的滥用量鲜有报道. 本研究采用污水分析法对中国典型旅游城市桂林市某污水处理厂的重大节假日与日常生活期间进水废水中常见非法药物甲基苯丙胺和氯胺酮及其代谢物的浓度进行检测,并通过反推模型推算不同时期的甲基苯丙胺与氯胺酮的滥用量. 同时运用SPE技术比较前处理条件(Oasis HLB 和Oasis MCX 两种SPE柱)对模拟样品中甲基苯丙胺和氯胺酮及其代谢物的萃取回收率,选定最适合桂林市污水中甲基苯丙胺(METH)和氯胺酮(KET)及其代谢物苯丙胺(AMP)和去甲氯胺酮(NK)前处理的方法. 从而为桂林市该区域非法药物的滥用与测定信息提供初步数据,以期为毒品滥用监测及禁毒工作提供科学依据.
1. 材料与方法(Materials and methods)
1.1 实验试剂及仪器
甲基苯丙胺(METH)、苯丙胺(AMP)、氯胺酮(KET)、去甲氯胺酮(NK)标准溶液及其相应的氘代内标替代物溶液METH-D5、AMP-D5、KET-D4、NK-D4购自美国Cerilliant公司,甲醇(HPLC级),甲酸(HPLC级)均购自上海麦克林生化科技有限公司. 氨水(AR)、盐酸(AR)购自杭州龙山精细化工有限公司,实验室用水均为超纯水.
主要仪器及耗材:固相萃取柱(Waters Oasis MCX,60 mg,3 mL;Waters Oasis HLB 60 mg,3 mL)购自美国Waters公司,高效液相色谱-串联质谱联用仪:Agilent 1260-6460,氮吹仪(上海精其仪器有限公司),12位固相萃取装置(上海析友分析仪器有限公司)等.
1.2 标准溶液的配制
分别吸取METH、AMP、KET、NK的标准溶液(1 mg·mL−1)用甲醇配制成质量浓度为100 μg·mL−1的混合标准一级储备液,取同位素内标溶液(100 μg·mL−1)用甲醇配制成质量浓度为10 μg·mL−1的混合同位素内标一级储备液. 使用时将混合标准一级储备液用甲醇配制成质量浓度为0.5—250 μg·L−1不同浓度梯度的标准曲线混合溶液,再分别用50 mL纯水制备成浓度梯度为1—500 ng·L−1的模拟样品. 上述每个浓度梯度的模拟样品等量加入100 μL混合同位素(50 μg·L−1)内标溶液,以补偿样品制备过程中的基质效应和损失.
1.3 样品采集
2021年10月2日—7日、10月17日—23日、12月21日—26日采集桂林市某污水处理厂的进水处废水样品,该污水处理厂主要服务桂林市中南区,只接收生活污水. 污水处理厂设计处理约38万居民人口的生活废水,3次采样期间平均日处理量分别为94826、92341、60074 m3·d−1,与全国其它地区的污水处理厂相比,该污水处理厂的处理水量属于中等偏下水平[7]. 使用便携式自动采样器(启恒环保HX-A型)每半个小时等量采集废水,等比例混合24 h的污水样品,混合样品收集完后立即用浓盐酸酸化至pH=2并在-20 ℃条件下储存,直至分析.
1.4 样品前处理
将采集后的混合样品解冻后使用玻璃纤维滤膜(0.45 μm)过滤,取50 mL过滤后的废水样品加入50 μg·L−1的混合同位素内标溶液100 μL,充分混合后使用下述最优的SPE条件进行前处理,每个样品制备3个平行样,空白样品与样品同时同步骤测定. Oasis-HLB和Oasis-MCX这两种SPE柱对碱性化合物具有高选择性和灵敏度,本研究事先使用超纯水制备成模拟样品考察这两种SPE柱对甲基苯丙胺和氯胺酮的萃取回收率.
参照Nd等[12]的方法使用Oasis-HLB(Waters Oasis HLB 60 mg,3 mL)固相萃取柱对非法药物进行富集. 依次使用6 mL甲醇和6 mL超纯水活化SPE柱,随后在HLB固相萃取柱上加入有混合同位素内标的50 mL污水样品,样品在SPE柱上以约1 mL·min−1的速率萃取,使用3 mL超纯水清洗SPE柱,柱子在真空下干燥20 min,最后用6 mL甲醇洗脱,洗脱液40 ℃氮吹至近干,再用500 μL甲醇溶液复溶,复溶液过0.22 μm有机滤膜后上机测定. 使用Oasis-MCX(Waters Oasis MCX 60 mg,3 mL)固相萃取柱富集非法药物时参照Jin等[13]的方法. SPE柱依次用4 mL甲醇和4 mL pH=2的超纯水活化,以1 mL·min−1的速率上样,上样结束后将SPE柱真空干燥20 min,使用4 mL的甲醇淋洗萃取柱,最后将4 mL的5%氨水-甲醇以1 mL·min−1的速率洗脱并收集洗脱液,萃取完成后将洗脱液40 ℃氮吹至近干,用300 μL的0.1%甲酸水溶液复溶,复溶液过0.22 μm有机滤膜后上机测定.
1.5 仪器条件
色谱条件:液相色谱柱:Shim-pack GIST C18(100 mm×2.1 mm,2 μm,日本岛津),柱温:30 ℃,进样量3 μL,流动相为0.1%甲酸水溶液(A相)—乙腈(B相)体系,流速为0.3 mL·min−1,洗脱梯度为:0—1.5 min:20% B;1.5—2.25 min:80% B;2.25—3.1 min:95% B;3.1—5.0 min:20% B,保留时间为8 min.
质谱条件:以电喷雾电离(ESI),采用正离子模式,多反应监测(MRM)模式检测,毛细管电压:3000 V,负离子:3000 V,干燥气温度:325 ℃,干燥气流量:12 L·min−1,脱溶剂和雾化气体是氮气,雾化器压力:40 psi,经优化后,METH、METH-D5、AMP、AMP-D5、KET、KET-D4、NK、NK-D4质谱参数如表1所示.
表 1 优化后的毒品及其代谢物的质谱参数Table 1. Optimized MS parameters of drugs and their metabolites化合物Compound name 母离子Precursor ion 子离子Product ion 碎裂电压/VFragmentor 碰撞能量/eVCollision energy METH 150.1 91.1 85 17 65.1 45 METH-D5 155.2 92 17 7 91 7 AMP 136.1 119.1 58 5 91.1 13 AMP-D5 141.1 124.2 58 5 93.1 13 KET 238.1 125 98 25 89.1 65 KET-D4 242.1 129.1 98 25 92.1 69 NK 224.1 207.1 88 10 125 22 NK-D4 228.1 211.1 83 10 129.1 22 1.6 方法验证与质量控制
对分析方法的检测限(LOD)、定量限(LOQ)、萃取回收率、基质效应进行验证保证分析过程中的质量控制,每10个样品中包含使用加标内标的超纯水程序空白,以检查潜在干扰和污染.
在50 mL pH=2的超纯水中定量加入目标分析物的混合标准溶液(METH、AMP、KET和NK)和等量的混合内标溶液,混合标准溶液梯度共设置3个低(10 ng·L−1)、中(50 ng·L−1)、高浓度(400 ng·L−1),每个浓度梯度设置7个平行,同时设置一组流程空白,流程空白仅加入等量的混合内标溶液不加目标分析物,分别使用”1.3”中所述的两种SPE方法对模拟样品进行前处理并进行测定. 根据空白和加标样品的测定数据计算提取回收率,以S/N>3为检出限,S/N>10为定量限,并且分别对样品连续多次测定(n=3)和多天重复测定(n=3)来衡量仪器的日内精密度与日间精密度.
1.7 非法药物消费量计算
目标分析物测定完浓度后,通过反推模型公式即可得到该区域的非法药物的消费量. 非法药物的反算公式如下:
千人日均消费量(mg⋅d−1)=目标物分析物浓度(ng⋅L−1)×进水流量(L⋅d−1)×f代谢物服务区人口 千人日均消费量是每千人每日的药物消费量,单位是mg·d−1;目标物浓度是污水厂每个采样周期内DTRs的平均浓度,单位是ng·L−1;进水流量是污水厂采样周期内的进水流量平均值,单位是L·d−1;
f代谢物 1.8 数据分析
利用SPSS 22.0(IBM, USA)对数据进行分析,非法药物及其代谢物的浓度单位为 ng·L−1,千人日均消费量的单位为 mg·d−1. 采用皮尔森相关分析检验非法药物与其代谢物之间的相关性,采用单因素方差分析检验不同时期非法药物浓度和滥用量的差异,采用t检验分析节假日与日常生活期间非法药物浓度和滥用量的差异,所有的结果均以P<0.05判定是否存在显著性.
2. 结果与讨论(Results and discussion)
2.1 方法学验证
本研究以3倍、10倍信噪比计算出检出限和定量限. 标准工作曲线范围为1—500 ng·L−1,目标分析物与相应氘代内标的定量离子对峰面积比y为纵坐标、标准曲线中目标物的含量x为横坐标进行线性回归,得到线性方程. 结果见表2,结果显示,两种固相萃取条件下,四种毒品及其代谢物质量浓度在曲线范围内呈现较良好的线性关系,其相关系数R2为0.9911—0.9977,LODs为0.65—1.43 ng·L−1,LOQs为1.91—4.32 ng·L−1.
表 2 不同SPE柱条件下目标物的线性范围、回归方程、相关系数、检出限和定量限Table 2. Linear ranges, regression equation, correlation coefficients, limits of detection(LOD), and limits of quantitation(LOQ) of DTRs under different SPE column conditions分析物Analyte 线性范围/(ng·L−1)Linear range 回归方程Regression equation R2 检出限/(ng·L−1)LOD 定量限/(ng·L−1)LOQ MCX METH 1—500 y = 0.0565x + 0.8173 0.9963 0.72 2.36 AMP 1—500 y = 0.0505x + 0.6301 0.9977 0.94 2.74 KET 1—500 y = 0.0344x + 0.404 0.9970 0.65 1.91 NK 1—500 y = 0.0291x + 0.4297 0.9944 1.22 3.60 HLB METH 1—500 y = 0.0377x + 0.98 0.9916 1.35 4.17 AMP 1—500 y = 0.031x + 1.0509 0.9859 1.43 4.32 KET 1—500 y = 0.0218x + 0.3735 0.9950 0.76 2.18 NK 1—500 y = 0.0196x + 0.3346 0.9911 0.94 2.89 分别制备低、中、高的3个浓度(10、50、400 ng·L−1)的混合储备溶液,在3种处理条件下进行测试:在纯水样本处理前添加混合储备溶液,纯水样本SPE处理后添加储备溶液,纯水样品不做处理直接添加储备溶液,每组处理条件设置7组平行样,测定完后计算萃取回收率、基质效应及精密度. 计算结果如表3所示,计算得到使用Oasis MCX固相萃取柱处理纯水样品时平均回收率为81.44%—105.92%,基质效应范围为72.36%—124.61%. 而使用HLB固相萃取柱进行前处理时,平均回收率为64.45%—109.52%,基质效应范围为61.38%—130.54%,两种前处理方法得到的RSDs均小于10%.
表 3 不同SPE柱条件下目标物的回收率、基质效应和精密度Table 3. Recovery, matrix effect and precision of the DTRs under different SPE column conditions回收率/%Recovery(n=7) 基质效应/%Matrix effects 精密度/%RSD 分析物Analyte 日内Intraday 日间Interday 10 ng·L−1 50 ng·L−1 400 ng·L−1 10 ng·L−1 50 ng·L−1 400 ng·L−1 10 ng·L−1 50 ng·L−1 400 ng·L−1 10 ng·L−1 50 ng·L−1 400 ng·L−1 MCX METH 105.41 105.92 103.51 75.24 98.43 102.43 3.54 2.91 3.16 6.42 5.33 5.58 AMP 97.16 103.04 98.27 87.52 104.92 89.59 4.16 2.36 4.04 6.24 5.04 5.25 KET 104.63 96.12 105.31 72.36 106.36 110.54 2.48 4.87 3.55 8.68 4.82 7.03 NK 81.44 92.33 103.64 122.43 124.61 101.92 2.13 3.32 2.73 9.75 8.13 8.62 HLB METH 95.72 109.52 93.18 61.38 125.41 112.43 5.82 4.90 5.36 5.53 6.49 6.24 AMP 95.15 99.84 102.42 130.54 101.47 95.60 4.03 6.93 6.35 6.14 7.33 7.90 KET 64.45 81.32 72.03 64.46 105.53 88.74 5.00 4.24 6.84 8.18 8.62 9.04 NK 68.86 73.54 80.01 103.60 115.51 105.27 5.09 4.16 6.08 9.06 9.70 8.43 通过比较两种SPE柱及固相萃取条件的萃取回收率和基质效应,发现混合型阳离子交换固相萃取小柱Oasis MCX对这4种毒品及其代谢物的分离效果良好,较亲水亲脂反相吸附萃取小柱Oasis HLB的回收率更高,能够更好地满足本研究中非法药物定量准确度的要求. 根据研究表明,Oasis MCX的吸附剂是含亲水基团的聚苯乙烯/二乙烯基苯共聚物上键合磺酸基团,能更有效的提取碱性化合物[18-19]. 甲基苯丙胺和氯胺酮及其代谢产物具有含氮的碱性基团,因此Oasis MCX柱能够更有效满足富集要求,所以本研究在现实污水样品前处理及后续实验中均考虑1.3使用Oasis-MCX固相萃取柱萃取富集目标分析物的方法.
2.2 非法药物的赋存特征
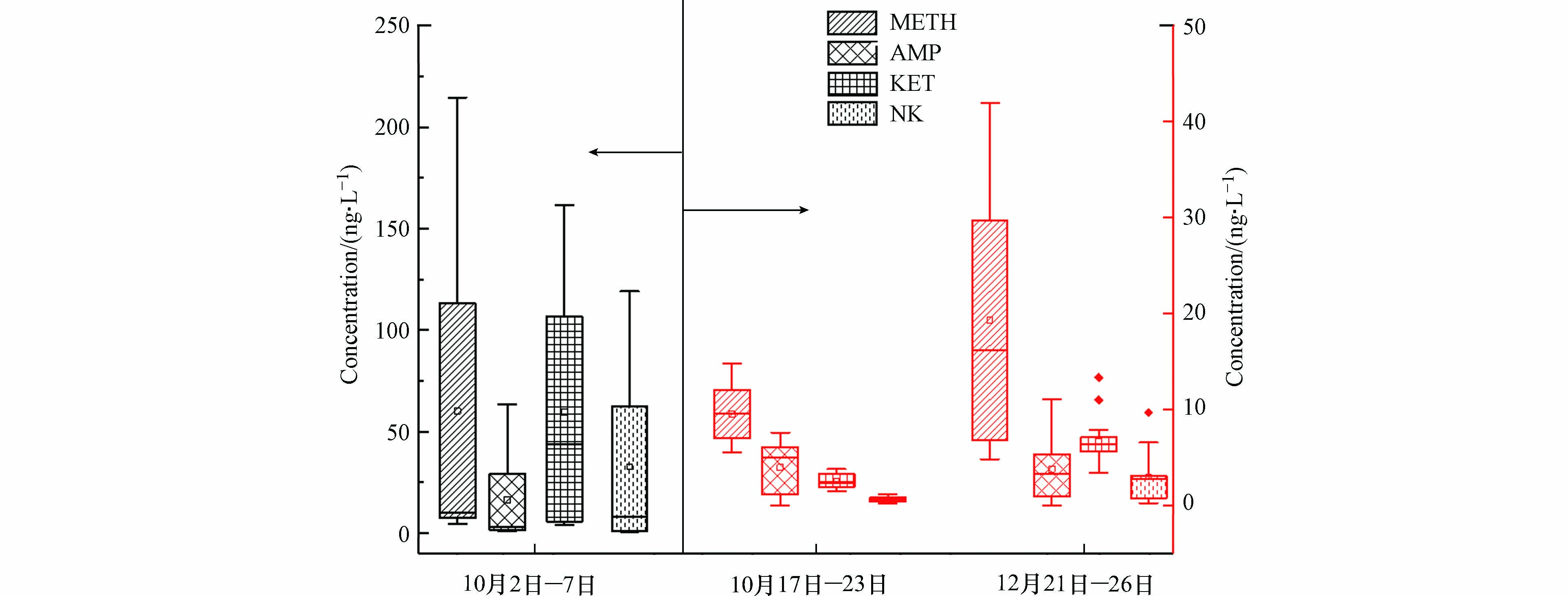
本研究采样期间,WWTP相应的非法药物及其代谢物的浓度水平如图1所示. 这4种毒品及其代谢物在全部污水样品中都有检出,其中METH检出率为100%,AMP的检出率为76%. 重大节假日期间(国庆假期)采集的样品中METH的浓度范围为(6.49±2.44)—(214.46±0.25)ng·L−1,平均浓度为(60.17±0.75)ng·L−1. 后续两次非节假日期间测定样品中METH浓度范围分别为(6.78±0.35)—(13.87±1.07)ng·L−1和(5.57±0.72)—(30.85±10.93)ng·L−1,平均浓度分别为(9.40±1.03)ng·L−1和(19.30±8.20)ng·L−1. AMP在重大节假日期间的浓度范围为(1.62±0.63)—(58.62±6.85)ng·L−1,非节假日期间AMP浓度范围分别为ND(未检出)—(6.48±0.74)ng·L−1和ND—(9.62±2.05)ng·L−1. KET和NK并没有在所有样品中检出,检出率分别为76.47%和57.45%. 重大节假日期间样品中KET的浓度范围为(4.59±0.48)—(144.77±23.61) ng·L−1,非节假日期间样品中KET的最高浓度为(9.00±3.76)ng·L−1. NK在重大节假日期间的浓度范围为(1.02±0.39)—(114.57±6.67)ng·L−1,非节假日期间NK的最高浓度为(3.42±0.54)ng·L−1. 由上述结果得出,重大节假日期间非法药物及其代谢物的浓度显著高于非节假日期间(P<0.05),苯丙胺类兴奋剂和氯胺酮是各种娱乐场所和聚会中常用的违禁药物,重大节假日期间大量的娱乐活动使桂林市非法药物的使用可能具有节假日效应. 而日常生活期间12月份WWTP进水废水中毒品及其代谢物浓度较10月份浓度普遍提升(P<0.05),这可能是气温降低,人们生活用水减少,没有过多的稀释生活污水目标分析物的含量.
根据METH的药代动力学研究表明,大约42%±17%的METH未经过人体代谢通过尿液排出体外,摄入后的30%的AMP和40%的METH在尿液中以原型排出,而高达7%的METH在代谢后以AMP的形式排出[20],如果污水中的AMP与METH浓度比值范围在0.08—0.15则被认为是由METH代谢产生的[21-22]. 本研究中METH和AMP浓度之间有着显著性正相关(P<0.01,r=0.995),但绝大多数AMP和METH的浓度比大于0.15,表明该区域可能存在外在AMP的来源. 研究表明,服用部分合法药物例如治疗帕金森病的辅助药物可以经过人体代谢产生METH,但其对污水中浓度基本没有贡献,且在中国,尚无含有可直接代谢为AMP成分的处方药[22]. 因此,桂林市该WWTP所服务区域存在着METH和AMP滥用共存的现象,可能有非法制毒泄漏或倾倒苯丙胺兴奋剂等行为[23]. 将本研究与其他地区污水中苯丙胺兴奋剂浓度比较时发现该区域的平均浓度低于其他城市的平均浓度,中国广州市WWTPs的进水废水中METH的平均浓度为(145.6±100.3)ng·L-1[15],Xu等[24]报道的青岛WWTPs废水中METH的最高浓度高达1016.0 ng·L−1. 桂林市该区域的日常生活期间AMP的平均浓度为(4.01±1.48)ng·L−1,低于北京(15.2 ng·L−1)、上海(22.7 ng·L−1)、深圳(26.4 ng·L−1)的浓度水平[7, 25]. NK和KET浓度之间也呈现出显著性正相关(P<0.01,r=0.992). 人体摄入KET后30%的代谢产物为其原型,还有1.6%和6%代谢为脱氢去甲氯胺酮(DNKET)和去甲氯胺酮(NK)[24],KET经人体代谢后污水中残留的KET与NK原理比值为0.27—2.10[26]. 而本研究KET的浓度与NK的浓度的比值为0.19—6.84,表明可能存在向污水管网直接倾倒氯胺酮的情况,致使污水中KET的浓度总体上高于NK. 本区域非法药物的实际浓度比值都超过理论比值可能与桂林市持续开展一系列的禁毒活动有关,根据后续研究报道[27],从2021年第一季度开始桂林市公安局进行城市生活污水毒情检测,精准追踪溯源,对污水检测毒品含量高的区域,采取多种措施压缩毒品违法犯罪活动空间,从而可能存在向污水管网恶意倾倒或排放非法药物的现象.
2.3 消费量计算
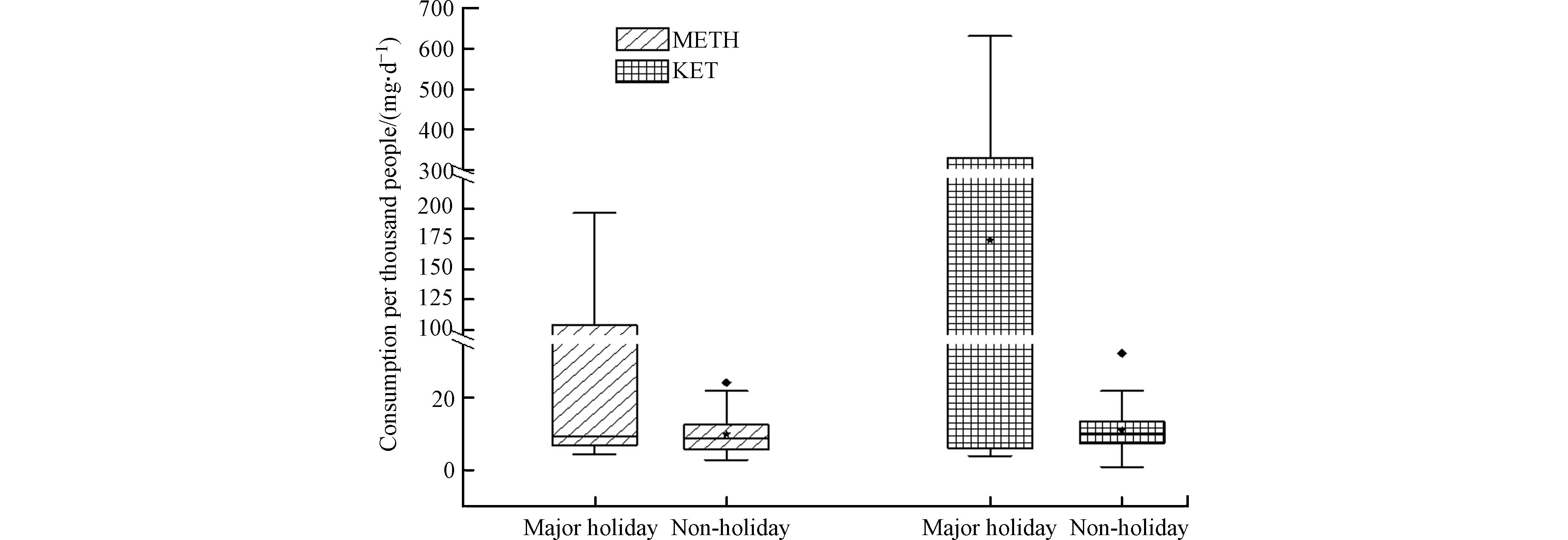
通过反推模型对广西桂林市该WWTP服务区的METH和KET的消费量进行了回测,结果如图2所示. 该污水厂服务区域重大节假日期间METH的千人日均消费量范围为(5.94±2.44)—(196.4±0.25)mg·d−1,平均值为(55.11±94.22)mg·d−1,非节假日期间METH的千人日均消费量范围为(3.23±0.72)—(17.90±10.93)mg·d−1,平均值为(9.79±4.25)mg·d−1·. 以NK作为DTR进行对KET的消费量进行反演,结果得出桂林市该区域重大节假日期间KET的千人日均消费量范围为(5.37±0.39)—(606.12±6.67)mg·d−1,平均值为(173.82±1.83)mg·d−1,而非节假日的KET的千人日均消费量范围为(1.93±0.15)—(15.21±0.83)mg·d−1,平均值为(10.50±1.05)mg·d−1.
日常生活期间桂林市METH与KET的消费量没有明显的差异(P>0.05),但是重大节假日期间非法药物的滥用量存在着暴增的现象(P<0.05),说明桂林市非法药物的消费具有明显的节假日效应. 重大节假日期间桂林市该区域METH和KET的千人日均消费量与东北和广州节假日期间的浓度相当[15, 28],日常生活期间METH的千人日均消费量低于全国千人日均消费水平,根据以往研究报道我国主要城市的污水厂进水废水中的METH千人日均消费量为97.70 mg·d−1[7, 29]. 相比于中国主要城市的METH消费量,KET在中国城市的总体消费量要低得多,但是KET消费量的空间变化高于METH. 与北京(每千人2.2 mg·d−1)、上海(每千人9.1 mg·d−1)相比,本研究的KET消费量更高,这与华南地区KET的消费量大于华北地区的事实相符[7]. 本研究通过对桂林市重大节假日与日常生活期间非法药物的滥用量调查发现,重大节假日期间非法药物消费量显著高于日常生活期间的消费量,表明重大节假日期间非法药物滥用的管控不容忽视,仍需要对桂林市的非法药物滥用情况进行长期监测,深入开展“清源断流”行动,全力遏制非法药物滥用危害.
3. 结论(Conclusion)
(1)比较了Oasis MCX固相萃取柱与Oasis HLB固相萃取柱对甲基苯丙胺与氯胺酮及其代谢产物的萃取回收率. 研究发现Oasis MCX固相萃取柱对模拟样品中这4种毒品及其代谢物的分离效果更好. Oasis MCX固相萃取柱处理模拟样品时平均回收率为81.44%—105.92%,基质效应范围为72.36%—124.61%.
(2)桂林市该污水处理厂进水样品中METH与KET的检出率分别为100%和76.47%. AMP/METH与KET/NK的浓度比值超过理论代谢范围,说明桂林市开展一系列禁毒活动后,可能存在向污水管网恶意倾倒或排放非法药物的现象.
(3)桂林市该污水厂服务地区的日常生活期间METH的千人日均消费量最高为(17.90±10.93)mg·d−1,国庆节期间千人日均消费量最高为(196.4±0.25)mg·d−1. 日常生活期间KET的千人日均消费量最高为(15.21±0.83)mg·d−1,而国庆节期间千人日均消费量最高为(606.12±6.67)mg·d−1. 节假日期间非法药物的滥用量存在着暴增的现象,桂林市该区域非法药物的消费具有显著的节假日效应,表明桂林市节假日期间非法药物滥用的管控不容忽视.
-
表 1 SRB富集培养基的组成
Table 1. Composition of SRB enrichment medium
药品名称Pharmaceutical ingredients 质量浓度/(g·L−1)Mass concentration K2HPO4 0.5 (NH4)2SO4 2.5 NaHCO3 0.5 CaCl2 0.2 MgSO4 1 乳酸钠sodium lactate 20 mL·L−1 L-抗坏血酸L-Ascorbic acid 0.1 L-半胱氨酸盐酸盐L-Cysteine hydrochloride monohydrate 0.5 酵母膏yeast extract 1.5 (NH4)2Fe(SO4)2·6H2O 0.5 表 2 不同处理中沉淀物中的原子比(Cu与络合剂物质的量比为1:10)
Table 2. The atomic ratios of precipitates from different treatments (molar ratio of Cu and complexing agent =1:10).
元素Element 原子比/%Atom Shewanella sp. JN01 Cu2+ Cu-EDTA Cu-GLDA Cu-CA Cu-MC C 63.30 67.13 78.21 71.85 72.00 75.19 O 29.85 19.45 19.03 16.13 23.28 21.69 S 6.85 9.07 1.70 6.64 3.36 1.57 Cu ND 4.34 1.07 5.38 1.36 1.56 ND.,未检出. ND., not detected. -
[1] LIU L W, LI W, SONG W P, et al. Remediation techniques for heavy metal-contaminated soils: Principles and applicability [J]. Science of the Total Environment, 2018, 633: 206-219. doi: 10.1016/j.scitotenv.2018.03.161 [2] WANG Z Z, WANG H B, WANG H J, et al. Effect of soil washing on heavy metal removal and soil quality: A two-sided coin [J]. Ecotoxicology and Environmental Safety, 2020, 203: 110981. doi: 10.1016/j.ecoenv.2020.110981 [3] GONG Y Y, ZHAO D Y, WANG Q L. An overview of field-scale studies on remediation of soil contaminated with heavy metals and metalloids: Technical progress over the last decade [J]. Water Research, 2018, 147: 440-460. doi: 10.1016/j.watres.2018.10.024 [4] 郭军康, 李艳萍, 李永涛, 等. 采用草酸和EDTA去除农田土壤中砷和镉污染 [J]. 环境工程, 2019, 37(5): 70-75. doi: 10.13205/j.hjgc.201905014 GUO J K, LI Y P, LI Y T, et al. Treatment of arsenic and cadmium in contaminated farmland soil with oxalic acid and EDTA [J]. Environmental Engineering, 2019, 37(5): 70-75(in Chinese). doi: 10.13205/j.hjgc.201905014
[5] WANG G Y, PAN X M, ZHANG S R, et al. Remediation of heavy metal contaminated soil by biodegradable chelator-induced washing: Efficiencies and mechanisms [J]. Environmental Research, 2020, 186: 109554. doi: 10.1016/j.envres.2020.109554 [6] GUAN W, ZHANG B F, TIAN S C, et al. The synergism between electro-Fenton and electrocoagulation process to remove Cu-EDTA [J]. Applied Catalysis B:Environmental, 2018, 227: 252-257. doi: 10.1016/j.apcatb.2017.12.036 [7] 郑雄开, 陶雪琴, 杜建军, 等. 模拟土壤淋洗废液中重金属的选择性去除与淋洗液的回收研究 [J]. 环境科学学报, 2020, 40(3): 995-1003. doi: 10.13671/j.hjkxxb.2019.0416 ZHENG X K, TAO X Q, DU J J, et al. Selective removal of heavy metals from simulated wastewater from leaching soil and recovery of eluent [J]. Acta Scientiae Circumstantiae, 2020, 40(3): 995-1003(in Chinese). doi: 10.13671/j.hjkxxb.2019.0416
[8] 薛璐璐, 袁翔, 朱梦羚, 等. 高级氧化法破络处理柠檬酸铜镍电镀废水 [J]. 净水技术, 2019, 38(3): 9-14,50. doi: 10.15890/j.cnki.jsjs.2019.03.003 XUE L L, YUAN X, ZHU M L, et al. Complex breakdown treatment for copper-nickel citrate electroplating wastewater by advanced oxidation process(AOP) [J]. Water Purification Technology, 2019, 38(3): 9-14,50(in Chinese). doi: 10.15890/j.cnki.jsjs.2019.03.003
[9] LI X, LAN S M, ZHU Z P, et al. The bioenergetics mechanisms and applications of sulfate-reducing bacteria in remediation of pollutants in drainage: A review [J]. Ecotoxicology and Environmental Safety, 2018, 158: 162-170. doi: 10.1016/j.ecoenv.2018.04.025 [10] KIEU H T Q, MÜLLER E, HORN H. Heavy metal removal in anaerobic semi-continuous stirred tank reactors by a consortium of sulfate-reducing bacteria [J]. Water Research, 2011, 45(13): 3863-3870. doi: 10.1016/j.watres.2011.04.043 [11] 董净, 代群威, 赵玉连, 等. 硫酸盐还原菌的分纯及对Cd2+钝化研究 [J]. 环境科学与技术, 2019, 42(5): 34-40. DONG J, DAI Q W, ZHAO Y L, et al. Isolation of sulfate-reducing bacteria and study on its passivation of Cd2+ [J]. Environmental Science & Technology, 2019, 42(5): 34-40(in Chinese).
[12] MOHAPATRA R K, PARHI P K, PANDEY S, et al. Active and passive biosorption of Pb(II)using live and dead biomass of marine bacterium Bacillus xiamenensis PbRPSD202: Kinetics and isotherm studies [J]. Journal of Environmental Management, 2019, 247: 121-134. [13] GU W Z, ZHENG D C, LI D P, et al. Integrative effect of citrate on Cr(Ⅵ) and total Cr removal using a sulfate-reducing bacteria consortium [J]. Chemosphere, 2021, 279: 130437. doi: 10.1016/j.chemosphere.2021.130437 [14] CASTRO L, BLÁZQUEZ M L, GONZÁLEZ F, et al. Anaerobic bioleaching of jarosites by Shewanella putrefaciens, influence of chelators and biofilm formation [J]. Hydrometallurgy, 2017, 168: 56-63. doi: 10.1016/j.hydromet.2016.08.002 [15] HÅKANSSON T, SJÖBERG S, MATTIASSON B. Treatment of metal ions and metal-chelate complexes in water with biologically produced H2S [J]. International Journal of Environment and Waste Management, 2012, 9(3/4): 330. doi: 10.1504/IJEWM.2012.046396 [16] LARKIN M A, BLACKSHIELDS G, BROWN N P, et al. Clustal W and Clustal X version 2.0 [J]. Bioinformatics (Oxford, England), 2007, 23(21): 2947-2948. doi: 10.1093/bioinformatics/btm404 [17] GUO X F, ZHAO G H, ZHANG G X, et al. Effect of mixed chelators of EDTA, GLDA, and citric acid on bioavailability of residual heavy metals in soils and soil properties [J]. Chemosphere, 2018, 209: 776-782. doi: 10.1016/j.chemosphere.2018.06.144 [18] PENG H L, LI D, YE J, et al. Biosorption behavior of the Ochrobactrum MT180101 on ionic copper and chelate copper [J]. Journal of Environmental Management, 2019, 235: 224-230. [19] CHEN M X, ZHANG Y, ZHOU J T, et al. Sulfate removal by Desulfovibrio sp. CMX in chelate scrubbing solutions for NO removal [J]. Bioresource Technology, 2013, 143: 455-460. doi: 10.1016/j.biortech.2013.06.037 [20] WANG Q W, CHEN J J, ZHENG A H, et al. Dechelation of Cd-EDTA complex and recovery of EDTA from simulated soil-washing solution with sodium sulfide [J]. Chemosphere, 2019, 220: 1200-1207. doi: 10.1016/j.chemosphere.2018.12.212 [21] WANG G Y, ZHANG S R, XU X X, et al. Heavy metal removal by GLDA washing: Optimization, redistribution, recycling, and changes in soil fertility [J]. Science of the Total Environment, 2016, 569/570: 557-568. doi: 10.1016/j.scitotenv.2016.06.155 [22] HUANG F, DANG Z, GUO C L, et al. Biosorption of Cd(Ⅱ) by live and dead cells of Bacillus cereus RC-1 isolated from cadmium-contaminated soil [J]. Colloids and Surfaces B:Biointerfaces, 2013, 107: 11-18. doi: 10.1016/j.colsurfb.2013.01.062 [23] SHAHSAVARI S, SETH R, CHAGANTI S R, et al. Inhibition of anaerobic biological sulfate reduction process by copper precipitates [J]. Chemosphere, 2019, 236: 124246. doi: 10.1016/j.chemosphere.2019.06.216 [24] GUZMAN J, SAUCEDO I, REVILLA J, et al. Copper sorption by chitosan in the presence of citrate ions: Influence of metal speciation on sorption mechanism and uptake capacities [J]. International Journal of Biological Macromolecules, 2003, 33(1/2/3): 57-65. [25] LU P J, HU W W, CHEN T S, et al. Adsorption of copper-citrate complexes on chitosan: Equilibrium modeling [J]. Bioresource Technology, 2010, 101(4): 1127-1134. doi: 10.1016/j.biortech.2009.09.055 [26] 袁媛, 刘自成, 李杰, 等. 新型生物质基复合水凝胶球珠高效吸附去除Ni-EDTA络合物的特性与机制 [J]. 离子交换与吸附, 2021, 37(1): 1-13. doi: 10.16026/j.cnki.iea.2021010001 YUAN Y, LIU Z C, LI J, et al. The removal of Ni-EDTA complex by a novel biomass based MCS/SA@PEI composite hydrogel beads [J]. Ion Exchange and Adsorption, 2021, 37(1): 1-13(in Chinese). doi: 10.16026/j.cnki.iea.2021010001
[27] ZHANG X L, HUANG P, ZHU S Y, et al. Nanoconfined hydrated zirconium oxide for selective removal of Cu(Ⅱ)-carboxyl complexes from high-salinity water via ternary complex formation [J]. Environmental Science & Technology, 2019, 53(9): 5319-5327. [28] PARSADOUST F, SHIRVANI M, SHARIATMADARI H, et al. Effects of GLDA, MGDA, and EDTA chelating ligands on Pb sorption by montmorillonite [J]. Geoderma, 2020, 366: 114229. doi: 10.1016/j.geoderma.2020.114229 [29] TYAGI S, MALIK W, ANNACHHATRE A P. Heavy metal precipitation from sulfide produced from anaerobic sulfidogenic reactor [J]. Materials Today:Proceedings, 2020, 32: 936-942. doi: 10.1016/j.matpr.2020.05.076 [30] BAI H, KANG Y, QUAN H E, et al. Treatment of copper wastewater by sulfate reducing bacteria in the presence of zero valent iron [J]. International Journal of Mineral Processing, 2012, 112/113: 71-76. doi: 10.1016/j.minpro.2012.06.004 [31] ZHANG M L, WANG H X, HAN X M. Preparation of metal-resistant immobilized sulfate reducing bacteria beads for acid mine drainage treatment [J]. Chemosphere, 2016, 154: 215-223. doi: 10.1016/j.chemosphere.2016.03.103 -




 DownLoad:
DownLoad: