-
近年来,随着湖泊富营养化程度的加剧,大量蓝藻在水体季节性增殖,导致水华蓝藻频发,对生态环境造成了危害[1-2]。目前常用的藻水分离的方法有化学分离[3-4]和物理分离[5-6]。
与沉降技术相比,过滤技术由于藻水分离效果好、出水质量高和易于规模化放大应用等优势在物理分离方法中的应用日益受到关注[7-8]。然而,利用过滤技术分离水华蓝藻时易出现严重过滤堵塞,难以保持持续较高的分离效率[9]。藻细胞及其分泌物极易粘附在过滤介质表面或形成致密的藻饼层造成膜污染,进而影响膜过滤性能[10-12]。近年来,有研究表明,利用混凝预处理可以使胶体和微粒物失稳并聚集在一起,改变其在过滤过程中的藻饼堆积形态,进而减缓膜污染,提高过滤性能[13-16]。例如,RACAR等 [13]单独使用氯化铁作为预处理混凝剂,混凝-过滤处理化工废水,结果发现混凝预处理可以有效缓解过滤通量下降,使其通量下降率降低4.2~19.2倍。而ZHANG等[17]用不同铝系混凝剂对含藻水混凝-过滤,结果表明,水样经混凝预处理后,膜通量均有提高,并且不同混凝剂的提高效果存在明显差异。因此混凝预处理不仅可以提高过滤通量,而且不同混凝剂对于过滤效果的提高存在显著差异。
混凝剂种类是影响混凝-过滤性能的重要因素[18]。聚丙烯酰胺(PAM),粘土/改性粘土,聚合铁盐等均是使用较广泛的水处理剂,与一般的无机絮凝剂相比,PAM具有较大的分子质量,能够通过网捕和吸附架桥作用聚合废水中的胶体颗粒及悬浮物,并且所生成的絮团沉降性能优异,但其存在投加成本高、药剂溶解性差等缺点[19],且PAM在水中也有残留风险。据王瑞等[20]研究发现,相对于PACl,PAM会增加出水的化学需氧量(COD)和氨氮含量,影响水质。邱丽霞等[21]通过改性粘土对球形棕囊藻的消除研究,发现在所有实验浓度下使用粘土/改性粘土均会导致部分藻细胞死亡,使胞内有机物释放到水体中,在短时间内,导致水体DOC含量明显升高。雷国元等[22]的研究表明,使用高浓度铁盐处理含藻水时,出水会出现色度问题。聚合氯化铝(polyaluminum chloride,PACl)因其低廉的价格,良好的处理性能常被用作水华爆发后应急处理的混凝剂[23]。WANG等[24]用硫酸铝和聚合氯化铝处理富藻水体,结果发现使用聚合氯化铝的处理成本更低且混凝后的絮体更紧实,然而其在生物质中的残留也影响到微藻生物质的资源化利用。
近年来,壳聚糖(chitosan,CTS)因其良好的生物降解性并且无毒无残留的优点,使其在微藻收获中的应用也日益受到关注[25]。冯辰辰等[19]利用硫酸铝、氯化铁、氢氧化钠和壳聚糖对小球藻进行混凝沉降,结果发现壳聚糖较其他混凝剂在更少用量下有更好的混凝效果。且NAYAK等[26]对比了硫酸铝、硫酸铁和壳聚糖等混凝剂对小球藻生物质高效收获的影响,结果发现壳聚糖有更优的处理效果。然而,PACl和CTS混凝预处理如何影响水华微囊藻的过滤去除尚不明晰。
本研究探究了PACl和CTS对水华微囊藻混凝-过滤分离特性的影响,研究了2种混凝剂对絮体特性、过滤通量、出水水质和生物质品质的影响,并对2种混凝剂在优化剂量下的药剂成本进行了分析,以期为混凝-过滤去除水华蓝藻时混凝剂的选择以及混凝-过滤机制的探索提供参考。
-
实验试剂主要有盐酸(1 mol·L−1;分析纯)、氢氧化钠(1 mol·L−1;分析纯)、聚合氯化铝(98%;麦克林)和壳聚糖(BR 500;国药集团化学试剂有限公司)。
实验仪器包括pH计(FE, METTLER TOLEDO, Switzerland)、六联搅拌仪(MY3000-2N/4N, MEIYU, China),分析天平(Mettler-Toledo analytical balbnce)、死端过滤装置(HP4750, Sterlitech, USA)、四通道精密微流体控制压力泵(FC-3P3-1V1-AS,介观生物,中国)。
-
本研究中使用的水华蓝藻于2020年7月在中国科学院地理与湖泊研究所太湖实验站附近水域采集,利用干重法测得藻细胞浓度为0.72g·L−1。镜检结果显示,野外采集的水华蓝藻中90%以上的藻种均为水华微囊藻(Microcystis flos-aquae)。
-
1)混凝实验。混凝实验在梅宇六联搅拌仪上进行,取300 ml水样于搅拌仪中,投加混凝剂,先快速搅拌(200 r·min−1)1min,使混凝剂与藻液快速混合均匀。调节体系pH至6.5±0.2后,继续慢速搅拌(50 r·min−1)5 min,使藻细胞在混凝剂的作用下碰撞絮凝,增大絮体。其中,混凝剂PACl的投加梯度设为0、65、100、136、172 mg·g−1(以Al+计)生物质;混凝剂CTS的投加梯度设为0、4.6、6.9、9.2、12、14 mg·g−1(以CTS计)生物质。
2)过滤实验。实验室过滤分离系统主要由程控仪(跨膜压差设置为34.5 kPa)、死端过滤器(有效过滤面积为14.6 cm2)、电子天平和电脑构成。过滤材料为5 μm孔径的尼龙膜。
过滤通量是指示过滤性能的重要指标,高的过滤通量意味着高的过滤分离性能。根据式(1)计算过滤通量。过滤通量下降率可以直观地反应过滤通量的变化,可根据式(2)计算。通过对饼层阻力的测量,研究藻类沉积对通量下降的影响。滤饼阻力根据式(3)计算。饼层比阻力系数(Rcs, m·g−1)是滤饼的一种固有特性,根据式(4)计算。
式中: J为膜通量,L·(m2·h)−1;V为t时间内透过膜的滤液体积,L;A为过滤有效膜面积,m2;t为过滤时间,h。
式中:D为通量下降率,%;Ji和Jf分别是初始时和结束时的过滤通量,L·(m2·h)−1。
式中:Rc和Rm分别为饼层阻力和膜阻力,m−1;TMP为跨膜压差,Pa;μ为藻液粘度系数,Pa·s。
式中:Rcs为比阻力系数,m·g−1; m为膜上生物质的打捞质量,g。
-
本实验采用分形维数和粒径分布来指示混凝后藻絮体的形态特征。根据分形几何理论,絮团颗粒的投影面积和最大长度之间存在如下关系:
式中:Df为分形维数,A为絮体的投影面积,d为投影的最大长度,β为比例常数。Df与絮体的紧实性有关,Df值越大,絮体结构越紧实[27]。
-
滤液中的铝含量利用电感耦合等离子体质谱仪(ICP MS, PE NexlON300X, PekinElmer, USA)测定,检测限为0.10 μg·L−1。生物质中的铝含量利用电感耦合等离子体-发射光谱仪(ICP-OES, OPTIMA 8000DV, PekinElmer, USA)测定,检测限为0.10 mg·L−1。
-
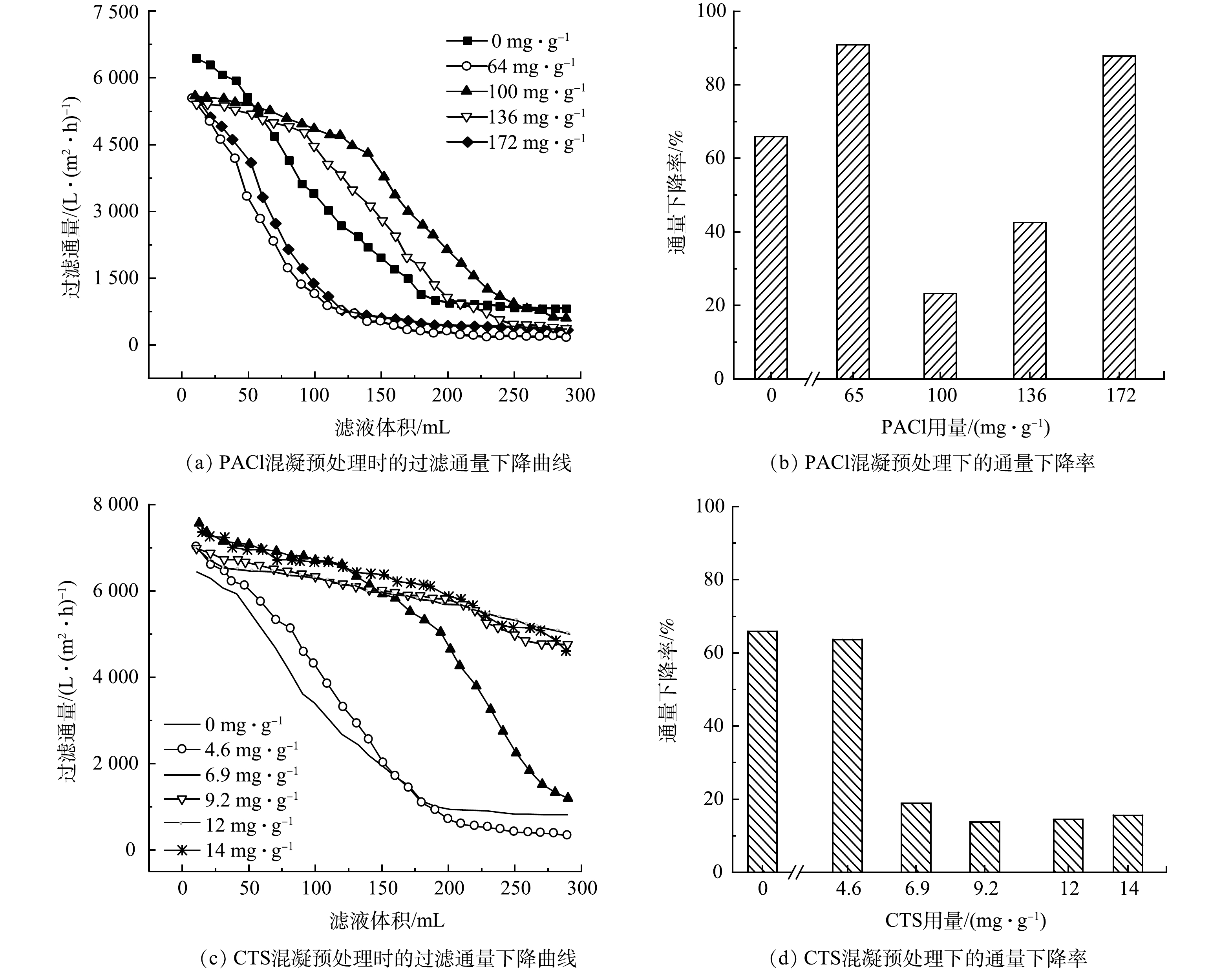
图1 (a)、图1 (b)分别反映了水华微囊藻在不同PACl剂量下的混凝-过滤通量变化曲线以及通量下降率。如图1 (a)所示,过滤通量随过滤体积增加逐渐降低,不同PACl剂量下,通量下降趋势有所不同。适量的PACl剂量(100 mg·g−1,136 mg·g−1)可以明显减缓过滤通量下降。由图1 (b)可见,当不投加PACl时,通量下降率达到65.9%;经PACl预处理后,通量下降率先上升到90.8%,然后下降到23.2%,最后一直上升至87.8%。所以,当PACl剂量为100~136 mg·g−1时,通量下降率得到了明显的减缓。由此可知,在本实验条件下,PACl最佳投加量为100 mg·g−1。
电中和在混凝过程中起到重要作用,当PACl投加量(65 mg·g−1)较少时,混凝效果较差,因此,未参与混凝的藻细胞和藻源型有机物(AOM)在过滤过程中可能造成膜堵塞,导致其过滤通量低于未投加药剂时的过滤通量;而PACl投加量较多时(172 mg·g−1),过多的正电荷使藻细胞间斥力增加,无法聚集,导致体系中胶体颗粒物复稳[28],混凝效果较差,且在过滤过程中,过多的PACl形成的铝胶体可能进一步增加膜堵塞,导致其过滤通量下降。CLARK等[29]也报道了在利用微滤或超滤进行水处理时,与不混凝直接过滤相比,过低或过高剂量的PACl易导致更大程度的膜污染。
图1 (c)和图1 (d)分别反映了水华微囊藻在不同CTS剂量下的混凝-过滤通量变化曲线以及通量下降率。由图1 (c)可见,采用CTS预混凝可以有效缓解过滤通量的下降,且CTS剂量越高,通量下降趋势逐渐变缓。与原液相比, CTS的投加量为6.9 mg·g−1时,过滤通量有了显著提高,但在过滤中后期过滤通量有一定幅度的下降,推测原因是,此时药剂量仍不足,不能完全凝聚所有藻细胞,在提高药剂用量后,过滤通量基本维持在一个相对较高的水平。图1 (d)可以看出,使用CTS作为混凝剂进行过滤预处理时,当CTS剂量为6.9 mg·g−1,通量下降率从63.7%下降到了18.9%。继续增加CTS剂量至9.2 mg·g−1时,通量下降率降至最低值13.8%。继续增加CTS剂量至12 mg·g−1和14 mg·g−1时,通量下降率依旧在20%以下,和无CTS相比,降低了50.3%。以上结果表明,与PACL相比,CTS的加入能够更显著地降低通量下降。
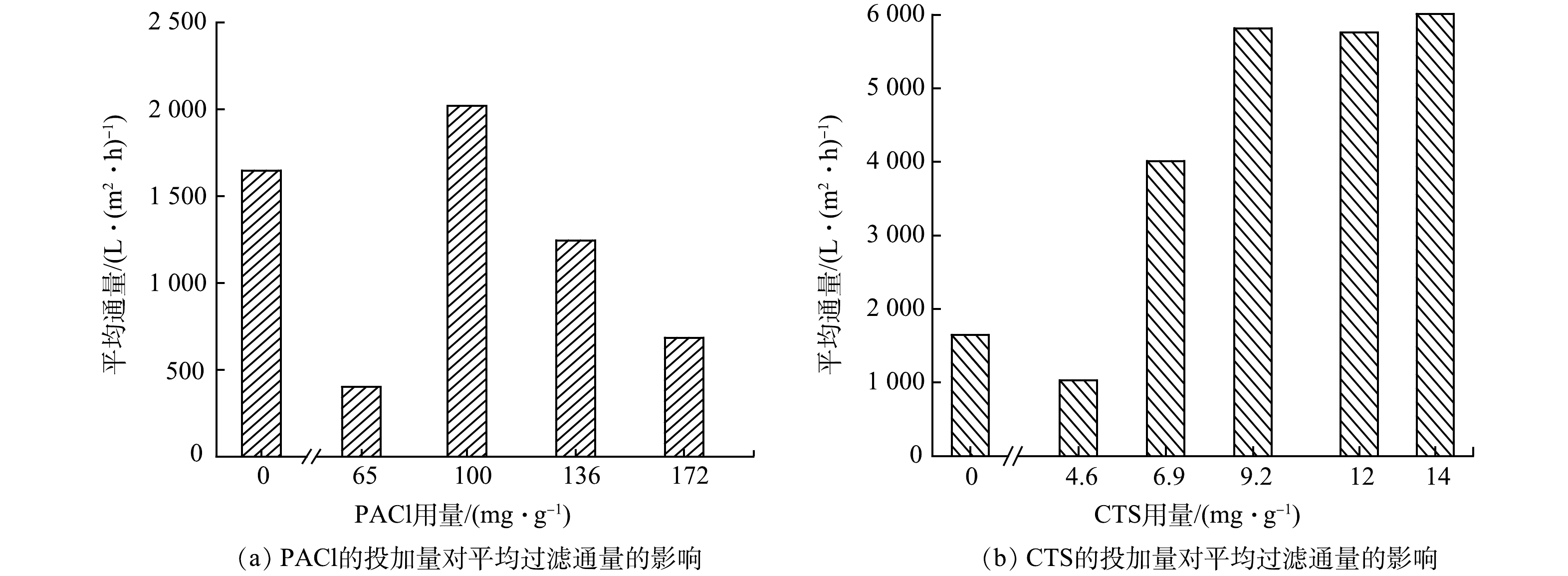
图2 (a)、图2 (b)分别反映了PACl和CTS不同投加量对混凝-过滤过程中平均过滤通量的影响。如图2所示,当PACl和CTS投加量均为0 mg·g−1时,平均过滤通量为1 647 L·(m2·h)−1。当采用PACl进行预混凝时,平均通量呈现先升高后下降的趋势,当PACl投加量为100 mg·g−1时,有最大的平均过滤通量为2 020 L·(m2·h)−1。当采用CTS进行预混凝时,随着CTS剂量增加至14 mg·g−1,平均通量先增加后保持不变,当CTS的剂量为9.2 mg·g−1时,平均过滤通量达到了最高值(5 816 L·(m2·h)−1)。与投加PACl相比,CTS作为预混凝剂会显著提高平均过滤通量,当两者在最优投加剂量下,CTS混凝预处理的藻液平均过滤通量为PACl的近3倍,且CTS的药剂需求量明显低于PACl。WANG等[15]利用混凝-过滤技术处理腐殖酸溶液,结果发现混凝后絮体特性的变化包括絮体大小、松散程度、粒径分布等对过滤性能的提高具有重要影响,而不同种类的混凝剂形成的絮体特性不同,所以絮体结构的差异可能导致了平均通量的不同。
WEI等[30-32]利用微滤/超滤(MF/UF)对微藻进行过滤分离,其通量为50~150 L·(m2·h)−1。与此相比,本研究采用混凝-过滤分离水华蓝藻,平均通量在401~6 011 L·(m2·h)−1。其通量提升的原因,除了藻种本身的过滤特性的差异外,采用5 µm的尼龙膜在无混凝剂条件下比WEI等的MF/UF的通量提升了8倍,混凝预处理后的通量进一步提升了3.5倍。结果表明,混凝预处理结合微孔过滤有可能解决水华藻类过滤通量低的技术瓶颈。
-
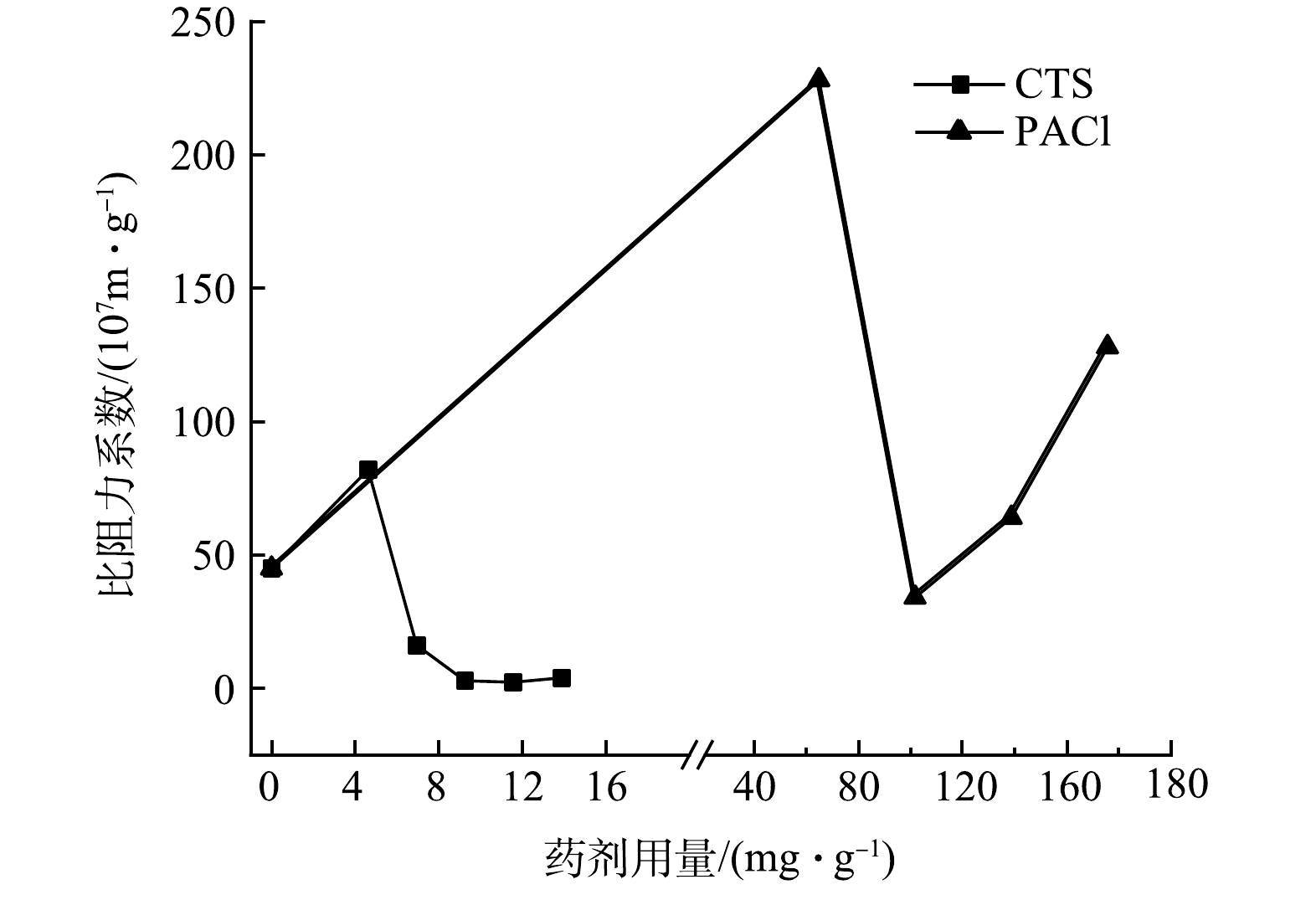
为了进一步揭示CTS、PACl混凝预处理后过滤通量的影响,本研究进一步分析了过滤滤饼的比阻力系数Rcs。Rcs是滤饼的一种固有特性,其数值越大,单位质量滤饼的阻力越大,相应的过滤通量也越低。如图3所示,在无混凝剂时,微囊藻的Rcs为4.49×108 m·g−1。投加CTS时,随着剂量的增加,Rcs在逐渐降低,这说明过滤所形成滤饼的通透性在逐渐增加;投加PACl时,Rcs先降低后增加,这说明过滤所形成滤饼的通透性先增加然后又逐渐降低。当CTS剂量为9.2 mg·g−1,PACl剂量为100 mg·g−1时,二者的Rcs比无混凝剂时的4.5×108 m·g−1分别降低了95%和24%,达到2.23×107 m·g−1和3.4×108 m·g−1。不同剂量下CTS预混凝的Rcs的变化范围要小于PACl,意味着投加CTS形成的滤饼的通透性更稳定。WICAKSANA等人[33]曾报道过堆积的小球藻细胞在被压缩时过滤阻力会增加。由此可见,投加PACl产生的滤饼阻力会有较大的波动,且更容易产生较大的过滤阻力,影响过滤的稳定性。
SRIPUI等[34]在研究米酒微滤过程中粒径及其分布对比阻力系数的影响时,发现比阻力系数随着悬浮物粒径的增加而降低,尤其是悬浮物粒径大于45 µm时,滤饼比阻力系数降低的更加明显。LEE等[35]的研究也发现在滤饼中40 µm的絮体比10 µm的絮体的比阻力系数更低,因为更小的絮体形成的滤饼更紧密,阻力更大。而微藻粒径在0.22~20 µm,所以可以通过混凝形成较大的絮体,减小比阻力系数,提高过滤效率。
-
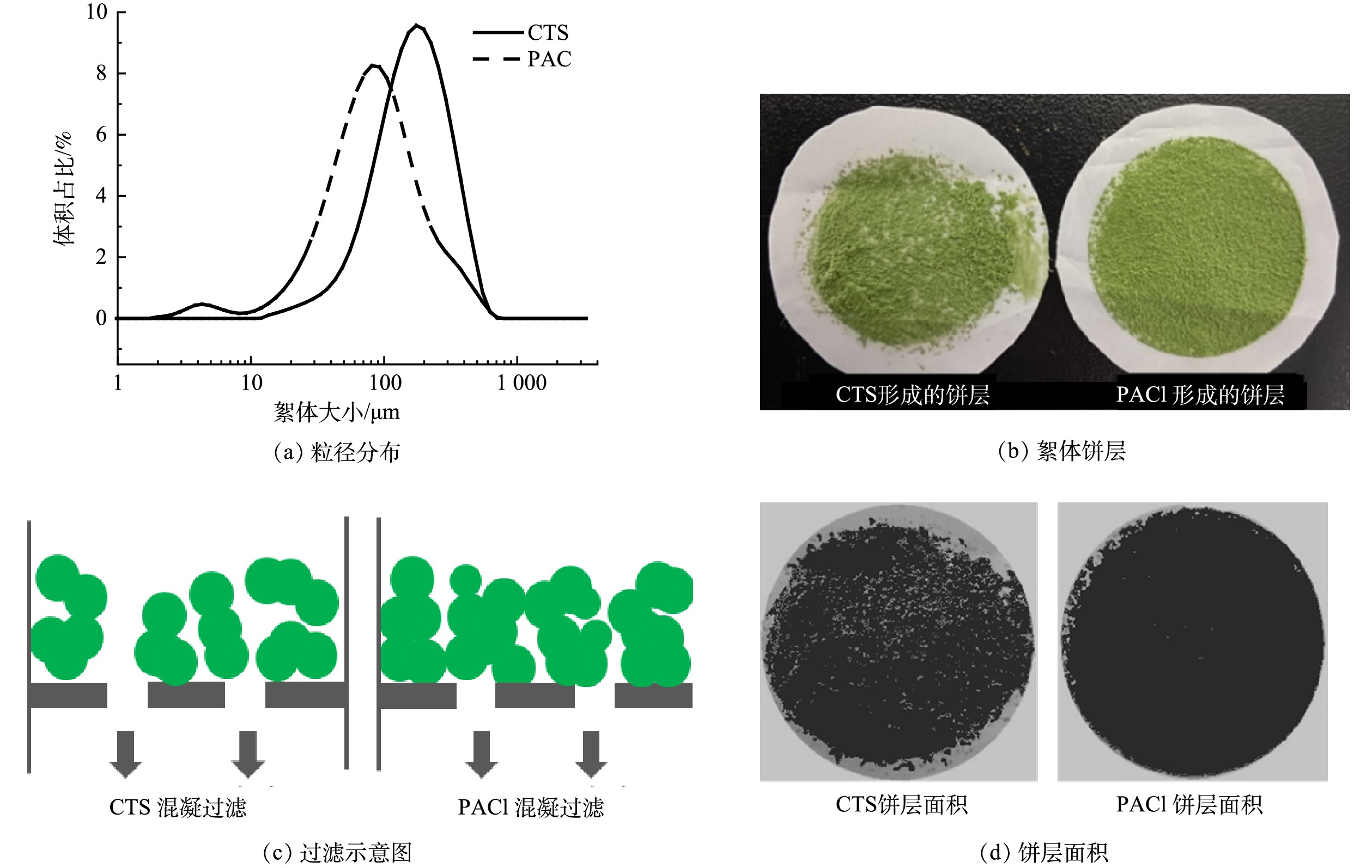
絮体特性是影响过滤性能的关键参数之一,为了进一步探讨不同混凝剂对水华微囊藻过滤饼层比阻力系数的影响,比较了最佳CTS投加量(9.2 mg·g−1)和最佳PACl投加量(100 mg·g−1)下形成的絮体粒径分布、絮体分形维数、饼层形貌特征及饼层面积。由图4 (a)可知,CTS形成的絮体平均粒径为224 μm,PACl形成的絮体平均粒径为133 μm。图4 (b)和图4 (c)为过滤等体积(50 mL)的藻液时CTS预混凝及PACl预混凝形成的絮体饼层形貌和混凝过滤示意图,由图4 (b)和图4 (c)可知,CTS形成的絮体较大,在过滤时絮体呈单个状稀疏地分布于膜表面,因而具有较大的过滤通量。而PACl形成的絮体较小,过滤时均匀的分布于膜表面,导致过滤过程中饼层阻力随着藻液堆积量的增加而增加,由此导致PACl用作混凝剂时,饼层阻力高,平均通量低。使用Image-Pro Plus(IPP)处理图4 (b)中膜上絮体饼层得到图4 (d),其中深色部分为较厚实的絮体饼层面积,而浅色部分为未被饼层占据的过滤面积。由IPP处理计算可得,CTS和PACl饼层面积分别占了总面积的77%和95%。由此可见,CTS具有相对较大的未被饼层占据的过滤面积也是其通量更高的一个原因。
-
铝是一种人体非必需的金属元素,研究发现铝对人体的发育和认知有毒性作用[36],而PACl是一种以铝离子为作用中心的无机高分子混凝剂,其在使用后会残留在滤液和生物质中。同时蓝藻生物质资源化利用有巨大前景,我国水华蓝藻的资源化主要聚焦在四个方面:作为生物质能源,生物肥料、饲料,微生物培养原料以及提取其生物活性物质[37],其中后3种对生物质品质要求较高,对铝含量有严格的要求,因此有必要对混凝-过滤后滤液和生物质中的铝含量进行检测。
在最佳PACl和CTS用量下滤液中铝残留质量浓度分别为(0.021 7±0.02) mg·L−1和(0.013 5±0.000 4) mg·L−1;生物质中的铝离子残留质量浓度分别为(10.9±0.003) mg·g−1和(0.13±0.032) mg·g−1。因此,无论是投加PACl或是CTS,滤液中铝离子残留均处于较低水平(小于0.05 mg·L−1),达到了《中国饮用水水质标准》(GB 5749-2006)中规定的铝含量小于等于0.2 mg·L−1的最低标准。由混凝-过滤后的生物质中铝残留测定结果发现,PACl中的铝离子绝大多数残留在生物质中,其含量(10.9 mg·g−1)约为CTS形成生物质中铝离子含量(0.13 mg·g−1)的84倍。结果表明,含有PACl的生物质会降低蓝藻生物质资源化利用的价值,因此,当蓝藻生物质进行资源化利用时,需对生物质中的残留铝离子进行回收,或选择像CTS这种不造成生物质污染的混凝剂。
-
在水华蓝藻处理过程中的成本很大一部分来自于药剂成本。为进一步评估CTS用于混凝-过滤去除水华蓝藻的经济性,对CTS和PACl混凝-过滤过程中的药剂成本进行了分析和评估。在PACl和CTS最佳剂量下所需的药剂成本如表1所示。由表1可见,在PACl剂量为100 mg·g−1,CTS为9.2 mg·g−1时,混凝药剂成本分别为380 元·t−1和1 488 元·t−1干藻。虽然CTS的药剂成本比PACl高出近4倍,但使用CTS预混凝可以显著提高过滤通量,提高设备处理效率,从而有望进一步降低能耗成本[38]。
此外,由2.4节结果可见,投加PACL混凝-过滤后的生物质中铝离子残留较多,不利于蓝藻生物质的资源化利用,需将残留的铝进一步回收。前期的研究结果表明,采用酸洗法可使铝在酸性条件下以铝离子形式溶出,达到净化生物质的目的,微藻生物质的净化成本约为1 150元·t−1 [39]。与使用CTS总成本(1 488 元·t−1)相比,PACl的成本会稍高(1 530 元t−1),且PACl的回收会增加工艺的复杂性。因此,从水华蓝藻控制及资源化利用的角度考虑,选用无毒无害的壳聚糖,可降低水华蓝藻混凝-过滤分离成本,推动混凝-过滤技术在水华蓝藻控制中的应用。
CTS的价格是其作为混凝-过滤预处理剂在藻水分离中应用的一个瓶颈[40]。开发环境友好型的有机混凝剂,如正电淀粉、生物混凝剂等是高效、低成本水华蓝藻去除的重要方向[41-42]。另外,还可将CTS打捞的蓝藻进行高值化资源化再利用,获得更高的收益以补偿CTS成本。例如在水华生物质鱼饲料原料加工技术中,采用品质分级控制的方式,将无毒素的新鲜水华蓝藻生物质通过CTS混凝收获,微波干燥后可作为鱼饲料原料。作为鱼饲料里的活性成分[43],CTS的添加有助于提升水华藻类生物质的饲料原料价格,从而有效克服CTS价格高用不起的瓶颈。除此之外,藻水分离工艺中使用有机、无机复配混凝剂也是一种解决方案[44]。据梁韩英等[45]的研究发现CTS和PACl联合使用所需的药剂成本比单独使用CTS混凝时要低。ZHANG等[46]将高碱度、高粘度壳聚糖与聚合氯化铝联合使用,混凝沉淀低温低浊度水,结果表明联合使用对浊度、DOC和UV254的去除率达到87%、63%和82%,在取得较好混凝去除效果的同时也有利于铝残留量的控制。
-
1) PACl、CTS混凝预处理明显减缓了水华微囊藻过滤分离过程中通量下降的趋势。使用100 mg·g−1 的PACl和9.2 mg·g−1 的CTS混凝预处理时,通量下降率从无预处理时的65.9%分别降低到23.2%和13.8%;平均通量从1 647 L·(m2·h)−1,分别提升到2 020 L·(m2·h)−1和5 816 L·(m2·h)−1。
2) 相比PACl,CTS的过滤通量的提升更为显著,其原因是CTS混凝形成的絮体更大,从而形成了比阻力系数较小的疏松饼层。在最优投加剂量下,CTS预处理的饼层比阻力系数为2.2×107 m·g−1,是PACl预处理的1/15。
3) PACl的药剂成本虽然低于CTS,但使用PACl会造成藻类生物质中铝残留。在优化剂量下,PACl预处理混凝-过滤分离得到的蓝藻生物质中Al含量达到了10.9 mg·g−1,是CTS预处理条件下的84倍。因此,考虑到生物质的资源化利用以及残余铝离子的回收成本,CTS(1 488 元·t−1)比PACl(1 530 元·t−1)略有优势。CTS的成本有望通过水华生物质的高值化利用、CTS-PACl复合型混凝剂等方式进一步降低。
PACl和CTS对水华微囊藻混凝-过滤的影响
Influence of PACl and CTS on the removal of Microcystis flos-aquae using coagulation-filtration
-
摘要: 过滤去除水华蓝藻时易出现过滤材料堵塞,混凝预处理可以改变水华蓝藻在过滤过程中的藻饼过滤特性,从而提高过滤通量。混凝剂种类是影响混凝-过滤分离性能的重要因素。本研究利用聚合氯化铝(PACl)和壳聚糖(CTS)进行预混凝,研究了2种混凝剂对絮体特性及过滤通量、出水水质和生物质品质的影响,并进行了2种混凝剂优化剂量添加条件下的药剂成本分析。结果表明,采用PACl和CTS在优化剂量下,过滤通量从无预处理时的1 647 L·(m2·h)−1分别提升到2 020 L·(m2·h)−1和5 816 L·(m2·h)−1,通量下降率由65.9%分别降低到23.2%和13.8%。两种不同混凝剂过滤性能的差异主要是由混凝形成的絮体大小和饼层阻力不同造成的。CTS、PACl混凝预处理减小了饼层的过滤比阻力系数。在优化剂量条件下,CTS、PACl混凝形成的饼层比阻力系数Rcs从无混凝剂时的4.49×108 m·g−1分别降低了95%和24%,达到了2.23×107 m·g−1和3.4×108 m·g−1。且CTS预处理形成饼层的比阻力系数是PACl预处理的1/15,因此,CTS更有利于提高混凝效率。虽然PACl的成本低于CTS,但使用PACl会造成藻类生物质中铝残留,因此考虑到生物质的资源化利用以及残余铝离子的回收成本,CTS比PACl略有优势,干生物质当量的药剂成本及残余铝离子的回收成本之和分别达到1 488元·t−1和1 530元·t−1。
-
关键词:
- 水华微囊藻(Microcystis flos-aquae) /
- 聚合氯化铝(PACL) /
- 壳聚糖(CTS) /
- 混凝 /
- 过滤
Abstract: Filter block occurs easily when cyanobacteria bloom is removed by filtration. Coagulation pretreatment changes the characteristics of algae cake during filtration separation process, and thus improves the filtration flux. The type of coagulant is an important factor affecting the performance of coagulation filtration separation. In this study, polyaluminum chloride (PACl) and chitosan (CTS) were used for pre-coagulation. The effects of two coagulants on floc characteristics, filtration flux, effluent quality and biomass quality were studied. The cost analysis of reagents at the optimum dosages of these two coagulants was performed. The results showed that coagulation pretreatment could significantly reduce the flux declining in the process of filtration separation of Microcystis flos-aquae. At the optimal dosages of PACl and CTS, the filtration flux increased from 1 647 L·(m2·h)−1 to 2 020 L·(m2·h)−1 and 5 816 L ·(m2·h)−1, respectively, and the flux reduction rate decreased from 65.9% to 23.2% and 13.8%, respectively. The difference in filtration performance of these two coagulants were caused by the differences of flocs size and cake resistance after coagulation. CTS and PACl coagulation reduced the specific cake resistance dramatically. At the optimized dosages of CTS and PACl, the specific cake resistance(Rcs) reached 2.23×107 m·g−1and 3.4×108 m·g−1, respectively, which were 95% and 24% lower than that without coagulant. The Rcs of cake formed after CST pre-coagulation was 1/15 that after PACl pre-coagulation, thus CST was more favorable for the improvement of coagulation efficency. Although the cost of PACl was lower than that of CTS, PACl will cause the aluminum residues in the collected algal biomass. Therefore, considering the resource utilization of biomass and the recovery cost of residual aluminum, the total cost of CTS was still lower than PACl. The sum of chemical cost of dry biomass equivalent and recovery cost of residual aluminum ions reached 1 488 yuan ·t−1 and 1 530 yuan ·t−1, respectively.-
Key words:
- Microcystis flos-aqua /
- polyaluminum chloride (PACl) /
- chitosan (CTS) /
- coagulation /
- filtration
-
重金属元素不易溶于水,治理困难,污染危害大,从而对人类的健康状况产生了非常不利的影响[1]。目前,对重金属污染土壤的修复技术主要以物理化学法为主,以电动法、微生物法和联合修复为辅[2]。电动法是在电场的作用下,以电透渗或电迁移的方式向电极运输土壤中的重金属离子(如Pb、Cd、Cr、Zn等),再集中收集处理。ALLIOUX等[3]开发了一种新的装置,从液体中脱盐并回收珍贵金属离子,如铜、锌、镍、银和锌/铜离子混合物,然后通过简单的电氧化工艺,使金属沉积后得以回收。有研究[4]发现,脱除某些元素(如Hg)或导电性不良的矿物(如某些硫化物)时,添加适当的化学药品,在约3个月内,通过与植物技术的联用,脱除了60%的Hg。微生物对于土壤改善和污染治理也具有优良的效果,主要通过对污染物的吸附作用、污染物形态的形态转换以及污染物之间的电子转移,达到脱除重金属的目的[5]。在众多微生物中,嗜酸性氧化亚铁硫杆菌(Acidithiobacillus ferrooxidans, A.f)是一种具有极强耐受性的好氧菌,长期生活在高浓度重金属环境中的A.f菌能形成一定的耐性和抗性[6],驯化后对重金属具有良好的脱除效果。
把微生物和电化学技术联合起来,已成为当今的研究热点,有利于提高生物修复的修复效率。虽然GILADI等[7]发现,微弱的电场作用可以抑制金黄色葡萄球菌(Staphylococcus aureus, S.aureus)的生长。但也有研究[8]表明,通过施加10~100 mA直流微弱电流能够刺激大肠杆菌(Escherichia coli)的生长和活动,这表明施加微弱的直流电可以加速微生物的生长。MAILLACHERUVU等[9]发现,在0.46 V·cm−1的电场强度下,有利于好氧微生物的培育,有利于增加微生物活性。
本研究针对实际电子废物拆解场地的重金属污染土壤,通过施加不同强度的微弱直流电,研究弱电场条件下嗜酸氧化亚铁硫杆菌对污染土壤中重金属脱除的影响。在保证对土壤扰动小、不易造成二次污染和低成本等优点的前提下,有效解决微生物修复土壤耗时长、效率低的缺陷。研究结果不仅可以提高污染土壤的重金属脱除效率,也为电化学与微生物联合修复土壤的实际应用提供了参考。
1. 材料与方法
1.1 供试材料
本实验使用的土壤样品按《土壤环境监测技术规范》中的相关要求[10],在浙江省温岭某电子废弃物拆解场地附近多点混合取样,采集0~20 cm表层土壤混合样品。土样经剔除植物根系、石砾后过100目筛,密封保存备用。采用HNO3-HF-HCl消解体系[11]对制备土样进行微波消解。
完全消解后,测定得到供试土壤的基本特征:pH为8.1,含水率为4.3%,有机质含量为6.7%,Zn、Cu、Ni、Cd、Cr的质量分数分别为(18 000 ±100.5)、(3 973 ±36.4)、(368 ±22.7)、(41 ±1.3)、(502±31.6) mg·kg−1。
供试菌种从德兴铜矿区土壤样品中筛选并分离得到,后经过实验室多次驯化富集[12]。
9K培养基配方:硫酸铵((NH4)2SO4)3 g·L−1、磷酸氢二钾(K2HPO4)0.5 g·L−1、氯化钾(KCl)0.1 g·L−1、七水硫酸镁(MgSO4·7H2O)0.5 g·L−1、硝酸钙(Ca(NO3)2)0.01 g·L−1、七水硫酸亚铁(FeSO4·7H2O)44 g·L−1。用浓硫酸(H2SO4, 40%)稀释过后的溶液调pH至2.0。
实验仪器包括:高纯度石墨电极(C, 99.9%,上海碳素厂);精密电子天平(AL204,瑞士MEMETTLER TOLEDO公司);移液枪(BIOHIT,赛默飞世尔科技中国有限公司);pH/电位计(STARTER3100,上海奥豪斯仪器有限公司);恒温振荡培养箱(ZHWY-2112B,上海智城分析仪器有限责任公司);微波消解仪(ANTON PAAR);电感耦合等离子体光谱仪(ICAP-7200,赛默飞世尔科技中国有限公司);紫外可见光分光光度计(TU-1810D,北京普析通用仪器有些责任公司)。
1.2 实验方法与分析方法
称取1 g制备土样,加入至盛有50 mL 9K培养基的150 mL的特制封闭电解容器中。初始pH为2,再向9K培养基接入体积分数10%的A.f菌,将2根直径6 mm石墨电极插入后将容器封闭,保证在通气的条件下尽可能地减少液体的损失,电极间距离为5 cm。将装置放于温度30 ℃、转速100 r·min−1的恒温水浴摇床中,连接直流稳压电源进行培养。设置3个电流强度处理,分别是20、60和100 mA,每个处理外加1个不加电场的空白对照组(CK1)和1个不接菌种的空白对照组(CK2),每个处理重复3次。周期为5 d。
在第0、1、2、3和5 天采集石墨电极以及培养基的样品。用5%HNO3消解石墨电极表面的电沉积并定容于50 mL容量瓶内。在培养基样品与电沉积消解后,样品按1∶20与1∶100比例用5%HNO3稀释,供分析目标重金属含量用。
对采集的土壤样品利用紫外可见光分光光度计测定有机质质量比[13];利用pH计、氧化还原电位仪对试验过程中的pH、Eh进行测定;用ICP-OES分析稀释后的液态样品中重金属Zn、Cu、Ni、Cd、Cr的浓度。
2. 结果与讨论
2.1 A.f菌在不同电流强度下pH的变化
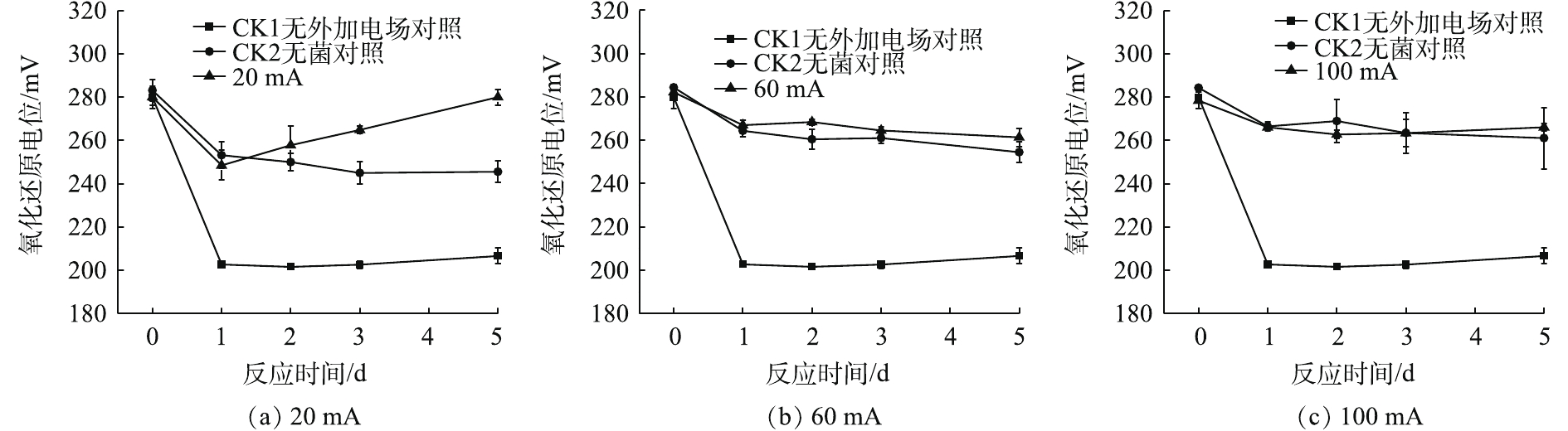
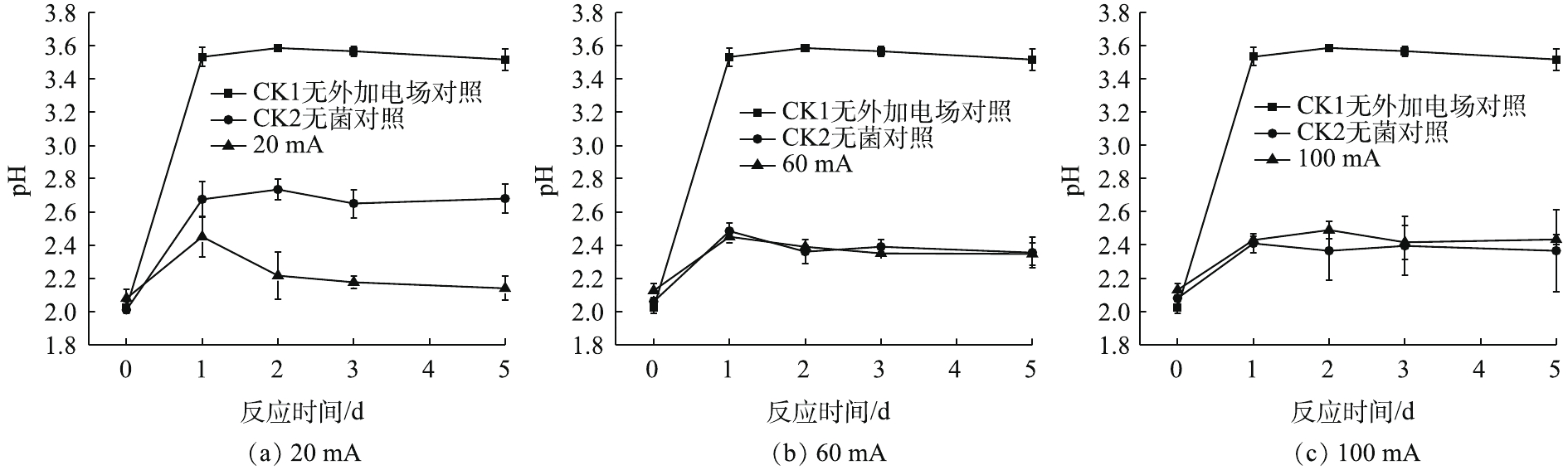
如图1(a)所示,与2组对照相比,20 mA实验组菌液的pH随时间的变化呈现小幅度上升,随后下降并趋于稳定。在0~1 d上升趋势明显;在1~2 d呈下降趋势;在3~5 d变化不明显,且pH稳定在2.1。加菌无电场对照组(CK1)在0~1 d上升,其pH在1~5 d维持在3.5左右;加电场无菌对照组(CK2)在第5天的pH保持在2.6左右,变化趋势略同于CK1对照组。
由图1(b)和图1(c)可以看出,施加60 mA与施加100 mA电流强度的实验组pH在第1 天后变化不明显,5 d后,pH稳定在2.3。与CK2对照相比,施加60 mA与施加100 mA的实验组随时间变化不明显,变化曲线大致相同。综上所述,在电场的作用下,对于电子废物拆解场地的重金属污染土壤来说,施加60 mA与100 mA的微弱电流后,5 d后的pH为2.3。
当A.f菌用于生物淋滤系统时,系统中pH的下降是嗜酸微生物大量繁殖的标志[14]。在厌氧条件下,A.f菌可以氧化元素硫并还原三价铁,出现了细胞的增殖[15],同时产生H+,降低pH,反应过程见式(1)。
S+6Fe3++4H2O→HSO−4+6Fe2++7H+ (1) 土壤的缓冲作用会让pH在第1 天有一定程度的上升。当系统施加微弱直流电后,菌液中仍存在微弱的电化学作用,阳极得到电子,导致H2的产生,从而使H+浓度略微下降。当菌液中发生电解水反应时,阳极所产生的H+形成了一个向阴极移动的酸区;阴极产生的OH−形成一个向阳极移动的碱区。当酸区的移动速度大于碱区时,使原本酸性菌液的pH呈现下降趋势[16],所以pH在第1天后下降。因此,在20 mA直流稳压电场的作用下,微电场可为A.f菌创造更加适宜的生存环境。
2.2 A.f菌在不同电流强度下氧化还原电位(Eh)的变化
如图2所示,在9种处理中,5 d后,施加20 mA的微弱电流的实验组氧化还原电位(Eh)最高,呈上升趋势,与2组对照相比,变化各不相同。由图2(a)可以看出,20 mA实验组在1 d后的ORP下降到245 mV;在5 d后,Eh达到280 mV。CK1对照组的上升趋势不明显,5 d后的Eh维持在200 mV;CK2对照组在1~3 d呈现下降趋势,并在3~5 d稳定在250 mV。
由图2(b)与图2(c)可知,在60 mA与100 mA电流强度的条件下,实验组与相应的CK2对照组的Eh变化规律大致相同。在电化学反应的作用下,5 d后的Eh达到260~270 mV,高于20 mA电流强度条件下的CK2对照组。综合来看,20 mA实验组的Eh更高,变化更明显。这说明在微电场的作用下,整个体系的氧化还原能力更强。
对A.f菌施加20 mA的微电场,Eh明显升高。在生物电化学反应中,氧还原反应是生物呼吸等生命过程中最重要的反应,也是能源转换系统的重要反应[17]。从图2(a)中可以看出,20 mA实验组的Eh明显上升,这是微生物和电化学共同作用的结果,外加适宜强度的直流电不仅可以促进细菌生长,加速菌体生长代谢的过程,还能增加细胞膜的通透性[18]。在生物淋滤系统中,Eh也是反映菌种生物活性的标志之一[14],同时体现了体系中金属离子氧化还原能力的强弱,Eh的上升有利于污染土壤中重金属的脱除。综上所述,对A.f菌施加20 mA的微电场,不仅增强了A.f菌的活性,也利于在石墨电极上还原金属离子。
2.3 不同电流强度对重金属脱除率的影响
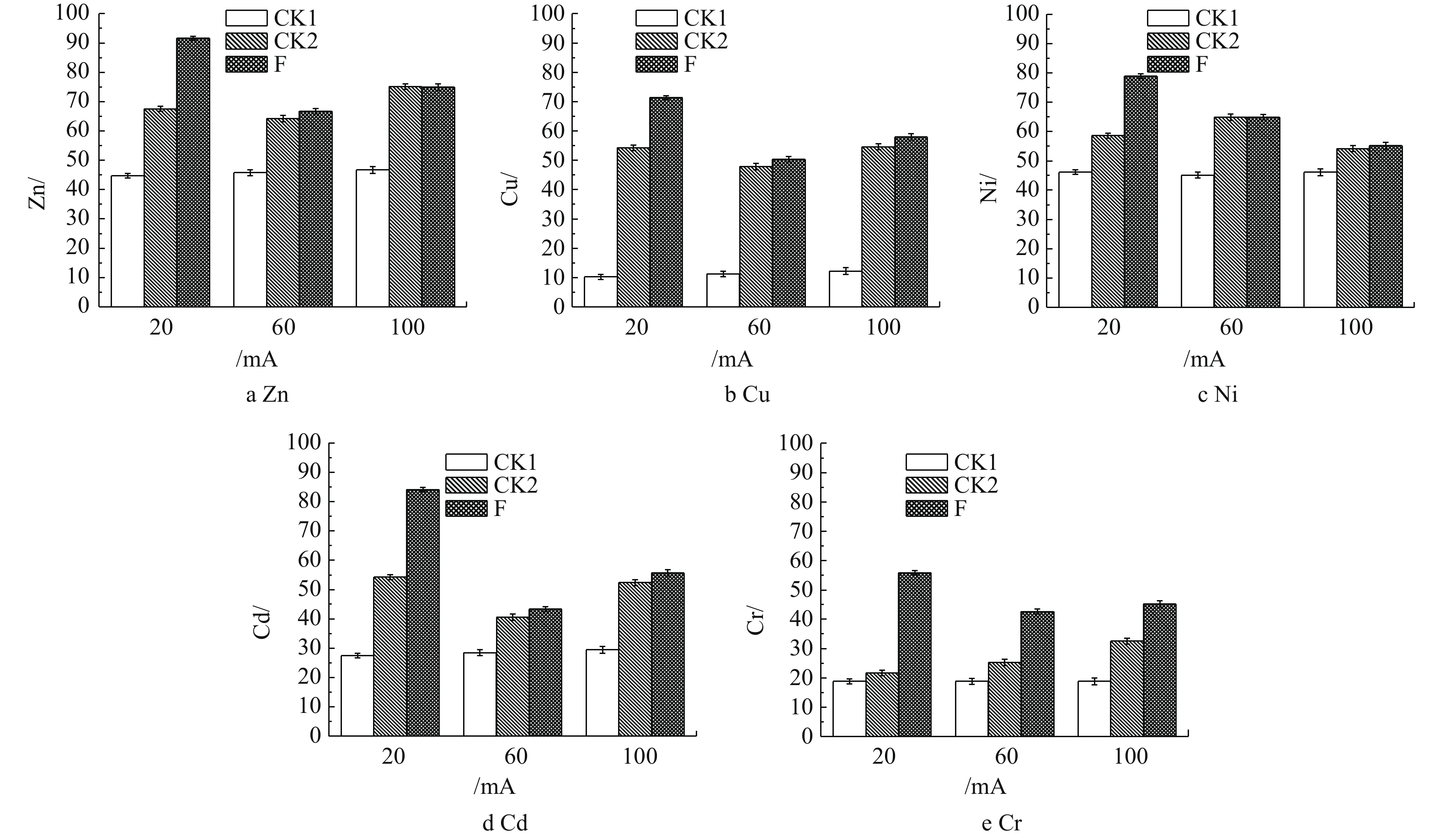
由图3可知,在电流强度为60 mA和100 mA时,在相应电流强度下,CK2对照组相比于F实验组对土壤中Zn、Cu、Ni、Cd和Cr脱除率的提升不明显。这说明在电流强度为60 mA与100 mA的条件下,整个体系的反应以电场作用为主导,且这样的电流强度对A.f菌淋洗土壤中的重金属存在消极的影响。这是由于实验所选用的嗜酸细菌(A.f),对于直流微弱电流的耐受性达到了极限,从而抑制了嗜酸细菌的氧化还原反应。在电流强度为100 mA时,对Zn、Cu、Cd、Cr的脱除率提升不明显。这说明当体系内的电场作用成为主导时,微弱直流电的小幅度提升不能提高重金属的脱除效率。根据电化学作用的机理,当体系的电流强度越大时,重金属离子迁移的速率越快。以上情况说明,施加不同强度的微弱直流电,对污染土壤中的重金属确实存在影响,但是具体影响还有待实验探究。而在20 mA条件下F实验组,明显提高了污染土壤中重金属的脱除率。土壤中Zn、Cu、Ni、Cd和Cr的脱除率较CK2对照组分别提高74%~91%、58%~72%、62%~78%、57%~85%和46%~56%。在20 mA的微电场条件下,相较CK1对照组,A.f菌对目标重金属的脱除率提高得更多,其中脱除Cu的提升效果最为明显,由10%提高至72%。可见,在电场的作用下,A.f菌对于污染土壤中重金属的脱除效果具有十分积极的影响。在20 mA的电场作用下,A.f菌可以提高脱除土壤中的重金属的效果。
由图3(a)可以看出,Zn的脱除率达到最高。对于重金属Zn来说,20 mA条件下的F实验组与CK2对照组相比,对Zn的脱除率高出16%,这是由于对A.f菌施加微电场的引起的。相比于20 mA条件下的CK1对照组对Zn的脱除率提升不高的原因是,在实验前,土壤中的Zn离子大部分是以离子态的形式存在的[19]。在培养基初始pH为2的条件下,浸出液中已有大量离子态的Zn,这些Zn离子再通过电场作用迁移至装置的阴极。
由图3(b)可知,施加20 mA的电场使A.f菌对Cu的脱除率高出CK2对照组14%,是因为在电场作用下,微生物淋滤的Fe2+出现了定向迁移,导致微生物在实验后期的养分不足,从而使Cu的硫化物结合态被A.f菌氧化进入的溶液速度减缓[20]。电流强度与反应时间也会对Cu离子的脱除效果产生影响,在不抑制A.f菌生长活动的前提下,增加反应时间,该体系对Cu脱除效果的提升仍然会十分明显[21]。
图3(c)表明,相较于20 mA条件下的F实验组和其他电流条件下的CK2对照组,Ni离子的脱除率可高出15%。这是由于在电场的作用下,Ni2+容易与OH−形成沉淀Ni(OH)2,pH对Ni离子的影响非常大[22]。在本体系中,酸性环境下非常利于Ni离子迁移到阴极上,所以电场的作用会较为明显,从而导致在20 mA条件下F实验组的脱除率提升并不明显。但是,较低的pH会对阳极产生不利影响,从而破坏体系的稳定性。
对于重金属Cd来说(图3(d)),经过驯化的A.f菌对Cd具有一定的耐受性,20 mA的电流条件下F实验组对Cd的脱除率高出CK2对照组28%。因为Cd离子在电场作用下的活动性有限,处于电场内不同位置Cd离子,其运动速率与该位置到阳极的距离成反比[23]。而F实验组在A.f菌的作用下,使更多的Cd成为离子态,让Cd离子向阴极运动,从而被脱除。
由图3(e)可以看出,20 mA条件下的F实验组对重金属Cr的脱除率仅高出其他电流条件下的F实验组10%。这是由于Cr在土壤中会以Cr3+、Cr6+的形式存在,而大部分Cr3+会形成Cr(OH)3沉淀。这些沉淀在电场作用下难以迁移,而土壤中Cr6+会以含氧阴离子的形式存在,在电场的作用下向阳极区域迁移[24]。A.f菌也仅仅是将硫化物结合态的Cr离子代谢进浸出液,同时硫化物结合态的Cr含量有限,导致本次实验中的脱除效果均不好。研究结果表明,在20 mA的微电场作用下,A.f菌可以更高效地脱除电子废弃物拆解场地土壤中重金属。在第5天时,20 mA条件下对土壤中重金属Zn、Cu、Ni、Cd、Cr的脱除效果最佳,脱除率分别达到91%、72%、78%、85%、56%。
3. 结论
1)在不同强度的微弱直流电场作用下,A.f菌脱除电子废物拆解场地污染土壤中重金属的研究结果表明:在20 mA直流稳压电场的作用下,可以为A.f菌创造更加适宜生存环境,可以提高整个体系的氧化还原能力。
2)在20 mA直流稳压电场的作用下,A.f菌对Cu脱除率的提升效果最为明显。当电流强度为60 mA以上时,对于A.f菌淋洗土壤中的重金属存在消极的影响。
3)当20 mA直流稳压电场作用于A.f菌时,可以高效脱除电子废物拆解场地的土壤重金属Zn、Cu、Ni、Cd、Cr,5 d后,其去除率分别达到91%、72%、78%、85%、56%。与仅施加电场或接菌的条件相比,脱除率提高18%以上,脱除后的土壤重金属含量低于建设用地土壤质量标准(GB 36600-2018)。因此,在20 mA微电场条件下,A.f菌生物淋洗作用,有利于高效脱除电子废弃物拆解场地土壤中高浓度重金属。
-
表 1 混凝剂成本的比较
Table 1. Comparison of coagulant costs
混凝剂 混凝剂单价/(元·t−1) 混凝剂用量/(t·t−1) 混凝剂成本/(元·t−1) 生物质净化成本/(元·t−1) 总成本/(元·t−1) PACl 3 800 0.100 380 1 150 1 530 CTS 160 000 0.009 1 488 0 1 488 -
[1] 董静, 李根保. 微囊藻群体形成影响因子及机理[J]. 水生生物学报, 2016, 40(2): 378-387. [2] CARMICHAEL W, BOYER G. Health imPACLts from cyanobacteria harmful algae blooms: Implications for the North American Great Lakes[J]. Harmful Algae, 2016, 54: 194-212. doi: 10.1016/j.hal.2016.02.002 [3] KONG Y, PENG Y, ZHANG Z, et al. Removal of Microcystis aeruginosa by ultrasound: Inactivation mechanism and release of algal organic matter[J]. Ultrasonics Sonochemistry, 2019, 56: 447-457. doi: 10.1016/j.ultsonch.2019.04.017 [4] 徐祥云, 彭君, 和智坤. 改性原位粘土去除滇池蓝藻[J]. 安徽农业科学, 2013, 41(10): 4576-4577. doi: 10.3969/j.issn.0517-6611.2013.10.122 [5] UMMALYMA S B, GNANSOUNOU E, SUKUMARAN R K, et al. Bioflocculation: An alternative strategy for harvesting of microalgae – An overview[J]. Bioresource Technology, 2017, 242: 227-235. doi: 10.1016/j.biortech.2017.02.097 [6] BARROS A I, GONCALVES A L, SIMOES M, et al. Harvesting techniques applied to microalgae: A review[J]. Renewable & Sustainable Energy Reviews, 2015, 41: 1489-1500. [7] TRUTTMANN L, SU Y, LEE S, et al. Gravity-driven membrane (GDM) filtration of algae-polluted surface water[J]. Journal of Water Process Engineering, 2020, 36: 101257. doi: 10.1016/j.jwpe.2020.101257 [8] ZHAO F, CHU H, YU Z, et al. The filtration and fouling performance of membranes with different pore sizes in algae harvesting[J]. Science of the Total Environment, 2017, 587: 87-93. [9] ZANG X, WANG L, XIAO J, et al. Harvesting colonial Microcystis flos-aquae using two-stage filtration: Influence of pre-filtration on harvesting performance[J]. Separation and Purification Technology, 2020, 245: 116736. doi: 10.1016/j.seppur.2020.116736 [10] 吴晓甜, 陶益, 周灿炜, 等. 陶瓷膜过滤收获微藻的效能与膜污染特征[J]. 应用化工, 2017, 46(06): 1027-1032. doi: 10.3969/j.issn.1671-3206.2017.06.001 [11] ZHAO F, SU Y, TAN X, et al. Effect of temperature on extracellular organic matter (EOM) of Chlorella pyrenoidosa and effect of EOM on irreversible membrane fouling[J]. Colloids and Surfaces B:Biointerfaces, 2015, 136: 431-439. doi: 10.1016/j.colsurfb.2015.09.031 [12] RICKMAN M, PELLEGRINO J, DAVIS R. Fouling phenomena during membrane filtration of microalgae[J]. Journal of Membrane ence, 2012, 423: 33-42. [13] RACAR M, DOLAR D, ŠPEHAR A, et al. Optimization of coagulation with ferric chloride as a pretreatment for fouling reduction during nanofiltration of rendering plant secondary effluent[J]. Chemosphere, 2017, 181: 485-491. doi: 10.1016/j.chemosphere.2017.04.108 [14] DENG L J, NGO H, GUO W S, et al. Pre-coagulation coupled with sponge-membrane filtration for organic matter removal and membrane fouling control during drinking water treatment[J]. Water Research, 2019, 157: 155-156. doi: 10.1016/j.watres.2019.03.052 [15] WANG W Y, YUE Q Y, LI R H, et al. Optimization of coagulation pre-treatment for alleviating ultrafiltration membrane fouling: The role of floc properties on Al species[J]. Chemosphere, 2018, 200: 86-92. doi: 10.1016/j.chemosphere.2018.02.114 [16] XU W, CHEN Y, LIANG H, et al. A comparison study of in-situ coagulation and magnetic ion exchange (MIEX) as pre-treatments for ultrafiltration: Evaluating effectiveness of organic matters removals and fouling mitigation[J]. Chemosphere, 2019, 214: 633-641. doi: 10.1016/j.chemosphere.2018.09.136 [17] ZHANG D, XU H, WANG X, et al. Influence of coagulation process on the ultrafiltration performance-The roles of Al species and characteristics of algae-laden water[J]. Separation & Purification Technology, 2017, 183: 32-42. [18] YANG R, LI H, HUANG M, et al. A review on chitosan-based flocculants and their applications in water treatment[J]. Water Research, 2016, 95: 59-89. doi: 10.1016/j.watres.2016.02.068 [19] 冯辰辰, 闫谨, 唐娜, 等. 五种絮凝剂采收小球藻的研究[J]. 应用化工, 2020, 49(4): 904-908. doi: 10.3969/j.issn.1671-3206.2020.04.025 [20] 王瑞, 杨福兴, 曲广淼. 絮凝剂对活性污泥降解有机物及除磷的影响[J]. 水处理技术, 2021, 47(2): 54-58. doi: 10.16796/j.cnki.1000-3770.2021.02.011 [21] 邱丽霞, 俞志明, 宋秀贤, 等. 改性粘土对球形棕囊藻的消除研究[J]. 海洋与湖沼, 2019, 50(1): 100-105. doi: 10.11693/hyhz20180800201 [22] 雷国元, 邹有红, 耿志毅, 等. 铁盐类混凝剂去除水中藻类生物的研究[J]. 武汉科技大学学报, 2003, 26(1): 35-38. [23] 陈思莉, 邴永鑫, 常莎, 等. 除藻剂应急治理湖水蓝藻水华案例分析[J]. 中国农村水利水电, 2019, 000(3): 20-23. doi: 10.3969/j.issn.1007-2284.2019.03.005 [24] WANG Y, ZHUO S, LI N, et al. Influences of various aluminum coagulants on algae floc structure, strength and flotation effect[J]. Procedia Environmental ences, 2011, 8(1): 75-80. [25] Zemmouri H, Drouiche M, Sayeh A, et al. Coagulation flocculation test of Keddara's Water Dam using chitosan and sulfate aluminium[J]. Procedia Engineering, 2012, 33: 254-260. doi: 10.1016/j.proeng.2012.01.1202 [26] NAYAK M, RASHID N, SUH W I, et al. Performance evaluation of different cationic flocculants through pH modulation for efficient harvesting of Chlorella sp. HS2 and their imPACLt on water reusability[J]. Renewable Energy, 2019, 136: 819-827. doi: 10.1016/j.renene.2019.01.050 [27] YAO M, NAN J, CHEN T, et al. Influence of flocs breakage process on membrane fouling in coagulation/ultrafiltration process-Effect of additional coagulant of poly-aluminum chloride and polyacrylamide[J]. Journal of Membrane Science, 2015, 491: 63-72. doi: 10.1016/j.memsci.2015.05.018 [28] 邵延林, 陈国木, 潘明熙, 等. 聚合氯化铝去除浸出液中单宁酸的影响因素及机理[J]. 有色金属工程, 2021, 11(6): 49-58. doi: 10.3969/j.issn.2095-1744.2021.06.009 [29] HOWE K J, CLARK M M. Effect of coagulation pretreatment on membrane filtration performance[J]. American Water Works Association, 2006, 98(4): 133-146. doi: 10.1002/j.1551-8833.2006.tb07641.x [30] VILLACORTE L O, EKOWATIY, WINTERS H. MF/UF rejection and fouling potential of algal organic matter from bloom-forming marine and freshwater algae[J]. Desalination, 2015, 367: 1-10. doi: 10.1016/j.desal.2015.03.027 [31] MO W, SOH L, WERBER J R, et al. Application of membrane dewatering for algal biofuel[J]. Algal Research, 2015, 11: 1-12. doi: 10.1016/j.algal.2015.05.018 [32] WEI Z, WEN Z, ZHANG X, et al. Characterization of dissolved organic matters responsible for ultrafiltration membrane fouling in algal harvesting[J]. Algal Research, 2013, 2(3): 223-229. doi: 10.1016/j.algal.2013.05.002 [33] WICAKSANA F, FANE A G, PONGPAIROJ P, et al. Microfiltration of algae (Chlorella sorokiniana): critical flux, fouling and transmission[J]. Journal of Membrane Science, 2012, 387: 83-92. [34] SRIPUI J, PRADISTSUWANA C, KERR W L, et al. Effects of particle size and its distribution on specific cake resistance during rice wine microfiltration[J]. Journal of Food Engineering, 2011, 105(1): 73-78. doi: 10.1016/j.jfoodeng.2011.01.033 [35] LEE S A, FANE A G, AMAL R, et al. The effect of floc size and structure on specific cake rresistance and compressibility in dead-end microfiltration[J]. Separation Science and Technology, 2003, 38(4): 869-887. doi: 10.1081/SS-120017631 [36] WALTON J R. Evidence for participation of aluminum in neurofibrillary tangle formation and growth in Alzheimer's disease[J]. Journal of Alzhmers Disease, 2010, 22(1): 65-72. doi: 10.3233/JAD-2010-100486 [37] 胡碧洋, 赵蕾, 周文静, 等. 我国水华蓝藻资源化研究现状、问题与对策[J]. 水生态学杂志, 2012, 33: 138-143. doi: 10.15928/j.1674-3075.2012.03.015 [38] 缺少内容 [39] WANG L, PAN B, GAO Y, et al. Efficient membrane microalgal harvesting: Pilot-scale performance and techno-economic analysis[J]. Journal of Cleaner Production, 2019, 218: 83-95. [39] YANG L, WANG L, ZHANG H, et al. A novel low cost microalgal harvesting technique with coagulant recovery and recycling[J]. Bioresource Technology, 2018, 266: 343-348. [40] ZHU L D, LI Z H, ERKKI H, et al. Microalgae Chlorella vulgaris biomass harvesting by natural flocculant: effects on biomass sedimentation, spent medium recycling and lipid extraction[J]. Biotechnology for Biofuels, 2018, 11(01): 183. doi: 10.1186/s13068-018-1183-z [41] NAZARI M T, RIGUETO C V T, REMPEL A, et al. Harvesting of Spirulina platensis using an eco-friendly fungal bioflocculant produced from agro-industrial by-products[J]. Bioresource Technology, 2021, 322: 124525. doi: 10.1016/j.biortech.2020.124525 [42] YANG Z, WU H, YUAN B, et al. Synthesis of amphoteric starch-based grafting flocculants for flocculation of both positively and negatively charged colloidal contaminants from water[J]. Chemical Engineering Journal, 2014, 244: 209-217. doi: 10.1016/j.cej.2014.01.083 [43] 李丽鹃, 龚全, 权可艳, 等. 壳聚糖对黄颡鱼生长及非特异性免疫机能的影响[J]. 西南农业学报, 2013, 26(6): 2614-2619. doi: 10.16213/j.cnki.scjas.2013.06.092 [44] MA C, HU W, PEIA H, et al. Enhancing integrated removal of Microcystis aeruginosa and adsorption of microcystins using chitosan-aluminum chloride combined coagulants: Effect of chemical dosing orders and coagulation mechanisms[J]. Colloids and Surfaces A:Physicochemical and Engineering Aspects, 2016, 490: 258-267. [45] 梁韩英, 程晓薇, 李俊鹏, 等. 壳聚糖联合聚合氯化铝强化混凝除藻的参数优化[J]. 中国环境科学, 2019, 39(6): 2568-2576. doi: 10.3969/j.issn.1000-6923.2019.06.040 [46] ZHANG Z, JING R, HE S, et al. Coagulation of low temperature and low turbidity water: Adjusting basicity of polyaluminum chloride (PAC) and using chitosan as coagulant aid[J]. Separation and Purification Technology, 2018, 206: 131-139. doi: 10.1016/j.seppur.2018.05.051 -






 下载:
下载: