-
由于工农业废水和市政污水中的含氮化合物排放进入自然水体中,导致富营养化、水生态功能障碍等一系列的环境问题[1-2]。随着国家和地方排放标准日益严苛[3],总氮达标排放已成为污水处理厂提标改造的重要目标。目前城市污水处理厂主要采用好氧硝化-缺氧反硝化的传统生物脱氮工艺,有机碳源的短缺,已成为总氮达标的重大挑战[4]。
在以反硝化脱氮为目标的污水处理厂提标改造中,往往需要外加有机碳源,如甲醇、乙醇、乙酸盐和葡萄糖。有机碳源的投加,不仅增加了运行成本,且有机碳源过量或不足时,可能导致二次污染或不完全反硝化[5]。尤其是进水基质浓度波动情况下,投加有机碳源的剂量难以控制,使得出水指标难以达标[1,6]。这种以高能耗、高物耗换取污染物削减工艺,已经不符合当前“控污降碳”的可持续发展理念。污水厂提标改造,总氮控制是关键[7],因此,亟待开发低碳高效反硝化生物脱氮工艺。
自养反硝化因无需外源有机碳源、不产生二次污染和剩余污泥产量少等优点[8-9],在低COD/N废水处理中具有良好的应用价值。按电子供体的不同,主要分为硫自养、铁自养和氢自养反硝化。硫自养反硝化效能较高,但对pH要求较高,需外加石灰石调节[10-11]。反应中间产物有生物毒性,且生成的硫酸盐是水体污染物。铁自养反硝化长期运行中易在铁表面形成一层钝化膜,影响传质效率,且反硝化会产生NH4+,并未实现彻底反硝化[12-13]。氢自养反硝化是清洁、经济的生物处理技术,但其受限制于氢气的储存、传质率及利用率[14-15],近些年,膜曝气生物反应器的研发有效改善了这一局限性。
氢基质膜生物膜反应器(H2-MBfR)将生物膜技术与中空纤维膜曝气扩散相结合,利用膜内外压力差为传质动力,H2以无泡曝气的方式传递到生物膜内部,微生物附着生长在中空纤维膜表面,H2利用率高,避免了H2泄漏的风险[16]。MBfR以H2为电子供体,将氧化性污染物还原为低毒或无毒的低价态产物[17],广泛应用于硝酸盐/亚硝酸盐、高氯酸盐/氯酸盐、铬酸盐、硫酸盐等氧化态污染物的研究[18-19]。TANG等[20]将H2-MBfR应用于实际地下水的反硝化效能,在初始NO3−质量浓度为11.9 mg·L−1时,反硝化速率为0.8~2.9 g·(m2·d)−1,亚硝酸盐累积率低,H2利用率100%。H2-MBfR反硝化体系的效能,受NO3−-N浓度、pH和氢通量等众多因素的影响。RITTMANN等发现在H2-MBfR中,自养反硝化的最佳pH在7.7~8.6, pH超过8.6,NO3−去除率显著下降、NO2−急剧积累[21]。增加H2压力,氢通量由0.04 mg·(cm2·d)−1增加到0.13 mg·(cm2·d)−1,可提高生物膜的还原效能[22]。H2-MBfR进行反硝化脱氮,有效解决H2溶解度和利用率低的局限性,无需外加有机碳源、无二次污染,在污水处理厂总氮提标改造中具有良好的应用前景。前期大部分研究主要以地下水中低浓度硝酸盐为对象,对于其在污水处理厂深度反硝化脱氮的研究尚不多见。本研究以H2作为电子供体,考察了MBfR反应器的反硝化性能,此外,考察了NO3−-N浓度、pH、氢通量等关键因素对H2-MBfR反硝化过程的影响,在此基础上分析了系统的微生物群落特征,为H2-MBfR致力于污水厂深度脱氮的工程化应用提供参考。
-
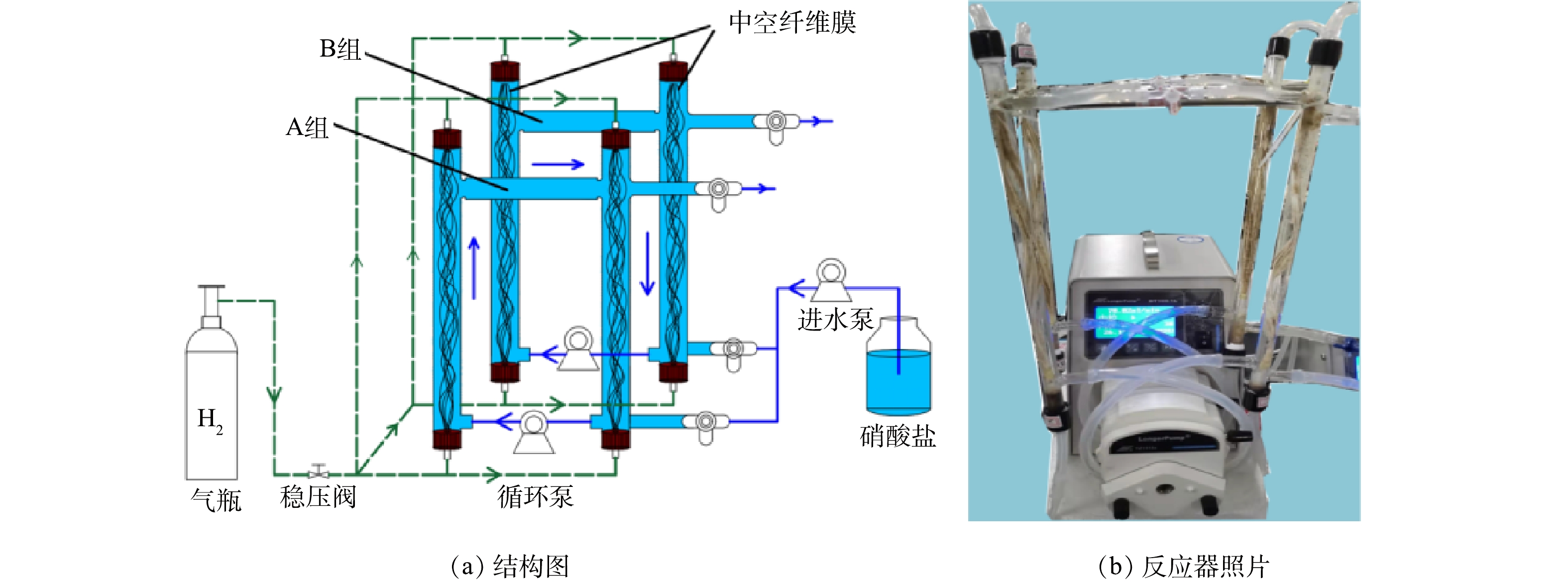
实验装置由2组H2-MBfR组成,分别命名为A组和B组(图1)。每组MBfR分为主管和副管,用硅胶管连接,通过蠕动泵实现水循环,以保证反应器内液体混合均匀,并在中空纤维膜外表面形成剪切力,促进微生物均匀生长。副膜主要用于取微生物样品,以防止生物取样对反应器运行造成较大的干扰[23]。反应器内径1.2 cm,高度36 cm,有32根PVDF中空纤维膜(膜内径250 μm,膜外径350 μm)组成的膜束,表面积为86.2 cm2。每组反应器总体积为80 mL,其中有效容积为60 mL。
-
氢自养反硝化的驯化和效能实验采用人工模拟配水,以20 mg·L−1的NaHCO3为无机碳源,培养基质由NaNO3、K2HPO4、KH2PO4和微量元素[24]按一定比例配成。微量元素分别为: 100 mg·L−1 ZnSO4·7H2O,30 mg·L−1 MnCl2·4H2O,300 mg·L−1 H3BO3,200 mg·L−1 CoCl2·6H2O,50 mg·L−1 CuSO4·5H2O,10 mg·L−1 NiCl2·6H2O,170 mg·L−1 MgCl2,100 mg·L−1 CaCl2·2H2O。
-
1)驯化挂膜和性能提升。为了考察接种污泥对反应器启动的影响,A组反应器接种反硝化污泥,B组反应器接种厌氧污泥,接种后反应器内污泥质量浓度为5 000 mg·L−1左右,分为驯化挂膜和性能提升2个阶段。启动阶段,采用间歇运行的方式,HRT由48 h逐渐降为24 h,氢分压维持0.05 MPa,进水NO3−-N浓度为1 mmol·L−1。每天检测进、出水pH、硝酸盐氮和亚硝酸盐氮。性能提升阶段,连续进水,逐步提高进水NO3−-N浓度,反应器的运行工况如表1所示。
2)反硝化速率根据式(1)进行计算,氢通量(通过中空纤维膜微孔曝气均匀分布在膜外表面的氢气量)根据式(2)进行计算。
式中:
$ {r}_{{\mathrm{N}\mathrm{O}}_{3}^{-}-\mathrm{N}} $ 为反硝化速率, mg·(L·h)−1。C△(NO3−-N)表示在某一时间段内硝酸盐浓度变化,mg·L−1;△t表示反应的时间,h。式中:Jm为氢通量,g·(m2·d)−1;K为在标准温度和大气压下氢气渗透率,为1.8
$ \times {10}^{-7} $ m3·(m2)−1; z为中空纤维膜的厚度(膜外径-膜内径),μm;$ {P}_{0} $ 表示中空纤维膜内氢气压力,bar;$ {P}_{\mathrm{m}-\mathrm{I}\mathrm{f}} $ 表示中空纤维膜和液膜界面间的氢气压力,bar;$ {k}_{1} $ 表示在标准温度和大气压下将氢气从体积转换为质量的系数,1 g·(0.0112m3)−1。3)分析方法。水样经0.45 μm水相滤膜过滤后进行分析。硝态氮分析采用紫外分光光度法(HJ/T 346-2007),亚硝态氮分析采用N-(1-奈基)-乙二胺分光光度法,pH通过便携式pH计(BestLab 962244)进行测定。
16S rRNA高通量测序分析:取接种污泥和反应器运行不同阶段的生物膜样品,送至美吉公司进行高通量测序分析。16S rRNA基因在V3~V4高变区测序,选用细菌通用引物338F(5’-ACTCCTACGGGAGGCAGCAG-3’)及806R(5’-GGACTACHVGGGTWTCTAAT-3’)。在优化序列的基础上按照97%相似性分析,得到每个OTU对应的物种分类信息,并在各水平上统计每个样品的群落组成,获得样品中微生物门(phylum)和属(genus)等物种组成及丰度。
-
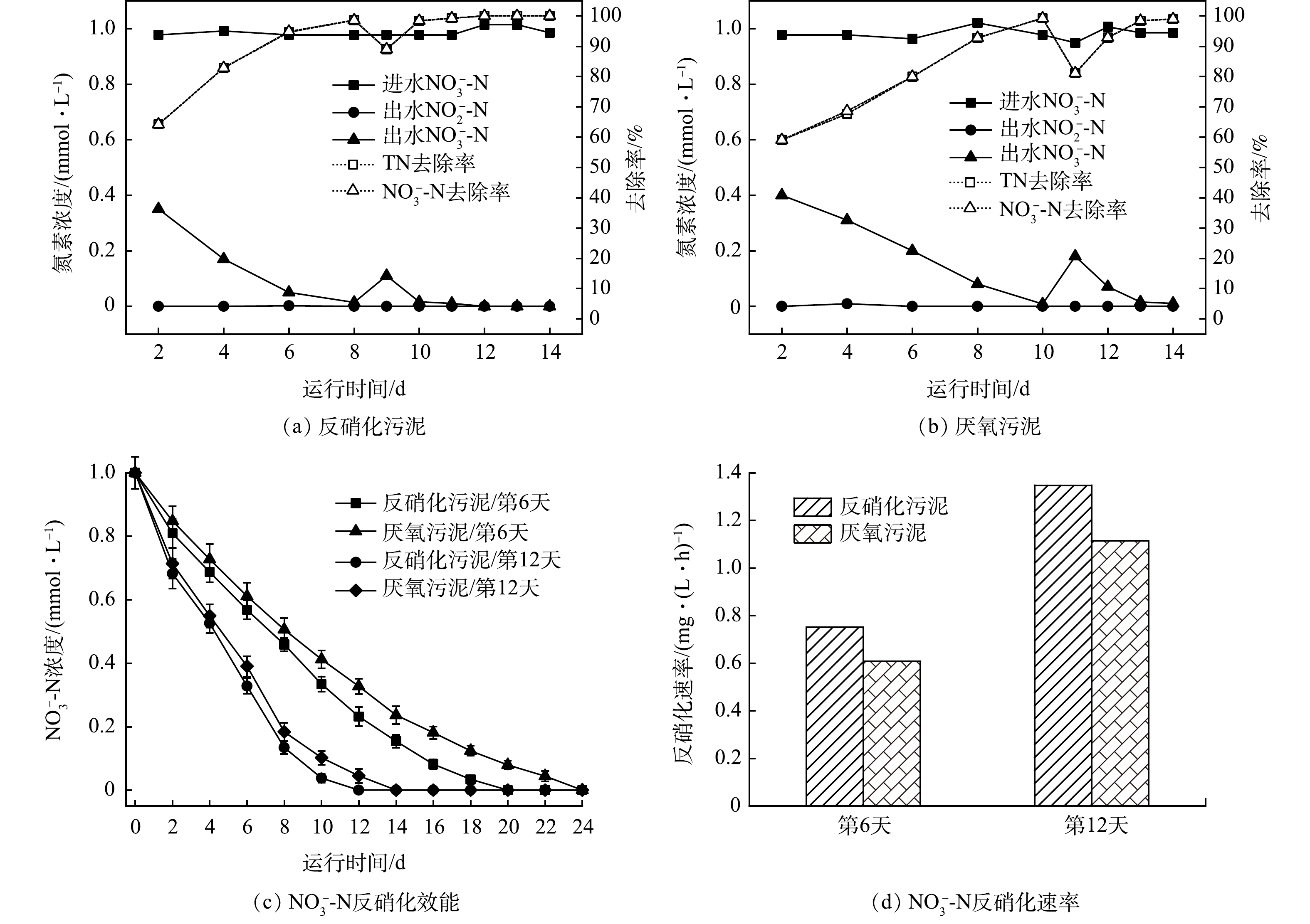
1)接种污泥对H2-MBfR启动效能比较。相对于传统的生物膜,MBfR的电子供体(氢气、氧气等)和电子受体(污染物)从生物膜的两侧相对扩散,属于反向扩散膜(counter-diffusion biofilm)[25]。因此,MBfR启动与微生物挂膜值得关注。接种不同污泥的MBfR反硝化驯化挂膜阶段的序批实验结果如图2所示。接种反硝化污泥的A组,反应器运行2 d后,NO3−-N浓度由进水的1 mmol·L−1下降至出水的0.35 mmol·L−1;运行8 d后,出水NO3−-N浓度低至0.014 mmol·L−1(图2(a))。从第9天开始,HRT调整为24 h,微生物很快适应,第10天NO3−-N去除率达到98.4%以上,并保持稳定。接种厌氧污泥的B组图2(b),反应器运行2 d后,出水NO3−-N浓度为0.4 mmol·L−1,反应器第10天,出水NO3−-N浓度低至0.008 mmol·L−1。在第11 天,调整HRT为24 h,NO3−-N浓度略有下降。随着反应的进行,第14天NO3−-N去除率达到98%以上。此时,中空纤维膜表面已附着一层黄褐色生物膜,出水pH维持在7.8左右,无中间产物的产生与累积,可认为MBfR驯化阶段已经完成。
为了探究接种污泥对H2-MBfR启动效能的影响,在反应器运行第6天和第12天,分别对A、B组进行原位批次实验,硝酸盐浓度变化和反硝化速率变化情况如图2(c)和图2(d)所示。发现A组对NO3−-N的反硝化速率均快于B组,A组反硝化速率由0.751 mg·(L·h)−1提高到1.347 mg·(L·h)−1,B组反硝化速率由0.608 mg·(L·h)−1提高到1.114 mg·(L·h)−1。从整个驯化过程来看,采用序批式运行,有利于生物膜的快速形成,均能在14 d内达到稳定的反硝化性能。A组反应器接种反硝化污泥,反应速率更快,10 d左右即可达到稳定的反硝化效果,有利于H2-MBfR反硝化的快速启动。
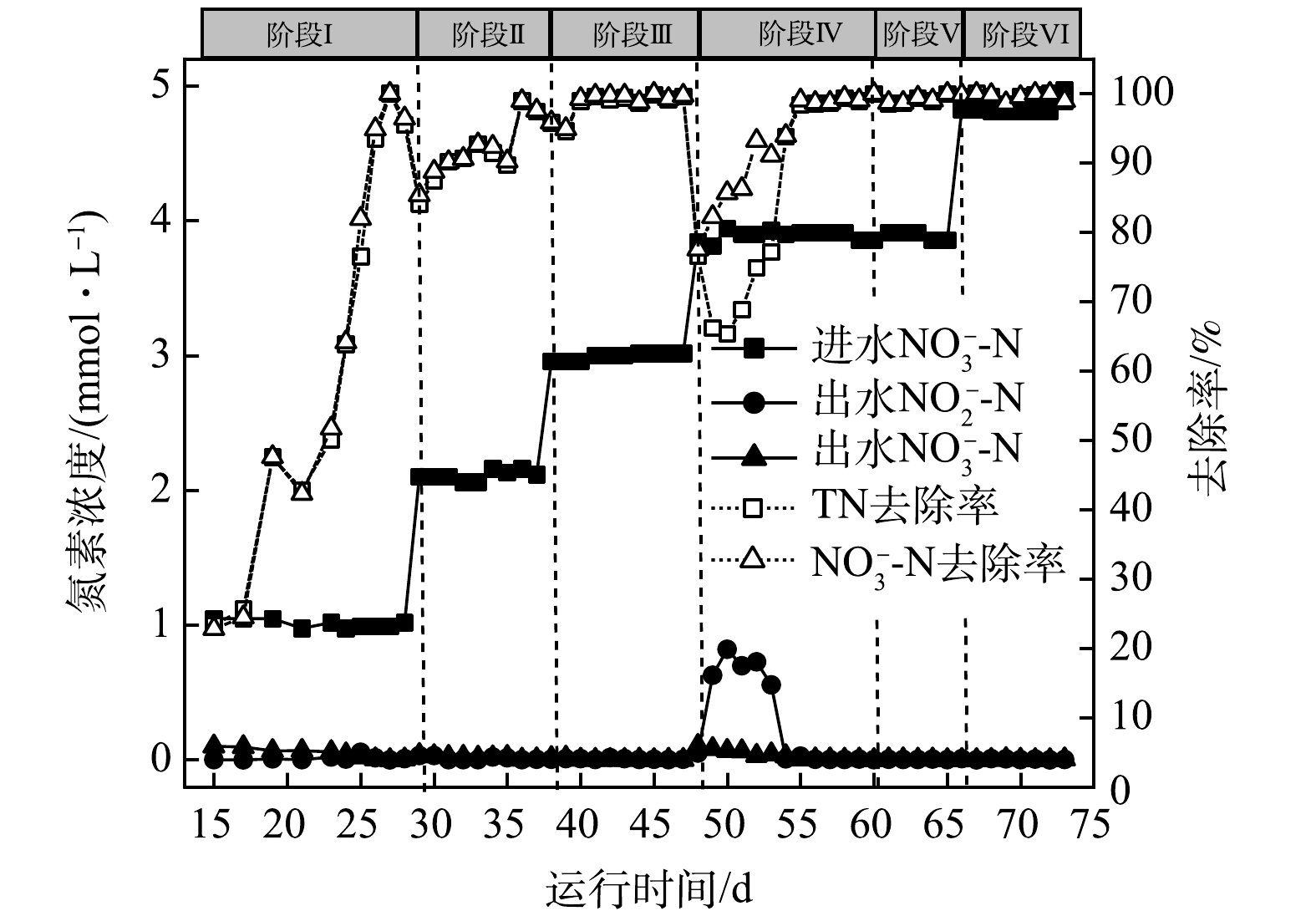
2) H2-MBfR反硝化效能的提升。考虑到A组和B组反应器形成稳定生物膜后,两者性能稳定,并无显著差异。因此,以A组为研究对象,考察进水浓度对系统反硝化效能的影响,运行工况见表1,反应器性能变化如图3所示。
在前3个阶段,进水NO3−-N浓度由1 mmol·L−1逐步提高到3 mmol·L−1,去除率维持在98.6%以上,无NO2−-N累积;第Ⅳ阶段,当进水NO3−-N浓度提高到4 mmol·L−1,反硝化去除率急剧下降至78%左右,出水NO3−-N浓度上升至0.86 mmol·L−1,且出水中有亚硝酸盐生成。在物料平衡分析中,发现尽管进水NO3−-N浓度提高,去除率下降,但是反硝化脱氮的总量与第III阶段基本持平,认为此时反硝化去除率下降应该与电子供体氢气的供给不足有关。在第50天将氢分压由0.05 MPa(0.080 g·(m2·d)−1)提高到0.06 MPa(0.096 g·(m2·d)−1),反硝化性能逐渐提升,出水NO3−-N和NO2−-N浓度逐渐下降。随后在第Ⅴ阶段,缩短HRT为6 h,运行负荷提高了3.3倍,反硝化去除率稳定在98.7%以上。在此基础上,进一步提高进水NO3−-N浓度至5 mmol·L−1,反硝化去除率均维持在98.5%以上,没有其他副产物生成。在氢气足够的条件下,系统反硝化效率高、性能稳定,且具有应对负荷变化的良好性能。氢气作为反硝化电子供体,氢分压对反硝化效能有重要影响。
相对于以有机物为电子供体的异养反硝化,氢自养反硝化工艺产物为氮气和水,无二次污染,污泥产率低,无温室气体CO2排放,甚至可以利用CO2作为微生物生长的无机碳源[26]。表2总结了不同有机电子供体和H2作为无机电子供体反硝化时NO3−-N去除率和CO2排放量。在异养反硝化过程中,不同有机电子供体,CO2的排放量略有差异,理论值为0.83~1.25 g,在实际运行过程中,由于有机物利用率不同,CO2应该高于理论值。H2-MBfR反应器通过无孔膜布气的方式,有效缓解了H2溶解度低的限制,提高了H2的利用率,且无CO2排放,在污水厂总氮达标、敏感水域硝酸盐控制中,具有很好的节能减排效果。
-
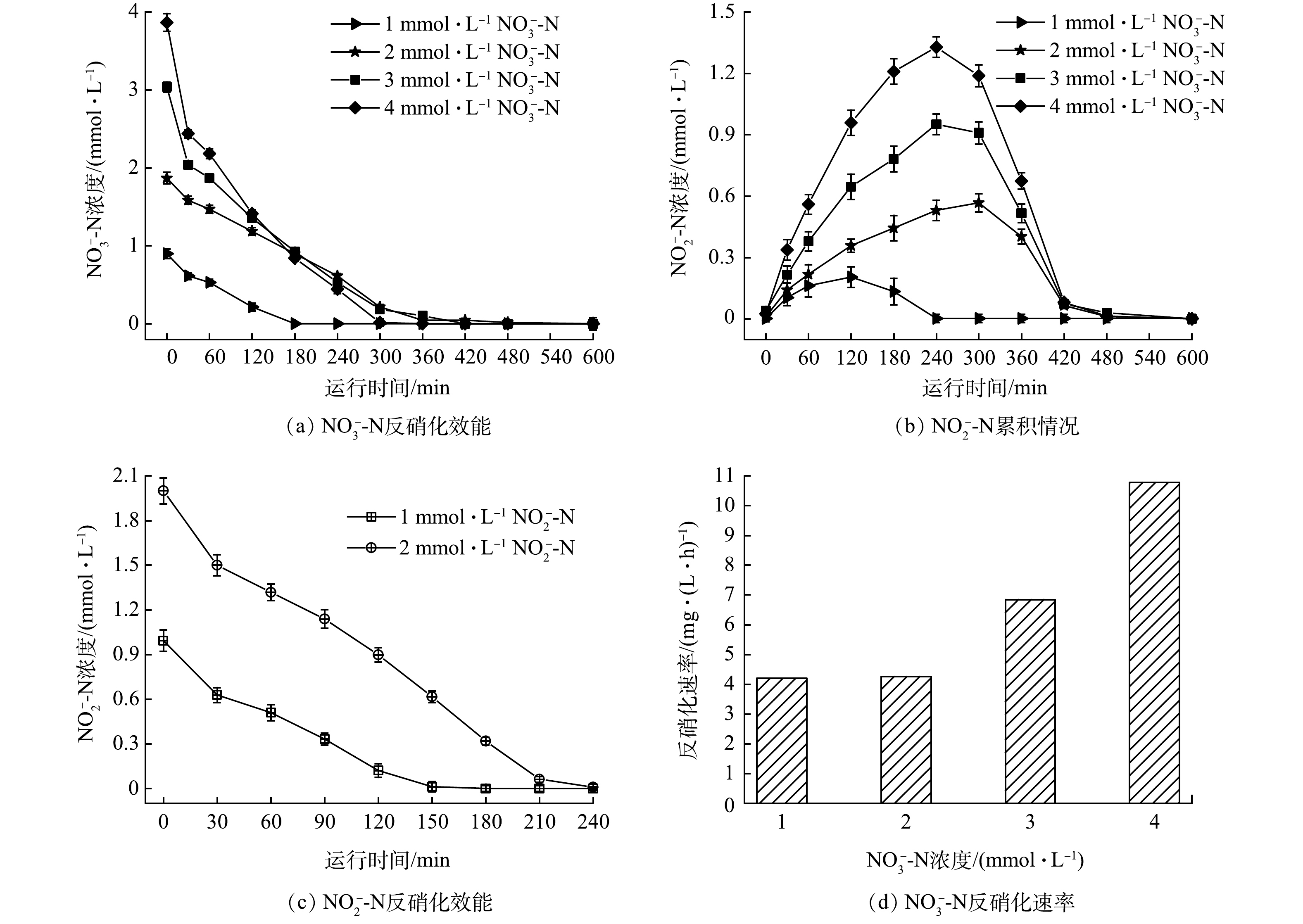
1)进水浓度对氢自养反硝化的影响。本研究在氢分压为0.06 MPa、HRT为15 h的条件下,通过原位批次实验考察不同NO3−-N浓度和NO2−-N浓度对反硝化活性的影响,结果如图4所示。提高进水NO3−-N浓度,反硝化速率增加(图4(d))。当NO3−-N浓度由1 mmol·L−1逐渐增加到4 mmol·L−1时,反硝化速率由4.20 mg·(L·h)−1提高到10.78 mg·(L·h)−1,且进水浓度越高,反硝化速率增幅越高。这个结果也可较好地解释在氢气足够的条件下H2-MBfR体系中随着进水硝酸盐浓度提高,反应器仍能维持高效反硝化的现象。批次实验结果表明,亚硝酸盐是氢基质反硝化的中间产物,进水NO3−-N浓度越高,亚硝酸盐积累量越大。反应过程中生成的NO2−-N在NO3−-N完全降解后120 min内被迅速去除。考察了1 mmol·L−1和2 mmol·L−1的NO2−-N的还原过程,NO2−-N的氢自养反硝化速率分别为5.5 mg·(L·h)−1和7.3 mg·(L·h)−1,略高于相同浓度的NO3−-N反硝化速率。曹相生等以CH3COONa为外加碳源的反硝化研究发现,无论碳源是否充足,反硝化过程中均出现亚硝酸盐氮先积累后逐渐消失的现象,亚硝酸盐氮积累是由硝酸盐氮还原到亚硝酸盐氮和亚硝酸盐氮还原到氮气的速率差造成的[31]。孙洪伟等发现亚硝酸盐氮还原速率低于硝酸盐氮还原速率是导致亚硝酸盐氮积累的主要原因[32]。本研究以氢气作为电子供体的氢自养反硝化过程中,亚硝酸盐的累积可能是硝酸盐转化率与亚硝酸盐还原率不同导致的。氢自养反硝化过程中,中间产物亚硝酸盐的生成速率高于亚硝酸盐被还原的速率,使得即使亚硝酸盐的还原速率高于硝酸盐的还原速率,过程中也会出现亚硝酸盐积累,但最终能够彻底被反硝化生成氮气。
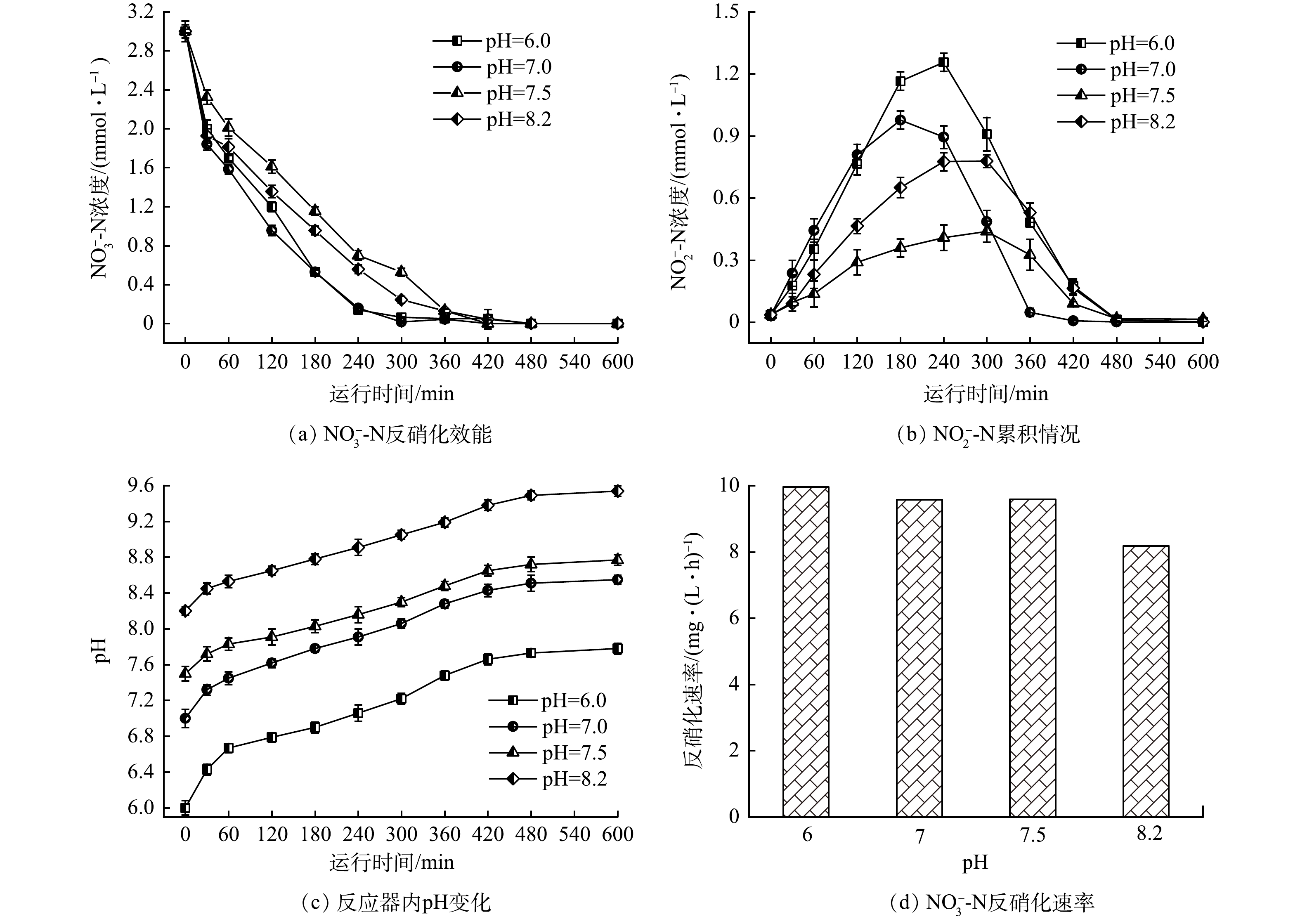
2) pH对氢自养反硝化的影响。pH是微生物体系的一个重要参数,反硝化过程中会导致碱度增加,氢自养反硝化的最佳pH在7.6~8.6[21,33],控制合理的pH有利于反应器的稳定运行。本研究在氢分压为0.05 MPa、HRT为15 h的条件下,考察pH对H2-MBfR的反硝化效果的影响,结果如图5所示。可见,进水pH维持在中性条件下,反硝化速率最快,过高或过低的初始pH均会影响反硝化速率。pH较低时电子供体不能被充分利用;而过高的pH会抑制氢自养反硝化菌活性[34-35]。初始pH在6~7.5时,硝态氮反硝化速率均在9.58 mg·(L·h)−1以上。但初始pH在7.5左右,以氢气为电子供体反硝化过程中,亚硝酸盐的积累率最低,且反应结束后,pH增加至8.2左右,体系中pH相对比较平稳。初始pH在6.5和7时,都会出现较高的亚硝酸盐积累,pH增幅达1左右。当进水pH在8左右,最终体系中pH超过9,不利于微生物正常代谢。因此,初始pH在7.5左右,体系中的pH可维持在理想的范围内,有利于微生物活性发挥。
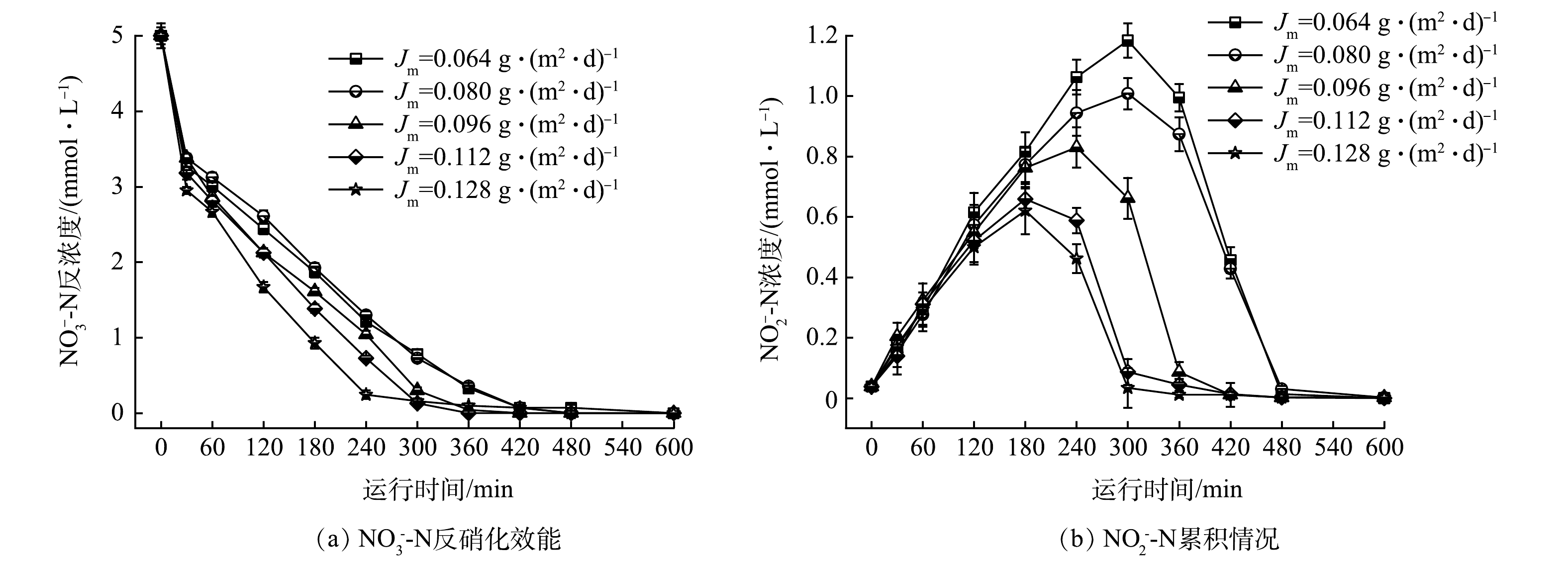
3)氢通量对氢自养反硝化的影响。氢气作为电子供体,对反硝化有重要的影响。在连续运行过程中,硝酸盐浓度提高,氢气不足,会抑制反硝化;由于氢气的溶解度较低,氢气过量无法被充分利用,造成资源浪费。本研究在HRT为6 h的条件下,考察Jm分别为0.064、0.080、0.096、0.112和0.128 g·(m2·d)−1对H2-MBfR的反硝化效果的影响(对应的氢分压分别为0.04、0.05、0.06、0.07和0.08 MPa)。由图6可见,随着Jm增加,NO3−-N的降解速率提高,这使得反硝化速率提高。当Jm为0.128 g·(m2·d)−1时,NO3−-N的降解速率最快为16.5 mg·(L·h)−1。中间产物NO2−-N的生成量随Jm增加而下降,且Jm越高,达到NO2−-N的最大积累量耗时越短。Jm为0.064 g·(m2·d)−1时,在300 min出现NO2−-N最大累积量1.18 mmol·L−1;Jm增加到0.128 g·(m2·d)−1时,在180 min时NO2−-N最大累积量为0.62 mmol·L−1。Jm对亚硝酸盐的累积影响与硝酸盐的反硝化速率具有很好的一致性。增加氢分压,提高了氢通量,微生物对污染物的去除能力及电子利用率增强[16]。调控合理的H2压力,使其保持在相对低能耗、高效率的反应状态[22]。 在实际运行过程中,从资源节约的角度优化Jm与氢分压,维持Jm为0.096 g·(m2·d)−1 (对应的氢分压为0.06 MPa)。
-
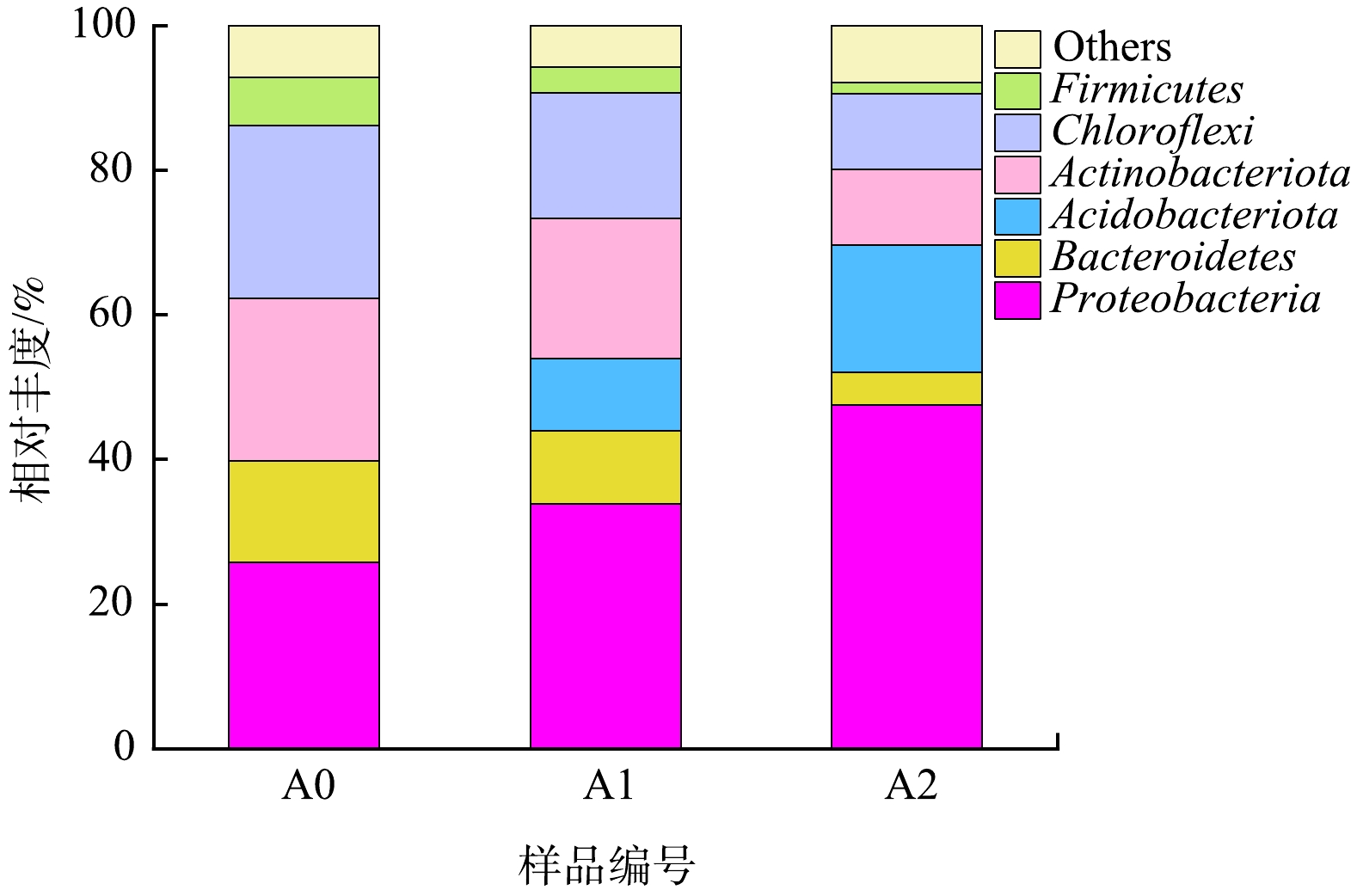
1)门水平微生物群落结构分析。生物膜是H2-MBfR系统稳定的核心。随着反应器的运行,生物膜逐渐增厚,但内循环水流剪切力,促使生物膜维持在相对稳定的厚度。对H2-MBfR反应器第1天接种污泥(A0)及其运行至第47天(A1)和第73天(A2)时生物膜样品进行高通量分析,其门水平微生物群落结构如图7所示。污泥样品中发现6个典型门属,分别为变形菌门Proteobacteria、拟杆菌门Bacteroidetes、酸杆菌门Acidobacteriota、放线菌门Actinobacteriota、绿湾菌门Chloroflexi、后壁菌门Firmicutes。Proteobacteria在所有样本中均占据主导地位,是活性污泥和生物膜中丰度最高的菌群之一,其中许多与反硝化相关的菌群属于Proteobacteria分类[36-37]。本研究接种污泥为反硝化污泥,Proteobacteria丰度达到25.7%,随着污泥反硝化性能提升,该门类菌属逐渐增加,达到33.8%和47.5%。尽管在接种污泥中未检测到Acidobacteriota,随着污泥反硝化性能提升,丰度明显增加,达到10%和17.6%。Actinobacteriota和Chloroflexi相对丰度显著下降。有研究[38]表明,Actinobacteriota菌门常引发活性污泥泥水分离问题和包含了多种与污泥膨胀相关菌属。H2-MBfR反应器内未添加有机碳源,可能是因为缺乏有机碳源抑制了Actinobacteriota菌门生长。
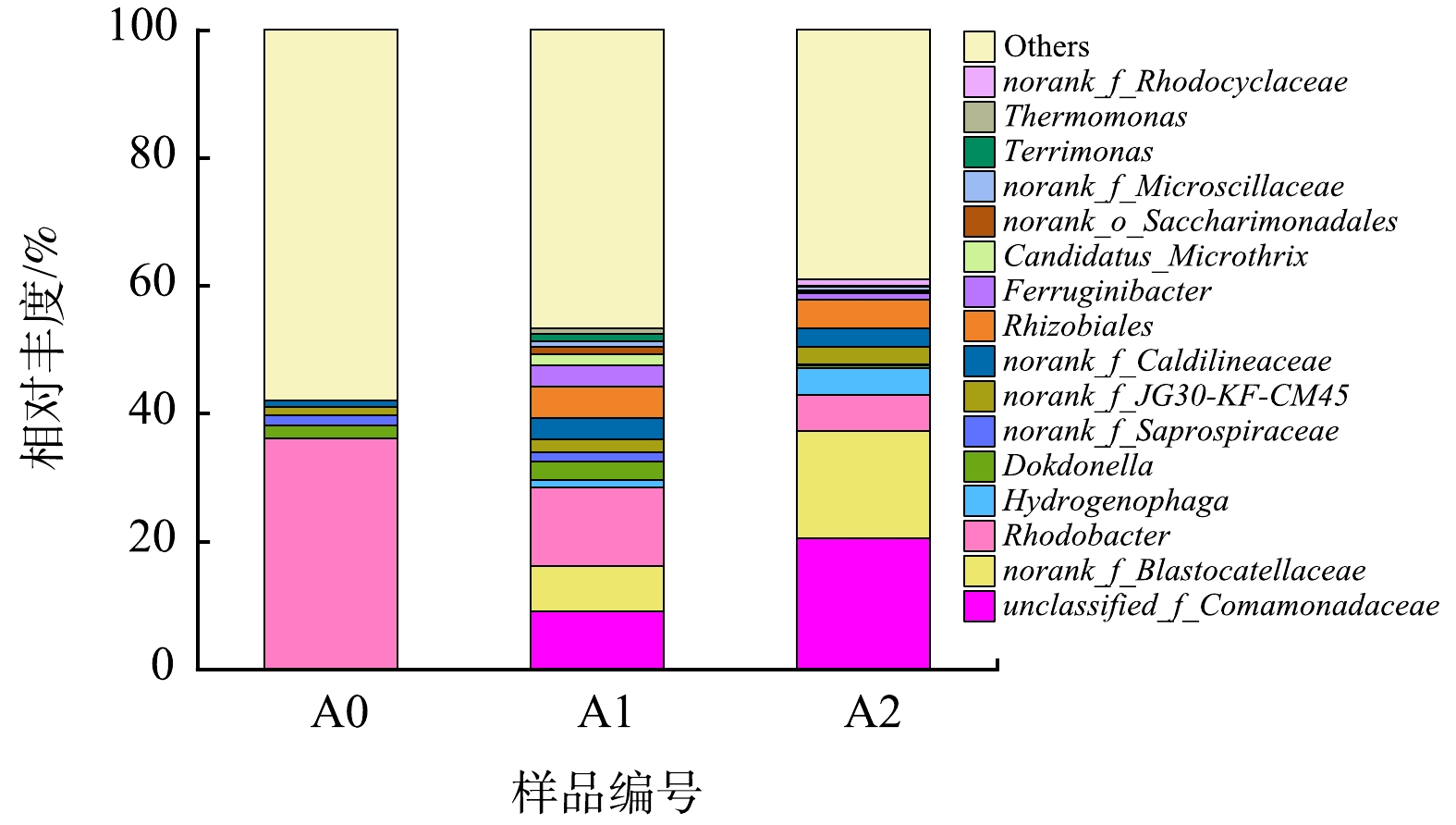
2)属水平微生物群落结构分析。从属水平进一步对微生物群落结构进行分析,如图8所示。H2-MBfR典型的反硝化菌属unclassified_f__Comamonadaceae、Hydrogenophaga和Rhodobacter属于Proteobacteria,norank_f__Blastocatellaceae属于Acidobacteriota,这4类菌属在反硝化稳定期可达到46%左右。优势菌属unclassified_f__Comamonadaceae、norank_f__Blastocatellaceae和Hydrogenophaga,相对丰度均明显增加。unclassified_f__Comamonadaceae和norank_f__Blastocatellaceae均为低有机物条件下典型的反硝化菌属,本系统中该类微生物可能是由于生物膜脱落水解导致内源反硝化。Hydrogenophaga是可以利用残余有机物或无机物的兼性自养反硝化菌[39],反应器内Hydrogenophaga丰度明显升高,与系统氢自养反硝化性能提升一致。氢基质膜生物膜的群落结构主要取决于液相中污染物的种类及浓度,当进水污染物只有硝氮时,优势菌种主要为红环菌属(Rhodocyclus)、噬氢菌属(Hydrogenophaga)等。本研究也发现红细菌属Rhodobacter是典型的微生物菌属,Hydrogenophaga随着系统反硝化性能提升,丰度增加。尽管典型的反硝化菌群丰度变化与H2-MBfR系统脱氮性能的变化有很好的契合度,反硝化微生物种类复杂,尚可能存在一部分未知的氢自养反硝化菌,需要进一步深入探讨。
-
1) 不同接种污泥的实验组采用序批式在14 d左右均可启动内循环H2-MBfR,反硝化效率稳定在98%以上,而接种反硝化污泥更有利于氢自养反硝化的快速启动。
2) 在氢气足够的条件下,H2-MBfR系统具有应对负荷变化的良好性能。提高进水NO3−-N浓度和缩短HRT,反应器运行负荷提高了3.3倍,反硝化去除率稳定在99%。相对于异养反硝化CO2的理论排放量(0.83~1.25 g),氢自养反硝化无二次污染、无温室气体排放。
3) 氢自养反硝化速率、中间产物亚硝酸盐累积率、累积峰值的时间与进水浓度、pH、氢通量密切相关。氢自养反硝化速率与进水浓度呈正相关,有利于H2-MBfR能够适应较大范围进水负荷波动。理想的进水pH在7.5左右,氢通量为0.096 g·(m2·d)−1。
4) Proteobacteria是H2-MBfR系统中主导菌门,随着系统反硝化性能提升,该门类菌属达到47.5%。unclassified_f__Comamonadaceae、norank_f__Blastocatellaceae、Hydrogenophaga和Rhodobacter是H2-MBfR系统中典型的反硝化菌属,在稳定期总丰度可达到46%左右。
H2-MBfR反硝化效能及影响因素
Denitrification efficiency and impact factors of a hydrogen-based membrane biofilm reactor
-
摘要: 氢自养反硝化因资源节约、无二次污染,是可持续的低碳污水处理工艺。为探究氢基质膜生物膜反应器(hydrogen-based membrane biofilm reactor)反硝化的快速启动及其脱氮性能,考察了不同进水浓度、pH、氢通量(Jm)等关键因素对H2-MBfR反硝化过程的影响,分析了系统的微生物群落特征。结果表明:不同接种污泥14 d内反应器的反硝化效率均可稳定在98%以上,接种反硝化污泥更有利于快速启动;在氢气足够的条件下,通过提高进水NO3--N浓度和缩短水力停留时间(HRT),反应器运行负荷提高了3.3倍,系统维持稳定、高效的反硝化性能,相对于异养反硝化,可节省CO2的理论排放量约为0.83~1.25 g(以NO3--N计);最佳初始pH在7.5左右,反硝化过程中亚硝酸盐的积累率最低;Jm与反硝化速率具有很好的一致性,提高Jm有利于提高反硝化效率。16s rRNA高通量测序结果表明,变形菌门Proteobacteria是H2-MBfR系统中主导菌门,随着系统反硝化性能提升,该门类菌属达到47.5%。unclassified_f__Comamonadaceae、norank_f__Blastocatellaceae、Hydrogenophaga和Rhodobacter是H2-MBfR系统中典型的反硝化菌属,在稳定期总丰度可达到46%左右。
-
关键词:
- 氢基质膜生物膜反应器 /
- 自养反硝化 /
- 影响因素 /
- 高通量测序 /
- 生物膜群落
Abstract: Hydrogen autotrophic denitrification is a sustainable low carbon wastewater treatment process due to resource conservation and no secondary pollution. In order to study the rapid start-up of denitrification and its denitrification performance in a hydrogen-based membrane biofilm reactor (H2-MBfR), the effects of key factors such as different influent concentrations, pH and hydrogen flux (Jm) on the denitrification process of H2-MBfR were investigated, and the microbial community characteristics of the system were analyzed. The results showed that: the denitrification efficiency of the reactors with different inoculated sludge could all be stabilized above 98% within 14 d, and the inoculation of denitrification sludge was more conducive to the rapid start-up than others. Under the condition of sufficient hydrogen, the reactor operating load increased by 3.3 times through increasing the influent NO3--N concentration and shortening the hydraulic retention time (HRT), and the system maintained a stable and efficient denitrification performance, and could save theoretical CO2 emissions of about 0.83-1.25 g (as NO3--N) comparing to heterotrophic denitrification. The optimal initial pH was around 7.5, and the lowest accumulation rate of nitrite during denitrification occurred accordingly. Jm had a good agreement with denitrification rate, and the increase of Jm was beneficial to improving denitrification efficiency. The results of 16s rRNA high-throughput sequencing showed that, the phylum Proteobacteria was the dominant phylum in the H2-MBfR system, and the genus of this phylum reached 47.5% as the denitrification performance of the system was improved. Unclassified_f__Comamonadaceae, norank_f__Blastocatellaceae, Hydrogenophaga and Rhodobacter were typical denitrifying genera in the H2-MBfR system, and the total abundance could reach about 46% in the stable phase. -

-
表 1 反应器性能提升过程对应的运行工况
Table 1. Operating conditions corresponding to the reactor performance improvement process
阶段 运行
时间/dNO3−-N浓度/
(mmol·L−1)H2压力/
MPaHTR/h pH Ⅰ 15~28 1 0.05 15 6.8~7.0 Ⅱ 29~37 2 0.05 15 6.8~7.0 Ⅲ 38~47 3 0.05 15 6.8~7.0 Ⅳ 48~59 4 0.06 15 6.8~7.0 Ⅴ 60~65 4 0.06 6 6.8~7.0 Ⅵ 66~73 5 0.06 6 6.8~7.0 表 2 不同电子供体的反硝化性能与CO2排放量比较
Table 2. Comparison of denitrification performance and CO2 emissions of different electron donors
电子供体 反应方程式 NO3--N去除率/% 反应器 CO2排放量 /g 参考文献 甲醇 5CH3OH + 6NO3-→3N2 + 5CO2 + 7H2O + 6OH- 92.8~98.7 附着生长填充床 0.83 [27] 乙醇 5C2H5OH + 12NO3-→6N2 + 10CO2 + 9H2O + 12OH- 100 流化床 0.83 [28] 乙酸盐 5CH3COO- + 13H+ + 8NO3-→4N2 + 10CO2 + 14H2O 99 连续搅拌反应器 1.25 [29] 葡萄糖 5C6H12O6 + 24NO3-+ 24H+→12N2 + 30CO2 + 42H2O 88~92 填充床 1.25 [30] 氢气 2NO3-+5H2+2H+→N2+6H2O 98.5 膜生物膜反应器 0 本研究 -
[1] CHU L B, WANG J L. Denitrification performance and biofilm characteristics using biodegradable polymers PCL as carriers and carbon source[J]. Chemosphere, 2013, 91(9): 1310-1316. doi: 10.1016/j.chemosphere.2013.02.064 [2] CONLEY D J, PAERL H W, HOWARTH R W, et al. Controlling eutrophication: Nitrogen and phosphorus[J]. Science, 2009, 323(5917): 1014-1015. doi: 10.1126/science.1167755 [3] 郝晓地, 方晓敏, 李季, 等. 污水碳中和运行潜能分析[J]. 中国给水排水, 2018, 34(10): 11-16. doi: 10.19853/j.zgjsps.1000-4602.2018.10.003 [4] WANG Y L, WANG D B, YANG Q, et al. Wastewater opportunities for denitrifying anaerobic methane oxidation[J]. Trends in Biotechnology, 2017, 35(9): 799-802. doi: 10.1016/j.tibtech.2017.02.010 [5] MARIN J A, CARAVELLI A H, ZARITZKY N E, et al. Nitrification and aerobic denitrification in anoxic-aerobic sequencing batch reactor[J]. Bioresource Technology, 2016, 200: 380-387. doi: 10.1016/j.biortech.2015.10.024 [6] CHU L B, WANG J L. Comparison of polyurethane foam and biodegradable polymer as carriers in moving bed biofilm reactor for treating wastewater with a low C/N ratio[J]. Chemosphere, 2011, 83(1): 63-68. doi: 10.1016/j.chemosphere.2010.12.077 [7] XIE G J, CHEN C, HU S H, et al. Complete nitrogen removal from synthetic anaerobic sludge digestion liquor through integrating anammox and denitrifying anaerobic methane oxidation in a membrane biofilm reactor[J]. Environmental Science & Technology, 2017, 51(2): 819-827. [8] CAPUA F D, PIROZZI F, ESPOSITO G, et al. Electron donors for autotrophic denitrification[J]. Chemical Engineering Journal, 2019, 362: 922-937. doi: 10.1016/j.cej.2019.01.069 [9] WEI X, WANG Y, HAO T Y, et al. pH control and microbial community analysis with HCl or CO2 addition in H2-based autotrophic denitrification[J]. Water Research, 2020, 168: 115200. doi: 10.1016/j.watres.2019.115200 [10] LIU L H, KOENIG A. Use of limestone for pH control in autotrophic denitrification batch experiments[J]. Process Biochemistry, 2002, 37: 885-893. doi: 10.1016/S0032-9592(01)00302-8 [11] MOON H S, AHN K H, LEE S, et al. Use of autotrophic sulfur-oxidizers to remove nitrate from bank filtrate in a permeable reactive barrier system[J]. Environmental Pollution, 2004, 129: 499-507. doi: 10.1016/j.envpol.2003.11.004 [12] 姚鹏程, 袁仪, 龙震宇, 等. 单质硫自养反硝化研究现状及展望[J]. 现代化工, 2018, 38(6): 28-33. doi: 10.16606/j.cnki.issn0253-4320.2018.06.007 [13] PANG Y M, WANG J L. Various electron donors for biological nitrate removal: A review[J]. Science of the Total Environment, 2021, 794: 148699. doi: 10.1016/j.scitotenv.2021.148699 [14] GHAFARI S, HASAN M, AROUA M K. Nitrate remediation in a novel upflow bio-electrochemical reactor (UBER) using palm shell activated carbon as cathode material[J]. Electrochimica Acta, 2009, 54(17): 4164-4171. doi: 10.1016/j.electacta.2009.02.062 [15] TANG Y N, ZHOU C, MEYER K, et al. Comparing heterotrophic and hydrogen-based autotrophic denitrification reactors for effluent water quality and post-treatment[J]. Water Scuence & Technology:Water Supply, 2012: 227-233. [16] LEE K C, RITTMANN B E. Applying a novel autohydrogenotrophic hollow-fiber membrane biofilm reactor for denitrification of drinking water[J]. Water Research, 2002, 36: 2040-2052. doi: 10.1016/S0043-1354(01)00425-0 [17] RITTMANN B E. The membrane biofilm reactor is a versatile platform for water and wastewater treatment[J]. Environmental Engineering Research, 2007, 12(4): 157-175. doi: 10.4491/eer.2007.12.4.157 [18] ZHAO H P, GINKEL A V, TANG Y N, et al. Interactions between perchlorate and nitrate eductions in the biofilm of a hydrogen-based membrane biofilm reactor[J]. Environmental Science & Technology, 2011, 45(23): 10155-10162. [19] 夏四清, 梁郡, 李海翔, 等. 利用氢基质生物膜反应器同步去除多种污染物[J]. 同济大学学报(自然科学版), 2012, 6: 876-881. doi: 10.3969/j.issn.0253-374x.2012.06.013 [20] TANG Y N, MICHAL Z E, ZHOU C, et al. Bioreduction of nitrate in groundwater using a pilot-scale hydrogen-based membrane biofilm reactor[J]. Frontiers of Environmental Science & Engineering in China, 2010, 4(3): 280-285. [21] LEE K C, RITTMANN B E. Effects of pH and precipitation on autohydrogenotrophic denitrification using the hollow-fiber membrane-biofilm reactor[J]. Water Research, 2003, 37(7): 1551-1556. doi: 10.1016/S0043-1354(02)00519-5 [22] MICHAL Z E, RITTMANN B E. Systematic evaluation of nitrate and perchlorate bioreduction kinetics in groundwater using a hydrogen-based membrane biofilm reactor[J]. Water Research, 2009, 43(1): 173-181. doi: 10.1016/j.watres.2008.09.035 [23] 冉雅郡, 周云, 杨潇潇, 等. MBfR处理水中氧化性污染物的研究进展[J]. 中国环境科学, 2018, 38(12): 4484-4493. doi: 10.3969/j.issn.1000-6923.2018.12.011 [24] XIA S Q, LI H X, ZHANG Z Q, et al. Bioreduction of para-chloronitrobenzene in drinking water using a continuous stirred hydrogen-based hollow fiber membrane biofilm reactor[J]. Journal of Hazardous Materials, 2011, 192(2): 593-598. doi: 10.1016/j.jhazmat.2011.05.060 [25] WANG R C, TERADA A, LACKNER S, et al. Nitritation performance and biofilm development of co- and counterdiffusion biofilm reactors: modeling and experimental comparison[J]. Water Research, 2009, 43(10): 2699-2709. doi: 10.1016/j.watres.2009.03.017 [26] ZHOU C, AURA O V, WANG Z C, et al. Palladium recovery in a H2-based membrane biofilm reactor: Formation of Pd(0) Nanoparticles through enzymatic and autocatalytic reductions[J]. Environmental Science & Technology, 2016, 50(5): 2546-2555. [27] RAJAPAKSE J P, SCUTT J E. Denitrification with natural gas and various new growth media[J]. Water Research, 1999, 33(18): 3723-3734. doi: 10.1016/S0043-1354(99)00088-3 [28] CONSTANTIN H, FICK M. Influence of C-sources on the denitrification rate of a highnitrate concentrated industrial wastewater[J]. Water Research, 1997, 31(3): 583-589. doi: 10.1016/S0043-1354(96)00268-0 [29] JESUS R A, ELIAS R F, JORGE G. Simultaneous biological removal of nitrogen, carbon and sulfur by denitrification[J]. Water Research, 2004, 38(14/15): 3313-3321. [30] XU Z S, DAI X H, CHAI X L. Effect of different carbon sources on denitrification performance, microbial community structure and denitrification genes[J]. Science of the Total Environmental, 2018, 634: 195-204. doi: 10.1016/j.scitotenv.2018.03.348 [31] 曹相生, 钱栋, 孟雪征. 乙酸钠为碳源时的污水反硝化规律研究[J]. 中国给水排水, 2011, 27(21): 76-79. doi: 10.19853/j.zgjsps.1000-4602.2011.21.022 [32] 孙洪伟, 王淑莹, 王希明, 等. 低温SBR反硝化过程亚硝态氮积累试验研究[J]. 环境科学, 2009, 30(12): 3619-3623. doi: 10.3321/j.issn:0250-3301.2009.12.029 [33] REZANIA B, CICEK N, OLESZKIEWICZ J A. Kinetics of hydrogen-dependent denitrification under varying pH and temperature conditions[J]. Biotechnology & Bioengineering, 2010, 92(7): 900-906. [34] REZANIA B, OLESZKIEWICZ J A, CICEK N, et al. Hydrogen-dependent denitrification in an alternating anoxic-aerobic SBR membrane bioreactor[J]. Water Science & Technology, 2005, 51(6/7): 403. [35] GINKEL S V, LAMENDELLA R, RITTMANN B E, et al. Microbial community structure during nitrate and perchlorate reduction in ion-exchange brine using the hydrogen-based membrane biofilm reactor (MBfR)[J]. Bioresource Technology, 2010, 101: 3747-3750. doi: 10.1016/j.biortech.2009.12.028 [36] XIA S Q, DUAN L, SONG Y H, et al. Bacterial community structure in geographically distributed biological wastewater treatment reactors[J]. Environmental Science & Technology, 2010, 44(19): 7391-7396. [37] LU H J, CHANDRAN K, STENSEL D. Microbial ecology of denitrification in biological wastewater treatment[J]. Water Research, 2014, 64: 237-254. doi: 10.1016/j.watres.2014.06.042 [38] 高春娣, 张娜, 韩徽, 等. 低温下丝状菌膨胀污泥的微生物多样性[J]. 环境科学, 2020, 41(7): 3373-3383. doi: 10.13227/j.hjkx.201912048 [39] XING W, LI J L, LI P, et al. Effects of residual organics in municipal wastewater on hydrogenotrophic denitrifying microbial communities[J]. Journal of Environmental Sciences, 2018, 65: 262-270. doi: 10.1016/j.jes.2017.03.001 -



 下载:
下载: