-
我国造纸行业废水年排放量达40×109 t,占全国工业废水排放量的1/6[1]。造纸废水中含有大量的半纤维素、木质素及化学药品,耗氧量大,对生态环境造成严重破坏,因此,造纸废水的处理是社会关注的热点之一[2-4]。在碳达峰和碳中和的目标下,既要保证造纸行业的增产,提高造纸行业的经济效益,也要减少造纸废水的排放,实现节能减排的目标,提高环境效益[5]。造纸废水的处理可分为化学处理法、物化处理法、生化处理法[6]。化学处理法和物化处理法虽可实现造纸废水的达标排放,但处理成本较高,易消耗更多的能源和物料,不符合节能降耗的理念。而生化处理法具有环保性和经济可行性,处理效果好,适用于有机物浓度高的造纸废水[7-8]。
由于造纸废水中含有难降解物质,造纸废水的可生化性较低,导致生物处理的有效性降低[9],因此,对传统生物处理技术的优化和改进成为研究热点[10]。生物电化学系统(bio-electrochemical systems,BES)是近年来环境领域一种新型的厌氧处理反应器,因其在电活性微生物介导的生物电化学作用下通过细菌代谢能够消除废水中存在的各种污染物,如难降解有机物和氮物质,而受到越来越多的关注[11-12],目前应用最广泛的为微生物电解池(microbial electrolysis cell,MEC)和微生物燃料电池(microbial fuel cell,MFC)[13]。有研究表明,在pH=7、外加电压为0.6 V、(30±2) °C的条件下,用MEC系统处理造纸废水,在7 d的批量循环中,500 mL废水的化学需氧量(以COD计)去除率为34%,显著提高了造纸废水的处理效率[14]。LIU等研究表明MEC-AD系统可加速碳的生物转化,生物甲烷生成速率提高了3倍[15]。有研究将厌氧生物膜反应器和MFC相结合,用于处理制浆造纸废水,22 d后添加陶粒的MFC表现出更好的生物电性能,COD去除率达到65.6%[16]。当向造纸废水中加入磷酸盐缓冲溶液时,在500 h的间歇循环中,可溶化学需氧量(SCOD)去除了(73±1)%,总化学需氧量(TCOD)去除了(76±4)%,纤维素几乎完全被去除[17]。除BES外,外加金属导电材料也是一种强化厌氧发酵的新方法[18]。有研究提出向级联暗发酵和厌氧消化体系中引入200 mg·L−1导电材料纳米磁铁矿(Fe3O4NPs),生物甲烷产量提高了22.9%,酪氨酸类蛋白质的荧光响应从59.11%下降到52.38%[19],证实了Fe3O4NPs可用于有机废物稳定、高速的生物甲烷化[20]。MEC、MFC和外加金属导电材料都可以创新开发高效稳定的生物处理新工艺,但针对不同厌氧发酵系统处理造纸废水的对比研究相对较少。
基于上述研究结果,本文以造纸废水为研究对象,构建了不同的厌氧发酵系统,测定了不同厌氧发酵系统中生物甲烷组分、液体组分、液体DOM以及微生物群落结构,通过对比生物甲烷量、总磷(TP)去除率、COD去除率、NH4+-N去除率、溶解性有机质(DOM)变化特征和菌群群落结构,优选出微生物降解造纸废水高效的处理系统。
-
本研究采用的造纸废水来源于河南省焦作市某造纸厂,通过造纸废水的水质分析可得:pH为8.80、SCOD为7 197.93 mg·L−1、TP为26.33 mg·L−1、NH4+-N为43.45 mg·L−1。不同厌氧发酵系统实验所用菌源来源于实验室长期驯化的菌液。
-
1)构建对照组。对照组为传统微生物厌氧发酵系统(AD),以1 000 mL的锥形瓶作为厌氧发酵的反应容器,造纸废水的添加量为900 mL,菌液的添加量为100 mL;往反应容器中通入氮气除氧,密封后放入35 ℃的恒温培养箱。
2)构建实验组。实验组分别为微生物单室电解池系统(MEC-AD)、微生物双室燃料电池系统(MFC-AD)和微生物加导电材料厌氧发酵系统(AD+Fe3O4NPs)。实验组A:MEC-AD用碳毡作为阳极,不锈钢网作为阴极,并用钛丝连接阴阳两极。反应容器、造纸废水和菌液的添加量同AD,通入氮气除氧,密封后置于磁力搅拌器上进行搅拌,转速350 r·min−1,温度设置为35 ℃,串联10 Ω的电阻,外接0.6 V的直流电压。实验组B:MFC-AD阴阳两极材质、反应容器及阳极室造纸废水和菌液的添加量同MEC-AD,阴极室以乙酸盐作为底物,阳极室与阴极室通过质子交换膜传递质子,阳极室除氧后密封置于磁力搅拌器上(参数同MEC-AD),串联1 000 Ω的电阻。实验组C:AD+Fe3O4NPs造纸废水和菌液的添加量同AD, Fe3O4NPs的添加量为2 g·L−1,除氧密封后放入35℃培养箱。(实验组①和②中所用碳毡跟不锈钢网大小均为10 cm×6 cm,在使用前要先进行预处理,先用1 moL·L−1的HCL浸泡24 h后用蒸馏水冲洗至中性,再用1 moL·L−1的NaOH浸泡24 h后用蒸馏水冲洗至中性,放到干燥箱中进行烘干)。
3) 4种厌氧发酵系统中各接1个500 mL的集气袋,每隔2 d分析生物甲烷组分且记录生物甲烷量。4种厌氧发酵系统隔10 d取1次液体,测定pH、COD、TP和NH4+-N,测定厌氧发酵反应前后液体DOM,并对生物甲烷高峰期的菌群结构进行鉴定。
-
1)不同厌氧发酵系统生物甲烷组分测定采用Agilent 7890A GC型气相色谱仪,检测器温度100℃,载气为He,流速为30 mL·min−1,采用进样针手动进样,每次进样体积1 mL。
2)产生物甲烷动力学分析。根据改进的Gompertz模型(式(1))[21]对不同厌氧发酵系统产生物甲烷阶段进行拟合修正。
式中:Gt为t时生物甲烷累计产量,mL;Go为模拟的生物甲烷累计产量,mL;Rmax为模拟的生物甲烷最大日产量,mL;λ为延滞期,d;t为厌氧发酵时间,d。
3)液体组分分析。pH利用pH计(型号:PHS-3C)测定;COD、TP和NH4+-N:取1 g液体进行稀释,按照标准方法测定(型号:多通道水质快速测定仪 TR-408),设定3个平行样。
4)液体三维荧光测试(3D-EEM)。将厌氧发酵前后的液体进行离心取上清液,经过0.45 μm微孔滤膜抽滤后,采用Hitachi F-7000荧光光度计测定,采用Origin软件进行处理3D-EEM数据,结合特定区域的光谱值进行分析表征。
5)菌群结构的鉴定。取50 mL生物甲烷高峰期的液体,在10 000 r·min−1下离心20 min,取离心后沉淀物质进行DNA提取、PCR扩增、高通量测序鉴定菌群结构。选取349F(5′-GYGCASCAGKCGMGAAW-3′)和806R(5′-GACTACHVGGGTATCTAATCC-3′)作为引物,高通量测序交付上海生工完成[22]。
-
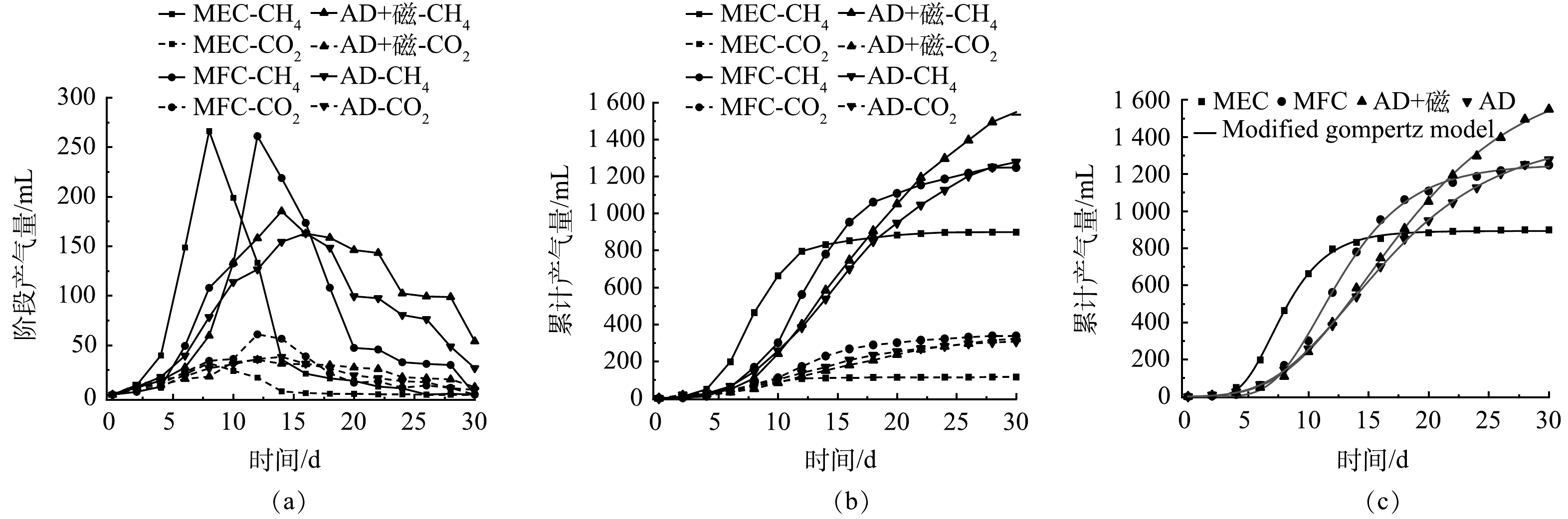
不同厌氧发酵系统的生物甲烷量情况如图1所示。AD系统的生物甲烷高峰值出现在第16天左右,为162.95 mL,生物甲烷总量为1 277.81 mL。MEC-AD系统的生物甲烷高峰值出现在第8天左右,为266.11 mL,相比于AD系统提前了8 d,相比于AD系统增加了103.16 mL;生物甲烷总量为898.91 mL,相比于AD系统下降了29.65%。MFC-AD系统的生物甲烷高峰值出现在第12天左右,为260.99 mL,相比于AD系统增加了98.04 mL,相比于AD系统提前了4 d;生物甲烷总量为1 248.24 mL,相比于AD系统下降了2.31%。有机质的厌氧发酵过程可分为水解、产酸、产乙酸、产甲烷4个阶段。MEC-AD系统和MFC-AD系统在水解阶段可以加速大分子和不溶性物质水解成可溶性小分子有机物,并在酸化阶段中加速小分子有机物进一步分解为挥发性脂肪酸、乙酸、丙酮酸等,而后通过产甲烷菌将酸化阶段的产物转化为生物甲烷[23],加快了造纸废水各组分降解速率和生物甲烷生成速率,对厌氧发酵具有明显的促进作用。厌氧发酵后期MEC-AD、MFC-AD系统内微生物可降解利用的碳源不足,抑制了厌氧发酵进程[24];此外,MEC-AD、MFC-AD系统在利用底物产生物甲烷的同时也会损耗一部分能量产电。上述2种原因导致MEC-AD、MFC-AD系统的生物甲烷产率急速降低,生物甲烷总量比AD系统低。AD+Fe3O4NPs系统的生物甲烷高峰出现在第14天左右,相比于AD系统提前了2 d,高峰值为185.15 mL,相比于AD增加了22.2 mL;生物甲烷总量为1 548.74 mL,相比于AD提高了21.20%。只有AD+Fe3O4NPs系统提高了生物甲烷总量,可能由于磁铁矿与菌群形成了复杂的聚集结构,介导了产乙酸菌与产甲烷菌之间的种间直接电子传递(DIET),在这个过程中保留了更多的生物量并改善了厌氧微生物的代谢活性,从而降低短链脂肪酸的积累,提高生物甲烷产率和总量[20,25]。
使用修正的Gompertz模型计算Rmax和λ以研究造纸废水在不同厌氧发酵系统中的消化机制,参数如表1所示。图1(c)反映了不同厌氧发酵系统用修正的Gompertz模型拟合的Go。基于拟合的参数,采用λ和Rmax评估各厌氧发酵系统厌氧消化周期内的产生物甲烷性能。λ反映了厌氧发酵系统中微生物对底物的降解情况,λ值越低,产甲烷菌对底物适应能力越强[26],MEC-AD系统、MFC-AD系统、AD+Fe3O4NPs系统相较于AD系统均可以有效缩短生物甲烷的迟滞期,促进生物甲烷的快速产出,由于生物电化学和Fe3O4NPs的刺激进一步促进了微生物的生长和增殖,增强了增溶、水解酸化的过程;Rmax表示厌氧发酵系统中底物的消耗率[27],λ值和Rmax值保持负相关性,表明产生物甲烷速率与微生物适应性具有协同性。此外,R2均大于0.99证明了修正的Gompertz模型可靠的预测精度。
-
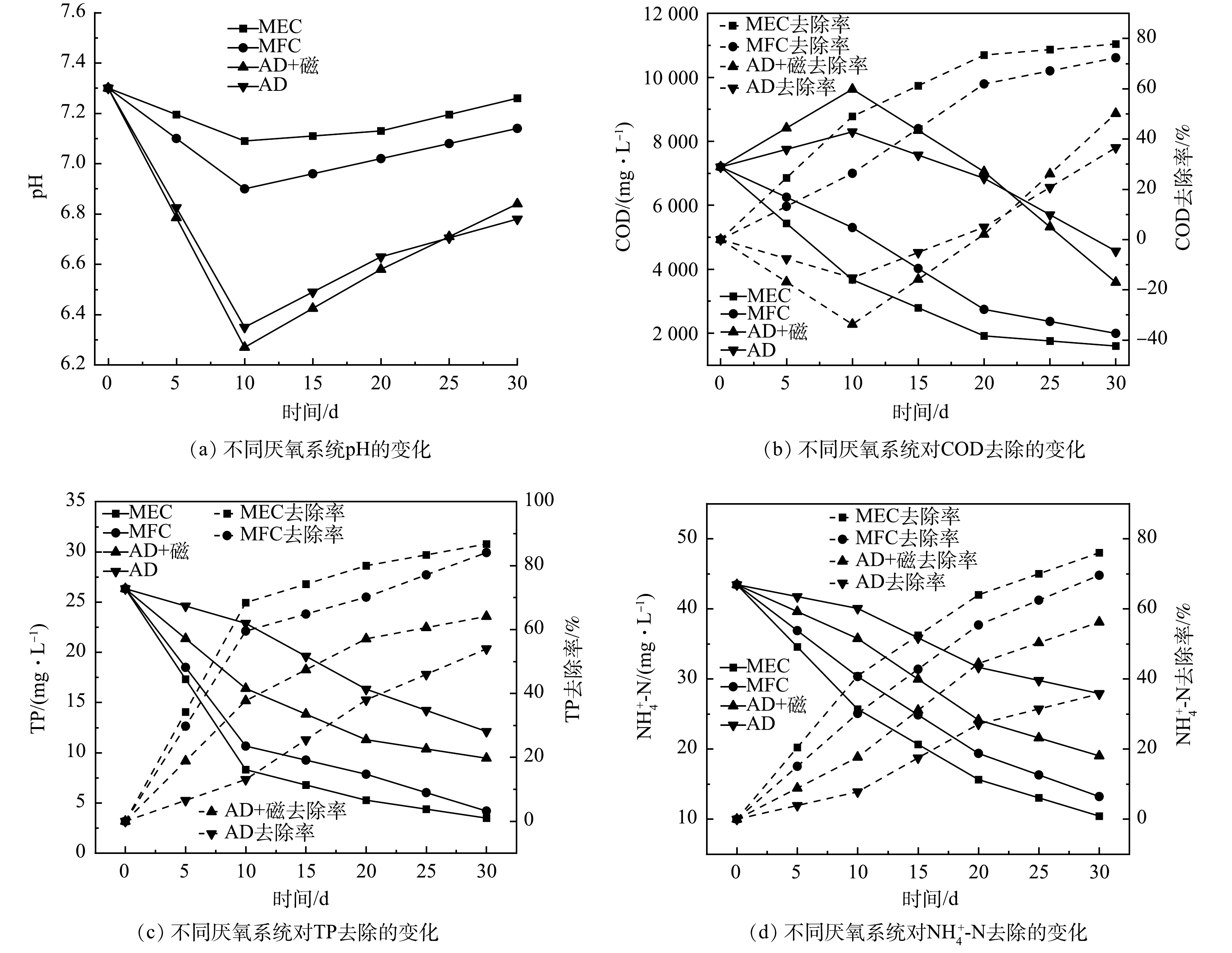
图2为经不同厌氧发酵系统处理前后造纸废水中各组分浓度和去除率的变化情况。在第10天各系统pH降到最小值,这是由于水解阶段与产酸发酵阶段AD、AD+Fe3O4NPs系统中高分子有机物在菌群的作用下生成了大量的小分子酸类,引起pH的降低,同时也造成了SCOD的升高。此外,MEC-AD、MFC-AD系统中SCOD下降。分析原因为,废水中可见的不溶性大分子有机物经厌氧消化而溶于水中,变成了均质溶液,随着厌氧发酵的进行,SCOD呈降低趋势。MEC-AD系统结束后SCOD为1 598.43 mg·L−1、TP为3.50 mg·L−1、NH4+-N为10.44 mg·L−1,其去除率分别为77.79%、86.71%和75.97%。由于MEC-AD系统外加电压刺激了菌群的活性,促进了菌群的生长,废水中更多的SCOD被菌群降解利用,余下的SCOD作为有机碳源为反硝化菌群提供了可靠的电子供体在反硝化脱氮过程中被消耗,降解磷的生物群落在缺氧环境中同时以硝态氮或者亚硝态氮替代氧气作为电子受体,从而达到生物除磷的目的[28]。MFC-AD系统结束后SCOD为1 992.54 mg·L−1、TP为4.20 mg·L−1、NH4+-N为13.23 mg·L−1,其去除率分别为72.32%、84.05%和69.55%。MFC-AD系统阳极表面电化学活性微生物厌氧降解废水中的SCOD产生电子通过质子交换膜达到阴极,与阴极含氮、含磷化合物发生氧化还原反应从而实现脱氮除磷。AD+Fe3O4NPs系统结束后SCOD为3 588.71 mg·L−1、TP为9.46 mg·L−1、NH4+-N为19.03 mg·L−1,其去除率分别为50.14%、64.07%和56.23%。AD+Fe3O4NPs系统中Fe3O4NPs可以协助促进菌群与废水中矿物之间的电子传递交互过程,可促进微生物代谢和能量的流动,从而提高了脱氮除磷的效率。4个厌氧发酵系统中的菌群从造纸废水中获得能量,一部分用于产气,一部分用于脱氮除磷,MEC-AD、MFC-AD系统更适合脱氮除磷,因而产气较少;AD、AD+Fe3O4NPs系统更适合产气,因而对废水中各组分去除效果较差。由此可见,相比AD,MEC-AD、MFC-AD、AD+Fe3O4NPs系统均可提高废水中各组分的去除率,去除效果表现为MEC-AD >MFC-AD>AD+Fe3O4NPs>AD。
-
对微生物降解前后的造纸废水进行三维荧光测试及解析,分析液体DOM的变化。根据激发波长(Ex)和发射波长(Em)的不同对3D-EEM光谱进行区域划分可得:Ⅰ区(Ex=200~250 nm,Em=240~330 nm)为类酪氨酸、Ⅱ区(Ex=200~250 nm,Em=330~380 nm)为类色氨酸、Ⅲ区(Ex=200~250 nm,Em=380~600 nm)为类富里酸、Ⅳ区(Ex=250~420 nm,Em=240~380 nm)为溶解性微生物产物、Ⅴ区(Ex=250~420 nm,Em=380~600 nm)为类腐殖质[29]。由图3中可以看出,厌氧降解之前原水包含2个荧光峰,解析出3种物质,分别为酪氨酸类蛋白质、色氨酸类蛋白质和溶解性微生物代谢物,蛋白质样峰在造纸废水中占主导地位。经厌氧降解后的废水均包含4个荧光峰且荧光峰对应位置相同,仅荧光强度不同,解析出5种物质,分别为酪氨酸类蛋白质、色氨酸类蛋白质、类富里酸物质、溶解性微生物代谢物和类腐殖酸物质。与原水相比,处理过后的废水多了类富里酸和类腐殖酸2种物质。这说明原造纸废水经过4个厌氧发酵系统处理后,废水中大分子和不可溶性物质被微生物分解成可溶性小分子有机物,导致可溶性微生物副产物及分解的荧光机质DOM显著增加,表现为类富里酸和类腐殖酸。由图3中可以看出,4种厌氧发酵系统对不同物质均可降解,污水中的DOM均有不同程度的降低。说明微生物群落能更好的利用可溶性小分子物质进行生长代谢,最终由产甲烷菌生成生物甲烷。由荧光峰强度的大小来看,MEC-AD系统对于酪氨酸类蛋白质、色氨酸类蛋白质和溶解性微生物代谢物降解效果最显著;MFC-AD系统对于类富里酸和类腐殖酸两种物质降解效果最显著;AD、AD+Fe3O4NPs系统对4种组分降解效果都不显著,但相比AD,AD+Fe3O4NPs系统对类腐殖质物质降解效果更好。由图3可见,降解能力整体依然表现为MEC-AD>MFC-AD>AD+Fe3O4NPs>AD。这与4种厌氧发酵系统对造纸废水各组分去除能力的结论相一致。
-
为了查明反应体系菌群结构对造纸废水降解程度的影响,对不同厌氧发酵系统在产生物甲烷高峰期进行微生物群落结构鉴定,各系统物种丰富度呈MEC-AD>MFC-AD> AD+Fe3O4NPs>AD,菌群种类及相对丰度见图4。由图4(a)可见,4个厌氧发酵系统原始混合菌群中优势细菌为Proteobacteria、Bacteroidetes、Pseudomonas、Macellibacteroides,丰度分别为6.1%~40.3%、7.2%~18.1%、4.2%~28.1%、9.3%~30.2%。其中Proteobacteria和Bacteroidetes是生物降解碳氮磷的主要细菌门类[30]。Proteobacteria为革兰氏阴性菌,在降解去除有机物和硝酸盐等方面具有重要作用[31]。Bacteroidetes为发酵菌门,多为厌氧细菌,可以将小分子的有机物转化成水溶性醇类、各种有机酸以及H2O、CO2、H2等,并且在蛋白质的降解中起重要作用[32-33]。Proteobacteria和Bacteroidetes在MEC-AD、MFC-AD系统的相对丰度远大于其他2个厌氧发酵系统,说明反应系统中的有机物可以在厌氧发酵阶段被快速降解,促进生物甲烷的快速产出。Macellibacteroides属于化能自养型微生物,主要参与大分子如蛋白质、糖、纤维素等的降解,其次也参与单糖的发酵产生酸、氢气和二氧化碳[34],在AD+Fe3O4NPs系统中相对丰度高。Pseudomonas属于假单胞菌科,本属细菌大多数为化能有机营养型,是一种降解能力极强的菌属,其对短链及长链烷烃、芳烃均有降解能力,同时也能参与碳水化合物的发酵[35],在AD系统中相对丰度高。Macellibacteroides和Pseudomonas在提高生物甲烷产量方面具有很大贡献。由图4(b)可知四个厌氧发酵系统原始混合菌群中优势古菌为Methanobacterium、Methanosaeta、Methanosarcina,相对丰度分别为8.1%~34.9%、5.1%~33.1%、9.2%~40.1%。Methanobacterium为氢营养型产甲烷菌,能将H2和CO2还原生成生物甲烷[36],为MEC-AD系统中的优势古菌。Methanosaeta是专性乙酸营养型产甲烷菌的代表,只利用乙酸产生甲烷,而且利用乙酸的效率很高,可将所利用乙酸分子中98%~99%的甲基转化成甲烷[37],为MFC-AD系统中的优势古菌。Methanosarcina为严格厌氧型,为甲基类发酵型产甲烷菌的主要菌属,能量代谢表现为甲基胺或甲醇转化为CH4、CO2和NH3,在H2存在时,其可以结合H2将小分子化合物还原为CH4,Methanosarcina为AD、AD+Fe3O4NPs系统中的优势古菌。4个厌氧发酵系统中均有较多的产甲烷菌群,可以利用细菌分解有机物提供的各种底物,通过不同途径产生CH4,但AD+Fe3O4NPs系统中丰度最高的Macellibacteroides可以广泛利用单糖和双糖作为电子供体,为微生物合成甲烷提供丰富的碳源和能量,这说明AD+Fe3O4NPs系统可提高生物甲烷总产量。
-
1) MEC-AD、MFC-AD、AD+Fe3O4NPs系统均可以促进生物甲烷的快速产出,MEC-AD系统促进效果最为显著,且可使产气高峰期提前8 d; AD+Fe3O4NPs系统不仅促进了生物甲烷的产出,还提高了生物甲烷的总产量,产率提高了21.20%。
2)各系统对废水中各组分的去除率整体表现为MEC-AD>MFC-AD>AD+Fe3O4NPs>AD,MEC-AD系统SCOD、TP和NH4+-N去除率分别为77.79%、86.71%和75.97%。
3)由荧光峰强度的大小来看,MEC-AD系统降解能力最强且对酪氨酸类蛋白质、色氨酸类蛋白质和溶解性微生物代谢物这3种物质降解效果最显著。
4) Proteobacteria和Bacteroidetes是MEC-AD系统中生物降解碳氮磷的主要细菌门类,更适合造纸废水厌氧发酵处理。
5) MEC-AD系统是微生物降解造纸废水最高效的处理系统。
不同厌氧发酵系统在造纸废水处理中的应用
Application of different anaerobic digestion systems in paper mill wastewater treatment
-
摘要: 在“碳达峰和碳中和”目标下寻求高效处理造纸废水的方法尤为迫切。以某造纸厂的废水为研究对象,利用不同的厌氧发酵系统对其进行微生物降解,分别对厌氧发酵过程中的生物甲烷组分、液体组分、液体DOM、微生物群落结构进行了测定和分析,优化了处理系统。结果表明:不同厌氧发酵系统对废水中各组分降解去除能力依次为MEC-AD>MFC-AD>AD+磁铁矿>AD;MEC-AD处理造纸废水具有高效性,可促使生物甲烷高峰期相对AD提前8 d,SCOD、TP和NH4+-N去除率分别达到了77.79%、86.73%和75.98%,废水DOM中酪氨酸类蛋白质、色氨酸类蛋白质和溶解性微生物的含量显著降低,生物甲烷高峰期菌群的优势菌属为Proteobacteria、Bacteroidetes。Abstract: It is particularly urgent to seek high-efficiency treatment of papermaking wastewater under the goal of 'Carbon peaking and carbon neutrality'. In this study, the wastewater from a paper mill was selected as the research object, and different anaerobic digestion systems were used to microbially degrade it. The biomethane composition, liquid composition, liquid DOM and microbial community structure in the anaerobic digestion process were determined to optimize the treatment system. The results showed that the order of degradation and removal ability of the components in wastewater by different systems was MEC-AD > MFC-AD > AD + magnetite > AD. Compared to AD, MEC-AD presented high-efficiency in papermaking wastewater treatment, which could promote 8 days in advance for the occurrence of biomethane peak period. The removal rates of SCOD, TP and NH4+-N reached 77.79 %, 86.73 % and 75.98 %, respectively. The tyrosine protein, tryptophan protein and soluble microorganisms in the wastewater DOM were significantly reduced. The dominant bacteria in biomethane production peak in MEC-AD were Proteobacteria and Bacteroidetes.
-
精神活性物质是指对人类中枢神经系统具有强烈兴奋或抑制作用的成瘾性物质,主要包括:阿片类,可卡因、海洛因和美沙酮等;安非他命类,苯丙胺、甲基苯丙胺和摇头丸等;大麻类,大麻酚和四氢大麻酚等[1]。《2021年世界毒品形势报告》显示,全球超过约2.75亿(15—64岁)人口,在过去一年中至少使用过一次精神活性物质,比2010年增加22%,每年约50万人直接死于精神活性物质的滥用[2],精神活性物质的滥用已经成为全球关注的问题。精神活性物质进入人体后,经过肌体的新陈代谢,以药物母体及其代谢产物的形式排出体外,经由下水道进入污水处理系统。Christian[3]在2001年首次提出,通过检测市政污水中目标物质的浓度与人体药物代谢动力学相结合,可以反推评估该地区精神活性物质的滥用情况及流行率。目前对市政污水中低浓度精神活性物质定性定量检测的主流方法为液相色谱质谱联用法[4]及气相色谱质谱联用法[5]。美国[6-7]、意大利[8]、西班牙[9]、澳大利亚[10]等多个国家已经利用Christian提出的方法开展了多种精神活性物质滥用情况的调查研究。
目标覆盖区域的服务人口数是利用精神活性物质滥用情况反推其滥用量及流行率过程中一个非常重要的参数,其数值的合理性和准确程度极大影响着推算结果的准确度。目前,目标覆盖区域服务人口数的推算方法主要有静态法和动态法,静态法有设计容量法和人口普查法等;动态法有水质参数法,常用的水质参数包括氨氮(NH4-N)、化学需氧量(COD)和总氮(TN)等[11],生物标志物法,常用的生物标志物包括可替宁、肌酸酐和咖啡因等[12]。其中设计容量法更偏向污水处理厂初建时设计的服务人口数,水质参数法和人均用水量法受工业污水占比影响较大,生物标志物法会受到年龄和身体状况等参数的影响,造成吸收和代谢的比例不一致。每种推算方法都有自身的特点和局限性,会给调查结果带来不确定性。因此,服务人口数的估算直接影响目标物滥用量和流行率的反演推算结果。
本研究使用层次分析法,综合多种目标覆盖区域服务人口数的估算方法,建立多参数人口模型,以此获得更为准确的服务人口数,并应用于精神活性物质滥用量和流行率的评估。
1. 材料与方法(Materials and methods)
1.1 实验材料
实验试剂与耗材:甲基苯丙胺(METH)、苯丙胺(AMP)、吗啡(MOR)、O6乙酰吗啡(6MAM)、可替宁(CTN)(1 mg·mL−1,美国Cerilliant公司);甲基苯丙胺-d8(METH-d8)、苯丙胺-d8(AMP-d8)、吗啡-d3(MOR-d3)、O6乙酰吗啡-d3(6MAM-d3)、可替宁-d3(CTN-d3)(100 μg·mL−1,美国Cerilliant公司);甲醇、二氯甲烷、氨水(色谱纯,上海安谱实验科技股份有限公司);盐酸(分析纯,国药集团化学试剂有限公司)、MCX固相萃取柱(3mL, 60 mg,美国Waters公司),玻璃纤维滤膜(0.45 μm,Whatman GF/F);
实验设备:Thermo Scientific TSQ Endura型高效液相色谱质谱仪(美国Thermo Scientific公司),WD-12型氮吹仪(杭州奥盛仪器有限公司),12孔配真空抽干装置固相萃取仪(美国Supelco公司),XW-80A型旋涡混合器(上海精科实业有限公司)。
1.2 样品采集
样品采集于我国西北部某城市主城区污水处理厂(S1、S2、S3、S4)和县(市、区)污水处理厂(X1、X2、X3、X4),以上8个污水处理厂基本覆盖该市所有行政区,覆盖人口数约占全市人口总数的89%。使用自动取样器于2019年冬季和2020年夏季,在污水处理厂进水口采集24 h混合水样约400 mL,样品连续采集一周。精神活性物质的吸食频率存在一定的周期性,连续采集样品一周基本能反映一个地区精神活性物质的滥用情况。样品采集后存放于聚酯(PET)瓶内,加盐酸调节pH≤2,冷冻运输至实验室,待后续分析。
1.3 样品前处理
样品在常温下解冻,经0.45 μm的玻璃纤维滤膜过滤,振荡混合均匀,量取50 mL滤液并添加氘代内标为待测样,固相萃取富集目标物:分别用甲醇、超纯水和pH 2的盐酸水溶液充分活化并平衡固相萃取柱,固相萃取待测样,样品流速控制在每滴1—2 s。富集完成后真空干燥固相萃取柱,依次用甲醇和5%氨水/甲醇溶液(M/M)淋洗洗脱并收集洗脱液。洗脱液在柔和氮气吹至近干后用20%(V/V)甲醇水复溶,转移至色谱瓶进行二次氮吹,最后用200 μL 20%(V/V)甲醇水溶液定容。
1.4 样品分析
使用Thermo Scientific TSQ Endura型高效液相色谱-质谱联用仪进行分析。色谱条件为:Waters XTerra MS C18反相色谱柱(100 mm×2.1 mm, 3.5 μm),流动相A为0.12%甲酸和30 mmol·L−1甲酸铵水溶液,B相为甲醇,流速0.3 mL·min−1,柱温30℃,进样量5 μL。质谱选用电喷雾离子源(ESI),采用ESI(+)模式。目标物特征选择离子、质谱条件及回收率如表1所示。
表 1 目标物特征选择离子、质谱条件及回收率Table 1. Target feature selection ions, mass spectrometry conditions and recovery rate物质Compound 母离子Parent ionm/z 定量离子Quantitative ion 定性离子Qualitative ion 保留时间/minRetention time 回收率/%Recovery rate m/z DP/V CE/V m/z DP/V CE/V MOR 286.0 152.1 82.0 55.0 165.0 82.0 32.0 2.73 88.45±5.22 MOR-d3 289.2 152.1 80.0 55.0 165.0 80.0 41.0 2.72 — 6MAM 328.1 165.3 90.0 36.0 211.3 90.0 36.0 4.35 84.61±3.40 6MAM-d3 331.1 165.1 90.0 38.3 211.2 90.0 25.0 4.36 — METH 150.1 91.1 30.0 16.0 119.1 30.0 16.0 4.62 101.65±4.95 METH-d8 158.2 93.2 40.0 19.0 124.2 40.0 10.3 4.59 — AMP 136.1 91.1 40.0 21.0 119.1 40.0 21.0 4.51 99.00±4.90 AMP-d8 144.2 127.2 40.0 10.3 97.2 40.0 16.0 4.44 — CTN 177.2 80.2 30.0 24.0 101.2 30.0 11.0 3.09 98.31±4.78 CTN-d3 180.1 80.2 30.0 25.0 101.2 30.0 22.4 3.08 — 1.5 质量控制
配制浓度分别为:1.56、3.13、6.25、12.50、25.00、50.00、100.00、150.00、200.00、250.00、300.00 μg·L−1的混合标准溶液,绘制标准曲线,线性良好(R2≥0.999)。
为确定目标物回收率在合理范围内,每12个样品添加一组浓度为100.00 μg·L−1的混合标准溶液为质控样品,结果显示目标物的回收率均在85%—105%之间。同时每12个样品添一组空白实验。
1.6 计算方法
利用水质参数法、生物标志物法和人均用水量法计算服务人口数,具体计算方法如式所示:
PT=CT×FmT (1) 式(1)中,PT是通过水质参数T计算后得到的服务人口数(万人);CT为水质参数T的浓度(mg·L−1);mT是水质参数T的人均产生量(g·d−1);F为污水处理厂日均处理量(104 m3·d−1)。
本文选用的水质参数T为氨氮(NH4-N),由于地区、生活习惯、年龄和性别比例的不同,人均排放量的比例亦不相同,结合文献调查结果[13-14]和该市具体情况,人均排放量mT取值为10 g·d−1。
PS=CS×FmS (2) 式(2)中,PS是通过生物标志物S计算后得到的服务人口数(万人);CS为生物标志物S的浓度(mg·L−1);mS是生物标志物的日产生量(g·d−1);F为污水处理厂日均处理量(104 m3·d−1)。
本文选用的生物标志物为可替宁,根据该市的烟草消耗、尼古丁含量及其在人体内代谢比例,运用水晶球软件模拟得到该市人均可替宁日产生量为1.47 mg·d−1。
PQ=Q10−3¯Q (3) 式(3)中,PQ是通过人均用水量法计算得到的服务人口数(万人);Q为污水处理厂日均处理污水量(104 m3·d−1);
¯Q 该市2019年水资源利用公报显示,城镇居民和农村居民人均用水量分别为123 L·d−1和52.9 L·d−1。
检验层次分析法建立模型的合理性与可靠性,需要对判断矩阵一致性进行检验,公式为:
C.I.=λmax−nn−1 (4) C.R.=C.I.R.I. (5) 式(4)和(5)中,C.I.为计算一致性指标;λmax为判断矩阵的最大特征值;n为矩阵阶数;R.I.是判断矩阵特征值的算术平均数,当n=4时取值0.90;C.R.为计算一致性比例。
精神活性物质滥用量及流行率的具体计算公式如下:
Ci,1=Ci,2×Mi,1E×Mi,2 (6) 式(6)中,Ci,1是精神活性物的浓度(μg·L−1);Ci,2是精神活性物质标志物的浓度(μg·L−1);Mi,1和Mi,2分别是精神活性物及其标志物的分子质量;E是精神活性物质标志物的代谢率,甲基苯丙胺的生物标志物为母体,代谢率为42%,海洛因的生物标志物为吗啡,代谢率为77%[15]。
mi=Ci,1×F'P (7) 式(7)中,mi是精神活性物质的人均滥用量(μg·d−1);Ci,1是精神活性物的浓度(10−3 μg·L−1);F'是污水处理厂进水流量(104 m3·d−1);P是服务人口数(万人)。
PR(%)=miR18—60×D×n×100\% (8) 式(8)中,PR为特定时间内,使用某种精神活性物质的人群数量占18——60岁总人数数量的比例;R18—60是该市居民中18—60岁的成年人口比例,经调查该市居民18—60岁成年人口的比例为62.4%;D是精神活性物质使用的典型剂量大小(mg·次−1),n是每天的平均使用频率(次·d−1)。
Bao等[16]研究发现,甲基苯丙胺的典型剂量为(135±80)mg·次−1,平均使用频率为0.31 次·d−1;陈小波,乔静等[17-18]研究发现,海洛因的典型剂量为44 mg·次−1,平均使用频率为2.40 次·d−1。
2. 结果与讨论(Results and discussion)
2.1 污水处理厂服务人口数计算模型
计算所需相关参数大小如表2所示。通过各方法获得的污水处理厂服务人口数,相关数据如表3所示。
表 2 各方法相关参数Table 2. Correlation parameters of each method污水处理厂Sewage treatment plant 日处理污水量/万tDaily amount of sewage treated NH4-N/(mg·L−1) 可替宁/(μg·L−1)Cotinine concentration S1 7.50 67.50 5.88 S2 15.00 60.72 5.29 S3 7.50 49.98 6.21 S4 5.50 49.57 6.07 X1 1.00 107.93 8.05 X2 0.50 30.97 4.46 X3 0.30 50.45 6.34 X4 2.00 28.39 4.14 表 3 污水处理厂服务人口数(万人)Table 3. Population served by sewage treatment plant (ten thousand people)污水处理厂Sewagetreatment plant 专家估算人口Expert estimates of population 设计容量法Design capacity method 水质参数法Water quality parameter method 生物标志物法Biomarker method 人均用水量法Per capita water consumption 多参数模型法Multi-parameter model method S1 41.1 30.0 50.6 30 48.8 37.2 S2 52.1 70.0 91.1 54 85.4 68.1 S3 40.7 50.0 37.5 32 42.7 36.3 S4 22.0 27.0 27.3 23 44.7 27.2 X1 4.70 6.00 11.0 5.5 15.3 8.08 X2 2.00 2.30 1.50 1.5 4.80 2.00 X3 1.54 3.00 1.50 1.3 4.00 1.85 X4 5.72 8.00 5.70 5.6 30.7 9.10 专家估算人口是以该市统计年鉴人口数为基础,结合污水处理厂日内污水流量波动、日间污水处理量波动和污水来源组成等因素综合推算得到的污水处理厂服务人口数。Castiglioni等[19]认为专家估算人口是最可靠的服务人口数的估算方法,因此以专家估算人口数为标准判断各方法推算服务人口数的准确度。但是该方法耗时耗力且经济成本较高。设计容量法是一种较为方便和简单获得服务人口数的方法,但是设计容量法获得的人口数更偏向污水处理厂初建设计的服务人口数,获得的服务人口数往往高于实际人口数。但也存在一些污水处理厂满负荷运行,甚至高于污水处理厂初建设计的服务人口数,如S1。而通过水质参数法推算的服务人口数,会受到工业污水的影响,导致主城区服务人口数偏高。主要是因为主城区4个污水处理厂的工业污水业占比较高,导致氨氮数据偏高,从而影响服务人口数的估算。生物标志物法推算的服务人口数也会与真实服务人口数有所差异,这是因为可替宁是尼古丁通过细胞色素P450(CYP)亚型2A6介导产生的代谢物[20],年龄和身体状况的差异,会导致尼古丁代谢为可替宁的比例不同。人均用水量法推算得到的服务人口数明显偏高,主要原因有两个方面,一是污水处理厂的人均用水量数据比实际值高;二是污水处理厂的工业污水占比比登记值高,从而导致推算结果的偏高。
由此可见,使用不同方法推算污水处理厂的服务人口数会得到不同的数据,每种方法都有其自身的特点和局限性,为减小单个计算方法带来的不确定性,本文使用层次分析法对不同参数所占的权重进行计算,建立污水处理厂服务人口数多参数计算模型。
在层次分析中,以可替宁计算得到的服务人口数为基础,其他方法推算的服务人口数与可替宁推算人口的相关系数矩阵(表4)作为依据,使用1—9标度法对重要性进行对比打分,将服务人口数相关系数矩阵转为服务人口数判断矩阵(表5),对不同方法的权重进行赋值。
表 4 服务人口数相关系数矩阵Table 4. Correlation coefficient matrix of service population设计容量人口Design capacity population 水质参数法Water quality parameter method 生物标志物法Biomarker method 人均用水量法Per capita water consumption 设计容量人口 1 0.55 0.43 0.83 水质参数法 1 0.53 0.77 生物标志物法 1 0.57 人均用水量法 1 表 5 服务人口数判断矩阵Table 5. Judgment matrix of service population设计容量人口Design capacity population 水质参数法Water quality parameter method 生物标志物法Biomarker method 人均用水量法Per capita water consumption 设计容量人口 1 1/4 1/5 1 水质参数法 4 1 1/4 2 生物标志物法 5 4 1 3 人均用水量法 1 1/2 1/3 1 计算得到的多参数人口模型公式为:
P=0.09×P设计容量法+0.23×P水质参数法+0.55×P生物标志物法+0.13×P人均用水量法 (9) 对矩阵的一致性进行检验,得到C.R.为0.078<0.1,认为矩阵的一致性是可以接受的。
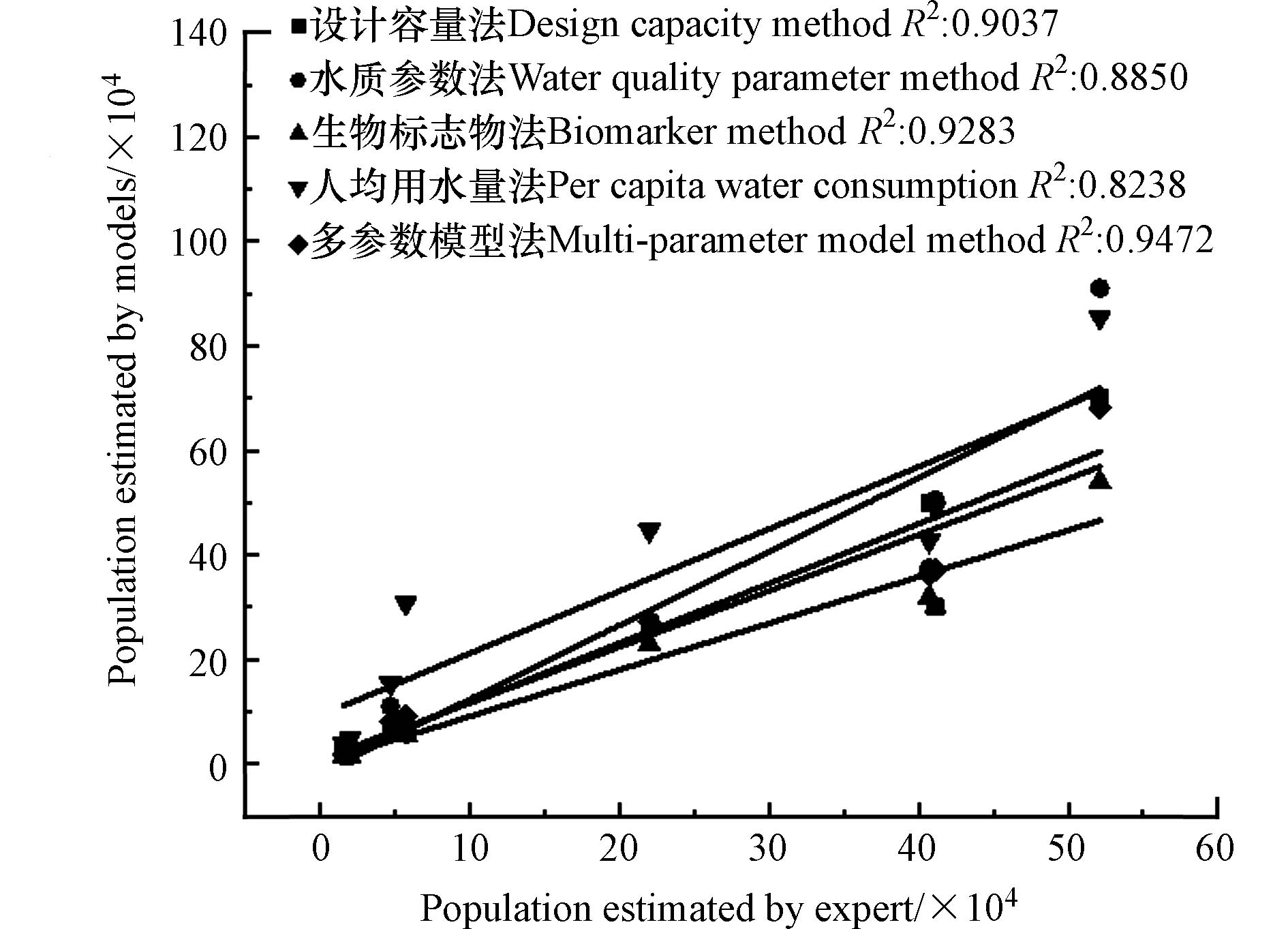
各方法计算得到的服务人口数与专家估算服务人口数相关性分析如图1所示。相关性分析中,设计容量法的R2=0.9037,水质参数法的R2=0.8850,生物标志物法的R2=0.9238,人均用水量法的R2=0.8238,多参数模型法的R2=0.9472,其中多参数模型法得到的服务人口数与专家估算的服务人口数相关性最强,更能够准确反映服务人口数。
2.2 全市精神活性物滥用情况
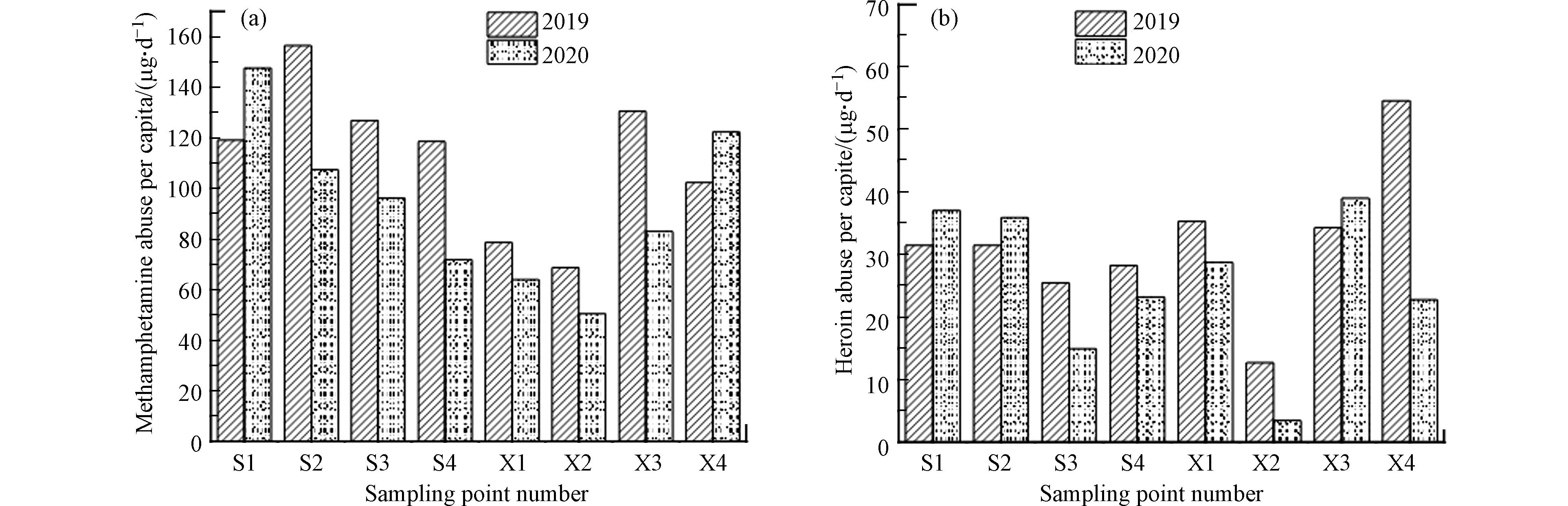
该市2019和2020年甲基苯丙胺和海洛因人均滥用量如图2所示。在2019年和2020年两次精神活性物质滥用调查中,每个样品均检出甲基苯丙胺和吗啡,甲基苯丙胺的人均滥用量分别为(112.60±25.20)μg·d−1和(92.81±28.41)μg·d−1;海洛因的人均滥用量分别为(31.70±10.93)μg·d−1和(25.65±11.42)μg·d−1。以《2019年中国毒品形势报告》、《2020年中国毒情形势报告》和该市公安部门提供的吸食精神活性物质信息为基础,从图2可以看出,该市主要吸食的传统精神活性物质为甲基苯丙胺,这也与《2020年中国毒情形势报告》相一致,同时该地区海洛因滥用量水平低于全国滥用量水平[21-22]。与2019年相比,2020年精神活性物质滥用量有所减小。我国传统精神活性物质以甲基苯丙胺和海洛因为主,因此精神活性物质总滥用量多采用两种物质加和的形式[21-22],该市精神活性物质总滥用情况为2019年(144.30±30.56)μg·d−1和2020年(118.46±37.34)μg·d−1。这与该市公安部门自2019年起加强对精神活性物质制造、贩售和吸食等行为的打击力度有着密不可分的关系。同时考虑到我国有近85%的毒品来源于金三角、金新月和北美等境外地区,2020年新冠疫情致使国内涉毒行为和境外流动受限也是导致精神活性物质滥用量下降的一个原因。对该市八个主城区及县(市、区)的精神活性物质滥用调查发现该市S2和S3的AMP/METH比值高于苯丙胺全部由甲基苯丙胺代谢的理论比值0.05—0.24[23](S2比值为0.99±0.17,S3比值为0.83±0.19),说明这两个地区苯丙胺存在其他来源。我国临床禁止使用苯丙胺类药物,因此可以推断这两个地区存在苯丙胺的滥用。同时该市的滥用量均小于北京、广州和大连等地[24-26],主城区高于县(市、区),说明精神活性物质的滥用情况与经济发展程度有关。这也与Bishop等[27]对小城市和农村精神活性物质的滥用量调查结果相一致,城市化水平和经济发展程度更高以及富裕人口更多的小城市,精神活性物质的滥用量高于农村精神活性物质的滥用量。经济的迅速发展导致人们生活节奏变快,在心理上,人们往往会选择吸食精神活性物质来释放压力,从而使得经济条件发达的地区精神活性物质的滥用情况更严重。
2.3 全市精神活性物质流行率
该市2019和2020年精神活性物质流行率,如表6所示。该市2019和2020年甲基苯丙胺的流行率分别为0.49%±0.17%和0.34%±0.11%,2019和2020年海洛因的流行率分别为0.48‰±0.17‰和0.39‰±0.18‰。该市18—60岁成年人甲基苯丙胺的流行率在Shao等[28]调查的全国15—65岁成年人甲基苯丙胺流行率0.08%—1.25%范围内,低于Pei等[29]对北京甲基苯丙胺流行率的估算。海洛因流行率低于Du等[26]调查的全国主要城市海洛因的平均流行率1.01‰。甲基苯丙胺的流行率与海洛因的流行率相比处于较高水平,这也与近年来甲基苯丙胺缉获量远高于海洛因缉获量这一事实相符合。造成以上现象的主要原因是甲基苯丙胺在中国更容易获得,其合成几乎不受地理位置的限制,从而导致甲基苯丙胺的流行率在某种程度上远高于海洛因的流行率。
表 6 精神活性物质流行率Table 6. Epidemic rate of psychoactive substances污水处理厂Sewage treatment plant 2019年 2020年 METH流行率/%Prevalence rate MOR流行率/‰Prevalence rate METH流行率/%Prevalence rate MOR流行率/‰ Prevalence rate S1 0.46 0.48 0.57 0.56 S2 0.60 0.48 0.41 0.55 S3 0.49 0.39 0.37 0.23 S4 0.45 0.43 0.28 0.35 X1 0.30 0.54 0.24 0.44 X2 0.26 0.19 0.19 0.05 X3 0.50 0.52 0.32 0.60 X4 0.83 0.83 0.35 0.35 3. 结论(Conclusion)
利用设计容量法、水质参数法、生物标志物法和人均用水量法对污水处理厂的服务人口数进行推算,使用层次分析法对权重进行赋值,建立了更合理的污水处理厂服务人口数估算模型,同时评估了2019和2020年该市精神活性物质的滥用量和流行率。结果显示,该市2019和2020年甲基苯丙胺的人均滥用量为(112.60±25.20)μg·d−1和(92.81±28.41)μg·d−1,流行率为0.49%±0.17%和0.34%±0.11%;海洛因的人均滥用量(31.70±10.93)μg·d−1和(25.65±11.42)μg·d−1,流行率为0.43‰±0.10‰和0.41‰±0.18‰。该市2020年较2019年精神活性物质的滥用量有所下降,不仅是因为公安机关加大了对毒品制造、贩卖、吸食的打击力度,也是新冠疫情防疫措施导致毒品的流通受阻所带来的结果,同时经济发展水平在一定程度上也影响了精神活性物质的滥用程度。
-
表 1 修正的Gompertz模型对不同厌氧系统中甲烷进行模拟的动力学参数
Table 1. Kinetic parameters of Modified Gompertz model for the simulation of methane in different anaerobic digestion systems
系统 修正的Gompertz模型 Go/mL λ/d Rmax/(mL·d−1) R2 MEC-AD 892.70 4.42 130.06 0.999 MFC-AD 1 251.60 7.07 114.66 0.998 AD+磁 1 746.51 7.66 88.67 0.999 AD 1 400.14 7.89 76.76 0.999 -
[1] SING A K, KUMAR A, BILAL M, et al. Organometallic pollutants of paper mill wastewater and their toxicity assessment on Stinging catfish and sludge worm[J]. Environmental Technology & Innovation, 2021, 24: 101831. [2] LIANG J, MAI W, WANG J, et al. Performance and microbial communities of a novel integrated industrial-scale pulp and paper wastewater treatment plant[J]. Journal of Cleaner Production, 2021, 278: 123896. doi: 10.1016/j.jclepro.2020.123896 [3] KRISHNA K V, SARKAR O, MOHAN S V. Bioelectrochemical treatment of paper and pulp wastewater in comparison with anaerobic process: Integrating chemical coagulation with simultaneous power production[J]. Bioresource Technology, 2014, 174: 142-151. doi: 10.1016/j.biortech.2014.09.141 [4] SONKAR M, KUMAR V, DUTT D. Use of paper mill sludge and sewage sludge powder as nitrogen and phosphorus sources with bacterial consortium for the treatment of paper industry wastewater[J]. Biocatalysis and Agricultural Biotechnology, 2020, 30: 101843. doi: 10.1016/j.bcab.2020.101843 [5] JOHANSSON M T, BROBERG S, OTTOSSON M. Energy strategies in the pulp and paper industry in Sweden: Interactions between efficient resource utilisation and increased product diversification[J]. Journal of Cleaner Production, 2021, 311: 127681. doi: 10.1016/j.jclepro.2021.127681 [6] VASHI H, IORHEMEN O T, TAY J H. Aerobic granulation: A recent development on the biological treatment of pulp and paper wastewater[J]. Environmental Technology & Innovation, 2018, 9: 265-274. [7] MEYER T, EDWARDS E A. Anaerobic digestion of pulp and paper mill wastewater and sludge[J]. Water Research, 2014, 65: 321-349. doi: 10.1016/j.watres.2014.07.022 [8] CHATTERJEE P, LAHTINEN L, KOKKO M, et al. Remediation of sedimented fiber originating from pulp and paper industry: Laboratory scale anaerobic reactor studies and ideas of scaling up[J]. Water Research, 2018, 143: 209-217. doi: 10.1016/j.watres.2018.06.054 [9] GARCIA-SEGURA S, OCON J D, CHONG M N. Electrochemical oxidation remediation of real wastewater effluents: A review[J]. Process Safety and Environmental Protection, 2018, 113: 48-67. doi: 10.1016/j.psep.2017.09.014 [10] KLIDI N, PROIETTO F, VICARI F, et al. Electrochemical treatment of paper mill wastewater by electro-Fenton process[J]. Journal of Electroanalytical Chemistry, 2019, 841: 166-171. doi: 10.1016/j.jelechem.2019.04.022 [11] ANGLADA Á, URTIAGA A, ORTIZ I. Contributions of electrochemical oxidation to waste-water treatment: Fundamentals and review of applications[J]. Journal of Chemical Technology and Biotechnology, 2009, 84: 1747-1755. doi: 10.1002/jctb.2214 [12] KHANDAKER S, DAS S, HOSSAIN M T, et al. Sustainable approach for wastewater treatment using microbial fuel cells and green energy generation: A comprehensive review[J]. Journal of Molecular Liquids, 2021, 344: 117795. doi: 10.1016/j.molliq.2021.117795 [13] 谢嘉玮, 朱国营, 谢军祥, 等. 难降解废水生物电化学系统强化处理的研究进展[J]. 工业水处理, 2020, 40(10): 1-7. [14] CHAURASIA A K, SHANKAR R, MONDAL P. Effects of nickle, nickle-cobalt and nickle-cobalt-phosphorus nanocatalysts for enhancing biohydrogen production in microbial electrolysis cells using paper industry wastewater[J]. Journal of Environmental Management, 2021, 298: 113542. doi: 10.1016/j.jenvman.2021.113542 [15] LIU W, CAI W, GUO Z, et al. Microbial electrolysis contribution to anaerobic digestion of waste activated sludge, leading to accelerated methane production[J]. Renewable Energy, 2016, 91: 334-339. doi: 10.1016/j.renene.2016.01.082 [16] CHEN F, ZENG S, LUO Z, et al. A novel MBBR–MFC integrated system for high-strength pulp/paper wastewater treatment and bioelectricity generation[J]. Separation Science & Technology, 2019: 1-10. [17] HUANG L, LOGAN B E. Electricity generation and treatment of paper recycling wastewater using a microbial fuel cell[J]. Applied Microbiology and Biotechnology, 2008, 80: 349-355. doi: 10.1007/s00253-008-1546-7 [18] ZHUANG H, ZHU H, ZHANG J, et al. Enhanced 2, 4, 6-trichlorophenol anaerobic degradation by Fe3O4 supported on water hyacinth biochar for triggering direct interspecies electron transfer and its use in coal gasification wastewater treatment[J]. Bioresource Technology, 2020, 296: 122306. doi: 10.1016/j.biortech.2019.122306 [19] CHENG J, LI H, DING L, et al. Improving hydrogen and methane co-generation in cascading dark fermentation and anaerobic digestion: the effect of magnetite nanoparticles on microbial electron transfer and syntrophism[J]. Chemical Engineering Journal, 2020, 397: 125394. doi: 10.1016/j.cej.2020.125394 [20] BAEK G, JUNG H, KIM J, et al. A long-term study on the effect of magnetite supplementation in continuous anaerobic digestion of dairy effluent–magnetic separation and recycling of magnetite[J]. Bioresource Technology, 2017, 241: 830-840. doi: 10.1016/j.biortech.2017.06.018 [21] 蒋昌旺, 李靖, 何迪, 等. 热碱预处理对高含固剩余污泥厌氧消化的影响及其动力学研究[J]. 环境污染与防治, 2019, 41(8): 906-909+915. doi: 10.15985/j.cnki.1001-3865.2019.08.008 [22] SOGIN M L, MORRISON H G, HUBER J A, et al. Microbial diversity in the deep sea and the underexplored “rare biosphere”[J]. Proceedings of the National Academy of Sciences, 2006, 103(32): 12115-12120. doi: 10.1073/pnas.0605127103 [23] 尤惠, 郑纯智, 张国华, 等. 餐厨垃圾两相厌氧发酵技术的研究进展[J]. 广州化工, 2021, 49(5): 41-43. doi: 10.3969/j.issn.1001-9677.2021.05.015 [24] 张淼,朱晨杰,范亚骏,吕小凡,季俊杰,葛丽英,吴军.进水C/N比对部分反硝化过程亚硝态氮积累和微生物特性的影响[J/OL].中国环境科学:1-9[2022-07-31].DOI:10.19674/j.cnki.issn1000-6923.20210928.015. [25] 李建, 王鸿辉, 马美萍, 等. 磁铁矿促进微生物种间电子传递的机制[J/OL][J]. 应用与环境生物学报, 2021: 1-15. [26] MAO C, WANG X, XI J, et al. Linkage of kinetic parameters with process parameters and operational conditions during anaerobic digestion[J]. Energy, 2017, 135: 352-360. doi: 10.1016/j.energy.2017.06.050 [27] PASALARI H, ESRAFILI A, REZAEE A, et al. Electrochemical oxidation pretreatment for enhanced methane potential from landfill leachate in anaerobic co-digestion process: Performance, Gompertz model, and energy assessment[J]. Chemical Engineering Journal, 2021, 422: 130046. doi: 10.1016/j.cej.2021.130046 [28] 孙峰, 余昕洁, 武威, 等. 基于SNADPR作用的复合式人工快速渗滤系统的运行性能及微生物学特征[J]. 环境工程学报, 2021, 15(10): 3387-3399. doi: 10.12030/j.cjee.202101132 [29] 蔡文君, 孙瑞芃, 王浩, 等. 济南市北大沙河水体溶解性有机物的三维荧光光谱分析[J]. 环境与发展, 2020, 32(8): 132-134. doi: 10.16647/j.cnki.cn15-1369/X.2020.08.075 [30] WANG Q, LV R, RENE E R, et al. Characterization of microbial community and resistance gene (CzcA) shifts in up-flow constructed wetlands-microbial fuel cell treating Zn (II) contaminated wastewater[J]. Bioresource Technology, 2020, 302: 122867. doi: 10.1016/j.biortech.2020.122867 [31] JIANG Y, WEI L, YANG K, et al. Rapid formation of aniline-degrading aerobic granular sludge and investigation of its microbial community succession[J]. Journal of Cleaner Production, 2017, 166: 1235-1243. doi: 10.1016/j.jclepro.2017.08.134 [32] 郭南飞, 韩智勇, 史瑞, 等. 农村垃圾厌氧-准好氧时空联合生物反应器中微生物群落分析[J]. 农业工程学报, 2020, 36(19): 200-208. doi: 10.11975/j.issn.1002-6819.2020.19.023 [33] CHEN D, WANG H, YANG K, et al. Performance and microbial communities in a combined bioelectrochemical and sulfur autotrophic denitrification system at low temperature[J]. Chemosphere, 2018, 193: 337-342. doi: 10.1016/j.chemosphere.2017.11.017 [34] PODOSOKORSKAYA O A, KOCHETKOVA T V, NOVIKOV A A, et al. Tenuifilum thalassicum gen. nov., sp. nov., a novel moderate thermophilic anaerobic bacterium from a Kunashir Island shallow hot spring representing a new family Tenuifilaceae fam. nov. in the class Bacteroidia[J]. Systematic and Applied Microbiology, 2020, 43(5): 126126. doi: 10.1016/j.syapm.2020.126126 [35] GRABOWSKI A, NERCESSIAN O, FAYOLLE F, et al. Microbial diversity in production waters of a low-temperature biodegraded oil reservoir[J]. FEMS Microbiology Ecology, 2005, 54(3): 427-443. doi: 10.1016/j.femsec.2005.05.007 [36] QIN R, LIN X, CHEN Z, et al. Evaluation of characteristics and microbial community of anaerobic granular sludge under microplastics and aromatic carboxylic acids exposure[J]. Science of The Total Environment, 2021: 148361. [37] 占迪, 何环, 廖远松, 等. 褐煤强化产甲烷菌群的群落分析及条件优化[J]. 微生物学报, 2018, 58(4): 684-698. doi: 10.13343/j.cnki.wsxb.20170453 -





 DownLoad:
DownLoad: