-
挥发性有机化合物(volatile organic compounds,VOCs)是一类重要大气污染物,与大气颗粒物、SO2、NOx同样为研究热点。世界卫生组织将饱和蒸汽压超过133.32 Pa、常压沸点为50~260 ℃的有机物定义为VOCs[1-2]。目前,VOCs处理技术包括吸附[3]、冷凝、热焚烧、催化燃烧、光催化[4]、等离子体催化降解技术[5]等。催化燃烧技术具有处理效率高、能耗低、无二次污染、适用范围广等优点,在VOCs治理领域具有广阔应用前景[6-10]。
研制高效稳定的催化剂是催化燃烧技术发展的核心[11-12]。常见的催化剂有贵金属和非贵金属氧化物催化剂[13-14]。常见的负载制备贵金属催化剂,一般以Pd、Pt、Rh、Pb等为活性组分,对于多种VOCs的催化燃烧具有较高活性[15-16]。钌(Ru) 作为铂系金属元素中最后被发现的金属元素,其活性较高,化学稳定性较强,低温催化效果较好,且Ru的价格相较于其他贵金属更为低廉。Ru与Au、Pt、Pd的催化活性差别不大,且在对乙酸乙酯、丁烷、丙烯等VOCs的催化活性较强,产物基本为CO2和H2O[17-18]。由于贵金属本身价格较昂贵、易挥发且高温下容易烧结,工业上常用比表面积高的载体来提高贵金属催化剂活性组分与反应物分子的接触面积,从而提高催化剂的活性及稳定性[19]。而沸石分子筛是一类具有孔道结构的优良材料,具有丰富的微孔、较大的比表面积、优异的热稳定性和较多的酸位点,可为活性组分提供有效表面和适宜孔结构,以降低活性组分的团聚,并增强催化剂的机械强度,为适宜的催化剂载体材料[20-23]。CeO2具有立方萤石结构[24],Ce3+和Ce4+间转换表现出独特的储氧能力和表面还原性,能有效提高负载型贵金属催化剂的催化活性及稳定性[25-27]。金属相互作用对催化剂活性具有促进作用[28-29]。王玉亭等[30]用Ce改性V2O5/TiO2催化剂发现投加浓度质量分数为10%的Ce可令催化剂在低浓度邻二甲苯的条件下有较好的氧化效率,T90%为380 ℃;SCIRÈ等[31]发现,Au/CeO2催化剂催化燃烧甲苯比CeO2催化剂具有更好的催化活性,由于Au的存在能减弱催化剂表面的Ce—O键强度,提高了催化剂表面晶格氧的流动性和活性,促进了催化剂在VOCs燃烧的活性。因此,以氧化铈与贵金属作为活性组分的催化剂,因其优异的氧转移机制及金属相互作用而备受研究者青睐。
本研究选取贵金属Ru和稀土金属Ce作为活性组分,将其负载到分子筛上制备成RuCe/ZSM-5催化剂,考察钌铈催化剂催化燃烧甲苯的性能,并通过改变Ru的负载量,调整实验条件及工况,得到活性优、选择性好、稳定性高的钌铈双金属催化剂,以期为贵金属催化技术在VOCs治理领域的应用提供参考。
-
RuCe/ZSM-5催化剂采用等体积浸渍法制备,具体方法为:取适量Ce(NO3)3溶液与适量亚硝酰硝酸钌(Ⅲ)溶液混合均匀;将混合前驱体溶液倒入经过450 ℃焙烧预处理1 h的ZSM-5分子筛中,加入适量的高纯水直到溶液刚好完全覆盖样品;室温充分搅拌3 h,置于80 ℃烘箱内12 h蒸干混合物;于500 ℃马弗炉中焙烧3 h,研磨筛分至40~60目保存使用。根据亚硝酰硝酸钌(Ⅲ)溶液添加量的不同制备了一系列不同Ru含量负载的Ru(a)/CeO2(20)-ZSM-5催化剂。催化剂表示为Ru(a)/CZ,a为Ru元素的负载量(%),实验中a取0.5、1.0和1.5。
-
采用X射线衍射仪(XRD,Bruker D8 ADVANCE,CuKα辐射,40 kV,120 mA)测试催化剂的晶体结构,扫描速度2θ=5 º·min−1,扫描范围4~85 °。获得数据使用Jade 6.5软件进行分析处理。样品的比表面积和孔径分布使用Micromeritics ASAP 2620全自动物理吸附仪测定。采用蔡司仪器的Gemini 300分析材料表面形貌,加速电压为30 kV。测试前需对样品进行真空喷金处理120 s以增强导电性。
-
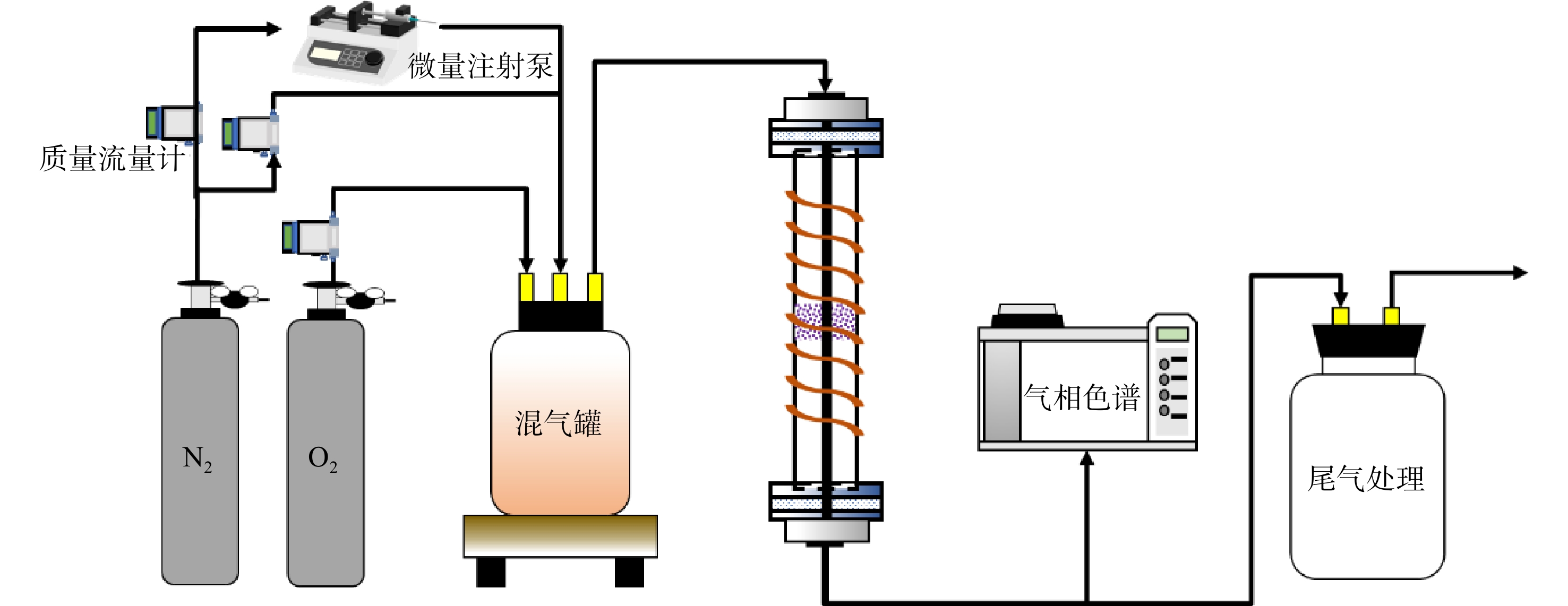
采用实验室自主搭建的固定床-色谱测试装置(图1)对制备的催化剂活性进行评价。装置主要包括气体管路、固定床反应器、流量控制和气体检测4个部分。反应物甲苯(液相)采用微量注射泵注射进入汽化室汽化后在混合室与载气充分混合进入固定床反应器进行燃烧。水蒸气同样利用微量注射泵将液态水加热汽化后与其他气路的气体进行混合。催化反应发生在常压状态下,在中间装有石英筛板的石英管(内径为9 mm)的固定床反应器上进行。催化剂的装填量约为100 mg。由于催化剂为较为致密的粉末,且催化反应为强放热反应,为保证催化剂通气顺畅及受热均匀,催化剂与石英砂按1:4的质量比混合均匀后装填至石英管中。催化反应后的气体进入配备有甲烷转化炉和FID检测器的Thermo Fisher Scientific Trace 1300气相色谱仪进行在线连续检测。用甲苯转化率为50%、90%时的温度T50%、T90%来反映催化剂的反应活性。
-
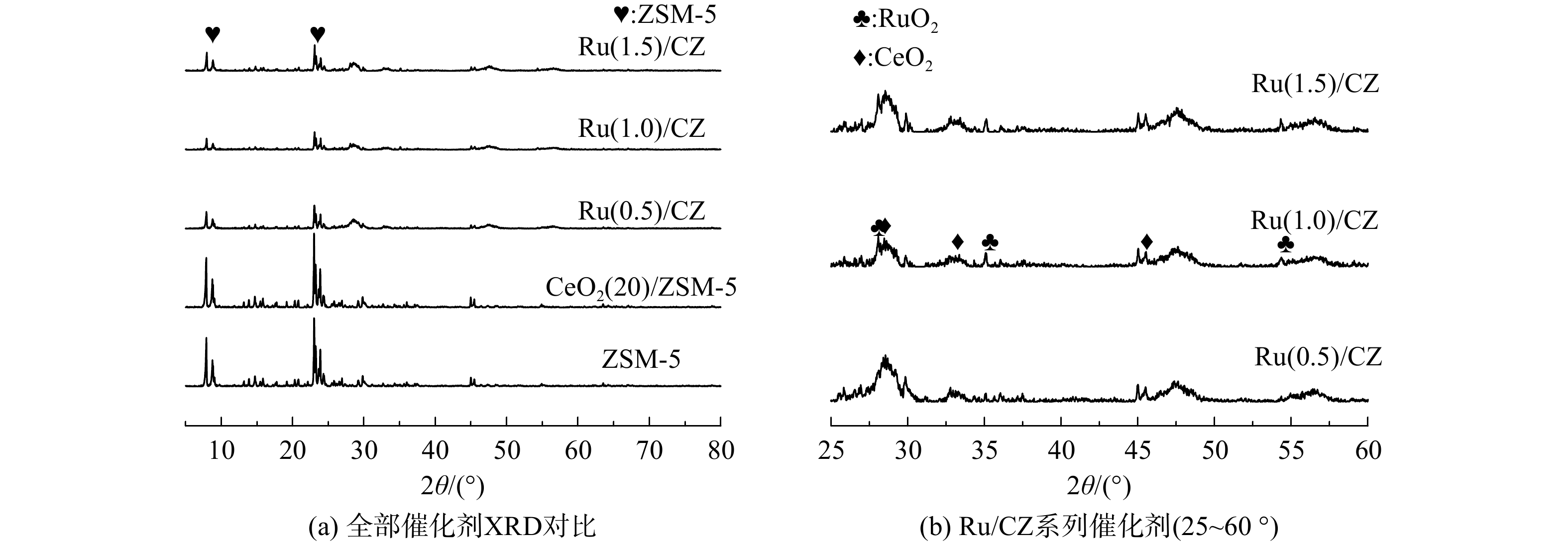
ZSM-5分子筛、CeO2(20)/ZSM-5催化剂和Ru/CZ系列催化剂XRD表征结果如图2所示。Ru和Ce的引入并未改变ZSM-5分子筛的结构,ZSM-5分子筛的特征峰衍射强度仍较高,但引入Ru的Ru/CZ催化剂ZSM-5分子筛衍射峰强度下降。猜测可能是由于Ru的引入降低了ZSM-5分子筛的结晶度,但催化剂载体ZSM-5结构并无明显变化。由于催化剂元素种类较多,不能清晰地分辨负载有Ru元素的Ru/CZ系列催化剂中Ru和Ce元素的XRD衍射峰,故将Ru/CZ系列催化剂3条谱线在25~60 °这一部分放大来观察,见图2(b)。在2θ为28.0 °、35.0 °、54.2 °处,出现了分别对应RuO2(110)、(101)、(211)晶面的衍射峰。在2θ为28.6 °、33.3 °、47.5 °处,出现了分别对应CeO2(111)、(200)、(220)晶面的衍射峰。对于Ru/CZ系列催化剂,随着Ru负载量的增大,代表RuO2物种3个晶面的衍射峰强度均略有增加。
采用扫描电镜对ZSM-5、Ce(20)/ZSM-5、Ru/CZ系列催化剂进行形貌观察,SEM图像见图3。ZSM-5分子筛为块状结构,上面的白色亮点为活性组分RuO2和CeO2,颗粒直径大概为30~50 nm。对比图3(a)~(b)与图4(c)~(e)发现,Ru元素的引入并未明显破坏分子筛本身结构,而部分活性组分颗粒出现团聚现象。这说明钌元素负载在CeO2(20)/ZSM-5材料上而制备的Ru/CZ系列催化剂是有效的。
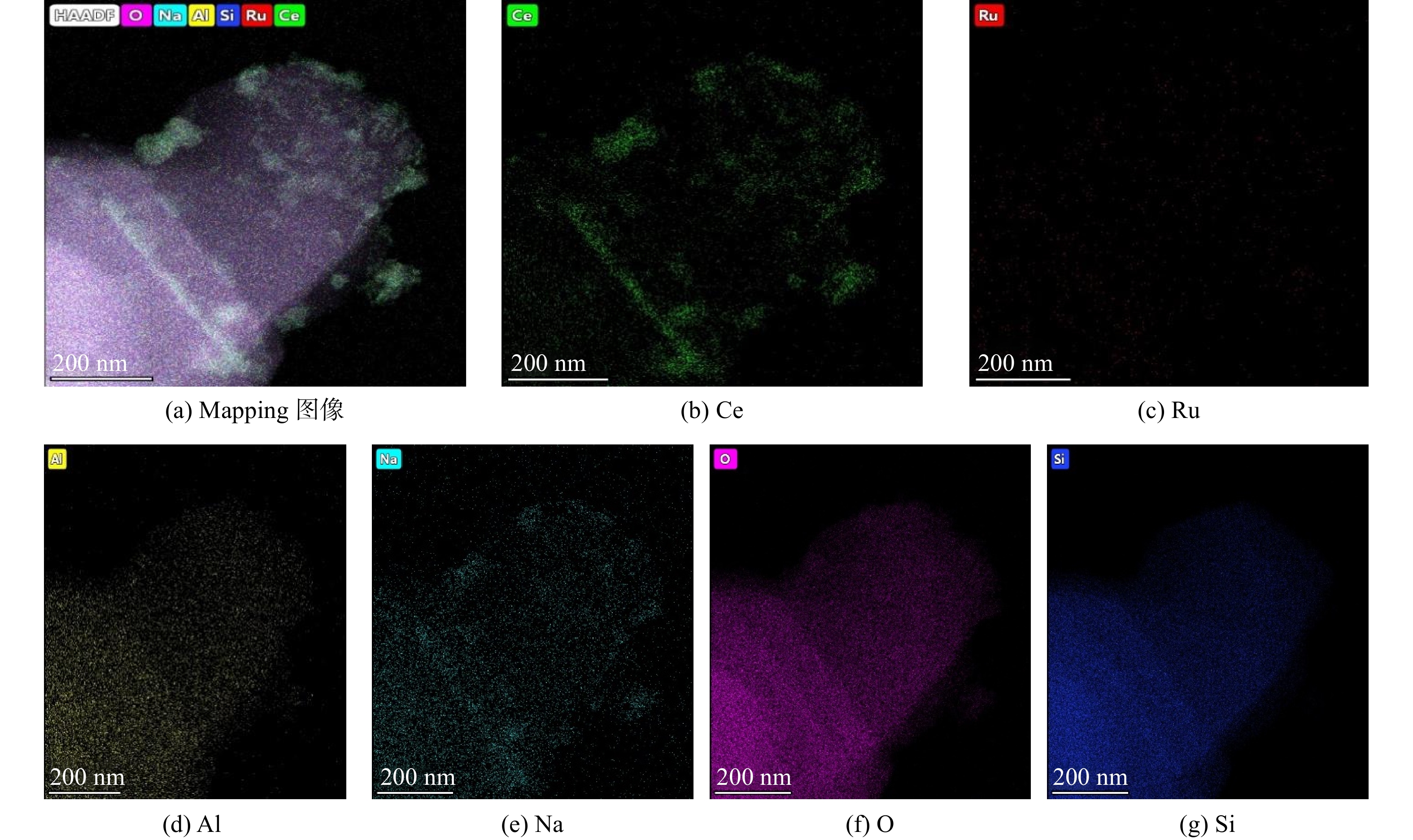
图4为Ru(1)/CZ催化剂的HAADF-STEM图像,展示了Ru(1.0)/CZ催化剂所有元素的分布情况。图4(b)为Ce元素在ZSM-5分子筛上的分布情况,说明Ce元素在整个催化剂表面均有分布,但以小团聚的状态分布,故团聚处斑点的亮度较明显。图4(c)展示了Ru元素的分布情况,表明Ru物种颗粒的尺寸较小,且在分子筛上分布均匀。因此,可推测图3中观察到的ZSM-5分子筛上成形的晶簇主要是由CeO2颗粒导致的。图4(d)~(g)分别为ZSM-5分子筛组成元素Al、Na、O和Si的分布情况。由于ZSM-5分子筛作为载体含量较多,其组成元素含量也较多,全部均匀呈现在mapping图中。
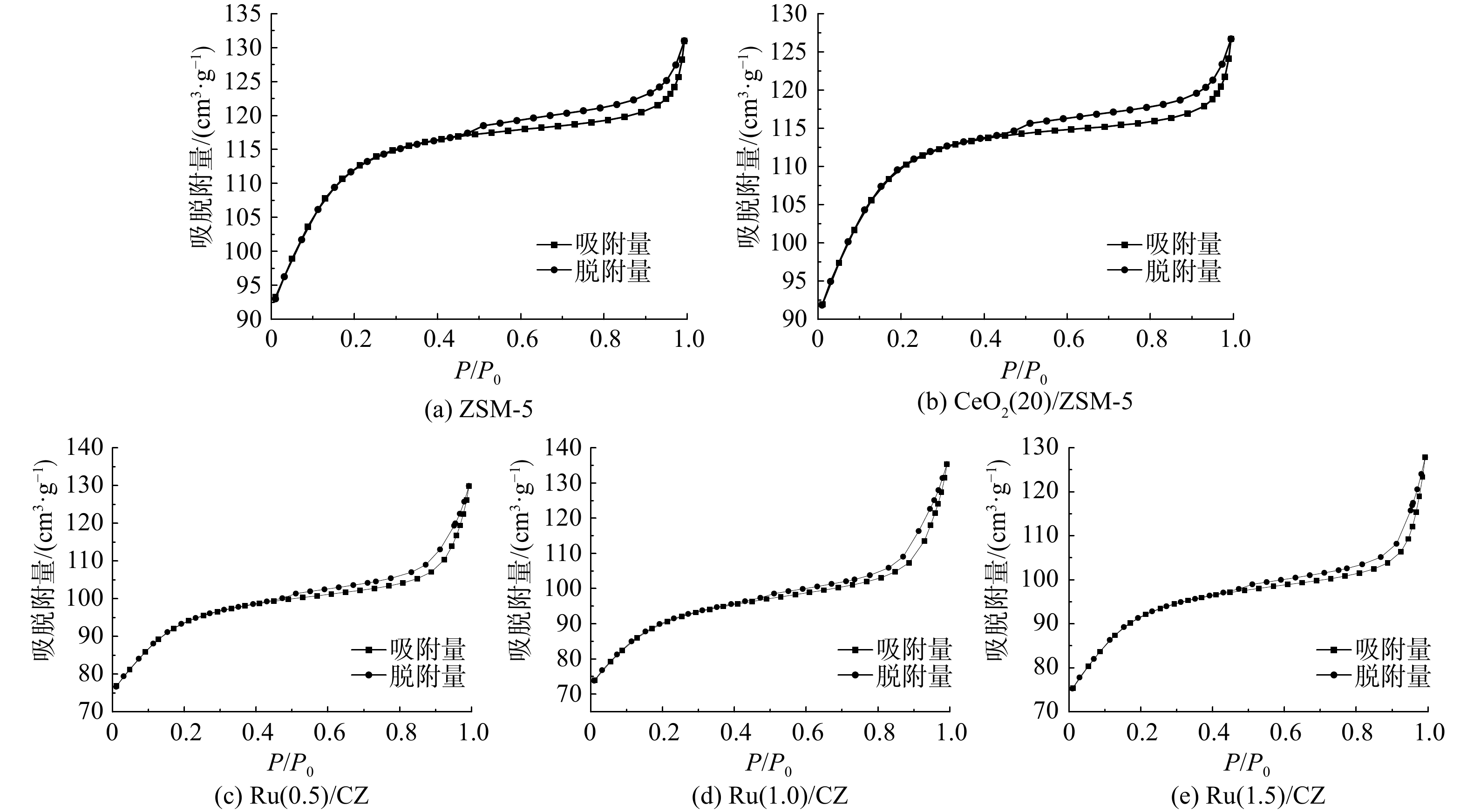
图5为不同Ru负载量的Ru/CZ催化剂的氮气吸附/脱附等温线和孔径分布曲线。表1为ZSM-5分子筛、CeO2(20)/ZSM-5和Ru/CZ系列催化剂的物理结构参数。CeO2(20)/ZSM-5催化剂中加入Ru元素后催化剂的吸附等温线呈现标准Ⅱ型。在P/P0<0.2时,Ru/CZ系列催化剂的吸附量陡然上升,说明吸附过程中存在微孔吸附。随着相对压力的变大,N2吸附量升高,表明样品受到压力影响,表面开始出现多层吸附。在相对压力(P/P0)约为0.48时,吸/脱附等温线H4型回滞环开始出现。这说明催化剂中存在层状结构的孔道并发生了毛细冷凝现象,即Ru/CZ系列催化剂中存在着介孔结构。Ru/CZ系列催化剂中绝大多数颗粒孔径为0~2 nm,平均孔径约为5 nm,与表1的孔径分布结果一致。3种不同Ru负载量的催化剂中,Ru(0.5)/CZ催化剂比表面积最大,为339.733 m2∙g−1;Ru(1.5)/CZ次之,为332.675 m2∙g−1;Ru(1.0)/CZ最小,为326.942 m2∙g−1。与空白ZSM-5分子筛对比可发现,Ru和Ce元素的负载会降低ZSM-5基底材料的比表面积,并堵塞材料的孔道结构。然而,比表面积下降得并不多,Ru/CZ系列催化剂仍具有较高的比表面积。这说明钌元素的加入并不会很大程度上影响材料的吸附性能。钌元素的负载使得催化剂材料的孔体积和孔径变大、比表面积变小,猜测可能是由于孔坍塌多个颗粒烧结形成一个颗粒。孔容孔径的增大可能会使得催化剂暴露更多活性位点,有利于增加反应物与催化剂的接触机会,且孔体积增大可能会使催化剂抗积碳和抗结焦能力变强。将Ru/CZ系列催化剂的物理结构参数互相比较可发现,Ru(1.0)/CZ催化剂的比表面积最小,但孔体积和平均孔径最大,3种催化剂的各项参数并没有随钌负载量的增加而发生线性变化。因此,通过BET表征并不能推测出Ru/CZ系列催化剂的催化活性大小。
-
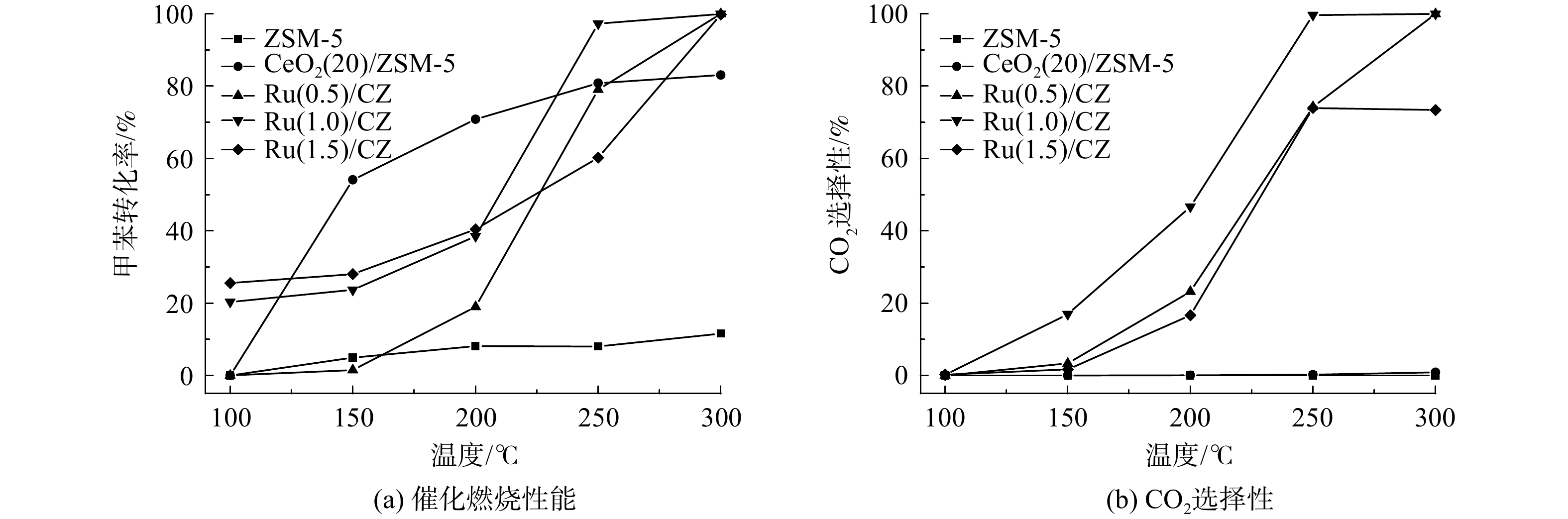
ZSM-5、CeO2(20)/ZSM-5和Ru/CZ系列催化剂的甲苯催化燃烧性能及CO2选择性如图6所示。催化剂的催化活性均随着反应温度的升高而有所提升,且Ru的负载显著提升了催化剂对甲苯的转化率,没有钌负载的CeO2(20)/ZSM-5催化剂在300 ℃时的最终转化率仅为82%。相比之下,有钌负载的Ru/CZ系列催化剂的转化率在同样的300 ℃下已达到100%。与此同时,结合图6和表2可知,Ru(0.5)/CZ催化剂、Ru(1.0)/CZ催化剂和Ru(1.5)/CZ催化剂的T50%值分别为225 ℃、210 ℃和245 ℃,T90%值分别为260 ℃、240 ℃和283 ℃。这表明Ru(1.0)/CZ催化剂在3者中具有最高的低温催化活性,可在240 ℃的低温条件下时就完全转化甲苯。虽然CeO2(20)/ZSM-5催化剂的整体催化转化甲苯效率不高且变化不大,但在低于225 ℃时,其催化甲苯的转化率要高于Ru/CZ系列催化剂,且由表1可知,钌负载后的催化剂比表面积降低,低于CeO2(20)/ZSM-5催化剂。在低温条件下,催化剂对甲苯的脱除效果中物理吸附占主导作用,高比表面积更有利于催化剂对甲苯的吸附。
另外,催化剂的CO2选择性均随反应温度的升高而升高。负载Ru的Ru/CZ催化剂最终催化燃烧甲苯的CO2选择性均可达到80%以上,而CeO2(20)/ZSM-5催化剂的CO2选择性随温度变化不大,且始终不足1%。这表明钌负载可提升CeO2(20)/ZSM-5催化剂催化甲苯使其降解成高浓度CO2的能力。对比Ru(0.5)/CZ催化剂、Ru(1.0)/CZ催化剂和Ru(1.5)/CZ催化剂的活性评价曲线发现:Ru(0.5)/CZ催化剂和Ru(1.0)/CZ催化剂均可将甲苯完全转化成CO2;Ru(1.0)/CZ催化剂在反应温度为240℃时CO2的选择性即可达到90%以上;Ru(0.5)/CZ催化剂在反应温度为300℃时CO2的选择性为100%;而Ru(1.5)/CZ催化剂在250℃和300℃时CO2的选择性均不到80%且相差不大。这说明Ru(1.0)/CZ催化剂CO2的选择性最优,Ru(0.5)/CZ催化剂其次,Ru(1.5)/CZ催化剂在3者中最差。
-
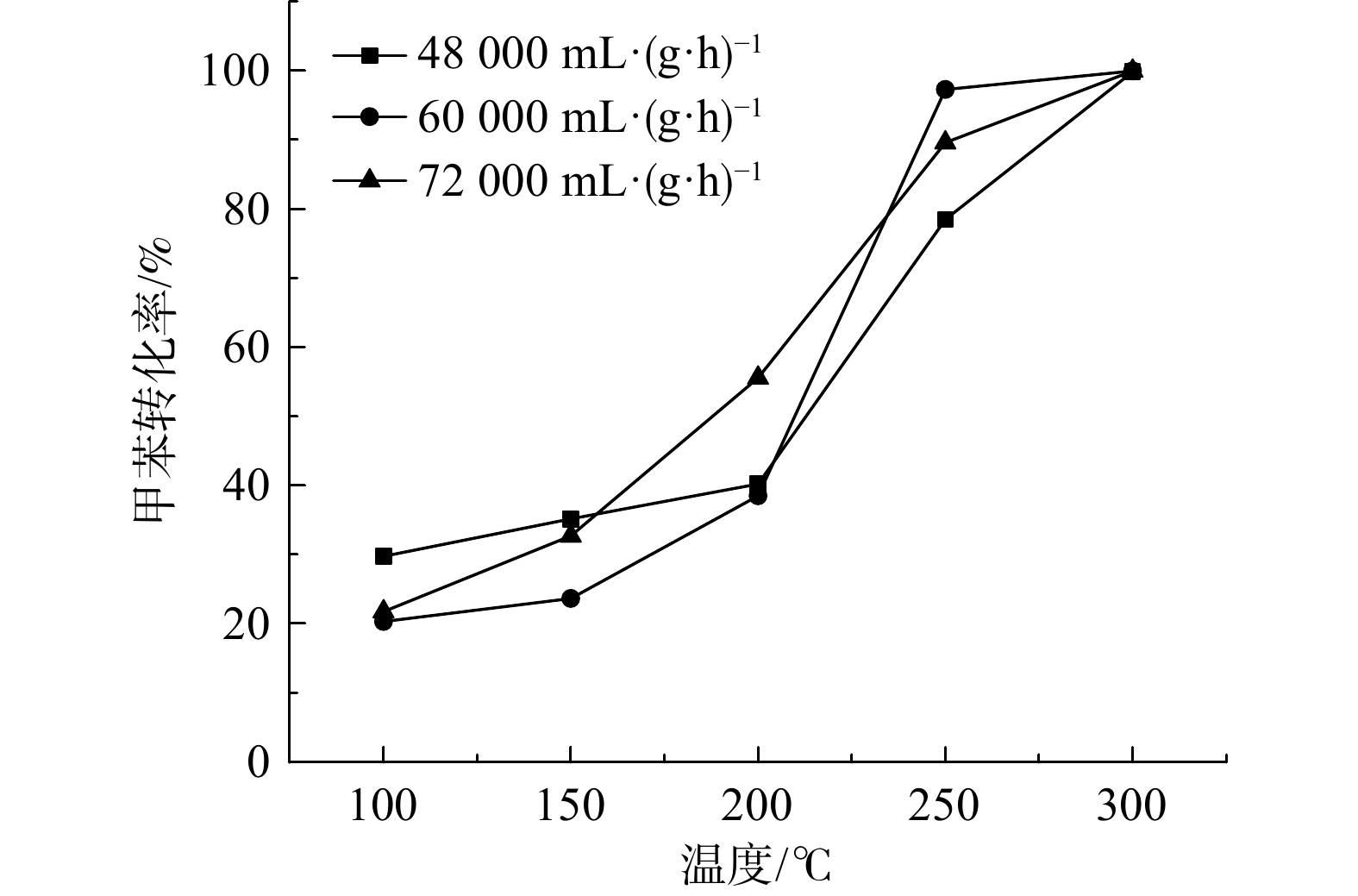
空速对甲苯催化氧化性能的影响如图7所示。在空速条件为60 000 mL·(g·h)−1时,Ru(1.0)/CZ催化剂可在反应温度为250 ℃时完全转化甲苯,而在48 000和72 000 mL·(g·h)−1空速条件下,Ru(1.0)/CZ催化剂要到300 ℃才可将甲苯100%转化。与此同时,反应温度在200 ℃以内、60 000 mL·(g·h)−1空速工况条件下,Ru(1.0)/CZ催化剂催化甲苯的转化率要低于48 000 mL·(g·h)−1空速条件下的转化率;在230 ℃以内60 000 mL·(g·h)−1空速工况下,甲苯的转化率始终低于72 000 mL·(g·h)−1空速条件下的转化率。以完全转化甲苯时的反应温度高低来衡量反应空速对催化剂催化性能的影响,60 000 mL·(g·h)−1的空速条件为最适宜条件。因此,较低空速48 000 mL·(g·h)−1和较高空速72 000 mL·(g·h)−1均不利于催化剂在较低温度下实现甲苯的完全转化。这可能是由于随着空速的增大,气体流速会增大,当反应温度上升时,反应器中气体状态更接近湍流,使得气流和样品接触更充分,反应效率变高。但反应速率同时受限于石英管的型制,又会一定程度上阻碍湍流的形成,空速过高会导致停留时间变短,平均反应效率变低。
-
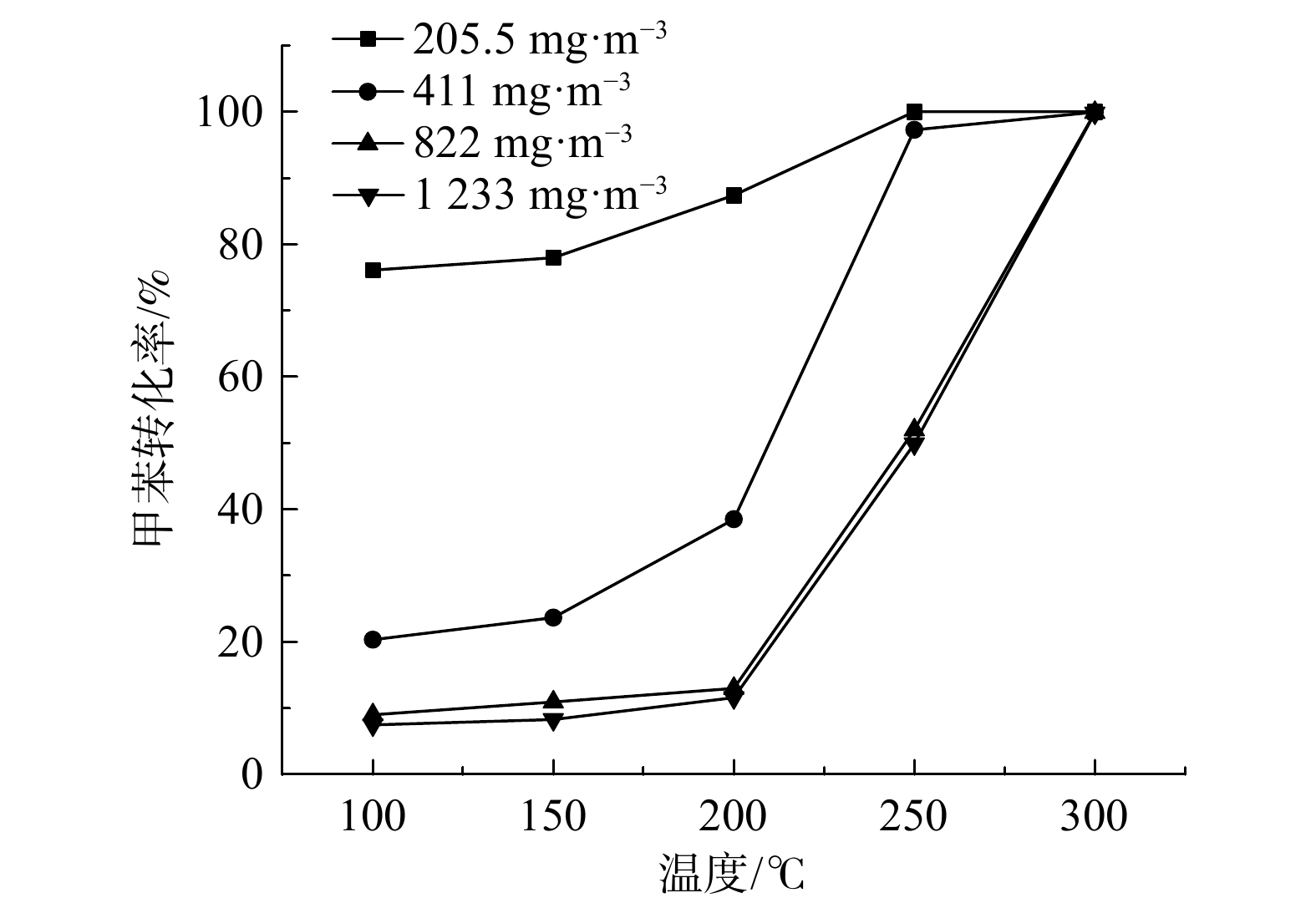
不同甲苯浓度下,Ru(1.0)/CZ催化剂催化燃烧甲苯性能如图8所示,Ru(1.0)/CZ催化剂催化燃烧甲苯的T50%和T90%如表3所示。在甲苯质量浓度为205.5~1 233 mg·m−3时,催化剂的活性随着甲苯质量浓度的升高而降低,转化率曲线逐步向高温移动。这表明在更高温度下才能发生更多的甲苯分子转化。4种不同甲苯质量浓度条件下的T90%分别为210 ℃、240 ℃、280 ℃和281 ℃。Ru(1.0)/CZ催化剂仅在210 ℃即可完全转化质量浓度为205.5 mg·m−3的甲苯,且此时催化剂催化氧化甲苯的T50%为125 ℃。而其余3种甲苯浓度T50%值均高于200 ℃,说明在进口甲苯质量浓度较低的情况下,Ru(1.0)/CZ催化剂表现出更优异的低温催化性能。另外,进口甲苯质量浓度从411 mg·m−3升至1 233 mg·m−3与205.5 mg·m−3升至411 mg·m−3的活性曲线相比,变化幅度较小。这可能是由于催化剂在反应器中的装填量为固定的,随着甲苯质量浓度的增大,甲苯分子数量增多,大量的甲苯分子吸附在催化剂表面还未来得及反应,就占据了部分活性位点,使得竞争吸附明显增强,即单位体积内Ru(1.0)/CZ催化剂表面的活性位点的数目一定,单位时间内相对能催化氧化的甲苯分子数减小,从而导致催化剂的活性降低。
-
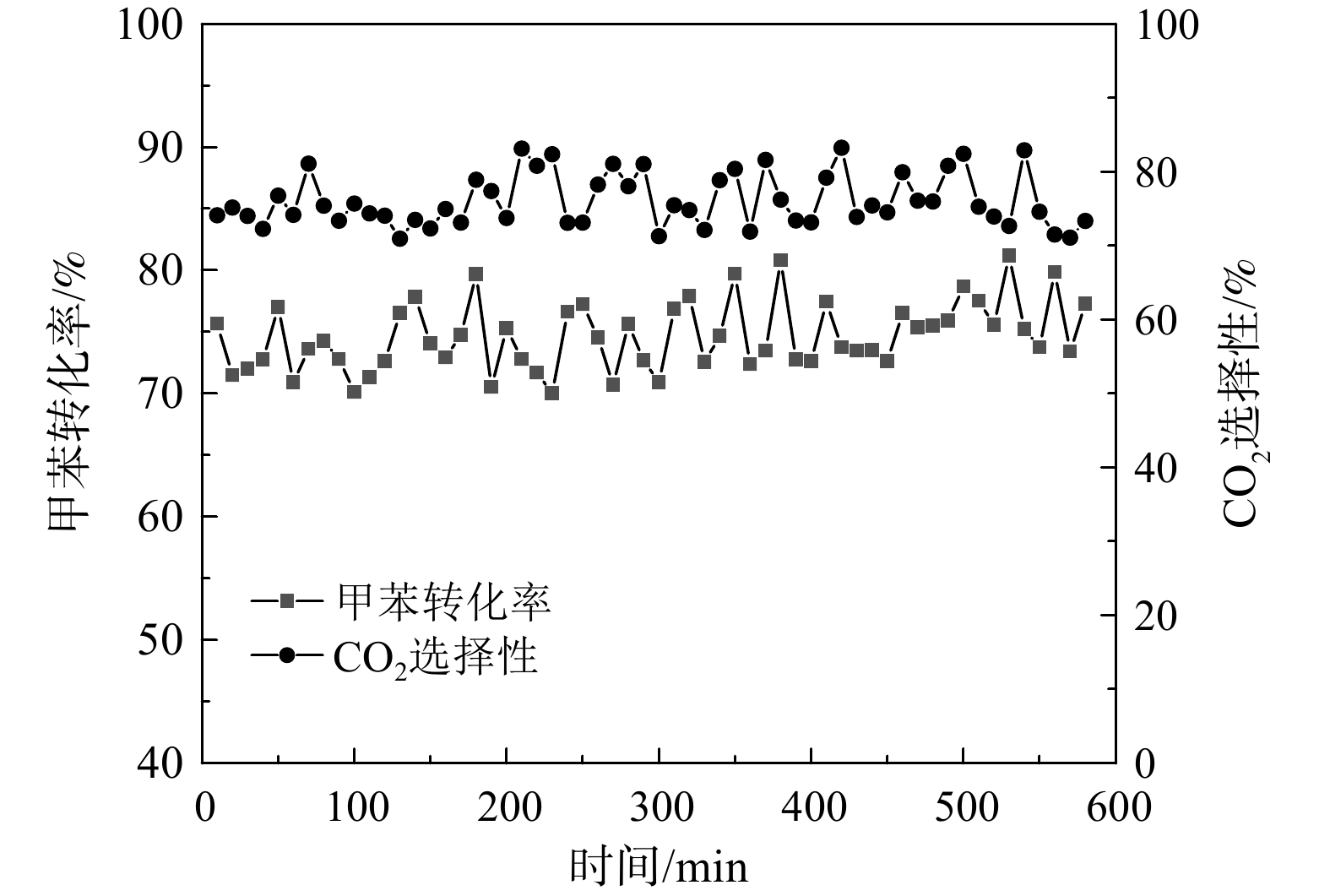
根据前述不同钌负载量对Ru/CZ催化剂催化燃烧甲苯的活性和CO2稳定性的研究结果,Ru(1.0)/CZ催化剂催化燃烧甲苯的活性最强,可在较低的240 ℃条件下完全转化甲苯,且CO2选择性较强,其催化燃烧甲苯不会有大分子副产物产生。因此,为进一步观察Ru(1.0)/CZ催化剂长时间反应条件下的稳定性和CO2选择性是否有改变,选取230 ℃的反应温度条件对催化剂进行活性稳定性评价,其测试结果如图9所示。Ru(1.0)/CZ催化剂催化燃烧甲苯稳定性研究的反应条件为:温度230 ℃,甲苯质量浓度为411 mg·m−3,质量空速为60 000 mL·(g·h)−1。在600 min内,Ru(1.0)/CZ催化剂的甲苯转化率为70%~80%,CO2选择性为70%~82%。转化率和CO2选择性的波动在仪器检测误差范围内。这说明该催化剂的稳定性良好,长时间运行没有失活表现。Ru(1.0)/CZ催化剂在230 ℃反应温度时的测试结果与图6对照一致。这说明Ru(1.0)/CZ催化剂催化燃烧甲苯活性评价的结果具有可重复性。
-
1) Ru的负载可提升CeO2(20)/ZSM-5催化剂催化甲苯使其降解成高浓度CO2的能力。
2) Ru(1.0)/CZ催化剂转换90%甲苯的温度低至210 ℃,并在较大空速和甲苯浓度范围内对甲苯具有优越的低温催化性能。
3) Ru(1.0)/CZ催化剂具有良好的稳定性及CO2选择性,长时间运行没有失活表现,具有在VOC处理领域开展工业化应用的潜力。
负载型钌铈催化剂的甲苯催化氧化性能
Catalytic oxidation of toluene by supported ruthenium-cerium catalyst
-
摘要: 以ZSM-5分子筛为载体,采用浸渍法制备了RuCe/ZSM-5催化剂,研究了催化剂在不同Ru负载量、空速、反应温度、甲苯浓度下对甲苯的催化氧化性能,并探讨了催化剂的CO2选择性及稳定性。结果表明:Ru的负载可提升CeO2(20)/ZSM-5催化剂催化甲苯使其降解成高浓度CO2的能力;Ru(1.0)/CZ催化剂表现出优异的低温催化性能、CO2选择性及稳定性,在210 ℃条件时即可转化90%的甲苯,且CO2选择性达到90%以上。本研究制备的催化剂在较大空速及甲苯浓度范围内对甲苯具有优越的低温催化性能,未来可应用于VOC的工业化处理应用中。
-
关键词:
- RuCe/ZSM-5 /
- 挥发性有机物 /
- 甲苯 /
- 催化氧化
Abstract: RuCe/ZSM-5 catalysts were prepared by impregnation method with ZSM-5 molecular sieve as support. The catalytic oxidation performances of the catalyst of toluene were studied under different Ru loadings, space velocities, reaction temperatures, toluene concentrations. The CO2 selectivity and stability were also discussed. It was indicated that Ru doping could improve the catalytic ability of CeO2(20)/ZSM-5 for toluene degradation into high concentration of CO2. The Ru(1.0)/CZ catalyst exhibited excellent low-temperature catalytic performance, CO2 selectivity and stability. 90% toluence can be converted at 210℃, and the CO2 selectivity reached more than 90%. The catalyst prepared in this study showed superior catalytic oxidation performance to toluene at low temperature in a large space velocity and and toluene concentration range, and can be potentially used in processing VOC industrial applications.-
Key words:
- RuCe/ZSM-5 /
- volatile organic compounds /
- toluene /
- catalytic oxidation
-
人工湿地(constructed wetlands,CWs)被认为是处理废水的低成本技术,其较低的建设和运营成本、便利的管理和高效的去除氮磷效率适合低浓度水平污染物的去除,能够较好地削减水体的污染物负荷,同时还具有良好的生态效应[1-2],已经广泛应用于污水处理。在人工湿地中,氮磷平衡是分析氮磷去除途径和评估各自去除贡献的常用方法[3]。人工湿地氮磷的去除途径主要是通过植物、基质和微生物的物理、化学和生物作用完成的[4]。WU等[5]发现,表面流人工湿地中植物同化吸收氮、磷的能力分别为8.46%~30.98%和0.46%~2.13%。LU等[6]指出,表面流人工湿地基质填料的吸附、截留、交换等作用去除水中磷的比例大约为26%。ZHANG等[7]发现,微生物的硝化反硝化作用是人工湿地去除废水中TN(66.9%~80.5%)的主要途径。
人工湿地植物不仅具有美学价值,还显示出对污染物的去除作用,它通过提供理想的附着位点来调节微生物群落,且根系分泌物可加速异养反硝化细菌的生长,增加微生物群落丰富度和多样性[8],有利于水中氮磷去除。DU等[9]发现,植物的种植增加了微生物的丰富度和生物多样性;同时,相关的反硝化属假单胞菌、不动杆菌、根瘤菌、芽孢杆菌和红假单胞菌丰度的增加,增强了微生物对氮的去除作用。HE等[10]发现,γ-变形菌、α-变形菌和β-变形菌是人工湿地基质中的主要细菌,并在减少硝酸盐和亚硝酸盐的功能上发挥了重要作用。DU等[11]发现,植物的种植改变了垂直流人工湿地微生物的组成,并指出假单胞菌属可能是微生物除磷吸附的主要参与者。但是,现有的研究缺少了人工湿地污染物去除途径和微生物群落相结合的分析,以及植物的种植对微生物群落以及微生物氮磷净化作用的影响分析。因此,为了系统地研究人工湿地净化机制和人工湿地处理效果与微生物群落之间的关系,采用5种人工湿地系统种植不同植被用于处理低浓度污水,通过人工湿地的氮磷平衡和高通量测序相结合的手段,研究种植不同植物的人工湿地系统氮磷净化效果差异、污染物的去除途径以及微生物群落的变化,并探讨了植物的种植对微生物群落和微生物氮磷净化作用的影响,以期为提高人工湿地对污水的净化效果提供参考。
1. 材料与方法
1.1 人工湿地装置与运行
人工湿地装置位于重庆大学校内,采用100 L的LLDPE桶(上口直径520 mm,下口直径430 mm,高度610 mm),湿地填料为沸石(粒径为2~5 mm),铺设高度为30 cm,湿地水深为20 cm。设置5组人工湿地实验,分别为无植物组(Ⅰ组)、黄菖蒲组(Ⅱ组)、水生美人蕉组(Ⅲ组)、梭鱼草组(Ⅳ组)和风车草组(Ⅴ组),植物的种植密度为30株·m-2,每组设置3个平行实验。
正式实验日期为2018-07-03—2018-09-30,水温维持在23.4~32.2 ℃。实验分为2个阶段:第1阶段(2018-07-03—2018-09-14),为低负荷阶段(COD=(45±5) mg·L−1、
NH+4 -N=(3.56±0.48) mg·L−1、TN=(5.18±0.30) mg·L−1、TP=(0.425±0.044) mg·L-1);第2阶段(2018-09-14—2018-09-30),为高负荷阶段(COD=(45±5) mg·L−1、NH+4 -N=(6.06±0.16) mg·L−1、TN=(8.15±0.18) mg·L−1、TP=(0.806±0.035) mg·L−1)。采用间歇性进水的方式,水力停留时间3 d后,收集水样用于后续的分析并排出湿地的污水,通入新配制的污水。实验中及时对实验植物进行维护,对死亡的植物用生长良好的备用植物替换。1.2 水质指标分析方法
在实验期间,每3 d对人工湿地的进、出水进行取样分析。其中,温度、pH、DO通过溶解氧仪(520M-01A,Thermo,USA)和pH计(8107UWMMD,Thermo,USA)测量。
NH+4 -N采用纳氏试剂分光光度法测定,TN采用过硫酸钾氧化-紫外分光光度法测定,TP采用钼酸铵分光光度法测定。1.3 基质和植物相关指标分析方法
在实验开始和结束阶段,采用梅花取样法分3层采样,然后将收集的各层基质混匀,采用H2SO4-H2O2溶液消解,采用半微量凯氏法测定全氮,用钼锑抗比色法测定全磷。在低负荷实验结束阶段,收集植物根系附近的基质样品,并置于无菌密封袋中,基质样品用于分析微生物群落结构,并储存在−80 ℃,直至DNA提取。在实验的开始和结束时测定湿地中植物的湿重,挑选代表性的植株样品在105 ℃下干燥10 min,以灭活植物中酶的活性,然后在70 ℃下干燥12 h,测定干重。将植物粉碎成粉末,混合均匀并密封保存,采用H2SO4-H2O2溶液消解,采用半微量凯氏法测定全氮,用钼锑抗比色法测定全磷。
1.4 高通量测序分析方法
通过OMEGA Soil DNA试剂盒提取根系基质样品中微生物DNA。使用通用细菌引物16S rRNA的5′-ACTCCTACGGGAGGCAGCAG-3′和5′-GGACTACHVGGGTWTCTAAT-3′(V3~V4区)对提取的DNA进行PCR扩增。PCR扩增条件:98 ℃(3 min)初始变性,然后进行25个循环,98 ℃变性30 s,50 ℃退火30 s,72 ℃延伸30 s,最后5 min延伸至72 ℃。将所有序列读数聚类到操作分类单位(OTU)(相似性阈值为97%)。高通量测序服务由上海美吉生物平台提供(上海,中国)。
1.5 人工湿地氮磷平衡计算方法
氮的去除是由植物吸收、基质吸附、微生物硝化-反硝化作用和NH3的挥发决定的,因为进水中氨氮相对较低并且pH为中性,NH3的挥发可忽略不计[12]。磷的去除由植物吸收、基质吸附和微生物作用决定。
基质总氮和总磷积累速率的计算见式(1)。
ηSR=(CSC1−CSC0)MSA−1t−1 (1) 式中:ηSR为基质的总氮和总磷积累速率,mg·(m2·d)−1;CSC0和CSC1为实验开始和结束时基质的总氮和总磷含量,mg·kg−1;MS为基质的质量,kg;A为湿地面积,m2;t为实验总运行时间,d。
植物总氮和总磷吸收速率的计算见式(2)。
ηPR=(CPC1M1,1−CPC0M1,0)A−1t−1 (2) 式中:ηPR为植物的总氮和总磷吸收速率,mg·(m2·d)−1;CPC0和CPC1为实验开始和结束时植物的总氮和总磷含量,mg·kg−1;M1,0和M1, 1为实验开始和结束时植物的干重,kg;A为湿地面积,m2;t为实验总运行时间,d。
微生物总氮和总磷去除速率的计算见式(3)。
ηMR=n∑i=1(Ci,0V−Ci,1V)A−1t−1−ηSR−ηPR (3) 式中:ηMR、ηSR和ηPR为微生物、基质和植物的总氮和总磷去除速率,mg·(m2·d)−1;Ci, 0和Ci, 1为每次进水和出水总氮和总磷浓度,mg·L−1;V为每次进水的水量,L;A为湿地面积,m2;t为实验总运行时间,d。
1.6 统计分析
用单因素方差分析(One-way ANOVA)进行差异性分析,检验数据间的差异性。用Pearson检验方法进行相关性分析,检验数据间的相关水平。所有统计分析均使用SPSS 22.0版软件进行,并且在P<0.05水平时被认为是显著的。
2. 结果与讨论
2.1 人工湿地对污水中氮磷的净化效果
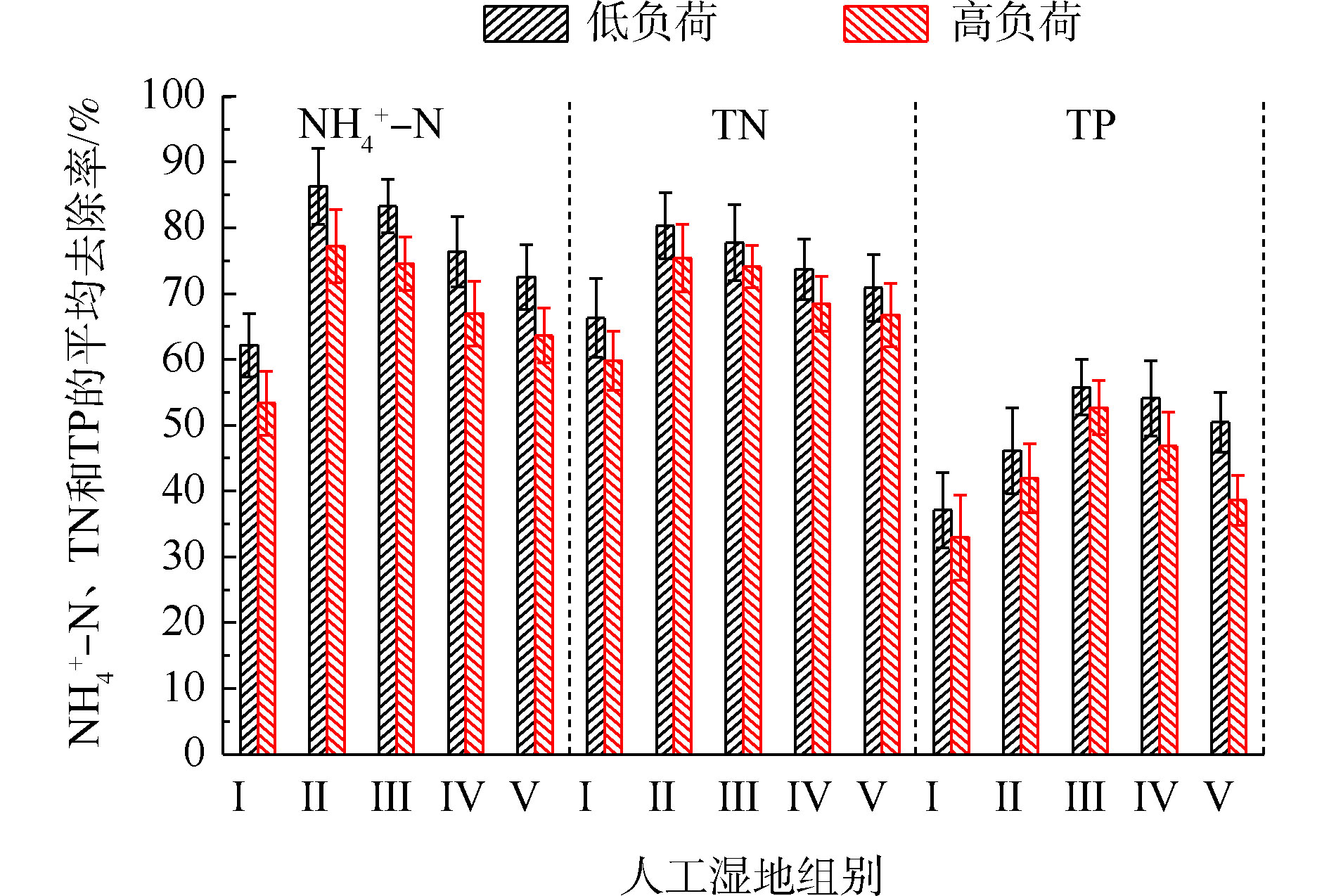
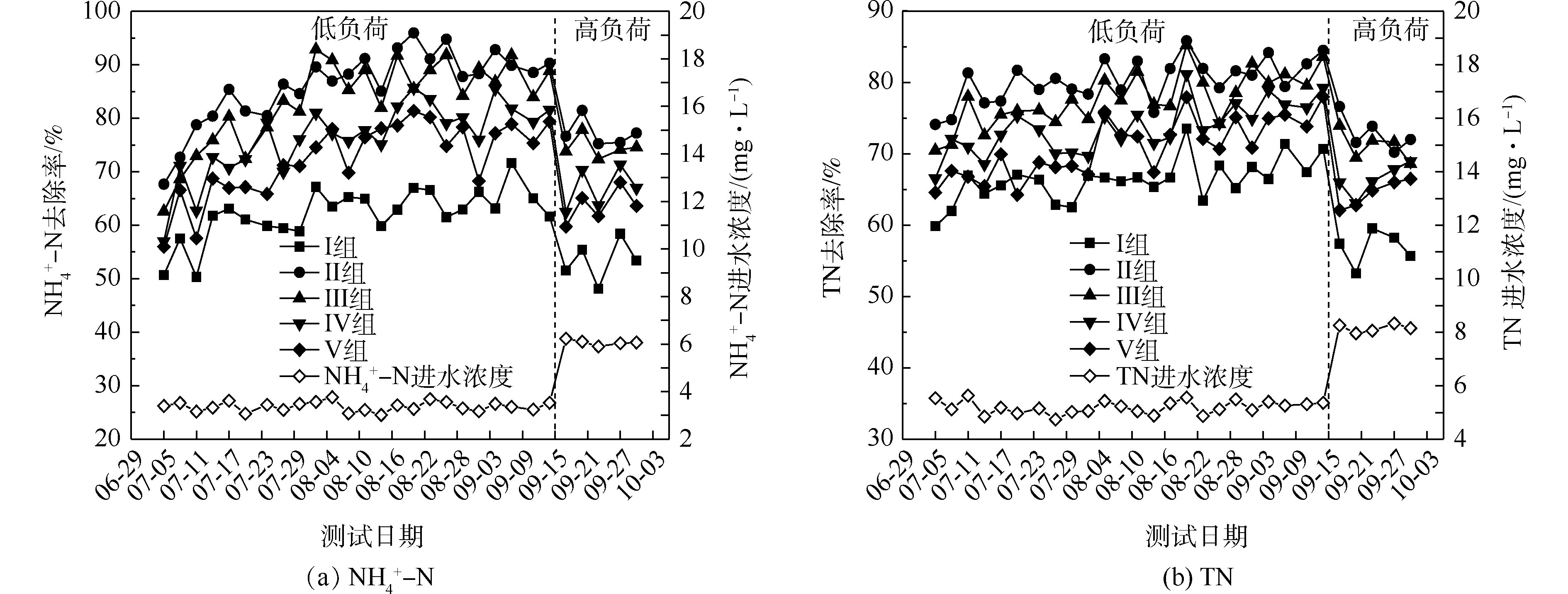
氮的去除率随取样时间的变化情况如图1所示。5组人工湿地系统都能有效地去除水中氨氮和总氮。在低负荷测试期间,
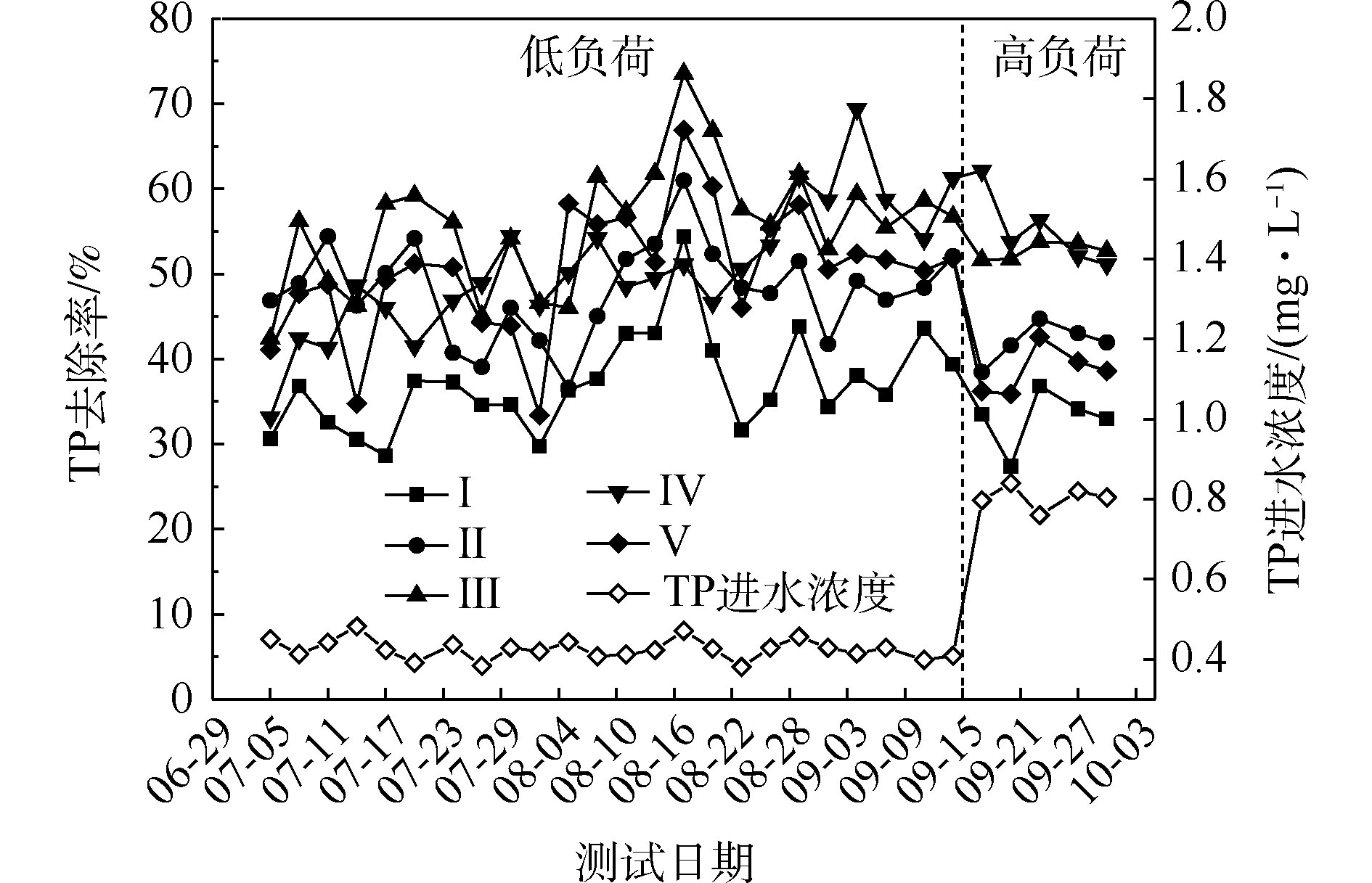
NH+4 -N的去除率为50%~94%,Ⅱ组(黄菖蒲)的去除率最高。如图2所示,Ⅰ组、Ⅱ组、Ⅲ组、Ⅳ组和Ⅴ组的平均去除率分别为62.16%、86.31%、83.28%、76.38%和72.51%。在低负荷测试期间,TN的去除率为59%~85%,Ⅱ组(黄菖蒲)表现出最高的去除性能。如图2所示,Ⅰ组、Ⅱ组、Ⅲ组、Ⅳ组和Ⅴ组的平均去除率分别为66.29%、80.30%、77.71%、73.68%和70.89%。夏季的人工湿地有高NH+4 -N和TN去除率,这与ZHANG等[13]的研究结论相似。在高负荷期间,各组NH+4 -N去除率均降低了9%~11%,TN去除率均降低了3%~8%,说明随着氮浓度的升高,氮的去除率会降低。NH+4 -N和TN表现出相似的去除趋势,这是因为NH+4 -N是进水中氮的主要来源,NH+4 -N经过硝化-反硝化作用去除,说明人工湿地有较强的反硝化作用。通过种植植物组与Ⅰ组比较发现,对NH+4 -N和TN去除有显著差异(P<0.05)。这是因为NH+4 -N容易被植物吸收和利用[14]以及植物的种植改变了基质微生物群落。磷的去除率随取样时间的变化情况如图3所示。5组人工湿地系统都能有效地去除水中总磷。在低负荷测试期间,TP的去除率为28%~73%,种植Ⅲ组(美人蕉)表现出最高的去除性能。如图2所示,Ⅰ组、Ⅱ组、Ⅲ组、Ⅳ组和Ⅴ组的平均去除率分别为37.09%、46.12%、55.77%、54.07%和50.45%。在高负荷期间,各组TP去除率均降低了3%~12%,说明随着TP浓度的升高,TP的去除率降低。通过种植植物组与Ⅰ组比较发现,TP的去除率显著提高(P<0.05)。这是因为植物生长过程中能吸收和利用磷酸盐,提高了TP的去除率[15]。
实验期间,进水和出水的pH、DO和水温T的平均值如表1所示。与进水DO相比,各组出水DO浓度都下降了1.80~2.64 mg·L−1。这是因为微生物去除COD和氨氧化过程中消耗了水体中的DO。另外,种植植物组比Ⅰ组DO要高,这是由于植物根系有泌氧功能,从而导致水体中DO浓度的增加。Pearson检验表明,DO与pH呈显著正相关(相关系数为0.923,P<0.05)。这是因为植物的光合作用会影响水体的碳酸电离平衡,导致氢氧根离子的浓度增加[16]。DO与
NH+4 -N去除率不存在相关性(P>0.05)。这可能与各组植物吸收作用和根系富集微生物群落不同有关。表 1 人工湿地进出水的参数Table 1. Characteristics of the influent and effluent in CWs组别 pH DO/(mg·L−1) 水温T/℃ 进水 7.73±0.25 5.12±1.22 27.63±2.31 Ⅰ组出水 7.11±0.31 2.48±0.32 27.42±2.68 Ⅱ组出水 7.22±0.13 2.74±0.45 27.11±2.12 Ⅲ组出水 7.29±0.23 2.93±0.34 26.66±2.78 Ⅳ组出水 7.36±0.18 3.32±0.51 26.87±2.43 Ⅴ组出水 7.33±0.29 3.12±0.41 27.23±2.92 2.2 人工湿地氮磷平衡分析
2.2.1 基质和植物的氮磷去除速率
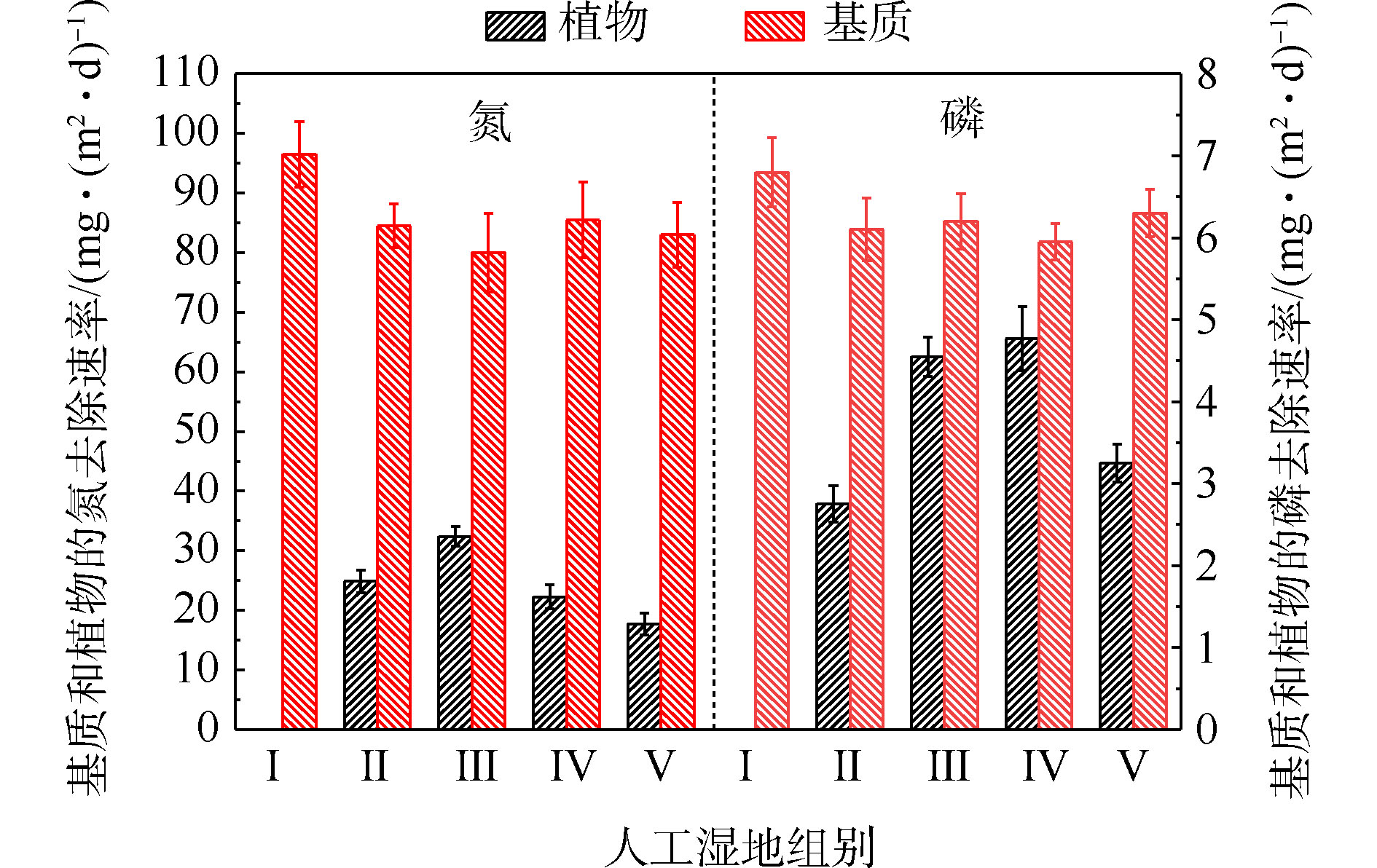
基质的氮磷平均积累速率如图4所示。由图4可知,Ⅱ组(84.46 mg·(m2·d)−1)、Ⅲ组(80.11 mg·(m2·d)−1)、Ⅳ组(85.53 mg·(m2·d)−1)和Ⅴ组(83.04 mg·(m2·d)−1)平均TN积累速率显著低于Ⅰ组(96.52 mg·(m2·d)−1)(P<0.05)。Ⅱ组(6.10 mg·(m2·d)−1)、Ⅲ组(6.21 mg·(m2·d)−1)、Ⅳ组(5.95 mg·(m2·d)−1)和Ⅴ组(6.42 mg·(m2·d)−1)平均TP积累速率低于Ⅰ组(6.81 mg·(m2·d)−1)( P <0.05)。这说明人工湿地中种植植物会降低基质中氮磷的积累速率,并与植物吸收和基质吸附2个氮磷积累过程存在竞争关系有关。种植植物组间的基质氮磷积累效果差异,与不同的植物具有不同生长状况有关[8]。
植物的氮磷平均吸收速率如图4所示。可以看出,平均氮吸收速率Ⅲ组(32.41 mg·(m2·d)−1)>Ⅱ组(24.87 mg·(m2·d)−1)>Ⅳ组(22.24 mg·(m2·d)−1)>Ⅴ组(17.73 mg·(m2·d)−1),平均磷吸收速率Ⅳ组(4.77 mg·(m2·d)−1)>Ⅲ组(4.55 mg·(m2·d)−1)>Ⅴ组(3.25 mg·(m2·d)−1)>Ⅱ组(2.75 mg·(m2·d)−1)。结果表明,水生美人蕉的氮吸收速率最高,梭鱼草的磷吸收速率最高。植物的氮磷平均吸收速率不同,与植物干重增加量、植物体内氮磷含量不同有关。
2.2.2 人工湿地氮磷平衡
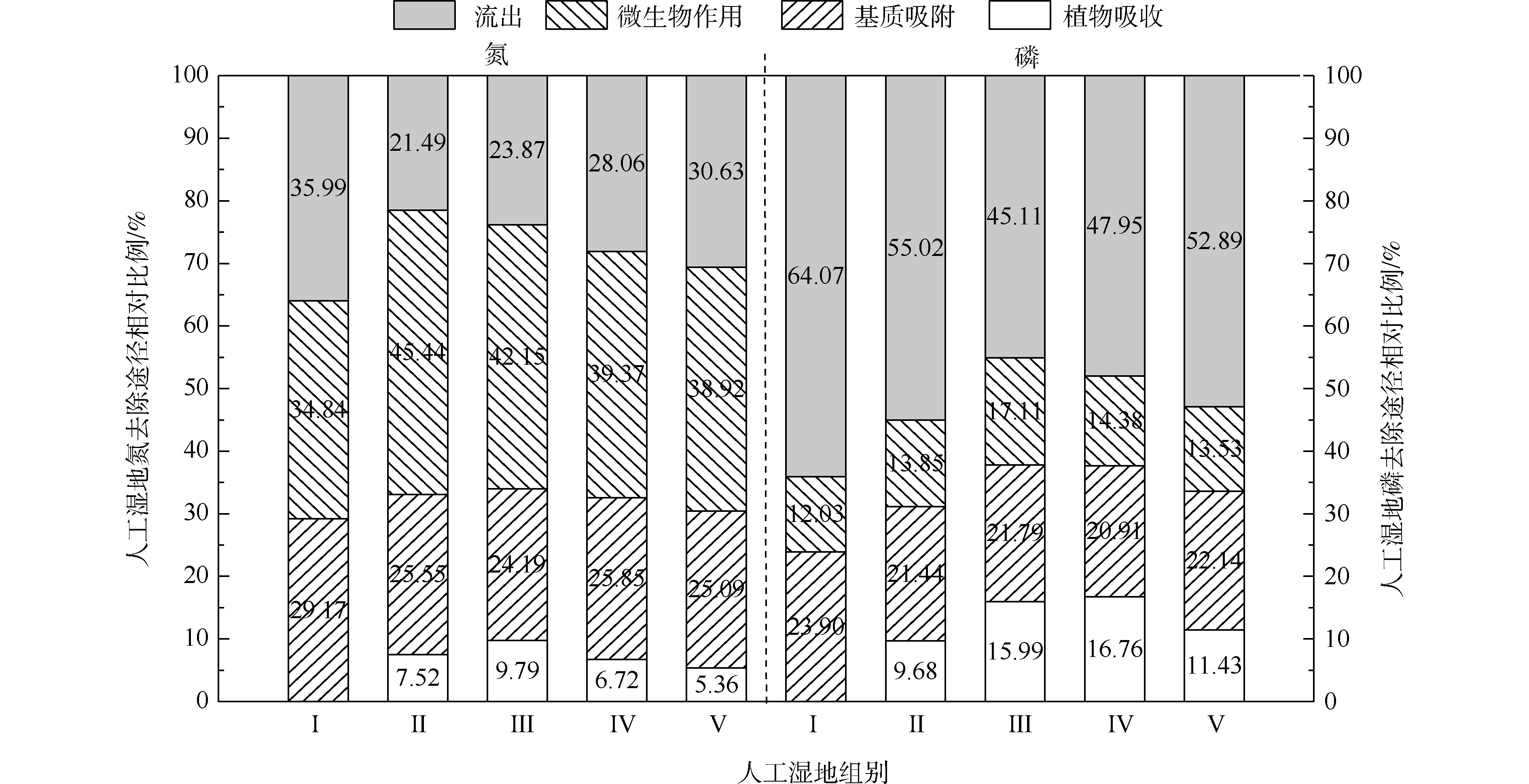
人工湿地水体氮磷的去除主要通过基质、植物、微生物和排水4种途径,各组人工湿地的基质、植物、微生物和排水的氮磷去除率占比如图5所示。在5个不同的实验组中,系统排水中的氮含量占总负荷的23.87%~35.99%,植物吸收的氮约占5.36%~9.79%,基质吸附氮约占24.19%~29.17%,系统微生物去除氮约占34.84%~45.44%。在氮的去除方面,微生物去除>基质吸附>植物吸收的作用。植物吸收氮仅占5.36%~9.79%,说明植物对水中氮直接吸收作用很小。郑于聪[17]研究了中试规模的人工湿地处理污水发现,植物对水中氮的去除贡献仅占5.80%~13.90%,即植物对污水中氮的去除贡献很小,与本实验的结果相似。微生物去除氮约占34.84%~45.44%,说明微生物作用是人工湿地氮去除的最主要的途径。通过与Ⅰ组比较,发现种植植物组微生物氮去除率明显增加(P<0.05)。这可能与植物根系分泌物能改善微生物生长环境,有利于反硝化微生物的附着生长有关。植物的种植不仅对氮有吸收作用(5.36%~9.79%),还增强了微生物对氮的去除作用(增加了4.08%~10.60%)。
在5个不同的实验组中,系统排水中的磷含量占总负荷的45.10%~64.07%,植物吸收的磷约占9.68%~16.76%,基质吸附磷约占20.91%~23.90%,系统微生物去除磷约占12.73%~17.11%。在磷的去除方面,排水中的磷含量达到45.10%~64.07%,说明人工湿地对总磷去除效果较差。这可能与TP浓度低和运行条件不利于人工湿地对其去除有关。基质吸附比植物吸收和微生物作用对磷去除作用强,说明了基质吸附是人工湿地中磷去除的主要途径。植物吸收磷仅占9.68%~16.76%,说明植物对水中磷直接吸收作用很小。吴海明[18]研究中试湿地处理污水发现,植物吸收的磷仅占湿地中磷总去除量的4.81%~22.23%。沈莹等[19]研究中试潜流湿地处理污染河水发现,植物的磷吸收量占湿地磷去除量的8.80%。以上研究均发现,植物对湿地中磷去除的贡献较小,与本实验有相似的结论。通过与Ⅰ组比较,种植植物组微生物磷去除率出现增加现象,Ⅲ组与各组有显著差异。这是因为植物根系分泌物的不同影响了基质中微生物群落分布[20]。植物的种植不仅对磷(9.68%~16.76%)有吸收作用,还增强了微生物对磷(增加了1.82%~5.08%)的去除作用。
2.3 人工湿地微生物群落分析
2.3.1 微生物序列和多样性分析
微生物多样性和丰富度如表2所示。各组湿地微生物测序中样本文库覆盖率(coverage)均大于0.98,说明测序结果可以很好地代表样本的真实情况[21]。Ⅰ组、Ⅱ组、Ⅲ组、Ⅳ组和Ⅴ组检测到的OTU数目分别为1 441、1 736、1 594、1 464和1 478,Ace分别为1 770.18、2 004.13、1 747.37、1 754.82和1 672.91,Chao分别为1 754.28、2 063.44、1 772.99、1 806.11和1 705.38,发现了Ⅱ组与其他组有明显差异(P<0.05),说明黄菖蒲的种植改善了微生物丰富度。Ⅰ组、Ⅱ组、Ⅲ组、Ⅳ组和Ⅴ组的Shannon指数为4.99、6.38、6.01、5.79和5.59,Simpson指数为0.024 5、0.003 3、0.006 7、0.011 0和0.020 8,植物组与Ⅰ组有明显差异(P<0.05)。其中Ⅱ组和Ⅲ组的多样性最高,说明种植植物能有效地改善群落多样性。植物种植改善了微生物群落多样性和丰富度,这与植物根系泌氧和根系分泌的碳源有利于微生物富集生长有关[22]。另外,通过逐步线性回归分析发现,Shannon和Sobs决定系数分别为0.828和0.208(P<0.05)。说明微生物丰富度和多样性的改善有利于微生物对氮的去除作用。
表 2 人工湿地微生物多样性和丰富度Table 2. Microbial diversity and richness in samples of CWs组别 测序数量/个 多样性指数 丰富度指数 覆盖率 Shannon Simpson Sobs Ace Chao Ⅰ 37 707 4.99 0.024 5 1 441 1 770.18 1 754.28 0.985 Ⅱ 42 513 6.38 0.003 3 1 736 2 004.13 2 063.44 0.986 Ⅲ 74 434 6.00 0.006 7 1 594 1 747.37 1 772.99 0.994 Ⅳ 38 033 5.79 0.011 0 1 464 1 754.82 1 806.11 0.982 Ⅴ 49 548 5.59 0.020 8 1 478 1 672.91 1 705.38 0.991 2.3.2 微生物门、纲分类水平组成差异分析
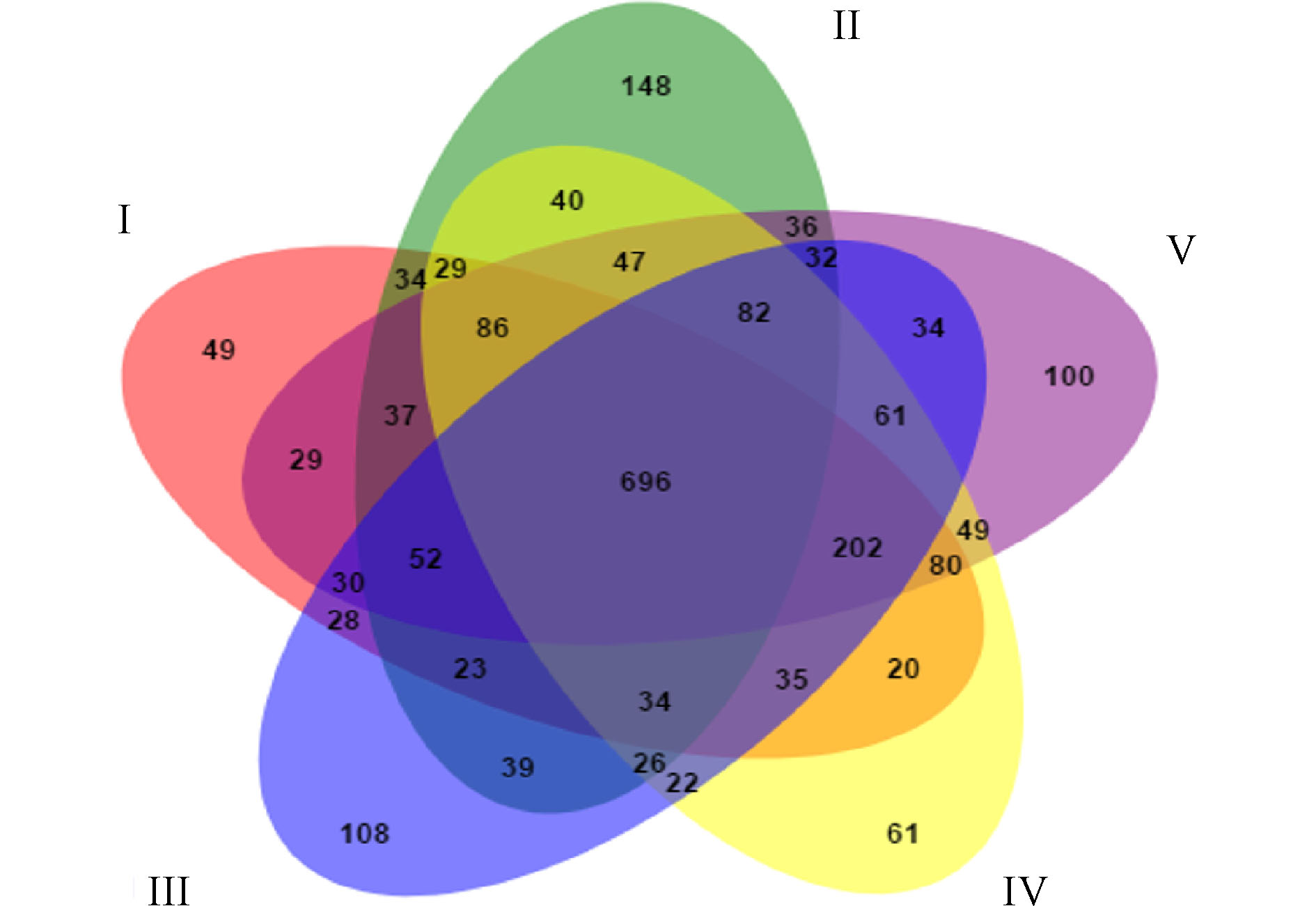
图6展示了人工湿地各组微生物独有和共有的OTU数目。5组中共有的OTU数目为696,分别占Ⅰ组、Ⅱ组、Ⅲ组、Ⅳ组和Ⅴ组检测到的OTU数目的48.33%、40.09%、43.66%、47.54%和47.09%,说明人工湿地基质微生物群落出现了显著的变化。这是因为植物根系改变了微生物生长的环境,使得微生物群落出现差异。
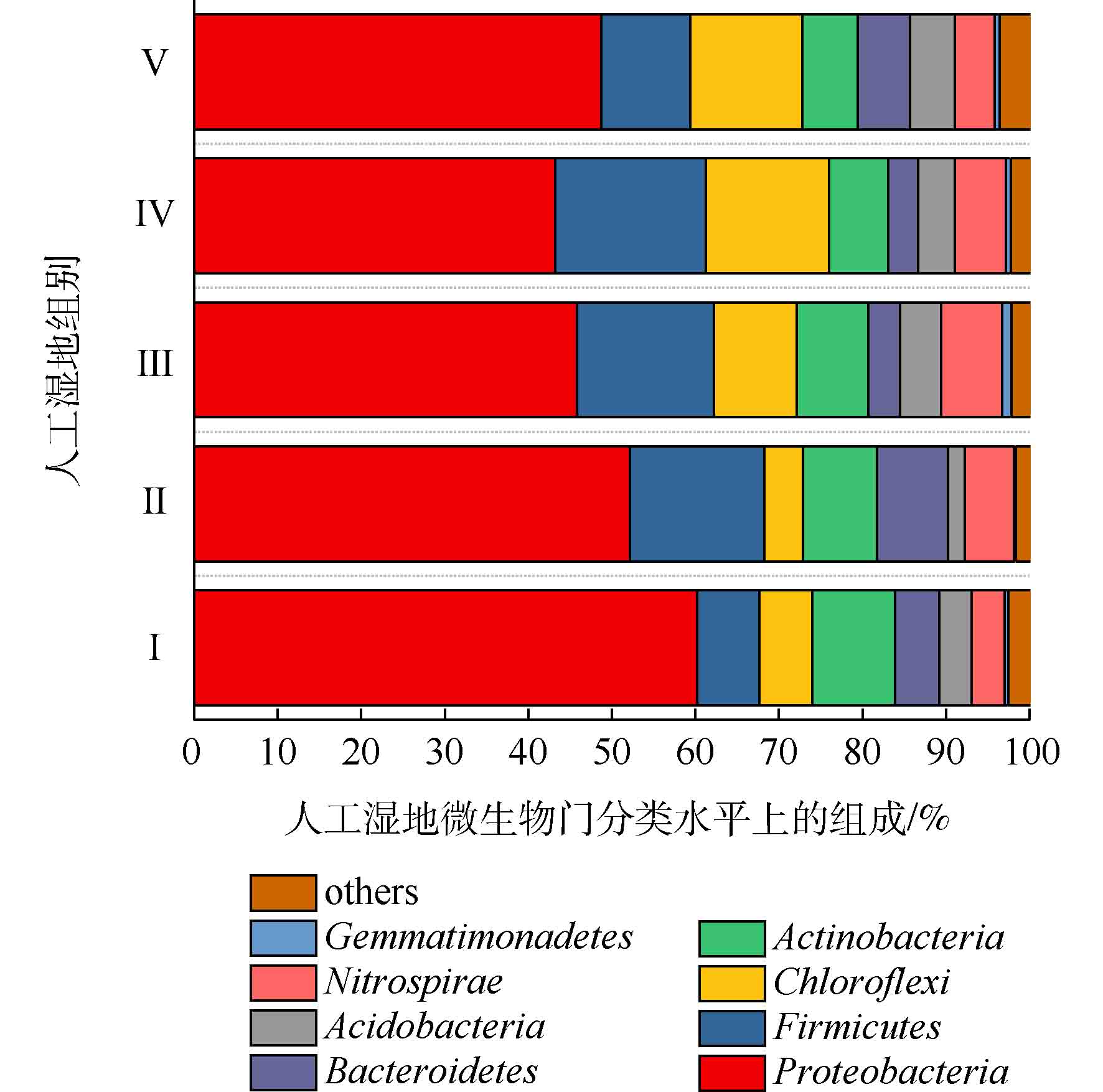
人工湿地各组微生物门水平组成如图7所示。可将微生物检测频率>1%的菌门做为主要的菌门[23]。共发现8个菌门,分别为变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、绿弯菌门(Chloroflexi)、放线菌门(Actinobacteria)、硝化螺旋菌门(Nitrospirae)、拟杆菌门(Bacteroidetes)、酸杆菌门(Acidobacteria)和芽单胞菌门(Gemmatimonadetes)。其中5大优势菌门分别为变形菌门、厚壁菌门、绿弯菌门、放线菌门和硝化螺旋菌门。ZHANG等[24]研究三亚河红树林湿地发现,湿地基质的优势菌门为变形菌、拟杆菌、放线菌和厚壁菌。LI等[25]研究发现,多级表面流湿地基质的优势菌门为变形菌、厚壁菌、绿弯菌和放线菌,其中变形菌为最主要的菌门。以上研究中人工湿地的优势菌门,与本实验的优势菌门相似,说明了人工湿地基质有相似的优势菌门。变形菌为最主要菌门,Ⅰ组、Ⅱ组、Ⅲ组、Ⅳ组和Ⅴ组的相对丰度为60.23%、52.15%、45.80%、43.19%和48.70%,其次是厚壁菌门(分别为7.39%、16.08%、16.42%、18.06%和10.64%),绿弯菌门(分别为6.39%、4.64%、9.91%、14.72%和13.46%),放线菌门(分别为9.88%、8.84%、8.53%、7.06%和6.59%)和硝化螺旋菌门(分别为3.94%、5.89%、7.31%、6.09%和4.74%)。相对于Ⅰ组,植物组变形菌门的相对丰度降低,这是因为植物的种植改善了微生物多样性。据相关研究,变形菌门和厚壁菌门对反硝化有至关重要的作用[26],硝化螺旋菌门含有丰富的硝化功能的菌属[27]。相对于Ⅰ组,植物组的厚壁菌门和硝化螺旋菌门相对丰度增加,这可能是植物组微生物有较高的氮去除率的原因。
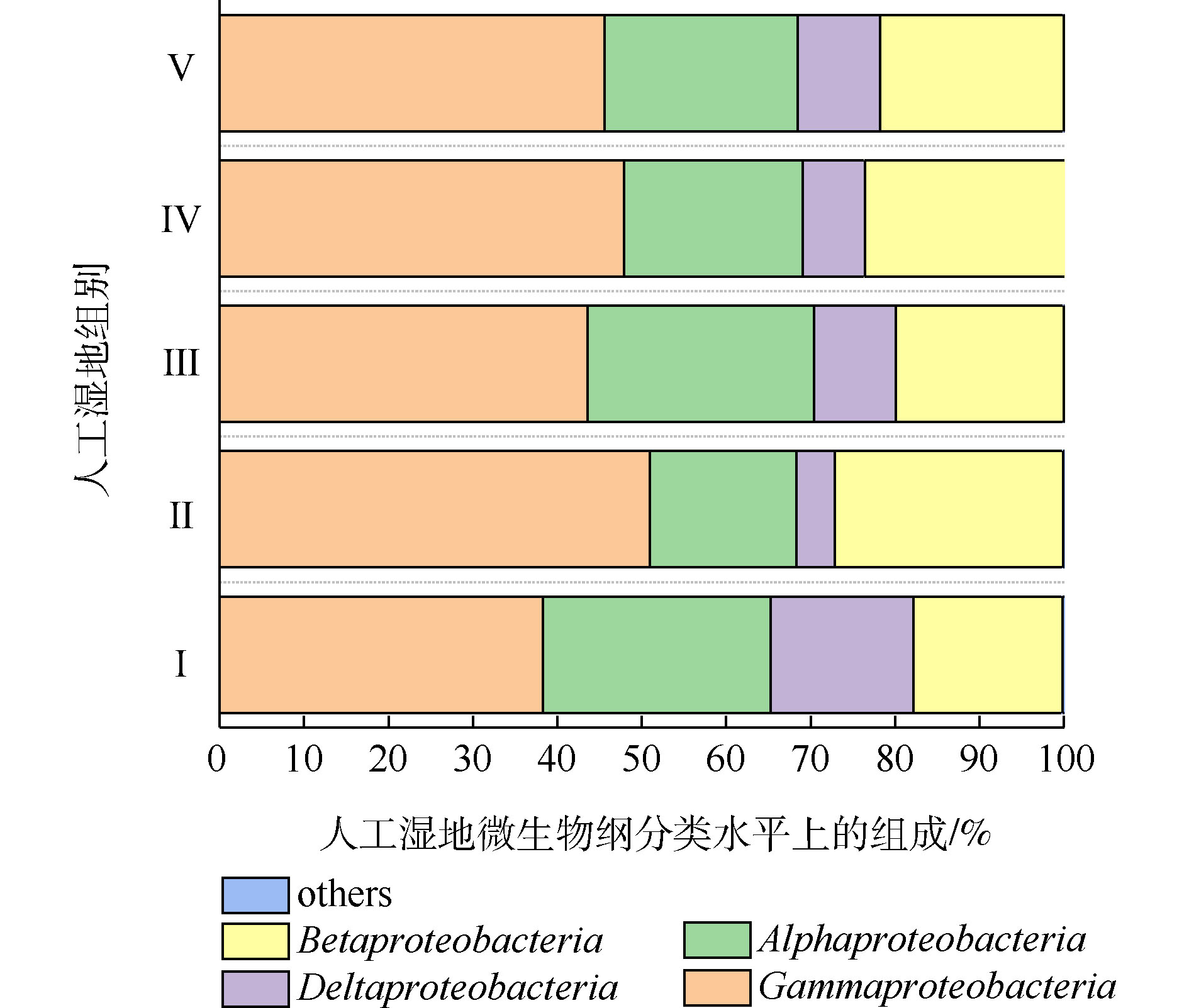
变形菌为最主要菌门。据相关研究,变形菌在人工湿地微生物氮磷去除中起到主要作用[28]。人工湿地各组变形菌的纲水平组成如图8所示。可将微生物检测频率>1%的菌纲做为主要的菌纲。共发现4个菌纲,分别为γ-变形菌纲(Gammaproteobacteria)、β-变形菌纲(Betaproteobacteria)、α-变形菌纲(Alphaproteobacteria)和δ-变形菌纲(Deltaproteobacteria),其中γ-变形菌纲、α-变形菌纲和β-变形菌纲是主要的菌纲。4个菌纲都属于革兰氏阴性菌,说明了人工湿地基质富集革兰氏阴性菌。这有利于污染物的生物降解。LI等[29-30]发现β-变形菌和γ-变形菌在去除硝酸盐和亚硝酸盐的生态功能方面发挥重要作用。ZHONG等[31]发现人工湿地中大多数可能的异养反硝化菌属于β-变形菌。LIU等[32]发现γ-变形菌纲中高丰度的假单胞菌属和动杆菌属细菌包含能发生高效聚磷的细菌。如图8所示,相比于Ⅰ组,植物组的β-变形菌和γ-变形菌的丰度均高于Ⅰ组,说明了植物根系富集β-变形菌和γ-变形菌。这可能是植物组微生物氮磷去除率高于Ⅰ组的原因。
2.3.3 功能微生物差异分析
据有关研究,不动杆菌属(Acinetobacter)、假单胞菌属(Pseudomonas)、芽孢杆菌属(Bacillus)、硫杆菌属(Thiobacillus)、脱氯单胞菌属(Dechloromonas)、罗思河小杆菌属(Rhodanobacter)、热单胞菌属(Thermomonas)和索氏菌属(Thauera)等具有反硝化的作用,参与氮的转化[33-35]。另据有关研究,硝化杆菌属(Nitrobacter)和硝化螺菌属(Nitrospira)具有硝化功能[36],氨基杆菌属(Aminobacterium)、亚硝化单胞菌属(Nitrosomonas)、亚硝化螺菌属(Nitrosospira)和亚硝化球菌属(Nitrosococcus)具有氨氧化功能[23,37]。另外,YAO等[38]发现不动杆菌可以通过异养来转化氮硝化和好氧反硝化。DU等[11]认为不动杆菌或假单胞菌可能是主要的在人工湿地中负责TP去除的属。STREICHAN等[39]发现假单胞菌具有高磷的PAO清除能力。
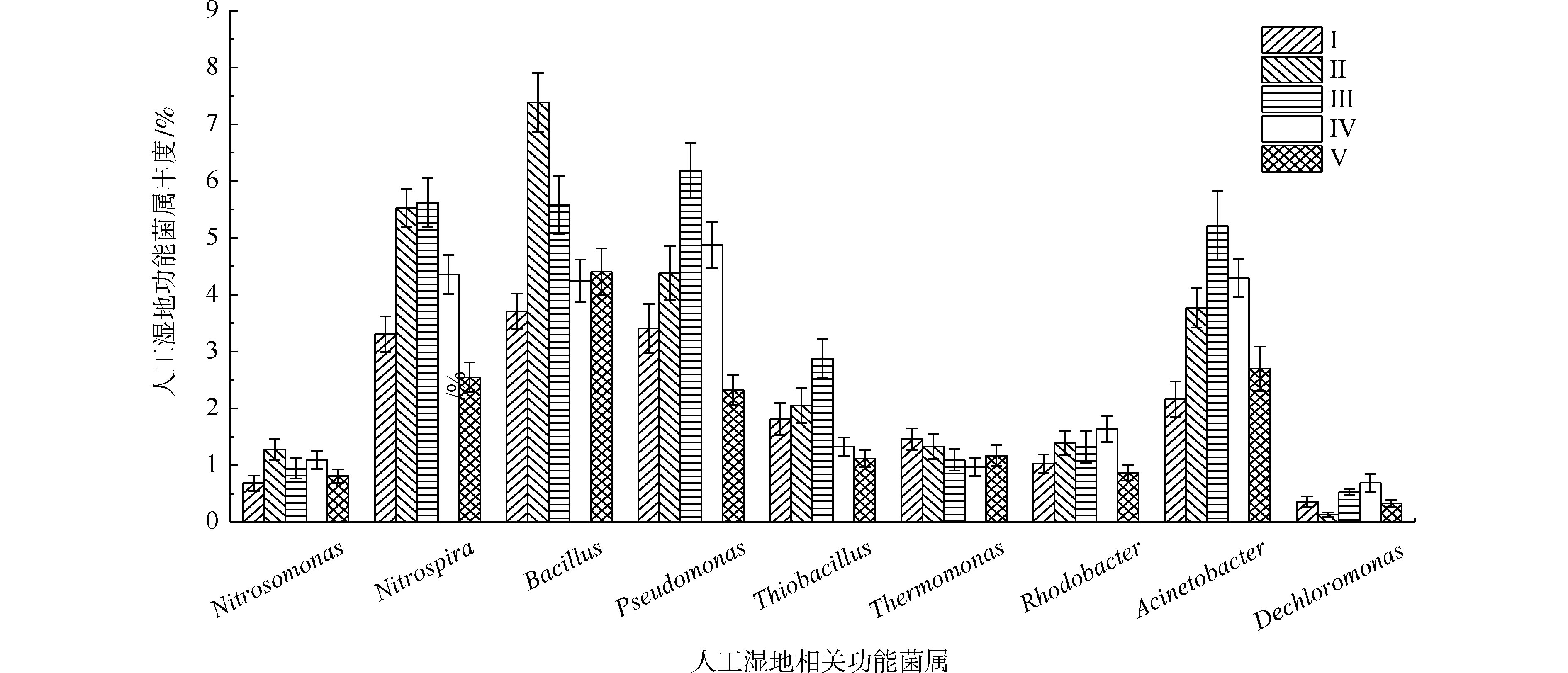
如图9所示,在人工湿地中检测出相对丰度大于0.5%的9种脱氮除磷功能菌属,分别是不动杆菌属、假单胞菌属、芽孢杆菌属、硫杆菌属、脱氯单胞菌属、红杆菌属、热单胞菌属、硝化螺菌属和亚硝化单胞菌属,发现了具有氨氧化细菌亚硝化单胞菌属丰度(0.68%~1.27%)远低于硝化作用硝化螺菌属(2.54%~5.62%)。据相关研究,某些硝化螺菌属能将
NH+4 -N完全氧化成NO−3 -N[40],这可能是人工湿地各组均有较好氨氮去除效果的原因。自养反硝化的硫杆菌的丰度(1.12%~2.87%)明显低于异养反硝化的不动杆菌属、假单胞菌属、芽孢杆菌属、热单胞菌属、红杆菌属和脱氯单胞菌属的总丰度(12.13%~19.91%),说明人工湿地易于富集异养反硝化菌。这是因为实验有较高的C/N(7.8~10.2),同时植物根系分泌碳源,可加速异养反硝化细菌的生长。不动杆菌属、假单胞菌属和芽孢杆菌属是丰度最高的异养反硝化菌属,占异养反硝化菌属总丰度的66.5%~75.9%,故认为这3个菌属在TN去除过程中起主要作用。植物组的不动杆菌属、假单胞菌属、芽孢杆菌属和硝化螺菌属丰度明显高于Ⅰ组,在Ⅱ组和Ⅲ组(最高微生物氮去除率的2组)丰度最高,表明不动杆菌、假单胞菌和芽孢杆菌丰度与人工湿地微生物氮去除率有关,其丰度的增加是植物组微生物氮去除率较高的原因。不动杆菌属、假单胞菌属具有高效聚磷作用和分泌有机酸和磷酸酶将难溶性磷转化可以被植物吸收利用的
H2PO−4 和HPO2−4 形态[41]。通过植物组与Ⅰ组比较发现,植物的种植提高了除磷功能菌属(不动杆菌属和假单胞菌属)的丰度,增强了微生物磷去除率,其中Ⅲ组(最高微生物磷去除率的组)丰度最高,表明不动杆菌和假单胞菌的丰度与人工湿地微生物磷去除率有关,其丰度的增加是植物组微生物磷去除率较高的原因。3. 结论
1)夏季人工湿地各组可有效地去除污水中
NH+4 -N、TN和TP污染物。低负荷下,NH+4 -N、TN和TP的平均去除率为51.48%~80.95%、62.43%~80.30%和37.09%~55.77%。高负荷下,NH+4 -N、TN和TP的平均去除率为45.53%~75.14%、53.67%~71.11%和32.97%~52.69%。种植植物的人工湿地比未种植人工湿地,在去除NH+4 -N、TN和TP污染物方面具有更好的性能。其中Ⅱ组(黄菖蒲)对氮的去除效果最好,Ⅲ组(美人蕉)对磷的去除效果最好。2)微生物作用(34.84%~45.44%)是人工湿地氮去除的主要途径,基质吸附(20.90%~23.91%)是人工湿地磷去除的主要途径。植物的种植不仅对氮(5.36%~9.79%)和磷(9.68%~16.76%)有吸收作用,还增强了微生物对氮(4.08%~10.60%)和磷(1.82%~5.08%)的去除作用。
3)植物的种植改善了基质微生物的丰富度和生物多样性,并发现微生物丰富度和多样性的改善有利于微生物对氮的去除作用。植物的种植提高了脱氮除磷功能微生物的丰度,增强了微生物对氮磷去除作用。人工湿地富集了假单胞菌属、不动杆菌属、芽孢杆菌属和硝化螺菌属等优势硝化和反硝化菌属,其中假单胞菌属、不动杆菌属、芽孢杆菌属和硝化螺菌属是人工湿地中主要的脱氮菌属,其丰度的增加是种植植物的人工湿地实验组微生物氮去除率较高的原因。人工湿地富集了优势聚磷菌属(不动杆菌和假单胞菌),不动杆菌和假单胞菌丰度增加是植物组微生物磷去除率较高的原因。
-
表 1 ZSM-5分子筛、CeO2(20)/ZSM-5和Ru/CZ系列催化剂的物理结构参数
Table 1. Physical structure parameters of ZSM-5 , CeO2(20)/ZSM-5, Ru(0.5)/CZ, Ru(1.0)/CZ, Ru(1.5)/CZ
样品名称 比表面积/(m2·g−1) 孔体积/(cm3·g−1) 平均孔径/nm ZSM-5 409.578 0.061 1 3.226 5 CeO2(20)/ZSM-5 404.820 0.051 8 3.165 5 Ru(0.5)/CZ 339.733 0.098 2 4.506 5 Ru(1.0)/CZ 326.942 0.103 0 5.175 2 Ru(1.5)/CZ 332.675 0.088 6 4.621 5 表 2 不同催化剂催化燃烧甲苯的T50%和T90%
Table 2. The T50% and T90% of toluene by catalytic combustion of different catalysts
催化剂名称 T50%/℃ T90%/℃ ZSM-5 — — CeO2(20)/ZSM-5 136 - Ru(0.5)/CZ 225 260 Ru(1.0)/CZ 210 240 Ru(1.5)/CZ 245 283 注:T50%、T90%分别代表甲苯转化率为50%、90%时的温度。 表 3 不同甲苯浓度下Ru(1.0)/CZ催化剂催化燃烧甲苯的T50%和T90%
Table 3. The T50% and T90% of toluene by catalytic combustion of Ru(1.0)/CZ catalyst with different toluene concentrations
甲苯浓度/(mg·m−3) T50%/℃ T90%/℃ 205.5 125 210 411 210 240 822 250 280 1 233 252 281 -
[1] GUO Y, WEN M, LI G, et al. Recent advances in VOC elimination by catalytic oxidation technology onto various nanoparticles catalysts: A critical review[J]. Applied Catalysis B:Environmental, 2021, 281: 119447. doi: 10.1016/j.apcatb.2020.119447 [2] YANG C, MIAO G, PI Y, et al. Abatement of various types of VOCs by adsorption/catalytic oxidation: A review[J]. Chemical Engineering Journal, 2019, 370: 1128-1153. doi: 10.1016/j.cej.2019.03.232 [3] ZHANG X, GAO B, CREAMER A E, et al. Adsorption of VOCs onto engineered carbon materials: A review[J]. Journal of Hazardous Materials, 2017, 338: 102-123. doi: 10.1016/j.jhazmat.2017.05.013 [4] LI J, YU E, CAI S, et al. Noble metal free, CeO2/LaMnO3 hybrid achieving efficient photo-thermal catalytic decomposition of volatile organic compounds under IR light[J]. Applied Catalysis B:Environmental, 2019, 240: 141-152. doi: 10.1016/j.apcatb.2018.08.069 [5] WANG H, CHEN S, WANG Z, et al. A novel hybrid Bi2MoO6-MnO2 catalysts with the superior plasma induced pseudo photocatalytic-catalytic performance for ethyl acetate degradation[J]. Applied Catalysis B:Environmental, 2019, 254: 339-350. doi: 10.1016/j.apcatb.2019.05.018 [6] WANG F, DAI H, DENG J, et al. Manganese Oxides with rod-, wire-, tube-, and flower-Like Morphologies: Highly effective catalysts for the removal of Toluene[J]. Environmental Science & Technology, 2012, 46(7): 4034-4041. [7] IKHLAQ A, KASPRZYK-HORDERN B. Catalytic ozonation of chlorinated VOCs on ZSM-5 zeolites and alumina: Formation of chlorides[J]. Applied Catalysis B:Environmental, 2017, 200: 274-282. doi: 10.1016/j.apcatb.2016.07.019 [8] LUO S, GAO L, WEI Z, et al. Kinetic and mechanistic aspects of hydroxyl radical-mediated degradation of naproxen and reaction intermediates[J]. Water Research, 2018, 137: 233-241. doi: 10.1016/j.watres.2018.03.002 [9] LUO S, WEI Z, SPINNEY R, et al. UV direct photolysis of sulfamethoxazole and ibuprofen: An experimental and modelling study[J]. Journal of Hazardous Materials, 2018, 343: 132-139. doi: 10.1016/j.jhazmat.2017.09.019 [10] LIU L, LI J, ZHANG H, et al. In situ fabrication of highly active γ-MnO2/SmMnO3 catalyst for deep catalytic oxidation of gaseous benzene, ethylbenzene, toluene, and o-xylene[J]. Journal of Hazardous Materials, 2019, 362: 178-186. doi: 10.1016/j.jhazmat.2018.09.012 [11] FENG S, LIU J, GAO B. Synergistic mechanism of Cu-Mn-Ce oxides in mesoporous ceramic base catalyst for VOCs microwave catalytic combustion[J]. Chemical Engineering Journal, 2022, 429: 132302. doi: 10.1016/j.cej.2021.132302 [12] ALI S, WU X, ZUHRA Z, et al. Cu-Mn-Ce mixed oxides catalysts for soot oxidation and their mechanistic chemistry[J]. Applied Surface Science, 2020, 512: 145602. doi: 10.1016/j.apsusc.2020.145602 [13] JIANG Y, GAO J, ZHANG Q, et al. Enhanced oxygen vacancies to improve ethyl acetate oxidation over MnOx-CeO2 catalyst derived from MOF template[J]. Chemical Engineering Journal, 2019, 371: 78-87. doi: 10.1016/j.cej.2019.03.233 [14] LU H, KONG X, HUANG H, et al. Cu-Mn-Ce ternary mixed-oxide catalysts for catalytic combustion of toluene[J]. Journal of Environmental Sciences, 2015, 32: 102-107. doi: 10.1016/j.jes.2014.11.015 [15] GAO P, WANG A, WANG X, et al. Synthesis of highly ordered Ir-containing mesoporous carbon materials by organic-organic self-assembly[J]. Chemistry of Materials, 2008, 20(5): 1881-1888. doi: 10.1021/cm702815e [16] GUO J, LIN C, JIANG C, et al. Review on noble metal-based catalysts for formaldehyde oxidation at room temperature[J]. Applied Surface Science, 2019, 475: 237-255. doi: 10.1016/j.apsusc.2018.12.238 [17] OKAL J, ZAWADZKI M. Catalytic combustion of butane on Ru/γ-Al2O3 catalysts[J]. Applied Catalysis B:Environmental, 2009, 89(1-2): 22-32. doi: 10.1016/j.apcatb.2008.11.024 [18] DAI Q, BAI S, WANG J, et al. The effect of TiO2 doping on catalytic performances of Ru/CeO2 catalysts during catalytic combustion of chlorobenzene[J]. Applied Catalysis B:Environmental, 2013, 142-143: 222-233. doi: 10.1016/j.apcatb.2013.05.026 [19] SANTOS V P, CARABINEIRO S A C, TAVARES P B, et al. Oxidation of CO, ethanol and toluene over TiO2 supported noble metal catalysts[J]. Applied Catalysis B:Environmental, 2010, 99(1-2): 198-205. doi: 10.1016/j.apcatb.2010.06.020 [20] CARRETTIN S, CONCEPCIÓN P, CORMA A, et al. Nanocrystalline CeO2 Increases the Activity of Au for CO Oxidation by Two Orders of Magnitude[J]. Angewandte Chemie International Edition, 2004, 43(19): 2538-2540. doi: 10.1002/anie.200353570 [21] GÓMEZ D M, GALVITA V V, GATICA J M, et al. TAP study of toluene total oxidation over a Co3O4/La-CeO2 catalyst with an application as a washcoat of cordierite honeycomb monoliths[J]. Physical chemistry chemical physics:PCCP, 2014, 16(23): 11447-11455. doi: 10.1039/C4CP00886C [22] 杨卜源, 佟丽华, 左树锋, 等. 添加铈对锰基催化剂的织构-结构及其氧化还原性能的影响[J]. 中国稀土学报. 2011, 29(4): 433-438. [23] DAI Q, WANG W, WANG X, et al. Sandwich-structured CeO2@ZSM-5 hybrid composites for catalytic oxidation of 1, 2-dichloroethane: An integrated solution to coking and chlorine poisoning deactivation[J]. Applied Catalysis B:Environmental, 2017, 203: 31-42. doi: 10.1016/j.apcatb.2016.10.009 [24] KHAN M E, KHAN M M, CHO M H. Ce3+-ion, surface oxygen vacancy, and visible light-induced photocatalytic dye degradation and photocapacitive performance of CeO2-Graphene nanostructures[J]. Scientific Reports, 2017, 7(1) [25] LIU X, ZENG J, WANG J, et al. Catalytic oxidation of methyl bromide using ruthenium-based catalysts[J]. Catalysis Science & Technology[J], 2016, 6(12): 4337-4344. [26] ZHAO J, XI W, TU C, et al. Catalytic oxidation of chlorinated VOCs over Ru/TixSn1-x catalysts[J]. Applied Catalysis B:Environmental, 2020, 263: 118237. doi: 10.1016/j.apcatb.2019.118237 [27] AOUAD S, ABI-AAD E, ABOUKAÏS A. Simultaneous oxidation of carbon black and volatile organic compounds over Ru/CeO2 catalysts[J]. Applied Catalysis B:Environmental, 2009, 88(3/4): 249-256. doi: 10.1016/j.apcatb.2008.10.002 [28] LIU C, XIAN H, JIANG Z, et al. Insight into the improvement effect of the Ce doping into the SnO2 catalyst for the catalytic combustion of methane[J]. Applied Catalysis B:Environmental, 2015, 176-177: 542-552. doi: 10.1016/j.apcatb.2015.04.042 [29] WANG J, ZHAO H, LIU X, et al. Study on the Catalytic Properties of Ru/TiO2 Catalysts for the Catalytic Oxidation of (Chloro)-Aromatics[J]. Catalysis Letters, 2019, 149(7): 2004-2014. doi: 10.1007/s10562-019-02802-x [30] PENG R, SUN X, LI S, et al. Shape effect of Pt/CeO2 catalysts on the catalytic oxidation of toluene[J]. Chemical Engineering Journal, 2016, 306: 1234-1246. doi: 10.1016/j.cej.2016.08.056 [31] SCIRÈ S, MINICÒ S, CRISAFULLI C, et al. Catalytic combustion of volatile organic compounds on gold/cerium oxide catalysts[J]. Applied Catalysis B:Environmental, 2003, 40(1): 43-49. doi: 10.1016/S0926-3373(02)00127-3 -




 下载:
下载: