-
随着我国碳达峰和碳中和目标的提出,传统工业行业的绿色低碳转型发展势在必行。浮选作为一种常用的选矿方法,耗水量巨大,优化浮选单元的取水结构,加大废水循环利用,不仅可以缓解常规用水的供求矛盾,节约浮选用水成本,还能在一定程度上促进绿色矿山的建设。城镇污水处理厂的二级出水具有水量大、受季节和气候影响小、就地可取的特点,是浮选单元的潜在供水水源。然而,二级出水中的细菌、病毒、原生动物等病原微生物在回用过程中会通过气溶胶传播、皮肤接触等途径对选矿厂工人造成潜在的健康风险[1-3]。有研究表明,城镇污水处理厂的出水回用于景观娱乐性用水时,休闲活动参与者的水源性肠道病原体暴露风险增加,有可能引发急性肠胃疾病、呼吸道疾病、皮肤疾病[4-5];用于喷洒灌溉、洗车、道路清扫时,水中病原体会以气溶胶的形式对人体,产生吸入暴露风险[6-8]。而将二级出水回用于干旱地区的矿区选矿厂浮选用水时,其中的病原微生物的削减和回用后对矿物分离的影响尚无报道。
近年来,臭氧氧化作为一种高效的氧化消毒技术受到了广泛关注[9-11],臭氧自身的氧化作用及其在水中分解产生的羟基自由基不仅可对病原体产生强大的灭活作用、削减病原微生物浓度[12-13]、降低回用水使用风险[14-15],而且可以降解水中有机物。刘洪均等[16]证明了城镇污水处理厂二级出水可以回用于内蒙古某铜钼矿浮选流程。随后,他们进一步发现回用水中的大肠杆菌及病毒等病原微生物在浮选过程存在潜在的健康风险,臭氧氧化作为应急处理措施可以应对该风险,但该研究并未确定臭氧氧化工艺的具体参数及优化后的浮选效果[17-19]。
基于此,本研究采用臭氧氧化技术深度处理城镇污水处理厂二级出水,优化了臭氧氧化操作参数,评价了病原微生物的去除效果,比较了二级出水臭氧处理前后浮选流程中各岗位的健康风险,系统评估了臭氧氧化二级出水回用于浮选单元的适用性。本研究成果可为城镇污水厂二级出水以及矿山生活区污水处理后回用于干旱地区矿区选矿厂提供参考。
-
矿石矿样。实验矿样来自内蒙古某铜钼矿,矿物组成中铜的独立矿物较多如黄铜矿(相对含量0.34%)、蓝辉铜矿(相对含量0.23%)等,脉石矿物以石英、白云母为主。矿样磨矿细度(0.074 mm)约占65%。
实验水样。水样来自内蒙古某市政污水处理厂的出水,该污水处理厂采用曝气活性污泥法二级处理工艺,污水经过过滤、沉淀等物理处理后,进入综合生化池,采用好氧生物处理后进入稳定塘。水样COD为25~60 mg·L−1,pH为6.80~7.60,悬浮物为10~55 mg·L−1,浊度为3.34~16 NTU,氨氮为1.60~5.70 mg·L−1。
-
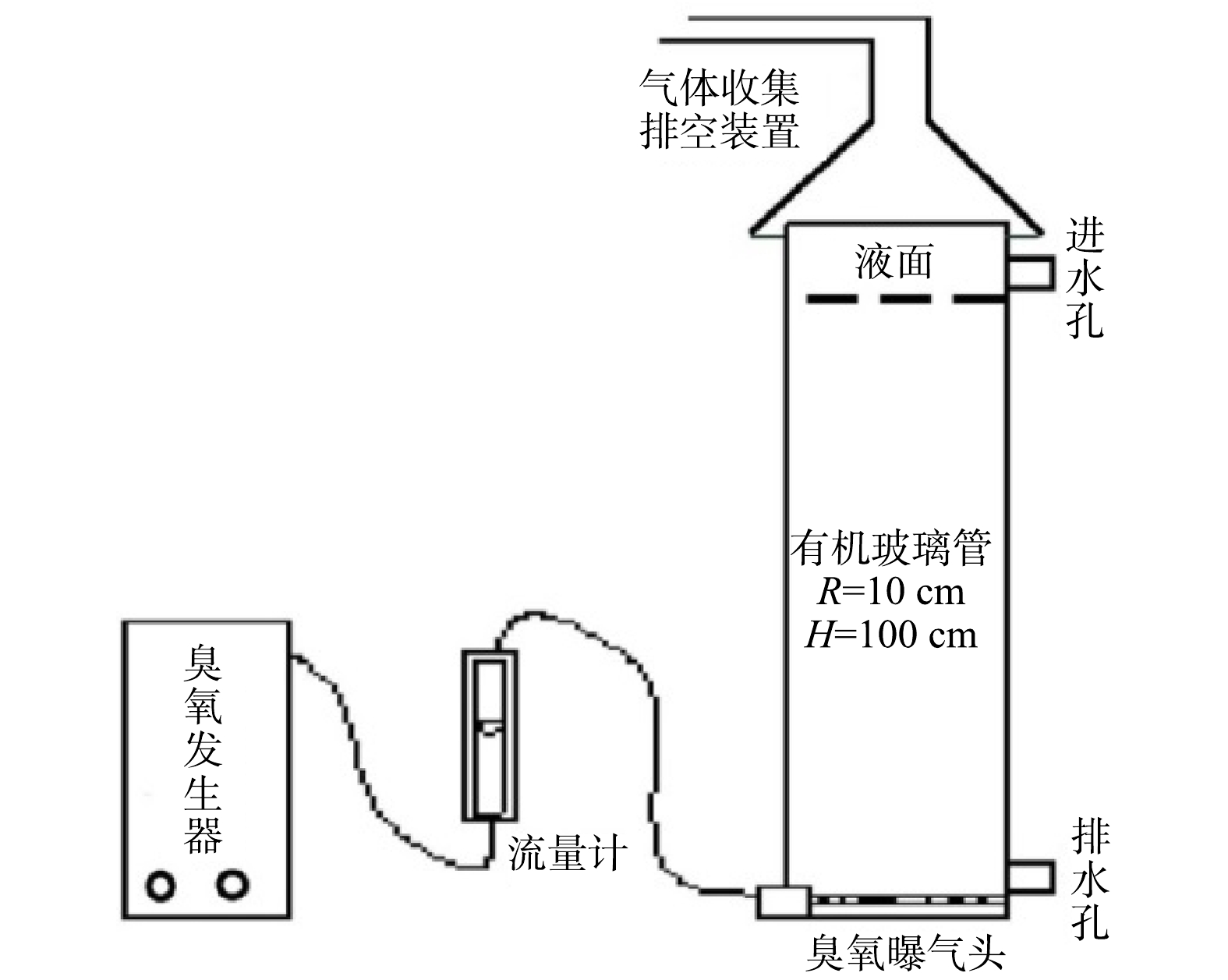
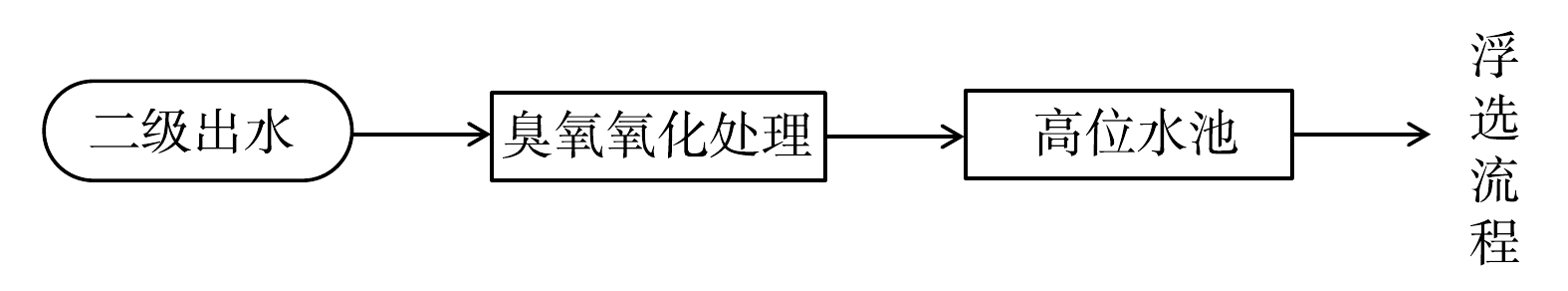
在实验过程中,分别于不同月份采集二级出水,分析其中的病原微生物含量,明确病原微生物在二级出水中的现有赋存特征。随后,采用实验室的批次实验,取一定量的二级出水投加臭氧进行氧化,改变水样的pH以及臭氧的投加量,以粪大肠杆菌作为指示性微生物,研究臭氧氧化对二级出水中病原微生物的削减效果,优化臭氧氧化的操作参数。实验中采用的臭氧发生装置为奥润牌(S-1BX型)空气源臭氧发生器。如图1所示,臭氧产量为600 mg·h−1,臭氧发生器与曝气头之间连有气体流量计,用于控制臭氧曝气量,反应器为有机玻璃材质,上部设有集气罩及排空装置。
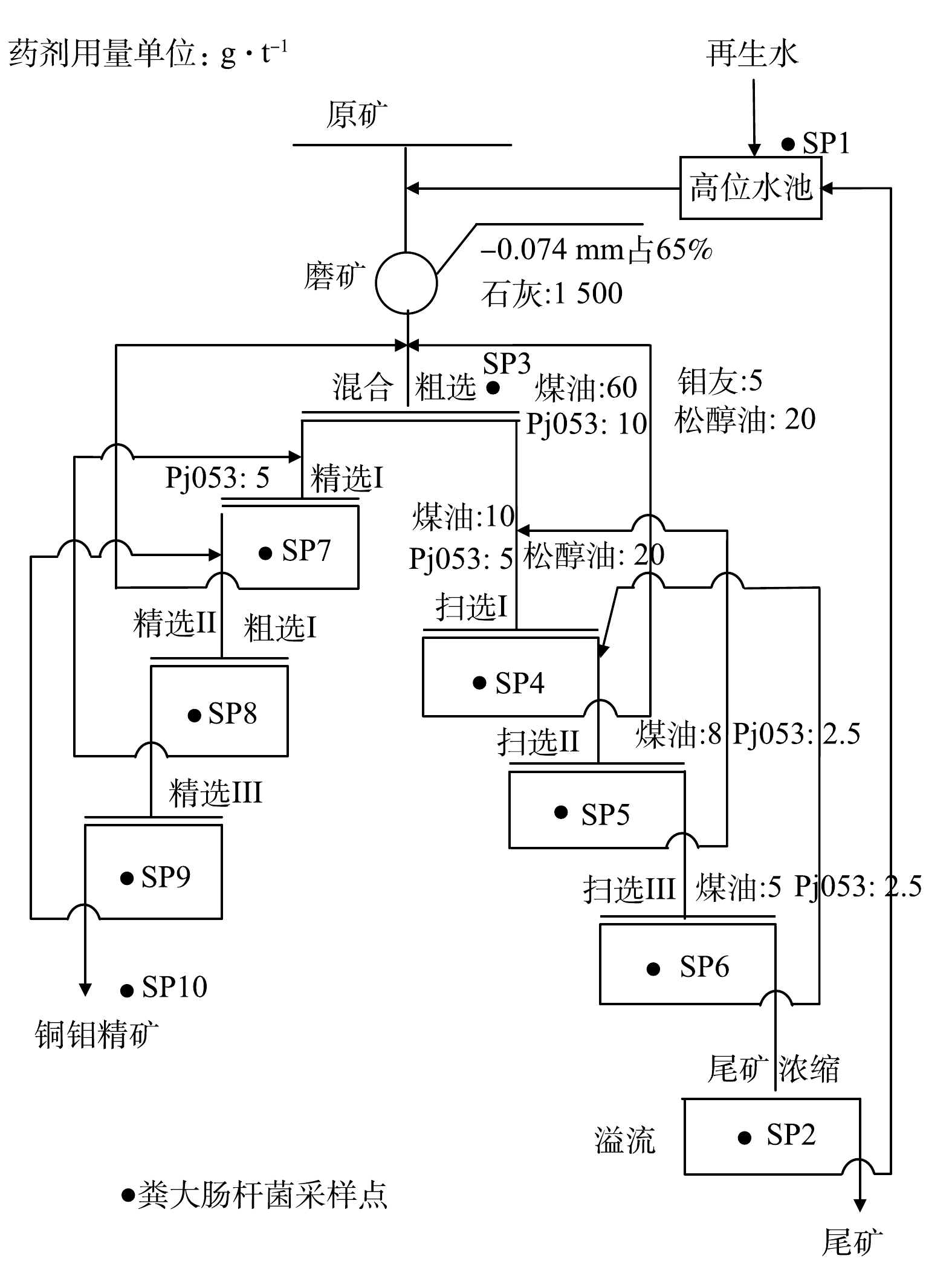
在上述实验的基础上,将市政污水处理厂二级出水通入臭氧氧化处理装置,处理后的水经矿区浮选厂的高位水池进入浮选系统进行铜钼混合浮选闭路实验,主要工艺流程如图2所示。浮选过程中,按照选矿厂原有药剂制度,加入捕收剂(煤油、Pj053、钼友)、酸碱调节剂(石灰)、起泡剂(松醇油),结合选矿厂工艺共设定10个检测点位(图3)。以未经处理的污水处理厂二级出水浮选为对照,分别测定各点位的粪大肠杆菌暴露剂量,评估浮选健康风险。其中高位水池(SP1)采集样品为水样,其余点位采集样品为水和矿物颗粒的混合物。以自来水浮选、未经处理的污水处理厂二级出水浮选为对照,以铜钼混合精矿的产率、品位、回收率为指标,评估浮选效果。
-
1)水质指标的测定。COD 采用快速消解分光光度法(哈希DR1010)测定;氨氮采用水杨酸-靛酚蓝法(哈希Amtax NA8000氨氮检测仪)测定;总磷采用钼酸铵分光光度法 (哈希NPW-160总磷/总氮测定仪)测定;浊度根据光学散射测量原理测定(上海雷磁 WZS-186浊度计);pH采用PHSJ-4F型实验室pH计(上海雷磁)测定。
2)水中细菌的分离与检测。经过滤浓缩后,采用多管发酵法检测粪大肠杆菌,采用平板计数法检测沙门氏菌、金黄色葡萄球菌和粪链球菌[20-21],粪大肠杆菌衰减率根据式(1)计算。
式中:S为粪大肠杆菌衰减率;C0为再生水中粪大肠杆菌初始浓度,个·L−1;Ct为臭氧作用t时刻后粪大肠杆菌浓度,个·L−1;
3)水中病毒的浓缩分离与检测。样品采用膜吸附-洗脱法进行浓缩,用洗脱液以磁力搅拌的方式将病毒洗脱后,利用病毒的保守序列设计通用引物进行PCR扩增,将基因测序结果做BLAST分析,进行分子生物学鉴定。
4)浮选流程中粪大肠杆菌浓度测定。城市生活污水中病原微生物种类繁多,对各工作岗位进行所有病原微生物定量检测并不现实,因此,选用常被用做指示菌种的粪大肠杆菌进行健康风险评估。由于矿物颗粒对粪大肠杆菌的吸附作用,浮选过程中暴露于浮选用水和矿物颗粒都有感染的可能,因此,实验中分别检测浮选用水和矿物颗粒中粪大肠杆菌浓度。为了使矿物颗粒与浮选用水中粪大肠杆菌群浓度计量单位统一,便于对比分析,采用水置换法将矿物颗粒吸附的粪大肠杆菌重新悬浮于PBS缓冲溶液中(0.02 mol·L−1 Na2HPO4,0.1 mol·L−1NaCl,0.003 mol·L−1 KCl pH=7.5),用缓冲溶液提取的粪大肠杆菌浓度来表征矿物颗粒吸附的粪大肠杆菌浓度,浮选用水中粪大肠杆菌采用多管发酵法测定[22]。
5)粪大肠杆菌健康风险定量评估模型。采用β-泊松分布模型计算病原微生物感染概率,病原微生物摄入剂量采用世界卫生组织推荐的意外暴露剂量(1 mL)和蓄意接触剂量(100 mL) [23]。粪大肠杆菌单次暴露感染概率根据式(2)计算,年暴露感染概率根据式(3)计算。
式中:Pi为粪大肠杆菌单次暴露感染概率;N为粪大肠杆菌摄入剂量,个·mL−1;α、β剂量-反应方程参数取值分别为0.1778、1.78×106[24]。
式中:Py为粪大肠杆菌年暴露感染概率;n为暴露频率,次·a−1;根据现场调查,暴露剂量为1 mL的暴露频率为365次·a−1,暴露剂量100 mL的暴露频率为20次·a−1。
-
本研究首先通过对不同月份市政污水处理厂二级出水的采样检测,分析二级出水中病原微生物的原有赋存特征。从表1可以看出,经过好氧生物处理后,污水处理厂二级出水中仍然检测出大量的病原微生物,其中粪大肠杆菌、沙门氏菌和粪链球菌在各个月份均有检出,粪大肠杆菌浓度最高(3.70×105~3.85 ×106 个·mL−1)。从时间分布特征上看,粪大肠杆菌和粪链球菌浓度季节差异明显,7、8月份浓度明显高于其他月份。这与夏季气温偏高有利于细菌繁殖有关。与之相反的是,沙门氏菌浓度(1.10×105~3.20×105 CFU·L−1)在气温较低的月份浓度偏高。这表明高温环境下沙门氏菌活性减弱,而低温环境利于其繁殖。金黄色葡萄球菌(0-320×103 CFU·L−1)偶有检出,检出月份出现在7月和8月。此外,4种细菌的浓度分布未表现出明显相关性。
水中轮状病毒、腺病毒、柯萨奇病毒在不同月份均有检出,检出率分别为77.78%、55.56%、44.44%,轮状病毒检出率最高。3种病毒的检出规律未呈现明显的季节性。上述结果表明,二级出水不经消毒处理直接回用于浮选流程,可能会造成病原微生物在浮选系统内的滋生蓄积,工人因暴露导致的感染风险增加。
-
由表2可以看出,污水处理厂二级出水中病原微生物种类繁多。因此,研究选用《城市污水再生利用 工业用水水质》(GB/T 19923-2005)推荐使用的粪大肠杆菌作为臭氧消毒的指示细菌。污水处理厂出水中粪大肠杆菌浓度波动较大,一般为103~106 个·L−1。基于消毒工艺的安全性考虑,通过接种一定量的粪大肠杆菌菌悬液,使其浓度达到最高值(3.65×106 个·L−1)进行消毒实验。
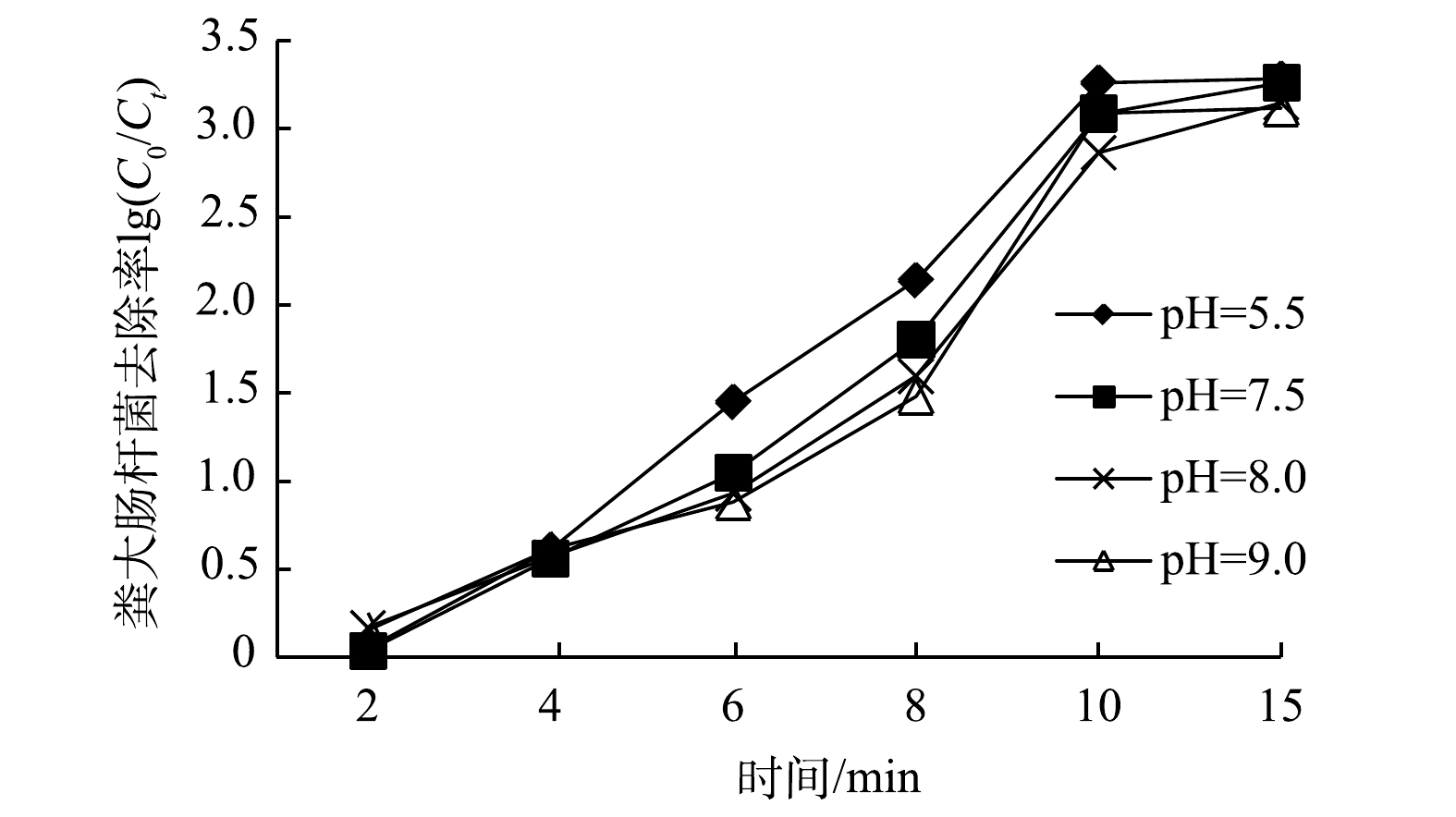
首先在臭氧投加量为5 mg·L−1的固定条件下,改变二级出水的pH,并考察pH对粪大肠杆菌灭活的影响。由图4可以看出,当pH为5.5~9.0时,消毒效果受pH影响不明显,但是酸性条件下消毒效果略好。这主要是因为酸性环境不利于臭氧的分解,水中作用于粪大肠杆菌的臭氧剂量大,从而灭活效果好。当臭氧氧化时间为0~10 min时,二级出水中粪大肠杆菌被迅速灭活,衰减率高达3.28lg个·L−1。氧化10~15 min后,粪大肠杆菌灭活率趋于稳定;氧化时间为15 min时,粪大肠杆菌几乎彻底灭活。由于污水处理厂二级出水的pH为6.8~7.6,灭活率变化较小,在考虑工艺运行成本的情况下,优先选择不调节pH,消毒时间优选为10 min。
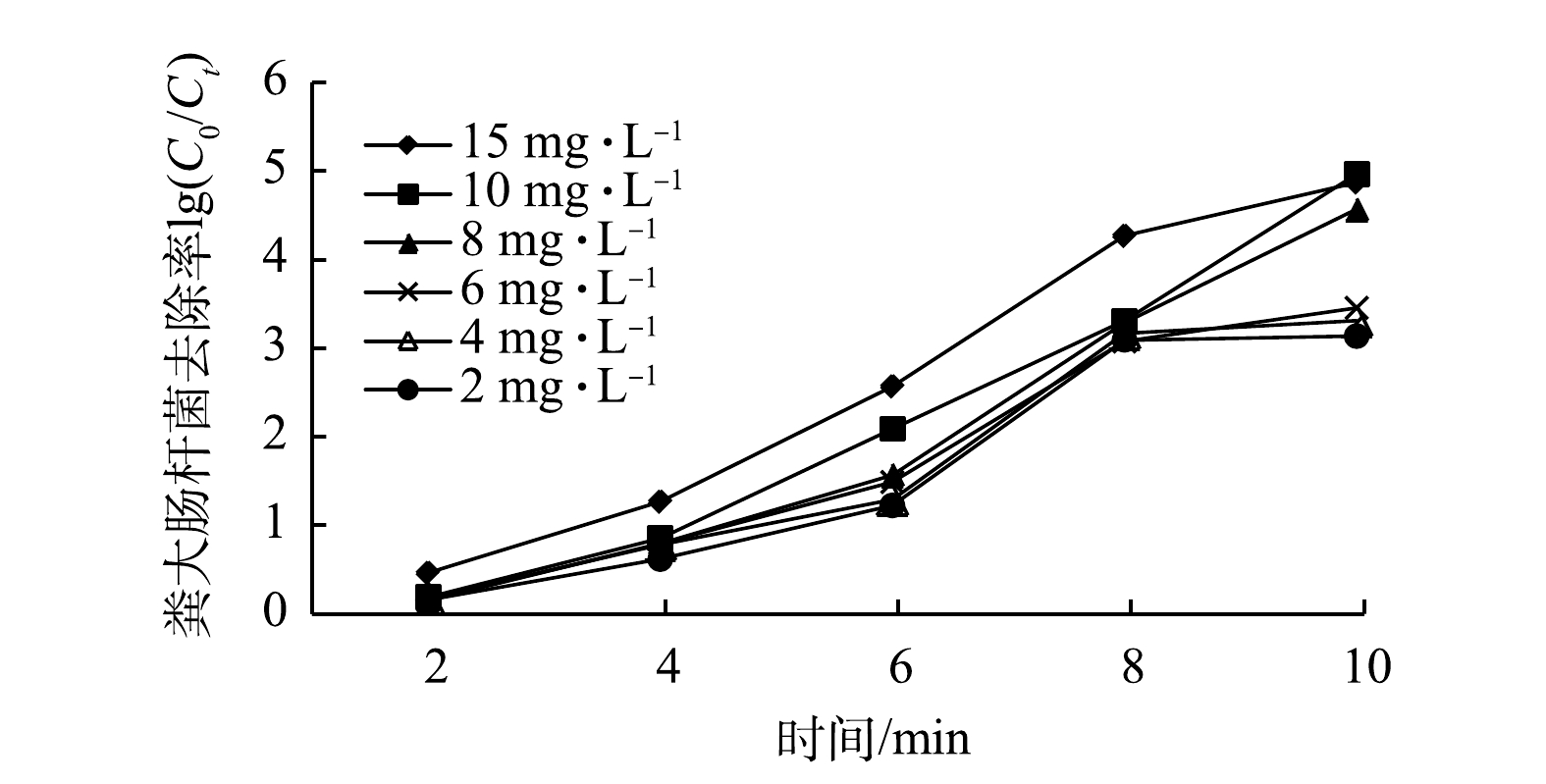
由图5可见,粪大肠杆菌衰减率随着臭氧投加量的增加呈增加趋势。臭氧投加量为2 mg·L−1、消毒时间为10 min时,水中粪大肠杆菌衰减率为3.28lg 个·L−1,此时出水中粪大肠杆菌浓度为2 700 个·L−1,未能达到《城市污水再生利用 工业用水水质》(GB/T 19923-2005)中粪大肠菌群指标要求。当臭氧投加量增加至4 mg·L−1和6 mg·L−1时,再生水中粪大肠杆菌衰减率分别为3.31lg个·L−1和3.44lg 个·L−1,此时出水中粪大肠杆菌浓度分别为1 800 个·L−1和65 个·L−1。当臭氧剂量> 10 mg·L−1时,氧化10 min可使水中粪大肠杆菌被彻底灭活。这主要是由于市政二级出水中尚含有部分有机物,这些有机物也会消耗臭氧,在一定程度上降低消毒效率,随着臭氧投加量的提高,有机物不断被氧化,粪大肠杆菌的灭活效率也得到提高[25-26]。
-
根据图3所示铜钼混合浮选闭路流程进行现场浮选模拟,评估各岗位的健康风险,对比分析混合浮选指标,从安全性和浮选效果综合分析二级出水臭氧氧化后回用于浮选的适用性。
1)二级出水臭氧氧化处理后用于浮选的健康风险分析。臭氧消毒实验表明当臭氧投加量大于4 mg·L−1时,出水水质能达到《城市污水再生利用 工业用水水质》(GB/T 19923-2005)中粪大肠菌群指标要求,但浮选实验流程为闭路实验,浮选用水在循环使用过程中可能会造成粪大肠菌的蓄积,因此基于安全与成本考虑,选用臭氧投加量分别为4 mg·L−1和6 mg·L−1处理的二级出水进行浮选实验,评估各岗位因暴露粪大肠杆菌导致的健康风险,评价阈值采用世界卫生组织推荐的单次感染风险值2.60×10−6、年感染风险值7.30×10−4作为水媒病原微生物感染风险的可接受水平[26]。由于矿物颗粒对粪大肠杆菌的强烈吸附作用,除岗位SP1外,其余岗位浮选用水中均未检测到粪大肠杆菌,感染风险为零。矿物颗粒中粪大肠杆菌感染概率如表2所示。使用臭氧投加量为4 mg·L−1、消毒时间为10 min的二级出水,在暴露剂量为100 mL的条件下,岗位SP1粪大肠杆菌的单次感染概率和年感染概分别为8.09×10−5、1.62×10−3,岗位SP2暴露于矿物颗粒中粪大肠杆菌的单次感染概率为2.24×10−6,均处于不可接受水平。这是因为尾矿浓缩池(SP2)中矿物颗粒富集了大量病原微生物,因而暴露导致的健康风险增大。增加臭氧投加量至6 mg·L−1时,各岗位矿物颗粒中粪大肠杆菌单次感染概率为4.00×10−7~4.79×10−8,年感染概率为1.59×10−6~7.99×10−6,岗位SP1高位水池中粪大肠杆菌的单次感染概率和年感染概率分别为1.35×10−6和4.70×10−4,全部处于可接受水平。当暴露剂量为1 mL时,使用臭氧投加量为4 mg·L−1和6 mg·L−1处理后的水,所有岗位浮选用水和矿物颗粒中粪大肠杆菌感染概率均处于可接受水平。因此,基于二级出水回用过程健康风险考虑,臭氧投加量为6 mg·L−1更为稳妥。
2)二级出水臭氧氧化处理后的浮选实验。选矿厂所在地区属于严寒地区,污水处理厂二级出水水质波动较大,为了考察水质对浮选指标的影响,分别使用混合水(污水处理厂原水与二级出水1:2混合)、二级出水、臭氧氧化处理后的二级出水(臭氧投加量为6 mg·L−1,消毒时间10 min)、进行铜钼混合浮选闭路实验的自来水,浮选结果如表3所示,浮选用水水质数据如表4所示。由表3和表4可见,浮选用水的水质对浮选指标影响较大,随着水中COD、悬浮物浓度的下降,浮选指标逐步得到改善。使用混合水用于浮选,铜钼混合精矿中铜、钼的品位分别为16.54%、0.64%,铜、钼的回收率分别为68.77%、46.87%,浮选过程泡沫层加厚,泡沫发粘,容易出现跑槽现象,而且能明显看到泡沫中夹杂的脉石矿物,此时的产品指标不能满足生产要求。选厂采用的铜钼混合浮选为泡沫浮选,是通过浮选药剂将有用矿物选择性地附着在矿浆中的空气泡上,并随之上浮到矿浆表面,达到有用矿物与脉石的分离的目的,而生活污水中的有机物有可能改变了矿物颗粒疏水性导致泡沫结构改变引起脉石矿物上浮;浮选药剂中的捕收剂煤油、PJ053、钼友为异极性有机化合物,生活污水中有机物可能干扰捕收剂与矿物颗粒的吸附作用,从而导致精矿中铜、钼的品位和回收率下降。另外,水中的悬浮物也会通过物理吸附消耗掉部分浮选药剂导致浮选指标下降;使用二级出水,浮选指标明显好转,铜、钼的品位分别提高了26.90%、78.13%,铜、钼的回收率分别提高了20.02%、62.85%。混合水、二级出水经臭氧氧化处理后用于浮选,浮选指标进一步改善,两者均能满足选厂要求,其中二级出水要优于混合水,其浮选指标与自来水几乎相当。
-
1)二级出水中粪大肠杆菌、沙门氏菌、粪链球菌、轮状病毒检出频率较高,直接使用未经处理的二级出水进行浮选,存在病原微生物感染风险。
2)水质对浮选指标影响较大,水中COD、悬浮物浓度的下降,可以改善浮选指标,增加铜钼精矿中铜、钼的品位和回收率。
3)使用臭氧氧化处理的二级出水进行浮选,当臭氧投加量为6 mg·L−1,消毒时间为10 min时,暴露于浮选用水和矿物颗粒中大肠杆菌的健康风险均处于可接受水平,且浮选指标良好。
臭氧氧化二级出水回用于选矿浮选的适用性
Feasibility of ozonation advanced treatment of secondary effluent for water reuse in flotation unit of mineral processing plants
-
摘要: 为优化干旱矿区浮选单元的取水结构,降低市政污水处理厂二级出水的回用风险,以内蒙古某铜钼矿为代表性研究对象,采用臭氧氧化工艺对该区域市政污水处理厂二级出水进行深度处理,探讨其对水中病原微生物的去除效果,研究处理后的二级出水对浮选指标的影响以及相应的健康风险,评估氧化处理工艺的二级出水回用于选矿浮选单元的适用性。结果表明,二级出水中大肠杆菌浓度具有明显的季节分布性,最高浓度可达3.85 ×106 个·mL−1,轮状病毒检出率为77.78%,直接回用具有一定风险;而且浮选用水的水质对浮选指标影响较大,随着COD、悬浮物浓度的下降,精矿中铜、钼的品位和回收率相应增加,浮选指标得到改善;采用臭氧氧化处理工艺二级出水,在臭氧投加量为6 mg·L−1、氧化时间为10 min、不调节pH的情况下,二级出水中粪大肠杆菌衰减率可达3.44lg 个·L−1。在该工艺条件下,使用处理后的二级出水进行浮选,浮选产品指标合格,且粪大肠杆菌单次暴露感染风险为4.71×10−8~1.35×10−6,年暴露感染风险为1.59×10−6~4.70×10−4,均为可接受水平。Abstract: In order to optimize the water supply structure of flotation unit in mineral processing plant of arid area and decrease the recycle risk of secondary effluent in wastewater treatment plant (WWTP), a copper-molybdenum mine located in Inner Mongolia was taken as the representative case, ozonation oxidation was employed to perform the advanced treatment of secondary effluent from a WWTP in this region. Then the removal efficiency of pathogenic microorganisms in secondary effluent was determined, the influence of treated secondary effluent on the flotation indices and the corresponding health risk were studied, the feasibility of these treated secondary effluent for water reuse in flotation unit of mineral processing plants was also evaluated. The results showed that the Fecal coliform concentration in secondary effluent had an obvious seasonal distribution characteristic with the highest concentration of 3.85×106mL−1, the detection rate of rotavirus was 77.78%, these indicated that direct reuse of secondary effluent had a potential risk. Moreover, the water quality for floatation had a significant effect the flotation indices. With the decrease of COD and suspended solids in water, the grade and recovery of copper and molybdenum in the concentrate increased, and the flotation indices were improved. When ozonation oxidation was used to treat secondary effluent, the attenuation rate of Fecal coliform could reach 3.44log·L−1 at ozone dosage of 6 mg·L−1, oxidation time of 10 min and non-adjusted pH. Under these conditions, the treated secondary effluent could meet the flotation water quality requirements and the qualified flotation products were achieved. Moreover, the single and the annual exposure risk of Fecal coliform were 4.71×10−8~1.35×10−6 and 1.59×10−6~4.70×10−4, respectively, which were both at an acceptable level.
-
Key words:
- arid mining area /
- ozone oxidation /
- flotation /
- pathogen
-
选择性催化还原法(selective catalytic reduction, SCR)脱除烟气中NOx是目前工业上烟气脱硝首选技术, 广泛应用于燃煤电厂等固定污染源的烟气脱硝, 脱硝效率较高, 能够满足我国当前脱硝实际, 是目前最好的NOx烟气净化治理脱硝技术[1]. SCR技术的核心是催化剂. 目前, 国内外应用较成熟SCR催化剂为V2O5/TiO2系列催化剂[2-4], 该催化剂在较高的反应温度(>350 ℃)具有较高的催化活性和抗硫性能. 由于我国的脱硝工艺必须采用末端布置, 然而末端放置的工艺方式会使得烟气温度大大降低, 低于SCR催化剂所需的活性温度. 又因V2O5/TiO2系列催化剂重金属元素V毒性较大对环境和人体健康的毒副作用以及成本较高等, 中低温(<250 ℃)高活性SCR脱硝催化剂的研究开发受到国内外众多研究者的高度关注[5-7].
中低温NH3-SCR催化剂主要包括Mn、Fe、Cu、Ce、Cr等非钒基氧化物催化剂[8-12], 其中, Mn基氧化物催化剂由于其较高的低温NH3-SCR脱硝性能、环境友好、价格低廉的优点而备受关注. Peña等[13]比较了各种负载金属氧化物的催化剂, 发现TiO2负载V、Cr、Fe、Mn、Ni、Cu、Co在NH3-SCR过程中, 活性顺序为Mn>Cu>Cr>Co>Fe>V>Ni. 研究表明锰的氧化形态、制备方法等对锰系催化剂的催化性能影响显著[14-15]. 本课题组对原位生长法制备脱硝催化剂进行了较为深入地研究. Zhang等[9]以管状的埃洛石为载体, 采用原位生长法成功地制备出了MnOx/HNTs催化剂, 在36000 h−1下, 50—300 ℃之间NO转化率可保持在90%以上, 催化剂表现出的高活性与MnOx呈非晶态良好地分散在埃洛石纳米管的管内与管外有关, 埃洛石所具有的空间纳米结构限制了MnOx的生长, 使其趋于无定形态, 促进了活性位点的形成与分散. Zhang等[12]分别采用原位生长法与浸渍法制备了CeMn/TiO2催化剂, 探究了制备方法对以粉末状TiO2为载体所制备的催化剂脱硝性能的影响. 其中, 采用原位生长法所制备的样品表现出更好的催化活性, Ce(1.0)Mn/TiO2-SP在125—300 ℃之间, 27000 h−1下, NO转化率接近100%.
综上可知, 原位生长法制备的脱硝催化剂具有良好的催化活性, 且活性组分在载体表面呈非晶态, 分散性高. 然而, 原位生长法制备过程中MnOx的负载机制尚不清晰[9,11-12]. 为了明晰原位生长法制备过程中MnOx的负载机制, 阐明催化剂的催化活性机理. 本文以20—40目硅藻土基多孔陶瓷颗粒为载体, 制备了Mn基多孔陶瓷催化剂, 以传统浸渍法作为对比, 考察了不同制备方法Mn基催化剂的低温SCR脱硝性能, 探究了原位生长法制备催化剂过程中活性组分的负载机制.
1. 实验部分(Experimental section)
1.1 材料与试剂
埃洛石(HAL, 郑州金阳光陶瓷有限公司),主要化学组成(质量分数)为: 50.31% SiO2、38.27% Al2O3、7.59% SO3、1.22% K2O、1.12% Fe2O3; 硅藻土(DE, 国药集团化学试剂有限公司), 主要化学成分(质量分数)为: 88.80% SiO2、 2.98% Al2O3、2.06% Fe2O3、2.03% CO2、1.21% Na2O; 乙酸锰 Mn(CH3COO)2,高锰酸钾KMnO4, 聚乙烯醇(PVA, (CH2CHOH)n),石墨(Graphite, C), 均由国药集团化学试剂有限公司提供,纯度为AR;模拟烟气由南京上元工业气体厂提供.
1.2 催化剂的制备
1.2.1 硅藻土基多孔陶瓷的制备
称取6 g硅藻土粉末与4 g埃洛石混合, 再称取0.4 g淀粉, 采用湿法球磨(球:原料:酒精= 2:1:0.6)将上述粉末混合均匀, 110 ℃干燥24 h, 过200目筛, 滴加4% wt. PVA, 研磨,经红外压片机4 MPa压片成型, 再经管式炉1000 ℃煅烧2 h, 得到硅藻土基多孔陶瓷. 将所得多孔陶瓷破碎后过20目筛, 作为催化剂载体, 并标记为DE-HAL.
1.2.2 Mn基硅藻土多孔陶瓷催化剂的制备
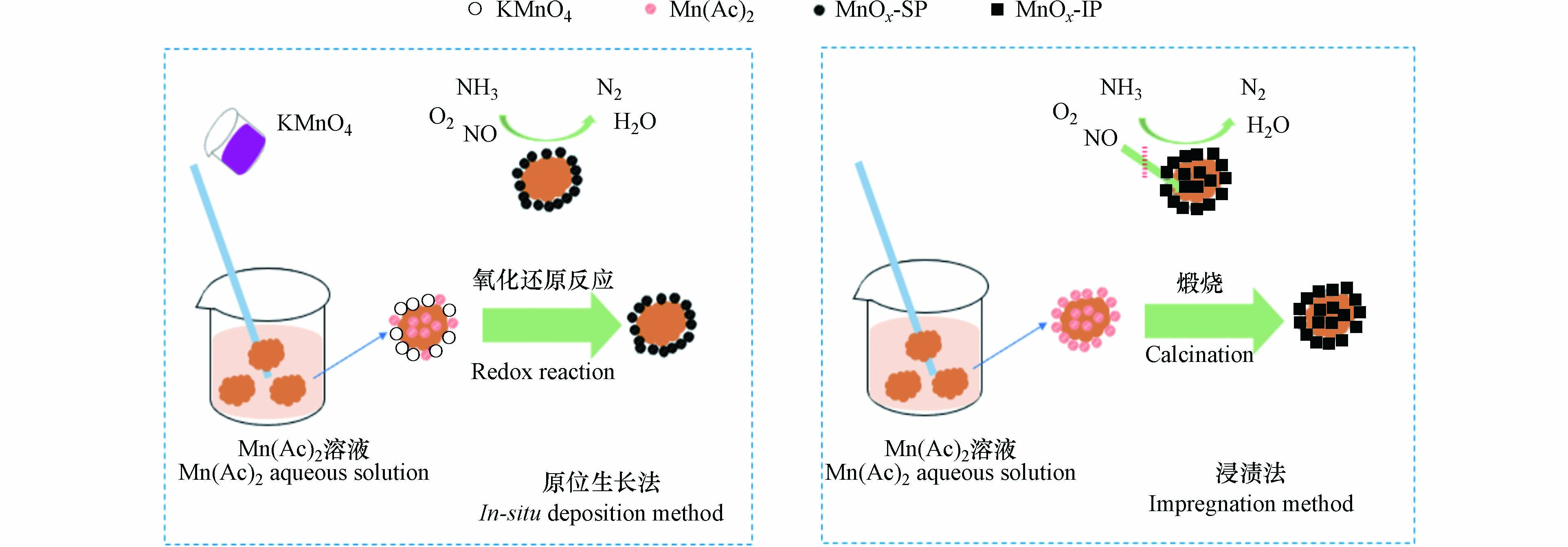
原位生长法: 称取5 g上述制备的硅藻土基多孔陶瓷, 称取化学计量的Mn(Ac)2溶解于一定量的去离子水中, 用以作为锰的前驱体. 将多孔陶瓷等体积浸渍于Mn(Ac)2溶液中, 静置24 h后加入KMnO4溶液, 搅拌后静置24 h, 多次洗涤抽滤至滤液澄清无色以达到除去K+的目的, 于鼓风干燥箱中110 ℃干燥24 h, 即得所需催化剂, 标记为Mn(8)/DE-HAL(SP)(催化剂中Mn元素质量分数为8%). 重复上述制备步骤, 但催化剂不经过洗涤抽滤, 干燥后在300 ℃下煅烧3 h, 标记为Mn(8)/DE-HAL(SP-300).
浸渍法: 称取5 g制备的硅藻土基多孔陶瓷, 称取化学计量的Mn(Ac)2溶解于一定量的去离子水中, 将多孔陶瓷等体积浸渍于Mn(Ac)2溶液中, 静置24 h后于烘箱中110 ℃干燥24 h, 再置于马弗炉中, 空气氛围, 300 ℃煅烧3 h, 标记为Mn(8)/DE-HAL(IP-300).
1.3 催化剂活性测试
催化剂的脱硝活性评价测试装置为长80 cm, 内径15 mm的竖式石英玻璃常压固定床反应器, 活性评价装置主要由模拟烟气(1000 mg·L−1 NO, 1000 mg·L−1 NH3, 6%vol H2O, 3%vol O2, N2为平衡气混合而成, 总流量为350 mL·min−1), 固定床反应器和分析检测装置的3部分组成. 反应空速为52000 h−1, 反应温度为100—300 ℃. 采用MRU OPTIMA7烟气分析仪在线测量反应器进出口NOx浓度,准确度为 ±3%。采用MGA6plus分析仪测定反应器出口N2O浓度,准确度为 ±2%。采用GT-1000-NH3分析仪测定NH3浓度,准确度为 ±1%.
催化剂脱硝活性以NO转化率和N2的选择性衡算,计算公式为:
NOconversion=CinNO−CoutNOCinNO×100% (1) N2selectivity=[NOin]+[NH3]in−[NO2]out−2[N2O]out[NOin+[NH3]in]×100% (2) 1.4 催化剂表征
采用美国康塔NOVA 2200e型比表面积及孔径分析仪分析样品的比表面积和孔径孔容. 采用荷兰帕纳科PANalytical X-Pert PRO MPD型X射线衍射仪对多孔陶瓷和催化剂的物相与晶型进行表征,Cu Kα射线, 操作电压为40 kV, 操作电流为40 mA, 扫描速度为4(o)·min−1, 扫描区间范围2θ=5°—70°. 采用美国Thermo ESCALAB250Xi型X射线光电子能谱仪对催化剂进行XPS测试, Al Kα射线, 管电压为1486.6 eV. 采用德国卡尔蔡司Gemini 500型热场发射扫描电子显微镜观察多孔陶瓷与催化剂的表面微观结构.采用全自动多功能吸附仪(TP-5080D)进行H2的程序升温还原(H2-TPR)实验.采用Micromeritics Autochem-II仪器对催化剂进行NH3/NO程序升温脱附(NH3/NO-TPD)实验,利用质谱(Hiden QIC-200)对脱附过程中出口气体浓度进行实时监测。.
2. 结果与讨论(Results and discussion)
2.1 催化剂活性评价
2.1.1 不同制备方法催化剂的脱硝活性
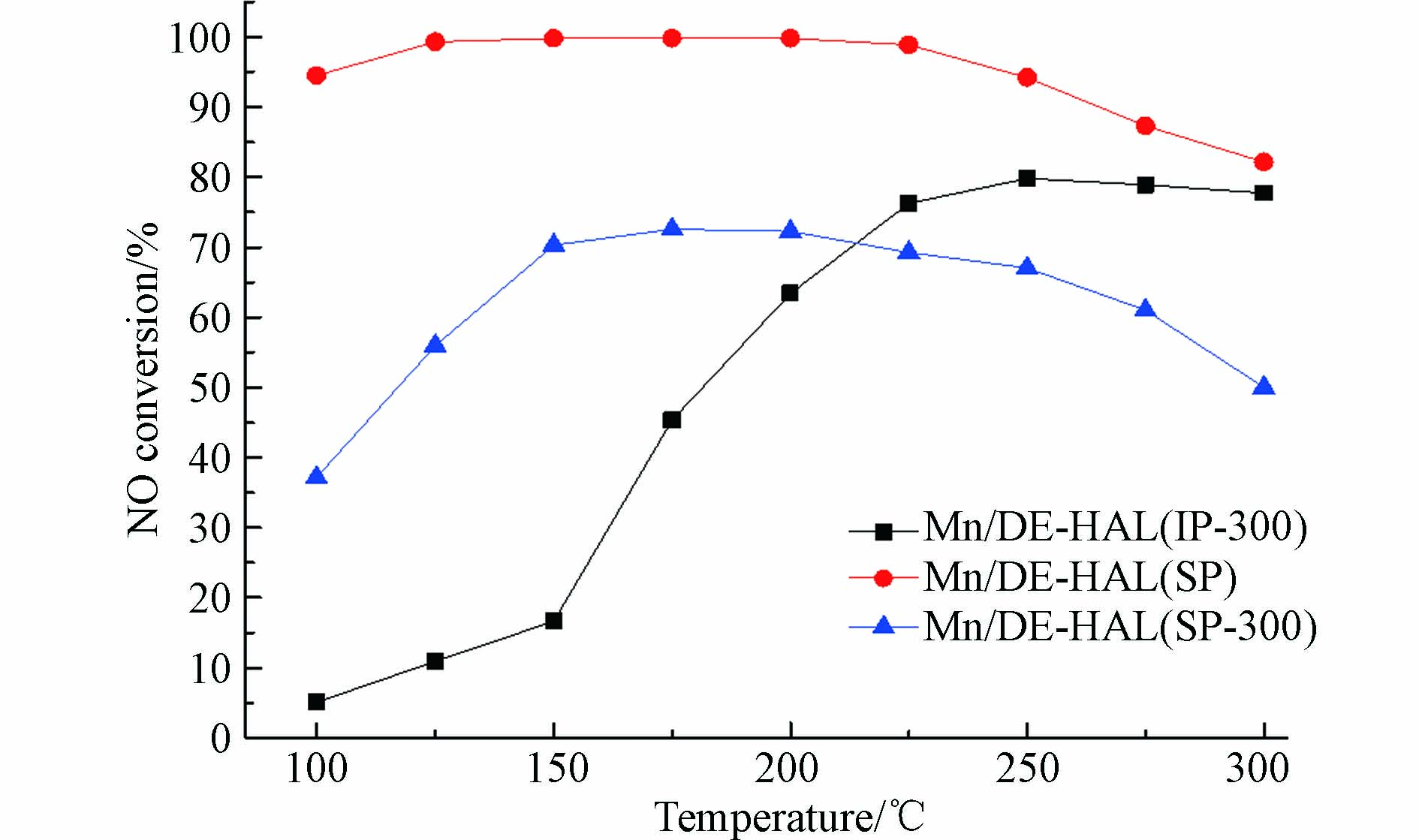
图1为不同制备方法催化剂的脱硝活性-温度曲线. 由图1可以看出, Mn/DE-HAL(SP)具有最优异的催化活性, 在100—250 ℃之间NO转化率高于90%, 225 ℃之后催化活性虽然随温度的升高而下降, 但在整个测试温度段, NO转化率不低于80%. Mn/DE-HAL(SP-300)在100 ℃时NO转化率约为38%, 150—200 ℃之间NO转化率约为70%, 该样品催化活性较差可能是由于催化剂中存在大量K元素, 研究表明, 碱金属会占据催化剂的部分酸性位点, 降低催化剂对NH3的吸附和活化能力[16], 从而导致催化剂催化活性较差. 此外, 煅烧也是降低样品NO转化率的原因之一. Mn/DE-HAL(IP-300)低温下催化活性较差, 150 ℃之后NO转化率显著增加, 在225—300 ℃之间催化活性较为稳定, NO转化率约为80%. 下文将通过表征分析对催化剂的理化性质进行进一步探究.
2.1.2 N2选择性
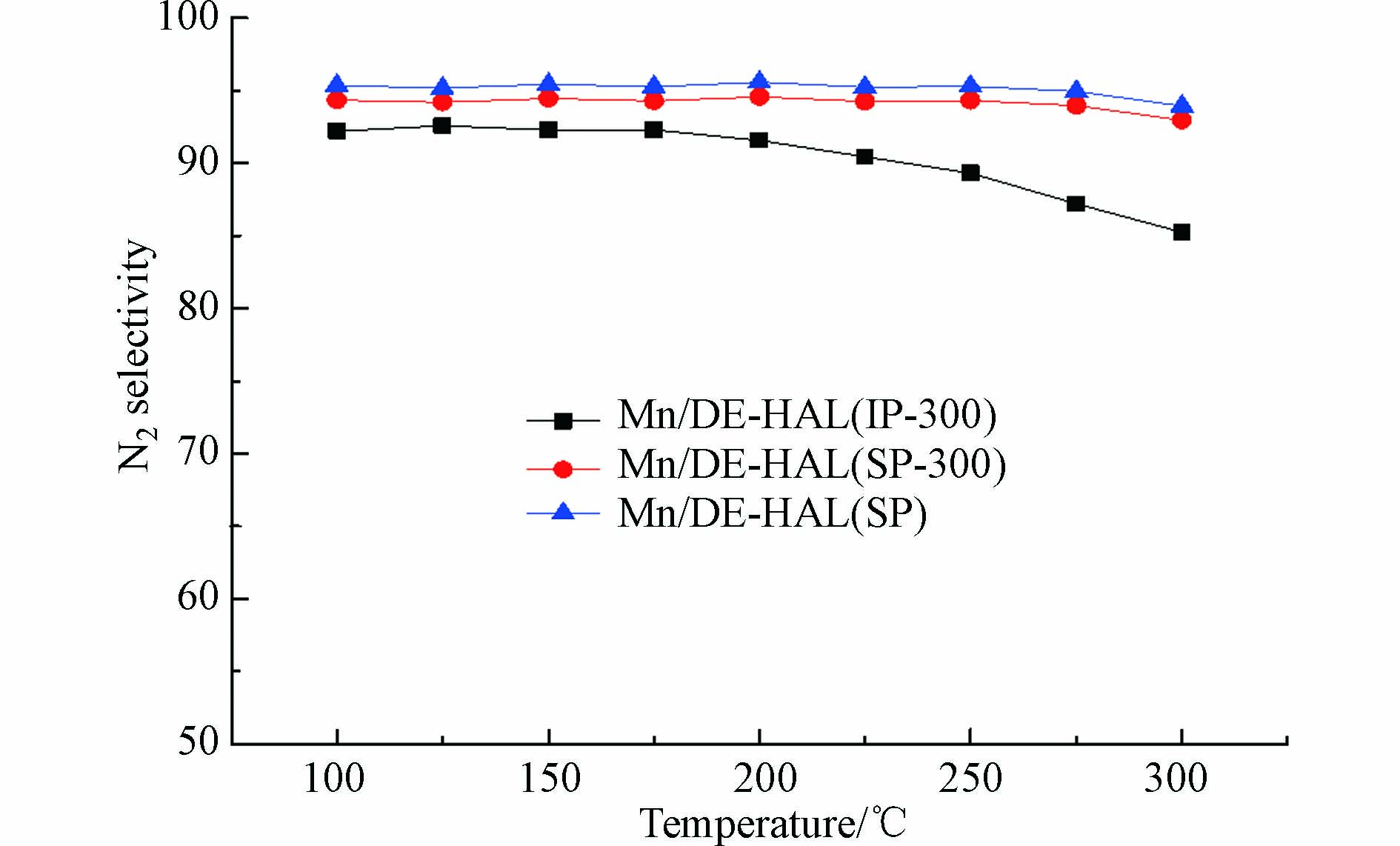
N2的选择性为Mn基SCR催化剂的重要性质之一,其实质上反映了反应系统中目的反应与副反应反应速率的竞争关系,选择性越高越有利于催化反应的进行. 图2为不同制备方法催化剂N2选择性曲线图. 由图2可以看出,在整个温度区间范围内, Mn/DE-HAL(SP)催化剂N2选择性均在95%左右,说明在100—300 ℃温度范围内,Mn/DE-HAL(SP)催化剂稳定性较好且具有高N2选择性.
2.2 催化剂表征
2.2.1 SEM分析
为了更直观地研究催化剂的形貌, 对样品进行了SEM表征. 图3为催化剂的SEM与Mapping图. 由图3(c)可以看出, 原位生长法所制备的催化剂表面MnOx呈絮状, 由图3(f)可以看出采用浸渍法所制备的样品表面的MnOx为颗粒状, 两种方法所制备的催化剂表面的活性组分形貌差异显著. 由图3(b)和图3(e)的Mapping图可以清晰地观察到Mn(8)/DE-HAL(SP)表面的活性组分的分散情况与Mn(8)/DE-HAL(IP-300)差别并不明显. 可见, 制备方法影响载体表面MnOx的形貌, 而对活性组分在载体表面的分散性没有太大影响. 对比两种不同制备方法催化剂形貌, 结果表明, 催化剂表面活性组分的分散性并非是影响催化剂脱硝性能的决定性因素. 图3(g)和(h)分别为原位生长法制备的催化剂的断裂面形貌图与Mapping图, 由图3(h)可以看出, MnOx并未进入颗粒内部; 图3(i)和图3(j)分别为浸渍法制备的催化剂的断裂面形貌图与Mapping图, 由图3(j)可以看出, MnOx同时负载在了颗粒内部. 该结果表明, 原位生长法所制备的催化剂, MnOx仅附着在陶瓷颗粒表面, 而浸渍法所制备的样品, MnOx进入了陶瓷颗粒内部. 下面将进一步探究出现这一现象的原因.
 图 3 不同制备方法催化剂的SEM和mapping图Figure 3. SEM and mapping images of catalysts prepared by different methods(a)、(c) Mn(8)/DE-HAL(SP); (d)、(f) Mn(8)/DE-HAL(IP-300); (b) Mn(8)/DE-HAL(SP)mapping; (e) Mn(8)/DE-HAL(IP-300) mapping; (g) Mn(8)/DE-HAL(SP) 断裂面; (i) Mn(8)/DE-HAL(IP-300) 断裂面; (h) Mn(8)/DE-HAL(SP) mapping断裂面; (j) Mn(8)/DE-HAL(IP-300) mapping断裂面.
图 3 不同制备方法催化剂的SEM和mapping图Figure 3. SEM and mapping images of catalysts prepared by different methods(a)、(c) Mn(8)/DE-HAL(SP); (d)、(f) Mn(8)/DE-HAL(IP-300); (b) Mn(8)/DE-HAL(SP)mapping; (e) Mn(8)/DE-HAL(IP-300) mapping; (g) Mn(8)/DE-HAL(SP) 断裂面; (i) Mn(8)/DE-HAL(IP-300) 断裂面; (h) Mn(8)/DE-HAL(SP) mapping断裂面; (j) Mn(8)/DE-HAL(IP-300) mapping断裂面.两种方法制备催化剂的第一步均是将载体浸渍于Mn(Ac)2溶液中, 浸渍法经过干燥煅烧后, 颗粒表面与内部均生成了MnOx, 而原位生长法在加入KMnO4进行化学反应, 再经过洗涤抽滤后颗粒内部已观察不到MnOx的存在. 现采用原位生长法制备催化剂, 不经水洗抽滤, 干燥后经300 ℃煅烧3 h, 探究是否是洗涤抽滤除去了颗粒内部的Mn(Ac)2.
图4为原位生长法制备Mn(8)/DE-HAL(SP-300)催化剂的SEM与Mapping图. 图4(a)为催化剂外表面的SEM图, 图4(d)为催化剂内部断裂面的SEM图. 由图4(b)和(c)可以看出, MnOx分散在催化剂的外表面, 由于干燥前未经过洗涤抽滤, 使得K大量存在于样品表面. 由图4(e)和(f)可以看出, 催化剂内部仍然有K, 但并未观察到MnOx的存在. 该结果表明, 采用原位生长法制备的样品内部的活性组分并非被洗涤除去. KMnO4不仅与样品表面的Mn(Ac)2反应, 位于多孔陶瓷颗粒内部的Mn2+也会迁移到样品表面与KMnO4反应生成MnOx. 这意味着, 原位生长法制备的催化剂, 活性组分富集在载体表面, 结合催化剂的催化活性分析可知, 这些负载在载体表面的MnOx在SCR反应中发挥着重要作用.
2.2.2 XRD分析
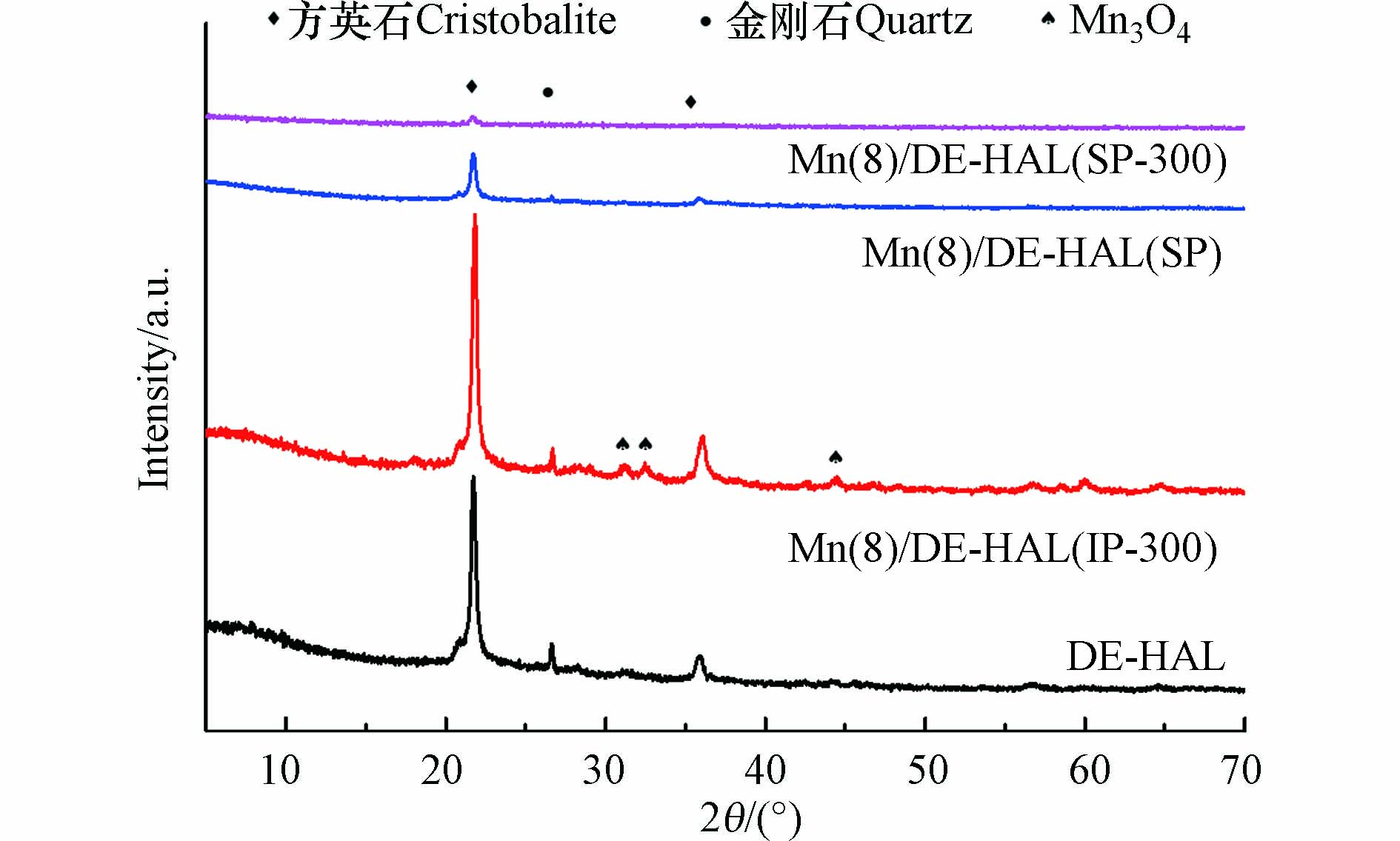
图5为多孔陶瓷和催化剂的XRD图谱. 如图5所示, DE-HAL在21.66°、35.87°以及31.05°处的峰归属于方石英的特征衍射峰(PDF#39-1425), 26.62°处的峰归属于石英的特征衍射峰(PDF#46-1045).
Mn/DE-HAL(SP)的石英峰与方石英峰均显著减弱, 出现这一现象原因一方面是因为MnOx包覆在载体表面, 削弱了其原有的衍射峰, 另一方面, 由于样品的特殊性, 使得筛选出来的样品MnOx含量较多. 此外, 样品中并未观察到MnOx的衍射峰, 这主要是由于活性组分在载体表面呈无定形态分布. Mn/DE-HAL(IP-300)中除了石英峰与方石英峰外, 在31.03°、32.44°以及44.37°处还可观察到Mn3O4的特征衍射峰(PDF#18-0803). 催化剂表面活性组分结晶度越低, 越具有较多的表面活性点位, 有利于提升催化剂的催化活性, 这可能是Mn/DE-HAL(SP)表现出更好的催化活性的重要原因.
2.2.3 比表面和孔结构分析
比表面积和孔结构是评价催化剂优良的重要指标, 总体而言, 较大的比表面积能够为催化剂提供更多的活性位点, 使活性组分MnOx得到更好的分散, 更有利于反应气体的吸附, 从而提高催化活性. 表1为样品的孔结构与BET数据, 其比表面积大小顺序为: Mn(8)/DE-HAL(SP) > Mn(8)/DE-HAL(SP-300) > Mn(8)/DE-HAL(IP-300) > DE-HAL. 可以看到, 与Mn(8)/DE-HAL(SP)相比, Mn(8)/DE-HAL(SP-300)与Mn(8)/DE-HAL(IP-300)的孔容较小, 这可能是由于煅烧使得活性组分堵塞了部分小孔. 此外, 负载MnOx后, 所有样品的孔径均有不同程度的减小, 这与活性组分和载体结合后, 形成了丰富的孔道结构有关. 相较于DE-HAL多孔陶瓷, 负载MnOx后, 样品的比表面积显著增加, 主要是由于MnOx成功负载后提升了样品的比表面积, 这意味着催化剂的比表面积主要是由MnOx贡献的. 结合SEM与Mapping分析, Mn/DE-HAL(SP)的活性组分主要分散在载体表面, Mn(8)/DE-HAL(IP-300)的活性组分分散在载体表面与内部孔隙中, 即MnOx对Mn/DE-HAL(SP)比表面积的贡献集中在载体表面, 对Mn(8)/DE-HAL(IP-300)比表面积的提升作用于载体表面与内部, 而表面的活性组分更容易参与到SCR反应中, 催化剂表面具有更多的反应活性位点, 有利于提升催化剂的脱硝性能, 这是Mn(8)/DE-HAL(SP)具有良好的催化活性的重要原因.
表 1 样品的孔隙结构和BET数据Table 1. Pore structure and BET data of samples样品Sample 比表面积/(m2·g−1)Specific surface area 孔容/(cm3·g−1)Pore volume 孔径/nmPore diameter DE-HAL 4 0.02 179.47 Mn(8)/DE-HAL(IP-300) 13 0.03 81.32 Mn(8)/DE-HAL(SP) 32 0.05 48.75 Mn(8)/DE-HAL(SP-300) 14 0.04 7.66 2.2.4 XPS分析
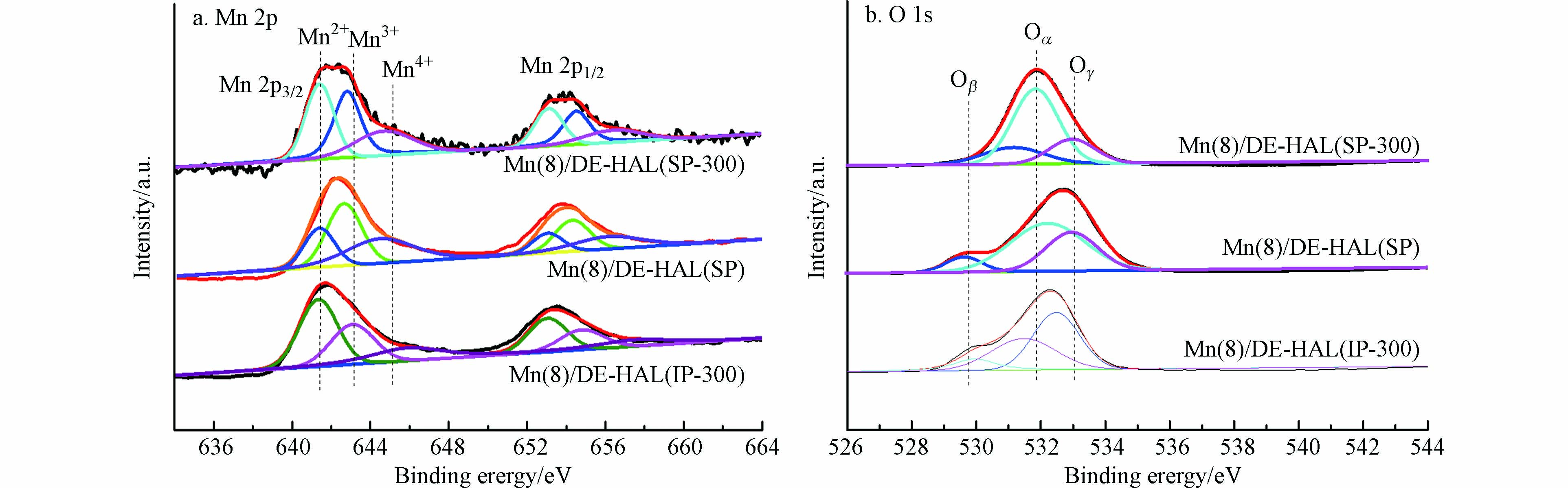
图6为采用两种方法所制备的催化剂XPS图谱, 表2为催化剂的XPS分析结果. 图6(a)中644.4—645 eV、642.2—642.7 eV和 640.9—641.4 eV的3个峰分别归属于Mn4+、Mn3+和Mn2+ [17-18]. Mn4+是Mn基催化剂在NH3-SCR反应中最活跃的物种, Mn4+易于吸附NH3并生成Mn4+-NH3, 而Mn3+有利于吸附NO并生成Mn3+-NO[19]. 研究表明, Mn4+-NH3可以与Mn3+-NO结合生成中间产物NH4NO3[19], 与NO反应生成NH4NO2会进一步分解成N2和H2O[20], 从而促进NH3-SCR反应的进行. 图6(b)中530.1—530.2 eV, 531.7—532.4 eV和533.5—534.4 eV的 3个峰分别归属于表面晶格氧(Oβ)、化学吸附氧(Oα)和吸附的水物种(Oγ)[21-22]. Oα在NH3-SCR反应中比Oβ更活泼, 因为其具有更高的迁移率[23], 有利于将NO氧化成NO2, 促进快速SCR反应的进行[24]. 与Mn(8)/DE-HAL(SP)相比, Mn(8)/DE-HAL(SP-300)的Mn4+比例降低了14.53%, 意味着碱金属的存在降低了Mn4+浓度; Oα的比例降低了11.58%, 研究表明, 碱金属会与表面氧中心形成强键[25], 抑制催化剂表面化学吸附氧的形成[26]. 相较于Mn(8)/DE-HAL(SP), Mn(8)/DE-HAL(IP-300)中Mn4+和Oα的比例分别降低了17.10%和9.54%. 该结果表明, 原位生长法可以提升催化剂表面Mn4+和Oα的浓度, 更高的Mn4+和Oα的相对百分比含量, 有利于促进SCR反应的进行, 提升样品的催化活性.
表 2 催化剂的XPS分析结果Table 2. XPS results of catalysts样品 Sample 表面原子浓度/% Surface atomic concentration Mn4+/Mn3+ Oα/(Oα+Oβ) Mn(8)/DE-HAL(SP) 83.46 86.70 Mn(8)/DE-HAL(SP-300) 66.36 77.16 Mn(8)/DE-HAL(IP-300) 68.93 75.12 2.2.5 H2-TPR分析
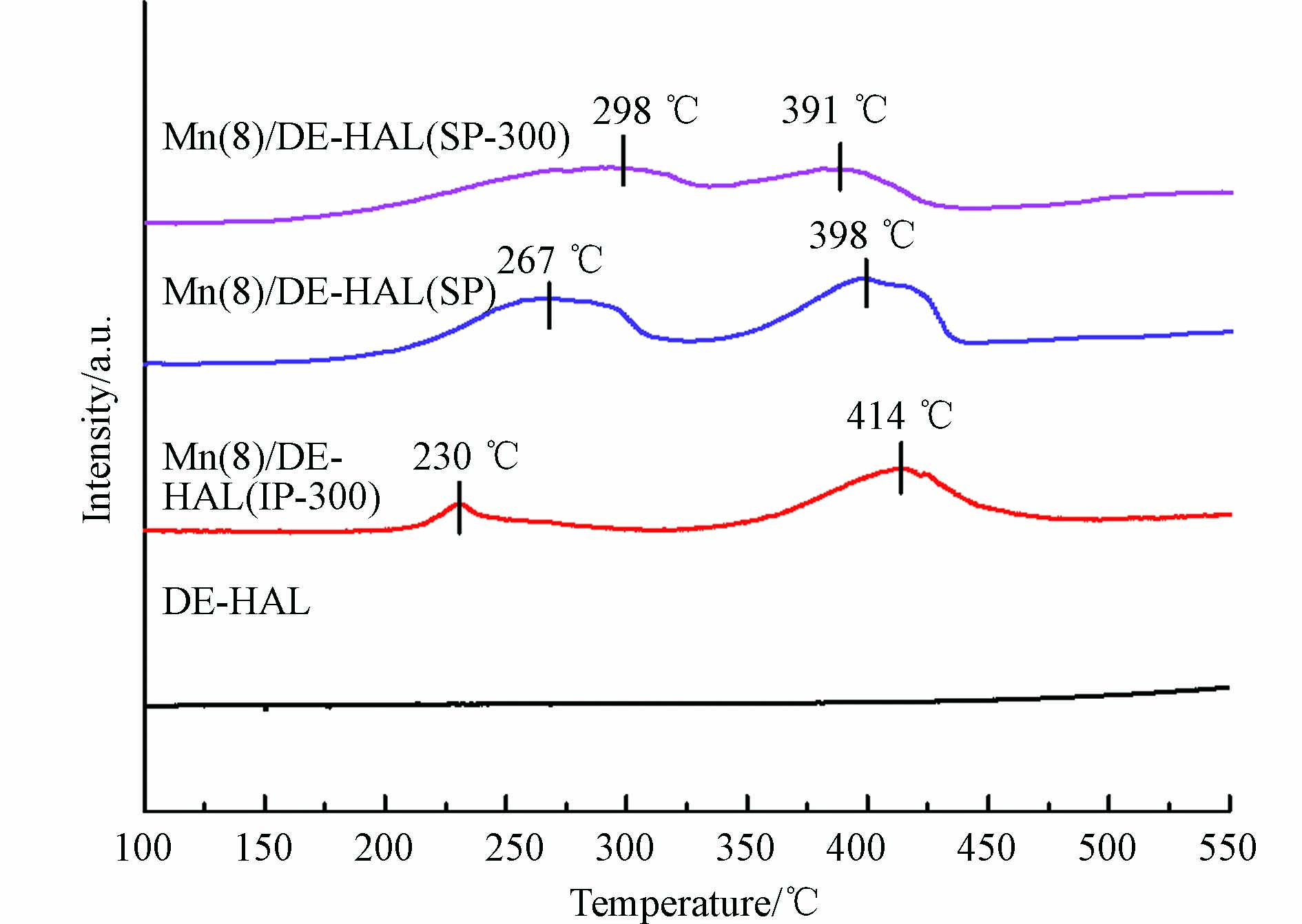
通过H2-TPR对催化剂氧化还原能力进行测试, 结果如图7所示, 未负载活性组分的陶瓷在100—550 ℃之间没有明显的还原峰, 而Mn(8)/DE-HAL(SP)在267 ℃和398 ℃处出现了2个还原峰, Mn(8)/DE-HAL(SP-300)在298 ℃和391 ℃处出现了两个还原峰, Mn(8)/DE-HAL(IP-300)的2个还原峰分别出现在230 ℃和414 ℃处, 催化剂在100—550 ℃之间的2个还原峰分别归因于MnO2到Mn2O3的还原和Mn2O3到MnO的还原[27]. 虽然Mn(8)/DE-HAL(IP-300)第1个还原峰温度最低, 但其峰面积较小, 而H2消耗峰的面积在某种程度上可以反应出催化剂表面活性物种的数量, 可以看出, Mn(8)/DE-HAL(IP-300)表面Mn4+浓度相对较低, 这与XPS结果是一致的. 原位生长法所制备的样品, 活性组分虽然仅分散在载体表面, 但却表现出更强的还原性, 这意味着载体表面的活性组分对催化剂的氧化还原能力有重要影响. 在低温区域, Mn(8)/DE-HAL(SP)的还原峰比Mn(8)/DE-HAL(SP-300)高, 且前者的H2消耗量也比后者大, 意味着Mn(8)/DE-HAL(SP)的氧化还原能力强于Mn(8)/DE-HAL(SP-300), 该结果表明, K的存在降低了催化剂的氧化还原能力.
2.2.6 NH3-TPD分析
图8为催化剂的NH3-TPD图谱. 研究表明, 在NH3-TPD中, 200 ℃以下的峰可归因于NH3在弱酸位点上物理和弱化学吸附的连续解吸, 200—450 ℃范围内的峰可归因于中弱酸位点[19]. 酸性位点的数量与分布情况是催化剂脱硝性能的重要影响因素, 是保证NH3吸附和活化的前提[23], 其中, 位于100—350 ℃的酸性位点数量影响催化剂低温下的脱硝性能[28].
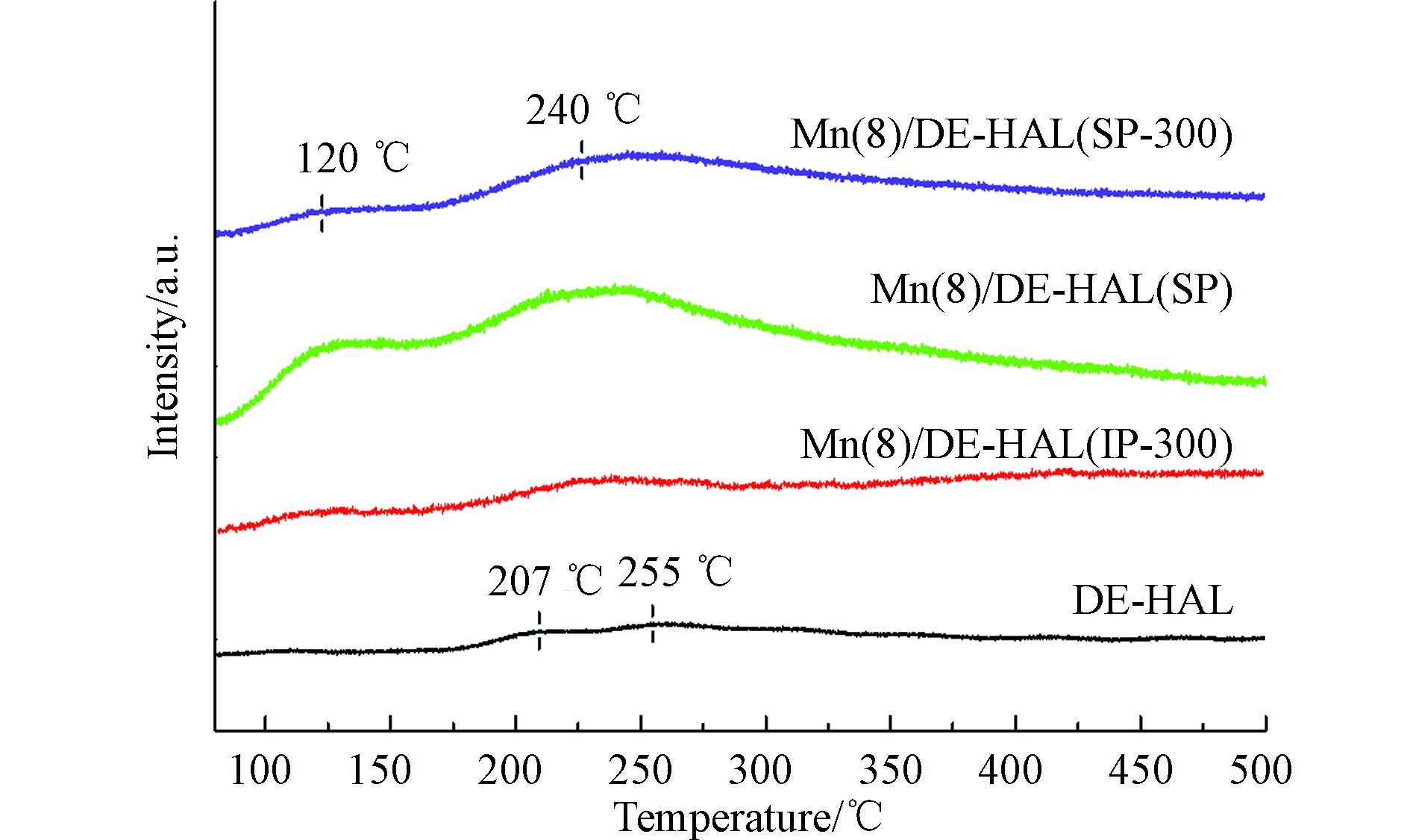
由图8可观察到, 未负载活性组分的陶瓷分别在207 ℃和255 ℃处出现了脱附峰, 3个催化剂分别在120 ℃和240 ℃处出现了脱附峰, 三者峰面积相差较大, 研究表明, NH3-TPD的峰面积与酸性位点的含量呈正比[29]. 对样品的峰面积进行拟合计算, 结果列于表3, 由计算结果知, 样品的峰面积大小顺序为Mn(8)/DE-HAL(SP) > Mn(8)/DE-HAL(IP-300) > Mn(8)/DE-HAL(SP-300). 研究表明, 碱金属会占据部分酸性位点, 降低催化剂对NH3的吸附与活化能力[16], 这是Mn(8)/DE-HAL(SP-300)的NH3脱附峰面积较小的重要原因. 采用原位生长法制备的催化剂, 活性组分富集在陶瓷颗粒表面, 使得样品表面含有大量酸性位点, 催化剂表面酸性位点越多, 吸附在其表面的氨种类就越多, 越有利于SCR反应.
表 3 样品的NH3-TPD积分结果Table 3. NH3-TPD integration of samples样品Sample Mn(8)/DE-HAL(SP) Mn(8)/DE-HAL(SP-300) Mn(8)/DE-HAL(IP-300) DE-HAL NH3-TPD /(eV·s) 1.18×10−7 1.09×10−7 1.14×10−7 1.06×10−7 2.2.7 NO-TPD分析
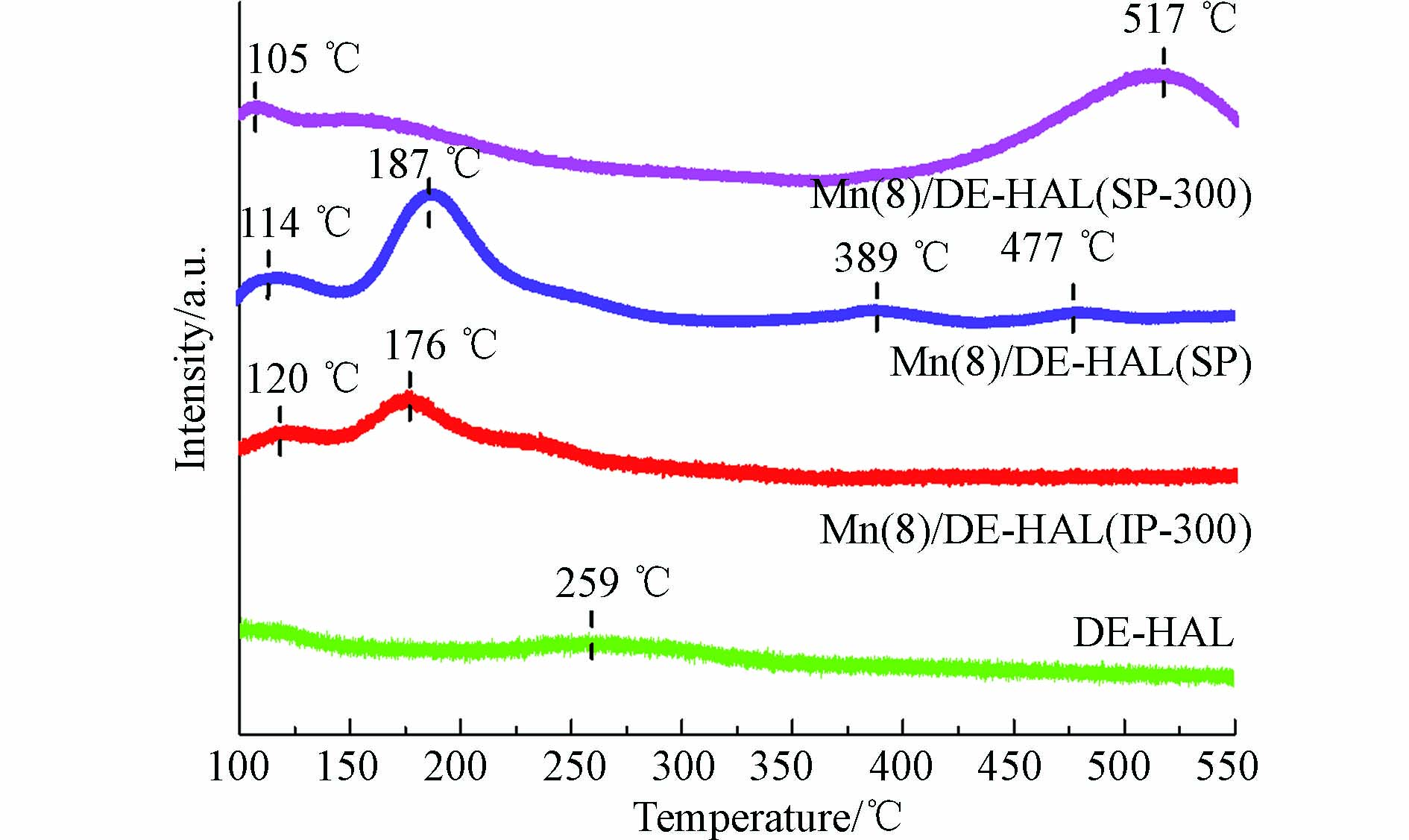
为了探明NO在催化剂表面的吸脱附行为与温度的关系, 对DE-HAL多孔陶瓷以及催化剂进行了NO-TPD测试. 如图9所示. DE-HAL仅在259 ℃有1个不明显的峰, Mn(8)/DE-HAL(IP-300)的脱附峰出现在120 ℃和176 ℃处. Mn(8)/DE-HAL(SP)分别在114 ℃和187 ℃处出现了2个脱附峰, 在389 ℃和477 ℃处出现了2个脱附峰. Mn(8)/DE-HAL(SP-300)分别在105 ℃个517 ℃处出现了NO的脱附峰. 研究表明, 200 ℃以下的脱附峰是由于催化剂表面弱配位的单齿亚硝酸盐物种的受热分解, 200 ℃以上的峰则是由于强配位的桥式亚硝酸盐和双齿硝酸盐的受热分解[30-31]. 在3个催化剂中, Mn(8)/DE-HAL(SP)在200 ℃以下的脱附峰面积最大, 表明其表面存在较多的亚硝酸盐, 这些物种有利于促进SCR反应的进行. 与Mn(8)/DE-HAL(SP)相比, Mn(8)/DE-HAL(SP-300)的脱附峰向更高温度转移, 这可能是由于K的存在改变了催化剂表面的化学环境, 影响了桥式亚硝酸盐和双齿硝酸盐分解温度.
2.3 催化剂制备过程机理
图10为催化剂制备过程中MnOx的负载机理图.
两种方法制备MnOx的原理虽不相同,但第一步均是将多孔陶瓷载体浸渍于Mn(Ac)2溶液中, 在这个过程中, Mn(Ac)2会分布于多孔陶瓷的表面以及内部孔隙中. 随后,原位生长法制备催化剂的过程中会往溶液中加入化学计量的KMnO4, 部分KMnO4与多孔陶瓷表面的Mn(Ac)2反应被消耗, 未被消耗的部分会将载体内部的Mn(Ac)2吸引到表面进行氧化还原反应, 所生成的MnOx均聚集在多孔陶瓷表面. 而浸渍法则是通过煅烧使Mn(Ac)2分解生成MnOx, Mn(Ac)2在分解过程中迁移较少. 最终, 所生成的活性组分分布于多孔陶瓷表面与内部孔隙中. 分散在载体表面的MnOx更容易与混合气体接触, 从而参与SCR反应, 而由于传质阻力, 混合气体不易进入到载体内部, 这意味着载体内部的活性组分对催化剂的催化活性贡献较小. 结合前面的数据与表征分析可知, 20—40目多孔陶瓷载体表面的活性组分在SCR反应中具有重要作用,原位生长法使活性组分富集在载体表面, 这一方面提升了催化剂的催化活性, 另一方面也提高了MnOx的利用率.
3. 结论(Conclusion)
原位生长法制备催化剂的过程中, MnOx最终只存在于多孔陶瓷颗粒表面, 浸渍于载体内部的Mn(Ac)2并非随着水洗抽滤被除去, 而是迁移到载体表面与KMnO4发生反应被消耗完全; 采用浸渍法制备的催化剂, 活性组分分散在载体表面与多孔陶瓷内部. 分布在20—40目多孔陶瓷颗粒载体表面的活性组分更容易与混合反应气体接触, 在SCR反应中发挥着重要作用, 而载体内部的活性组分由于传质阻力, 不易参与到SCR反应中. 原位生长法使活性组分聚集到载体表面, 既提升了催化剂的脱硝能力, 又提高了MnOx的利用率.
-
表 1 污水处理厂二级出水病原微生物检测结果
Table 1. Detection results of pathogens in secondary water of sewage treatment plant
月份 粪大肠杆菌/(103个·L−1) 沙门氏菌/(103 CFU·L−1) 金黄色葡萄球菌/(103 CFU·L−1) 粪链球菌/(103 CFU·L−1) 腺病毒 轮状病毒 柯萨奇病毒 3月 608 303 0 95 − − + 4月 1 680 320 0 1 360 − + − 5月 362 130 37 213 + + − 6月 1 320 160 0 203 + + + 7月 3 560 200 232 2 560 + + − 8月 3 850 150 102 2 850 + + + 9月 370 110 0 106 + + − 10月 950 260 0 1 800 − + + 11月 680 280 0 950 − − − 注:“+”为阳性,“−”为阴性。 表 2 浮选用水和矿物颗粒中粪大肠杆菌暴露感染概率
Table 2. Probability of Fecal escherichia coli exposure in flotation water and mineral particles
暴露途径 岗位 单次暴露风险 年暴露风险 4 mg·L−1臭氧 6 mg·L−1臭氧 4 mg·L−1臭氧 6 mg·L−1臭氧 浮选用水 SP1 8.09×10−5 1.35×10−6 1.62×10−3 4.70×10−4 矿物颗粒 SP2 2.24×10−6 4.00×10−7 4.47×10−5 7.99×10−6 SP3 1.42×10−6 1.60×10−7 2.84×10−5 3.21×10−6 SP4 4.08×10−7 1.23×10−7 8.15×10−6 2.42×10−6 SP5 4.79×10−7 7.99×10−8 9.59×10−6 1.59×10−6 SP6 4.00×10−7 1.79×10−7 7.99×10−6 3.52×10−6 SP7 4.79×10−7 8.79×10−8 9.60×10−6 1.76×10−6 SP8 2.40×10−7 9.59×10−8 4.79×10−6 1.92×10−6 SP9 1.60×10−7 4.79×10−8 3.20×10−6 7.99×10−6 SP10 4.02×10−7 6.39×10−8 7.89×10−6 1.8×10−6 表 3 再生水铜钼混合浮选闭路实验结果
Table 3. Results of copper-Molybdenum mixed flotation using reclaimed water
水质种类 品位/% 回收率/% 铜 钼 铜 钼 混合水 16.54 0.64 68.77 46.87 臭氧氧化后的混合水 19.35 1.05 81.54 75.36 二级出水 20.99 1.14 82.54 76.33 臭氧氧化后的二级出水 24.86 1.68 86.28 79.55 自来水 25.91 1.80 90.60 88.40 表 4 浮选用水水质
Table 4. water quality in flotation process
水质种类 COD/(mg·L−1) 悬浮物/(mg·L−1) 浊度/(NTU) 氨氮/(mg·L−1) 总磷/(mg·L−1) pH 混合水 170.87 155.67 20.55 67.42 6.65 7.8 臭氧氧化后的混合水 71.42 50.78 5.34 15.44 2.30 7.2 二级出水 65.50 56.34 3.42 5.65 1.60 7.5 臭氧氧化后的二级出水 22.70 50.55 1.85 1.81 1.35 7.6 自来水 2.34 5.62 1.65 0.52 0.10 7.2 -
[1] WÉRY N, LHOUTELLIER C, DUCRAY F, et al. Behaviour of pathogenic and indicator bacteria during urban wastewater treatment and sludge composting, as revealed by quantitative PCR[J]. Water Research, 2008, 42(1-2): 53-57. [2] 张振兴, 王江权, 郑祥. 水体病原微生物定量风险评价: 历史、现状与发展趋势[J]. 环境科学学报, 2016, 36(1): 1-6. [3] ESFAHANI A R, BATELAAN O, HUTSON J L. Combined physical, chemical and biological clogging of managed aquifer recharge and the effect of biofilm on virus transport behavior: A column study[J]. Journal of Water Process Engineering, 2019, 33 (10): 1-11. [4] BEAUDEQUIN D, HARDEN F, ROIKO A , et al Modelling microbial health risk of wastewater reuse: Asystems perspective [J]. Environment International , 2015, 84 (8) : 131-141 [5] 孙傅, 沙婧, 张一帆, 等. 城市景观娱乐水体微生物风险评价[J]. 环境科学, 2013, 34(3): 934-942 [6] KISTEMANNA T, SCHMIDT A A , FLEMMING H C. Post-industrial river water quality: Fit for bathing again? [J]. International Journal of Hygiene and Environmental Health, 2016, 219 (7) : 629-642. [7] ABIA, A L K, EUNICE U J, GENTH B, et al. Quantitative microbial risk assessment (QMRA) shows increased publichealth risk associated with exposure to river water under conditions ofriverbed sediment resuspension[J]. Science of the Total Environment, 2016, 566/567(5): 1143-1151. [8] 吴乾元, 李永艳, 胡洪营, 等. 再生水在洗车利用中的暴露剂量研究[J]. 环境科学学报, 2013, 33(3): 845-850. [9] 王连杰, 李金河, 郑兴灿等. 城镇污水系统中病毒特性和规律相关研究分析[J]. 中国给水排水, 2020, 36(6): 14-21. [10] 董慧峪, 李凌菲, 刘沛峰, 等. 饮用水消毒工艺对病毒的灭活[J]. 环境工程学报, 2020, 14(7): 1718-1727. doi: 10.12030/j.cjee.202002138 [11] 张松, 李菲菲, 史晨, 等. 生活污水的臭氧深度处理及其急性毒性[J]. 环境工程学报2017, 11(6): 3469-3474. [12] 潘观连, 张逢, 席劲瑛, 等. 臭氧对再生水中指示病原微生物的灭活特性[J]. 环境工程学报2015, 9(7): 3192-3196. [13] MELNIK L O, VAKULENKO V F, SAPRYKINA M M, et al. Change of the oxidation-reduction potential of model and natural waters in the ozone disinfection process[J]. Journal of Water Chemistry and Technology, 2021, 43(1): 85-91. [14] TORII S, MIURA F, ITAMOCHI M, et al. Impact of the heterogeneity in free chlorine, UV254, and ozone susceptibilities among coxsackievirus B5 on the prediction of the overall inactivation efficiency[J]. Environmental Science and Technology, 2021, 55(5) : 3156-3164 [15] ZHAO J, SHANG C, ZHANG X, et al. The multiple roles of chlorite on the concentrations of radicals and ozone and formation of chlorate during UV photolysis of free chlorine[J]. Water Research, 2021, 190(11): 116680. [16] 刘洪均, 徐涛, 孙春宝. 城市中水用于乌努格吐山铜钼矿浮选过程的研究[J]. 有色金属:选矿部分, 2014(1): 56-60. [17] 窦培谦, 寇珏, 孙春宝, 等. 城市再生水中大肠杆菌在浮选过程中迁移规律[J]. 工程科学学报, 2017, 39(5): 669-675. [18] 窦培谦, 寇珏, 孙春宝, 等. 城市再生水中病毒对浮选过程的影响规律[J]. 中国矿业, 2017, 26(8): 133-139. [19] 窦培谦, 孙春宝. 城市再生水回用于浮选的健康风险评价及应急处置[J]. 安全与环境学报, 2018, 18(1): 252-256. [20] 中华人民共和国国家卫生和计划生育委员会. 食品微生物学检验 粪大肠菌群计数: GB 4789.39-2013 S].
[21] 程丽娟, 薛泉宏. 微生物学实验技术[M]. 北京: 科学出版社, 2012. [22] ABIA L K A, UBOMBA-JASWA E, SSEMAKALU C C, et al. Development of a rapid approach for the enumeration of Escherichia coli in riverbed sediment: Case study, the Apies River, South Africa[J]. Journal of Soils and Sediments, 2015, 15(12): 2425-2432. [23] FEWTRELL L, BARTRAM J. Water Quality: Guidelines, Standards and Health-Assessment of Risk and RiskManagement for Water-Related Infectious Disease World Health Organization (WHO) Water Series[M]. London, IWA Publishing, 2001. [24] USEPA & USDA/FSIS. Microbial risk assessment guideline: Pathogenic microorganisms with focus on food andwater[EB/OL]. (2012-07)[2022-04].https://www.epa.gov/risk/microbial-risk-assessment-guideline-pathogenic-microorganisms-focus-food-and-water. [25] 郑晓英, 王俭龙, 李鑫玮等. 臭氧氧化深度处理二级处理出水的研究[J]. 中国环境科学, 2014, 34(5): 1159-1165. [26] 窦培谦. 再生水中病原微生物在铜钼矿浮选过程中的迁移特征研究[D]. 北京: 北京科技大学, 2019. -




 下载:
下载: