-
噻虫胺(Clothianidin,CLO)是第2代新烟碱类杀虫剂,与吡虫啉、噻虫嗪并列为3大最广谱的新烟碱类农药,其占新烟碱类农药使用量的14.3%,具有广谱、触杀、胃杀和內吸性等特点,可用于控制半翅目、鞘翅目和某些鳞翅目等害虫[1-3]。从20世纪90年代进入市场以来,新烟碱类杀虫剂的生产量、销售量和使用量持续增长,并在环境水体中被广泛检出且具有较高存在水平[4]。2016年珠江流域的3条主干河流水样检测结果显示噻虫嗪、噻虫胺和啶虫脒等3种新烟碱类杀虫剂检出率为100%[5]。2019年我国地下水中检出噻虫胺的最大质量浓度达到0.137 μg·L−1[6]。残留的新烟碱类杀虫剂会对环境生物产生毒害作用,研究表明当花粉中噻虫胺等新烟碱类杀虫剂达到亚致死剂量时会对蜜蜂等授粉类昆虫生存造成多方面困难,包括掌握花卉特性、导航以及觅食等[7]。因此,如何有效去除环境中残留的新烟碱类杀虫剂成为环境污染与修复领域亟待解决的问题之一。
生物炭是生物质(包括农业残留物、富含生物质的动植物、粪肥、污泥等)在厌氧或缺氧的条件下热解和碳化后产生的高度芳香化物质,具有比表面积大、孔隙发达及含氧官能团丰富等优点[8-9]。生物炭能够通过π-π电子供体-受体相互作用、静电吸附作用、氢键作用、疏水分配和孔填充效应等方式吸附去除包括抗生素[10-11]、农药[12-13]、苯系物[14-15]等污染物。目前,越来越多的研究开始通过物理、化学和生物等方法对生物炭进行改性,以进一步提高其对污染物的去除能力[16-20]。
化学改性是目前最常用的改性方法,通常包括酸碱改性法、氧化还原改性法和高分子材料改性法[21]。高锰酸钾具有强氧化性,且能够分解生成价态丰富的锰氧化物,能够对生物炭起到良好的改性效果。一方面能够通过氧化作用对生物炭的比表面积、孔隙结构、官能团等理化性质产生影响,另一方面其分解生成的锰氧化物具有较高的比表面积、较强的吸附和氧化能力以及在酸性和中性条件下稳定存在的优点,负载在生物炭上可提高污染物去除效率[22-23]。杉木是一种栽培广、生长快的树种,具有良好的生态和经济价值,本研究以杉木原木为原料,在700 ℃条件下烧制得到杉木生物炭,通过高锰酸钾在高温条件下改性生物炭,考察了改性后生物炭对水中噻虫胺的吸附性能及机理,为新烟碱类杀虫剂环境污染修复提供参考。
-
噻虫胺(C6H8ClN5O2S,纯度大于97.8%)购自上海阿拉丁生化科技股份有限公司,解离常数pKa=11.1,土壤半衰期24.3~26.4 d[24]。NaNO3为分析纯,购自无锡市晶科化工有限公司,Ca(NO3)·4H2O为分析纯,购自上海阿拉丁生化科技股份有限公司,HNO3为分析纯,购自无锡市展望化工试剂有限公司,NaOH为分析纯,购自上海泰坦科技股份有限公司,KMnO4为分析纯,购自无锡市展望化工试剂有限公司,实验用水均为超纯水,电导率为18.2 MΩ·cm。
-
高效液相色谱仪(e2695,美国Waters),用于CLO浓度定量分析;X射线衍射仪(XRD-6100,日本岛津),用于改性后生物炭表面锰氧化物晶型分析;扫描电子显微镜(SU8100,日本Hitachi),用于观察生物炭的表面形貌;傅里叶红外光谱仪(Cary660,美国Agilent),用于分析样品表面官能团;全自动比表面和孔隙度测定仪(Mini Ⅱ,日本Belsorp),用于测定生物炭的比表面积及孔隙结构;X射线光电子能谱仪(K-Alpha+,美国Thermo)用于分析MnOx-BC中Mn价态;X射线衍射(X´Pert PRO MPD,荷兰PANalytical B.V.),用于分析MnOx-BC中MnOx晶型。
-
1)杉木生物炭制备。将杉木切割成方形薄块(长×宽×高为3 cm×2 cm×0.5 cm),每个小块用锡箔纸包裹,放入150 mL石英坩埚内,置于马弗炉中,于700 ℃条件下高温热解6 h,炉内自然冷却后取出,研磨,过100目筛,封装备用。此生物炭标记为BC。
2)改性生物炭制备。采用LI等[25]的方法,在50 mL的刚玉坩埚中分别加入5 g BC,0.5 g高锰酸钾和40 mL超纯水,用玻璃棒搅拌均匀后,置于超声波清洗仪中超声2 h,80 ℃下烘干,将烘干的样品置于马弗炉中以20 ℃·min−1的升温速率加热到700 ℃,保持0.5 h后冷却至室温,取出样品,经反复真空抽滤后,真空冷冻干燥60 h,研磨过100目筛,装入自封袋中备用,将上述样品分别标记为MnOx-BC。
-
生物炭的零电荷点(pHpzc)采用WU等[26]的方法测定。具体方法为:实验在250 mL的具塞锥形瓶中进行,反应总体积为100 mL,首先,向具塞锥形瓶中加入1 mol·L−1的NaNO3溶液1 mL用于控制离子强度,然后,通过1 、0.1和0.01 mol·L−1的NaOH和HCl,依次将溶液的pH调节为3~11,加入30 mg生物炭,向具塞锥形瓶中通入0.8 L·min−1的N2,最后,将配好的溶液置于组合式恒温摇床中,摇床转速为200 r·min−1,经48 h后测定最终pH,ΔpH为最终pH与初始pH的差值,以初始pH与ΔpH作图,ΔpH=0时,即为生物炭的pHpzc。
-
实验在250 mL的具塞锥形瓶中进行,反应总体积为100 mL,噻虫胺母液质量浓度为100 mg·L−1,使用0.01 mol·L−1 HCl和NaOH溶液调节溶液pH,使用1.0 mol·L−1 NaNO3溶液调节离子强度。吸附反应在组合式恒温摇床中进行,摇床转速为200 r·min−1。采用5 mL的针筒注射器取样,经0.45 μm的混合纤维素滤膜过滤后,使用高效液相色谱检测溶液中剩余污染物浓度。
在进行吸附动力学实验时,溶液初始pH为5.0,温度为25 ℃,噻虫胺质量浓度初值为10 mg·L−1,生物炭添加量为0.3 g·L−1,取样时间分别为0.25、0.5、1、2、4、6、8、12、24 h。测定各时间点时溶液中剩余污染物浓度,用准一级动力学模型和准二级动力学模型对实验数据进行拟合,取3个平行组的实验结果平均值。
在进行等温吸附实验时,噻虫胺的质量浓度设为3.0、5.0、8.0、10、15、18、20 mg·L−1,生物炭添加浓度为0.3 g·L−1,温度分别为15、25和35 ℃。吸附24 h后取样,测定溶液中噻虫胺浓度,用Langmuir和Freundlich模型拟合实验数据。
在考察初始pH和离子强度对吸附的影响时,本实验使用1、0.1和0.01 mol·L−1 HCl和NaOH分别将噻虫胺溶液初始pH调节为3.0、5.0、7.0、9.0、11.0,以考察初始pH对吸附效果的影响。用1.0 mol·L−1的NaNO3和Ca(NO3)2调节溶液中金属离子质量浓度分别为0、0.01、0.1和0.5 mol·L−1,以考察离子强度对吸附效果的影响,其余条件与吸附动力学实验一致。
-
噻虫胺采用高效液相色谱检测,吸收波长为265 nm,色谱柱为XBridge@C18(250 mm × 4.6 mm,5 μm),柱温为30 ℃,流动相甲醇与水的体积比为45∶55。生物炭对噻虫胺的去除率(R)和吸附量(qe)分别根据式(1)和式(2)计算;采用准一级动力学方程(式(3))、准二级动力学方程(式(4))和内部扩散方程(式(5))对吸附动力学过程进行拟合;采用Langmuir(式(6))和Freundlich(式(7))吸附模型对吸附过程进行拟合。
式中:R为生物炭对噻虫胺的去除率;qe为生物炭平衡吸附量,mg·g−1;C0和Ce分别为噻虫胺的初始质量浓度和平衡质量浓度,mg·L−1; V为反应溶液体积,L;m为生物炭添加量,g。
式中:qt和qe分别为t时刻和吸附平衡时噻虫胺吸附量,mg·g−1;k1为准一级吸附动力学速率常数,min−1;k2为准二级吸附动力学速率常数,g·(mg·min)−1;k3为颗粒内扩散速率常数,mg·(g·min1/2)−1。
式中:qe和qm分别为平衡吸附量和理论最大吸附量,mg·g−1;Ce为吸附平衡质量浓度,mg·L−1;KF和KL分别是Langmuir和Freundlich方程的相关系数,1/n为Freundlich的经验系数。
-
图1为BC和MnOx-BC的扫描电镜图。可见,BC和MnOx-BC表面形貌并无明显差异,生物炭表面均有一些圆孔结构。这可能是因杉木组分中的纤维素等在缺氧条件下分解为有机气体在高温条件下挥发溢出所致[27]。MnOx-BC表面出现了许多颗粒物,尤其在圆孔结构内颗粒更多,可能是高锰酸钾改性后生物炭表面生成的含锰化合物。通过抗坏血酸溶解和微波消解处理高锰酸钾改性生物炭,测得改性后生物炭中Mn的质量分数达到4.09%。
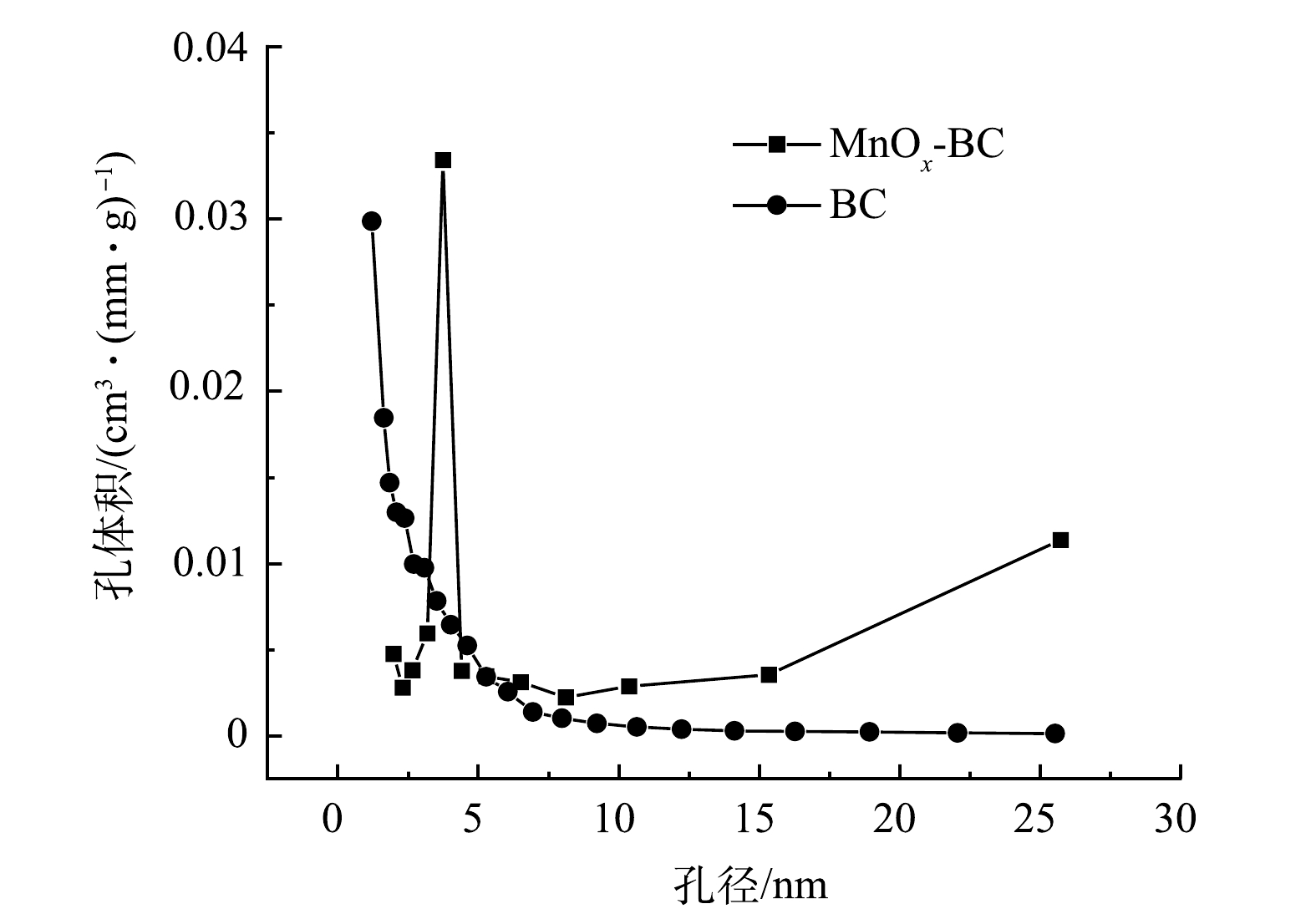
对改性前后生物炭的比表面积和孔隙结构进行表征分析,结果见图2和表1。经过高锰酸钾改性后生物炭比表面积、孔体积和平均孔径均得到一定程度的提升,比表面积和孔体积分别较原始生物炭提高了12.08%和12.33%。改性生物炭比表面积提高可能是因为高锰酸钾活化了杉木生物炭的表面以及负载于生物炭表面的MnOx本身具有一定的比表面积所致[28]。改性后生物炭的零电荷点有所升高,表明改性后生物炭表面可带有更多的负电荷,这种变化则更有利于其对噻虫胺的吸附。
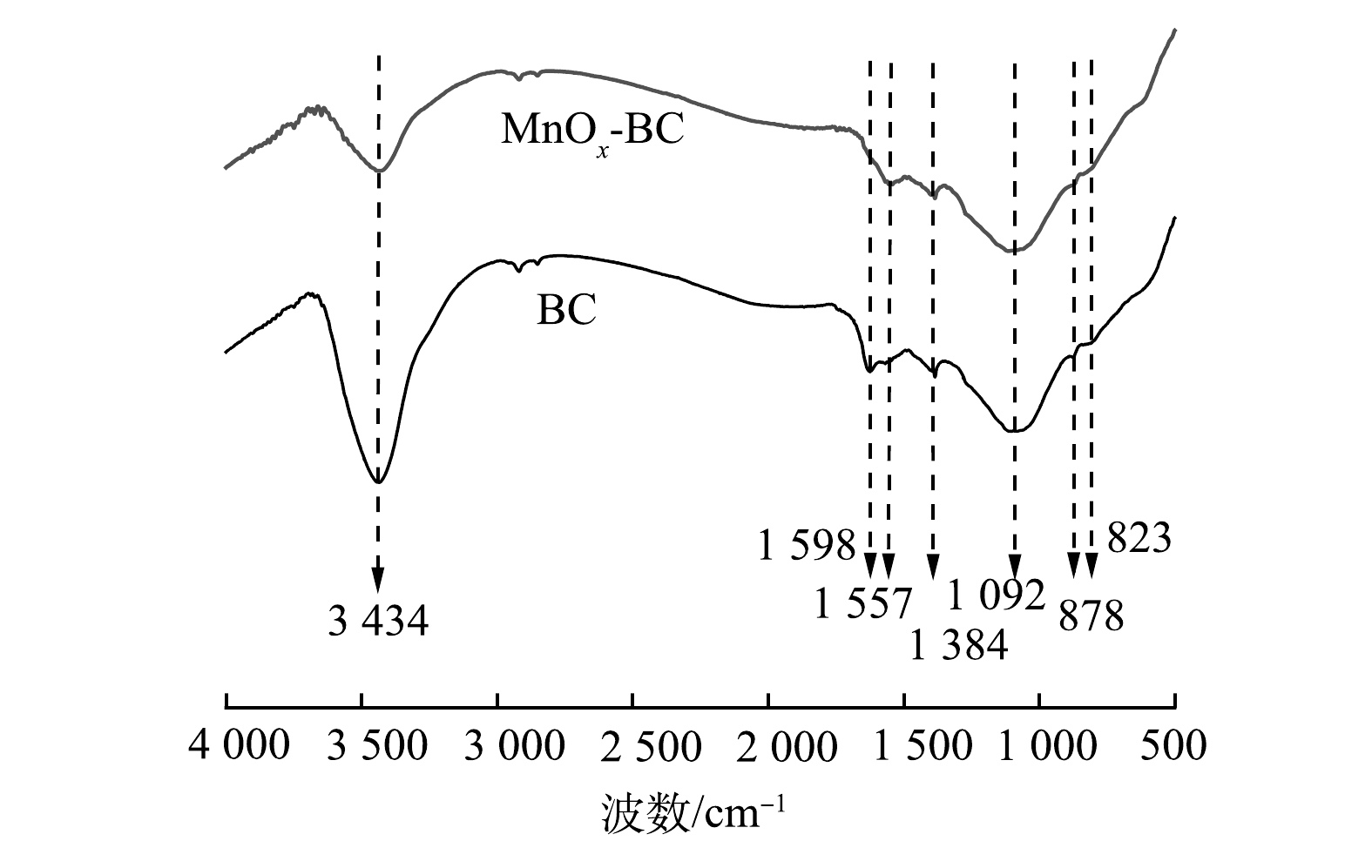
图3为BC和MnOx-BC的傅里叶红外光谱图。可以看出,BC和MnOx-BC具有许多相似的特征峰。3 434 cm−1处的宽峰是酚羟基(—OH)的伸缩振动峰,1 598 cm−1处的吸收峰是芳香环中的C=O伸缩振动峰,1 384和1 092 cm−1处的吸收峰可以归因于羧基(—OH)的弯曲模式和C—O拉伸振动,878 cm−1和823 cm−1附近的吸收峰主要是由于C—H伸缩振动引起的[29-32]。BC和MnOx-BC差异较大的是改性后生物炭在1 520 cm−1处出现了不饱和C=C伸缩振动特征峰。此外,在500~800 cm−1内没有发现明显的Mn—O振动峰,这可能与负载量相关。
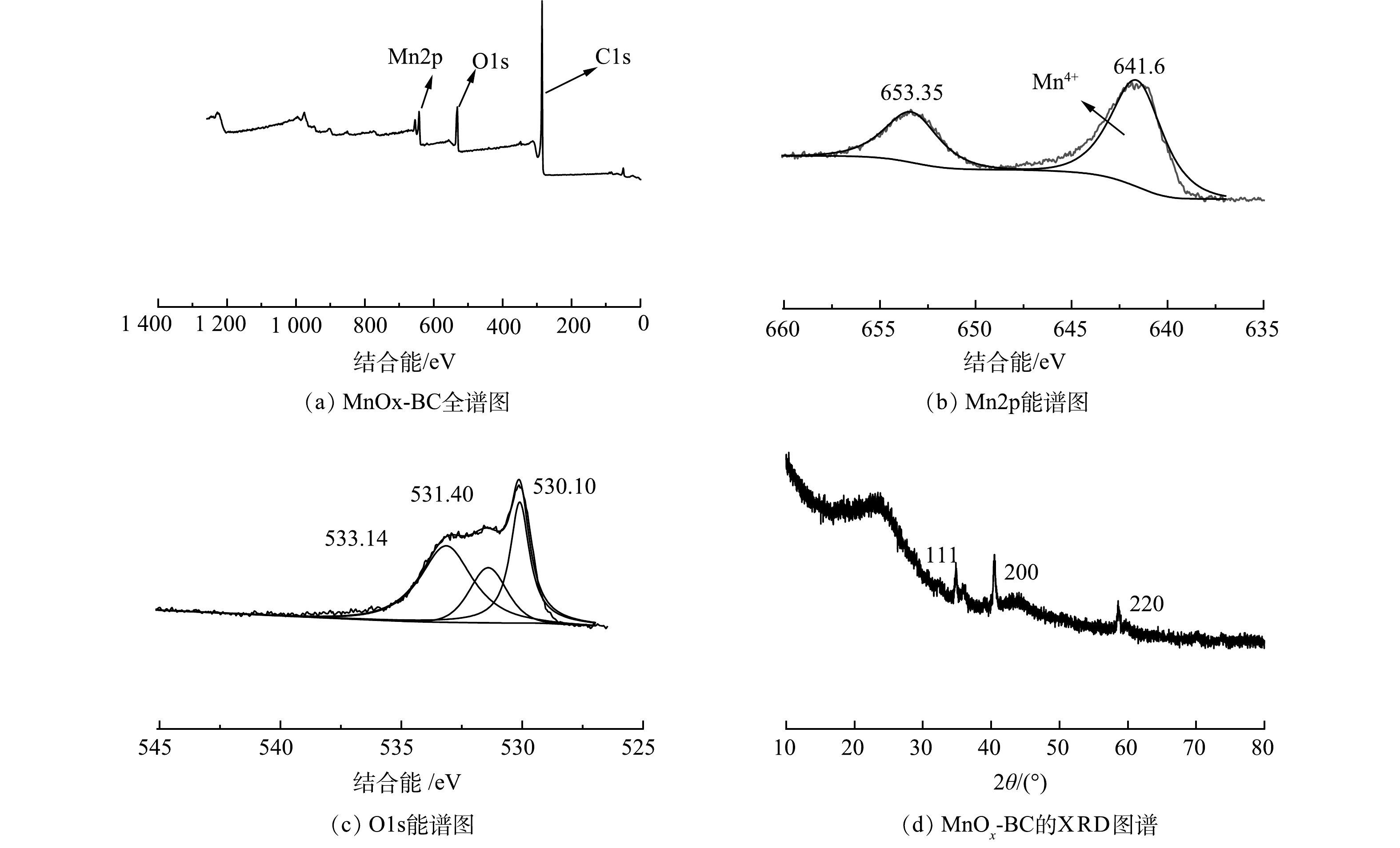
采用X-射线光电子能谱(XPS)对MnOx-BC表面的Mn元素进行价态分析,采用X射线衍射(XRD)对MnOx-BC的晶体结构进行分析。由图4(a)可知,MnOx-BC主要含有的元素为C、O和Mn。分别对Mn和O的谱图进行分峰拟合,结果表明,对MnOx-BC的Mn2p能谱图拟合出现了2个峰,其中结合能在653.35 eV和641.60 eV处的谱峰属于Mn2p1/2和Mn2p3/2,Mn2p1/2与Mn2p3/2之间的间距为11.75 eV,表明在MnOx中有Mn4+的存在[33]。O1s能谱图中在530.10、531.40和533.14 eV处出现了3个特征峰,表明MnOx-BC存在着MnO2、金属锰氧化物(Mn-O)以及羟基(-OH)[34]。由图4(d)可见,整体上X射线衍射图谱衍射峰不尖锐,表面改性后生成的锰氧化物的结晶度差,属于无定型锰氧化物。MnOx-BC在34.9°、40.5°和58.7°处出现衍射峰,与γ-MnO2的衍射峰位置最为接近[35]。
-
BC和MnOx-BC对噻虫胺的吸附动力学如图5所示。由图5可见,BC和MnOx-BC对溶液中的噻虫胺呈现出相近的吸附动力学过程。BC和MnOx-BC对噻虫胺的吸附量在短时间内(30 min)随着时间的推移而迅速增大,之后伴随吸附增速减缓过程,8 h后,吸附量趋于稳定。此现象与生物炭表面的活性位点有限性有关,吸附初始阶段,生物炭表面的活性位点充分,目标污染物能够迅速占据活性位点而呈现出吸附量的急速上升。随着吸附的继续进行,可供吸附的活性位点逐渐减少,吸附速率开始下降,最终,吸附趋于平衡。此现象与已有研究结果相类似[36]。
为了更好的评价2种生物炭的吸附特性及其速率控制步骤和机理,采用准一级和准二级动力学方程对BC和MnOx-BC吸附噻虫胺的动力学过程进行拟合,结果见表2。BC和MnOx-BC对噻虫胺的准二级动力学拟合R2(0.944和0.964),高于准一级动力学拟合的R2(0.877和0.900),且准二级动力学拟合的平衡吸附量较准一级更加接近于实验值。这说明MnOx-BC和BC对CLO的吸附过程受到2种以上因素共同影响[37]。
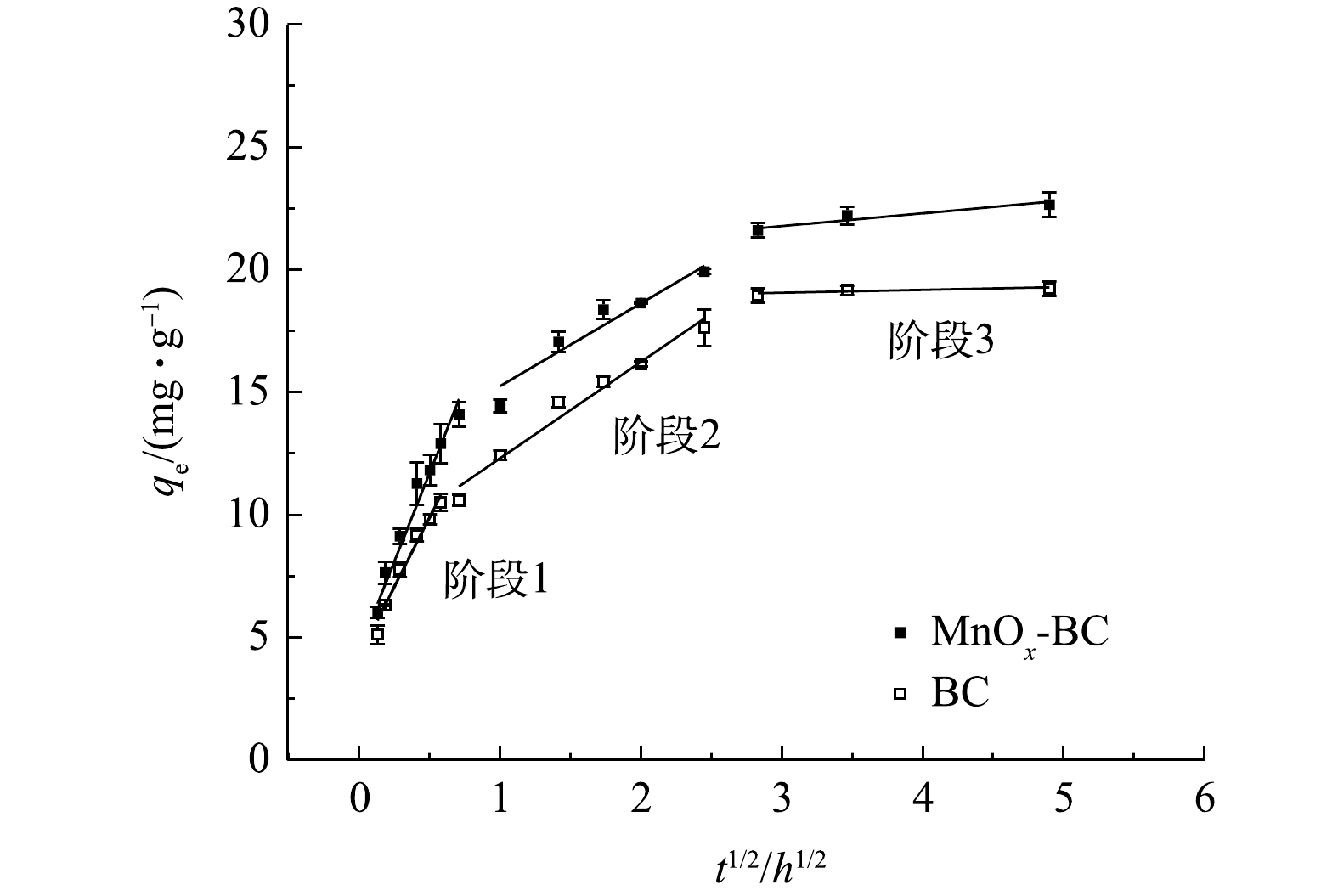
颗粒内扩散模型反映了吸附过程中的实际控速步骤和吸附机理[38]。由于实验条件及吸附材料和目标污染物的理化性质不同,吸附过程通常可分为阶段2和阶段3[39-40]。阶段2吸附机理为污染物通过液膜扩散到吸附剂表面和污染物在吸附剂表面发生吸附的2个过程。阶段3吸附机理为污染物跨水膜扩散到吸附剂表面、污染物在吸附剂孔隙内扩散和吸附趋平衡的3个过程。本研究中颗粒内扩散拟合结果见图6和表3。如图6所示,BC和MnOx-BC对噻虫胺的吸附过程存在明显的3个阶段,分别为污染物跨水膜扩散到吸附剂表面,污染物在吸附剂孔隙内扩散和吸附趋平衡3个过程。对比表3中的k值,每种生物炭吸附拟合斜率大小均为k1 > k2 > k3,说明污染物向吸附剂的扩散是速率逐渐减小直至达到吸附平衡的过程。BC和MnOx-BC阶段3的模型拟合程度均较低,此外,各阶段的拟合曲线均未经过原点,说明颗粒内扩散不是唯一的速率控制步骤。这与前述准二级动力学拟合结果一致,其他研究中也有类似结果[41]。本研究结果表明,BC和MnOx-BC对噻虫胺的吸附过程可能存在着表面吸附和孔隙填充作用。
-
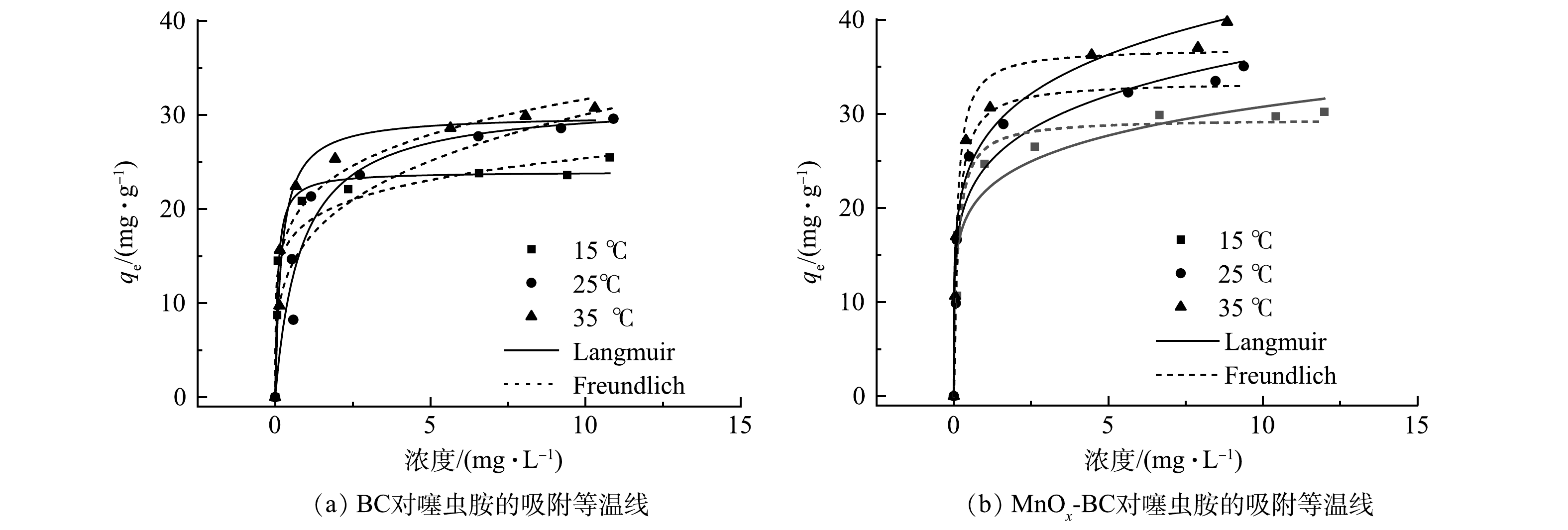
为了进一步了解BC和MnOx-BC对噻虫胺吸附容量和吸附机理,分别采用Langmuir和Freundlich吸附模型对数据进行拟合,结果见图7和表4。总体上,随着噻虫胺初始质量浓度的增加,BC和MnOx-BC的吸附量均呈现出先增加后稳定的现象。此外,随着温度的上升,BC和MnOx-BC的吸附量也同样有所增加,说明该吸附过程为吸热过程。Langmuir模型拟合的相关系数明显高于Freundlich,说明2种生物炭对噻虫胺的吸附属于单分子层吸附,温度对杀虫剂在BC和MnOx-BC上的吸附形式没有影响。使用Langmuir模型拟合计算出BC和MnOx-BC对噻虫胺的理论最大吸附容量分别为31.56 mg·g−1和37.00 mg·g−1。
-
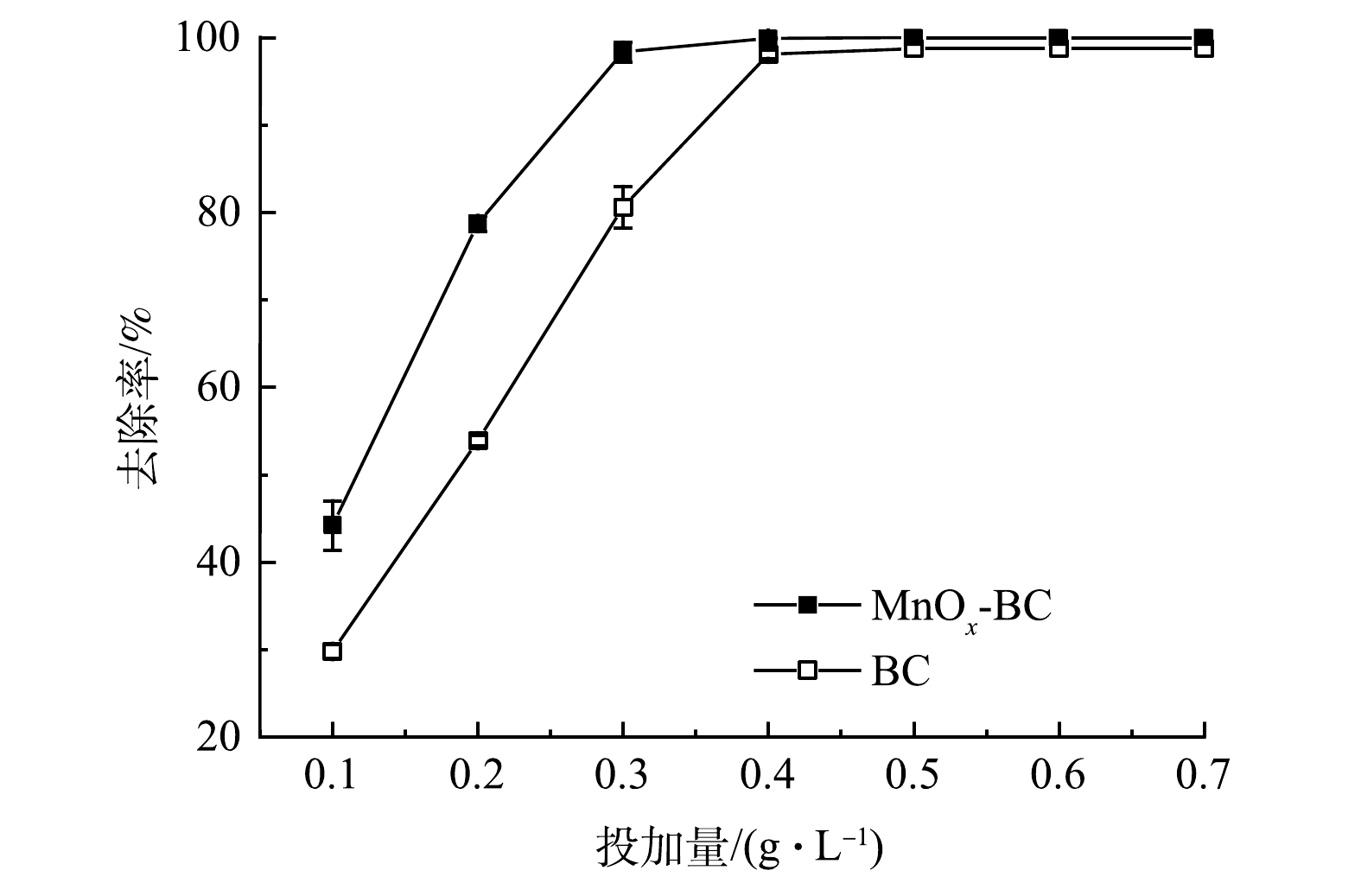
由图8可见,随着吸附剂投加量的增加,BC和MnOx-BC对噻虫胺的去除率均呈现出先增加后趋于平缓的趋势,在相同投加量下,MnOx-BC比BC有更好污染物去除效果。当MnOx-BC的投加量达到0.3 g·L−1时,噻虫胺的去除率达到98.36%,而达到相近的噻虫胺去除率,BC的投加量需要0.4 g·L−1。
-
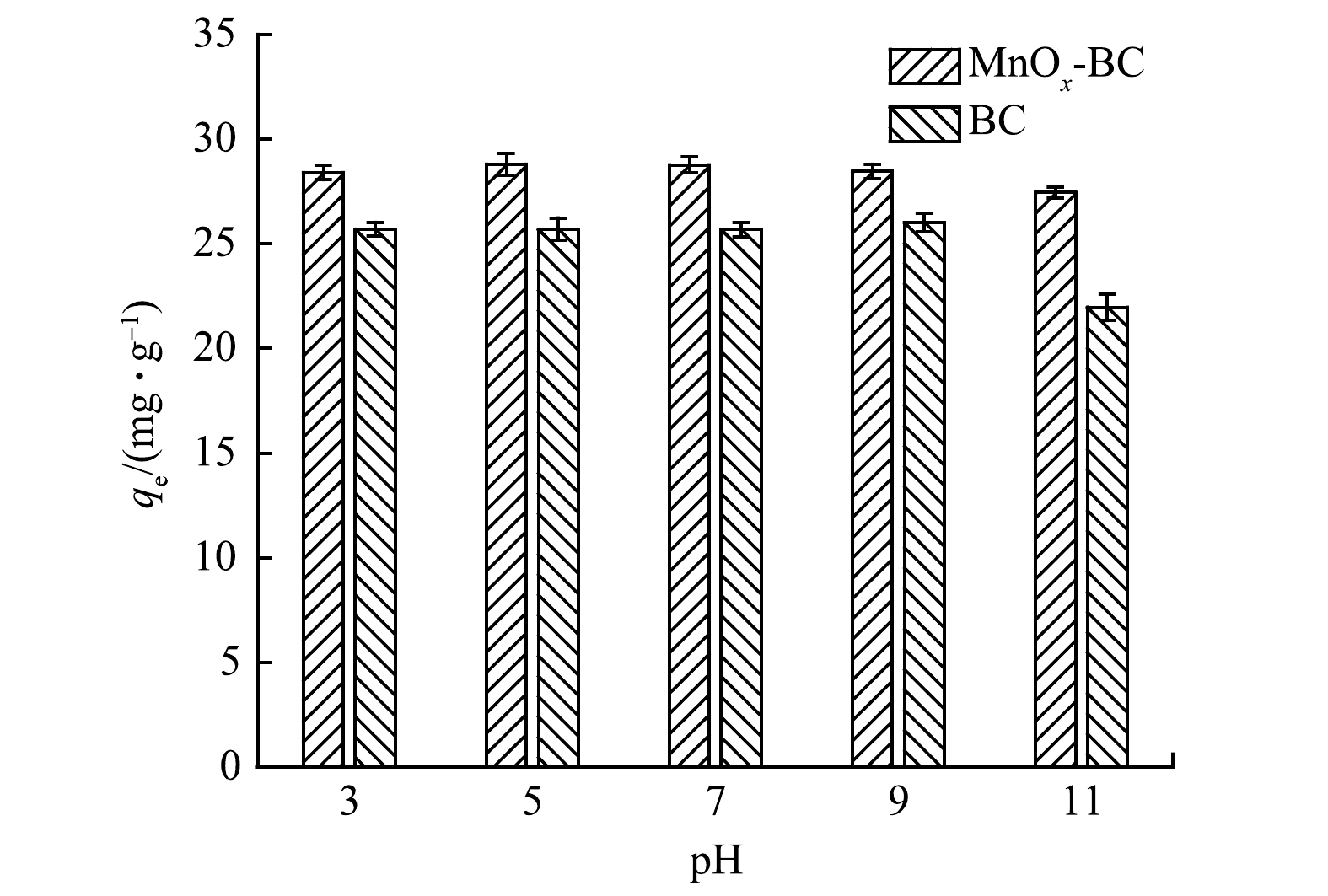
溶液pH是影响吸附效果的重要因素之一,影响目标污染物的解离程度和生物炭的表面电荷[42]。初始pH对BC和MnOx-BC吸附噻虫胺的影响如图9所示。由图9可以看出,当pH为3.0~9.0时,2种生物炭的吸附量未发生明显变化。这说明2种生物炭均能在较宽的pH范围内对新烟碱类杀虫剂具有良好的吸附效果。当初始pH为11时,BC和MnOx-BC对噻虫胺的吸附量均有所下降。这可能是由于碱性条件钝化了生物炭表面的活性位点和减弱了质子化的BC和MnOx-BC噻虫胺分子间的氢键作用[43-44]。此外,BC吸附量的下降幅度大于MnOx-BC,分别为15.4%和4.5%,说明改性后生物炭比原始生物炭有更好的吸附稳定性。
-
溶液离子强度对BC和MnOx-BC吸附噻虫胺的影响如图10所示。随着Na+和Ca2+浓度的增加,BC和MnOx-BC的吸附容量均有所下降。当Na+质量浓度由0增加到0.5 mol·L−1时,BC和MnOx-BC对噻虫胺的吸附量分别下降了和8.18%和5.49%。Ca2+质量浓度由0增加到0.5 mol·L−1时,BC和MnOx-BC对噻虫胺的吸附量分别下降了18.11%和13.65%。由此可知,Na+和Ca2+的添加对噻虫胺的吸附均有一定的抑制作用,且Ca2+的抑制作用大于Na+,这可能与2种离子的电荷量和电负性有关。一方面,相同浓度的Ca2+呈现的离子强度比Na+更高;另一方面,Ca2+的电负性(1.00)大于Na+(0.93),具有更强的水合能力,能更有效地占据生物炭表面的活性位点[45-46]。
-
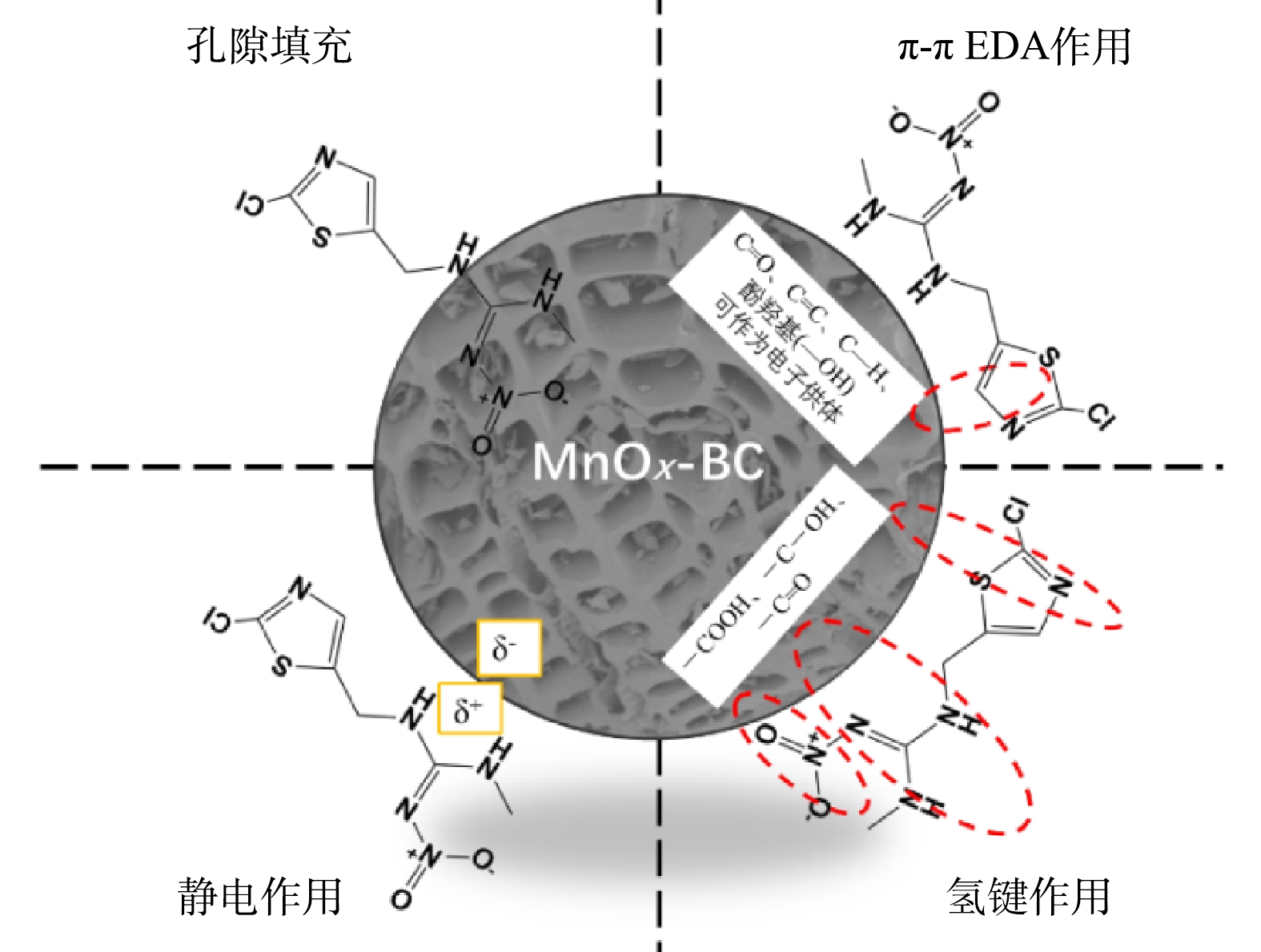
1)孔隙填充作用。孔隙填充作用主要由炭质材料的孔隙结构特性所决定[47]。由图2和表1可知,BC和MnOx-BC孔隙结构主要为中孔结构。通过颗粒内扩散方程拟合图7中颗粒内扩散的阶段2可知,噻虫胺在MnOx-BC孔隙内都得到一定量的富集。ZHU等[48]发现了比表面积和孔隙结构是影响生物炭吸附有机物的重要因素,并提出了孔填充机制。ZHAO等[49]也报道了孔隙填充作用在花生壳生物炭吸附吡虫啉中起到重要作用。基于此,孔隙填充作用是MnOx-BC能够吸附噻虫胺的重要机制之一。
2) π-π电子供体-受体(EDA)相互作用。噻虫胺的分子结构中含有芳香环π系统,使噻虫胺的π电子密度较低;苯杂环中的N、S原子的强吸电子作用会使得芳香环π系统的π电子密度进一步降低,使得噻虫胺可作为很强的π-电子受体;此外,由于噻虫胺分子中的氨基官能团可以将其孤立电子对给予芳香环,使得氨基官能团也可做为π-电子受体[44]。由图3可知,BC和MnOx-BC均具有C=O、C=C、C—H、羧基、酚羟基等官能团,其中C=O、C=C、C―H、酚羟基等芳香性官能团均可作为电子供体与噻虫胺形成π-π电子供体-受体相互作用[50-51]。
3)氢键作用。通过FT-IR分析可知,MnOx-BC表面均具有羧基(―COOH)、酚羟基(―OH)和羰基(C=O)等含氧官能团,这些官能团均能与噻虫胺分子中O和N原子容易形成氢键作用,促进MnOx-BC对噻虫胺的吸附。
4)静电作用。在本研究的初始pH范围内,噻虫胺以阳离子的形式存在于水溶液中。由表1可知,MnOx-BC的pHPZC=7.22,当平衡pH<pHPZC,MnOx-BC表面带正电,此时,MnOx-BC与噻虫胺并非表现为静电排斥,而是以阳离子-π相互作用发生吸附;当平衡pH>pHPZC时,MnOx-BC表面带负电,此时,MnOx-BC与噻虫胺之间可发生静电吸附作用。由图10可见,Na+和Ca2+对吸附过程呈现出的抑制作用也可以说明MnOx-BC对噻虫胺的吸附过程中存在静电吸附作用[52]。
综上所述,MnOx-BC对水溶液中噻虫胺的吸附机制主要包括孔隙填充、π-π电子供体-受体相互作用、氢键作用和静电作用,如图11所示。
-
1)高锰酸钾改性杉木生物炭,在生物炭表面负载晶型结构差的锰氧化物,改性后生物炭的孔隙更加丰富、比表面积更大,pHpzc更高,吸附性能得到进一步提高,使用Langmuir模型拟合得到MnOx-BC对噻虫胺的理论最大吸附量达到37 mg·g−1。
2) BC和MnOx-BC对噻虫胺的吸附动力学符合准二级动力学方程,且吸附过程存在3个阶段,依次为污染物跨水膜扩散到吸附剂表面阶段、污染物在吸附剂孔隙内扩散阶段和吸附平衡阶段。Langmuir模型能更好地拟合等温吸附数据,说明吸附过程属于单分子层吸附。MnOx-BC对pH和离子强度的变化表现出更好的吸附稳定性。
3) MnOx-BC对水溶液中噻虫胺的吸附机理主要包括孔隙填充、π-π电子供体-受体相互作用、氢键作用和静电作用。
高锰酸钾改性生物炭对水中噻虫胺吸附性能及机理
Adsorption of clothianidin by potassium permanganate modified biochar in aqueous solution
-
摘要: 以700 ℃热解制备的杉木生物炭(BC)为原料,采用高锰酸钾高温氧化法制备了改性生物炭(MnOx-BC),考察了其对广泛使用的新烟碱类杀虫剂噻虫胺的强化去除及作用机理。结果表明,高锰酸钾改性生物炭对噻虫胺的去除能力较原始生物炭有所提高,Langmuir模型拟合得到MnOx-BC对噻虫胺的最大吸附容量达到37 mg·g−1。MnOx-BC对噻虫胺的吸附动力学符合准二级动力学方程,颗粒内扩散模型拟合显示吸附过程分为3个阶段。MnOx-BC对噻虫胺的吸附过程属于单分子层吸附,不同pH条件下MnOx-BC比BC具有更好的吸附稳定性,共存离子Ca2+对MnOx-BC吸附抑制作用大于Na+。MnOx-BC对噻虫胺的吸附机理主要包括孔隙填充、π-π电子供体-受体相互作用、氢键作用和静电作用。Abstract: In this study, a type of biochar (BC) prepared from Chinese fir pyrolysis at 700℃ was taken as raw material, then the modified biochar (MnOx-BC) was prepared by potassium permanganate oxidation method. The enhanced removal effect and mechanism of clothianidin (CLO) by MnOx-BC were investigated. The results showed that CLO removal ability by potassium permanganate modified biochar was improved compared with the original biochar, and the maximum adsorption capacity obtained from Langmuir model fitting was up to 37 mg·g−1. The kinetics of CLO adsorption by MnOx-BC was in accordance with the quasi-second-order kinetic equation, and the fitting of the diffusion model showed that the adsorption process was divided into three stages. The adsorption process of CLO on MnOx-BC belonged to monolayer adsorption. MnOx-BC had better adsorption stability than BC at different pHs, and the inhibition effect of Ca2+ on MnOx-BC adsorption capacity was greater than that of Na+. The adsorption mechanisms mainly included pore filling, π-π electron donor-acceptor interaction and hydrogen bonding and electrostatic interaction.
-
Key words:
- biochar /
- potassium permanganate /
- modification /
- clothianidin /
- adsorption
-
随着我国经济水平的提高,城镇污水处理无论在数量还是质量上都得到了迅速发展。截至2017年12月,我国已运行污水处理厂5 006座,处理能力近1.85×108 m3 ·d−1,预计2016—2020年城镇生活污水排放量仍将保持6%的快速增长趋势[1-2]。随着人们对环境质量要求的逐渐提高,政府对城镇污水处理厂排放标准的要求也进一步提高。虽然目前部分地区出台了更加严格的地方标准,但是目前《城镇污水处理厂污染物排放标准》 (GB 18918-2002)一级A排放标准(以下简称一级A标准)(或一级B)仍是我国大部分城镇污水处理厂执行的主要标准。由于进水水质或污水处理厂运行调控水平等原因,城镇污水处理厂出水的稳定达到标准(一级A标准)仍存在较大难度。
在城镇污水处理厂运行过程中,总氮(TN)和总磷(TP)是影响稳定达标的重点指标。因氮的去除完全依靠生物代谢过程,脱氮效果受环境因素影响较多,故脱氮效果较难控制。与此相比,磷的去除可以借助化学除磷药剂,去除难度较小。因此,总氮是制约城镇污水处理厂出水稳定达标的关键指标。
本研究针对出水执行一级A排放标准的城镇污水处理厂,构建了总氮超标逻辑分析方法,借助污水处理厂全流程分析手段,应用于某城镇污水处理厂,实现了出水水质达标排放标准的目标。
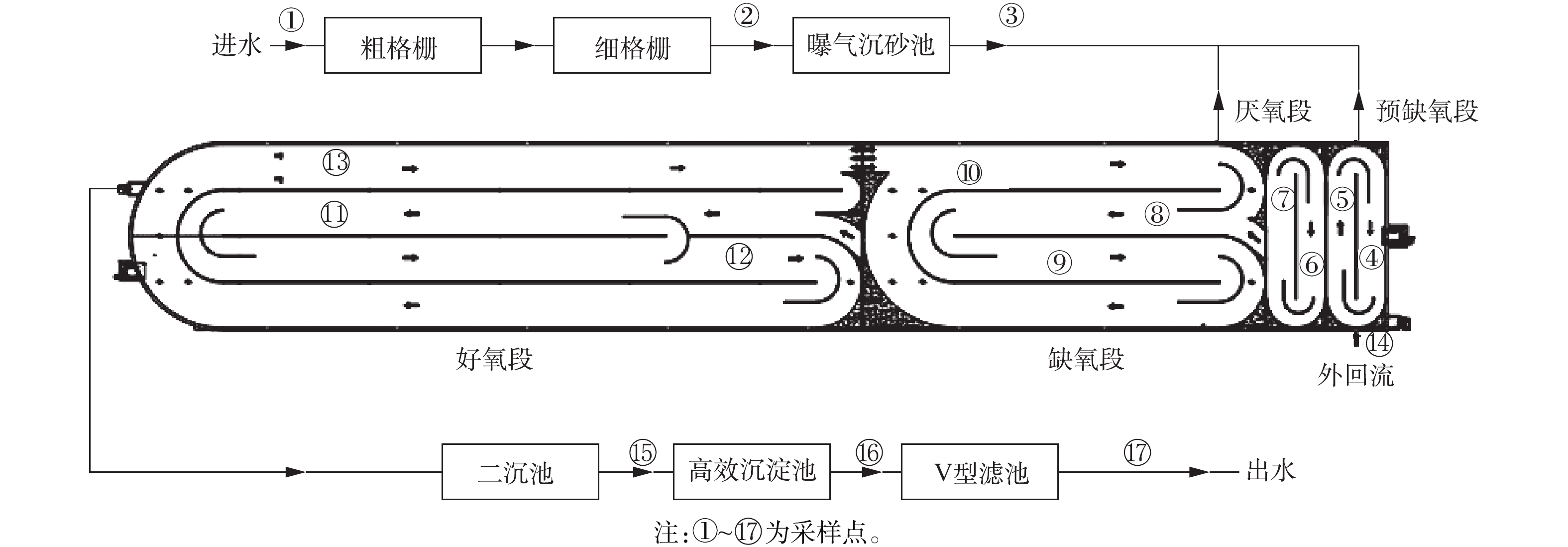
1. 污水处理厂基本情况水质测试方法
1.1 某城镇污水处理厂基本情况
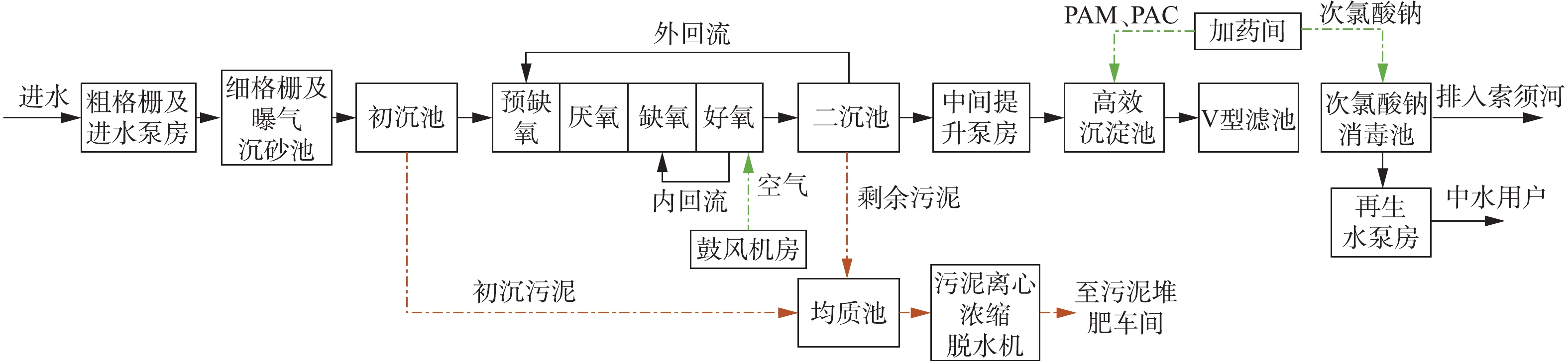
某污水处理厂设计规模为5×104 m3·d−1,实际运行进水量为4×104 m3·d−1,工艺流程如图1所示。设计出水水质执行《贾鲁河流域水污染物排放标准》(DB 41/908-2014)郑州区排放限值(以下简称贾鲁河排放标准),如表1所示。该污水处理厂自2018年3月开始调试运行,持续至2018年7月,出水TN仍未实现达标排放。
表 1 现阶段城镇污水处理厂污染物排放标准Table 1. Discharge standard of pollutants from sewage treatment plant at present stage标准 COD/(mg·L−1) BOD5/(mg·L−1) SS/(mg·L−1) TN/(mg·L−1)  -N/(mg·L−1)
-N/(mg·L−1)TP/(mg·L−1) pH 一级A出水标准 50 15 10 15 5(8)1) 0.5(1)2) 6~9 贾鲁河排放标准 40 10 10 15 3 0.5 — 注:1)括号内数值为水温≤12 ℃时的控制指标;2)括号内数据适用于2005年12月31日前建立的污水处理厂。 借助全流程分析手段,可对污水处理厂各功能单元的处理效果进行科学评估,为TN超标逻辑分析方法的应用提供重要数据,并为生物处理工艺的调整和优化提供建设性意见。此次全流程分析在该厂各单元总共设置了17个采样点,具体分布如图2所示。
1.2 测试方法
本研究测定的水质指标包括:化学需氧量(COD)、溶解性化学需氧量(SCOD)、TN、溶解性总氮(STN)、氨氮(
NH+4 -N)、NO−3 -N、总磷(TP)、溶解性总磷(STP)、磷酸盐(PO3−4 -P)、混合液悬浮固体浓度(MLSS)、混合液挥发性悬浮固体浓度(MLVSS)。上述指标采用标准方法[3] 测定。SCOD、STN和STP均为污水经0.45 μm玻璃纤维滤膜所得水样的COD、TN与TP浓度。另外,使用WTW牌便携式水质分析仪Multi 3430监测了水中pH、DO和Eh。反硝化潜力测试方法。首先,取8 L缺氧池活性污泥泥水混合液,搅拌至其溶解氧浓度为0。之后,向泥水混合液中加入1.20 g的硝酸钾,以保证初始
NO−3 -N浓度,根据实验目的加入适量无水乙酸钠2 g,分别在0、1、3、5、10、15、20、30、45、60、90和120 min取20 mL混合液,使用0.45 μm玻璃纤维滤膜过滤水样,并测定滤后水样的NO−3 -N浓度。释磷潜力测试方法。首先,取8 L好氧池中段活性污泥混合液,沉淀后撇去上清液,并加入蒸馏水,反复清洗3次,消除硝态氮对厌氧释磷的影响,最终保留8 L泥水混合液,搅拌并维持溶解氧浓度为0。之后,向泥水混合液中加入2 g乙酸钠,分别在0、10、20、30、40、50和60 min取20 mL混合液,使用0.45 μm玻璃纤维滤膜过滤水样,并测定滤后水样
PO3−4 -P浓度。2. 结果与讨论
2.1 出水TN超标逻辑分析方法
基于微生物脱氮原理及大量实际工程经验,构建了图3所示的城镇污水处理厂总氮超标逻辑分析方法。针对城镇污水处理厂出水总氮超标问题,首先须对污水厂出水总氮(TN)成分进行分析,对出水中
NO−3 -N、NH+4 -N或不可氨化有机氮过高导致的出水TN超标进行针对性分析判断。溶解性有机氮是一类含氮化合物的总称。从生物可利用性角度看,溶解性有机氮可分为易生物降解有机氮和难生物降解有机氮,污水处理工艺对溶解性有机氮的去除效果有限[4-5]。因此,为保证污水处理厂正常生产,若发现出水有机氮突然升高,应对上游排污企业取样排放,以明确污水中有机氮的来源[6]。
出水
NO−3 -N浓度过高是城镇污水处理厂最易发现的问题。当出水NO−3 -N浓度过高时,须先确定缺氧池末端和好氧池末端NO−3 -N浓度,以判断是否是由于运行参数不合理引起以上问题。之后,结合实际情况,对生物系统的反硝化菌群相对丰度、水温、缺氧池DO和进水碳源条件逐一排查,最终确定造成出水NO−3 -N浓度过高的真正原因,具体方法如下。1)缺氧池末端与好氧池末端
NO−3 -N浓度。当城镇污水处理厂出水NO−3 -N浓度大于11 mg·L−1时,须先确定缺氧池末端与好氧池末端NO−3 -N浓度,以此确定缺氧池反硝化效率是否达到最大。前者远小于后者,则须适当加大内回流,提高缺氧池脱氮化效率;若前者与后者相近,则说明缺氧池反硝化效果不佳。造成缺氧池反硝化效果不佳的主要原因为:活性污泥中反硝化菌群较低的丰度限制了缺氧池的脱氮效果;缺氧池内环境抑制了反硝化细菌的活性。影响反硝化细菌活性的环境因素包括水温、DO和碳源水平等[7]。2)反硝化菌群相对丰度。对污水处理厂活性污泥进行反硝化潜力实验,可判断活性污泥中反硝化菌群相对丰度是否处于正常水平。若反硝化潜力较低,应检查是否存在污泥老化、污泥中毒和池底积泥现象,并采取相应措施。若反硝化潜力在正常水平,则表明环境因素是造成缺氧池脱氮不佳的主要原因,应进一步检测缺氧池内水温、DO和进水碳源条件。
3)水温。反硝化细菌生长的最适温度为25~35 ℃,当水温超过这一范围,则细菌活性下降明显[8-9]。若生物池水温过低(小于10 ℃),可通过投加适量碳源来提高反硝化菌活性;另外,还可通过适当加大外回流比等措施,增大单位容积内的生物量[10],以提高缺氧池脱氮效率的上限。
4)缺氧池DO。若缺氧池DO﹥0.5 mg·L−1,不利于反硝化细菌的脱氮反应,可通过适当减小内回流比、降低好氧池内回流口附近曝气量,及适当提高进水量等措施进行调节[11]。
5)工艺进水碳源条件。生物脱氮反应须利用进水中的易降解有机物作为电子供体,污水处理工艺进水C/N较低会严重影响脱氮效果[12]。若进水BOD5/TN≤4,缺氧池内反硝化过程将会因有机物浓度过低而受限[13],因此,应在合适的位点采取外加优质碳源的措施,提高缺氧池脱氮效率。
城镇污水处理厂出水
NH+4 -N浓度主要受进水NH+4 -N浓度、好氧池pH和好氧池水温等因素影响。针对该问题须分别检测城镇污水处理厂进水NH+4 -N浓度、好氧池pH和好氧池水温等来排查问题。之后,通过交叉曝气实验,进一步寻找抑制好氧池硝化细菌活性的其他因素。具体分析方法如下。1)进水
NH+4 -N浓度。当城镇污水处理厂出水NH+4 -N浓度超过2 mg·L−1时,表明好氧池硝化效果不佳。首先应检测好氧池pH和水温,确认好氧池内微生物所处环境是否正常。若好氧池内pH和水温均正常,则应进一步检测进水NH+4 -N浓度。若进水NH+4 -N浓度高于设计值1.5倍以上,则应适当减少进水量,以增大污水在好氧池内的停留时间,提高好氧池的脱氮效率,并排查上游高浓度NH+4 -N排放企业。若好氧池pH和水温与进水NH+4 -N浓度均正常,则应进行交叉曝气实验做进一步分析。2)好氧池pH。硝化细菌对pH的变化较敏感,若生物池pH﹤6.80或pH﹥8.50,则应投加相应化学药剂调节pH[14-15]。
3)好氧池水温。若水温低于10 ℃,温度便成为限制硝化细菌硝化速率的主要原因,可通过增加外回流比、适当增大曝气量、延长SRT等措施提高硝化效率[16]。
4)交叉曝气实验。交叉曝气实验是将出水
NH+4 -N正常的污水处理厂与目标污水处理厂的活性污泥和进水作为4个实验对象,两两配对进行的曝气实验。通过交叉曝气试验可确定好氧池是否存在DO较低、HRT不足和污泥中毒等问题[17-18]。确定好氧池存在问题后,可参考图3中提出的应对措施,制定具体解决方案,最终实现出水达标的目的。2.2 TN超标逻辑分析方法在污水处理厂的实际应用
1)某城镇污水处理厂TN、
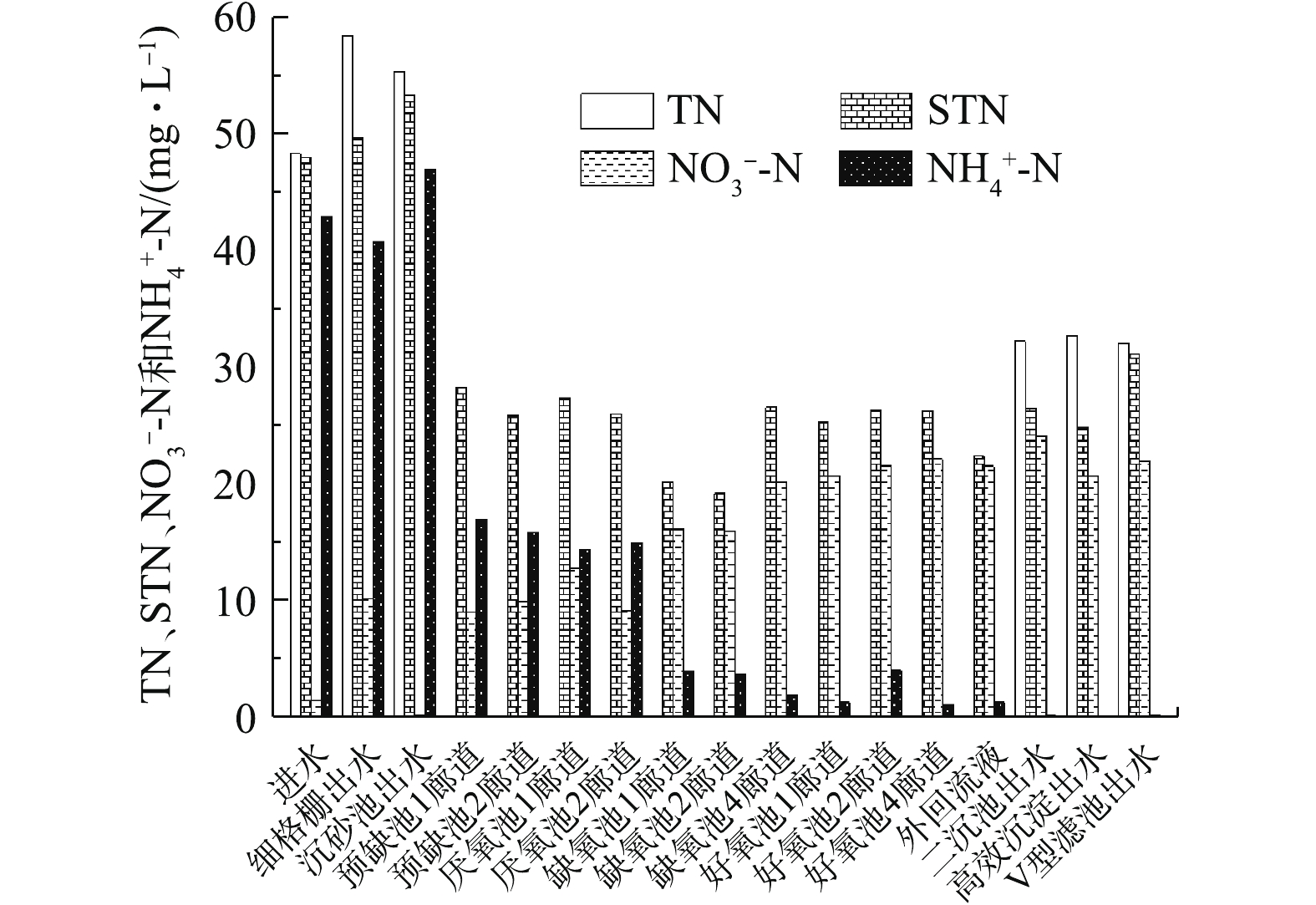
NH+4 -N和NO−3 -N的全流程分析。在图4中,进水TN浓度略高于STN和NH+4 -N浓度,NO−3 -N为0,表明该污水处理厂进水有机氮浓度较低。预缺氧池至厌氧池硝态氮浓度在8 mg·L−1以上,表明预缺氧池脱氮效果较差,不能为厌氧池内的聚磷菌提供适宜的释磷环境。缺氧池至好氧池STN浓度变化较小,该污水处理厂最终出水TN为31.04 mg·L−1,NH+4 -N为0.25 mg·L−1,表明生物系统反硝化效果较差,但硝化效果较好。该厂出水TN超标是由NO−3 -N较高造成的,因此,缺氧池并未实现良好的反硝化功能,有必要进行反硝化潜力实验,以检测该污水处理厂活性污泥中的反硝化菌群相对丰度是否在正常水平。2)某城镇污水处理厂活性污泥反硝化潜力的确定。污水处理厂活性污泥在使用进水碳源进行反硝化过程中,会受到进水pH、有机物浓度和内回流溶解氧等因素影响。通过实验模拟反硝化细菌的最适环境,可判断该厂活性污泥中的反硝化菌群相对丰度是否处于正常水平或该厂所用工艺是否还有提高脱氮率的空间。由图5和表2可知,反硝化潜力为8.96 mg·(g·h)−1。以生活污水为主的污水处理厂活性污泥反硝化潜力在8 mg·(g·h)−1左右[19],因此,该厂反硝化菌群相对丰度处于正常水平。
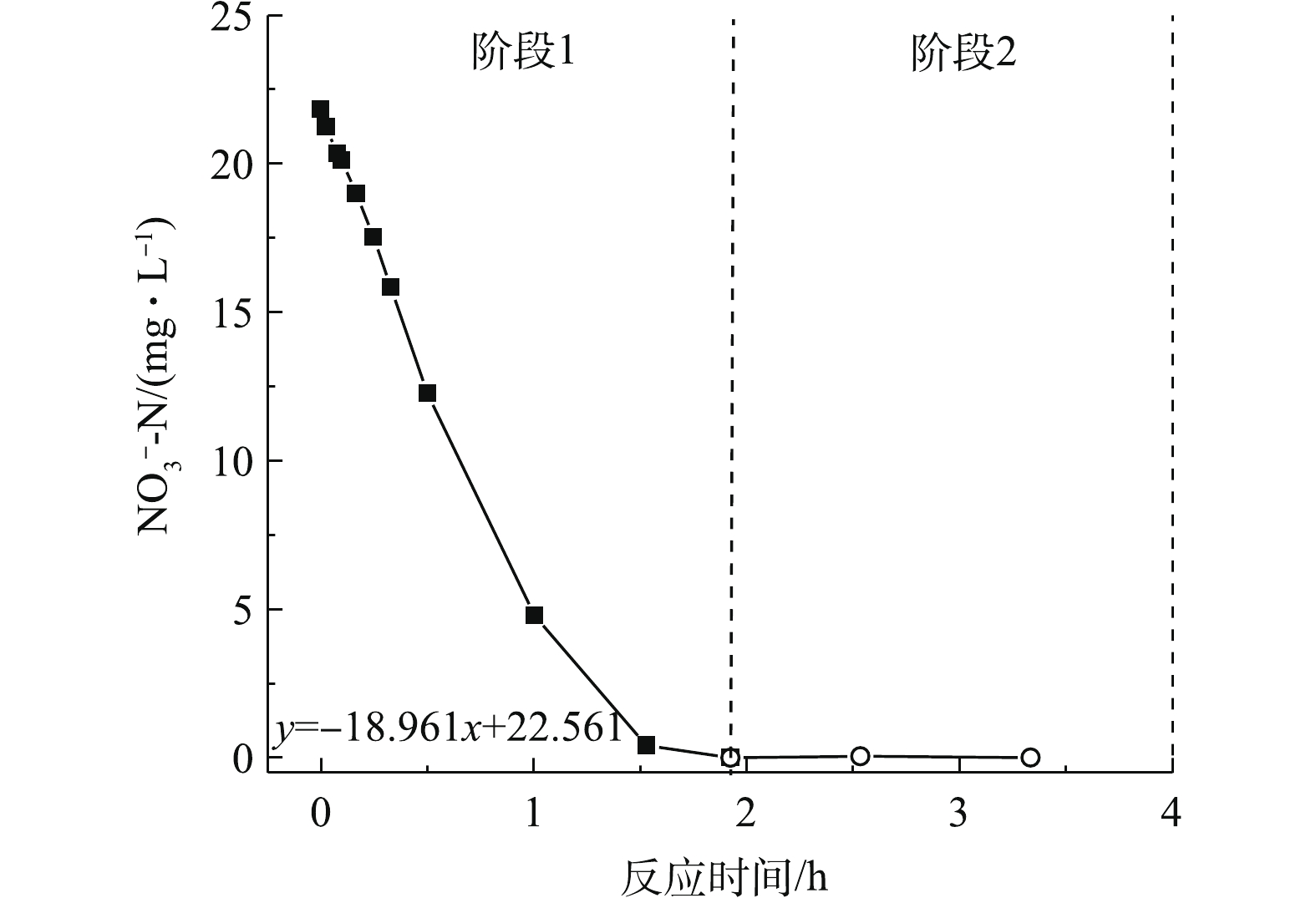
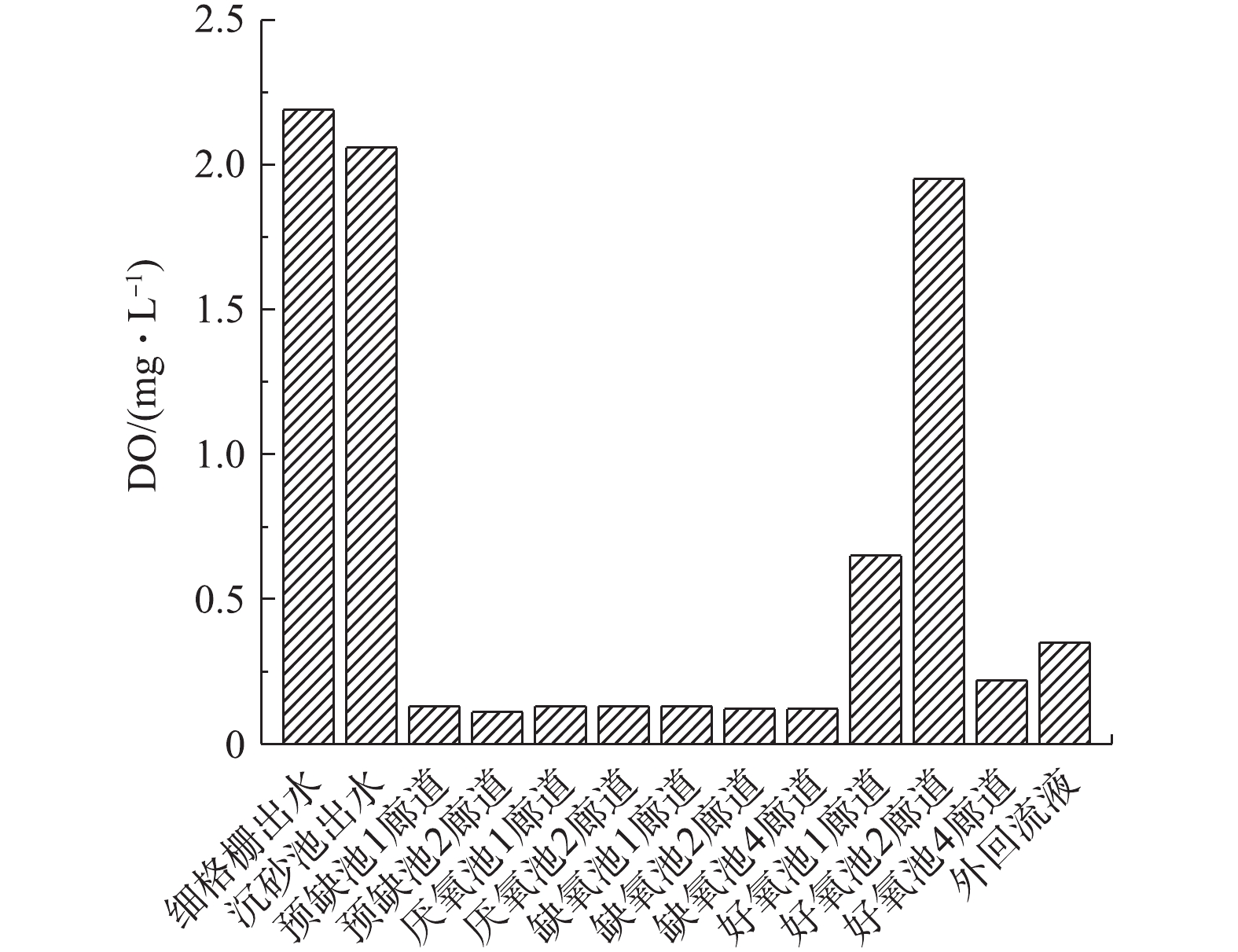
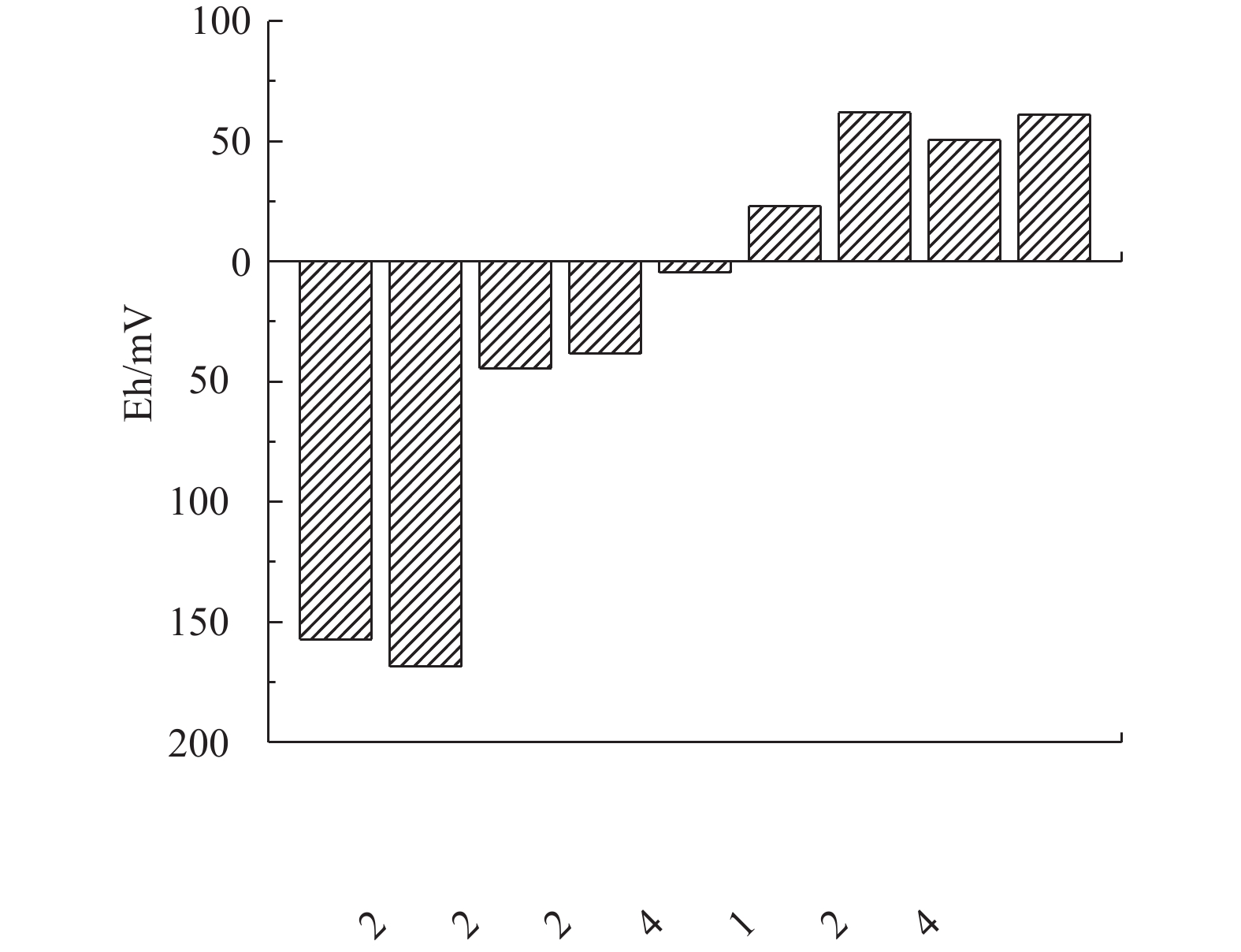
表 2 不同反应阶段活性污泥反硝化潜力Table 2. Denitrification potential of activated sludge at different reaction stages阶段 硝态氮消耗速率/(mg· h−1) MLVSS/(mg·L−1) 反硝化潜力/(mg·(g·h)−1) 1 18.96 2 115 8.96 2 1.80 2 115 0.85 3)缺氧池反硝化条件的分析。本次实验于7月份进行,水温在25 ℃左右。由上述实验可知,水温并未对反硝化菌活性造成负面的影响。由图6可知,该污水处理厂好氧池之前的功能区DO控制良好,缺氧池DO浓度均在0.10 mg·L−1左右,具备缺氧条件。沉砂池出水DO浓度为2.06 mg·L−1,此较高的DO浓度进水会使部分易降解有机物被无效消耗,可降低后续生物脱氮的碳源利用率。
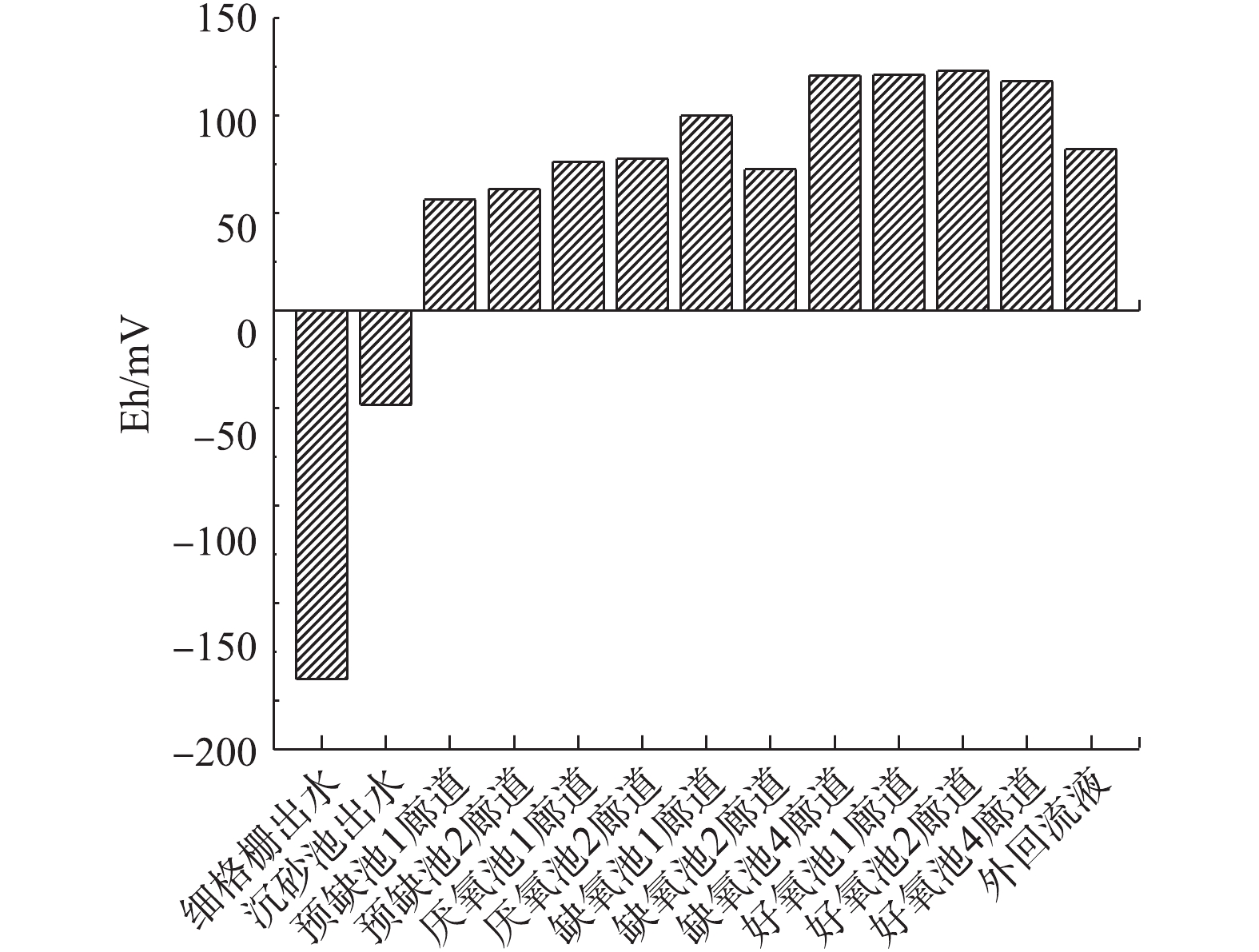
Eh是水质中一个重要指标,它用来反映水呈现出的整体宏观氧化-还原性。电位为正表示溶液显示出一定的氧化性,为负则说明溶液显示出还原性[20-21]。如图7所示,相比于细格栅出水,曝气沉砂池出水Eh升高明显,说明曝气沉砂池消耗了部分的碳源,致使水体表现出氧化性,使后续生物池可用于生物脱氮的碳源减少。
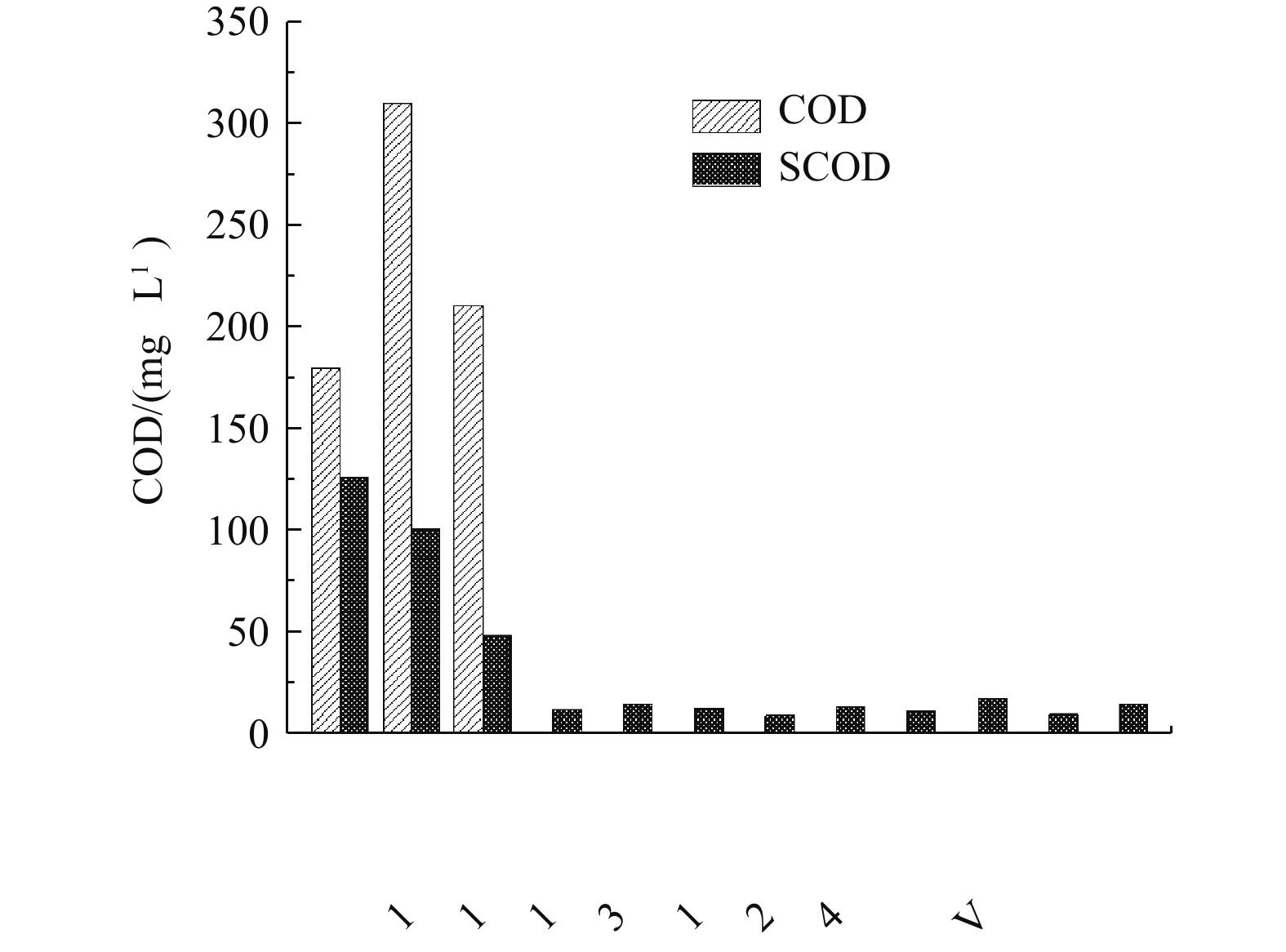
由图8可知,污水处理厂进水COD为150~300 mg·L−1,但SCOD仅为48.40 mg·L−1,故可供微生物直接利用的易降解有机物较少,属于低C/N进水。因此,在应后续生物池中,可采取碳源投加措施。在运行调试初期,该厂已对缺氧池采取了碳源投加的措施,碳源投加量为10 t·d−1,投加位点为缺氧池4廊道,但反硝化效果并不理想。考虑到缺氧池4廊道为内回流廊道,易携带溶解氧,造成碳源的无效损失,故须调整碳源投加位点。
4)优化措施和采取优化措施后的结果。根据现有条件,该厂可以考虑采取2种方法补充后续生物段所需碳源:关闭或降低沉砂池曝气系统,使细格栅出水越过沉砂池直接进入前缺氧池;优化碳源投加位点。具体措施如下。
①关闭沉砂池曝气系统。本研究所依托的污水处理厂,由于沉砂池设计存在缺陷,导致沉砂池基本丧失截留进水无机颗粒和有机颗粒的能力,因此,采取了停止曝气沉砂池的措施。与图7相比,图9中前缺氧池、厌氧池、缺氧池Eh均由正值变为负值,变化幅度最大超过101.30 mV。这表明沉砂池关闭曝气系统后有效提高了后续生物池中有机物的含量,为提高污水厂脱氮效率奠定了基础。
②优化碳源投加位点。该厂前期虽已进行碳源投加工作,但缺氧池4廊道为内回流廊道,易携带大量的溶解氧。在该位置投加碳源,反硝化菌群在与大量以氧气作为电子受体的异养微生物竞争碳源时处于劣势,因此,缺氧池脱氮效率没有显著提高。由于厌氧池的主要功能为生物释磷,若将碳源投加位点提前至厌氧池,在强化缺氧池生物脱氮效率的基础上,还可强化厌氧池生物释磷功能。
由图10可知,在采取以上优化措施后,前缺氧池与厌氧池
NO−3 -N均低于0.12 mg·L−1,为厌氧释磷提供了良好的环境;其他各功能区TN浓度与图4相比,均有不同程度降低,最终出水TN降至12.74 mg·L−1,可满足贾鲁河标准出水要求。3. 结论
1)通过将总氮去除原理与大量工程实践相结合,构建了以一级A排放标准为目标的污水处理厂总氮超标逻辑分析方法。该方法借助于污水处理厂全流程测试手段,分析各影响因素和生化功能区TN、
NO−3 -N、NH+4 -N浓度的变化,在逐步查找原因的同时,提供了相应的解决方案,可操作性强。2)将TN超标逻辑分析方法在某污水处理厂进行实际应用,在进行出水TN成分和各功能单元COD、TN、
NO−3 -N、NH+4 -N、DO和Eh等指标变化情况分析、反硝化菌群相对丰度和碳源投加位点判断等一系列因素评估后,通过采取关闭沉砂池曝气系统和调整碳源投加位点的措施,最终解决了该厂出水总氮超标的问题。 -
表 1 BC和MnOx-BC的结构特征
Table 1. Structural characteristics of BC and MnOx-BC
吸附剂 比表面积/(cm3·g-1) 孔体积/(cm3·g-1) 平均孔径/nm 零电荷点 BC 440.27 0.227 2.06 6.82 MnOx-BC 493.45 0.255 2.58 7.22 表 2 BC和MnOx-BC吸附噻虫胺动力学参数
Table 2. Kinetic parameters of CLO adsorption by BC and MnOx-BC
吸附剂 准一级动力学方程 准二级动力学方程 q1/(mg·g−1) k1/h−1 R2 q2/(mg·g−1) k2/(g·(mg·min)−1) R2 BC 17.56 1.87 0.900 18.81 0.15 0.964 MnOx−BC 19.48 2.23 0.877 21.13 0.15 0.944 表 3 BC和MnOx-BC吸附噻虫胺的颗粒内扩散方程拟合参数
Table 3. Fitting parameters of the intraparticle diffusion equation for CLO adsorption by BC and MnOx-BC
吸附剂 阶段1 阶段2 阶段3 k1 C1 R2 k2 C2 R2 k3 C3 R2 BC 11.32 4.26 0.990 3.99 0.972 0.972 0.11 18.72 0.595 MnOx-BC 14.41 4.52 0.974 3.38 11.88 0.957 0.52 20.22 0.891 表 4 BC和MnOx-BC吸附噻虫胺的吸附等温线拟合参数
Table 4. Fitting parameters of adsorption isotherms for BC and MnOx-BC toward CLO
吸附剂 温度/℃ Langmuir Freundlich qm/(mg g−1) KL/(L·mg−1) R2 1/n KF R2 BC 15 23.96 2.70 0.939 0.14 18.49 0.869 25 30.00 1.20 0.902 0.16 16.51 0.835 35 31.56 4.88 0.949 0.18 20.10 0.900 MnOx-BC 15 29.48 8.08 0.968 0.15 21.72 0.952 25 33.43 7.79 0.983 0.17 24.23 0.952 35 37.00 10.09 0.946 0.19 25.67 0.981 -
[1] 张敏恒, 赵平, 严秋旭, 等. 新烟碱类杀虫剂市场与环境影响[J]. 农药, 2012, 51(12): 859-862. [2] BASS C, DENHOLM I, WILLIAMSON M S, et al. The global status of insect resistance to neonicotinoid insecticides[J]. Pesticide Biochemistry and Physiology, 2015, 121: 78-87. doi: 10.1016/j.pestbp.2015.04.004 [3] 胡倩, 阳海, 石妮, 等. 光催化体系中噻虫胺降解动力学及机制[J]. 环境科学, 2016, 37(9): 3524-3531. [4] SIMON-DELSO N, AMARAL-ROGERS V, BELZUNCES L P, et al. Systemic insecticides (neonicotinoids and fipronil): Trends, uses, mode of action and metabolites[J]. Environmental Science and Pollution Research, 2015, 22(1): 5-34. doi: 10.1007/s11356-014-3470-y [5] ZHANG C, TIAN D, YI X H, et al. Occurrence, distribution and seasonal variation of five neonicotinoid insecticides in surface water and sediment of the Pearl Rivers, South China[J]. Chemosphere, 2019, 217: 437-446. doi: 10.1016/j.chemosphere.2018.11.024 [6] MAHAI G, WAN Y J, XIA W, et al. A nationwide study of occurrence and exposure assessment of neonicotinoid insecticides and their metabolites in drinking water of China[J]. Water Research, 2021, 189: 116630. doi: 10.1016/j.watres.2020.116630 [7] WHITEHORN P R, O'CONNOR S, WACKERS F L, et al. Neonicotinoid pesticide reduces bumble bee colony growth and queen production[J]. Science, 2012, 336(6079): 351-352. doi: 10.1126/science.1215025 [8] MANDAL A, SINGH N, PURAKAYASTHA T J. Characterization of pesticide sorption behaviour of slow pyrolysis biochars as low cost adsorbent for atrazine and imidacloprid removal[J]. Science of the Total Environment, 2017, 577: 376-385. doi: 10.1016/j.scitotenv.2016.10.204 [9] KIM K H, KIM J Y, CHO T S, et al. Influence of pyrolysis temperature on physicochemical properties of biochar obtained from the fast pyrolysis of pitch pine (Pinus rigida)[J]. Bioresource Technology, 2012, 118: 158-162. doi: 10.1016/j.biortech.2012.04.094 [10] NIE T, HAO P, ZHAO Z, et al. Effect of oxidation-induced aging on the adsorption and co-adsorption of tetracycline and Cu2+ onto biochar[J]. Science of the Total Environment, 2019, 673: 522-532. doi: 10.1016/j.scitotenv.2019.04.089 [11] YIN Y Y, GUO X T, PENG D. Iron and manganese oxides modified maize straw to remove tylosin from aqueous solutions[J]. Chemosphere, 2018, 205: 156-165. doi: 10.1016/j.chemosphere.2018.04.108 [12] YU X Y, MU C L, GU C, et al. Impact of woodchip biochar amendment on the sorption and dissipation of pesticide acetamiprid in agricultural soils[J]. Chemosphere, 2011, 85(8): 1284-1289. doi: 10.1016/j.chemosphere.2011.07.031 [13] TAHA S M, AMER M E, ELMARSAFY A E, et al. Adsorption of 15 different pesticides on untreated and phosphoric acid treated biochar and charcoal from water[J]. Journal of Environmental Chemical Engineering, 2014, 2(4): 2013-2025. doi: 10.1016/j.jece.2014.09.001 [14] 马锋锋, 赵保卫. 不同热解温度制备的玉米芯生物炭对对硝基苯酚的吸附作用[J]. 环境科学, 2017, 38(2): 837-844. [15] 李政剑, 石宝友, 苏宇, 等. 粉末活性炭粒径对水中菲吸附动力学的影响效应研究[J]. 环境科学学报, 2013, 33(1): 67-72. [16] LYU H H, XIA S Y, TANG J C, et al. Thiol-modified biochar synthesized by a facile ball-milling method for enhanced sorption of inorganic Hg2+ and organic CH3Hg+[J]. Journal of Hazardous Materials, 2020, 384: 121357. doi: 10.1016/j.jhazmat.2019.121357 [17] LIATSOU I, PASHALIDIS I, DOSCHE C. Cu(II) adsorption on 2-thiouracil-modified Luffa cylindrica biochar fibres from artificial and real samples, and competition reactions with U(VI)[J]. Journal of Hazardous Materials, 2020, 383: 120950. doi: 10.1016/j.jhazmat.2019.120950 [18] ZHU S H, ZHAO J J, ZHAO N, et al. Goethite modified biochar as a multifunctional amendment for cationic Cd(II), anionic As(III), roxarsone, and phosphorus in soil and water[J]. Journal of Cleaner Production, 2020, 247: 119579. doi: 10.1016/j.jclepro.2019.119579 [19] 赵志伟, 陈晨, 梁志杰, 等. 锰氧化物改性生物炭对水中四环素的强化吸附[J]. 农业环境科学学报, 2021, 40(1): 194-201. doi: 10.11654/jaes.2020-0803 [20] LIU Y, ZHANG L X, ZHANG Z F, et al. Citrate-modified biochar for simultaneous and efficient plant-available silicon release and copper adsorption: Performance and mechanisms[J]. Journal of Environmental Management, 2022, 301: 113819. doi: 10.1016/j.jenvman.2021.113819 [21] 杨广西. 生物炭的化学改性及其对铜的吸附研究[D]. 合肥: 中国科学技术大学, 2014. [22] 蒋子旸, 徐敏, 伍钧. 高铁酸钾/高锰酸钾改性生物炭对Cd2+的吸附研究[J]. 农业环境科学学报, 2021, 40(4): 876-883. doi: 10.11654/jaes.2020-1123 [23] ZHANG J Z, MA X F, YUAN L, et al. Comparison of adsorption behavior studies of Cd2+ by vermicompost biochar and KMnO4-modified vermicompost biochar[J]. Journal of Environmental Management, 2020, 256: 109959. doi: 10.1016/j.jenvman.2019.109959 [24] 管欢, 黄慧俐, 行艳景, 等. 噻虫胺在甘蔗和土壤中的残留分析及消解动态[J]. 现代农药, 2015, 14(2): 42-45. doi: 10.3969/j.issn.1671-5284.2015.02.014 [25] LI R N, WANG Z W, ZHAO X T, et al. Magnetic biochar-based manganese oxide composite for enhanced fluoroquinolone antibiotic removal from water[J]. Environmental science and pollution research international, 2018, 25(31): 31136-31148. doi: 10.1007/s11356-018-3064-1 [26] LIU W J, ZENG F X, JIANG H, et al. Preparation of high adsorption capacity bio-chars from waste biomass[J]. Bioresource Technology, 2011, 102(17): 8247-8252. doi: 10.1016/j.biortech.2011.06.014 [27] 张涵瑜, 王兆炜, 高俊红, 等. 芦苇基和污泥基生物炭对水体中诺氟沙星的吸附性能[J]. 环境科学, 2016, 37(2): 689-696. [28] GAO J, HEDMAN C, LIU C, et al. Transformation of sulfamethazine by manganese oxide in aqueous solution[J]. Environmental Science & Technology, 2012, 46(5): 2642-2651. [29] LIN L, ZHOU S W, HUANG Q, et al. Capacity and mechanism of arsenic adsorption on red soil supplemented with ferromanganese oxide-biochar composites[J]. Environmental science and pollution research international, 2018, 25(20): 20116-20124. doi: 10.1007/s11356-018-2188-7 [30] TAN X L, FANG M, CHEN C L, et al. Counterion effects of nickel and sodium dodecylbenzene sulfonate adsorption to multiwalled carbon nanotubes in aqueous solution[J]. Carbon, 2008, 46(13): 1741-1750. doi: 10.1016/j.carbon.2008.07.023 [31] OUYANG D, CHEN Y, YAN J C, et al. Activation mechanism of peroxymonosulfate by biochar for catalytic degradation of 1, 4-dioxane: Important role of biochar defect structures[J]. Chemical Engineering Journal, 2019, 370: 614-624. doi: 10.1016/j.cej.2019.03.235 [32] LIU S, XU W H, LIU Y G, et al. Facile synthesis of Cu(II) impregnated biochar with enhanced adsorption activity for the removal of doxycycline hydrochloride from water[J]. Science of the Total Environment, 2017, 592: 546-553. doi: 10.1016/j.scitotenv.2017.03.087 [33] JOSHI T P, ZHANG G, CHENG H Y, et al. Transformation of para arsanilic acid by manganese oxide: Adsorption, oxidation, and influencing factors[J]. Water Research, 2017, 116: 126-134. doi: 10.1016/j.watres.2017.03.028 [34] WANG X, HUANG K, CHEN Y, et al. Preparation of dumbbell manganese dioxide/gelatin composites and their application in the removal of lead and cadmium ions[J]. Journal of Hazardous Materials, 2018, 350: 46-54. doi: 10.1016/j.jhazmat.2018.02.020 [35] HUANG J Z, ZHONG S F, DAI Y F, et al. Effect of MnO2 Phase Structure on the Oxidative Reactivity toward Bisphenol A Degradation[J]. Environmental Science & Technology, 2018, 52(19): 11309-11318. [36] 孙航, 蒋煜峰, 石磊平, 等. 不同热解及来源生物炭对西北黄土吸附敌草隆的影响[J]. 环境科学, 2016, 37(12): 4857-4866. [37] 谭珍珍, 张学杨, 骆俊鹏, 等. 小麦秸秆生物炭对四环素的吸附特性研究[J]. 水处理技术, 2019, 45(2): 32-38. [38] ZHOU Y Y, LIU X C, XIANG Y J, et al. Modification of biochar derived from sawdust and its application in removal of tetracycline and copper from aqueous solution: Adsorption mechanism and modelling[J]. Bioresource Technology, 2017, 245(Pt A): 266-273. [39] 张连科, 王洋, 王维大, 等. 生物炭负载纳米羟基磷灰石复合材料的制备及对铅离子的吸附特性[J]. 化工进展, 2018, 37(9): 3492-3501. [40] 孙绪兵, 吴雪梅, 朱建发, 等. 羧基甲壳素对Pb(Ⅱ)的吸附性能及机理研究[J]. 中国环境科学, 2018, 38(8): 3018-3028. doi: 10.3969/j.issn.1000-6923.2018.08.030 [41] 徐大勇, 张苗, 杨伟伟, 等. 氧化铝改性污泥生物炭粒制备及其对Pb(Ⅱ)的吸附特性[J]. 化工进展, 2020, 39(3): 1153-1166. [42] LIU P, LIU W J, JIANG H, et al. Modification of bio-char derived from fast pyrolysis of biomass and its application in removal of tetracycline from aqueous solution[J]. Bioresource Technology, 2012, 121: 235-240. doi: 10.1016/j.biortech.2012.06.085 [43] LI H Q, HU J T, MENG Y, et al. An investigation into the rapid removal of tetracycline using multilayered graphene-phase biochar derived from waste chicken feather[J]. Science of the Total Environment, 2017, 603-604: 39-48. doi: 10.1016/j.scitotenv.2017.06.006 [44] 杨奇亮, 吴平霄. 改性多孔生物炭的制备及其对水中四环素的吸附性能研究[J]. 环境科学学报, 2019, 39(12): 3973-3984. [45] PEIRIS C, GUNATILAKE S R, MLSNA T E, et al. Biochar based removal of antibiotic sulfonamides and tetracyclines in aquatic environments: A critical review[J]. Bioresource Technology, 2017, 246: 150-159. doi: 10.1016/j.biortech.2017.07.150 [46] 李蕊宁. 改性马铃薯秸秆生物炭对水体中典型抗生素的吸附性能研究[D]. 兰州: 兰州大学, 2018. [47] 赵华轩, 郎印海. 磁性生物炭对水中CIP和OFL的吸附行为和机制[J]. 环境科学, 2018, 39(8): 3729-3735. [48] ZHU X D, LIU Y C, ZHOU C, et al. A novel porous carbon derived from hydrothermal carbon for efficient adsorption of tetracycline[J]. Carbon, 2014, 77: 627-636. doi: 10.1016/j.carbon.2014.05.067 [49] ZHAO R L, MA X X, XU J Q, et al. Removal of the Pesticide Imidacloprid from Aqueous Solution by Biochar Derived from Peanut Shell[J]. BioResources, 2018, 13(3): 5656-5669. [50] AHMED M B, ZHOU J L, NGO H H, et al. Single and competitive sorption properties and mechanism of functionalized biochar for removing sulfonamide antibiotics from water[J]. Chemical Engineering Journal, 2017, 311: 348-358. doi: 10.1016/j.cej.2016.11.106 [51] 王宇宙, 吴安心. 芳环超分子体系中的π-π作用[J]. 有机化学, 2008, 28(6): 997-1011. [52] KANG J, LIU H J, ZHENG Y M, et al. Application of nuclear magnetic resonance spectroscopy, Fourier transform infrared spectroscopy, UV-Visible spectroscopy and kinetic modeling for elucidation of adsorption chemistry in uptake of tetracycline by zeolite beta[J]. Journal of Colloid and Interface Science, 2011, 354(1): 261-267. doi: 10.1016/j.jcis.2010.10.065 -




 下载:
下载: