-
诺氟沙星是第三代喹诺酮类抗菌药物,具有广谱抗菌作用。近年来,由于诺氟沙星等抗生素的不合理使用,导致在部分水体、土壤和人体体液中均能检测到抗生素残留。诺氟沙星的毒理学研究表明,长时间使用会使细菌产生耐药性,进入食物链中危害人体健康,具有一定的生理生化毒性,已经给生态环境和人体健康造成了严重的威胁[1],因此需要严格控制环境中诺氟沙星的残留量,以保证生态环境的可持续性。目前,对于诺氟沙星的去除方法主要有光催化降解[2-4],超声强化电活化过硫酸盐[5],活性炭吸附[6-7],生物转盘反应[8],生物炭[9-11],活性污泥法[12]等。尽管这些方法具有高效的特点,但也存在设备要求高,过程复杂,耗时长等缺点。因此,开发一种简单、快速、性价比高的诺氟沙星去除方法十分必要。
分子印迹技术也称分子模板技术[13-14],可以自定义结合位点,对模板分子的形状大小,官能团产生记忆效应,模板分子与功能单体形成多重结合位点,聚合过程中交联剂将其记忆下来,洗脱后留下相匹配的立体孔穴,可进行重复吸附。分子印迹技术广泛应用于固相萃取[15]、膜分离[16-19]、传感器[20-21]等领域,在生物大分子分离、手性化合物分离等方面有较大的应用潜力[22]。通过分子印迹技术制备的分子印迹聚合物(molecularly imprinted polymer, MIP),具有抗恶劣环境能力强,稳定性好,使用寿命长等优点。关于分子印迹聚合物膜的研究已有相关报道[23],但制备过程复杂,制膜用材料种类多且合成条件要求高,不利于分子印迹膜材料的推广普及。
目前分子印迹共混膜多用于催化和萃取中[24-25],未见其广泛应用于环境水处理中。本研究以诺氟沙星为模板分子,甲基丙烯酸为功能单体,乙二醇二甲基丙烯酸酯为交联剂,采用本体聚合法制备分子印迹聚合物,而后与聚砜铸膜液按比例混合制备出可以在低压力下对诺氟沙星有特异性截留作用的分子印迹共混膜,为去除生活用水中的诺氟沙星提供参考技术。
-
聚砜购于上海塑料工业联合公司曙光化工厂为工业品;N-甲基吡咯烷酮(NMP,分析纯)、N,N-二甲基甲酰胺(分析纯)、三氯甲烷(分析纯)、偶氮二异丁晴(AIBN,分析纯)、甲醇(分析纯)和乙酸(分析纯)均购于天津大茂化学试剂厂;诺氟沙星(NFEX,分析纯)、氧氟沙星(分析纯)、红霉素(分析纯)、克百威(分析纯)和乙二醇二甲基丙烯酸酯(EGDMA,分析纯)均购于上海麦克林有限公司;甲基丙烯酸(MAA,质量分数99%)购于美国Alfa Aesar化学有限公司;实验用水均为去离子水。
可调式涂膜器;JASCO-V630型紫外分光光度计;DZF真空干燥箱;膜性能评价仪;TDZ4-WS型台式离心机;JR-2型水浴锅;SCQ-2000超声波清洗器;Quanta 250型扫描电子显微镜;NicoLet 6700傅里叶变换红外光谱仪。
-
称取0.3194 g(1 mmol)NFXC溶于10 mL体积比为8∶2氯仿和N,N-二甲基甲酰胺混合剂中,加入0.5164 g(6 mmol)MAA。在转速550 r·min−1条件下磁力搅拌6 h,使NFXC和MAA充分作用,加入5.9466 g(30 mmol)EGDMA和20 mg AIBN,振荡待其完全混溶,转移至50 mL 离心管中,通氮15 min 以除尽氧气,防止聚合过程中发生副反应,60 ℃的条件下经24 h 完全热聚合反应得到聚合物。将得到的聚合物研磨并过100目筛,配制甲醇∶乙酸(9∶1, V∶V)溶液作为洗脱液,索氏提取24 h 去除模板分子,再用甲醇溶液洗至中性,真空干燥后即得诺氟沙星分子印迹聚合物。
采用相转化法制备分子印迹共混膜。称取7 g预先干燥的聚砜溶入48 mL的NMP中,静止脱泡,得到澄清透明铸膜液,将分子印迹聚合物与铸膜液按比例混合,使两者处于均匀异相混合状态,再将共混液用刮膜器匀速涂在洁净、干燥的玻璃板上,蒸发10 s后,将玻璃板整体置于水凝固浴中凝结成膜,置于水中24 h去除多余溶剂,而后烘干保存。
-
膜水通量是指单位时间内在一定压力下单位膜面积可通过溶液的体积流量,将制备完成的分子印迹共混膜置于膜性能分析仪中,室温条件,0.2 MPa 压力下用蒸馏水预压30 min,然后测定单位时间内通过膜的蒸馏水的体积,并用下列公式来计算膜水通量:
其中,J是水通量(L·m−2·h−1),V是溶液渗透的体积(L),A是有效膜表面积(m2),Δt是渗透时间(h)。
-
膜截留率和水通量一样,也是膜性能表征的重要指标,配制10 mg·L−1诺氟沙星溶液,以醋酸为助溶剂,在室温条件下,0.2 MPa 压力下测试共混膜对诺氟沙星的截留率,过膜收集滤液,测其吸光度,对比标准曲线得出浓度后,用下列公式计算截留率:
其中,R是分离百分比(%),Cp是渗透溶液中诺氟沙星浓度(mg·L−1),Cf是进料溶液中的诺氟沙星浓度(mg·L−1)。
-
剪取一定大小的膜片在水中浸润,用滤纸吸干膜表面水分后,用电子天平称量湿膜的质量Ww,而后将膜置于干净的表面皿内,放入60 ℃的烘箱中干燥至恒重,同样用天平称量其质量,记下干膜质量Wd,按下式计算孔隙率:
其中,Pr为膜的孔隙率(%);Ww为湿膜的质量(g);Wd为干膜的质量(g)。
-
诺氟沙星分子印迹共混膜制备流程如图1所示,通过本体聚合法制备分子印迹聚合物,以诺氟沙星为模板分子,甲基丙烯酸为功单体,乙二醇二甲基丙烯酸酯为交联剂,偶氮二异丁腈为热引发剂,聚合反应成稳定络合物,诺氟沙星便被固定在其中。由文献可知诺氟沙星与甲基丙烯酸以氢键相结合[26],通过洗脱液破坏其连接氢键,诺氟沙星分子便可随洗脱液脱离聚合物,留下立体孔穴作为特异性识别位点与诺氟沙星分子重新结合,实现对废水中诺氟沙星的吸附处理。将其与铸膜液混合制成分子印迹共混膜后,膜中孔结构相互连通,有利于分子的运输扩散,根据Piletsky门模型理论[27],溶液通过膜时,分子主要通过分子扩散和压力进入膜内,溶液在膜孔之间相互流通,膜内分子印迹聚合物可对模板分子充分吸附。
利用扫描电子显微镜表征聚合物与共混膜微观结构如图2所示。从图2a中可以看到,前期制备的分子印迹聚合物为不定型状态,表面致密紧实;图2b为分子印迹共混膜微观形貌图,表面已形成细小膜孔结构,可供液体流动;图2c为共混膜横截面微观结构图,可以观察到聚合物镶嵌在共混膜结构之中,没有发生形状的变化。
利用傅里叶红外光谱法研究了诺氟沙星分子印迹聚合物的结构,MAA、EGDMA、分子印迹聚合物洗脱前后的红外光谱如图3所示。曲线a为MAA的红外光谱图,1623 cm−1 处为C=C双键伸缩振动峰,1701 cm−1处为羧基中C=O伸缩振动峰,2999 cm−1处图为羟基中—OH 伸缩振动峰。曲线b为EGDMA的红外光谱图,1642 cm−1处为C=C双键伸缩振动峰,1715 cm−1处为交联剂中C=O伸缩振动峰。
由曲线a和b可知,功能单体和交联剂的红外谱图存在明显差别。曲线c、d分别为诺氟沙星分子印迹聚合物洗脱后和洗脱前的红外光谱图,曲线c中962 cm−1处为—COOH吸收峰,1151 cm−1处为—OH 面外弯曲振动峰,1631 cm−1处为C=C伸缩振动峰,1733 cm-1处为羧基吸收峰,这些峰在曲线d中同样存在,说明聚合物结构主要是由MAA和EGDMA反应制得。从曲线d可以观察到,在930、1260 、1578 cm−1处呈现了分别代表诺氟沙星分子N—H,—OH和N—H等特征官能团的特征峰[28],由此可推断样品为结合有模板分子诺氟沙星的分子印迹聚合物结构。曲线c中没有出现这些特征峰,说明经过洗脱后诺氟沙星已从聚合物中脱离出去。
-
为保证分子印迹聚合物具有更好的吸附性能,对分子印迹共混膜的制备方法进行优化。改变模板分子诺氟沙星和功能单体甲基丙烯酸的聚合摩尔比,固定其它添加比例,聚合条件不变,测试不同合成比例聚合物的吸附量,选出吸附量最大的配比进行优化。取不同条件制备的分子印迹聚合物各100 mg,分别加入到10 mL以乙酸作为助溶剂浓度为1 g·L−1的诺氟沙星溶液中。将离心管置于25 ℃恒温振荡箱中,振荡吸附,经过不同时间取出离心管,离心后取上清液,检测其吸光度并根据标准曲线计算其浓度,绘制动力吸附曲线。对比不同合成比例的吸附平衡时间和最大吸附量,选择最优比例。
从图4中可以看到,4种不同配比分子印迹聚合物的吸附动力学曲线趋势相似,在前60 min内吸附量快速增长,而后缓慢上升,最终达到吸附平衡状态。而随着诺氟沙星与甲基丙烯酸摩尔比的增加,单位时间内聚合物对诺氟沙星的最大吸附量逐渐增加,当摩尔比为1∶6时达到最大值。此后随着摩尔比的增加,最大吸附量呈下降趋势。这是因为过多的甲基丙烯酸在聚合过程中自身相互缔合,促使聚合物的非特异性结合变强,从而对诺氟沙星的吸附量不断降低。本研究选取摩尔比1∶6为分子印迹聚合物的最优合成配比,最大吸附量为 31.41 mg·g−1。
-
将分子印迹聚合物与铸膜液按不同比例混合,分子印迹聚合物在共混膜干膜中的质量百分数分别为0%、5.56%、14.62%、22.72%、37.50%、46.27%、53.90%、59.88%、63.84%和67.16%。在室温25 ℃和0.2 MPa条件下,考察不同比例对膜吸附性能的影响,按相同比例分别刮取3张相同大小膜,分别进行3次膜性能评价,取其平均值绘制图线,如图5所示。
图5a为共混膜对诺氟沙星的截留率,以乙酸为助溶剂配制浓度为100 mg·L-1的模拟废水分别过膜。随着聚合物添加量的增加,截留的诺氟沙星数量也逐渐增加,当添加量为59.88%时基本达到对该浓度废水的最大吸附量。图5b为膜水通量变化趋势,随着聚合物添加量的增加,水通量呈明显下降趋势。由于分子印迹聚合物具有致密结构,随着添加量的增加使得共混膜结构更加致密,孔隙率逐渐减小(见图5c),导致膜水通量逐渐下降。当聚合物添加量增至63.84%时,膜孔隙率无明显变化,此时膜水通量趋于稳定。
综上所述,聚合物添加量为63.84%时,膜截留率、水通量和孔隙率都基本趋于稳定,因此选取63.84%作为本研究的最优聚合物添加比例。
-
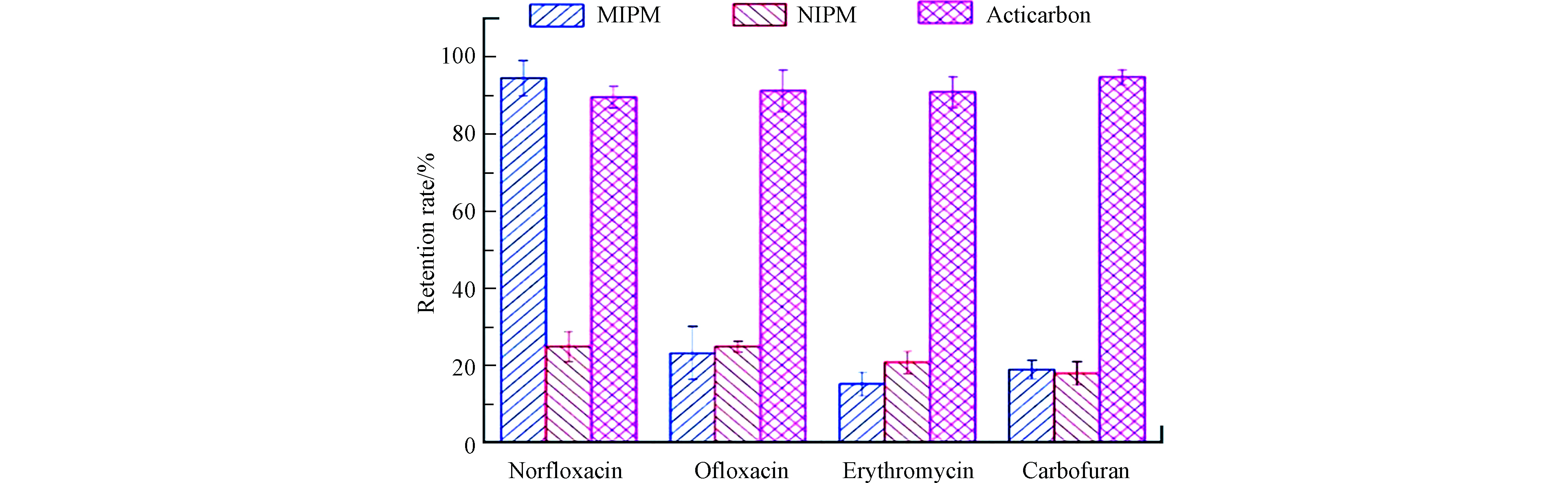
选取不同有机污染物分子对制备的分子印迹共混膜进行选择性截留测试,分别配制浓度为100 mg·L−1的模拟废水,添加等体积的乙酸作为助溶剂。在室温0.2 MPa下过膜,测试分子印迹共混膜对4种物质的选择性截留率,以空白共混膜为对照组。如图6所示,选取与诺氟沙星同为喹酮类药物的氧氟沙星作为第二组对照,选取同为抗生素但属于不同种类的红霉素作为第三组对照,选取不同种类且结构不相似的农药克百威做为第四组对照。由图6可知,分子印迹共混膜对诺氟沙星具有较高的特异性截留率,说明聚合物中的识别孔穴可对模板分子进行特异性截留且具有较高的选择性。而对于其它分子只有膜孔结构的物理截留作用,但没有选择性。此外我们添加了活性炭共混膜作为截留对照,发现其虽然有较好的截留性能但缺少特异识别性,且截留过后无法对其进行洗脱不适于回收再利用。综上可知,分子印迹共混膜具有良好的选择吸附性能。
-
配制浓度为10 mg·L−1的诺氟沙星模拟废水进一步考察分子印迹共混膜的重复使用性。在室温25 ℃和0.2 MPa压力下进行膜性能测试,实验重复进行五组,每组用甲醇∶乙酸(9∶1, V∶V)作为洗脱液洗脱。如图7所示,为洗脱5次对诺氟沙星截留率和膜水通量的影响趋势图。随着洗脱次数的增加,分子印迹共混膜对诺氟沙星的去除性能有一定的下降,可能是因为在重复洗脱的过程中破坏了少量聚合物中的印迹结合位点,但反复洗脱多次后逐渐趋于稳定并始终维持在80%以上,水通量基本维持不变的状态。洗脱次数对NIPM的截留率和水通量影响不大,因为NIPM对照组中不含任何结合位点,洗脱不会对其产生破坏作用。因此,洗脱次数对膜性能有一定的损耗作用,但共混膜仍维持较高的截留效率,具有很好的重复使用性。
-
本研究以诺氟沙星为模板分子,利用本体聚合法制备了分子印迹聚合物,而后将其作为特异性截留材料与铸膜液混合,采用相转化法制备分子印迹共混膜,并用于特异性截留水中诺氟沙星。实验表明,诺氟沙星分子印迹聚合物对诺氟沙星具有特异吸附性,在诺氟沙星分子与功能单体摩尔比为1∶6条件下制备的聚合物具有最大平衡吸附量,分子印迹聚合物在共混膜干膜中的质量百分数为63.84%时,具有良好的水通量和截留性能。重复洗脱5次后,水通量维持不变,虽然截留性能稍有损耗,但仍维持在80%以上,具有良好的可重复使用性。在结构类似物中也具有较高的特异性截留性能。
诺氟沙星分子印迹共混膜的制备及应用
Preparation and application of norfloxacin molecularly imprinted blend membrane
-
摘要: 本文以诺氟沙星为模板分子,甲基丙烯酸为功能单体,乙二醇二甲基丙烯酸酯为交联剂,采用本体聚合法制备分子印迹聚合物,与聚砜铸膜液混合,制备出可以在低压力下对诺氟沙星有特异性截留作用的分子印迹共混膜。采用红外光谱对共混膜的结构进行表征,利用扫描电子显微镜对共混膜微观形貌进行表征。研究了聚合物的质量分数对共混膜水通量和截留率的影响,选出最佳混合比例并考察了选择性透过率。结果表明,当聚合物添加量为63.84%时,分子印迹基膜具有良好的支撑能力和较大的水通量。基于该基膜所制备的诺氟沙星分子印迹共混膜水通量为272.34 L·m−2·h−1(操作压力0.2 MPa),对诺氟沙星截留率为89.47%,具有很好的去除效果。Abstract: The molecularly imprinted polymer (MIP) was synthesized by bulk polymerization with norfloxacin as template molecules, methacrylic acid as the functional monomer, and ethylene glycol dimethacrylate as the crosslinker. Then norfloxacin MIP was mixed with polysulfone casting solution to prepare the molecularly imprinted blend membrane that can specifically trap norfloxacin under low pressure. Infrared spectroscopy was used to characterize the structure of the blend membrane, and the scanning electron microscope was used to characterize the micromorphology of the blend membrane. The influence of the mass fraction ratio of the polymer on the water flux and retention rate of the blend membrane was studied. The results show that the molecularly imprinted base membrane has a good supporting capacity and a large water flux when the polymer content is 63.84%. The water flux of the norfloxacin molecularly imprinted blend membrane prepared based on the base membrane is 272.34 L·m−2·h−1 (operating pressure 0.2 MPa), and the retention rate of norfloxacin is 89.47%, which shows a good removal effect.
-
Key words:
- molecularly imprinted blend membrane /
- norfloxacin /
- retention rate
-
诺氟沙星是第三代喹诺酮类抗菌药物,具有广谱抗菌作用。近年来,由于诺氟沙星等抗生素的不合理使用,导致在部分水体、土壤和人体体液中均能检测到抗生素残留。诺氟沙星的毒理学研究表明,长时间使用会使细菌产生耐药性,进入食物链中危害人体健康,具有一定的生理生化毒性,已经给生态环境和人体健康造成了严重的威胁[1],因此需要严格控制环境中诺氟沙星的残留量,以保证生态环境的可持续性。目前,对于诺氟沙星的去除方法主要有光催化降解[2-4],超声强化电活化过硫酸盐[5],活性炭吸附[6-7],生物转盘反应[8],生物炭[9-11],活性污泥法[12]等。尽管这些方法具有高效的特点,但也存在设备要求高,过程复杂,耗时长等缺点。因此,开发一种简单、快速、性价比高的诺氟沙星去除方法十分必要。
分子印迹技术也称分子模板技术[13-14],可以自定义结合位点,对模板分子的形状大小,官能团产生记忆效应,模板分子与功能单体形成多重结合位点,聚合过程中交联剂将其记忆下来,洗脱后留下相匹配的立体孔穴,可进行重复吸附。分子印迹技术广泛应用于固相萃取[15]、膜分离[16-19]、传感器[20-21]等领域,在生物大分子分离、手性化合物分离等方面有较大的应用潜力[22]。通过分子印迹技术制备的分子印迹聚合物(molecularly imprinted polymer, MIP),具有抗恶劣环境能力强,稳定性好,使用寿命长等优点。关于分子印迹聚合物膜的研究已有相关报道[23],但制备过程复杂,制膜用材料种类多且合成条件要求高,不利于分子印迹膜材料的推广普及。
目前分子印迹共混膜多用于催化和萃取中[24-25],未见其广泛应用于环境水处理中。本研究以诺氟沙星为模板分子,甲基丙烯酸为功能单体,乙二醇二甲基丙烯酸酯为交联剂,采用本体聚合法制备分子印迹聚合物,而后与聚砜铸膜液按比例混合制备出可以在低压力下对诺氟沙星有特异性截留作用的分子印迹共混膜,为去除生活用水中的诺氟沙星提供参考技术。
1. 材料与方法(Materials and methods)
1.1 仪器与试剂
聚砜购于上海塑料工业联合公司曙光化工厂为工业品;N-甲基吡咯烷酮(NMP,分析纯)、N,N-二甲基甲酰胺(分析纯)、三氯甲烷(分析纯)、偶氮二异丁晴(AIBN,分析纯)、甲醇(分析纯)和乙酸(分析纯)均购于天津大茂化学试剂厂;诺氟沙星(NFEX,分析纯)、氧氟沙星(分析纯)、红霉素(分析纯)、克百威(分析纯)和乙二醇二甲基丙烯酸酯(EGDMA,分析纯)均购于上海麦克林有限公司;甲基丙烯酸(MAA,质量分数99%)购于美国Alfa Aesar化学有限公司;实验用水均为去离子水。
可调式涂膜器;JASCO-V630型紫外分光光度计;DZF真空干燥箱;膜性能评价仪;TDZ4-WS型台式离心机;JR-2型水浴锅;SCQ-2000超声波清洗器;Quanta 250型扫描电子显微镜;NicoLet 6700傅里叶变换红外光谱仪。
1.2 诺氟沙星分子印迹共混膜的制备
称取0.3194 g(1 mmol)NFXC溶于10 mL体积比为8∶2氯仿和N,N-二甲基甲酰胺混合剂中,加入0.5164 g(6 mmol)MAA。在转速550 r·min−1条件下磁力搅拌6 h,使NFXC和MAA充分作用,加入5.9466 g(30 mmol)EGDMA和20 mg AIBN,振荡待其完全混溶,转移至50 mL 离心管中,通氮15 min 以除尽氧气,防止聚合过程中发生副反应,60 ℃的条件下经24 h 完全热聚合反应得到聚合物。将得到的聚合物研磨并过100目筛,配制甲醇∶乙酸(9∶1, V∶V)溶液作为洗脱液,索氏提取24 h 去除模板分子,再用甲醇溶液洗至中性,真空干燥后即得诺氟沙星分子印迹聚合物。
采用相转化法制备分子印迹共混膜。称取7 g预先干燥的聚砜溶入48 mL的NMP中,静止脱泡,得到澄清透明铸膜液,将分子印迹聚合物与铸膜液按比例混合,使两者处于均匀异相混合状态,再将共混液用刮膜器匀速涂在洁净、干燥的玻璃板上,蒸发10 s后,将玻璃板整体置于水凝固浴中凝结成膜,置于水中24 h去除多余溶剂,而后烘干保存。
1.3 膜水通量
膜水通量是指单位时间内在一定压力下单位膜面积可通过溶液的体积流量,将制备完成的分子印迹共混膜置于膜性能分析仪中,室温条件,0.2 MPa 压力下用蒸馏水预压30 min,然后测定单位时间内通过膜的蒸馏水的体积,并用下列公式来计算膜水通量:
J=VAΔt 其中,J是水通量(L·m−2·h−1),V是溶液渗透的体积(L),A是有效膜表面积(m2),Δt是渗透时间(h)。
1.4 膜截留率
膜截留率和水通量一样,也是膜性能表征的重要指标,配制10 mg·L−1诺氟沙星溶液,以醋酸为助溶剂,在室温条件下,0.2 MPa 压力下测试共混膜对诺氟沙星的截留率,过膜收集滤液,测其吸光度,对比标准曲线得出浓度后,用下列公式计算截留率:
R=Cf−CpCf 其中,R是分离百分比(%),Cp是渗透溶液中诺氟沙星浓度(mg·L−1),Cf是进料溶液中的诺氟沙星浓度(mg·L−1)。
1.5 膜孔隙率
剪取一定大小的膜片在水中浸润,用滤纸吸干膜表面水分后,用电子天平称量湿膜的质量Ww,而后将膜置于干净的表面皿内,放入60 ℃的烘箱中干燥至恒重,同样用天平称量其质量,记下干膜质量Wd,按下式计算孔隙率:
Pr=Ww−WdWw 其中,Pr为膜的孔隙率(%);Ww为湿膜的质量(g);Wd为干膜的质量(g)。
2. 结果与讨论(Results and discussion)
2.1 分子印迹聚合物膜的制备及其原理分析
诺氟沙星分子印迹共混膜制备流程如图1所示,通过本体聚合法制备分子印迹聚合物,以诺氟沙星为模板分子,甲基丙烯酸为功单体,乙二醇二甲基丙烯酸酯为交联剂,偶氮二异丁腈为热引发剂,聚合反应成稳定络合物,诺氟沙星便被固定在其中。由文献可知诺氟沙星与甲基丙烯酸以氢键相结合[26],通过洗脱液破坏其连接氢键,诺氟沙星分子便可随洗脱液脱离聚合物,留下立体孔穴作为特异性识别位点与诺氟沙星分子重新结合,实现对废水中诺氟沙星的吸附处理。将其与铸膜液混合制成分子印迹共混膜后,膜中孔结构相互连通,有利于分子的运输扩散,根据Piletsky门模型理论[27],溶液通过膜时,分子主要通过分子扩散和压力进入膜内,溶液在膜孔之间相互流通,膜内分子印迹聚合物可对模板分子充分吸附。
利用扫描电子显微镜表征聚合物与共混膜微观结构如图2所示。从图2a中可以看到,前期制备的分子印迹聚合物为不定型状态,表面致密紧实;图2b为分子印迹共混膜微观形貌图,表面已形成细小膜孔结构,可供液体流动;图2c为共混膜横截面微观结构图,可以观察到聚合物镶嵌在共混膜结构之中,没有发生形状的变化。
利用傅里叶红外光谱法研究了诺氟沙星分子印迹聚合物的结构,MAA、EGDMA、分子印迹聚合物洗脱前后的红外光谱如图3所示。曲线a为MAA的红外光谱图,1623 cm−1 处为C=C双键伸缩振动峰,1701 cm−1处为羧基中C=O伸缩振动峰,2999 cm−1处图为羟基中—OH 伸缩振动峰。曲线b为EGDMA的红外光谱图,1642 cm−1处为C=C双键伸缩振动峰,1715 cm−1处为交联剂中C=O伸缩振动峰。
由曲线a和b可知,功能单体和交联剂的红外谱图存在明显差别。曲线c、d分别为诺氟沙星分子印迹聚合物洗脱后和洗脱前的红外光谱图,曲线c中962 cm−1处为—COOH吸收峰,1151 cm−1处为—OH 面外弯曲振动峰,1631 cm−1处为C=C伸缩振动峰,1733 cm-1处为羧基吸收峰,这些峰在曲线d中同样存在,说明聚合物结构主要是由MAA和EGDMA反应制得。从曲线d可以观察到,在930、1260 、1578 cm−1处呈现了分别代表诺氟沙星分子N—H,—OH和N—H等特征官能团的特征峰[28],由此可推断样品为结合有模板分子诺氟沙星的分子印迹聚合物结构。曲线c中没有出现这些特征峰,说明经过洗脱后诺氟沙星已从聚合物中脱离出去。
2.2 分子印迹共混膜的优化
2.2.1 分子印迹聚合物合成方法的优化
为保证分子印迹聚合物具有更好的吸附性能,对分子印迹共混膜的制备方法进行优化。改变模板分子诺氟沙星和功能单体甲基丙烯酸的聚合摩尔比,固定其它添加比例,聚合条件不变,测试不同合成比例聚合物的吸附量,选出吸附量最大的配比进行优化。取不同条件制备的分子印迹聚合物各100 mg,分别加入到10 mL以乙酸作为助溶剂浓度为1 g·L−1的诺氟沙星溶液中。将离心管置于25 ℃恒温振荡箱中,振荡吸附,经过不同时间取出离心管,离心后取上清液,检测其吸光度并根据标准曲线计算其浓度,绘制动力吸附曲线。对比不同合成比例的吸附平衡时间和最大吸附量,选择最优比例。
从图4中可以看到,4种不同配比分子印迹聚合物的吸附动力学曲线趋势相似,在前60 min内吸附量快速增长,而后缓慢上升,最终达到吸附平衡状态。而随着诺氟沙星与甲基丙烯酸摩尔比的增加,单位时间内聚合物对诺氟沙星的最大吸附量逐渐增加,当摩尔比为1∶6时达到最大值。此后随着摩尔比的增加,最大吸附量呈下降趋势。这是因为过多的甲基丙烯酸在聚合过程中自身相互缔合,促使聚合物的非特异性结合变强,从而对诺氟沙星的吸附量不断降低。本研究选取摩尔比1∶6为分子印迹聚合物的最优合成配比,最大吸附量为 31.41 mg·g−1。
2.2.2 聚合物添加量对分子印迹共混膜的影响
将分子印迹聚合物与铸膜液按不同比例混合,分子印迹聚合物在共混膜干膜中的质量百分数分别为0%、5.56%、14.62%、22.72%、37.50%、46.27%、53.90%、59.88%、63.84%和67.16%。在室温25 ℃和0.2 MPa条件下,考察不同比例对膜吸附性能的影响,按相同比例分别刮取3张相同大小膜,分别进行3次膜性能评价,取其平均值绘制图线,如图5所示。
图5a为共混膜对诺氟沙星的截留率,以乙酸为助溶剂配制浓度为100 mg·L-1的模拟废水分别过膜。随着聚合物添加量的增加,截留的诺氟沙星数量也逐渐增加,当添加量为59.88%时基本达到对该浓度废水的最大吸附量。图5b为膜水通量变化趋势,随着聚合物添加量的增加,水通量呈明显下降趋势。由于分子印迹聚合物具有致密结构,随着添加量的增加使得共混膜结构更加致密,孔隙率逐渐减小(见图5c),导致膜水通量逐渐下降。当聚合物添加量增至63.84%时,膜孔隙率无明显变化,此时膜水通量趋于稳定。
综上所述,聚合物添加量为63.84%时,膜截留率、水通量和孔隙率都基本趋于稳定,因此选取63.84%作为本研究的最优聚合物添加比例。
2.3 诺氟沙星分子印迹共混膜的特异性截留性能
选取不同有机污染物分子对制备的分子印迹共混膜进行选择性截留测试,分别配制浓度为100 mg·L−1的模拟废水,添加等体积的乙酸作为助溶剂。在室温0.2 MPa下过膜,测试分子印迹共混膜对4种物质的选择性截留率,以空白共混膜为对照组。如图6所示,选取与诺氟沙星同为喹酮类药物的氧氟沙星作为第二组对照,选取同为抗生素但属于不同种类的红霉素作为第三组对照,选取不同种类且结构不相似的农药克百威做为第四组对照。由图6可知,分子印迹共混膜对诺氟沙星具有较高的特异性截留率,说明聚合物中的识别孔穴可对模板分子进行特异性截留且具有较高的选择性。而对于其它分子只有膜孔结构的物理截留作用,但没有选择性。此外我们添加了活性炭共混膜作为截留对照,发现其虽然有较好的截留性能但缺少特异识别性,且截留过后无法对其进行洗脱不适于回收再利用。综上可知,分子印迹共混膜具有良好的选择吸附性能。
2.4 洗脱次数对膜截留性能的影响
配制浓度为10 mg·L−1的诺氟沙星模拟废水进一步考察分子印迹共混膜的重复使用性。在室温25 ℃和0.2 MPa压力下进行膜性能测试,实验重复进行五组,每组用甲醇∶乙酸(9∶1, V∶V)作为洗脱液洗脱。如图7所示,为洗脱5次对诺氟沙星截留率和膜水通量的影响趋势图。随着洗脱次数的增加,分子印迹共混膜对诺氟沙星的去除性能有一定的下降,可能是因为在重复洗脱的过程中破坏了少量聚合物中的印迹结合位点,但反复洗脱多次后逐渐趋于稳定并始终维持在80%以上,水通量基本维持不变的状态。洗脱次数对NIPM的截留率和水通量影响不大,因为NIPM对照组中不含任何结合位点,洗脱不会对其产生破坏作用。因此,洗脱次数对膜性能有一定的损耗作用,但共混膜仍维持较高的截留效率,具有很好的重复使用性。
3. 结论(Conclusion)
本研究以诺氟沙星为模板分子,利用本体聚合法制备了分子印迹聚合物,而后将其作为特异性截留材料与铸膜液混合,采用相转化法制备分子印迹共混膜,并用于特异性截留水中诺氟沙星。实验表明,诺氟沙星分子印迹聚合物对诺氟沙星具有特异吸附性,在诺氟沙星分子与功能单体摩尔比为1∶6条件下制备的聚合物具有最大平衡吸附量,分子印迹聚合物在共混膜干膜中的质量百分数为63.84%时,具有良好的水通量和截留性能。重复洗脱5次后,水通量维持不变,虽然截留性能稍有损耗,但仍维持在80%以上,具有良好的可重复使用性。在结构类似物中也具有较高的特异性截留性能。
-
-
[1] HWANG Y H, KIM M S, SONG B, et al. Altered pharmacokinetics of enrofloxacin in experimental models of hepatic and renal impairment [J]. Veterinary Research Communications, 2009, 33(5): 481-487. doi: 10.1007/s11259-008-9195-y [2] 乐夏云, 郑田留, 张贞勇, 等. TiO2光催化降解水中诺氟沙星 [J]. 化工管理, 2018, 3(9): 9-10. doi: 10.3969/j.issn.1008-4800.2018.09.009 LE X Y, ZHENG T L, ZHANG Z Y, et al. Photocatalytic degradation of norfloxacin in water using TiO2 [J]. Chemical Management, 2018, 3(9): 9-10(in Chinese). doi: 10.3969/j.issn.1008-4800.2018.09.009
[3] 张聪璐, 侯晓虹, 周东艳, 等. TiO2光催化降解水中盐酸左氧氟沙星 [J]. 沈阳药科大学学报, 2016, 33(4): 321-325. ZHANG C L, HOU X H, ZHOU D Y, et al. Photocatalytic degradation of levofloxacin hydrochloride in water using TiO2 [J]. Journal of Shenyang Pharmaceutical University, 2016, 33(4): 321-325(in Chinese).
[4] HONG S, RATPUKDI T, SIVAGURU J, et al. Glutaraldehyde removal from produced waters using visible light driven photocatalysis [J]. Proceedings of the Water Environment Federation, 2017, 4: 5312-5331. [5] 张祺. 超声强化电活化过硫酸盐去除水中抗生素的研究[D]. 武汉: 华中科技大学, 2016. ZHANG Q. Ultrasonic enhanced electroactivated persulfate removal of antibiotics in water[D]. Wuhan: Huazhong University of Science and Technology, 2016 (in Chinese).
[6] 赵敏芳. 活性炭工艺对氟喹诺酮的去除及药物对微生物的影响研究[D]. 济南: 山东建筑大学, 2016. ZHAO M F. Study on the removal of fluoroquinolone by activated carbon process and the effect of drugs on microorganism[D]. Jinan: Shandong Jianzhu University, 2016 (in Chinese).
[7] JIANG C Y, ZHANG X X, XU X X, et al. Magnetic mesoporous carbon material with strong ciprofloxacin adsorption removal property fabricated through the calcination of mixed valence Fe based metal-organic framework [J]. Journal of Porous Materials, 2016, 23(5): 1297-1304. doi: 10.1007/s10934-016-0188-x [8] 李晓丽, 成小英, 蒋俊, 等. 诺氟沙星对生物转盘反应器处理污染河水性能的影响 [J]. 环境科学学报, 2019, 39(8): 2483-2491. LI X L, CHENG X Y, JIANG J, et al. Influence of norfloxacin on the performance of rotating biological contactor for the treatment of polluted river water [J]. Journal of Environmental Science, 2019, 39(8): 2483-2491(in Chinese).
[9] LI Y, WANG Z W, XIE X Y, et al. Removal of Norfloxacin from aqueous solution by clay-biochar composite prepared from potato stem and natural attapulgite [J]. Colloids and Surfaces A-Physicochemical and Engineering Aspects, 2017, 514: 126-136. [10] ZHANG W, GAO H, HE J, et al. Removal of norfloxacin using coupled synthesized nanoscale zero-valent iron (nZVI) with H2O2 system: Optimization of operating conditions and degradation pathway [J]. Separation and Purification Technology, 2016, 172: 158-167. [11] LUO J W, LI X, GE C J, et al. Sorption of norfloxacin, sulfamerazine and oxytetracycline by KOH-modified biochar under single and ternary systems [J]. Bioresource Technology, 2018, 263: 385-392. doi: 10.1016/j.biortech.2018.05.022 [12] ZHAO R N, LI X H, HU M C, et al. Efficient enzymatic degradation used as pre-stage treatment for norfloxacin removal by activated sludge [J]. Bioprocess and Biosystems Engineering, 2017, 40(11): 1-10. [13] HAUPT K, LINARES A V, BOMPART M, et al. Direct fluorimetric sensing of UV-excited analytes in biological and environmental samples using molecularly imprinted polymer nanoparticles and fluorescence polarization [J]. Biosensors and Bioelectronics, 2012, 32(5): 1012-1026. [14] SHEN X T, XU C G, YE L, et al. Moleculary imprinted polymers for clean water: Analysis and purification [J]. Industrial Engineering Chemistry Research, 2013, 52(39): 13890-13899. doi: 10.1021/ie302623s [15] 刘奇鹰, 施航, 郭远明, 等. 分子印迹-固相萃取-气相色谱-质谱联用测定沉积物中的16种邻苯二甲酸酯 [J]. 环境化学, 2018, 37(6): 1376-1381. doi: 10.7524/j.issn.0254-6108.2017082301 LIU Q Y, SHI H, GUO Y M, et al. Determination of 16 phthalic acid esters (PAEs) in sediments by molecularly imprinted solid phase extraction coupled with gas chromatography-mass spectrometry [J]. Environmental Chemistry, 2018, 37(6): 1376-1381(in Chinese). doi: 10.7524/j.issn.0254-6108.2017082301
[16] 张慧晓, 张峰, 杜幸洁, 等. 氯霉素分子印迹复合膜的制备及其吸附性能研究 [J]. 应用化工, 2013, 42(7): 1238-1241. ZHANG H X, ZHANG F, DU X J, et al. Study of chloramphenicol molecularly imprinted composite membrane and its adsorption properties [J]. Applied Chemical Industry, 2013, 42(7): 1238-1241(in Chinese).
[17] GHASEMI S, NEMATOLLAHZADEH A. Molecularly imprinted polymer membrane for the removal of naphthalene from petrochemical wastewater streams [J]. Advances in Polymer Technology, 2017, 37(6): 2288-2293. [18] AKBARI-ADERGANI B, SADEGHIAN G H, ALIMOHAMMADI A, et al. Integrated photografted molecularly imprinted polymers with a cellulose acetate membrane for the extraction of melamine from dry milk before HPLC analysis [J]. Journal of Separation Science, 2017, 40(6): 1361-1368. doi: 10.1002/jssc.201601245 [19] DI B M P, MERGOLA L, SCORRANO S, et al. Towards a new strategy of a chitosan-based molecularly imprinted membrane for removal of 4-nitrophenol in real water samples [J]. Polymer International, 2017, 66: 1055-1063. doi: 10.1002/pi.5360 [20] BI X Y, YANG K L. On-line monitoring imidacloprid and thiacloprid in celery juice using quartz crystal microbalance [J]. Analytical Chemistry, 2009, 81(2): 527-532. doi: 10.1021/ac801786a [21] 范存华, 杨逸群, 赵伟, 等. 双亲聚合物分子印迹自组装胶束电化学传感器研究 [J]. 化学学报, 2013, 71(6): 934-940. doi: 10.6023/A12121113 FAN C H, YANG Y Q, ZHAO W, et al. Research on amphiphilic copolymer MIP micelles electrochemical sensor [J]. Acta Chimica Sinica, 2013, 71(6): 934-940(in Chinese). doi: 10.6023/A12121113
[22] MALGORRATA R, JUSTYNA P, MORRISON C, et al. Application of molecularly imprinted polymers in analytical chiral separations and analysis [J]. TrAC Trends in Analytical Chemistry, 2018, 102: 91-102. doi: 10.1016/j.trac.2018.01.011 [23] ZHAO J, WU Y L, ZHOU S, et al. Molecularly imprinted nanocomposite membranes based on GO/PVDF blended membranes with an organic–inorganic structure for selective separation of norfloxacin [J]. New Journal of Chemistry, 2017, 41: 14966-14976. doi: 10.1039/C7NJ03402D [24] NARAYANASAMY B, RAJENDRAN S. Electropolymerized bilayer coatings of polyaniline and poly (N-methylaniline) on mild steel and their corrosion protection performance [J]. Progress in Organic Coatings, 2010, 67(3): 246-254. doi: 10.1016/j.porgcoat.2009.12.001 [25] ZHANG B, ZHAO J, SHA B, et al. Selective solid-phase extraction using molecularly imprinted polymers for the analysis of norfloxacin in fish [J]. Analytical Methods, 2012, 4(10): 3187-3192. doi: 10.1039/c2ay25707f [26] LANCELOT G. Hydrogen bonding between nucleic acid bases and carboxylic acids [J]. Journal of the American Chemical Society, 1977, 99(21): 7037-7042. doi: 10.1021/ja00463a044 [27] PILETSKY S A, NICHOLLS I A, ROZHKO M I, et al. Molecularly imprinted polymer tyrosinase mimics [J]. Ukrainian Biochemical Journal, 2005, 77(6): 1363-1375. [28] DAVE V, YADAV R B, KUSHWAHA K, et al. Lipid-polymer hybrid nanoparticles: Development & statistical optimization of norfloxacin for topical drug delivery system [J]. Bioactive Materials, 2017, 2: 269-280. doi: 10.1016/j.bioactmat.2017.07.002 -





 下载:
下载: