-
底泥是湖泊及其流域中重金属等污染物的重要归宿和蓄积库,底泥中的重金属形态和分布不仅能够反映自然和人类活动对湖泊的影响,也反映底泥对水体生态系统的威胁[1-3]。重金属在底泥的垂向分布与水平分布研究同样重要,它们在底泥某层位中的分布可反映某一历史时段内湖泊流域自然和人为活动所造成的重金属流失与污染强度 [4]。重金属是相对保守的物质,具有潜在危害性,一般认为底泥中重金属的毒性几乎与总量无关,而与间隙水中可生物利用的金属组分相关,间隙水中重金属离子浓度与底泥中重金属形态关系紧密[5-6]。底泥中重金属形态主要为金属可交换态、碳酸盐结合态、铁锰氧化物结合态、有机质及硫化物结合态和残渣晶格态,它们各自表现出不同的物理化学稳定性、生物可利用性及潜在生态毒害性 [7-8]。重金属的可交换态最易被生物利用,毒性最强,碳酸盐结合态也较易重新释放进入水相,因而可以用底泥中金属可交换态及碳酸盐结合态重金属占重金属总量的百分数来评价底泥中重金属的稳定程度 [6, 9]。
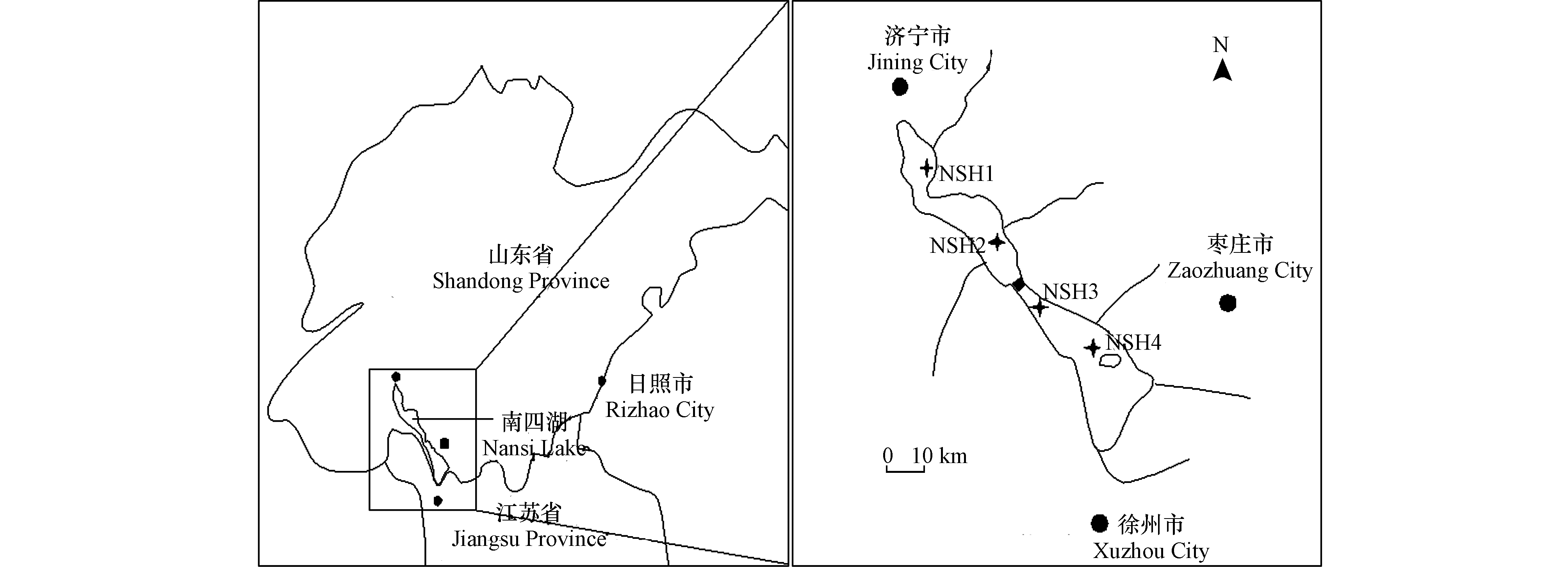
南四湖是我国华北平原上面积最大的淡水湖,湖泊面积1266 km2,自北向南依次由南阳、独山、昭阳和微山4个湖串联而成,平均水深约1.46 m。作为华东最重要的煤炭能源基地,南四湖周边地区的城市发电、民用煤燃烧,造纸、食品、化工、医药等行业企业的迅速发展,以及航运交通等方面的影响,南四湖近20年来底泥中Hg、Pb 、Cd和As的含量呈快速增长趋势,尤其是Hg和Pb的污染最为严重 [10-11]。底泥典型重金属对环境的危害除了与其总量有关外,更大程度上取决于其在环境系统中的形态和分布,其元素赋存形态是判断底泥中重金属的毒性响应以及生态风险的重要指标[3, 8]。作为南水北调东线工程最重要的输水通道和京杭大运河最重要的航运路段,对南四湖底泥典型重金属污染物的形态和污染程度进行分析评价具有重要意义[3]。然而,目前针对南四湖不同湖区底泥重金属污染研究多集中在总量水平分布上,而对其形态和垂向分布研究则较少[3, 12]。
本文以南四湖4个湖区为研究对象,在探讨4种典型重金属元素(Pb、Cd 、Hg 、As)主要生物有效形态垂向分布特征的基础上,对其表层底泥(0—4 cm)重金属污染程度、潜在生态风险性及稳定性进行评价,揭示南四湖近年来的重金属污染状况,为其水环境保护和底泥污染治理提供参考依据。
-
为充分反映南四湖不同湖区底泥性质的差异,结合现场环境条件,在南阳、独山、昭阳和微山等4个湖区的湖心分别设置代表性采样点,采样点布设应避免航运船只扰动及人工养殖的影响,具体采样点见图1。4个采样点位置及经纬度从北向南依次为:南阳湖区(NSH1,35°9′5.64″N,116°39′39″E)、独山湖区(NSH2,35°2′13.08″N,116°50′31.8″E)、昭阳湖区(NSH3,34°50′12.96″N,117°2′8.5″E)和微山湖区(NSH4,34°41′16.26″N,117°13′18.3″E)。
-
2015年1月采集底泥样品,ϕ85 mm×600 mm有机玻璃管的柱状采样器每点采集3根平行样,上部用原样点水样注满后两端用橡皮塞塞紧,垂直放置,小心带回实验室[3]。在室内按10 cm以内间距为2 cm和10 cm以下间距为5 cm进行切样,自然风干至恒重,研磨后过100目筛备用。
-
用Tessier分级提取法对底泥重金属进行形态含量分析[13],本文主要分析生物效应较强的3种形态:金属可交换态、碳酸盐结合态和铁锰氧化物结合态。因通过分级提取重金属各形态含量总和往往与实际总量有差异,本文采用三酸提取法对相应重金属总量进行一次性提取[14]。用电感耦合等离子体发射光谱仪(ICP-OES VISTA-MPX,美国Varian公司)检测重金属Pb、Cd、Hg和As总量及各形态含量。ICP-OES 工作前采用双内标Rh 和Re 对分析信号进行校正,RSD 在3%以下,测定前验证标准曲线,每种元素的线性相关系数达到0.9999以上,每批样品做1个平行空白和2个标准参考物质,全程采用空白样品进行对照,用以验证数据的准确性[15]。ICP-OES 测定Pb、Cd、Hg、As 等4种元素的检出限分别为0.01、0.01、0.02、0.05 μg·L−1。
-
底泥重金属污染评价方法很多,地积累指数法[16]与潜在生态危害指数法[17]因简单易行而被广泛应用[3]。地积累指数法能直观的判定重金属污染级别,但该法侧重单一金属元素,潜在生态危害指数法能够综合反映底泥中重金属对生态环境的影响,但其生物毒性加权系数存在主观性,因此将地积累指数(Igeo)和生态危害指数(RI)相互补充进行风险评价更为合理[3, 5]。
南四湖流域原为黄河泛滥平原,本文综合考虑黄河干流底泥和南四湖流域未受污染土壤的化学元素含量选取湖泊底泥中元素分析的环境背景值[3, 18]。参照相关研究,各重金属生物毒性响应因子分别为: Pb5、 Cd30、 Hg30、As10[3, 19]。
-
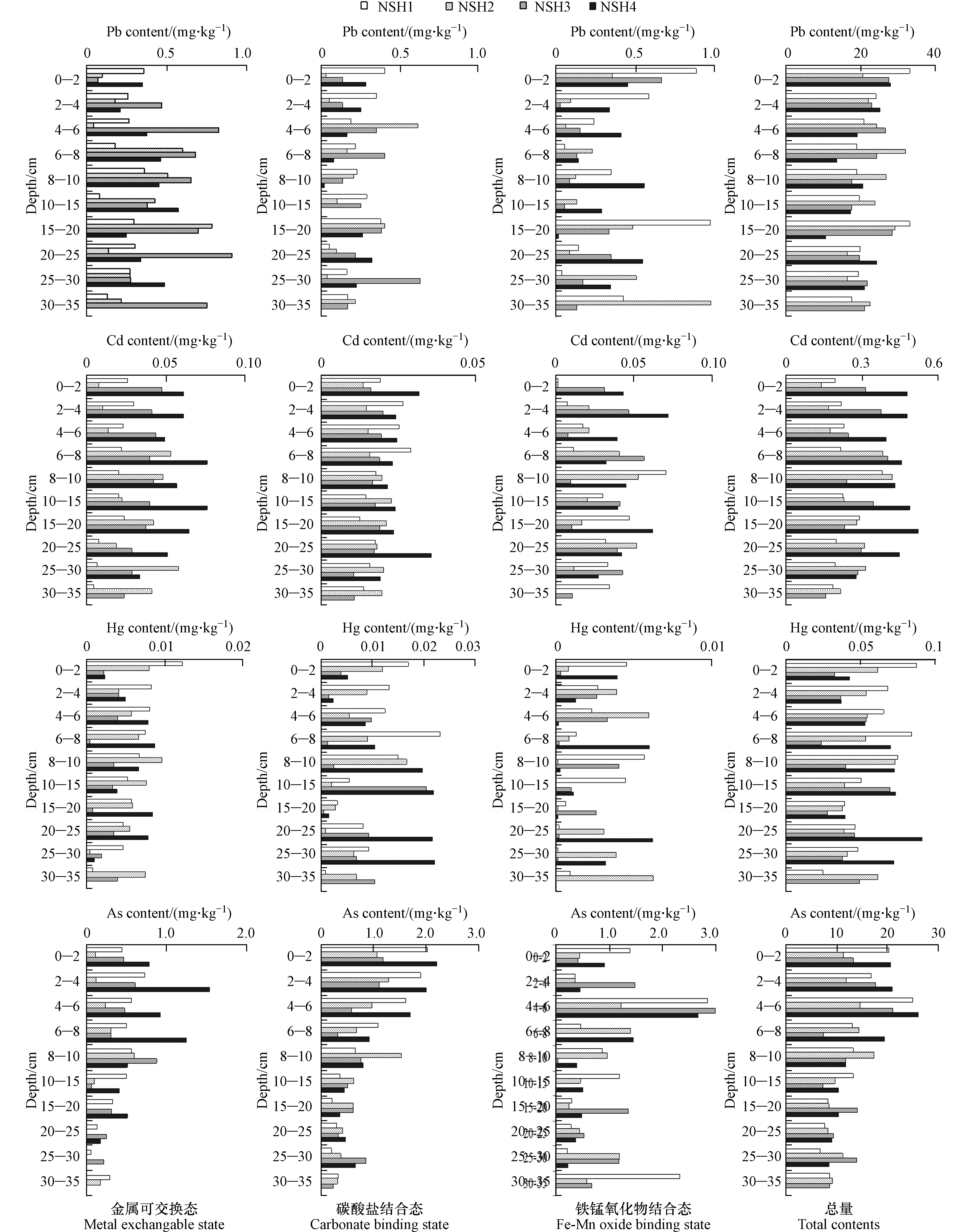
底泥重金属中的金属可交换态和碳酸盐结合态因其生物有效性大,能够更直接的反映底泥重金属的赋存现状与风险;铁锰氧化物比表面积大,吸附重金属能力强,在特定年份受铁锰浓度及重金属污染影响而沉积在相应层次中,铁锰氧化物结合态能反映出沉积各层对应年份的外源污染状况[20-21]。南四湖4个湖区采样点底泥典型重金属Pb、Cd、Hg、As的金属可交换态、碳酸盐结合态和铁锰氧化物结合态含量及总量的垂向分布见图2。重金属在底泥的垂向分布特征可反映某一历史时段内湖泊流域自然和人为活动所造成的重金属流失与污染强度,由图2可见,南四湖的4个湖区不同采样点典型重金属形态与含量在垂向分布上差异较大,各元素各形态未表现出一致的变化规律,说明各湖区采样点典型重金属近年来的污染状况亦有所差异。
4个湖区采样点Pb的金属可交换态、碳酸盐结合态、铁锰氧化物结合态含量较低,且差异不大,都在1 mg·kg−1的范围内波动,各形态仅占Pb总量的2%左右,底泥Pb的潜在风险相对较小。垂向上,南阳湖区采样点Pb的3种形态和总量有较为一致的变化趋势,即随深度增加呈波动下降,但存在15—20 cm处的相对高值,表明南阳湖区Pb在该层年份污染较重,而且近几年污染未有明显降低,南四湖东部地区是我国重要的煤田能源基地,煤炭燃烧过程和冶金、电镀等工业产生的大量废水是底泥Pb的主要来源[22]。独山湖和昭阳湖采样点表层底泥Pb的金属可交换态与碳酸盐结合态含量较底层明显降低,Pb的总量在表层亦表现出降低趋势,表明近几年这两个湖区Pb污染有所降低;微山湖采样点Pb各形态垂向分布较为复杂,可交换态随深度增加而增加,碳酸盐结合态和铁锰氧化物结合态随深度波动较大,无明显规律,从总量上看,微山湖表层底泥Pb含量有增加趋势。总体上,随着近几年南四湖的综合治理,独山湖和昭阳湖底泥Pb污染有所降低,南阳湖和微山湖降低不明显,但南四湖底泥Pb的含量总体不高,污染风险相对较低。
南四湖各湖区采样点Cd的金属可交换态占比较高,约占总量的15%左右,说明底泥Cd具有较高的释放风险,研究表明,冶金、电镀等工业产生的大量废水和湖区周边农药与化肥的大量使用等是南四湖底泥Cd 的主要来源[22]。垂向上,各湖区差异明显,南阳湖、昭阳湖、微山湖的金属可交换态及碳酸盐结合态有随深度增加呈波动下降的趋势,而独山湖表层6 cm内该赋存形态含量明显小于下层,表明独山湖表层底泥Cd的生物有效性明显降低。铁锰氧化物结合态变化趋势可以看出,南阳湖、独山湖表层赋存含量明显小于深层底泥,表明这两个区域当前污染状况有所好转,而微山湖、昭阳湖则相反,近年表现出一定程度的污染,且波动性大。总量上,南阳湖、独山湖、昭阳湖Cd含量峰值出现在6—8 cm,微山湖Cd含量峰值出现在15—20 cm,4个湖区表层0—2 cm含量均略小于2—4 cm,这一现象也见于以上3种结合态,表明近几年湖区外源Cd污染负荷有降低趋势。
南四湖各湖区样点底泥Hg的金属可交换态和碳酸盐结合态占总量的比例在20%以上,底泥中Hg的迁移性较强,具有较大的释放风险,值得关注。垂向上,南阳湖采样点Hg的金属可交换态及碳酸盐结合态呈现出随深度增加而减小的趋势,铁锰氧化物结合态15 cm以上含量也明显高于下层,表明该湖区近几年Hg污染没有得到缓解;独山湖金属交换态与碳酸盐结合态有较为一致的变化趋势,即8—10 cm含量最高;昭阳湖三形态垂向分布规律不明显,整体各赋存形态含量要小于其他湖区。微山湖采样点金属交换态与碳酸盐结合态表层含量均较下层低,该湖区近年Hg污染有所降低。总量上,南阳湖、独山湖Hg均有随深度增大而波动减小的趋势,微山湖则相反,昭阳湖不明显,总体上,南阳湖底泥Hg污染较为严重,且近几年未见明显好转,而独山湖、昭阳湖和微山湖Hg污染有降低趋势。南阳湖位于南四湖最北段,靠近济宁市区,除城区煤炭燃烧产生大量Hg外,城区生活污水和工业废水的大量排放应亦是其Hg含量增加的主要原因[22]。
南四湖各湖区采样点As的垂向分布特征明显,除独山湖外,其他湖区金属可交换态及碳酸盐结合态均有随深度增加而呈波动减小的趋势;独山湖三种形态含量在6—8 cm层出现峰值,采样点位该层As污染曾经较重,这和当时地方大力发展水产养殖,鱼类饵料中含有微量的As有关,该湖区禁渔后,As污染有所好转,这从总量的垂向分布中亦能得到验证。总量上,虽然4个湖区采样点As有随深度增加而波动递减,但As污染峰值均出现在2—8 cm区间,说明近几年南四湖各湖区As污染开始逐步降低。
-
表层底泥对上覆水影响最为直接,研究表明,风力等动力扰动对底泥理化指标的影响主要集中在表层0—3 cm[23-24]。本研究选择0—4 cm深度的表层底泥作为分析对象,即取0—2 cm和2—4 cm底泥重金属含量的平均值,具体结果见表1。从表1可见,Pb、Cd、Hg、As的4种重金属在4个湖区的含量分别为21.31—28.46、0.16—0.50、0.037—0.079和12.91—20.81 mg·kg−1,对比《土壤环境质量 农用地土壤污染风险管控标准(GB15618—2018)》,4种重金属含量均低于该标准水田风险筛选值(6.5<pH<7.5)。根据底泥富集系数法[25]对4种重金属进行污染程度评价,4种重金属的富集系数均大于1,4个湖区采样点底泥均受到不同程度的重金属污染,Cd和Hg富集最明显,其次为As和Pb。4个湖区采样点Cd富集系数均在2以上,其中以微山湖污染最为突出,富集系数达到6.44,为显著污染,其次是昭阳湖、南阳湖和微山湖,富集系数依次为3.95、3.03和2.07,均为中度污染。4个湖区采样点Hg污染程度也较重,富集系数均在2以上,污染大小顺序为南阳湖>独山湖>微山湖>昭阳湖,南阳湖富集系数为5.26,为显著污染。各采样点As污染程度由高到低依次为微山湖、南阳湖、昭阳湖和独山湖,微山湖富集系数为2.78,为中度污染。南阳湖Pb的富集最明显,富集系数为1.9,然后依次是微山湖、昭阳湖和独山湖,均为无—弱污染等级。总体上,底泥富集系数法显示,南四湖底泥典型重金属Hg、Cd、As和Pb均有一定程度污染,污染较重的区域为南阳湖和微山湖,独山湖和昭阳湖相对较轻,这与刘良等的研究结果一致[11]。
通过相关公式[26]计算出的南四湖各采样点表层底泥(0—4 cm)重金属地积累指数Igeo和潜在生态风险因子Ei、生态风险指数RI结果见表2。由表2看出,根据地积累指数Igeo进行评价,南四湖4个湖区表层底泥普遍受到Hg、Cd、As污染,Pb相对较轻。昭阳湖和微山湖Cd污染较重,分别达到中等污染和中-强污染等级,其中微山湖最严重,南阳湖和独山湖Cd污染相对较轻,为轻-中等级。南阳湖Hg污染最为突出。As在4个湖区均为轻-中污染水平,独山湖最轻。Pb污染独山湖最轻,其他3个湖区均为轻-中污染等级,其中南阳湖最重。
从潜在生态风险因子评价可以看出,4种元素在4个湖区的污染风险等级与地积累指数法得到的污染等级较为接近,但因引入了生物毒性响应因子,生物毒性较强的元素污染风险等级较地积累指数法的污染等级高,说明潜在生态危害指数法更注重污染对生态的危害,同时,生物毒性加权系数亦具有一定的主观性。从表2中Ei看出,4个湖区采样点都明显受到Hg和Cd的污染,为中—强污染风险等级,As、Pb相对较轻,为轻微生态污染风险等级。具体来看,南阳湖区Hg污染风险最强,微山湖Cd污染风险最强,均达到很强等级。从潜在生态风险指数RI看,南阳湖、微山湖达到了重污染生态风险等级,其中Hg和Cd分别是最主要的生态风险贡献因子,昭阳湖、独山湖为中等污染生态风险强度,各湖区污染风险强度大小顺序表现为:微山湖>南阳湖>昭阳湖>独山湖。这与孟祥华等[10]和刘良等[11]的研究基本一致,但也有差异,主要在于微山湖重金属Cd污染因子的贡献加大。另外,底泥中重金属元素各形态组成差异较大,各形态迁移转化能力不同,评价时综合考虑以上因素,才能对其生态风险做出更科学的评价[27],由各湖区底泥Pb、Cd、Hg、As的形态分析得知,南阳湖和独山湖区Cd和Hg的金属可交换态、碳酸盐结合态、铁锰氧化物结合态含量占比分别高达36%和33%,具有较高的迁移性,存在生态风险相对较大,应予以重视。
-
底泥中重金属的形态分布不是一成不变的,它们会随着周围环境条件的变化,如:水体温度、pH、底泥有机质和外源重金属等的改变而发生转化[6]。基于重金属可交换态最易被生物利用,毒性最强,碳酸盐结合态也较易重新释放进入水相的特点,很多学者用底泥中金属可交换态及碳酸盐结合态重金属占重金属总量的百分数来评价底泥中重金属的稳定程度[6, 9]。本文采用该法得到的南四湖各湖区表层0—4 cm底泥重金属的稳定度(SAC)见表3。由表3看出,Pb、Cd、Hg、As等4种重金属元素的稳定度差异较大,Hg、Cd、As的稳定性较小,Pb相对比较稳定。结合表1重金属富集系数及表2重金属污染评价发现,重金属的稳定性评价与总量污染评价有一定相关性,但并不一致,如微山湖Cd富集系数为6.44,南阳湖为3.03,微山湖Cd污染要明显重于南阳湖,但其稳定度(18.6%)却明显小于南阳湖(25.0%),说明南阳湖底泥Cd中金属可交换态和碳酸盐结合态占比更高、更活跃,对湖泊水环境的变化更敏感,释放风险亦更大 [28]。4个湖区Pb虽然受到一定程度的污染,但考虑到稳定度,其二次释放潜力较小,潜在生态危害并不高。Hg在南阳湖采样点最不稳定,稳定度大小顺序为昭阳湖>微山湖>独山湖>南阳湖。4个湖区各采样点As稳定度均为中等稳定,大小顺序为昭阳湖>独山湖>南阳湖>微山湖,其中,微山湖最不稳定。
-
(1)底泥富集系数法显示,典型重金属Pb、Cd、Hg、As在南四湖4个湖区表层底泥(0—4 cm)中富集系数均大于1,均受到不同程度的污染,其中,Cd、Hg富集最为明显,其次为As和Pb,4个湖区采样点表层底泥污染较重的为南阳湖和微山湖,独山湖和昭阳湖相对较轻。
(2)南四湖4个湖区采样点Pb的金属可交换态、碳酸盐结合态、铁锰氧化物结合态含量较低,在1 mg·kg−1的范围内波动,约占Pb总量的2%左右,潜在风险较小,Cd的金属可交换态占比较高,约占总量的15%左右,Hg的金属可交换态和碳酸盐结合态占总量的比例在20%以上,Hg和Cd的潜在风险较大。垂向分布上,4个湖区各重金属形态差异较大,无明显规律,有的随深度增加而波动下降,如As在南阳湖、昭阳湖和微山湖的垂向分布,总体上,除南阳湖表层底泥Hg含量外,其他湖区采样点表层底泥Cd、Hg、As含量均下降,近几年南四湖各湖区重金属污染有降低趋势。
(3)地积累指数评价结果显示,南四湖4个湖区采样点表层底泥普遍受到Hg、Cd、As污染,Pb污染相对较轻。微山湖Cd污染最重,南阳湖Hg污染最为突出,As在4个湖区均为轻—中污染水平,独山湖污染最轻。从潜在生态风险指数RI看出,南阳湖、微山湖为重污染生态风险强度,昭阳湖、独山湖为中等污染风险强度,污染风险程度大小顺序为:微山湖>南阳湖>昭阳湖>独山湖。
(4)南四湖各采样点表层底泥Pb、Cd、Hg、As的稳定度差异较大,其中,Hg、Cd、As稳定性较小,Pb最为稳定。4个湖区Cd均为中等稳定,稳定度大小顺序为独山湖>昭阳湖>微山湖>南阳湖。Hg在南阳湖最不稳定,各湖区大小顺序为昭阳湖>微山湖>独山湖>南阳湖。As的稳定度大小为昭阳湖>独山湖>南阳湖>微山湖。综合比较,南阳湖区底泥Hg污染应引起足够重视。
山东南四湖底泥典型重金属的形态分布、稳定度与风险评价
Fraction distribution, stability and risk assessment of typical heavy metals in sediment of Nansi Lake, Shandong Province, China
-
摘要: 为研究南四湖底泥重金属赋存形态与稳定度的空间差异,利用柱状底泥采样器分别在南阳湖、独山湖、昭阳湖和微山湖采集原位柱状样,在对典型重金属Pb、Cd、Hg、As形态分析的基础上,结合地积累指数法和潜在生态风险指数法,对表层底泥(0—4 cm)重金属污染程度进行评价,并对其稳定性进行分析。结果表明,南四湖的4个湖区采样点位表层底泥Pb、Cd、Hg、As均存在一定程度的富集,Hg、Cd富集最为明显,Pb、As次之;Cd和Hg的金属可交换态占比较高,约占总量的10%—15%,潜在风险较大。垂向分布上,4个湖区采样点各重金属形态差异较大,无明显规律。总体上,除南阳湖Hg污染外,其他湖区重金属污染均有降低趋势;地积累指数评价显示,4个湖区采样点表层底泥普遍受到Hg、Cd、As污染,Pb污染相对较轻,微山湖Cd污染和南阳湖Hg污染最为突出;潜在生态风险指数显示,南阳湖、微山湖为重污染生态风险强度,昭阳湖、独山湖为中等污染生态风险强度,污染风险顺序为:微山湖>南阳湖>昭阳湖>独山湖;各湖区采样点4种重金属元素稳定度差异较大,Hg、Cd、As稳定性较小,Pb比较稳定,四湖区各重金属稳定度顺序:Cd为独山湖>昭阳湖>微山湖>南阳湖,Hg为昭阳湖>微山湖>独山湖>南阳湖,As为昭阳湖>独山湖>南阳湖>微山湖。综合比较,南阳湖区底泥Hg污染应引起足够重视。Abstract: In order to study the space differences of heavy metal fraction and stability of sediments in Nansi Lake, columnar sediment sampler was used to collect the intact in situ sediment cores from Nanyang Lake, Dushan Lake, Zhaoyang Lake and Weishan Lake, respectively. On the basis of analyzing the fractions of typical heavy metal Pb, Cd, Hg, As, using geographical accumulation index method and potential ecological risk index method, the heavy metal pollution level of surface sediment (0—4 cm) was evaluated, and the stability of them was analyzed. Results showed that Pb, Cd, Hg, As in the surface sediments of four lakes were all enriched to a certain extent, and Hg, Cd enrichement was the most obvious, followed by Pb and As. The metal exchangeable state amounts of Cd and Hg, accounting for about 10—15% of the total amount, were very high with highly potential risk. The vertical distribution of heavy metal forms in four lakes was quite different with no obvious rules, and in general, the heavy metal pollution had the decreasing trend in Nansi Lake in recent years except for Hg in Nanyng Lake. According to the evaluation of geographical accumulation index, the surface sediments of four lakes were polluted by Hg, Cd and As, and the Cd pollution in Weishan Lake and Hg pollution in Nanyang Lake were the most serious. The potential ecological risk index showed that the sediments of Nanyang Lake and Weishan Lake had heavy ecological pollution risks, Zhaoyang Lake and Dushan Lake had moderate pollution risks, and the pollution risk order was Weishan Lake> Nanyang Lake>Zhaoyang Lake>Dushan Lake. The stability of sediment Hg, Cd and As was poor, the Pb was relatively stable, and the order of Cd stability in four lakes was Dushan Lake>Zhaoyang Lake>Weishan Lake>Nanyang Lake, the Hg was Zhaoyang Lake>Weishan Lake>Dushan Lake>Nanyang Lake, and the As was Zhaoyang Lake>Dushan Lake>Nanyang Lake>Weishan Lake, respectively. Comprehensive comparison, more attention should be paid to Hg pollution in sediment of Nanyang Lake.
-
Key words:
- heavy metals /
- fraction distribution /
- pollution assessment /
- stability /
- Nansi Lake
-
碳酸酐酶(CA)是一种普遍存在的含锌金属酶,其主要功能是催化CO2的水合反应,反应式如下所示:CO2+H2O↔HCO3−+H+,它是目前已知的催化最快的酶之一[1]. 由于游离CA在高温、强酸或强碱溶剂和化学杂质等条件下容易失活,限制了其大规模的工业应用. 因此,采用分子修饰[2]、定向进化[3]、酶固定化[4]等策略来提高其稳定性和活性. 在上述方法中,酶固定化因其操作简单、方便的特点而被广泛应用.
通过选择良好的载体和合适的固定化方法对游离CA进行固定是降低催化剂成本、提高稳定性和可重复使用性的有效途径[5]. 基于固定化CA的生物催化剂因其低耗能和高效率被认为是转化CO2的环境友好的候选方法. 固定化CA主要通过酶促反应吸收[6],CO2矿化生成金属碳酸盐[7]和多酶级联反应[8]来进行CO2转化. 吸收是目前应用最为广泛的CO2捕集技术之一[6]. 然而,吸收溶剂具有再生所需能量高、吸收速率慢和稳定性低等缺点[9]. CA作为促进剂可以提高CO2吸收反应速率,从而降低反应器尺寸和成本. 在某些情况下,CA还用于促进酶催化的CO2转化. CA参与的多酶级联反应用于生产甲酸盐和甲醇等高价值产品[7].
无论CA是以何种方式转化CO2,CO2转化实验始终以烟气为基础,而烟气中具有高温和其他化合物(NOx和SOx等)[10]. 这些可能会影响CA的活性和稳定性,进而减缓CA转化CO2实际工业应用中的反应速率.
1. 碳酸酐酶的性质和催化机理(Properties and catalytic mechanism of carbonic anhydrase)
1.1 碳酸酐酶的性质
CA广泛存在于细菌、真菌和藻类等生物体内,分为不同的类别(α、β、γ、δ、ζ、η和θ)[11]. 大多数CA从牛血红细胞中提取,少数CA从羊和猪等哺乳动物的肝脏以及重组细菌中获得[12]. CA是一种以锌离子作为活性位点的金属酶,在某些情况下,也可以选择其他金属原子,如Cd2+、Co2+、Fe2+或Mn2+来代替Zn2+[13-14],催化各种水解反应,包括羧酸、卤化物、尿素和可水解底物的水合作用[15]. 虽然相同的催化反应由不同的CAs进行,但它们既没有结构相似性,也没有其他相关性[16].
1.2 碳酸酐酶的催化CO2水合机理
在自然状态下,CO2的可逆水合反应十分缓慢,一级反应速率常数仅为5×10−2 s−1,反应步骤如下所示[17]:
(1)CO2水合生成H2CO3:
CO2(aq)+H2O↔H2CO3 (1) (2)H2CO3电离生成
HCO−3 CO2−3 H2CO3↔H++HCO−3 (2) HCO−3↔H++CO2−3 (3) 反应式(1)是CO2水合反应的限速步骤,也是生物系统中碳矿化和碳再利用技术的切入点[18]. 随着CA的引入,Kcat值可高达1.6×106 s–1[19],说明CA可以高效催化CO2的可逆水合反应. 与此同时,CO2水合反应的机制发生改变,变为以下两个步骤[20]:
第一步是CA中与活性中心的Zn2+相连的H2O去质子化形成中间产物EZnOH−,随后CO2被EZnOH−中的OH−水合形成EZn
HCO−3 HCO−3 HCO−3 HCO−3 第二步是EZnH2O的去质子化:EZnH2O通过酶分子中的质子转运体将质子(H+)转运至溶剂中并被还原成具有催化活性的EZnOH−.
2. 碳酸酐酶的固定化(Immobilization of carbonic anhydrase)
酶固定化的催化活性和稳定性在很大程度上取决于载体和固定化方法的选择,首先应在固定化过程中保持酶活性[21]. 近年来,各种材料已被用作固定化CA的载体,包括水凝胶[22]、壳聚糖[23]、二氧化硅[19]和金属有机框架(MOFs)[24]等. 酶可以通过多种方法固定在载体上,例如包埋、吸附、交联、共价结合、交联酶聚集体(CLEAs)[25]和纳米花型酶-无机杂化固定化酶(简称纳米花)[26]等. CA固定化方法优缺点如表1所示.
表 1 CA固定化方法优缺点Table 1. Advantages and disadvantages of CA immobilization methods吸附是一种简单有效的固定化方法,通过氢键、疏水键、离子键和范德华力的相互作用将酶固定在载体表面. 在多数情况下,与载体的温和相互作用可确保固定后酶的微小构象变化[27],这在很大程度上取决于载体的性质. Yin等[24]结合了磁性材料易于回收和可重复使用性,以及MOF具有高孔隙率、大比表面积和良好稳定性的优点,构建了核壳磁性ZIF-8@Fe3O4复合材料. CA通过吸附固定在ZIF-8@Fe3O4上. 游离CA和CA@ZIF-8@Fe3O4分别在40 ℃的1 mol·L−1 MDEA中储存9 d,CA@ZIF-8@Fe3O4的活性随着储存时间的延长而逐渐降低,但其活性始终高于等量游离CA. 包埋是一种将酶限制在载体材料中的固定化方法,可以有效防止酶浸出和变性[6]. Hsieh等[19]将二氧化硅缩合肽(R5)与硫化氢碳酸酐酶(SazCA)融合形成R5-SazCA,再把R5-SazCA包埋到二氧化硅纳米颗粒(R5-SazCA-SP)中. 在70 ℃培养3 h后,R5-SazCA和R5-SazCA-SP的残余活性分别为49%和60%,表明CA固定化后热稳定性得到改善. 增强的热稳定性通常归因于二氧化硅交联网络施加的空间约束,这有助于维持CA的立体结构.
共价结合是一种常用的固定化方法,可以显著增强和提高酶的稳定性. 改性载体表面的胺基、羟基、羧基或环氧基等官能团和CA的氨基酸残基之间可以形成共价键,从而使得酶和载体中间具有很强的相互作用[28]. Shamna等[29]将CA通过共价结合固定在胺官能化的铝-硅氧烷气凝胶珠(BCA-Al/Si-NH2)上. BCA-Al/Si-NH2杂化珠的动力学参数与游离酶相当. 固定化CA具有热稳定性、pH稳定性和储存稳定性,这是由于酶的多点附着和酶与载体之间的相互作用导致酶刚性增加,从而减少了构象变化. Sun等[30]将CA通过戊二醛(GA)共价连接到聚偏二氟乙烯(PVDF)膜和聚乙烯膜(PE)的表面,这些膜固定化CA之前通过聚乙烯亚胺(PEI)和多巴胺(DA)的共沉淀进行了修饰. PEI/PDA-PE的活性回收率高于PEI/PDA-PVDF,因为PE具有更大的孔结构和改性后更好的亲水性,从而引起更高的酶负载量和更好的酶亲和力. 此外,固定化后,CA的储存稳定性和可重复使用性得到很大提高.
考虑到载体材料的物理和化学性质、操作条件等,通常需要多种固定化方法的协同作用从而获得高效的固定化CA[6]. Chang等[31]将CA通过吸附-交联法固定在地质聚合物微球上,与游离CA相比,固定化CA的最适pH值从7.5增加到8.0,最适温度从25 ℃增加到30 ℃. Effendi等[11]将Sulfurihydrogenibium yellowstonense CA(SyCA)共价结合在新型聚丙烯腈(PAN)和聚对苯二甲酸乙二醇酯(PET)纳米纤维上,所得复合材料通过戊二醛(GA)进一步交联. 固定化粗SyCA在60 ℃下保留了超过100%的相对残余活性,这归因于粗SyCA的胺基和纳米纤维的羟基之间的共价结合,而且固定化粗SyCA和GA之间交联也会形成共价键. 此外,测定了固定化CA对SOx和NOx的耐受性. 固定化SyCA在50 mmol·L−1 HNO3和H2SO4存在下的残余酶活性分别为57.1%和61.6%.
CLEAs是一种无需载体的新型固定化酶制备技术,该方法包括沉淀和交联两个主要步骤[26]:(1)通过沉淀剂(盐、水溶性有机溶剂或非离子聚合物)在溶液中形成酶聚集体;(2)聚集体中酶分子通过交联剂交联,使它们在去除沉淀剂后不溶. 然而,对于工业应用来说,CLEA柔软且容易断裂,为了提高CLEA的机械性能,Jun等[32]使用纳米纤维共价连接bCA,然后交联并进行沉淀,以获得bCA沉淀涂层(EPC). EPC在剧烈摇动下868 d后仍保留其活性的65.3%,EPC的高稳定性可以通过酶沉淀和交联的结合来解释,使酶分子之间通过化学键紧密的链接,从而有效防止酶变性和浸出. 纳米花型酶-无机杂化固定化酶由2012年Ge等[33]首次提出,通过将酶与硫酸铜在磷酸盐缓冲溶液中共沉淀,从而形成典型的花瓣状结构. Wen等[22]对此固定化方法进一步研究,将双金属离子(Cu2+和Zn2+)代替单个金属离子来固定CA,然后将双金属基杂化纳米花(CANF)复合材料嵌入到聚乙烯醇(PVA)/壳聚糖(CS)水凝胶膜(PVA/CS@CANF)中. 水凝胶膜在8个循环后仍保持其原始活性的75%以上,在60 ℃下仍有超过80%的相对活性. 此外,PVA/CS@CANF膜转化CO2产生的CaCO3量是游离CA的9倍.
3. CA转化CO2的应用(Application of CA to CO2 conversion)
二氧化碳排放是造成温室效应的主要原因. 当前,CO2捕集、利用和封存(CCUS)技术已广泛应用于减少CO2排放到大气中. CCUS技术将CO2资源化,便于运输和长期储存[29]. 基于CA的生物酶法通过捕集大气或废气中的CO2,并进一步转化为高价值的工业化学品和燃料,如金属碳酸盐、甲醇和甲酸等.
3.1 CA在CO2矿化中的应用
CA催化的CO2水合反应生成的碳酸氢盐可进一步用作碳源,用于合成无机碳酸盐和促进藻类的生长. CA将CO2矿化生成CaCO3的原理为CA首先催化CO2水合形成碳酸氢根离子(4),然后与添加的Ca2+反应生成CaCO3(5),CaCO3易于分离和储存以供进一步利用. Shamna等[29]将CA共价连接在铝-硅氧烷气凝胶珠上,并进一步检测了其将CO2转化为CaCO3的能力:1 mg游离bCA和17 μg bCA-Al/Si-NH2生成CaCO3质量为32.4 mg和12 mg. 通过XRD表明CA转化的碳酸钙的晶相为方解石,且CaCO3的晶体结构不会因添加酶而改变. Jun等[32]使用纳米纤维共价固定bCA,然后进行交联并沉淀,以获得bCA沉淀涂层(EPC). CA通过催化系统中鼓泡的CO2的可逆水合生成碳酸氢盐,为微藻提供光合作用的碳源. 添加 EPC的系统与含有25 mmol·L−1 NaHCO3和不含碳源的相比,分别使微藻生长加速了134%和231%. Xu等[34]将CA与戊二醛(GA)交联并包埋在漂浮的海藻酸钙水凝胶珠中,并将珠子保留在微藻-大气界面便于直接从空气中捕集CO2. 与(22.7±0.5) mg·L−1每天的自然生长速率相比,游离CA和CA-GA珠粒分别将微藻的生长速率提高到(37±3)mg·L−1每天和(40±1)mg·L−1每天,而且珠子容易回收和重复使用,具有广阔的工业前景.
CO2+H2O→HCO−3+H+ (4) Ca2++HCO−3→CaCO3+H+ (5) 当前通过全细胞固定化构建了用于CO2捕集的新型全细胞催化剂,避免酶泄漏和细胞裂解从而提高酶的稳定性和可重复使用性[7]. Sharma等[35]将含CA的苦参棒状杆菌菌株的细胞共价固定到戊二醛功能化的角蛋白颗粒上. 含有144 U·mg−1 CA的菌株细胞裂解物形成65.12 mg CaCO3. 进行10次CO2转化后,固定化细胞和游离细胞CaCO3的相对产量分别为53.46%和22.15%. Moon等[36]将周质水生弧菌CA(hmCA)的全细胞催化剂通过包埋固定在聚氨酯泡沫上(pCA-PUF),经9次循环使用后,pCA-PUF的高相对活性没有明显下降,并且显示出良好的可重复使用性. 使用该固定化生物催化剂将设计的填充床反应器中的CO2捕集速率提高了80%. 微生物细胞表面展示是将某一蛋白或短肽(靶蛋白)与微生物细胞的外膜蛋白(载体蛋白)以融合蛋白的形式锚定在微生物细胞表面的技术. 大肠杆菌是生产重组蛋白最常用的宿主细胞之一[37]. Zhu等[38]以大肠杆菌为宿主细胞,通过将SazCA作为靶蛋白与冰核蛋白(INPN)(载体蛋白)锚定在细胞外膜上构建表面展示菌株. 工程菌株矿化CO2产生的CaCO3质量(241 mg)明显高于胞内表达菌株(173 mg). Tan等[39]将(Mesorhizobium loti CA)MlCA克隆到3个载体中且在大肠杆菌中表达,并将离心获得的全细胞样品固定在琼脂上. 结果表明,全细胞生物催化剂具有良好的稳定性,储存40 d后相对活性保持近100%. 此外,具有固定化全细胞生物催化剂的系统可在3.5 min内有效地将CO2100%转化为CaCO3. 通过表2展示了固定化CA矿化CO2性能的比较.
表 2 CA在二氧化碳捕集中的矿化性能Table 2. Mineralization performance of CA in carbon dioxide capture碳酸酐酶种类Types of carbonic anhydrase 矿化特性Mineralization properties CaCO3晶相CaCO3 crystal phase 参考文献Reference 牛CA(bCA) 固定化细胞比游离细胞的CaCO3产量增加了1.35倍;固定化细胞和游离细胞的CaCO3 相对产量在10个循环后分别为53.46%和22.15% 球霰石和方解石 [35] bCA 17 μg固定化CA产生12 mg CaCO3 方解石 [29] CA CA@ZIF-8获得的CaCO3的产量是游离 CA的22倍 球霰石 [40] 硫化氢碳酸酐酶(SazCA) 固定化CA转化CO2形成碳酸钙的时间比游离CA缩短了33% 球霰石和方解石 [19] SazCA 工程菌株矿化CO2产生的CaCO3质量(241 mg)高于细胞内表达菌株(173 mg) — [38] 周质水生弧菌CA(hmCA) 固定化CA将填充床反应器中的CO2捕集速率提高了80% — [36] CA PVA/CS@CANF膜转化CO2产生的CaCO3 量是游离CA的9倍 — [22] bCA 添加EPC的系统与含有25 mmol·L−1 NaHCO3和不含碳源的对照相比,分别使微藻生长加速了134%和231% — [32] bCA 与(22.7±0.5)mg·L−1·d−1的自然生长速率相比,游离CA和CA-GA珠粒分别将微球藻的生长速率提高到(37±3)mg·L−1·d−1和(40±1)mg·L−1·d−1 — [34] Sulfurihydrogenibium yellowstonense CA(SyCA) 固定化粗CA的CaCO3总产量是游离CA的5.8倍 — [11] CA 固定化CA产生的CaCO3质量是空白实验的5倍 — [31] bCA CA@ZIF-8和PVA/CS/CA@ZIF-8水凝胶膜获得的CaCO3产量分别为游离CA的20倍和32.6倍. 球霰石和方解石 [41] Mesorhizobium loti CA(MICA) 具有固定化全细胞生物催化剂的系统可在3.5 min内有效地将CO2100%转化为CaCO3 — [39] 3.2 液体吸收法捕集CO2
到目前为止,已经开发了使用纯水、碳酸盐溶液(Na2CO3和K2CO3等)和醇胺溶液等吸收二氧化碳的工艺. 常用于捕集CO2的醇胺溶液主要有伯胺(一乙醇胺,MEA)、仲胺(二乙醇胺-DEA)、叔胺(N-甲基二乙醇胺-MDEA、二异丙醇胺-ADIP和三乙醇胺-TEA)和哌嗪(PZ)等[42]. MEA吸收速度快,不易挥发,但是溶剂在汽提塔中的解吸需要大量的能量,导致电费成倍增加,需要对其进行改进. 与MEA相比,K2CO3溶液具有低毒性,不易腐蚀,在高温下高效且低成本的再生等优点,而且MDEA再生能耗低、吸收CO2容量大. 但是K2CO3溶液和MDEA吸收速率较慢,添加CA可显著促进MDEA和K2CO3溶液吸收CO2[17].
当前,固定化CA已用于纯水中吸收二氧化碳研究. Chang等[31]将CA通过吸附-交联法固定在地质聚合物微球上. 采用水浴设定不同温度,pH计可监测反应溶液pH值随不同催化反应条件的变化,从而评价固定化CAs的催化性能. 当温度为30 ℃,气体流速为300 mL·min−1时,溶液的pH值明显下降. Xu等[43]将CA通过交联固定在聚多巴胺(PDA)/聚乙烯亚胺(PEI)修饰的聚偏氟乙烯(PVDF)膜上(简称CA-m-PVDF复合膜),在气液膜接触器中使用速率为0.25 m·s−1的水作为吸收剂,CA-m-PVDF复合膜具有较高的CO2通量值(2.5×10−3 mol·m−2·s−1),该CO2通量值比未添加CA时增加约160%.
MDEA吸收CO2的过程中形成不稳定的氨基甲酸盐和碳酸氢根离子,加热时释放出CO2达到解吸和再生的目的. Zhang等[44]将CA通过吸附固定到ZIF-L-1(MOFs)上,得到CA/ZIF-L-1复合材料. 由于ZIF-L-1和CA均含有Zn2+,两者之间存在协同作用,ZIF-L-1中的咪唑基团(mIm)可以作为亲核试剂参与CO2的水合生成碳酸氢盐(6),而且该反应能够促进CO2的液-固传质. 加入0.05 g·L−1 CA/ZIF-L-1后,MDEA中的CO2吸收率提高了2.5倍. Du等[45]进行了类似的研究,把CA包埋到不同粒径的ZIF-8(CA/ZIF-8)中,并将CO2吸收到MDEA中,MDEA的吸收率增加到2.4倍. Xu等[46]将CA固定在表面改性的磁性Fe3O4纳米颗粒(MNP)上,并用原位聚合合成MNP-CA纳米凝胶. 通过反应器测试了MNP-CA纳米凝胶加速MDEA水溶液中CO2吸收的有效性,MNP-CA纳米凝胶在30 ℃的CO2吸收率为不含CA时的170%. 而且MNP-CA纳米凝胶的加入使湿壁柱气相中的总传质系数(KG)在60 ℃时增加了4.61倍. 费潇瑶[47]使用共价结合法将氨基功能化介孔材料固定在CA上(CA/AFS)对用于MDEA溶液解吸CO2进行了研究,固定化CA的加入对CO2平衡解吸量基本没有影响,但CA/AFS的加入可以在未达到平衡状态之前,提高CO2的瞬时解吸量.
H2O+mIm+CO2↔mIm++HCO−3 (6) CO2在碳酸盐溶液中的总反应如下所示(7),CA可有效促进二氧化碳吸收到碳酸盐溶液中[9]. Fabbricino等[48]将嗜热细菌的碳酸酐酶(SspCA)作为膜锚定蛋白固定在大肠杆菌细胞的外膜(INPN-SspCA)上. 在碱性溶液(0.5 mol·L−1 Na2CO3/0.5 mol·L−1 NaHCO3)吸收CO2反应过程中,加入SspCA的膜细胞碎片用作生物催化剂,观察到压力值的迅速下降和比未添加催化剂时更高的CO2吸收率. Peirce等[49]报道了CA在高浓度碳酸盐溶液中容易失活,因此将工业级碳酸酐酶(NovoCA)固定在顺磁性Fe3O4纳米颗粒上进行改善,并分别在25 ℃和40 ℃的条件下,于0.5 mol·L−1 Na2CO3/NaHCO3缓冲液(pH=9.6)和10%wt K2CO3溶液的搅拌池反应器中进行CO2吸收测试[10]. 溶液中固定化CA的Kcat/Km均在5.52×10−1—5.52 L·mol−1·s−1之间. Qi等[50]通过湿壁柱测定表明,在20% wt K2CO3溶剂中加入2 g·L−1 CA后,CO2总传质系数(KG)提高了约5倍. 当CA浓度从零增加到2.5 g·L−1时,CO2捕集效率增加了4.6倍.
CO2−3+H2O+CO2↔2HCO−3 (7) Gladi等[17]探究了在湿壁柱中对4种溶液(MEA、AMP(2-氨基-2-甲基-1-丙醇)、MDEA和K2CO3溶液)添加0.2% wt CA后吸收CO2的影响. 研究表明,添加CA显著增加了MDEA和K2CO3的液侧传质膜系数,AMP略微增加,而MEA没有变化. MDEA的反应速率随温度升高而降低,而在较低的溶剂浓度(5% wt—15 %wt)下,温度和溶剂浓度对K2CO3中反应速率的影响较小,但在20% wt时,温度升高会显着提高反应速率. 此外,混合溶剂对CO2进行吸收比单一溶剂表现出更高的吸收效率,因为它们结合了单一溶剂的优点. Sahoo等[51]将CA共价固定到异质功能化载体(HFS)和锌络合物(Zn-Im)上(CA/Zn-Im:HFS),并将CA/Zn-Im:HFS加入到混合溶剂(30% wt MEA+7.5% wt PZ+15% wt K2CO3)中加快CO2的吸收和解吸. 含有CA/Zn-Im: HFS的混合溶剂(21.65 %wt)在20 min内CO2的吸收量高于纯混合溶剂(13.75 %wt). 含有CA/Zn-Im: HFS的混合溶剂比纯混合溶剂的CO2相对解吸率高1.57倍. 通过表3展示了CA在二氧化碳吸收中的催化性能.
表 3 CA在二氧化碳吸收中的催化性能Table 3. Catalytic performance of CA in carbon dioxide absorption吸收剂成分Absorbent ingredients 温度Temperature 催化特性Catalytic properties 参考文献References 100 mg的固定化CA(固载量为2 mg·g−1)+H2O 30 ℃ 反应进行30 min,CO2吸收量Gv=1.858×10−4 L [31] CA-m-PVDF复合膜+0.25 m·s−1 H2O 25 ℃ CA-m-PVDF复合膜CO2通量值为2.5×10−3 mol·m−2·s−1 [43] 0.05 g·L−1 CA/ZIF-L-1+20 mL 1 mol·L−1 MDEA 40 ℃ MDEA中的CO2吸收率提高了2.5倍 [44] CA/ZIF-8+MDEA 40 ℃ CO2吸收到含有不同粒径的ZIF-8的MDEA溶液中,MDEA溶液的吸收率增加到2.4倍 [45] 10 mg MNP-CA纳米凝胶+100 mL 1 mol·L−1 MDEA 30 ℃ 反应3 h后,MNP-CA纳米凝胶的CO2吸收率为不含CA时的170% [46] 0.3 kg m−3工业级碳酸酐酶(NovoCA)+2—3 mol·L−1 K2CO3(碳酸盐转化度0—40%) 25 ℃和40 ℃ 当加入的酶浓度低于0.018 kg·m−3时,Kcat/Km值介于0.50×102 L·mol−1·s−1和0.39×103 L·mol−1·s−1之间 [49] 0.2×10−2—1.5×10−2 kg NovoCA·m−3 Fe3O4纳米颗粒固定化CA+0.5 mol·L−1 Na2CO3/NaHCO3缓冲液(pH=9.6) 25 ℃和40 ℃ 固定化CA的Kcat/Km值介于4.87—8.06 L·mol−1·s−1之间 [10] 0.2×10−2—1.5×10−2 kg NovoCA·m−3 Fe3O4纳米颗粒固定化CA+10%wt K2CO3溶液(碳酸盐转化度0—40%) 25 ℃ 固定化CA的Kcat/Km值介于3.24—6.73 L·mol−1·s−1之间 [10] 嗜热细菌的全细胞固定(INPN-SspCA)+0.5 mol·L−1 Na2CO3/NaHCO3 25 ℃ INPN-SspCA的Kcat/Km值介于9.94×10−1—3.09 L·mol−1·s−1之间 [48] 2 g·L−1 CA+20% wt K2CO3 40 ℃ 与未添加CA相比,CO2总传质系数(KG)提高了约5倍 [50] 0.22 g·L−1 CA+30% wt K2CO3(pH~11—12) 50 ℃ CA的Kcat/Km值为5.3×108 L·mol−1·s−1 [52] 0.2% wt CA+30% MDEA/15% K2CO3 17—50 ℃ 添加CA显著增加了MDEA和K2CO3的液侧传质膜系数 [17] 0.2% wt CA+30% wt MEA + 7.5% wt PZ+15% wt K2CO3 30 ℃ 含有CA/Zn-Im: HFS的混合溶剂(21.65% wt)在20 min内CO2的吸收量高于纯混合溶剂(13.75% wt) [51] 0.2% wt CA+30% wt MEA +7.5% wt PZ+15% wt K2CO3 90 ℃ 含有CA/Zn-Im: HFS的混合溶剂比纯混合溶剂的CO2相对解吸率高1.57倍. [51] 3.3 多酶复合级联催化CO2
CO2加氢提供了一种碳再生方法,可以通过特定的催化剂转化为甲酸盐、甲醛和甲醇等高价值化学品和燃料. 固定化酶催化因具有反应条件温和、选择性高、可多次催化和效率高等优点,在CO2加氢中引起了广泛关注. 但是,常压下CO2的低溶解度严重限制了酶促反应的速率[53]. CA不仅能够加速CO2的水合,还用于促进酶催化的CO2转化. Wang等[54]报道随着CA的加入,甲酸脱氢酶的底物从CO2转化为更易溶解的
HCO−3 甲酸本身是一种具有商业价值的化学品,它可用作燃料电池的原料和青贮饲料防腐剂,并且二氧化碳形成甲酸所需的能量较低[55]. Zhai等[56]把CA固定在聚乙烯亚胺(PEI)和聚多巴胺(PDA)的改性的二氧化硅微球(PDA/PEI-SiO2-CA)上,并将其添加到含有NADH和FDH的反应溶液中,从而将CO2转化为甲酸盐. 通过改性在SiO2表面引入氨基,氨基与CO2反应形成氨基甲酸酯和碳酸氢盐,因此CA固定在PDA/PEI-SiO2表面上可产生协同效应. 在PDA/PEI-SiO2-CA存在下,初始反应速率是空白对照的48.6倍,甲酸盐产量也高于空白对照. Zhang等[57]通过微生物转谷氨酰胺转胺酶(MTG)充当“交联介质”将CA和FateDH交联在一起形成交联酶. 在二氧化碳转化为甲酸的实验中,交联酶的催化效率可高达游离酶的5.8倍.
固定多酶体系转化CO2生产甲酸已得到广泛研究. 然而,价格昂贵的辅因子(NADH)的再生和循环利用仍然是CO2高效转化的主要问题[58]. Ren等[53]通过将CA、FateDH、GDH(谷氨酸脱氢酶)、PEI(阳离子聚电解质)和辅因子原位包埋到ZIF-8中,构建了纳米级多酶反应器(Co-IMR). NADH通过带正电的PEI和带负电的辅因子之间的离子交换被束缚在ZIF-8中,并通过嵌入ZIF-8中的GDH再生. Co-IMR在8次重复循环使用后仍保留其初次甲酸生产率的50%,表现出良好的重复使用性. 与游离多酶系统相比,Co-IMR在8次重复循环使用后,总累积甲酸产量增加了4.6倍. Chai等[55]进行了类似研究,制备了ZIF-8/CA&FDH薄膜. ZIF-8中的咪唑基团和CA的协同作用使得CO2对甲酸的整体催化活性提高了1.6倍. Wang等[59]将CA、FateDH、GDH包埋在聚多巴胺微胶囊上. 与游离多酶相比,聚多巴胺微胶囊中固定化多酶体系催化产生的HCOOH高4.5倍以上,基于NADH的甲酸产率为342%. Li等[60]使用胺官能化MIL-101(Cr)作为核心,其具有CO2气体吸附性能,再通过包埋将CA、FateDH和GDH 3种酶固定在外层HKUST-1上. 胺官能化的MIL-101(Cr)释放的CO2底物首先进入CA并水合为碳酸氢根离子,然后
HCO−3 甲醇是一种重要的化工原料及能源物质,由合成天然气制备的甲醇程序复杂,且成本较高[8]. 多酶级联催化CO2甲醇化作为一种生物催化手段近年来引起了较多关注. Wang等[61]把FateDH、FaldDH和ADH共固定在聚苯乙烯微粒上,从而将CO2转化为甲醇. 在没有添加CA的情况下,固定多酶体系11次重复循环使用后产生了48%的累计甲醇收率. 甲醇的收率较低,有待进一步改进. Ji等[62]通过将甲酸脱氢酶、甲醛脱氢酶、乙醇脱氢酶和谷氨酸脱氢酶四种酶和辅因子原位包埋在阳离子聚电解质掺杂的中空纳米纤维腔内,并通过在中空纳米纤维的外表面上组装CA加速CO2水合,进行了进一步研究. 对于涉及3种脱氢酶的CO2还原酶系统,实现了103.2%的最高甲醇收率,该反应系统10次重复循环使用后产生了940.5%的累积甲醇收率.
3.4 CA转化CO2的工业应用
基于CA的生物催化系统可以有效地促进CO2的捕集和分离,但只有少数案例与工业过程中的实际应用密切相关. 对于工业应用,CA必须长时间在高温、高离子强度、高pH值和高剪切应力的条件下保持较高活性和稳定性. Lalande等[63]设计并安装了含有固定化CA的CO2填充柱,用于回收和循环利用来自水泥熟料生产的CO2. 固定化CA催化CO2水合形成碳酸氢根离子与添加的CaCl2反应生成的CaCO3被用作波特兰水泥厂的原料. 2015年,在加拿大魁北克省[64]进行了基于CA的CO2捕集工艺的有史以来规模最大的测试. 该测试使用了添加定向进化CA的20% wt的K2CO3/KHCO3溶液,能够在2500 h内以80%的平均捕集效率每天从燃烧天然气的锅炉的燃烧气体中捕集1×104 kg CO2. 实验过程中仅产生少量无毒碱性废水,无需特殊处理直接排入市政下水道. 此外,从汽提塔装置中排出的CO2气体的纯度约99.3%,可用于生产燃料、塑料和化学品等产品. Reardon等[65]在威尔逊维尔的国家碳捕集中心(NCCC)将CA固定在吸收柱的内表面,以20% wt K2CO3和非挥发性碱性盐溶液(AKM-24)作为吸收剂. 固定化CA使传质速率提高了6—7倍,并在40 d 3460 h内保持了超过80%的烟气中CO2的捕集效率. 为了评估CA催化的CO2加速吸收到MDEA水溶液中,在威尔逊维尔的NCCC进行中试规模的CO2捕集实验. 捕集装置在连续6 d吸收温度25—35 ℃和87 ℃解吸温度之间循环,在稳态条件下每天能够捕集多达68.1 kg的二氧化碳[3]. 总而言之,与之前的无生物催化剂过程相比,CA介导的CO2捕集过程具有显著促进作用.
4. 结论与展望(Conclusions and prospects)
为了改善游离CA在高温、强酸或强碱溶剂和化学杂质等条件下容易失活的特性,使用合适的载体和固定化方法对CA进行固定. CO2可通过酶促反应吸收,或通过CA一步催化或级联催化转化为无机碳酸盐、甲酸和甲醇等高价值产品. 固定化CA转化CO2的应用取得了一定的成效,但是仍存在一些技术瓶颈,可总结为以下几个方面:(1)CA价格昂贵. (2)CA对烟气中存在的高温、SOx和NOx耐受性差. (3)固定化方法尚不完善和载体的酶负载量低导致固定化CA活性低.
针对上述问题,未来的研究方向应集中于:(1)从转基因生物中提取大量CA,降低CA生产成本. (2)进一步研究CAs相关基因的生理作用和代谢途径,以提高化学和热稳定性. (3)研发先进的固定化方法和制备具有良好的机械强度、稳定性和对酶亲和力高的载体,提高固定化CA活性.
-
表 1 南四湖表层底泥(0—4 cm)重金属含量及富集系数
Table 1. Heavy metal contents and enrichment factors in surface sediments (0—4 cm) of Nansi Lake
项目 Project Pb Cd Hg As 南阳湖 含量/(mg·kg−1) 28.46±4.17 0.23±0.01 0.079±0.011 18.64±2.01 富集系数 1.90 3.03 5.26 2.49 污染程度 无—弱污染 中度污染 显著污染 中度污染 独山湖 含量/(mg·kg−1) 21.31±0.89 0.16±0.02 0.058±0.007 12.91±0.29 富集系数 1.42 2.07 3.87 1.72 污染程度 无—弱污染 中度污染 中度污染 无—弱污染 昭阳湖 含量/(mg·kg−1) 25.14±3.86 0.30±0.03 0.037±0.019 15.50±1.84 富集系数 1.68 3.95 2.43 2.07 污染程度 无—弱污染 中度污染 中度污染 中度污染 微山湖 含量/(mg·kg−1) 26.51±1.28 0.50±0.01 0.041±0.003 20.81±3.02 富集系数 1.77 6.44 2.72 2.78 污染程度 无—弱污染 显著污染 中度污染 中度污染 农用地土壤污染风险管控标准值(水田,6.5<pH<7.5) 140 0.6 0.6 25 环境背景值/(mg ·kg−1) 15 0.077 0.015 7.5 注:富集系数为底泥重金属含量同环境背景值的比值. Note: Enrichment coefficient is the ratio of sediment heavy metal contents to environmental background values. 表 2 南四湖表层底泥(0—4 cm)重金属地积累指数Igeo及潜在生态风险指数RI
Table 2. The index of geoaccumulation (Igeo) and potential ecological risk index (RI) of heavy metals in surface sediments (0—4 cm) of Nansi Lake
区域District 潜在生态风险因子EiPotential ecological risk index Ei RI 地积累指数IgeoIndex of geoaccumulation Igeo Pb Cd Hg As Pb Cd Hg As 南阳湖 9.49 80.93 156.44 24.85 272.97 0.34 0.85 1.80 0.73 轻微 强 强 轻微 重污染 轻—中 轻—中 中 轻—中 独山湖 7.10 59.88 115.40 15.61 199.09 −0.08 0.41 1.36 0.06 轻微 中 强 轻微 中等污染 无 轻—中 中 轻—中 昭阳湖 8.38 134.61 69.15 20.67 233.88 0.16 1.58 0.62 0.46 轻微 强 中 轻微 中等污染 轻—中 中 轻—中 轻—中 微山湖 8.84 186.95 80.41 27.75 304.99 0.24 2.05 0.84 0.89 轻微 很强 强 轻微 重污染 轻—中 中—强 轻—中 轻—中 表 3 南四湖各采样点表层底泥(0—4 cm)重金属稳定程度
Table 3. The stable risks of heavy metals in surface sediment (0—4 cm) of Nansi Lake
区域District Pb Cd Hg As 南阳湖 SAC 2.4% 25.0% 32.7% 13.6% 分级 稳定 中等稳定 不稳定 中等稳定 独山湖 SAC 0.8% 14.9% 28.6% 11.0% 分级 极稳定 中等稳定 中等稳定 中等稳定 昭阳湖 SAC 1.6% 18.1% 16.9% 10.9% 分级 稳定 中等稳定 中等稳定 中等稳定 微山湖 SAC 2.1% 18.6% 18.6% 15.7% 分级 稳定 中等稳定 中等稳定 中等稳定 -
[1] CHATTERJEE M, SILVA F E V, SARKAR S K, et al. Distribution and possible source of trace elements in the sediment cores of a tropical macrotidal estuary and their ecotoxicological significance [J]. Environment International, 2007, 33(3): 346-356. doi: 10.1016/j.envint.2006.11.013 [2] 马长城, 孙竹梅, 胥军, 等. 湖北菱角湖沉积物中重金属垂直分布及形态分析 [J]. 环境科学与技术, 2014, 37(3): 136-139. MA C C, SUN Z M, XU J, et al. Vertical distribution and speciation analysis of heavy metals in sediments of Lingjiao Lake, Hubei [J]. Environmental Science and Technology, 2014, 37(3): 136-139(in Chinese).
[3] 张智慧, 李宝, 梁仁君. 南四湖南阳湖区河口与湖心沉积物重金属形态对比研究 [J]. 环境科学学报, 2015, 35(5): 1408-1416. ZHANG Z H, LI B, LIANG R J. Comparison of sediment heavy metal fractions at estuary and center of Nanyang Zone from Nansi Lake, China [J]. Acta Scientiae Circumstantiae, 2015, 35(5): 1408-1416(in Chinese).
[4] 杨丽原, 沈吉, 张祖陆, 等. 南四湖表层底泥重金属污染及其风险性评价 [J]. 湖泊科学, 2003, 15(3): 252-256. doi: 10.3321/j.issn:1003-5427.2003.03.009 YANG L Y, SHEN J, ZHANG Z L, et al. Distribution and ecological risk assessment for heavy metals in superficial sediments of Nansihu Lake [J]. Journal of Lake Science, 2003, 15(3): 252-256(in Chinese). doi: 10.3321/j.issn:1003-5427.2003.03.009
[5] 范成新, 张路. 太湖-沉积物污染与修复原理[M]. 北京: 科学出版社, 2009: 162—165. FAN C X, ZHANG L. Principles of sediment pollution and remediation in Lake Taihu[M]. Beijing: Science Press, 2009: 162—165 (in Chinese).
[6] 汪玉娟, 吕文英, 刘国光, 等. 沉积物中重金属的形态及生物有效性研究进展 [J]. 安全与环境工程, 2009, 16(4): 27-29,37. doi: 10.3969/j.issn.1671-1556.2009.04.007 WANG Y J, LV W Y, LIU G G, et al. Progress in research on heavy metal speciation and bioavailability in sediment [J]. Safety and Environmental Engineering, 2009, 16(4): 27-29,37(in Chinese). doi: 10.3969/j.issn.1671-1556.2009.04.007
[7] ALCOCK S, BARCELO D, HANSEN P-D. Monitoring freshwater sediments [J]. Biosensors and Bioelectronics, 2003, 18(8): 1077-1083. doi: 10.1016/S0956-5663(02)00210-5 [8] 章骅, 何品晶, 吕凡, 等. 重金属在环境中的化学形态分析研究进展 [J]. 环境化学, 2011, 30(1): 130-137. ZHANG H, HE J J, LV F, et al. A review on the methods for investigating heavy metal speciation in environmental chemistry [J]. Environmental Chemistry, 2011, 30(1): 130-137(in Chinese).
[9] SINGH K P, MOHAN D, SINGH V K, et al. Studies on distribution and fractionation of heavy metals in Gomti river Sediments-a tributary of the Ganges, India [J]. Journal of Hydrology, 2005, 312: 14-27. doi: 10.1016/j.jhydrol.2005.01.021 [10] 孟祥华, 刘恩峰, 杨丽原, 等. 南四湖及主要入湖河流沉积物金属空间分布特征与污染评价 [J]. 环境科学研究, 2010, 23(1): 1-6. MENG X H, LIU E F, YANG L Y, et al. Spatial distribution and contamination evaluation of metals in sediments from Nansihu Lake and its main inflow rivers [J]. Research of Environmental Sciences, 2010, 23(1): 1-6(in Chinese).
[11] 刘良, 张祖陆. 南四湖表层沉积物重金属的空间分布、来源及污染评价 [J]. 水生态学杂志, 2013, 34(6): 7-15. doi: 10.3969/j.issn.1674-3075.2013.06.002 LIU L, ZHANG Z L. Spatial distribution, sources metals in the surface and pollution assessment of heavy sediments of Nansihu Lake [J]. Journal of Hydroecology, 2013, 34(6): 7-15(in Chinese). doi: 10.3969/j.issn.1674-3075.2013.06.002
[12] 刘恩峰, 沈吉, 王建军, 等. 南四湖表层沉积物重金属的赋存形态及底部界面扩散通量的估算 [J]. 环境化学, 2011, 29(5): 870-874. LIU E F, SHEN J, WANG J J, et al. Chemical forms of the heavy metals in surface sediment from Nansihu Lake and their diffusion flux at the sediment-water interface [J]. Environmental Chemistry, 2011, 29(5): 870-874(in Chinese).
[13] TESSIER A, CAMPBELL P G C, BISSON M, et al. Sequential extraction procedure for the speciation of particulate trace metals [J]. Analytical Chemistry, 1979, 51(7): 844-852. doi: 10.1021/ac50043a017 [14] 张霖琳, 梁宵, 加那尔别克·西里甫汗, 等. 在土壤及底泥重金属测定中不同前处理和分析方法的比较 [J]. 环境化学, 2013, 32(2): 302-306. doi: 10.7524/j.issn.0254-6108.2013.02.018 ZHANG L L, LIANG X, JANARBEK X L F H, et al. Comparison of different pretreatment and analytical method of heavy metals in soil and sediment samples [J]. Environmental Chemistry, 2013, 32(2): 302-306(in Chinese). doi: 10.7524/j.issn.0254-6108.2013.02.018
[15] 邱继彩, 梁仁君, 孙爱德, 等. 祊河下游河水中重金属污染评价 [J]. 中国农学通报, 2013, 29(20): 176-180. doi: 10.11924/j.issn.1000-6850.2013-0721 QIU J C, LIANG R J, SUN A D, etal. Evaluation of heavy metal pollution in the Beng downstream river water [J]. Chinese Agricultural Science Bulletin, 2013, 29(20): 176-180(in Chinese). doi: 10.11924/j.issn.1000-6850.2013-0721
[16] MULLER G. Index of geoaccumulation in sediments of Rhine River [J]. GeoJournal, 1969, 2(3): 109-118. [17] HKANSON L. An ecological risk index for aquatic pollution control:a sedimentological approach [J]. Water Research, 1980, 14(8): 975-1001. doi: 10.1016/0043-1354(80)90143-8 [18] 张朝生, 章申, 王立军, 等. 长江与黄河沉积物金属元素地球化学特征及其比较 [J]. 地理学报, 1998, 53(4): 314-322. doi: 10.3321/j.issn:0375-5444.1998.04.005 ZHANG C S, ZHANG S, WANG L J, et al. Geochemistry of metals in sediments from Changjiang River and Huanghe River and their comparison [J]. Acta Geographica Sinica, 1998, 53(4): 314-322(in Chinese). doi: 10.3321/j.issn:0375-5444.1998.04.005
[19] 徐争启, 倪师军, 庹先国, 等. 潜在生态危害指数法评价中重金属毒性系数计算 [J]. 环境科学与技术, 2008, 31(2): 112-115. doi: 10.3969/j.issn.1003-6504.2008.02.030 XU Z Q, NI S J, TUO X G, et al. Calculation of heavy metals’ toxicity coefficient in the evaluation of potential ecological risk index [J]. Environmental Science and Technology, 2008, 31(2): 112-115(in Chinese). doi: 10.3969/j.issn.1003-6504.2008.02.030
[20] KALNEJAIS L H, MARTIN W R, SIGNELL R P, et al. Role of sediment resuspension in the remobilization of particulate-phase metals from coastal sediments [J]. Environmental Science & Technology, 2007, 41(7): 2282-2288. [21] 俞慎, 历红波. 沉积物再悬浮-重金属释放机制研究进展 [J]. 生态环境学报, 2010, 19(7): 1724-1731. doi: 10.3969/j.issn.1674-5906.2010.07.038 YU S, LI H B. Perspectives on the release of heavy metals via sediment resuspension [J]. Ecology and Environment, 2010, 19(7): 1724-1731(in Chinese). doi: 10.3969/j.issn.1674-5906.2010.07.038
[22] 沈吉, 张祖陆, 杨丽原, 等. 南四湖-环境与资源研究[M]. 北京: 地震出版社, 2008: 141—159. SHEN J, ZHANG Z L, YANG L Y, et al. Nansi Lake-environmental and resource studies[M]. Beijing: Seismological Press, 2008, 141—159 (in Chinese).
[23] 李宝, 孙春意, 张智慧, 等. 小埠东橡胶坝对沂河临沂城区蓄水段沉积物重金属分布的影响 [J]. 水土保持学报, 2014, 28(4): 243-246. LI B, SUN C Y, ZHANG Z H, et al. Effects of Xiaobudong rubber dam on the distribution of sediment heavy metals in Yihe River at Linyi City, Shandong Province [J]. Journal of Soil and Water Conservation, 2014, 28(4): 243-246(in Chinese).
[24] LOPEZ-GALVAN E, BARCELO-QUINTAL I, SOLIS-CORREA H E, et al. Calculation of the ecological risk index in the José Antonio Alzate Dam, State of Mexico, Mexico [J]. Biological Trace Element Research, 2010, 135: 121-135. doi: 10.1007/s12011-009-8501-z [25] 王霞. 黄河上游典型地区底泥重金属调查与污染评价[D]. 兰州: 兰州交通大学, 2014, 22—24. WANG X. Investigation and pollution assessment of heavy metals in surface sediments from typical regions in upstream of Yellow River[D]. Lanzhou: Lanzhou Jiaotong University, 2014, 22—24 (in Chinese).
[26] 毛志刚, 谷孝鸿, 陆小明, 等. 太湖东部不同类型湖区疏浚后沉积物重金属污染及潜在生态风险评价 [J]. 环境科学, 2014, 35(1): 187-193. MAO Z G, GU X H, LU X M, et al. Pollution distribution and potential ecological risk assessment of heavy metals in sediments from the different eastern dredging regions of Lake Taihu [J]. Chinese Journal of Environmental Science, 2014, 35(1): 187-193(in Chinese).
[27] 田林锋, 胡继伟, 罗桂林, 等. 贵州百花湖沉积物重金属稳定性及潜在生态风险性研究 [J]. 环境科学学报, 2012, 32(4): 886-894. TIAN L F, HU J W, LUO G L, et al. Ecological risk and stability of heavy metals in sediments from Lake Baihua in Guizhou Province [J]. Acta Scientiae Circumstantiae, 2012, 32(4): 886-894(in Chinese).
[28] 程晓东, 郭明新. 河流底泥重金属不同形态的生物有效性 [J]. 农业环境保护, 2001, 20(1): 19-22. CHEN X D, GUO M X. Bioavailability of heavy metals at different forms in sediment [J]. Agro-Environmental Protection, 2001, 20(1): 19-22(in Chinese).
-










 DownLoad:
DownLoad: