-
随着社会经济的高速发展,人类正面临着能源匮乏和水环境污染的双重危机,亟需开发环境友好、可重复再生的清洁能源。相较于化石能源,生物质能源因具有可再生性、原料丰富和环境友好等优点[1],被认为是环境可持续发展框架下新能源的重要发展方向[2]。在众多生物质原料中,微藻具有生长周期短、光合效率高、适应污水生长以及“不与人争粮和不与粮争地”的优势,被认为是一种极具潜力的生物柴油生产原料[3]。当前,利用微藻制备生物柴油,已成为新型可再生清洁能源开发的研究热点,但高成本问题始终制约着微藻生物柴油的产业化进程[4]。因此,如何提升油脂产率,提高微藻工艺的综合效益已成为促进微藻生物燃料实现低成本、规模化生产的关键。
截止目前,营养盐调控仍是提高微藻产量及油脂含量的可靠方法[5],通常情况下,培养体系中营养成分如碳、氮、硫等的变化会影响微藻生长与内部物质的积累[6]。碳是微藻生长必不可少的营养元素[7],约占藻细胞干质量的50%,是藻细胞的主要组成部分。KHAWAJA等[8]研究表明,不同碳源对促进微藻生长存在较大差异,在异养情况下,小分子碳源更有利于微藻生长。氮是蛋白质合成的重要元素,对促进碳源代谢至关重要。ANAND等[9]研究表明,贫氮条件更利于微藻积累油脂,富氮条件更利于促进微藻生长,存在兼顾微藻生长与油脂积累的氮浓度。碳、氮的耦合作用对微藻生长的促进作用也不容忽视。ZHENG等[10]指出,C/N过低会抑制微藻生长,过高不利于释放微藻生长潜力,存在适宜微藻生长的最适C/N。此外,硫是微藻碳氮代谢的关键偶联元素,调控着微藻生长和细胞代谢过程。LV等[11]研究表明,硫酸盐缺乏会削弱微藻生长与污水净化的能力;王倩雅等[12]也指出,硫限制会导致藻细胞碳氮代谢途径重新调整。当前,针对营养元素影响微藻生长、油脂积累的研究主要集中于单一碳源、单一氮源方面,而对不同C/N条件下硫元素的影响研究较少,而从硫元素出发研究微藻的生长、胞内组分动态变化,对全面了解微藻光合产油机制具有重要意义。
因此,本研究以斜生栅藻为研究对象,探究了微藻生长、碳氮去除、油脂积累与脂肪酸分布对水体C/N变化的响应规律以及硫在其中的调控作用,旨在了解不同C/N条件下硫对微藻光合作用、碳氮利用和油脂积累的影响,以期为探究微藻碳流趋向油脂积累的光合营养机制提供参考。
-
本实验选用由中科院淡水藻种库提供的斜生栅藻(Scenedesmus obliquus,FACHB-12)作为受试藻种。斜生栅藻属于绿藻门,适应污水环境且对营养盐具有较高的吸收转化能力,是生产生物柴油的优势藻种[13]。实验前先将藻种在无菌条件下转接至装有BG11培养基的锥形瓶中,于(25±1) ℃、光照度4800 Lx,光暗比12 h:12 h的恒温培养箱(PGX-350B,宁波赛福实验仪器有限公司)中进行扩大培养,培养期间应每天随机变换锥形瓶位置以保证受光均匀,并按时摇动锥形瓶3次确保藻水混合均匀。实验中所用玻璃制品、培养基等均经高温高压灭菌后使用(温度121 ℃,时间20 min)。
-
乙酸钠、氯化铵是促进微藻生长的优质营养盐[14-15],因此,本实验选用乙酸钠和氯化铵分别作为实验用碳源、氮源,并结合前人已有研究配制实验用水[16],即1 L实验用水中包含385 mg NaAc(300 mg·L−1 COD);115 mg NH4Cl(30 mg·L−1
NH+4 -N);13 mg KH2PO4;0.55 mg FeCl2·4H2O;6 mg CaCl2;66 mg MgCl2·6H2O;1 mL A5溶液 (A5溶液为微量金属的混合液,1 L的A5溶液包括:0.08 g·L−1 CuCl2·2H2O、1.86 g·L−1 MnCl2·4H2O、0.22 g·L−1 ZnCl2、0.39 g·L−1 Na2MoO4·2H2O、0.05 g·L−1 Co(NO3)2·6H2O、2.86 g·L−1 H3BO3)。其中,根据调整配方中NH4Cl的质量配制氮元素浓度分别为0、5、10、20、40 mg·L−1的实验用水。此外,将配方中的FeCl2·4H2O、MgCl2·6H2O替换成等质量的FeSO4·7H2O、MgSO4·7H2O,用于配制含硫实验用水。上述实验用水配制完毕随即置于高压灭菌锅(SN310C,日本雅马拓公司)中灭菌,隔夜冷却后使用。 -
本实验在已有研究基础上设置4种不同C/N水平[17](C/N水平为:7.5,15,30,60)及缺硫、含硫两种条件,对照组中不含NH4+-N,每组设置3个平行实验。首先,将藻液置于BG11培养基中培养10 d至对数生长期,再将对数生长期藻液置于高速冷冻离心机(TGL168,长沙湘智离心机有限公司),在3500 r·min−1、4 ℃条件下离心8 min,舍弃上清液,用15 mg·L−1的NaHCO3溶液冲洗藻体并离心2次,以去除藻细胞表面吸附的营养盐;随后用无菌水冲洗、离心2次再将其转入无氮培养基培养3 d以耗尽藻细胞内营养盐并离心获取藻细胞;最后用无菌水冲洗、离心3次后用无菌水再悬浮,测定藻细胞密度后供实验使用。实验开始时,在已灭菌的锥形瓶里加入500 mL实验用水,再加入一定量上述实验藻液,保证初始接种密度为1×106 cells mL−1,实验周期设置为5 d。每天定时取样。在培养结束后,离心收集各平行实验微藻生物量并富集于50 mL离心管中,经冲洗和真空冷冻干燥(DZF-6020,上海煜南仪器有限公司)用于油脂与脂肪酸测定。
-
取混匀的藻浓液1 mL于15 mL离心管中,用无菌水稀释至10 mL并摇匀,用滴管取适量藻液注入血球计数板(25×16)并利用显微镜(CX33,南京奥力科学仪器有限公司)计数3次,若3次误差大于10%,则重新计数直至符合实验标准。同时,保证每个计数格中的藻细胞数为5—8个,以便精准计数,否则应调整藻液稀释倍数重新计数。
-
取适量藻密度已知的藻浓液按5倍梯度稀释7个样品(每个梯度下的藻密度可根据计算得到),利用紫外可见分光光度计(DR 6000,美国哈希公司)在682 nm波长下进行测定,以得到的吸光度值为横坐标,藻密度为纵坐标绘制藻密度标准曲线(y=197.53x,R2=0.9999)。
-
水质参数:污水pH采用pH计(FE 28,美国梅特勒-托利多公司)测定;水体COD采用COD快速消解仪(DRB 200,美国哈希公司)测定;水体
NH+4 -N浓度采用纳氏试剂分光光度法(HJ535-2009)测定。油脂含量及脂肪酸:取适量真空冷冻干燥后的微藻混合样于试管中,加入10 mL盐酸溶液,在70 —80 ℃下水浴,至试样消解完全;取出试管,加入10 mL乙醇并混匀,将试管中的水解液转移到分液漏斗中,用乙醚石油醚混合液冲洗试管和塞子,冲洗液并入分液漏斗中,加盖振摇后静置,将醚层提取液收集到250 mL烧瓶中,按上述步骤重复提取水解液3次,再用乙醚石油醚混合液冲洗漏斗,并收集到已恒重的烧瓶中,将烧瓶置水浴上蒸干,最后置于 (100 ± 5) ℃干燥至恒重,计算油脂含量。然后对脂肪进行皂化以及脂肪酸甲酯化处理,再利用气相色谱仪(Agilent 7890A,美国安捷伦公司)进行脂肪酸分析,色谱柱为HP-88 (100 m×0.25 mm×0.20 μm),检测器为FID,采用分流方式进样,分流比为0.8。
其中,
Mt 为收获时藻的生物质浓度(mg·L−1),Lt 为收获时总脂含量,t 为培养时间。 -
实验数据采用SPSS 25进行单因素方差分析,采用LSD法进行统计检验,P<0.05表示差异有统计学意义;采用Origin 2017进行绘图。
-
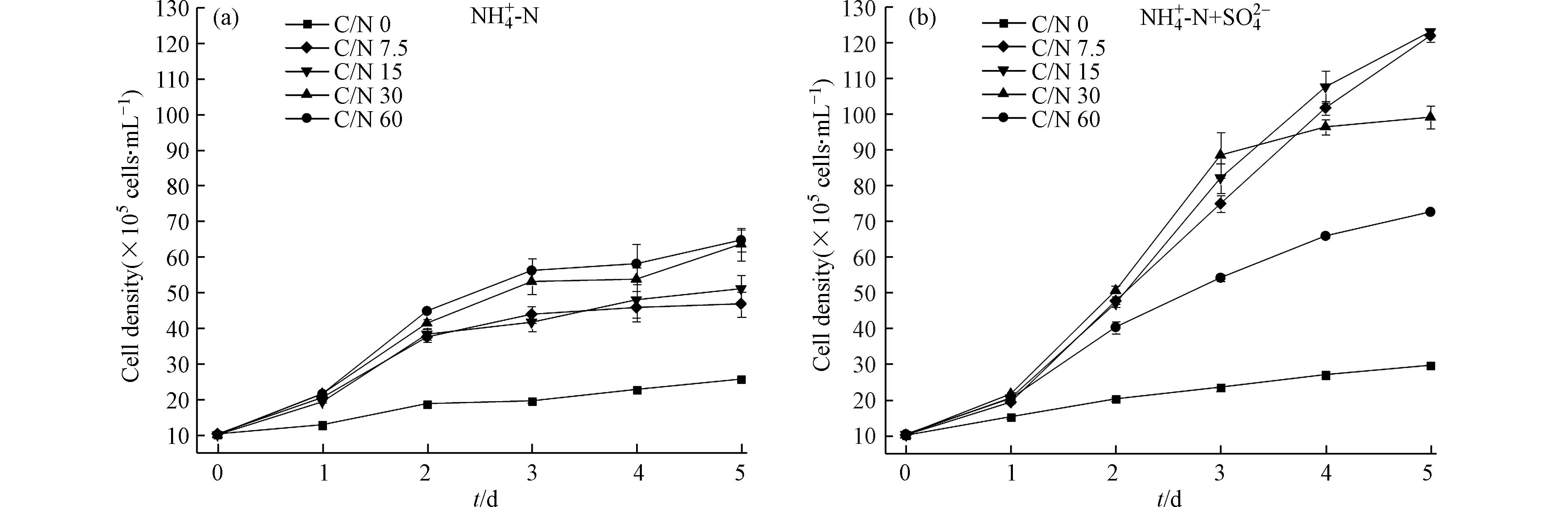
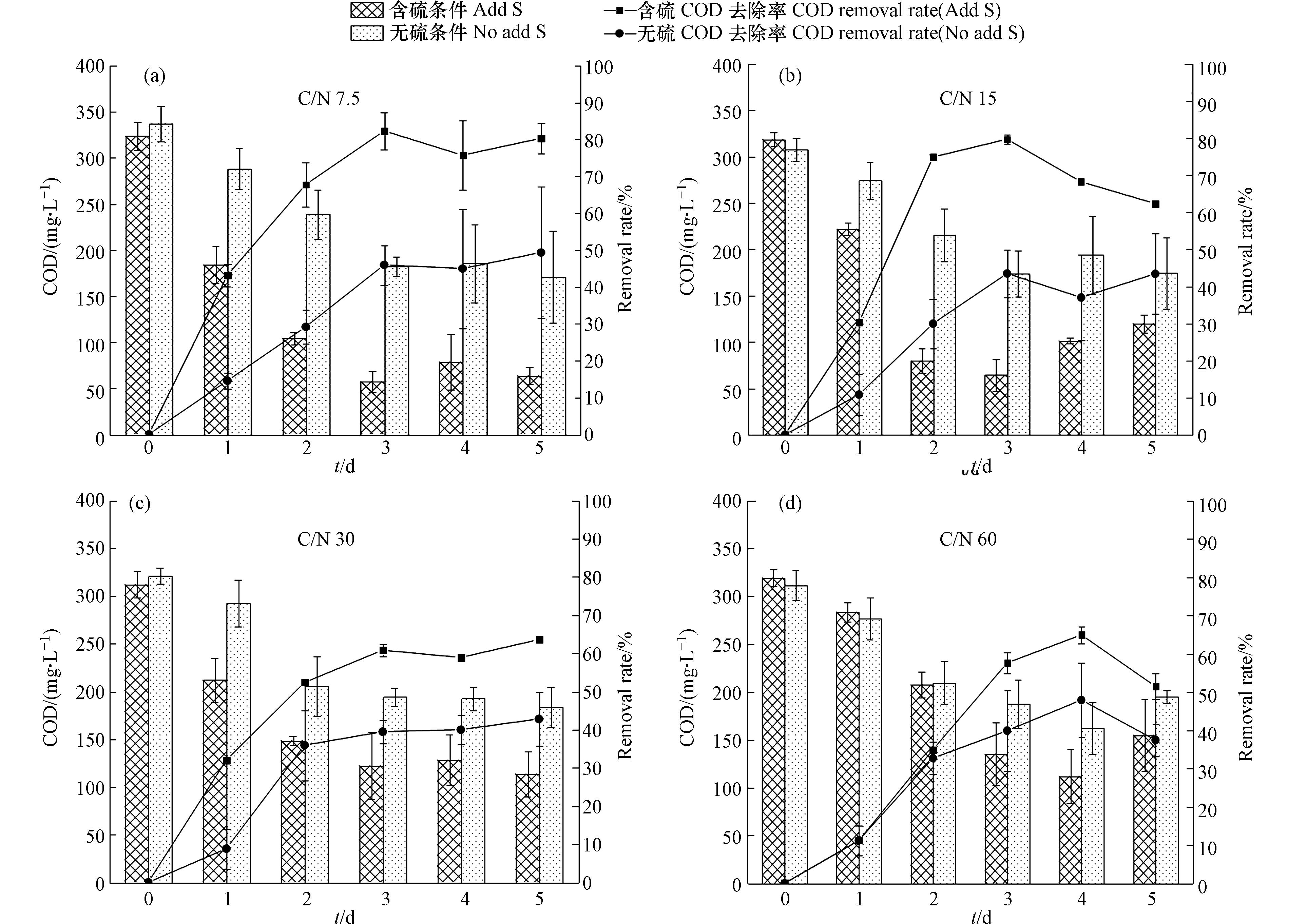
图1为无硫和含硫条件下,水体的C/N对微藻生长的影响情况。培养到第5天,含硫条件下各组别藻细胞密度显著高于无硫组(P<0.05)。
如图1所示,在无硫条件下,斜生栅藻在培养初始阶段经过短暂的适应期后加速生长,藻细胞密度不断升高,随着C/N的增大,藻细胞密度也逐渐上升,培养到第5天,C/N为60的组别藻密度达到最大,为6.46×106 cells·mL−1;而在含硫条件下,藻细胞密度在C/N为15时达到最高,为1.23×107 cells·mL−1,较无硫条件提升了90%。无硫条件下藻细胞密度较低主要是因为藻细胞内加氧酶的酶活性降低,并诱导活性氧的产生,从而抑制了生长[18]。硫作为叶绿素合成的重要因子,加入后可有效促进藻细胞合成叶绿素,进而增强微藻光合作用,促进了藻细胞生长[19],使得含硫条件下藻细胞密度有了较大的提高。MICHAL等[1]通过实验也证实了这一点。此外,在高C/N条件下碳源充足,随着氮素的消耗,氮逐渐成为微藻生长的限制因子[20],而氮元素作为氨基酸的重要组成部分,需要以适当的形式进行合成或外部补充[21],培养环境中氮元素降低反而影响藻细胞利用碳源进行增殖,致使微藻生长受到限制。周涛等[22]通过实验还发现,
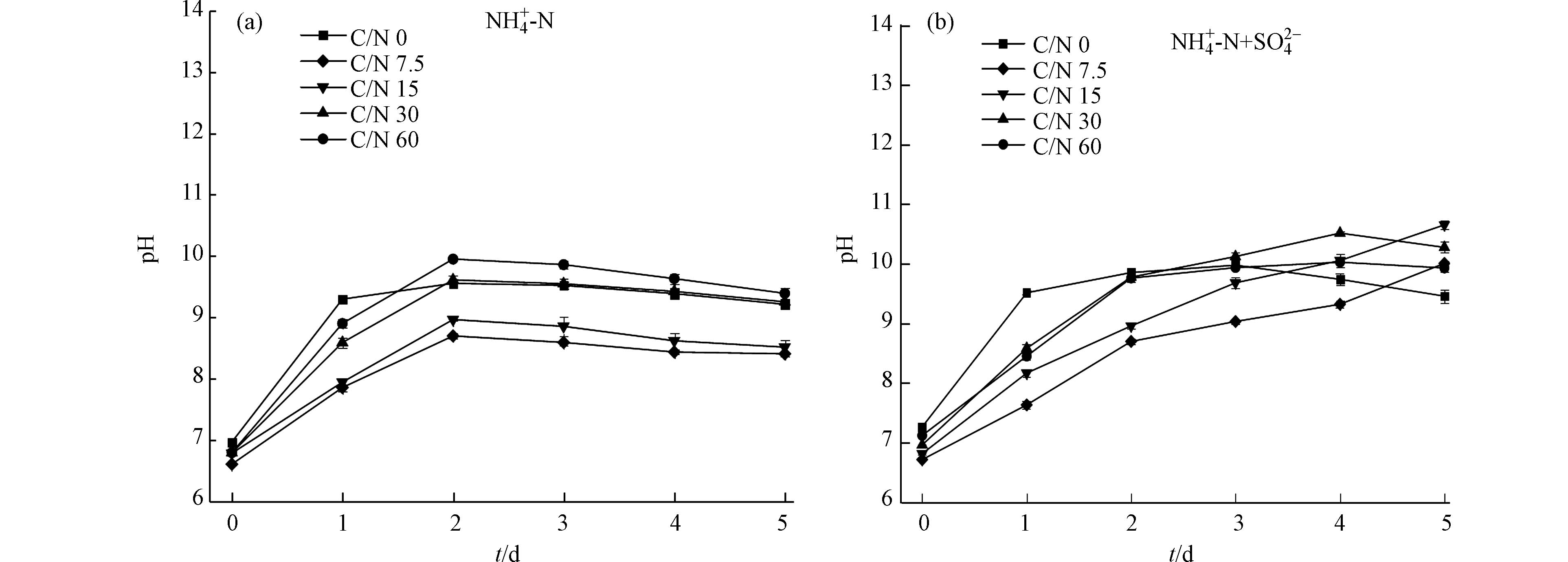
NH+4 -N不宜过高,否则会对藻细胞产生毒害作用,影响其正常生长。因此,在微藻精细化培养过程中应综合考虑碳氮硫等的影响。图2为不同C/N下无硫、含硫条件对微藻生长系统pH变化的影响情况。由图2可以看出,在无硫条件下,各组别pH均呈现先上升后下降的趋势,且均在第2天达到最大,随后趋于稳定。这主要是由于:在无硫条件下藻细胞利用营养物合成生命活动必要的蛋白质、叶绿素等过程受到抑制,生长潜力无法释放,且在低C/N条件下系统中的NH4+-N表现出毒害性,进一步抑制细胞生长,进而导致系统pH下降[3];在含硫条件下,各组别pH变化存在较大差异,C/N为30和60的实验组呈先升后降的趋势,C/N为7.5和15的实验组在培养周期内pH逐渐升高,表明这2组有较大的生长潜力。硫元素加入后,有效驱动藻细胞大量合成叶绿素等光合作用必要前体物,光合作用增强,光合作用产物增多,使得系统pH有一定提高。
-
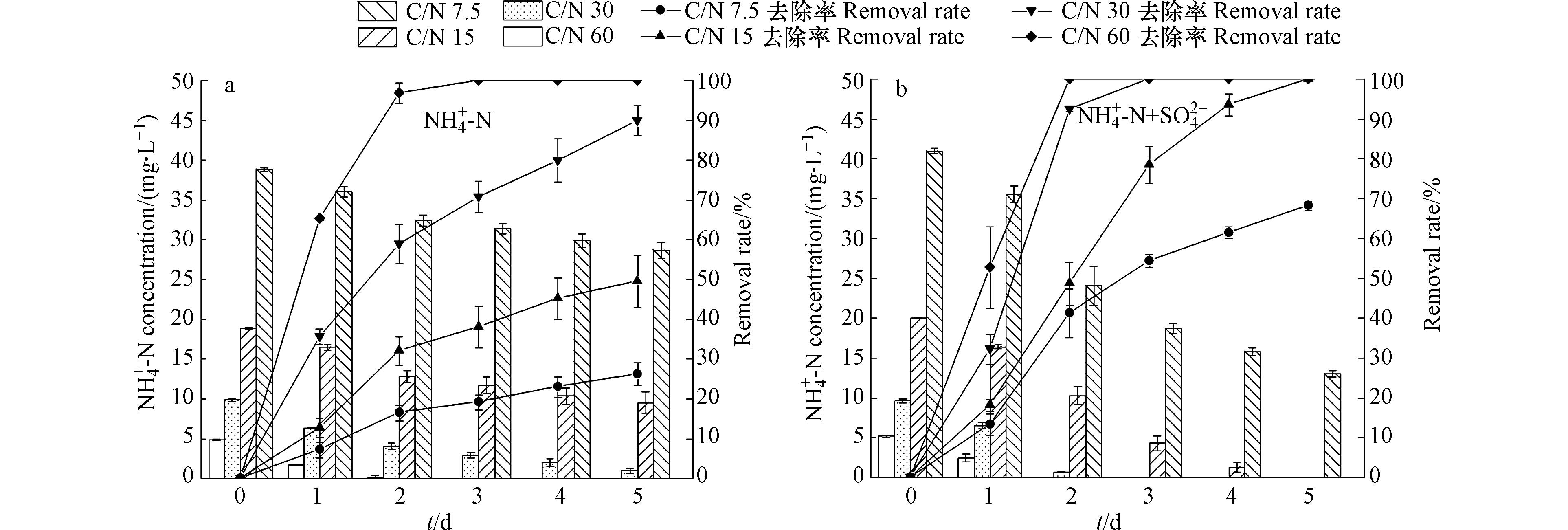
图3为不同C/N下无硫、含硫条件对微藻去除
NH+4 -N能力的影响情况。由图3(a)可知,在无硫条件下,微藻对NH+4 -N的去除率随着C/N增大而升高;培养到第3天,C/N为60的实验组中微藻对NH+4 -N的去除率高达100%,高于低C/N组别。而由图3(b)可知,在含硫条件下,当C/N为15、30、60时,微藻对NH+4 -N的去除率均能达到100%,C/N为7.5的实验组微藻对NH+4 -N的去除率为73.6%,较在无硫时提升了1.49倍。对比无硫、含硫条件下,C/N为60的实验组去除率差异不明显,含硫条件下C/N为7.5、15和30的实验组中斜生栅藻对NH+4 -N去除能力显著优于无硫条件(P<0.05)。其原因是,硫元素加入后藻细胞生长加快,吸收利用NH+4 -N的能力增强,相较于无硫条件,能更多的利用NH+4 -N合成有机物质,从而提高NH+4 -N去除效率。图4为不同C/N下无硫、含硫条件对系统COD值的影响。由图4可知,含硫条件下微藻对有机物的去除效率优于无硫条件,且在培养前期微藻对营养物的利用效率更高。整体看来,COD去除率随着C/N降低而升高。培养到第5天,含硫条件下各实验组中微藻对营养物的去除率均高于50%,在C/N为7.5时COD值较初始下降了82.29%,去除效率达到80.33%,较无硫条件提升了63%;而在C/N为15、30、60时,微藻对营养物的利用效率分别是无硫条件的1.43、1.48、1.37倍。硫元素加入有效提升了微藻对碳源的利用效率。这主要是由于微藻从无氮培养基中转入含硫实验污水后大量合成叶了绿素、蛋白质等物质,藻细胞大量吸收营养物质以满足自身生理需求。GALINA等[23]也指出,藻细胞在合成蛋白质、油脂等过程中需要提供能量进行支撑,进一步促进藻细胞吸收有机物。此外,本研究的结果表明,当C/N在7.5—15时,微藻生长与碳氮利用的综合效益较好,但适宜不同种类微藻生长的条件存在差异,兼顾不同微藻碳氮利用与生长的C/N可能会有一定区别[24]。
-
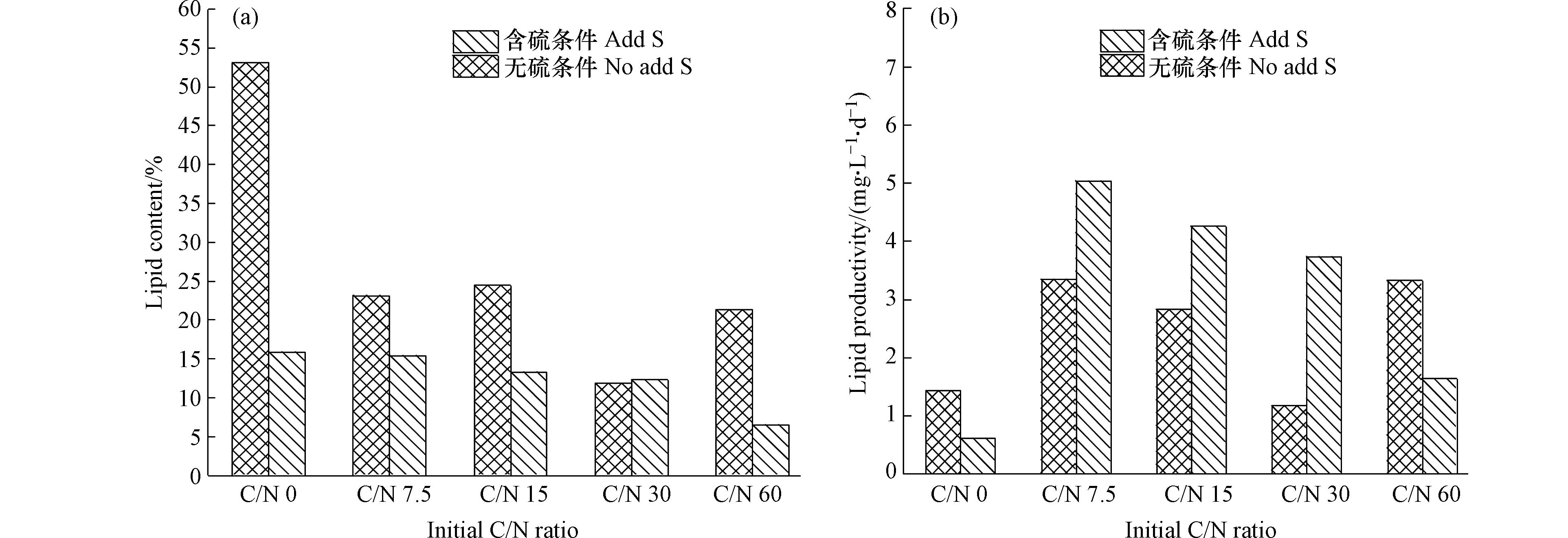
图5(a)为不同C/N下无硫、含硫条件对油脂含量的影响情况。由图5(a)可以看出,无硫条件下,实验组的油脂含量在11.8%—24.4%,且随着C/N的增大先升后降,在C/N为15时达到最大,为24.4%,低于无硫对照组的53.1%,在氮、硫双重限制下的油脂含量是单一硫限制的3.34倍。有研究表明,营养盐限制越多更有利于碳流趋向油脂积累[25]。而在含硫条件下,油脂含量在6.5%—15.4%,且随着C/N增大而减小,在C/N为7.5时最高,占细胞干质量的15.4%,但远低于无硫条件的23.1%。这说明硫元素加入反而不利于微藻积累油脂。其原因在于藻细胞受到营养盐限制等外界环境胁迫时更倾向于积累油脂[26],当硫元素限制或缺乏时影响了藻细胞正常生长,油脂作为一种持久性储能物质,对藻细胞应对营养胁迫和维持正常生命活动具有重要意义[27],因此,藻细胞在硫胁迫时油脂含量更高。此外,氮限制也有利于微藻积累油脂且较低的C/N更利于油脂合成,油脂含量最高可达15.9%。这主要是由于氮素缺乏降低微藻对氮的同化作用,引起藻细胞内部小分子前体物和还原力积累,更利于微藻细胞合成油脂。ANAND等[9]也指出,氮素限制会抑制蛋白质等物质的合成,驱使藻细胞趋向更多的油脂积累。
不同C/N水体中微藻油脂产率对比情况如图5(b)所示。在无硫条件下,油脂产率随着C/N增大先下降后上升,在C/N为60时达到最大,为3.35 mg·(L·d)−1。而在含硫条件下,C/N为7.5、15和30的实验组油脂产率均高于无硫条件,且随着C/N增大产率降低,油脂产率在C/N为7.5时达到最大值,为5.04 mg·(L·d)−1,较无硫条件提升了50.51%。其原因在于硫限制虽然有效提升了油脂含量,但同时加剧了生长和脂质合成的矛盾,外源硫加入后刺激了藻细胞生长,释放了微藻生长潜力,以此来弥补油脂含量降低带来的损失,从而提高了油脂产率;且随着C/N的降低,藻细胞利用营养物质促进生长的效率更高,增殖速率更快,从而能进一步弥补损失。黄怡等[28]通过研究发现,高硫条件更利于提升油脂产率,而本实验结果表明,高硫条件提升油脂产率不仅受硫浓度影响,还与培养体系的C/N息息相关。当C/N较高时,外源硫加入未能有效提升油脂产率,而随着C/N的降低,油脂产率才逐渐升高。因此,在进行微藻精细化培养时,既要关注硫浓度,也应综合考虑不同C/N的影响。
表1为不同C/N下无硫、含硫条件对斜生栅藻脂肪酸组成及相对含量的影响情况。由表1可知,十六烷酸(C16:0)、十八烷酸(C18:0)、十八碳烯酸(C18:1)、十八碳二烯酸(C18:2)、十八碳三烯酸(C18:3)占据脂肪酸的绝大多数。在无硫条件下,各实验组中C18:1相对含量较高,但均小于对照组,且随C/N增大先下降后上升,在C/N为60时最大,为47.11%。对含硫条件而言,C/N为7.5、15、30、60的组别培养5 d后C16—C18的脂肪酸对总脂肪酸的占比分别为97.11%、97.67%、97.63%和97.23%。单不饱和脂肪酸含量随C/N增大先升高后降低,在C/N为15时达到最大,为48.45%。有研究表明,生物柴油的理化性质与脂肪酸组分密切相关[29],C16—C18的脂肪酸更适宜生产生物柴油[30],并且高品位的生物柴油应尽量多地含有单不饱和脂肪酸且尽量减少饱和脂肪酸和多不饱和脂肪酸含量[31],而单不饱和脂肪酸更有利于提升生物柴油的低温流动性、氧化安定性等性能[32]。因此,C/N为15时得到的油脂产物更利于生产高品质柴油。
-
(1)外源硫加入有利于释放微藻生长潜力,且C/N较低时硫促进生长的效果更好。培养到第5天,C/N为15的达到最大,藻密度为1.23×107 cells·mL−1,较无硫条件提升了90%。
(2)外源硫加入可有效提升微藻对碳、氮源的利用效率。C/N为7.5时微藻对有机物的利用效率最高,为80.33%,较无硫条件提升了63%;C/N为7.5时,水体
NH+4 -N的去除率为73.6%,较无硫条件提高了149%,其余各组NH+4 -N均能完全去除。(3)外源硫加入有利于提高油脂产率但不利于油脂积累。油脂产率随着C/N升高而降低且在C/N为7.5时达到最大,为5.04 mg·(L·d)−1,较无硫条件提升了50.51%;低C/N条件下油脂含量更高,C/N为7.5时油脂含量为15.4%,较无硫条件下降了33.3%;C/N为15时单不饱和脂肪酸含量最高,更适宜生产高品质生物柴油。
不同C/N下硫对斜生栅藻生长与油脂积累的调控
Regulation of sulfur on growth and lipid accumulation of Scenedesmus obliquus under different C/N ratio
-
摘要: 为探究不同C/N污水下下硫对微藻生长、水体净化与油脂积累的调控作用,以斜生栅藻为研究对象,通过改变
NH+4 -N浓度配制了4种不同C/N的实验用水,对比研究了斜生栅藻在无硫和含硫条件下经5 d培养后的生长、碳氮利用与油脂合成情况。结果表明,外源硫添加可有效促进微藻的生长,当C/N为15时,藻细胞密度达到最大,为1.23×107 cells·mL−1,较无硫条件提高了90%;同时,外源硫也有助于提升藻细胞对碳氮的利用效率,微藻对有机物的利用效率随着C/N的降低而升高,并在C/N为7.5时最大,为80.33%,较无硫条件提升了63%;当C/N为7.5时NH+4 -N去除率为73.6%,较无硫条件提升了149%,其余实验组别NH+4 -N去除率均达100%;此外,在含硫条件下,油脂产率和油脂含量均随着C/N升高而降低,均在C/N为7.5时达到最大,油脂产率为5.04 mg·(L·d)−1,相较于无硫条件提升了50.51%,油脂含量为15.4%,较无硫条件下降了33.3%,表明硫加入可有效提升油脂产率但不利于油脂积累,在低C/N条件下促进作用更强。综合来看,当C/N在7.5—15时,外源硫加入取得的综合效益最佳。通过探究微藻生长、碳氮利用、油脂积累的适宜条件,可为微藻的精细化培养提供参考。Abstract: To explore the regulating effect of sulfur on the growth and lipid accumulation of Scenedesmus obliquus under different C/N ratio conditions, taked Scenedesmus obliquus as the research object, set 4 kinds of experimental water with different C/N ratios by changing the concentration of ammonia nitrogen, and comparatively studied the growth and lipid synthesis of microalgae after 5 days of culture under both sulfur-free and sulfur-containing conditions. The results showed that the addition of exogenous sulfur can effectively promote the growth of microalgae. When C/N ratio was 15, the density of microalgae reached the maximum, which was 1.23×107 cells·mL−1, it was 90% higher than the sulfur-free condition. Additional sulfur also helped to improve the carbon and nitrogen utilization efficiency of microalgae. The utilization efficiency of organic matter by microalgae increased with the decrease of carbon to nitrogen ratio, when C/N was 7.5, it reached 80.33%, which was 63% higher than that of sulfur-free conditions, while the ammonia nitrogen removal efficiency was 73.6%, which was 149% higher than the sulfur-free condition, and the removal efficiency of the remaining experimental groups reached 100%. In addition, under the sulfur-containing condition, the lipid yield and lipid content both decreased with the increase of carbon to nitrogen ratio. When C/N ratio was 7.5, the lipid yield was highest, which was 5.04 mg·(L·d)−1, it was 50.51% higher than that of sulfur-free conditions. When the C/N ratio was 7.5, the lipid content was 15.4%, which was 33.3% lower than the sulfur-free condition, indicating that sulfur addition can effectively increase the lipid yield but was not conducive to the accumulation of lipid, and exogenous sulfur had a stronger promoting effect under low carbon to nitrogen ratio conditions. In summary, when the C/N ratio was between 7.5 and 15, the overall benefits were relatively best. By exploring the appropriate conditions for microalgae growth, carbon and nitrogen utilization, and lipid accumulation,This research can provide references for the refined cultivation of microalgae.-
Key words:
- Scenedesmus obliquus /
- ammonia nitrogen /
- sulfur /
- growth and metabolism /
- lipid accumulation
-
铜绿微囊藻是产生藻华的主要藻种之一,高藻水会给自来水厂水质处理带来困难,藻细胞在新陈代谢过程中会释放有机物至水体中,其中包括嗅味物质,并在消毒工艺过程中产生消毒副产物[1-2]。目前,常用的除藻方法有生物去除法、化学去除法和物理去除法3种[3]。物理法包括超滤膜法、气浮法和活性炭吸附法。超滤膜法对水中藻细胞和胞外聚合物(extracellular organic matters,EOM)有良好的去除效果,但是藻及藻源有机物极易堵塞膜孔,造成严重的膜污染。气浮法只适合高藻低浊度的水处理,同时水厂须新建的构筑物及新增加的水泵增大了能耗,使水厂处理成本增加。生物法处理采用能溶解藻的细菌破坏藻细胞壁,但藻破裂死亡后会将细胞内有机物的释放,消耗水体中溶解氧,增加水体中总有机碳的浓度,破坏水生生物的生态平衡[4]。
与上述技术相比,化学法特别是混凝沉淀法依旧是最好的除藻方法之一,铝系混凝剂因其经济高效成为目前水厂使用最广泛的混凝剂。CHRISTOPHER等[5]通过研究发现,混凝前后钾离子浓度没有明显变化,证明铝系混凝剂没有杀死藻细胞,没有破坏藻细胞细胞壁结构。通过Ferron逐级络合比色法可将铝系絮凝剂的形态分成3种:单体形态Ala、中等聚和形态Alb、胶体及固体形态Alc[6]。YAN等[7]认为这3种形态去除有机物(nature organic matter, NOM)的机理分别为络合、电中和、吸附。分子式为[AlO4Al12(OH)24(H2O)12]7+的Al13带有很高的正电荷及很强的架桥能力,是Alb的主要活性成分。WANG等[8]和ISHIFUJI等[9]发现,低浓度的EOM能促进混凝,高浓度的EOM却抑制混凝过程。虽然很多学者研究了不同混凝剂对藻细胞的去除效果,但是混凝除藻过程中胞外聚合物对不同混凝剂混凝效果的影响研究并不充分,对于哪种铝系混凝剂去除藻的EOM效果最优及作用机理也没有达成共识[2-4]。
混凝剂的选取是除藻的关键因素之一,AlCl3为传统铝盐絮凝剂,其特点是制备工艺简单。PACl的特点是除浊效果好、成本适中、污泥产量少。本研究对比了2种最常见的铝系混凝剂对藻细胞的去除效果,分析了溶出有机物和形成絮体的特征,讨论了胞外有机物在混凝过程中和铝形态的相互作用,研究了EOM对混凝除藻的影响,为水厂优化混凝处理富藻水提供参考。
1. 材料与方法
1.1 实验试剂与仪器
实验试剂均为国药集团生产优级纯试剂,包括NaOH、AlCl3·6H2O、NaHCO3以及BG11藻培养基。该培养基包括NaNO3、K2HPO4、MgSO4·7H2O、CaCl2·2H2O、EDTANa2、Na2CO3、柠檬酸、柠檬酸铁铵、H3BO3、MnCl2·4H2O、ZnSO4·7H2O、Na2MoO4、CuSO4·5H2O、Co(NO3)2·6H2O。实验仪器包括pH计(FE, METTLER TOLEDO, Switzerland),浊度仪(2100N, HACH, USA),紫外/可见光分光光度计(UH5300, HITACHI, Japan),马尔文激光粒度分析仪(3000, MALVERN, UK),梅宇六联搅拌仪(MY3000-6F, MEIYU, China),高效排阻测定仪(WATERS1525液相色谱仪)连接东曹凝胶色谱柱(Shoko Corporation, Japan)。
1.2 藻种培养及水样配置
铜绿微囊藻(蓝藻)购于中国科学院武汉水生生物研究所,藻种接种至120 ℃灭菌15 min的BG11培养基中,并放入人工培养箱,人工培养箱的设置参数为:温度25 ℃,光照强度2 000 lx,光暗比12 h∶12 h[10]。
藻细胞的密度与悬浮藻液在680 nm处的吸光度具有良好的线性关系,因此,本研究以含藻水在680 nm的吸光度值作为藻细胞密度的度量标准。在实验中,将处于初始稳定期的铜绿微囊藻溶液用去离子水稀释至680 nm处,吸光度值为0.3,加入5 mmol·L−1 NaNO3和4 mmol·L−1 NaHCO3以提供离子强度和碱度。
1.3 实验和分析方法
本实验采用AlCl3和PACl 2种混凝剂,PACl采用慢速滴碱法[11]制备。采用Al-Ferron逐时络合比色法测定铝形态:反应时间<1 min的形态为单体态Ala,反应时间为1~120 min的形态为Alb,不反应的形态为Alc。实验所用混凝剂的Ferron表征结果见表1。可以看出,AlCl3主要以Ala为主(92.53%),PACl以Alb为主(79.18%)。
表 1 2种混凝剂铝形态的分布Table 1. Al species distribution of two coagulants% 混凝剂种类 Ala Alb Alc AlCl3 92.53 3.92 3.55 PACl 11.47 76.18 12.35 使用六联搅拌机进行实验,加入混凝剂后,进行0.5 min的250 r·min−1快速搅拌,促进混凝剂的均匀分散,40 r·min−1慢速搅拌10 min,促进絮体形成,沉淀30 min后,取液面下2 cm的样品进行OD680及浊度检测。
三维荧光主要用于描绘水中有机物的特征。本实验使用F-7000三维荧光分析(Hitachi,Japan),采用氘灯,设置发射波长(Em)为220~550 nm,设置激发波长(Ex)为200~400 nm。用高效体积排阻色谱仪(HPSEC)测定混凝前后溶液中有机物的表观分子质量。HPSEC应用的是Waters的液相分析系统,主要包括Waters 2487双波长检测器和Waters1525双泵系统。选用凝胶色谱柱(Shoko Corporation, Japan)对样品进行分离。配置含有0.02 mol·L−1磷酸盐缓冲液及 0.01 mol·L−1 NaCl的流动相,流动相用0.22 µm滤膜过滤,在使用前,超声15 min,排出流动相中的微气泡。样品测定前,用0.22 µm滤膜过滤。测试时,流动相流速为 0.8 mL·min−1,进样体积为200 μL,在紫外波长254 nm处检测样品。
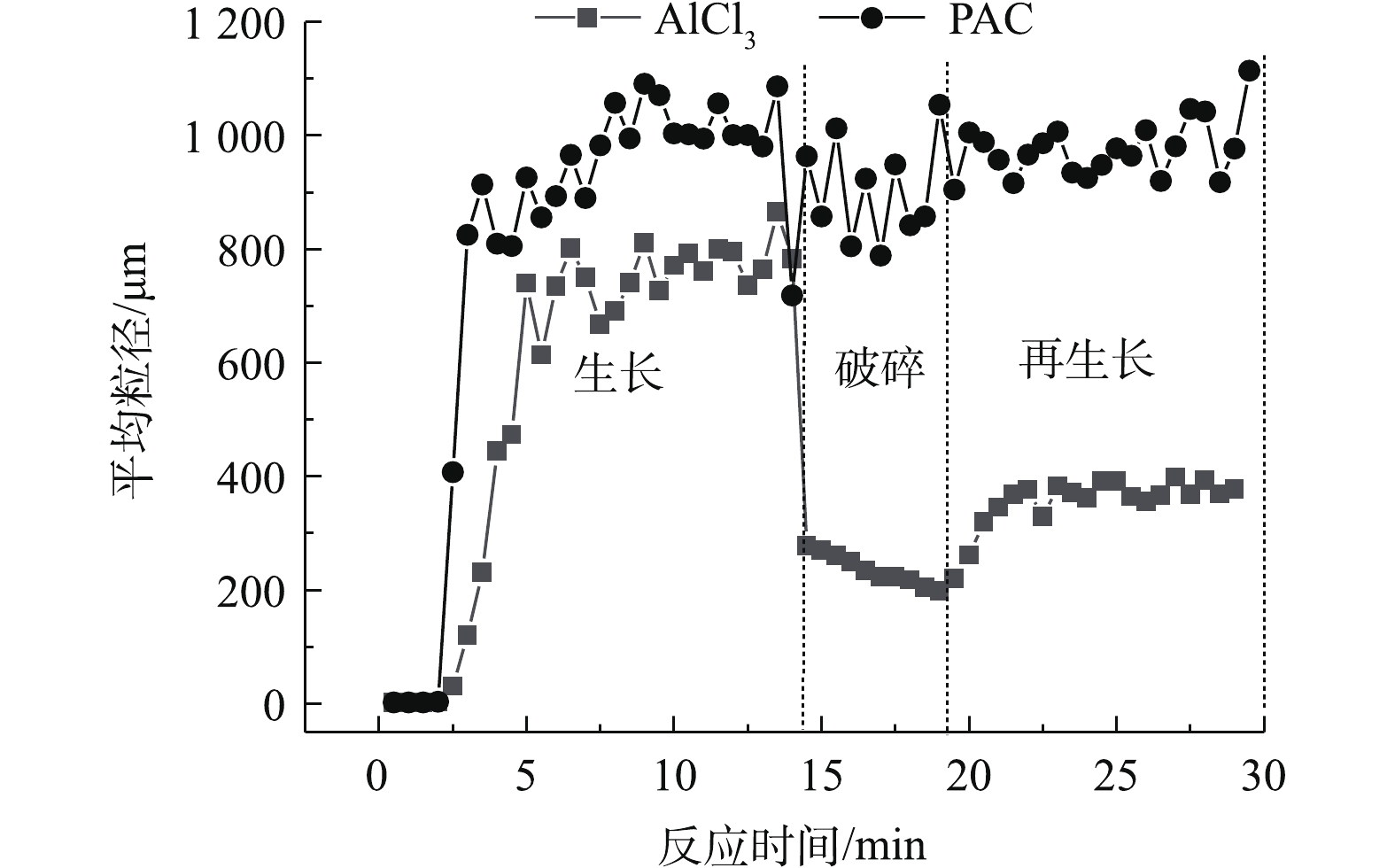
采用马尔文激光粒度仪对混凝过程中形成的絮体进行连续监测[12]。投加混凝剂后,用蠕动泵将溶液引入样品池,以光散色确定絮体生长的平均粒径[13](用D50表示)。投加混凝剂慢速搅拌约10 min后,以 200 r·min−1快速搅拌5 min,模拟絮体与水厂构筑物的碰撞过程。为了描述絮体的强度及再生长能力,可使用强度因子和恢复因子2个指标,絮凝过程中的强度因子(Rs)和恢复因子(Rf)计算方法[14]见式(1)和式(2)。
Rs=d2d1×100 (1) Rf=d3−d2d1−d2×100 (2) 式中:d1为慢速搅拌时的絮体平均粒径,μm;d2为絮体破碎时的平均粒径,μm;d3为再重组絮凝的平均粒径。
将混凝后絮体进行24 h冷冻干燥,将少量絮体粘贴至样品盘导电胶表面上,然后对样品进行喷金,采用日立SU8020扫描电子显微镜对其表面形貌进行分析。
2. 结果与讨论
2.1 不同混凝剂的除藻效果
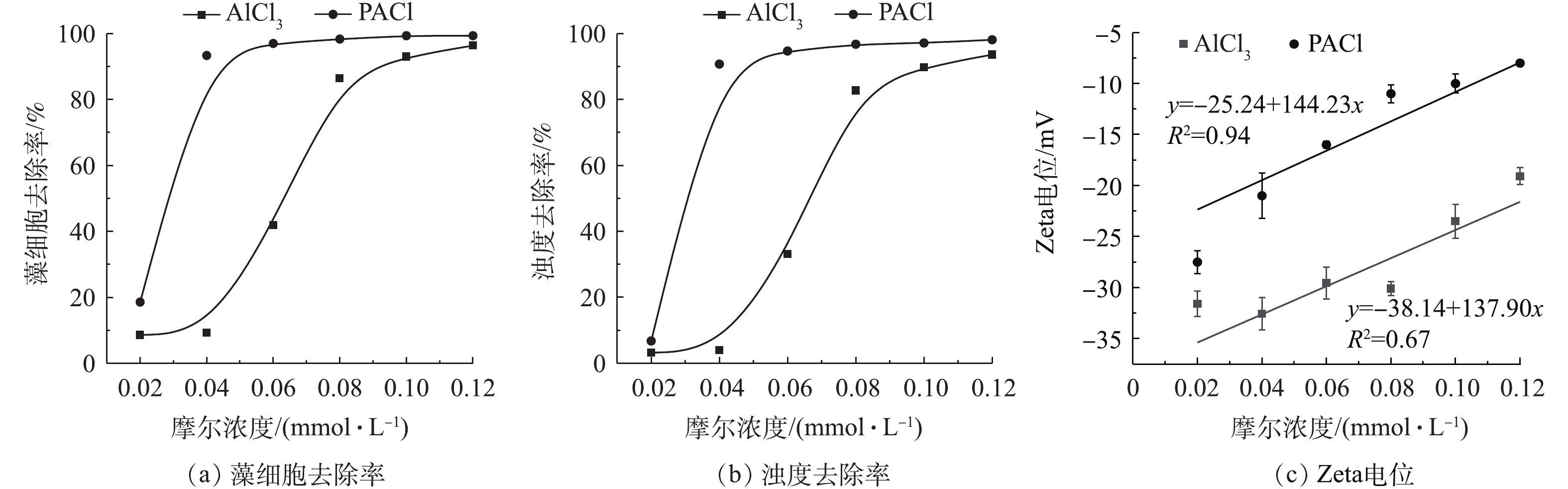
投加不同摩尔浓度混凝剂,考察单体铝和聚合铝2种混凝剂对藻细胞以及浊度的去除率。由图1可以看出,对于这2种铝盐混凝剂,浊度去除率和藻细胞的去除率都随着混凝剂摩尔浓度的增加而增加,但是相同投加量下PAC对藻的去除效果优于AlCl3。在摩尔浓度为0.04 mmol·L−1时,投加PACl对藻细胞的去除率能达到93%,而投加AlCl3的藻细胞去除率只有9%;投加PACl和AlCl3对浊度去除率分别为91%和4%。这是因为PACl中存在大量高电量且稳定的多核预水解产物(Alb),中和水中带负电的dEOM及藻细胞。含有较低正电荷的AlCl3只有不断增大投加量,才达到与高聚合态混凝剂 PACl相同的混凝效果,因此,AlCl3在摩尔浓度为0.08 mmol·L−1时才能达到85%的藻细胞去除率[15]。由图1(c)可知,PACl和AlCl3的Zeta电位均随着投加量的升高而增大,这是因为投加带正电的混凝剂压缩了胶体的双电层。将Zeta电位和混凝剂投加量线性拟合,PAC的R2为0.94,可以看出,Zeta电位随PAC投加量成正比增加,因此,PAC中的Alb电中和藻表面负电荷是混凝除藻的主要机理。而AlCl3的R2为0.67,说明在较低混凝投加量下(0.02、0.04、0.06 mmoL·L−1)为电中和,随着投加量的增加,氯化铝的架桥网捕作用得以有效发挥[16-17]。
2.2 pH对混凝的影响
pH是水化学的一个很重要的指标,为了考察pH对混凝的影响,调节水样的pH为6.0、6.5、7、7.5、8、8.5。2种混凝剂的投加量为0.08 mmol·L−1时,藻细胞去除率为80%以上。由图2可知,在弱酸性及中性条件下,AlCl3和PACl都有着较高的藻细胞去除率。在pH为6时,AlCl3对藻细胞的去除率为95%,PACl对藻细胞的去除率甚至达到了98%,这与本研究的结果一致。CLASEN等[18]研究表明,铝系混凝剂的最佳pH为6~6.5。随着pH的升高,2种混凝剂对藻细胞的去除率均降低,但是AlCl3下降更为显著。pH从6.5上升至7时,AlCl3对藻细胞的去除率从95%下降至68%;当pH为7时,水溶液中主要存在的是单体态的铝,此时对藻细胞的去除率低于酸性条件下的去除率。对于PACl,pH从6上升至7.5时,藻细胞去除率一直保持在95%左右;pH上升至8.5,藻细胞去除率降至85%。这是因为PACl中预水解生成的Alb为Al13聚体,化学性质较为稳定,受pH的影响较小[19]。如图2所示,在混凝时,相同pH下PAC的Zeta电位高于AlCl3,这说明AlCl3体系更稳定,絮体沉降性低于PAC。
2.3 混凝后系统中的有机物分析
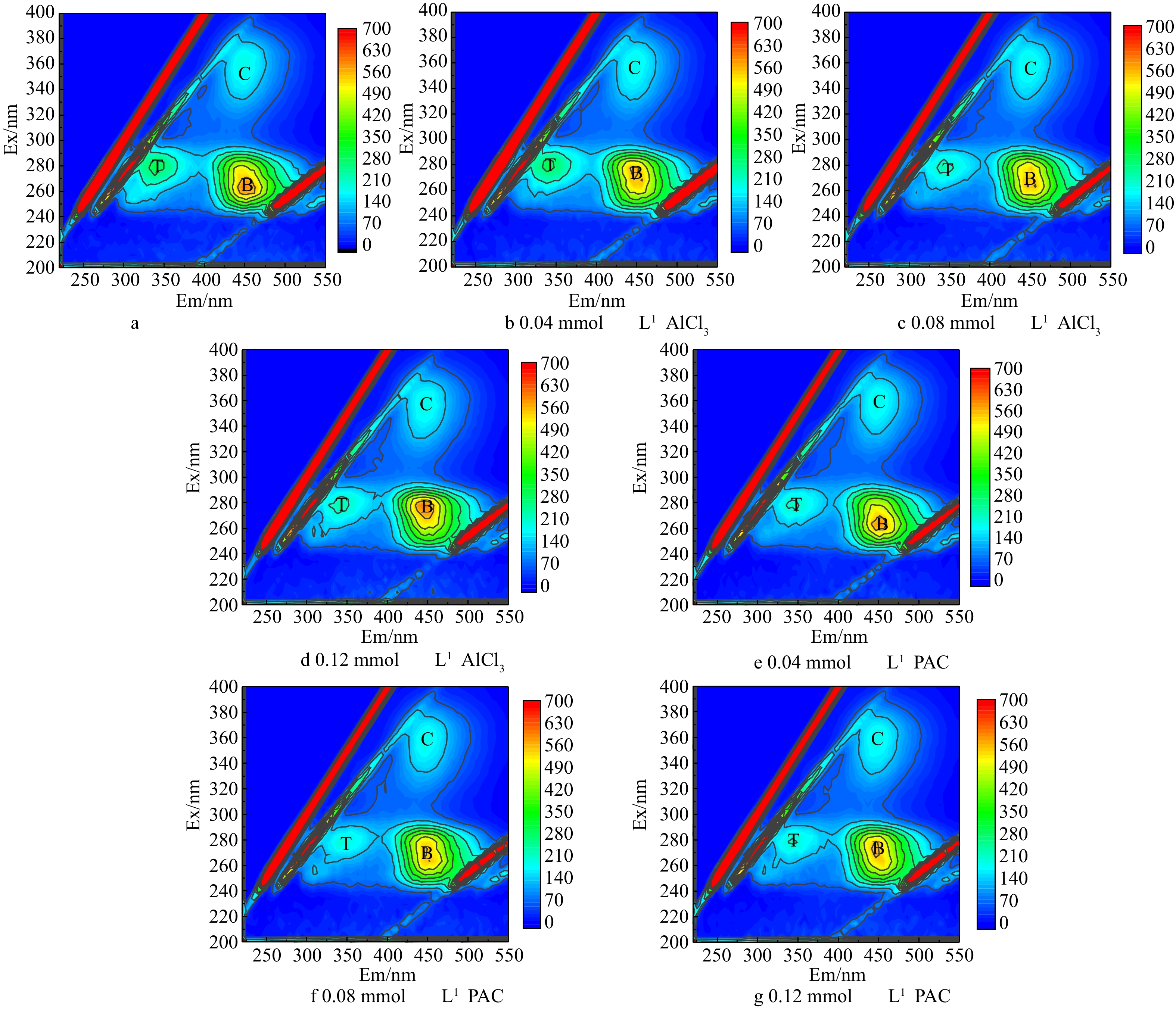
为研究混凝过程中胞外有机物的去除情况,取混凝剂摩尔浓度为0.04、0.08、0.12 mmol·L−1的沉后水,过0.45 μm滤膜后进行EEM测试,结果见图3。可以看出,藻混凝前后都有T、B和C 3个峰,分别代表微生物代谢产物、富里酸和腐殖酸[20]。有研究[8]表明,芳香类蛋白质的降解会导致发射及激发波长的蓝移。而图3中的2种混凝剂荧光图的特征峰位置均没有发生变化,只是强度发生了变化,这说明AlCl3及PACl在混凝过程中仅导致了蛋白质的聚集沉淀。
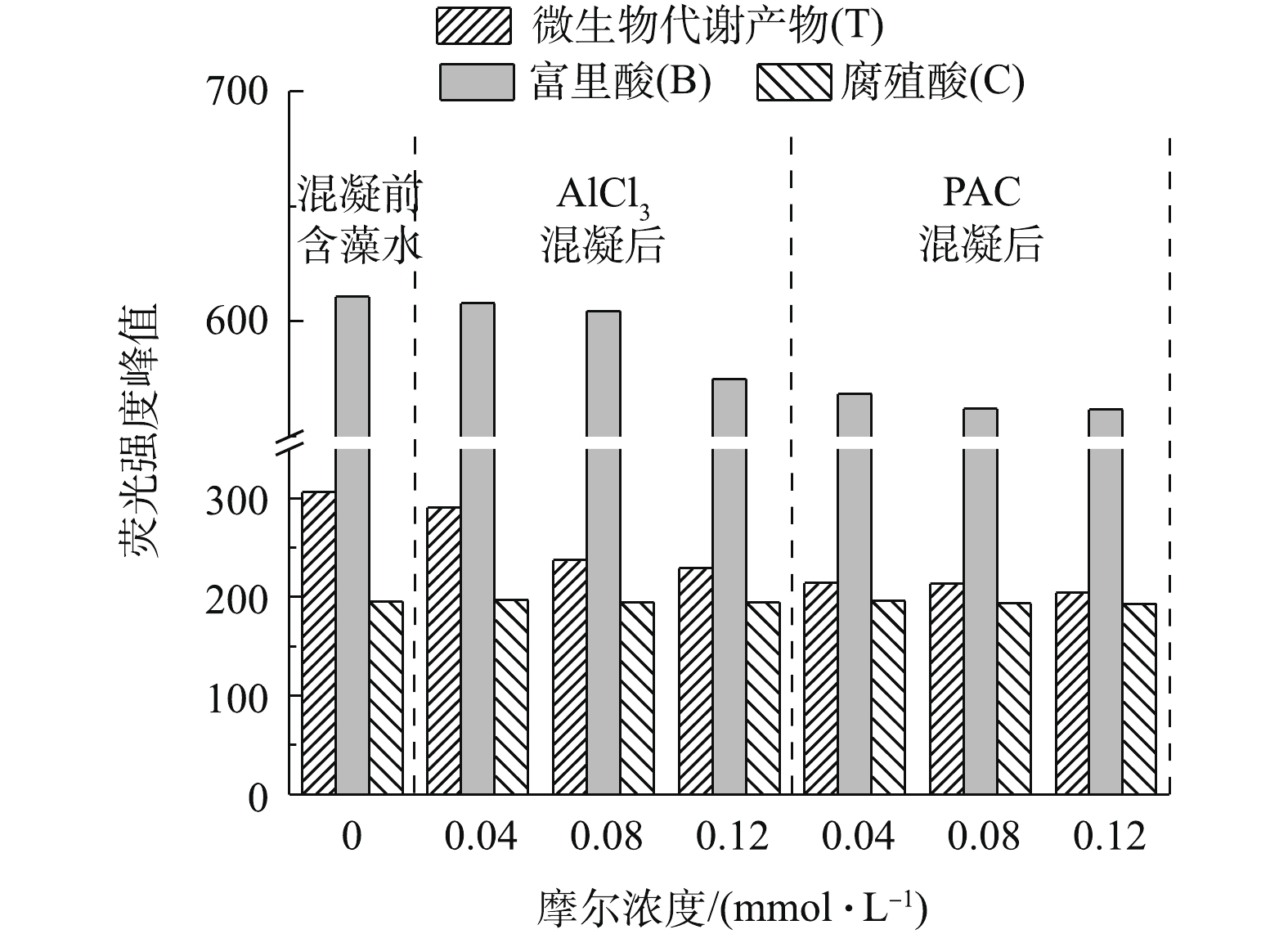
为了进一步分析三维荧光图中各组分随摩尔浓度的变化,选出T、B和C 3个峰强最大值(见图4)。首先,AlCl3和PACl在本实验的摩尔浓度下对腐殖酸基本无去除效果。与原水对比,0.04 mmol·L−1 AlCl3摩尔浓度下的T、B和C 3个峰值未发生明显变化,这说明Ala在此摩尔浓度下对EOM的3种组分几乎无去除。当AlCl3摩尔浓度上升到0.08 mmol·L−1时,腐殖酸没有去除效果,微生物代谢产物的荧光强度从306降低到237,去除率为22%。当AlCl3的摩尔浓度上升至0.12 mmol·L−1时,富里酸开始去除,峰强从611下降至575,去除率为5.8%。当PACl为0.04、0.08、0.12 mmol·L−1时,3个摩尔浓度下3种胞外有机物的去除率接近,当PACl浓度为0.08 mmol·L−1时,对微生物代谢产物的去除率为30.3%左右,PACl对微生物代谢产物的去除率比AlCl3高7.7%。
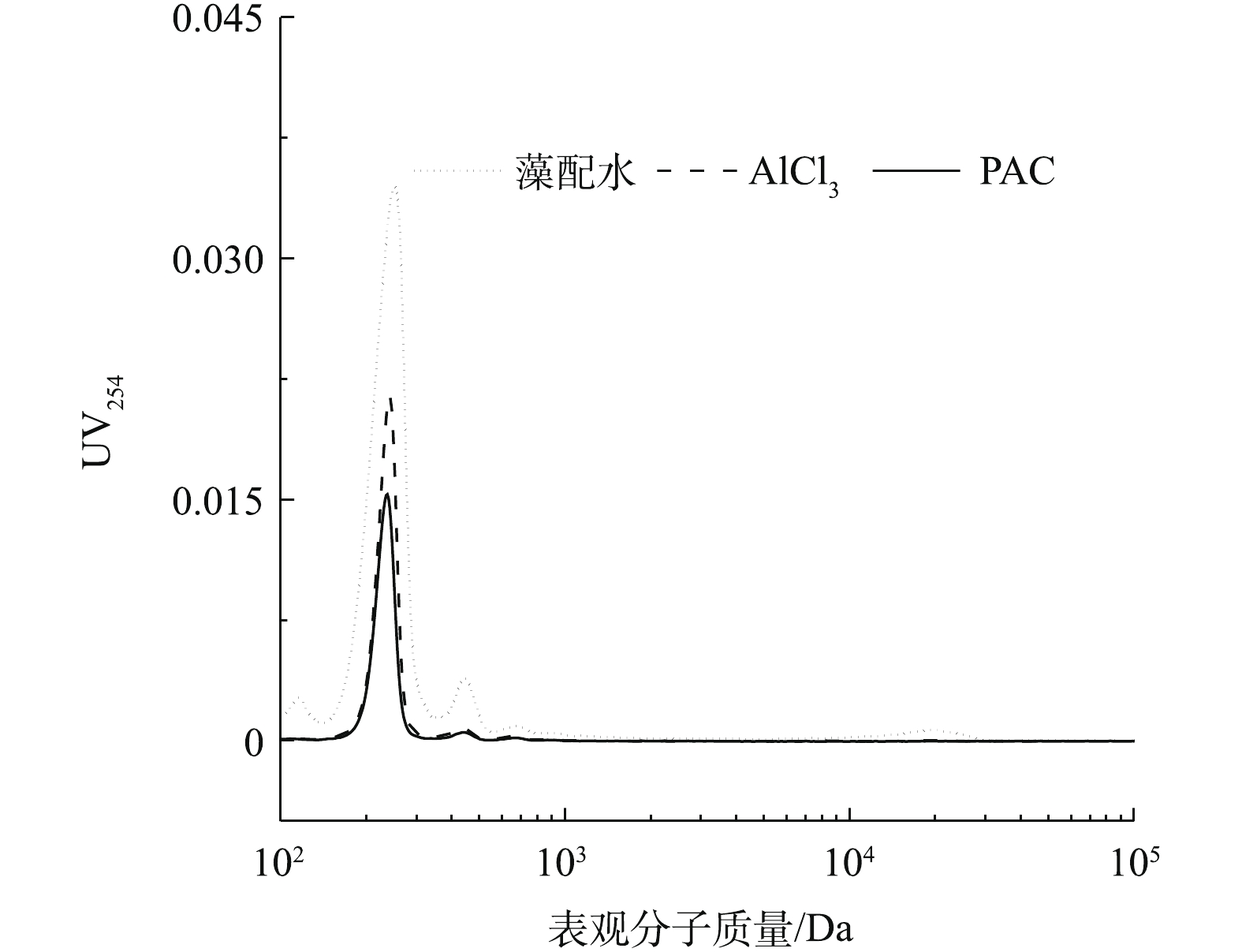
为进一步分析2种铝形态混凝对溶液体系中藻胞外有机物的影响,采用高效液相排阻色谱分析了藻配水、PACl和AlCl3摩尔浓度为0.08 mmol·L−1沉后水有机物的表观分子质量分布情况,结果见图5。可以看出,在表观分子质量为200~300 Da处有1个强峰,表观分子质量为400~500 Da处有1个次强峰,在分子质量为20 000 Da处有1个小峰。2种混凝剂混凝静置后,表观分子质量为400~500 Da和20 000 Da这2个峰几乎消失,这说明AlCl3和PACl都能沉降表观分子质量为400~500 Da和20 000 Da的有机物,这符合马敏等[21]的研究结果,表观分子质量较大或芳香度较高的胞外聚合物在铝盐混凝中可被优先去除。结合三维荧光分析可知,这2个峰可能为憎水性的蛋白质或多糖。但是对于200~300 Da处的最强峰,PACl对其的去除率明显高于AlCl3,这和三维荧光得出的结论相符。结合图1可以看出,在摩尔浓度为0.08 mmol·L−1时,PACl比AlCl3多去除了表观分子质量为200~300 Da的胞外有机物,造成PACl对藻细胞的去除率比AlCl3的高10%。
2.4 絮体特征
当摩尔浓度为0.08 mmol·L−1时,用马尔文激光粒度仪监测投加不同混凝剂生成絮体的特征,结果见图6。可以看出,待絮体粒径达到稳定时,投加AlCl3的藻配水中絮体的平均粒径可增加至800 μm,投加PACl的藻配水中絮体的平均粒径可增加至1 000 μm。但到了破碎期,2种混凝剂投加下形成的絮体表现出不同的强度。在剪切力的作用下,投加AlCl3生成的絮体迅速破裂至200 μm,而投加PACl形成的絮体粒径能保持在9 000 μm左右。这从表2中的强度因子可以证明,强度因子越大,絮体结构越紧密结实,PACl的强度因子86.28%远大于AlCl3的强度因子31.82%。分形维数[22-24]是用来确定絮体形态及强度的一个常用指标,分型维数为3时表示该颗粒为球形,PACl絮体的分形维数为2.17,大于AlCl3絮体的分形维数1.76,这也能证明PACl产生的絮体更密实。在絮体再生长期,投加PACl的絮体经过碰撞再链接,又能生长至1 000 μm,而投加AlCl3的絮体再生长后只能达到400 μm,为生长期的一半。这也可从表2得到验证,PACl的恢复因子49.52%大于AlCl3的29.6%。
表 2 混凝后絮体的强度因子、恢复因子与分形维数Table 2. Strength factor, recovery factor and fractal dimensions of flocs formed after coagulation混凝剂 强度因子/% 恢复因子/% 分形维数 AlCl3 31.82 29.60 1.76 PACl 86.28 49.52 2.17 为了直观地观察絮体的形貌,采用扫描电子显微镜观察摩尔浓度为0.08 mmol·L−1 PACl和AlCl3冷冻干燥后的絮体,见图7。
由图7(a)可以看出,绝大多数藻细胞相互紧贴,主要是由于Alb中和了藻细胞表面的负电荷,这些抱团的藻细胞聚集体再通过片状Al(OH)3卷扫网捕形成更大的絮体。由图7(b)可以看出,藻细胞和片状Al(OH)3近似均匀混合,因此可以确定主要混凝机理为卷扫网捕。可以看出,PACl絮体的密集性高于AlCl3的密集性,这与PACl絮体分形维数大于AlCl3的结论相吻合。
3. 结论
1)在常规混凝条件下,PACl比AlCl3具有更好的藻细胞和藻源有机物去除率。当投加量为0.08 mmol·L−1时,对藻的去除率分别为96%和82%。
2)当pH为6~8时,PACl均可保持95%以上的藻细胞去除率,AlCl3只能在pH为6~6.5狭小的范围内保持相同的去除率。
3)三维荧光结果表明,最佳投加量为0.08 mmol·L−1 时,PAC可去除30.3%的微生物代谢产物,AlCl3去除22.6%的微生物代谢产物。PACl中含有的Alb对提高微生物代谢产物和富里酸的去除发挥了重要作用。
4)在摩尔浓度为0.08 mmol·L−1时,PACl比AlCl3多去除了分子量为200~300 Da的胞外有机物。PACl的强度因子和恢复因子均大于AlCl3,且絮体的分形维数2.17大于AlCl3的1.76,因此,PACl形成絮体的密实程度大于AlCl3的絮体。
-
表 1 不同C/N下无硫、含硫条件对斜生栅藻脂肪酸组成及相对含量的影响(%)
Table 1. Effects of sulfur-free and sulfur-containing conditions on the composition and relative content of fatty acids in Scenedesmus obliquus under different C/N ratio
组别Groups C/N C16:0 C16:1 C18:0 C18:1 C18:2 C18:3 Others 无硫组Sulfur-free group 0 30.40 0.15 5.29 50.82 4.79 3.70 4.85 7.5 32.06 0.34 2.56 41.92 8.44 12.58 2.10 15 38.16 0.22 3.08 39.21 7.18 9.33 2.82 30 29.38 0.20 2.84 45.62 7.93 11.54 2.49 60 29.14 0.18 3.49 47.11 8.24 9.21 2.63 含硫组Sulfur-containing group 0 25.52 0.15 3.99 55.72 5.61 6.02 2.99 7.5 24.70 0.53 0.66 18.48 13.31 39.43 2.89 15 26.78 0.60 3.19 47.14 8.16 11.80 2.33 30 26.15 0.51 2.57 43.06 10.02 15.32 2.37 60 22.86 0.61 0.90 23.90 15.58 33.38 2.77 -
[1] MICHAL B, GRAHAM J E, ANNA K, et al. Transcriptome analysis of the sulfate deficiency response in the marine microalgae Emiliania huxleyi [J]. New Phytologist, 2013, 199(3): 650-662. doi: 10.1111/nph.12303 [2] ABOMOHRA A E F, ELADEL H, EL-ESAWI M, et al. Effect of lipid-free microalgal biomass and waste glycerol on growth and lipid production of Scenedesmus obliquus: Innovative waste recycling for extraordinary lipid production [J]. Bioresource Technology, 2018, 249: 992-999. doi: 10.1016/j.biortech.2017.10.102 [3] YIN Z H, ZHU L D, LI S X, et al. A comprehensive review on cultivation and harvesting of microalgae for biodiesel production: Environmental pollution control and future directions [J]. Bioresource Technology, 2020, 301: 122804. doi: 10.1016/j.biortech.2020.122804 [4] 谢雅清, 郁彬琦, 靳翠丽, 等. 微藻规模化培养与生物能源开发 [J]. 现代化工, 2019, 39(8): 27-32. XIE Y Q, YU B Q, JIN C L, et al. Large-scale cultivation of microalgae for bio-energy utilization [J]. Modern Chemical Industry, 2019, 39(8): 27-32(in Chinese).
[5] RAN W Y, WANG H T, LIU Y H, et al. Storage of starch and lipids in microalgae: Biosynthesis and manipulation by nutrients [J]. Bioresource Technology, 2019, 291: 121894. doi: 10.1016/j.biortech.2019.121894 [6] QIU R H, GAO S, LOPEZ P A, et al. Effects of pH on cell growth, lipid production and CO2 addition of microalgae Chlorella sorokiniana [J]. Algal Research, 2017, 28: 192-199. doi: 10.1016/j.algal.2017.11.004 [7] GAO F, YANG H L, LI C, et al. Effect of organic carbon to nitrogen ratio in wastewater on growth, nutrient uptake and lipid accumulation of a mixotrophic microalgae Chlorella sp. [J]. Bioresource Technology, 2019, 282: 118-124. doi: 10.1016/j.biortech.2019.03.011 [8] BASHIR K M I, MANSOOR S, KIM N R, et al. Effect of organic carbon sources and environmental factors on cell growth and lipid content of Pavlova lutheri [J]. Annals of Microbiology, 2019, 69(4): 353-368. doi: 10.1007/s13213-018-1423-2 [9] ANAND J, ARUMUGAM M. Enhanced lipid accumulation and biomass yield of Scenedesmus quadricauda under nitrogen starved condition [J]. Bioresource Technology, 2015, 188: 190-194. doi: 10.1016/j.biortech.2014.12.097 [10] ZHENG H L, LIU M Z, LU Q, et al. Balancing carbon/nitrogen ratio to improve nutrients removal and algal biomass production in piggery and brewery wastewaters [J]. Bioresource Technology, 2018, 249: 479-486. doi: 10.1016/j.biortech.2017.10.057 [11] LV J, GUO J Y, FENG J, et al. Effect of sulfate ions on growth and pollutants removal of self-flocculating microalga Chlorococcum sp. GD in synthetic municipal wastewater [J]. Bioresource Technology, 2017, 234: 289-296. doi: 10.1016/j.biortech.2017.03.061 [12] 王倩雅, 张莹, 李爱芬, 等. 硫素营养水平对产油尖状栅藻光合生理及生化组成的影响 [J]. 水生生物学报, 2017, 41(4): 904-913. doi: 10.7541/2017.113 WANG Q Y, ZHANG Y, LI A F, et al. Effects of sulfur concentration on the photosynthetic physiology and biochemical composition of Scenedesmus acuminatus [J]. Acta Hydrobiologica Sinica, 2017, 41(4): 904-913(in Chinese). doi: 10.7541/2017.113
[13] ZHANG T Y, WU Y H, ZHU S F, et al. Isolation and heterotrophic cultivation of mixotrophic microalgae strains for domestic wastewater treatment and lipid production under dark condition [J]. Bioresource Technology, 2013, 149: 586-589. doi: 10.1016/j.biortech.2013.09.106 [14] 余亚岑, 钱领, 刘广发, 等. 碳源对巴氏杜氏藻生长及其脂类含量的影响 [J]. 厦门大学学报(自然科学版), 2015, 54(6): 812-818. YU Y C, QIAN L, LIU G F, et al. The influence of carbon resources on the growth and lipid content of Dunaliella bardawil [J]. Journal of Xiamen University (Natural Science), 2015, 54(6): 812-818(in Chinese).
[15] 刘祥, 杨美娟, 散而复, 等. 不同营养模式下固定化斜生栅藻和普通小球藻氨氮去除能力对比分析 [J]. 环境科学研究, 2020, 33(8): 1869-1876. LIU X, YANG M J, SAN E F, et al. Comparative analysis of ammonia nitrogen removal capacity of immobilized Scenedesmus obliquus and Chlorella vulgaris under different trophic modes [J]. Research of Environmental Sciences, 2020, 33(8): 1869-1876(in Chinese).
[16] SHEN Y, GAO J Q, LI L S. Municipal wastewater treatment via co-immobilized microalgal-bacterial symbiosis: Microorganism growth and nutrients removal [J]. Bioresource Technology, 2017, 243: 905-913. doi: 10.1016/j.biortech.2017.07.041 [17] MA C, WEN H Q, XING D F, et al. Molasses wastewater treatment and lipid production at low temperature conditions by a microalgal mutant Scenedesmus sp. Z-4 [J]. Biotechnology for Biofuels, 2017, 10: 111. doi: 10.1186/s13068-017-0797-x [18] ZHANG Y, HUANG Z Z, ZHENG H L, et al. Growth, biochemical composition and photosynthetic performance of Scenedesmus acuminatus under different initial sulfur supplies [J]. Algal Research, 2020, 45: 101728. doi: 10.1016/j.algal.2019.101728 [19] CHENG J, WANG Z Y, LU H X, et al. Hydrogen sulfide improves lipid accumulation in Nannochloropsis oceanica through metabolic regulation of carbon allocation and energy supply [J]. ACS Sustainable Chemistry & Engineering, 2020, 8(6): 2481-2489. [20] 许海, 陈丹, 陈洁, 等. 氮磷形态与浓度对铜绿微囊藻和斜生栅藻生长的影响 [J]. 中国环境科学, 2019, 39(6): 2560-2567. doi: 10.3969/j.issn.1000-6923.2019.06.039 XU H, CHEN D, CHEN J, et al. Effects of nitrogen and phosphorus forms and concentrations on the growth of Microcystis aeruginosa and Scenedesmus obliquus [J]. China Environmental Science, 2019, 39(6): 2560-2567(in Chinese). doi: 10.3969/j.issn.1000-6923.2019.06.039
[21] 尚常花, 王忠铭, 袁振宏, 等. 氮限制对产油杜氏藻转录组的影响 [J]. 中国油料作物学报, 2016, 38(4): 524-528. doi: 10.7505/j.issn.1007-9084.2016.04.018 SHANG C H, WANG Z M, YUAN Z H, et al. Effect of nitrogen limitation on transcriptome of oleaginous Dunaliella parva [J]. Chinese Journal of Oil Crop Sciences, 2016, 38(4): 524-528(in Chinese). doi: 10.7505/j.issn.1007-9084.2016.04.018
[22] 周涛, 李正魁, 冯露露. 氨氮和硝氮在太湖水华自维持中的不同作用 [J]. 中国环境科学, 2013, 33(2): 305-311. doi: 10.3969/j.issn.1000-6923.2013.02.017 ZHOU T, LI Z K, FENG L L. The different roles of ammonium and nitrate in the bloom self-maintenance of Lake Taihu [J]. China Environmental Science, 2013, 33(2): 305-311(in Chinese). doi: 10.3969/j.issn.1000-6923.2013.02.017
[23] 王蒙, 李纯厚, 戴明, 等. C/N对牟氏角毛藻生长速率和总脂含量的影响[J]. 水产学报, 2010, 34(10): 1518-1524. WANG M, LI C H, DAI M, et al. The effect of C/N on the growth and total lipid content of Chaetoceros muelleri[J]. Journal of Fisheries of China, 2010, 34(10): 1518-1524(in Chinese).
[24] ADAMS C, GODFREY V, WAHLEN B, et al. Understanding precision nitrogen stress to optimize the growth and lipid content tradeoff in oleaginous green microalgae [J]. Bioresource Technology, 2013, 131: 188-194. doi: 10.1016/j.biortech.2012.12.143 [25] TAKESHITA T, OTA S, YAMAZAKI T, et al. Starch and lipid accumulation in eight strains of six Chlorella species under comparatively high light intensity and aeration culture conditions [J]. Bioresource Technology, 2014, 158: 127-134. doi: 10.1016/j.biortech.2014.01.135 [26] PAL D, KHOZIN-GOLDBERG I, COHEN Z, et al. The effect of light, salinity, and nitrogen availability on lipid production by Nannochloropsis sp [J]. Applied Microbiology and Biotechnology, 2011, 90(4): 1429-1441. doi: 10.1007/s00253-011-3170-1 [27] 黄怡, 高保燕, 王飞飞, 等. 不同磷、硫及二氧化碳浓度对标志链带藻生长和碳水化合物积累的影响 [J]. 微生物学报, 2019, 59(10): 1915-1926. HUANG Y, GAO B Y, WANG F F, et al. Effects of phosphorus, sulfur and carbon dioxide concentrations on growth and carbohydrate accumulation of Desmodesmus insignis [J]. Acta Microbiologica Sinica, 2019, 59(10): 1915-1926(in Chinese).
[28] THUNYARATCHATANON C, LUENGNARUEMITCHAI A, JITJAMNONG J, et al. Influence of alkaline and alkaline earth metal promoters on the catalytic performance of Pd-M/SiO2 (M = na, ca, or Ba) catalysts in the partial hydrogenation of soybean oil-derived biodiesel for oxidative stability improvement [J]. Energy & Fuels, 2018, 32(9): 9744-9755. [29] MIAO X L, WU Q Y. Biodiesel production from heterotrophic microalgal oil [J]. Bioresource Technology, 2006, 97(6): 841-846. doi: 10.1016/j.biortech.2005.04.008 [30] 韩松芳, 金文标, 涂仁杰, 等. 细菌对城市污水中斜生栅藻生长与产脂的影响 [J]. 中国环境科学, 2017, 37(10): 3867-3872. doi: 10.3969/j.issn.1000-6923.2017.10.031 HAN S F, JIN W B, TU R J, et al. Effects of bacteria on growth and lipid production of Scenedesmus obliquus cultivated in municipal wastewater [J]. China Environmental Science, 2017, 37(10): 3867-3872(in Chinese). doi: 10.3969/j.issn.1000-6923.2017.10.031
[31] HOEKMAN S K, BROCH A, ROBBINS C, et al. Review of biodiesel composition, properties, and specifications [J]. Renewable and Sustainable Energy Reviews, 2012, 16(1): 143-169. doi: 10.1016/j.rser.2011.07.143 [32] HOEKMAN S K, BROCH A, ROBBINS C, et al.Review of biodiesel composition, properties, and specifications[J].Renewable and Sustainable Energy Reviews, 2012, 16(1): 143-169. -








 DownLoad:
DownLoad: