-
随着我国餐饮、养殖、制药、食品和皮革等产业的发展,产生了大量的高氨氮废水,如果这些废水排入河流湖泊和地下水,会导致水体富营养化[1-2]。对于此类高氨氮废水,传统的硝化反硝化技术需要大量曝气,在碳氮比较低的情况下还需额外补充大量碳源,产生大量的经济成本。此外,传统的硝化反硝化技术脱氮效率较低,需要较长的水力停留时间(hydraulic retention time, HRT)和较大的占地面积,还会产生大量剩余污泥[3-4]。因此,亟需突破传统脱氮技术运行能耗高、脱氮效率低、占地面积大、剩余污泥产量多等技术瓶颈,开发一种节能、高效、省地和产泥量少的快速脱氮处理技术。厌氧氨氧化(anammox)是迄今最高效节能的脱氮方式[5-6],可以在不加碳源的条件下实现自养高负荷脱氮,污泥产量低。然而,厌氧氨氧化菌(anAOB)的自养性和生长缓慢增加了污水处理工艺的启动期[7]。因此,加快anAOB的生长速率,实现anammox工艺的快速启动及高效脱氮,对于anammox的推广应用及污水处理运行节能减排具有重要的现实意义。
目前文献中报道的anAOB的倍增周期为10~20 d,anAOB的缓慢生长导致反应器启动时间较长[8]。全球第一座大规模anammox污水处理厂于2002年在鹿特丹建成并投入运行,启动耗时3.5 a,比预期的2 a要长[9]。anAOB的缓慢生长速度和底物的抑制作用以及控制复杂等使得anammox工艺实际应用受到限制[10]。以前的研究通常在反应器中接种厌氧污泥[11]、硝化污泥[12]、反硝化污泥[13],甚至anammox絮凝污泥[14],但由于群落中anammox丰度较低,这些策略通常必须在低进水负荷下启动,导致启动时间更长。显然,尽管anammox工艺已经研究了20多年,但启动周期长仍是其实际应用的主要障碍[15-16]。
Anammox颗粒污泥相对于絮体污泥具有较强的环境适应能力和脱氮性能[17-18],将其作为接种污泥将有助于anammox的启动。此外,贾方旭等[13]关于anAOB与其他细菌之间的协同竞争关系的研究表明,anAOB与硝化菌和反硝化菌在不同条件下存在竞争和协同关系。然而,利用anAOB与其他菌群之间的协同作用加速anammox启动的研究则相对较少,同时硝化菌和反硝化菌相对于anAOB更容易获得。因此,本研究的重点是接种少量成熟anammox颗粒污泥到含有硝化污泥和反硝化污泥的反应器,以验证接种少量anammox颗粒污泥,利用菌群协同机制是否可实现anammox工艺快速启动,并通过氮素转化和氮平衡的计算分析了anammox反应器的脱氮性能,同时采用高通量技术分析了anammox反应器中微生物群落丰度的变化规律。
-
采用人工配制的模拟废水作为进水,模拟废水的NH3-N、
NO−2 -N和无机碳源使用NH4Cl、NaNO2、NaHCO3按需配置,其他组分包括27.2 mg·L−1 KH2PO4、135.92 mg·L−1 CaCl2·2H2O、300 mg·L−1 MgSO4·7H2O、570 mg·L−1KCl以及1 mL·L−1微量元素I和微量元素II。微量元素I包括5 g·L−1 EDTA和5 g·L−1 FeSO4·7H2O;微量元素II包括15 g·L−1 EDTA、0.014 g·L−1 H3BO4、0.845 g·L−1 MnCl2·4H2O、0.25 g·L−1 CuSO4·5H2O、0.43 g·L−1 ZnSO4·7H2O、0.19 g·L−1 NiCl2·6H2O、0.16 g·L−1 NaSeO4·10H2O、0.22 g·L−1 NaMoO4·2H2O、0.24 g·L−1 CoCl2·6H2O[19]。接种污泥取自实验室培养的anammox种泥、反硝化污泥和硝化污泥,其悬浮固体质量浓度为(mixed liquor suspended solids, MLSS)分别为8 553、6 834和6 532 mg·L−1,挥发性悬浮固体质量浓度(mixed liquid volatile suspended solids, MLVSS)分别为7 095、5 331和5 265 mg·L−1。 -
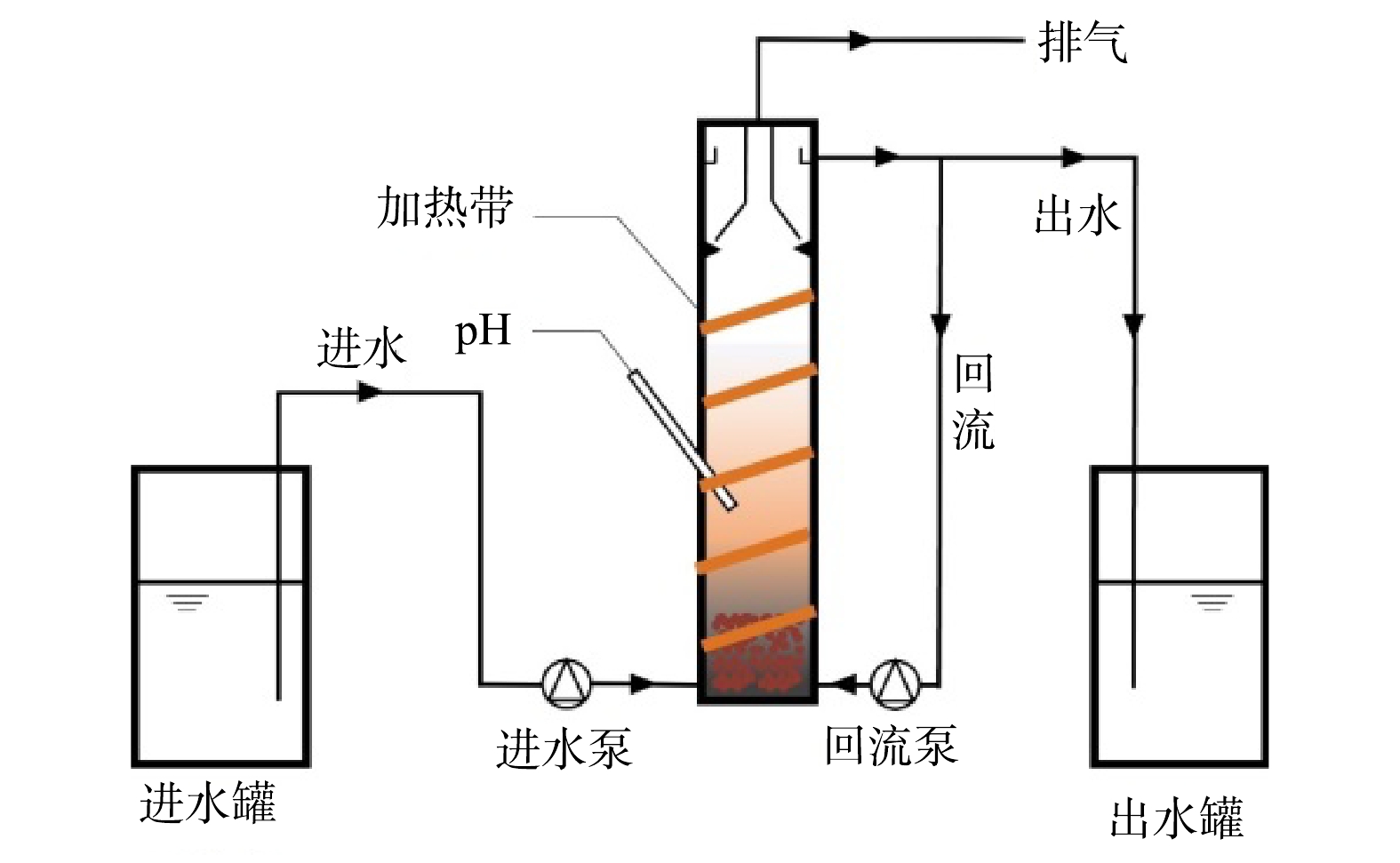
本研究所用的实验装置如图1所示。实验所用的上流式厌氧污泥床反应器(up-flow anaerobic sludge bed,UASB),反应器由圆柱形有机玻璃制成,内径为7 cm,高为30 cm,工作体积为1 L。反应器内混合液温度通过外置加热带控制,由底部进水,上部溢流出水,底部设置有回流管,部分出水可通过回流管进入反应器内,可通过调整回流液的流量调整反应器回流比(reflux ration, R)。
-
本研究设置3组实验:A组只接种 500 mg·L−1的anammox污泥,作为空白组;B组接种500 mg·L−1的anammox污泥和5 000 mg·L−1的反硝化污泥;C组接种500 mg·L−1的anammox污泥和5 000 mg·L−1的硝化污泥(污泥质量浓度均以MLSS计)。在整个实验期间,控制3组反应器温度为(35±1) ℃,为了消除pH对反应器性能的影响,通过投加30 g·L−1碳酸氢钠溶液调节系统pH至7.5~8.0。实验分为3个阶段:阶段I(1~54 d),主要考察底物质量浓度对反应器脱氮效果的影响;阶段II(55~96 d),主要考察在高负荷条件下,调整HRT和回流比对反应器脱氮效果的影响;阶段III(97~116 d),通过降低进水负荷考察其对反应器脱氮性能恢复的影响。不同阶段的运行参数见表1。每天取进出水水样并检测水质变化。
-
MLSS、MLVSS、NH3-N、
NO−2 -N和NO−3 -N用国标法测定[20];COD使用快速测定仪(连华5B-3C,连华科技)测定;DO使用便携式溶解氧仪(HACH-HQ30,哈希水质分析仪器(上海)有限公司)测定和pH使用pH计(FE20K,梅特勒-托利多国际贸易(上海)有限公司)测定;反应器中的游离氨(FA)和游离亚硝酸(FNA)的质量浓度分别按照式(1)和式(2)进行计算[21]。式中:
CFA 为游离氨质量浓度,mg·L−1;CFNA 为游离亚硝酸质量浓度,mg·L−1;CNH3−N 为氨氮质量浓度,mg·L−1;CNO−2−N 为亚硝酸盐质量浓度,mg·L−1;T为温度,℃。 -
取3组反应器中不同阶段混合液各 50 mL,8 000 r·min−1下离心去除上清液,剩余固体用于微生物分析。依据 E.Z.N.A.®soil DNA kit 对样品进行 DNA 抽提,并使用凝胶电泳和NanoDrop2000检测提取DNA的质量和纯度;使用338F(5’-ACTCCTACGGGAGGCAGCAG-3’) 和806R(5’-GACTACHVGGGTWTCTAAT-3’) 对16S rRNA基因V3~V4可变区进行PCR扩增。PCR扩增程序为:首先在95 ℃预变性3 min,然后在95 ℃变性30 s,在55 ℃退火30 s,在72 ℃延伸30 s,并执行27个循环,然后在72 ℃稳定延伸10 min,最后在4 ℃进行保存。每个样本3个重复。将同一样本的PCR扩增产物混合后使用2%琼脂糖凝胶回收,利用AxyPrep DNA Gel Extraction Kit 进行回收产物纯化,2%琼脂糖凝胶电泳检测,并用Quantus™ Fluorometer 对回收产物进行检测定量。最后通过Miseq PE300平台进行测序。
-
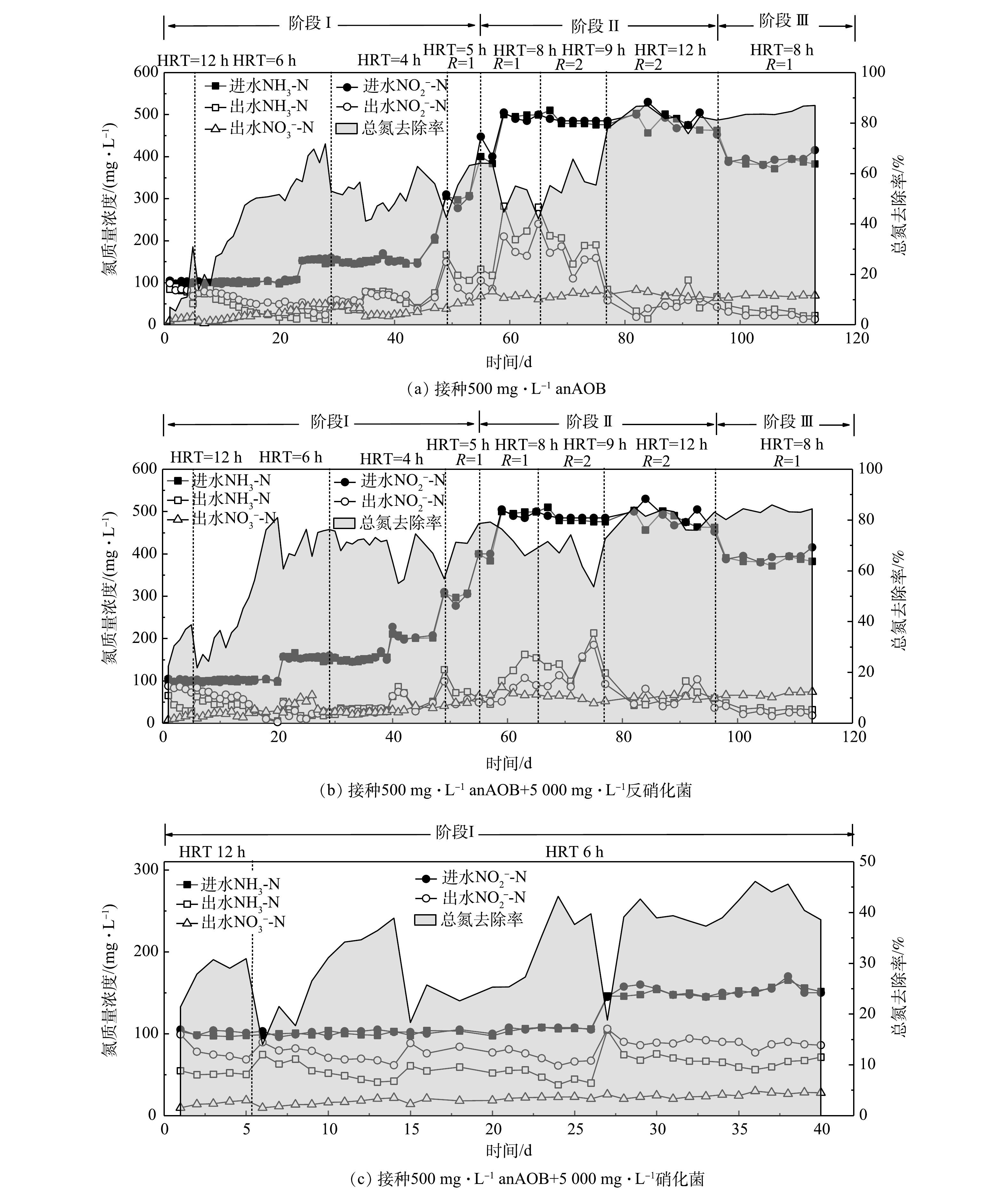
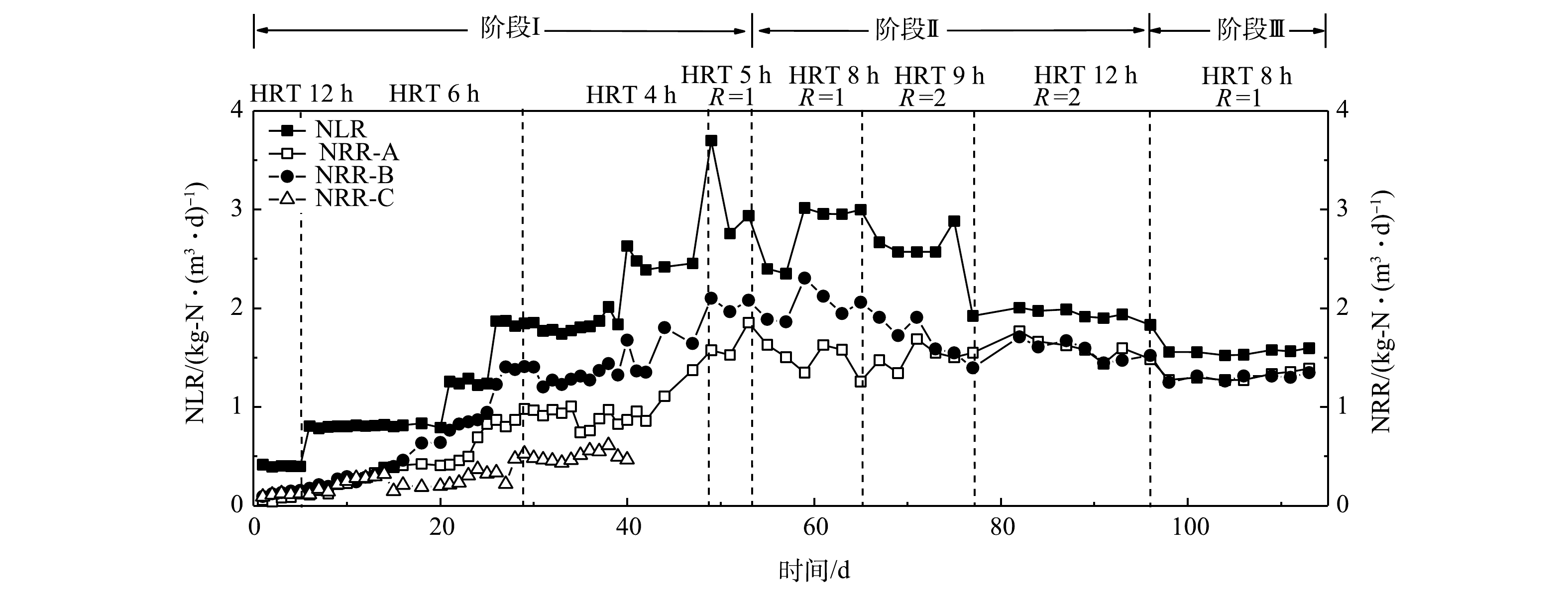
3个反应器的进出水氮素变化如图2所示。在第I阶段,在进水负荷相同的条件下,A组和B组的TN去除率随时间延长逐渐升高,在进水总氮质量浓度由200 mg·L−1提高至600 mg·L−1的过程中,2组的TN去除率整体呈现出逐渐升高的趋势。其中,B组的TN去除率最高,平均去除率可达70%左右;A组的TN平均去除率约为60%。这说明反硝化菌的存在有利于促进系统TN的去除。图3反映了3组反应器在脱氮过程中的总氮负荷率和总氮去除效率(NRR)的变化。在第I阶段(0~54 d),在相同的NLR下,B组表现出最高的总氮去除效率,启动30 d后,B组的NRR达到了1.41 kg·(m3·d)−1,相对于A组(0.97 kg·(m3·d)−1)提高了31.2%。这同样说明反硝化菌的存在有利于TN的去除。XU等 [22]关于anammox污泥中anAOB和其他菌之间关系的研究结果也表明,反硝化菌Denitratisoma 的存在可提高anAOB活性。由此可推测,通过接种反硝化菌和anAOB可提高anAOB的活性。相对于A组和B组,C组的TN去除率最低(图2),仅有40%左右,且在后期没有升高的趋势,C组的NRR仅有0.48 kg·(m3·d)−1,低于空白组A组(50.5%)。这可能是由于硝化菌与anAOB存在底物竞争,不利于anAOB的富集增长,这与贾方旭等[8]的研究结果相似。因此,C组运行40 d后停止运行,第II和III阶段主要对比A组和B组的脱氮效果。
在第II阶段(55~96 d),升高进水NH3-N和
NO−2 -N质量浓度至500 mg·L−1,A组和B组的出水NH3-N和NO−2 -N波动较大。将HRT从8 h延长到9 h,同时升高回流比R为2,然而出水水质依然有波动,B组较A组波动较小;延长HRT为12 h后,出水水质有所好转,但90 d后依然有上升趋势。这充分证明,当进水总氮质量浓度升至1 000 mg·L−1后,导致系统脱氮效果变差,也说明过高的进水负荷抑制anAOB活性。李媛[23]也做了类似的研究,当进水总氮质量浓度由200 mg·L−1升高到600 mg·L−1、HRT由8 h缩短到6 h时,NRR迅速下降,NRR由1.2 kg·(m3·d)−1下降到1.03 kg·(m3·d)−1。在第III阶段(97~116 d),为了恢复系统的脱氮性能,提高系统的稳定性,分别降低进水NH3-N和
NO−2 -N质量浓度至400 mg·L−1,系统出水基本稳定,A组和B组的TN去除率稳定在80%以上,NRR维持在1.3 kg·(m3·d)−1左右。这说明通过降低进水负荷能够缓解对anAOB的抑制,有助于系统脱氮性能的恢复。图4反映了3组反应器脱氮过程中
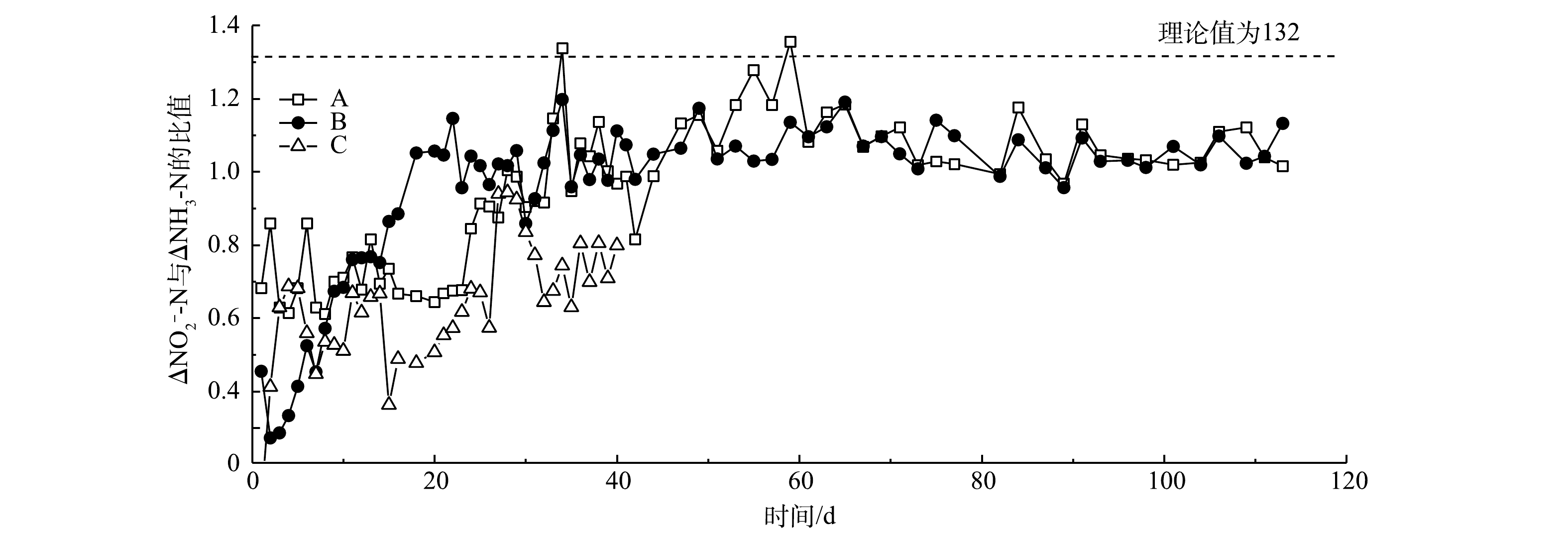
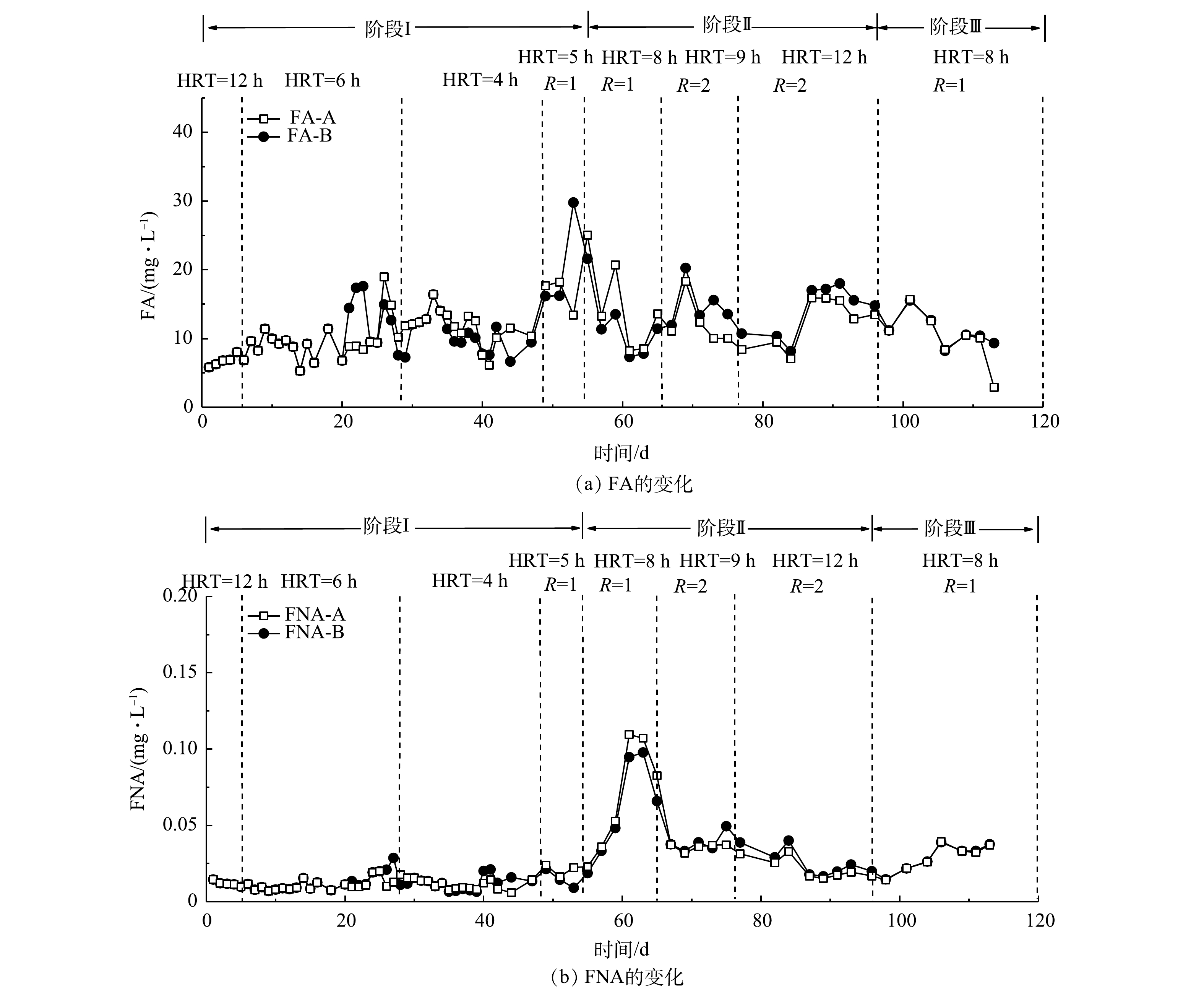
NO−2 -N去除量(△NO−2 -N)与NH3-N去除量(△NH3-N)的比值变化。A、B和C 3组反应器中NO−2 -N去除量与NH3-N去除量比例开始呈上升趋势,后续趋于稳定,基本保持在1.1左右。由厌氧氨氧化反应方程[24-25]可知,在厌氧氨氧化稳定运行时,NO−2 -N去除量与NH3-N去除量的理论比值为1.32。本研究的NO2−-N去除量与NH3-N去除量的比值与理论值差异较小。其原因为:一是由于进水中含有一定量的溶解氧,会发生亚硝化和硝化作用,导致少量NH3-N转化为NO−2 -N或者NO−3 -N;二是菌群在富集过程中可能会释放氧化剂[26]。有研究表明,在低浓度厌氧氨氧化菌培养条件下,系统由于菌群浓度降低会产生氧化剂(超氧化物或羟基自由基),导致中NH3-N的消耗量增高[27]。B组的NO−2 -N去除量与NH3-N去除量比例在20 d后基本保持稳定,而A组在30 d后才趋于稳定,C组持续表现出较大波动。这充分说明反硝化菌的存在有利于anammox的启动,使anammox在最短的时间内在反应器内起主导作用,而硝化菌与anAOB存在底物竞争,从而导致C组NO−2 -N去除量与NH3-N去除量比例持续处于较低水平,并且有较大波动,对于anammox的启动具有抑制作用。游离氨(FA)和游离亚硝酸(FNA)的质量浓度对于anammox过程具有很大的影响[20]。为了评估FNA和FA对anammox过程的影响,本研究计算了A组和B组anammox过程的FA和FNA,探究高负荷进水条件下anammox受抑制的机理。图5反映了A组和B组脱氮过程中FA和FNA的变化。A组和B组在整个anammox脱氮过程中FA的质量浓度低于30 mg·L−1。已有研究[22]表明,控制FA的质量浓度低于50 mg·L−1对于anammox没有抑制作用。而在第II阶段,FNA的质量浓度已经达到0.05 mg·L−1以上,甚至超过了0.1 mg·L−1。anammox过程FNA质量浓度超过0.05 mg·L−1对于anAOB具有明显的抑制作用[19, 28]。这充分说明,当进水
NO−2 -N质量浓度达到500 mg·L−1时,会导致FNA的质量浓度升高,当FNA的质量浓度超过0.05 mg·L−1时,会抑制anAOB的活性。通过降低进水NO−2 -N浓度,可使FNA低于0.05 mg·L−1,进而使系统逐渐恢复。 -
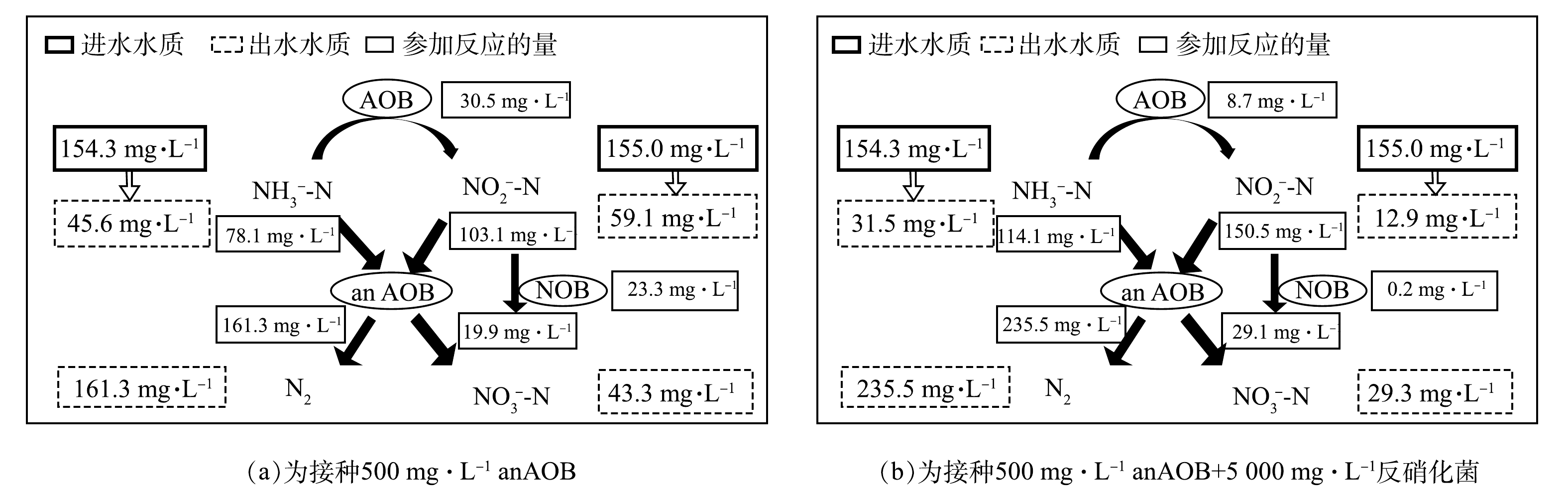
为了进一部分解析A组和B组2种启动方式对anammox启动的差异以及氮素转化的规律,通过对启动30 d后A组和B组的进出水氮素指标核算系统的氮素转化,结果如图6所示。在进水NH3-N为154.3 mg·L−1,在
NO−2 -N为155.0 mg·L−1的条件下,A组的总氮去除率达到52.2%,B组的总氮去除率达到76.2%,2组的总氮去除均是通过anammox实现的,B组比A组提高了24%。这充分说明,反硝化菌的存在有利于提高anAOB的活性。此结果与已有的研究结果一致[20]。此外,A组有30.5 mg·L−1的NH3-N被氨氧化菌氧化成NO−2 -N,同时有23.3 mg·L−1的NO−2 -N被亚硝酸盐氧化菌氧化成了NO−3 -N。而B组中有仅有8.7 mg·L−1的NH3-N被氨氧化菌氧化成NO−2 -N,0.2 mg·L−1的NO−2 -N被亚硝酸盐氧化菌氧化成了NO−3 -N,硝化反应的占比远低于anammox。该结果说明,B组可为anAOB提供较好的启动环境,更大程度的避免硝化菌等其他杂菌的影响,使anAOB最短的时间在反应器内起主导作用,实现快速启动。 -
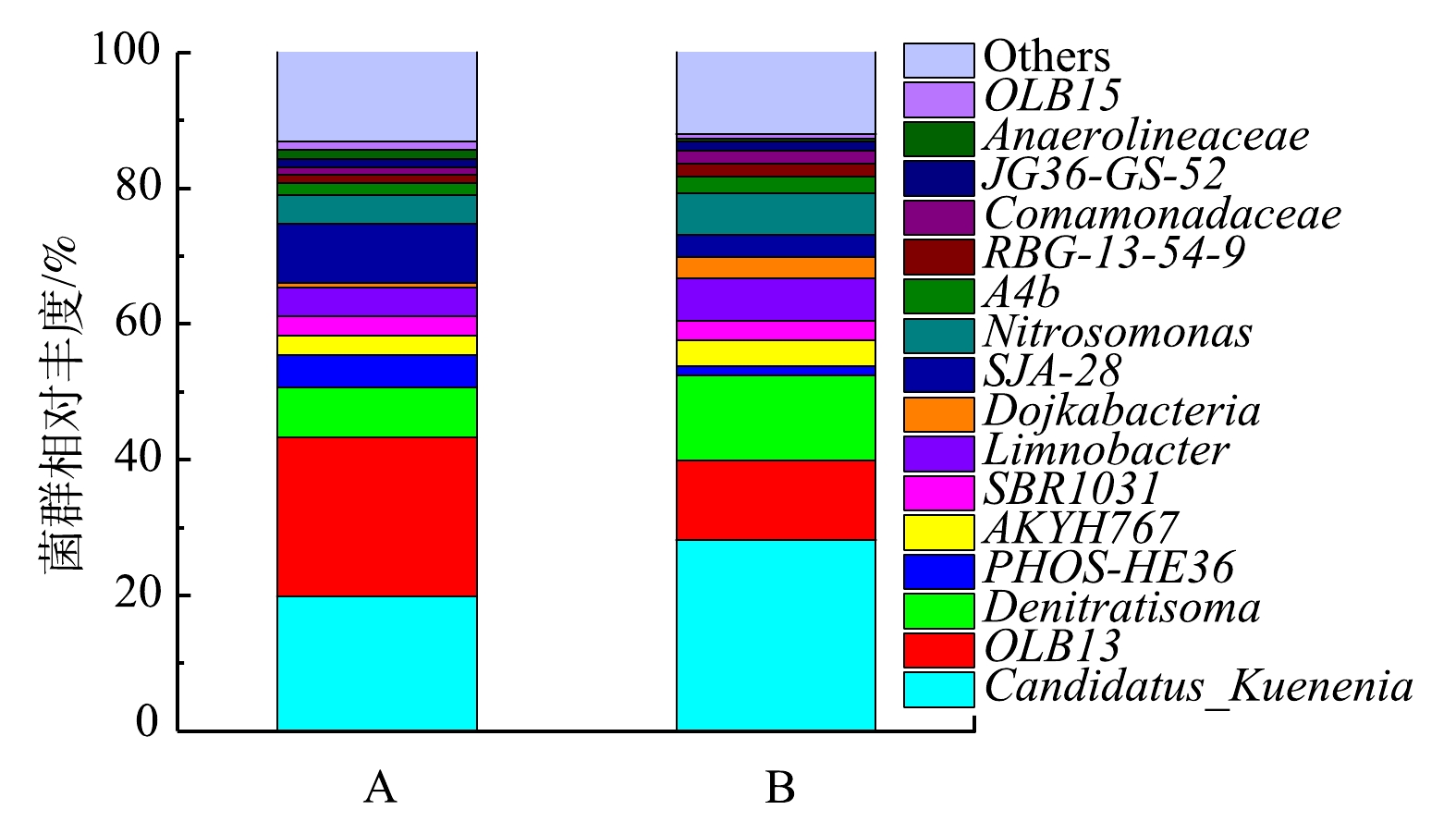
反应器anammox的启动过程是anAOB富集的过程。为了进一部分解析A组和B组接种方式对anAOB菌群丰度的影响,将A组和B组启动30 d后,取样进行高通量测序。细菌种群在属水平上的相对丰度如图7所示。2组反应器中主要的菌属为Candidatus Kuenenia, OLB13和Denitratisoma。其中Candidatus Kuenenia是anAOB,在A组中的丰度占比为19.8%,在B组中的丰度占比为28.1%,相对于A组提高了41%。这说明B组的接种方式有利于anAOB菌群丰度的提升,从而促进anAOB的活性。这也充分印证了在第2.1节中的推测。Denitratisoma是常见的反硝化菌属[29],在A组和B组中的丰度占比分别为7.3%和12.6%。ZHANG等[30]的研究表明,Candidatus Kuenenia 的相对丰度与Denitratisoma 的相对丰度趋势具有一定的正相关性,说明 Candidatus Kuenenia与Denitratisoma 有很强的正相互作用,侧面验证了Denitratisoma的存在有利于体现Candidatus Kuenenia的活性。OLB13属于厌氧菌,是厌氧消化的核心微生物种群之一[31-32]。已有研究[12]表明,脱氮反应系统中OLB13和Denitratisoma的存在对于Candidatus Kuenenia 的活性表达具有积极作用。因此,通过反硝化菌和anAOB的同时接种可以为anAOB提供一种较好的增殖环境,从而有利于提高anAOB丰度,促进反应器anammox脱氮效率的提升。
-
1)向反应器中投加5 000 mg·L−1反硝化污泥(以MLSS计)和500 mg·L−1 anammox污泥(以MLSS计)进行接种,可以实现anammox的快速启动。启动30 d以后,总氮去除负荷可达1.41 kg·(m3·d)−1以上。
2)进水
NO−2 -N质量浓度达到500 mg·L−1时,会导致FNA质量浓度超过0.05 mg·L−1,从而严重影响anAOB的活性,进而导致反应器出水水质波动;通过降低进水NO−2 -N质量浓度可以使系统恢复。3)本研究所用的脱氮系统中,主导anammox的anAOB为Candaditue Kuenenia,与单独接种anammox污泥相比,接种反硝化污泥和anammox污泥可使Candaditue Kuenenia的丰度提高40.0%,从而使反应器脱氮效率提高了31.2%。
低接种量条件下实现厌氧氨氧化快速启动的策略
Strategy on fast start-up of anaerobic ammonia oxidation under low inoculation conditions
-
摘要: 厌氧氨氧化(Anaerobic ammonia oxidation, anammox)是目前最高效节能的脱氮方式,可以在不加碳源的条件下实现自养高负荷脱氮。然而,厌氧氨氧化菌(Anaerobic ammonia oxidizing bacterial, anAOB)因其生长缓慢,会导致污水处理工艺的启动周期较长。因此,为缩短anammox的启动周期,设置了3种不同污泥接种方式(A:接种500 mg·L−1 anAOB; B:接种500 mg·L−1 anAOB+5 000 mg·L−1反硝化菌;C:接种500 mg·L−1 anAOB+5 000 mg·L−1硝化菌)开展anammox启动实验,分析了底物浓度对脱氮效果的影响以及不同接种条件下微生物群落的差异。结果表明,采用向反应器投加500 mg·L−1 anAOB+5 000 mg·L−1反硝化菌的接种方式,可以实现anammox的快速启动;启动30 d后,总氮去除效率(nitrogen removal rate, NRR)可达1.41 kg·(m3·d)−1以上。微生物群落分析结果表明,反应器中主要存在的anAOB为Candaditue Kuenenia;与单独接种anammox污泥相比,接种反硝化污泥和anammox污泥会使Candaditue Kuenenia的相对丰度提高了40.0%,从而使脱氮效率提高了31.2%。底物浓度对anammox过程的影响结果表明,进水
NO−2 -N质量浓度达到500 mg·L−1时会导致游离亚硝酸(FNA)浓度升高,而当FNA质量超过0.05 mg·L−1时,会严重影响anAOB活性,导致反应器出水水质波动;通过降低进水NO−2 -N浓度,可以使系统恢复。以上研究结果说明,通过接种反硝化菌和anAOB的方式可实现anammox的快速启动,加速实现anammox工艺在污水处理中大规模应用。Abstract: Anaerobic ammonia oxidation (anammox) was by far the most efficient and energy-saving method of nitrogen removal, which achieved autotrophic and high-load nitrogen removal without adding carbon sources. However, the slow growth characteristic of anaerobic ammonia oxidizing bacteria (anAOB) prolonged the start-up period of wastewater treatment process. Therefore, in order to shorten the start-up cycle of anammox, three sludge inoculation methods (A inoculation with 500 mg·L−1 anAOB; B inoculation with 500 mg·L−1 anAOB+5 000 mg·L−1 denitrifying bacteria; C inoculation with 500 mg·L−1 anAOB+5 000 mg·L−1 nitrifying bacteria) were set up to conduct experiment of anammox. The effect of substrate concentration on the nitrogen removal and the difference of microbial community under different inoculation conditions were analyzed. The results indicated that the method of inoculating low-concentration anammox sludge (500 mg·L−1) and denitrification sludge (5 000 mg·L−1) achieved a rapid start of anammox, and the nitrogen removal rate (NRR) exceeded 1.41 kg·(m3·d)−1 after 30 days. The result of microbial analysis showed that the main anammox bacteria in the reactor was Candidatus Kuenenia. Comparing with the inoculation with anammox sludge alone, the abundance of Candaditue Kuenenia in the inoculation with denitrification sludge and anammox sludge increased by 40.0%, thereby the nitrogen removal efficiency increased by 31.2%. The result of the effect of substrate load showed that when the concentration ofNO−2 -N reached 500 mg·L−1, the concentration of free nitrous acid (FNA) increased, FNA concentration exceeding 0.05 mg·L−1 would seriously affect the activity of anAOB and caused the unstable quality of effluent. The system could be restored by reducing the nitrite nitrogen concentration of influent. These results indicated the rapid start of anammox could be achieved by inoculating denitrifying bacteria and anAOB, which will accelerate the large-scale application of the anammox process in sewage treatment.-
Key words:
- anaerobic ammonia oxidation (anammox) /
- fast start-up /
- inoculation /
- nitrogen removal /
- microorganism
-
2009—2019年,全国共发生突发环境事件3 643起。其中生态环境部(包括原环境保护部)直接调度指导处置的突发环境事件有1 225起,包括水污染事件1 060起,占比约87%[1-2]。由于河流水系是一个有机联系的整体,故一旦发生突发性污染事件,极易对事故点下游流域产生影响和危害,造成巨大经济损失并引起公众恐慌。如2018年湘赣渌江铊污染事件,其污染范围跨越江西、湖南2省;2017年嘉陵江铊污染事件,污染范围波及陕西、四川2省;2016年新疆额尔齐斯河汞污染事件及同年新疆伊犁河柴油泄漏事件,均险些造成跨国界污染。在我国经济社会的持续高速发展、突发性环境污染事件频发的背景下,我国的环境风险管理体系仍有待完善,存在重应急轻防范、重突发污染事件轻长期慢性影响等问题,尚未完全实现向以风险控制为目标导向的环境风险管理模式转变。在“十四五”以及未来很长一段时期内,流域性水环境风险将是我国环境风险管理的重要内容,严防流域性突发水环境事件发生、提高流域水环境风险管理水平、开展流域水环境风险评估技术体系研究等迫在眉睫。
突发环境事件风险评估结果的可靠性与代表性是环境风险管理的关键。现阶段,我国流域环境风险评估工作主要偏重于特定污染物的生态风险评价[3-4]、健康风险评价[5-6]及累积性环境风险评价[7-8]等方面。针对突发性水污染事件环境风险评估方法的研究甚少。如指数评价法[9-11]、贝叶斯网格法[12-13]、相对风险评估法[14-15]等都较少关注流域级水环境风险因子的释放规律及环境敏感受体受损害的途径和程度等[16],尚不能准确描述和评估流域尺度环境风险的传递性、累积性或削减性影响,其风险表征也不够具体,可操作性有待提高。我国已发布了《企业突发环境事件风险评估指南(试行)》(环办〔2014〕34号)[17]、《尾矿库环境风险评估技术导则(试行)》(HJ 740-2015)[18]以及《行政区域突发环境事件风险评估推荐方法》(环办应急〔2018〕9号)[19]。以上指南、导则及推荐方法解决了风险评估中存在的诸多问题,但仍存在不能完全反映流域突发环境事件特征,以及与环境风险管理脱节等问题。
本文以水环境敏感受体为评估基础,在对流域内固定风险源、移动风险源进行水环境风险分类、分级及表征的基础上,提出流域级环境风险分级及表征的技术方法。根据环境风险评估结果与流域风险特征,确定流域环境风险重点和优先管理对象,并有针对性地提出防范对策,以期实现与环境风险管理的有效衔接,补充我国流域环境风险评估体系。
1. 总体思路
本技术方法以《国家突发环境事件应急预案》(国办函〔2014〕119号)中“附件1突发环境事件分级标准”为基础,着重关注突发环境事件分级标准中所涉及的重要环境敏感受体,如集中式饮用水源地、跨界(国界、省界、市界、县界)以及重要生态功能区等。依据突发环境事件分级标准的“特别重大、重大、较大、一般”4级,将环境敏感受体分为3级,即一级、二级和三级,涉及特别重大和重大突发环境事件的统一为一级环境敏感受体。以流域内环境敏感受体保护为目的,在全面收集流域水文水系、地形地貌、社会经济,以及现有环境风险源(固定源和移动源)、环境敏感受体情况等资料的基础上,开展流域内固定源和移动源的风险识别、评估与分级。
主要技术思路为:1)对流域内“一废一库一品”企业,如采选冶炼、尾矿库、石油、化工、钢铁、医药、危化品水陆运输等风险源逐一调查(现场调查风险源的位置、生产情况、危险废物和污水处置情况、排水情况、环境保护情况等)并补充收集相关资料(如风险源布局图、厂区平面图、雨污管网图等图件,以及环境应急预案、环境风险评估、环境影响评价、环境应急资源调查等报告),以识别重点环境风险源,建立环境风险源清单,并对清单内企业逐一进行突发环境事件风险评估;2)根据环境风险源评估结果,结合流域内跨界断面、集中式饮用水源地、国家级自然保护区、重要湿地、特殊生态系统等环境敏感受体特征分析,对流域水环境突发性环境风险进行综合评估,并通过环境风险源地图、环境敏感受体图等对评估结果进行表征;3)根据流域突发性水环境风险评估结果,结合流域现有风险防控措施及应急救援能力差距,提出流域水环境风险防控策略及建议,为全面提升流域水环境风险管理水平,科学施策提供理论依据和技术支撑。
2. 流域水环境敏感受体识别与分级
2.1 流域水环境敏感受体识别
在开展流域水环境风险评估工作前,需详细调查流域内所有水环境敏感受体,制作出流域水环境敏感受体清单,绘制流域水环境敏感受体分布图。典型的水环境敏感受体包括集中式饮用水水源地保护区、涉水自然保护区、重要湿地、重要水生生物栖息地、水产种质资源保护区、跨界(国、省、市、县界)断面等。
2.2 流域水环境敏感受体敏感性等级划分
参考《国家突发环境事件应急预案》(国办函〔2014〕119号)中规定的突发环境事件分级标准,将环境敏感受体敏感性划分为以下3级:1)一级环境敏感受体——跨国界水体,或跨省界,或县级以上城市集中式生活饮用水水源地,或珍稀濒危野生动植物天然集中分布区,或重要水生生物的自然产卵场及索饵场、越冬场和洄游通道;2)二级环境敏感受体——跨设区的市界,或乡镇集中式生活饮用水水源地,或国家级自然保护区,或国家级风景名胜区,或世界文化和自然遗产地,或国家级森林公园,或国家级地质公园,或国家级湿地,或国家级文物保护单位;3)三级环境敏感受体——跨县界,或其他未达到二级的环境敏感受体。
3. 选择污染物在水环境中的扩散模型
根据评估地区特征与污染物特征,选择水环境中风险因子的扩散模型,包括零维水质模型、一维稳态模型及一维动态混合模型。资料充分时也可采用二维、三维水质模型。
1)零维水质模型适用于持久性污染物,河流为恒定流。假设污染物进入河道瞬间完全混合均匀(溶解或分散),并整体分散(稀释作用),即将污染物泄漏点至环境敏感受体间的河道作为一个整体。污染物在其中均匀混合。
2)非持久性污染物稳定态采用一维稳态模型,即一维稳态稀释、降解综合模式,忽略污染物的纵向弥散系数(在稳态条件下,纵向弥散系数对结果影响小)。该模型适用于非持久性污染物,河流为恒定流。当污染物在河流断面上达到完全混合后,分析污染物在水流方向输移、转化的变化情况时采用此模型。
3)一维动态混合模型适用于非持久性污染物,非恒定流,可用于预测任何时刻的水质状况。
4. 流域水环境风险源识别与评估
4.1 流域固定型水环境风险源识别与评估
1)固定型水环境风险源识别。收集并分析相关资料,包括企业基本信息、周边环境敏感受体、涉及环境风险物质和数量、生产工艺、安全生产管理、环境风险单元及现有环境风险防控与应急措施,以及现有环境应急资源等。按照《企业突发环境事件风险评估指南(试行)》(国办发〔2013〕101号)的要求,综合企业信息、环境风险传播途径及环境敏感受体,识别固定型水环境风险源(以下简称固定源)。
2)流域固定源水环境风险评估。按突发环境事件事发点下游受影响水环境敏感受体最高等级来划分固定源环境风险等级。当一级环境敏感受体受到影响时确定为重大环境风险源;当二级环境敏感受体受到影响时确定为较大环境风险源;当三级环境敏感受体受到影响时确定为一般环境风险源。
以环境敏感受体水质安全为核心,通过估算环境污染物泄漏进入河流后的影响范围,及核算受影响范围内所有环境敏感受体的最高级别,以最高级别确定此环境风险源的风险等级。突发性环境污染事件的应急处置,关注的主要问题是污染物在河道中的浓度与污染扩散的水平距离。因此,首先在对流域固定源进行水环境风险评估时,采用合适的污染物扩散模型进行演算,得出的污染物可能影响的污染范围;随后根据此结果,结合影响范围内环境敏感受体等级划分环境风险源的风险等级。
4.2 流域移动型水环境风险源识别与评估
1)移动性水环境风险源识别。移动型水环境风险源(以下简称移动源)主要关注流域内危险化学品(以下简称危化品)道路运输以及船舶运输。调研流域内沿河道路路段、船舶运输路线及危化品种类等情况时,一是制作流域内陆路、水路运输路线与水系分布图,重点关注临近河流及水系联通沟渠的路段;二是掌握危化品在流域内的运输情况,包括危化品运输路线、种类、理化性质、单次运输量、运输工具类型、泄漏可能造成的环境风险类型等情况。
2)流域移动源水环境风险评估。流域移动源水环境风险评估包括环境风险路段识别和环境风险评估参数选择。环境风险路段识别即对流域内所有危化品运输线路进行统计分析,识别水环境敏感受体风险路段(路线),即流域内各干支流的沿河公路、桥梁、水路等,危化品一旦泄漏将可能对下游水环境敏感受体产生影响。
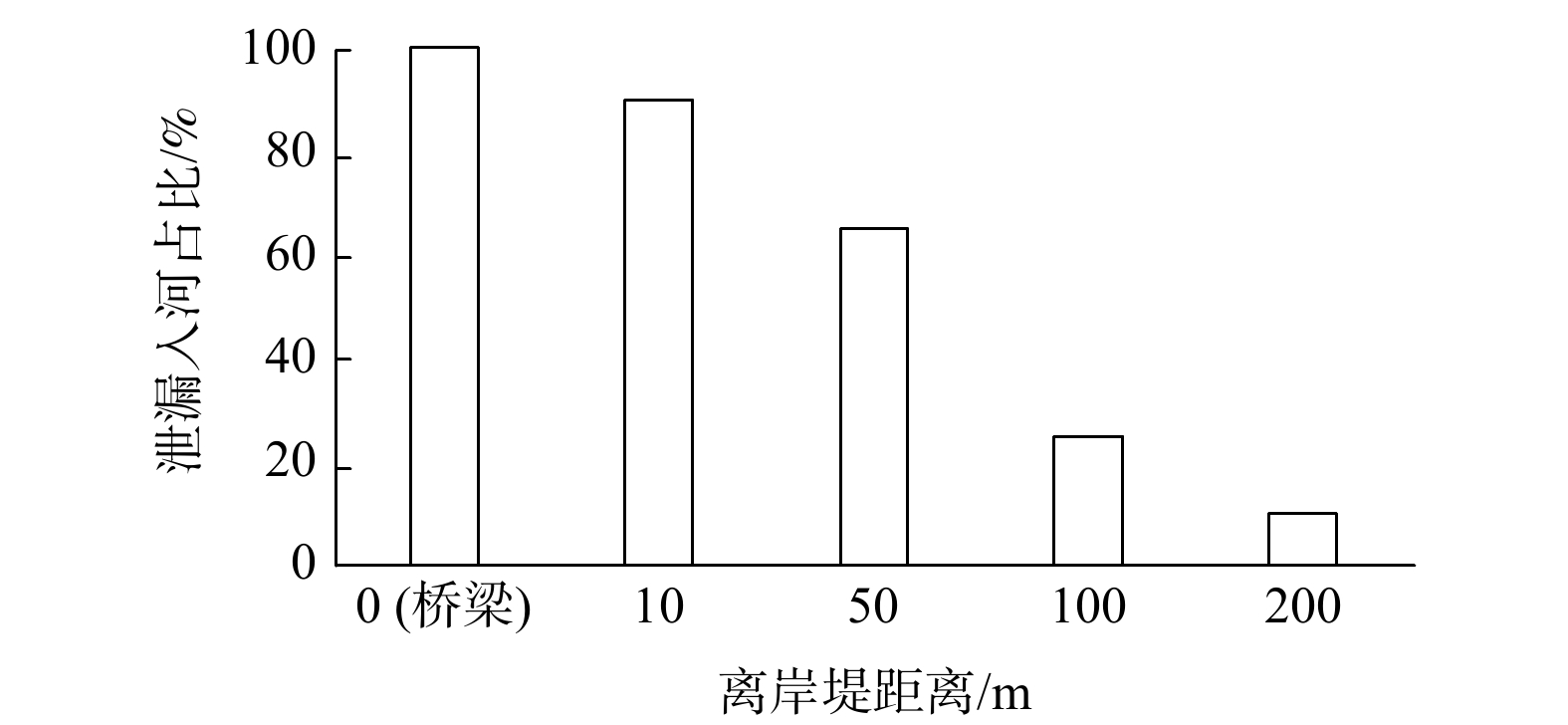
环境风险评估参数选择包括4个方面。一是危化品主要化学成分及表征指标分析。二是危化品泄漏量。建议采用危化品最小运输单元的运输量为危化品水陆两类运输最大泄漏量。根据对以往案例的统计结果,陆路运输中液体类危化品基本都发生在道路路沿与河岸堤顶间距在200 m范围内,路河间距越小,泄漏入河量总体越大;桥梁或翻车直接入河(水库、湖泊)可以按100%泄漏入河处理。水路运输的泄漏量按泄漏全部入河处理。液体类危化品泄漏入河量按图1测算。针对固体类危化品泄漏入河仅考虑离河岸堤10 m范围内的路段及跨河桥梁,泄漏量按最不利条件泄漏,即全部泄漏计算。三是危化品泄漏时间。当发生液体类危化品泄漏事件,其泄漏时间长短将影响危化品进入河流的初始浓度大小。首先利用伯努利方程计算出危化品(液体)泄漏速率,随后根据危化品运输量与泄漏速率的比值得出泄漏时间。四是环境风险路段的环境风险分析与分级。针对所有危化品对识别的所有环境风险路段(即评估路段)逐一进行环境风险分析与评估。结合受影响的环境敏感受体的级别确定该路段环境风险等级。当一级环境敏感受体受到影响时为重大环境风险路段(路线);当二级环境敏感受体受到影响时为较大环境风险路段(路线);当三级环境敏感受体受到影响为一般环境风险路段(路线)。
其中,液体类危化品泄漏速率根据式(1)计算。固体类危险化学品释放时间与污染物在水中的饱和溶解度、污染物总量以及河流流量等因素有关,具体计算见式(2)。
QL=Cd×A×ρ×√2(P−P0)+2ρghρ (1) 式中:QL为危化品泄漏速度,kg·s−1;Cd为危化品泄漏系数,此值常用0.6~0.64;A为裂开面积,m2;P为容器内介质压力,Pa;P0为环境压力,Pa;g为重力加速度;h为裂口之上液位高度,m;ρ为危化品密度,kg·m−3。
T释放时间=S污染物总量/(K饱和溶解度×Q流量) (2) 式中:T为污染物释放时间,s;S为固体类危险化学品所含污染物总量,g;K为污染物在水中的饱和溶解度,g·m−3;Q为河流流量,m3·s−1。
4.3 典型情景分析
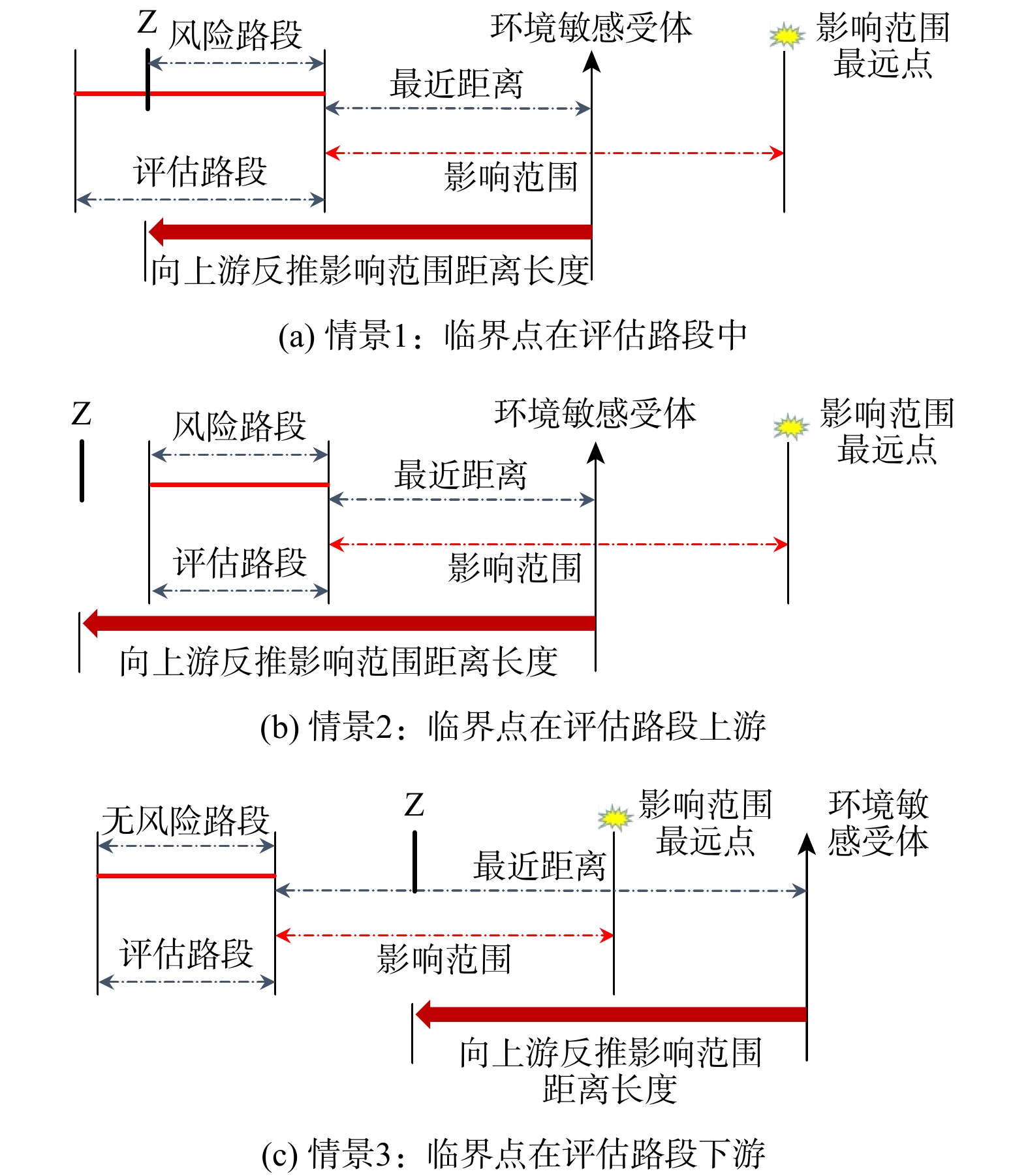
环境风险路段长度计算以环境敏感受体为基准点,通过水质模型对污染物影响距离予以计算。在此影响距离内寻找环境敏感受体,如无环境敏感受体,则该路段为无风险路段。如有环境敏感受体,则以此环境敏感受体为基础并向上游反推(若有多个环境敏感受体,则从环境敏感受体等级从高到低依次进行),即得到临界点。若污染物在临界点处泄漏,则下游环境敏感受体处污染物的浓度刚好达到GB3838-2002相关指标限值要求,该临界点设为Z点。Z点以上为无风险路段,Z点以下为有风险路段,即环境敏感受体和Z点内的危化品运输路线为有风险的路段。环境敏感受体与临界点Z点间的距离即为环境风险路段长度。具体分为以下3个情景,如图2所示。
1)情景一。对于某一环境敏感受体以及某一评估路段,当临界点Z落在评估路段中,该评估路段Z点以上环境风险等级为无风险,即污染物在Z点以上泄漏后的环境风险小。Z点以下为有风险路段。
2)情景二。对于某一环境敏感受体以及某一评估路段,当临界点Z落在评估路段上游某处,则该评估路段环境风险等级为有风险。
3)情景三。对于某一环境敏感受体以及某一评估路段,污染物泄漏扩散影响范围内无环境敏感受体,即当临界点Z落在评估路段下游某处,则该评估路段环境风险等级为无风险。
4.4 风险评估结果的地图表征
流域水环境风险评估结果以一张图予以表征,即在流域水系图上,结合流域水环境敏感受体(红色△表示一级水环境敏感受体、黄色△表示二级水环境敏感受体、蓝色△表示三级水环境敏感受体),将评估出的固定源和移动源按照水环境风险等级不同以红、黄、蓝全部标识出来,其中,红色表示重大环境风险源(重大环境风险路段)、黄色表示较大环境风险源(较大环境风险路段)、蓝色表示一般环境风险源(一般环境风险路段)。同时,用绿色表示无环境风险路段。
5. 结语
关注环境风险源强度与环境敏感受体敏感性之间的交互关系,可直观有效地评估环境风险源对流域内环境敏感受体的影响程度,有效保护环境敏感受体,适应环境应急管理需求。提出流域环境风险评估方法统一了固定源和移动源的流域性突发环境风险评估,可用以对流域内存在的固定源和移动源进行全面识别与分级,是我国现有环境风险评估体系的补充,并可为提升我国流域水环境风险管理水平提供参考。
-
表 1 厌氧氨氧化反应器不同阶段的运行参数
Table 1. Operating parameters of different stages of anammox reactor
阶段 运行时间/d 进水NH3-N质量浓度/(mg·L−1) 进水 NO−2 R HRTa/h NLR b/(kg·(m3·d)−1) I 1~6 100 100 0 12 0.8 7~28 100 100 0 6 1.6 29~48 150 150 0 4 1.8 49~54 300 300 1 5 2.88 II 55~65 500 500 1 8 3 66~76 500 500 2 9 2.67 77~96 500 500 2 12 2 III 97~116 400 400 1 8 2.4 注:a HRT为水力停留时间;b NLR为总氮负荷。 -
[1] 赵志瑞, 马斌, 张树军, 等. 高氨氮废水与城市生活污水短程硝化系统菌群比较[J]. 环境科学, 2013, 34(4): 1448-1456. [2] 闫家望. 高氨氮废水处理技术及研究现状[J]. 中国资源综合利用, 2018, 36(3): 99-101. doi: 10.3969/j.issn.1008-9500.2018.03.035 [3] 陈重军, 王建芳, 张海芹, 等. 厌氧氨氧化污水处理工艺及其实际应用研究进展[J]. 生态环境学报, 2014, 23(3): 521-527. doi: 10.3969/j.issn.1674-5906.2014.03.023 [4] 徐峥勇. 基于亚硝化、厌氧氨氧化与反硝化的脱氮耦合工艺及其控制策略研究[D]. 长沙: 湖南大学, 2011. [5] LI X, LU M Y, HUANG Y, et al. Influence of seasonal temperature change on autotrophic nitrogen removal for mature landfill leachate treatment with high-ammonia by partial nitrification-Anammox process[J]. Journal of Environmental Sciences, 2021, 102: 291-300. doi: 10.1016/j.jes.2020.09.031 [6] CHEN G, LI J, DENG H, et al. Study on Anaerobic ammonium oxidation (Anammox) sludge immobilized in different gel carriers and its nitrogen removal performance[J]. Journal of Residuals Science & Technology, 2015, 12: S47-S54. [7] WANG J X, LIANG J D, SUN L, et al. Granule-based immobilization and activity enhancement of anammox biomass via PVA/CS and PVA/CS/Fe gel beads[J]. Bioresource Technology, 2020, 309: 123448. doi: 10.1016/j.biortech.2020.123448 [8] 贾方旭, 彭永臻, 杨庆. 厌氧氨氧化菌与其他细菌之间的协同竞争关系[J]. 环境科学学报, 2014, 34(6): 1351-1361. [9] VAN DER STAR W R L, ABMA W R, BLOMMERS D, et al. Startup of reactors for anoxic ammonium oxidation: Experiences from the first full-scale anammox reactor in Rotterdam[J]. Water Research, 2007, 41(18): 4149-4163. doi: 10.1016/j.watres.2007.03.044 [10] HU B L, ZHENG P, TANG C J, et al. Identification and quantification of anammox bacteria in eight nitrogen removal reactors[J]. Water Research, 2010, 44(17): 5014-5020. doi: 10.1016/j.watres.2010.07.021 [11] BI Z, QIAO S, ZHOU J T, et al. Fast start-up of Anammox process with appropriate ferrous iron concentration[J]. Bioresource Technology, 2014, 170: 506-512. doi: 10.1016/j.biortech.2014.07.106 [12] WANG T, ZHANG H M, YANG F L, et al. Start-up of the anammox process from the conventional activated sludge in a membrane bioreactor[J]. Bioresource Technology, 2009, 100: 2501-2506. doi: 10.1016/j.biortech.2008.12.011 [13] CHEN H, HU H Y, CHEN Q Q, et al. Successful start-up of the anammox process: Influence of the seeding strategy on performance and granule properties[J]. Bioresource Technology, 2016, 211: 594-602. doi: 10.1016/j.biortech.2016.03.139 [14] 王晓霞. ASBR反应器内厌氧氨氧化的快速启动及其脱氮性能研究[D]. 青岛: 青岛大学, 2012. [15] PHAN T N, TRUONG T T V, Ha N B, et al. High rate nitrogen removal by ANAMMOX internal circulation reactor (IC) for old landfill leachate treatment[J]. Bioresource Technology, 2017, 234: 281-288. doi: 10.1016/j.biortech.2017.02.117 [16] WANG S H, Guo J B, LIAN J, et al. Rapid start-up of the anammox process by denitrifying granular sludge and the mechanism of the anammox electron transport chain[J]. Biochemical Engineering Journal, 2016, 115: 101-107. doi: 10.1016/j.bej.2016.09.001 [17] 王朝朝, 冀颖, 闫立娜, 等. 厌氧氨氧化颗粒污泥UASB反应器的快速启动[J]. 中国给水排水, 2019, 35(11): 15-20. [18] 许冬冬, 康达, 郭磊艳, 等. 厌氧氨氧化颗粒污泥研究进展[J]. 微生物学通报, 2019, 46(8): 1988-1997. [19] ZHANG Y L, HE S L, NIU Q G, et al. Characterization of three types of inhibition and their recovery processes in an anammox UASB reactor[J]. Biochemical Engineering Journal, 2016, 109: 212-221. doi: 10.1016/j.bej.2016.01.022 [20] 国家环境保护总局. 水和废水监测分析方法[M]. 4版. 北京: 中国环境科学出版社, 2002. [21] PARK, S, BAE, W. Modeling kinetics of ammonium oxidation and nitrite oxidation under simultaneous inhibition by free ammonia and free nitrous acid[J]. Process Biochemistry, 2009, 44(6): 631-640. doi: 10.1016/j.procbio.2009.02.002 [22] XU L Z J, ZHANG Q, FU J J, et al. Deciphering the microbial community and functional genes response of anammox sludge to sulfide stress[J]. Bioresource Technology, 2020, 302: 122885. doi: 10.1016/j.biortech.2020.122885 [23] 李媛. 厌氧氨氧化工艺启动和运行特性及其受抑机理研究[D]. 无锡: 江南大学, 2014. [24] STROUS M, KUENEN J G, JETTEN M S M. Key physiol-ogy of anaerobic ammonium oxidation[J]. Applied and Environmental Microbiology, 1999, 65(7): 3248-3250. doi: 10.1128/AEM.65.7.3248-3250.1999 [25] STROUS M, HEIJNEN J J, KUENEN J G, et al. The sequencing batch reactor as a powerful tool for the study of slowly growing anaerobic ammonium-oxidizing microorganisms[J]. Applied Microbiology and Biotechnology, 1998, 50(5): 589-596. doi: 10.1007/s002530051340 [26] HYOKWAN B, MINKYU C, CHANGSOO L, et al. Enrichment of ANAMMOX bacteria from conventional activated sludge entrapped in poly(vinyl alcohol)/sodium alginate gel[J]. Chemical Engineering Journal, 2015, 281: 531-540. doi: 10.1016/j.cej.2015.06.111 [27] ZHANG Z, LIU S. Insight into the overconsumption of ammonium by anammox consortia under anaerobic conditions[J]. Journal of Apply Microbiology, 2014, 117(6): 1830-1838. doi: 10.1111/jam.12649 [28] NIU Q G, HE S L, ZHANG Y L, et al. Process stability and the recovery control associated with inhibition factors in a UASB-anammox reactor with a long-term operation[J]. Bioresource Technology, 2016: 132-141. [29] FAHRBACH M, KUEVER J, MEINKE R, et al. Denitratisoma oestradiolicum gen. nov., sp. nov., a 17b-oestradiol-degrading, denitrifying betaproteobacterium[J]. International Journal of Systematic and Evolutionary Microbiology, 2006, 56: 1547-1552. doi: 10.1099/ijs.0.63672-0 [30] ZHANG Q, WU J, YE Y Y, et al. Microbial and genetic responses of anammox process to the successive exposure of different antibiotics[J]. Chemical Engineering Journal, 2020: 127576. [31] ZHOU S, ZHANG Z, SUN Z L, et al. Responses of simultaneous anammox and denitrification (SAD) process to nitrogen loading variation: Start-up, performance, sludge morphology and microbial community dynamics[J]. Science of the Total Environment, 2021, 795: 148911. doi: 10.1016/j.scitotenv.2021.148911 [32] XIA Y, WANG Y, WANG Y, et al. Cellular adhesiveness and cellulolytic capacity in Anaerolineae revealed by omics-based genome interpretation[J]. Biotechnology Biofuels, 2016, 9: 111. doi: 10.1186/s13068-016-0524-z -









 下载:
下载: