-
近年来,荧光纳米材料因在光催化、生物传感、消毒、离子检测、光电器件和污染物去除等许多领域具有广阔的应用前景而备受关注[1-4]. 荧光纳米材料包括半导体量子点、氮化碳、纳米金刚石、碳纳米管、石墨烯量子点、碳点以及各种复合材料. 含重金属的量子点具有毒性,故环保型荧光纳米材料的制备和应用成为重要的发展趋势.
氮化碳是一种非常有前途的应用材料[5],目前已广泛用于水分解、太阳能传输、污染物去除和检测等领域[6-8],一般通过高温热解工艺由富含氮的前体(如三聚氰胺,氰胺和双氰胺)制备,所得的氮化碳通常具有粒径大、水溶性差、发光性能弱等特点. 近年来,光响应性能增强的氮化碳纳米薄膜和氮化碳量子点的制备和应用受到越来越多研究者的关注[9-10]. Liu等[11]利用有机胺制备光致发光氮化碳量子点,将其作为新型类过氧化物酶,运用比色法检测H2O2和葡萄糖. Zhang等[12]采用水热合成法制备具有光氧化还原催化性能的富碳氮化碳纳米薄膜. 石墨相C3N4纳米片的制备及应用于生物成像、生物传感和离子检测也有相关报道[13-20]. Qiao等[21]报道了硒掺杂石墨氮化碳纳米薄膜的合成方法,并应用于过氧化氢和黄嘌呤比色法检测. Zheng等[22]报道了磁性氮化碳纳米片的简便合成及其在食用油样品中多环芳烃磁性固相萃取中的应用. 研究利用简单的方法合成具有不同形态的氮化碳纳米材料,拓展其应用领域是很有意义的工作.
氯(Cl2)、次氯酸(HClO)和次氯酸根离子(ClO−)具有强氧化性,常用作水的消毒剂. 水中溶解的Cl2、HClO和ClO−的总和定义为游离氯[23]. 游离氯在水中的残留浓度不宜过高,监测其在水中的含量很有必要. 游离氯的测定方法包括碘滴定法[24]、比色法[25]、化学发光法[26]、离子色谱法[27]、液相色谱法[28]、流动注射分析[29]等. 尽管每种方法都有其优点,但仍普遍存在检测灵敏度低、选择性差、使用有毒试剂或应用程序复杂等缺点,开发简便、有效和环保的游离氯测定方法显得很重要.
本研究应用简便的微波辅助溶剂热法,以柠檬酸和三聚氰胺为前驱体制备荧光氮化碳纳米材料(CNNPs),以CNNPs为荧光探针建立对游离氯的定量测定方法,并用于真实水样中游离氯的测定.
-
一水合柠檬酸(CA)、三聚氰胺和油酸均为分析纯,购自上海国药化学试剂有限公司(中国);硫酸奎宁,分析纯,购自阿拉丁工业公司(中国上海);超纯水通过Milli-Q系统(Millipore,Bedford,MA,美国)制备.其他试剂均为分析纯试剂,无需进一步纯化即可使用.
-
利用简单的一步微波辅助溶剂热法制备CNNPs. 将1.5 g CA分别和1.5、0.75、0.5、0.3 g三聚氰胺置于30 mL反应管中,加入10 mL油酸,在1200 r·min−1的磁力搅拌条件下,将混合物置于微波合成器(Anton Paar Monowave 300,奥地利)中在220 ℃下加热15 min,反应过程中压力保持在2.32 MPa. 反应完成后,反应管自然冷却至室温,收集棕色沉淀物. 将沉淀物用正己烷充分洗涤,分散在超纯水中,并以5000 r·min−1离心30 min以除去大颗粒产物. 对应产物分别命名为:CNNPs-1、CNNPs-2、CNNPs-3、CNNPs-5.
-
利用TEM(FEI Tecnai G2 F20)分析CNNPs材料的表面形貌,利用Bruker DAVINCI D8 ADVANCE衍射仪测定X射线衍射(XRD)光谱,利用Thermo ESCALAB 250XI多功能成像电子光谱仪(Thermo Fisher)测定X射线光电子能谱(XPS),利用Magna-IR 750傅里叶变换红外(FT-IR)光谱仪(Nicolet)测定FT-IR光谱,利用UV-2550分光光度计(Shimadzu)测定紫外-可见(UV-Vis)光谱,利用Cary Eclipse PL分光光度计(Varian)测定荧光光谱,使用Vario ELⅢ 元素分析仪(Elementar, Germany)测定元素组成.
-
以硫酸奎宁为参比,通过比较积分荧光强度(PL)计算CNNPs的量子产率. 将硫酸奎宁溶解在0.1 mol·L−1硫酸中,并将获得的CNNPs溶解在超纯水中(η=1.33),所测吸光度保持在0.1以下. CNNPs的量子产率由以下方程式确定:
式中,Q为量子产率,I为积分荧光强度,η为溶剂的折射率,A为吸光度,下标R表示参比样品. 硫酸奎宁在激发波长350 nm下的量子产率为0.577,0.1 mol·L−1 硫酸溶液和超纯水的折射率均为1.33.
-
实验中,CNNPs-5溶液的浓度均为2.5 μg·mL−1. 往CNNPs-5溶液中加入50 μmol·L−1的次氯酸钠,测定溶液在0—60 min内的荧光强度变化. 测定CNNPs-5溶液在添加30 μmol·L−1的次氯酸钠和未添加次氯酸钠时,荧光强度在pH 4—10范围内的变化,分别记为F和F0. 游离氯浓度检测实验中,往CNNPs-5溶液中分别添加0、2、4、6、8、10、15、30、50、60、70、80、90、100 μmol·L−1的次氯酸钠,测定425 nm处的发射荧光强度,根据3倍标准偏差规则(LOD=3Sd/s)计算检测限(LOD).
-
设置两个对照实验,在选择性响应实验中选取16种离子,包括ClO−、Cl−、
ClO−3 、ClO−4 、Br−、BrO−3 、NO−2 、NO−3 、HPO2−4 、PO3−4 、SO2−3 、SO2−4 、Ca2+、Ag+、Cu2+和Pb2+,浓度均为100 μmol·L−1,分别加入到CNNPs-5水溶液中,并记录425 nm处的荧光强度响应. 其中阴离子添加的是其对应的钠盐,Ca2+、Ag+、Cu2+和Pb2+添加的分别是CaCl2、AgNO3、CuCl2和Pb(NO3)2. 在另一个对照干扰实验中,将100 μmol·L−1的ClO−溶液和300 μmol·L−1的上述离子加入CNNPs-5水溶液中,未添加干扰离子的溶液作为对照组,分别记录荧光猝灭响应. -
采集不同位置的2份自来水样品,自来水样品不经处理,添加3种不同浓度的游离氯溶液,运用上述检测方法对所含游离氯浓度进行检测,并计算相对标准偏差.
-
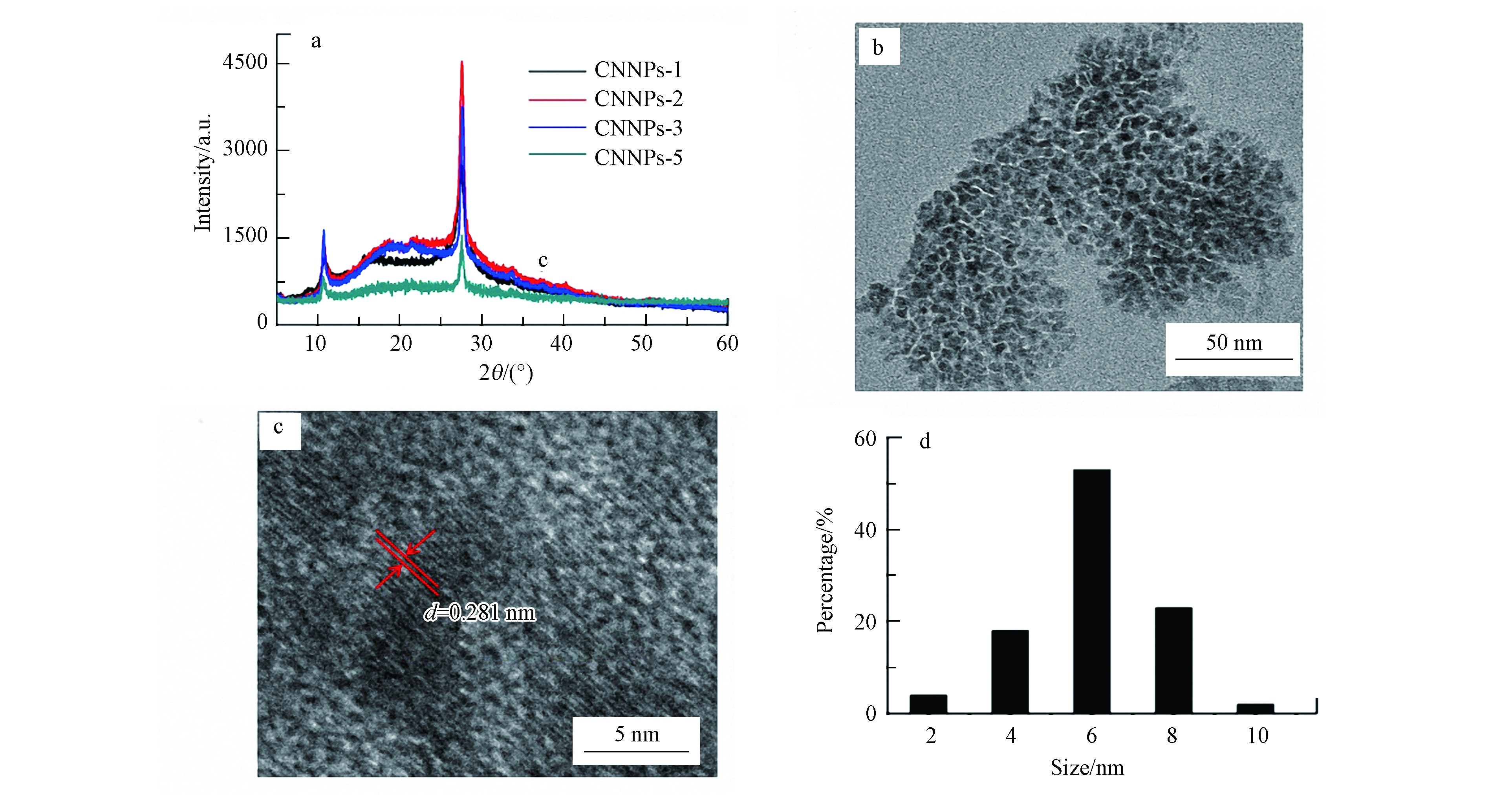
本研究制备的CNNPs样品XRD谱图如图1(a)所示。可以看出,各样品的谱峰均集中在27.5°,与石墨相氮化碳的相关报道一致[5,30],表明成功制备了CNNPs. 柠檬酸的用量越大,所制备的CNNPs水溶性增加,即相对其他3种合成CNNPs材料(CNNPs-1、CNNPs-2、CNNPs-3),CNNPs-5的水溶性最佳,后续选取CNNPs-5作进一步表征和实验. CNNPs-5的微观形貌和粒径分布如图1(b)—(d)所示:CNNPs-5为准球形粒子;具有明显的晶格条纹,测得晶格参数为0.281 nm,与石墨相氮化碳的(002)晶面一致[17];随机测定TEM视野下CNNPs-5材料的50个颗粒粒径大小,结果显示粒径主要分布在4.0—6.0 nm的范围内.
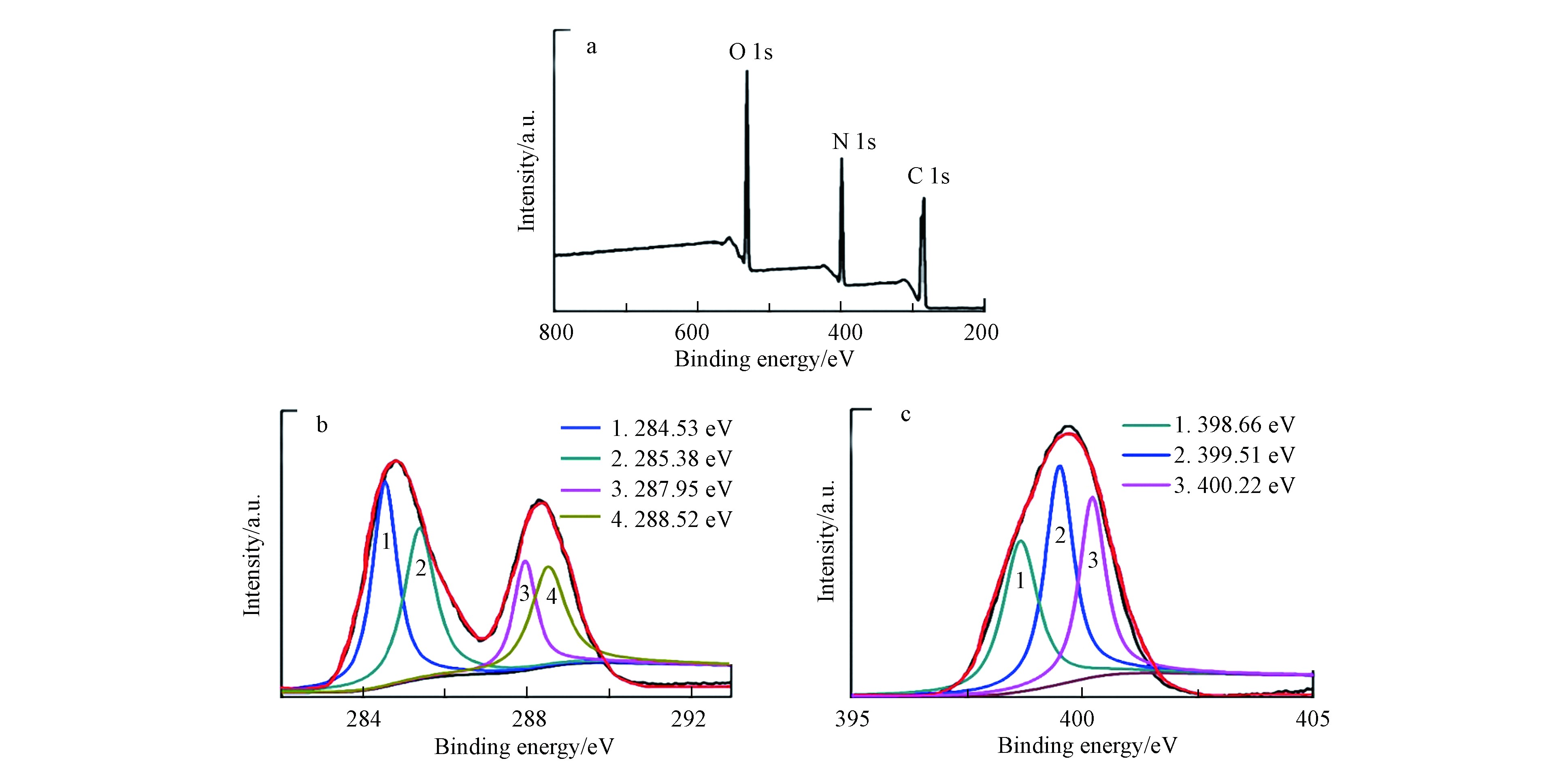
CNNPs-5的XPS谱图(图2a)在285.4、398.4、531.3 eV处有3个峰,可分别归属于C-1s、N-1s和O-1s.C-1s光谱可分解为284.53、285.38、287.95、288.52 eV处的4个峰(图2b),表明存在4种类型的碳键:sp2 C=C或sp3 C—C,C—N或C—O,sp2 C=N,C=O. N-1s光谱的分解表明存在3种类型的氮键:C—N—C(398.66 eV)、N—(C)3(399.51 eV)和C—N—H(400.22 eV)(图2c)[31].
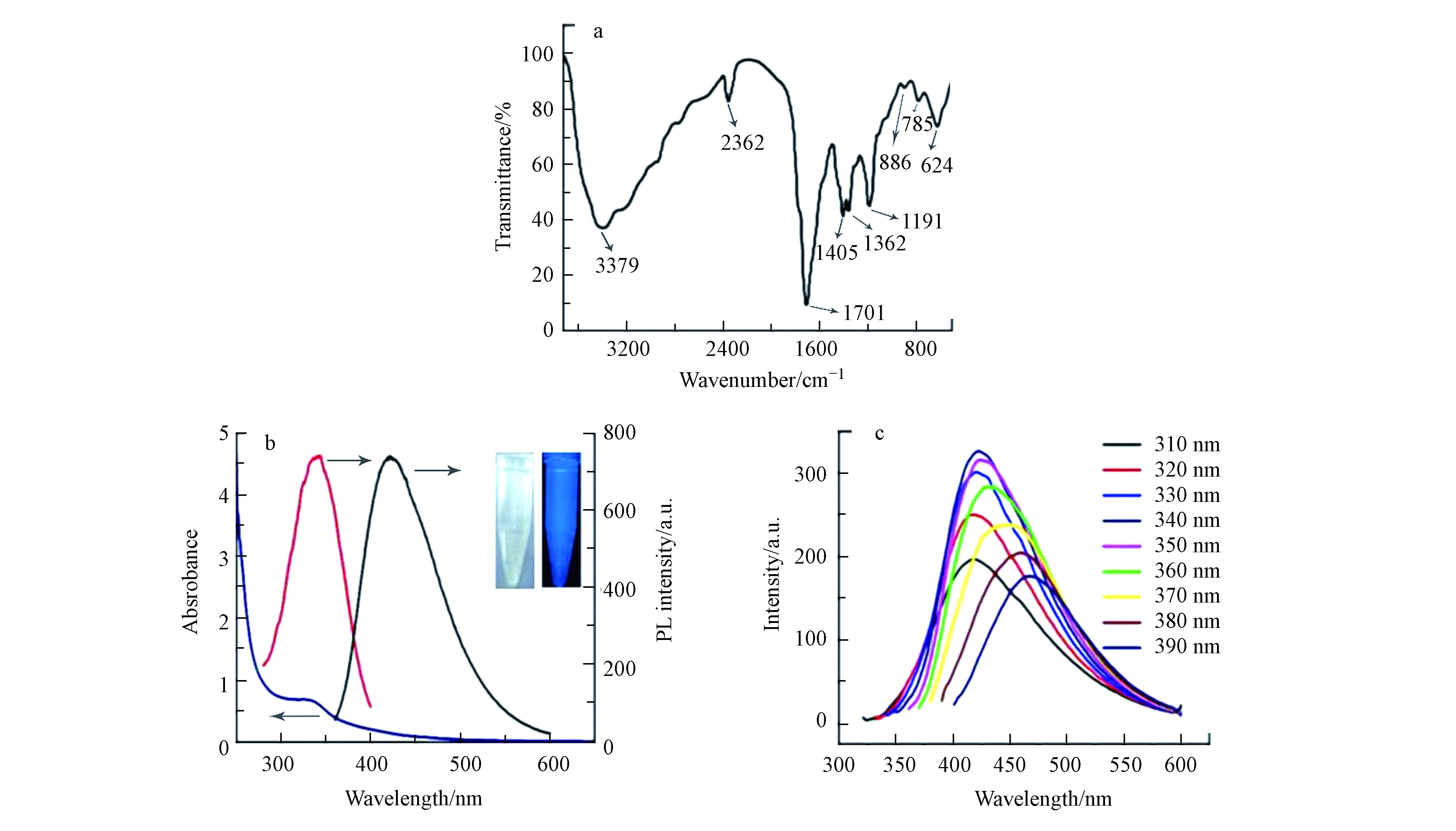
FT-IR光谱(图3a)在1405和1362 cm−1处显示两个特征峰,可归因于芳族C=N伸缩振动. 指纹区域中785 cm−1处的特征峰为s-三嗪环的呼吸振动模式[32],1701 cm−1处的强峰归因于不对称的C=O和C=N的伸缩振动,3379 cm−1处的宽峰归因于N—H和O—H的伸缩振动.
紫外可见光谱(图3b)显示存在一个以335 nm为中心的特征峰,可归因于表面激发态能量的捕获[33],吸收带延伸至550 nm. 激发依赖荧光光谱(图3c)显示,随激发波长在310—350 nm范围内增大,发射波长基本保持不变;随激发波长在350—390 nm范围内增大,发射波长由425 nm红移至460 nm. 随激发波长的增大,荧光强度先增大后减小,在340 nm的激发波长下,425 nm处可观察到最强发射峰,与氮化碳纳米粒子的UV-vis吸收特征相符. 使用硫酸奎宁作为参照,计算得CNNPs-5的量子产率为15.1 %. CNNPs-5在365 nm紫外光下显示出亮蓝色的荧光(图3b,插图).
元素分析结果表明,产物元素组成(质量分数)包含33.11 %的碳,38.46 %的氮,4.15 %的氢和24.28 %的氧. 可以看出,CNNPs-5含有丰富的氧和氮,碳化程度相对较低,含氧和氮的官能团(如羟基和氨基)可能位于石墨氮化碳单元的边缘,这些官能团使产物具有良好的水溶性. Messina等[34]认为富氮碳纳米点的荧光源于壳表面的电子态,可认为本研究所获得的CNNPs-5为功能性氮化碳纳米粒子.
从上述表征结果分析,本研究合成方法具有反应温度较低、操作简便、回收率高、后处理简单等优点,借助微波场的反应时间相对较短,提供了一种合成水溶性氮化碳纳米粒子的简单方法. 合成的材料既具有氮化碳的结构,同时表面丰富的官能团赋予了纳米材料很好的水溶性.
-
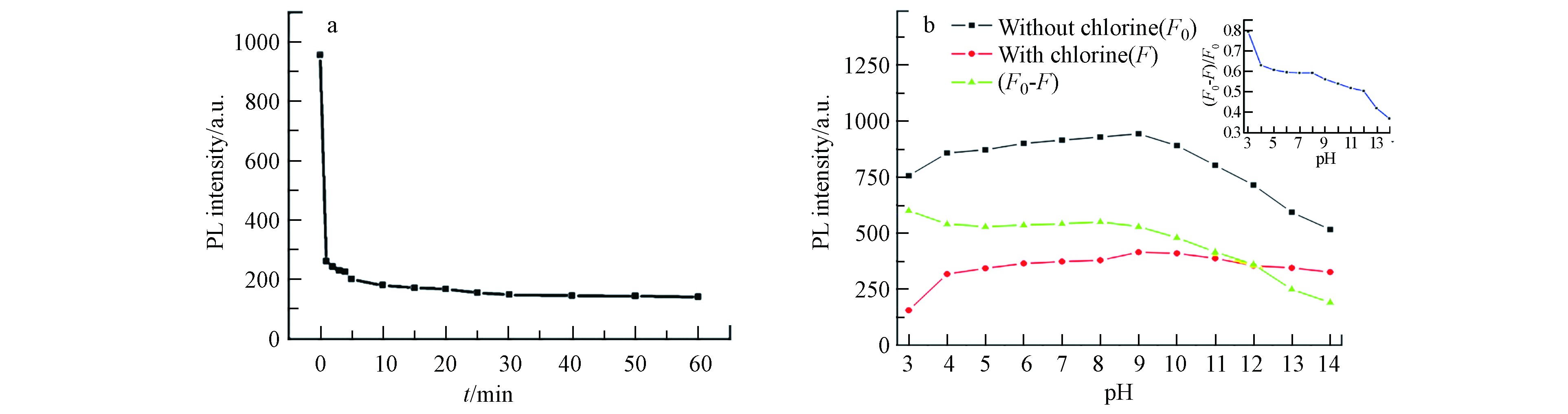
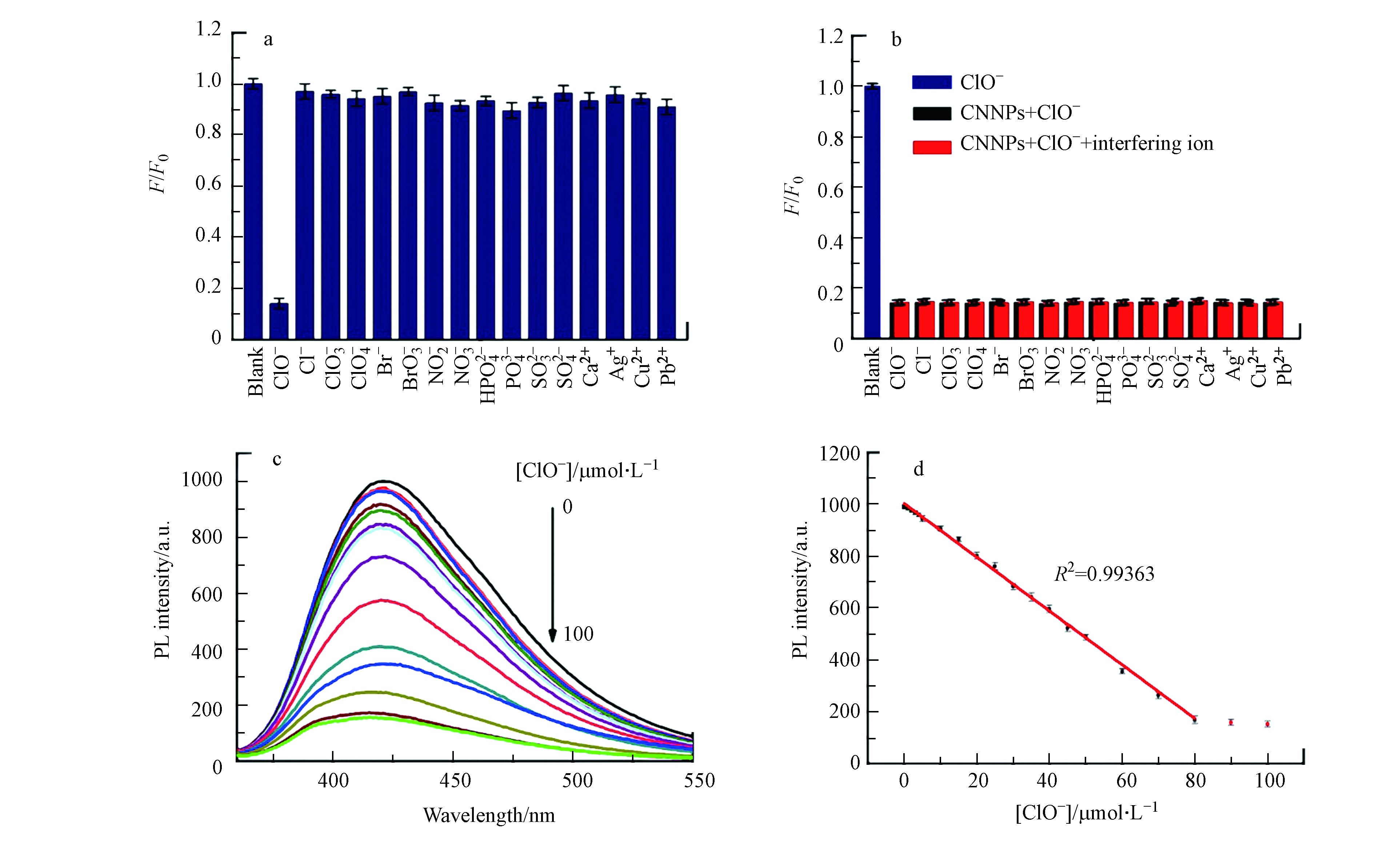
将获得的CNNPs-5用于游离氯的检测,结果如图4a所示,在425 nm处,最初1 min内,50 μmol·L−1次氯酸钠浓度下CNNPs-5的荧光强度猝灭率约为86%. 在接下来的60 min内,荧光强度基本保持稳定. 该结果表明,游离氯对所制备的CNNPs的荧光猝灭非常迅速,可用于溶液中游离氯的快速测定.
图4b显示了次氯酸盐作用下,不同pH值对CNNPs-5荧光响应的影响. 在没有游离氯的情况下,CNNPs-5的荧光强度在4—10的pH范围内基本保持不变,但在较高酸性(pH=3)或较大碱性(pH>10)的情况下明显降低. 在游离氯存在情况下,荧光随pH值变化的趋势与无游离氯时的相似,但在酸性介质中,游离氯对CNNPs-5荧光的猝灭程度比在碱性介质中更为显著. pH值会影响HClO、ClO−和Cl2之间的化学平衡,在酸性至弱碱性溶液(pH=3—9)中,游离氯主要为HClO;在强碱性溶液(pH>9)中,游离氯主要以ClO−的形式存在[35]. HClO的氧化能力比ClO−强,因此氧化可能是荧光猝灭的主要原因. 基于这些实验,该测定方法适用于酸性至弱碱性环境.
为了评估CNNPs-5测定游离氯方法的选择性,进行了两个对照实验(pH=7.0). 其中选择性响应实验分别添加100 μmol·L−1与生物和环境密切相关的离子,实验结果如图5a所示,在加入ClO−的情况下可观察到明显的荧光猝灭,而其他离子的影响可忽略不计. 在另一个干扰实验中,将ClO−和选择性响应实验离子加入CNNPs-5水溶液的实验结果如图5b(红色条),未添加干扰离子的溶液作为对照组(黑色条,图5b). 实验表明,其他共存离子对ClO−猝灭的影响可以忽略. 这两个对照实验表明,所制备的CNNP-5对ClO−具有高度选择性.
基于以上CNNPs-5的荧光猝灭结果,将不同浓度的ClO−添加到CNNPs-5水溶液中,随着ClO−浓度的增加,荧光强度逐渐降低. 图5c表明,在0—80 μmol·L−1的范围内,荧光强度与ClO−的浓度之间存在良好的线性关系(R2=0.9936). 图5d显示添加各种浓度ClO−后CNNPs-5的荧光发射光谱. 根据3倍标准偏差规则(LOD=3Sd·s−1)计算得检测限(LOD)为0.22 μmol·L−1. 如表1所示,所获得的LOD较利用其他荧光探针的线性范围更宽,或检测限更低[23,36-41]. 表明该分析方法对ClO−离子具有出色的选择性和灵敏度. 不同批次合成的CNNPs-5对ClO−离子的响应一致.
-
自来水样品在未经任何预处理的情况下,掺入不同浓度的ClO−离子,运用上述方法进行分析. 结果如表2所示,从不同位置采集的2份自来水样品中的游离氯浓度分别为1.12、1.09 μmol·L−1,样品的回收率为96.3%—107.5%,相对标准偏差(RSD)小于3.70%(n=3),表明该方法适用于天然水样品的检测.
-
本研究建立了一种简单的利用微波辅助溶剂热法,在适中的反应温度下,利用柠檬酸和三聚氰胺在油酸介质中制备获得荧光氮化碳纳米材料(CNNPs),所制备的CNNPs具有中等的荧光量子产率(15.1%),简单纯化处理可直接用于测定水中游离氯浓度. 该方法简便、快速、低成本且环境友好,测试结果与比色法测试结果一致,可用于检测实际样品中的游离氯.
微波辅助法制备荧光氮化碳纳米材料及其在游离氯检测中的应用
Microwave-assisted preparation of fluorescent carbon nitride nanoparticles and their application in the detection of free chlorine
-
摘要: 在220 ℃下借助微波辅助溶剂热法,利用柠檬酸和三聚氰胺制备荧光氮化碳纳米材料(CNNPs),通过多种分析技术表征了制备的CNNPs。基于游离氯能快速猝灭CNNPs的荧光,将CNNPs做为荧光探针用于游离氯的定量测定,其荧光猝灭速度小于1 min;选择性响应实验和干扰实验表明该测定方法具有较好的灵敏度和选择性,游离氯的线性响应范围为0—80 μmol·L−1,检测限低至0.22 μmol·L−1。该方法适用于实际水样中游离氯的检测。Abstract: Fluorescent carbon nitride nanoparticles (CNNPs) were prepared from citric acid and melamine by a facile microwave-assisted solvothermal method at moderate reaction temperature (220 ℃). The obtained CNNPs were characterized by multiple analytical techniques. Free dissolved chlorine can quench the fluorescence of the CNNPs with excellent sensitivity and selectivity. The quenching speed was rather quick (less than 1 min), selective response experiments and interference experiments showed that this determination method had excellent sensitivity and selectivity. The linear response range of free chlorine was from 0 to 80 μmol·L−1. The limit of detection was as low as 0.22 μmol·L−1. We conclude that this method is applicable to detect free chlorine in real water samples.
-
Key words:
- carbon nitride nanoparticles /
- fluorescent quenching /
- free chlorine /
- melamine /
- citric acid
-
近年来,农村生活污水排放量不断增大,随之而引起的水体污染问题也越来越突出[1]。由于农村污水产生面广且分散,水质和水量波动大,常规的好氧生物或生态处理工艺往往无法达到令人满意的处理效果[2-3]。而厌氧生物处理技术以其较低的能耗、较少的污泥产生量和较好的能源回收潜力越来越引起研究者的关注[4]。
厌氧生物处理技术主要依靠厌氧微生物的生物降解作用,实现污水中污染物的去除[5]。厌氧折流板反应器(ABR)和厌氧滤池(AF)是2种常用的污水厌氧处理技术,具有处理效率高、结构简单等优点,因而备受研究者的关注[6-7]。
由于农村污水污染物浓度低,厌氧微生物生长速度缓慢且对环境条件较为敏感,故处理农村污水的厌氧反应器往往需要较长的启动时间。杨春等[8]利用填充有无纺布填料的ABR处理农村污水,在反应器运行至第60 d时才完成启动,在启动期的最高COD去除率为66%。赵丽等[9]等利用接种了厌氧颗粒污泥的ABR处理模拟畜禽养殖废水,反应器的启动期长达64 d。MOUSSAVI等[10]利用未接种污泥的上流式化粪池处理农村生活污水,运行81 d才完成启动。由于处理农村污水的厌氧反应器的启动时间过长,使反应器在实际污水处理的应用中往往受到一定限制。因此,如何对用于农村污水处理的厌氧反应器进行有针对性地设计以实现反应器的快速启动非常重要。
本研究构建了基于厌氧折流板和厌氧滤池工艺集成的强化复合厌氧反应器。通过考察反应器的COD去除率、各格室pH和Eh及CH4产生量变化等,研究其快速启动特性。该研究结果可为强化复合厌氧反应器在农村污水处理的应用提供参考。
1. 材料与方法
1.1 强化复合厌氧反应器的构建
通过有机结合填料型厌氧折流板反应器和厌氧滤池各自的优势,构建出强化复合厌氧反应器。利用厌氧活性污泥法和厌氧生物膜法的协同作用,强化反应器内的传质和微生物反应,提高污水中污染物的处理效率。
如图1所示,强化复合厌氧反应器分为填料型厌氧折流区单元和厌氧滤池区单元。强化复合厌氧反应器有效容积为120 L,长、宽、高分别为80、20和103 cm。反应器由上部的折流区单元和下部的滤池区单元串联而成。其中,厌氧折流区单元内设4个格室,上、下流格室宽度比为3∶1,4个格室上部均悬挂立体弹性填料,填料的中心绳为聚酰胺材质,丝条材质为聚丙烯。厌氧滤池区以3 mm孔径的有机玻璃板为滤料支撑板,其上填充砾石和陶粒轻质颗粒滤料。其中的砾石粒径为5~8 mm、陶粒粒径为4~6 mm,两者的填充率为40~50%。滤池区单元中间设倾斜布水板,底部设置锥形槽,折流区单元流失至滤池区单元的污泥可在锥形槽中有效沉积,并回流至折流区单元或排出,以避免滤池区单元的堵塞。待处理污水首先进入折流区单元,折流区单元未能降解的污染物在滤池区单元内进一步降解。
厌氧折流区单元的4个格室将不同类型的厌氧微生物分格室生长和代谢,实现产酸相和产甲烷相的分离。在厌氧折流区的4个格室均填充立体弹性填料,截留污水中的颗粒物及微生物絮体,使污泥不发生流失,确保各格室内有足够的微生物量;同时,格室型设计可为絮体在填料中的聚集和密度增大创造条件,有利于颗粒污泥的形成。厌氧滤池区单元则依靠滤料的截留、吸附以及厌氧微生物的生物降解作用,提高污水中污染物的去除效果,保证反应器出水水质和增强抗冲击负荷能力。
强化厌氧反应器的厌氧折流区单元和厌氧滤池区单元为上下串联形式,结构紧凑,能够大大减小整体占地面积。通过厌氧折流区污泥层和填料的截留和沉淀作用,污水中的大部分悬浮物得以去除,从而能够保证厌氧滤池区单元填料不发生堵塞。厌氧滤池区单元与厌氧折流区单元发挥协同作用,实现污水中污染物的高效去除。
1.2 接种污泥与进水水质
复合厌氧反应器采用实际农村生活污水作为进水,进水水质参数:pH为6.5~8.5、COD为187~380 mg·L−1、
NH+4 -N浓度为30~60 mg·L−1、TP浓度为3.0~7.0 mg·L−1。接种污泥取自北京市某城市污水厂二沉池,经厌氧驯化、培养成熟后使用。培养期间加入一定的营养液并对上清液进行外排,不定时对污泥进行搅拌。污泥接种量为反应器有效容积的35%左右。接种污泥参数:pH为6.9、SVI为68.71 mL·g−1、MLVSS浓度为5 643.52 mg·L−1、MLSS浓度为9 282.10 mg·L−1。
1.3 强化复合厌氧反应器的启动
将厌氧驯化、培养成熟的污泥边搅拌边用蠕动泵均匀接种至反应器不同格室,并通入农村生活污水,静置2 d后,反应器开始连续运行。反应器启动采用维持进水浓度不变、逐步缩短HRT的方法,HRT由最初的40 h逐渐缩短至33、24 h;进水COD在187~380 mg·L−1、容积负荷为0.11~0.38 kg·(m3·d)−1(以COD计)。在反应器的启动期间,温度维持在(35±1) ℃,不进行排泥。
1.4 检测指标及分析方法
各项检测指标均参照《水和废水监测分析方法》[11]进行测定。其中,COD采用重铬酸钾-紫外分光光度法测定;MLSS 和MLVSS浓度采用重量法测定。甲烷体积采用湿式气体流量计计量法测定;pH采用FiveEasy Plus台式pH计测定;Eh值采用哈希HQ11D氧化还原电位检测仪测定。
2. 结果与讨论
2.1 强化复合厌氧反应器对COD的去除效果
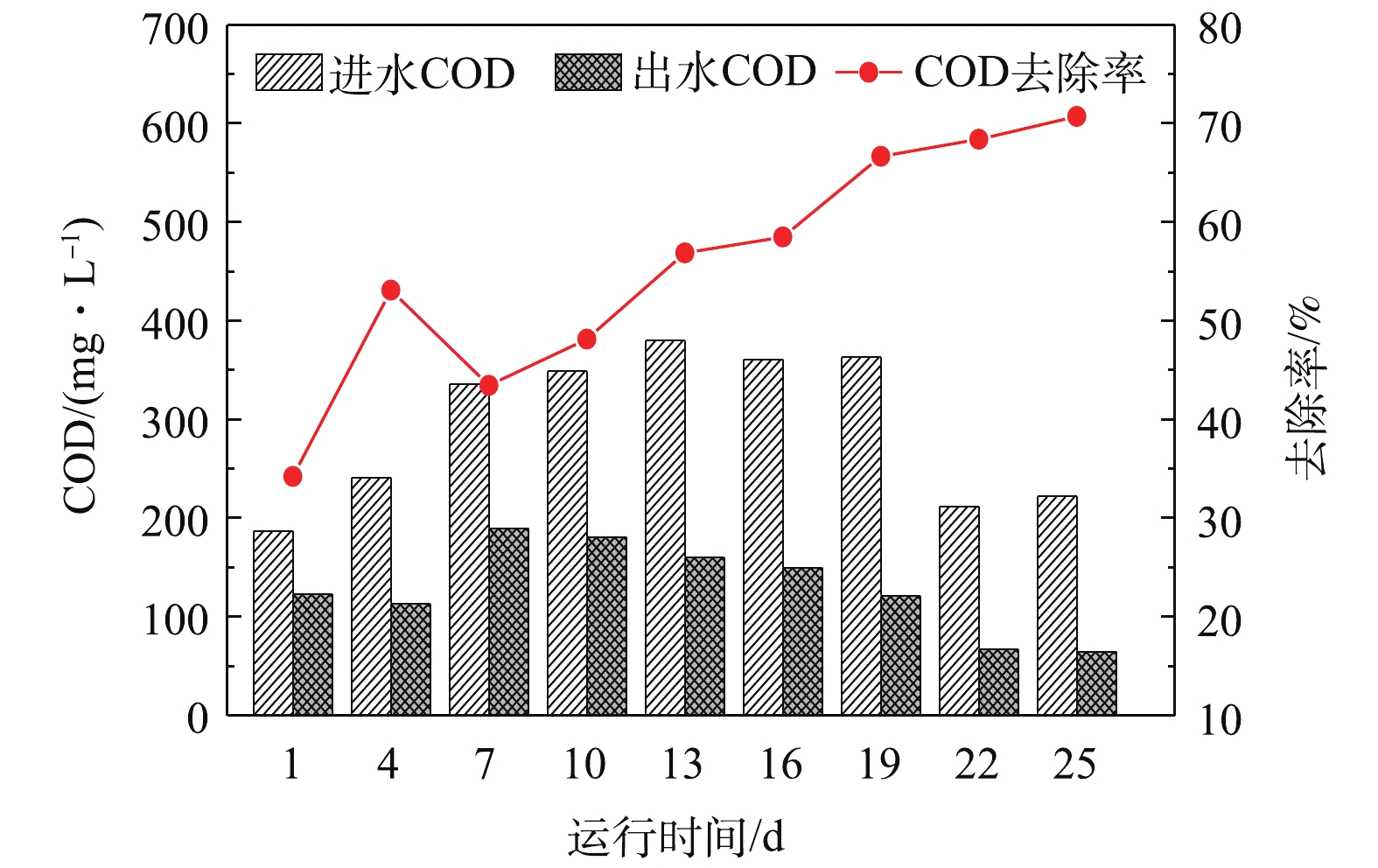
复合厌氧反应器启动期的进、出水COD和COD去除率变化如图2所示。可以看出,进水COD在187~380 mg·L−1。其中,在启动初期(1~10 d),反应器出水COD相对较高(113~190 mg·L−1);到了启动中期(11~19 d),反应器出水COD逐渐降低,去除率逐渐升高,到第19天,COD去除率已达66.67%;到了启动后期(20~25 d),反应器出水COD进一步减小,在第25天时,反应器出水COD降至65 mg·L−1,去除率达70.7%,且趋于稳定。可见,在反应器启动初期,由于接种污泥尚未适应反应器中特殊的厌氧环境,优势微生物种群数量和活性均不高,对COD的去除率也相对较低;随着反应器运行期的延长,水解酸化菌和产甲烷菌快速增殖、活性增加,对COD的去除率不断升高,并逐渐趋于稳定。
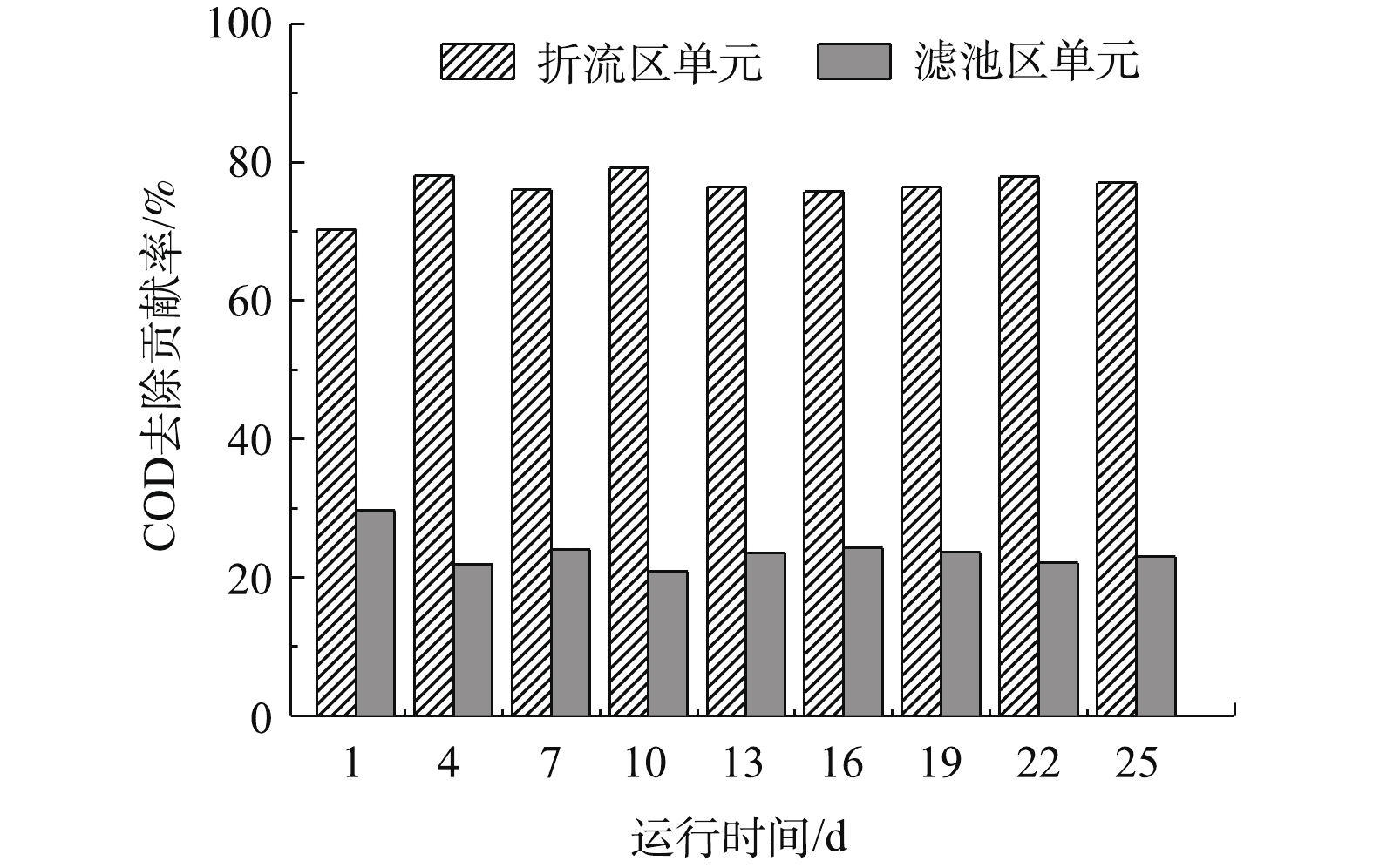
强化复合厌氧反应器对COD的去除,主要基于折流区单元的生物降解作用及滤池区单元的截留、吸附和滤料表面生物膜层的生物降解作用。在反应器启动期,折流区和滤池区两个不同单元对进水COD的去除贡献率变化结果见图3。可以看出,折流区单元对COD的去除贡献率为70.3~79.2%,平均为76.4%;而滤池区单元对COD的去除贡献率仅为20.8~29.7%,平均为23.6%。这表明,在反应器的启动期,折流区单元对整体COD的去除起主导作用。分析其原因可知,农村污水COD相对较低,经折流区单元处理后的出水COD更低。对于较低COD的进水,滤池区单元的滤料挂膜难,微生物和底物基质之间传质驱动力低,从而导致对COD的生物降解作用较小,滤池区单元对COD的去除主要基于滤料的截留、吸附等物化作用[12]。因此,滤池区单元对COD的去除率相对较低且稳定。
2.2 强化复合厌氧反应器启动期不同格室pH的变化
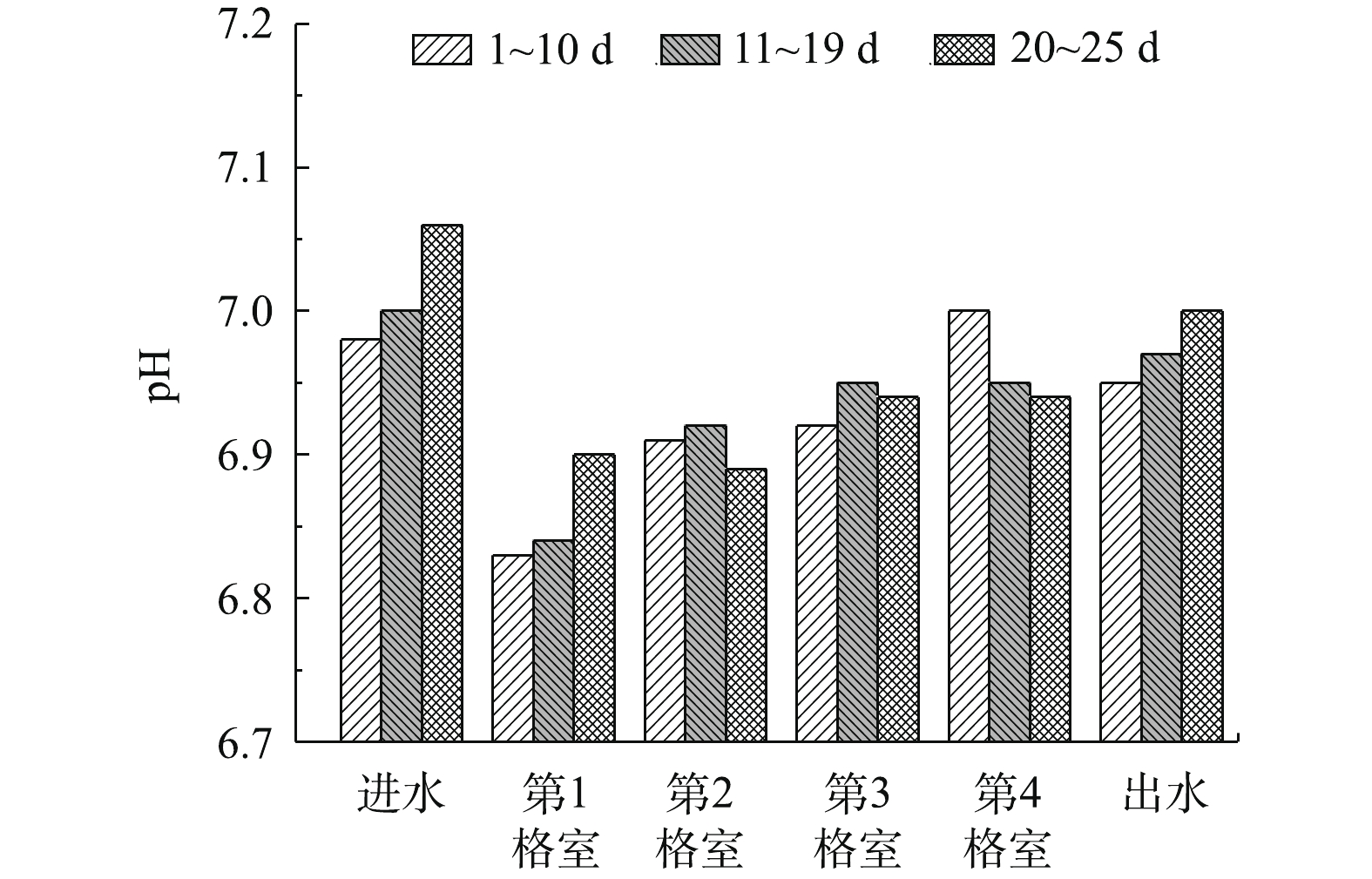
pH对厌氧微生物的生长及活性可产生重要影响,进而影响整个厌氧处理过程[13]。因此,pH是反映启动期厌氧反应器运行正常与否的一个重要指标。在启动期,反应器不同格室pH变化如图4所示。可以看出,在启动期,反应器不同格室的pH为6.8~7.0,在厌氧产甲烷菌生长的最适pH范围内[13-14]。在污水厌氧生物处理过程中,甲烷产生的最佳pH范围为6.6~7.6,如果pH降至6.5以下,则会严重抑制甲烷的生成[14]。
在启动初期和中期(1~19 d),反应器前端(第1、2格室)的pH(6.8~6.9)小于后端(第3、4格室)的pH(6.9~7.0)。这是因为,在启动期,反应器的前端格室进水COD较高,COD发生水解酸化,产生较多量的挥发性脂肪酸(VFAs),且产酸菌和产甲烷菌之间没有建立代谢平衡,VFAs的产生速率大于消耗速率,致使前端格室内VFAs积累,pH降低。在启动后期(20~25 d),反应器后端格室的pH变化渐小,但前端格室特别是第一格室的pH有一定幅度的增加。这表明,到了反应器启动后期,不同格室内的产酸和产甲烷反应逐渐形成动态平衡,产甲烷菌能有效消耗产酸过程产生的VFAs。
2.3 强化复合厌氧反应器启动期不同格室Eh的变化
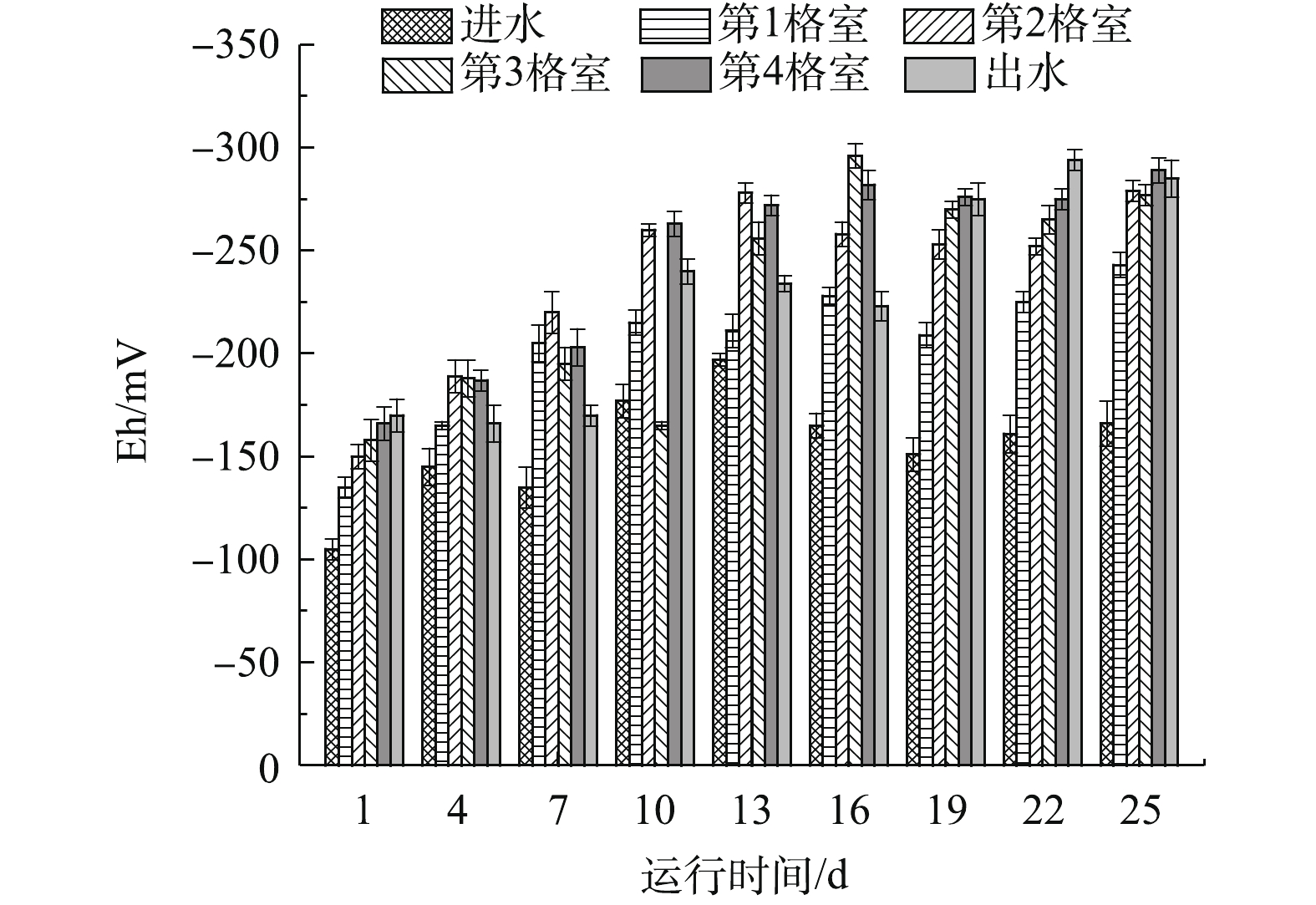
Eh是表征污水厌氧生物处理系统的一个综合性指标,既可以反映污水有机物的可生物降解潜力,也可以指示反应器中水解酸化相和产甲烷相的分布[15-17]。在启动期,反应器4个格室Eh的变化如图5所示。可以看出,在启动期,反应期进水Eh在(−105±5)~(−197±3) mV、出水Eh在(−166±9)~(−294±5) mV。其中,在启动初、中期(1~19 d),反应器Eh整体呈下降趋势,各格室Eh范围为(−135±5)~(−296±6) mV,且沿程方向逐渐降低;在启动后期(20~25 d),反应器Eh变化幅度减小,出水Eh在(−285±9)~(−294±5) mV。这表明,在启动后期,反应器中的产甲烷菌逐渐适应了系统内的环境,其产甲烷反应和水解酸化菌的产酸反应趋于平衡。在本研究中,Eh沿程降低的趋势符合厌氧系统水解酸化相和产甲烷相的分布特点[15]。VONGVICHIANKUL等[18]发现,厌氧过程产酸阶段的Eh在(-284±33) mV、产甲烷阶段的Eh为(-336±29) mV。
2.4 强化复合厌氧反应器启动期CH4产生量的变化
CH4产生量也是衡量污水厌氧处理反应器运行状况性的重要指标。研究了反应器启动期CH4产生量的变化,结果见图6。可以看出,在启动期,反应器的CH4产生量随着有机负荷率(OLR)的增大而增大。自运行的第4天起,反应器开始产生少量CH4;到第10天,进水OLR为0.10 kg·(m3·d)−1,CH4产生量达116 mL·d−1;到了第19天,OLR升高至0.17 kg·(m3·d)−1,而CH4产生量达309 mL·d−1。在反应器启动初期,厌氧微生物增殖缓慢且活性较低,特别是产甲烷菌的增殖速度低,因而限制了产甲烷过程,导致反应器的CH4产生量较低;随着反应器启动期的延长,特别是到了启动后期,产甲烷菌数量和活性均有了较大的提高,导致CH4产生量增加并趋于稳定。
2.5 强化复合厌氧反应器折流区单元填料挂膜情况
分别对反应器启动初期(第5天)和启动期末(第25天)折流区单元的填料挂膜情况进行了分析,结果见图7。可以看出,在反应器启动初期(第5天),填料丝条表面附着一层絮状污泥,污泥呈棕黄色,污泥量少,且缺乏光泽。在反应器启动期末(第25天),填料表面附着的污泥量增加,相邻填料丝之间生物膜彼此连接,厚度增加,絮体和污泥床层中有气泡生成,同时水面有一层白色浮膜形成,这表明折流区单元内污泥生长和填料挂膜情况良好。
同时,对折流区单元4个格室的污泥层高度和不同高度处的污泥VSS浓度进行了分析。发现折流区单元4个格室的污泥层高度为24~32 cm,不同高度处的污泥VSS浓度为6.7~23.5 g·L−1。其中,不同格室污泥层高度和VSS浓度大小顺序均为第1格室>第2格室>第3格室>第4格室。
2.6 小结(标题请左顶格排,后面文字请换行排) 综合分析反应器在启动期进水COD的去除率、CH4产生量、不同格室pH和Eh变化,可以得出:强化复合厌氧反应器能够在25 d成功实现启动。与常规农村污水处理厌氧反应器相比,强化复合厌氧反应器启动时间较短。RENUKA等[19]开发的厌氧折流板-滤池反应器(PABFR)共5个格室,前端3格室设置为活性污泥单元,后端2格室填充塑料鲍尔环,反应器的启动时间为61 d。其启动时间长的原因可能是,前端3个格室中有可能发生部分活性污泥的流失,从而导致格室中生物量的减少。
3. 结论
1)就本研究构建的基于填料型厌氧折流和厌氧滤池技术的新型强化复合厌氧反应器而言,在控制反应温度为(35±1) ℃条件下,通过逐渐缩短HRT的方式,反应器可在25 d成功实现快速启动。
2)强化复合厌氧反应器对进水COD的去除主要基于折流区单元的生物降解和滤池区单元的截留、吸附和部分生物降解作用。其中,折流区单元对整体COD的去除起主要作用,而滤池区单元对COD的去除贡献相对较小。
3)在启动后期,强化复合厌氧反应器的CH4产生量趋于稳定,不同格室内的pH和Eh趋于平衡,污泥生长和填料挂膜情况良好。
-
图 3 CNNPs-5的IR光谱(a),UV-Vis光谱和光致发光光谱(b),激发依赖发射光谱(c)(b)中插图分别是在日光(左)和365 nm紫外光(右)下拍摄的照片
Figure 3. The IR spectrum (a), UV-Vis and photoluminescence spectrum (b), and excitation-dependent emission spectrum (c) of the CNNPs-5. The two illustrations in (b) were photos taken under daylight (left) and 365 nm ultraviolet light (right).
表 1 不同方法检测ClO−的性能比较
Table 1. Comparison of performance of detecting ClO− by different methods
表 2 自来水样品中游离氯的测定
Table 2. Determination of free chlorine in tap water samples
样品Samples 添加量/(µmol·L−1)Added 总氯/(µmol·L−1)Total found 样品值/(µmol·L−1)Found 回收率/%Recovery 相对标准偏差/%RSD 1 0.1 1.21 1.12 96.3 3.40 0.5 1.62 100.6 3.10 1.0 2.10 97.6 1.61 2 0.1 1.20 1.09 107.5 2.70 0.5 1.61 103.4 3.70 1.0 2.06 96.8 2.05 -
[1] LIM SY, SHEN W, GAO Z. Carbon quantum dots and their applications [J]. Chemical Society Reviews, 2015, 44: 362-381. doi: 10.1039/C4CS00269E [2] 余致汐, 贺南南, 陈欢, 等. 甲壳素复合石墨相氮化碳的制备及光催化杀菌性能 [J]. 环境化学, 2020, 39(5): 1271-1278. doi: 10.7524/j.issn.0254-6108.2019081206 YU Z X, HE N N, CHEN H, et al. Preparation of chitin composite graphite phase carbonitride and its photocatalytic sterilization performance [J]. Environmental Chemistry, 2020, 39(5): 1271-1278(in Chinese). doi: 10.7524/j.issn.0254-6108.2019081206
[3] El-KHATIB A M, YOUSEFN S, GHATASS Z F, et al. Synthesized silver carbon nanotubes and zinc oxide nanoparticles and their ability to remove methylene blue dye [J]. Journal of Nanoneuroscience, 2019, 56: 1-16. [4] YUE L, LI H, SUN Q, et al. Red-Emissive ruthenium-containing carbon dots for bioimaging and photodynamic cancer therapy [J]. ACS Applied Nano Materials, 2020, 3: 869-876. [5] CHAMORRO-POSADA P, DANTE R C, VAZQUEZ-CABO J, et al. Experimental and theoretical investigations on a CVD grown thin film of polymeric carbon nitride and its structure [J]. Diamond and Related Materials, 2021, 111: 108169. doi: 10.1016/j.diamond.2020.108169 [6] LIU J, LIU Y, LIU N, et al. Metal-free efficient photocatalyst for stable visible water splitting via a two-electron pathway [J]. Science, 2015, 347: 970-974. doi: 10.1126/science.aaa3145 [7] ZHU J, XIAO P, LI H, et al. Graphitic carbon nitride: synthesis, properties, and applications in catalysis [J]. ACS Applied Materials & Interfaces, 2014, 6: 16449-16465. [8] 章家立, 李阳, 彭小明, 等. g-C3N4在水环境污染物去除和检测方面的应用研究进展 [J]. 华东交通大学学报, 2019, 36(1): 109-116. ZHANG J L, LI Y, PENG X M, et al. On applications of graphitic carbon nitride in pollutant removal and detection in water environment [J]. Journal of East China Jiaotong University, 2019, 36(1): 109-116(in Chinese).
[9] ZHANG J, CHEN Y, WANG X. Two-dimensional covalent carbon nitride nanosheets: synthesis, functionalization, and applications [J]. Energy & Environmental Science, 2015, 8: 3092-3108. [10] 马贺成, 刘建军, 于迎春, 等. 二维石墨相氮化碳纳米片的制备及其在光催化领域的研究进展 [J]. 应用化学, 2019, 36(3): 259-268. doi: 10.11944/j.issn.1000-0518.2019.03.180241 MA H C, LIU J J, YU Y C, et al. Research progress in preparation and photocatalysis of two-dimensional graphitic carbon nitride nanosheets [J]. Chinese Journal of Applied Chemistry, 2019, 36(3): 259-268(in Chinese). doi: 10.11944/j.issn.1000-0518.2019.03.180241
[11] LIU S, TIAN J, WANG L, et al. A general strategy for the production of photoluminescent carbon nitride dots from organic amines and their application as novel peroxidase-like catalysts for colorimetric detection of H2O2 and glucose [J]. RSC Advances, 2012, 2: 411-413. doi: 10.1039/C1RA00709B [12] ZHANG P, LI X, SHAO C, et al. Hydrothermal synthesis of carbon-rich graphitic carbon nitride nanosheets for photoredox catalysis [J]. Journal of Materials Chemistry A, 2015, 3: 3281-3284. doi: 10.1039/C5TA00202H [13] ASAITHAMBI S, SAKTHIVEL P, KARUPPAIAH M, et al. The bifunctional performance analysis of synthesized Ce doped SnO2/g-C3N4 composites for asymmetric supercapacitor and visible light photocatalytic applications [J]. Journal of Alloys and Compounds, 2021: 158807. [14] LIU Y, WANG Q, LEI J, et al. Anodic electrochemiluminescence of graphitic-phase C3N4 nanosheets for sensitive biosensing [J]. Talanta, 2014, 122: 130-134. doi: 10.1016/j.talanta.2014.01.018 [15] RONG M, LIN L, SONG X, et al. Fluorescence sensing of chromium(VI) and ascorbic acid using graphitic carbon nitride nanosheets as a fluorescent “switch” [J]. Biosensors & Bioelectronics, 2015, 68: 210-217. [16] 陈珠灵, 林敏秀, 宋志平, 等. 基于石墨相氮化碳量子点直接荧光猝灭法检测碘离子的研究 [J]. 光谱学与光谱分析, 2019, 39(7): 2029-2033. CHEN Z L, LIN M X, SONG Z P, et al. Study of direct fluorescencence quenching of graphitic carbon nitride for the detection of iodine ions [J]. Spectroscopy and Spectral Analysis, 2019, 39(7): 2029-2033(in Chinese).
[17] ZHANG H, HUANG Y, HU S, et al. Fluorescent probes for “off-on” sensitive and selective detection of mercury ions and L-cysteine based on graphitic carbon nitride nanosheets [J]. Journal of Materials Chemistry C, 2015, 3: 2093-2100. doi: 10.1039/C4TC02394C [18] ABDOLMOHAMMAD-ZADEH H, RAHIMPOUR E. A novel chemosensor based on graphitic carbon nitride quantum dots and potassium ferricyanidechemiluminescence system for Hg(Ⅱ) ion detection [J]. Sensors and Actuators B: Chemical, 2016, 225: 258-266. doi: 10.1016/j.snb.2015.11.052 [19] HAN J, ZOU HY, GAO MX, et al. A graphitic carbon nitride based fluorescence resonance energy transfer detection of riboflavin [J]. Talanta, 2016, 148: 279-284. doi: 10.1016/j.talanta.2015.10.038 [20] XIE H, DONG J, DUAN J, et al. Magnetic nanoparticles-based immunoassay for aflatoxin B1 using porous g-C3N4 nanosheets as fluorescence probes [J]. Sensors and Actuators B:Chemical, 2019, 278: 147-152. doi: 10.1016/j.snb.2018.09.089 [21] QIAO F, WANG J, AI S, et al. As a new peroxidase mimetics: The synthesis of selenium doped graphitic carbon nitride nanosheets and applications on colorimetric detection of H2O2 and xanthine [J]. Sensors and Actuators B: Chemical, 2015, 216: 418-427. doi: 10.1016/j.snb.2015.04.074 [22] ZHENG H B, DING J, ZHENG S J, et al. Facile synthesis of magnetic carbon nitride nanosheets and its application in magnetic solid phase extraction for polycyclic aromatic hydrocarbons in edible oil samples [J]. Talanta, 2016, 148: 46-53. doi: 10.1016/j.talanta.2015.10.059 [23] DONG Y, LI G, ZHOU N, et al. Graphene quantum dots as a green and facile sensor for free chlorine in drinking water [J]. Analytical Chemistry, 2012, 84: 8378-8382. doi: 10.1021/ac301945z [24] ZHOU M, LI T, ZU M, et al. Membrane-based colorimetric flow-injection system for online free chlorine monitoring in drinking water [J]. Sensors and Actuators B:Chemical, 2021, 327: 128905. doi: 10.1016/j.snb.2020.128905 [25] MA Z, CHEN X, WANG C, et al. A novel ratiometric fluorescence probe for hypochlorite detection and its application in cell imaging [J]. Journal of Molecular Structure, 2020, 1221: 128812. doi: 10.1016/j.molstruc.2020.128812 [26] CLAVER J B, MIRON M C V, CAPITAN-VALLVEY L F. Determination of hypochlorite in water using a chemiluminescent test strip [J]. Analytica Chimica Acta, 2004, 522: 267-273. doi: 10.1016/j.aca.2004.06.051 [27] CHEN P, WEI W Z, YAO S Z. Different valency chlorine species analysis by non-suppressed ion-chromatography with double cell quartz crystal detector [J]. Talanta, 1999, 49: 571-576. doi: 10.1016/S0039-9140(99)00041-7 [28] WATANABE T, IDEHARA T, YOSHIMURA Y, et al. Simultaneous determination of chlorine dioxide and hypochlorite in water by high-performance liquid chromatography [J]. Journal of Chromatography A, 1998, 796: 397-400. doi: 10.1016/S0021-9673(97)01009-1 [29] POBOZY E, PYRZYNSKA K, SZOSTEK B, et al. Flow-injection spectrophotometric determination of free residual chlorine in waters with 3, 3′-dimethylnaphtidine [J]. Microchemical Journal, 1995, 51: 379-86. doi: 10.1006/mchj.1995.1044 [30] ZHOU J, YANG Y, ZHANG C. A low-temperature solid-phase method to synthesize highly fluorescent carbon nitride dots with tunable emission [J]. Chemical Communications, 2013, 49: 8605-8607. doi: 10.1039/c3cc42266f [31] LIN L, RONG M, LU S, et al. A facile synthesis of highly luminescent nitrogen-doped graphene quantum dots for the detection of 2, 4, 6-trinitrophenol in aqueous solution [J]. Nanoscale, 2015, 7: 1872-1878. doi: 10.1039/C4NR06365A [32] CAO X, MA J, LIN Y, et al. A facile microwave-assisted fabrication of fluorescent carbon nitride quantum dots and their application in the detection of mercury ions [J]. Spectrochimica Acta Part A, 2015, 151: 875-880. doi: 10.1016/j.saa.2015.07.034 [33] ANIKUMAR P, WANG X, CAO L, et al. Toward quantitatively fluorescent carbon-based “quantum” dots [J]. Nanoscale, 2011, 3: 2023-2027. doi: 10.1039/c0nr00962h [34] MESSINA F, SCIORTINO L, POPESCU R, et al. Fluorescent nitrogen-rich carbon nanodots with an unexpected β-C3N4 nanocrystallinestructure [J]. Journal of Materials Chemistry C, 2016, 4: 2598-2605. doi: 10.1039/C5TC04096E [35] LIU J, SHANGGUAN M, ZENG X, et al. Phosphorescent iridium (Ⅲ) complex for efficient sensing of hypochlorite and imaging in living cells [J]. Analytical Biochemistry, 2020, 592: 113573. doi: 10.1016/j.ab.2019.113573 [36] SHIRAISHI Y, YAMADA C, TAKAGI S, et al. Fluorometric and colorimetric detection of hypochlorous acid and hypochlorite by a naphthalimide–dicyanoisophorone conjugate [J]. Journal of Photochemistry and Photobiology A:Chemistry, 2021, 406: 112997. doi: 10.1016/j.jphotochem.2020.112997 [37] NING Y, CUI J, LU Y, et al. De novo design and synthesis of a novel colorimetric fluorescent probe based on naphthalenone scaffold for selective detection of hypochlorite and its application in living cells [J]. Sensors and Actuators B:Chemical, 2018, 269: 322-330. [38] WU H, ZHANG W, WU Y, et al. A 7-diethylaminocoumarin-based chemosensor with barbituric acid for hypochlorite and hydrazine [J]. Microchemical Journal, 2020, 159: 105461. doi: 10.1016/j.microc.2020.105461 [39] ZHANG Y M, FANG H, ZHU W, et al. Ratiometric fluorescent sensor based oxazolo-phenazine derivatives for detect hypochlorite via oxidation reaction and its application in environmental samples [J]. Dyes and Pigments, 2020, 172: 107765. doi: 10.1016/j.dyepig.2019.107765 [40] RHA C J, LEE H, KIM C. Development of an azo-naphthol-based probe for detecting hypochlorite (ClO−) via color change in aqueous solution [J]. Inorganic Chemistry Communications, 2020, 121: 108244. doi: 10.1016/j.inoche.2020.108244 [41] WANG H, ZHANG L, GUO X, et al. Comparative study of Cl, N-Cdots and N-Cdots and application for trinitrophenol and ClO− sensor and cell-imaging [J]. Analytica Chimica Acta, 2019, 1091: 76-87. doi: 10.1016/j.aca.2019.09.019 -





 下载:
下载: