-
氨氮作为水体中的主要污染物之一,容易使水体富营养化,导致“水华”和“赤潮”发生,严重威胁生态环境[1]。硝化和反硝化作用是生物脱氮的两个重要步骤。硝化作用是在好氧条件下氨氧化细菌(ammonia-oxidizing bacteria,AOB)和亚硝酸盐氧化细菌(nitrite-oxidizing bacteria,NOB)将氨氮转化为亚硝酸盐和硝酸盐的过程,反硝化作用是通过反硝化细菌将硝酸盐和亚硝酸盐还原成气态氮的过程。生物脱氮因经济高效、易于操作和绿色无二次污染等优点成为研究热点。但是,由于硝化细菌生长缓慢、同化效率低和环境敏感性高,并且高氨氮废水中存在大量的游离氨会对传统生物脱氮法中的微生物活性产生抑制作用,因此,保持细菌的活性,维持生物量是影响脱氮效率的关键因素[2]。
群体感应(quorum sensing,QS)是指微生物能自发合成并释放信号分子来感知周围细菌密度,当信号分子的浓度到达一定阈值后被细胞感知并调控相关基因的表达,从而调节微生物的一些行为,如生物膜的形成、生物发光和胞外多糖产生等[3-4]。已知的信号分子根据其化学种类的不同分为三大类:革兰氏阴性菌分泌的酰基高丝氨酸内酯(N-acyl-homoserine-lactones,AHLs)、革兰氏阳性菌分泌的寡肽(autoinducter peptide,AIP)和能同时调控革兰氏阴性菌和阳性菌实现细菌种间交流的呋喃硼酸二酯(AI-2)。酰基高丝氨酸内酯环是AHLs信号分子的共同特征,酰基侧链的长度、碳链骨架饱和度和取代基的不同导致了AHLs的多样性和特异性[5]。硝化功能细菌属于革兰氏阴性菌,种内产生的信号分子为AHLs,因此,本实验主要研究AHLs类信号分子对硝化细菌的影响。
1997年BATCHELOR等[6]首次发现Nitrosomonas europaea存在群体感应现象,其中高细胞密度培养比低细胞密度培养会产生和积累更多AHLs,并且外源添加3-oxo-C6-HSL信号分子有利于饥饿状态下的N. europaea恢复生长。最近的研究表明,硝化细菌可以通过QS调节自身的行为,例如提高细菌的活性、促进生物膜的生长以及调节胞外聚合物(extracellular polymeric substances,EPS)的合成,从而更好地聚集,占用更多资源和空间,保持环境中的种群优势[6-8]。在硝化反应器的混合培养中,投加不同种类的AHLs可发现,AHLs通过改变EPS的组成防止生长缓慢的硝化细菌流失,并且3-oxo-C6-HSL和C6-HSL有利于促进细菌的附着并提高脱氮效率[7]。同样,将硝化颗粒污泥中含有AHL的细胞提取物添加到硝化活性污泥中,处理30 d后,提高了细胞的粘附和聚集性,提高了微生物的活性,最大氨氮去除率提高了83.3%[8]。前期调研发现,C7-HSL是少见的酰基侧链C原子为奇数的信号分子且在污水处理中研究较少,而C8-HSL和3-oxo-C10-HSL是脱氮过程中的典型信号分子。因此,本研究添加C7-HSL、C8-HSL和3-oxo-C10-HSL到硝化系统中,通过观察污泥生长特性、硝化性能的变化以及EPS成分的改变,研究信号分子对处理高氨氮负荷污水的影响。
-
AHLs类信号分子N-Heptanoyl-L-homoserine lactone (C7-HSL)、N-Octanoyl-L-homoserine lactone (C8-HSL)和N-(3-oxodecanoyl)-L-homoserine lactone (3-oxo-C10-HSL) 购买自美国sigma-aldrich公司,并储存在−20 ℃。实验所用试剂无特殊说明均为分析纯。
-
本实验污泥取自武汉市沙湖污水处理厂二沉池,经曝气后添加到序批式反应器(sequencing batch reactor, SBR)中,并逐步提高氨氮浓度来驯化富集脱氮功能细菌。SBR的有效容积为18 L,循环周期为8 h(进水0.25 h,曝气搅拌6.5 h,静沉0.5 h,出水0.25 h,静置0.5 h),每周期进出水体积为9 L。接种初期,污泥总悬浮固体浓度(mixed liquor suspended solids,MLSS)为3.2 g·L−1,初始污泥沉降比(sludge settling velocity, SV)为24%,
NH+4 -N降解效率为69.65%。运行60 d后,进水NH+4 -N质量浓度从初始的30 mg·L−1逐步提高到200 mg·L−1,反应器中出水的NH+4 -N和NO−2 -N质量浓度均低于1 mg·L−1,而NO−3 -N逐渐累积,表明硝化细菌已成功富集。实验用水为人工合成污水,每次配水加入NaHCO3使pH维持在8.0~8.3,具体配方[9]见表1。 -
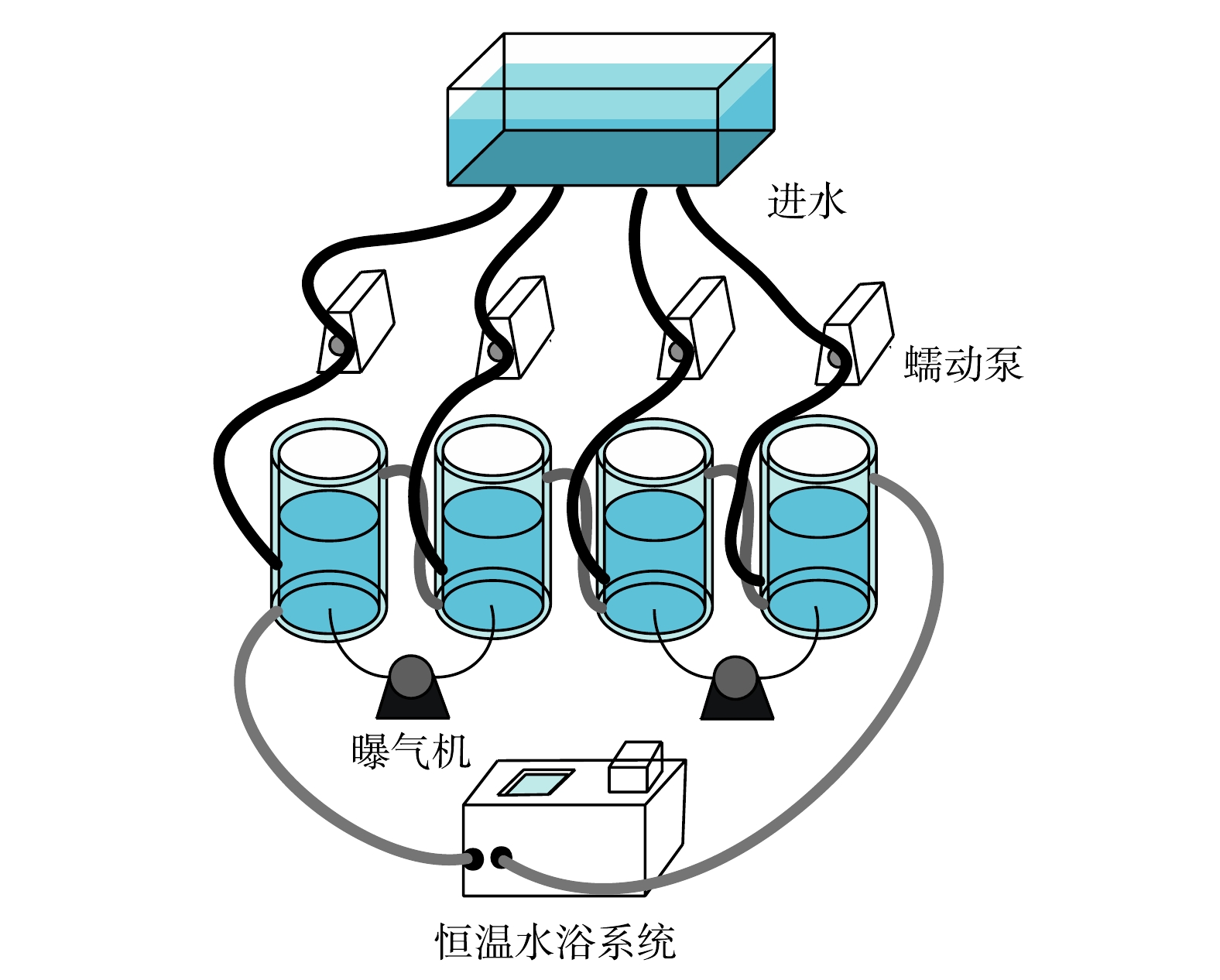
将SBR中的活性污泥分别接种到体积为1 L的4个SBR中(图1),分别为空白组、C7-HSL组、C8-HSL组和3-oxo-C10-HSL组,以相同条件运行40 d。恒温水循环系统设置为25 ℃,控制DO在2.0左右,进水pH维持在8.0~8.1,出水pH维持在7.0~7.1。每周期12 h(进水1 h,曝气搅拌9 h,静沉出水1 h,休息1 h),每周期进出水500 mL,每天排泥大约3%,进水配方见表1。初始MLSS为3.52 g·L−1,初始进水
NH+4 -N质量浓度为200 mg·L−1,在第5、9、15天分别提高NH+4 -N质量浓度至250、300、400 mg·L−1,每天分别加入0.5 μmol·L−1信号分子。每2 d监测出水NH+4 -N、NO−2 -N、NO−3 -N、TN,以及定时测量pH、蛋白质、多糖及TOC的浓度变化来分析各类信号分子对硝化活性污泥的影响。在反应器运行稳定后,第35天,每隔1 h测量反应器中NH+4 -N的质量浓度以分析信号分子对硝化污泥NH+4 -N降解的影响。 -
实验中MLSS、混合液挥发性悬浮固体浓度(mixed liquid volatile suspended solids,MLVSS)、出水悬浮物(effluent suspended solids,ESS)、TN、
NH+4 -N、NO−3 -N、NO−2 -N的质量浓度均按照《水和废水监测分析方法》测定[10]。TOC的测定采用TOC分析测试仪(multi N/C 2100,德国耶拿),DO和pH分别采用溶解氧仪(HQ40d,哈希)和pH计(PB-10,赛多利斯)测定。 -
EPS的提取采用高速离心法[11],分为松散结合型EPS (loosely-bond EPS,LB-EPS)和紧密结合型EPS (tightly-bond EPS,TB-EPS)。蛋白质的测定采用SK3501 BCA 改良型试剂盒(上海生工,中国)。多糖的测定为苯酚-浓硫酸法,具体方法参照DUBOIS等[12]的研究。TB-EPS的检测采用荧光光度计(F-7000 FL Spectrophotometer,日本)测量三维荧光光谱(fluorescence excitation-emission matrix, EEM),光谱设置条件如下:激发波长(Ex) 200~450 nm,步长5 nm;发射波长(Em) 280~550 nm,步长5 nm;狭缝宽度为5 nm,扫描速度2 400 nm·min−1。
-
利用固相萃取(solid-phase extraction,SPE)技术对样品中的AHLs进行浓缩,具体操作遵循LI等[13]的方法。AHL的检测参考胡惠秩[14]的方法。对于AHL定量,构建了5~100 nmol·L−1的基质匹配标准曲线,经计算C7-HSL、C8-HSL和3-oxo-C10-HSL的加标回收率分别为(98.82±4.21)%、(100.00±5.56)%、(97.65±6.85)%。
-
每次从每个反应器各取3个平行样,测量结果取平均值,用SPSS软件(R26.0.0.0)分析数据的差异性与相关性。游离氨(free ammonia,FA)与游离亚硝酸(free nitrous acid,FNA)可以表征其对NOB的抑制作用,FA和FNA一般根据式(1)和式(2)进行计算;在活性实验中,氨氮的消耗速率(
VNH+4 )按照式(3)进行计算。式中:CFA为游离氨质量浓度,mg·L−1;CFNA为游离亚硝酸质量浓度,mg·L−1;
Ct,NH3 为总亚硝酸盐质量浓度,mg·L−1;T为温度,℃。式中:
VNH+4 为消耗氨氮的速率,mg·(g·h)−1;CNH+4 为消耗氨氮的质量浓度,mg·L−1;M为污泥浓度,g·L−1;t为时间,h。 -
经过40 d的运行,4组SBR中的硝化污泥均得到了一定程度的增长。如表2所示,与空白组相比,添加了信号分子反应器的MLSS显著增加(P<0.05),增长率大约在20%~50%,其中C7-HSL组的MLSS增加的最多,达到(3.76±0.15) g·L−1,其增长量在1.24 g·L−1左右,大约是空白组增长量的5倍。出水悬浮物ESS可反映活性污泥的沉降能力与结构稳定性,实验组的ESS均比空白组低,空白组最高为0.035 g·L−1,C7-HSL组最低为0.025 g·L−1。计算MLVSS/MLSS可以反映硝化污泥中生物量的比例。结果表明,C7-HSL组的MLVSS/MLSS值最高,为0.764。比较各组平均生长速率(以MLSS计),实验组较空白组平均生长速率显著增加(P<0.05),C7-HSL组增加最明显,为(0.169±0.022) g·(L·d)−1,比空白组高出35.20%,C8-HSL组和3-oxo-C10-HSL组也明显高于空白组9.60%和10.40%。LI等[7]添加C6-HSL和3-oxo-C6-HSL,使得微生物的生长速率分别提高至0.260 g·(L·d)−1和0.227 g·(L·d)−1,几乎是空白组的2倍,同时提高了NH4+-N降解率。同样地,WU等[8]在硝化活性污泥中添加从硝化颗粒污泥中提取的含AHL的细胞提取物,经过30 d的培养后,污泥增长速率增加了0.01 g·(L·d)−1。本研究结果印证了LI和WU的研究中添加信号分子后污泥平均生长速率提高和氨氮降解效率提高的结论,但生长速率的结果有所不同。这种差异可能是因信号分子浓度的不同造成的,LI等[7]每天投加的信号分子浓度为2 μmol·L−1,WU等[8]的细胞提取物里含有的信号分子浓度比较低。综上所述,添加信号分子可以明显促进微生物的生长,提高微生物的生长速率,其中C7-HSL信号分子的提升效果最显著。
-
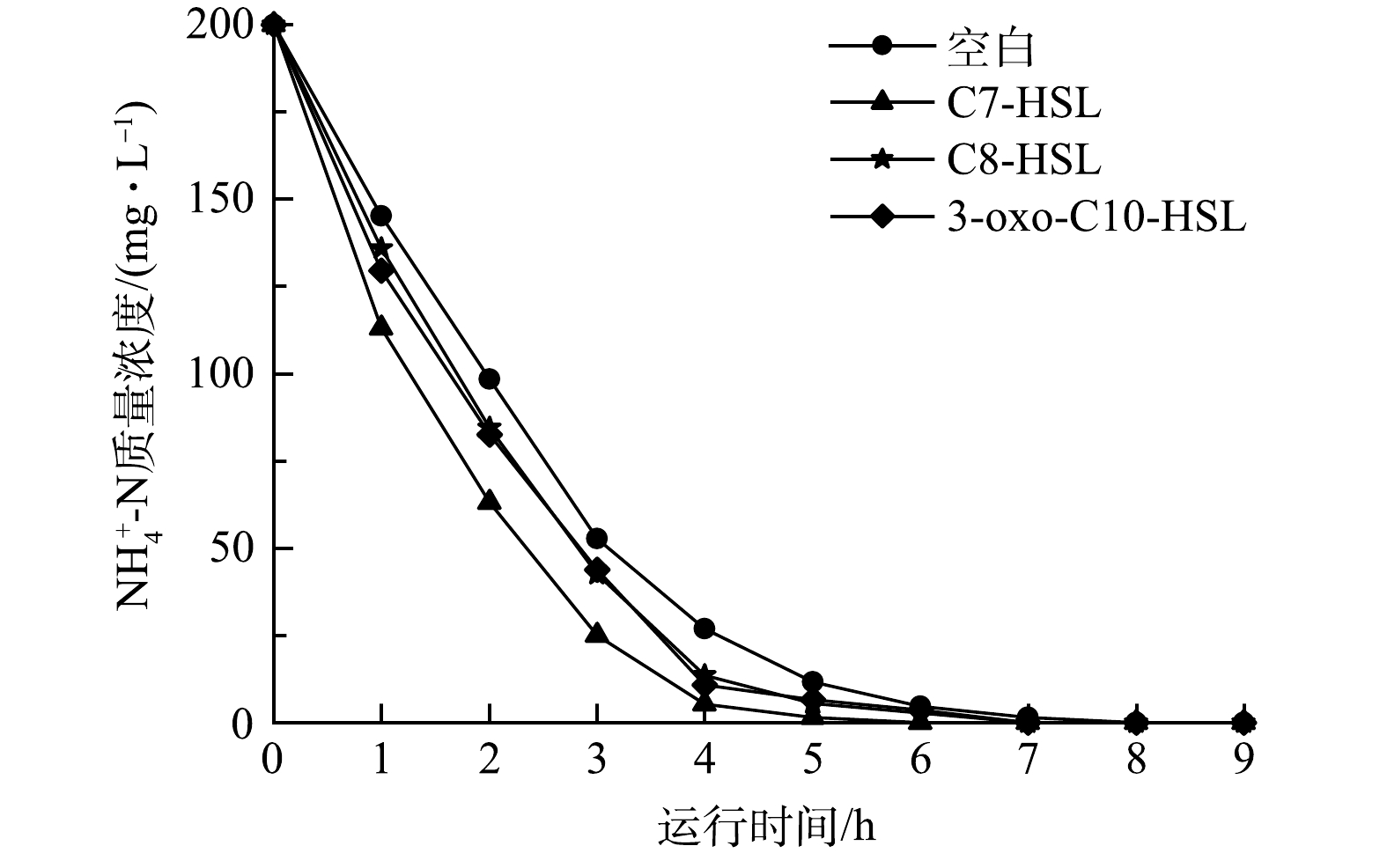
由图2可以看出,在小试实验初期,进水
NH+4 -N质量浓度为200 mg·L−1,运行第1天各组NH+4 -N的降解率较相近,均在75%左右,与接种污泥的NH+4 -N降解率(>95%)相比有一定差距。这可能是由于污泥适应环境需要一定的时间。到第3天,空白组和实验组的NH+4 -N降解率均显著增加(P<0.05),达到98%以上。实验第5天,将NH+4 -N质量浓度提高到250 mg·L−1,各组NH+4 -N降解率均在92%左右,无显著差异。第7天空白组和实验组的NH+4 -N降解率在98%左右,依旧无显著差异;在第9天提高进水NH+4 -N质量浓度到300 mg·L−1,空白组、C7-HSL组、C8-HSL组和3-oxo-C10-HSL组NH+4 -N的降解率分别为88.09%、93.85%、89.98%和90.12%。可以看出,添加信号分子提高了NH+4 -N的降解率,其中C7-HSL组效果最显著。第15天,进水NH+4 -N质量浓度提高到了400 mg·L−1,第17天,C7-HSL组NH+4 -N的降解率达到99%,但空白组的NH+4 -N的降解率仅为87.42%,直到第23天,空白组的NH4+-N的降解率才达到99%,比C7-HSL组NH+4 -N的降解率达到99%的时间延迟了6 d。C8-HSL组和3-oxo-C10-HSL组在第19天NH+4 -N的降解率达到99%,比C7-HSL组延迟了2 d。在23 d以后,空白组和实验组NH+4 -N的降解率基本维持在99%以上。结果表明,添加信号分子有助于缩短系统达到稳定的时间。值得注意的是,在第15天,进水
NH+4 -N质量浓度提高到400 mg·L−1后,除C7-HSL组,其他组的NO−2 -N逐渐积累,NO−3 -N逐渐减少。C8-HSL组和3-oxo-C10-HSL组NO−2 -N的积累趋势较空白组缓慢,但随着反应器的运行,3组NO−2 -N的积累量逐渐趋同,在第33天,出水NO−2 -N的质量浓度均大约在320 mg·L−1。C7-HSL组的NOB,经过6 d逐渐适应环境,反应器出水中几乎没有NO−2 -N的积累。通过FA与FNA表征其对NOB的抑制作用,如表3所示,由于进水NH+4 -N质量浓度高,FA在反应开始就抑制NOB,但除C7-HSL组,由于NO−2 -N的积累,FNA对NOB的抑制越来越严重。以上数据说明,C7-HSL、C8-HSL和3-oxo-C10-HSL信号分子有利于提高NOB活性,但是C8-HSL和3-oxo-C10-HSL较C7-HSL相比,对NOB活性提高有限,不足以使其应对更高的NO−2 -N负荷。在第35天时,每隔1 h测量每个反应器中的
NH+4 -N质量浓度,对NH+4 -N在一个运行周期的降解速率进行研究,结果如图3所示。第1 h内,实验组NH+4 -N的降解量均比空白组高,其中降解最多的是C7-HSL组,降解了(87.02±1.06) mg·L−1,比空白组降解量高59%左右,C8-HSL组和3-oxo-C10-HSL组降解率相近,大约为34%。考虑到各组MLSS不同,计算各组单位MLSS降解NH+4 -N的量,空白组、C7-HSL组、C8-HSL组和3-oxo-C10-HSL组分别为19.69、23.14、21.03和22.36 mg·(g·h)−1,C7-HSL组NH+4 -N降解效率最高,比空白组高出17.52%。同时,对比NH+4 -N降解到达95%的所需的时间, C7-HSL组比空白组提前2 h,比C8-HSL组和3-oxo-C10-HSL组提前1 h。NH+4 -N降解效率的差异表明信号分子可以增强AOB的活性,其中C7-HSL组的效果最好,3-oxo-C10-HSL组效果次之。此外,通过氮平衡的计算,系统中约50%的氮随着出水排出,氮损失在8%~12%。因为氮源是微生物生长所必须的物质,推测此部分氮被细菌自身生长繁殖所消耗。实验中空白组的出水总氮高于实验组,这可能是信号分子提高了微生物的生长速率,导致更多的氮被用于微生物的生长[17]。高NH4+-N负荷下,NH4+-N降解效率的提高,可能与在信号分子的作用下MLSS的增长和微生物活性增强有关,使得系统的稳定性得到加强,缩短了系统达到稳定所需的时间。
-
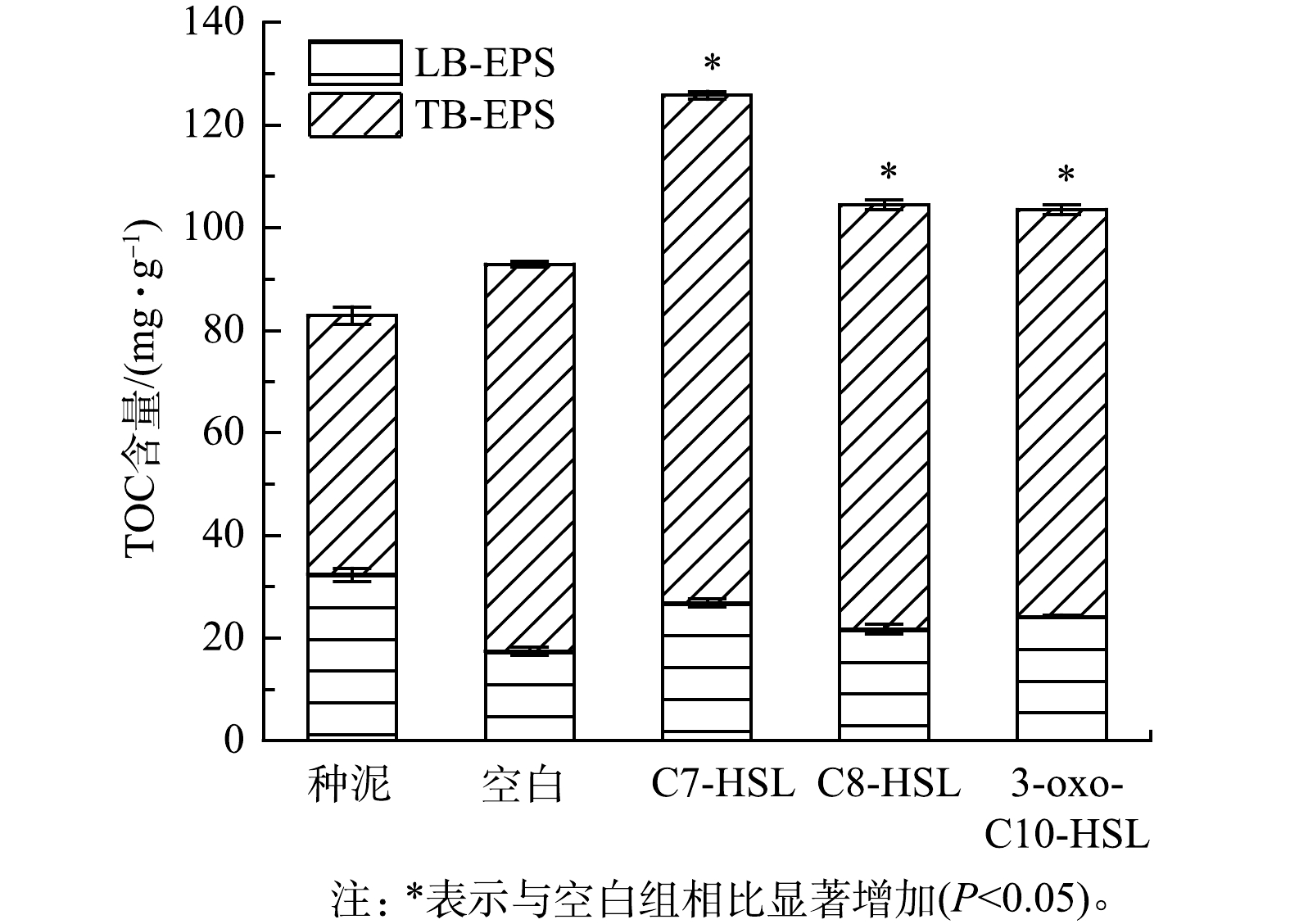
EPS主要是微生物自身代谢产生的高分子聚合物,是细菌抵御外界环境压力的重要屏障[18]。EPS的主要由蛋白质、多糖、腐殖酸和无机物组成,其中蛋白质和多糖的含量占总EPS的70%~80%,对微生物结构及其聚集体的稳定起重要作用[19]。TOC可以表征总EPS的含量[20]。图4表示反应器中LB-EPS和TB-EPS的TOC的变化情况,可以看出,TB-EPS是活性污泥EPS的主要组成部分。经过40 d的培养,所有组别总TOC含量增加,其中C7-HSL组增长最多,较接种污泥增长了51.9%。对于TB-EPS,空白组、C7-HSL组、C8-HSL组和3-oxo-C10-HSL组分别增长了24.90、48.42 、32.26和28.77 mg·g−1(以MLSS计),C7-HSL组TB-EPS的增长量几乎是空白组增长量的2倍。与TB-EPS的变化趋势不同,所有组别的LB-EPS的含量都下降,空白组下降最多,下降了14.91 mg·g−1,C7-HSL组下降最少,只下降了5.45 mg·g−1。这说明在信号分子的作用下,微生物分泌的EPS有增加的趋势,其中C7-HSL对EPS的影响明显优于其他两种信号分子。YEON等[21]在膜生物反应器中观察到,添加C8-HSL可以使EPS的含量增加。而有研究者发现,添加香草醛、猪肾脏化酶可使AHL降解,导致EPS含量降低[22]。QS可以通过介导尿苷二磷酸-N-乙酰半乳糖胺(UDP-GlcNAc)的合成来实现对EPS含量的调节[23]。LB-EPS和TB-EPS对污泥的絮凝沉降性有重要影响,由于LB-EPS通常带负电,其产生的静电斥力导致细胞附着能力降低,因此,LB-EPS含量越高,污泥细胞的附着力越低。TB-EPS中存在的大量羟基以及部分羧基提供丰富充足的阳离子结合位点,以及TB-EPS中含有的相对疏松、对聚集有利的蛋白二级结构使TB-EPS发挥主要的污泥促聚作用[24],由此可知,TB-EPS含量越高,对污泥的聚集越有利[25]。本实验结果说明,添加信号分子有利于TB-EPS的形成,从而促进了污泥的聚集,增加稳定性。
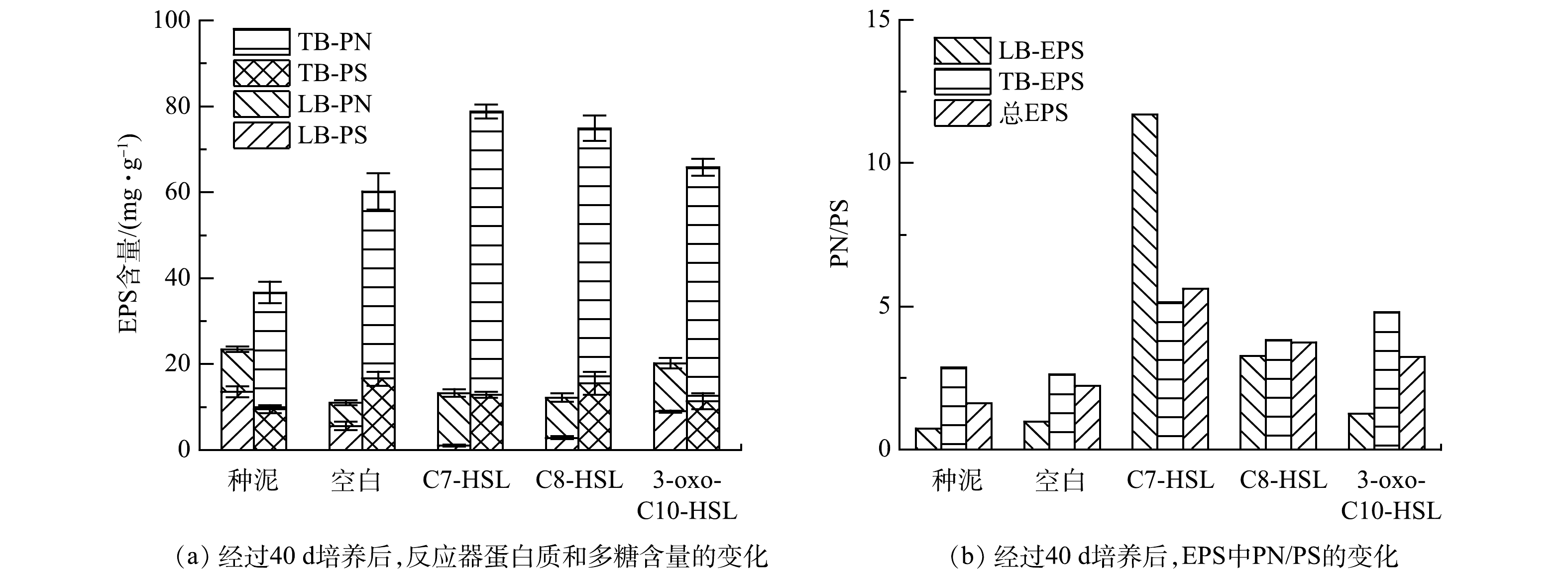
图5(a)表示TB-EPS和LB-EPS中蛋白质(PN)和多糖(PS)的含量。各组总蛋白质含量均升高,对于TB-EPS中蛋白质含量,空白组、C7-HSL组、C8-HSL组和3-oxo-C10-HSL组较种泥增长了60.32%、142.63%、118.43%和100.40%。而对于LB-EPS中蛋白质含量,相较种泥的(9.9±0.65) mg·g−1,C7-HSL组和3-oxo-C10-HSL组的含量分别增长23.64%和13.23%,而空白组下降了82.32%,C8-HSL组下降5.86%。以上结果表明,蛋白质是EPS的主要组成成分,同时信号分子可以促进EPS中蛋白质的合成,对TB-EPS中蛋白质合成的影响更大,促进效果排序为C7-HSL>C8-HSL>3-oxo-C10-HSL。总多糖的含量变化与蛋白质含量变化相反,其中LB-EPS中的多糖含量较种泥均下降,C7-HSL组下降最多,下降了12.52 mg·g−1。与LB-EPS多糖含量变化相反,空白组、C7-HSL组、C8-HSL组和3-oxo-C10-HSL组TB-EPS的多糖含量较种泥的(9.51±0.96) mg·g−1分别增长了74.68%、35.29%、63.28%和19.35%。结果表明,信号分子对LB-EPS中多糖的合成有明显的抑制作用,其中C7-HSL抑制作用最明显。对于TB-EPS中的多糖,实验组的多糖含量比种泥高,但比空白组低。结合总多糖含量变化,前述结果说明信号分子抑制了EPS中多糖的合成,其中C7-HSL的抑制作用最明显。在YU的研究中,添加C8-HSL导致EPS的多糖减少9.8%,添加C6-HSL使多糖含量增加了42.3%。而在本实验中,信号分子的添加,导致多糖含量减少了10%~40%,此差异可能是由于信号分子种类的不同造成的[26]。蛋白质和氨基酸组成的二级结构显著促进了疏水相互作用,进而促进了微生物聚集体的高聚集活性[27],而多糖是污泥亲水性重要成分。同时,EPS是带负电的负离子层,蛋白质含有的羧基带正电荷,能中和羧基和磷酸基团的负电荷,从而降低污泥的表面净负电荷,提高污泥的聚集性[28]。此外,也有研究表明,QS可以调节细胞外蛋白质的含量,提高微生物的聚集能力和污泥结构的稳定性[7,29]。
对比EPS中蛋白质和多糖的比值,如图5(b)所示,经过40 d的培养,所有组别的蛋白质/多糖(PN/PS)值较种泥均增大,并且实验组比空白组高。其中C7-HSL组中LB-EPS和TB-EPS的PN/PS均最大,分别为11.70和5.13,分别是空白组的12.1倍和1.9倍,是C8-HSL组的3.6倍和1.3倍,是3-oxo-C10-HSL组的9.4倍和1.1倍。根据TAN等[30]的研究结果,AHLs不仅会影响EPS浓度,也会改变PN/PS的比值,而PN/PS比值的升高有利于微生物的聚集和活性污泥的稳定,提高污泥絮凝沉降性能。
通过以上的结果与分析可看出,信号分子的添加可以促进EPS的形成,并改变EPS组成成分,促进微生物产生更多的胞外蛋白,从而增强污泥的稳定性。出水悬浮物ESS的浓度可以表征活性污泥结构的稳定性,从实验结果可以看出,实验组的ESS均比空白组低。这一结果印证了添加信号分子可以增强污泥的稳定性。
-
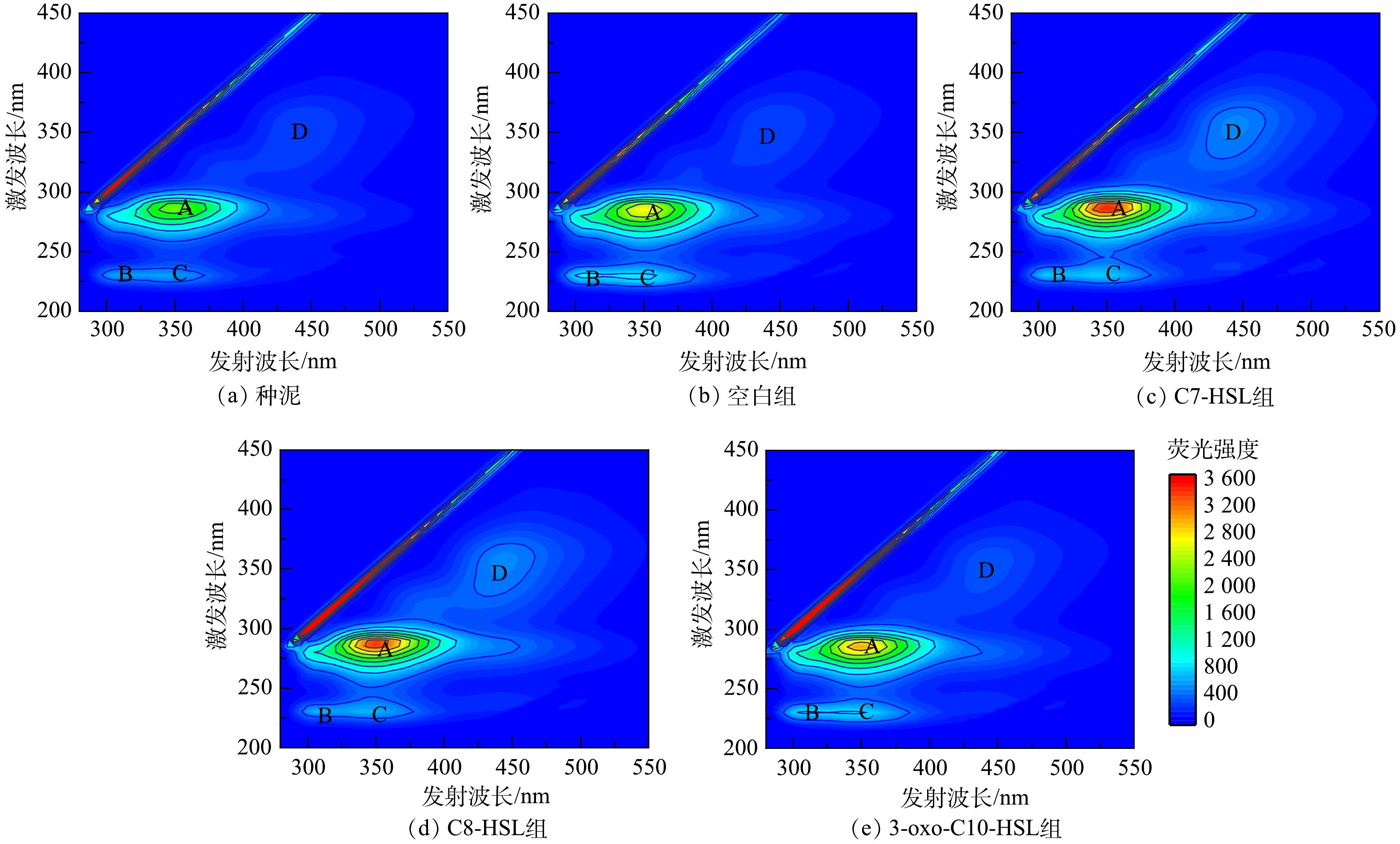
3D-EEM光谱可以进一步表征污泥EPS中不同种类蛋白质与腐殖酸的变化。参照CHEN等[31]的研究,根据峰位置将荧光区域分为Ⅰ~Ⅴ5个部分,分别代表芳香类蛋白、类黄腐酸、微生物副产物类蛋白和腐殖酸。由图6可知,3D-EEM谱图中主要存在4个峰,即A、B、C、D ,不同样品中对应的TB-EPS峰参数如表4所示。经过40 d的培养,各组样品TB-EPS峰的种类以及位置相似,但荧光强度不同,其主要成分为蛋白质类物质,这与测定的TB-EPS中蛋白质占主要成分相一致。在各组样品中,A峰荧光强度比B、C、D峰的荧光强度高,A峰位置在Ⅳ区,代表物质为微生物副产物类蛋白(主要为色氨酸类蛋白)[32]。实验组相较于空白组,A峰荧光强度均有所提升,C7-HSL组A峰的荧光强度最大为3 466.555,比空白组提高了26.80%。B峰和C峰,表示类芳香族蛋白,与A峰的结果不同,空白组的B、C峰较实验组高,实验结果表明,信号分子有可能通过促进微生物副产物类蛋白的产生从而改变EPS的化学结构。色氨酸类蛋白为疏水性物质,可以促进污泥形成更紧密的结构,并且可与EPS中芳环氨基酸结构共同作用提高活性污泥结构稳定性[33-34]。D峰在Ⅴ区,表示腐殖酸,说明样品中存在高分子量和高芳香度基团。腐殖酸在粘附和提供电子供体或受体方面起重要作用,在EPS的絮凝和生物吸附起次要作用,其影响很大程度上取决于它们的性质和浓度[35]。种泥与空白组TB-EPS的D峰的荧光强度相近,而比实验组的低,说明信号分子可能促进了腐殖酸的产生。
-
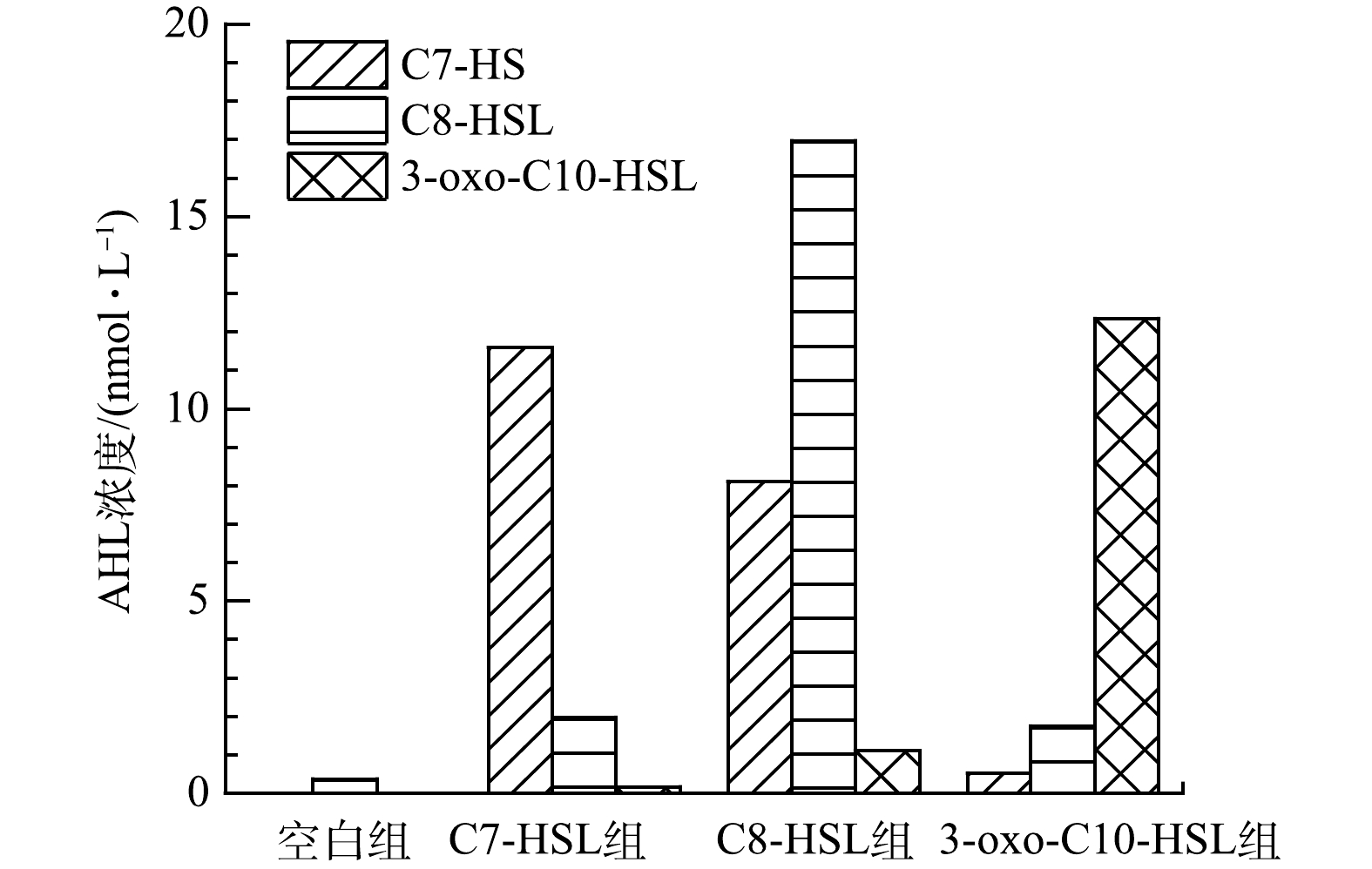
图7表示运行1个周期后空白组与实验组出水信号分子的浓度变化。空白组中C7-HSL和3-oxo-C10-HSL浓度均低于检测限(≤0.02 nmol·L−1)。从信号分子剩余量结果可知,外源添加的信号分子几乎全部被消耗。其中,C7-HSL组浓度最低,说明C7-HSL被利用的最多,这与C7-HSL组MLSS增长最多、微生物平均生长速率最高的变化规律相符。同时,C7-HSL组硝化污泥的活性、
NH+4 -N降解速率以及EPS的增长量也比C8-HSL组和3-oxo-C10-HSL组高,说明C7-HSL对高NH+4 -N负荷下硝化污泥有更好的调控作用。值得注意的是,C8-HSL组中内源产生的C7-HSL浓度高达8.112 nmol·L−1,而3-oxo-C10-HSL组C7-HSL仅为0.523 nmol·L−1,空白组未检测到,说明C8-HSL可能与C7-HSL关系密切。3-oxo-C10-HSL组比C8-HSL组消耗的信号分子多,3-oxo-C10-HSL组的污泥浓度、污泥平均生长速率和硝化污泥活性较C8-HSL组稍高,但EPS含量、蛋白质含量以及3D-EEM光谱中A峰表示的色氨酸类蛋白含量均比C8-HSL组低。这可能是由于C8-HSL组内源产生的C7-HSL造成的,也可能是由于C8-HSL和3-oxo-C10-HSL对EPS的调控作用不同。有研究[36]表明,C8-HSL的添加使硝化细菌EPS中各种成分的荧光强度大幅增加,然而3-oxo-C10-HSL的加入降低了EPS的荧光强度。空白组、C7-HSL组和3-oxo-C10-HSL组都内源产生了C8-HSL,其含量排序C7-HSL组>3-oxo-C10-HSL组>空白组,相应的MLSS变化趋势为C7-HSL组>3-oxo-C10-HSL组>空白组。统计学分析结果表明,信号分子的浓度与生物密度呈正相关(r=0.863, P=0.003)。
-
有研究[37]表明,在低温条件下,信号分子的添加可加速膜生物反应器中生物膜的生长并且提高了生物膜的活性;在中盐度(2%)条件下,添加AHL可提高好氧颗粒污泥的COD去除率[38]。从本研究结果可以看出,在高
NH+4 -N负荷下,信号分子可以显著提高硝化污泥的活性。然而,在较低NH+4 -N负荷条件下,空白组与实验组的NH+4 -N降解率无显著差异。之前的研究[26]中也发现了类似现象,当进水NH+4 -N质量浓度为114 mg·L−1时,添加信号分子对NH+4 -N的去除率没有明显影响。其可能的原因是在没有环境压力时,信号分子对微生物的调控作用不明显。同时,本实验在考察EPS的成分时发现,在空白组处于高氨氮负荷时,TB-EPS的含量增多,LB-EPS含量减少,同时蛋白质增加。这些变化均可以增加污泥的稳定性,说明在高NH+4 -N条件下,即使没有外源添加信号分子,微生物的代谢也会发生变化以适应不利的环境条件。而在实验组中,外源添加信号分子的污泥中TB-EPS和蛋白质增加量更多,多糖的比例更少,说明信号分子可以增强微生物对抗不利环境的能力。但是,我们也发现信号分子对微生物对抗不利条件的作用是有限的,不同信号分子对抗相同不利条件的能力存在差异。外源信号分子可以提高NOB细菌的亚硝酸盐利用率和硝化速率[39]。本研究中,NOB在面对FA浓度抑制时,C8-HSL和3-oxo-C10-HSL信号分子有利于提高NOB活性,但是C8-HSL和3-oxo-C10-HSL对NOB活性提高有限,导致FNA浓度越来越高,不足以使其应对更高的亚硝酸盐负荷,NOB活性逐渐被抑制。然而,在面对同样高浓度的亚硝酸盐时,外源添加C7-HSL的活性污泥经过6 d的适应,几乎没有亚硝酸盐的积累,说明不同的信号分子对功能基因的调节有差异。基于以上的分析,我们推测:信号分子可以提高微生物对抗环境压力的能力,尤其是在高氨氮负荷的冲击下,可以有效缓解高浓度亚硝酸盐对NOB活性的抑制。今后的研究也可以尝试外源添加信号分子去除某些新型污染物,比如多氯联苯、双酚A,还可以通过信号分子促进EPS的形成,利用EPS复杂的三维结构吸附重金属,从而提高其在重金属等不利条件下的活性。
-
1)信号分子可以显著促进微生物的生长,提高硝化污泥的活性。其中,C7-HSL较C8-HSL和3-oxo-C10-HSL效果更明显,尤其在高
NH+4 -N负荷条件下,C7-HSL可以显著提高NOB活性,有效缓解高NO−2 -N对系统的抑制。2)信号分子可以促进活性污泥EPS的形成,并且改变EPS的组成,从而促进色氨酸类蛋白和腐殖酸的形成,提高蛋白质/多糖的比值。
3)信号分子有利于微生物对抗不利的环境,添加C7-HSL可为处理高
NH+4 -N负荷废水提供一种新思路。
AHLs群体感应信号分子对活性污泥反应器处理高氨氮废水的影响
Effect of N-acyl-homoserine-lactones mediated quorum sensing on the treatment of high ammonia nitrogen wastewater by activated sludge reactor
-
摘要: 硝化细菌生长缓慢、同化效率低、环境敏感性高,并且高氨氮废水中存在大量的游离氨会对硝化细菌活性产生抑制作用。本实验采用序批式反应器,研究添加C7-HSL、C8-HSL和3-oxo-C10-HSL对活性污泥处理高氨氮废水的影响。结果表明,信号分子可以显著促进微生物的生长,有效提高亚硝酸盐氧化菌(nitrite-oxidizing bacteria,NOB)的活性,同时可促进胞外聚合物(extracellular polymeric substance,EPS)的形成,改变EPS的组成,从而有效缓解高
NO−2 -N对系统的抑制,说明信号分子有利于微生物对抗不利的环境条件,缩短系统达到稳定的时间。其中C7-HSL效果最显著,污泥平均生长速率提升35.20%,降解效率提高17.52%,同时EPS增长了35.45%,蛋白质/多糖显著提升,并促进了色氨酸类氨基酸和腐殖酸的形成。以上研究结果可为处理高氨氮废水提供一种新的调控策略。Abstract: Nitrifying bacteria have slow growth, low assimilation efficiency and high environmental sensitivity, and the presence of a large amount of free ammonia in the wastewater with high ammonia nitrogen can inhibit the activity of nitrifying bacteria. In this experiment, a sequencing batch reactor was used to study the effect of adding C7-HSL, C8-HSL and 3-oxo-C10-HSL on the treatment of high ammonia nitrogen wastewater by activated sludge. The results showed that the signaling molecules could significantly promote the growth of microorganisms, effectively enhance the activity of nitrite-oxidizing bacteria (NOB), and promote the formation of extracellular polymeric substance (EPS), thus effectively alleviating the inhibition of highNO−2 -N on the system, indicating that the signal molecules were conducive to microorganisms against adverse environmental conditions, then and the time for system approaching to stability was reduced. C7-HSL showed the most significant effect among these signal molecules. The average growth rate, degradation efficiency and EPS content of sludge increased by 35.20%, 17.52% and 35.45%, respectively. Simultaneously, protein/polysaccharide significantly increased, which promoted the formation of tryptophan proteins and humic acids. This study provides a new regulatory strategy for the treatment of high ammonia nitrogen wastewater.-
Key words:
- quorum sensing /
- signal molecules /
- high ammonia /
- extracellular polymeric substances
-
表 1 人工合成污水营养元素配方
Table 1. Formula of nutrient elements in synthetic wastewater
营养元素 质量浓度/(mg·L−1) 营养元素 质量浓度/(mg·L−1) (NH4)2SO4 141~1 885 FeCl2·4H2O 1.988 NaCl 585 MnCl2·2H2O 0.081 KH2PO4 54 NiCl2·6H2O 0.024 KCl 75 CoCl2·6H2O 0.024 CaCl2·2H2O 74 CuCl2·6H2O 0.017 MgSO4·7H2O 49 ZnCl2 0.068 Na2EDTA 4.292 Na2MoO4· 2H2O 0.024 注:(NH4)2SO4为反应器唯一 NH+4 NH+4 NH+4 表 2 SBR硝化污泥生长状况
Table 2. Growth of nitrifying sludge in SBR
组别 种泥MLSS/(g·L−1) 运行40 d后MLSS/(g·L−1) 运行40 d后MLVSS/(g·L−1) MLVSS/MLSS 平均ESS/(g·(L·d)−1) 平均生长速率/(g·(L·d)−1) 空白 2.52±0.07 2.78±0.06 1.56±0.07 0.561 0.035 0.125±0.013 C7-HSL 2.52±0.07 3.76±0.15 2.87±0.22 0.764 0.025 0.169±0.022 C8-HSL 2.52±0.07 3.05±0.23 2.06±0.27 0.675 0.032 0.137±0.030 3-oxo-C10-HSL 2.52±0.07 3.15±0.37 2.10±0.18 0.667 0.028 0.138±0.044 表 3 FA与FNA浓度
Table 3. Concentrations of FA and FNA
mg·L−1 组别 第15天进水 第15天出水 第17天进水 第17天出水 FA FNA FA FNA FA FNA FA FNA 空白组 13.054* 0.000 0.485* 0.021 16.970* 0.044* 0.347* 0.047* C7-HSL组 13.054* 0.000 0.159* 0.003 13.902* 0.004 0.022* 0.007 C8-HSL组 13.054* 0.000 0.348* 0.014 15.338* 0.029 0.141* 0.037* 3-oxo-C10-HSL组 13.054* 0.000 0.278* 0.013 14.946* 0.027 0.127* 0.033* 注:*表示NOB活性被抑制。FA>0.1~1mg·L−1时,NOB开始被抑制,NOB的活性随着FA浓度的升高而降低;FNA>0.03 mg·L−1时,NOB开始被抑制,FNA>0.2 mg·L−1时,NOB被完全抑制[15−16]。 表 4 运行40 d后样品TB-EPS的峰值的荧光特性
Table 4. Fluorescence characteristics of peak value of TB-EPS after 40 days operation
组别 A峰 B峰 C峰 D峰 (Ex/Em)/nm 强度 (Ex/Em)/nm 强度 (Ex/Em)/nm 强度 (Ex/Em)/nm 强度 种泥 280/350 2 365.554 230/305 573.562 230/345 565.843 355/445 288.842 空白组 285/350 2 733.813 220/305 934.161 230/340 887.892 355/445 262.043 C7-HSL组 285/350 3 466.555 230/305 744.254 230/345 748.513 355/445 491.738 C8-HSL组 285/350 3 368.555 230/310 639.237 230/345 650.533 355/445 493.638 3-oxo-C10-HSL组 285/350 3 178.554 230/310 854.892 230/345 843.012 355/455 343.223 -
[1] 杨成荫, 陈杨, 欧阳坤, 等. 氨氮废水处理技术的研究现状及展望[J]. 工业水处理, 2018, 38(3): 1-5. doi: 10.11894/1005-829x.2018.38(3).001 [2] HOLMES D E, DANG Y, SMITH J A. Nitrogen cycling during wastewater treatment[J]. Advances in Applied Microbiology, 2019, 106: 113-192. [3] PAPENFORT K, BASSLER B L. Quorum sensing signal-response systems in Gram-negative bacteria[J]. Nature Reviews Microbiology, 2016, 14(9): 576-588. doi: 10.1038/nrmicro.2016.89 [4] YANG J, WU D, LI A, et al. The addition of N-hexanoyl-homoserine lactone to improve the microbial flocculant production of agrobacterium tumefaciens strain F2, an exopolysaccharide bioflocculant-producing bacterium[J]. Applied Biochemistry and Biotechnology, 2016, 179(5): 728-739. doi: 10.1007/s12010-016-2027-6 [5] DECHO A W, FREY R L, FERRY J L. Chemical challenges to bacterial AHL signaling in the environment[J]. Chemical Reviews, 2011, 111(1): 86-99. doi: 10.1021/cr100311q [6] BATCHELOR S E, COOPER M, CHHABRA S R, et al. Cell density-regulated recovery of starved biofilm populations of ammonia-oxidizing bacteria[J]. Applied and Environmental Microbiology, 1997, 63(6): 2281-2286. doi: 10.1128/aem.63.6.2281-2286.1997 [7] LI A J, HOU B L, LI M X. Cell adhesion, ammonia removal and granulation of autotrophic nitrifying sludge facilitated by N-acyl-homoserine lactones[J]. Bioresource Technology, 2015, 196: 550-558. doi: 10.1016/j.biortech.2015.08.022 [8] WU L J, LI A J, HOU B L, et al. Exogenous addition of cellular extract N-acyl-homoserine-lactones accelerated the granulation of autotrophic nitrifying sludge[J]. International Biodeterioration & Biodegradation, 2017, 118: 119-125. [9] SMOLDERS G, VAN DER MEIJ J, VAN LOOSDRECHT M, et al. Stoichiometric model of the aerobic metabolism of the biological phosphorus removal process[J]. Biotechnology and Bioengineering, 1994, 44(7): 837-848. doi: 10.1002/bit.260440709 [10] 国家环境保护总局. 水和废水监测分析方法[M]. 4版. 北京: 中国环境科学出版社, 2002. [11] LIU H, FANG H H. Extraction of extracellular polymeric substances (EPS) of sludges[J]. Journal of Biotechnology, 2002, 95(3): 249-256. doi: 10.1016/S0168-1656(02)00025-1 [12] DUBOIS M, GILLES K A, HAMILTON J K, et al. Colorimetric method for determination of sugars and related substances[J]. Analytical Chemistry, 1956, 28(3): 350-356. doi: 10.1021/ac60111a017 [13] LI X, FEKETE A, ENGLMANN M, et al. Development and application of a method for the analysis of N-acylhomoserine lactones by solid-phase extraction and ultra high pressure liquid chromatography[J]. Journal of Chromatography A, 2006, 1134(1/2): 186-193. [14] 胡惠秩. 常/低温下AHLs类群体感应信号分子对SBBR系统影响的研究[D]. 哈尔滨: 哈尔滨工业大学, 2017. [15] 张宇坤, 王淑莹, 董怡君, 等. 游离氨和游离亚硝酸对亚硝态氮氧化菌活性的影响[J]. 中国环境科学, 2014, 34(5): 1242-1247. [16] ANTHONISEN A C, LOEHR R C, PRAKASAM T B, et al. Inhibition of nitrification by ammonia and nitrous acid[J]. Journal - Water Pollution Control Federation, 1976, 48(5): 835-852. [17] 侯保连, 李安婕, 孙趣. AHLs群体感应信号分子对硝化污泥附着生长及硝化效果的影响[J]. 环境科学学报, 2015, 35(9): 2773-2779. [18] LIU Y Q, LIU Y, TAY J H. The effects of extracellular polymeric substances on the formation and stability of biogranules[J]. Applied Microbiology and Biotechnology, 2004, 65(2): 143-148. [19] LIANG Z, LI W, YANG S, et al. Extraction and structural characteristics of extracellular polymeric substances (EPS), pellets in autotrophic nitrifying biofilm and activated sludge[J]. Chemosphere, 2010, 81(5): 626-632. doi: 10.1016/j.chemosphere.2010.03.043 [20] MENG L, XI J, YEUNG M. Degradation of extracellular polymeric substances (EPS) extracted from activated sludge by low-concentration ozonation[J]. Chemosphere, 2016, 147: 248-255. doi: 10.1016/j.chemosphere.2015.12.060 [21] YEON K M, CHEONG W S, OH H S, et al. Quorum sensing: A new biofouling control paradigm in a membrane bioreactor for advanced wastewater treatment[J]. Environmental Science & Technology, 2009, 43(2): 380-385. [22] ZHAO R, ZHANG H, ZOU X, et al. Effects of inhibiting acylated homoserine lactones (AHLs) on anammox activity and stability of granules'[J]. Current Microbiology, 2016, 73(1): 108-114. doi: 10.1007/s00284-016-1031-y [23] TANG X, GUO Y, WU S, et al. Metabolomics uncovers the regulatory pathway of acyl-homoserine lactones based quorum sensing in anammox consortia[J]. Environmental Science & Technology, 2018, 52(4): 2206-2216. [24] 陈宇航. 活性污泥聚集过程中胞外聚合物的构成及功能分析[D]. 重庆: 重庆大学, 2019. [25] FENG Q, TAI X, SUN Y, et al. Influence of turbulent mixing on the composition of extracellular polymeric substances (EPS) and aggregate size of aerated activated sludge[J]. Chemical Engineering Journal, 2019: 378. [26] YAN X, ZHENG S, HUO Z, et al. Effects of exogenous N-acyl-homoserine lactones on nutrient removal, sludge properties and microbial community structures during activated sludge process[J]. Chemosphere, 2020: 255:126945. [27] HOU X L, LIU S T, ZHANG Z T. Role of extracellular polymeric substance in determining the high aggregation ability of anammox sludge[J]. Water Research, 2015, 75: 7551-7562. [28] 宋悦, 魏亮亮, 赵庆良, 等. 活性污泥胞外聚合物的组成与结构特点及环境行为[J]. 环境保护科学, 2017, 43(2): 35-40. [29] LV J, WANG Y, ZHONG C, et al. The effect of quorum sensing and extracellular proteins on the microbial attachment of aerobic granular activated sludge[J]. Bioresource Technology, 2014, 152: 53-58. [30] TAN C H, KOH K S, XIE C, et al. The role of quorum sensing signalling in EPS production and the assembly of a sludge community into aerobic granules[J]. The ISME Journal, 2014, 8(6): 1186-1197. doi: 10.1038/ismej.2013.240 [31] CHEN J, LEBOEUF E J, DAI S, et al. Fluorescence spectroscopic studies of natural organic matter fractions[J]. Chemosphere, 2003, 50(5): 639-647. doi: 10.1016/S0045-6535(02)00616-1 [32] DONG H, ZHANG K, HAN X, et al. Achievement, performance and characteristics of microbial products in a partial nitrification sequencing batch reactor as a pretreatment for anaerobic ammonium oxidation[J]. Chemosphere, 2017, 183: 212-218. doi: 10.1016/j.chemosphere.2017.05.119 [33] DONG J, ZHANG Z, YU Z, et al. Evolution and functional analysis of extracellular polymeric substances during the granulation of aerobic sludge used to treat p-chloroaniline wastewater[J]. Chemical Engineering Journal, 2017, 330: 596-604. doi: 10.1016/j.cej.2017.07.174 [34] 刘前进, 刘立凡. 胞外聚合物中蛋白质对好氧污泥颗粒化的影响[J]. 环境工程学报, 2021, 15(3): 929-938. doi: 10.12030/j.cjee.202008172 [35] SHI Y H, HUANG J H, ZENG G M, et al. Exploiting extracellular polymeric substances (EPS) controlling strategies for performance enhancement of biological wastewater treatments: An overview[J]. Chemosphere, 2017, 180: 396-411. doi: 10.1016/j.chemosphere.2017.04.042 [36] WANG X J, WANG W Q, LI Y, et al. Biofilm activity, ammonia removal and cell growth of the heterotrophic nitrifier, Acinetobacter sp. , facilitated by exogenous N-acyl-homoserine lactones[J]. RSC Advances, 2018, 8(54): 30783-30793. [37] HU H, HE J, LIU J, et al. Biofilm activity and sludge characteristics affected by exogenous N-acyl homoserine lactones in biofilm reactors[J]. Bioresource Technology, 2016, 211: 339-347. [38] LI C, LI W, LI H, et al. The effect of quorum sensing on performance of salt-tolerance aerobic granular sludge: Linking extracellular polymeric substances and microbial community[J]. Biodegradation, 2019, 30(5): 447-456. [39] 申秋璇. 硝化细菌群体感应信号分子及其产生效应的研究[D]. 北京:中国科学院大学, 2017. -








 下载:
下载: