-
厌氧氨氧化(anaerobic ammonium oxidation, ANAMMOX)是在缺氧条件下,ANAMMOX菌利用NO2−-N(电子受体)将NH4+-N(电子供体)氧化为N2的反应过程[1-3]。相较于传统硝化-反硝化脱氮工艺,ANAMMOX工艺具有曝气量少、不消耗有机物及污泥产量低等特点,并已被成功应用于城市污水处理厂的污泥消化液及与此类似的含有高浓度氨氮的工业废水处理中[4]。然而,ANAMMOX菌生长缓慢且世代周期长[5],这成为限制厌氧氨氧化技术广泛应用的主要原因。因此,寻找合适的接种污泥用于厌氧氨氧化工艺的启动是十分必要的。
ANAMMOX菌广泛存在于城市污水处理厂中,但相对丰度较低[6-7],对总氮(total nitrogen,TN)的去除贡献一般可忽略不计。然而,在生长环境适合的条件下,ANAMMOX菌或能完成富集并发挥脱氮作用。2013年,在新加坡樟宜污水处理厂多级A/O工艺中(活性污泥)发现了ANAMMOX过程。分子生物技术结果显示,该厂活性污泥中ANAMMOX菌的含量达到106~107 mL−1,对TN的去除贡献可达62%[8]。除活性污泥外,2019年LI等[9]发现,缺氧池填料生物膜上存在大量的ANAMMOX菌。经过分子生物学、同位素标记及物料衡算等技术手段分析,发现生物膜上的ANAMMOX菌占比为0.11%,若以该生物膜启动部分反硝化-厌氧氨氧化工艺(partial denitrification and ANAMMOX,PD/A),将极大缩短启动时间。而若以该生物膜为接种污泥启动亚硝化-厌氧氨氧化工艺(partial nitritation and ANAMMOX,PN/A),由于其所含硝化菌数量较少,PN/A工艺的启动或存在一定难度。2020年,本课题组发现,某城市污水处理厂好氧池生物膜上同时含有氨氧化菌(ammonium oxidation bacteria,AOB)和ANAMMOX菌,相对丰度分别为0.01%和0.71%,以该生物膜作为接种污泥或可成功快速启动PN/A工艺。
综上所述,本文以好氧池生物膜为接种污泥启动两段式PN/A移动床生物膜反应器(moving bed biofilm reactor,MBBR),通过测定反应器进出水及功能微生物活性,并采用高通量等手段对生物膜上的微生物种群进行了分析,考察了好氧池生物膜作为接种污泥启动两段式亚硝化厌氧氨氧化反应器的特性,探索了适用于厌氧氨氧化技术启动的接种污泥,为厌氧氨氧化工艺的大规模应用提供参考。
-
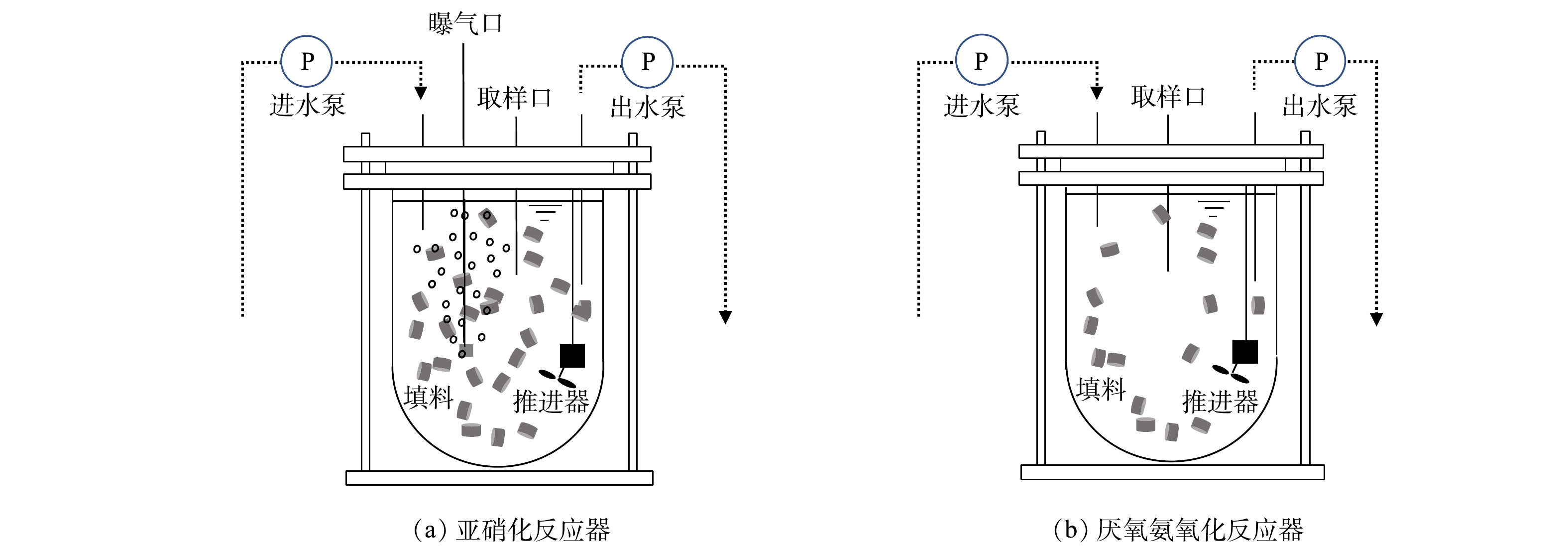
亚硝化和厌氧氨氧化反应器均由有机玻璃制成,其内设置推进器且在侧壁垂直方向设置进出水及取样口(图1)。反应器采用水浴加热,温度控制为30~35 ℃,pH控制在7.5~8.1。反应器均以序批式模式运行,进出水等均由自控系统控制。亚硝化反应器有效容积4.5 L, 填充率为33%,水力停留时间(hydraulic retention time,HRT)为12~15 h,运行周期为240 min,其中进水10 min、反应220 min及出水10 min。该反应器进水采用人工配制,其组分为0~750 mg·L−1 NH4+-N(NH4Cl)、1~4 g·L−1 KHCO3、100 mg·L−1、MgSO4·7H2O、180 mg·L−1、CaCl2·2H2O、50 mg·L−1 KH2PO4,微量元素为1 mL·L−1[10]。厌氧氨氧化反应器有效容积为4.5 L,填充率为18%,HRT为12~18 h。反应器运行次序和亚硝化反应器相同,进水采用人工配制(非亚硝化反应器出水),组分为30~360 mg·L−1 NH4+-N (NH4Cl),40~380 mg·L−1 NO2−-N(NaNO2),0.5~1 g·L−1 KHCO3,其余同亚硝化反应器。
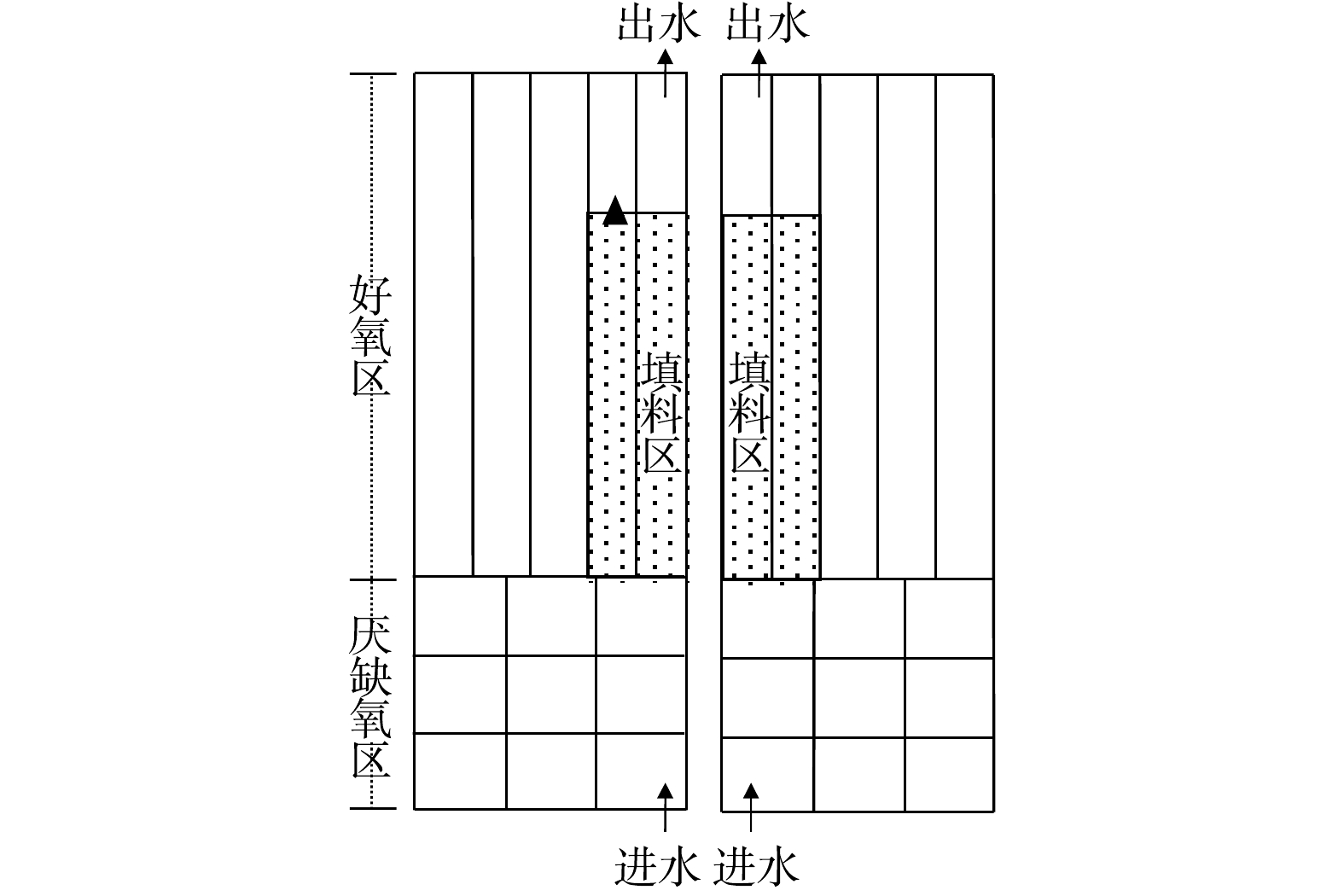
接种生物膜取自某城市污水处理厂好氧区(图2)。填料型号为K3(比表面积为500 m2·m−3;填充率为25%),填料区占总好氧区体积的22%,生物膜污泥质量浓度为12.05 g·m−2。
-
NH4+-N的测定采用纳氏试剂分光光度法;NO2−-N的测定采用N-(1-萘基)-乙二胺分光光度法;NO3−-N的测定采用紫外分光光度法[11];pH由在线式pH计(Inpro 4010,梅特勒)测定;溶解氧(DO)由在线式溶氧仪(Inpro 6050,梅特勒)测定。
-
活性测定参考REGMI等[12]描述的方法进行。在测定硝化活性时,取出若干填料,用纯水淘洗2~3次后,置于600 mL的反应瓶中,分别加入30 mg·L−1 NH4+-N、40 mg·L−1 NO2−-N及微量元素等,然后曝入空气,控制DO质量浓度在5 mg·L−1以上。在测定过程中,控制温度为30~35 ℃,定期从反应瓶中取出水样,根据所取水样中的NH4+-N和NO2−-N质量浓度变化确定AOB和亚硝酸盐氧化活性(nitrite oxidation bacteria, NOB)的基质消耗速率(L),根据式(1)计算得出AOB和NOB的表面活性。
式中:R为表面活性,mg·(m2·d)−1;L为基质消耗速率,mg·(L·d)−1;
φ 为反应瓶填料面积体积比,m2·L−1。ANAMMOX菌活性测定方法如下:取出若干填料,用无氧水淘洗2~3次后,置于600 mL的反应瓶中,同时加入30 mg·L−1 NH4+-N、40 mg·L−1 NO2−-N及微量元素,然后通入氮气5 min,使DO降低至0.05 mg·L−1以下,最后加入0.5 g·L−1 KHCO3。在测定过程中,反应瓶置于恒温摇床上以保证基质混合均匀,控制温度为30~35 ℃,定期从反应瓶中取出水样,根据所取水样中的NH4+-N、NO2−-N和NO3−-N质量浓度变化确定ANAMMOX的基质消耗速率,再通过相同的算法得出ANAMMOX表面活性。
-
从生物填料上取下一定数量的生物膜,经去离子水淘洗离心后按照试剂盒E.Z.N.A.® soil DNA Kit (Omega Bio-tek,Norcross GA, U.S.)规定的方法对DNA进行提取。以提取的DNA为PCR模板,采用V3-V4引物(序列为:338F:5'-ACTCCTACGGGAGGCAGCAG-3'和806R:5'-GGACTACHVGGGTWTATAAT-3'),在ABI Gene Amp® 9700 PCR thermo-cycler(ABI, CA,USA)上进行PCR反应。将同一样本的PCR产物混合后使用2%琼脂糖凝胶回收PCR产物,利用AxyPrep DNA Gel Extraction Kit(Axygen Biosciences,Union City,CA,USA)进行回收产物纯化,2%琼脂糖凝胶电泳检测,并用Quantus™ Fluorometer(Promega,USA)对回收产物进行检测定量。使用NEXTflexTM Rapid DNA-Seq Kit(Bioo Scientific,美国)进行建库,利用Illumina公司的Miseq PE300/NovaSeq PE250平台进行测序(上海美吉生物医药科技有限公司,www.majorbio.com)。
-
生物膜样品的荧光原位杂交参照AMANN等[13]描述的方法进行。杂交后的污泥样品通过激光共聚焦显微微镜(TCS SP8,莱卡)进行观察,并在100倍物镜下采集图像。杂交中所用的16S rRNA探针见表1。
-
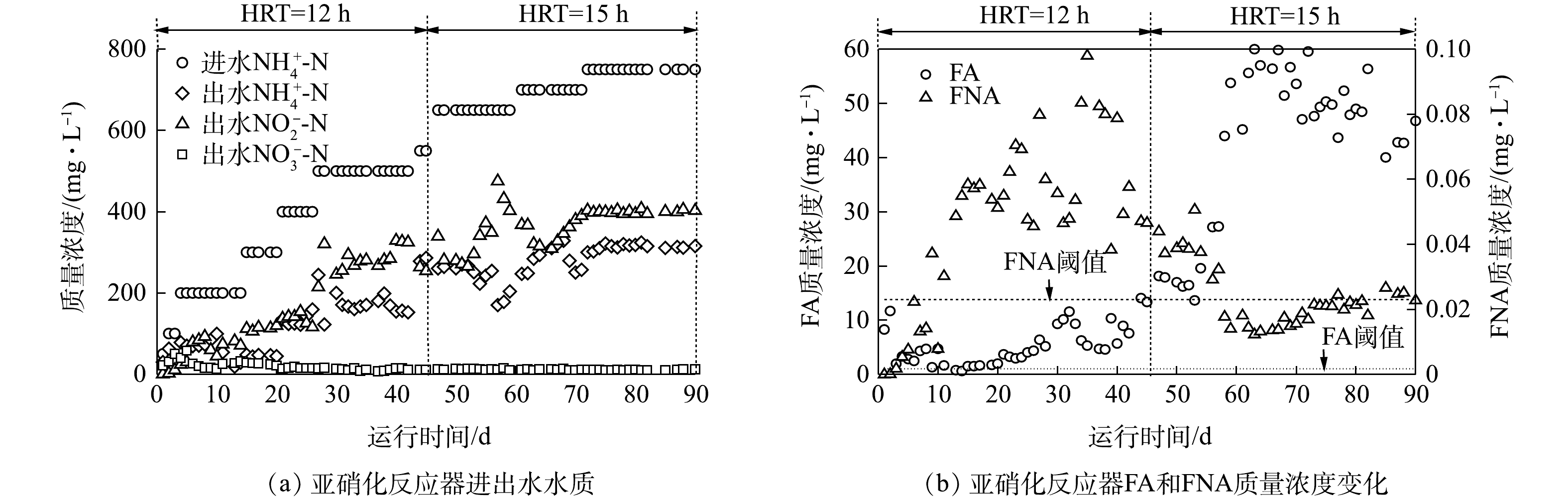
图3(a)为亚硝化反应器的运行效果。随着进水NH4+-N质量浓度由50 mg·L−1逐步提升至750 mg·L−1,亚硝化反应器负荷由750 mg·(m2·d)−1增至9 000 mg·(m2·d)−1,待反应器稳定运行后,平均出水NH4+-N和NO2−-N质量浓度为(313.85±6.58) mg·L−1和(400.2±3.81) mg·L−1,平均出水NO2−-N和NH4+-N质量浓度比值为1.28±0.03,满足厌氧氨氧化反应的需求。在亚硝化反应器启动过程中,采用游离氨(free ammonium, FA)或游离亚硝酸(free nitrous acid,FNA)抑制手段达到抑制淘汰NOB,使得AOB成为优势菌种。由图3(b)可知,在1~10 d,NOB主要受FA抑制,此时段质量浓度为(4.57±3.18) mg·L−1,大于FA对NOB的抑制阈值(1 mg·L−1)[14],此时平均NO2−-N积累率为(36.07±26.14)%。随着AOB的增长及NOB被有效抑制(11~57 d),反应器内的NO2−-N质量浓度明显升高,使得平均FNA质量浓度达到0.0699 mg·L−1,大于FNA对NOB的抑制阈值[15](0.023 mg·L−1),此时NOB受到FA和FNA双重抑制,平均NO2−-N积累率为85.02%。在运行至第59天时,将反应器pH由7.39±0.23升至8.13±0.07后,FNA质量浓度降至(0.019±0.004) mg·L−1,此时NOB主要受到FA抑制,平均NO2−-N积累率(88.54±5.52)%。综上所述,通过FA抑制或FA和FNA双重抑制均可有效抑制NOB,实现亚硝化过程的快速启动。
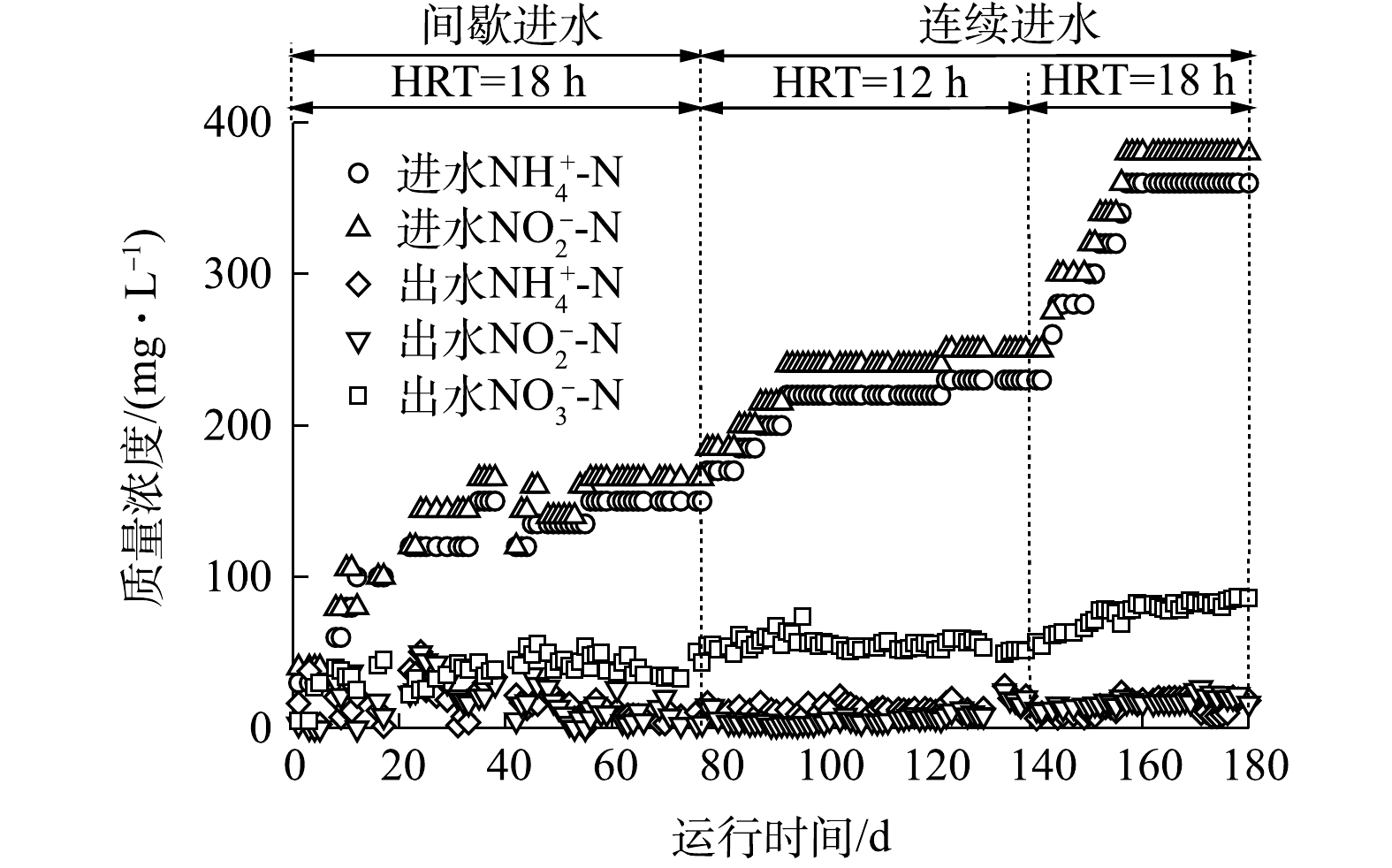
图4为厌氧氨氧化反应器运行效果。随着进水NH4+-N和NO2−-N质量浓度分别从30 mg·L−1和40 mg·L−1增至360 mg·L−1和380 mg·L−1,反应器负荷从1 312 mg·(m2·d)−1增至13 875 mg·(m2·d)−1。待反应器运行稳定后,出水NH4+-N和NO2−-N质量浓度分别维持在(16.07±4.79) mg·L−1和(19.18±3.05) mg·L−1,平均TN去除率稳定在(84.14±0.66)%。由于ANAMMOX菌以一定的比例消耗NH4+-N和NO2−-N并生成NO3−-N,因此,反应器的基质消耗比(ΔNO2−-N/ΔNH4+-N)和生成比(ΔNO3−-N/ΔNH4+-N)可作为厌氧氨氧化反应器运行效果判断的一项性能指标。本实验中,第1天ΔNO2−-N/ΔNH4+-N为2.76,ΔNO3−-N/ΔNH4+-N为0.37,其均大于STROUS等[16]所给出的理论值(ΔNO2−-N/ΔNH4+-N为1.32,ΔNO3−-N/ΔNH4+-N为0.26),说明反应器启动初期存在反硝化和硝化过程。这主要因为生物膜上存在一定数量的异养菌和硝化菌。由于进水中不含有机物,异养菌难以适应新环境而发生细胞自溶,异养菌可利用NO2−-N作为电子受体进行反硝化过程,使得ΔNO2−-N/ΔNH4+-N比值偏大。除反硝化过程外,因反应器未严格密封以及进水中存在部分溶解氧,故接种生物膜上的NOB发生了硝化反应,使得ΔNO3−-N/ΔNH4+-N比值偏大。随着反应器的持续运行,异养菌被逐步淘汰且厌氧氨氧化成为主导反应,基质消耗比和生成比关系趋于稳定,ΔNO2−-N/ΔNH4+-N为1.10±0.07,ΔNO3−-N/ΔNH4+-N为0.30±0.13,该数值和理论值接近,说明厌氧氨氧化反应器成功启动。
-
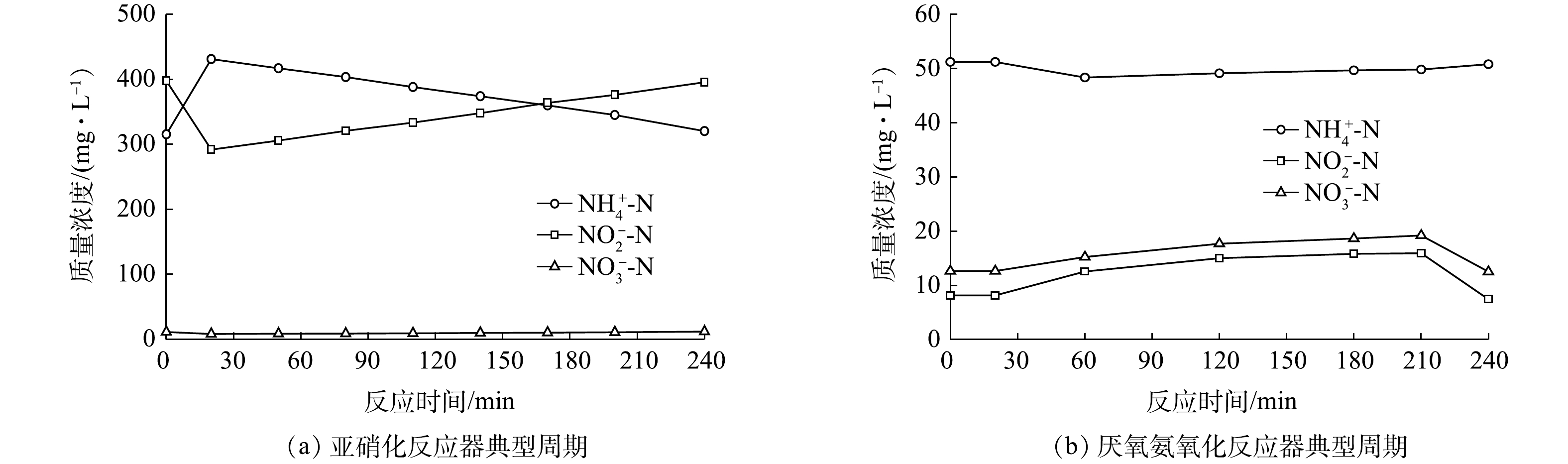
图5(a)为亚硝化反应器典型周期氮组分变化情况。当进水结束时,NH4+-N和NO2−-N质量浓度分别达到最高值和最低值,对应FA和FNA质量浓度也达到最大值和最小值(FA质量浓度为47.73 mg·L−1,FNA质量浓度为0.016 mg·L−1)。随着反应的进行,NH4+-N质量浓度从431.12 mg·L−1降至320.45 mg·L−1,NO2−-N质量浓度从291.82 mg·L−1升至395.45 mg·L−1,而NO3−-N质量浓度增幅仅为3.66 mg·L−1,NO2−-N积累率为93.54%,表明氧化的NH4+-N几乎全部转化为NO2−-N且未被进一步氧化。
在厌氧氨氧化反应器运行前期(1~77 d),采用间歇进水方式运行,在进水NH4+-N和NO2−-N质量浓度分别为150 mg·L−1和165 mg·L−1时,FA和FNA质量浓度最大可达1.50 mg·L−1和0.012 mg·L−1。由于此FNA质量浓度已达到文献报道的ANAMMOX菌抑制阈值下限(0.011~0.077 mg·L−1)[15-17],为避免后期进水浓度提高后FA和FNA对ANAMMOX菌产生抑制,在第77天后将反应器改为连续进水方式。图5(b)为厌氧氧化反应器典型周期氮组分变化(进水NH4+-N和NO2−-N质量浓度分别为360 mg·L−1和380 mg·L−1)。整个周期内NH4+-N和NO2−-N质量浓度均维持在较低水平,最大FA和FNA质量浓度仅为1.25 mg·L−1和0.016 mg·L−1,表明连续进水模式能有效避免反应器内基质浓度过高,可保证ANAMMOX菌在不受抑制的情况下以最大速率进行增殖。
-
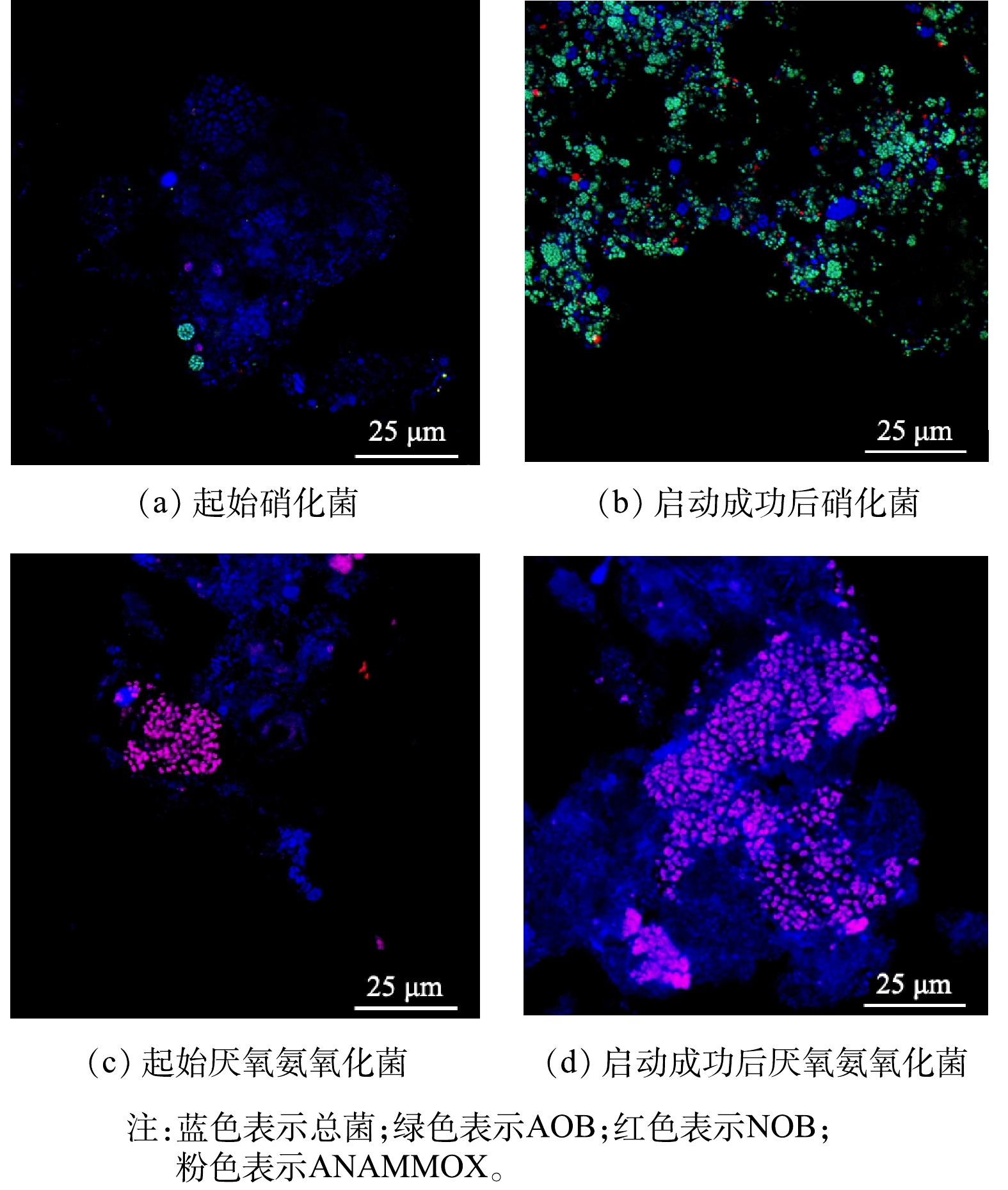
接种生物膜呈灰黑色且生物量较少(图6(a)),这主要是因为该填料处于好氧池末端,NH4+-N和有机物的负荷较低,导致微生物增殖缓慢。随着亚硝化和厌氧氨氧化反应器的运行,接种后的生物膜均发生明显的变化。在亚硝化反应器中,填料上的生物量明显增加且颜色仍呈现灰黑色(图6(b))。在厌氧氨氧化反应器中,除生物量明显增加外,生物膜颜色呈红棕色(图6(c)),说明ANAMMOX菌在生物膜上成功富集。
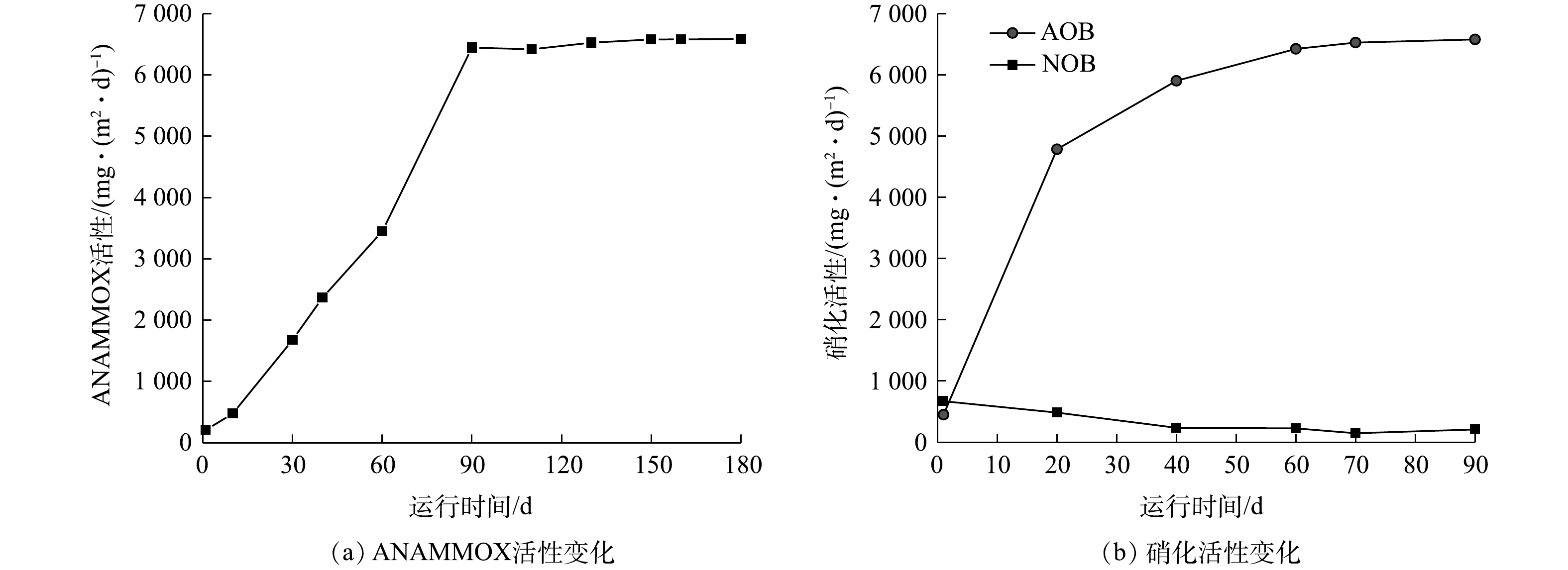
有研究表明,AOB和ANAMMOX菌的世代周期分别为0.29~0.33 d−1[18]和11~20 d−1[1,5],表明厌氧氨氧化反应器的启动需要更长的时间。基于这一考虑,本实验中首先启动厌氧氨氧化反应器,经过90 d的启动,ANAMMOX活性从209.86 mg·(m2·d)−1增至6 448.32 mg·(m2·d)−1,其后保持不变(图7(a)),说明90 d时填料上所能容纳的生物量已达到最大。此时,生物膜上ANAMMOX菌的增殖量等于脱落和衰减量之和,生物膜上的ANAMMOX菌已经达到最大值,说明反应器已经成功启动。但此时反应器的运行负荷尚未达到最大,随着进水基质浓度的不断提高,反应器的负荷也在逐渐提高,到180 d时,反应器的去除负荷已接近ANAMMOX的最大活性,反应器的潜力完全得到发挥,从这点说,经过180 d反应器成功启动。亚硝化反应器在厌氧氨氧化反应器启动90 d后开始启动,运行期间AOB的活性随时间的变化关系与ANAMMOX相同,在第60天时,AOB活性从450.72 mg·(m2·d)−1增至5 902.56 mg·(m2·d)−1,其后维持恒定(图7(b)),说明第60天时,亚硝化菌在生物膜中已达到稳态。NOB由于始终受到FA或FNA的抑制,其活性始终维持在较低水平,可避免亚硝氮被进一步氧化为硝氮,为亚硝化反应器的稳定运行创造了条件。
-
生物膜在不同培养方式下的微生物种群结构可通过荧光原位杂交技术进行检测。由图8(a)和图8 (b)可见,在亚硝化反应器中,AOB所占份额由低变高,且基本检测不出NOB,表明在亚硝化反应器通过FA或FNA抑制成功富集AOB的同时也达到了NOB的目的,实现了亚硝化反应器的稳定运行。在厌氧氨氧化反应器中(图8(c)和图8 (d)),ANAMMOX菌所占份额明显增加且表现出较强的荧光信号,表明ANAMMOX菌成为厌氧氨氧化反应器中的优势菌种。
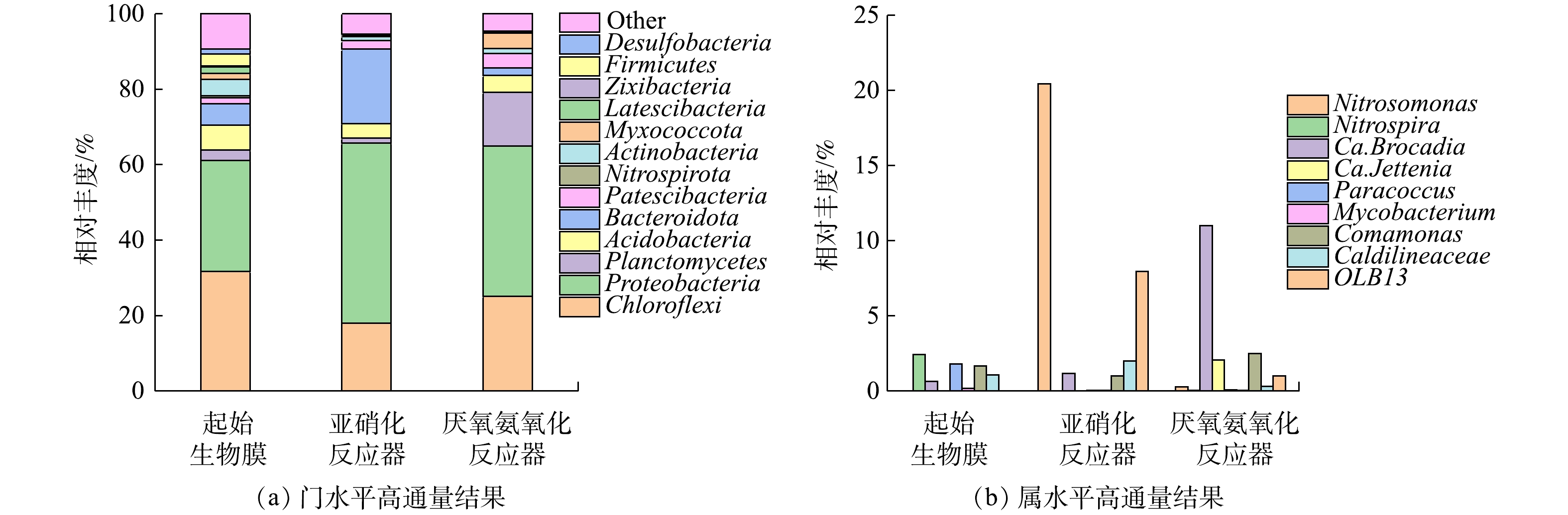
高通量结果(图9)表明,同一接种生物膜在不同条件下培养前后,Chloroflexi,Proteobacteria,Acidobacteria仍维持较高的相对丰度。Chloroflexi菌门起始相对丰度为31.71%,经过2个反应器培养后,相对丰度分别降至18.02%和25.11%。Proteobacteria菌门包括异养菌和部分AOB,其在亚硝化和厌氧氨氧化反应器中的增幅分别为18.29%和10.40%。Planctomycetes菌门包含现有已知所有ANAMMOX菌[1,19],其在亚硝化和厌氧氨氧化反应器中的占比为1.26%和4.26%。对Bacteroidota菌门而言,其起始相对丰度仅为5.65%,经反应器培养后,其占比分别变为19.71%和2.03%,这与Planctomycetes菌门呈现出相反的变化趋势。在属水平上,亚硝化反应器中探明的AOB主要为Nitrosomonas,相对丰度从0.02%增至20.09%,该增幅和Proteobacteria菌门的增幅接近,表明Proteobacteria菌门相对丰度的增加主要为Nitrosomonas增加所致。对NOB而言,起始生物膜上探明的主要为Nitrospira,其相对丰度为0.41%,而在亚硝化反应器中未检测出Nitrospira的存在,说明通过FA或FNA抑制成功淘汰了Nitrospira,从而实现了亚硝化反应的稳定进行。在厌氧氨氧化反应器中,探明的ANAMMOX菌主要为Ca. Brocadia,此结果和目前主流系统内已探明的典型种属一致[20-21],占比由0.62%增至11.00%。除Ca. Brocadia菌属外,还探明有Ca. Jettenia菌属,其相对丰度由未检出增至2.07%。ANAMMOX菌属总增幅为12.45%,其和Planctomycetes菌门增幅接近,表明Planctomycetes菌门相对丰度的增加主要是由于ANAMMOX菌的增加。
硝化菌作为硝化-反硝化过程中的主导微生物而广泛存在于活性污泥,占比可达1%~10%[22-23],以活性污泥作为接种污泥可快速完成亚硝化过程的启动[24-25]。而ANAMMOX菌虽广泛存在于城市污水处理厂中[6-7],但其占比远小于硝化菌。若以活性污泥作为接种污泥启动厌氧氨氧化过程,则需要很长的时间才能启动厌氧氨氧化反应器,因此,为加速厌氧氨氧化的启动过程,选取合适的接种污泥就显得尤为重要。不同接种污泥启动厌氧氨氧化反应器特性如表2所示。以活性污泥、硝化污泥及厌氧污泥作为接种污泥启动厌氧氨氧化反应器,均可实现ANAMMOX反应器的启动。通过对比可发现,以厌氧污泥和硝化污泥为接种污泥所需启动时间较短,而以活性污泥和生物膜为接种污泥所需的启动时间则较长。本实验中,ANAMMOX反应器的启动时长虽有180 d,但处理负荷远大于其他研究,表明以好氧池生物膜为接种污泥启动的厌氧氨氧化反应器可达到较高的负荷,且具有数量多及采集运输便利等优势,从而为厌氧氨氧化工艺启动接种污泥的选择提供了便利。
-
1)以某城市污水处理厂好氧池生物膜为接种污泥可成功启动亚硝化反应器,在进水NH4+-N质量浓度为750 mg·L−1的条件下,反应器负荷可达9 000 mg·(m2·d)−1(以NH4+-N计),平均出水NO2−-N和NH4+-N浓度比值为1.28。
2)以某城市污水处理厂好氧池生物膜为接种污泥可成功厌氧氨氧化反应器,在进水NH4+-N和NO2−-N质量浓度分别为360 mg·L−1和380 mg·L−1的条件下,厌氧氨氧化反应器负荷(以TN计)可达13 875 mg·(m2·d)−1,TN去除率为(84.14±0.66)%。
3)以好氧池生物膜为接种污泥的两段式亚硝化厌氧氨氧化工艺的快速启动为厌氧氨氧化技术接种污泥的选择提供参考。
以城市污水处理厂好氧池生物膜作为接种污泥快速启动两段式亚硝化-厌氧氨氧化反应器的可行性
Rapid start-up of a two-stage partial nitritation-ANAMMOX MBBR with inoculated biofilm from aeration tank
-
摘要: 为探讨以城市污水处理厂好氧池生物膜作为接种污泥启动厌氧氨氧化工艺的可行性,启动了两段式亚MBBR亚硝化-厌氧氨氧化工艺并成功运行。结果表明,经过90 d的启动,在进水NH4+-N质量浓度为750 mg·L−1的条件下,亚硝化反应器负荷(以NH4+-N计)可达到9 000 mg·(m2·d)−1,平均出水NO2−-N和NH4+-N质量浓度比值为1.28,满足厌氧氨氧化的反应要求。经过180 d的启动,在进水NH4+-N和NO2−-N质量浓度分别为360 mg·L−1和380 mg·L−1的条件下,厌氧氨氧化反应器负荷(以TN计)可达到13 875 mg·(m2·d)−1,TN去除率可达(84.14±0.66)%。活性测定结果显示,AOB和ANAMMOX活性(以NH4+-N计)分别可达6 423.84 mg·(m2·d)−1和6 448.32 mg·(m2·d)−1且均可维持恒定。高通量测序结果表明,亚硝化反应器中的Nitrosomonas占比由0.02%增至20.09%,为AOB的主导菌属;厌氧氨氧化反应器中,Ca. Brocadia和Ca. Jettenia为主要的ANAMMOX菌,占比分别达到11.00%和2.07%。采用好氧池生物膜作为接种污泥可快速启动两段式亚硝化厌氧氨氧化工艺。
-
关键词:
- 接种污泥 /
- 厌氧氨氧化 /
- 部分亚硝化 /
- 移动床生物膜反应器(MBBR)
Abstract: To investigate the feasibility of aerobic biofilm from a wastewater treatment plant (WWTP) as the inoculated biofilm to conduct the start-up of ANAMMOX process, two bed biofilm reactors (MBBR) were established to start-up two stage partial nitritation-ANAMMOX (PN/A) process. The results showed that, after 90 days of start-up, the nitrogen load of PN reactor could reach 9 000 mg·(m2·d)−1 (as NH4+-N) at the influent ammonium concentration of 750 mg·L−1. The average ratio of mass concentration of nitrite to ammonium in effluent was 1.28, which could meet the stoichiometric of ANAMMOX process. After 180 days of start-up, the TN load could reach 13875 mg·(m2·d)−1 (as TN) at the influent ammonium concentration of 360 mg·L−1 and nitrite concentration of 380 mg·L−1 in ANAMMOX reactor, and the average TN removal efficiency could reach (84.14±0.66)%. The activities of AOB and ANAMMOX (as NH4+-N) were 6 423.84 mg·(m2·d)−1and 6 448.32 mg·(m2·d)−1, respectively, and were stably maintained. The high-throughput sequencing results showed that Nitrosomonas was the predominance for AOB bacteria with relative abundance increased from 0.02% to 20.09% in PN reactor. The Ca. Brocadia and Ca. Jettenia were the predominance for ANAMMOX bacteria in ANAMMOX reactor, and the relative abundance of Ca. Brocadia and Ca. Jettenia reached 11.00% and 2.07%, respectively. The successful start-up of two-stage PN/A reactor with aerobic biofilm provided a novel alternative for the selection of inoculated sludge.-
Key words:
- seed sludge /
- ANAMMOX /
- partial nitrification /
- MBBR
-
厌氧氨氧化(anaerobic ammonium oxidation, ANAMMOX)是在缺氧条件下,ANAMMOX菌利用NO2−-N(电子受体)将NH4+-N(电子供体)氧化为N2的反应过程[1-3]。相较于传统硝化-反硝化脱氮工艺,ANAMMOX工艺具有曝气量少、不消耗有机物及污泥产量低等特点,并已被成功应用于城市污水处理厂的污泥消化液及与此类似的含有高浓度氨氮的工业废水处理中[4]。然而,ANAMMOX菌生长缓慢且世代周期长[5],这成为限制厌氧氨氧化技术广泛应用的主要原因。因此,寻找合适的接种污泥用于厌氧氨氧化工艺的启动是十分必要的。
ANAMMOX菌广泛存在于城市污水处理厂中,但相对丰度较低[6-7],对总氮(total nitrogen,TN)的去除贡献一般可忽略不计。然而,在生长环境适合的条件下,ANAMMOX菌或能完成富集并发挥脱氮作用。2013年,在新加坡樟宜污水处理厂多级A/O工艺中(活性污泥)发现了ANAMMOX过程。分子生物技术结果显示,该厂活性污泥中ANAMMOX菌的含量达到106~107 mL−1,对TN的去除贡献可达62%[8]。除活性污泥外,2019年LI等[9]发现,缺氧池填料生物膜上存在大量的ANAMMOX菌。经过分子生物学、同位素标记及物料衡算等技术手段分析,发现生物膜上的ANAMMOX菌占比为0.11%,若以该生物膜启动部分反硝化-厌氧氨氧化工艺(partial denitrification and ANAMMOX,PD/A),将极大缩短启动时间。而若以该生物膜为接种污泥启动亚硝化-厌氧氨氧化工艺(partial nitritation and ANAMMOX,PN/A),由于其所含硝化菌数量较少,PN/A工艺的启动或存在一定难度。2020年,本课题组发现,某城市污水处理厂好氧池生物膜上同时含有氨氧化菌(ammonium oxidation bacteria,AOB)和ANAMMOX菌,相对丰度分别为0.01%和0.71%,以该生物膜作为接种污泥或可成功快速启动PN/A工艺。
综上所述,本文以好氧池生物膜为接种污泥启动两段式PN/A移动床生物膜反应器(moving bed biofilm reactor,MBBR),通过测定反应器进出水及功能微生物活性,并采用高通量等手段对生物膜上的微生物种群进行了分析,考察了好氧池生物膜作为接种污泥启动两段式亚硝化厌氧氨氧化反应器的特性,探索了适用于厌氧氨氧化技术启动的接种污泥,为厌氧氨氧化工艺的大规模应用提供参考。
1. 材料与方法
1.1 MBBR运行参数及接种污泥
亚硝化和厌氧氨氧化反应器均由有机玻璃制成,其内设置推进器且在侧壁垂直方向设置进出水及取样口(图1)。反应器采用水浴加热,温度控制为30~35 ℃,pH控制在7.5~8.1。反应器均以序批式模式运行,进出水等均由自控系统控制。亚硝化反应器有效容积4.5 L, 填充率为33%,水力停留时间(hydraulic retention time,HRT)为12~15 h,运行周期为240 min,其中进水10 min、反应220 min及出水10 min。该反应器进水采用人工配制,其组分为0~750 mg·L−1 NH4+-N(NH4Cl)、1~4 g·L−1 KHCO3、100 mg·L−1、MgSO4·7H2O、180 mg·L−1、CaCl2·2H2O、50 mg·L−1 KH2PO4,微量元素为1 mL·L−1[10]。厌氧氨氧化反应器有效容积为4.5 L,填充率为18%,HRT为12~18 h。反应器运行次序和亚硝化反应器相同,进水采用人工配制(非亚硝化反应器出水),组分为30~360 mg·L−1 NH4+-N (NH4Cl),40~380 mg·L−1 NO2−-N(NaNO2),0.5~1 g·L−1 KHCO3,其余同亚硝化反应器。
接种生物膜取自某城市污水处理厂好氧区(图2)。填料型号为K3(比表面积为500 m2·m−3;填充率为25%),填料区占总好氧区体积的22%,生物膜污泥质量浓度为12.05 g·m−2。
1.2 水质指标测定
NH4+-N的测定采用纳氏试剂分光光度法;NO2−-N的测定采用N-(1-萘基)-乙二胺分光光度法;NO3−-N的测定采用紫外分光光度法[11];pH由在线式pH计(Inpro 4010,梅特勒)测定;溶解氧(DO)由在线式溶氧仪(Inpro 6050,梅特勒)测定。
1.3 活性的测定
活性测定参考REGMI等[12]描述的方法进行。在测定硝化活性时,取出若干填料,用纯水淘洗2~3次后,置于600 mL的反应瓶中,分别加入30 mg·L−1 NH4+-N、40 mg·L−1 NO2−-N及微量元素等,然后曝入空气,控制DO质量浓度在5 mg·L−1以上。在测定过程中,控制温度为30~35 ℃,定期从反应瓶中取出水样,根据所取水样中的NH4+-N和NO2−-N质量浓度变化确定AOB和亚硝酸盐氧化活性(nitrite oxidation bacteria, NOB)的基质消耗速率(L),根据式(1)计算得出AOB和NOB的表面活性。
R=Lφ (1) 式中:R为表面活性,mg·(m2·d)−1;L为基质消耗速率,mg·(L·d)−1;
φ ANAMMOX菌活性测定方法如下:取出若干填料,用无氧水淘洗2~3次后,置于600 mL的反应瓶中,同时加入30 mg·L−1 NH4+-N、40 mg·L−1 NO2−-N及微量元素,然后通入氮气5 min,使DO降低至0.05 mg·L−1以下,最后加入0.5 g·L−1 KHCO3。在测定过程中,反应瓶置于恒温摇床上以保证基质混合均匀,控制温度为30~35 ℃,定期从反应瓶中取出水样,根据所取水样中的NH4+-N、NO2−-N和NO3−-N质量浓度变化确定ANAMMOX的基质消耗速率,再通过相同的算法得出ANAMMOX表面活性。
1.4 高通量测序
从生物填料上取下一定数量的生物膜,经去离子水淘洗离心后按照试剂盒E.Z.N.A.® soil DNA Kit (Omega Bio-tek,Norcross GA, U.S.)规定的方法对DNA进行提取。以提取的DNA为PCR模板,采用V3-V4引物(序列为:338F:5'-ACTCCTACGGGAGGCAGCAG-3'和806R:5'-GGACTACHVGGGTWTATAAT-3'),在ABI Gene Amp® 9700 PCR thermo-cycler(ABI, CA,USA)上进行PCR反应。将同一样本的PCR产物混合后使用2%琼脂糖凝胶回收PCR产物,利用AxyPrep DNA Gel Extraction Kit(Axygen Biosciences,Union City,CA,USA)进行回收产物纯化,2%琼脂糖凝胶电泳检测,并用Quantus™ Fluorometer(Promega,USA)对回收产物进行检测定量。使用NEXTflexTM Rapid DNA-Seq Kit(Bioo Scientific,美国)进行建库,利用Illumina公司的Miseq PE300/NovaSeq PE250平台进行测序(上海美吉生物医药科技有限公司,www.majorbio.com)。
1.5 荧光原位杂交
生物膜样品的荧光原位杂交参照AMANN等[13]描述的方法进行。杂交后的污泥样品通过激光共聚焦显微微镜(TCS SP8,莱卡)进行观察,并在100倍物镜下采集图像。杂交中所用的16S rRNA探针见表1。
表 1 荧光原位杂交所用探针Table 1. Probes used in FISH探针名称 RNA序列 标记细菌种属 Eub338 GCTGCCTCCCGTAGAGT 所有微生物 Eub338II GCAGCCACCCGTAGGTGT 所有微生物 Eub338III GCTGCCACCCGTAGGTGT 所有微生物 Amx368 CCT TTC GGG CAT TGC GAA 所有厌氧氨氧化菌 Nso1225 CGCCATTGTATTACGTGTGA β-Proteobacterial ammonia-oxidizing bacteria Nsm156 TATTAGCACATCTTTCGAT Nitrosomonas spp Nsv443 CCGTGACCGTTTCGTTCCG Nitrosospira spp Ntspa662 GGAATTCCGCGCTCCTCT Genus Nitrospira Nit3 CCTGTGCTCCATGCTCCG Genus Nitrobacter 2. 结果与分析
2.1 MBBR运行效果
图3(a)为亚硝化反应器的运行效果。随着进水NH4+-N质量浓度由50 mg·L−1逐步提升至750 mg·L−1,亚硝化反应器负荷由750 mg·(m2·d)−1增至9 000 mg·(m2·d)−1,待反应器稳定运行后,平均出水NH4+-N和NO2−-N质量浓度为(313.85±6.58) mg·L−1和(400.2±3.81) mg·L−1,平均出水NO2−-N和NH4+-N质量浓度比值为1.28±0.03,满足厌氧氨氧化反应的需求。在亚硝化反应器启动过程中,采用游离氨(free ammonium, FA)或游离亚硝酸(free nitrous acid,FNA)抑制手段达到抑制淘汰NOB,使得AOB成为优势菌种。由图3(b)可知,在1~10 d,NOB主要受FA抑制,此时段质量浓度为(4.57±3.18) mg·L−1,大于FA对NOB的抑制阈值(1 mg·L−1)[14],此时平均NO2−-N积累率为(36.07±26.14)%。随着AOB的增长及NOB被有效抑制(11~57 d),反应器内的NO2−-N质量浓度明显升高,使得平均FNA质量浓度达到0.0699 mg·L−1,大于FNA对NOB的抑制阈值[15](0.023 mg·L−1),此时NOB受到FA和FNA双重抑制,平均NO2−-N积累率为85.02%。在运行至第59天时,将反应器pH由7.39±0.23升至8.13±0.07后,FNA质量浓度降至(0.019±0.004) mg·L−1,此时NOB主要受到FA抑制,平均NO2−-N积累率(88.54±5.52)%。综上所述,通过FA抑制或FA和FNA双重抑制均可有效抑制NOB,实现亚硝化过程的快速启动。
图4为厌氧氨氧化反应器运行效果。随着进水NH4+-N和NO2−-N质量浓度分别从30 mg·L−1和40 mg·L−1增至360 mg·L−1和380 mg·L−1,反应器负荷从1 312 mg·(m2·d)−1增至13 875 mg·(m2·d)−1。待反应器运行稳定后,出水NH4+-N和NO2−-N质量浓度分别维持在(16.07±4.79) mg·L−1和(19.18±3.05) mg·L−1,平均TN去除率稳定在(84.14±0.66)%。由于ANAMMOX菌以一定的比例消耗NH4+-N和NO2−-N并生成NO3−-N,因此,反应器的基质消耗比(ΔNO2−-N/ΔNH4+-N)和生成比(ΔNO3−-N/ΔNH4+-N)可作为厌氧氨氧化反应器运行效果判断的一项性能指标。本实验中,第1天ΔNO2−-N/ΔNH4+-N为2.76,ΔNO3−-N/ΔNH4+-N为0.37,其均大于STROUS等[16]所给出的理论值(ΔNO2−-N/ΔNH4+-N为1.32,ΔNO3−-N/ΔNH4+-N为0.26),说明反应器启动初期存在反硝化和硝化过程。这主要因为生物膜上存在一定数量的异养菌和硝化菌。由于进水中不含有机物,异养菌难以适应新环境而发生细胞自溶,异养菌可利用NO2−-N作为电子受体进行反硝化过程,使得ΔNO2−-N/ΔNH4+-N比值偏大。除反硝化过程外,因反应器未严格密封以及进水中存在部分溶解氧,故接种生物膜上的NOB发生了硝化反应,使得ΔNO3−-N/ΔNH4+-N比值偏大。随着反应器的持续运行,异养菌被逐步淘汰且厌氧氨氧化成为主导反应,基质消耗比和生成比关系趋于稳定,ΔNO2−-N/ΔNH4+-N为1.10±0.07,ΔNO3−-N/ΔNH4+-N为0.30±0.13,该数值和理论值接近,说明厌氧氨氧化反应器成功启动。
2.2 典型周期
图5(a)为亚硝化反应器典型周期氮组分变化情况。当进水结束时,NH4+-N和NO2−-N质量浓度分别达到最高值和最低值,对应FA和FNA质量浓度也达到最大值和最小值(FA质量浓度为47.73 mg·L−1,FNA质量浓度为0.016 mg·L−1)。随着反应的进行,NH4+-N质量浓度从431.12 mg·L−1降至320.45 mg·L−1,NO2−-N质量浓度从291.82 mg·L−1升至395.45 mg·L−1,而NO3−-N质量浓度增幅仅为3.66 mg·L−1,NO2−-N积累率为93.54%,表明氧化的NH4+-N几乎全部转化为NO2−-N且未被进一步氧化。
在厌氧氨氧化反应器运行前期(1~77 d),采用间歇进水方式运行,在进水NH4+-N和NO2−-N质量浓度分别为150 mg·L−1和165 mg·L−1时,FA和FNA质量浓度最大可达1.50 mg·L−1和0.012 mg·L−1。由于此FNA质量浓度已达到文献报道的ANAMMOX菌抑制阈值下限(0.011~0.077 mg·L−1)[15-17],为避免后期进水浓度提高后FA和FNA对ANAMMOX菌产生抑制,在第77天后将反应器改为连续进水方式。图5(b)为厌氧氧化反应器典型周期氮组分变化(进水NH4+-N和NO2−-N质量浓度分别为360 mg·L−1和380 mg·L−1)。整个周期内NH4+-N和NO2−-N质量浓度均维持在较低水平,最大FA和FNA质量浓度仅为1.25 mg·L−1和0.016 mg·L−1,表明连续进水模式能有效避免反应器内基质浓度过高,可保证ANAMMOX菌在不受抑制的情况下以最大速率进行增殖。
2.3 生物膜及功能微生物活性变化
接种生物膜呈灰黑色且生物量较少(图6(a)),这主要是因为该填料处于好氧池末端,NH4+-N和有机物的负荷较低,导致微生物增殖缓慢。随着亚硝化和厌氧氨氧化反应器的运行,接种后的生物膜均发生明显的变化。在亚硝化反应器中,填料上的生物量明显增加且颜色仍呈现灰黑色(图6(b))。在厌氧氨氧化反应器中,除生物量明显增加外,生物膜颜色呈红棕色(图6(c)),说明ANAMMOX菌在生物膜上成功富集。
有研究表明,AOB和ANAMMOX菌的世代周期分别为0.29~0.33 d−1[18]和11~20 d−1[1,5],表明厌氧氨氧化反应器的启动需要更长的时间。基于这一考虑,本实验中首先启动厌氧氨氧化反应器,经过90 d的启动,ANAMMOX活性从209.86 mg·(m2·d)−1增至6 448.32 mg·(m2·d)−1,其后保持不变(图7(a)),说明90 d时填料上所能容纳的生物量已达到最大。此时,生物膜上ANAMMOX菌的增殖量等于脱落和衰减量之和,生物膜上的ANAMMOX菌已经达到最大值,说明反应器已经成功启动。但此时反应器的运行负荷尚未达到最大,随着进水基质浓度的不断提高,反应器的负荷也在逐渐提高,到180 d时,反应器的去除负荷已接近ANAMMOX的最大活性,反应器的潜力完全得到发挥,从这点说,经过180 d反应器成功启动。亚硝化反应器在厌氧氨氧化反应器启动90 d后开始启动,运行期间AOB的活性随时间的变化关系与ANAMMOX相同,在第60天时,AOB活性从450.72 mg·(m2·d)−1增至5 902.56 mg·(m2·d)−1,其后维持恒定(图7(b)),说明第60天时,亚硝化菌在生物膜中已达到稳态。NOB由于始终受到FA或FNA的抑制,其活性始终维持在较低水平,可避免亚硝氮被进一步氧化为硝氮,为亚硝化反应器的稳定运行创造了条件。
2.4 微生物种群结构变化
生物膜在不同培养方式下的微生物种群结构可通过荧光原位杂交技术进行检测。由图8(a)和图8 (b)可见,在亚硝化反应器中,AOB所占份额由低变高,且基本检测不出NOB,表明在亚硝化反应器通过FA或FNA抑制成功富集AOB的同时也达到了NOB的目的,实现了亚硝化反应器的稳定运行。在厌氧氨氧化反应器中(图8(c)和图8 (d)),ANAMMOX菌所占份额明显增加且表现出较强的荧光信号,表明ANAMMOX菌成为厌氧氨氧化反应器中的优势菌种。
高通量结果(图9)表明,同一接种生物膜在不同条件下培养前后,Chloroflexi,Proteobacteria,Acidobacteria仍维持较高的相对丰度。Chloroflexi菌门起始相对丰度为31.71%,经过2个反应器培养后,相对丰度分别降至18.02%和25.11%。Proteobacteria菌门包括异养菌和部分AOB,其在亚硝化和厌氧氨氧化反应器中的增幅分别为18.29%和10.40%。Planctomycetes菌门包含现有已知所有ANAMMOX菌[1,19],其在亚硝化和厌氧氨氧化反应器中的占比为1.26%和4.26%。对Bacteroidota菌门而言,其起始相对丰度仅为5.65%,经反应器培养后,其占比分别变为19.71%和2.03%,这与Planctomycetes菌门呈现出相反的变化趋势。在属水平上,亚硝化反应器中探明的AOB主要为Nitrosomonas,相对丰度从0.02%增至20.09%,该增幅和Proteobacteria菌门的增幅接近,表明Proteobacteria菌门相对丰度的增加主要为Nitrosomonas增加所致。对NOB而言,起始生物膜上探明的主要为Nitrospira,其相对丰度为0.41%,而在亚硝化反应器中未检测出Nitrospira的存在,说明通过FA或FNA抑制成功淘汰了Nitrospira,从而实现了亚硝化反应的稳定进行。在厌氧氨氧化反应器中,探明的ANAMMOX菌主要为Ca. Brocadia,此结果和目前主流系统内已探明的典型种属一致[20-21],占比由0.62%增至11.00%。除Ca. Brocadia菌属外,还探明有Ca. Jettenia菌属,其相对丰度由未检出增至2.07%。ANAMMOX菌属总增幅为12.45%,其和Planctomycetes菌门增幅接近,表明Planctomycetes菌门相对丰度的增加主要是由于ANAMMOX菌的增加。
硝化菌作为硝化-反硝化过程中的主导微生物而广泛存在于活性污泥,占比可达1%~10%[22-23],以活性污泥作为接种污泥可快速完成亚硝化过程的启动[24-25]。而ANAMMOX菌虽广泛存在于城市污水处理厂中[6-7],但其占比远小于硝化菌。若以活性污泥作为接种污泥启动厌氧氨氧化过程,则需要很长的时间才能启动厌氧氨氧化反应器,因此,为加速厌氧氨氧化的启动过程,选取合适的接种污泥就显得尤为重要。不同接种污泥启动厌氧氨氧化反应器特性如表2所示。以活性污泥、硝化污泥及厌氧污泥作为接种污泥启动厌氧氨氧化反应器,均可实现ANAMMOX反应器的启动。通过对比可发现,以厌氧污泥和硝化污泥为接种污泥所需启动时间较短,而以活性污泥和生物膜为接种污泥所需的启动时间则较长。本实验中,ANAMMOX反应器的启动时长虽有180 d,但处理负荷远大于其他研究,表明以好氧池生物膜为接种污泥启动的厌氧氨氧化反应器可达到较高的负荷,且具有数量多及采集运输便利等优势,从而为厌氧氨氧化工艺启动接种污泥的选择提供了便利。
表 2 不同接种污泥启动厌氧氨氧化反应器特性比较Table 2. Comparison of start-up of ANAMMOX reactor with different inoculated sludges序号 接种污泥 反应器类型 启动时长/d HRT/h NRL/(kg·(m3·d)−1) 温度/℃ 参考文献 1 好氧池生物膜 MBBR 180 18 0.99 30~35 本实验 2 缺氧池生物膜 MBBR 248 18 0.59 13~37 [26] 3 活性污泥 SBR 170 24 1.92 35 [27] 4 活性污泥 USFCWs 105 48 0.058 37 [28] 5 硝化污泥 SBR 61 24 0.14 32 [29] 6 硝化污泥 MBR 70 24 0.098 33 [30] 7 硝化污泥 ABR 111 24 0.089 33 [30] 8 厌氧颗粒污泥 SBR 70 24 0.14 32 [29] 9 厌氧消化污泥 SBR 85 24 0.14 32 [29] 注:USFCWs,人工湿地;SBR,序批式反应器;NRL,氮负荷。 3. 结论
1)以某城市污水处理厂好氧池生物膜为接种污泥可成功启动亚硝化反应器,在进水NH4+-N质量浓度为750 mg·L−1的条件下,反应器负荷可达9 000 mg·(m2·d)−1(以NH4+-N计),平均出水NO2−-N和NH4+-N浓度比值为1.28。
2)以某城市污水处理厂好氧池生物膜为接种污泥可成功厌氧氨氧化反应器,在进水NH4+-N和NO2−-N质量浓度分别为360 mg·L−1和380 mg·L−1的条件下,厌氧氨氧化反应器负荷(以TN计)可达13 875 mg·(m2·d)−1,TN去除率为(84.14±0.66)%。
3)以好氧池生物膜为接种污泥的两段式亚硝化厌氧氨氧化工艺的快速启动为厌氧氨氧化技术接种污泥的选择提供参考。
-
表 1 荧光原位杂交所用探针
Table 1. Probes used in FISH
探针名称 RNA序列 标记细菌种属 Eub338 GCTGCCTCCCGTAGAGT 所有微生物 Eub338II GCAGCCACCCGTAGGTGT 所有微生物 Eub338III GCTGCCACCCGTAGGTGT 所有微生物 Amx368 CCT TTC GGG CAT TGC GAA 所有厌氧氨氧化菌 Nso1225 CGCCATTGTATTACGTGTGA β-Proteobacterial ammonia-oxidizing bacteria Nsm156 TATTAGCACATCTTTCGAT Nitrosomonas spp Nsv443 CCGTGACCGTTTCGTTCCG Nitrosospira spp Ntspa662 GGAATTCCGCGCTCCTCT Genus Nitrospira Nit3 CCTGTGCTCCATGCTCCG Genus Nitrobacter 表 2 不同接种污泥启动厌氧氨氧化反应器特性比较
Table 2. Comparison of start-up of ANAMMOX reactor with different inoculated sludges
序号 接种污泥 反应器类型 启动时长/d HRT/h NRL/(kg·(m3·d)−1) 温度/℃ 参考文献 1 好氧池生物膜 MBBR 180 18 0.99 30~35 本实验 2 缺氧池生物膜 MBBR 248 18 0.59 13~37 [26] 3 活性污泥 SBR 170 24 1.92 35 [27] 4 活性污泥 USFCWs 105 48 0.058 37 [28] 5 硝化污泥 SBR 61 24 0.14 32 [29] 6 硝化污泥 MBR 70 24 0.098 33 [30] 7 硝化污泥 ABR 111 24 0.089 33 [30] 8 厌氧颗粒污泥 SBR 70 24 0.14 32 [29] 9 厌氧消化污泥 SBR 85 24 0.14 32 [29] 注:USFCWs,人工湿地;SBR,序批式反应器;NRL,氮负荷。 -
[1] KUENEN J G. Anammox bacteria: From discovery to application[J]. Nature Reviews Microbiology, 2008, 6(4): 320-326. doi: 10.1038/nrmicro1857 [2] SCHMIDT I, SLIEKERS O, SCHMID M, et al. New concepts of microbial treatment processes for the nitrogen removal in wastewater[J]. FEMS Microbiology Reviews, 2003, 27(4): 481-492. doi: 10.1016/S0168-6445(03)00039-1 [3] BAGCHI S, BISWAS R, NANDY T. Autotrophic ammonia removal processes: Ecology to technology[J]. Critical Reviews in Environmental Science and Technology, 2012, 42(13): 1353-1418. doi: 10.1080/10643389.2011.556885 [4] TERADA A, ZHOU S, HOSOMI M. Presence and detection of anaerobic ammonium-oxidizing (anammox) bacteria and appraisal of anammox process for high-strength nitrogenous wastewater treatment: A review[J]. Clean Technologies and Environmental Policy, 2011, 13(6): 759-781. doi: 10.1007/s10098-011-0355-3 [5] LOPEZ H, PUIG S, GANIGUE R, et al. Start-up and enrichment of a granular anammox SBR to treat high nitrogen load wastewaters[J]. Journal of Chemical Technology and Biotechnology, 2008, 83(3): 233-241. doi: 10.1002/jctb.1796 [6] WANG S, PENG Y, MA B, et al. Anaerobic ammonium oxidation in traditional municipal wastewater treatment plants with low-strength ammonium loading: Widespread but overlooked[J]. Water Research, 2015, 84: 66-75. doi: 10.1016/j.watres.2015.07.005 [7] NEJIDAT A, DIAZ-RECK D, MASSALHA N, et al. Abundance and diversity of anammox bacteria in a mainstream municipal wastewater treatment plant[J]. Applied Microbiology and Biotechnology, 2018, 102(15): 6713-6723. doi: 10.1007/s00253-018-9126-y [8] YESHI C, HONG K B, LOOSDRECHT M C M V, et al. Mainstream partial nitritation and anammox in a 200, 000 m3/day activated sludge process in Singapore: Scale-down by using laboratory fed-batch reactor[J]. Water Science and Technology, 2016, 74(1): 48-56. doi: 10.2166/wst.2016.116 [9] LI J, PENG Y, ZHANG L, et al. Quantify the contribution of anammox for enhanced nitrogen removal through metagenomic analysis and mass balance in an anoxic moving bed biofilm reactor[J]. Water Research, 2019, 160: 178-187. doi: 10.1016/j.watres.2019.05.070 [10] GRAAF A A V D, BRUIJN P D, ROBERTSON L A, et al. Autotrophic growth of anaerobic ammonium-oxidizing micro-organisms in a fluidized bed reactor[J]. Microbiology, 1996, 142(8): 2187-2196. doi: 10.1099/13500872-142-8-2187 [11] 国家环境保护局. 水和废水监测分析方法[M]. 4版. 北京: 中国环境科学出版社, 2002. [12] REGMI P, HOLGATE B, MILLER M W. Nitrogen polishing in a fully anoxic anammox MBBR treating mainstream nitritation-denitritation effluent[J]. Biotechnology and Bioengineering, 2016, 113(3): 635-642. doi: 10.1002/bit.25826 [13] AMANN R, KRUMHOLZ L R, STAHL D A. Fluorescent-oligonucleotide probing of whole cells for determinative, phylogenetic, and environmental studies in microbiology[J]. Journal of Bacteriology, 1990, 172(2): 762-770. doi: 10.1128/jb.172.2.762-770.1990 [14] ANTHONISEN A C, LOEHR R C, PRAKASAM T B S, et al. Inhibition of nitrification by ammonia and nitrous-acid[J]. Water Pollution Control Federation, 1976, 48(5): 835-852. [15] JIN R C, YANG G F, YU J J, et al. The inhibition of the anammox process: A review[J]. Chemical Engineering Journal, 2012, 197: 67-79. doi: 10.1016/j.cej.2012.05.014 [16] STROUS M, HEIJNEN J J, KUENEN J G, et al. The sequencing batch reactor as a powerful tool for the study of slowly growing anaerobic ammonium-oxidizing microorganisms[J]. Applied Microbiology and Biotechnology, 1998, 50(5): 589-596. doi: 10.1007/s002530051340 [17] TANG C J, ZHENG P, HU B L, et al. Influence of substrates on nitrogen removal performance and microbiology of anaerobic ammonium oxidation by operating two UASB reactors fed with different substrate levels[J]. Journal of Hazardous Materials, 2010, 181(1/2/3): 19-26. [18] GE S, WANG S, YANG X, et al. Detection of nitrifiers and evaluation of partial nitrification for wastewater treatment: A review[J]. Chemosphere, 2015, 140: 85-98. doi: 10.1016/j.chemosphere.2015.02.004 [19] CAO S, DU R, PENG Y, et al. Novel two stage partial denitrification (PD)-Anammox process for tertiary nitrogen removal from low carbon/nitrogen (C/N) municipal sewage[J]. Chemical Engineering Journal, 2019, 362: 107-115. doi: 10.1016/j.cej.2018.12.160 [20] CLARACREINO, SUÁREZ-OJEDA M E, PÉREZ J, et al. Stable long-term operation of an upflow anammox sludge bed reactor at mainstream conditions[J]. Water Research, 2018, 128: 331-340. doi: 10.1016/j.watres.2017.10.058 [21] LAURENI M, FALAS P, ROBIN O, et al. Mainstream partial nitritation and anammox: Long-term process stability and effluent quality at low temperatures[J]. Water Research, 2016, 101: 628-639. doi: 10.1016/j.watres.2016.05.005 [22] YAO Q, PENG D C. Nitrite oxidizing bacteria (NOB) dominating in nitrifying community in full-scale biological nutrient removal wastewater treatment plants[J]. AMB Express, 2017, 7(1): 1-11. doi: 10.1186/s13568-016-0313-x [23] 姚倩. 生物脱氮系统中硝化菌的种群结构、功能及反应动力学研究[D]. 西安: 西安建筑科技大学, 2018. [24] 王博, 姚倩, 彭党聪, 等. 双重抑制下亚硝化系统的启动及运行特性[J]. 环境工程学报, 2017, 11(3): 1525-1532. doi: 10.12030/j.cjee.201511064 [25] 李惠娟, 彭党聪, 陈国燕, 等. 两种不同抑制策略下部分亚硝化系统运行特性比较[J]. 环境科学, 2017, 38(5): 267-275. [26] 吕恺, 彭党聪, 姚雪薇, 等. 常温MBBR处理低浓度含氮废水的快速启动及运行状况[J]. 环境工程学报, 2020, 14(10): 146-153. [27] 李惠娟, 彭党聪, 陈国燕, 等. ANAMMOX的快速启动及EPS在ANAMMOX颗粒污泥中的空间分布[J]. 环境科学, 2017, 38(7): 2931-2940. [28] LI H, CHI Z, YAN B. Successful start-up of the anammox process in constructed wetland microcosms: Influence of the electron acceptors on performance, microbial community, and functional genes[J]. Environmental Science and Pollution Research, 2019, 26: 5202-5209. doi: 10.1007/s11356-018-3996-5 [29] 路青, 李秀芬, 华兆哲, 等. 接种污泥源对厌氧氨氧化启动效能的影响[J]. 生态与农村环境学报, 2009, 25(4): 60-65. doi: 10.3969/j.issn.1673-4831.2009.04.012 [30] 闾刚, 徐乐中, 沈耀良, 等. 快速启动厌氧氨氧化工艺[J]. 环境科学, 2017, 38(3): 1116-1121. -




 下载:
下载: