-
人类对化石能源需求的逐年增加,导致了其储量的剧烈下降;而且,化石能源的大量使用也造成了环境污染问题的频发[1]。因此,寻找可替代的清洁能源已成为能源发展的新趋势。作为第4代生物质燃料,微藻具有生长速率快、二氧化碳固定效率高、油脂累积量高,不与人争粮争地等优势,在未来商业与工业化应用方面潜力巨大,故相关研究已成为生物质能源研究领域的热点[2-3]。而且,微藻可以高效吸收水中氮、磷等物质,并利用其作为自身营养物质生长,因而可在累积能源生物质的同时,实现净水目的。有研究表明,微藻可有效降低生活污水、食品加工及畜禽养殖污水中的污染物,在COD、氨氮(
NH+4 -N)、总磷(TP)的去除率及油脂累积量方面具有巨大的潜力[4-6]。目前,基于微藻的污水处理与资源化技术在世界范围内得到了较好的发展,具有广阔的应用前景[7]。然而,基于微藻的水处理与资源化技术的产业化推广仍面临许多挑战,其中藻细胞的收获是实现营养物质后续增值利用的关键环节,也是制约其大规模商业化应用的瓶颈。微藻细胞直径仅为3~30 μm,密度接近水,带负电荷。因此,藻细胞可以稳定地悬浮在水中,难以被自然分离[8]。传统的微藻收获技术主要包括离心法、膜过滤法、气浮法及絮凝法等[9-12]。前3种方法操作便捷、分离速度快、分离效率高,但其设备安装复杂、造价高[9-10];而絮凝法中,化学絮凝法主要利用微藻和絮凝剂之间的电荷中和作用回收藻细胞,其收获率高,但存在残留金属离子二次污染问题[9-11]。近年来,生物絮凝法因其具备良好的环境友好性、无二次污染、操作简便等优点受到了广泛的关注,具有广阔的工业化应用前景[12]。生物絮凝法包括微生物絮凝和微藻细胞自絮凝2种方式[13]。微生物絮凝是利用细菌或真菌等微生物分泌的胞外分泌物(exocellular polymeric substances,EPS)及自身结构,通过电荷中和或网捕卷扫作用使藻细胞絮凝。细菌、真菌与放线菌是主要的絮凝微生物。其中,真菌在自然界中存在广泛、容易获得,其菌丝结构致密、吸附效果好,应用潜力大[12-14]。有研究结果表明,米曲霉、青霉和黑曲霉等真菌可实现90%以上微藻回收[15-16]。黑曲霉(Aspergillus niger)是一种常见的曲霉属真菌,属于半知菌亚门的丛梗孢科,具有生长快速、成球性能好、菌丝球结构致密、比表面积大等特点,可实现90%以上的藻细胞回收率,在微藻收获领域受到了学者们广泛关注[17-21]。经收获后的黑曲霉菌丝球与藻细胞混合体可直接通过水热法转化为生物原油,且其操作过程简单高效。然而,目前针对富油小球藻絮凝效果及其絮凝机制方面的探讨较为欠缺。
本研究首先考察了从猪粪沼气站分离纯化的一株高含油小球藻Chlorella sp. M-12对猪粪沼液中氮磷的吸收效果,随后采用黑曲霉菌丝球对其进行了生物絮凝采收;考察了不同因素及水平对黑曲霉菌丝球絮凝收获Chlorella sp. M-12的影响,并初步探讨了其絮凝机制。本研究结果可为能源微藻的快速、高效、经济采收方法与技术提供参考。
-
本实验所用藻种为从北京市平谷区某沼气站的土壤中自行分离纯化而得到的一株小球藻Chlorella sp. M-12,其含油率最高可达50%。藻种的培养基为BG-11[18],培养温度为(25±1)℃,光照强度为200 μmol·(m2·s)−1,光照周期L∶D(光∶暗)为12∶12。微藻生长3 d后进入指数增长期,后续实验均采用指数增长期获得的微藻作为供试藻种。微藻的干重-光密度曲线见式(1)。
式中:Y为微藻细胞干重,mg·L−1;
ρL 为光密度;R2为拟合度。实验所用黑曲霉(Aspergillus niger)购自中国微生物菌种保藏中心(CGMCC,编号XZ0007)。将其接种于灭菌后的麦芽汁试管斜面固体培养基[13]内,以制备黑曲霉孢子悬浊液。接种的黑曲霉生长50~70 h后进入对数生长期,此时试管内形成表面带有黑色颗粒状孢子的白色菌丝球。将0.5 mL灭菌的马丁氏培养基[12]加入上述盛有菌丝球的斜面试管中,将孢子振荡至马丁氏培养基中,并将其转移至5 mL灭菌离心管中,最终采用无菌水将孢子悬浊液稀释至50 mL,并置于250 mL三角瓶中备用。使用无菌吸管将上述制备的黑曲霉孢子悬浊液1 mL转移至灭菌的、盛有100 mL马丁氏培养基的250 mL三角瓶中,置于恒温振荡培养器中(培养温度为28 ℃、pH为6.0、转速为150 r·min−1)。培养约30 h后会形成肉眼可见成团的菌丝颗粒,随后很快形成菌丝球。第4天即可得到大量大小均匀、吸附性能良好的菌丝球(此时菌丝球干重为1.40~1.60 g·L−1、直径为4~5 mm)。
供试污水采用经过厌氧发酵及絮凝-好氧生物滤池法处理过的猪粪沼液。该沼液的COD、
NH+4 -N与TP浓度分别为1 100~1 200 mg·L−1、700~730 mg·L−1及32~40 mg·L−1。沼液pH为8.0~8.5。 -
考察Chlorella sp. M-12对不同沼液稀释液中COD、NH4+-N和TP的去除效果及藻生物量积累状况。反应器为250 mL锥形瓶,供试体积为150 mL。猪粪沼液经过0.22 µm滤膜过滤后,用去离子水稀释至6个不同的沼液浓度梯度(2.5%、5%、10%、15%、20%、25%;对应氨氮质量浓度分别为24、40、89、124、150、182 mg·L−1)。相应地,COD 、NH4+-N与TP质量浓度分别为100~300、24~182及2.0~10.0 mg·L−1。将处于对数生长期的微藻接种于上述6组猪粪沼液中,每组实验重复3次。微藻的初始接种量为30~100 mg·L−1(干重),每隔2 d测定污水中的COD、NH4+-N与TP质量浓度及微藻干重。
-
1)黑曲霉菌丝球絮凝收获Chlorella sp. M-12条件优化。考察不同的菌、藻干重比,初始pH,培养温度,培养转速对黑曲霉菌丝球絮凝收获Chlorella sp. M-12的效果。所有处理组的反应器为250 mL锥形瓶;黑曲霉菌丝球在藻液中停留时间为2 h,每组实验重复3次。
菌藻干重比。设置黑曲霉菌丝球∶微藻(菌藻干重比)比为1∶1、1∶2、1∶3。制取干重为1.6 g·L−1的黑曲霉菌丝球混合液。将上述混合液于2 000 r·min−1下离心2 min后弃去上清液,获得黑曲霉菌丝球备用。制备符合上述菌藻干重之比的Chlorella sp. M-12藻液。将制取的Chlorella sp. M-12藻液于7 000 r·min−1离心15 min后弃去上清液获得藻细胞,再用100 mL蒸馏水将其转移至250 mL三角瓶中,摇动三角瓶使其分散均匀。调节藻液初始pH为6.0,加入已制备好的黑曲霉菌丝球,设置温度为28 ℃,培养转速为180 r·min−1。
初始pH。采用1 mol·L−1的盐酸和1 mol·L−1氢氧化钠溶液调节Chlorella sp. M-12藻液初始pH分别为5.0、6.0、7.0、8.0、9.0、10.0,再加入黑曲霉菌丝球。设置菌藻干重比为1∶1、温度为28 ℃、培养转速为180 r·min−1。
温度。温度梯度设置为24、28、32和36 ℃。初始pH为6.0,菌藻干重比为1∶1、温度为28 ℃、培养转速为180 r·min−1。
培养转速。转速分别设置为120、140、160和180 r·min−1。设置菌藻干重比为1∶1、初始pH为6.0、温度为28 ℃。
上述所有实验处理组均每隔15 min取8 mL上清液测定OD680。
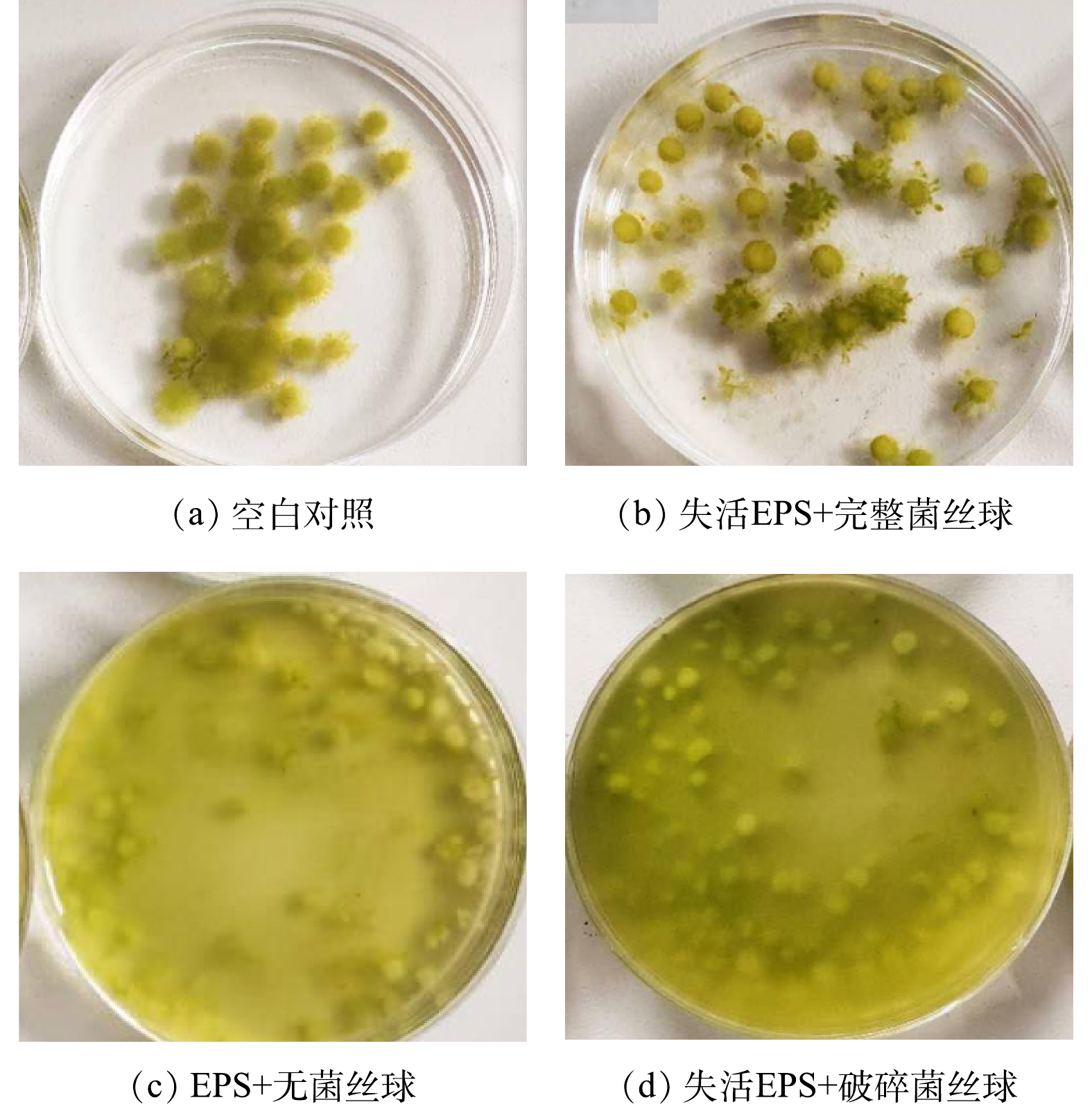
2)黑曲霉菌丝球絮凝收获Chlorella sp. M-12机制。采用培养成熟的黑曲霉菌丝球作为实验材料,设置4组处理:1)空白对照组,即菌丝球的EPS未经处理且菌丝球保存完好的组别,目的是为了考察EPS未失活状态下与黑曲霉菌丝共同作用对Chlorella sp. M-12收获率的影响;2)失活EPS+完整菌丝球组,即将菌丝的EPS移除但保留菌丝结构完整性的处理组,其目的是为了考察完整的、未遭到破坏的菌丝球对Chlorella sp. M-12收获率的影响;3)EPS+无菌丝球,即提取了黑曲霉菌丝球的EPS并将其加入藻液中进行絮凝的处理组,代表了只有EPS而无菌丝的作用下对Chlorella sp. M-12收获率的影响;4)失活EPS+破碎菌丝,即移除菌丝球的EPS并将菌丝球剪碎的处理组,其目的是为了考察在菌丝球完整结构被破坏与失活的EPS作用下,Chlorella sp. M-12收获率变化。将菌丝球置于70 ℃的恒温水浴锅中加热30 min可以获得失活的EPS菌丝球[22-23];剪碎菌丝球处理组则用灭菌后的剪刀或美工刀将完整的菌丝球剪碎,破坏其完整结构。
-
黑曲霉菌丝球直径采用游标卡尺进行测量[14]。黑曲霉菌丝球干重的测量参考《水与废水监测分析方法(第四版)》中的残渣测量方法[24]。pH、COD、NH4+-N及TP指标参考《水与废水监测分析方法(第四版)》中相应方法 [24]。微藻Chlorella sp. M-12生物量测定采用光密度法[24]。EPS的提取与测量方法参见参考文献[22-23]。采用扫描电镜(JSM-7001F,日本电子公司)对收获微藻前后的黑曲霉菌丝球形态与结构进行观察。
微藻收获率的计算方法见式(2)。
式中:R为收获效率;N0为藻细胞初始光密度;Nt为絮凝后剩余藻细胞光密度。
-
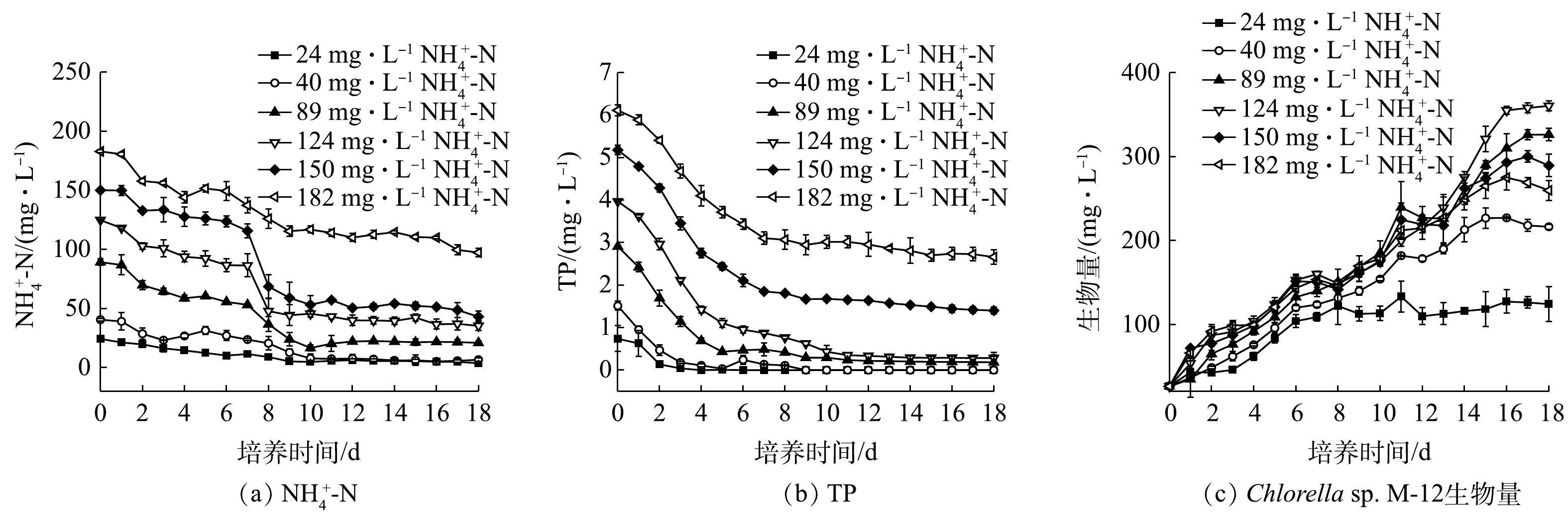
在不同污染物质量浓度下,Chlorella sp. M-12对猪粪沼液中
NH+4 -N与TP的去除率如图1所示。结果表明,各组NH+4 -N与TP浓度随处理时间的延长均有所下降。其中,NH+4 -N去除率的最高值出现在24 mg·L−1NH+4 -N组(图1(a)),达84.18%。TP去除率的最高值出现在24和40 mg·L−1NH+4 -N组,均达100%(图1(b))。上述结果表明,Chlorella sp. M-12具有较强的脱氮除磷潜力。微藻生物量的最高值出现在24 mg·L−1NH+4 -N组,达350 mg·L−1(图1(c)),即每消耗1 g的NH+4 -N可产出4.3 g微藻干物质。另外,微藻在水体中通常采用光自养模式生存,所利用的碳源为空气中CO2。在本研究中,COD去除率为30%~50%。这说明,在含有机物的猪粪沼液中,Chlorella sp. M-12采用了兼养模式生存,回收了一部分有机碳源。 -
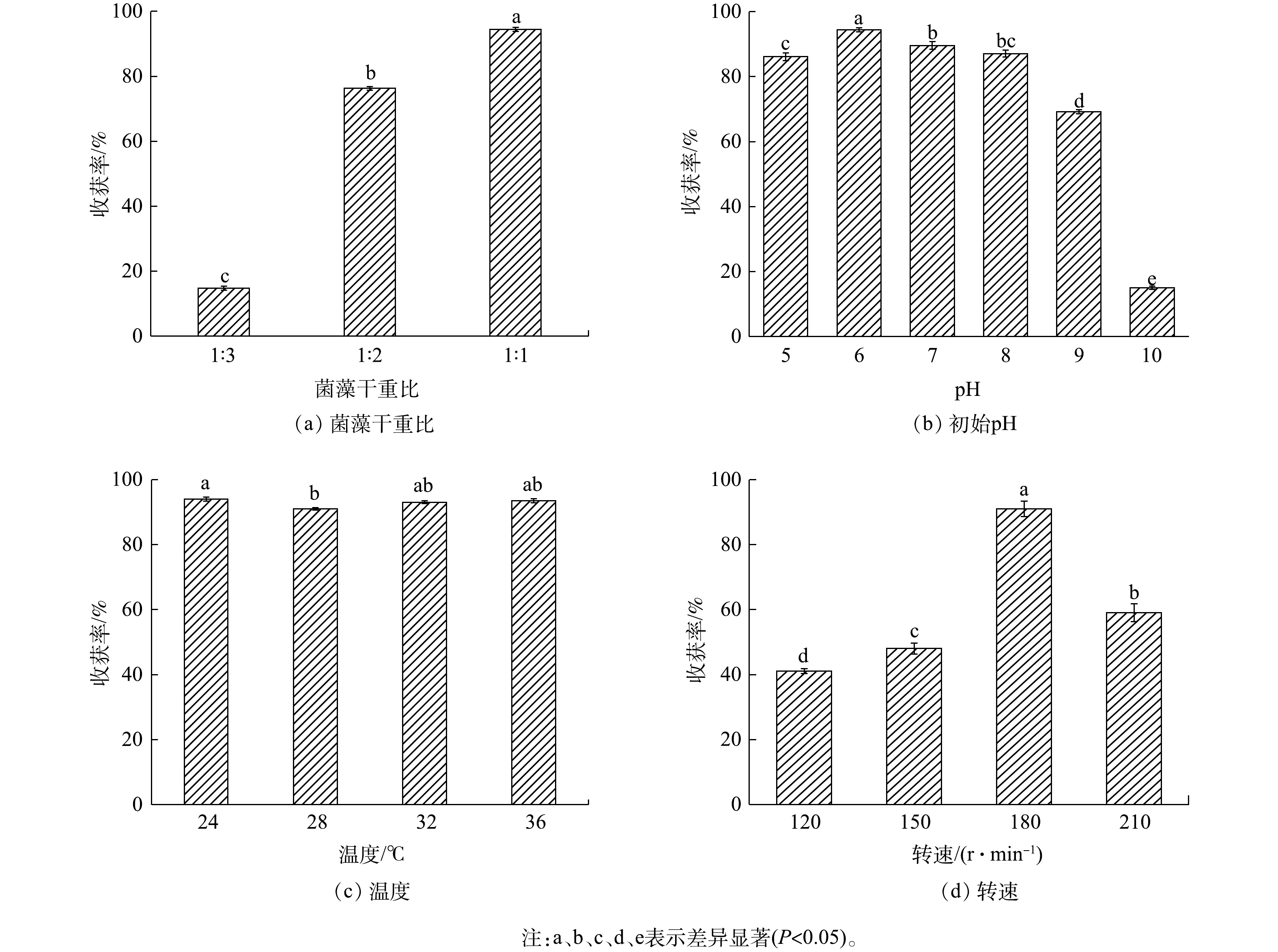
1)菌藻干重比对絮凝收获Chlorella sp. M-12的影响。由图2(a)可知,较高的菌藻干重之比有利于Chlorella sp. M-12的絮凝收获。在反应1 h之内,黑曲霉菌丝球与Chlorella sp. M-12干重之比为1∶1组的收获率最高,达到94.2%。这与叶晨松[15]和XIE等[16]的研究结果一致,即最佳菌藻的投量之比为1∶1时,微藻的絮凝收获率最高,可达98%。同时,因叶晨松[15]和XIE等[16]所使用的青霉、刺孢小克银汉霉菌与黑曲霉同样都属于霉菌,而霉菌絮凝收获微藻可能是由于霉菌胞外EPS及自身结构的网捕卷扫作用造成的,因此,提高菌藻干重比,可显著提高微藻的收获率。
2)初始pH对黑曲霉收获Chlorella sp. M-12的影响。由图2(b)可知,初始pH对Chlorella sp. M-12的收获率具有一定的影响。当pH为5.0~10.0时,Chlorella sp. M-12的收获率随pH的升高呈现先升后降的趋势。初始pH在5.0~8.0的范围内,Chlorella sp. M-12收获率均可达85%以上。尤其当pH为6.0时,Chlorella sp. M-12收获率最高,达到94.7%。而当pH达到9.0时,微藻收获率降低至69.2%,当pH达到10.0时,微藻收获率降低至15.0%。上述结果与前人的研究结果略有差异,叶晨松[15]、顾琼等[25]和ZHOU等[20]分别利用了青霉、卷枝毛霉和米曲霉收获普通小球藻,得到的最适pH分别是4.0、6.0和4.0,其收获率分别达到了99%、81%和100%。
微藻适宜生长pH范围通常为5~11,此时溶液等电点能使带负电的细胞相互排斥,保持细胞分散且稳定的状态[26]。在微藻生长的过程中,其细胞代谢产物会不断溶解至培养液中,导致培养液pH逐渐升高,最终呈碱性。而大部分真菌在偏酸性环境中生长更为旺盛,形成的菌丝活性更强,更容易形成菌丝球,并且该过程会产生一定量的EPS,有利于吸附微藻细胞[12]。本研究结果与其他研究结果的差异,可能是由于所使用的真菌所适宜生长的pH范围不同造成的。
3)温度对黑曲霉菌丝球收获Chlorella sp. M-12的影响。图2(c)表明,在24~36 ℃下,各组Chlorella sp. M-12收获率均在91%~94%,且各组之间差异性不明显。这与前人的研究结论一致,即在25~40 ℃时,菌丝球对栅藻的吸附率均可达90%以上[15-18, 26]。其原因可能是:在较短的吸附时间内(15~20 min),温度梯度的变化对真菌及微藻的生理生化代谢活动影响程度较低。
4)转速对黑曲霉菌丝球收获Chlorella sp. M-12的影响。图2(d)表明,当转速为180 r·min−1时,Chlorella sp. M-12收获率最高,达到91%。而当转速低于180 r·min−1时(120、150 r·min−1),Chlorella sp. M-12的收获率仅为40%~50%。然而,高转速也不利于微藻收获:当转速升至210 r·min−1时,Chlorella sp. M-12的收获率低于60%。这与裴轩瑗[18]的研究结果类似,即适宜的转速(160 r·min−1)可保证黑曲霉对栅藻的收获率达到最高(96%)。
传统的絮凝主要包括网捕卷扫、电荷中和与吸附架桥3种作用方式[27-29]。在不同的转速下,菌丝球与微藻的接触程度也各不相同,进而导致上述3种絮凝作用方式产生不同的效果。有研究表明,菌丝球收获微藻的效果,一方面取决于两者的碰撞概率;另一方面取决于菌丝球的吸附性能[27]。而碰撞概率又由微生物粒径、微生物形状和相对运动所决定,因此,可以通过改变转速,调整菌丝球与微藻之间的相互运动,从而影响2者的碰撞概率,并最终获得较高的微藻收获率。在慢速条件下,菌体和微藻的相对运动较慢、碰撞效果较差,大部分微藻不能较好地附着在菌丝球上;而当转速过高时,菌丝球可能会因水流剪切力过大而阻碍菌丝球表面絮凝物质/电荷与微藻细胞之间的相互作用,甚至破坏菌丝球的完整结构,从而降低微藻收获率[27-28]。因此,保持合适的转速可以增加混合液体的湍流,使得藻细胞产生一定的动能,从而克服水流阻力进入菌丝球内部,并更好地黏附在菌丝上,实现较高的收获率。
前人研究普遍采用不同属的霉菌进行藻细胞收获[15-18, 26]。其中,发现对收获效果影响较大的因素是初始pH。最佳pH多在霉菌最适生长的pH范围内。这说明,霉菌的生长状态对微藻的絮凝采收起到了重要作用。另外,适宜的转速对真菌絮凝藻细胞效果有一定的影响,这说明除了碰撞产生的作用外,霉菌与微藻细胞之间的电荷相互作用,可能是影响微藻絮凝效果的原因之一。另外,温度对真菌絮凝微藻效果普遍影响不大。
-
菌丝球收获Chlorella sp. M-12前、后,其内部菌丝形态的扫描电镜如图3(a)~图3(c)所示。可以看出,收获藻细胞前的黑曲霉菌丝球为致密的球状物,其结构较为完整,菌丝表面光滑,菌丝球内部的菌丝相互缠绕并交织成致密的网状结构。这种结构使菌丝球具有较高的比表面积,为微藻的吸附提供了较高的吸附容量与结合点位。由图3(d)可以看出,收获Chlorella sp. M-12后的黑曲霉菌丝球内外部及菌丝上附着有藻细胞。李祎等[12]及BARROS等[26]的研究表明,真菌收获微藻主要通过直接与间接絮凝2种方式进行。其中,直接絮凝是真菌的菌丝球通过网捕卷扫将藻细胞黏合在一起,从而形成大体积的沉降物。本研究进一步验证了此结论,即菌丝的完整性可能是提高絮凝效果的重要原因。
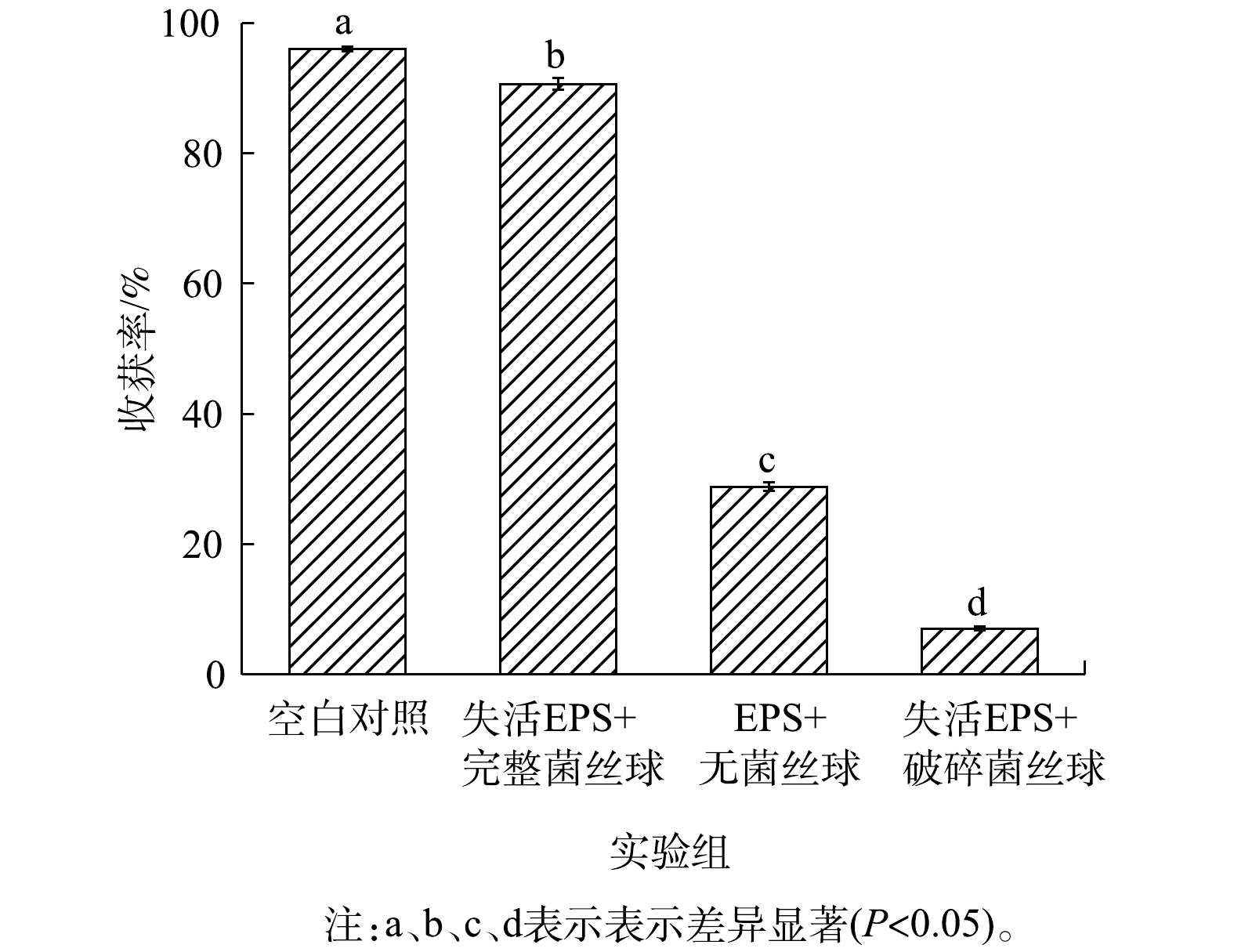
图4与图5分别为经过不同处理后Chlorella sp. M-12收获率及菌藻成球外观状态。由图4可知,Chlorella sp. M-12收获率由高到底顺序为:EPS+完整菌丝球(96.0%)>失活EPS+完整菌丝球(90.6%)>EPS+无菌丝球(28.8%)>失活EPS+破碎菌丝球组(7.0%),且各组之间差异显著。因此,可以推测,黑曲霉菌丝球的网捕卷扫作用与EPS的电荷中和的共同作用获得了较高的Chlorella sp. M-12收获率。其中,完好菌丝球的网捕卷扫作用在收获Chlorella sp. M-12中占主导:在EPS失活条件下,只存在完整的菌丝球时,Chlorella sp. M-12的收获率虽然有下降,但仍然达到91%;而无菌丝球或者菌丝球被破坏时,Chlorella sp. M-12的收获率分别下降到28.8%和7.0%,比空白组分别降低了67.2%以及89.0%。另外,由上述结果可知,EPS对 Chlorella sp. M-12的收获起次要的作用:当只有EPS存在时,Chlorella sp. M-12的收获率为28.8%。这说明,真菌的菌丝球通过分泌带有不同电荷属性的蛋白质、多糖等物质,利用电中和特性,最终可使藻细胞聚集并絮凝沉降。
-
1)高含油小球藻Chlorella sp. M-12对猪粪沼液中
NH+4 -N与TP的去除率可分别高达84.2%与100%;营养回收方面,每消耗1 g的NH+4 -N可生产4.3 g的微藻干物质。这表明,Chlorella sp. M-12具有较强的氮磷吸收潜力。2)黑曲霉菌丝球能高效收获能源微藻Chlorella sp. M-12,其最佳收获条件为:菌藻干重比为1∶1、初始pH为6.0、培养温度为28 ℃,转速为180 r·min−1。在最佳条件下,Chlorella sp. M-12收获率可在1 h内达90%以上。
3)黑曲霉菌丝球结构的完整性产生的网捕卷扫与EPS的共同作用是实现高效Chlorella sp. M-12絮凝收获的重要原因。其中,菌丝球的网捕卷扫的功能占主导作用,其次为菌丝球分泌的EPS的电荷中和作用。
黑曲霉菌丝球絮凝能源微藻Chlorella sp. M-12的优化
Flocculation effect optimization of Aspergillus niger mycelium to an energy microalgae Chlorella sp. M-12
-
摘要: 针对能源微藻采收效率低、能耗高的问题,采用一株黑曲霉Aspergillus niger的菌丝球絮凝能源微藻Chlorella sp. M-12,以期提供一种快速高效的营养回收及藻细胞采收方法。通过优化实验考察了能源微藻Chlorella sp. M-12去除猪粪沼液污染物的效果及黑曲霉菌丝球初始投量、pH、温度及转速等条件对絮凝Chlorella sp. M-12的影响,并进行了絮凝机制分析。结果表明,在初始
NH+4 -N质量浓度为24 mg·L−1 时,猪粪沼液中NH4+-N、TP去除率分别达到84.2%及100.0%,每消耗1 gNH+4 -N可产出4.3 g Chlorella sp. M-12干物质。黑曲霉菌丝球与Chlorella sp. M-12干重比为1∶1、初始pH为6.0、培养温度为28 ℃、转速为180 r·min−1时,Chlorella sp. M-12的收获率可达90%以上。黑曲霉菌丝球的网捕卷扫及其胞外聚合物的电中和作用导致了较高的Chlorella sp. M-12收获率。该研究结果可为微藻污水资源化技术中资源回收及藻细胞采收提供参考。Abstract: Aiming at solving the problems of low harvesting ratio and high cost of energy microalgae collection, the mycelial of a strain of Aspergillus niger were used to flocculate Chlorella sp. M-12, which was expected to provide a rapid and effective method for nutrient recovery and microalgal cells harvesting. The optimization experiments about piggery biogas slurry treatment by using Chlorella sp. M-12, and initial inoculate size of Aspergillus niger mycelium, initial pH, temperature, and rotation speed for Chlorella sp. M-12 flocculation were implemented. In addition, the bio-flocculation mechanism was also explored. Results showed that with the initialNH+4 -N concentration of 24 mg·L−1,NH+4 -N and TP removal in piggery biogas slurry reached 84.2% and 100%, which meant consuming 1 gNH+4 -N could produce 4.3 g dry microalgal biomass. The highest Chlorella sp. M-12 harvest ratio reached above 90% under the optimal conditions with the Aspergillus niger mycelium to Chlorella sp. M-12 (dry cell weight) ratio of 1∶1, initial pH of 6.0, temperature of 28 ℃ and rotation speed of 180 r·min−1. The trapping and sweeping, and the charge neutralization effects of Aspergillus niger mycelium ball might be the main reason for the high Chlorella sp. M-12 harvest ratio. This research will provide the theoretical bases and technology support for the nutrients recovery and microalgal harvest from wastewater. -
-
[1] 叶玉. 全球能源治理: 结构、挑战及走向[J]. 国际石油经济, 2011, 19(8): 44-50. doi: 10.3969/j.issn.1004-7298.2011.08.010 [2] 刘晓晨. 藻类在水体脱氮除磷中的作用及其资源化利用[J]. 环境科学与技术, 2014, 37(3): 18-24. [3] MEMON A R, ANDRESEN J, HABIB M, et al. Simulated sugar factory wastewater remediation kinetics using algal-bacterial raceway reactor promoted by polyacrylate polyalcohol[J]. Bioresource Technology, 2014, 157: 37-43. doi: 10.1016/j.biortech.2014.01.047 [4] SHAHID A, MALIK S, ZHU H, et al. Cultivating microalgae in wastewater for biomass production, pollutant removal, and atmospheric carbon mitigation: A review[J]. Science of the Total Environment, 2020, 704: 135303. doi: 10.1016/j.scitotenv.2019.135303 [5] 沈俏会. 基于产油微藻的污水深度处理及过程调控[D]. 杭州: 浙江大学, 2015. [6] 仪超. 以生活污水为底物的产油微藻筛选与培养条件优化研究[D]. 哈尔滨: 哈尔滨工业大学, 2013. [7] 张海阳, 匡亚莉, 林喆. 能源微藻采收技术研究进展[J]. 化工进展, 2013, 32(9): 2092-2098. [8] CHRISTENSON L, SIMS R. Production and harvesting of microalgae for wastewater treatment, biofuels, and bioproducts[J]. Biotechnology Advances, 2011, 29(6): 686-702. doi: 10.1016/j.biotechadv.2011.05.015 [9] 郭锁莲, 赵心清, 白凤武. 微藻采收方法的研究进展[J]. 微生物学通报, 2015, 42(4): 721-728. [10] HUNTLEY M E, JOHNSON Z I, BROWN S L, et al. Demonstrated largescale production of marine microalgae for fuels and feed[J]. Algal Research, 2015, 10: 249-265. doi: 10.1016/j.algal.2015.04.016 [11] 张佳琪, 庞宁, 杨舒棋, 等. 絮凝法采收生物燃料微藻的研究进展[J]. 环境保护与循环经济, 2017, 37(3): 25-30. doi: 10.3969/j.issn.1674-1021.2017.03.007 [12] 李祎, 许艳婷. 絮凝微生物采收微藻的作用机制研究进展[J]. 微生物学通报, 2019, 46(5): 1196-1203. [13] 刘洁霞. pH诱导能源微藻原位絮凝方法的建立及机理研究[D]. 广州: 暨南大学, 2014. [14] MURADOV N, TAHA M, MIRANDA A F, et al. Fungal-assisted algal flocculation: Application in wastewater treatment and biofuel production[J]. Biotechnology for Biofuels, 2015, 8(1): 1-24. doi: 10.1186/s13068-014-0179-6 [15] 叶晨松. 基于丝状真菌的微藻收获技术研究及废水处理初探[D]. 南昌: 南昌大学, 2018 [16] XIE S, SUN S, DAI S Y, et al. Efficient coagulation of microalgae in cultures with filamentous fungi[J]. Algal Research, 2013, 2: 28-33. doi: 10.1016/j.algal.2012.11.004 [17] 王宝石, 李林波, 谭凤玲, 等. 剪切力敏感型微生物形态塑造及其在柠檬酸发酵中的应用[J]. 食品与发酵工业, 2018, 44(12): 267-273. [18] 裴轩瑗. 黑曲霉菌丝球固定栅藻强化生物量的采收[D]. 哈尔滨: 哈尔滨工业大学, 2017. [19] LI Y, XU Y T, LIU L, et al. Flocculation mechanism of Aspergillus niger on harvesting of Chlorella vulgaris biomass[J]. Algal Research, 2017, 27: 402-412. [20] ZHOU W G, MIN M, HU B, et al. Filamentous fungi assisted bio-flocculation: A novel alternative technique for harvesting heterotrophic and autotrophic microalgal cells[J]. Separation and Purification Technology, 2013, 107(2): 158-165. [21] PRAJAPATI S K, KUMAR P. Exploring pellet forming Filamentous fungi as tool for harvesting non-flocculating unicellular microalgae[J]. Bioenergy Research, 2014, 7(4): 1430-1440. doi: 10.1007/s12155-014-9481-1 [22] 唐虹, 康得军, 匡帅, 等. 胞外聚合物提取方法的研究进展[J]. 市政技术, 2016, 34(5): 162-166. doi: 10.3969/j.issn.1009-7767.2016.05.043 [23] KADIR W N A, LAM M K, UEMURA Y, et al. Bio-harvesting and pyrolysis of the microalgae Botryococcus braunii[J]. Bioresource Technology, 2015, 191: 117-123. doi: 10.1016/j.biortech.2015.04.113 [24] 国家环境保护总局. 水和废水监测分析方法[J]. 4版. 北京:中国环境科学出版社, 2002: 102. [25] 顾琼, 金文标, 陈远清, 等. 利用卷枝毛霉成球特性高效收获微藻[J]. 环境科学, 2017, 38(2): 688-696. [26] BARROS A I, GONÇALVES A L, SIMÕES M, et al. Harvesting techniques applied to microalgae: A review[J]. Renewable and Sustainable Energy Reviews, 2015, 41: 1489-1500. doi: 10.1016/j.rser.2014.09.037 [27] 任婷婷. 絮凝搅拌效果的试验及流场模拟研究[D]. 马鞍山: 安徽工业大学, 2016. [28] 万春, 张晓月, 赵心清, 等. 利用絮凝进行微藻采收的研究进展[J]. 生物工程学报, 2015, 31(2): 161-171. [29] 刘亚. 浮选体系中气泡与矿粒絮凝体作用过程研究[D]. 唐山: 华北理工大学, 2018. -














 下载:
下载: