-
生物炭由于其价格低廉、来源广泛,并且在去除土壤、水体污染物应用中展现了良好的应用潜力[1-3],引起了研究者对其与污染物相互作用机制的关注与探索。生物炭吸附-降解污染物能力与生物炭的比表面积、极性、芳香性以及表面官能团等结构有较大关联[4-5],而上述结构特性均与生物炭制备温度密切相关[6-7]。前期研究显示,随着制备温度的增高,生物炭比表面积增大、C结构形成致密的芳香环,但O元素随之下降,表面含氧官能团种类、数量也随之发生变化[8-10]。因此,由于制备温度产生的生物炭含氧结构的性质差异导致其与污染物之间的相互的作用方式也发生改变[11-12]。
早期研究者针对生物炭去除污染物的探索主要集中在吸附过程。随着研究的不断深入,研究者发现水体或土壤中添加生物炭后,污染物表观浓度的减少过程不仅包含吸附,还伴随着降解的作用[13-14]。这一结论引发了研究者对生物炭作为新型功能性材料去除污染物的机制新的思考与探索。在对生物炭降解作用的探索过程中,生物炭中的环境持久性自由基(environmentally persistent free radicals, EPFRs)对污染物的氧化作用吸引了研究者的关注[15-17]。有研究在生物炭-对硝基苯酚(PNP)降解体系中,将EPFRs列为降解的主要原因[13]并排除了小分子自由基对PNP降解的贡献;还有研究组发现EPFRs活化过硫酸盐降解促进污染物降解的过程[18]。然而,随着研究的深入,污染物降解程度与EPFRs信号强度出现了不完全匹配的现象。通常,400—700 ℃制备的生物炭自由基信号最强,但自由基信号强度较弱的生物炭(小于400 ℃或大于700 ℃制备)的降解程度反而更高[19-20]。随着越来越多的降解现象无法通过EPFRs一种途径完全解释,研究者们提出,生物炭降解污染物机制可能还包含除了EPFRs以外的途径。近期,生物炭含氧结构参与降解污染物的想法被提出[21],并逐渐成为生物炭去除污染物的研究重点。
为了明确生物炭表面含氧观官能团类型以及含量在去除污染物过程中的作用,研究者通过不同的检测手段对生物炭表面含氧官能团进行定性、定量分析,并使用多种改性方式调控生物炭表面含氧官能团类型和相对含量[4, 22-23],主要以物理、化学改性方式为主,针对性地提高生物炭的氧化或还原能力;还包括微生物作为电子供体与含氧官能团产生协同作用,达到增强污染物吸附-降解的目的[23]。本文以生物炭制备温度为背景,总结了不同温度制备的生物炭在吸附与降解污染物过程中因含氧结构的不同产生的差异,并在现有的研究基础上,归纳了通过不同热解方式、氧化/还原剂改性生物炭以及负载目标官能团等多种方式增强生物炭去除污染物的能力,为后期有选择性地应用生物炭提供一定的参考与依据。
-
与活性炭、石墨烯等其他碳基材料相比,生物炭在吸附污染物方面展现出更优越的性能[24]。早期研究结果表明,吸附机制主要分为物理吸附和化学吸附。物理吸附与生物炭的孔半径、数量、C结构有关[25-26]。在物理吸附过程中,100—400 ℃制备的生物炭保留着部分未完全炭化的结构,这些未炭化的部分也参与了部分吸附行为[8, 26-27]。此制备温度区间烧制的生物炭由于比表面积有限,更大程度上是通过氧化还原或催化的方式达到吸附污染物的目的[24, 28]。而500—1000 ℃烧制的生物炭拥有更大的比表面积,以及更完整的芳香结构[29]。结构的变化导致生物炭吸附方式随之改变[30],丰富的芳香结构使500、1000 ℃烧制的生物炭极性降低,疏水性的增强在吸附污染物时发挥了巨大作用[8, 27, 31]。化学吸附过程当中,由于含氧官能团(—COOH、C=O、—OH)的亲水性[26, 32],在吸附有机污染物,尤其是疏水性污染物时,具有更强的结合能力[26]。生物炭去除无机金属(例如金属汞、二价铜、二价铅,六价铬)[33]过程中,生物炭表面—COOH与酚羟基官能团(Phenolic-OH)反应表现出较高的活性[34],与有机污染物去除过程类似,不同温度制备的生物炭对金属的去除同样表现出了差异性。小于400 ℃制备的低丰度的炭结构更有利于铅的固定,C=O与金属离子形成π离子键,能够有效地的固定铜、镍、镉、铅[35]。而制备温度超过500 ℃时,生物炭O含量损失增多,极性降低,此时,氢键和π-π键在生物炭对无机金属吸附中起主要作用[36-37]。
总体而言,降低生物炭制备温度能够较好地保留炭表面的O元素,含氧官能团的含量相对更加丰富,更有利于吸附过程的进行,其中—COOH、Phenolic-OH等官能团参与了主要吸附过程。从污染物的表观去除率来看,热解温度超过500 ℃的生物炭展现了更大的去除效率,因为该过程除吸附以外,降解效率占据较大的比重[38]。因此仅仅根据吸附效率判定生物炭去除污染物的能力是不客观的,综合考虑生物炭对污染物吸附-降解效率才是评估生物炭环境效应最科学、全面的方式。
-
前期,部分研究者认为生物炭中EPFRs是生物炭降解污染物的主要因素[18, 39]。然而,随着研究的进一步深入,研究者观察到有机污染物降解程度与生物炭中EPFRs信号不匹配的现象,并发现生物炭的降解能力与其表面的一种含氧结构——醌基团(Quinoid C=O)产生了紧密的关联[40]。在木炭制备的生物炭实验中,Saquing等[41]证明了生物炭具有氧化还原循环能力,而该氧化还原循环功能与生物炭表面的Quinoid C=O有着紧密关联[42-43]。与生物炭吸附污染物过程一致,因不同温度制备的生物炭而产生的结构差异在降解途径中也展现了不同机制[44]。在Yu等[19]的研究中,Quinoid C=O和Phenolic-OH被认为是表面的活性位点,对生物炭降解五氯酚的贡献达到了56%,其中900 ℃生物炭对五氯酚的降解效率大于400 ℃生物炭,因为900 ℃生物炭表面Quinoid C=O数量明显更多,其良好的导电性也一定程度上加速了电子传递。在生物炭反硝化过程中,300 ℃生物炭中Phenolic作为电子供体有效地增强了反硝化过程,而800 ℃生物炭中Quinoid C=O作为电子受体抑制了N2O的反硝化过程,但是其电导体结构促进了N2O的还原[14]。大于700 ℃制备的生物炭其导电结构在降解有机污染物过程中辅助Quinoid结构加速电子传递,从而促进降解过程。但最近的研究显示在水热炭厌氧催化甲烷的生成中排除了导电结构的作用,再次强调了含氧官能团在电子传递过程中的重要性[45]。同样,生物炭含氧官能团-重金属污染物体系中,介导物质的加入间接影响降解的途径同样被证实,在Fang研究组中,金属的加入影响EPFRs种类、数量的形成,间接影响酚类化合物降解效率[46]。文中虽未明确指出官能团参与反应过程,但其电子传递氧化Fe2+的过程同样涉及电子传递过程,体系中含氧官能团的作用有待探究。
显然,不管是通过吸附还是降解的方式,两种机制均降低了污染物的表观浓度。与吸附过程相同,生物炭含氧官能团的种类受制备温度的影响,在降解过程中也因其结构变化展现了一定差异性(表1)。不同的是,降解过程中电子接受或供给会影响中间产物的性质,中间产物是否会对环境产生更大的毒害效应,与生物炭性质以及其中的化学反应过程是紧密相关的。因此,生物炭的制备条件是决定其性质的重要因素,后文将从生物质来源、制备温度以及不同的性质进行细致的区分,并对生物炭结构特性进行细致的归纳总结。
-
生物炭来源广泛且种类多样,通常生物炭的制备多使用农业、工业废弃物以及动物粪便作为原料,在低氧或无氧条件下进行热解处理[51-52]。不同来源的生物质在原始组成上包含一定的差异[51],例如以农业废弃物,水稻秸秆、玉米秸秆等植物残留物为原料的生物炭中保留了C、H、O、N、P、S、K、Mg、Si等元素;而以猪粪、牛粪等动物粪便制备的生物炭Mg、Si含量相对较少[53]。近年来较多的研究者使用活性污泥制备生物炭,此类生物炭中包含较多残留的重金属物质[54]。制备过程中不同的原始材料组分的变化也不一样,例如产率和灰分的含量[55]与原料中水分、纤维素、半纤维素、木质素的含量以及热解温度有关[56]。在热解过程中,最先开始分解的是半纤维素成分,其次是纤维素,最后是木质素[57]。Beesley等[58]研究结果显示硬木原生质制备的生物炭更加适用于吸附有机污染物,而软木原生质制备的生物炭对无机污染物吸附效率更高。但在热解升温过程中,不同生物质来源制备的生物炭元素组成、比表面积、官能团种类以及含量变化趋势是一致的。
-
微波辐射加热法、水热炭化等方式是现阶段常见的制碳方法,对比传统的马弗炉热解方式,在同样的制备温度下,微波辐射加热法制炭产率更高,并包含更多的微孔结构[59-60]。随着制备温度的增高,其O含量损失的速率也低于马弗炉加热,这一过程直接导致了其极性和含氧官能团的数量高于传统的生物炭,并且在同样制备温度(>500 ℃)下,其产生的自由基浓度更高。上述物理特性的优势均为其作为良好的吸附剂、氧化还原催化剂提供了潜在优势[61]。水热炭化法是另一种特殊的制炭方法,以超临界水为介质,原生质在一定的压力和温度下进行加热产生的碳材料[62]。水热法制备的碳材料能够较为完整地保留O元素,因此其含氧官能团较传统热解制备的生物炭更为丰富[23]。虽然微波加热法和水热炭化法在制炭过程中较马弗炉热解法能更好地保留有机质含量,但从经济的角度考虑其设备的价格,制炭效率以及实验条件、操作简易程度而言,马弗炉热解法更适于大范围的推广及应用。
-
生物炭制备温度一般在100—900 ℃之间,通常生物炭制备的升温速率选择中低速热解方式[63-64]。生物炭比表面积、元素组成、自由基信号强度以及官能团种类等特性均受到热解温度的影响。O元素作为生物炭中较活泼的次要元素存在于其表面不同的官能团结构中,其中,Phenolic-OH和Quinoid C=O是含氧官能团中供给和接收电子的两个主要位点[65],这两种结构在溶解性有机质(DOM)、热解炭材料中均存在,但不同的热解温度会导致O元素与C元素结合方式发生变化,这一改变将直接影响含氧官能团的性质。制备温度低于400 ℃的生物炭由于未完全炭化,其比表面积(<100 m2·g−1)以及形成EPFRs浓度较低,pH值偏酸性。此时生物炭O元素含量高(>20%),表面含氧官能团总量较为丰富,主要是以Phenolic-OH、—COOH等酸性官能团为主[65]。大量Phenolic-OH存在提高了生物炭极性[24],使还原能力大于氧化能力,在吸附极性或非极性污染物时均发挥了巨大作用[63, 66]。当制备温度达到500 ℃时,原生质中无机碳被分解,有机碳发生缩合反应,形成高聚合芳香环,生物炭还原、氧化能力以及EPFRs浓度均达到最大值,电子交换能力最大值能达到2 mmol·g−1[65]。此时,生物炭表面Phenolic-OH含量达到最大值、Quinoid C=O数量也相较小于500 ℃制备的生物炭逐渐增多。随着制备温度继续增加,由于H、O等元素含量下降,此时O元素的含量小于总元素含量的10 %,含氧官能团数量也随之降低。当制备温度超过600 ℃时,Phenolic-OH在高温条件下被迅速分解,Quinoid C=O含量大于Phenolic-OH,此时生物炭主要表现出氧化性[65]。有研究者在对比了多种原生质在不同温度下制备的生物炭后,发现制备温度过高或过低均不利于官能团的形成,600 ℃生物炭含氧官能团数量比300 ℃生物炭下降率最多可达96.2%[6]。傅里叶红外光谱(FTIR)和光电子能谱(XPS)是检测生物炭官能团两种最常见的手段,在红外光谱图中,Phenolic-OH、Quinoid C=O、—COOH等官能团分别在波段1262、1578、1712 cm−1有伸缩振动[8, 26-27]。随着制备温度的增加,光谱图上伸缩振动随之减弱或消失[30],说明高温分解了这些酸性官能团,制备温度在400—600 ℃时,最有利于含氧官能团的形成[6, 27, 37]。
研究者在进行吸附-降解实验时,通常选择一系列温度制备的生物炭与污染物相互作用,不同温度的生物炭对污染物均存在吸附-降解现象,但其程度无法与生物炭中某一种特性相匹配,例如比表面积或自由基信号强度。在生物炭-对硝基苯酚降解体系中,对硝基苯酚降解程度与自由基信号呈正比[13],但在生物炭-罗丹明B体系中,低比表面积、低自由基信号强度的200 ℃生物炭对罗丹明B同样存在降解,降解程度甚至高于高比表面积、高自由基信号强度的500 ℃生物炭。因此,生物炭对污染物的吸附/降解过程存在多种机制共存,需要多方面综合考虑。
-
生物炭含氧官能团特性可以通过物理、化学改性方法进行调控。通常物理方法可通过改变热解方式以及温度控制最大程度地保留生物炭的有机质组分,提高产率以及内孔大小、数量、以及表面官能团含量[67-68],增加污染物与生物炭有效接触面积,增强吸附-降解效果[27, 59];而化学改性是通过化学氧化剂或者还原剂的添加,在生物炭与污染物反应前对其进行预处理[4],实现生物炭表面官能团相互转化,反应后通过与未处理生物炭对污染物吸附-降解程度进行对照,进一步掌握生物炭特定性质与污染物间的关联。
Phenolic-OH、Quinoid C=O为生物炭表面典型的含氧官能团结构[69],为了验证其在电子得失过程中的重要性,研究者通过化学改性或负载目标官能团调控生物炭表面含氧官能团种类、数量,针对性地提高生物炭氧化或还原能力。Klüpfel等[65]系统测定了6种来源的草本和木本原生质在200—700 ℃烧制下生物炭得失电子能力,泛醌(ubiquinone)作为Quinoid模型化合物通过吸附与生物炭表面结合,通过电化学工作站检测,反应后的生物炭电子接受能力(EAC)值增大,验证Quinoid在电子转移过程中提供了接受电子的位点,同时验证了表面Quinoid在生物炭电子转移过程中的重要作用。上述方法是通过吸附特定的Quinoid等结构,通过负载的方式,增加生物炭表面活性位点数量,增强吸附-降解的效果。而另一种改性方式是通过使用氧化剂或者还原剂实现生物炭表面官能团相互转化,增加特定含氧官能团含量,达到调控其氧化还原能力的目的。实验常见的氧化剂主要包括HNO3、H2SO4、H2O2[67],这些酸性氧化剂主要增加生物炭表面酸性含氧官能团,例如—COOH。还原剂通常选用硼氢化物(KBH4、NaBH4)对生物炭进行前处理[23],实现了生物炭表面酚羟基官能团和Quinoid数量的转化,使生物炭EAC或电子供给能力(EDC)达到相对最大的程度,进而明确Phenolic-OH或Quinoid C=O在降解时的贡献。值得注意的是,通过化学改性调控生物炭EDC/EAC,实际上是通过增加或减少生物炭表面某种特定的含氧官能团数量来影响其EDC/EAC,这一过程的验证进一步强调了生物炭含氧官能团在氧化还原反应过程中的重要性。
-
微生物的添加同样被证实能够促进有机污染物的降解,与物理、化学改性方法不同的是,生物炭-有机污染物中,微生物的加入没有改变生物炭原有的特性,而是与生物炭表面含氧官能团产生协同作用,增强降解效率[70]。Yu等[71]在实验中使用微生物作为电子供体,生物炭与胡敏酸分别作为电子受体进行对照,结果显示,生物炭电子接收能力强于胡敏酸,并且900 ℃生物炭降解能力强于500 ℃生物炭,Quinoid C=O发挥了重要作用;Saquing等的研究得到了同样的结论,在微生物的作用下,生物炭可以同时作为电子供体还原硝酸盐和电子受体氧化醋酸盐,Phenolic-OH和Quinoid C=O发挥了主要作用。总体而言,生物炭在整个体系中充当了电导体以及电子接收的载体,微生物的加入为电子转移加大了动力来源,增强了体系中降解的程度。
综上所述,物理或化学改性以及微生物的添加均是为了更好地理解生物炭性质与污染物的关联程度。上述改性过程中,Phenolic-OH和Quinoid C=O对降解作用再次被强调,但目前的研究尚处于初步阶段。生物炭的改性提高了吸附-降解的效率,但改性过程中伴随着大量强酸、强碱化学物质的使用。在土壤或水体改良中,附着在改性生物炭表面的酸或碱会不会释放到土壤或水体造成二次污染?甚至加大土壤或水体后续的治理难度?因此,如何正确使用生物炭在实际环境中的应用以及如何规避上述问题,是未来生物炭应用中值得思考的问题。
-
生物炭作为土壤改良剂已在全国范围内大量推广与使用,了解并掌握生物炭特性是其长期应用于环境的前提与保障。通过前期的研究已得知生物炭理化性质、官能团种类、数量均受到制备温度的影响,并系统地归纳生物炭不同特性与不同类型污染物吸附-降解的过程,针对不同性质污染物选择合适来源、制备温度以及改性方式制备的吸附-降解效率最高的生物炭,也同样是生物炭应用过程中不可或缺的一步。目前,针对生物炭与污染物相互作用仍存在以下几个典型的问题需要进一步研究与思考:
(1)以制备温度为界限,进一步归纳不同制备温度生物炭的结构特性,并结合生物质来源、反应条件(例如pH、光照)与污染物性质,针对性地选择反应活性较高的生物炭,最大程度地发挥生物炭环境功能。
(2)虽然目前针对EPFRs在降解中的作用被逐渐弱化,但其作用仍是不可忽视的。从前期的研究结果来看,EPFRs的形成机理以及与污染物的相互作用的机制仍然不清晰。因此,现阶段EPFRs在环境中的效应仍是研究的重点。
(3)生物炭与微生物协同作用研究尚少,自然(水体或土壤)环境中,生物炭与环境将产生怎样的长期效应尚没有准确的预判,但其与微生物的相互作用的过程是广泛存在于环境中的,这一过程为生物炭在自然条件下的应用开辟了新的思考与想法,同时也带来了更多需要考虑的环境效应。
(4)生物炭研究的局限性较高。普遍来看,目前针对生物炭的研究还处于实验室研究阶段,由于反应条件过于理想化的设置,导致实验结果无法真实、客观地诠释生物炭在自然环境中的反应效应,因此如何准确预估生物炭在自然环境下的迁移转换,是当前解决生物炭研究局限性关键问题之一。
生物炭含氧官能团的生成溯源及其在污染物吸附-降解过程中的作用
Traceability of oxygen-containing functional groups in biochars and their roles in the adsorption-degradation of contaminants.
-
摘要: 近年来,生物炭在土壤、水体污染物去除中展现了良好的应用潜力。大量学者围绕生物炭吸附-降解污染物的作用机制展开了深入的研究,发现生物炭含氧官能团结构在污染物去除过程中扮演着重要角色。生物炭制备温度是影响其含氧官能团结构的主要因素,因此本文以生物炭热解温度为背景,区分了生物炭中环境持久性自由基(EPFRs)降解污染物的贡献,探究了生物炭中酚羟基(Phenolic-OH)和醌基团(Quinoid C=O)等活性含氧官能团对污染物的吸附-降解作用机制。此外,本文对生物炭中含氧官能团的产生和含量进行了溯源综述,包括制备生物炭的生物质来源、制备工艺和制备温度,总结了通过物理、化学改性方法对生物炭含氧官能团结构的影响,针对性地提出了提高生物炭的氧化/还原能力的方法,以及微生物与生物炭含氧官能团结构协同作用去除污染物的技术手段,为后续生物炭的工程应用奠定理论基础。Abstract: In recent years, biochars have shown good application potential in the removal of soil and water contaminants. Many researchers have carried out in-depth research on the mechanisms of how biochars adsorb and degrade contaminants, and the oxygen-containing functional groups(OCFGs) of biochars have been found to play an important role in the removal of contaminants. Therefore, this paper used the biochar pyrolysis temperatures as the background, distinguished the contribution of environmental persistent free radicals (EPFRs) of biochars in the degradation of contaminants, and explored the adsorption-degradation mechanism of active OCFGs such as Phenolic-OH and Quinoid C=O on contaminants. Moreover, this paper reviewed the traceability and content of OCFGs in biochars, including the biomass source, preparation process, and pyrolysis temperature. In addition, the effect of physical and chemical modification on the structure of OCFGs has been summarized. The methods for improving the oxidation/reduction capacity of biochar, and the technical means for removing contaminants by the synergistic effect of microorganisms and OCFGs of biochar were proposed. This review attempted to provide a theoretical foundation for the subsequent practical engineering application of biocahrs.
-
Key words:
- biochar /
- oxygen-containing functional group /
- electron transfer /
- adsorption /
- degradation
-
大气氮磷沉降是陆地和水体生态系统重要的营养来源. 在过去几十年,随着全球社会经济的快速发展,人类活动明显改变了氮磷的“地球−化学”循环,增加了大气中氮磷含量[1],导致大气沉降超过了生态系统的临界负荷,从而造成了水体富营养化、土壤酸化等一系列的负面生态效应[2]. 大气中活性氮主要来源于化石燃料燃烧和农业活动,磷主要来源于矿物尘、生物颗粒和燃烧源[3]. 大气沉降是氮磷等营养元素“地球−化学”循环的重要途经,分为干沉降和湿沉降. 干沉降以气态和颗粒态通过空气动力和自身重力迁移到地表的形式,湿沉降是通过雨、雪、雹等形式迁移到地表的过程[4]. 其中,湿沉降中营养元素多为水溶性,迁移到生态系统中可以被直接利用而备受关注[5].
关于营养盐湿沉降特征研究较多集中在沿海海域和内陆湖泊. Xing等[6]研究了胶州湾大气湿沉降中氨氮
(NH+4−N) (NO−3−N) (NO−2−N) 三峡库区地处长江上游,水库蓄水造成水流变缓,水体富营养化突出. 因此,探究三峡库区大气氮磷沉降规律、负荷及其影响对于区域水环境污染控制具有重要意义. 一些研究者曾在三峡典型区域开展了氮沉降研究工作[13-14],本团队也曾报道了三峡库区湿沉降沉降中无机氮的时空变化和来源[15-16],但这些研究均缺乏亚硝态氮和磷的沉降研究. 为完善区域在营养盐沉降上的不足,本研究于2017年1月—2017年12月在三峡库区腹地3个典型区域进行了湿沉降样品收集,测定了其中氮磷形态浓度(
NO−3−N NH+4−N NO−2−N 1. 材料与方法(Materials and methods)
1.1 采样地点
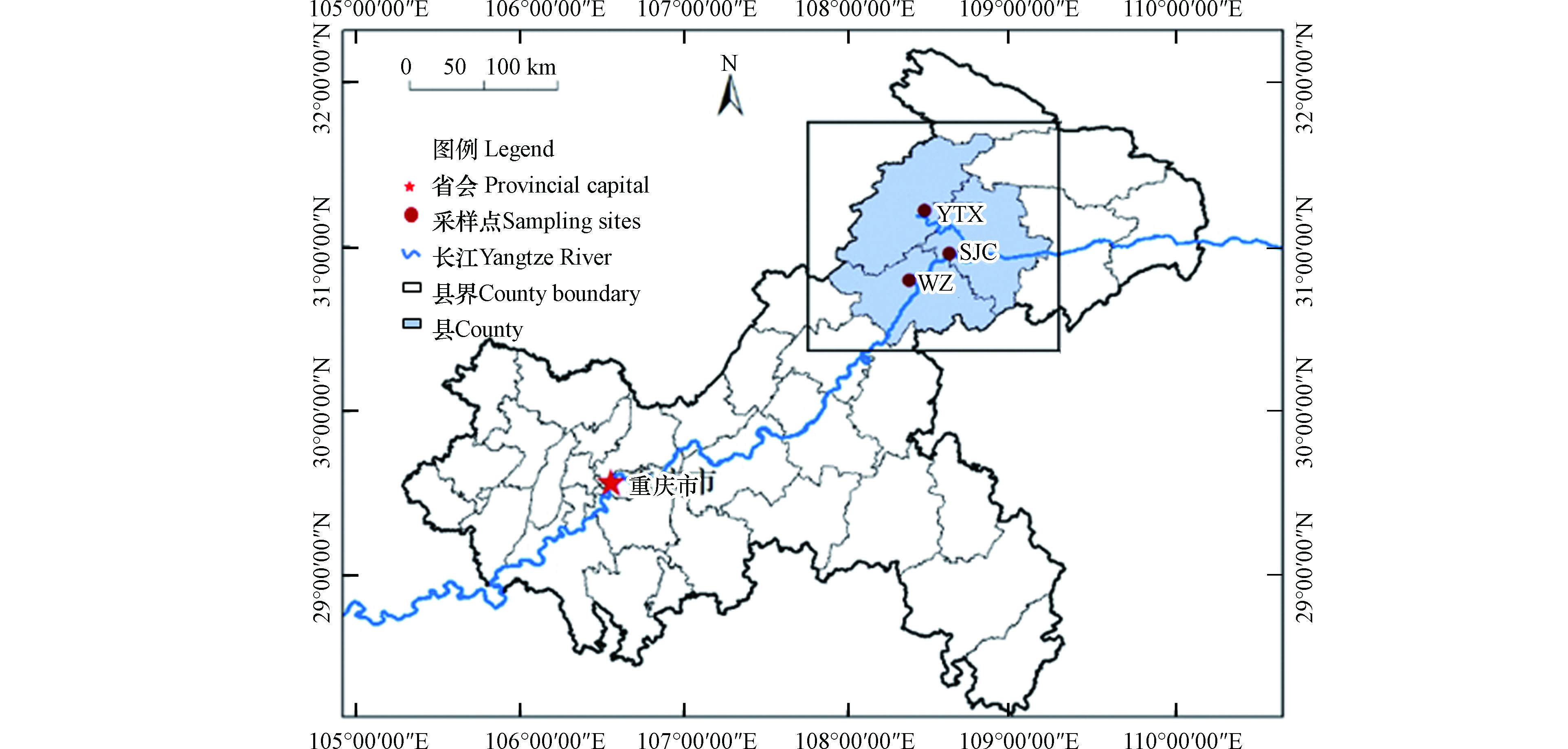
本研究3个采样点分别位于三峡库区重庆市万州区、开州区和云阳县(图1). 万州城区站点(WZ)设置在重庆三峡学院老校区S教教学楼楼顶,距离地面高约27 m,站点周边居住区和商业区,站点东侧约100 m有一条城市交通主干道沙龙路二段,该站点为代表典型城区环境;晒经村站点(SJC)位于云阳县人和街道晒经村,距离云阳县城约3 km,距离长江干流约400 m,代表郊区站点;野塘溪站点(YTX)位于开州区厚坝镇野塘溪村,距离彭溪河约2 km,代表农业区域.
1.2 样品采集
用降水降尘自动采样器(APS−3A,长沙湘蓝)收集降水样品,在无降水发生时,盖板遮住降水收集桶,在发生降水时自动打开盖板开始采样,样品以天为单位(9:00—翌日9:00)收集,一天之间发生多次降水则合并为1个样品. 同时仪器配备精度为0.1 mm的雨量计,用以记录降雨量. 样品每周收集1次,带回实验室后立即经0.45 µm滤膜过滤,并置于冰柜中冷冻保存尽快测量. 采样及盛装样品所用聚乙烯塑料桶在使用前用10%盐酸浸泡3 d,然后用超纯水洗净烘干备用.
1.3 样品分析和质量控制
用全自动连续流动分析仪(荷兰SKALARSan++)分析了样品中的
NO−3−N NH+4−N NO−2−N 1.4 数据处理
沉降通量Dpp(kg·hm−2·a−1)计算方法如下:
Dpp=∑ni=1Ci×Pi100 式中,Ci为次降雨中每种氮素或磷素的浓度(mg·L−1),Pi为次降雨量(mm),100为单位换算系数.
湿沉降的年均浓度是用年降雨量进行加权平均计算:
Cr=∑Ci×Pi/∑Pi 式中,Cr为年加权平均浓度(mg·L−1),Ci和Pi与沉降通量计算公式相同.
氮素浓度关系为:
ρ(DON)=ρ(DTN)−ρ(DIN) ρ(DIN)=ρ(NH+4−N)+ρ(NO−3−N)+ρ(NO−2−N) 式中,DIN为溶解性无机氮,DON为溶解性有机氮,单位均为mg·L −1.
本研究采用Microsoft Excel 2016和Origin 2017数据进行统计分析及制图,后向轨迹模拟分析采用Trajstat(中国气象科学研究院大气成分研究所王亚强团队开发)进行计算. Trajstat内置的轨迹计算模块与NOAAHYSPLIT一致,HYSPLIT(Hybrid Single Particle Lagrangian Integrated)是由美国国家海洋和大气管理局(NOAA)的空气资源实验室(ARL)与澳大利亚气象局共同研制的专业气象轨迹模式,广泛用于多种污染物在区域中传输和扩散的研究中[3,17-18]. 考虑到边界层的影响,本研究轨迹计算高度取1200 m,此高度高于混合层平均高度约3 km,比较适用于降水云层[19]. 气团以降水发生日的世界标准时间(UTC)0:00为起始时间,向后推算72 h,然后导入轨迹营养盐浓度,并将所有轨迹进行聚类,最后提取出主要方位后向轨迹,同时得到每条聚类轨迹的占比和营养盐浓度. 气象数据来源于NOAAARL预测数据,可在网上自行下载(ftp://arlftp.arlhq.noaa.gov/pub/archives/gdas1/).
2. 结果与讨论(Results and discussion)
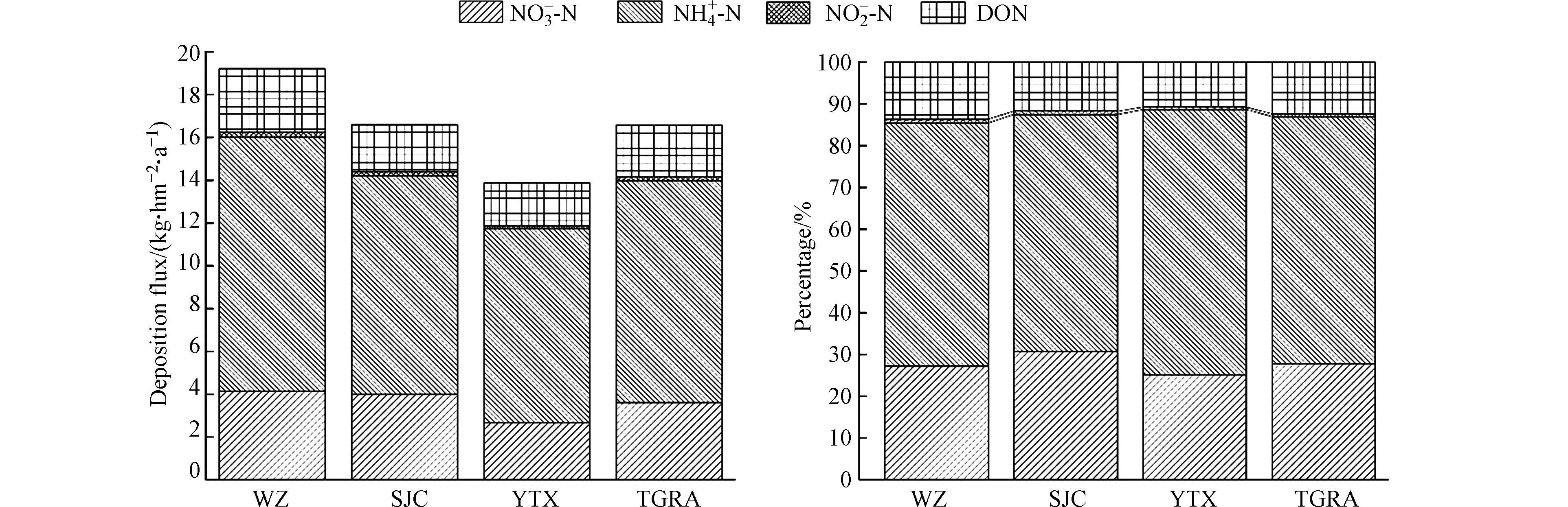
2.1 氮磷湿沉降总体浓度特征
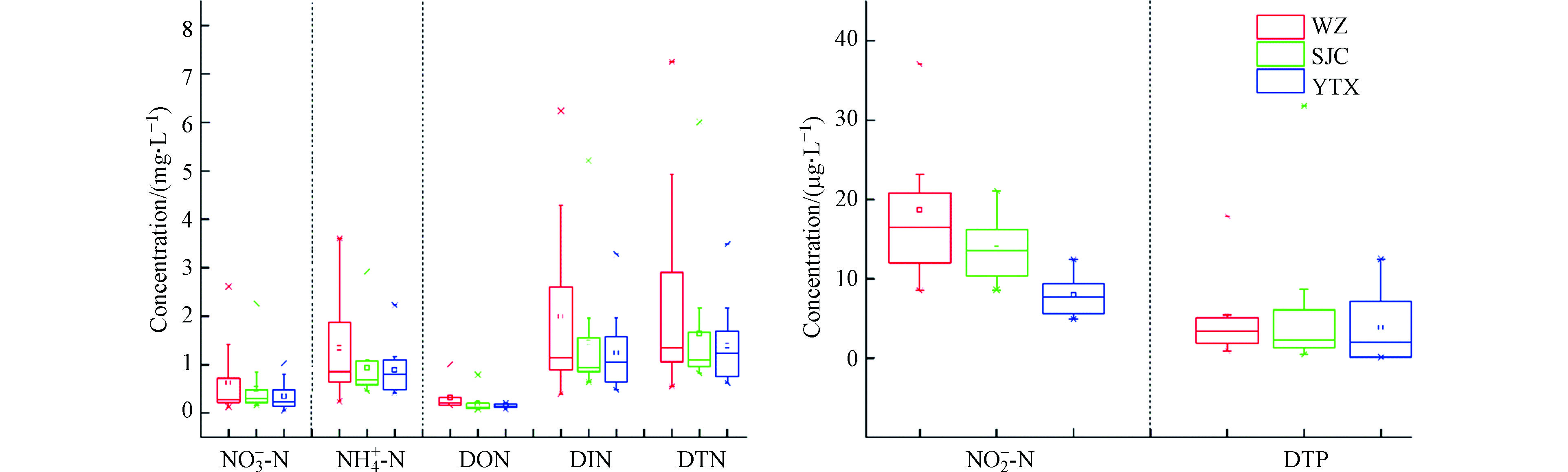
表1为三峡库区腹地
NO−3−N NH+4−N NO−2−N NO−3−N NH+4−N NO−2−N NH+4−N NO−3−N NO−2−N 表 1 湿沉降中氮磷浓度统计Table 1. Statistics of nitrogen and phosphorus concentration in wet deposition营养盐 Nutrients 算术平均Arithmetic mean 加权平均Weighted average 标准差Standard deviation 变异系数Coefficient of variation 最小值Minimum 中位数Median 最大值Maximum NO3−−N/(mg·L−1) 0.49 0.24 0.56 1.14 0.06 0.28 2.61 NH4+−N/(mg·L−1) 1.05 0.68 0.78 0.74 0.24 0.78 3.60 NO2−−N/(μg·L−1) 13.46 11.14 7.31 0.54 4.90 11.95 37.10 DON/(mg·L−1) 0.22 0.16 0.20 0.90 0.08 0.17 1.01 DTN/(mg·L−1) 1.78 1.09 1.51 0.85 0.55 1.24 7.25 DTP/(μg·L−1) 4.89 3.36 6.37 1.30 0.10 2.45 31.80 用《地表水环境质量标准》(GB3838−2002)评价三峡库区腹地降水氮磷浓度,结果显示,DTP满足Ⅰ类水质标准,
NH+4−N 与国内其他同类区域(表2)相比,三峡库区湿沉降中DTN浓度水平要远低于南京和西宁郊区,也低于沿海地区的太湖和杭嘉湖地区以及盐亭和秣陵的农区,与滇池、黑龙江凉水国家自然保护区水平相近,但要高于西藏林芝市,也高于同为水库生态区的大河口水库以及戴云山国家自然保护区,总的来说处于中等偏下的水平. 在
NO−3−N NH+4−N NO−3−N NH+4−N 表 2 国内典型区域湿沉降氮磷浓度Table 2. Wet deposition concentrations of nitrogen and phosphorus in typical regions in China地点 Sites 采样点类型 Type of sampling site 监测时间Monitoring time NO−3−N NH+4−N NO−2−N DON/(mg·L−1) DTN/(mg·L−1) DTP/(μg·L−1) 文献Reference 戴云山国家自然保护区 林区(保护区) 2015.3.27—2015.10.09 0.24 0.44 — 0.31 0.99 — [20] 黑龙江凉水国家自然保护区 林区(保护区) 2015.5—2015.10 0.41 0.68 9.00 0.45 1.54 — [21] 滇池 水域 2014.1—2014.12 — — — 0.22 1.36 130.00 [9] 太湖 水域 2009.8—2010.7 — — — — 3.17 77.00 [22] 2017.8—2018.7 — — — — 3.16 56.00 大河口水库 水域 2014.3—2016.2 0.15 0.20 25.00 — 0.50 80.00 [23] 盐亭县 农区 2008—2013 1.05 1.48 — 0.02 2.55 [24] 秣陵县 农区 2010.3—2012.2 1.03 1.26 — — — 117.50 [25] 长沙县 农区 2010.9—2011.8 0.40 0.68 − 0.13 1.21 — [26] 南京郊区 郊区 2005.6—2006.5 2.77 1.74 210 5.36 10.08 — [27] 西宁近郊 郊区 2014.1—2015.12 1.8 2.2 — — — — [28] 杭嘉湖地区 城区 2013.9—2014.8 — — — — 2.60 20.00 [29] 林芝市 城区 2017.3—2017.10 0.13 0.22 — 0.39 0.74 108.80 [30] 三峡库区腹地 城区 2017.1—2017.12 0.26 0.76 13.80 0.19 1.22 3.50 本研究 郊区 2017.1—2017.12 0.26 0.66 12.20 0.14 1.07 3.30 农区 2017.1—2017.12 0.19 0.64 7.50 0.14 0.97 3.40 混合 2017.1—2017.12 0.24 0.68 11.14 0.16 1.09 3.36 2.2 氮磷湿沉降浓度时空变化特征
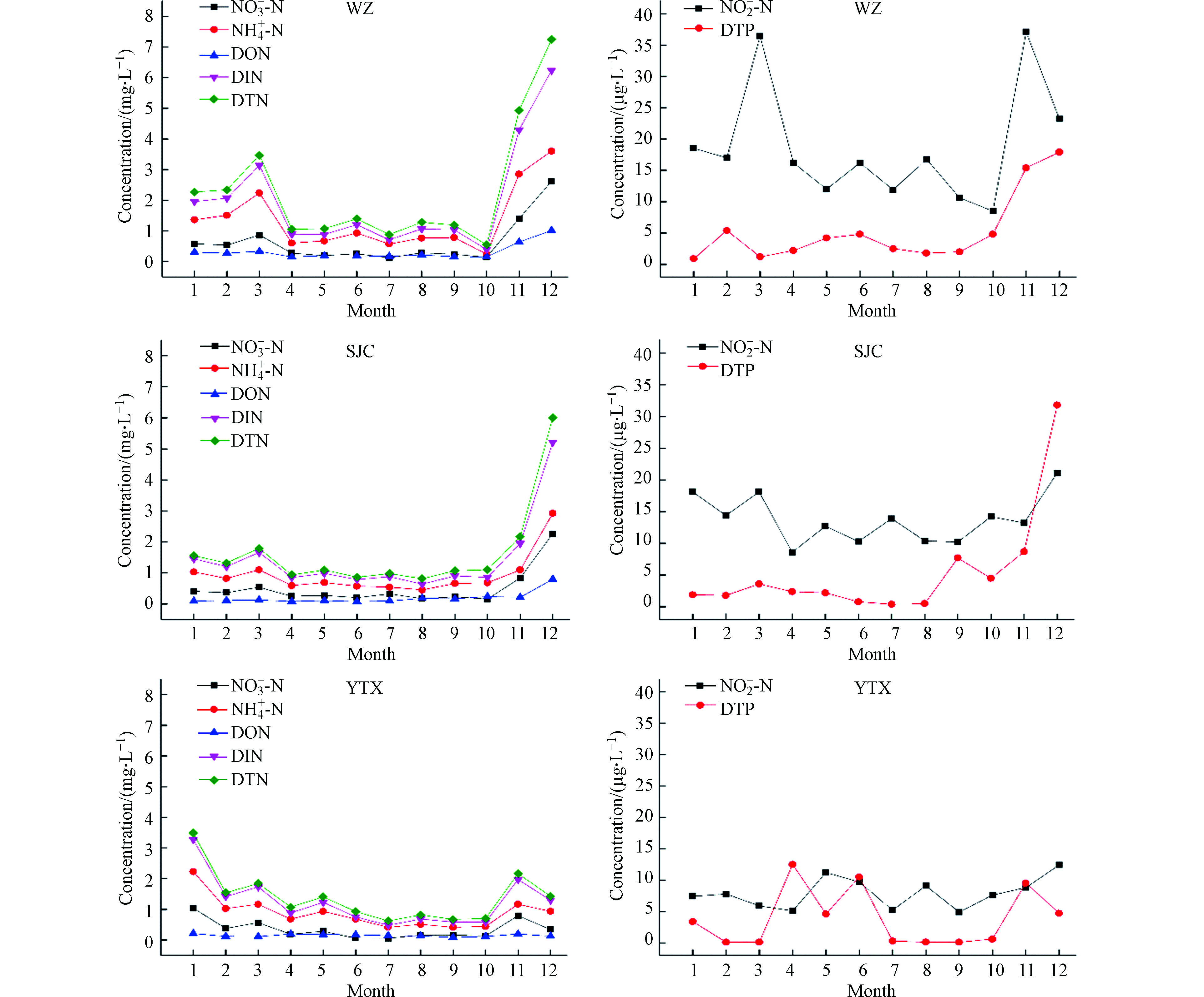
如图2所示,从时间变化上来看,三峡库区湿沉降中氮磷浓度月变化趋势有明显的差异. 较高的氮浓度主要呈现在冬季,其次为秋季和春季,夏季最低. 万州和晒经村的DTN浓度峰值出现在12月份,而野塘溪则出现在1月,从浓度峰值大小来看,WZ>SJC>YTX,分别为7.25 mg·L −1、6.01 mg·L −1和3.49 mg·L −1. 在季节分布上,冬季万州DTN浓度占全年比值高达42.8%,晒经村则达到45.1%,趋近全年一半的贡献量,野塘溪采样点也达到了38.6%,可以明显看出冬季是三峡库区高浓度氮沉降高发季节. 磷沉降方面,DTP浓度月变化起伏比较大的是野塘溪的4月份、6月份和11月份,由于野塘溪采样点处于农业区域,农村有焚烧秸秆的习惯,根据时间节点分析DTP浓度有可能是受生物质燃烧以及陆源气团影响而产生比较大的波动[27]. 高浓度的磷沉降也主要呈现在冬季,除了野塘溪DTP浓度峰值在4月份(12.5 μg·L −1)外,万州和晒经村DTP浓度最大值均出现在12月份,分别为17.90 μg·L −1、31.80 μg·L −1. 放眼全年,冬季DTP浓度在万州和高阳分别占比38.4%和53.5%,为四季最高;野塘溪最高在春季,为36.99%. 库区夏季磷浓度占比最低,为12.34%. 总体来说,库区内氮和磷的高浓度沉降都主要集中在冬季,一方面是因为冬季燃烧供暖导致活性氮释放增加;另一方面夏季高降雨量也加剧了大气中氮磷物质稀释效应从而削弱了夏季浓度[4].
从湿沉降的区域变化特征(图3)来看,整体上三峡库区的DTN浓度为0.55−7.25 mg·L −1,DTP浓度为0.10−31.80 μg·L −1. 而不同类型氮磷在3个站点湿沉降中不同分布表现为,DTN年均浓度方面WZ>SJC>YTX,分别为1.22、1.07、0.97 mg·L −1;DTP年均浓度方面WZ>YTX>SJC,分别为3.45、3.35、3.28 μg·L −1;DIN年均浓度方面WZ>SJC>YTX,分别为1.03、0.93、0.83 mg·L −1;DON年均浓度方面WZ>SJC≈YTX,分别为0.19、0.14、0.14 mg·L −1. 氮磷浓度变化趋势总体符合城区>郊区>农区. 3个站点中,DIN在DTN中占比都超过了80.0%,而DON只维持在10.0%左右的水平. DIN中
NH+4−N NH+4−N NO−2−N 2.3 氮磷湿沉降通量时空特征
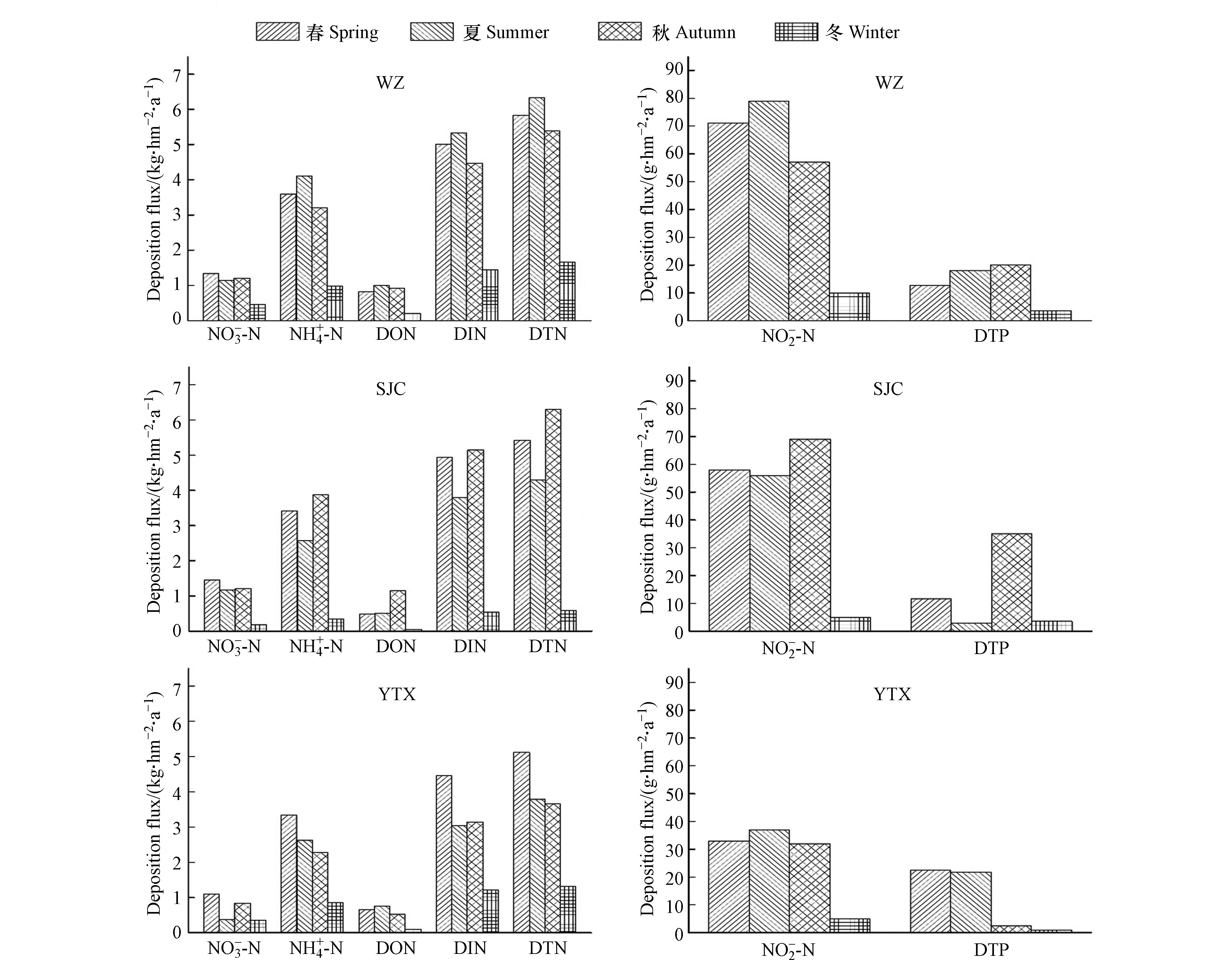
除了探讨氮磷的浓度,氮磷沉降通量也是反映区域氮磷水平的一个重要特征. 3个站点氮磷湿沉降通量随季节变化的关系如图4所示. 由图4可知,氮和磷沉降通量呈现出比较显著的季节性差异,但是两者在四季分布情况不尽相同.
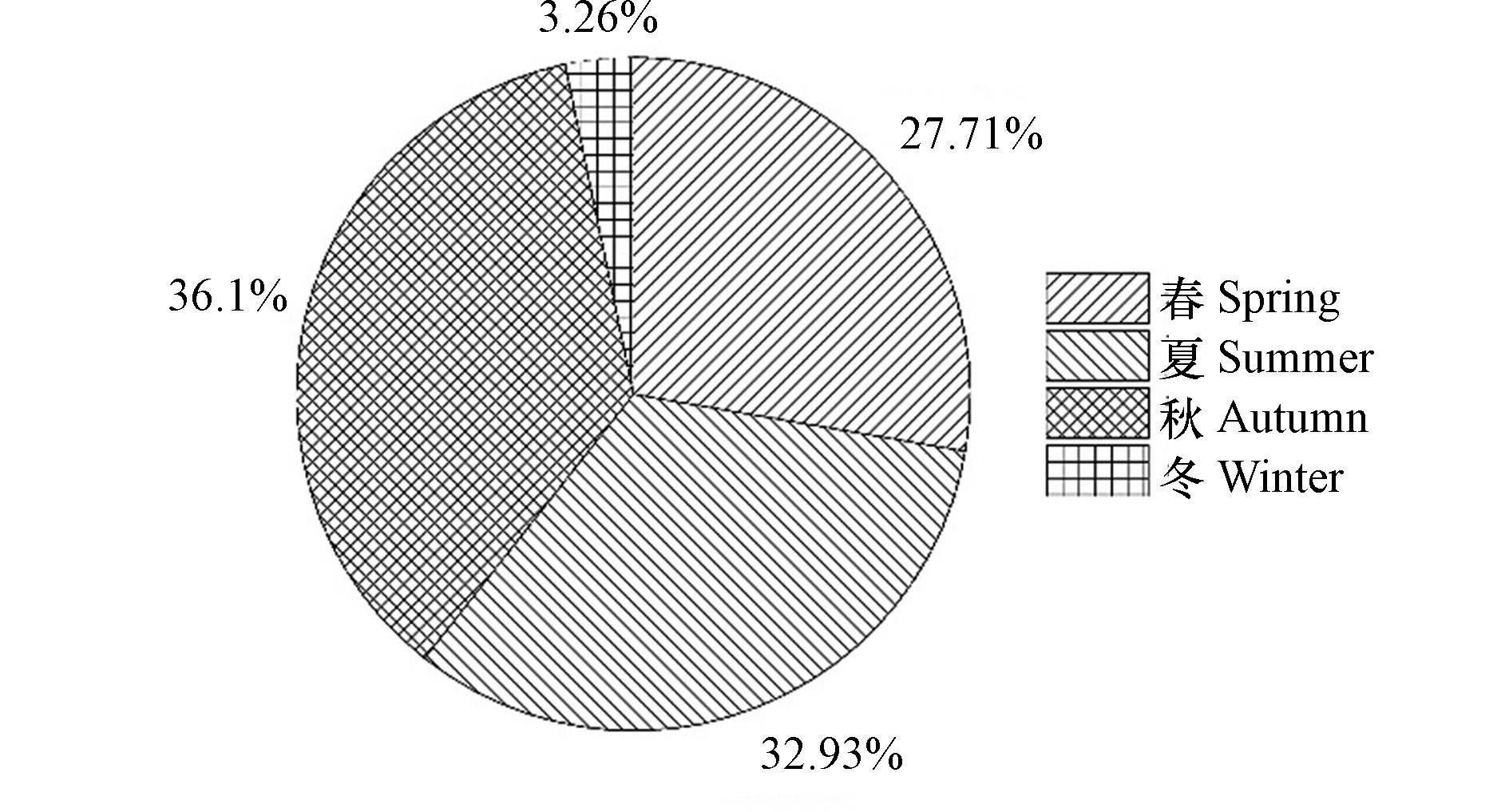
总体上看,区域氮沉降量季节分布特征基本为春、夏、秋三季相当,冬季最少. 其中春季沉降占比最高,为32.9%;秋季次之,为30.9%. 春季区域DTN沉降通量均值为5.45 kg·hm −2·a −1,DIN沉降通量均值为4.8 kg·hm −2·a −1,DON沉降通量均值为0.66 kg·hm −2·a −1;秋季区域DTN沉降通量均值为5.12 kg·hm −2·a −1,
NH+4−N 降雨量是影响氮磷沉降通量的一个重要因素. 如图5所示,区域内降水主要集中在春、夏、秋三季,三季降雨量超过全年的90.0%,而氮、磷沉降通量与降雨量都呈显著正相关关系(r=0.90,P<0.05;r=0.63,P<0.05),结合前述氮磷沉降通量季节分布特征可以推测降雨量一定程度上影响着区域内氮磷湿沉降通量.
图6呈现了3个站点
NO−3−N NH+4−N NO−2−N NO−3−N NH+4−N NO−2−N 2.4 氮磷湿沉降来源分析—气团后向轨迹模拟
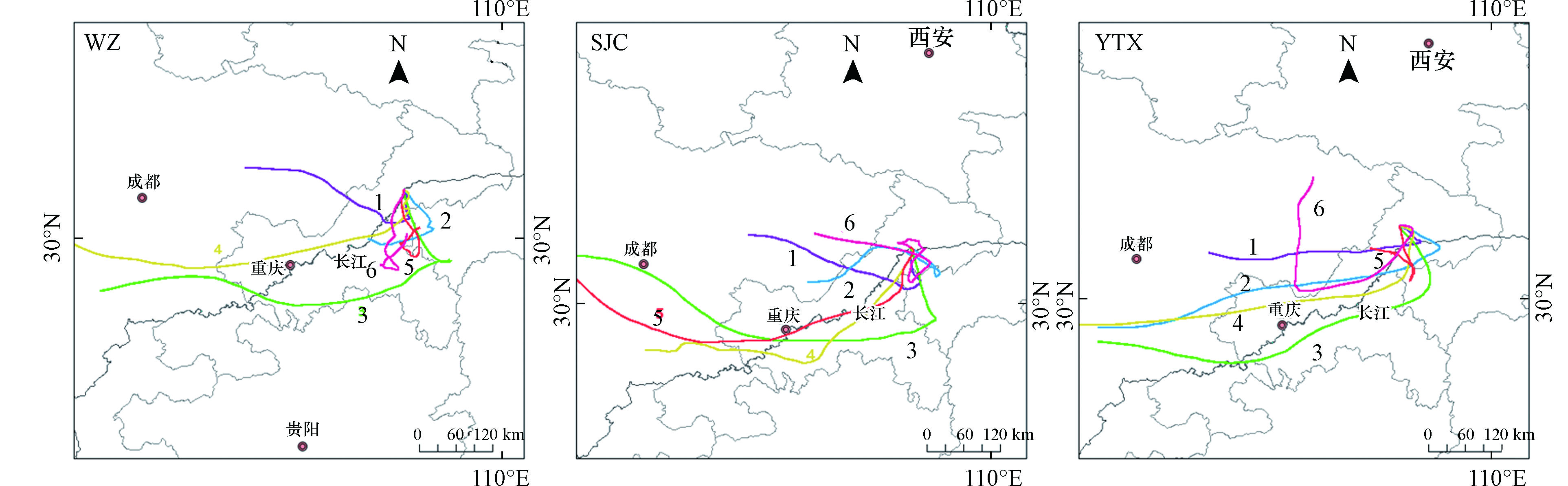
大气湿沉降中的氮磷浓度不仅会受到区域内生产生活排放性污染的影响,气团的运动轨迹以及气溶胶的浓度都可能对湿沉降中的组分含量产生影响[36]. 不同来源的气团会直接影响地区营养盐沉降,多数研究表明,来自陆地的气团会引起高氮沉降[37-38]. 因此,本研究利用王亚强团队开发的Trajstat(MeteoInfo插件版)进行气团后向轨迹模拟分析,探究研究区域气团来源以及走向趋势. 设置起始高度为1200 m,将所有雨天到达采样站点的气团后向推移72 h得到气团的后向轨迹,对每个地点的所有轨迹进行聚类后得到6条主要轨迹,如图7所示. 由图7可知,3个站点的气团都主要来自重庆、四川和湖北.
在万州站点,气团主要来自于重庆与湖北交界处以及四川东部,大部分的气团都经过了这两个区域. Cluster1起源于四川东部,途经南充、达州,然后在重庆东北部进入万州站点,该类轨迹占比31.0%,仅次于Cluster5(34.5%). Cluster2起源于重庆丰都县,途经重庆石柱县、湖北利川,北上抵达站点. Cluster3则源于四川盆地中部,经渝南、黔北、恩施南部区域后到达万州. 由表3可知,Cluster2(13.8%)和Cluster3(11.7%)占比相近,两者气团中
NO−3−N NH+4−N NO−3−N NH+4−N 表 3 轨迹中氮磷平均浓度Table 3. Average concentrations of nitrogen and phosphorus in the clusters of trajectories地点Sites Cluster 占比/%Percentage NO−3−N NH+4−N DON/(mg·L−1) DTP/(μg·L−1) 万州(WZ) 1 31.0 0.47 1.11 0.27 3.69 2 13.8 0.74 1.54 0.36 5.86 3 11.7 0.61 1.31 0.31 4.63 4 3.5 0.44 1.10 0.25 2.72 5 34.5 0.54 1.20 0.29 5.05 6 5.5 0.97 1.87 0.40 5.34 晒经村(SJC) 1 51.7 0.46 0.90 0.17 4.96 2 13.8 0.58 1.00 0.21 5.92 3 11.7 0.49 0.93 0.19 5.15 4 13.1 0.46 0.93 0.14 3.95 5 4.8 0.4 0.92 0.11 2.46 6 4.8 0.29 0.56 0.14 1.31 野塘溪(YTX) 1 26.9 0.35 0.89 0.16 3.62 2 13.8 0.36 0.91 0.15 4.04 3 11.7 0.34 0.88 0.15 3.63 4 3.5 0.72 1.56 0.15 1.42 5 38.6 0.35 0.97 0.17 5.94 6 5.5 0.38 1.03 0.18 6.85 晒经村站点气团主要来自于四川东部,这类气团占所有聚类轨迹的65.5%,说明川东地区是影响晒经村大气活性氮的主要区域,其中Cluster1占比51.7%,而Cluster2虽然仅占比13.8%,但是气团中
NO−3−N NH+4−N 野塘溪站点气团来源比例与万州相似,但是来源比例有所差异. 占比最大的是Cluster5,为38.6%,气团起源于重庆梁平区附近,途经万州、利川后进入野塘溪站点,Cluster1占比为26.9%,源于四川南充附近,气团较为清洁. Cluster4和Cluster6两类轨迹气团占比最低,分别为3.5%和5.5%. Cluster4气团源于青藏高原中部,穿越成渝城市群,无机氮含量最高,Cluster6气团源于四川盆地东部,DON和DTP含量最高. 而Cluster2和Cluster3都源于四川盆地中南部,Cluster2途经重庆中北部及广安以南区域进入站点,Cluster3则经过重庆中南部和恩施西部地区到达野塘溪站点,两类气团中氮磷浓度都处于较低水平.
气团后向轨迹分析表明,四川盆地是东南部区域是三峡库区腹地降水营养盐的主要潜在源区. 然而,区域营养盐还是主要来自于本地及周边区域的源排放. 已有研究表明,大气中的
NH+4−N NO−3−N NO−3−N NH+4−N NO−3−N 大气中磷的来源主要分为自然源和人为源,包括地壳源、火山源、海洋源、生物质及化石燃料的燃烧、化肥的挥发等[42]. 3个站点居于内陆,受到火山源和海洋源的影响很小,所以其磷的来源主要是地壳源和人为源. 具体来说,万州站点位于城区,周边工厂居多,化石燃料燃烧可能处于磷贡献首位;野塘溪和晒经村则可能是生物质燃烧和施肥引起的磷含量增加.
3. 结论(Conclusion)
三峡库区腹地大气湿沉降中DTN、DTP年均浓度分别为1.09 mg·L −1、3.36 μg·L−1,
NH+4−N NO−2−N -
表 1 生物炭含氧官能团在污染物吸附降解过程中的作用
Table 1. Role of oxygen-containing functional groups of biochars in the process of contaminants adsorption and degradation
原生质Raw materials 污染物Contaminants 去除方式The way of the removal 制备温度/℃Temperature 官能团类型Functional groups 参考文献References 家禽粪便 除草剂 吸附 400 Hydroquinone [24] 木材生物炭 汞 吸附 600 —COOH、Phenolic-OH [33] 生物炭 罗丹明B 吸附 — C=O、Phenolic-OH [47] 橘子皮 1-萘酚;萘 吸附 150—700 —OH [30] 玉米秸秆 西马嗪 吸附 100—600 —COOH、C=O [26] 谷物 甲基紫 吸附 350 —COOH、Phenolic-OH [48] 生物炭 N2O 降解 300 Phenolic-OH [14] 水稻秸秆 邻苯二甲酸二乙酯 降解 — Quinoid [49] 水稻秸秆 五氯酚 降解 900 Quinoid C=O [19] 硬木生物炭 乙酸盐、硝酸盐 降解 550 Phenolic-OH、Quinoid C=O [41] 水稻秸秆 罗丹明B 吸附、降解 500、1000 Quinoid C=O [20] 水稻秸秆 对硝基苯酚 吸附、降解 500 Quinoid [40] 碳基材料 — 氧化 —- —COOH [50] -
[1] LEHMANN J. A handful of carbon [J]. Nature, 2007, 447(7141): 143-144. doi: 10.1038/447143a [2] CHEN Q, ZHENG J, ZHENG L, et al. Classical theory and electron-scale view of exceptional Cd(Ⅱ) adsorption onto mesoporous cellulose biochar via experimental analysis coupled with DFT calculations [J]. Chemical Engineering Journal, 2018, 350: 1000-1009. doi: 10.1016/j.cej.2018.06.054 [3] LEHMANN J, DA SILVA J P, STEINER C, et al. Nutrient availability and leaching in an archaeological Anthrosol and a Ferralsol of the Central Amazon basin: Fertilizer, manure and charcoal amendments [J]. Plant and Soil, 2003, 249(2): 343-357. doi: 10.1023/A:1022833116184 [4] CHU G, ZHAO J, HUANG Y, et al. Phosphoric acid pretreatment enhances the specific surface areas of biochars by generation of micropores [J]. Environmental Pollution, 2018, 240: 1-9. doi: 10.1016/j.envpol.2018.04.003 [5] KOLB S E, FERMANICH K J, DORNBUSH M E. Effect of charcoal quantity on microbial biomass and activity in temperate soils [J]. Soil Science Society of America Journal, 2009, 73(4): 1173-1181. doi: 10.2136/sssaj2008.0232 [6] SUN J, HE F, PAN Y, et al. Effects of pyrolysis temperature and residence time on physicochemical properties of different biochar types [J]. Acta Agriculturae Scandinavica Section B-Soil and Plant Science, 2017, 67(1): 12-22. [7] NOVAK J M, BUSSCHER W J, LAIRD D L, et al. Impact of biochar amendment on fertility of a southeastern coastal plain soil [J]. Soil Science, 2009, 174(2): 105-112. doi: 10.1097/SS.0b013e3181981d9a [8] CHUN Y, SHENG G Y, CHIOU C T, et al. Compositions and sorptive properties of crop residue-derived chars [J]. Environmental Science & Technology, 2004, 38(17): 4649-4655. [9] KIM K H, KIM J Y, CHO T S, et al. Influence of pyrolysis temperature on physicochemical properties of biochar obtained from the fast pyrolysis of pitch pine (Pinus rigida) [J]. Bioresource Technology, 2012, 118: 158-162. doi: 10.1016/j.biortech.2012.04.094 [10] MENDEZ A, TARQUIS A M, SAA-REQUEJO A, et al. Influence of pyrolysis temperature on composted sewage sludge biochar priming effect in a loamy soil [J]. Chemosphere, 2013, 93(4): 668-676. doi: 10.1016/j.chemosphere.2013.06.004 [11] CAO X, MA L, GAO B, et al. Dairy-manure derived biochar effectively sorbs lead and atrazine [J]. Environmental Science & Technology, 2009, 43(9): 3285-3291. [12] LU H, ZHANG W, YANG Y, et al. Relative distribution of Pb2+ sorption mechanisms by sludge-derived biochar [J]. Water Research, 2012, 46(3): 854-862. doi: 10.1016/j.watres.2011.11.058 [13] YANG J, PAN B, LI H, et al. Degradation of p-nitrophenol on biochars: Role of persistent free radicals [J]. Environmental Science & Technology, 2016, 50(2): 694-700. [14] CHEN G, ZHANG Z, ZHANG Z, et al. Redox-active reactions in denitrification provided by biochars pyrolyzed at different temperatures [J]. Science of the Total Environment, 2018, 615: 1547-1556. doi: 10.1016/j.scitotenv.2017.09.125 [15] DELLINGER B, LONINICKI S, KHACHATRYAN L, et al. Formation and stabilization of persistent free radicals [J]. Proceedings of the Combustion Institute, 2007, 31: 521-528. doi: 10.1016/j.proci.2006.07.172 [16] LOMNICKI S, TRUONG H, VEJERANO E, et al. Copper oxide-based model of persistent free radical formation on combustion-derived particulate matter [J]. Environmental Science & Technology, 2008, 42(13): 4982-4988. [17] 马超然, 张绪超, 王朋, 等. 生物炭理化性质对其反应活性的影响 [J]. 环境化学, 2019, 11: 2425-2434. MA C Y, ZHANG X C, WANG P, et al. Effect of physical anf chemical properties of biochar on its reactivity [J]. Environmental Chemistry, 2019, 11: 2425-2434(in Chinese).
[18] FANG G, GAO J, LIU C, et al. Key role of persistent free radicals in hydrogen peroxide activation by biochar: implications to organic contaminant degradation [J]. Environmental Science & Technology, 2014, 48(3): 1902-1910. [19] YU L, YUAN Y, TANG J, et al. Biochar as an electron shuttle for reductive dechlorination of pentachlorophenol by Geobacter sulfurreducens [J]. Sci Rep, 2015(5): 16221. [20] WU D, LI F, CHEN Q, et al. Mediation of Rhodamine B photodegradation by biochar [J]. Chemosphere, 2020, 256: 127082. doi: 10.1016/j.chemosphere.2020.127082 [21] YU X, GONG W, LIU X, et al. The use of carbon black to catalyze the reduction of nitrobenzenes by sulfides [J]. Journal of Hazardous Materials, 2011, 198: 340-346. doi: 10.1016/j.jhazmat.2011.10.052 [22] ZHANG C, KATAYAMA A. Humin as an electron mediator for microbial reductive dehalogenation [J]. Environmental Science & Technology, 2012, 46(12): 6575-6583. [23] QIN Y, ZHANG L, AN T. Hydrothermal carbon-mediated fenton-like reaction mechanism in the degradation of alachlor: Direct electron transfer from hydrothermal carbon to Fe(Ⅲ) [J]. Acs Applied Materials & Interfaces, 2017, 9(20): 17116-17125. [24] OH S Y, SON J G, CHIU P C. Biochar-mediated reductive transformation of nitro herbicides and explosives [J]. Environmental Toxicology and Chemistry, 2013, 32(3): 501-508. doi: 10.1002/etc.2087 [25] ZHU D Q, KWON S, PIGNATELLO J J. Adsorption of single-ring organic compounds to wood charcoals prepared under different thermochemical conditions [J]. Environmental Science & Technology, 2005, 39(11): 3990-3998. [26] ZHANG G, ZHANG Q, SUN K, et al. Sorption of simazine to corn straw biochars prepared at different pyrolytic temperatures [J]. Environmental Pollution, 2011, 159(10): 2594-2601. doi: 10.1016/j.envpol.2011.06.012 [27] CHEN B, ZHOU D, ZHU L. Transitional adsorption and partition of nonpolar and polar aromatic contaminants by biochars of pine needles with different pyrolytic temperatures [J]. Environmental Science & Technology, 2008, 42(14): 5137-5143. [28] OH S Y, SON J G, HUR S H, et al. Black carbon-mediated reduction of 2,4-dinitrotoluene by dithiothreitol [J]. Journal of Environmental Quality, 2013, 42(3): 815-821. doi: 10.2134/jeq2012.0411 [29] YANG K, JIANG Y, YANG J, et al. Correlations and adsorption mechanisms of aromatic compounds on biochars produced from various biomass at 700 degrees C [J]. Environmental Pollution, 2018, 233: 64-70. doi: 10.1016/j.envpol.2017.10.035 [30] CHEN B, CHEN Z. Sorption of naphthalene and 1-naphthol by biochars of orange peels with different pyrolytic temperatures [J]. Chemosphere, 2009, 76(1): 127-133. doi: 10.1016/j.chemosphere.2009.02.004 [31] CHEN T, ZHANG Y, WANG H, et al. Influence of pyrolysis temperature on characteristics and heavy metal adsorptive performance of biochar derived from municipal sewage sludge [J]. Bioresource Technology, 2014, 164: 47-54. doi: 10.1016/j.biortech.2014.04.048 [32] CHEFETZ B, BILKIS Y I, POLUBESOVA T. Sorption-desorption behavior of triazine and phenylurea herbicides in Kishon river sediments [J]. Water Research, 2004, 38(20): 4383-4394. doi: 10.1016/j.watres.2004.08.023 [33] PARK J H, WANG J J, ZHOU B, et al. Removing mercury from aqueous solution using sulfurizedbiochar and associated mechanisms [J]. Environmental Pollution, 2019, 244: 627-635. doi: 10.1016/j.envpol.2018.10.069 [34] CAO X, HARRIS W. Properties of dairy-manure-derived biochar pertinent to its potential use in remediation [J]. Bioresource Technology, 2010, 101(14): 5222-5228. doi: 10.1016/j.biortech.2010.02.052 [35] UCHIMIYA M, KLASSON K T, WARTELLE L H, et al. Influence of soil properties on heavy metal sequestration by biochar amendment: 1. Copper sorption isotherms and the release of cations [J]. Chemosphere, 2011, 82(10): 1431-1417. doi: 10.1016/j.chemosphere.2010.11.050 [36] HARVEY O R, HERBERT B E, RHUE R D, et al. Metal interactions at the biochar-water interface: Energetics and structure-sorption relationships elucidated by flow adsorption microcalorimetry [J]. Environmental Science & Technology, 2011, 45(13): 5550-5556. [37] LIAN F, XING B. Black carbon (biochar) in water/soil environments: molecular structure, sorption, stability, and potential risk [J]. Environmental Science & Technology, 2017, 51(23): 13517-13532. [38] WU C, LIU X, WU X, et al. Sorption, degradation and bioavailability of oxyfluorfen in biochar-amended soils [J]. Science of the Total Environment, 2019, 658: 87-94. doi: 10.1016/j.scitotenv.2018.12.059 [39] LIAO S, PAN B, LI H, et al. Detecting free radicals in biochars and determining their ability to inhibit the germination and growth of corn, wheat and rice seedlings [J]. Environmental Science & Technology, 2014, 48(15): 8581-8587. [40] YANG J, PIGNATELLO J J, PAN B, et al. Degradation of p-nitrophenol by lignin and cellulose chars: H2O2-mediated reaction and direct reaction with the char [J]. Environmental Science & Technology, 2017, 51(16): 8972-8980. [41] SAQUING J M, YU Y H, PEI C C. Wood-derived black carbon (biochar) as a microbial electron donor and acceptor [J]. 2016, 3(2): 62-66. [42] KEMPER J M, AMMAR E, MITCH W A. Abiotic degradation of hexahydro-l,3,5-trinitro-1,3,5-triazine in the presence of hydrogen sulfide and black carbon [J]. Environmental Science & Technology, 2008, 42(6): 2118-2123. [43] ZEE F P V D, BISSCHOPS I A E, LETTINGA G, et al. Activated carbon as an electron acceptor and redox mediator during the anaerobic biotransformation of azo dyes [J]. Environmental Science & Technology, 2003, 37(2): 402-408. [44] SUN T, LEVIN B D A, GUZMAN J J L, et al. Rapid electron transfer by the carbon matrix in natural pyrogenic carbon [J]. Nature Communications, 2017(8): 14873. [45] REN S, USMAN M, TSANG D C W, et al. Hydrochar-facilitated anaerobic digestion: Evidence for direct interspecies electron transfer mediated through surface oxygen-containing functional groups [J]. Environmental Science & Technology, 2020, 54(9): 5755-5766. [46] FANG G, LIU C, GAO J, et al. Manipulation of persistent free radicals in biochar to activate persulfate for contaminant degradation [J]. Environmental Science & Technology, 2015, 49(9): 5645-5653. [47] QIU Y, ZHENG Z, ZHOU Z, et al. Effectiveness and mechanisms of dye adsorption on a straw-based biochar [J]. Bioresource Technology, 2009, 100(21): 5348-5351. doi: 10.1016/j.biortech.2009.05.054 [48] XU R K, XIAO S C, YUAN J H, et al. Adsorption of methyl violet from aqueous solutions by the biochars derived from crop residues [J]. Bioresource Technology, 2011, 102(22): 10293-10298. doi: 10.1016/j.biortech.2011.08.089 [49] FANG G, LIU C, WANG Y, et al. Photogeneration of reactive oxygen species from biochar suspension for diethyl phthalate degradation [J]. Applied Catalysis B-Environmental, 2017, 214: 34-45. doi: 10.1016/j.apcatb.2017.05.036 [50] CHEN C Y, JAFVERT C T. The role of surface functionalization in the solar light-induced production of reactive oxygen species by single-walled carbon nanotubes in water [J]. Carbon, 2011, 49(15): 5099-5106. doi: 10.1016/j.carbon.2011.07.029 [51] GASKIN J W, STEINER C, HARRIS K, et al. Effect of low-temperature pyrolysis conditions on biochar for agricultural use [J]. Transactions of the Asabe, 2008, 51(6): 2061-2069. doi: 10.13031/2013.25409 [52] YUAN J H, XU R K. The amelioration effects of low temperature biochar generated from nine crop residues on an acidic Ultisol [J]. Soil Use and Management, 2011, 27(1): 110-115. doi: 10.1111/j.1475-2743.2010.00317.x [53] XIAO X, CHEN B L, ZHU L Z. Transformation, morphology, and dissolution of silicon and carbon in rice straw-derived biochars under different pyrolytic temperatures [J]. Environmental Science & Technology, 2014, 48(6): 3411-3419. [54] JIN J W, LI Y N, ZHANG J Y, et al. Influence of pyrolysis temperature on properties and environmental safety of heavy metals in biochars derived from municipal sewage sludge [J]. Journal of Hazardous Materials, 2016, 320: 417-426. doi: 10.1016/j.jhazmat.2016.08.050 [55] WANG Z, HAN L, SUN K, et al. Sorption of four hydrophobic organic contaminants by biochars derived from maize straw, wood dust and swine manure at different pyrolytic temperatures [J]. Chemosphere, 2016, 144: 285-291. doi: 10.1016/j.chemosphere.2015.08.042 [56] DEMIRBAS A. Effects of temperature and particle size on bio-char yield from pyrolysis of agricultural residues [J]. Journal of Analytical and Applied Pyrolysis, 2004, 72(2): 243-248. doi: 10.1016/j.jaap.2004.07.003 [57] LIU W J, LI W W, JIANG H, et al. Fates of chemical elements in biomass during its pyrolysis [J]. Chem Rev, 2017, 117(9): 6367-6398. doi: 10.1021/acs.chemrev.6b00647 [58] BEESLEY L, MORENO-JIMENEZ E, GOMEZ-EYLES J L, et al. A review of biochars' potential role in the remediation, revegetation and restoration of contaminated soils [J]. Environmental Pollution, 2011, 159(12): 3269-3282. doi: 10.1016/j.envpol.2011.07.023 [59] CHU G, ZHAO J, CHEN F, et al. Physi-chemical and sorption properties of biochars prepared from peanut shell using thermal pyrolysis and microwave irradiation [J]. Environmental Pollution, 2017, 227: 372-379. doi: 10.1016/j.envpol.2017.04.067 [60] LUQUE R, MENENDEZ J A, ARENILLAS A, et al. Microwave-assisted pyrolysis of biomass feedstocks: the way forward? [J]. Energy & Environmental Science, 2012, 5(2): 5481-5488. [61] MENENDEZ J A, DOMINGUEZ A, FERNANDEZ Y, et al. Evidence of self-gasification during the microwave-induced pyrolysis of coffee hulls [J]. Energy & Fuels, 2007, 21(1): 373-378. [62] MUMME J, ECKERVOGT L, PIELERT J, et al. Hydrothermal carbonization of anaerobically digested maize silage [J]. Bioresource Technology, 2011, 102(19): 9255-9260. doi: 10.1016/j.biortech.2011.06.099 [63] AHMAD M, RAJAPAKSHA A U, LIM J E, et al. Biochar as a sorbent for contaminant management in soil and water: A review [J]. Chemosphere, 2014, 99: 19-33. doi: 10.1016/j.chemosphere.2013.10.071 [64] DEMIRBAS A, ARIN G. An overview of biomass pyrolysis [J]. Energy Sources, 2002, 24(5): 471-482. doi: 10.1080/00908310252889979 [65] KLÜPFEL L, KEILUWEIT M, KLEBER M, et al. Redox properties of plant biomass-derived black carbon (biochar) [J]. Environmental Science & Technology, 2014, 48(10): 5601-5611. [66] SUN K, KEILUWEIT M, KLEBER M, et al. Sorption of fluorinated herbicides to plant biomass-derived biochars as a function of molecular structure [J]. Bioresource Technology, 2011, 102(21): 9897-9903. doi: 10.1016/j.biortech.2011.08.036 [67] 林庆毅, 姜存仓, 张梦阳. 生物炭老化后理化性质及微观结构的表征 [J]. 环境化学, 2017, 36(10): 2107-2114. doi: 10.7524/j.issn.0254-6108.2017021703 LIN Q Y, QIANG C C, ZHANG M Y. Characterization of the physical and chemical structures of biochar under simulated aging condition [J]. Environmental Chemistry, 2017, 36(10): 2107-2114(in Chinese). doi: 10.7524/j.issn.0254-6108.2017021703
[68] 黄兆琴, 胡林潮, 程德义, 等. 化学老化后稻壳生物炭理化性质的改变及微观结构表征 [J]. 环境化学, 2019, 8: 1735-1744. doi: 10.7524/j.issn.0254-6108.2018101605 HUANG Z Q, HU L C, CHENG D Y, et al. Characterization of physicochemical properties and microstructure of rice husk-derived biochar after chemical aging [J]. Environmental Chemistry, 2019, 8: 1735-1744(in Chinese). doi: 10.7524/j.issn.0254-6108.2018101605
[69] QIN W, WANG Y, FANG G, et al. Evidence for the generation of reactive oxygen species from hydroquinone and benzoquinone: Roles in arsenite oxidation [J]. Chemosphere, 2016, 150: 71-78. doi: 10.1016/j.chemosphere.2016.01.119 [70] ZHANG P, ZHENG S, LIU J, et al. Surface properties of activated sludge-derived biochar determine the facilitating effects on Geobacter co-cultures [J]. Water Research, 2018, 142: 441-451. doi: 10.1016/j.watres.2018.05.058 [71] YU L, WANG Y, YUAN Y, et al. Biochar as electron acceptor for microbial extracellular respiration [J]. Geomicrobiology Journal, 2016, 33(6): 530-536. doi: 10.1080/01490451.2015.1062060 -












 下载:
下载: