-
含氮废水的处理方法主要有物理法、化学法、生物法等,而生物法是目前污水处理厂最常用的方法[1]。传统的生物法脱氮是利用微生物将水体中的有机氮、氨态氮和硝态氮转化成氮气的过程,包括氨化、硝化和反硝化的3个步骤。其中反硝化作用是由反硝化细菌在厌氧条件下将硝酸盐还原为氮气或氮氧化物的过程,是去除污水中含氮污染物的关键步骤。目前反硝化作用作为一种重要的脱氮工艺已得到广泛应用,但在实际应用中发现存在反硝化速率低的问题,从而影响了生物系统脱氮效率。反硝化过程需要有机物作为电子供体,研究表明我国城市污水处理厂普遍存在进水碳氮比低的问题,碳源不足已经成为制约污水处理厂脱氮效率的主要因素[2]。有很多学者采用新型生物脱氮工艺来提高脱氮效率,例如短程硝化反硝化[3]、厌氧氨氧化[4]和同步硝化反硝化[5]等。但新型工艺受到众多因素的影响,目前在实际工程中难以大规模推广应用。在实际污水处理过程中,碳源不足是制约反硝化脱氮效果的主要原因,但也有研究表明反硝化的电子传递速率是影响反硝化效率的因素之一[6-7]。反硝化反应涉及多重电子传递过程,电子传递速率是影响反硝化速率的重要因素。氧化还原介体是一类能够在电子受体和电子供体之间可逆地被氧化和还原,从而加速电子转移的化合物[8]。通过投加氧化还原介体提高反硝化中电子传递速率是提高生物脱氮速率的有效措施,因此成为目前的研究热点。
研究表明投加氧化还原介体可以提高反硝化过程电子传递速率、降低反应活化能从而加快反硝化脱氮速率[7, 9],通过提高生物反硝化性能减少缺氧池容积、节约投资成本,具有显著的经济效益。氧化还原介体-反硝化技术与新型生物脱氮工艺相比,其对水质、运行环境、操作条件等要求低,易于实施,管理方便。并且氧化还原介体种类多,来源较广泛,因此具有很好的应用前景。该技术的应用为解决生物转化速率慢的问题和高效脱氮提供了新思路。为此,本文对现阶段氧化还原介体强化生物反硝化脱氮研究进展进行了综述。
-
微生物的反硝化过程也称作硝酸盐呼吸。在厌氧条件下,反硝化细菌以硝酸盐为最终电子受体,有机碳为电子供体,在各种酶的作用下,将硝酸盐依次还原成
NO−2 、NO、N2O、N2,同时将有机碳氧化成CO2的过程并从中获得能量合成细胞[10]。其中涉及的酶主要包括硝酸盐还原酶(NaR)、亚硝酸盐还原酶(NiR)、一氧化氮还原酶(NoR)和一氧化二氮还原酶(N2OR)。反硝化的四步生化反应及其作用酶如表1所示。 -
对于异养型反硝化细菌,微生物在各种酶的作用下通过电子传递链将最初电子供体提供的电子传递给最终电子受体
NO−3 ,其中电子传递链是由与细胞膜紧密结合的电子载体NADH、FP、FeS、CoQ、Cyt b、Cyt bc1复合体和Cyt c等辅酶组成的[6, 14]。电子总是由低电动势传递给高电动势的,结合图1可以描述反硝化细菌的电子传递链。首先,有机物产生的直接电子供体NADH将电子传递给复合体Ⅰ,然后复合体Ⅰ将电子传递给CoQ,从此处,电子传递分两路进行。其一是CoQ将电子传递给NaR中的Cyt b使
NO−3 还原,同时也向膜外排出质子。其二是CoQ将电子传递给复合物Ⅲ,然后复合体Ⅲ将电子传递给Cyt c,最后Cyt c分别将电子传递给NiR、NoR和N2OR进而完成反硝化过程。当电子供体不足时,反硝化反应中4个步骤会存在电子竞争问题,相应的还原酶活性越强,其电子竞争能力就越强[15]。 -
氧化还原介体(RMs),也称为电子穿梭体,是指能够加速电子从最初电子供体向最终电子受体传递的一类化合物,可以使氧化还原速率提高一至几个数量级[16]。很多研究发现RMs在厌氧条件下不仅可以加速降解高氯酸盐[17]、硝基化合物[18]、偶氮染料[16, 19]等多种污染物,还可以加速微生物将硝酸盐、亚硝酸盐还原成氮气[7, 20]。随着污水处理厂污染物排放标准的提高,低成本、高效率的脱氮技术的研发日益重要,反硝化是去除含氮污染物的关键步骤。反硝化过程中伴随着电子传递,RMs可以提高电子转移效率,目前学者们致力于寻找不同种类的RMs,研究其强化反硝化效果及其作用机制。
作为一种有效的电子穿梭体,介体的氧化还原电位(ORP)应该介于最初电子供体和最终电子受体之间,反硝化电子传递链中电子载体和常见的介体的氧化还原电位具体见表2。RMs强化反硝化脱氮过程主要分为两步,如图2所示:第一步是在各种酶的作用下微生物将电子传递给介体,使介体还原,是生物步骤;第二步是还原态的介体将电子传递给氮氧化合物,使污染物还原,是非生物步骤。RMs对促进反硝化过程的作用机制主要体现在以下3个方面。
1)作为载体在反硝化电子传递链中传递电子,加速电子转移速率;Guo等[9]考察了多金属氧酸盐(POMs)对反硝化性能的影响,其中磷钼酸(PMo12)具有多个氧化还原位点,具有很好地传递电子能力;电化学阻抗谱法和循环伏安实验表明0.05 mmol·L−1的PMo12的添加使反硝化体系的电阻减少了34.28%,提高了电子转移速率,PMo12体系还原硝酸盐速率是对照体系的3.93倍,同时对亚硝酸盐还原也有积极作用。
2)作为一种催化剂降低反硝化反应的活化能;Xie等[31]的研究表明,在相同条件下,添加了0.25 mmol·L−1氯化血红素的体系和对照体系的反应活化能分别为3.27 kJ·mol−1和25.04 kJ·mol−1,氯化血红素的添加使反硝化反应活化能降低了87%。
3)提高反硝化关键酶的酶活性,并能取代辅酶Q参与电子传递过程。Yin等[25]的研究发现,25 μmol·L−1的AQ分别使NaR和NiR活性提高1.7倍和1.3倍,75 μmol·L−1的ME分别使NaR和NiR活性提高1.97倍和1.36倍,75 μmol·L−1的LAW和100 μmol·L−1的AQDS分别使NiR活性提高了47.6%和208%。Liu等[26]的研究表明AQS在反硝化过程中所起的作用可能与辅酶Q的类似,同时降低了反应体系的氧化还原电位,从而加速了电子传递过程。
-
目前促进反硝化过程的氧化还原介体主要为外源性RMs,研究较多的外源性RMs是腐殖质和醌类物质,有研究表明碳质材料和卟啉类化合物也可作为介体加快电子传递速率。常见外源性RMs种类及其在反硝化过程中作用如表3所示。
(1) 腐殖质
腐殖质(HS)是由动、植物或微生物残体等经生物酶或微生物的分解、氧化及合成等过程形成的一种有机高分子化合物,具有很强的电子转移能力[43]。其电子穿梭能力主要得益于醌、酚等官能团的存在,尤其是醌基团在电子传递中起到了重要的作用[44]。Li等[7]的研究表明,富里酸(FA)通过糖酵解和三羧酸循环增加碳源代谢,产生更多有效的NADH,通过复合体Ⅰ和复合体Ⅲ促进NADH向反硝化酶的转移从而促进硝酸盐还原。有研究表明,亚硝酸盐的累积是由于硝酸盐还原酶和亚硝酸盐还原酶活性不平衡引起的[25],过量的亚硝酸盐对微生物有毒害作用会抑制反硝化作用,从而降低TN的去除。FA的添加会促进反硝化关键酶的合成和催化活性,尤其是提高了亚硝酸盐还原酶和一氧化二氮还原酶的酶活性,显著的降低亚硝酸盐的累积和N2O的排放,使总氮去除率提高1.34倍。吴磊[32]考察了腐殖活性污泥对生物脱氮的促进作用,研究发现腐殖活性污泥对硝酸盐和亚硝酸盐生物反硝化菌有很好的促进效果,通过腐殖酸中的醌类基团充当胞外电子穿梭体,提高硝酸盐生物反硝化速率1.63倍,提高亚硝酸盐生物反硝化速率1.91倍。目前,由于天然腐殖质存在多个氧化还原位点,且不同来源的腐殖质其氧化还原特性也存在差异[45],因此常使用小分子醌类物质作为模板物进行相关研究。
(2) 醌类物质
醌类物质是一类含有两个双键的六碳原子环状二酮结构的芳香族化合物,能够可逆的接受和提供电子用于微生物还原硝酸盐、亚硝酸盐、一氧化二氮。其作用机理是微生物将有机物提供的电子传递给醌类物质使其还原成氢醌,然后氢醌被氧化成醌类将电子传递给硝酸盐[46]。Xi等[20]考察了5种水溶性RMs对反硝化加速效果,结果表明5种介体使反硝化速率提高了1.1—1.5倍,其中AQDS的催化效果最好;通过电子传递链抑制剂确定AQDS加速作用点,研究表明AQDS桥接了NADH与泛醌之间断裂(由抑制剂阻断的)的电子传递链,减少了抑制剂对反硝化电子传递的抑制作用。赵丽君等[47]采用AQS调控亚硝酸盐反硝化过程,研究结果表明AQS降低了反硝化体系的ORP,在反硝化过程中起辅酶Q的作用并加速了细胞色素传递电子的全过程从而加速了
NO−2 向N2O的转化。由于外源性溶解性醌类物质难降解且易随出水流失,会造成二次污染和增加运行成本。针对这一问题,很多学者采用固定化技术将介体包埋制备成材料用于强化反硝化过程。Guo等[36]利用海藻酸钙固定蒽醌制备成小球,蒽醌固定化小球降低了体系的氧化还原电位,使反硝化速率提高约2倍。杜海峰等[37]利用醋酸纤维素包埋醌类介体制备成介体小球,结果表明介体小球在反应10 h时可使硝酸盐去除率提高1.84倍,并具有很好的重复利用性。
(3) 碳质材料
碳质材料是一类固态的可重复利用的RMs,如生物炭、石墨、氧化石墨烯(GO)等。生物炭是指在低氧环境下,通过高温热解将稻草、玉米秆或其他农作物碳化得到的产物。由于其具有氧化还原活性成分和芳香族结构,可以作为电子穿梭体从而促进污染物还原[48]。Wu等[40]研究表明,300 ℃下制备的生物炭具有良好的接受和提供电子能力,生物炭的添加使反硝化体系碳源代谢能力增加从而产生更多的有效电子供体,并提高NaR、NiR和N2OR的酶活性加速了
NO−3 -N、NO−2 -N和N2O的还原,同时使反硝化体系电子传递活性提高1.37倍,从而减少了NO−2 -N积累和N2O排放,提高了TN的去除。石墨微粒(MGPs)能提高污泥对含氮污水的降解效果,其加速效果取决于MGPs的粒径和投加量。Li等[42]的研究表明MGPs对反硝化有加速作用,0.16 g·L−1的MGPs使合成废水的反硝化速率提高了83.4%。GO在废水中不仅有吸附的作用,还可作为电子穿梭体加快电子传递过程[49]。由于GO的吸附、催化等性能和较高的机械强度,常与其他材料掺杂用于强化污染物去除效果。Tang等[50]利用GO改性聚乙烯醇和海藻酸钠材料,研究其在低温下对反硝化的促进效果,研究表明在长期运行下,0.15 g·L−1 GO改良材料具有稳定的脱氮效果,提高了微生物的活性,使硝酸盐还原率提高了3.92倍。(4) 卟啉类化合物
卟啉是一类由4个吡咯环通过4个次甲基桥互联而成的芳香大环化合物。金属卟啉类具有催化的功能,能够降低反硝化反应的活化能,同时可以作为电子载体参与反硝化电子传递过程,提高反硝化脱氮效率。在自然界的生物体内都有卟啉类化合物的存在,如叶绿素、血红素、细胞色素等。其中细胞色素c是反硝化电子传递链中不可缺少的可移动电子载体,通过血红素中心的铁原子在二价态和三价态之间的变化,在细胞体内进行可逆的电子传递反应[51]。Xie等[31]的研究表明5种不同卟啉化合物的添加均使硝酸盐还原率提高了2—3倍,其中氯化血红素催化效果最好。氯化血红素的添加使体系的ORP迅速下降并达到稳定值并使反应活化能降低了87%,有利于硝酸盐的还原。并通过机理研究发现氯化血红素的金属配体和卟啉配体都有可能参加了反硝化的电子转移过程,加速了复合体Ⅲ的电子传递。叶绿素是一种生态友好型天然氧化还原介体,Lu等[30]发现0.02 mmol·L−1叶绿素a提高了系统的电子转移活性使硝酸盐和亚硝酸盐还原率提高7.26倍和7.31倍,并且叶绿素a具有良好的重复利用性,经过5次循环使用,其对硝酸盐的还原率是空白组的2—5.3倍。
-
反硝化反应涉及多重电子传递过程,电子传递速率是影响反硝化速率的重要因素。氧化还原介体通过促进电子转移效率、降低反应活化能从而提高脱氮效率。目前有关反硝化过程电子介体的研究主要集中在外源性RMs,尤其是腐殖质和醌类物质。外源性介体对反硝化的增效机制主要体现在增加碳源代谢提高NADH产量、提高关键酶的活性、促进电子载体间电子传递等几个方面。少量介体的投加可以显著提高硝酸盐还原速率,减少亚硝酸盐的累积和N2O的生成。
在污水处理系统中,水溶性RMs虽然可以加速反硝化过程,但其易随废水排放而流失,连续投加会增加运行成本。因此,学者们用载体将RMs固定化,固定化介体克服了介体流失问题,易实现固液分离,且具有良好的重复利用性,但其也存在一些问题,如固定化介体在一定程度上减少了微生物与介体的接触面积,限制了介体的催化活性,同时固定化介体的稳定性也需进一步提高。因此提高固定化介体的稳定性及强化催化效率可以作为未来的研究方向之一。此外,目前反硝化过程应用的RMs要以外源性物质为主,大部分为人工合成化合物,其存在潜在的环境风险。内源性RMs是由微生物产生并分泌到细胞外具有电子传递功能的一类物质,包括黄素类、吩嗪类、黑色素等。内源性RMs的分泌虽然会消耗微生物一部分能量,但这些RMs能被多次反复利用,并降低环境污染风险,对微生物毒害较小[52]。然而关于内源性介体在反硝化中的应用还鲜有报道,有待深入研究。
氧化还原介体强化生物反硝化脱氮研究进展
Enhanced biological denitrification by redox mediators: A review
-
摘要: 传统的生物脱氮包括氨化、硝化、反硝化,而反硝化过程是去除污水中含氮污染物的关键步骤。在实际污水处理过程中,低反硝化速率影响了生物系统脱氮效果。研究发现反硝化反应涉及多重电子传递过程,电子传递速率是影响反硝化速率的重要因素。氧化还原介体是一类能够在电子供体和电子受体之间可逆地被氧化和还原,加速电子传递的化合物。研究表明,氧化还原介体可以促进反硝化的电子转移速率,降低反应的活化能从而提高脱氮效果。本文总结了反硝化作用中电子传递过程,在此基础上,论述了氧化还原介体定义及作用,重点分析氧化还原介体的种类及其在反硝化过程中的应用,并指出了今后的研究方向,以提高氧化还原介体在反硝化过程中的应用。Abstract: The traditional biological nitrogen removal includes ammoniation, nitrification and denitrification. Denitrification is the key step in nitrogen removal. Slow denitrification rate is the bottleneck for nitrogen removal in practical wastewater. Denitrification involved multiple electron transfer processes, and electron transfer rate was the important factor for denitrification rate. Redox mediators were compounds that can be reversibly oxidized and reduced between an electron donor and an electron acceptor, thus electron transfer can be accelerated. The studies showed that the redox mediators can improve the denitrification by increasing the electron transfer rate and decreasing the activation energy of the reaction. This paper summarized the electron transfer process of denitrification and discussed the definition and functions of redox mediators. The kinds of redox mediators and their application in the denitrification process was reviewed. Moreover, the future research directions were pointed out to improve the application of redox mediators in denitrification.
-
Key words:
- nitrogen removal /
- redox mediators /
- denitrification /
- electron transfer
-
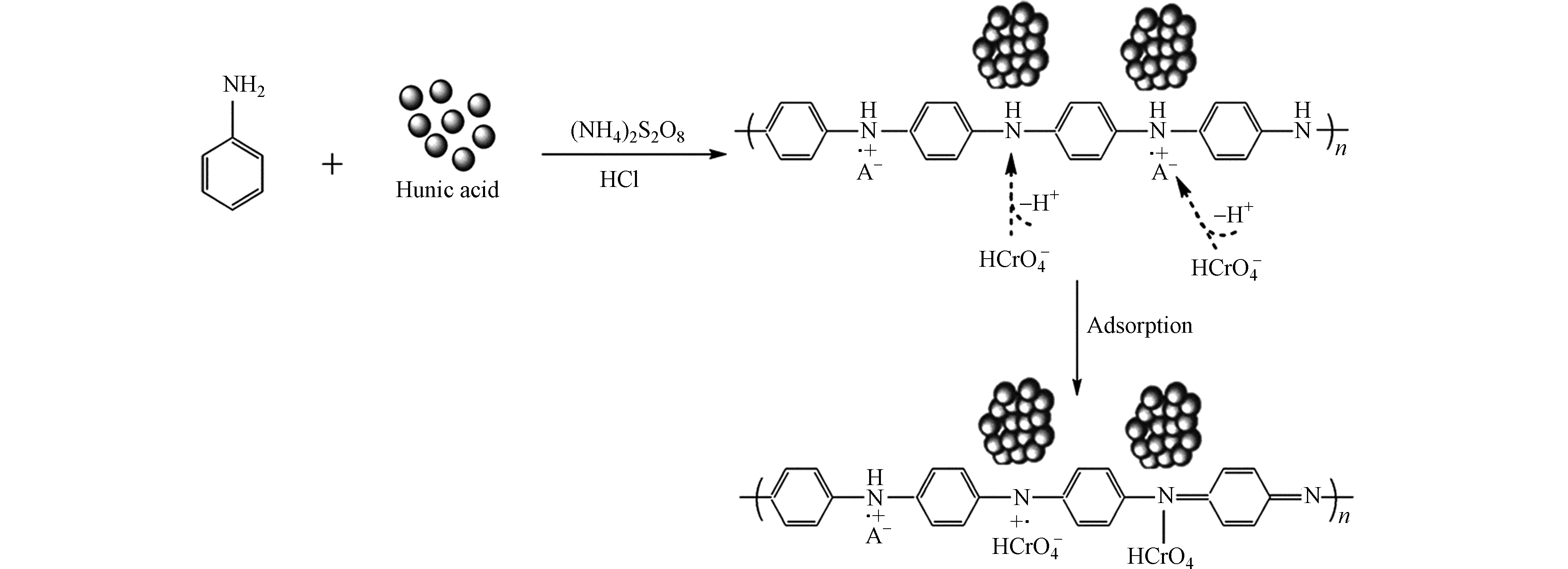
由于自然过程(风化作用和生化作用)以及在世界范围内许多工业和制造过程中的使用不断增加,水生生态系统中的铬污染已成为一个突出问题,对生态环境和人类健康构成严重威胁。铬以Cr(Ⅲ)和Cr(Ⅵ)的形式存在于环境中,虽然Cr(Ⅲ)是人体必需的微量营养素,但Cr(Ⅵ)在水介质中可高度溶解,具有急性毒性、致突变性和致癌性,Cr(Ⅵ)的毒性是Cr(Ⅲ)的500倍[1]。
铬在制造和工业使用时,由于贮存和泄漏处理不当,导致多次被释放到环境中,造成地下水和土壤的污染。自然过程也会导致地下水中铬的浓度升高,例如,超镁铁质岩石可能具有较高的铬含量,其主要存在于母体矿物中的Cr(Ⅲ)中,但在风化过程中被四价锰氧化物氧化为Cr(Ⅵ)。尽管Cr(Ⅵ)的释放可能来自许多环节,但对环境危害最大的是铬铁矿加工残渣的处置不当。与铬铁矿加工残渣接触的水pH >12,并且水中的Cr(Ⅵ)浓度可超过1mmol·L−1[2-3]。当这种水不可避免地从废物堆中逸出到地球圈,会产生Cr(Ⅵ)羽流,其中pH值从高碱性值向天然土壤pH值变化。在水体环境中,Cr(Ⅵ)通常以可溶阴离子基团形式存在,如
CrO2−4 HCrO−4 Cr2O2−7 Cr2O2−7 Cr2O2−7 HCrO−4 CrO2−4 xCr3++(1−x)Fe3++3H2O⟶(CrxFe1−x)(OH)3(s)+3H+ (1) xCr3++(1−x)Fe3++2H2O⟶CrxFe1−xOOH(s)+3H+ (2) HA是一种通过微生物的分解和转化植物残留物而累积起来的高分子有机物质[14],具有生物化学稳定性高、表面积大、结构复杂、带有多种活性官能团等特点。它在全球总计达数万亿吨,通常存在于河流,湖泊,海洋,土壤和煤矿中。HA广泛应用于农业,林业,畜牧业和化学工业等领域[15-16],多项研究已将HA用作污染物的吸附剂[17-18]。尽管HA的存在会污染地下水和地表水,但其优点胜于其用于处理工业废水的缺点,并且可以在后续深加工中将其完全清洗。此外,HA表面富含官能团,包括羧基、羟基和羰基[19]。这些基团可用于与阳离子物质进行离子交换、吸附、络合和螯合[20-22]。目前国内外对利用HA去除水体和土壤中铬离子的研究尤为重视。
本文旨在系统地阐述HA的结构特征和与Cr(Ⅵ)的作用机理,分析了矿物质和纳米复合材料去除Cr(Ⅵ)的过程中HA的影响,总结了仍然存在的局限性和尚待解决的问题,以便为HA处理含Cr(Ⅵ)废水的应用提供未来展望。
1. 腐植酸的结构特征及去除Cr(Ⅵ)机理(Structure characteristics and Cr(Ⅵ) removal mechanism of humic acid)
1.1 腐植酸的结构特征
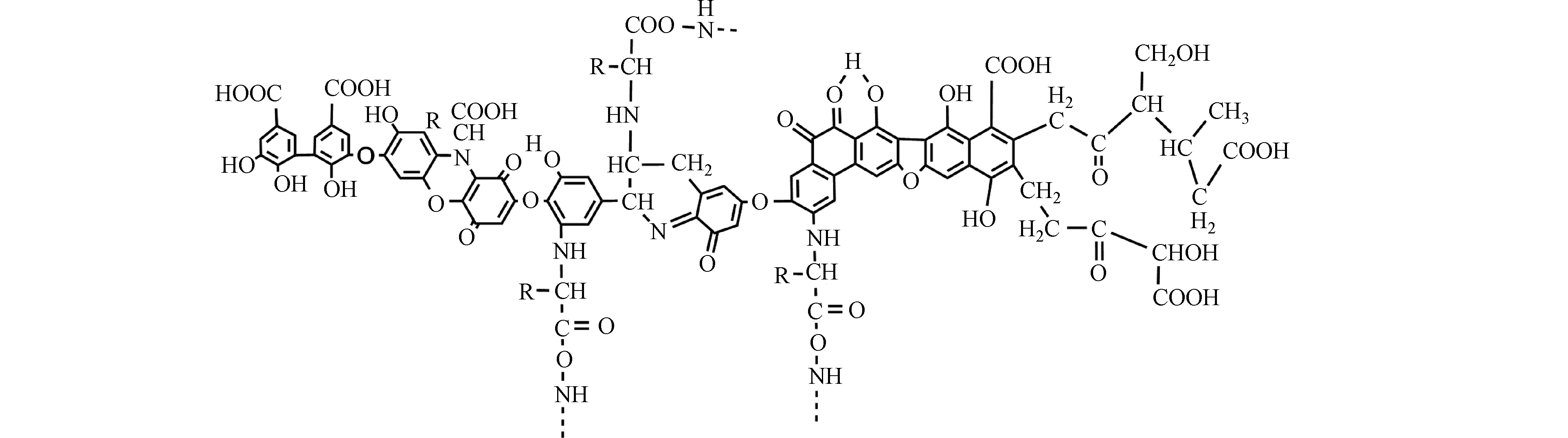
HA是包含于腐殖质(HS)的大分子,HS是由细菌和真菌对植物和动物的残留物进行腐烂和转化而产生的深色、异质的有机化合物。主要的HS前体分子是通过植物产生的生物聚合物和蛋白质的解聚和氧化形成的,这些分子含有未分解的聚合物片段和酚类、羟基、羧基和氨基残基[23]。传统的“聚合物模型”假设前体是由微生物合成的随机卷曲的聚合物大分子,而有研究表明HS是超分子缔合的[24-25]。两亲性前体分子聚集在一起形成胶束状粒子,而其它植物降解的生物分子则与疏水或亲水结构域有关[26-27]。虽然目前大多数证据支持这种“胶束模型”,但是在HS数百万年的老化和降解过程中并不排除聚合物大分子的形成 [28-29]。
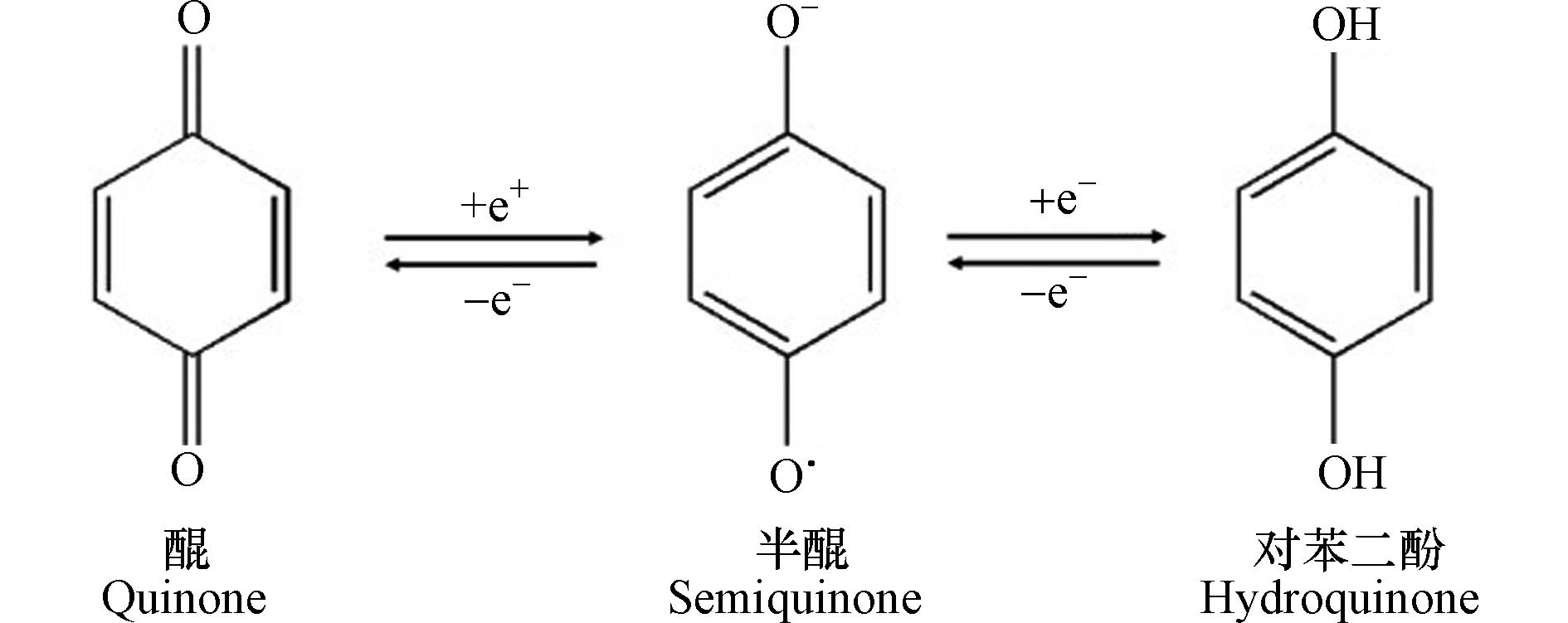
HA是可溶于碱性介质,部分可溶于水而不溶于酸性介质的HS组分[30]。由于具有两亲性,HA在中性至酸性条件下会形成胶束状结构,称为假胶束[31]。已经探索出该性质可用于污染修复[32],并增加疏水性药物的水溶性[33-34]。HA含有不同的官能团,其数量取决于HA的来源、年龄、气候和提取的环境条件。HA的各种功能主要归因于酚和羧酸官能团,它们允许—OH/—OOH的脱质子化。这使得HA拥有了许多功能,如具有改善植物生长和增强营养[35],与重金属络合[36],抗病毒和抗炎活性[37]。此外,HA结构中酚类、羧酸和醌的存在与其抗氧化、抗突变/去突变和杀菌/杀菌活性有关[38]。HA的化学组成可能会因来源,年龄,气候和生物学条件而异,因此很难对这些物质进行精确表征。它们的分子量在2.0 kDa到1300 kDa之间[39],并且它们包含许多官能团,如图1所示[33],HA主要由酚、羧酸、烯醇、醌和醚官能团组成,但也可能包括糖和肽。但是,酚羟基和羧基在HA结构中更为普遍。HA分子的巨大结构由亲水部分(由—OH基团组成)和疏水部分(由脂族链和芳环组成)组成。醌是电子接受基团,负责产生活性氧(ROS)。它们被还原为半醌,由其芳环稳定,并进一步还原为更加稳定的对苯二酚(图2)[40]。Aeschbacher等[41]研究了从不同来源中获得的HA中的电子接受部分(醌)和供电子部分(酚类),发现这些物质的来源和年龄直接影响其氧化还原特性。13C NMR分析表明,与陆生HA相比,水生HA具有更高的给电子数和更低的电子接受基团[40]。Aeschbacher等[41]做出以下假设:HA中的酚羟基会减慢醌的氧化转化,从而提高其在含氧环境中的持久性。
1.2 腐植酸去除铬离子机理
水生环境中金属阳离子在溶液中的作用与H+相同,即电荷中和,电荷越高,阳离子在HA假胶束的形成中越有效。此外,多价阳离子与相邻链上的酚羟基和羧基基团相互作用,增强了假胶束结构域和去污作用。von Wandruszka[42]提出这种相互作用的机制如下:HA分子与金属阳离子之间的相互作用最初完全是静电作用,并且阳离子会移动到HA中热力学上更稳定的位置。此过程形成球状HA-金属络合物。对HA与金属离子结合的研究表明,这种相互作用随金属不同而变化,并受金属离子浓度以及HA的来源、分子量和浓度影响[43]。Christl等[43]证明HA与金属离子之间的结合能力与HA的分子大小有关。用尺寸排阻色谱-聚丙烯酰胺凝胶电泳分离HA得到的3个级分的13C NMR分析证实,分子量较低的HA组分具有最多的酚羟基和羧基,因此是可以最有效地结合金属离子的组分。此外,Christl和Kretzschmar[44]发现在较高金属离子浓度下,可观察到两个HA大小级分之间的差异,因为较小的级分由于官能团数较多而具有较高的结合能力。HA通过与金属离子结合形成络合物,从而去除水和土壤中的重金属,是一个很好的重金属污染补救措施。重金属污染的水(包括铬污染)一般是呈酸性,使得HA的溶解度会降低,从而干扰HA-金属配合物的形成。但是铬污染的水中铬以阴离子形式存在,酸性环境下反而有利于HA对铬的还原。
Cr(Ⅵ)能与含有酚羟基、醇羟基的有机物反应从而被还原为Cr(Ⅲ)。与这些基团的反应被认为涉及到一种铬酸盐中间体,该中间体可由这些基团与单体H2CrO4和
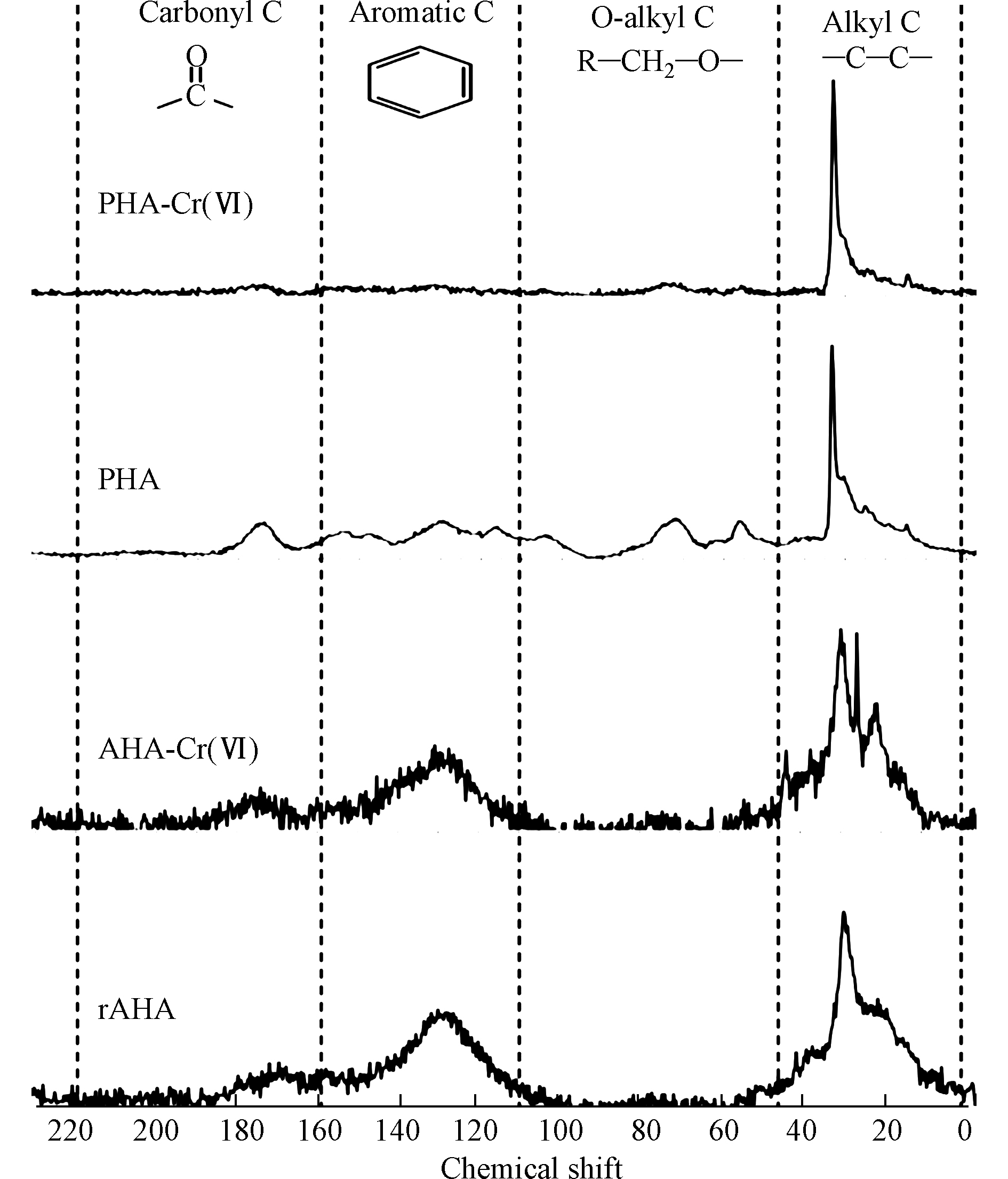
HCrO−4 CrO2−4 CrO2−4 HA还原Cr(Ⅵ)降低了铬的毒性,产生的Cr(Ⅲ)与HA中的两个碳原子形成一个内层吸附复合物,大大减少了Cr(Ⅲ)扩散或重新氧化成可移动Cr(Ⅵ)的机会。Cr(Ⅵ)的还原速率和还原Cr(Ⅵ)的总容量与所使用的HA的反应活性呈正比,特别是HA中酚羟基和醇羟基的密度。Zhang等[53]研究了从东北典型黑土中提取的HA在pH=1.0时对Cr(Ⅵ)的还原,结果表明,HA中的酚羟基和醇羟基官能团是还原Cr(Ⅵ)的主要电子给体,而不是羧基和羰基,它们更可能参与铬的络合反应,而且HA颗粒表面的酚羟基和醇羟基对Cr(Ⅵ)还原的活性远高于其内部。Aldmour等[54]研究泥炭腐植酸(PHA)和褐煤腐植酸(AHA)对Cr(Ⅵ)的还原,发现HA将Cr(Ⅵ)还原为Cr(Ⅲ)通常涉及与芳香族的反应,特别是与酚羟基的反应。PHA的变化表明醇羟基也可能发生了反应。HA样品与过量的Cr(Ⅵ)反应,使pH值从3升到7,表明在酸性体系中Cr(Ⅵ)与HA反应消耗了H+。Cr(Ⅵ)的还原必然导致HA的氧化,但13C-NMR谱没有鉴定出产生的官能团(图3)。研究表明,Cr(Ⅲ)吸附在HA上导致羰基Cr(Ⅲ)络合物的形成和与电子再分配相关的屏蔽导致羰基的13C-NMR谱信号减少。因此,用PHA和AHA还原Cr(Ⅵ)很可能会生成新的羰基[52]。
2. 腐植酸对矿物质和纳米复合材料去除Cr(Ⅵ)的影响(Effect of humic acid on Cr(Ⅵ) removal by minerals and nanocomposites)
2.1 腐植酸对矿物质去除Cr(Ⅵ)的影响
铬的界面行为是了解铬在污染环境中的环境效应的基础,然而,复杂的表面会导致铬表现出各种各样的行为。铬的迁移和转化主要受固-液界面的相互作用控制,尤其是沿铁氧化物界面的相互作用。HS与矿物相互作用时,带负电的HS可能会保留在带正电的矿物表面上。因此,HS和矿物之间的相互作用可能会改变任何一种物质的原始特性,并产生复杂的HS矿物[55]。因此,有必要研究铬与具有不同特性的各种HS矿物界面的相互作用。HS是一种富含官能团的有机分子,包含HA和黄腐酸(FA),HA可以吸附在矿物表面,改变矿物的的反应性和表面特性[56]。HA对Cr(Ⅵ)离子具有很强的络合能力[57],并且对矿物表面具有很高的亲和力[58],已被认为是控制水中各种元素行为的重要因素。Kantar等[59]在pH为3—8体系中,研究HA对含Ca2+、Mg2+等阳离子体系中黄铁矿去除Cr(Ⅵ)的影响,发现HA对黄铁矿吸收Cr(Ⅵ)有抑制作用。HA吸附在黄铁矿表面,与Cr(Ⅵ)竞争黄铁矿表面位置;HA通过与黄铁矿反应位点结合改变了黄铁矿表面的静电特性,导致反应位点与
CrO2−4 HA作为一种自然水生环境中普遍存在的天然有机质,已被用于磁铁矿的表面改性来修复受Cr(Ⅵ)污染的水。由于HA官能团和磁铁矿的表面羟基之间的络合-配位交换反应,HA对磁铁矿具有高亲和力。完全被HA覆盖的磁铁矿颗粒具有HA的特性和磁铁矿的磁性,与金属氧化物相关的特性相反[55],溶液pH > 3时,零电荷点和负电荷点的低pH值抑制了它们的团聚。磁铁矿中的Fe(Ⅱ)可以将Cr(Ⅵ)还原为Cr(Ⅲ),随后Cr(Ⅲ)被氧化铁表面的羟基螯合,形成内层表面配合物[60]。但是,磁铁矿中的Fe(II)极易自氧化形成磁性降低的Fe(Ⅲ),不利于磁铁矿在磁场条件下的分离。Jiang等[61]用HA包覆磁铁矿纳米颗粒在pH = 4条件下还原Cr(Ⅵ)发现,HA使Fe(Ⅱ)不受自氧化和Cr(Ⅵ)电子转移的影响,并通过HA将Cr(Ⅵ)还原为无毒的Cr(Ⅲ)来保留材料的磁性,使得在磁场条件下HA-Fe3O4颗粒在处理后易于分离。
Zheng等[62]研究了HA在铁矿(磁铁矿和赤铁矿)吸附Cr(Ⅵ)过程中的作用以及Cr(Ⅵ)吸附到铁矿HS络合物表面上的界面行为。发现化学吸附起了重要作用,且在较高温度下,磁铁矿HA复合物、磁铁矿FA复合物和赤铁矿FA复合物对Cr(Ⅵ)的吸附较好;而在较低的温度下,磁铁矿、赤铁矿和赤铁矿HA复合物对Cr(Ⅵ)吸附能力较好。此外,铁矿物上的HA分子对Cr(Ⅵ)的亲和力比FA分子弱。化学吸附和物理吸附同时存在于Cr(Ⅵ)在铁矿物质和铁矿HS络合物上的吸附。此外,除赤铁矿HA复合物外,所有铁矿物质和铁矿HS络合物的化学吸附作用最为明显。
Yu等[63]研究Fe(Ⅱ)诱导水铁矿(Fh)-HA共沉淀转化过程中吸附Cr(Ⅵ)的行为,发现在Fh-HA的老化过程中,在无Fe(Ⅱ)存在下,共沉淀HA通过吸附和络合作用将Cr(Ⅵ)固定在赤铁矿中;在Fe(Ⅱ)存在下,Fe(Ⅱ)能将吸附的Cr(Ⅵ)还原为Cr(Ⅲ)(式3、4)。
3Fe2++HCrO−4+7H+⟶3Fe3++Cr3++4H2O (3) 3Fe2++CrO2−4+8H+⟶3Fe3++Cr3++4H2O (4) 此外,吸附的Cr(Ⅵ)在Fh和Fh-HA的相变过程中,可以在水相Fe(Ⅱ)的促进下,通过结构掺入的方式结合到次生矿中。在中性条件下,当Fe(Ⅱ)初始浓度较低(0.2 mmol·L−1)时,水溶性残余Cr(Ⅵ)可并入次生矿物中的Cr(Ⅲ)- Fe(Ⅱ)共沉淀物中。最后,通过共沉淀HA还原和络合次生矿物中的Cr(Ⅵ),进一步促进转化过程中Cr(Ⅵ)的固定化。
2.2 腐植酸对纳米复合材料去除Cr(Ⅵ)的影响
纳米材料由于大比表面积和高反应活性广泛用于去除废水中重金属。HA普遍存在于水生环境中,并具有多种官能团,可使其与金属离子络合并与纳米材料相互作用。这些相互作用不仅可以改变纳米材料的环境行为,而且可以影响纳米材料对重金属的去除和迁移。因此,所涉及的相互作用和潜在机制值得进行深入研究。
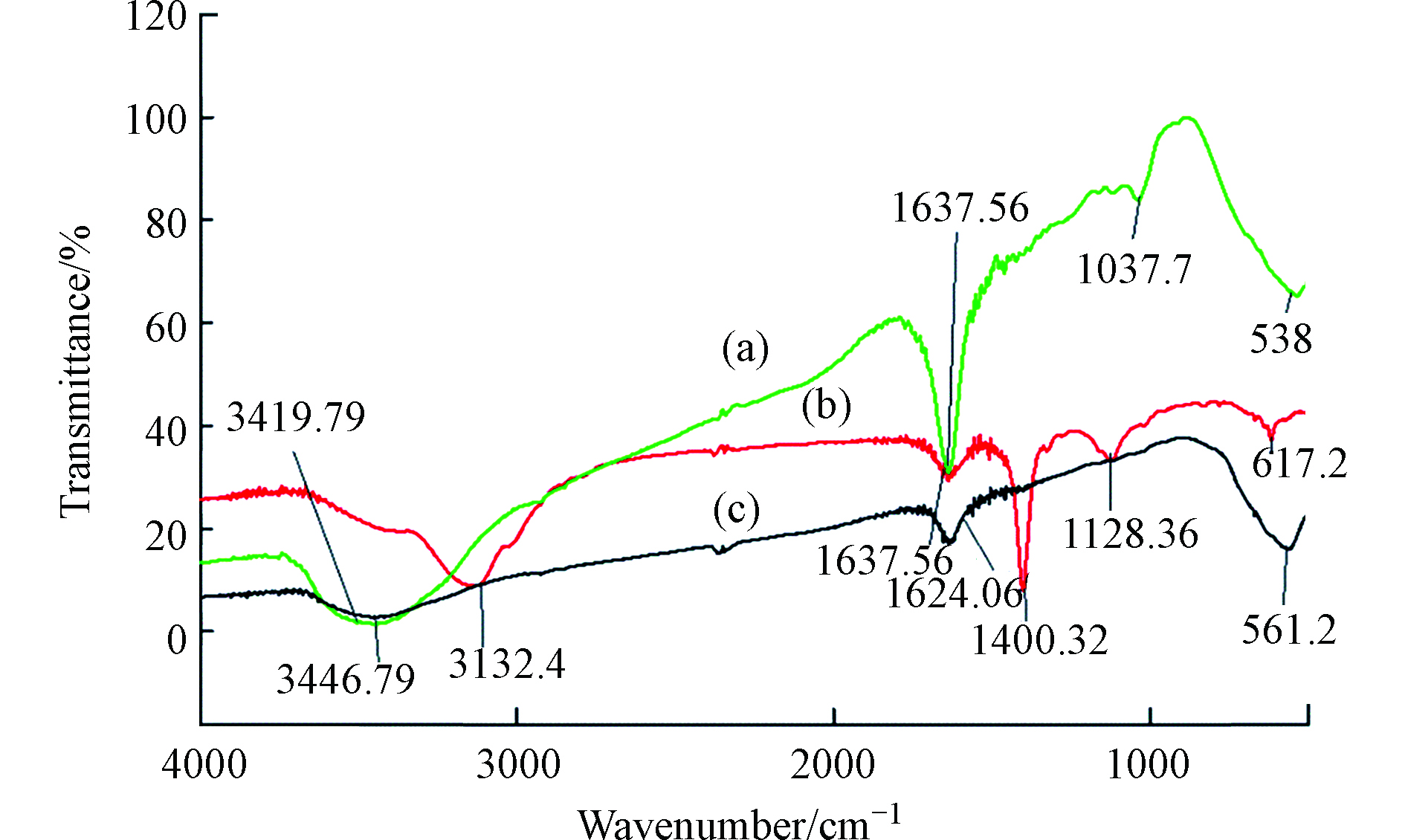
将HA通过各种改性方法制备出不溶性HA基吸附材料,已成为HA吸附铬离子的一种新的研究方向,Lu等[64]通过水热法制备了蒙脱石/ Fe3O4 /HA(MFH)纳米复合材料,将HA涂覆在Fe3O4纳米粒子上以及将HA涂覆的Fe3O4纳米粒子分散在蒙脱石上,可以保护Fe3O4纳米粒子免受氧化并抑制其聚集。研究表明,蒙脱石、Fe3O4纳米粒子和HA之间的协同作用可有效增强Fe3O4纳米粒子从废水中去除Cr(Ⅵ)的活性和效率。对HA、HA包覆(HINP)和未包覆氧化铁纳米粒子(INP)进行FTIR分析[65],如图4所示,在INP和HINP的561 cm−1和617 cm−1处出现了强吸收带,这是磁铁矿为主要相的Fe─O键拉伸振动导致[66]。如预期[67]那样,HINP光谱中在1400 cm−1处由于─CH2基团的振动出现了强吸收峰,而在INP中却没有观察到。在3419.79 cm−1和3421.72 cm−1处存在O─H伸缩振动,表明HA和INP之间的相互作用导致氢键的形成。HINP在1128 cm−1和1637 cm−1的吸收峰分别是由于C─O和芳香族C=C拉伸所致[68]。表明HA与INP表面之间的键合主要是通过配位交换反应。
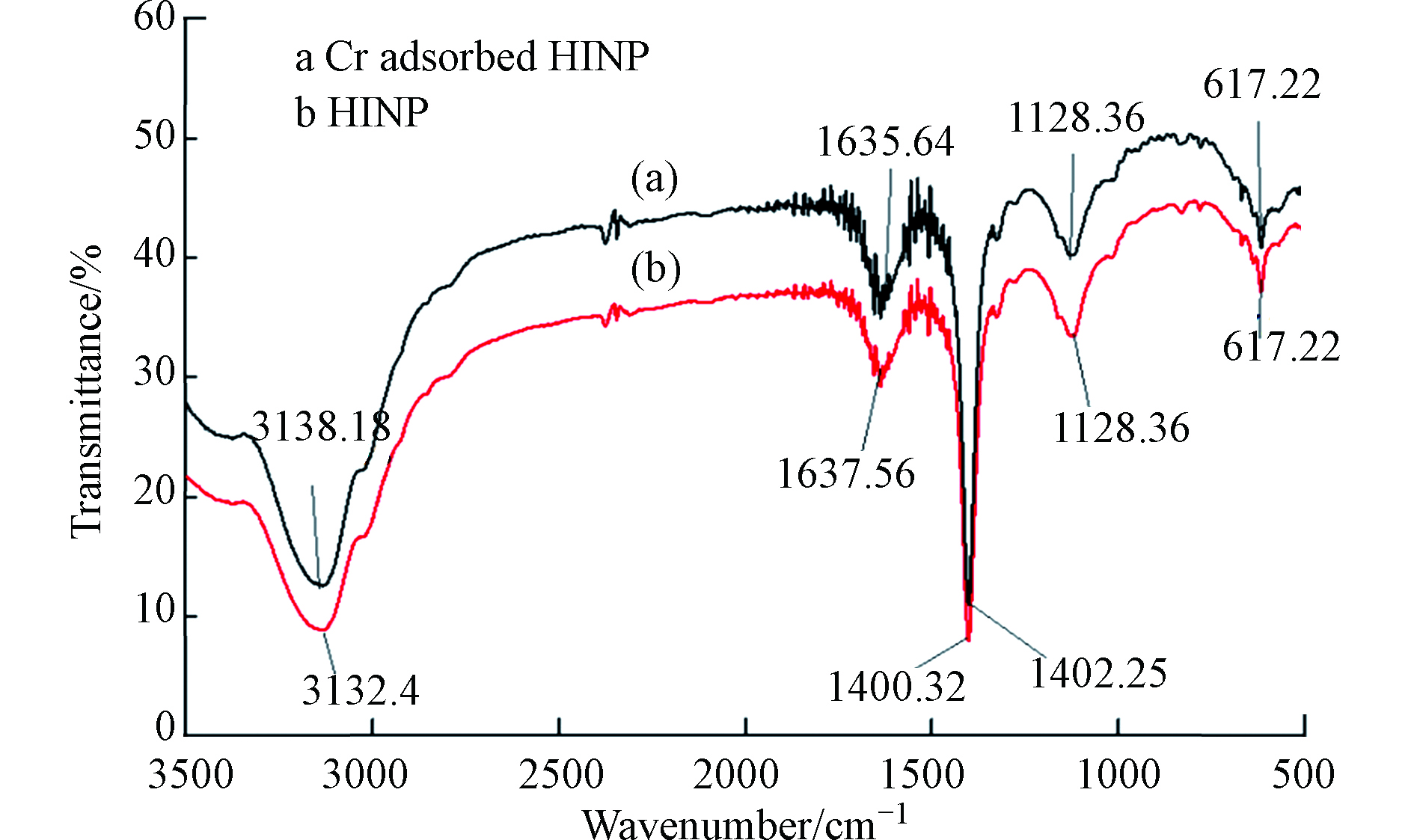
Cr(Ⅵ)吸附后关键FTIR谱带的移动(图5)表明,金属结合过程发生在吸附剂表面。从3132.4 cm−1(HINP)到3138.18 cm−1(铬负载的HINP)的明显偏移表明表面羟基参与吸附。在铬吸附之后,HINP中烯烃基团的C = C拉伸也从1637.56 cm−1变为1635.64 cm−1[69]。
Zhang等[70]将黑液中的木质素转化为一种HA包覆的氮掺杂磁性多孔碳吸附剂(HA-N-MPC),用于去除水中的Cr(Ⅵ)。研究发现,在pH = 2时,HA-N-MPC对Cr(Ⅵ)的吸附主要是化学吸附且吸附能力非常高,为130.5 mg·g−1。HA-N-MPC对Cr(Ⅵ)去除主要包括3个过程:(1)由于表面积大且介孔结构发达,HA-N-MPC可以轻松快速地捕获Cr(Ⅵ)。(2)在pH值较低的水溶液中,通过静电作用和化学作用将带负电荷的Cr(Ⅵ)物质吸附到HA-N-MPC表面;(3)吸附的Cr(Ⅵ)通过HA-N-MPC吸附剂上某些电子给体的电子转移而还原为Cr(Ⅲ)。Zhang等[71]研究聚苯胺/HA纳米复合材料(PANI/HA)对水中Cr(Ⅵ)的吸附发现PANI/HA对材料稳定性和Cr(Ⅵ)去除效率有显著的提高,HA的存在可以通过阻止初始PANI的聚集来增强其稳定性。
PANI/HA-1吸附前后的形貌(图6)显示,PANI/HA-1粒子表现出短棒状粒子的形态,与其相比,铬负载的PANI/HA-1显示嵌入短棒状颗粒的球形小颗粒消失,这可能是由于负载铬与PANI/HA基质之间的相互作用。在pH值为3—7之间和较低的初始Cr(Ⅵ)浓度下,PANI/HA-1(HA为0.12 g)对Cr(Ⅵ)去除率较高;制备的PANI/HA-1大部分处于完全氧化状态,Cr(Ⅵ)在pH 5.0时被PANI / HA-1吸收,而PANI / HA-1从初始的完全氧化状态变为部分还原状态(图7)。PANI/HA-1对Cr(Ⅵ)的脱附研究表明,1.0 mol·L−1 NaOH洗脱液比HCl洗脱液具有更高的脱附效率,并且通过对电化学解吸,可以将PANI/HA中加载的Cr(Ⅵ)从PANI/HA基体中去除(图8),为重金属解吸开辟了新的途径。
3. 结语(Conclusion)
HA是一种对Cr(Ⅵ)有强烈的络合和吸附能力的清洁的物质,能有效降低废水中Cr(Ⅵ)的毒性,减少铬的迁移,是废水中铬污染的优良去除剂。现有研究多集中于加强HA对含铬废水的去除效果,对HA与铬离子的微观作用机理研究较少。同时,HA与矿物质相互作用改变了矿物的反应性和表面特性,使得与铬相互作用的途径和动力学发生改变。因此,有必要对铬在不同性质HA矿物界面上的结合行为进行系统的研究,加深对铬离子的去除和迁移的理解。HA与铬离子络合并与纳米材料相互作用,不仅改变了纳米材料的环境行为,而且影响着纳米材料对铬离子的去除和迁移,需要进一步研究纳米材料、HA和铬离子之间的相互作用机理。HA在土壤中广泛存在强Cr(Ⅵ)截留效应,进一步研究HA与Cr(Ⅵ)的作用机制将有助于提高HA对环境中Cr(Ⅵ)的去除能力。
-
表 1 反硝化脱氮步骤及作用酶的特点
Table 1. The steps of denitrification and the characteristics of enzymes
步骤Step 作用酶Enzyme 酶的特点Characteristics of enzyme NO3-+2H++2e-→NO2-+H2O NaR 存在膜结合硝酸盐还原酶和周质硝酸盐还原酶,这两种酶在表达条件、结构和编码基因有很大差异[11]。 NO2-+2H++e-→NO+H2O NiR 细胞周质酶,含有两种不同类型的细胞色素:Cyt c和Cyt d1[12]。 2NO+2H++2e-→N2O+H2O NoR 膜结合的细胞色素bc型酶,含有非血红素铁;该酶很不稳定,对NO有着极高的亲和力,可使NO浓度维持在低于毒害临界值的水平[11-12]。 N2O+2H++2e-→N2+H2O N2OR 细胞周质酶,易受pH的抑制,对氧的敏感度高于其他脱氮酶,该酶的每个亚基具有6个Cu原子[13],还含有细胞色素。 表 2 反硝化电子传递链中电子载体和常见RMs的ORP
Table 2. ORP of electron carriers in denitrifying electron transport chains and common RMs
反硝化中电子载体[13, 21-22]Electron carriers for denitrification[13, 21-22] ORP/mV 氧化还原介体Redox mediator ORP/mV 烟酰胺腺嘌呤二核苷酸(NADH) −320 黄素腺嘌呤二核苷酸(FAD)[23] −219 黄素蛋白(FP) −300 核黄素(RF)[24] −208 黄素单核苷酸(FMN) −219 2-羟基-1,4-萘醌(LAW)[25] −139 铁硫蛋白(FeS) −180 甲萘醌(ME)[25] +203 细胞色素b(Cyt b) +30 2-蒽醌二磺酸钠(AQS)[26] −218 辅酶Q(CoQ) +100 2,6-蒽醌二磺酸钠(AQDS)[25, 27] −184 细胞色素c(Cyt c) +254 绿脓菌素(PYO)[28] −32 硝酸盐(NO3−) +433 吩嗪-1-羧酸(PCA)[29] −114 亚硝酸盐(NO2−) +320 叶绿素a[30] −35 表 3 外源性RMs种类及其在反硝化过程中的应用
Table 3. Exogenous RMs species and applications in denitrification
种类Kind 氧化还原介体Redox mediator 强化效果Enhanced effectiveness 参考文献Reference 腐殖质 富里酸 总氮去除率提高1.34倍,降低亚硝酸盐累积和减少N2O排放 [7] 腐殖酸 与对照组比,HS-A2O可将总氮去除率提高10%,同时污泥产量减少30% [32] 可溶性醌类物质 AQDS 反硝化速率提高1.5倍 [20] AQ、ME和LAW 反硝化速率分别提高1.60、1.25、2.08倍 [25] NQS,AQDS,LAW 显著提高N和S元素的去除 [33] 2-羟基-1,4-萘醌 使硝酸盐还原率提高了1.38倍 [34] NQS 在低温下,NQS使硝酸盐去除率提高1.5倍,总氮去除率提高1.74倍 [35] 固定醌类物质 海藻酸钙固定蒽醌 反硝化速率提高约2倍 [36] 醋酸纤维素包埋醌类介体 硝酸盐去除率提高1.84倍 [37] 固定醌类物质 醌基功能型高分子生物载体(PET-1,8-DCA) 反硝化速率提高1.2倍 [38] 聚吡咯固定化介体(AQS/PPY/ACF) 减少亚硝酸盐的累积,反硝化速率提高约35%,具有很好的重复性 [39] 碳质材料 生物炭 TN去除率提高415%,N2O排放量减少78% [40] 生物炭 低温热解的生物炭强化了反硝化效果,高温热解的生物碳减少74.1%—99.9%的N2O排放 [41] 石墨微粒(MGPs) MGPs浓度为0.16 g·L−1,反硝化速率提高83.4% [42] 卟啉类化合物 氯化血红素 硝酸盐还原率提高2—3倍,反应活化能降低87% [31] 叶绿素 硝酸盐和亚硝酸盐还原率提高7.26倍和7.31倍 [30] 无机类 磷钼酸 硝酸盐还原速率提高3.93倍 [9] -
[1] 周少奇, 周吉林. 生物脱氮新技术研究进展 [J]. 环境污染治理技术与设备, 2000, 1(6): 11-19. ZHOU S Q, ZHOU J L. The advances in investigation of new technologies on biological nitrogen removal [J]. Techniques and Equipment for Environmental Pollution Control, 2000, 1(6): 11-19(in Chinese).
[2] LIU W, YANG H, YE J J, et al. Short-chain fatty acids recovery from sewage sludge via acidogenic fermentation as a carbon source for denitrification: A review [J]. Bioresource Technology, 2020, 311: 123446. doi: 10.1016/j.biortech.2020.123446 [3] GAO D W, PENG Y Z, WU W M. Kinetic model for biological nitrogen removal using shortcut nitrification-denitrification process in sequencing batch reactor [J]. Environmental Science & Technology, 2010, 44(13): 5015-5021. [4] XU X C, XUE Y, WANG D, et al. The development of a reverse anammox sequencing partial nitrification process for simultaneous nitrogen and COD removal from wastewater [J]. Bioresource Technology, 2014, 155: 427-431. doi: 10.1016/j.biortech.2013.12.111 [5] CHEN H, ZHAO X H, CHENG Y Y, et al. Iron robustly stimulates simultaneous nitrification and denitrification under aerobic conditions [J]. Environmental Science & Technology, 2018, 52(3): 1404-1412. [6] CHEN J W, STROUS M. Denitrification and aerobic respiration, hybrid electron transport chains and co-evolution [J]. Biochimica et Biophysica Acta, 2013, 1827(2): 136-144. doi: 10.1016/j.bbabio.2012.10.002 [7] LI M, SU Y L, CHEN Y G, et al. The effects of fulvic acid on microbial denitrification: promotion of NADH generation, electron transfer, and consumption [J]. Applied microbiology and Biotechnology, 2016, 100(12): 5607-5618. doi: 10.1007/s00253-016-7383-1 [8] 班巧英, 刘琦, 余敏, 等. 氧化还原介体催化强化污染物厌氧降解研究进展 [J]. 科技导报, 2019, 37(21): 88-96. BAN Q Y, LIU Q, LI J Z, et al. Review on catalytic effects of redox mediator in anaerobic degradation of pollutants [J]. Science & Technology Review, 2019, 37(21): 88-96(in Chinese).
[9] GUO H X, CHEN Z, GUO J B, et al. Enhanced denitrification performance and biocatalysis mechanisms of polyoxometalates as environmentally-friendly inorganic redox mediators [J]. Bioresource Technology, 2019, 291: 121816. doi: 10.1016/j.biortech.2019.121816 [10] FELEKE Z, SAKAKIBARA Y. A bio-electrochemical reactor coupled with adsorber for the removal of nitrate and inhibitory pesticide. [J]. Water Research, 2002, 36(12): 3092-3102. doi: 10.1016/S0043-1354(01)00538-3 [11] 肖晶晶, 郭萍, 霍炜洁, 等. 反硝化微生物在污水脱氮中的研究及应用进展 [J]. 环境科学与技术, 2009, 32(12): 97-102. doi: 10.3969/j.issn.1003-6504.2009.12.022 XIAO J J, GUO P, HUO W J, et al. Application of denitrifying microbes to wastewater denitrification [J]. Environmental Science and Technology, 2009, 32(12): 97-102(in Chinese). doi: 10.3969/j.issn.1003-6504.2009.12.022
[12] WASSER I M, DE VRIES S, MOENNE-LOCCOZ P, et al. Nitric oxide in biological denitrification: Fe/Cu metalloenzyme and metal complex NOx redox chemistry [J]. American Chemical Society, 2002, 102(4): 1201-1234. [13] PATRICK W, HEINZ K, FRANK N, et al. NosX function connects to nitrous oxide (N2O) reduction by affecting the Cu Z center of NosZ and its activity in vivo [J]. FEBS Letters, 2005, 579(21): 4605-4609. doi: 10.1016/j.febslet.2005.07.023 [14] 王淑莹, 孙洪伟, 杨庆, 等. 传统生物脱氮反硝化过程的生化机理及动力学 [J]. 应用与环境生物学报, 2008, 14(5): 732-736. doi: 10.3321/j.issn:1006-687X.2008.05.029 WANG S Y, SUN H W, YANG Q, et al. Biochemical reaction mechanism and kinetics of denitrification [J]. Chinese Journal of Applied and Environmental Biology, 2008, 14(5): 732-736(in Chinese). doi: 10.3321/j.issn:1006-687X.2008.05.029
[15] PAN Y T, NI B J, YUAN Z G. Modeling electron competition among nitrogen oxides reduction and N2O accumulation in denitrification [J]. Environmental Science & Technology, 2013, 47(19): 11083-11091. [16] 康丽, 郭建博, 李洪奎, 等. 氧化还原介体催化强化偶氮染料脱色研究进展 [J]. 河北工业科技, 2010, 27(6): 447-450, 464. doi: 10.7535/hbgykj.2010yx06026 KANG L, GUO J B, LI H K, et al. Research advance of catalytic effect of redox mediator in azo dye decolorization process [J]. Hebei Journal of Industrial Science and Technology, 2010, 27(6): 447-450, 464(in Chinese). doi: 10.7535/hbgykj.2010yx06026
[17] 王倩. 介体催化高氯酸盐生物降解机理及动力学研究[D]. 石家庄: 河北科技大学, 2015. WANG Q. Study mechanism and kinetic of ClO4- bio-degradation with redox mediators[D]. Shijiazhuang: Heibei University of Science and Technology, 2015(in Chinese).
[18] AMEZQUITA-GARCIA H J, RAZO-FLORES E, CERVANTES F J, et al. Activated carbon fibers as redox mediators for the increased reduction of nitroaromatics [J]. Carbon, 2013, 55: 276-284. doi: 10.1016/j.carbon.2012.12.062 [19] MENG X, LIU G, ZHOU J, et al. Effects of redox mediators on azo dye decolorization by Shewanella algae under saline conditions [J]. Bioresource Technology, 2014, 151: 63-68. doi: 10.1016/j.biortech.2013.09.131 [20] XI Z H, GUO J B, LIAN J, et al. Study the catalyzing mechanism of dissolved redox mediators on bio-denitrification by metabolic inhibitors [J]. Bioresource Technology, 2013, 140: 22-27. doi: 10.1016/j.biortech.2013.04.065 [21] 张万辉. 微生物反硝化及其电化学强化研究进展 [J]. 安徽农业科学, 2014, 42(19): 6324-6326, 6355. doi: 10.3969/j.issn.0517-6611.2014.19.080 ZHANG W H. The mechanism of denitrification and the enhancement by electrode [J]. Journal of Anhui Agricultural Sciences, 2014, 42(19): 6324-6326, 6355(in Chinese). doi: 10.3969/j.issn.0517-6611.2014.19.080
[22] YANG J X, FENG L, PI S S, et al. A critical review of aerobic denitrification: Insights into the intracellular electron transfer [J]. Science of the Total Environment, 2020, 731: 139080. doi: 10.1016/j.scitotenv.2020.139080 [23] JIA R, YANG D Q, XU D K, et al. Electron transfer mediators accelerated the microbiologically influence corrosion against carbon steel by nitrate reducing Pseudomonas aeruginosa biofilm [J]. Bioelectrochemistry, 2017, 118: 38-46. doi: 10.1016/j.bioelechem.2017.06.013 [24] MARSILI E, BARON D B, SHIKHARE I D, et al. Shewanella secretes flavins that mediate extracellular electron transfer [J]. Proceedings of the National Academy of Sciences of the United States of America, 2008, 105(10): 3968-3973. doi: 10.1073/pnas.0710525105 [25] YIN S, QIAO S, ZHOU J T, et al. Effects of redox mediators on nitrogen removal performance by denitrifying biomass and the activity of Nar and Nir [J]. Chemical Engineering Journal, 2014, 257: 90-97. doi: 10.1016/j.cej.2014.07.029 [26] LIU H J, GUO J B, QU J H, et al. Biological catalyzed denitrification by a functional electropolymerization biocarrier modified by redox mediator [J]. Bioresource Technology, 2012, 107: 144-150. doi: 10.1016/j.biortech.2011.12.071 [27] LI H B, GUO J B, LIAN J, et al. Effective and characteristics of anthraquinone-2, 6-disulfonate (AQDS) on denitrification by Paracoccus versutus sp. GW1 [J]. Environmental Technology, 2013, 34(17): 2563-2570. doi: 10.1080/09593330.2013.781198 [28] HUANG L Y, HUANG Y, LOU Y T, et al. Pyocyanin-modifying genes phzM and phzS regulated the extracellular electron transfer in microbiologically-influenced corrosion of X80 carbon steel by Pseudomonas aeruginosa [J]. Corrosion Science, 2020, 164: 108355. doi: 10.1016/j.corsci.2019.108355 [29] WANG Y, KEM S E, NEWMAN D K. Endogenous phenazine antibiotics promote anaerobic survival of pseudomonas aeruginosa via extracellular electron transfer [J]. Journal of Bacteriology, 2010, 192(1): 365-369. doi: 10.1128/JB.01188-09 [30] LU C C, XIE Z, GUO J B, et al. Chlorophyll as natural redox mediators for the denitrification process [J]. International Biodeterioration & Biodegradation, 2020, 148: 104895. [31] XIE Z, GUO J B, LU C C, et al. Biocatalysis mechanisms and characterization of a novel denitrification process with porphyrin compounds based on the electron transfer chain [J]. Bioresource Technology, 2018, 265: 548-553. doi: 10.1016/j.biortech.2018.05.069 [32] 吴磊. 腐殖活性污泥A2/O系统脱氮除磷效果与反应动力学研究[D]. 哈尔滨: 哈尔滨工业大学, 2014. WU L. Study on the performance and kinetics of nitrogen and phosphorus removal in humic activated sludage A2/O system[D]. Harbin: Harbin Institute of Technology, 2014(in Chinese).
[33] CLICERIO A T, MARIA I E A, ANNA C T, et al. Effects of different quinoid redox mediators on the removal of sulphide and nitrate via denitrification [J]. Chemosphere, 2007, 69(11): 1722-1727. doi: 10.1016/j.chemosphere.2007.06.004 [34] SU J F, LI G Q, HUANG T L, et al. The mixotrophic denitrification characteristics of Zoogloea sp. L2 accelerated by the redox mediator of 2-hydroxy-1, 4-naphthoquinone [J]. Bioresource Technology, 2020, 311: 123533. doi: 10.1016/j.biortech.2020.123533 [35] 苑宏英, 孙锦绣, 王小佩, 等. 投加介体强化低温污水生物反硝化脱氮的研究 [J]. 环境科学与技术, 2016, 39(11): 90-94. YUAN H Y, SUN J X, WANG X P, et al. Study on performance of sewage biological denitrification at low temperature adding redox mediator [J]. Environmental Science & Technology, 2016, 39(11): 90-94(in Chinese).
[36] GUO J B, KANG L, YANG J L, et al. Study on a novel non-dissolved redox mediator catalyzing biological denitrification (RMBDN) technology [J]. Bioresource Technology, 2010, 101(11): 4238-4241. doi: 10.1016/j.biortech.2010.01.029 [37] 杜海峰, 赵丽君, 郭延凯, 等. 醋酸纤维素包埋非水溶性介体催化强化生物反硝化特性 [J]. 环境工程学报, 2014, 8(6): 2417-2422. DU H F, ZHAO L J, GUO Y K, et al. Accelerating characteristic of non-dissolved redox mediators immobilized by cellulose acetate(CA) on denitrification [J]. Acta Scientiae Circumstantiae, 2014, 8(6): 2417-2422(in Chinese).
[38] XU Q, GUO J B, NIU C M, et al. The denitrification characteristics of novel functional biocarriers immobilised by non-dissolved redox mediators [J]. Biochemical Engineering Journal, 2015, 95: 98-103. doi: 10.1016/j.bej.2014.12.004 [39] 郭延凯. 聚吡咯固定化介体制备及其调控生物反硝化特性研究[D]. 石家庄: 河北科技大学, 2012. GUO Y K. Study on the denitrification regulation characteristic by a functional electropolymerization biocarrier modified by redox mediators[D]. Shijiazhuang: Hebei University of Science and Technology, 2012(in Chinese).
[40] WU Z S, XU F, YANG C, et al. Highly efficient nitrate removal in a heterotrophic denitrification system amended with redox-active biochar: a molecular and electrochemical mechanism [J]. Bioresource Technology, 2019, 288: 297-306. [41] CENH G H, ZHANG Z R, ZHANG Z Y, et al. Redox-active reactions in denitrification provided by biochars pyrolyzed at different temperatures [J]. Science of the Total Environment, 2018, 615: 1547-1556. doi: 10.1016/j.scitotenv.2017.09.125 [42] LI J Z, PENG Z Z, HU R Y, et al. Micro-graphite particles accelerate denitrification in biological treatment systems [J]. Bioresource Technology, 2020, 308: 122935. doi: 10.1016/j.biortech.2020.122935 [43] 李丽, 檀文炳, 王国安, 等. 腐殖质电子传递机制及其环境效应研究进展 [J]. 环境化学, 2016, 35(2): 254-266. doi: 10.7524/j.issn.0254-6108.2016.02.2015071002 LI L, TAN W B, WANG G A, et al. Electron transfer mechanisms of humic substances and their environmental implications: A review [J]. Environmental Chemistry, 2016, 35(2): 254-266(in Chinese). doi: 10.7524/j.issn.0254-6108.2016.02.2015071002
[44] MARTINEZ C M, ALVAREZ L H, CELIS L B, et al. Humus-reducing microorganisms and their valuable contribution in environmental processes [J]. Applied Microbiology and Biotechnology, 2013, 97(24): 10293-10308. doi: 10.1007/s00253-013-5350-7 [45] FUITON J R, MCKNIGHT D M, FOREMAN C M, et al. Changes in fulvic acid redox state through the oxycline of a permanently ice-covered Antarctic lake [J]. Springer Nature Journal, 2004, 66(1): 27-46. [46] VAN DER ZEE F P, CERVANTES F J. Impact and application of electron shuttles on the redox (bio) transformation of contaminants: A review [J]. Biotechnology Advances, 2009, 27(3): 256-277. doi: 10.1016/j.biotechadv.2009.01.004 [47] 赵丽君, 马志远, 郭延凯, 等. 氧化还原介体调控亚硝酸盐反硝化特性研究 [J]. 环境科学, 2013, 34(9): 3520-3525. ZHAO L J, MA Z Y, GUO Y K, et al. Nitrite denitrification characteristics with redox mediator [J]. Environmental Science, 2013, 34(9): 3520-3525(in Chinese).
[48] SAQUING J M, YU Y H, CHIU P C. Wood-derived black Carbon (biochar) as a microbial electron donor and acceptor [J]. Environmental science & Technology Letters, 2016, 3(2): 62-66. [49] 黄硕, 于德爽, 陈光辉, 等. 氧化石墨烯强化厌氧氨氧化菌的脱氮性能 [J]. 中国环境科学, 2019, 39(5): 1945-1953. doi: 10.3969/j.issn.1000-6923.2019.05.018 HUANG S, YU D S, CHEN G H, et al. Improvement of the activity of anammox bacteria using graphene oxide [J]. China Environmental Science, 2019, 39(5): 1945-1953(in Chinese). doi: 10.3969/j.issn.1000-6923.2019.05.018
[50] TANG M Z, JIANG J, LV Q L, et al. Denitrification performance of Pseudomonas fluorescens Z03 immobilized by graphene oxide-modified polyvinyl-alcohol and sodium alginate gel beads at low temperature [J]. Royal Society Open Science, 2020, 7(3): 191542. doi: 10.1098/rsos.191542 [51] 王丹. 紫外可见光照下细胞色素C氧化还原反应研究[D]. 长春: 吉林大学, 2016. WANG D. Research on oxidation-reduction of cytochrome c irradiated by the UV-Vis light[D]. Changchun: Jilin University, 2016(in Chinese).
[52] 马金莲, 马晨, 汤佳, 等. 电子穿梭体介导的微生物胞外电子传递: 机制及应用 [J]. 化学进展, 2015, 27(12): 1833-1840. doi: 10.7536/PC150533 MA J L, MA C, TANG J, et al. Mechanisms and applications of electron shuttle-mediated extracellular electron transfer [J]. Progress in Chemistry, 2015, 27(12): 1833-1840(in Chinese). doi: 10.7536/PC150533
-











 下载:
下载: