-
塑料给人们带来很多方便的同时,也给人们带来了困扰。由于产量大,耐受性强,回收率低等原因,塑料在环境中不断积累,在赤道、极地、峰顶和海底都能找到不同种类的塑料残体。在这些塑料残体中,尺寸小于5 mm的塑料被定义为微塑料,由于其特有的理化性质和毒性效应而受到广泛关注[1-3]。目前,微塑料包括初级微塑料和次级微塑料。顾名思义,初级微塑料就是尺寸小于5 mm塑料颗粒的直接应用和排放,例如洗面奶中去角质的颗粒物主要成分就是微塑料[4];次级微塑料来源于大尺寸塑料残体的光解、热解、水解以及生物降解等[5-8]。
微塑料一旦被摄取,会引起摄食活性,存活率和繁殖率的降低等毒性效应,并常伴有炎症反应[9-11]。此外,微塑料还可以随循环系统在生物体内迁移,进入不同的组织和器官,从而在生物体内富集[2]。常常除了自身的毒性,微塑料可以通过吸附作用作为有机和无机污染物传输载体,如多氯联苯、多环芳烃、多溴联苯醚和有机氯农药等[12-16]。Bakir等模拟了肠道系统内污染物的吸附/解吸行为,发现在模拟肠道内污染物从微塑料上的解吸速率是海水中的30倍[17]。一旦被摄取,就像“特洛伊木马”一样将所携带污染物快速解吸,从而提高污染物的毒性和生物可利用性,进一步增加了微塑料的潜在风险。除了不断吸附外源污染物之外,塑料本身会根据特定的用途引入不同的化学添加剂,这些添加剂会随着塑料的老化渗滤到环境中,引起雌激素效应和内分泌干扰效应[16]。
光化学降解是塑料在环境中老化和降解的主要途径。暴露于空气中,经太阳光或紫外光照射,微塑料可以生成含氧基团,如羰基和羟基。未经老化的微塑料往往对疏水性有机物具有很好的吸附性能,随着老化程度的加深,含氧官能团的增加,对亲水性有机污染物的吸附显著增加。Liu等研究了老化前后聚氯乙烯微塑料对抗生素环丙沙星的吸附,发现老化后PVC微塑料结构中的含氧官能团可以与环丙沙星分子之间形成氢键作用,使得环丙沙星的吸附量显著提高[18]。因此,光解老化可以显著改变微塑料的环境行为,从而产生新的环境效应。然而,目前有关微塑料环境转化的研究还很有限。因此,有关不同性质微塑料光解老化过程亟待研究。
本研究以常用塑料制品为研究对象,经机械破碎得到相应的微塑料,于空气中进行太阳光照暴露,研究它们的红外光谱变化情况,并与标准谱图对比,确定塑料种类,以及自然光解老化对塑料结构的影响,从而为分析其潜在的环境行为提供理论指导。
全文HTML
-
收集生活与实验室中常见的塑料制品(如图1),包括塑料袋、饮料瓶、外卖盒、离心管、枪头和注射器(注射器筒与注射器推杆)。将各种塑料制品经液氮冷冻处理后用研磨粉碎机(A11 basic Analytical mil,IKA,Germany)机械破碎,得到相应的粉末状微塑料样品,装瓶待用。
-
将制备好的微塑料进行太阳光光照暴露,暴露地点为江苏省南京市栖霞区南京大学仙林校区环境学院(北纬N32°07′10.16″,东经E118°56′52.71″),样品倾斜角度为30°,以便于更充分接触光照。暴露时间为2019年1月1日—2019年12月31日,共计365 d,天气信息见网址http://www.tianqihoubao.com/lishi/nanjing/month/201901.html。分别使用光强仪(CEL-NP2000-10, Ceaulight Inc., Beijing, China)和温度计测定了9:00、12:00和15:00光照强度和温度。光照强度(365 nm)为0.1—2.8 mW·cm−2(平均(1.2±0.6) mW cm−2),温度为−3—38 ℃(平均(22±9) ℃)。
-
本研究采用衰减全反射-傅里叶变换红外光谱(ATR-FTIR)(Tensor 27,Bruker,Germany)分析光照前后微塑料的种类以及红外光谱变化情况,分辨率为4 cm−1,扫描次数为32,采集范围600—4000 cm−1。为分析微塑料在光照前后表面形貌变化,场发射扫描电子显微镜(SEM,FEG Quanta 250,FEI Co.,Netherland)被用来采集微塑料的SEM图片,操作电压为10 kV。Brunauer-Emmett-Teller(BET)分析仪(Micrometrics ASAP2020)和测角仪(Rame-Hart 250, Succasumna, NJ, USA)分别用于测定微塑料老化前后的BET比表面积和接触角。
1.1. 微塑料制备
1.2. 光照暴露实验
1.3. 微塑料表征
-
测量7种常见塑料样品的红外光谱图,并与红外光谱仪自带数据库中的标准红外谱结果以及文献进行匹配和比较,分析其主要成分。红外结果表明,塑料袋和注射器推杆属于PE塑料,外卖盒、离心管、枪头和注射器筒属于PP塑料,饮料瓶属于PET塑料。
-
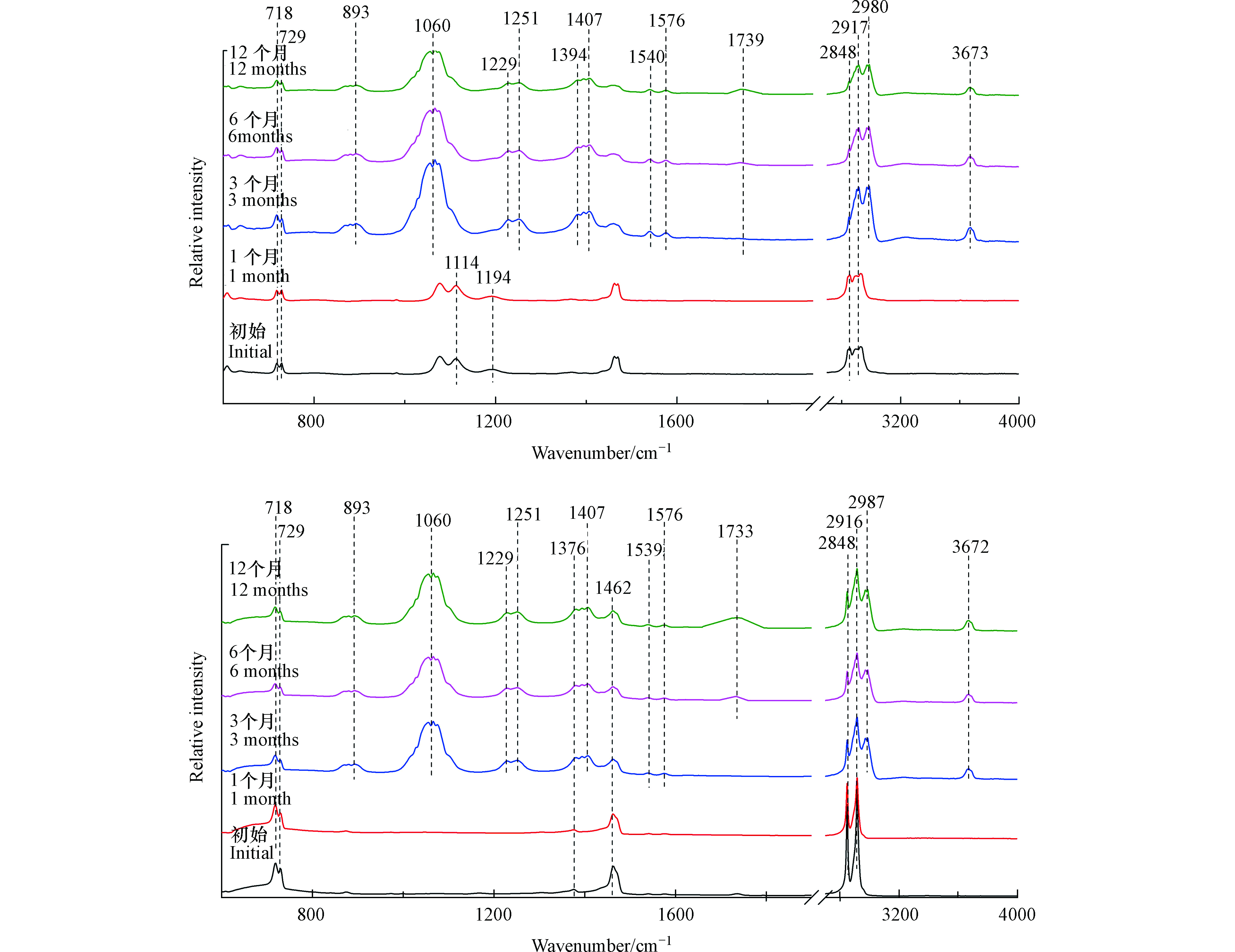
如图2(a)所示,塑料袋样品在光照1个月后,其红外光谱图没有发生显著变化。
然而,在光照3个月后,出现了新的红外吸收峰。3673 cm−1处的红外吸收峰表示O—H伸缩振动,2987 cm−1与2972 cm−1处的红外吸收峰表示甲基C—H伸缩振动,1576 cm−1与1540 cm−1处的红外吸收峰对应芳烃的C=C伸缩振动,1407 cm−1处的红外吸收峰表示O—H弯曲振动,893、1056、1066、1229、1251 cm−1处的红外吸收峰表示C—O伸缩振动[19]。所以塑料袋在光照3个月后可能生成了羟基与苯环。此外,光照3个月后,1194 cm−1与1114 cm−1处的红外吸收峰逐渐减弱,这两个峰代表醚键C—O—C的伸缩振动[20],这说明在光照导致塑料袋微塑料表面醚键的断裂。如图2(b)所示,注射器推杆微塑料三阶段变化与塑料袋微塑料相似。由于添加剂成分的不同,未检测到醚键C—O—C红外特征吸收峰。
-
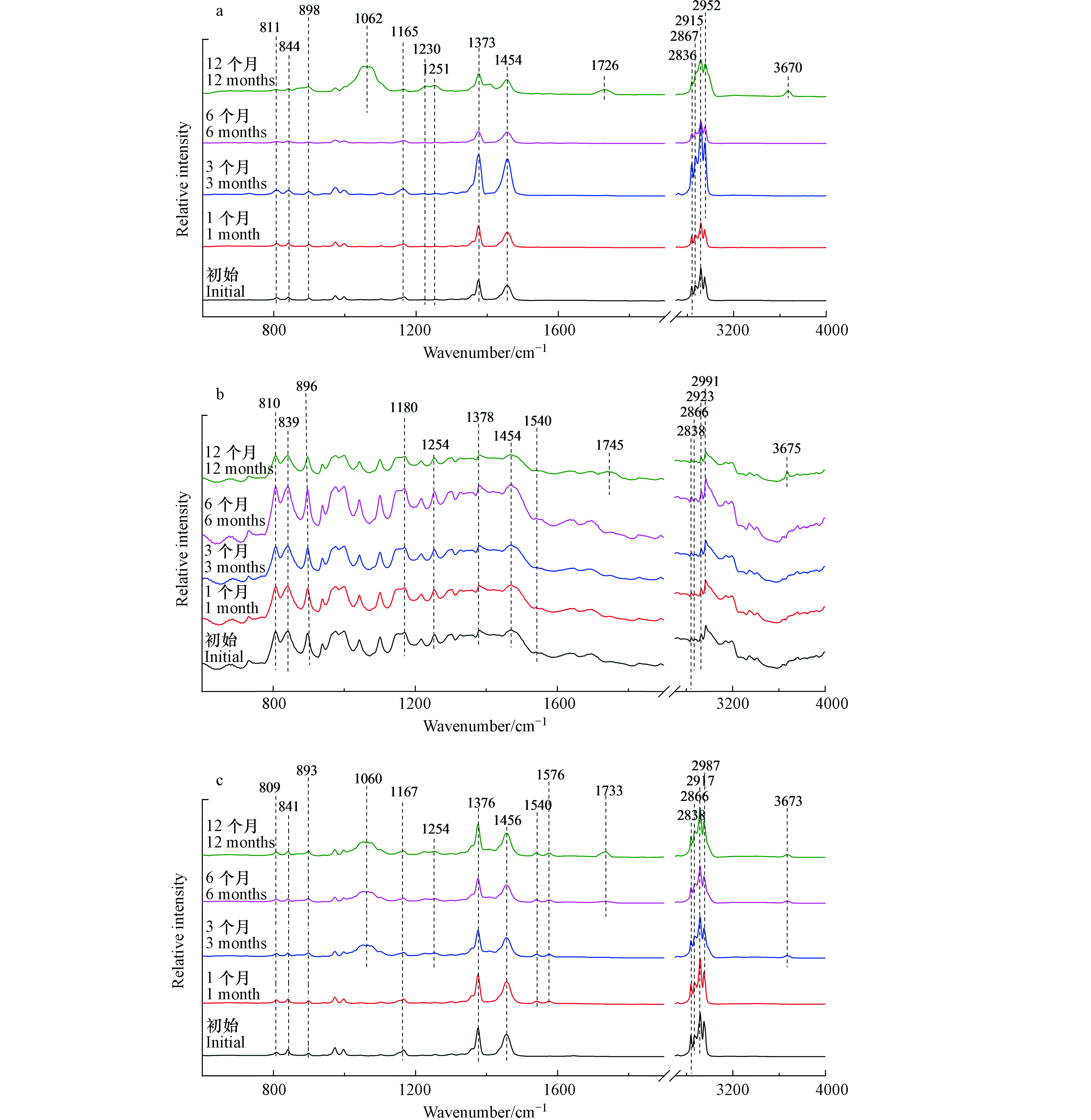
外卖盒红外光谱如图3(a)所示,暴露前6个月,外卖盒的红外光谱没有发现显著变化。然而,在光照12个月后,出现一些新的红外吸收峰。1062 cm−1和1251 cm−1处的红外吸收峰表示C—O伸缩振动[19]。1726 cm−1和3670 cm−1处的红外吸收峰分别表示光老化过程中产生的碳基(—C=O)和羟基(O—H)的伸缩振动[21]。对于注射器筒来说,光照12个月后,其红外光谱出现的—C=O(1745 cm−1)和O—H(3675 cm−1)红外特征峰是其光老化过程中的主要变化(图3(b))。
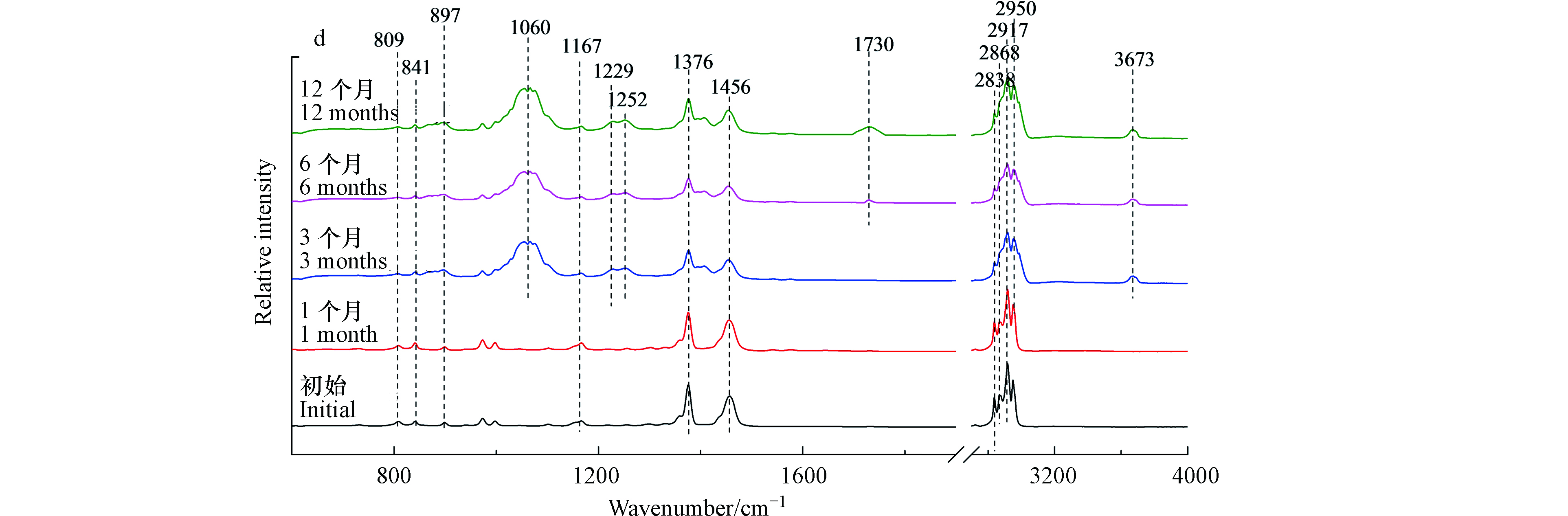
图3(c)与图3(d)分别为枪头与离心管的红外光谱。光照3个月后,红外光谱发生显著变化。在1060、1254、1540/1576 cm−1出现新的吸收峰,分别对应C—O伸缩振动和芳烃的C=C伸缩振动[19]。当光照6个月以后,在1733 cm−1和3673 cm−1出现新的吸收峰,分别对应—C=O伸缩振动和O—H的伸缩振动[21]。离心管微塑料也有类似的结果,光照3个月后出现C—O和芳烃的C=C结构,6个月后出现羰基和羟基官能团。
-
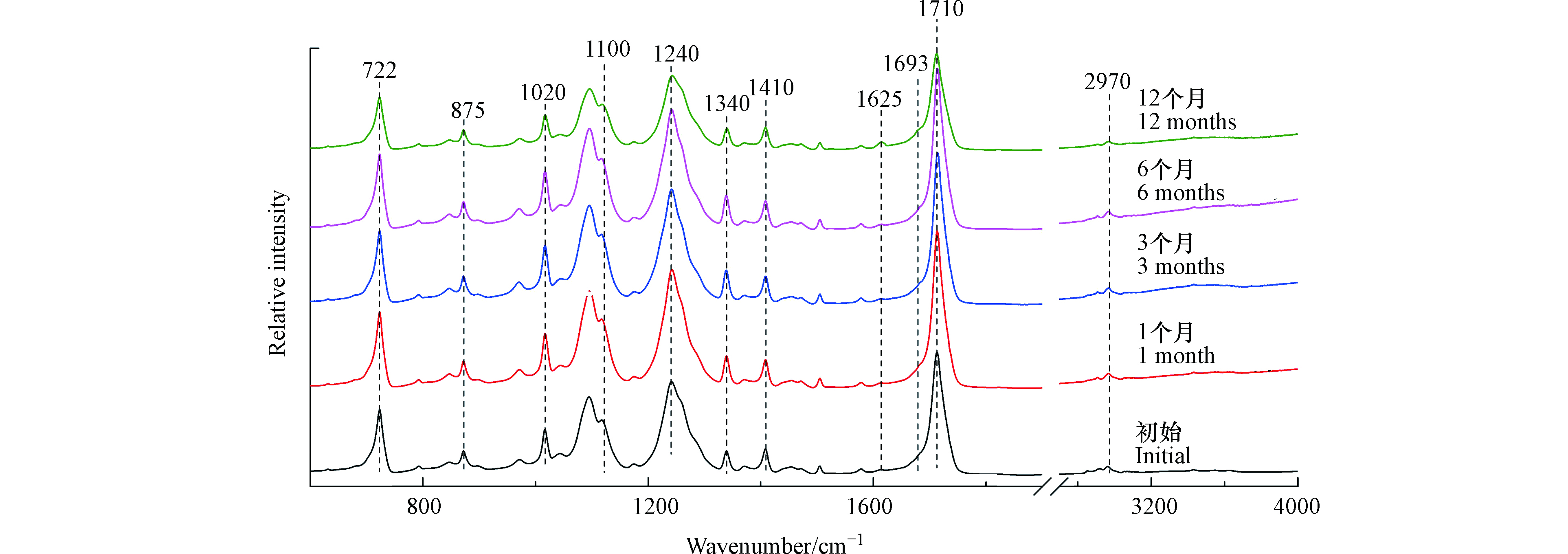
如图4所示,1100、1240、1710、2970 cm−1分别代表PET结构中亚甲基伸缩振动、酯基伸缩振动、羰基伸缩振动和C—H伸缩振动[22]。饮料瓶在光照12个月后,其红外光谱图没有出现新的红外吸收峰,但是在1625 cm−1和1693 cm−1处的红外吸收峰显著增强,这两个红外吸收峰分别代表脂肪链上C=C的伸缩振动和羧基的伸缩振动[22]。因此,PET微塑料在光照12个月后,会产生C=C双键和羧基。
-
测定了SEM照片来表征微塑料自然光解老化前后的表面形貌,如图5所示。塑料袋和注射器推杆微塑料在自然光照处理后,表面出现明显的龟裂。然后对于其他类型的微塑料,在光照12个月之后,微塑料的表面形貌没有发生显著变化。因此,PE材质的微塑料更容易发生光解老化,进而发生破碎分解现象,这与红外光谱的结果一致。此外,分别测定了微塑料老化前后的BET比表面积和接触角。如图6所示,自然光解后,微塑料的水滴接触角显著降低,表明微塑料在光照老化之后亲水性增强。自然光解老化后,微塑料BET比表面积增加,尤其塑料袋和注射器推杆微塑料(表1),这是由于光照后微塑料表面龟裂,微孔增加,这与微塑料的SEM结果一致。
2.1. 塑料样品种类分析
2.2. 微塑料红外光谱分析
2.2.1. PE类常见塑料
2.2.2. PP类常见塑料
2.2.3. PET类常见塑料
2.3. 微塑料老化前后表面形貌和性质分析
-
通过测定7种生活与实验室常见塑料产品不同光照时间的红外光谱和表面形貌性质,得到以下结论:(1)PE类微塑料在光照暴露3个月后,有对应羟基、甲基与苯环C=C伸缩振动的红外吸收峰出现,同时对应醚键的红外吸收峰消失。所以PE类微塑料在自然光照条件下不稳定,结构极易产生变化;(2)PP类微塑料外卖盒和注射器筒的稳定性要强于枪头和离心管;(3)PET类微塑料在光照6个月没有显著变化,在光照12个月后会产生C=C双键和羧基;(4)除PET以外,微塑料在自然光照12个月以后,都会产生羰基和羟基等亲水性官能团,接触角减小,亲水性增强;(5)微塑料光解老化后,表面出现龟裂,并伴随比表面积的增加。微塑料的自然老化将会对其理化性质和环境行为产生影响。



 DownLoad:
DownLoad: