-
根据活性微生物在污水中的生长条件和生长状态,生物处理技术分为悬浮生长工艺(活性污泥法)和附着生长工艺(生物膜法)[1]。在附着生长处理系统中,微生物(细菌、真菌、藻类、微型动物等)会借助水力动力和自凝聚作用黏附于载体(填料)上,形成微生物及其代谢产物所组成的膜状活性体系生物膜[2]。
生物膜特性直接决定水处理效果,研究者们采用各种参数来表征生物膜特性。常采用生物量(MLSS)、活性生物量(MLVSS)表征活性微生物数量。采用扫描电子显微镜(SEM)或共焦激光扫描显微镜(CLSM)揭示生物膜结构与形貌[3-4],可以看出,生物膜具有复杂的三维结构,由细胞团簇、孔道和胞外聚合物(EPS)组成。EPS是分布于细胞表面的高分子化合物,由微生物细胞代谢、自溶、脱落及进水基质组成,对维持生物膜结构完整性和代谢产物传质通道的畅通性起着至关重要的作用。根据EPS在生物膜中位置,可分为溶解性EPS(外层,S-EPS)、松散结合型EPS(中层,LB-EPS)和紧密结合型EPS(内层,TB-EPS)[5-6]。一些生化特性指标,如脱氢酶活性(DHA),也常用来表示生物膜微生物活性[7]。
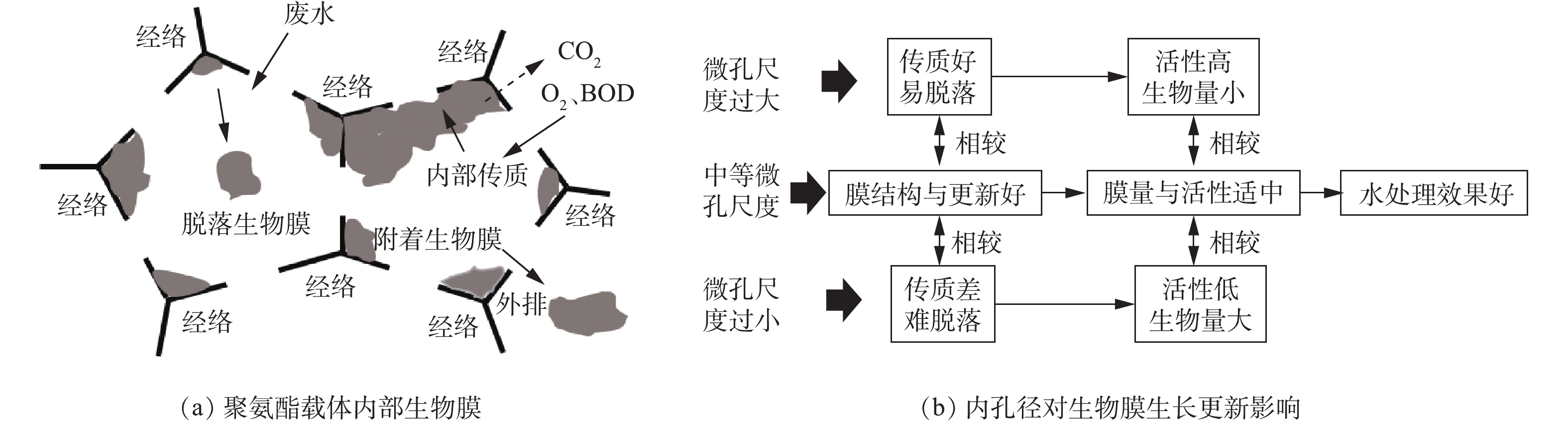
微生物在载体表面快速、稳定地附着是生物膜法成功的基础。影响微生物附着的因素可归纳为微生物特性、载体特性、环境特性3个方面[8],其中生物载体是最基本的、也一直是生物膜领域的研究热点。有研究表明,载体类型[9]、比表面积[10]对附着在载体上的生物膜特性有显著影响。沸石拥有非常高的比表面积(2 000 m2·g−1),但其表面多数微孔环境(1~1.5 nm)难以被微生物利用,生物膜难以更新;高分子有机材料因其优越的物理结构、低廉的成本而广泛应用于污水处理,但表面化学特性(电荷性、生物亲和性等)较差,导致生物膜在形成速度、数量、紧密度等方面存在问题。载体尺寸与孔径大小同样对生物膜的数量、结构和活性有着较大的影响[11]。NGUYEN等[12]以不同尺寸海绵作为载体,在厌氧和好氧下进行挂膜实验,结果表明,中等尺寸(2 cm×2 cm×2 cm)拥有最佳的生物膜量和废水处理效果。AHMAD等[13]同样发现中等尺寸(15 mm)聚氨酯泡沫有利于维持好氧区与厌氧区之间的平衡。
在已有的报道中,对于载体表面物理结构和载体外尺寸研究较多,但对载体内部孔径及其生物膜特性研究很少。微孔孔径小的载体比表面积大,生物膜可附着面积多,但微孔中老化的生物膜难自行从孔隙中排出,会因堵塞而使内比表面积锐减,不能正常发挥应有净化作用[14]。适当扩大载体内部孔径有利于提高生物量与废水处理效率[15],但会增大水力剪切作用造成生物膜脱落,且不利于载体内部厌氧氨氧化反应[16]。因此,载体内部孔径过大、过小均不利生物膜生长与脱落,不利污水处理。载体内理想的微孔孔径不仅可以为生物膜附着和生长提供足够的空间,而且可促进微生物细胞与基质之间物质扩散和氧传递。本研究从生物膜生物量、EPS组分、DHA和生物膜结构等方面,考察了载体微孔孔径对生物膜特性的影响,分析了不同孔径载体废水处理效果,探索了载体内部微孔孔径与生物膜特性的相关性,以期为从内部微孔孔径角度合理选择与研发新型载体提供参考。
-
实验载体为购自市场(昆山茂祯电子有限公司)的5种孔径(0.6、1、2、3、4 mm)聚氨酯过滤海绵,加工成约10 mm×10 mm×10 mm的立方体小块(R1、R2、R3、R4、R5)。用0.85%乙醇溶液浸泡1 d,取出用蒸馏水清洗,自然晾干后待用。不同载体性能参数如表1所示。平均孔径反映载体内部微孔孔径特征;孔隙率为材料内部孔隙体积占其总体积的百分率,采用浸泡介质法[15]测定;表观密度为单位体积载体的干质量,采用容重法测定,孔隙率和表观密度反映载体孔径数量和利用率;空隙率为单位体积载体所具有的空隙体积比,采用体积法[17]进行测定;亲水性表征载体的亲水性能,以持水倍率[15]表示。
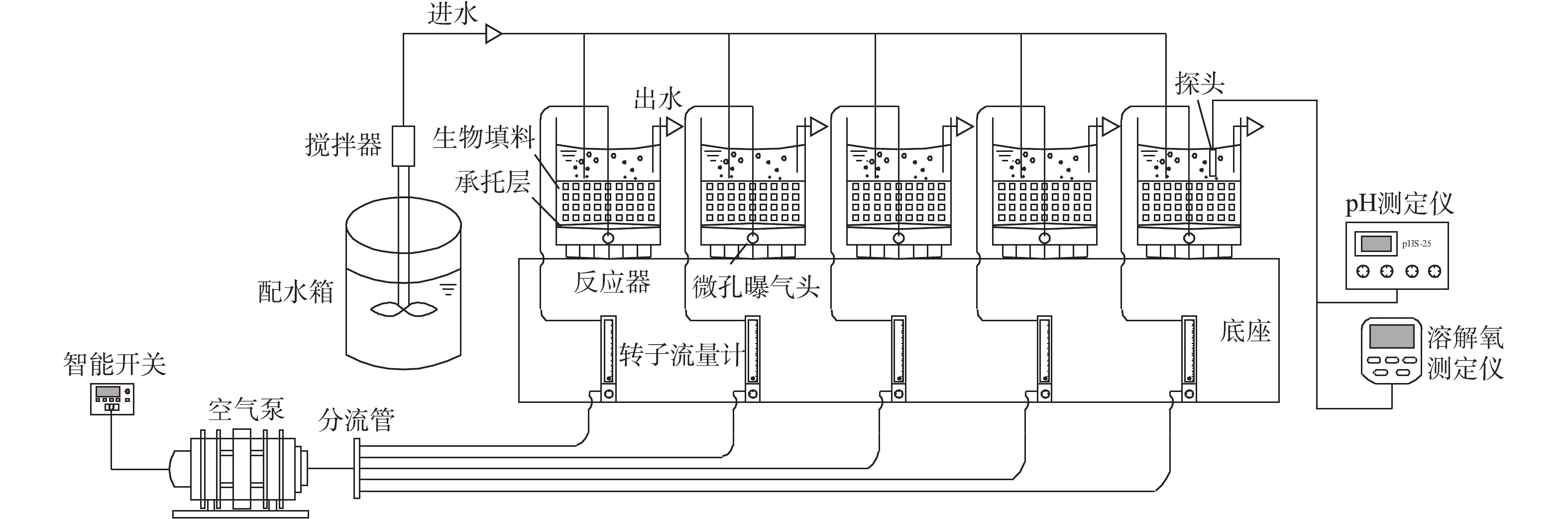
实验装置如图1所示,主体由5根材质、尺寸相同柱状有机塑料柱并联构成。反应柱直径为10.20 cm,高度为23.10 cm,有效容积为1.5 L,各反应器中载体的体积填充率均为40%。反应器在室温(20±5) ℃下运行,由空气压缩机供氧,转子流量计控制供气量,维持反应器中DO浓度为2.58~5.24 mg·L−1,使用智能定时器控制曝气时间。
-
在自来水中分别添加葡萄糖、氯化铵、磷酸二氢钾,并补充微量元素浓缩液作为微量元素来源[12],配制成人工模拟废水,采用磷酸缓冲溶液维持进水pH为7.5~8.0。模拟废水基本组成如下:(551.19±32.87) mg·L−1 COD、(31.16±4.41) mg·L−1
NH+4 -N、(5.56±0.73) mg·L−1 TP、0.61 mg·L−1 NaCl、0.19 mg·L−1 Ca(OH)2、5.07 mg·L−1 MgSO4·7H2O、0.28 mg·L−1 MnCl2·4H2O、0.44 mg·L−1 ZnSO4·7H2O、0.39 mg·L−1 CuSO4·5H2O、0.42 mg·L−1 CoCl2·6H2O、1.45 mg·L−1 FeCl3、30.00 mg·L−1酵母浸膏。采用接种挂膜法进行挂膜启动,污泥取自马鞍山市某污水厂曝气池,清洗后闷曝48 h,再将污泥(4 000 mg·L−1)投入各反应器中。
-
在整个实验期间,采用序批式生物膜法(SBBR)运行,每天运行2个周期,每个周期包括曝气(10 h)、沉淀(1.5 h)、排水与进水(0.5 h)。在挂膜期间,为保持接种污泥量,每周期换水率为50%。15 d后,载体内表面均出现分散的污泥颗粒,反应器换水率调整到100%。
-
使用指标MLSS、MLVSS表征生物膜量,EPS表征生物膜化学组成,f、DHA表征生物膜活性;使用SEM观察生物膜微观结构与形貌特征。
根据报道的方法[18],在载体挂膜后,将待测样品剪切成2 mm×2 mm×1 mm的小块,浸没于2.5%的戊二醛溶液中,放置于4 ℃冰箱,固定1.5 h;取出后,再采用0.85%的生理盐水轻微漂洗固定样品3次,每次10 min;接着依次利用30%、50%、70%、90%、100%的乙醇溶液对样品进行梯度脱水,脱水时间为15 min,脱水后冷冻干燥;最后,用离子溅射镀膜仪进行喷金处理。处理完成后,采用扫描电镜(SEM,JSM-6490LV,日本)观察拍摄。
生物膜MLVSS、MLSS采用重量法[19]测定,将MLVSS与MLSS的比值记作f。EPS采用加热法进行分层提取[20],其中PN和PS分别采用改进的Lowry法[21]和苯酚-硫酸法[22],将两者之和作为EPS总量。对载体成熟生物膜EPS进行分层分质分析,外层S、中层LB、内层TB中的EPS量分别以S-EPS、LB-EPS、TB-EPS表示;各层蛋白质和多糖分别以S-PN、LB-PN、TB-PN和S-PS、LB-PS、TB-PS表示;总蛋白质、多糖、EPS分别以Tol-PN、Tol-PS、Tol-EPS表示。
DHA采用改进的TTC法[7]测定。在测定样品加入所有试剂后,不直接进行水浴,而是先放入4 ℃冰箱低温冷藏24 h,再进行水浴与萃取,可使TTC扩散到整个生物膜层厚度,提高TPF萃取量。
-
COD、
NH+4 -N、TP等均采用国家标准方法[19]进行测定;DO、温度采用便携式溶解氧测定仪(雷磁JPBJ-608)测定;pH采用数显pH计(雷磁pHS-25)测定。 -
采用Excel对测量数据统计,平行样取均值;采用Origin与CAD完成相关图表制作;采用SPSS19软件进行载体内微孔孔径与生物膜特性、水处理效果相关性分析。
-
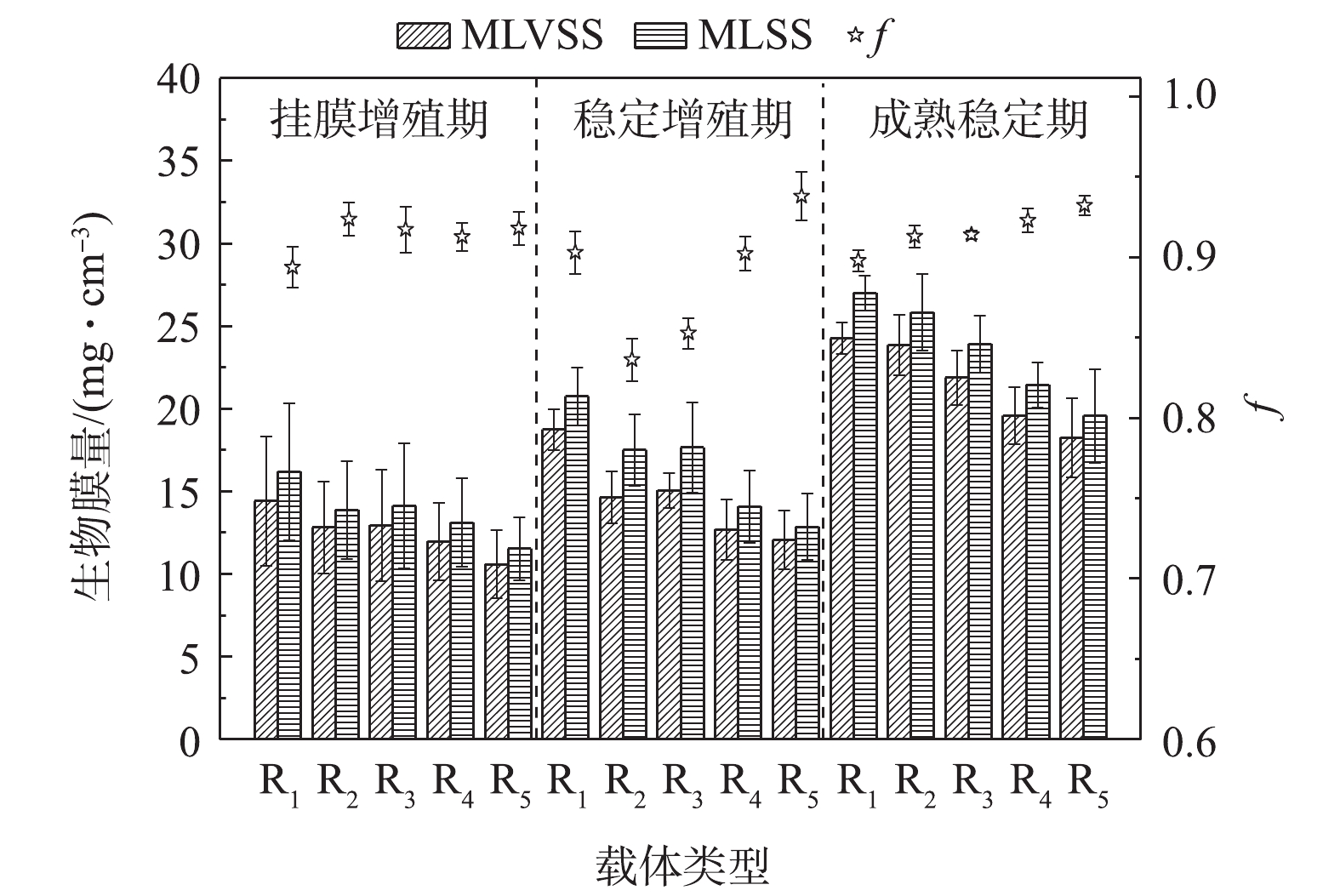
微生物在载体表面形成生物膜是一个不断更新的动态过程,大量游离细菌逐渐固定在载体上,并不断地固着繁殖、累积、老化、脱落,使生物膜不断地维持与环境相符的数量和活性[23]。本研究中的反应器共运行75 d,除去15 d接种期外,根据生物膜量与活性的变化规律,分为3个时期[24]:挂膜增殖期(0~15 d)、稳定增殖期(15~45 d)和成熟稳定期(45~60 d)。不同反应器内载体生物膜量的变化情况如图2所示。
挂膜增殖期,丰富的营养物质使各微孔载体微生物迅速增殖,载体上生物膜量逐渐累积且变幅较大,微孔孔径对生物膜量与f的影响并不显著,小孔径载体(R1~R3)生物膜的MLVSS、MVSS略优于大孔径载体(R4、R5)。而在生物膜成熟稳定后,小孔径载体的生物膜量显著大于大孔径载体,其结果为R1((27.02±1.06) mg·cm−3)>R2((25.85±2.30) mg·cm−3)>R3((23.94±1.72) mg·cm−3)>R4((21.47±1.37) mg·cm−3)>R5((19.60±2.83) mg·cm−3)。这是因为小孔径的聚氨酯海绵拥有更高的内部比表面积,其为微生物提供更多的可附着、生长空间。尽管小孔不利于载体孔径深度方向的传质(载体中心区域几乎见不到生物膜),但内部也不易受到水力剪切作用的干扰,且小孔径载体外层区域依然可附着较为可观的生物量。大孔径载体的高空隙率会产生更为剧烈的水力剪切作用和其他物理化学作用,从而加速生物膜解吸脱落速率,在一定程度上限制了生物膜量的增长[25]。
R1~R5对应的f分别为0.898±0.006、0.913±0.007、0.914±0.003、0.923±0.008、0.932±0.006,其随载体内微孔孔径的增大而增大。这是因为小孔容易截留、累积污水中的无机物杂质,且不易于大孔径载体生物膜的脱落与更新,因此,f会低于大孔径载体。
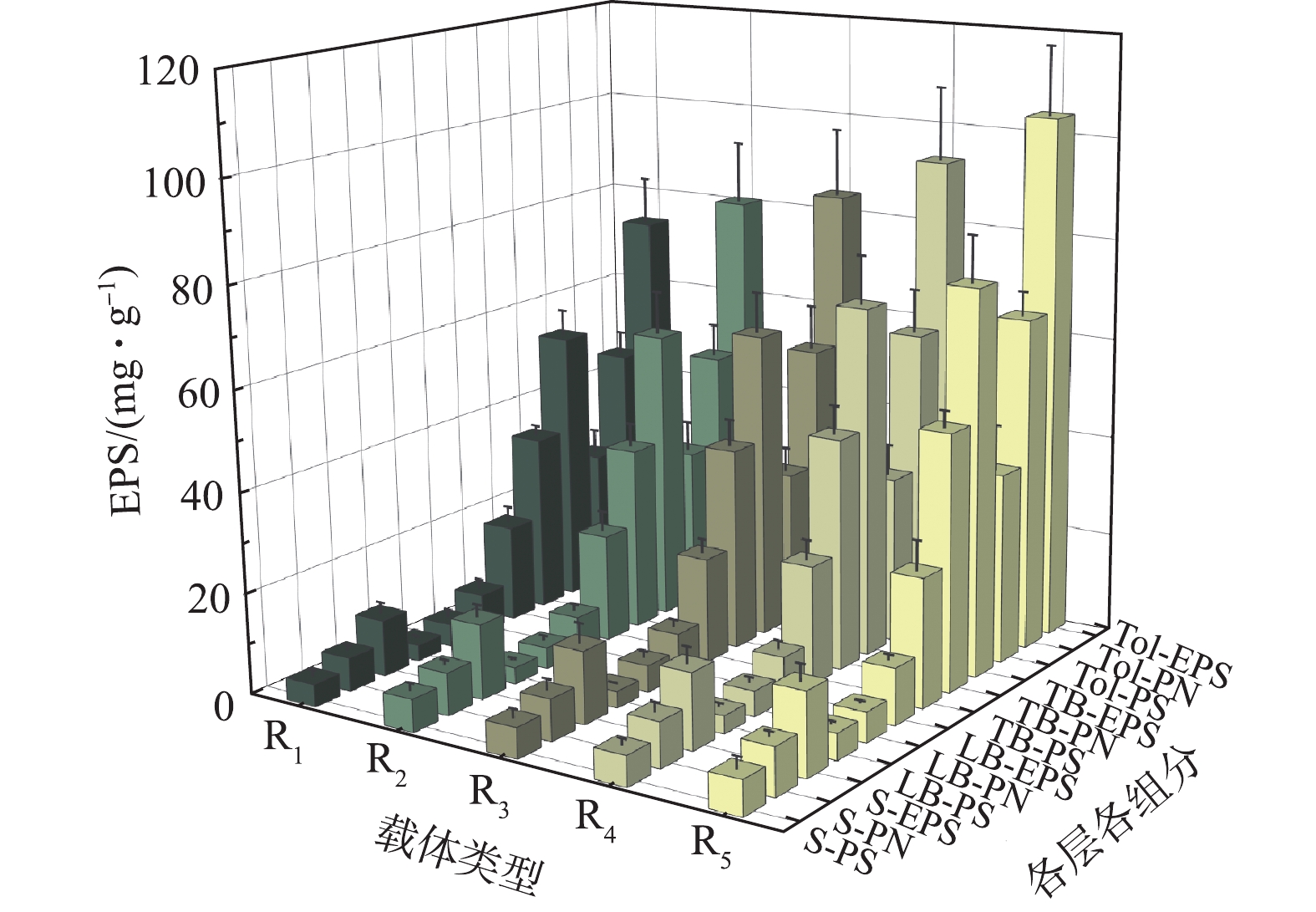
不同微孔孔径对生物膜EPS的影响如图3所示。从EPS分层看,TB层>S层>LB层,TB层EPS占总量的72.13%~74.68%,与细胞紧密结合的TB-EPS是EPS的主要组成部分,受内层分泌TB-EPS的挤压,分布于生物膜外层S-EPS、中层LB-EPS结构疏松、流动性较强,含量较低[26];从组分看,各层蛋白质含量高于多糖,PN/PS为1.30~1.99,这说明蛋白质为EPS主要组分[21,26]。生物膜EPS在各层各组分的分布具有相似的规律,说明载体微孔孔径大小对EPS各组分在各污泥层的分布规律影响较小。
从微孔孔径上看,EPS各组分含量随孔径的增大而递增,R1~R5的Tol-EPS分别为(73.19±9.17)、(80.48±12.19)、(84.11±13.29)、(93.28±14.52)、(104.07±13.56) mg·g−1,主要体现在TB-EPS的增长。微生物生长条件的差异会影响其生长速率进而影响EPS的产量[27],大孔有利于废水流通于载体内表面,从而提高了废水与载体内微孔的接触频率,使营养物质、DO的传输速率更高,促进了微生物的生长代谢速度,故可分泌更多的EPS。此外,大孔径内更为剧烈的水力条件会也促进具有保护细胞免受外界影响、维持生物膜稳定作用的EPS分泌[28]。
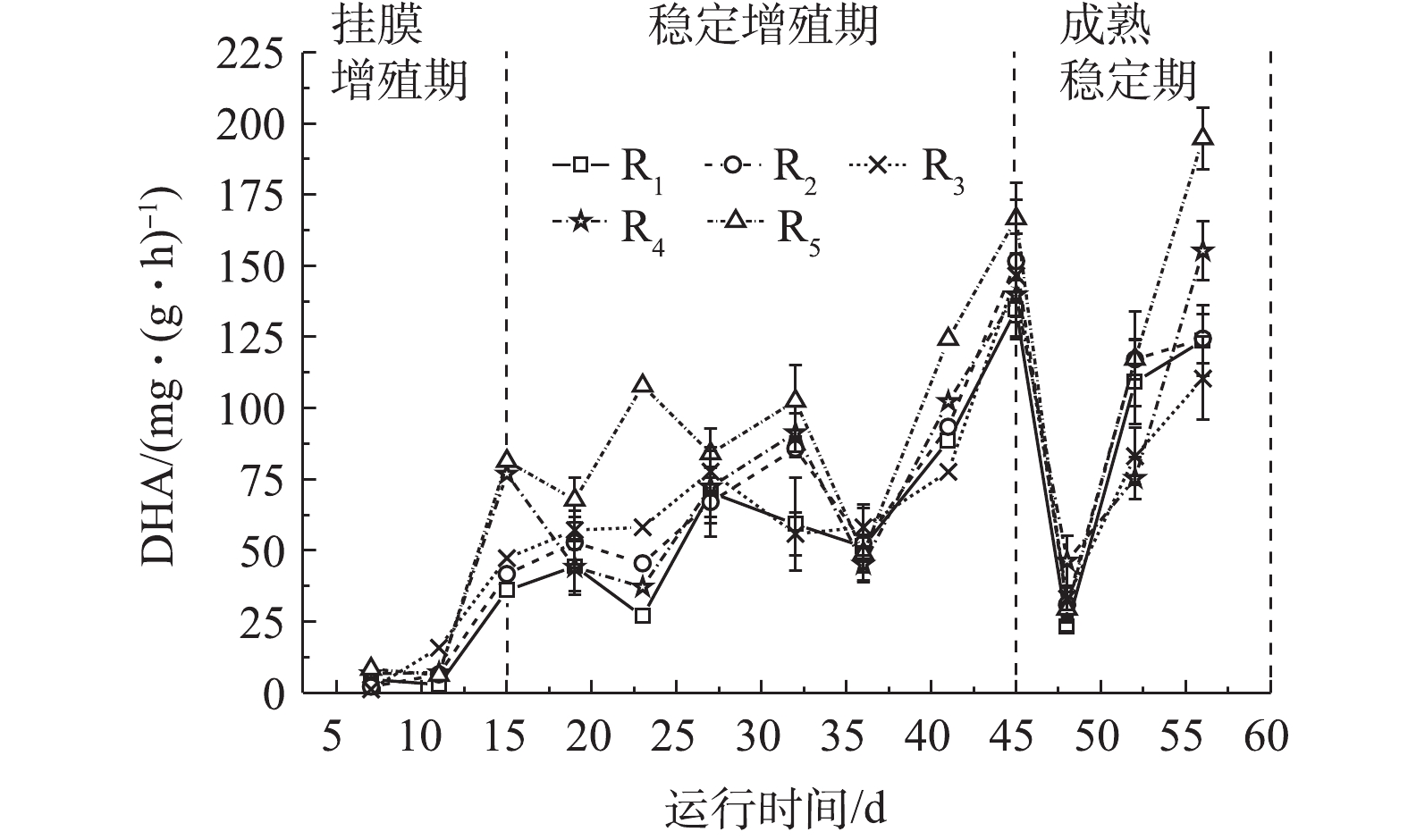
脱氢酶是微生物细胞所产生参与污染物氧化分解的氧化还原酶,能一定程度上反映微生物对有机物的降解能力[29]。在实验中,不同微孔孔径载体生物膜脱氢酶活性如图4所示。由图4可知,各微孔载体生物膜DHA变化与生物量变化吻合。在挂膜增殖期,游离微生物逐渐固定于载体上,不断吸收营养物质而大量增殖,代谢活动剧烈,DHA从1.28~8.42 mg·(g·h)−1迅速上升至36.02~76.86 mg·(g·h)−1;在稳定增殖期,DHA在26.88~124.31 mg·(g·h)−1波动,这是因为微生物由物化依附载体向生化黏附载体过渡,迅速增殖的微生物受水力剪切等环境作用,不断脱落与更新,导致DHA有较大波动变化。成熟期生物膜逐渐成熟稳定,DHA较高,且趋于稳定。
在生物膜成熟稳定后,R1~R5的DHA分别为(116.48±13.68)、(120.80±12.65)、(96.80±13.29)、(125.30±8.75)、(156.02±16.56) mg·(g·h)−1。小孔径聚氨酯载体拥有更高的生物量,高生物膜量会堵塞污泥内部的通道和空穴,进而抑制营养物质和氧的传质,使生物膜活性降低[30],大孔径载体传质快,代谢旺盛,生物膜脱落与更新更为频繁,有助于脱氢酶活性的提高,因此微孔孔径小的载体生物膜DHA值低于微孔孔径大的载体生物膜。
不同载体在成熟稳定期的生物膜微观结构表征结果如图5所示。聚氨酯载体内孔骨架较为光滑,孔径分布均匀、立体多层(图5(a)),骨架结构为微生物生长提供了丰富的附着空间,错综的孔径结构也能为内部生物膜提供良好的隐蔽环境,减少水力剪切力对生物膜的冲刷。不同结构载体上微生物的黏附会形成不同形貌生物膜,继而影响生物膜的生长发育,这些形貌差异是由载体与载体、载体与水流之间摩擦作用产生的剧烈水力条件所造成[31]。小孔径载体(R1、R2)内生物膜(图5(b)、图5(c))结构松散,细菌群落生长较慢,可见较多的丝状菌。由于适度的水力剪切作用刺激微生物EPS的分泌,中等孔径载体(R3、R4)生物膜具有多孔性和致密性(图5(d)、图5(e)),载体与细菌菌落具有较强的黏结作用,球形菌、丝状菌多呈菌落形式均匀分布于EPS基质中,形成非常致密、较均匀的网状结构。大孔径载体(R5)生物膜为抵御更为强烈的水力剪切力,分泌大量的黏性聚合物(EPS)使生物膜致密且粗糙,表面拥有丰富的孔洞结构(图5(f))。但细菌群落不多见,可能是较大的剪切作用将细菌从载体表面剥离,阻碍了细菌群落的生长。
-
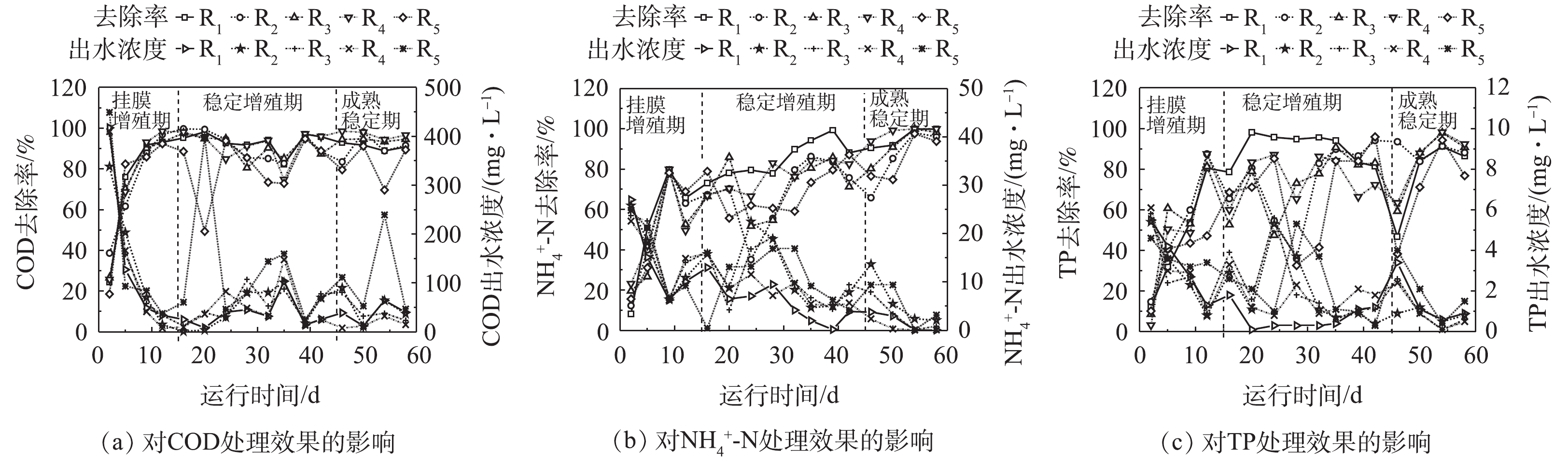
各微孔孔径载体反应器污染物出水浓度、去除效果如图6所示。生物膜在挂膜增殖初期,由于生物膜累积较薄,未形成良好的好氧、厌氧区域[32],对含C有机物、N、P元素的吸附、降解与转化能力较弱。随后微生物迅速繁殖,COD、
NH+4 -N、TP的去除率迅速上升,10 d后,各反应器出水COD降至40.0 mg·L−1,去除率均可达90%以上,且各微孔孔径载体对污染物去除效果并未呈现明显的差异。在生物膜稳定增殖期,小孔径载体,尤其是R1表现出强烈的去除优势,COD、NH+4 -N、TP的出水浓度较低,去除率可维持在82.3%~98.3%、73.1%~99.1%、78.5%~98.1%。因为小孔径载体积累了很高的生物量,小孔形成的隐蔽区域也为硝化菌与反硝化菌提供了良好的生活环境,高生物量、好氧-厌氧区域的形成使小孔径载体拥有优异的废水处理效果。微孔孔径最大的R5载体出水浓度较劣且不太稳定,其对COD、NH+4 -N、TP的去除率为49.4%~94.8%、59.1%~87.1%、38.3%~95.9%。尽管大孔径载体的生物膜活性(DHA)更高,但强烈水力剪切作用使其生物膜发育缓慢。当生物膜成熟稳定后,小孔径载体(R1、R2)对COD、TP的去除率出现略微下降,这可能是小孔不利于生物膜更新,生物膜活性降低导致的。大孔径载体(R5)对污染物去除效果仍是最差。中等孔径载体表现出很好的污染物去除效果,R3和R4对COD、NH+4 -N、TP的平均去除率分别为94.2%±0.8%、96.3%±1.6%、96.4%±3.5%,98.9%±0.6%、92.3%±3.4%、92.8%±2.8%,载体反应器出水中COD、NH+4 -N、TP浓度低于40.0、1.5、0.6 mg·L−1。总之,中等孔径载体在生物膜成熟后拥有稳定污染物去除效果与生物膜动态生长,更适合污水处理中载体的长期应用。 -
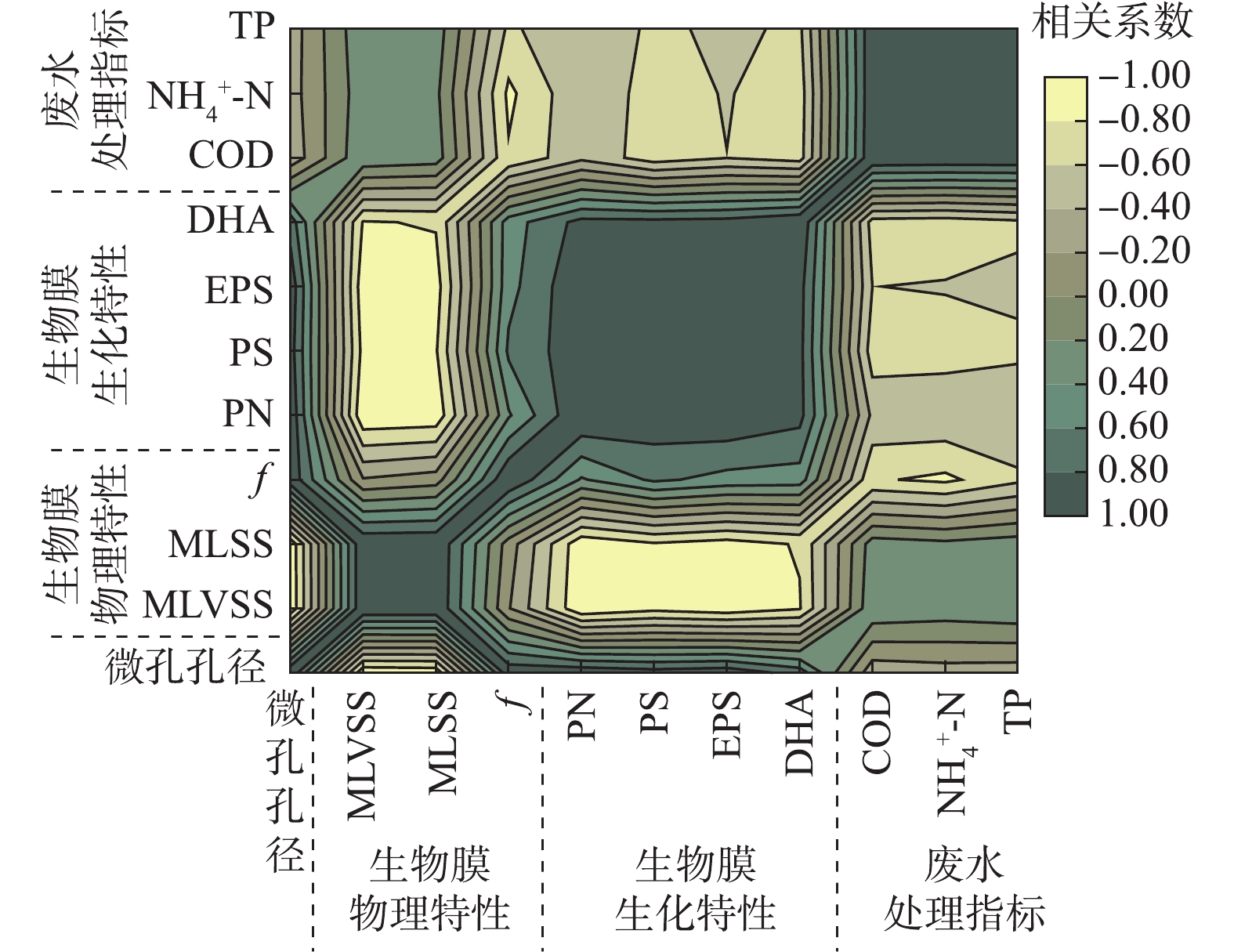
图7为生物载体内微孔孔径、生物膜特性以及废水处理效果间的相关系数矩阵图,可根据颜色深浅直接看出不同参数之间相关性的正负与强弱。
载体微孔孔径与MLVSS、MLSS的相关系数分别为−0.963(P<0.01)、−0.949(P<0.05),呈显著负相关。载体微孔孔径与生物膜f (相关系数=0.945,P<0.05)、DHA(0.717)呈正相关性,两者表征微生物活性具有同向性。载体微孔孔径与PN、PS、EPS之间的相关系数分别达到0.964 (P<0.01)、0.893 (P<0.05)、0.940 (P<0.05),均呈显著正相关。大孔径载体生物膜为了抵御强烈的水力冲击等外部环境影响,微生物会分泌更多的黏性EPS。此外,PN、PS与EPS相关系数分别为0.979、0.987,说明胞外聚合物组分之间相互影响。
从废水处理效果来看,载体微孔孔径与污染物去除率之间相关性均不显著,其与COD、
NH+4 -N、TP去除率之间的相关性系数分别为−0.335、−0.292、−0.306。说明在生物载体的应用过程中,过度地增大或减小载体内微孔孔径并不一定有益于生物膜反应器的废水处理效率的提高。废水处理指标之间相关性很强,COD与NH+4 -N(相关系数=0.982,P<0.01)、COD与TP(相关系数=0.981,P<0.01)、NH+4 -N与TP(相关系数=0.932,P<0.05)均呈现显著正相关。中等微孔孔径(2 mm、3 mm)载体不仅能维持适量的微生物量,还能保持良好的生物膜结构与活性,为生物膜反应器提供良好的长期运行条件与处理效果(图8)。因此,通过选择适宜的载体微孔孔径来控制生物膜特性,可保证优异的生物量、活性和更新状况,是使生物膜反应器在长期运行中保持高效处理效果的关键性因素。
-
1)小孔径载体(R1、R2)的微小孔径阻碍了营养物质和DO的渗透,导致其生物膜结构较为松散,微生物以高比表面积的丝状菌为主;大孔径载体(R5)会分泌大量的黏性EPS,使其生物膜结构更为致密;中等孔径载体(R3、R4)拥有良好的生物膜结构,杆状菌、球形菌和丝状菌共存。
2)微孔孔径大小与MLVSS (相关系数=−0.949,P<0.05)和MLSS (相关系数=−0.963,P<0.01)呈显著负相关,MLSS、MLVSS均随着载体微孔孔径的增大而减小。
3)载体微孔孔径与PN (相关系数=0.964,P<0.01)、PS (相关系数=0.893,P<0.05)、EPS (相关系数=0.940,P<0.05)、f (相关系数=0.945,P<0.05)呈显著正相关。由于水力剪切、营养物质传输等作用,微孔孔径大的R3~R5载体上的生物膜具有更高的生物活性(DHA、f ),有利于胞外聚合物的分泌与积累,主要体现在TB-EPS层的显著增长。但载体内微孔孔径大小对EPS各组分在各污泥层的分布规律影响较小。
4)在生物膜挂膜增殖的前中期,高生物量使小孔径载体拥有更为优异的废水处理效果。但在生物膜成熟稳定后,中等孔径R3 (2 mm)、R4 (3 mm)载体表现出最为优异的生物膜特性与污染物去除效果,对COD、
NH+4 -N、TP的去除率分别稳定在94.2%~98.9%、92.3%~96.3%、92.8%~96.4%,说明2~3 mm的微孔孔径最为适宜。
载体内微孔孔径对生物膜特性及废水处理效果的影响
Effect of carrier micropore diameter on biofilm characteristics and wastewater treatment performance
-
摘要: 为解决载体內部微孔孔径在废水生物膜法中缺乏选型依据的问题,采用5种孔径(0.6~4 mm)聚氨酯海绵生物载体构建了SBBR,考察了载体内微孔孔径对生物膜特性(MLSS、EPS、DHA)及废水处理效果的影响,分析了载体内部微孔孔径与生物膜特性的相关性。结果表明:载体内微孔孔径与MLVSS、MLSS呈显著负相关,而与PN、PS、EPS和f呈显著正相关;高生物量使小孔径载体(0.6 mm,1 mm)在反应器运行前中期拥有最佳的废水处理效果,同时过多的生物膜在微孔环境中会堵塞内部的通道和空穴,进而抑制传质,使生物膜活性(DHA、f )降低;而大孔径载体(4 mm)内部传质快、水力剪切作用强,加速生物膜解吸脱落速率,促进了生物膜活性的提高与EPS(主要是TB-EPS)的释放,但同样限制了生物膜量的增长。相较而言,中等孔径载体(2 mm,3 mm)适宜的微孔不仅能维持适量的微生物量,还能保持良好的生物膜结构和活性,为生物膜反应器提供良好的长期运行条件和处理效果。Abstract: In order to improve the lack of selection basis of micropore size of the carrier of wastewater biofilm process, polyurethane sponge carrier with 5 micropore diameters (0.6~4 mm) were used to build five laboratory-scale sequencing batch biofilm reactors (SBBR). The effect of the micropore diameter of the carrier on the biofilm characteristics (biomass, EPS and DHA) and wastewater treatment performance was investigated. The relationship between the micropore diameter of the carrier and the biofilm characteristics was analyzed. The results showed that the micropore diameter of the carrier was negatively correlated with MLVSS and MLSS, but positively correlated with PN, PS, EPS and f. During the early and middle periods of SBBR operation, high biomass led to the best wastewater treatment effect by the small-pore carrier (0.6 mm, 1 mm), and meanwhile too much biofilm blocked the internal channels and holes in the microporous environment, thus inhibited the mass transfer, and reduced the biofilm activity (DHA, f). However, for the large-pore carrier (4 mm), the mass transfer was fast and the hydraulic shear was strong, which accelerated the desorption and detaching rate of biofilm, promoted the biofilm activity and the EPS release (mainly TB-EPS), but limited the growth of biofilm biomass. Comparatively, the appropriate micropore in medium-pore carrier (2 mm, 3 mm) could not only maintain the appropriate microbial biomass, but also ensure an excellent biofilm structure and activity, providing good long-term operating conditions and treatment performance.
-
邻苯二甲酸酯(phthalates esters,PAEs)又称酞酸酯,是邻苯二甲酸形成的酯类总称,传统的PAEs具有性能良好、生产工艺成熟的特性[1],被大量合成以生产各种塑料[2] ,其产量约占塑化剂总产量的80%[3]。PAEs被广泛应用于食品包装、医疗卫生、化妆品等生活各个方面[4],其在环境中无处不在,可以通过呼吸、饮食和皮肤接触等途径进入生物体内[5],由于PAEs具有类雌性激素活性,其进入生物体后会促使生殖系统紊乱[6]。PAEs带来的环境污染问题日益严重,成为国内外研究的热点之一。有研究学者指出,陆地土壤中微塑料的含量是海洋体系中的4~23倍[7],PAEs通过大气沉降、灌溉和工业废水排放等过程的迁移和转化进入到土壤中,土壤是受PAEs污染主要的汇[8]。PAEs对人体健康和生态环境均构成了潜在的危害,目前已经成为全球最主要的污染物之一[9]。因此,US EPA将邻苯二甲酸二甲酯(DMP)、邻苯二甲酸二乙酯(DEP)、邻苯二甲酸二丁酯(DBP)、邻苯二甲酸丁基苄基酯(BBP)、邻苯二甲酸二(2-乙基)己酯(DEHP)和邻苯二甲酸二正辛酯(DNOP)列为优先控制污染物[10],我国也将DEP、DBP、DNOP列为优先控制污染物[11]。
兰州城区化工业发展迅速,区域人口密集,交通拥堵,以及频繁的人群活动带给土壤环境强烈的干扰[12]。近几年,越来越多的学者开始关注甘肃地区土壤环境污染问题,不过大多关注农田土壤的研究[13-14],对兰州城区土壤环境问题的研究较少且主要以重金属为主[15-16],几乎没有关于兰州城区土壤 PAEs 污染的相关研究。考虑到城市快速发展对土壤的累积影响效应,及土壤环境污染物对人群健康风险,对兰州主城区不同区域土壤中PAEs的含量和污染特征进行分析,对土壤中PAEs的来源进行分析讨论,利用US EPA推荐的健康风险评价模型[17]评估6种优先控制PAEs对人群的致癌/非致癌风险评价,筛选出兰州城区土壤中主要PAEs污染物,以期待结果可以为兰州城区土壤环境决策和相关的标准制定提供一定的理论依据和数据参考。
1. 材料与方法
1.1 样品采集
本研究与兰州市加油站区域土壤调查项目联合开展,主要采集加油站附近的表层土壤。在对兰州现有加油站进行实地调研,并了解了城市加油站地块分布后,选取兰州市24个采样点,于2021年10—11月采集表层土壤样品24组,其中,城关区9组,七里河区6组,安宁区4组,西固区5组。考虑到钻探点位0~20 cm为混凝土,故选择在0~50 cm的表层土层进行采样,所有采样点位使用GPS记录采样点位的经纬度坐标,并记录四周环境状况。通过Arc GIS 10.2绘制兰州城区采样点,见图1。前期土壤样品剔除植物根系、砾石等杂物后,采集500 g土壤放入500 mL螺口棕色玻璃瓶中。同一个采样点同时采集土壤样品、土壤平行样品,2份为1组。所有样品放在<4 ℃保温箱中避光冷藏带回实验室分析检测。
1.2 实验试剂
所用试剂:二氯甲烷(色谱纯)、乙酸乙酯(色谱纯),无水硫酸钠(分析纯)、中性氧化铝(74~150 μm,分析纯)。标样为邻苯二甲酸酯6种PAEs混标DMP、DEP、DBP、BBP、DEHP和DNOP,内标物邻苯二甲酸二乙基己基酯(DEHP-D4)、邻苯二甲酸二正戊酯(DPP-D4),替代物苯甲酸苄酯(BBZ)。
1.3 实验过程
参考《土壤中邻苯二甲酸酯测定 气相色谱-质谱法:GB/T 39234—2020》和《土壤和沉积物6种邻苯二甲酸酯类化合物的测定 气相色谱-质谱法:HJ 1184—2021》中的方法提取土壤中PAEs。准确量取1.00 g中性氧化铝于玻璃层析柱中,先用5 mL二氯甲烷活化15 min,再使用乙酸乙酯淋洗玻璃层析柱,氮吹2 min后备用。称取10.00 g土壤样品,加入5.00 g无水硫酸钠研磨均化成流沙状,全部放入50 mL棕色玻璃瓶中。加入200 μL BBZ,再加入20 mL乙酸乙酯,静置30 min,设置涡旋离心机700 r/min,提取20 min,使其充分提取,静置20 min。全部提取液过氧化铝玻璃层析柱,净化液收集于30 mL玻璃离心管中,吸取1 mL至进样小瓶中,加入10 μL内标物使用液待测。空白样品使用石英砂代替,按照和土壤样品相同的处理步骤制备。
本实验使用岛津GC-MS 2010 ULTRA气相色谱-质谱联用仪。色谱条件:色谱柱:DB-5MS(30 m×0.25 mm×0.25 µm);程序升温:初始温度50 ℃,保持1 min,以15 ℃/min速率升温至280 ℃,保持5 min;载气为高纯度氦气(纯度≥99.999%);进样口温度280 ℃;不分流进样;载气流速1.2 mL/min(恒流)。质谱条件:电子轰击源(EI);电子能量70 eV;离子源温度230 ℃;数据采集方式为SIM模式。目标物的定量参数,见表1。
表 1 目标物的定量参数Table 1. Quantitative parameters of the targetPAEs CAS编码 定量离子/m·z−1 定性离子/m·z−1 类型 定量内标 出峰时间/s DMP 131-11-3 163 77 目标物 内标物1 10.717 DEP 84-66-2 149 177、150 目标物 内标物1 11.997 BBZ 120-51-4 105 91、77 替代物 内标物1 13.590 DBP 84-74-2 149 150、223 目标物 内标物1 14.873 DPP-d4 358730-89-9 153 154、241 内标物1 − 16.177 BBP 85-68-7 149 91、206 目标物 内标物2 17.643 DEHP 117-81-7 149 167、57 目标物 内标物2 19.097 DNOP 117-84-0 149 150、279 目标物 内标物2 21.343 DEHP-d4 93951-87-2 153 171、71 内标物2 − 19.090 注:“-”代表本身为内标物,无需内标定量。 6种PAEs分离较好,其中DEHP和内标物2(DEHP-d4)出峰重合,因离子碎片不同,可完全分开,不影响定量结果。6种PAEs色谱图,见图2。
1.4 质量控制
本实验的样品采集和保存环节避免接触塑料制品,以防对土壤样品和实验的准确度造成影响[18]。在全流程空白样品与运输空白样品中均未检出PAEs。依据《土壤和沉积物中6种邻苯二甲酸酯类化合物的测定 气相色谱-质谱法:HJ 1184—2021》,在实验开始前,使用铬酸洗液和蒸馏水清洗所有的玻璃器皿,再使用烘箱烘干备用。实验过程中使用的氧化铝、石英砂、铝箔和无水硫酸钠均经过马弗炉400 ℃的温度条件下灼烧6 h,待冷却后收集于玻璃器皿中备用。向空白样品中分别添加0.02、0.03、0.05、0.1、0.2、0.4和 0.5 mg/L的6种PAEs进行回收率试验,得到空白样品加标回收率为60.0%~91.0%。采用7个浓度点配线性标准曲线,各线性R2均在0.999以上。前处理过程中每份样品做3个平行样,且所有样品在处理过程中均加入苯甲酸苄酯作为替代物,替代物回收率为61.06%~120.3%。样品前处理保证10个样品做3个空白试验,确保实验的准确性。
1.5 人群健康风险评价方法
基于兰州城市快速发展及人群活动对土壤造成的压力,针对兰州城区土壤受PAEs污染对人群健康风险进行评估。我国于2019年推出《建设用地土壤污染风险评估技术导则:HJ 25.3—2019》,由于该规范目前仅有DEHP、DEP、DBP、BBP和DNOP污染物且缺少部分风险评估毒性参数数据,不能完成风险评估的计算,因此本研究采用US EPA提出的PAEs非致癌和致癌风险评价方法[17]。城市土壤中PAEs可经口摄入、皮肤接触和呼吸吸入3种途径进入人体危害健康[19],查阅《城市用地分类与规划建设用地标准:GB 50137—2011》,在城市土壤中,成人的暴露期长、频率高,以成人为对象,通过计算3种途径的非致癌风险(HQ)数值和致癌风险(CR)数值,研究土壤中PAEs含量水平对人体的非致癌和致癌风险。PAEs单体中,DMP、DEP、DBP和DNOP为与人类健康有关的非致癌物质,DEHP、BBP为致癌物质[20]。PAEs非致癌/致癌健康风险评价公式模型,见表2。
表 2 非致癌/致癌风险评估模型公式Table 2. Non-carcinogenic / carcinogenic risk assessment model formula项目 PAEs非致癌/致癌风险评价公式 非致癌风险 HQ=Σ(ADDi/RfDi) 致癌风险 CR=Σ(ADDi×CFS) 摄入途径 ADDi=ADDingest+ADDinhale+ADDdermal 经口直接摄入ADDingest ADDingest=(csoil×IRS×EF×ED/BW×AT) ×CF 呼吸吸入ADDinhale ADDinhale= (csoil×EF×ED×Ij/PEF×AT) ×103 皮肤接触ADDdermal ADDdermal=(csoil×SA×AF×ABS×EF×ED/ BW×AT) ×CF 注:csoil为土壤PAEs浓度,mg/kg。 此模型中健康风险暴露评估参数值(表3)参考US EPA推荐数值、相关研究文献[20-22]、《城市用地分类与规划建设用地标准:GB 50137—2011》和《建设用地土壤污染风险评估技术导则:HJ 25.3—2019》选取。对于非致癌物质,HQ>1表现出非致癌风险;对于致癌物质,CR>10−6表现出致癌风险[17]。结合US EPA和我国公布的优先控制污染物名单进行筛选,本研究针对6种PAEs进行健康风险评价。
表 3 健康风险暴露评估模型参数Table 3. Health risk exposure assessment model parameters参数 含义 单位 数值 参考文献 IRS 土壤摄入量 mg·d−1 100 [17] EF 接触频率 d·a−1 350 [17] ED 曝光时间 a 24 [17] BW 平均体重 kg 70 [17] CF 转换因子 − 10−6 [17] AT 平均寿命 d 非致癌:365×ED致癌:25 550 [20] Ij 呼吸率 m3·d−1 13.5 [21] PEF 颗粒排放因子 m3·kg−1 1.36×109 [17] SA 皮肤暴露面积 cm2·d−1 57 000 [17] AF 土壤粘附因子 mg·cm−1 0.07 [17] ABS 皮肤从土壤中吸收的污染物分数 − 0.1 [22] CFS 致癌率 mg·kg−1·d−1 DEHP=0.014 [17] RfD 非致癌物经某种途径摄入的日均推荐剂量 mg·kg−1·d−1 DBP=0.1DNOP=0.04 [22] 注:“-”代表无单位。 2. 结果与分析
2.1 城区土壤PAEs浓度水平
兰州城区土壤PAEs浓度水平,见表4。监测期间采集的全部土壤样品中,DMP、DEP和BBP未检出,DBP、DEHP和DNOP有检出,表明兰州城市土壤已经受到PAEs的污染。本研究中所检测出的3种PAEs浓度之和(ΣPAEs)范围为0.044~1.034 mg/kg,平均浓度为0.217 mg/kg,PAEs单体中DBP浓度范围为0.012~0.211 mg/kg,平均浓度为0.065 mg/kg;DEHP浓度范围0.002~0.31 mg/kg,平均浓度为0.063 mg/kg;DNOP浓度范围0.01~0.643 mg/kg,平均浓度为0.089 mg/kg。DBP、DEHP和DNOP平均浓度水平排序依次为DNOP>DBP>DEHP。
表 4 兰州市城区土壤PAEs浓度水平Table 4. Urban soil PAEs concentration in Lanzhoumg·kg−1 PAEs 范围 平均值 中位数 最大值 最小值 标准差 变异系数 检出率/% DMP ND − − − − − − 0 DEP ND − − − − − − 0 BBP ND − − − − − − 0 DBP 0.012~0.211 0.065 0.066 0.246 0.012 0.043 0.062 100 DEHP 0.002~0.316 0.063 0.032 0.032 0.001 0.072 0.009 100 DNOP 0.01~0.643 0.089 0.029 0.040 0.007 0.110 0.010 100 注:ND代表未检出;“-”代表无数值。 通过对比24个采样点土壤中PAEs浓度水平(图3)发现,22#点位ΣPAEs含量最高,该点位处于以工业为主的西固区,可能与该区域工业发展引起的土壤污染有关[23],其他点位土壤也受到PAEs不同程度污染。
2.2 PAEs在不同城区土壤中的组成特征
兰州城区土壤中6种PAEs单体中仅有DBP、DEHP、DNOP检出,含量水平见表5,兰州城区整体土壤受PAEs污染程度排序:西固区>七里河区>城关区>安宁区,其PAEs组成见图4,DNOP是贡献率最高的PAEs单体,贡献率为19%~56%,DBP和DEHP的贡献率也分别占到了23~51%和10%~45%,同时可以验证DBP和DEHP是我国使用量最多的两种PAEs[24]。本研究中,DNOP、DBP和DEHP为兰州城区土壤PAEs的主要污染物。
表 5 各区土壤PAEs单体含量水平Table 5. Soil PAEs monomer content level in each areamg·kg−1 行政区 DBP DEHP DNOP ΣPAEs R M R M R M 城关区(9) 0.012~0.089 0.031 0.021~0.215 0.061 0.010~0.133 0.045 0.137 七里河区(6) 0.065~0.094 0.076 0.013~0.201 0.072 0.016~0.099 0.034 0.182 安宁区(4) 0.049~0.072 0.060 0.002~0.020 0.012 0.011~0.083 0.045 0.117 西固区(5) 0.067~0.211 0.118 0.022~0.316 0.095 0.028~0.643 0.269 0.482 注:()内代表采样点位数量;R代表含量范围;M代表平均值。 张文娟等[25]对西安不同功能区PAEs污染情况进行调查,6个功能区PAEs从高到低依次为交通区>工业区>混合区>公园>文教区>住宅区。WANG et al[26]发现西安市DBP、DEHP各自平均含量最大值均出现在交通区。而加油站作为交通区的节点,是人们驾驶出行频繁进出的场所,且加油站具有汽车尾气排放、车胎与地面间磨损释放PAEs、车流量大等场所特点,尾气排放加速空气中的PAEs进入土壤,都会使得加油站场所内区域性PAEs浓度有增高的趋势。且PAEs属于半挥发性有机物,PAEs对土壤的污染会随着时间的发展产生累积效应,大气远距离的干、湿沉降也会使得土壤区域PAEs含量偏高[27]。
PAEs的来源分析对于控源减排至关重要,因此,进一步推断兰州各城区土壤中PAEs的可能来源。从研究结果发现,西固区以DNOP单体为主要污染物,西固区具有以石油化工、煤炭为主要产区的区域背景,工厂分布疏散,工厂运作过程中会向大气和土壤中释放PAEs;七里河区和安宁区以DBP单体为主要PAEs污染物,七里河区为商贸区,安宁区为文教区,楼群密集,人口相对较多,人群活动密集;城关区以DEHP单体为主要污染物,城关区作为兰州城区的交通枢纽和经济中心,具有人群活动密集、交通拥挤等区域特点。DBP、DNOP、DEHP被广泛用于汽车轮胎、表面油漆、道路沥青材料、化妆品和个人护理产品中使用,在工业中作增塑剂以改善产品的可塑性[28-29],且已有研究表明,PAEs含量与人群活动相关[30]。由于各行政区区域背景不同,因此,可推出兰州城区各行政区的PAEs来源也不尽相同,西固区PAEs的潜在来源主要是工业污染源,工业生产活动中油漆、沥青和塑料等材料的使用,塑化剂类污染物排放都会使得区域性DNOP单体偏高;七里河区和安宁区PAEs潜在来源主要是人为污染源,区域内人群活动密集,日常塑制生活垃圾、化妆和个护产品的丢弃等人为活动,使得七里河区和安宁区以DBP单体为主要的PAEs污染物;城关区PAEs的潜在来源主要为交通污染源,汽车等运输工具在运输过程中,汽车尾气排放、轮胎磨损、道路沥青铺设等活动加速了PAEs进入土壤中,导致城关区域受DEHP单体污染较为明显。
2.3 土壤中PAEs环境质量评价
本研究采样点在加油站内,加油站在城市土地利用类型中属于二类用地,参考我国《土壤环境质量 建设用地土壤污染风险管控标准:GB 36600—2018》二类用地土壤污染物的筛选值和管制值,DEHP筛选值为121 mg/kg,管制值为1 210 mg/kg,DNOP土壤环境筛选值为2 812 mg/kg,管制值为5 700 mg/kg。本研究结果显示,检测到的2种PAEs单体:DEHP和DNOP远低于我国城市土壤污染物管制值。由于我国未设定土壤中PAEs单体DBP的污染控制标准,本研究参考US EPA设定的土壤PAEs化合物控制标准和治理标准,在调查的24个采样点中,有6个采样点土壤样品DBP含量超过0.08 mg/kg的控制标准,其余均明显低于控制标准。
为了进一步评估兰州市城区土壤受PAEs污染情况,将兰州城区土壤PAEs浓度水平(ΣPAEs=0.217 mg/kg)与国内外其他城市土壤进行对比,见表6。兰州城市土壤ΣPAEs浓度水平明显低于西安城市土壤(10.95 mg/kg)、北京城市土壤(2.76 mg/kg)和沈阳城市土壤(0.652 mg/kg)、远低于广州城市土壤(41.191 mg/kg),重庆市城市土壤(0.214 mg/kg)与本研究PAEs浓度水平相当;与国外其他城市相比较,兰州城市土壤PAEs浓度水平远远低于巴黎城市土壤(13.46 mg/kg)和莫斯科城市土壤(49.83 mg/kg),兰州市土壤PAEs略高于丹麦土壤(0.071 mg/kg)。通过整体数据比对可以看出,DEHP、DBP是我国土壤受PAEs污染的两个主要单体污染物,在重庆城市土壤中,DEHP和DBP占比ΣPAEs分别为63.38%、26.56%;广州城市土壤中,DEHP占比达到87.96%,DBP占比9.87%。
表 6 不同地区土壤PAEs浓度水平Table 6. Soil PAEs concentration levels in different regionsmg·kg−1 地区 DMP DEP DBP BBP DNOP DEHP ΣPAEs 参考文献 西安城市土壤 0.188 0.187 4.174 0.091 0 0.188 0 6.122 10.950 [25] 重庆城市土壤 0.004 0.016 0.057 0.000 6 0.000 5 0.136 0.214 [31] 北京城市土壤 0.010 0.020 0.790 0.030 0 0.030 0 1.880 2.760 [32] 沈阳城市土壤 0.105 0.177 0.157 0.035 0 0.003 0 0.175 0.652 [33] 广州城市土壤 0.098 0.054 4.067 0.160 0 0.582 0 36.230 41.191 [34] 巴黎城市土壤 − 0.100 0.140 0.130 0 0.090 0 13.000 13.460 [35] 丹麦城市土壤 0.000 1 0.000 6 0.008 0.000 5 0.013 0 0.049 0.071 [36] 莫斯科城市土壤 0.470 0.420 31.740 − − 17.200 49.830 [37] 兰州城区土壤 ND ND 0.065 ND 0.089 0 0.063 0.217 本研究 注:表格中的数值均选自平均值;ND为未检出;“−”为无数值。 2.4 PAEs健康风险评价
本研究选取US EPA推荐的方法评估了兰州城区土壤中仅检测到的3种PAEs单体(DBP、DEHP、DNOP)通过非饮食途径的人体健康风险,3种PAEs单体中DBP、DNOP对人体健康表现出非致癌性,DEHP表现出致癌性,结果见图5。对于非致癌性PAEs单体,DBP的HQ数值为1.144×10−3~2.02×10−2,DNOP的HQ数值为1.947×10−5~1.25×10−3,本研究所检测到的3种PAEs单体的非致癌和致癌风险系数范围,与US EPA规定的风险管控数值相比,非致癌风险数值在US EPA规定的安全阈值范围内(HQ<1),致癌性PAEs单体DEHP的CR数值为7.476×10−10~1.181×10−7,同样低于US EPA规定的致癌风险可接受水平(CR<10−6)。
对于兰州城区土壤中PAEs对人体健康风险评价可见,DBP、DNOP虽不存在非致癌风险,但2种单体贡献率最高达到51%和56%,应引起重视。PAEs单体DEHP对人体健康不存在致癌风险,但应采取积极的方式预防其带来的潜在危害。
3. 结论与展望
(1)2021年10—11月对兰州城区24个点位土壤进行采样,所有土壤样品中均检测到3种PAEs单体DBP、DEHP和DNOP。ΣPAEs污染物浓度0.044~1.034 mg/kg,平均值为0.217 mg/kg。3种PAEs单体相较于国内城市用地土壤标准,DEHP、DNOP未超标,相较于US EPA设定的控制标准部分点位DBP单体含量超标。总体上,与国内外其他地区城市土壤相比兰州城区土壤PAEs浓度水平相对较低。
(2)本研究依据US EPA推荐的人体健康风险评价模型进行评估,结果表明,兰州城区土壤中PAEs单体DBP、DNOP浓度水平对人体健康的HQ数值小于1,致癌PAEs单体DEHP对人体健康的CR数值小于10−6,表明土壤中PAEs对人体的非致癌风险和致癌风险数值均处于US EPA规定的风险区间内。
(3)DBP、DNOP和DEHP作为兰州城区土壤的主要PAEs污染物,主要来源交通运输、工业材料和人群活动的影响。不同类型塑料包装物引起的土壤污染存在显着差异。且随着使用时间延长土壤污染越严重。因此对生活塑料垃圾进行适当的分类处理会降低土壤的污染程度,使用可回收、可降解的环保塑制产品推进清洁汽油的使用也可以有效预防土壤环境污染的发生。
-
表 1 各尺寸聚氨酯载体主要性能参数
Table 1. Main property parameters of polyurethane carriers with various sizes
载体类型 平均孔径/mm 孔隙率/% 表观密度/(g·cm−3) 空隙率/% 持水倍率 R1 0.6 98.4 33.2 83.0 17.7 R2 1.0 97.7 29.5 85.0 19.3 R3 2.0 97.1 26.4 88.0 21.9 R4 3.0 96.3 24.7 94.0 22.5 R5 4.0 95.6 24.3 97.0 23.7 -
[1] FELFӦLDI T, JURECSKA L, VAJNA B, et al. Texture and type of polymer fiber carrier determine bacterial colonization and biofilm properties in wastewater treatment[J]. Chemical Engineering Journal, 2015, 264: 824-834. [2] HU H Z, HE J G, LIU J, et al. Biofilm activity and sludge characteristics affected by exogenous N-acyl homoserine lactones in biofilm reactors[J]. Bioresource Technology, 2016, 211: 339-347. [3] MA W W, HAN Y X, MA W C, et al. Enhanced nitrogen removal from coal gasification wastewater by simultaneous nitrification and denitrification (SND) in an oxygen-limited aeration sequencing batch biofilm reactor[J]. Bioresource Technology, 2017, 244: 84-91. [4] PICULELL M, SUAREZ C, LI C, et al. The inhibitory effects of reject water on nitrifying populations grown at different biofilm thickness[J]. Water Research, 2016, 104: 292-302. [5] 胡小兵, 朱荣芳, 唐素兰, 等. 不同负荷下生物膜脱落与载体生物膜生物特性的相互影响[J]. 环境科学学报, 2017, 37(8): 2925-2935. [6] OBEROI A S, PHILIP L. Performance evaluation of attached biofilm reactors for the treatment of wastewater contaminated with aromatic hydrocarbons and phenolic compounds[J]. Journal of Environmental Chemical Engineering, 2017, 5(4): 3852-3864. [7] TARJÁNYI-SZIKORA S, OLÁH J, MAKÓ M, et al. Comparison of different granular solids as biofilm carriers[J]. Microchemical Journal, 2013, 107: 101-107. [8] HUANG H, PENG C, PENG P C, et al. Towards the biofilm characterization and regulation in biological wastewater treatment[J]. Applied Microbiology and Biotechnology, 2019, 103(3): 1115-1129. [9] DIAS J, BELLINGHAM M, HASSAN J, et al. Impact of carrier media on oxygen transfer and wastewater hydrodynamics on a moving attached growth system[J]. Chemical Engineering Journal, 2018, 351: 399-408. [10] GUO K, FREGUIA S, DENNIS P G, et al. Effects of surface charge and hydrophobicity on anodic biofilm formation, community composition, and current generation in bioelectrochemical systems[J]. Environmental Science & Technology, 2013, 47(13): 7563-7570. [11] LIM J W, SENG C E, LIM P E, et al. Nitrogen removal in moving bed sequencing batch reactor using polyurethane foam cubes of various sizes as carrier materials[J]. Bioresource Technology, 2011, 102(21): 9876-9883. [12] NGUYEN T T, NGO H H, GUO W, et al. Effects of sponge size and type on the performance of an up-flow sponge bioreactor in primary treated sewage effluent treatment[J]. Bioresource Technology, 2010, 101(5): 1416-1420. [13] AHMAD M, LIU S, MAHMOOD N, et al. Effects of porous carrier size on biofilm development, microbial distribution and nitrogen removal in microaerobic bioreactors[J]. Bioresource Technology, 2017, 234: 360-369. [14] 郝晓地, 安兆伟, 孙晓明, 等. 悬浮填料强化污水生物处理的实际作用揭示[J]. 中国给水排水, 2013, 29(8): 5-9. [15] 耿佳, 冯芳, 孔丹, 等. 聚氨酯生物膜载体处理高氨氮废水的研究[J]. 环境科学与技术, 2013, 36(6): 124-127. [16] KUMARASAMY M V, MAHARAJ P. The effect of biofilm growth on wall shear stress in drinking water PVC pipes[J]. Polish Journal of Environmental Studies, 2015, 24: 2479-2483. [17] 周芬. 混凝土改性亲水性生物填料的开发及其应用研究[D]. 广东: 华南理工大学, 2012. [18] 李延, 解迪, 梁文艳, 等. SBBR反应器运行中生物膜胞外聚合物的变化特征[J]. 环境科学与技术, 2016, 39(4): 95-101. [19] 国家环境保护总局. 水和废水监测分析方法[M]. 4版. 北京: 中国环境科学出版社, 2002. [20] 姚萌, 罗红元, 谢小青, 等. 城市污水厂活性污泥胞外聚合物的三维荧光特性分析[J]. 中国环境科学, 2012, 32(1): 94-99. [21] FANG F, LU W T, SHAN Q, et al. Characteristics of extracellular polymeric substances of phototrophic biofilms at different aquatic habitats[J]. Carbohydrate Polymers, 2014, 106: 1-6. [22] 陈寰. 苯酚-硫酸法测定好氧颗粒污泥胞外聚合物中多糖浓度的研究[J]. 四川环境, 2012, 31(5): 1-3. [23] TAN C, XU H R, CUI D, et al. Effects of tourmaline on nitrogen removal performance and biofilm structures in the sequencing batch biofilm reactor[J]. Journal of Environmental Sciences, 2018, 67(5): 130-138. [24] ZHU Y, ZHANG Y, REN H Q, et al. Physicochemical characteristics and microbial community evolution of biofilms during the start-up period in a moving bed biofilm reactor[J]. Bioresource Technology, 2015, 180: 345-351. [25] RENNER L D, WEIBEL D B. Physicochemical regulation of biofilm formation[J]. MRS Bulletin, 2011, 36(5): 347-355. [26] 胡小兵, 叶星, 周元凯, 等. 胞外聚合物对活性污泥吸附生活污水碳源的影响[J]. 环境科学学报, 2016, 36(11): 4062-4069. [27] LI T G, BAI R B, LIU J X. Distribution and composition of extracellular polymeric substances in membrane-aerated biofilm[J]. Journal of Biotechnology, 2008, 135(1): 52-57. [28] 樊鹏超, 曾薇, 纪兆华, 等. 城市污水厂活性污泥中胞外聚合物与工艺运行及污泥沉降性能的相关性分析[J]. 环境科学学报, 2017, 37(8): 2996-3002. [29] 宋浩亮, 邱兵, 赵奕良, 等. Ni2+对生物膜活性及胞外聚合物的短期影响[J]. 水处理技术, 2018, 44(2): 37-41. [30] ZHANG X Y, LI J, YU Y B. et al. Biofilm characteristics in natural ventilation trickling filters (NVTFs) for municipal wastewater treatment: Comparison of three kinds of biofilm carriers[J]. Biochemical Engineering Journal, 2016, 106: 87-96. [31] HUANG Q Y, WU H Y, CAI P, et al. Atomic force microscopy measurements of bacterial adhesion and biofilm formation onto clay-sized particles[J]. Scientific Reports, 2015, 5: 16857. [32] GONG Z, YANG F L, LIU S T, et al. Feasibility of a membrane-aerated biofilm reactor to achieve single-stage autotrophic nitrogen removal based on Anammox[J]. Chemosphere, 2007, 69(5): 776-784. -





 下载:
下载: