-
中国作为一个水资源匮乏的国家,人均水资源占有量仅为世界人均水资源占有量的25%。其中,地下水作为第2大淡水资源,已成为我国多数城市的供水水源。但由于人类在农业生产过程中对氮肥的过度使用以及工业中含氮废水的不达标排放等原因[1-2],地下水中的硝酸盐污染不断加剧,呈现出污染范围不断扩大、程度不断加深的趋势[3]。HAN等[4]对中国的52个地下水系统数据进行汇总,发现部分含水层中(36个浅层含水层中的25个,37个深层或岩溶含水层中的10个)的地下水硝酸盐污染水平已远远超过了美国环境保护署公布的最大污染量(10 mg·L−1
NO−3 -N)。同时在不同的接触浓度和接触时间条件下,水中硝态氮对人体有着不同程度的危害,轻微时会使血红蛋白失去输氧能力,从而使人体产生缺氧症状,严重时导致消化道系统发生癌变,并且也会造成类似水体富营养化的环境问题,从而产生严重的经济损失[5-6]。因此,地下水中的硝酸盐污染的治理将是一个亟待解决的问题。长期以来,人们对地下水硝酸盐的去除做了大量的研究工作,总结出了许多可行的防治措施,这些方法主要包括生物修复技术、物理化学修复技术(离子交换、反渗透RO、电渗析法)和化学修复技术[7-11]。其中,物理化学处理技术只是将污染物转移或浓缩,并没有将污染物除去,因此,在地下水水质修复的应用中受到限制。近年来,零价铁在有毒重金属、有机氯化物的去除过程中展现出优良的性能,因而被广泛应用,并得到大量推广[12-13]。但是随着零价铁去除地下水硝酸盐研究的不断深入,发现其在实际的运用中仍存在许多问题,主要包括:纳米零价铁粒径较小且带有一定的磁性,极易在水体中发生团聚,失去了原有的迁移性;在利用纳米零价铁去除硝酸盐时,纳米零价铁在还原的过程中会在其表面形成氢氧化铁副产物,从而抑制反应的进行[14]。因此,对零价铁进行改性,以获得更稳定的性能尤为重要。针对以上问题,国内外学者已经提出了许多关于纳米零价铁的改性方法,活性炭负载零价铁的复合材料表现出优良的硝酸盐去除性能。此外,修宗明等[15]还发现活性炭与铁粉在溶液中可形成铁炭原电池(铁为阴极,炭为阳极),其产生的电场可以促进硝酸根的还原,从而大大促进硝酸盐的去除。
本研究以玉米秸秆作为生物炭的原料,采用液相还原法研究了不同制备条件(溶剂体系、生物炭与零价铁的质量比例)对零价铁-生物炭复合材料(ZVI-BC)的影响,以优选制备条件;通过严格控制厌氧环境和模拟地下水环境,对在优选制备条件下制备的复合材料去除地下水中硝酸盐的效果进行了评估,同时考察了不同实验条件对硝酸盐去除效果的影响;从动力学、氮平衡等方面探讨了零价铁-生物炭复合材料还原硝酸盐的可能途径;将生物炭的吸附性能与零价铁的还原性能结合,为零价铁-生物炭复合材料在地下水硝酸盐的治理中提供参考。
-
七水硫酸亚铁(FeSO4·7H2O)、硼氢化钠(NaBH4)、聚乙烯吡络烷酮K30(PVP)、无水乙醇、氨基磺酸、磺胺、N-1-萘乙二胺盐酸盐、亚硝酸钠(NaNO2)、片状氢氧化钠(NaOH)、过硫酸钾(K2S2O8)、酒石酸钾钠、碘化汞(HgI2),购自成都市科龙化工试剂厂;碘化钾(KI)、硝酸钾(KNO3),购自天津市光复精细化工研究所;盐酸,购自西陇科学股份有限公司。以上药剂均为分析纯级,使用前没有经过进一步的处理。实验用水均为自制去离子水。
-
水浴恒温振荡器(THZ-82,常州荣华仪器制造有限公司);手提式压力蒸汽灭菌器(DSX-280B,上海市中安医疗器械厂);箱式电阻炉(SX2-10-13,沈阳市节能电炉厂);双光束紫外可见分光光度计(TV-1901,北京普析通用仪器有限责任公司);可见分光光度计(N-1100D,上海美谱仪器有限公司)。
-
复合材料的合成分为2个步骤:生物炭的制备以及零价铁与生物炭的复合。生物炭的制备:将玉米秸秆放入温度为400 ℃的马弗炉中煅烧4 h,经冷却、研磨和过筛(100目)获得实验所需生物炭。复合材料的制备:首先,称取5.0 g FeSO4·7H2O溶于不同溶剂体系(去离子水体系、无水乙醇与去离子水体积比为3∶7的醇水体系和PVP分散剂体系);然后,将溶液转移至三口烧瓶中,在氮气通入的情况下,使用电动搅拌器以500 r·min−1的转速搅拌,在搅拌的过程中,加入不同质量的生物炭(0、0.1、0.3、0.5、0.7和1.0 g);接下来,称取1.891 5 g NaBH4,溶于50 mL容量瓶中,并使用蠕动泵以6 mg·L−1的速度加入上述混合溶液中,加药结束后,继续反应20 min;最后,将混合溶液倒入离心管中,离心所得的固体依次用脱氧后的去离子水和无水乙醇清洗3次后,置于真空干燥箱中以60 ℃的温度烘干5 h。
-
采用荷兰Empyrean XRD-2型X射线衍射仪(XRD)分别对不同零价铁与生物炭质量比的复合材料的晶型进行表征;利用德国sigma300型扫描电子显微镜(SEM)对复合材料的表面形貌进行观察;利用日本FEI Tecnai-G20型透射电子显微镜(TEM)观察复合材料的内部形貌;使用美国Thermo escalab 250Xi X射线光电子能谱仪(XPS)对复合材料的元素组成及其价态进行分析。
-
1)硝酸盐、亚硝酸盐、氨氮及总氮的测定。硝酸盐、亚硝酸盐、氨氮及总氮的测定分别依据HJ/T 346-2007、GB 7493-1987、HJ 535-2009及HJ 636-2012。通过设定不同浓度梯度的硝酸盐、亚硝酸盐、氨氮及总氮,使用紫外分光光度计分别测定220(275)、540、420及220(275) nm处的吸光度,以获得硝酸盐、亚硝酸盐、氨氮及总氮标准曲线,硝酸盐、亚硝酸盐、氨氮及总氮浓度分别为0~1 mg·L−1、0~10 mg、0~100 μg和0~100 μg,在此范围内各物质的浓度与吸光度呈良好的线性关系,可决系数R2分别为0.999 7、0.999 8、0.999 4、0.999 2。可依据各物质的吸光度值,通过线性回归方程计算,得出样品中硝酸盐、亚硝酸盐、氨氮及总氮浓度。
2)硝酸盐初始浓度对降解性能的影响。配置一系列100 mL初始浓度为20、40、60、80、100 mg·L−1的硝酸盐溶液,分别加入0.15 g制得的零价铁-生物炭复合材料,用0.1 mol·L−1的HCl或NaOH溶液调节pH至6.0,置于振荡速度为220 r·min−1、反应温度为25 ℃的恒温振荡器内,振荡3 h,磁吸分离,取上清液经0.45 μm微孔滤膜过滤后,测定其吸光度,再进一步计算硝酸盐的浓度。
3)溶液pH对降解性能的影响。配置一系列100 mL浓度为20 mg·L−1的硝酸盐溶液,分别加入0.15 g制得的零价铁-生物炭复合材料,配制不同pH 的缓冲溶液,调节pH 至3.0、5.0、7.0、9.0和11.0,置于振荡速度为220 r·min−1、反应温度为25 ℃的恒温振荡器内振荡3 h,磁吸分离,取上清液经0.45 μm微孔滤膜过滤后测定其吸光度,计算硝酸盐的浓度。
4)复合材料投加量对降解性能的影响。配置一系列100 mL浓度为20 mg·L−1的硝酸盐溶液,分别加入0.05、0.1、0.15、0.3和0.4 g零价铁-生物炭复合材料,用0.1 mol·L−1的HCl或NaOH溶液调节pH至6.0,置于振荡速度为220 r·min−1、反应温度为25 ℃的恒温振荡器内,振荡3 h,磁吸分离,取上清液经0.45 μm微孔滤膜过滤后,测定其吸光度,计算硝酸盐的浓度。
5)反应体系温度对降解性能的影响。配置一系列100 mL浓度为20 mg·L−1的硝酸盐溶液,分别加入0.15 g制得的零价铁-生物炭复合材料,用0.1 mol·L−1的HCl或NaOH溶液调节pH至6.0,置于振荡速度为220 r·min−1、反应温度分别为10、15、20及25 ℃的恒温振荡器内,振荡3 h,磁吸分离,取上清液经0.45 μm微孔滤膜过滤后,测定其吸光度,计算硝酸盐的浓度。
-
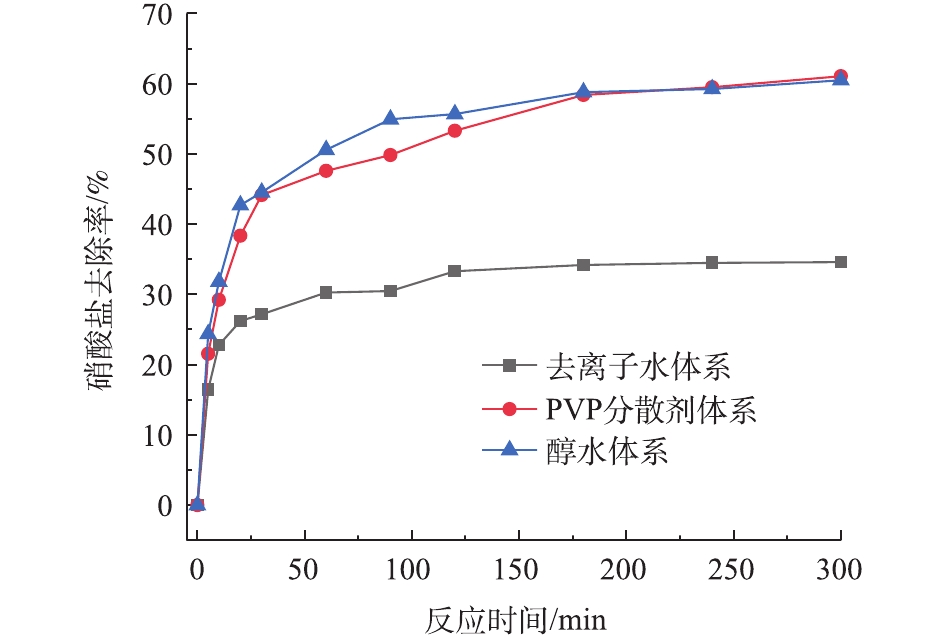
1)溶剂体系的影响。图1为在不同溶剂体系中制备的零价铁-生物炭复合材料对水中硝酸盐去除效果的影响。由图1可见,在不同溶剂体系中,复合材料在前10 min对硝酸盐的去除率差别不大,但10 min后呈现出明显的差别,且去除率由大到小排列依次是PVP分散剂体系、醇水体系以及去离子水体系。这是由于零价铁作为磁性材料,在溶液中进行反应时容易受到磁力影响,从而团聚成较大的颗粒,导致材料的比表面积变小和迁移性能下降,进而对硝酸盐的去除能力有所降低[16]。在醇-水体系中,乙醇会吸附在固-液界面上,形成一层阻碍颗粒团聚的溶剂化膜,增加了颗粒的稳定性[17]。而PVP作为高分子表面活性剂,其可在颗粒表面形成吸附层,降低固-液间的表面张力,使颗粒表面易于湿润,从而增加固体颗粒带电量,提高颗粒间的反作用力,防止颗粒间的团聚,进一步提高复合材料的降解效果。故本实验在制备复合材料时,使用PVP分散剂体系作为材料制备的溶剂体系。
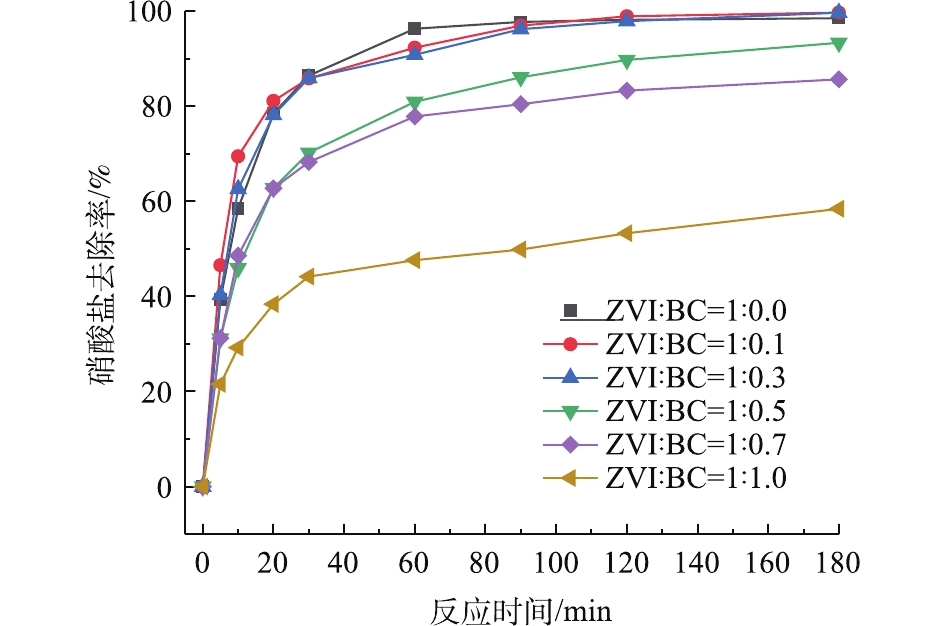
2)生物炭与零价铁质量比的影响。为了考察了不同生物炭与零价铁质量比例对所制备复合材料去除硝酸盐性能的影响,共设置了6个不同的比例(ZVI∶BC=1∶0.0、1∶0.1、1∶0.3、1∶0.5、1∶0.7、1∶1.0)。由图2可知,当ZVI∶BC=1∶0.1和1∶0.3时,复合材料对硝酸盐的去除率分别为99.70%和99.66%,均大于ZVI∶BC=1∶0时对应的去除率(98.49%),这说明生物炭的加入在一定程度上避免了零价铁的团聚,从而保证了复合材料的反应活性。此外,在ZVI∶BC=1∶0.1、1∶0.3的条件下,其对硝酸盐的去除速率和去除量十分接近,这与WU等[18]的研究结果是一致的。这表明当生物炭与零价铁的质量比小于0.3时,复合材料所提供的活性点位已经能够满足对硝酸盐的还原反应。值得注意的是,当生物炭与零价铁的质量比大于0.3时,复合材料对硝酸盐的去除率呈下降趋势。这表明复合材料对硝酸盐的去除主要依靠零价铁的还原性,而生物炭的吸附作用较弱;同时活性炭在复合材料占有较大比例时,复合材料的比表面积会变小,硝酸盐还原的活性位点变少,复合材料降解硝酸盐的能力会有所下降[19]。因此,在进一步的研究和实际工程应用中,选择合适的负载质量比具有十分重要的意义。由于去除率在生物炭与零价铁的质量比为0.1或0.2时最高,考虑到实验耗材的问题,本研究在制备复合材料时选择纳米零价铁与生物炭的质量比为1∶0.1。
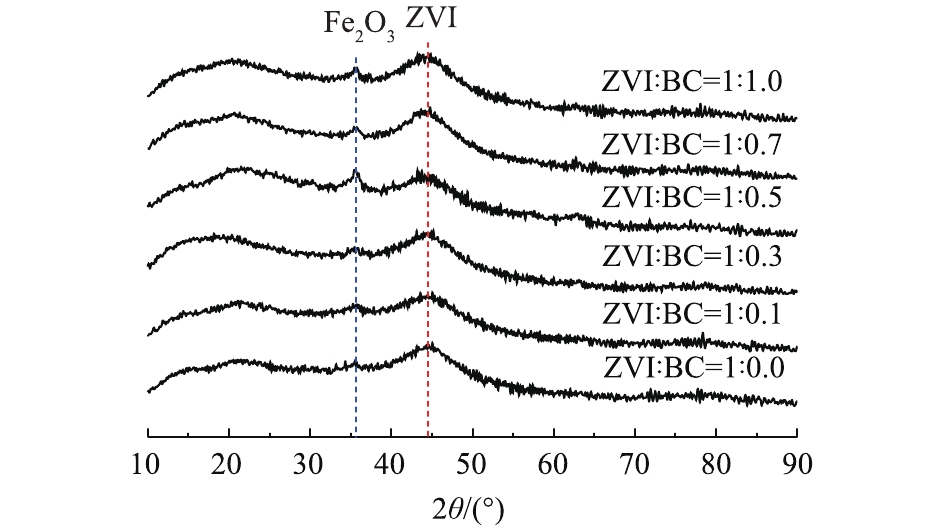
为了更好地了解复合材料的晶型,对不同零价铁与生物炭质量比的复合材料进行了XRD表征,结果如图3所示。在15°~30°出现了宽而缓的弥散衍射峰,这与郑庆福等[20]的研究结果相符合。这说明有机结晶化合物经过炭化后,变为更细,且具有石墨化结构的微晶炭,同时炭化过程会因失水或裂解会析出大量的盐分。在2θ=44.8°处出现了零价铁的特征衍射峰,可以观察到随着零价铁与生物炭质量比的上升,特征衍射峰峰面积变大。同时可以观察到2θ=35.7°处出现了衍射峰,这是由于在制备过程中,有少量的材料被氧化成了Fe2O3。
-
1)扫描电子显微镜(SEM)表征。为了更好地对复合材料的表面形貌进行分析,对复合材料进行了SEM表征。由图4可见,零价铁呈现颗粒状,生物炭则以片状的形态堆叠。零价铁分布在生物炭的表面以及生物炭之间的空隙中,生物炭的存在使得零价铁彼此分散,只有少量零价铁发生了团聚。
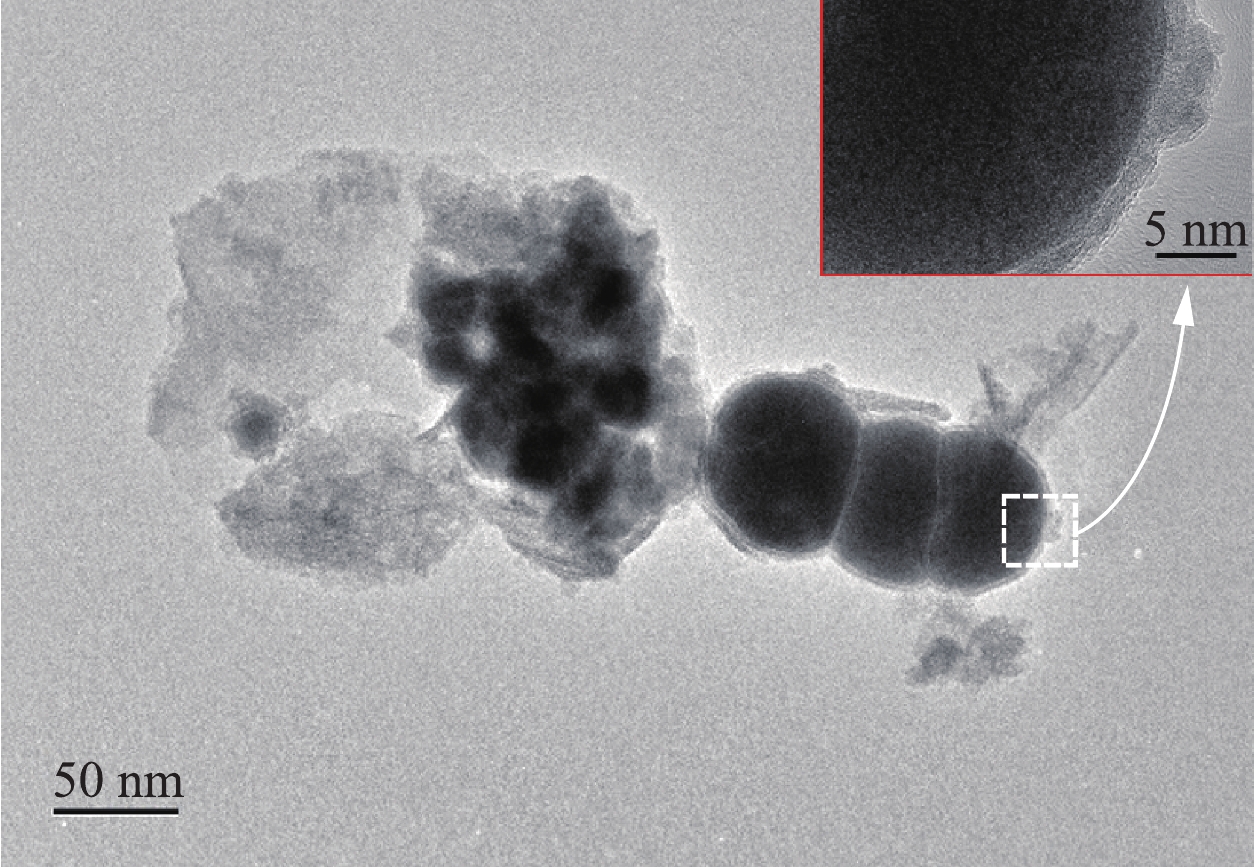
2)透射电镜(TEM)表征。为了观察生物炭与零价铁的结合情况,对复合材料进行了TEM测试。由图5可见,部分零价铁颗粒分散在片状活性炭表面,另一部分零价铁成链状接连在一起,同时可以注意到成链状的零价铁颗粒表面附有一层灰色的薄膜,这是由于在材料制备与测试过程中,零价铁与空气发生了氧化作用,从而被氧化成了Fe2O3。
3) X射线光电子能谱(XPS)表征分析。为了分析零价铁-生物炭复合材料的元素组成及其价态,对复合材料进行了XPS分析。XPS表征结果表明,材料不仅有铁元素和碳元素(图6(a)),还包含了氧元素和氮元素。氮元素的出现与李同燕等[21]的研究结果一致,在使用未处理的农业废弃物制备生物炭时,会释放含氮化合物。由Fe2p的XPS(图6(b))表征结果可见,Fe以不同价态存在,2个主峰分别处于711.48 eV和725.18 eV,其代表了FeO和Fe2O3 2种化合物。2种铁氧化物的出现说明材料不可避免的暴露在了含氧环境中,从而被氧化形成了氧化膜。
-
1)硝酸盐初始浓度的影响。图7展示了不同硝酸盐初始浓度对硝酸盐去除率的影响。由图7可以看出,当初始硝酸盐浓度分别为20、40、60、80和100 mg·L−1时,复合材料在前5 min对硝酸盐的去除速率几乎相同,但在5 min后,初始硝酸盐浓度大于60 mg·L−1的组别中的硝酸盐去除速率明显下降。这是由于复合材料对硝酸盐的去除主要依靠零价铁与硝酸盐发生的还原作用。在零价铁-生物炭复合材料投加量一定时,复合材料具有的反应活性位点对低浓度条件下的
NO−3 更加充足,但在高浓度条件下,NO−3 无法立即与有限的复合材料相接触,被吸附的NO−3 需要被还原后,才能进一步被复合材料吸附,因此,在5 min后表现出初始浓度越高,反应速率越低的现象。值得注意的是,随着初始硝酸盐浓度的增加,硝酸盐去除速率有明显下降,这是因为在NO−3 被还原的过程中,会产生氢氧化铁和氧化铁等副产物,其可包裹在复合材料表面,并且初始NO−3 浓度越高,这类物质生成的越多,影响了反应的进行[22]。2)反应体系初始pH的影响。为探究pH对降解效果的影响,调节初始pH为3~11,考察pH对所制备的复合材料的降解性能。由图8可见,当pH=3、5和7时,复合材料在前10 min对硝酸盐的去除速率基本一致,达到了48%~49%;但在pH=9和11时,复合材料对硝酸盐的去除率只有39%和32%。在10 min之后,不同初始pH体系中复合材料对硝酸盐的去除效果发生了明显的变化,pH越大,硝酸盐去除率越低,且达到反应平衡的时间越长。这与之前对纳米铁的研究结果相似,零价铁对硝酸盐的还原属于酸驱动反应。在酸性条件下,溶液中氢离子较多,能与零价铁表面形成的氧化物和氢氧化物反应,使得零价铁能一直与硝酸盐接触反应[23]。碱性条件下,零价铁与硝酸盐的反应会生成OH−,从而使得反应体系的pH迅速升高,反应过程中还会产生二价和三价的铁离子,其可与OH−结合生成氢氧化物,且包裹在零价铁颗粒表面,阻碍了零价铁与硝酸盐的接触反应,因此,在10 min后,对硝酸盐的去除速率下降。虽然pH的变化对复合材料去除水中硝酸盐会产生一定的影响,但在180 min后,硝酸盐基本可去除完全,所以将所制备的材料运用到不同环境的地下水时,可忽略pH对其的影响。
3)复合材料投加量的影响。图9探讨了零价铁-生物炭复合材料在去除水中硝酸盐的适宜投加量。由图9可知,当零价铁-生物炭复合材料投加量为0.5、1和1.5 g·L−1时,均不能完全去除水中硝酸盐,而当复合材料投加量为3.0 g·L−1和4.0 g·L−1时,对硝酸盐的去除率基本一致,分别达到了97.71%和99.79%,同时两者的去除速率也大致相同。这说明零价铁-生物炭复合材料投加量为3.0 g·L−1时,复合材料能反应的硝酸盐的量已接近饱和。RODRIGUEZ-MAROTO等[24]的研究表明,复合材料表面的零价铁提供了反应的活性位点,随着反应的进行,材料表面的零价铁会被氧化生成成氧化物或氢氧化物,从而阻碍反应的继续进行,因此,增加材料的投加量可以弥补被氧化物或氢氧化物覆盖的反应活性位点,进而增加了对硝酸盐的去除率。同时,随着复合材料投加量的增加,在同一反应时间内,相应的活性反应位点的数量也相对增加,因此,出现了在反应初期投加的零价铁-生物炭复合材料越多,硝酸盐去除速率越高的现象。
4)反应体系温度的影响。图10为反应体系中温度对硝酸盐去除率的影响结果。由图10可见,前10 min内反应速率基本一致,但在10 min过后,反应速率出现了变化,当反应体系温度越高时,硝酸盐的去除速率越高。在反应时间为180 min、温度为25 ℃的反应体系中,硝酸盐已基本去除,反应已接近平衡,但在温度为20、15和10 ℃的反应体系中,硝酸盐的去除率仅有88.05%、80.01%及75.65%。这是因为随温度的升高,反应速率也会增加。根据范特贺夫定律,在一定范围内,温度每升高10 ℃,生化反应的速率会增加2~3倍,但在本实验中,只有25 ℃和10 ℃的反应速率接近2倍。这是由于零价铁-生物炭复合材料对水中硝酸盐的去除过程中,不仅有化学还原作用,还存在生物炭对硝酸盐的吸附作用,并且吸附效果是随着温度的上升而下降的。考虑到实际工程中地下水的温度一般情况下在15 ℃以上,因此,使用所制备的复合材料去除地下水中的硝酸盐是有效可行的。
-
1)动力学分析。为了更好地了解硝酸盐的去除行为,采用准一级动力学方程、准二级动力学方程对不同初始硝酸盐浓度条件下的降解数据进行拟合,所得动力学参数见表1。图11(a)和图11(b)分别是准一级反应动力学模型、准二级反应动力学模型的拟合结果。由图11(a)、图11(b)和表1可以看出,准一级和准二级反应动力学模型只有在硝酸盐浓度低,即复合材料(ZVI∶BC=1∶0.1)占比较大时拟合度更好,说明零价铁-生物炭复合材料去除水中硝酸盐只有在复合材料与污染物质量比较大时才能符合准一级反应。当用二级反应来模拟还原反应时,反应速率明显下降,因此,不能单纯使用反应级数来描述该反应过程。
2)氮平衡分析。为了探讨复合材料(ZVI∶BC=1∶0.1)在去除硝酸盐过程中三氮的变化规律,基于影响因素探讨结果以及实际的地下水硝酸盐污染环境,设置了模拟污染液硝酸盐浓度为60 mg·L−1、反应温度为25 ℃、复合材料投加量为1.5 g·L−1、反应体系初始pH=6、振荡速度为220 r·min−1,将复合材料投入污染液后,在一定时间间隔取样测定总氮、硝酸盐、亚硝酸盐以及氨氮的浓度,实验结果如图12所示。由图12可见,在零价铁-生物炭复合材料对硝酸盐的去除过程中,能检测到的亚硝酸盐含量很少,最高仅为0.8 mg·L−1,并且在60 min时已经检测不到其存在。这可能是由于亚硝酸盐只是硝酸盐被还原为氨氮的中间产物,不会在还原过程中稳定存在,故在此不对亚硝酸盐进行讨论。在利用零价铁-生物炭复合材料去除水中硝酸盐的过程中,可以发现硝酸盐的去除速率大于氨氮的生成速率,这是由于2种物质的反应存在一定的先后顺序,硝酸盐首先被吸附在复合材料的表面,在表面被零价铁还原后产生氨氮,且材料对硝酸盐的吸附速率是快于与硝酸盐反应的速率。总氮的含量在前30 min出现了先下降再上升的情况,这也说明了零价铁-生物炭复合材料对硝酸盐的去除为先吸附而后降解的过程。在反应结束后,70%以上被去除的硝酸盐被纳米零价铁还原为了氨氮,说明氨氮是纳米零价铁还原硝酸盐的主要产物,这一结果与前人的研究结果[25-26]相符。值得注意的是,在实验结束后,总氮含量下降了约13%,由于实验条件的限制,本实验未在反应过程中进行气体的收集。在现有研究中,对此现象有着不同的解释:HWANG等[27]在使用纳米铁去除硝酸盐的过程中发现,随着反应体系pH的升高,铵根离子伴随着机械搅拌会以氨气形式排出溶液;CHOE等[28]的研究发现,纳米铁还原硝酸盐的最终产物为N2,没有氨氮的生成。
3)反应前后复合材料(ZVI∶BC=1∶0.1)XRD表征分析。为了探讨反应前后零价铁-生物炭复合材料的变化情况,对反应前后的复合材料(ZVI∶BC=1∶0.1)分别进行了表征。由图13可见,在2θ=15°~30°处出现了宽而缓的弥散衍射峰,这是具有石墨化结构微晶炭的衍射峰,2θ=44.8°为零价铁的弥散衍射峰。其中,2θ=15°~30°处的衍射峰在反应前后未发生明显变化,说明生物炭未直接参与反应,而2θ=44.8°处的衍射峰在反应过后消失,说明反应过程消耗了零价铁。结合图谱可知,新出现的衍射峰2θ=30.4°、35.7°、43.4°、53.8°和62.9°,其分别对应了氧化铁的(012)、(110)、(113)、(116)、(214)衍射峰,所以复合材料中的零价铁主要被氧化成了Fe2O3[29]。
在实验中严格控制了无氧环境,RYU等[30]的研究表明,在无氧和厌氧环境下,Fe0先被氧化成Fe2+,因为pH的上升会形成Fe(OH)2,接着被氧化成Fe2O3,基于上述对反应途径的分析,零价铁-生物炭复合材料去除水中硝酸盐的过程如式(1)~式(3)所示。
-
1)在零价铁-生物炭复合材料的制备过程中,以硝酸盐的去除率考察材料的性能,当选择PVP分散剂作溶剂和ZVI∶BC=1∶0.1时,复合材料对硝酸盐的去除效果最佳。
2) XRD分析表明,随着零价铁与生物炭质量比的增加,零价铁的特征衍射峰峰面积越大。SEM和TEM表征均显示颗粒状的零价铁零散地负载在片状的生物炭表面,只有少量的零价铁发生了团聚。同时零价铁的表面存在一层灰色氧化膜,经XPS表征分析表明,该层灰色氧化膜为FeO和Fe2O3。
3)通过ZVI-BC复合材料对水中硝酸盐的去除研究发现,初始浓度越大,反应初期硝酸盐去除速率越慢;复合材料投加量为3 g·L−1时,有着最佳的硝酸盐去除效果;反应体系的pH对复合材料去除硝酸盐影响不大;反应体系的温度为25 ℃,反应时间为180 min,复合材料对硝酸盐的去除能达到平衡。
4)零价铁-生物炭复合材料与硝酸盐反应的最终产物以氨氮为主。反应终止时,总氮含量减少了约13%,可能是硝酸盐在反应过程中转化成了氮气或氨气,对此还需后续研究来做进一步分析。反应前后复合材料XRD分析表明,复合材料中的零价铁在反应后主要被氧化成了Fe2O3。
零价铁-生物炭复合材料对地下水中硝酸盐的去除
Nitrate removal from groundwater by zero-valent iron-biochar composites
-
摘要: 为了解决我国日益严重的地下水中硝酸盐污染问题,采用液相还原法制备了零价铁-生物炭复合材料(ZVI-BC)。研究了不同制备条件对ZVI-BC合成的影响,并通过X射线衍射(XRD)、电子扫描显微镜(SEM)、透射电镜(TEM)和X射线光电子能谱(XPS)对优选制备条件下所合成的复合材料进行了表征分析。在严格控制厌氧环境的基础上,考察了初始pH、初始硝酸盐浓度、复合材料投加量和反应温度对复合材料去除水中硝酸盐效率的影响,并从动力学、氮平衡等方面初步探讨了零价铁-生物炭复合材料还原硝酸盐的途径。结果表明:复合材料的优选制备条件为聚乙烯吡络烷酮K30(PVP)作溶剂、ZVI∶BC=1∶0.1,通过对在优选制备条件下得到的零价铁-生物炭复合材料的SEM表征,发现成链状连接的零价铁颗粒负载在层状分布的生物炭表面,其对硝酸盐具有良好的去除效果;初始硝酸盐浓度越大,则反应初期硝酸盐去除速率越慢,硝酸盐的去除率越低;硝酸盐去除率随复合材料投加量的增加而有所升高;反应体系中的pH对复合材料降解硝酸盐的影响不大;反应体系的温度越高,硝酸盐去除速率越快;硝酸盐去除过程不能单纯的使用反应级数来表示,硝酸盐反应的最终产物主要为氨氮。生物炭负载零价铁有效的减少了零价铁的团聚,进一步促进了硝酸盐的去除,在地下水硝酸盐的去除中具有良好的应用前景。Abstract: In order to solve the problem of increasingly serious nitrate pollution in groundwater of China, zero-valent iron-biochar composites (ZVI-BC) were prepared by liquid phase reduction. The effects of different preparation conditions on the synthesis of ZVI-BC were studied, and the composites synthesized under the optimal preparation conditions were characterized by X-ray diffraction (XRD), electron scanning microscope (SEM), transmission electron microscope (TEM) and X-ray photoelectron spectroscopy (XPS). Under the strictly anaerobic environment condition, the effects of initial pH, initial nitrate concentration, composite dosage and reaction temperature on the removal efficiency of nitrate in water were investigated. The ways of reducing nitrate by zero-valent iron-biochar composites were preliminarily discussed from the aspects of kinetics and nitrogen balance. The results show that the preferred preparation conditions of the composites were following: polyvinylpyrrolidone K30 (PVP) as solvent and ZVI∶BC=1∶0.1. The SEM images of the composites obtained under the optimized preparation condition showed that the zero-valent iron particles with chain-like connection were loaded on the surface of biochar with lamellar distribution structure, having a good removal performance for nitrate. The higher the initial concentration, the slower the nitrate removal rate at the initial stage of the reaction, the lower the nitrate removal rate. The removal rate of nitrate increased with the increase of composites dosage. The pH of the reaction system had slight effect on nitrate removal by the composites, and the higher the temperature of the reaction system, the faster the nitrate removal rate. The nitrate removal process could not be simply expressed by the use of reaction series, and ammonia nitrogen was the main final product of nitrate reaction. Biochar loaded with zero-valent iron could effectively reduce the agglomeration of zero-valent iron and further promote the removal of nitrate, which has a good application prospect in the removal of nitrate from groundwater.
-
Key words:
- zero-valent iron /
- biochar /
- nitrate /
- groundwater
-
赤泥是铝土矿提取氧化铝过程中产生的一种盐碱化副产物[1]。全球每年产生赤泥 (1.2~1.5)×108 t,截至2020年,全球赤泥库存已达40×108 t[2]。尽管目前已有不少关于赤泥综合利用的尝试,如有价金属回收、开发建筑材料、环境修复等,但全球的赤泥利用率仍不足10%[3],这将导致大量的赤泥只能通过筑坝堆存[4]。由于赤泥具有高盐碱性、腐蚀性、浸出毒性等不良特性,其在堆存过程中易对周边水体、土壤、植被等造成严重破坏[5]。例如,赤泥中的碱性物质迁移至水体和土壤环境会对水生动物和植物产生毒性,从而抑制其正常生长甚至导致其死亡[6-7]。我国是全球最大的氧化铝生产和消费国[8],氧化铝生产过程中产生的大量赤泥堆存造成的环境安全问题已严重制约氧化铝工业的可持续发展[9]。因此,消除赤泥的潜在环境风险刻不容缓。
近年来,植被恢复已成为消除赤泥潜在环境风险的有效途径[10]。由于赤泥具有碱性强、养分贫瘠、物理结构差等极端立地特征,致使在赤泥堆场上成功开展植被恢复较为困难[11]。采取基质改良措施将赤泥转化为类土基质是决定赤泥堆场能否成功开展植被恢复的关键[12]。其中,团聚体是指示赤泥土壤化的重要指标,其作为最基本的土壤系统单元活跃地参与地球表层生态系统过程[13-14]。团聚体对土壤的物理、化学和生物过程起着关键的调控作用。目前,关于不同类型有机-无机改良剂对赤泥理化性质、微生物特性、团聚体结构与稳定性影响的研究已有较多报道[15-17]。
研究表明,由于不同粒径团聚体颗粒与有机物和矿物质的结合方式不同[18],致使不同粒径团聚体中酶活性、微生物群落分布存在空间分异性[19],进而影响团聚体中养分的分布及其生物有效性。赤泥团聚体结构及其有机碳分布受风化过程和植被的影响[20],但关于改良剂与植被联合修复对赤泥团聚体中养分、酶活性、微生物空间分异特征影响的研究鲜有报道,这将制约对赤泥土壤化过程中养分生物地球化学过程以及能否在赤泥上成功建立稳定植被群落的认识。本研究拟通过开展盆栽修复实验,探究改良剂与植被联合修复下赤泥团聚体中养分、酶活性、微生物群落的空间分异特征及其彼此间的关系,旨在为深入理解改良剂与植被联合修复下赤泥土壤化过程中养分迁移转化特征及其潜在影响机理提供参考。
1. 材料与方法
1.1 实验材料
2021年7月在位于贵州省清镇市站街镇的贵州广铝铝业有限公司的赤泥堆场 (106°20′15″E,26°39′36″N) 采集赤泥样品。将采集的新鲜赤泥自然风干后去除杂物,研磨过2 mm筛备用。木醋液pH为2.99、电导率 (EC) 为4.57 mS·cm−1;磷石膏采自贵州省福泉市瓮福磷石膏堆场,其组分为CaSO4·2H2O;菌渣采自某食用菌生产基地;鱼粪采自某水产养殖基地;黑麦草种子购于某园林公司。赤泥与改良剂的理化性质见表1。
表 1 赤泥与改良剂的理化性质Table 1. Physicochemical properties of bauxite residue and amendments供试材料 pH EC/(mS·cm−1) 全氮/(g·kg−1) 全磷/(g·kg−1) 有机质/(g·kg−1) 有效氮/(mg·kg−1) 有效磷/(mg·kg−1) 速效钾/(mg·kg−1) 赤泥 10.86 1.00 0.14 2.30 7.81 1.59 3.98 595 磷石膏 5.24 2.44 0.14 3.80 2.90 7.72 57.25 85.20 鱼粪 6.48 3.23 1.40 56.13 61.20 275.58 212.08 880.00 菌渣 4.66 5.48 1.40 3.80 55.30 310.99 648.15 6 206.00 1.2 实验设计
共设5个处理组:1) 赤泥+纯水+黑麦草 (R) ;2) 赤泥+2%木醋液+2%磷石膏+5%菌渣+5%鱼粪+黑麦草 (RA1) ;3) 赤泥+2%木醋液+5%磷石膏+5%菌渣+5%鱼粪+黑麦草 (RA2) ;4) 赤泥+5%木醋液+2%磷石膏+5%菌渣+5%鱼粪+黑麦草 (RA3) ;5) 赤泥+5%木醋液+5%磷石膏+5%菌渣+5%鱼粪+黑麦草 (RA4) 。每个处理设置3个平行。不同体积分数的木醋液为其原液用去离子水稀释所得。磷石膏、菌渣、鱼粪的添加量为赤泥质量的占比。赤泥盆栽修复实验方法为:分别称取1 500 g赤泥置于一系列塑料 (口径和高度分别为20、17 cm) ,按液固比为1∶2.5分别添加不同体积分数的木醋液和纯水对赤泥进行碱性调控,稳定陈化3 d后,再分别添加不同改良剂 (磷石膏、菌渣、鱼粪) 与赤泥混合均匀。每盆播种黑麦草种子50粒,定期浇水,维护植物生长 (其中,对照组中黑麦草未正常发芽) ,于室外遮雨棚中培养90 d后,采集各处理组的赤泥样品。采用干筛法[21]将赤泥筛分为1~2 mm、0.5~1 mm、0.25~0.5 mm、<0.25 mm的团聚体。将获得的赤泥团聚体样品分为3部分,一部分保存于−80 ℃冰箱用于分析微生物群落组成及多样性,一部分置于4 ℃冰箱保存用于测定酶活性,一部分于室内自然风干、研磨过筛后用于测定有机质与养分质量分数。
1.3 主要测试指标及测定方法
赤泥团聚体养分与有机质质量分数参照鲁如坤[22]的方法测定,采用酶试剂盒 (购自苏州科铭生物技术有限公司) 并参照关松荫等[23]的方法测定赤泥团聚体酶活性。将赤泥样品送至上海某检测公司测定微生物群落组成及多样性,测定方法的概述详见参考文献[24]。
1.4 数据处理
采用SPSS 22.0对各处理组进行单因素方差分析 (One-Way ANOVA) ,各组间多重比较采用LSD法,显著水平为P<0.05;采用Origin 2021作图。微生物数据分析方法参考TAN等[24]的研究。
2. 结果与讨论
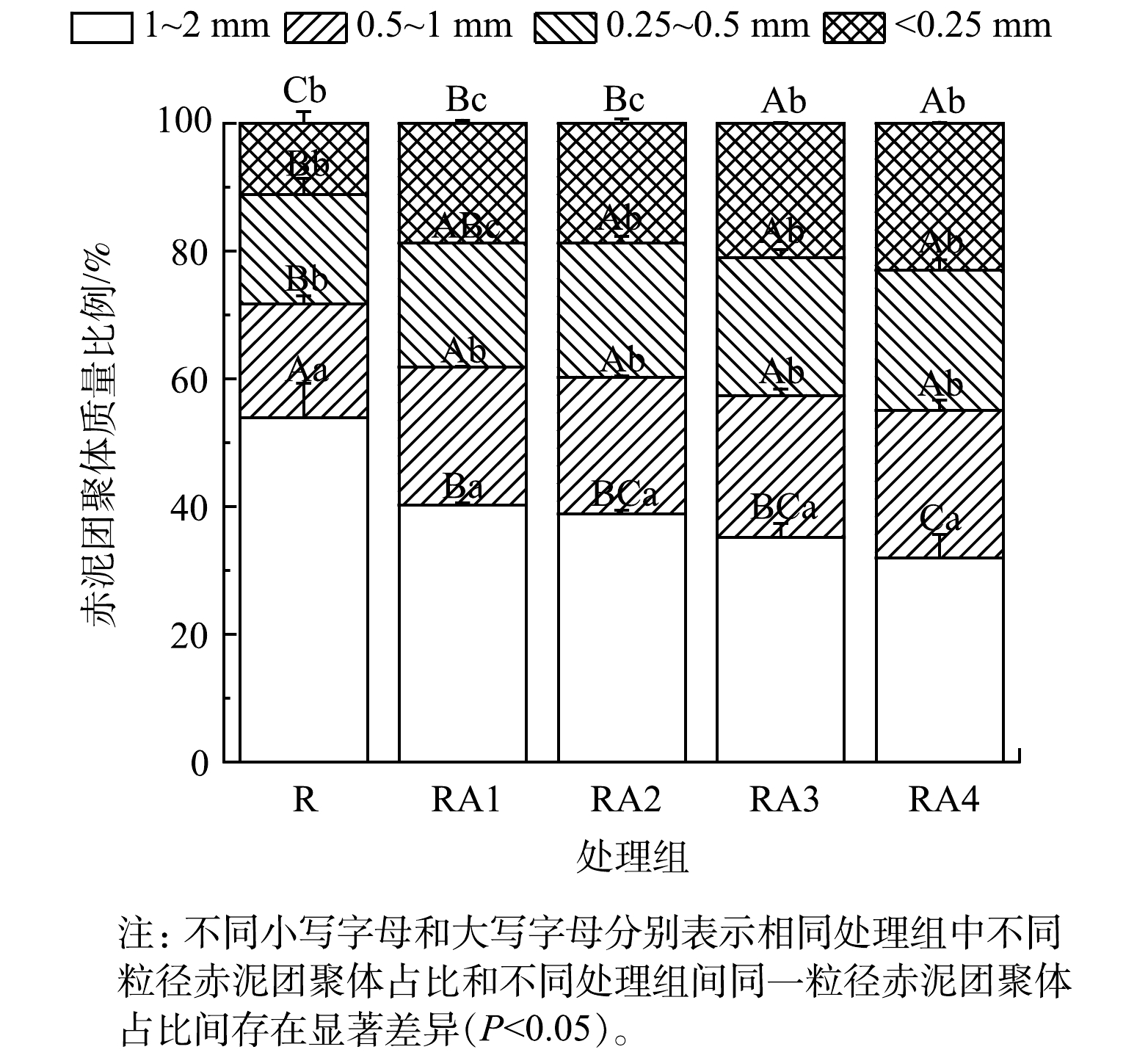
2.1 改良剂与植被联合修复对赤泥团聚体组成特征的影响
赤泥团聚体组成特征见图1。R组团聚体粒径主要集中在1~2 mm,大团聚体 (2~0.25 mm) 与微团聚体 (<0.25 mm) 占比分别为87.27%、10.89%。与R组相比,RA1、RA2、RA3、RA4处理组大团聚体 (2~0.25 mm) 占比分别降低至80.42%、79.78%、78.17%、75.84%,微团聚体 (<0.25 mm) 占比分别增加至18.56%、18.41%、20.77%、22.64%。总体上,大团聚体占比均高于微团聚体,其原因可能包括:有机改良剂及植物根系分泌物中新鲜有机碳胶结形成的不稳定大团聚体易破坏为微团聚体[25];随着赤泥生境的改善,微生物群落及酶活性增加促进赤泥中输入的有机物分解,导致大团聚体稳定性丧失,释放稳定的微团聚体[26-27]。同时,由于赤泥中交换性Na+的半径较小,导致其具有较大的水合半径,造成水合斥力增大,从而使胶粒间引力减弱,破坏赤泥团聚体结构[28-30]。赤泥中Fe3+的还原[31]、植物根系的破坏[32]和植物细根与菌丝形成核的分解[33]也可能导致微团聚体的形成。
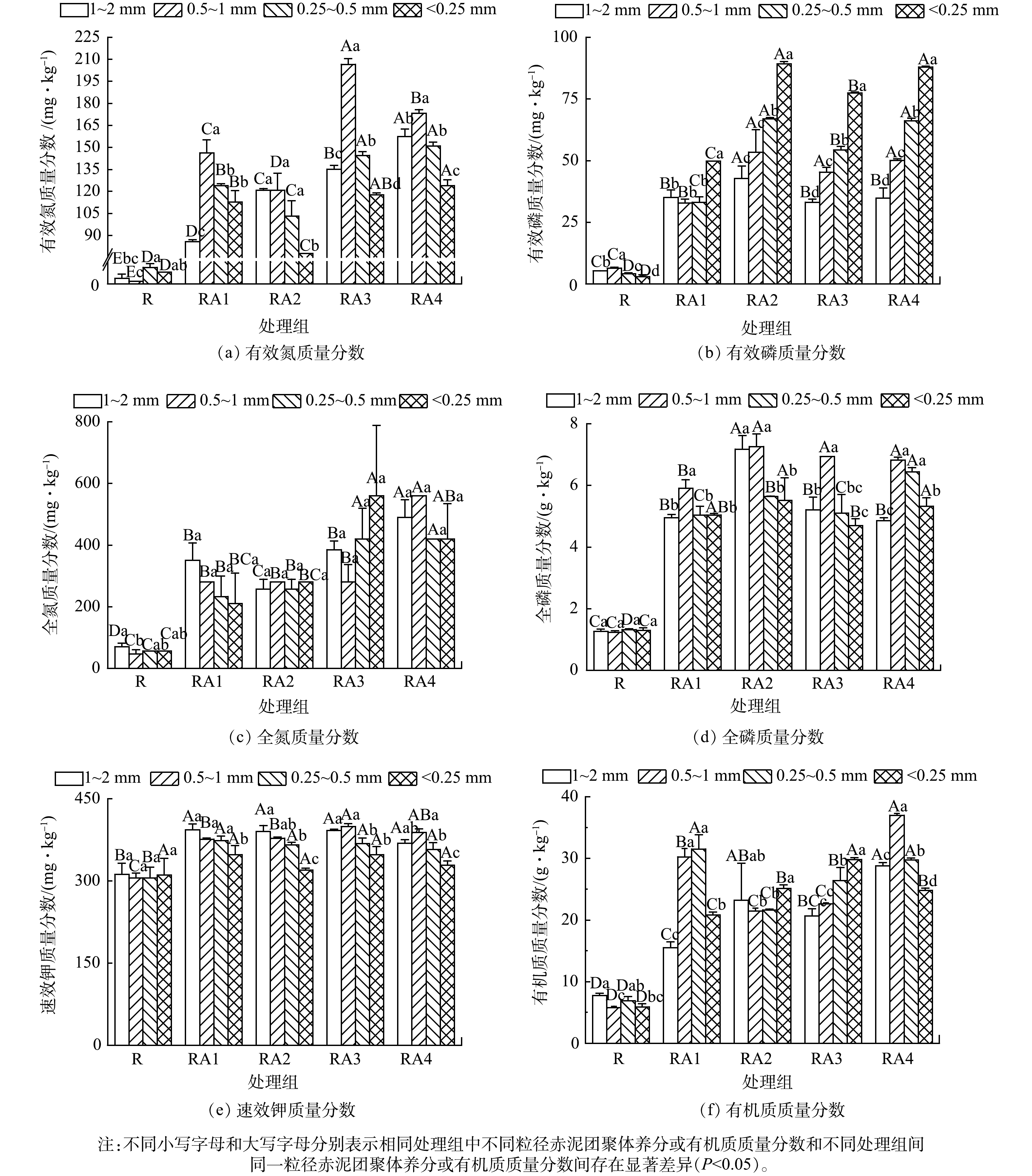
2.2 改良剂与植被联合修复对赤泥团聚体中养分及有机质质量分数空间分异特征的影响
赤泥团聚体中养分及有机质质量分数空间分异特征见图2。与R组相比,RA1、RA2、RA3、RA4处理组中不同粒径团聚体的养分质量分数显著增加,有效氮、有效磷、全氮、全磷、速效钾、有机质的质量分数分别增加8.29~129.00、4.17~29.39、2.67~11.00、2.61~4.89、0.03~0.31、1.00~5.38倍。整体上,有机质主要分布于<1 mm团聚体 (图2(f)) ,这是由于小粒径团聚体中吸附的大量有机质通过胶结作用附着在大团聚体表面[34-35],由于1~2 mm团聚体易受破坏,增加<1 mm团聚体的质量比例,导致有机质主要分布于<1 mm团聚体。有效氮、有效磷、全氮、全磷、速效钾等亦主要分布于<1 mm团聚体 (图2(a)~图2(e)) ,其原因可能是由于微生物的分解转化过程造成营养物质分布的差异[36]。此外,有机质的矿化作用也是增加团聚体中氮、磷、钾质量分数的重要原因[37]。全磷 (图2(d)) 、有效磷 (图2(b)) 分别主要分布在0.5~1 mm、<0.25 mm团聚体中,2者分布特征存在差异可能与赤泥微团聚体中高浓度的铁铝氧化物吸附磷素并增加磷的有效性有关[38-39]。整体上,养分及有机质主要分布于<1 mm团聚体。
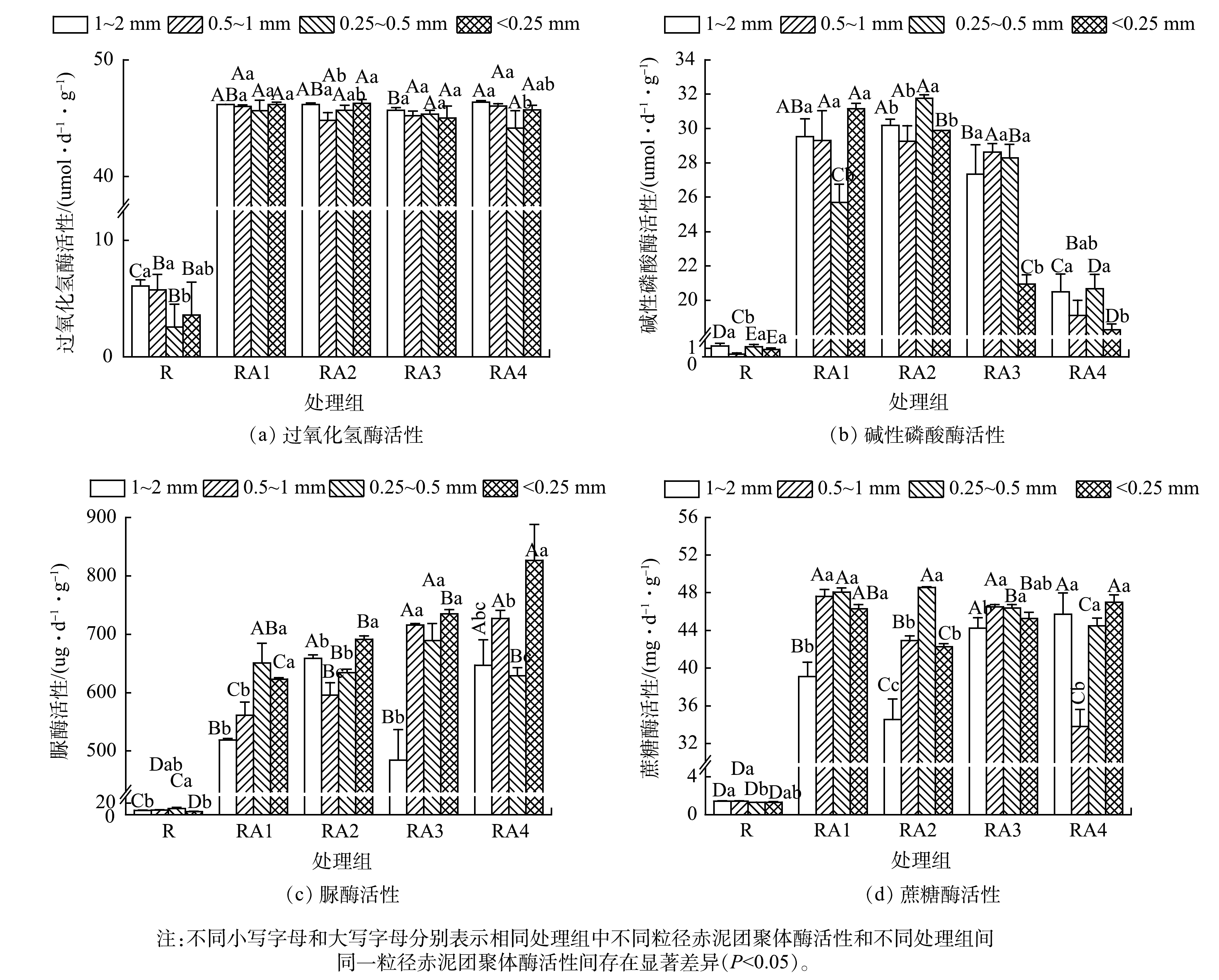
2.3 改良剂与植被联合修复对赤泥团聚体酶活性空间分异特征的影响
赤泥团聚体中酶活性空间分异特征见图3。与R组相比,其它处理组中各粒径团聚体的酶活性总体上均有不同程度的增加。过氧化氢酶活性在1~2 mm、<0.25 mm团聚体中较高 (图3(a)) ;碱性磷酸酶和脲酶活性分别在0.25~0.5 mm和<0.25 mm团聚体中最高;蔗糖酶活性在0.25~1 mm、<0.25 mm团聚体中较高。总体上,<1 mm团聚体中的酶活性最高。其原因可能是改良剂和植物改善赤泥养分质量分数及微环境并促进微生物生长[40],而不同粒径团聚体中微生物的分布差异也会调控酶活性的分布特征。此外,植物根系是土壤酶的来源之一,也会对酶活性造成影响[41]。与WANG等[42]的研究结果 (微团聚体的酶活性较低) 不同的是,本研究中酶活性最低的情形大多集中于>0.25 mm团聚体,这可能与微团聚体质量比例增加或微团聚体质量分数偏多有关。
2.4 改良剂与植被联合修复对赤泥团聚体中微生物群落空间分异特征的影响
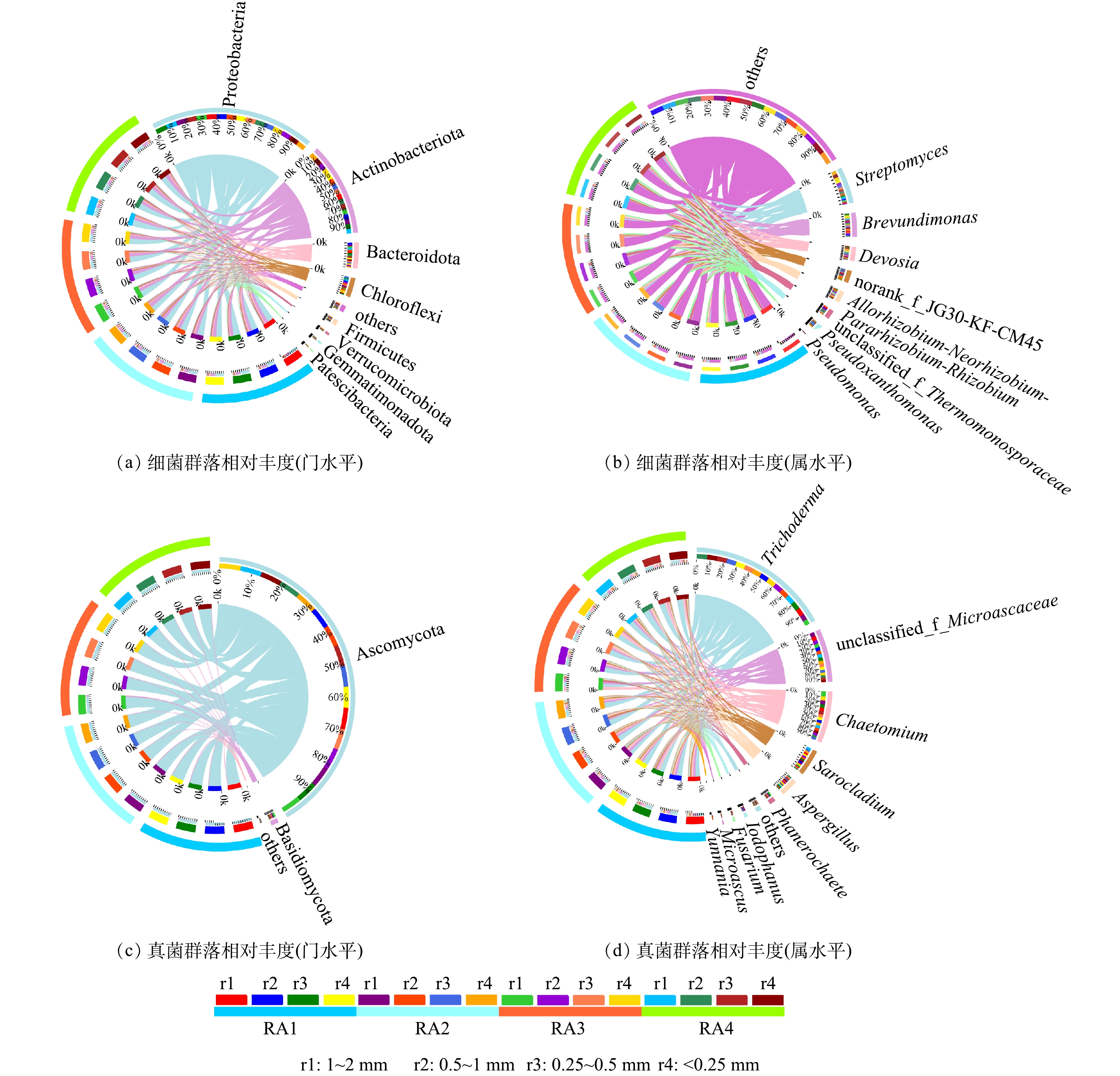
1) 改良剂与植被联合修复对赤泥团聚体微生物群落多样性空间分异特征的影响。赤泥团聚体微生物群落多样性见表2和表3。单个样本的覆盖率均大于99%,表明测序结果能真实地反映赤泥样品中的细菌和真菌群落。R组无微生物群落检出,其原因可能是新鲜赤泥的极端生境导致微生物无法生存,这与李辉等[43]的研究结果 (新鲜赤泥中微生物数量极少导致有效序列数过低) 相同。相比R组,其他处理组中细菌的Alpha多样性指数均不同程度增加。整体上Shannon指数在<1 mm团聚体中最高。Simpson指数在<0.25 mm的团聚体中最高,在1~2 mm团聚体中最低。Ace和Chao1指数在<1 mm团聚体中最高,而在1~2 mm团聚体最低。真菌Shannon指数主要在1~2 mm团聚体中最高,在<0.25 mm团聚体中最低。真菌Simpson指数则主要在0.25~0.5 mm团聚体最高。真菌Ace和Chao1指数在0.5~2 mm团聚体中均最低,但在0.25~0.5 mm团聚体中最高。由此可见,改良剂与植被联合修复主要增加了<1 mm团聚体中微生物群落多样性与物种丰富度,其原因可能是由于不同粒径赤泥团聚体中微生物群落分布受养分分布特征的影响。LIAO等[19]研究也表明,不同粒径土壤团聚体中养分分布不均匀,为微生物提供空间上不均匀的微生境。此外,由于团聚体周转[27, 36]会造成大粒径团聚体外部的微生物脱落至较小粒径团聚体中。
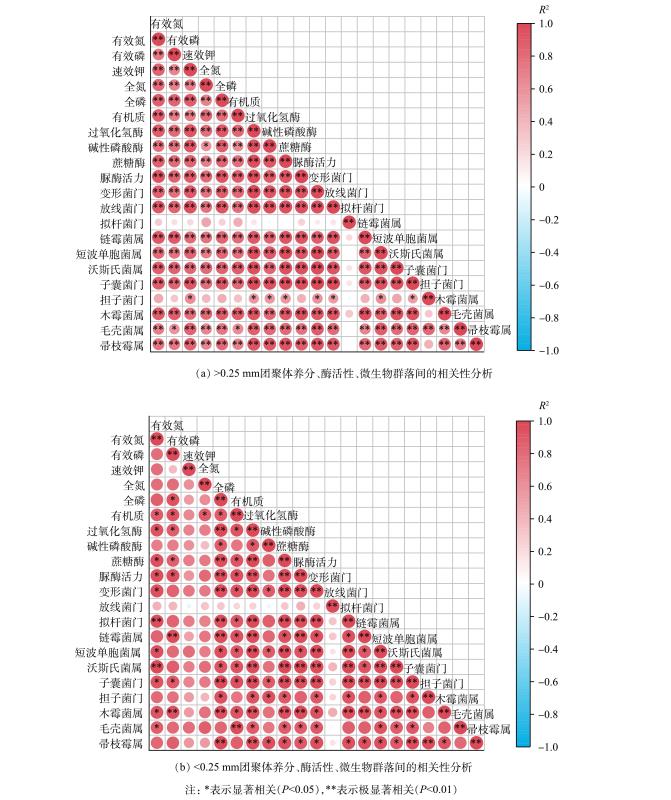
表 2 赤泥团聚体细菌群落多样性和丰富度指数Table 2. The diversity and richness indices of bacterial community in the aggregates of bauxite residue处理组 粒径/mm 群落多样性 群落丰富度 Coverage Shannon Simpson Ace Chao1 R 1~2 0 0 0 0 0 0.5~1 0 0 0 0 0 0.25~0.5 0 0 0 0 0 <0.25 0 0 0 0 0 RA1 1~2 5.16±0.02Aa 0.017±0.001Ab 1192.54±2.26Ab 1185.54±3.35Aa 0.992 0.5~1 5.19±0.02Aa 0.017±0.001Bb 1270.14±4.60Aa 1285.13±3.92Aa 0.991 0.25~0.5 5.16±0.01Aa 0.018±0.000Ab 1258.79±1.63Ba 1255.87±5.54Ca 0.992 <0.25 5.15±0.02Aa 0.024±0.001Aa 1260.69±26.90Aa 1259.93±53.69Aa 0.992 RA2 1~2 5.15±0.03Aa 0.015±0.001Ab 1220.11±20.39Aa 1233.18±24.87Aa 0.992 0.5~1 5.07±0.03BCab 0.020±0.000ABb 1236.33±20.71Aa 1260.89±13.52Aa 0.992 0.25~0.5 5.17±0.04Aa 0.021±0.001Ab 1262.56±1.99Ba 1256.87±1.83Ca 0.992 <0.25 5.00±0.03Bb 0.038±0.004Aa 1254.81±6.80Aa 1278.07±10.05Aa 0.992 RA3 1~2 5.14±0.03Aab 0.017±0.000Ab 1229.62±13.07Ac 1271.45±50.85Aa 0.991 0.5~1 5.00±0.00Cb 0.025±0.003Aab 1247.35±33.04Abc 1300.47±41.87Aa 0.991 0.25~0.5 5.22±0.06Aa 0.020±0.002Aab 1339.93±12.02Aa 1375.23±12.93Aa 0.991 <0.25 5.05±0.06ABab 0.032±0.005Aa 1325.78±26.14Aab 1341.55±35.15Aa 0.991 RA4 1~2 5.17±0.03Aa 0.017±0.002Ab 1239.05±26.15Aa 1250.61±32.81Aa 0.992 0.5~1 5.14±0.04ABab 0.019±0.001ABb 1284.65±39.02Aa 1307.56±64.90Aa 0.991 0.25~0.5 5.22±0.02Aa 0.020±0.001Ab 1286.19±9.32Ba 1285.89±2.21Ba 0.992 <0.25 5.01±0.03ABb 0.034±0.004Aa 1308.35±44.03Aa 1326.79±53.21Aa 0.991 注:不同小写字母和大写字母分别表示相同处理组中不同粒径赤泥团聚体细菌Alpha多样性指数和不同处理组间同一粒径赤泥团聚体细菌Alpha多样性指数存在显著差异 (P<0.05) 。 表 3 赤泥团聚体真菌群落多样性和丰富度指数Table 3. The diversity and richness indices of fungal community in the aggregates of bauxite residue处理组 粒径/mm 群落多样性 群落丰富度 Coverage Shannon Simpson Ace Chao1 R 1~2 0 0 0 0 0 0.5~1 0 0 0 0 0 0.25~0.5 0 0 0 0 0 <0.25 0 0 0 0 0 RA1 1~2 2.11±0.06Aa 0.20±0.02Aa 179.01±2.79Ba 184.35±4.80Ba 0.999 0.5~1 2.06±0.05Aa 0.23±0.01Ba 247.06±52.57Aa 237.08±35.68Aa 0.999 0.25~0.5 2.12±0.05Aa 0.21±0.02Aa 232.57±9.56ABa 212.03±16.97Aa 0.999 <0.25 1.98±0.03Aa 0.25±0.02Aa 250.64±2.35Aa 217.48±1.11Aa 0.999 RA2 1~2 2.23±0.15Aa 0.18±0.02Ab 219.28±15.60ABab 203.26±2.21Aa 0.999 0.5~1 2.05±0.09Aa 0.22±0.02Bab 179.40±8.00Ab 192.76±1.18Aa 0.999 0.25~0.5 1.95±0.03Ba 0.26±0.01Aa 251.39±3.11ABa 204.42±12.63Aa 0.999 <0.25 2.05±0.02Aa 0.23±0.00Aab 243.66±14.33Aa 201.47±3.66Aa 0.999 RA3 1~2 2.18±0.00Aa 0.17±0.01Ab 176.66±3.89Ba 176.70±6.70Ba 0.999 0.5~1 2.03±0.06Ab 0.23±0.01Ba 195.19±6.53Aa 199.20±5.96Aa 0.999 0.25~0.5 2.03±0.02ABb 0.24±0.01Aa 224.36±4.95Ba 218.23±1.83Aa 0.999 <0.25 2.00±0.01Ab 0.23±0.01Aa 202.44±29.16Aa 182.06±20.50Aa 0.999 RA4 1~2 2.03±0.17Aa 0.23±0.05Aa 234.14±19.16Aa 215.42±2.51Aa 0.999 0.5~1 1.86±0.03Aa 0.30±0.01Aa 208.98±19.10Aa 199.33±1.93Aa 0.999 0.25~0.5 1.97±0.03ABa 0.26±0.01Aa 278.17±24.44Aa 222.45±10.86Aa 0.999 <0.25 1.95±0.06Aa 0.28±0.03Aa 233.05±17.11Aa 214.49±16.01Aa 0.999 注:不同小写字母和大写字母分别表示相同处理组中不同粒径赤泥团聚体真菌Alpha多样性指数和不同处理组间同一粒径赤泥团聚体真菌Alpha多样性指数存在显著差异 (P<0.05) 。 2) 改良剂与植被联合修复对赤泥团聚体微生物群落组成空间分异特征的影响。赤泥团聚体微生物群落组成如图4所示,在门水平上 (图4(a)) ,主要优势细菌门为变形菌门 (Proteobacteria)、放线菌门 (Actinobacteriota)、拟杆菌门 (Bacteriodota)、绿弯菌门 (Chloroflexi)、厚壁菌门 (Firmicutes)。其中,Proteobacteria、Bacteriodota的相对丰度在1~2 mm团聚体中最高,Actinobacteriota和Chloroflexi分别主要分布在<0.25 mm和0.5~1 mm团聚体。有研究表明,赤泥自然堆放23 a后,由于其极端生境得到显著改善,Proteobacteria、Actinobacteriota和Firmicutes的相对丰度显著增加[43],这与本研究结果相似。在属水平上 (图4(b)) ,主要优势细菌属有链霉菌 (Streptomyces)、短波单胞菌 (Brevundimonas)、沃斯氏菌 (Devosia)。其中,Streptomyces和Brevundimonas的相对丰度分别在<0.25 mm和1~2 mm团聚体中最高。Devosia的相对丰度在<1 mm团聚体中最高,在1~2 mm团聚体中最低。
在门水平上 (图4(c)) ,优势真菌主要有子囊菌门 (Ascomycota) 、担子菌门 (Basidiomycota) 。不同处理组的不同粒径团聚体中Ascomycota的相对丰度达89.5%以上,其分别在<0.25 mm和1~2 mm团聚体中最高和最低。在属水平上 (图4(d)) ,优势真菌属主要有木霉菌属 (Trichodema) 、毛壳菌属 (Chaetomium) 、帚枝霉属 (Sarocladium) 、曲霉菌属 (Aspergillus) 、白腐真菌 (Phanerochaete) 、镰刀真菌 (Fusarium) 。真菌优势物种的相对丰度在门水平和属水平上大多在<1 mm团聚体中最高。
2.5 改良剂与植被联合修复对赤泥团聚体中养分、酶活性、微生物群落间关系的影响
赤泥团聚体中养分、酶活性、微生物群落间的相关性见图5。在大团聚体 (>0.25 mm) 中,养分与酶活性、变形菌门、放线菌门、链霉菌属、短波单胞菌属、沃斯氏菌属、子囊菌门、木霉菌属、毛壳菌属、帚枝霉属间均呈显著 (P<0.05) 或极显著 (P<0.01) 正相关。酶活性与变形菌门、放线菌门、链霉菌属、短波单胞菌属、沃斯氏菌属、子囊菌门、木霉菌属、毛壳菌属、帚枝霉属、担子菌门间呈显著 (P<0.05) 或极显著 (P<0.01) 正相关。而养分 (图2) 与酶活性 (图3) 主要分布在<1 mm团聚体中,这可能是真菌优势物种的相对丰度在门水平和属水平上大多在<1 mm团聚体中最高的原因。大粒径团聚体的主要胶结物质为有机质等有机胶体[44],有机质与全磷呈正相关,且0.5~1 mm团聚体中有机质处于较高水平 (图2(f)) ,这可能是导致0.5~1 mm团聚体中全磷质量分数较高 (图2(d)) 的重要原因。在微团聚体 (<0.25 mm) 中,酶活性、养分、微生物间大多呈显著正相关 (P<0.05) 。综上表明,改良剂与植被联合修复下,不同粒径赤泥团聚体中养分、酶活性、微生物群落间主要表现出协同关系,其能积极促进彼此的正向增长。
3. 结论
1) 赤泥团聚体中有效氮、有效磷、全氮、全磷、速效钾、有机质质量分数分别增加了8.29~129.00、4.17~29.39、2.67~11.00、2.61~4.89、0.03~0.31、1.00~5.38倍,其主要分布于<1 mm团聚体。
2) 赤泥团聚体中过氧化氢酶、碱性磷酸酶、脲酶、蔗糖酶活性分别增加了6.51~16.90、30.61~174.49、60.51~164.91、22.90~36.25倍;微生物群落丰度和多样性均不同程度增加;酶活性与微生物群落丰度和多样性大多在<1 mm团聚体中最高。
-
表 1 不同反应动力学模型拟合参数
Table 1. Fitting parameters of various reaction kinetic models
硝酸盐初始浓度/(mg·L−1) 准一级动力学方程 准二级动力学方程 k1/(mg·(L·min)−1) R2 k2/(mg·(L·min)−1) R2 20 0.061 57 0.993 0.006 53 0.991 40 0.049 57 0.989 0.002 79 0.992 60 0.010 47 0.800 0.000 61 0.985 80 0.014 78 0.910 0.000 66 0.983 100 0.016 28 0.866 0.000 57 0.974 -
[1] WAN R, ZHENG X, CHEN Y G, et al. Using cassava distiller’s dried grains as carbon and microbe sources to enhance denitrification of nitrate-contaminated groundwater[J]. Applied Microbiology and Biotechnology, 2015, 99(6): 2839-2847. doi: 10.1007/s00253-014-6155-z [2] ZHANG Y M, WANG X C, CHENG Z, et al. Effect of fermentation liquid from food waste as a carbon source for enhancing denitrification in wastewater treatment[J]. Chemosphere, 2016, 144: 689-696. doi: 10.1016/j.chemosphere.2015.09.036 [3] 浮海梅, 金云霄. 浅谈地下水硝酸盐污染[J]. 地下水, 2009, 31(3): 85-87. doi: 10.3969/j.issn.1004-1184.2009.03.028 [4] HAN D M, CURRELL M J, CAO G L. Deep challenges for China’s war on water pollution[J]. Environmental Pollution, 218: 1222-1233. [5] LIU Y, ZHANG B G, TIAN C X, et al. Optimization of enhanced bioelectrical reactor with electricity from microbial fuel cells for groundwater nitrate removal[J]. Environmental Technology, 2015, 37(8): 1008-1017. [6] MAILA Y A, EL-NAHAL I, AL-AGHA M R. Seasonal variations and mechanisms of groundwater nitrate pollution in the Gaza Strip[J]. Environmental Geology, 2004, 47(1): 84-90. doi: 10.1007/s00254-004-1136-7 [7] 吴耀国. 地下水环境中反硝化作用[J]. 环境污染治理技术与设备, 2002, 3(3): 27-31. [8] MAZUR L P, CECHINEL M A P, VILAR V J P, et al. Brown marine macroalgae as natural cation exchangers for toxic metal removal from industrial wastewaters: A review[J]. Journal of Environmental Management, 2018, 223: 215-253. [9] EPSZTEIN R, NIR O, LAHAV O, et al. Selective nitrate removal from groundwater using a hybrid nanofiltration-reverse osmosis filtration scheme[J]. Chemical Engineering Journal, 2015, 279: 372-378. doi: 10.1016/j.cej.2015.05.010 [10] BELKADA F D, KITOUS O, DROUICHE N, et al. Electrodialysis for fluoride and nitrate removal from synthesized photovoltaic industry wastewater[J]. Separation and Purification Technology, 2018, 204: 108-115. doi: 10.1016/j.seppur.2018.04.068 [11] CHEN Y X, ZHANG Y, CHEN G H. Appropriate conditions or maximizing catalytic reduction efficiency of nitrate into nitrogen gas in groundwater[J]. Water Research, 2003, 37(10): 2489-2495. doi: 10.1016/S0043-1354(03)00028-9 [12] GUO X J, YANG Z, DONG H Y, et al. Simple combination of oxidants with zero-valent-iron (ZVI) achieved very rapid and highly efficient removal of heavy metals from water[J]. Water Research, 2016, 88: 671-680. doi: 10.1016/j.watres.2015.10.045 [13] BELGHIT H, COLAS C, MOUVET C, et al. Liquid chromatography-high-resolution mass spectrometry for identifying aqueous chlordecone hydrate dechlorinated transformation products formed by reaction with zero-valent iron[J]. International Journal of Environmental Analytical Chemistry, 2015, 95(2): 93-105. doi: 10.1080/03067319.2014.994615 [14] 张唯, 沈峥, 王晨璐, 等. 纳米零价铁的改性及其在废水处理中的应用综述[J]. 净水技术, 2016, 35(4): 23-30. doi: 10.3969/j.issn.1009-0177.2016.04.004 [15] 修宗明, 全化民, 康海彦, 等. 铁屑去除酸法地浸采铀地下水中硝酸盐的试验研究[J]. 环境工程学报, 2007, 3(1): 37-40. doi: 10.3969/j.issn.1673-9108.2007.01.011 [16] 李利, 王祥润. 纳米铁作为纳米材料对污染修复效能评述[J]. 中国资源综合利用, 2018, 36(8): 99-101. doi: 10.3969/j.issn.1008-9500.2018.08.033 [17] 宋锡瑾, 宣锋, 王杰. 纳米氢氧化镁的制备[J]. 应用基础与工程科学学报, 2006, 14(4): 523-527. doi: 10.3969/j.issn.1005-0930.2006.04.009 [18] WU L M, LIAO L B, LV G C, et al. Micro-electrolysis of Cr (VI) in the nanoscale zero-valent iron loaded activated carbon[J]. Journal of Hazardous Materials, 2013, 254-255: 277-283. doi: 10.1016/j.jhazmat.2013.03.009 [19] LIU G, ZHOU Y Q, LIU Z Y, et al. Efficient nitrate removal using micro-electrolysis with zero valent iron/activated carbon nanocomposite[J]. Journal of Chemical Technology & Biotechnology, 2016, 91(12): 2942-2949. [20] 郑庆福, 王志民, 陈保国, 等. 制备生物炭的结构特征及炭化机理的XRD光谱分析[J]. 光谱学与光谱分析, 2016, 36(10): 3355-3359. [21] 李同燕, 李文奇, 胡伟武, 等. 玉米秆碳源去除地下水硝酸盐[J]. 环境工程学报, 2015, 9(9): 4245-4251. doi: 10.12030/j.cjee.20150925 [22] 李海莹, 王薇, 金朝晖, 等. 纳米铁的制备及其对污染地下水的脱硝研究[J]. 南开大学学报: 自然科学版, 2006, 39(1): 8-13. [23] CHEN S S, HSU H D, LI C W. A new method to produce nanoscale iron for nitrate removal[J]. Journal of Nanoparticle Research, 2004, 6(6): 639-647. doi: 10.1007/s11051-004-6672-2 [24] RODRIGUEZ-MAROTO J M, GARCIA-HERRUZO F, GARCIA-RUBIO A, et al. Kinetics of the chemical reduction of nitrate by zero-valent iron[J]. Chemosphere, 2009, 74(6): 804-809. doi: 10.1016/j.chemosphere.2008.10.020 [25] SHI J L, YI S N, HE H L, et al. Preparation of nanoscale zero-valent iron supported on chelating resin with nitrogen donor atoms for simultaneous reduction of Pb2+ and NO−3 [J]. Chemical Engineering Journal, 2013, 230: 166-171. doi: 10.1016/j.cej.2013.06.088[26] SONG Y J, SONG S F. Preparation, characterization, and kinetics of nanoscale iron in nitrate nitrogen removal from polluted water[J]. Toxicological & Environmental Chemistry, 2015, 97(3/4): 379-387. [27] HWANG Y H, KIM D G, SHIN H S. Effects of synthesis conditions on the characteristics and reactivity of nano scale zero valent iron[J]. Applied Catalysis B: Environmental, 2011, 105(1/2): 144-150. [28] CHOE S, CHANG Y Y, HWANG K Y, et al. Kinetics of reductive denitrification by nanoscale zero-valent iron[J]. Chemosphere, 2000, 41(8): 1307-1311. doi: 10.1016/S0045-6535(99)00506-8 [29] PETCHAROEN K, SIRIVAT A. Synthesis and characterization of magnetite nanoparticles via the chemical co-precipitation method[J]. Materials Science and Engineering B, 2012, 177(5): 421-427. [30] RYU A, JEONG S W, JANG A, et al. Reduction of highly concentrated nitrate using nanoscale zero-valent iron: Effects of aggregation and catalyst on reactivity[J]. Applied Catalysis B: Environmental, 2011, 105(1/2): 128-135. -




 DownLoad:
DownLoad: