-
随着我国水处理需求及能力的大幅度提升,剩余污泥的产量也逐渐增大。据预测,2020—2025年间,剩余污泥的年产量将突破6×107 t (以含水率80%计)[1]。相比污水的处理,我国的污泥处理能力相对滞后[2]。由于污泥中含有大量的重金属和有毒有害物质[3],80%以上的污泥由于处理不当,已成为造成环境二次污染的污染源[4]。因此,污泥的妥善处理处置已成为亟需解决的环境问题之一。
剩余污泥中的有机物主要包括蛋白质和多糖[5]。其中,蛋白质含量为20%~40%,是一种有机质资源,通过污泥蛋白质回收实现其资源化,是剩余污泥处理处置的重要途径之一[6]。剩余污泥中的蛋白质主要存在于微生物细胞内,通过水解破胞技术将微生物细胞内蛋白质释放到溶液中,是污泥蛋白质回收的前提[7]。目前,水解破胞技术主要包括物理法、化学法和生物法。XIAO等[8]采用热处理溶出污泥蛋白质,可使溶液中的蛋白质浓度提高12倍。肖本益等[9]采用碱法处理活性污泥,10 g·L−1的污泥在pH 12.0的条件下,处理12 h后,溶解性蛋白质浓度增加了2 058.6 mg·L−1。章文锋等[10]采用酶法回收污泥蛋白质,发现碱性蛋白酶在pH 8、温度55 ℃、酶投加量2%、反应时间4 h及污泥液固比4∶1条件下,污泥蛋白提取率可达52.5%。ASSAWAMONGKHOLSIRI等[11]采用热酸法溶出蛋白质,在pH为1.0的条件下,预处理6 h,然后在110 ℃下加热60 min,可溶性蛋白质浓度提高了4.8倍。CHO等[12]发现,在60 ℃和pH 12的条件下处理1 h,污泥释放的蛋白质是未预处理污泥的2.4倍,而单独碱解释放的蛋白质是未预处理污泥的2.1倍。LIU等[13]用超声联合碱处理的方法溶出污泥蛋白,在18 kHz和pH 12下处理1 h,蛋白质浓度增加到7.9 g·L−1。SAHINKAYA[14]采用超声联合酸处理的方法分解污泥,在超声功率密度为1 W·mL−1、处理时间为10 min、初始污泥pH为2.0的最佳条件下,蛋白质浓度可达1 750 mg·L−1。然而,目前污泥联合水解工艺多处于实验室研究阶段,其中试及产业化效果则有待考证。
为此,本研究建立了日处理规模为1 m3剩余污泥(含水率为80%)的中试水解系统。采用酶联合热碱水解技术,优化了影响蛋白质溶出效果的关键工艺条件,包括酶解时间、酶投加量及碱解时间等;同时,进一步研究了污泥水解的动力学特性,解析了联合水解过程的限速步骤,以期为剩余污泥联合水解工艺的产业化应用提供必要的技术参数。
全文HTML
-
实验所用污泥取自天津某污水处理厂脱水污泥,该厂采用A2/O工艺。脱水污泥含水率为80.52%、有机物含量为51.46%、粗蛋白含量为22.47%。水解用酶制剂为通用商品酶,木瓜蛋白酶和碱性蛋白酶酶活分别为8×105 U·g−1和1×105 U·g−1、最适pH分别为6.0~7.0和8.5~10.5、最适温度分别为(50~55) ℃和(40~60) ℃。
-
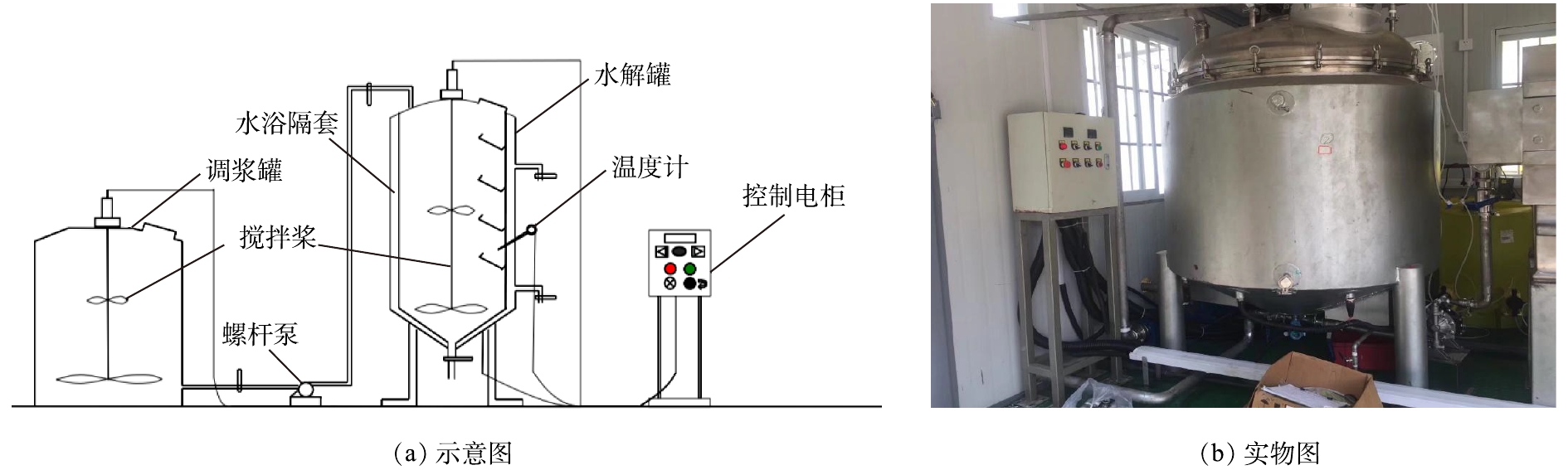
处理规模为1 m3(含水率为80%)的中试污泥水解装置示意图及实物图如图1所示。水解罐内外均为不锈钢,水浴加热,功率为20 kW,容积为1.5 m3,内部直径为1.1 m。螺杆泵流量为5 m3·h−1,功率为2.2 kW。调浆桶体积为1.5 m3,使用PE材质。
-
先将脱水污泥分别配制成20、30、40和50 g·L−1污泥混合液,在55 ℃条件下,分别投加1%、2%和3%污泥干重的复合酶(木瓜蛋白酶∶碱性蛋白酶=12∶1);然后,分别酶解1、1.5、2和2.5 h;接着,分别在70、80和90 ℃条件下,投加NaOH将污泥溶液pH调至12.5,进行热碱水解,水解时间分别为0.5、1、1.5、2、2.5和3 h,研究酶-热碱联合水解条件对蛋白质溶出效果的影响。
-
将脱水污泥配制成10、20、30、40和50 g·L−1的污泥混合液,在55 ℃条件下,分别投加污泥干重1%、2%和3%的复合酶,研究其污泥酶解动力学特性。
将脱水污泥配制成30 g·L−1的污泥混合液,在55 ℃条件下,分别投加污泥干重1%的复合酶,酶解1.5 h后,在80 ℃并调节pH至12.5进行碱解,研究其碱解动力学特性。
-
污泥粗蛋白采用凯式定氮法[15]测定;TCOD(总化学需氧量)、SCOD(溶解性化学需氧量)、
NH+4 -N(氨氮)、PO3−4 -P(磷酸盐)和TP(总磷)均采用标准方法[16]测定。污泥含水率、有机物含量及pH等均参照《城市污水处理厂污泥检测方法》中的方法[17]进行测定。溶液中蛋白质浓度采用考马斯亮蓝G-250法[18]测定。蛋白质溶出率根据式(1)计算得出。
式中:
w1 为蛋白质溶出率;c 为上清液蛋白质浓度,mg·L−1;V 为离心后所得上清液体积,L;m 为原始污泥中蛋白质质量,mg。COD溶出率根据式(2)计算得出。
式中:
w2 为COD溶出率;CSCOD 为处理后上清液SCOD浓度,mg·L−1;CSCOD0 为原污泥溶液初始SCOD,mg·L−1;CTCOD 为原污泥溶液的TCOD,mg·L−1。
1.1. 实验材料
1.2. 实验装置
1.3. 酶-热碱联合水解的关键工艺条件优化
1.4. 动力学特性研究
1.5. 分析方法
-
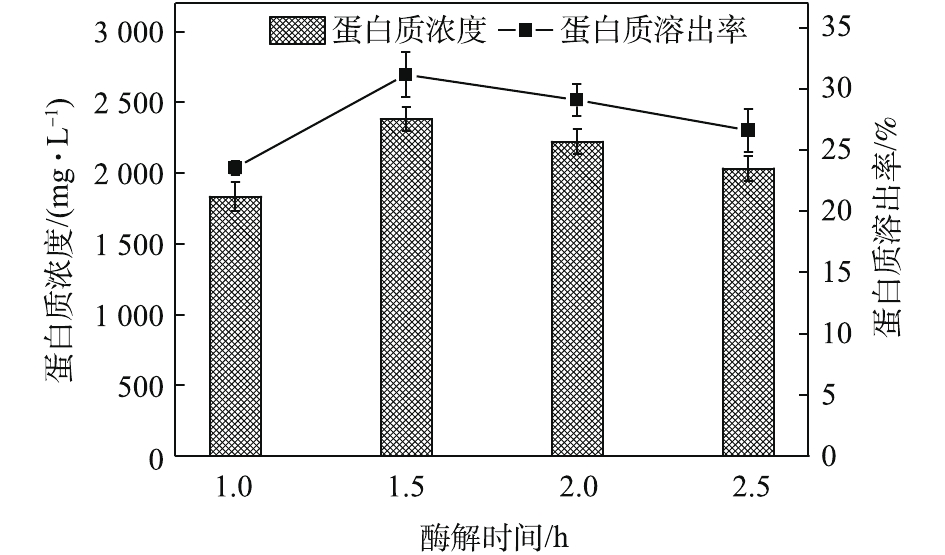
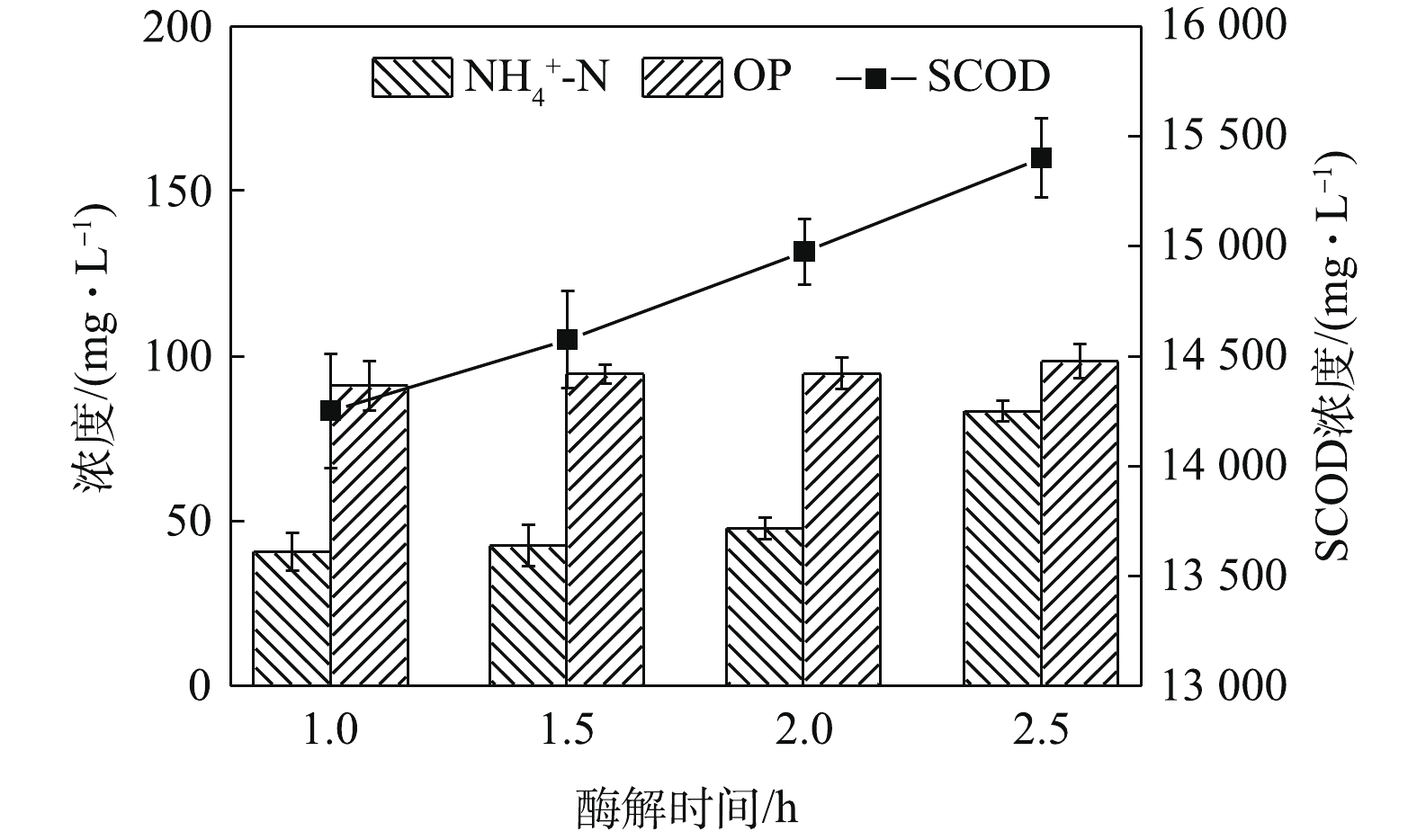
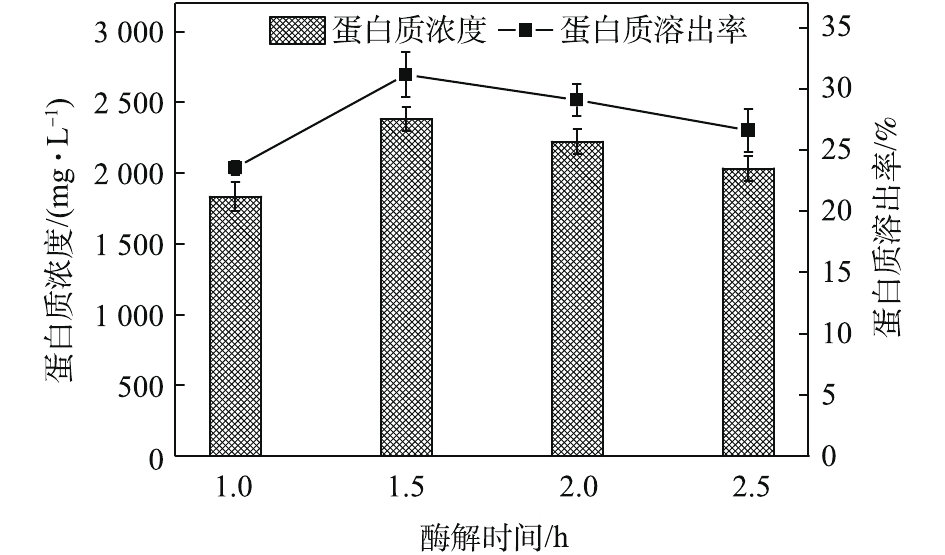
酶解时间对污泥蛋白质溶出效果的影响如图2所示,随着酶解时间的延长,蛋白质浓度和蛋白质溶出率均呈现出先增加再降低的趋势。酶解时间为1.5 h时,蛋白质浓度和蛋白质溶出率均达到最高,分别为2 381.05 mg·L−1和31.18%。酶可以破坏污泥的絮体结构[19],将细胞表面暴露出来,进一步分解微生物细胞壁[20],提高污泥的水解效果,利于蛋白质的溶出。然而,随着酶解时间的进一步提高,投加的酶会水解部分溶出的蛋白质,最终生成小分子酸、氨和CO2[21],从而导致水解液中蛋白质浓度降低,这也可以从图3中
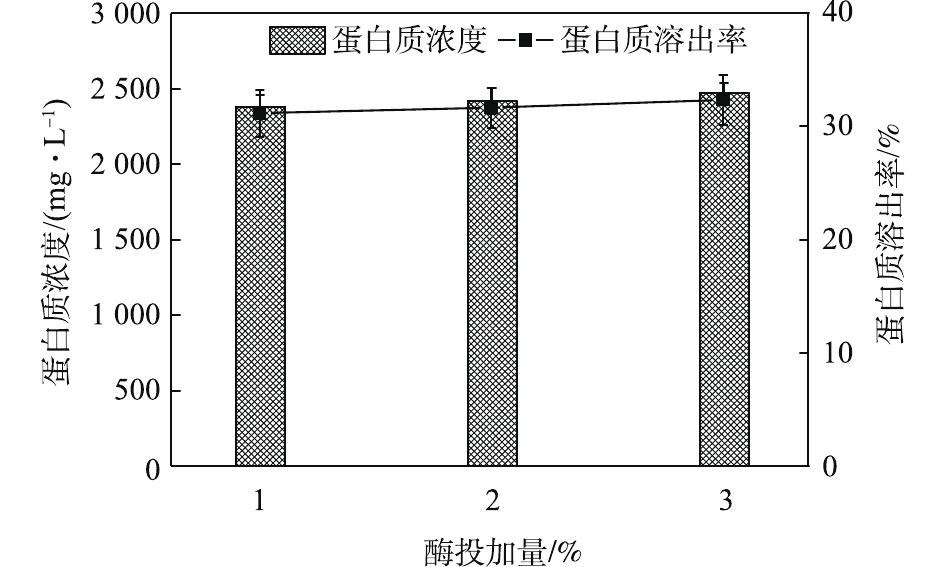
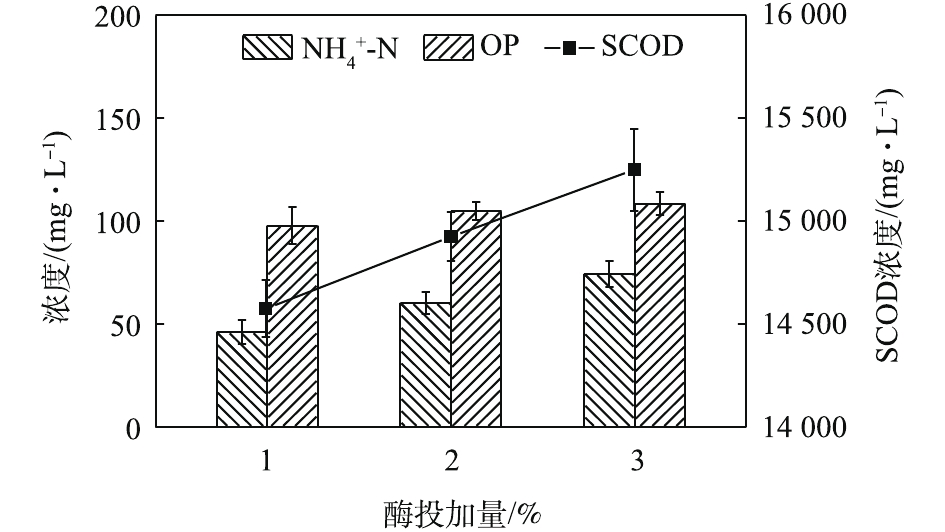
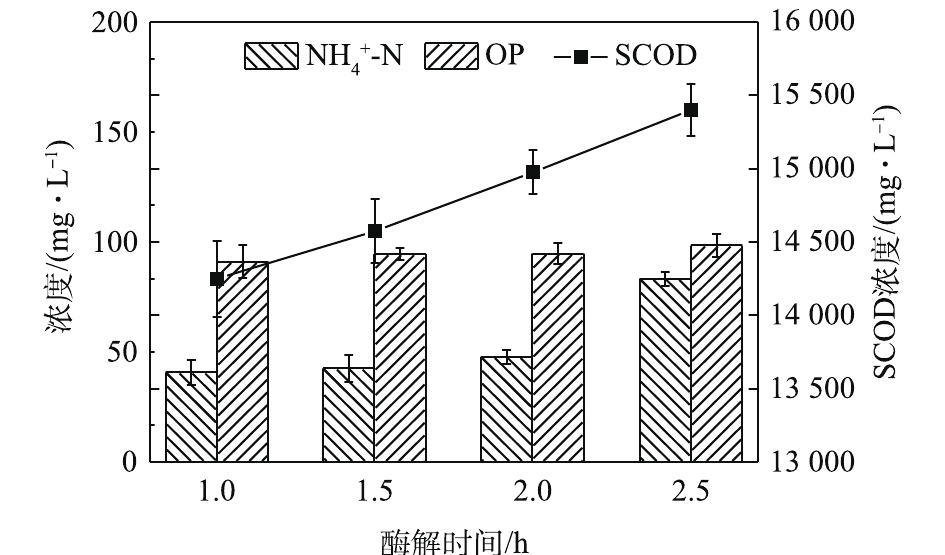
NH+4 -N浓度的变化看出。如图3所示,NH+4 -N浓度在酶解2 h后明显上升,从47.87 mg·L−1上升到83.33 mg·L−1。这说明,过长的酶解时间会导致溶出的蛋白质分解。OP(有机磷,即总磷和磷酸盐之差)含量虽略有上升却较为接近。这说明酶解时间的延长对污泥内DNA、RNA等含有有机磷物质的溶出影响不大,即污泥破胞效果并没有随着酶解时间的延长而明显加强。这一点从SCOD的变化也能反映出来,SCOD从酶解1 h时的14 250 mg·L−1上升到酶解2.5 h时的15 400 mg·L−1,反应时间延长了1.5 h,SCOD却只增加了近1 000 mg·L−1,效果并不明显。因此,酶解时间为1.5 h时,污泥蛋白质溶出效果最佳。酶投加量对污泥蛋白质溶出效果的影响如图4所示,酶投加量为1%时,污泥水解液中蛋白质浓度为2 381.05 mg·L−1。当酶投加量由1%增加至3%时,水解液中蛋白质浓度及污泥蛋白质溶出率呈略微增加的趋势,蛋白质浓度只增加了3.8%。由图5可知,
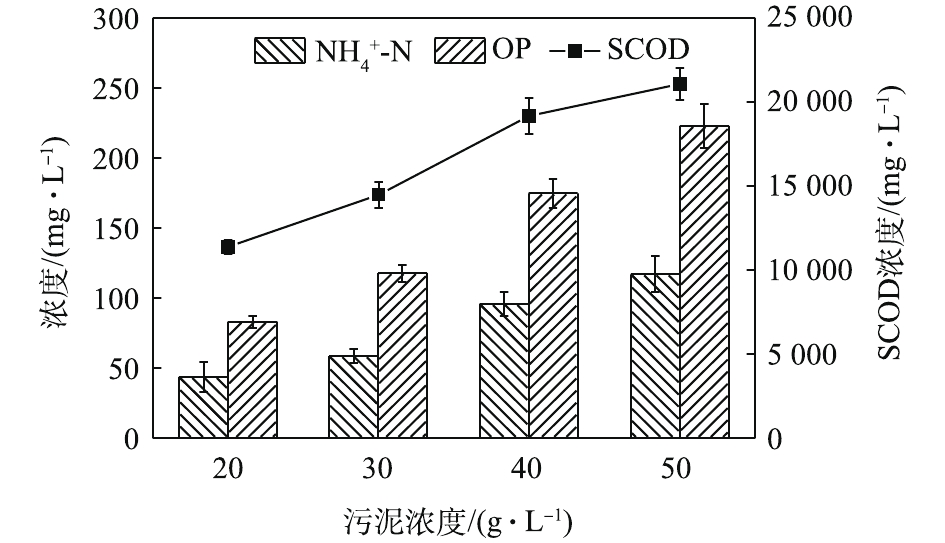
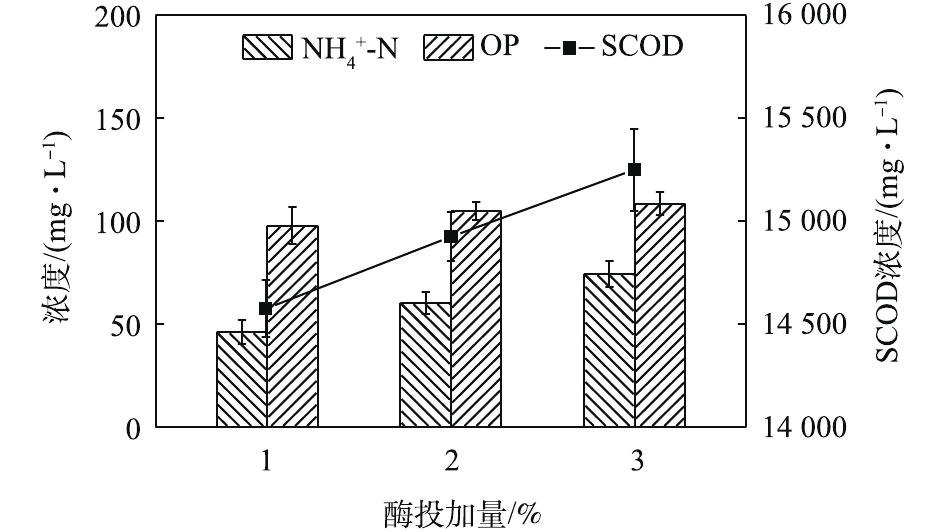
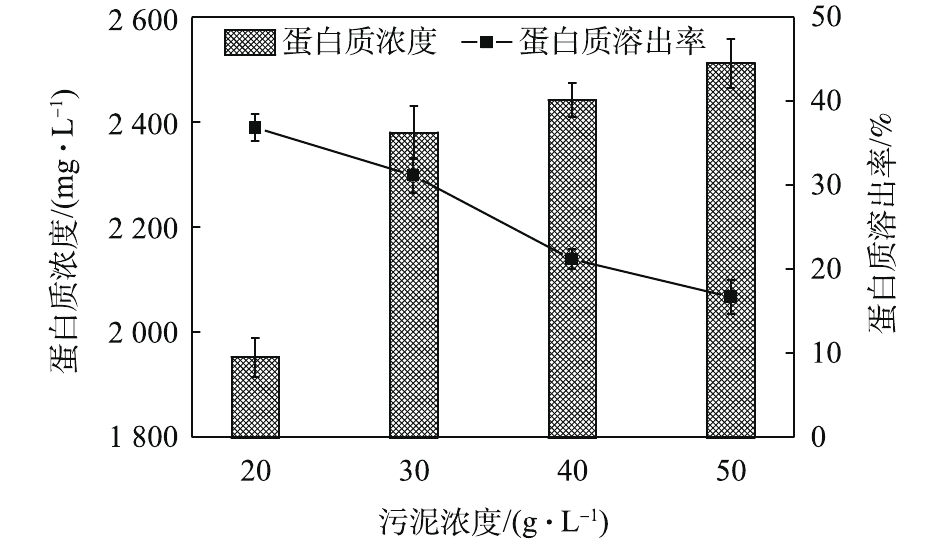
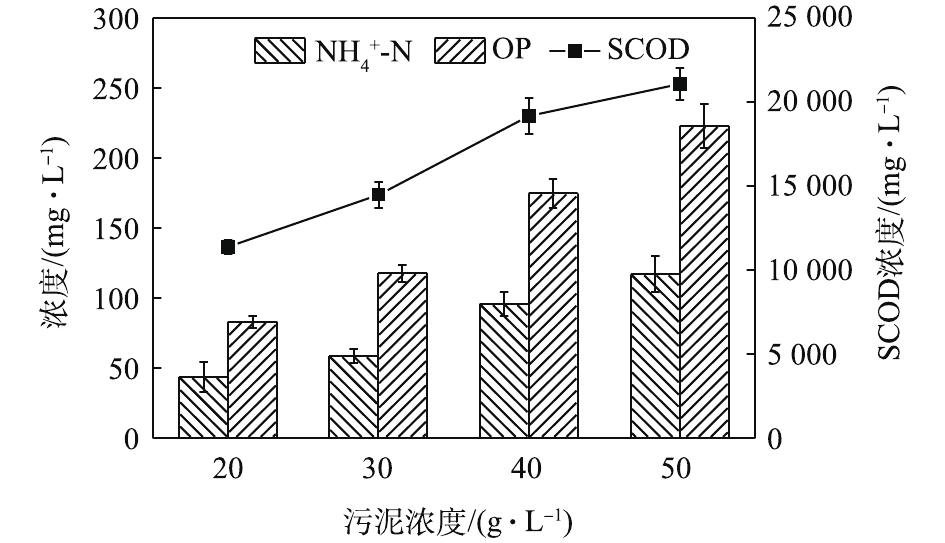
NH+4 -N浓度随着酶投加量的增加而显著的增加。酶的投加量为3%时,污泥水解液中NH+4 -N浓度为74.47 mg·L−1,相比酶投加量为1%,NH+4 -N浓度增加了62%。这可能是因为,酶量较多时,蛋白质易被降解并转化为多肽和氨基酸并进一步降解[22],这也与NH+4 -N浓度升高的结果一致。因此,酶投加量的增加对污泥蛋白质溶出效率几乎无影响,但成本却明显提高。从SCOD和OP含量变化也可发现,酶投加量的增加,对于污泥的破胞效果影响甚微。因此,综合考虑效果和成本,最佳的酶投加量为污泥干重的1%。污泥浓度对污泥蛋白质溶出率的影响如图6所示。由图6可以看出,随着污泥浓度的增加,水解液中蛋白质浓度先明显增加,后缓慢增加。当污泥浓度由20 g·L−1增加至30 g·L−1时,水解液中蛋白质浓度由1 952.47 mg·L−1增加至2 381.05 mg·L−1。然而,进一部提高污泥浓度,水解液中蛋白质浓度呈现略微增加的趋势,50 g·L−1时蛋白质浓度仅为2 512.63 mg·L−1。但是,蛋白质溶出率却随着污泥浓度的增加而降低,20 g·L−1时的蛋白质溶出率最高,达到了36.88%;其次是30 g·L−1时的31.18%,最低为50 g·L−1时的16.71%。与污泥浓度为20 g·L−1时的蛋白质浓度和溶出率相比,当污泥浓度分别为30和40 g·L−1时,其蛋白质浓度分别提高了21.95%和25.09%。但是,蛋白质溶出率却分别降低了15.46%和42.46%。可以发现,当污泥浓度高于30 g·L−1时,蛋白质浓度提升不明显,而且溶出率明显降低。这是因为,污泥浓度越高,底物所含的蛋白质含量更多,因此溶出的蛋白质浓度更高。但是,污泥浓度越高,碱及热量的传质越困难,可能导致污泥受热不均或不充分,水解效果越差[23],蛋白质溶出率越低。所以,综合考虑,污泥浓度为30 g·L−1时,蛋白质溶出效果最优。这也可以从图7中的SCOD含量变化得到印证,虽然污泥浓度的升高使水解液中的SCOD浓度也随之升高,但计算却发现COD溶出率随之降低;同时,污泥浓度的升高也会使溶液的传热效率降低,导致能耗更高,因此最佳污泥浓度为30 g·L−1。
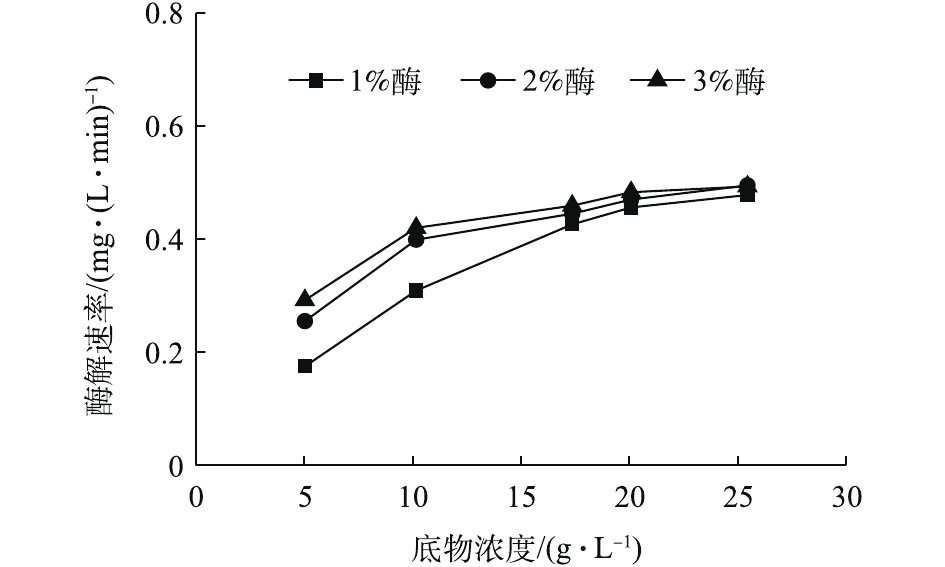
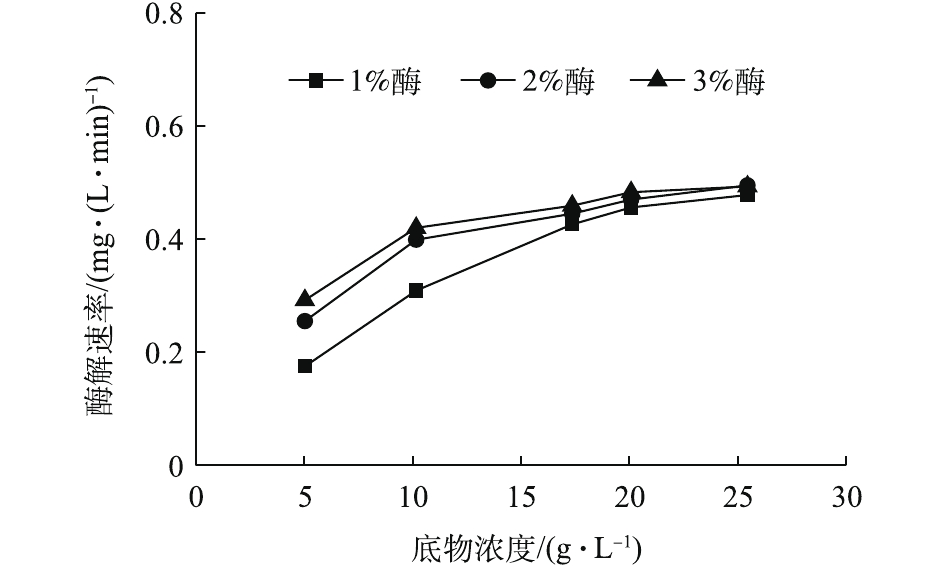
由于污泥成分复杂,而其中的无机物无法作为底物来参与酶解反应。因此,以污泥中的VSS(可挥发性悬浮物)作为底物,来研究底物浓度与酶解速率的关系。不同酶投加量条件下,各底物浓度下的酶解速率如图8所示。可以发现,酶解速率都随着底物浓度的增加先增加,再逐渐趋于稳定,在底物浓度较低时,反应速率与底物浓度几乎呈正比关系,呈一级反应;当底物浓度较高时,反应速率增加缓慢或不增加,呈零级反应。因此,底物浓度和反应速率的曲线,符合经典的米氏方程[24],故可用米氏方程对实验数据作进一步拟合。同时发现,酶投加量的增加,在底物浓度较低时,可以提高反应速率。然而,当底物浓度大于17.37 g·L−1,即污泥浓度高于30 g·L−1时,酶投加量的增加对反应速率并无明显影响,从这一点也可以说明1%的酶投加量为最佳酶投加量。
Michaelis-Menten假定了酶与底物的酶促反应分2步[25]进行。
式中:
K1 、K−1 、K2 和K−2 分别为各向反应的速度常数;E 表示酶;S 表示底物;E-S表示酶-底物络合物,即中间产物;P 表示最终产物。酶(
E )与底物(S )结合生成中间产物(E-S),在中间产物分解成产物(P )的同时,E 重新游离出来。在反应初期,P 浓度极低,不足以引起可逆反应,故K−2 可忽略不计。因此,第2步反应是单向的,即可推出酶解动力学方程为式(4)。式中:
v 为酶解速率;CS 为底物质量浓度;CE0=CE+CE-S ,CE-S 为中间产物浓度。令
Km=(K−1+K2)/K1 ,vmax=K−1CE0 ,则方程可以简化为式(5)。方程(5)即为复合酶水解污泥的米氏方程。由方程(5)可以得出式(6)。
式中:
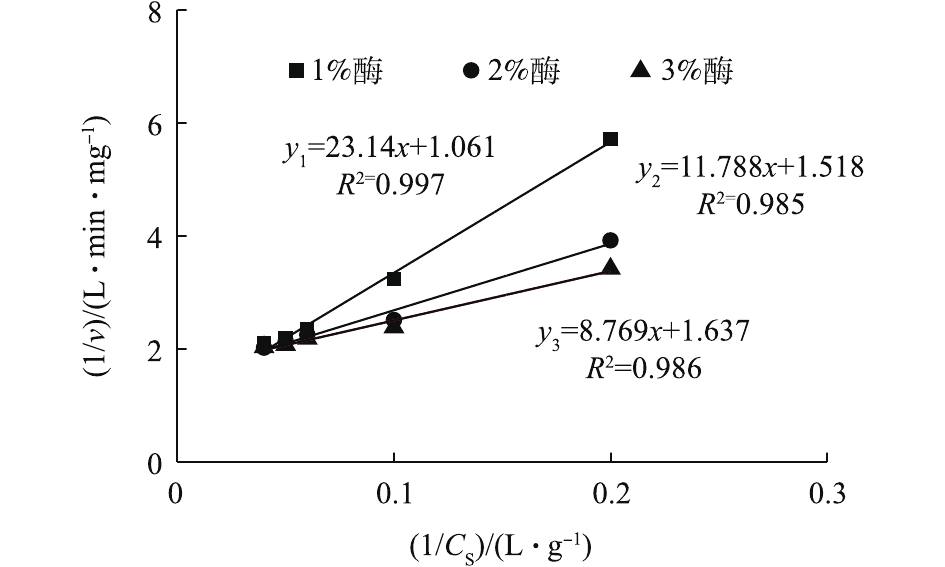
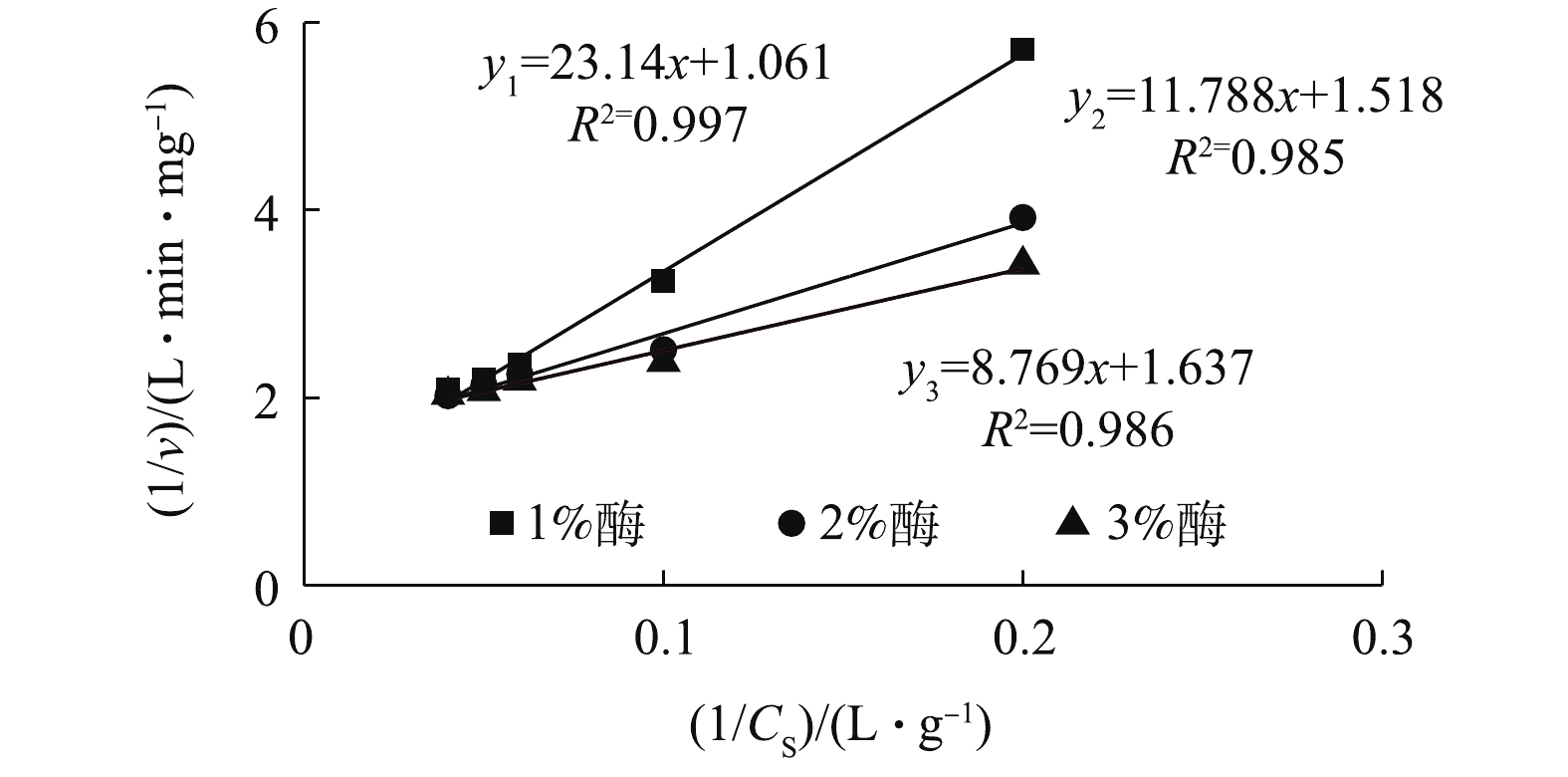
Km/vmax 为直线斜率;1/vmax 为截距。采用Lineweaver-Burk(双倒数作图法)[26]求解动力学模型参数,对Lineweaver-Burk图数据进行拟合,如图9所示。结果表明,动力学方程拟合效果较好,结果如表1所示。可见,随着酶投加量的增加,
vmax 和Km 值都呈降低趋势。其原因可能是酶浓度的升高增强了底物竞争,这反而不利于污泥的水解。因此,1%的酶投加量为最佳,这也与前面的结果一致。当酶投加量为1%时,vmax 为0.709 mg·(L·min)−1,Km 为13.13 mg·L−1。 -
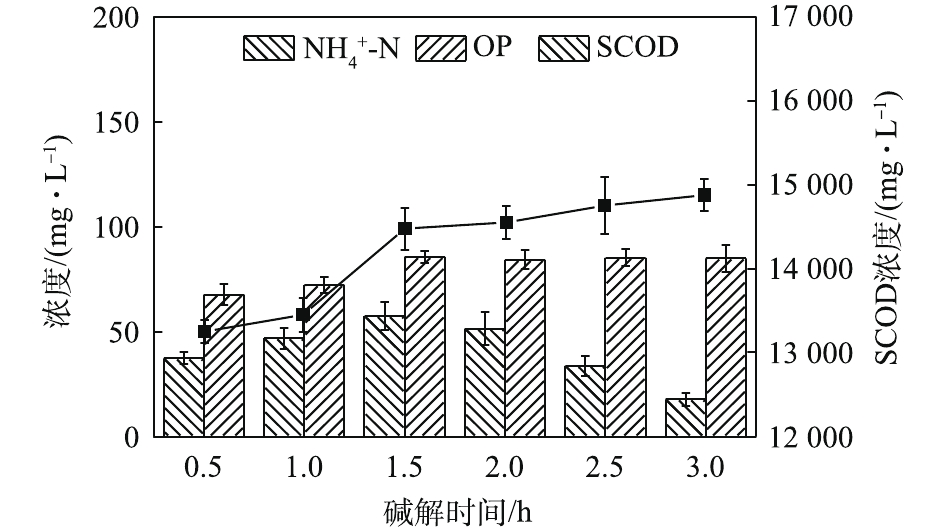
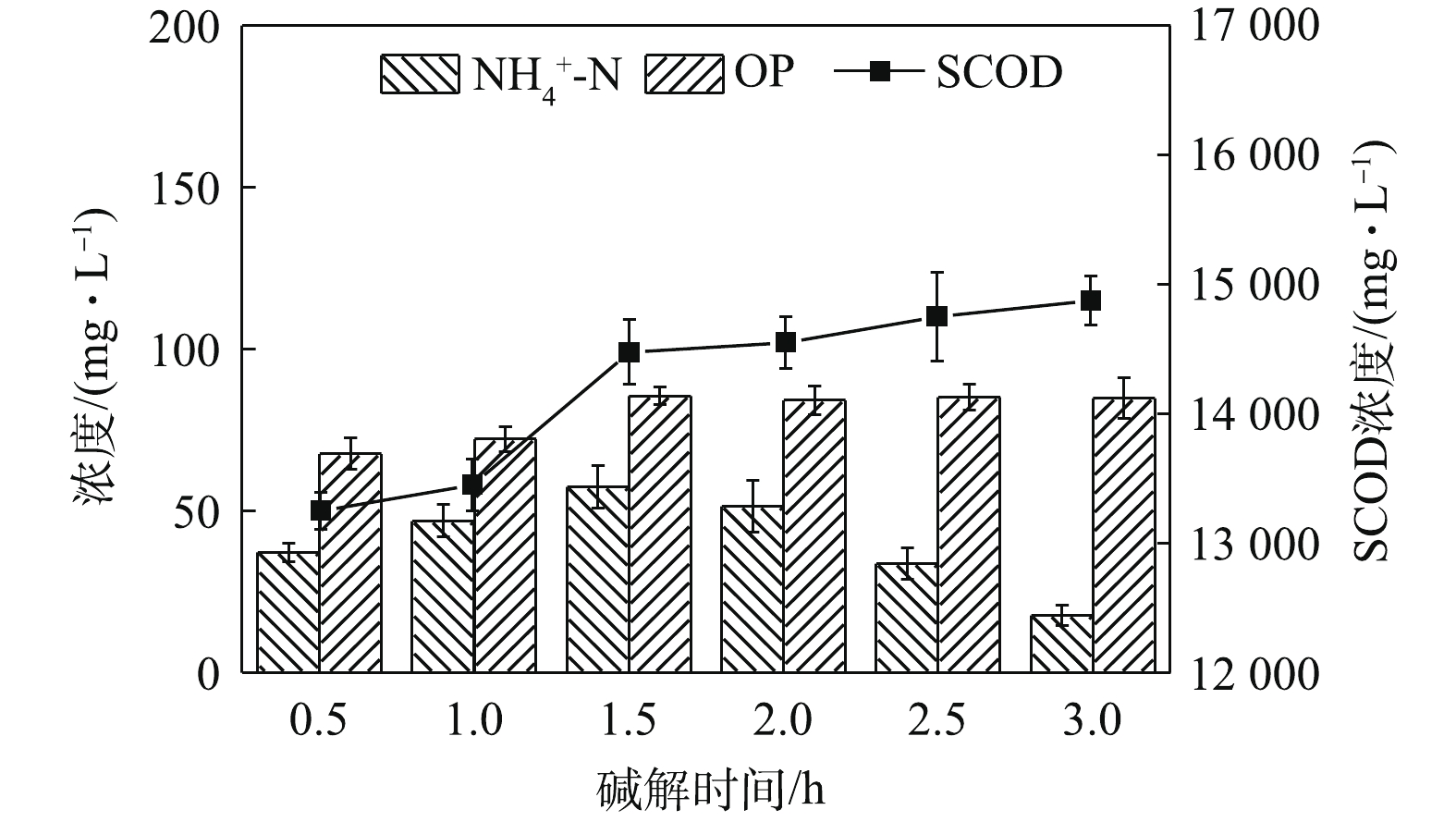
在酶解时间1.5 h、酶投加量1%和污泥浓度30 g·L−1的最佳条件下,继续进行污泥的热碱水解。图10给出了碱解时间对污泥蛋白质溶出效率的影响。由图10可知,碱解时间为1.5 h时,水解液中的蛋白质浓度最高,达2 149.47 mg·L−1,28.15%的蛋白质溶出率也为最高。过短或过长的碱解时间均导致污泥中蛋白质溶出效率降低。这是因为,碱能使膜脂皂化和微生物细胞损伤,破坏细胞结构[27],有效地释放胞内蛋白质;但是,在碱性条件下,蛋白质易发生水解[28],当碱解时间过长时,蛋白质水解速率超过其溶出速率,降低了水解液中蛋白质浓度,影响了整个污泥水解过程中蛋白质溶出效率。期间,SCOD和
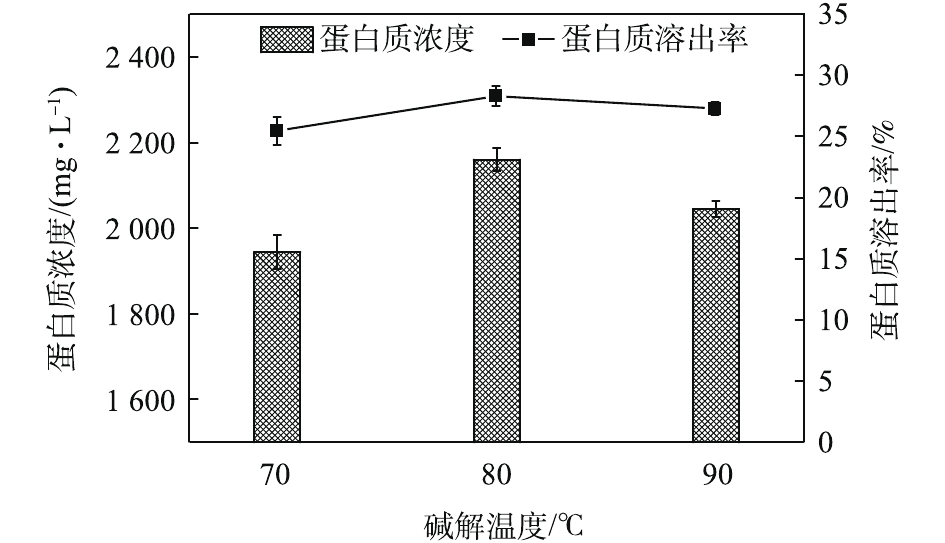
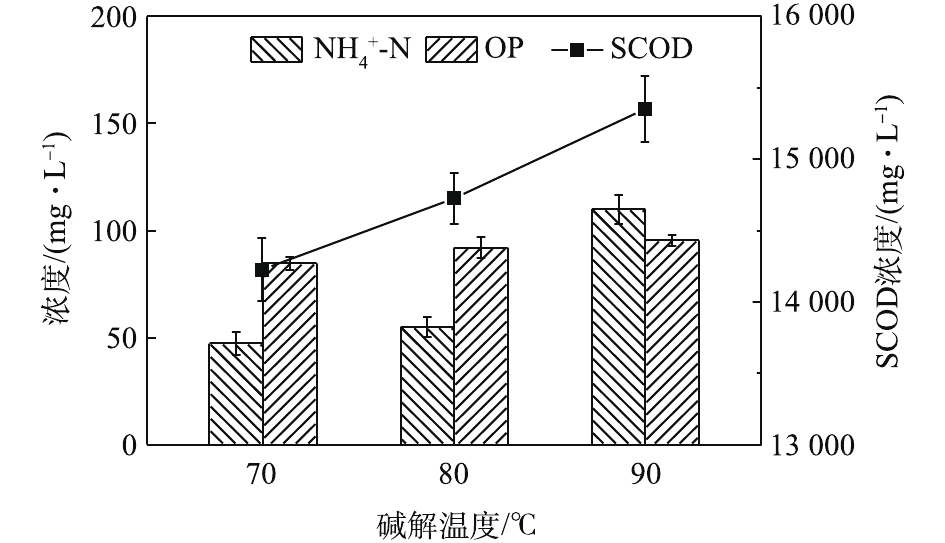
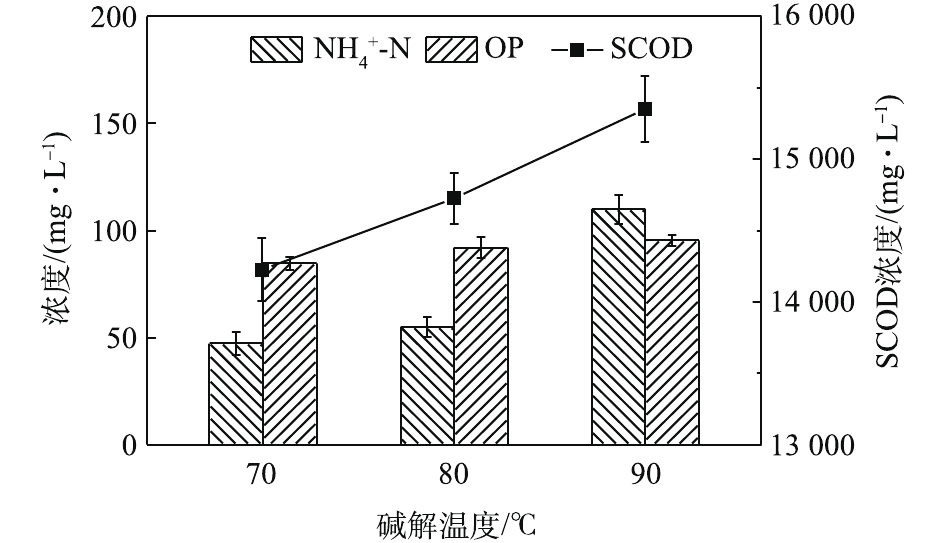
NH+4 -N及OP的浓度变化如图11所示。可见,随着碱解时间的延长,SCOD浓度先快速增加后缓慢增加。这是因为,更长的碱解时间导致更多的物质溶解溶入液相,提高了SCOD含量,而OP含量随着碱解时间的延长先增加后趋于稳定。NH+4 -N含量的变化趋势则有所不同,呈先增加后逐渐降低的趋势。其可能的原因是,在碱性条件下,NH+4 -N更容易与OH−结合呈NH3·H2O状态并从液相中挥发出来,造成NH+4 -N浓度的降低。这一点与BI等[29]的研究发现一致。因此,最佳碱解时间为1.5 h。如图12所示,不同碱解温度条件下,污泥水解液的蛋白质浓度及蛋白质回收率均随着碱解温度的升高先增加后减小,分别从70 ℃时的1 944.21 mg·L−1和25.56%上升到80 ℃时的2 160 mg·L−1和28.29%,然后下降到90 ℃时的2 044.21 mg·L−1和27.28%。蛋白质在高温强碱环境下易降解发生脱氨作用,生成氨气和不饱和羧酸盐,氨气在碱性条件下逸出[30],降低了溶解性蛋白质浓度。当酶解温度温度由70 ℃升高到80 ℃时,由于温度的升高,污泥受热分解效果更好,因而蛋白质浓度和蛋白质溶出率均有所升高。然而,当酶解温度温度由80 ℃升到90 ℃时,温度的升高及升温时间的增加导致部分蛋白质的降解或变性[31]。何玉凤[32]也发现,当温度在75~95 ℃时,蛋白质容易变性,导致蛋白质浓度和溶出率的降低。观察图13中SCOD等的变化发现,随着碱解温度的升高,SCOD浓度也呈上升趋势。这说明,有更多的有机物随着温度的升高而分解,污泥水解效果得到提高。
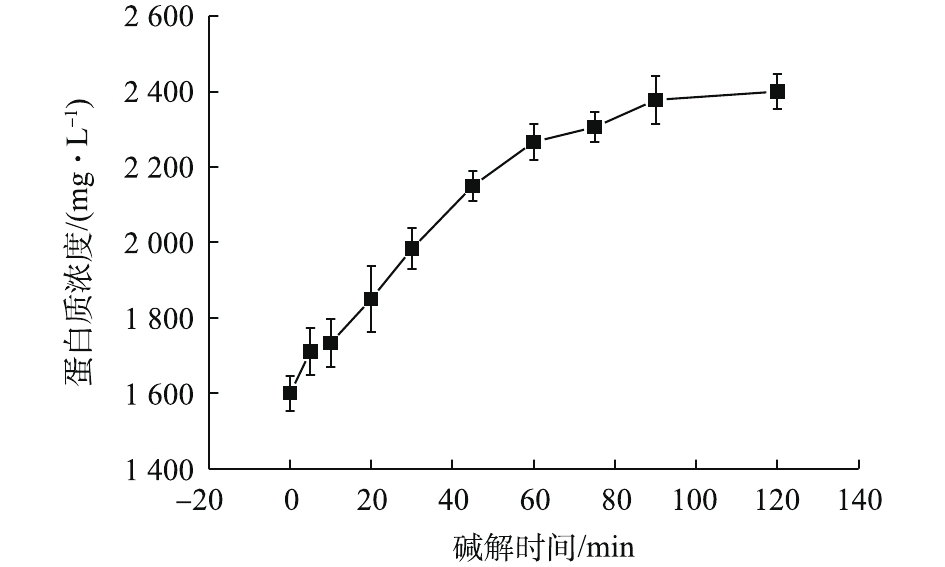
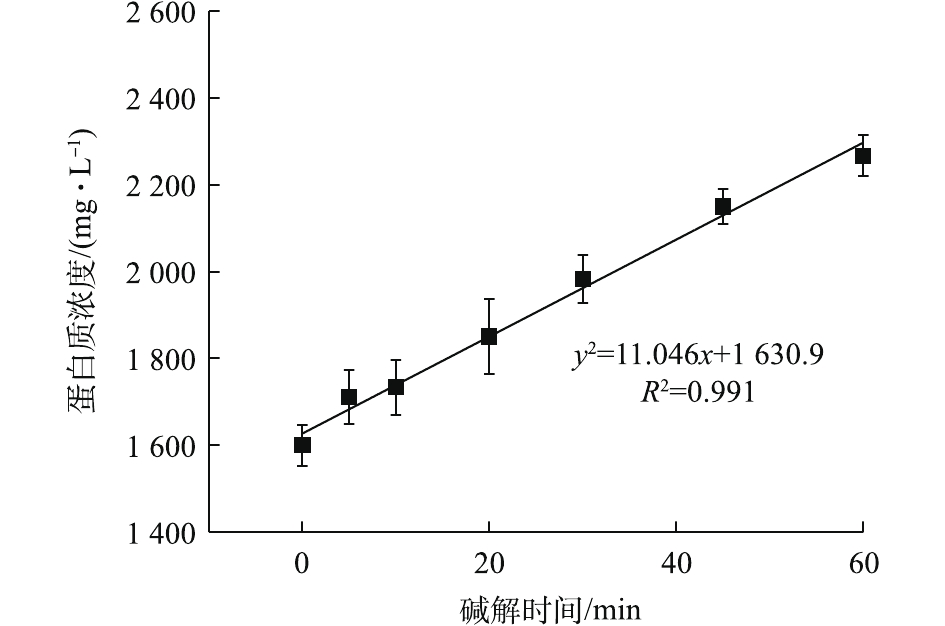
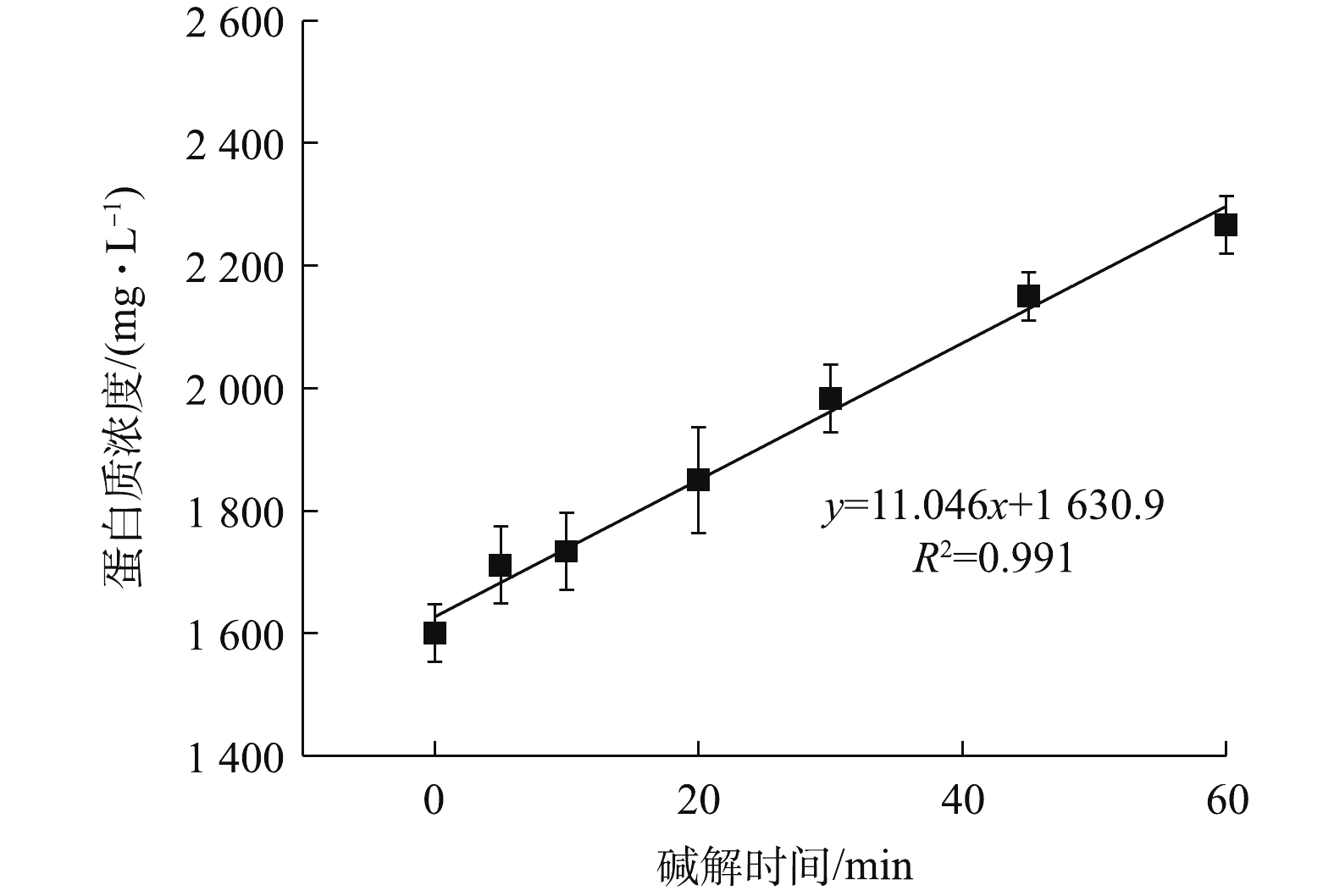
NH+4 -N浓度在90 ℃下明显升高,也说明了有更多的蛋白质在此温度下被降解。OP含量从70 ℃时的84.60 mg·L−1增加90 ℃时的95.40 mg·L−1。这说明温度的升高能提高污泥的破胞效果,但效果有限。因此综合分析,最佳碱解温度为80 ℃。由图14可知,当污泥浓度为30 g·L−1时,酶解1.5 h后进行碱解,蛋白质浓度随着碱解时间的延长而升高。酶解时间为0 min时,蛋白质浓度为1 600.01 mg·L−1。这是因为,加碱将pH调到12.5以后,升温过程中热解加上碱解,使得0 min时的蛋白质浓度较酶解完大幅上升。蛋白质浓度升高到20 min时的1 849.99 mg·L−1继而快速上升到30 min时的1 983.31 mg·L−1,一直快速上升到60 min时的2 266.61 mg·L−1。酶解时间为60~90 min时,蛋白质浓度上升变缓。酶解时间为90 min时,蛋白质浓度为2 377.71 mg·L−1,继续延长碱解时间,酶解时间到120 min时,蛋白质浓度为2 399.93 mg·L−1,趋于稳定。这可能是因为随着实验的进行,前期污泥细胞的破坏较为剧烈,导致蛋白质浓度快速升高,其后效果减弱,但是依然在进行蛋白质的溶出,最后反应接近完全。因此,蛋白质浓度趋于稳定。基于此,将60 min前结果进行线性拟合,以拟合得到的方程斜率作为该浓度下碱解反应的速率,方程拟合结果如图15所示,结果表明,动力学方程拟合效果较好。
进一步求得方程参数,结果发现动力学方程为y=11.046x+1 630.9(R2=0.991),拟合效果较好,即30 g·L−1的污泥溶液的碱解速率为11.046 mg·(L·min)−1。可以发现,与酶解相比,碱解速率提高了15.58倍,酶解是剩余污泥联合水解的限速步骤。这是因为,酶解效果跟多种因素有关。首先,可能是因为部分生物酶被截流或束缚在污泥结构中,与污泥细胞的充分接触受到了限制[33];其次,也可能是污泥成分复杂,对酶活性影响较大。而细胞壁中存在的脂类物质可以被碱分解,只要混合均匀,碱解效果就会较好;而且,碱解温度比酶解温度高25 ℃,一般反应温度每上升10 ℃,反应速率会提高2~3倍[34]。因此,碱解速率远高于酶解速率。
2.1. 污泥酶解的关键因素优化及其动力学
2.2. 污泥碱解的关键因素优化及其动力学
-
1)采用酶-热碱联合水解工艺,日处理量为1 m3剩余污泥(含水率80%)中试水解系统的最佳酶解时间为1.5 h、复合酶投加量为1%、污泥浓度为30 g·L−1、碱解时间为1.5 h、碱解温度为80 ℃。此时,水解上清液中蛋白质浓度为2 160 mg·L−1。以上研究结果可为该工艺的产业化应用提供必要的技术参数。
2)剩余污泥的酶解过程遵循米氏方程,最大酶解速率
vmax 和米氏常数Km 分别为0.709 mg·(L·min)−1和13.13 mg·L−1。剩余污泥的碱解过程符合零级动力学方程,碱解速率为11.046 mg·(L·min)−1。酶-热碱联合水解工艺中,酶解是限速步骤,如何在实践中进一步提高酶解速率是该工艺产业化应用成功与否的关键。




 下载:
下载:

 /(mg·L-1)
/(mg·L-1) /(mg·(L·min)-1)
/(mg·(L·min)-1)