-
市政脱水污泥是城镇污水处理厂的副产物,其中含有大量的有机污染物、病原体[1-2],如处置不当会对人体健康和环境安全产生威胁[3]。因此,市政脱水污泥被美国环保局定义为一种环境污染物[4]。2016年,我国污泥的产量约为3×107 t,日本为7.4×107 t,欧洲为9.8×106 t (干质量),美国为5.6×106~5.7×106 t (干质量)。预计至2020年,我国的污泥产量将达到6×107 t[5-6]。目前,大多数的污泥都用来填埋、焚烧、堆肥发酵以及土地利用,这些处理处置方式易造成资源浪费,也均有一定产生二次污染的风险[7]。因此,越来越多的研究关注于寻找污泥处理处置的新途径。
污泥中含有大量有机物,适合热解制备生物炭,而且热解能够有效杀灭病原体,达到减量化、无害化、稳定化、资源化的目的。由于污泥的成分复杂,因此,热解后的污泥基炭通常具有一定的官能团和孔洞结构,可用于吸附和催化降解污染物[8]。1971年,KONG等[9]就开始利用炭化淤渣制备污泥基炭。随后,污泥基活性炭的制备的得到了广泛关注。近年来,出现了以市政污泥做为原材料,利用物理活化、化学活化与高/低温热解技术为主体的污泥炭基功能材料的制备技术。这些制备炭材料的技术也正逐步成为污泥资源化利用的新方式[10]。任爱玲等[11]利用天津市东郊污水处理厂的污泥为原料,通过40%的ZnCl2溶液活化,制备得到的污泥基活性炭的比表面积为193~256 m2·g−1;碳材料对于制药废水中的COD去除率达到87%,对于溶液中色度的吸附率可以达到80%。刘庆等[12]将城市污泥负载上TiO2制备光催化剂用于Hg2+的去除,当水溶液中Hg2+的浓度为20 mg·L−1时,材料对溶液中Hg2+的去除率达88.5%。庞浩亮等[13]以焦化废水污泥作为原材料,通过浸渍的方法负载纳米TiO2,以ZnCl2作为活化剂制备污泥基光催化材料降解罗丹明B,去除率达98.16%。游洋洋等[14]利用生物法处理污水的剩余污泥与芬顿氧化法产生的含铁化学污泥为原材料,添加玉米芯为增碳剂,以ZnCl2为活化剂,制备臭氧催化剂降解罗丹明B,其降解效果高于80%。
Fe等金属元素可以促进芬顿反应,因此,很多研究利用污泥制备Fe负载型活性炭。传统的制备方法包括共沉淀或浸渍方法制备的Fe负载型活性炭:通过物理或化学活化的方式处理污泥先得到多孔前驱体,再通过含铁离子的溶液浸渍后进一步炭化[15-16]制得负载铁的活性炭。将污泥制备成吸附剂或者催化剂均有良好的应用价值。但是,无论是将污泥热解为吸附材料还是对污泥进行负载将其制备为催化剂,都需要对其进行活化。单独活化需要加入大量的化学药剂[17-18],以增加材料的孔隙率。例如,以KOH作为活化剂的浓度大约为3 mol·L−1,该方法费用高、工艺设备复杂,还存在未负载上的铁在炭表面结块的现象。本研究选用FeCl3·6H2O(Fe)[19]改性污泥基生物炭(C),提前将脱水污泥与铁盐混合,一步制备铁炭复合材料。以罗丹明B、对硝基苯酚为目标污染物进行实验,检验材料的光芬顿催化效果和稳定性,为污泥的资源化利用和难降解有机污染物的去除提供参考。
全文HTML
-
本实验所使用的市政脱水污泥来自上海市某污水处理厂;实验用到的罗丹明B、对硝基苯酚、双氧水(30%)、FeCl3·H2O为分析纯;高纯氮(>99.999%)。
-
高温管式炉(YB-CA上海辰华仪器有限公司);紫外灯(21-30W ZW30Z18Y 杭州亚光照明灯饰有限公司);紫外分光光度仪(6600UV-VIS 北京斯普特科技有限公司)。
-
在脱水污泥基铁炭复合材料制备时,取一定量的市政脱水污泥烘干,检测其干湿比重。按照FeCl3·H2O与污泥的干重比例为基准,称取不同质量的湿污泥,与铁盐一同放入搅拌机中混匀。将混合物放入105 ℃的烘箱中烘干后放入管式炉中焙烧,管式炉的升温、降温速率均为5 ℃·min−1,控温2 h[19]。将烧制的材料,充分研磨,过60目筛,备用。
在进行铁炭复合材料制备参数的优化时,以罗丹明B为目标污染物,固定焙烧温度为850 ℃,探究铁盐与干污泥的最佳配比。待比值确定后,固定该比值,对其焙烧温度进行优化。
在进行降解实验时,设置实验过程中有机污染物的浓度为50 mg·L−1 [20],量取150 mL污染物的水溶液于石英烧杯中,加入50 mg催化材料。在pH=4的条件下反应,静置30 min,待催化材料吸附达到稳定后,加入1 mL浓度为3%的双氧水[21],同时开启紫外灯,进行光芬顿催化降解,每隔5 min取1次样。
为考察不同酸碱条件下材料的催化性能,测试了酸性、中性、碱性条件下材料催化降解罗丹明B的效果。选取的pH分别为4、7、10。选取催化效果较好的pH条件,以对硝基苯酚为目标污染物进行降解实验,探究材料对难降解酚类有机污染物的催化降解性能。
在进行催化性能的对比实验时,设置7组对照实验,研究紫外光(UV)、双氧水(H2O2)、催化材料的作用效果,验证材料的催化性能。催化条件分别为UV、Fe/C-750-(1∶1)、H2O2、UV+H2O2、H2O2+Fe/C-750-(1∶1)、UV+Fe/C-750-(1∶1)、UV+Fe/C-750-(1∶1)+H2O2。
在进行可循环性实验时,以罗丹明B为目标污染物,通过简单的离心回收材料,放入105 ℃的烘箱中烘干后再次使用。
-
通过紫外分光光度计全光谱扫描和固定波长检测,对材料的催化效果进行测试。罗丹明B的紫外测试波长为553 nm、对硝基苯酚采用紫外全波长扫描[22]。
通过BET、SEM对材料进行表征,观察其比表面积和表面的结构[20];通过XRD、FT-IR测试获得材料的内部铁元素形成的化合物以及铁元素形成的化学键含量的变化[19]。
1.1. 实验材料
1.2. 实验仪器
1.3. 实验方法
1.4. 分析方法
-
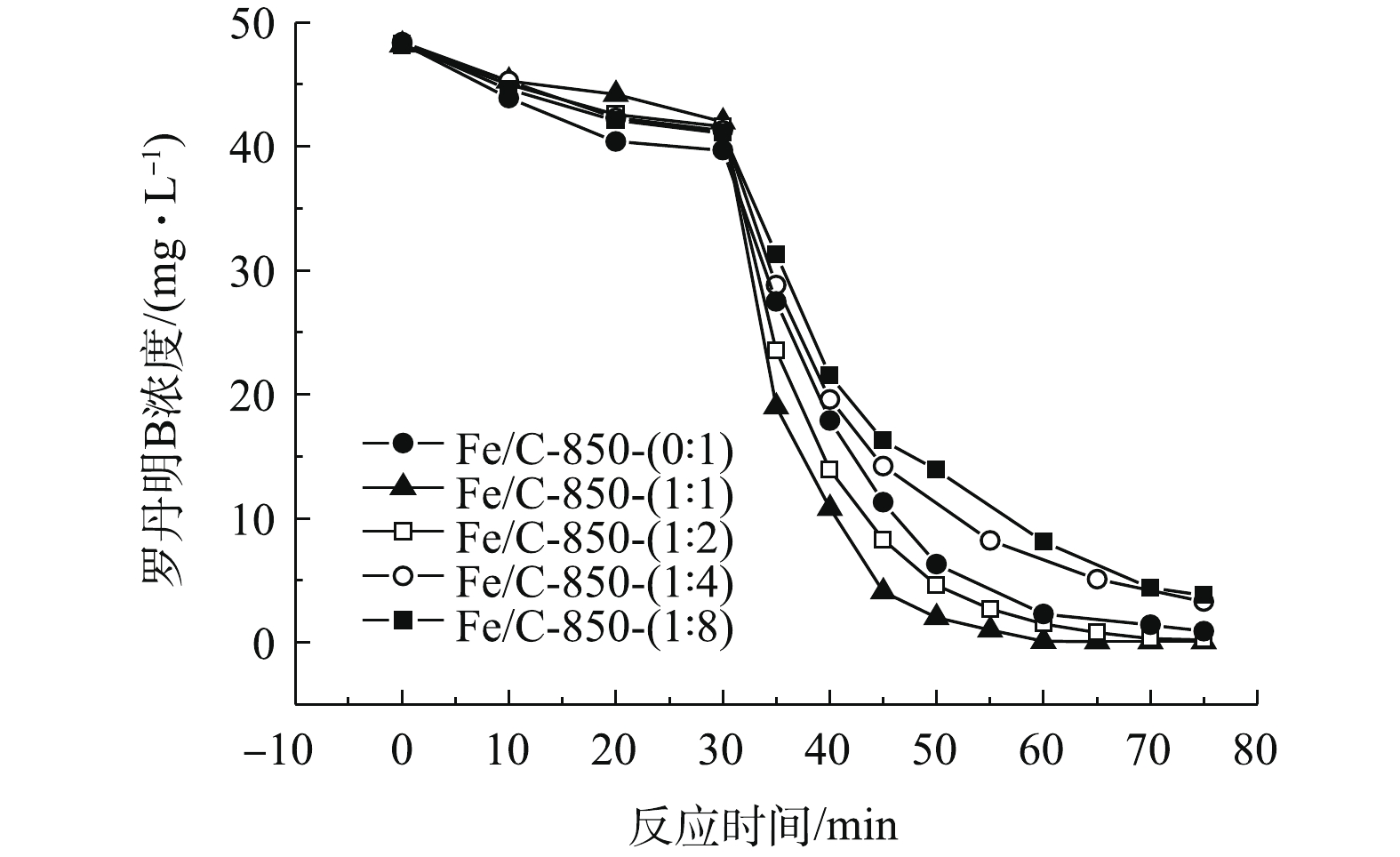
实验考察了铁盐掺杂量对材料催化降解罗丹明B的影响。有研究表明,铁元素能够促进光芬顿反应的进行[16]。铁盐的负载量过少催化效果不明显,负载量过多易造成铁盐结块现象和资源的浪费。因此,实验控制铁盐与干污泥的配比为0∶1~1∶1,选定铁盐与干污泥的配比分别为0∶1、1∶8、1∶4、1∶2、1∶1,探究铁盐适宜的掺杂量。在850 ℃下制得的样品分别为Fe/C-850-(0∶1)、Fe/C-850-(1∶8)、Fe/C-850-(1∶4)、Fe/C-850-(1∶2)、Fe/C-850-(1∶1)。
反应的前30 min是暗反应阶段,没有开启紫外灯,罗丹明B的去除主要依靠是材料的吸附作用。如图1所示,未掺杂铁盐的材料对罗丹明B的吸附率为17.8%。掺杂铁盐后,材料的吸附率略有下降。随着铁盐掺杂量的增多,材料的吸附量逐渐减少,其吸附率分别为14.9% (1∶8)、14.7% (1∶4)、13.5% (1∶2)、12.8% (1∶1)。这是因为,铁盐占据了原材料中的孔隙,破坏了材料的表面结构,从而降低了材料的比表面积。
30 min后,材料达到吸附稳定,此时开启紫外灯。在紫外灯照射下,材料的催化效果如图1所示,催化效果:Fe/C-850-(1∶1)>Fe/C-850-(1∶2)>Fe/C-850-(0∶1)>Fe/C-850-(1∶4)>Fe/C-850-(1∶8)。铁盐:干污泥为1∶4、1∶8时,材料的催化效果不如未掺杂铁盐的污泥基炭。结合材料的吸附结果,考虑可能是铁盐的掺杂量少不仅不能有效地负载铁盐,反而会破坏材料表面的结构,导致材料上的结合位点减少,不能提升材料的催化效果。当比例增加到1∶2时,罗丹明B的剩余浓度为0.8 mg·L−1(去除率98.6%),超过未掺杂铁盐的污泥基炭,但仍需要反应时间75 min。当比例进一步提高到1∶1时,在60 min内,罗丹明B的去除率即可达到98.8%。对比Fe/C-850-(1∶1)、Fe/C-850-(1∶2)、Fe/C-850-(1∶4)、Fe/C-850-(1∶8)的催化效果,可以看出,随着铁盐掺杂量的增加,材料的催化效果逐步提升。
综上所述,铁盐的掺杂会破坏材料原有的结构,过少的铁盐掺杂量并不能有效提升材料的催化性能。当铁盐的掺杂量上升时,材料能够明显的加速反应的进行,提升催化效果,表明铁盐成功负载。因此,铁盐的最佳掺杂比例为1∶1。
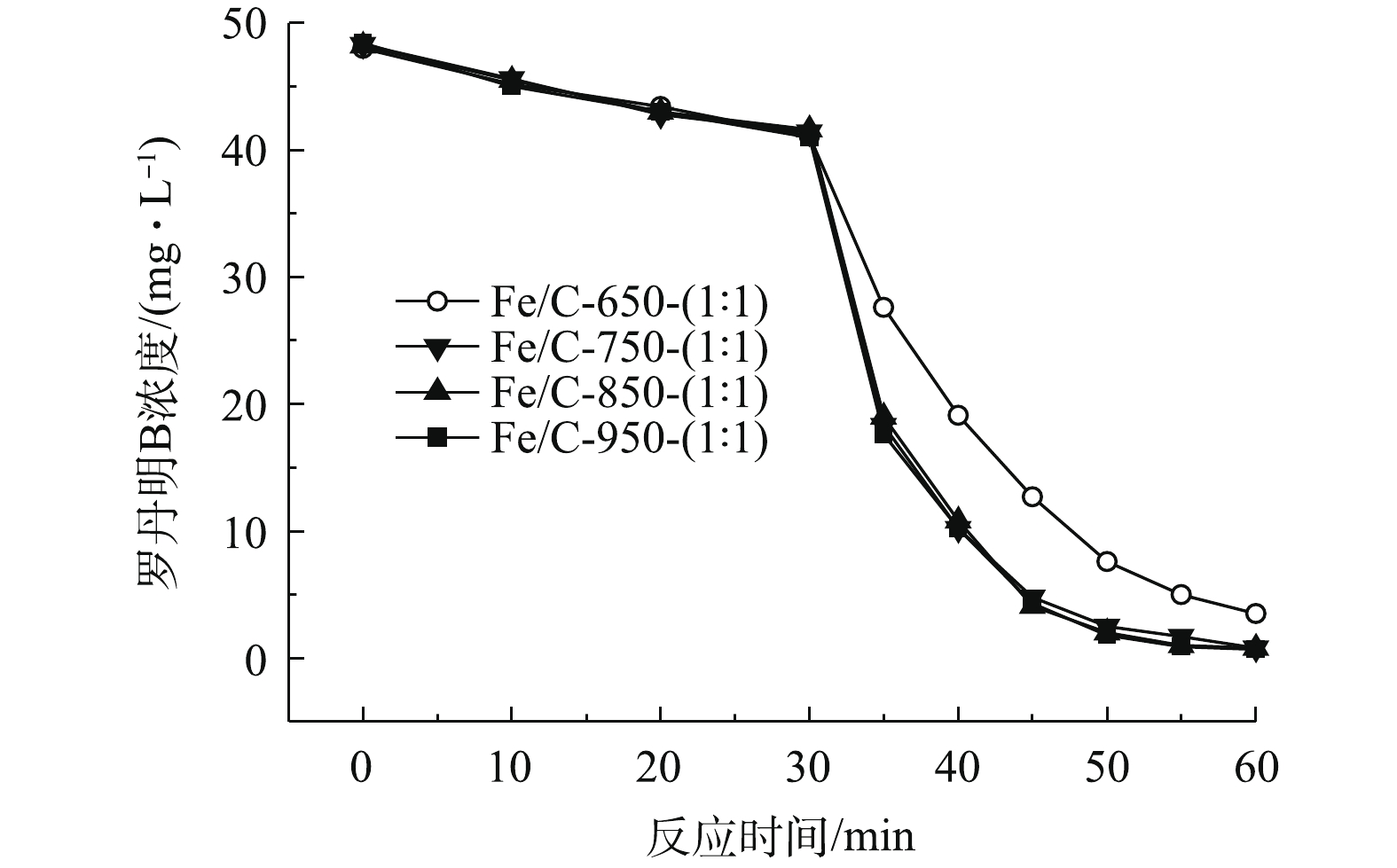
不同的制备温度会对材料中炭的生成以及材料表面的官能团产生影响[23-24],从而影响材料的催化效果。为探究不同焙烧温度对材料催化效果的影响,实验固定铁盐与污泥的比例为1∶1,设定其焙烧温度分别为650、750、850、950 ℃,对应得到一系列的材料样品分别为Fe/C-650-(1∶1)、Fe/C-750-(1∶1)、Fe/C-850-(1∶1)、Fe/C-950-(1∶1)。
如图2所示,焙烧温度对材料的催化降解效果的影响并不明显。650 ℃(Fe/C-650-(1∶1))的焙烧温度较低。其原因可能是,污泥的焙烧效果不好,没有形成良好的孔洞结构,导致其吸附量的降低[23]。Fe/C-650-(1∶1)做催化材料时,罗丹明B的剩余浓度为3.7 mg·L−1(去除率92.7%)。其他3种温度(750、850、950 ℃)下,焙烧制得的材料催化光芬顿反应对罗丹明B的降解效果都在98%左右,相差不大。由于750 ℃下的制备材料耗费的能源少、时间短、效果好。因此,选定最适合的焙烧温度为750 ℃。
-
对比不同的掺杂量和不同焙烧温度对材料表面结构以及含铁化合物形成的影响。实验选取样品Fe/C-850-(0∶1)、Fe/C-850-(1∶8)、Fe/C-850-(1∶1)、Fe/C-750-(1∶1)进行BET、SEM、XRD和FT-IR表征分析。
选取不加铁盐的材料(Fe/C-850-(0∶1))与掺杂量为1∶1的材料(Fe/C-850-(1∶1))做BET测试。结果发现,Fe/C-850-(0∶1)的比表面积为69.8 m2·g−1,而Fe/C-850-(1∶1)的比表面积为42.2 m2·g−1。这一结果与图1中的吸附测试结果一致。这说明铁盐的掺杂会导致材料的孔洞结构被破坏、比表面积下降。
材料的表面结构见图3,不掺杂铁盐的材料有一定程度的孔洞结构,但没有明显的片状结构。掺杂的铁盐量过少也不会形成特殊的片状结构,而且会破坏原有的结构,使得孔洞闭合,降低材料的催化活性。这与降解实验结果一致。在材料Fe/C-850-(1∶1)、Fe/C-750-(1∶1)中发现了明显的花型片状结构。这说明,六水合氯化铁与污泥的比例达到1∶1时,在750、850 ℃下烧制都可以形成明显的花型片状结构。这与DAI等[19]的研究结果一致。这一结构能够为反应提供良好的结合位点,有效地促进反应的进行与降解实验的结果一致。
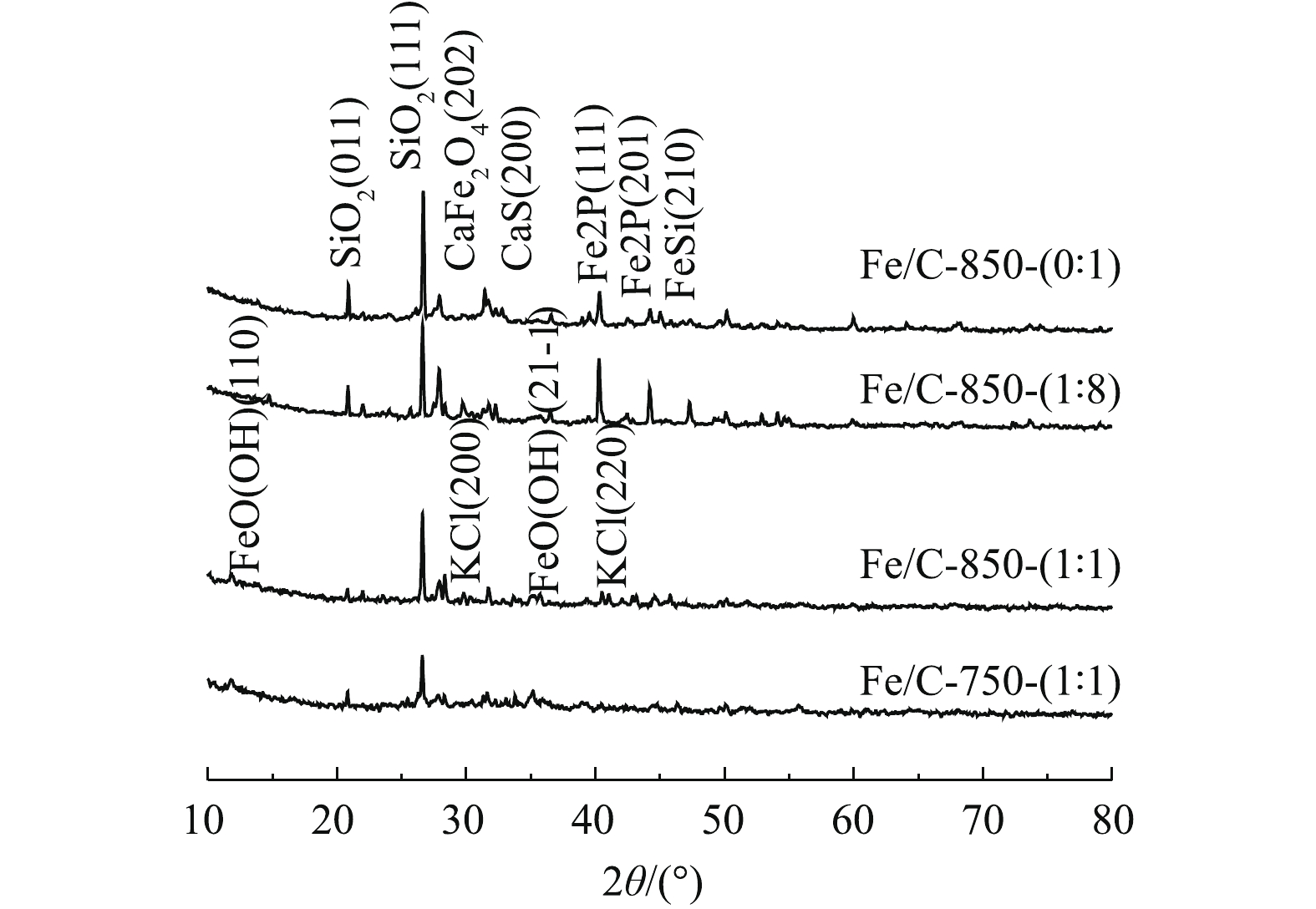
通过XRD测试结果了解4种样品内形成的含铁化合物,检测铁元素的负载情况。测试结果如图4所示,铁元素成功地负载于污泥基炭材料上,形成了多种含铁化合物。所有样品中都有大量SiO2[25]的出现。这表明原污泥中含有大量的硅元素。正如样品Fe/C-850-(0∶1)、Fe/C-850-(1∶8)所示,材料中有FeSi2(2θ=40.0°,44.2°)的出现。这说明在铁盐掺杂比例少时形成了FeSi2,也表明原污泥中含有少量的铁元素。这解释了在降解实验中不掺杂铁盐材料会有一定的效果。随着铁盐掺杂量的增加,多种含铁化合物的相继出现。在样品Fe/C-850-(1∶1)、Fe/C-750-(1∶1)中出现含铁化合物FeO(OH)(2θ=10.8°,35.1°)和Fe8O8(OH)8Cl1.35(2θ=16.8°,35.3°)。两者分别是FeOOH的α-和β-2种不同晶型结构[26-27]。而且,随着氯元素掺杂量的上升,在样品Fe/C-850-(1∶1)、Fe/C-750-(1∶1)中形成了KCl[27]。此外,掺杂进去的Fe3+与污泥中有机物发生氧化还原作用出现了Fe2P和Fe—C[28](2θ=26.4°,44.5°)。Fe2+能够直接与H2O2发生反应,所以Fe2+的出现能够有效地加速反应的进行[16],缩短反应时间。随着铁盐掺杂量的增加,Fe—C的特征峰振动幅度逐渐加强。同样,在FT-IR的测试结果中也得到了这一结论。
综合上述结果,可以看出,铁盐与市政脱水污泥成功复合,铁盐的掺杂量越多,铁炭复合材料上形成的含铁化合物种类越多。750 ℃和850 ℃下烧制的样品之间的XRD测试结果差别不大。这与图2中罗丹明B的降解结果吻合。
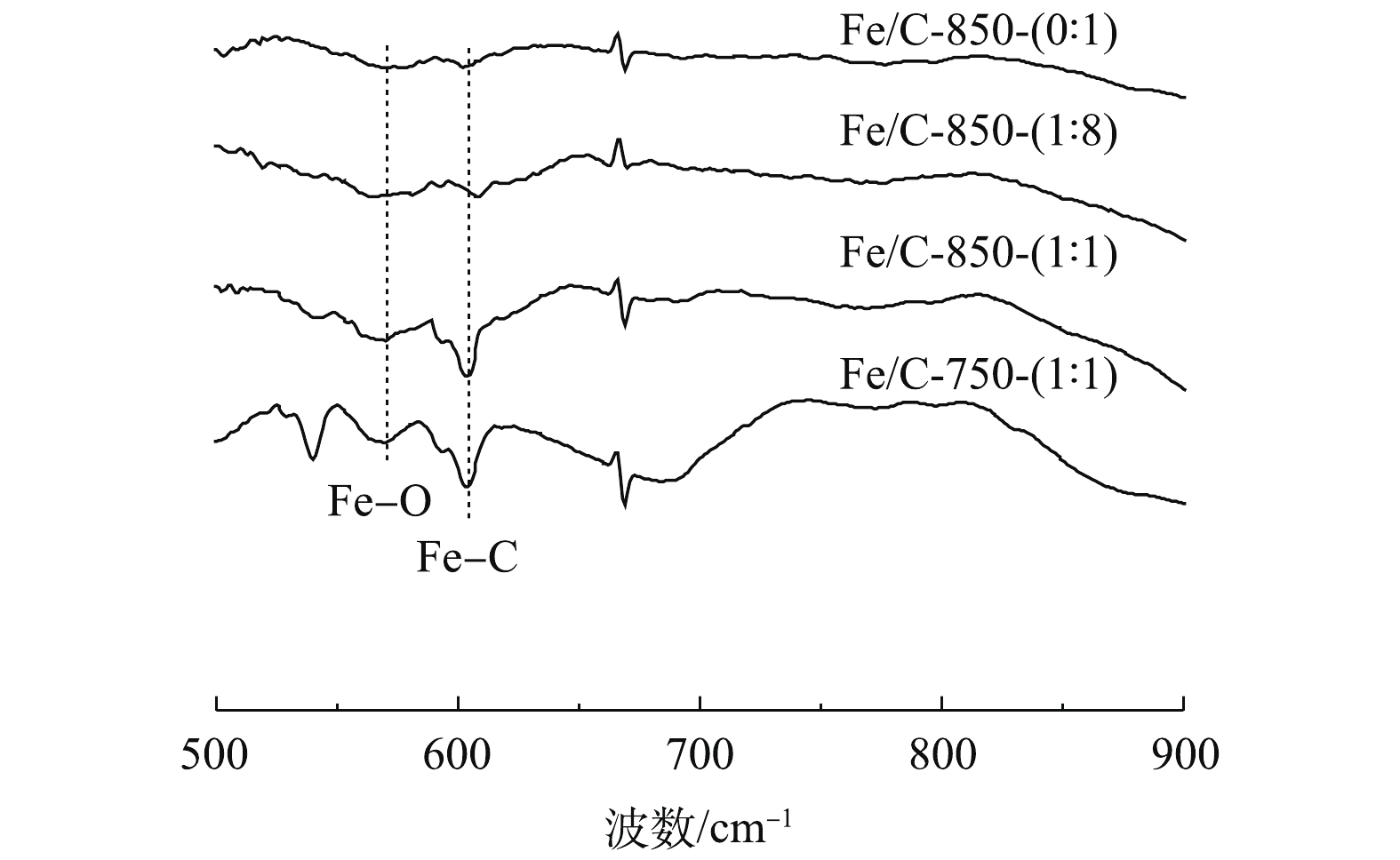
如图5所示,FT-IR图的570 cm−1处存在Fe—O吸收峰[29],随着铁盐掺杂比例的增加吸光度越来越强,Fe—O峰值越来越明显。对比Fe/C-850-(1∶1)、Fe/C-750-(1∶1),可知不同温度之间的峰型并没有太大差别。在604 cm−1处观察到的Fe—C吸收峰出现同样的变化趋势。Fe—O与Fe—C吸收峰的变化趋势说明,随着铁盐掺杂量的增加,铁的负载量越来越多,形成了更多的含铁化合物。这一结果与XRD的测试结果一致,两者相互印证,表明铁盐负载成功。
-
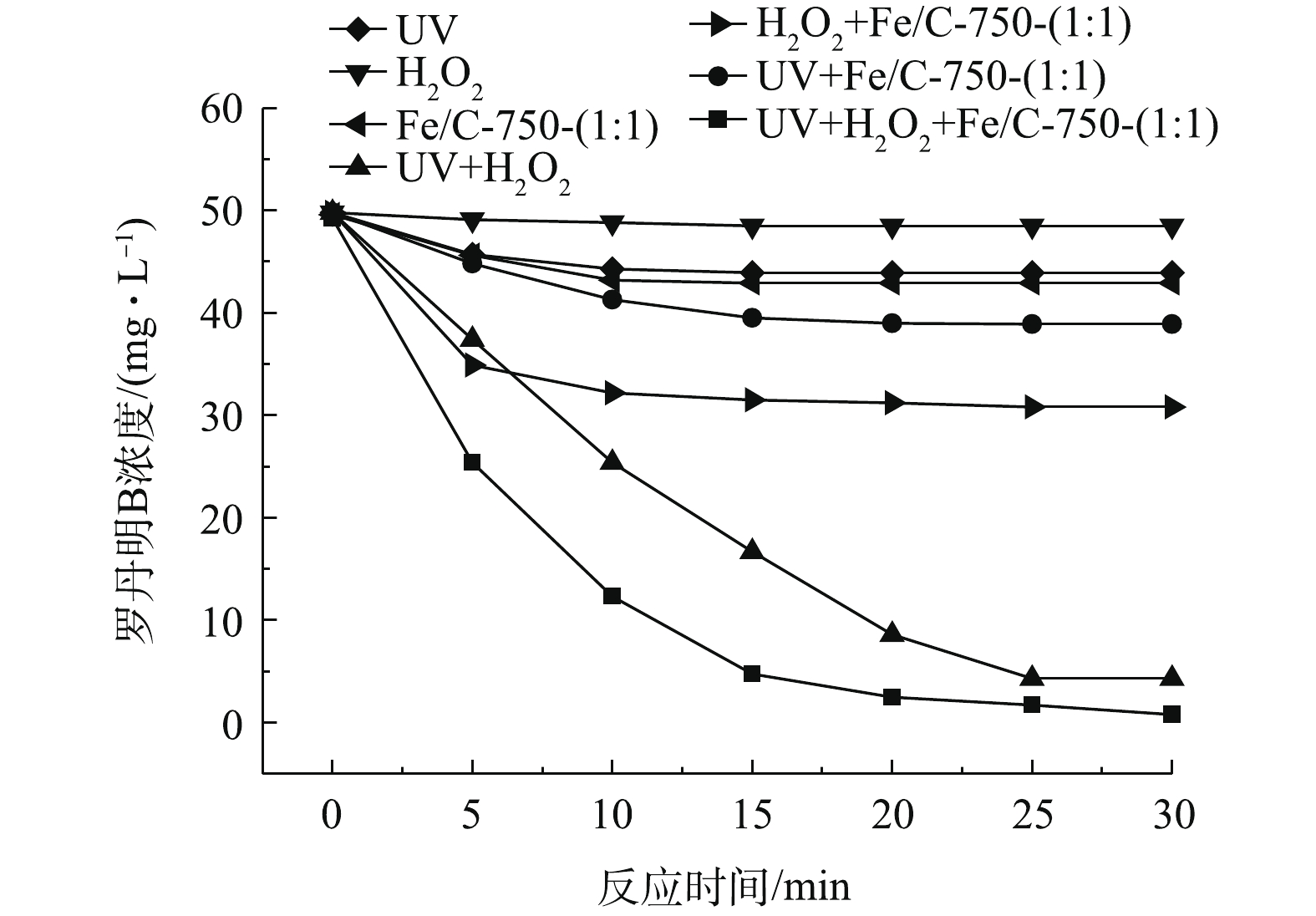
有研究发现,UV可以激发H2O2的自分解产生OH·降解有机污染物[30]。因此,实验过程中罗丹明B的降解不能确切地证明材料有催化作用。为验证铁炭复合材料Fe/C-750-(1∶1)的催化效果,并探究UV、H2O2在降解过程中的作用,分别设置3组实验探究其实验效果:UV、Fe/C-750-(1∶1)、H2O2单独使用时的效果;UV+H2O2、H2O2+Fe/C-750-(1∶1)、UV+Fe/C-750-(1∶1)两两联合作用的效果;UV+Fe/C-750-(1∶1)+H2O2三者联同作用的效果。
如图6所示,在单独UV的照射下,罗丹明B有一定量的降解;单独的Fe/C-750-(1∶1)对罗丹明B有一定的吸附;单纯的H2O2并没有效果。从H2O2+Fe/C-750-(1∶1)曲线中看出,在没有UV的条件下,催化效果并不能说明紫外光在反应的过程中是起作用的。UV+H2O2的实验结果与MONTEAGUDO等[30]的研究结果一致,紫外光可以激发H2O2的自分解,产生·OH,对罗丹明B有一定的降解效果,但反应速度慢。对比UV+H2O2和UV+ Fe/C-750-(1∶1)+H2O2曲线发现,铁碳复合材料Fe/C-750-(1∶1)起到了催化作用,大大缩短了反应的时间,并提高了H2O2的利用率。
综合上述结果,在反应的过程中有机污染物的快速降解是UV、Fe/C-750-(1∶1)、H2O2三者共同作用的结果。UV可以促进H2O2自分解,也能促进材料中的Fe3+转化为Fe2+。Fe2+与H2O2反应,生成OH·,加速降解有机污染物,促进光芬顿反应的进行。其反应方程式[19]如式(1)~式(3)所示。
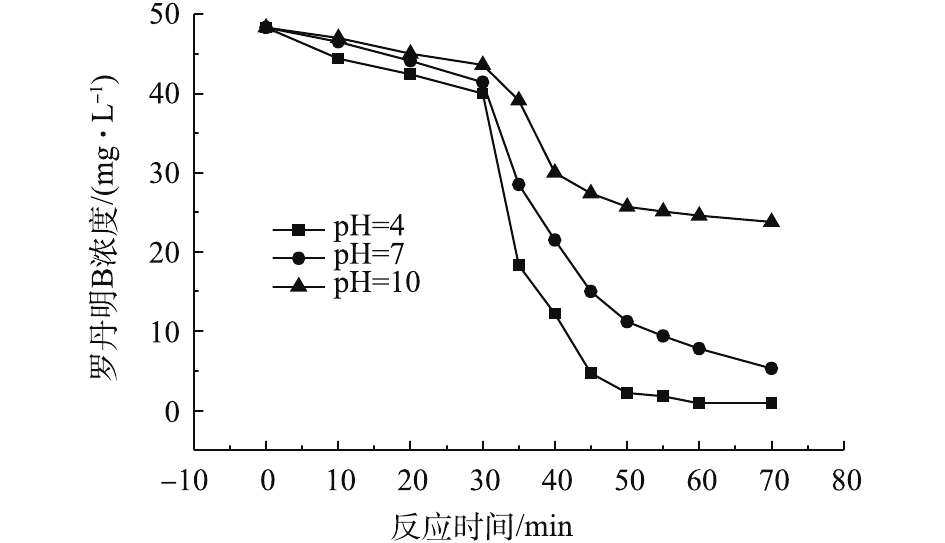
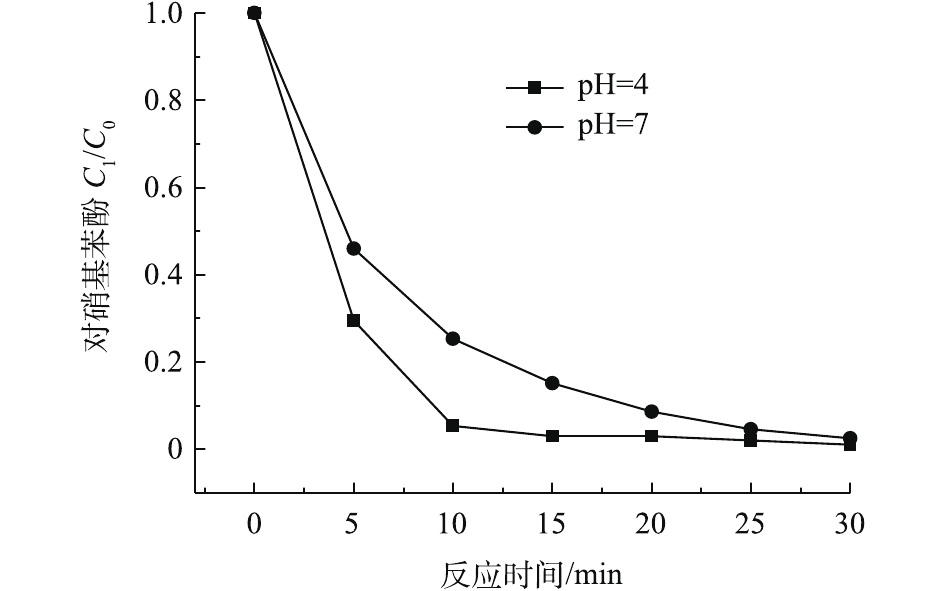
实验考察了Fe/C-750-(1∶1)对罗丹明B和对硝基苯酚的催化降解效果。Fenton反应通常在酸性条件下具有良好的降解效果,而在中性、碱性条件下的降解效果并不理想。为探究本材料在不同pH下的催化性能,选取在酸性(pH=4.0)、中性(pH=7.0)、碱性(pH=10.0)的条件下对罗丹明B进行降解。
如图7所示:在强碱性条件下,材料的催化效果较差;在酸性和中性条件下,材料具有很好的催化效果,罗丹明B的分别为98.0%和88.6%。GUO等[31]研究了石墨烯基碳材料改性铁作为非均相Fenton催化剂用于降解有机污染物,发现该催化剂具有较宽的pH适用范围。XRD测试结果表明,有多种含Fe2+和Fe3+的化合物出现,其中就有α-FeOOH和β-FeOOH。这一实验结果与HE等[32]和LI等[33]的研究结果一致,均发现FeOOH能够提升芬顿反应的pH适用范围。
为了进一步验证材料的催化性能以及材料在pH=7的条件下的催化性能,实验选取在酸性、中性的条件下,考察材料对有机污染物对硝基苯酚的催化降解效果。如图8所示,在酸性条件下,50 mg·L−1的对硝基苯酚水溶液在15 min时,左右对硝基苯酚的浓度降低为1.5 mg·L−1(去除率97%);在中性的条件下,催化反应30 min左右,能达到97.5%的降解率。
综上所述,实验制备的铁碳复合材料Fe/C-750-(1∶1)有良好的稳定性,pH应用范围广,能催化光Fenton反应降解难降解的酚类有机污染物。
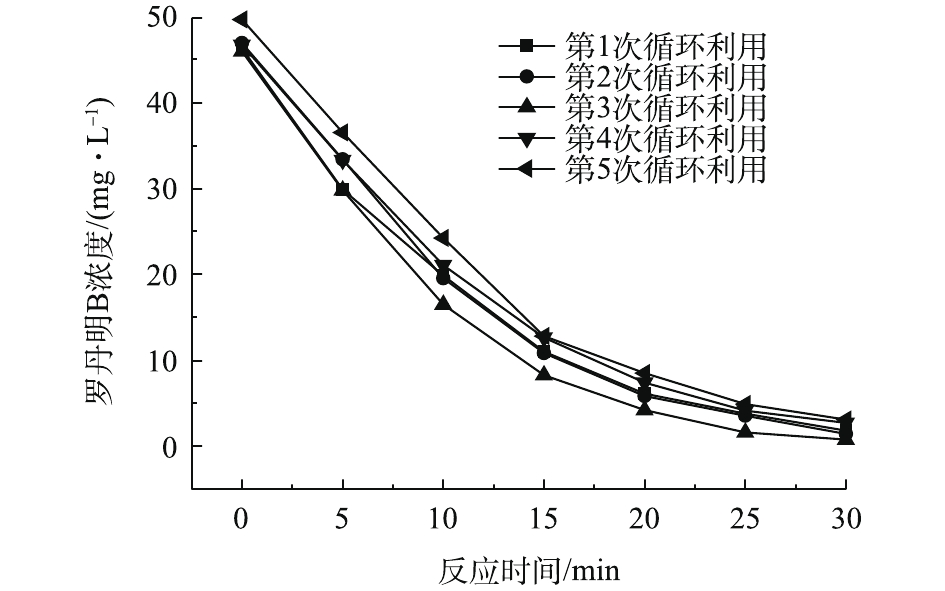
光芬顿催化材料如果不能循环利用,就会产成固体废物,造成二次污染。因此,设计实验对材料的可循环性进行探究。如图9所示,材料的第2、3次催化效果相比于第1次有所提升。这可能是由于第1次使用之后,材料的粒径更加细化、分散更加均匀,所以催化效果会提升。随着循环次数的增加,催化效果有所降低。在第5次循环利用时,铁炭复合材料对于罗丹明B的催化降解率仍达到93.7%,表现出良好的可循环性。
取酸性条件下第1次反应过后的溶液进行ICP测试,Fe离子的浸出量为0.07 mg·g−1。铁元素会有少量的浸出,但并不影响其可循环性。
2.1. 最优铁盐掺杂量的探究及温度的优化
2.2. 材料的表征
2.3. 材料的对比实验及其稳定系探究
-
1) XRD、FT-IR、SEM表征结果表明,以市政脱水污泥为前体,通过一步掺杂铁盐热解制备铁炭复合催化材料的方式可以成功的在复合材料上负载铁盐,并可以形成特殊的片状结构,有利于反应的进行。
2)利用铁炭复合材料催化光Fenton反应,可有效降解有机污染物罗丹明B、对硝基苯酚。在pH=4的条件下,降解率分别为98.3%、97.0%(15 min);pH=7时,降解率分别为88.6%、97.5%(30 min)。此结果表明,相比常规Fenton反应,该复合材料有较宽的pH适应范围。其最佳铁盐与干污泥的质量比为1∶1,最佳焙烧温度为750 ℃。
3)通过对铁炭复合材料进行对比实验发现,材料具有很好的催化性能,可以提高双氧水的利用率,缩短反应时间。在循环性能测试中发现,在材料的第5次循环利用时,罗丹明B的降解率仍然可达到93.7%。这说明,以市政脱水污泥为原材料制备的铁炭复合材料具有很好的催化性能和良好的稳定性。





 DownLoad:
DownLoad: