-
重金属元素不易溶于水,治理困难,污染危害大,从而对人类的健康状况产生了非常不利的影响[1]。目前,对重金属污染土壤的修复技术主要以物理化学法为主,以电动法、微生物法和联合修复为辅[2]。电动法是在电场的作用下,以电透渗或电迁移的方式向电极运输土壤中的重金属离子(如Pb、Cd、Cr、Zn等),再集中收集处理。ALLIOUX等[3]开发了一种新的装置,从液体中脱盐并回收珍贵金属离子,如铜、锌、镍、银和锌/铜离子混合物,然后通过简单的电氧化工艺,使金属沉积后得以回收。有研究[4]发现,脱除某些元素(如Hg)或导电性不良的矿物(如某些硫化物)时,添加适当的化学药品,在约3个月内,通过与植物技术的联用,脱除了60%的Hg。微生物对于土壤改善和污染治理也具有优良的效果,主要通过对污染物的吸附作用、污染物形态的形态转换以及污染物之间的电子转移,达到脱除重金属的目的[5]。在众多微生物中,嗜酸性氧化亚铁硫杆菌(Acidithiobacillus ferrooxidans, A.f )是一种具有极强耐受性的好氧菌,长期生活在高浓度重金属环境中的A.f菌能形成一定的耐性和抗性[6],驯化后对重金属具有良好的脱除效果。
把微生物和电化学技术联合起来,已成为当今的研究热点,有利于提高生物的修复效率。GILADI等[7]发现,微弱的电场作用可以抑制金黄色葡萄球菌(Staphylococcus aureus, S.aureus)的生长。但也有研究[8]表明,通过施加10~100 mA直流微弱电流能够刺激大肠杆菌(Escherichia coli)的生长和活动,这表明施加微弱的直流电可以加速微生物的生长。MAILLACHERUVU等[9]发现,在0.46 V·cm−1的电场强度下,有利于好氧微生物的培育,有利于增加微生物活性。
本研究针对实际电子废物拆解场地的重金属污染土壤,通过施加不同强度的微弱直流电,研究弱电场条件下嗜酸氧化亚铁硫杆菌对污染土壤中重金属脱除的影响。在保证对土壤扰动小、不易造成二次污染和低成本等优点的前提下,有效解决微生物修复土壤耗时长、效率低的缺陷。研究结果不仅可以提高污染土壤的重金属脱除效率,也为电化学与微生物联合修复土壤的实际应用提供了参考。
全文HTML
-
本实验使用的土壤样品按《土壤环境监测技术规范》中的相关要求[10],在浙江省温岭某电子废弃物拆解场地附近多点混合取样,采集0~20 cm表层土壤混合样品。土样经剔除植物根系、石砾后,过100目筛,密封保存备用。采用HNO3-HF-HCl消解体系[11]对制备土样进行微波消解。
完全消解后,测定得到供试土壤的基本特征:pH为8.1,含水率为4.3%,有机质含量为6.7%,Zn、Cu、Ni、Cd、Cr的质量分数分别为(18 000 ±100.5)、(3 973 ±36.4)、(368 ±22.7)、(41 ±1.3)、(502±31.6) mg·kg−1。
供试菌种从德兴铜矿区土壤样品中筛选并分离得到,后经过实验室多次驯化富集[12]。
9K培养基配方:硫酸铵((NH4)2SO4) 3 g·L−1、磷酸氢二钾(K2HPO4) 0.5 g·L−1、氯化钾(KCl) 0.1 g·L−1、七水硫酸镁(MgSO4·7H2O) 0.5 g·L−1、硝酸钙(Ca(NO3)2) 0.01 g·L−1、七水硫酸亚铁(FeSO4·7H2O) 44 g·L−1。用浓硫酸(H2SO4, 40%)稀释过后的溶液调pH至2.0。
实验仪器:高纯度石墨电极(C, 99.9%,上海碳素厂);精密电子天平(AL204,瑞士MEMETTLER TOLEDO公司);移液枪(BIOHIT,赛默飞世尔科技中国有限公司);pH/电位计(STARTER3100,上海奥豪斯仪器有限公司);恒温振荡培养箱(ZHWY-2112B,上海智城分析仪器有限责任公司);微波消解仪(ANTON PAAR);电感耦合等离子体光谱仪(ICAP-7200,赛默飞世尔科技中国有限公司);紫外可见光分光光度计(TU-1810D,北京普析通用仪器有些责任公司)。
-
称取1 g制备土样,加至盛有50 mL 9K培养基的150 mL的特制封闭电解容器中。初始pH为2,再向9K培养基接入体积分数10%的A.f菌,将2根直径6 mm石墨电极插入后将容器封闭,保证在通气的条件下尽可能地减少液体的损失,电极间距离为5 cm。将装置放于温度30 ℃、转速100 r·min−1的恒温水浴摇床中,连接直流稳压电源进行培养。设置3个电流强度处理,分别是20、60和100 mA,每个处理外加1个不加电场的空白对照组(CK1)和1个不接菌种的空白对照组(CK2),每个处理重复3次。周期为5 d。
在第0、1、2、3和5 天采集石墨电极以及培养基的样品。用5%HNO3消解石墨电极表面的电沉积并定容于50 mL容量瓶内。在培养基样品与电沉积消解后,样品按1∶20与1∶100比例用5%HNO3稀释,供分析目标重金属含量用。
对采集的土壤样品利用紫外可见光分光光度计测定有机质的质量比[13];利用pH计、氧化还原电位仪对实验过程中的pH、Eh进行测定;用ICP-OES分析稀释后的液态样品中重金属Zn、Cu、Ni、Cd、Cr的浓度。
1.1. 供试材料
1.2. 实验方法与分析方法
-
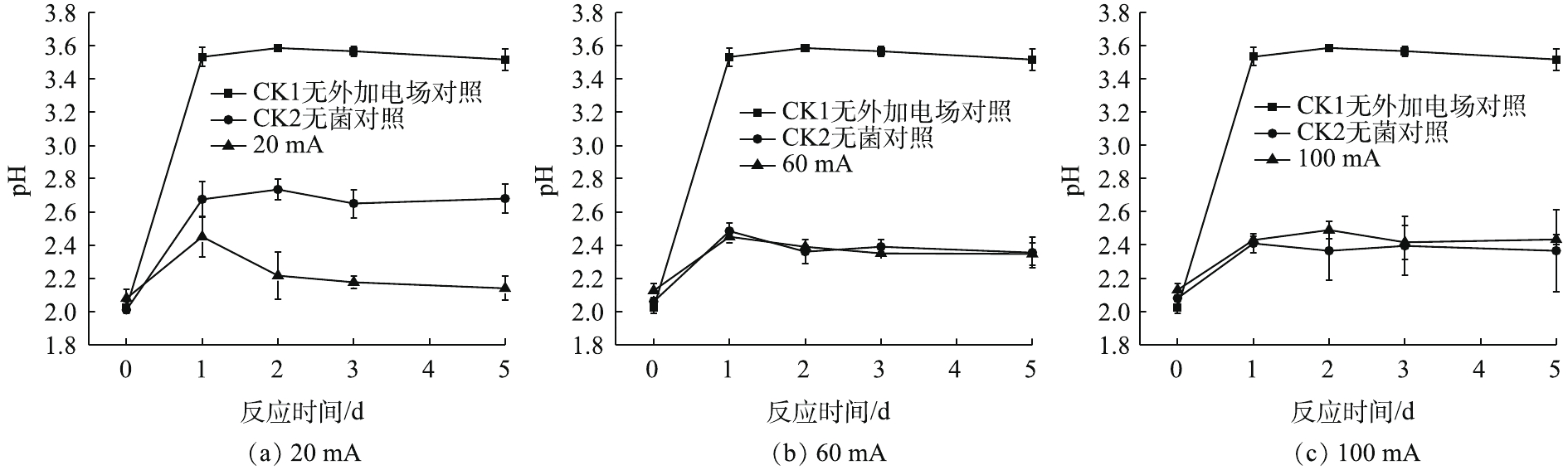
如图1(a)所示,与2组对照相比,20 mA实验组菌液的pH随时间的变化呈现小幅度上升,随后下降并趋于稳定。在0~1 d上升趋势明显;在1~2 d呈下降趋势;在3~5 d变化不明显,且pH稳定在2.1。加菌无电场对照组(CK1)在0~1 d上升,其pH在1~5 d维持在3.5左右;加电场无菌对照组(CK2)在第5天的pH保持在2.6左右,变化趋势略同于CK1对照组。
由图1(b)和图1(c)可以看出,施加60 mA与施加100 mA电流强度的实验组pH在第1 天后变化不明显,5 d后,pH稳定在2.3。与CK2对照相比,施加60 mA与施加100 mA的实验组随时间变化不明显,变化曲线大致相同。综上所述,在电场的作用下,对于电子废物拆解场地的重金属污染土壤来说,施加60 mA与100 mA的微弱电流后,5 d后的pH为2.3。
当A.f菌用于生物淋滤系统时,系统中pH的下降是嗜酸微生物大量繁殖的标志[14]。在厌氧条件下,A.f菌可以氧化元素硫并还原三价铁,出现了细胞的增殖[15],同时产生H+,降低pH,反应见式(1)。
土壤的缓冲作用会让pH在第1 天有一定程度的上升。当系统施加微弱直流电后,菌液中仍存在微弱的电化学作用,阳极得到电子,导致H2的产生,从而使H+浓度略微下降。当菌液中发生电解水反应时,阳极所产生的H+形成了一个向阴极移动的酸区;阴极产生的OH−形成一个向阳极移动的碱区。当酸区的移动速度大于碱区时,使原本酸性菌液的pH呈现下降趋势[16],所以pH在第1天后下降。因此,在20 mA直流稳压电场的作用下,微电场可为A.f菌创造更加适宜的生存环境。
-
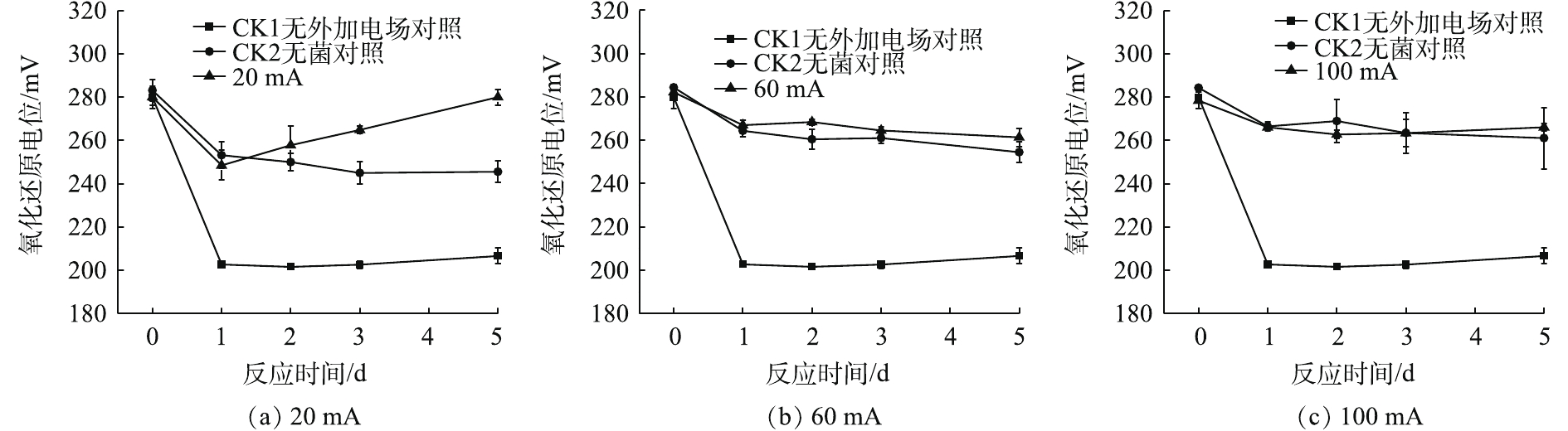
如图2所示,在9种处理中,5 d后,施加20 mA的微弱电流的实验组氧化还原电位(Eh)最高,呈上升趋势,与2组对照相比,变化各不相同。由图2(a)可以看出,20 mA实验组在1 d后的Eh下降到245 mV;在5 d后,Eh达到280 mV。CK1对照组的上升趋势不明显,5 d后的Eh维持在200 mV;CK2对照组在1~3 d呈现下降趋势,并在3~5 d稳定在250 mV。
由图2(b)与图2(c)可知,在60 mA与100 mA电流强度的条件下,实验组与相应的CK2对照组的Eh变化规律大致相同。在电化学反应的作用下,5 d后的Eh达到260~270 mV,高于20 mA电流强度条件下的CK2对照组。综合来看,20 mA实验组的Eh更高,变化更明显。这说明在微电场的作用下,整个体系的氧化还原能力更强。
对A.f菌施加20 mA的微电场,Eh明显升高。在生物电化学反应中,氧还原反应是生物呼吸等生命过程中最重要的反应,也是能源转换系统的重要反应[17]。从图2(a)中可以看出,20 mA实验组的Eh明显上升,这是微生物和电化学共同作用的结果,外加适宜强度的直流电不仅可以促进细菌生长,加速菌体生长代谢的过程,还能增加细胞膜的通透性[18]。在生物淋滤系统中,Eh也是反映菌种生物活性的标志之一[14],同时体现了体系中金属离子氧化还原能力的强弱,Eh的上升有利于污染土壤中重金属的脱除。综上所述,对A.f菌施加20 mA的微电场,不仅增强了A.f菌的活性,也利于在石墨电极上还原金属离子。
-
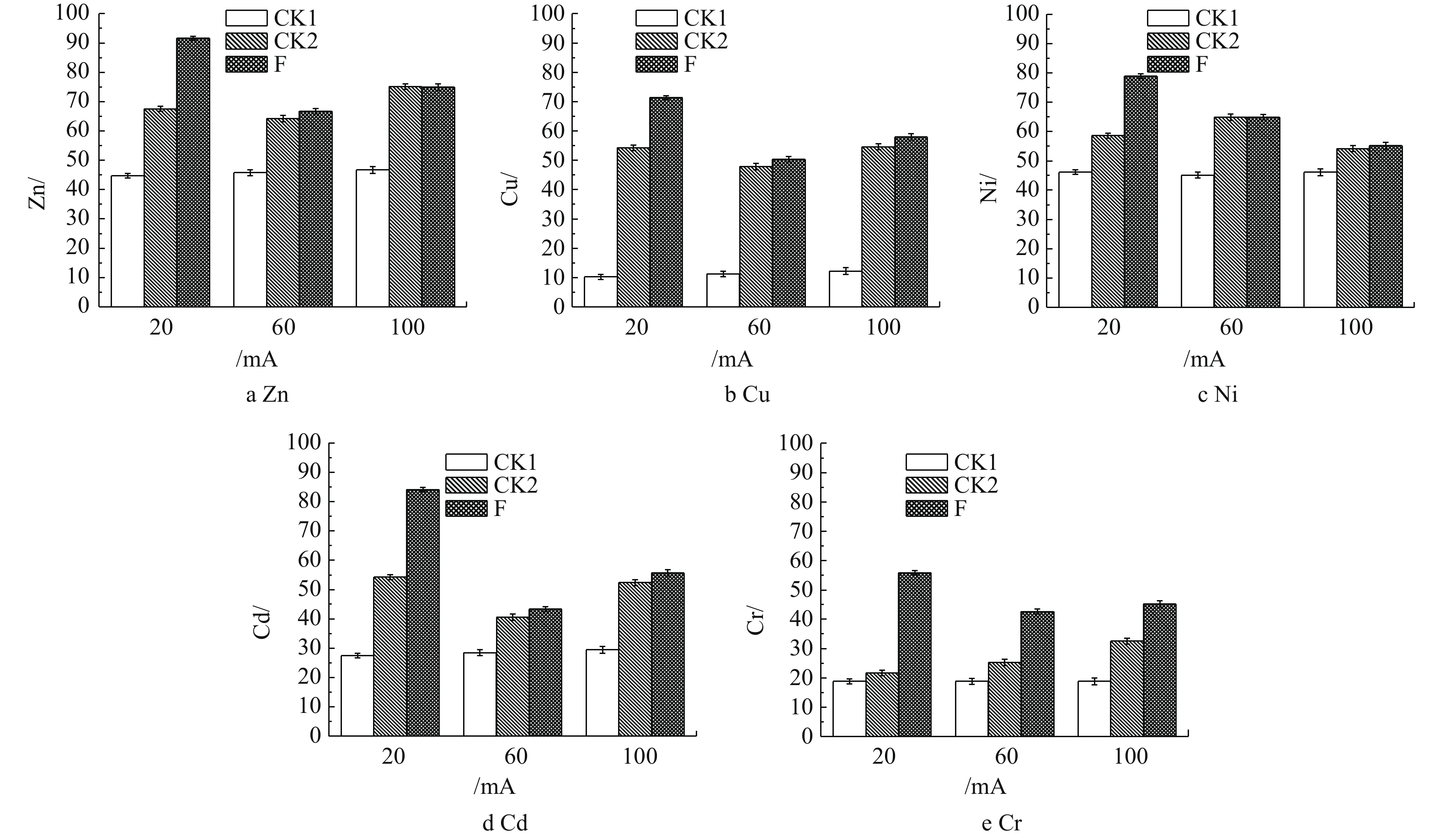
由图3可知,当电流强度为60 mA和100 mA时,在相应电流强度下,CK2对照组相比于F实验组对土壤中Zn、Cu、Ni、Cd和Cr脱除率的提升不明显。这说明在电流强度为60 mA与100 mA的条件下,整个体系的反应以电场作用为主导,且这样的电流强度对A.f菌淋洗土壤中的重金属存在消极的影响。这是由于实验所选用的嗜酸细菌(A.f),对于直流微弱电流的耐受性达到了极限,从而抑制了嗜酸细菌的氧化还原反应。在电流强度为100 mA时,对Zn、Cu、Cd、Cr的脱除率提升不明显。这说明当体系内的电场作用成为主导时,微弱直流电的小幅度提升不能提高重金属的脱除效率。根据电化学作用的机理,当体系的电流强度越大时,重金属离子迁移的速率越快。以上情况说明,施加不同强度的微弱直流电,对污染土壤中的重金属确实存在影响,但是具体的影响还有待实验探究。而在20 mA条件下,F实验组明显提高了污染土壤中重金属的脱除率。土壤中Zn、Cu、Ni、Cd和Cr的脱除率较CK2对照组分别提高74%~91%、58%~72%、62%~78%、57%~85%和46%~56%。在20 mA的微电场条件下,相较CK1对照组,A.f菌对目标重金属的脱除率提高得更多,其中脱除Cu的提升效果最为明显,由10%提高至72%。可见,在电场的作用下,A.f菌对于污染土壤中重金属的脱除效果具有十分积极的影响。在20 mA的电场作用下,A.f菌可以提高脱除土壤中重金属的效果。
由图3(a)可以看出,Zn的脱除率达到最高。对于重金属Zn来说,20 mA条件下的F实验组与CK2对照组相比,对Zn的脱除率高出16%,这是由于对A.f菌施加微电场的引起的。相比于20 mA条件下的CK1对照组对Zn的脱除率提升不高的原因是,在实验前,土壤中的Zn离子大部分是以离子态的形式存在的[19]。在培养基初始pH为2的条件下,浸出液中已有大量离子态的Zn,这些Zn离子再通过电场作用迁移至装置的阴极。
由图3(b)可知,施加20 mA的电场使A.f菌对Cu的脱除率高出CK2对照组14%。这是因为在电场作用下,微生物淋滤的Fe2+出现了定向迁移,导致微生物在实验后期的养分不足,从而使Cu的硫化物结合态被A.f菌氧化进入的溶液速度减缓[20]。电流强度与反应时间也会对Cu离子的脱除效果产生影响,在不抑制A.f菌生长活动的前提下,增加反应时间,该体系对Cu脱除效果的提升仍然会十分明显[21]。
图3(c)表明,相较于20 mA条件下的F实验组和其他电流条件下的CK2对照组,Ni离子的脱除率可高出15%。这是由于在电场的作用下,Ni2+容易与OH−形成沉淀Ni(OH)2,pH对Ni离子的影响非常大[22]。在本体系中,酸性环境非常利于Ni离子迁移到阴极上,所以电场的作用会较为明显,从而导致在20 mA条件下F实验组的脱除率提升并不明显。但是,较低的pH会对阳极产生不利影响,从而破坏体系的稳定性。
对于重金属Cd来说(图3(d)),经过驯化的A.f菌对Cd具有一定的耐受性,20 mA的电流条件下F实验组对Cd的脱除率高出CK2对照组28%。因为Cd离子在电场作用下的活动性有限,处于电场内不同位置的Cd离子,其运动速率与该位置到阳极的距离成反比[23]。而F实验组在A.f菌的作用下,使更多的Cd成为离子态,让Cd离子向阴极运动,从而被脱除。
由图3(e)可以看出,20 mA条件下的F实验组对重金属Cr的脱除率仅高出其他电流条件下的F实验组10%。这是由于Cr在土壤中会以Cr3+、Cr6+的形式存在,而大部分Cr3+会形成Cr(OH)3沉淀。这些沉淀在电场作用下难以迁移,而土壤中Cr6+会以含氧阴离子的形式存在,在电场的作用下向阳极区域迁移[24]。A.f菌通过自身的代谢作用,将土壤中硫化物结合态的Cr浸出。由于土壤中硫化物结合态的Cr含量有限,导致A.f菌对Cr的浸出量较少,使Cr的脱除率低于其他重金属。研究结果表明,在20 mA的微电场作用下,A.f菌可以更高效地脱除电子废弃物拆解场地土壤中重金属。在第5天时,20 mA条件下对土壤中重金属Zn、Cu、Ni、Cd、Cr的脱除效果最佳,脱除率分别达到91%、72%、78%、85%、56%。
2.1. A.f菌在不同电流强度下pH的变化
2.2. A.f菌在不同电流强度下氧化还原电位(Eh)的变化
2.3. 不同电流强度对重金属脱除率的影响
-
1)在不同强度的微弱直流电场作用下,A.f菌脱除电子废物拆解场地污染土壤中重金属的研究结果表明:在20 mA直流稳压电场的作用下,可以为A.f菌创造更加适宜的生存环境,可以提高整个体系的氧化还原能力。
2)在20 mA直流稳压电场的作用下,A.f菌对Cu脱除率的提升效果最为明显。当电流强度为60 mA以上时,对A.f菌淋洗土壤中的重金属存在消极的影响。
3)当20 mA直流稳压电场作用于A.f菌时,可以高效脱除电子废物拆解场地的土壤重金属Zn、Cu、Ni、Cd、Cr,5 d后,其去除率分别达到91%、72%、78%、85%、56%。与仅施加电场或接菌的条件相比,脱除率提高18%以上,脱除后的土壤重金属含量低于建设用地土壤质量标准(GB 36600-2018)。因此,将A.f菌置于20 mA的微电场条件下,可以高效脱除电子废弃物拆解场地土壤中高浓度重金属,使土壤质量达到国家标准。





 下载:
下载:
 百度学术
百度学术


