-
近年来,很多废水逐渐呈现出低C/N比的水质特征,譬如化肥废水以及废水经过厌氧发酵后的生化出水。传统生物脱氮技术难以很好地适应该类废水,处理过程中需要额外增加碳源及补充碱度等,处理效果不好且经济效益不高。基于传统生物脱氮理论的深入研究和工程实践,一系列新型生物脱氮工艺应运而生,如同步硝化反硝化工艺(SND)、短程硝化反硝化工艺(SHARON)、厌氧氨氧化工艺(ANAMMOX)、全程自养脱氮的CANON工艺和OLAND工艺[1-2]。其中,CANON工艺是SLIEKERS等[3]在厌氧氨氧化工艺基础上提出来的一体化全程自养脱氮工艺(completely autotrophic ammonium removal over nitrite),该工艺在1个反应器中由氨氧化菌(AOB)和厌氧氨氧化菌(ANAMMOX)同时完成氨氧化和厌氧氨氧化2个反应。与传统生物脱氮工艺相比,CANON工艺在取得较高生物脱氮效果的同时对曝气、有机碳源等能耗的需求显著降低,优势明显,近年来备受中外学者青睐[4-5]。但CANON工艺因其一体化的系统易受温度、pH、碱度、溶解氧(DO)等运行条件变化的影响[6-8],启动周期很长。付昆明等[9]在接种普通活性污泥中,耗时210 d以启动CANON工艺;而奥地利Strass污水处理厂[10]经历了2.5 a才能够完成启动,实现了0.7 kg·(m3·d)−1的氨氮去除率,从启动到应用,较传统成熟工艺滞后了1 a。因此,从工程应用角度分析,突破CANON工艺启动时间长的瓶颈是目前的研究重点。
从微生物角度分析,实现CANON工艺的快速启动和稳定运行亟需解决的难题是AOB和ANAMMOX的快速培养和富集[11]。近年来,CANON工艺快速启动的研究主要集中在垃圾渗滤液、污泥消化液、养殖场废水等高氨氮(>500 mg·L−1)、低C/N比废水的处理[12-14],其中实现快速启动的方法大多是培养AOB和ANAMMOX共存的复合颗粒污泥[15-16]。对于中低浓度的氨氮废水(<500 mg·L−1),ANAMMOX富集极易受DO等条件变化的影响[17-18],颗粒污泥的形成十分缓慢。因此,在低基质浓度下如何控制系统DO和氮负荷等条件以实现CANON的快速启动是目前研究的难点和重点。李思敏等[19]和付昆明等[20]研究发现,填料挂膜可以促进厌氧氨氧化微生物的富集生长,增加AOB和ANAMMOX对水质水量变化的耐受程度;同时,在低基质浓度下,通过缩短水力停留时间(HRT)以实现较高的氮素去除负荷的方式也有利于CANON反应器的快速启动。
本研究采用升流式生物膜反应器,在实验室条件下,以模拟氨氮废水为基质(200 mg·L−1),采用逐步缩短HRT协同提高DO、回流比满足微生物阶段性生长需求的方式,对恒温(35 ℃)条件下的CANON工艺启动进行了研究,旨在解决中低浓度氨氮废水处理中所存在的ANAMMOX富集困难、CANON工艺启动时间长的问题。
全文HTML
-
接种污泥来自于某市政污水处理厂二沉池普通活性絮体污泥,接种污泥浓度为8.50 g·L−1。实验用水采用人工配水,配水所用药品包括NH4Cl、KH2PO4、FeSO4、MgSO4·7H2O、NaHCO3、CaCl2等,具体水质浓度如下:氨氮为200 mg·L−1左右,碱度为1 600 mg·L−1左右,Ca2+为30 mg·L−1,Mg2+为30 mg·L−1,Fe2+为10 mg·L−1,TP为15 mg·L−1;在反应器整个运行期间,水浴控制恒温(35 ℃左右),系统pH为7.8~8.2。
-
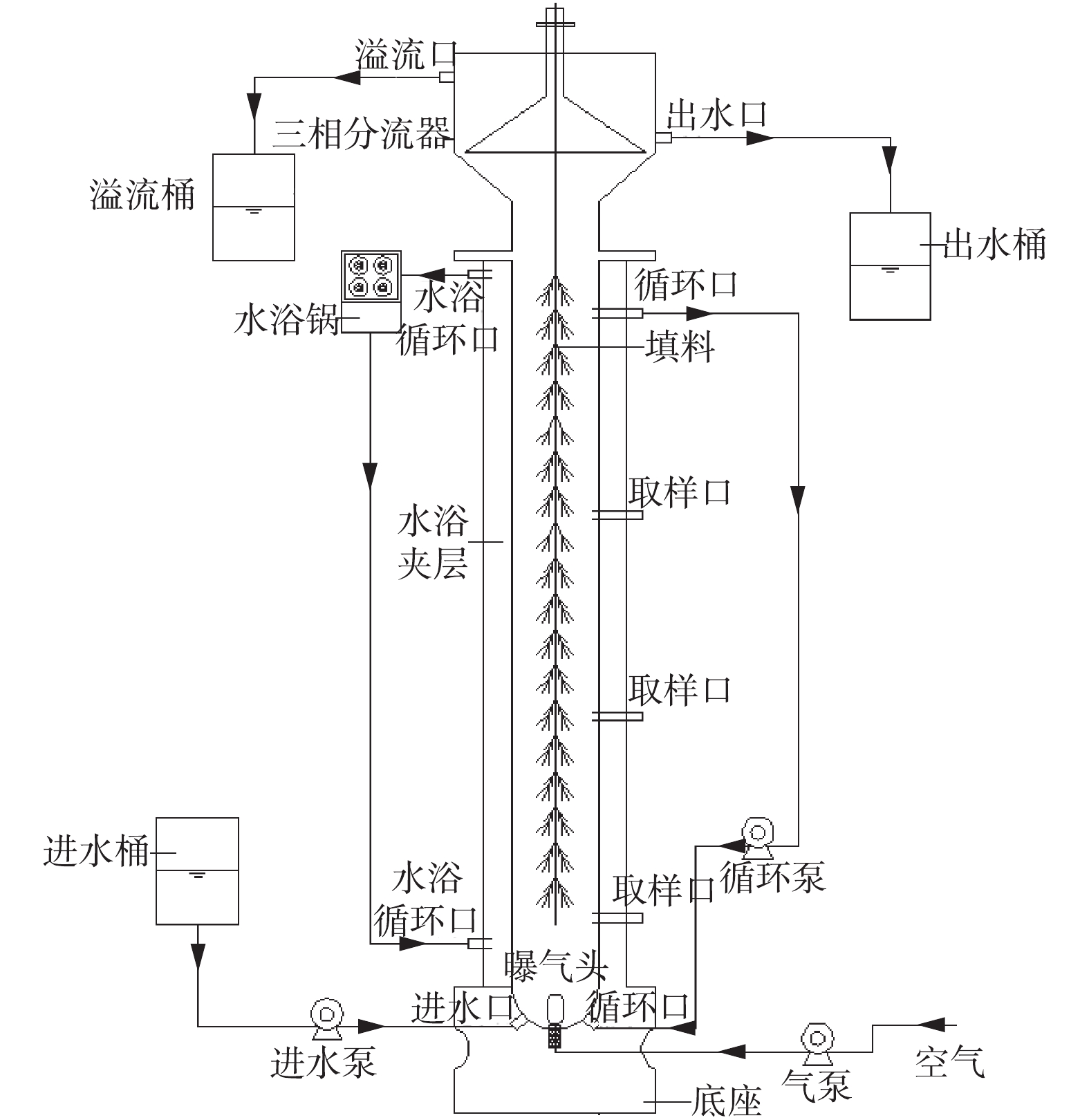
图1为升流式生物膜反应装置,材质为有机玻璃,反应器内径为0.06 m,外径为0.10 m,柱高为1.3 m,有效容积为3.5 L。反应装置底座连接进气口、进水口以及循环口,分别配有气泵、曝气头、进水泵和循环泵;反应装置柱体设有水浴保温夹层且用避光材料包裹;反应装置中间悬挂弹性针状填料,填料占反应装置有效体积的20%~30%;反应器顶部设有三相分离器,用以泥水分离。
-
根据调控参数不同和系统状态差异,将整个启动过程分为污泥驯化阶段、AOB和ANAMMOX富集阶段、系统强化阶段3个阶段。不同阶段逐步缩短HRT、提高曝气量,通过调整回流比平衡进水氮负荷(NIL)和DO。在本研究中,对于回流比的调控主要考虑2个方面:一方面是缓冲作用,其中包括稀释底部进水氨氮浓度以降低对菌群的抑制和通过调整循环量使底部曝气在反应器内分散均匀;另一方面,随着污泥沉降性的改变,提高上升流速保证污泥流动状态以强化传质。根据各阶段污泥沉降性不同,本反应器以控制上升流速在0.2~0.5 m·h−1为依据。启动过程,各阶段主要运行参数调控如表1所示。
-
${\rm{NH}}_4^ + $ -N、${\rm{NO}}_2^ - $ -N、${\rm{NO}}_3^ - $ -N、TN均参照文献中的方法[21]进行分析测定;溶解氧选择哈希HACH-HQ30d荧光溶氧仪测量;系统pH采用FE28 meter pH计直接测量;污泥微观形态由Nikon-ECLIPSE显微镜配合Canon-DS126311相机观察拍照;污泥粒径采用Mastersizer 2000激光粒度仪测定;微生物群落通过16S rRNA进行高通量测序分析。系统的自由氨(FA)、自由亚硝酸(FNA)值[22-23]分别按照式(1)和式(2)进行计算。
式中:CFA为游离氨浓度,mg·L−1;CFNA为游离亚硝酸浓度,mg·L−1;
$C_{t,\;{\rm{NH}}_3} $ 为总亚硝酸盐浓度,mg·L−1;T为温度,℃。活性实验中,氨氮的消耗速率(
${V_{{\rm{NH}}_4^ + }}$ )按照式(3)进行计算。式中:
${V_{{\rm{NH}}_4^ + }}$ 为消耗氨氮的速率,mg·(g·h)−1;${{C_{{\rm{NH}}_4^ + }}}$ 为消耗氨氮的浓度,mg·L−1;M为污泥浓度,g·L−1;t为时间,h。
1.1. 实验原料
1.2. 实验装置
1.3. 实验方法
1.4. 分析方法
-
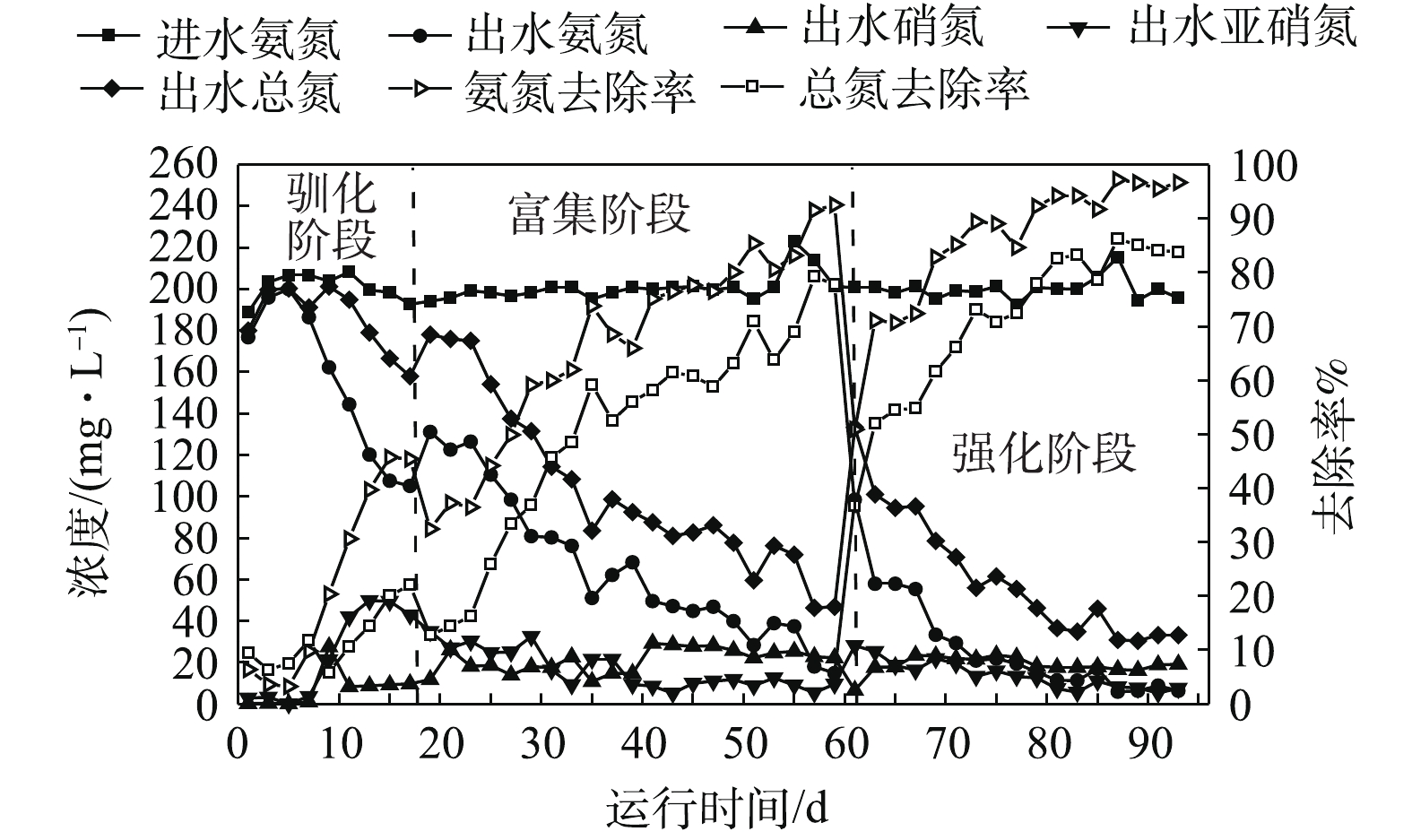
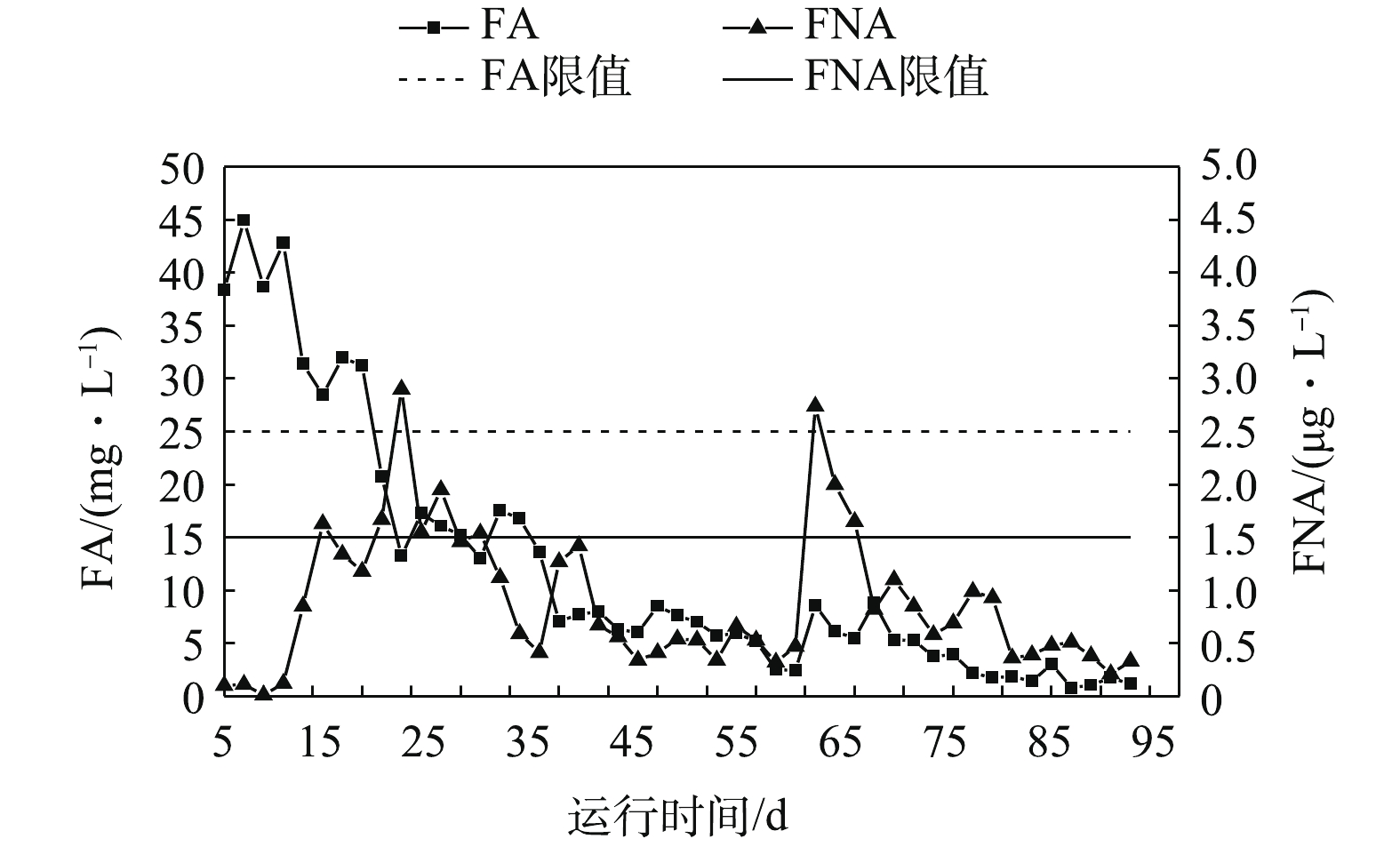
在污泥驯化阶段(1~17 d),HRT为12 h,设置回流比为50%、上升流速为0.21 m·h−1,满足柱内絮体污泥的流动状态。在运行初期(1~7 d),系统处于厌氧状态,强化抑制接种污泥中NOB的活性,为启动亚硝化创造条件。如图2所示,在厌氧阶段,反应器出水氨氮大于190 mg·L−1,出水硝氮和亚硝氮接近0,该过程无亚硝化和厌氧氨氧化反应发生。系统内大量的碱度和氨氮无法利用,pH暂时高于8.2,从而导致FA在一定时间段内处于较高的水平。有研究[14]表明,游离氨的存在对NOB的抑制作用明显大于AOB,因此,适量游离氨的存在有利于AOB成为系统中的优势菌群。从第8天开始,系统开始进行曝气,曝气量为0.05 L·h−1,控制DO浓度为0.10~0.20 mg·L−1,在避免NOB的过量繁殖的同时为亚硝化创造条件。如图3所示,随着亚硝化反应的加强,亚硝酸盐开始累积,FNA在 8~17 d逐渐升高,且达到HUANG等[24]和韩志勇等[25]报道的平均抑制水平(1.5 μg·L−1)。在运行至第17天时,出水中硝氮为9 mg·L−1左右,亚硝氮为49 mg·L−1,氨氮去除率可达到45%,总氮去除率可达到20%。
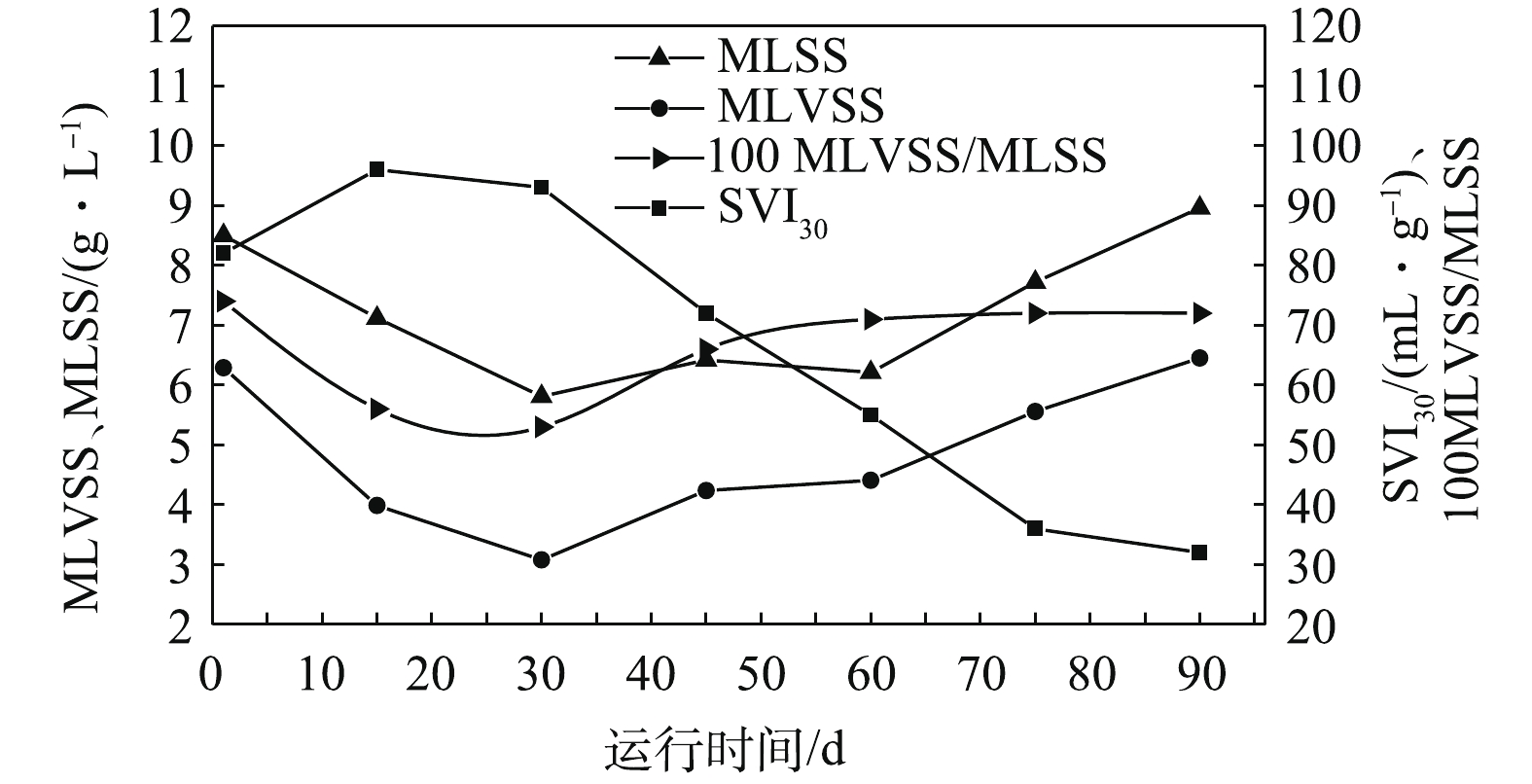
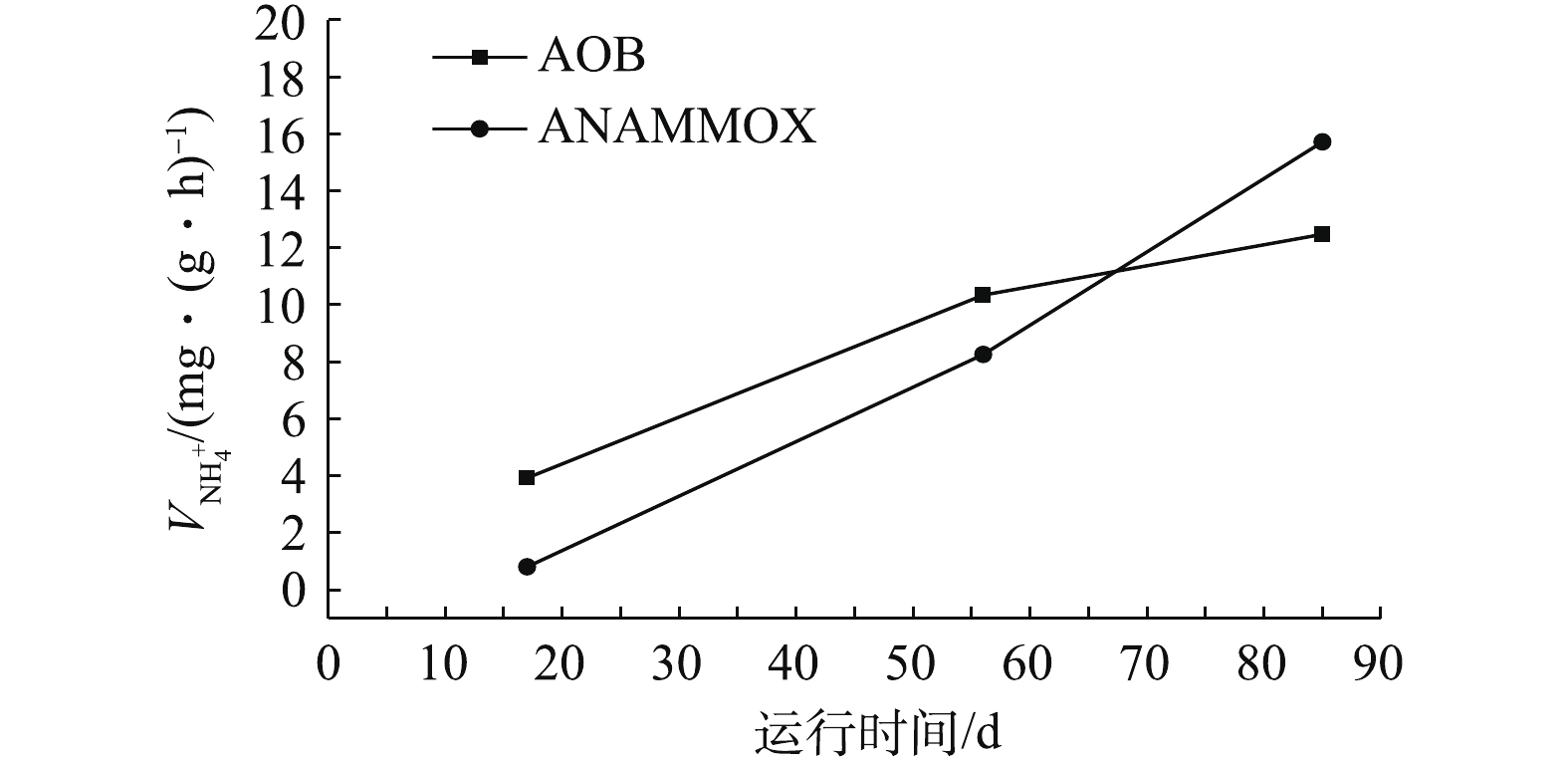
在污泥驯化阶段,SVI30由82 mL·g−1增加到96 mL·g−1(图4),污泥沉降性变差。同时MLSS、MLVSS分别由8.5、6.29 g·L−1下降至7.12、3.99 g·L−1,两者的比值由0.74下降至0.56,这可能是系统淘汰了不适应菌群所致。17 d时进行污泥的的活性实验测试,得到AOB对氨氮的去除速率为2.93 mg (g·h)−1。结果表明,污泥驯化阶段亚硝化过程已经初步形成,但由于ANAMMOX增殖慢,厌氧氨氧化过程不是十分显著。
在AOB和ANAMMOX富集阶段(18~60 d),为了实现AOB和ANAMMOX的快速富集,提高系统氨氮和总氮去除率,在运行第19 天时,将HRT缩短至8 h,NIL为0.597 kg·(m3·d)−1。由图2可知,随着HRT的缩短,系统NIL增加,氨氮和总氮去除率分别下降至32%和12%,这可能是AOB受FNA抑制活性降低导致。因此,加大回流比至100%,可以减轻FA和FNA累积对菌群的抑制作用。同时,在此阶段内,将曝气量提升至0.06 L·h−1,DO提升至0.3~0.4 mg·L−1。该阶段内AOB主导的亚硝化顺利进行,为厌氧氨氧化创造了条件,此时氨氮去除率由32%逐渐上升至68%,总氮去除率为50%左右,推测部分亚硝氮和剩余氨氮在ANAMMOX的作用下生成少量硝氮和氮气。但由于ANAMMOX活性不高,出水亚硝氮剩余20 mg·L−1左右,厌氧氨氧化反应不完全。第40天时,提升曝气量至0.08 L·h−1,初期DO上升至0.35~0.5 mg·L−1,加大回流比至150%,加快上升流速至0.35 m·h−1。随着反应的进行,DO很快恢复至0.3~0.4 mg·L−1。反应器运行第56 天时,出水氨氮降至20 mg·L−1以下,亚硝氮浓度降至10 mg·L−1以下,硝氮为23 mg·L−1左右,总氮去除率达到78%。在整个过程中,pH始终稳定在7.9~8.1,提供适当的回流有利于溶解氧在系统内分布均匀,避免底部过高的DO抑制ANAMMOX的活性。FA和FNA分别逐渐降低至抑制浓度25 mg·L−1和1.5 μg·L−1以下,对系统不产生抑制作用。
在AOB和ANAMMOX富集阶段,填料上逐渐出现红色生物膜,系统中SVI30由驯化阶段的96 mL·g−1逐渐下降至55 mL·g−1,污泥沉降性能得到了改善。与此同时,MLVSS/MLSS从0.56降到0.53,再上升至0.71,污泥中生物组分明显增加。在运行第56天时,分别对AOB和ANAMMOX进行了活性测试(图5),此时AOB消耗氨氮的速率为10.35 mg·(g·h)−1,ANAMMOX消耗氨氮的速率为14.26 mg·(g·h)−1,两者生物活性显著提高,氨氮去降性能明显改善。持续运行7 d后,系统对氨氮的平均去除率达到90%以上,可认为AOB和ANAMMOX已经成为优势菌群,且富集成功。
在系统强化阶段(61~93 d),为了进一步提高系统运行负荷及总氮去除效率,加快ANAMMOX的挂膜进度、改善污泥性能,实现CANON的高效稳定运行,反应器运行至第61 天时继续缩短HRT至6 h,NIL为0.795 kg·(m3·d)−1。同时,在逐渐将曝气量由0.08 L·h−1提高至0.12 L·h−1的过程中,系统DO在0.3~1.0 mg·L−1范围内波动。总氮去除率随着HRT的缩短而下降至36%,这说明系统内增大的NIL和DO致使亚硝氮短期内大量积累(出水亚硝氮28 mg·L−1),推测ANAMMOX活性受抑制,厌氧氨氧化过程反应受到影响。通过提高循环比至200%,使上升流速增大至0.42 m·h−1,从而释底部进水氨氮浓度的方式降低对菌群的抑制。在该阶段中,FA始终处于限值25 mg·L−1以下,由于短暂的亚硝氮积累,FNA在提高负荷的1周内迅速升高,随后很快降到正常值水平。随着反应器的持续运行,系统保证了适宜的上升流态和合适的DO条件,更多ANAMMOX挂在弹性针状填料上,系统趋于稳定。运行至93 d 时,填料上挂满了红色的ANAMMOX菌群,絮体污泥主要为棕黄色。
在系统强化阶段,SVI30由55 mL·g−1继续下降至32 mL·g−1,MLVSS和MLSS分别增长至6.45 g·L−1和8.96 g·L−1,呈上升趋势;而MLVSS/MLSS在该阶段为0.71~0.72(图4),且较为稳定,是污泥性能变好的特征。通过对在85 d时AOB和ANAMMOX的活性测试,得到AOB消耗氨氮的速率为12.28 mg·(g·h)−1,ANAMMOX消耗氨氮的速率为16.72 mg·(g·h)−1,两者均具有很高的生物活性(图5)。结果表明,通过缩短HRT提高NIL,同时通过加大回流比以提高上升流速的方式有利于淘汰劣势菌种和富集优势菌群。如图2所示,该阶段后期氨氮平均去除率可达到95%,总氮平均去除率可达到82%,这表明升流式生物膜反应器中CANON工艺的成功启动且运行稳定。
在CANON工艺启动过程中,与好氧菌AOB不同,ANAMMOX属于厌氧菌,大量溶解氧的存在对ANAMMOX有抑制作用[26],因此,创造适合两者共存的环境是实现CANON工艺快速启动的关键[27-28],而本实验通过悬挂弹性针状填料在反应器内部分割好氧/厌氧区,同时给ANAMMOX菌群提供附着生长点,实现了两者在微氧系统里的共存,增大了CANON系统对溶解氧的耐受阈值。
-
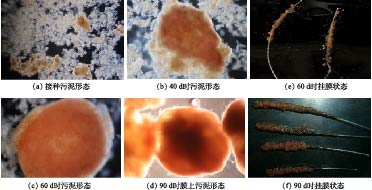
随着反应器的运行,污泥的颜色、形态也不断变化,其结果如图6所示。污泥启动初期呈絮体状态(图6(a)),颜色为浅黄色,平均粒径为54.809 μm;反应器运行至40 d时,系统出现了较多的ANAMMOX菌群,污泥开始变为棕黄色并呈聚集态变化(图6(b)),平均粒径为107.360 μm;缩短HRT至8 h后,反应器负荷提高,同时提高循环量加大柱内污泥碰撞频率,在该状态下运行至60 d时红色ANAMMOX菌群开始松散地挂在弹性针状填料上(图6(e)),反应器絮体污泥中也存在少量红色颗粒污泥,该阶段颗粒平均粒径迅速增长到302.624 μm;在反应器运行至90 d时,系统内污泥平均粒径达到473.607 μm;填料上挂满了红色的ANAMMOX污泥(图6(f)),该污泥在显微镜下呈球形状态,颜色为红褐色(图6(d))。不同阶段的污泥变化结果表明,提高负荷、适时提高曝气量和控制合适循环量的方式有利于污泥性能改善、促进ANAMMOX挂膜的形成,可为系统稳定运行提供保障。
-
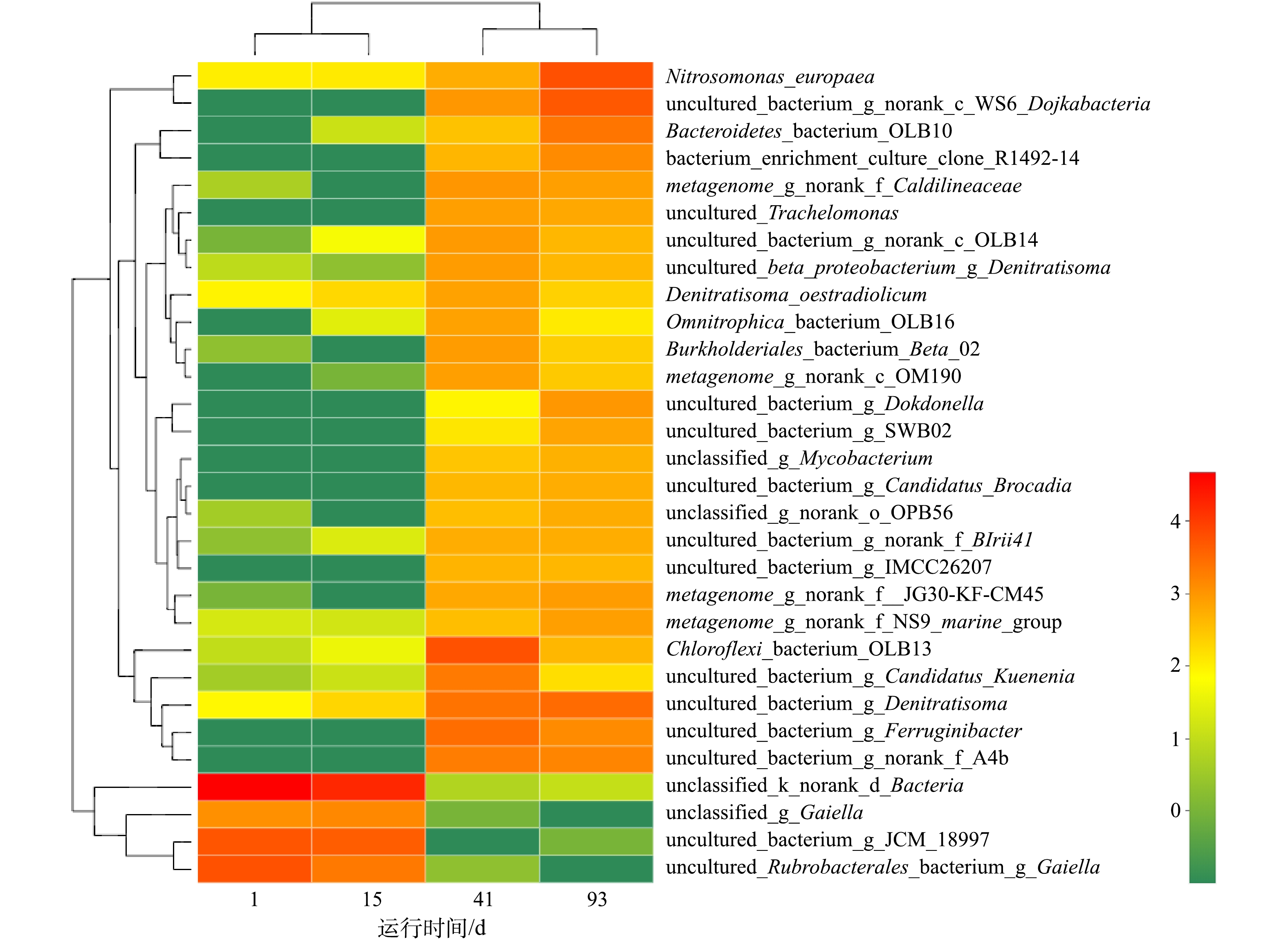
通过细菌16S rRNA测序方法分析了CANON反应器启动过程中不同时间段4个污泥样品的微生物群落组成。如图7所示,各个阶段反应器内微生物的群落结构组成变化明显。接种初期的活性污泥,含有少量的AOB和ANAMMOX。反应器运行第15天时,通过生物多样性分析发现,AOB占细菌总DNA条数的2.08%,ANAMMOX占比仅为1.8%,与污泥接种初期相比,AOB和ANAMMOX数量变化不大。运行至41 d时,AOB快速富集,其占比增长至15.40%,逐渐成为优势菌种。由于ANAMMOX倍增时间长,相比AOB生长较为缓慢,以Candidatus_Kuenenia为主的ANAMMOX在该阶段仅增殖至6.31%。在反应器运行至第3阶段时,ANAMMOX在填料上不断富集,第93天时,系统污泥中AOB占比增长至19.46%,ANAMMOX占比增长至22.49%,此时可认为絮体中的AOB和填料上的ANAMMOX已经成为该系统的优势菌群,这与上述实验结果一致。
在本研究中,AOB在富集阶段快速增长,而倍增周期长的ANAMMOX则因为填料提供了附着生长点[29],在挂膜阶段迅速增殖成为优势菌群,这说明针状填料的添加加速了ANAMMOX的富集。对比微生物群落热图(图7),整个启动过程中数量变化明显的为快速增长的AOB和ANAMMOX菌属中的Candidatus_Brocadia和Candidatus_Kuenenia,在氨氮作为唯一氮源的CANON系统中,这2种菌以亚硝氮为电子受体,对氨氮具有较强的去除能力。同时,反应系统结构导致的差异是影响厌氧氨氧化细菌群落结构和分布的重要原因[30];在本研究中,一方面,推测启动初期厌氧模式和升流模式淘汰了NOB等非功能菌群;另一方面,厌氧氨氧化菌属的黏附性强于其他菌属[31-33],通过添加针状填料形成生物膜,避免了生物量的流失。该结果为中低浓度氨氮废水处理中ANAMMOX的富集提供了一种可行方式,给CANON工艺的工程化应用提供了数据支持。
2.1. CANON工艺的启动过程
2.2. 污泥形态变化
2.3. 微生物群落组成分析
-
1) CANON工艺采用缩短HRT提高负荷、适时提高曝气量和回流比的方式成功启动,创造了利于AOB和ANAMMOX共存增殖的条件,在93 d后,实现了CANON工艺的启动,很大程度上缩短了启动时间,为CANON工艺的快速启动提供了一种新思路。
2)活性污泥经过3个阶段的运行后,升流式生物膜反应器中CANON工艺能稳定运行。反应器内氨氮去除率达到95%,总氮去除率达到82%,FA和FNA均在合适范围内,最终回流比为200%,系统可接受DO为0.1~1.0 mg·L−1,系统对DO耐受阈值提高,对实际废水的处理具有意义。
3)在升流式反应器中,被淘汰的NOB随着系统的升流模式排出反应器,针状填料的添加给微生物菌群提供了生长附着点,加快了ANAMMOX的富集,功能菌AOB和ANAMMOX(以Candidatus_Brocadia和Candidatus_Kuenenia为主) 占比分别为19.46%和22.49%,成为系统优势菌群。启动完成时,系统集成絮体、颗粒和填料挂膜3种污泥形态为一体,解决了中低浓度氨氮废水中CANON工艺难以高效稳定运行的问题。



 下载:
下载: