-
正渗透技术是一种新兴的膜分离技术,其在污水浓缩处理中具有一定的应用潜力。正渗透(forward osmosis,FO)是一种膜工艺,在不同的行业中得到广泛的应用。在食品加工行业中,正渗透技术逐步取代了传统的热加工分离技术,SHALINI等[1]的研究表明,与热分离过程相比,通过正渗透过程后,甘蔗原汁可以在18 h内由250 mL浓缩至99.6 mL,且不会失去原有的色泽和风味的同时,提高了工作效率。在废水处理行业中,JIANG等[2]在4 mol·L−1的NH4HCO3作为汲取液的情况下,采用正渗透膜技术从油砂废水中回收85%以上的水,对离子型污染物有80%~100%的截留率。GE等[3]利用Na3[Cr(C2O4)3)]络合物作为汲取液,在60 ℃时,从高含砷原水中回收水,最终将含砷量降至10 μg·L−1以下,达到了世界卫生组织(WHO)的标准。在净水行业中,FO成为一种可行的海水淡化工艺,以NH3-CO2为汲取液应用于正渗透海水淡化,均获得了较高的脱盐效率,并且汲取液可以通过加热回收。由于不需要大量借助外力,FO技术耗能相当于传统脱盐技术的72%~85% [4]。
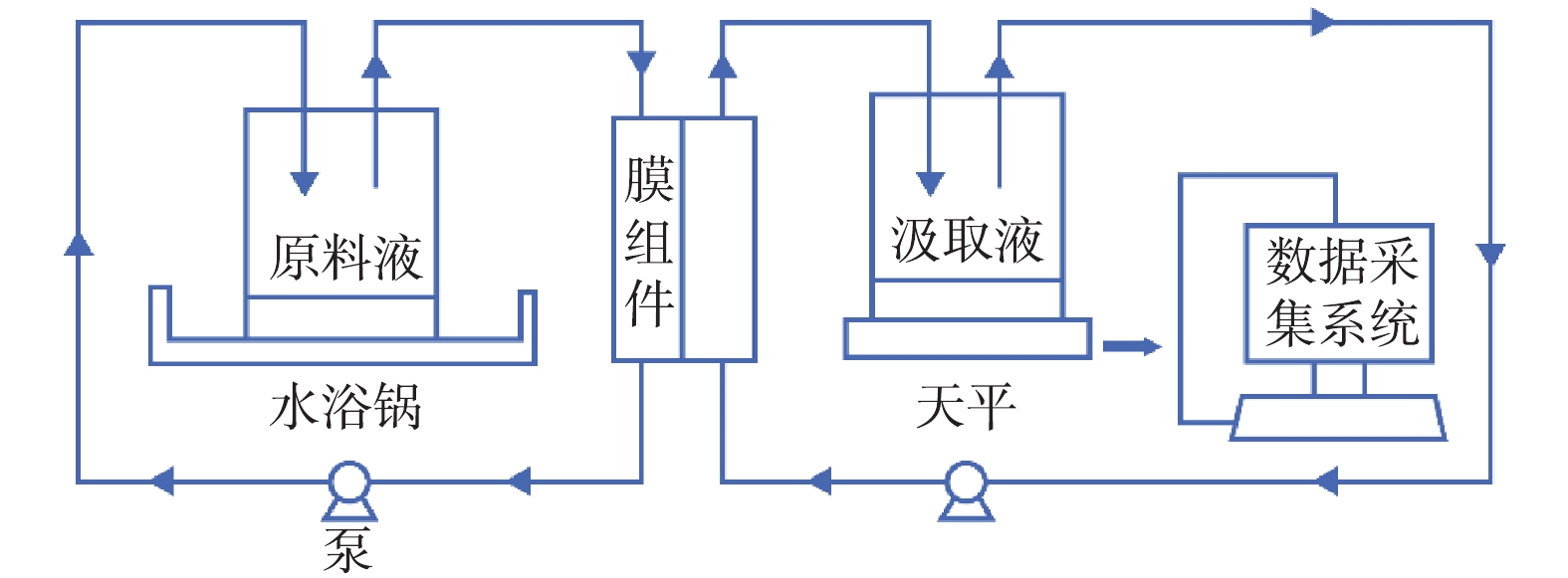
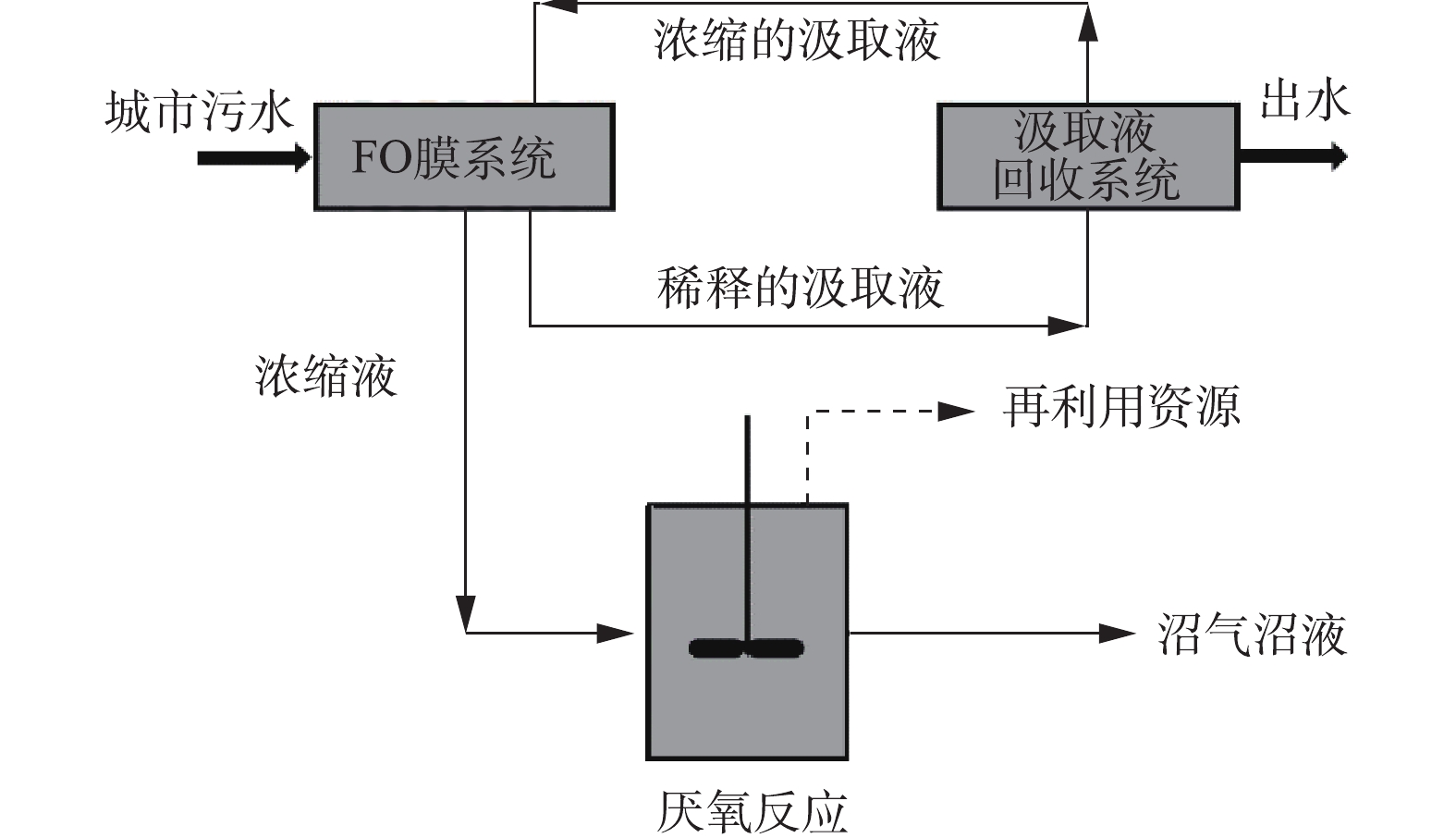
近年来,FO工艺因在废水资源回收方面的优势受到广泛关注[5-8]。FO不需借助大量外界能量,依靠渗透压差来浓缩污水[9-10],浓缩后的污水可以进行资源化处理;膜上积累的污染物结构松散,恢复性较好[11-14];被稀释后的汲取液,如氯化钠可以通过反渗透方式回收,氯化镁可以通过纳滤方式回收;回收后的汲取液重新进入FO系统[15],同时获得高质量出水,如图1所示。汲取液是否能提供高的渗透压、低的反混通量和便捷回收,是FO工艺的关键之一。
LIU等[16]使用碳酸氢铵与8种可溶性无机盐(K2SO4、NaCl、KCl、KNO3、NH4Cl、NH4NO3、尿素和(NH4)2HPO4)的混合汲取溶液处理去离子水和微咸水时,发现8种混合汲取液的水通量均得到增强。这说明混合无机盐汲取液具有一定的协同作用。HAMDAN等[17]利用渗透压计算得出,NaCl和MgCl2的混合汲取液可以获得优良的可持续性操作渗透压性能。目前,鲜有混合无机盐汲取液浓缩城市污水的有关研究报道。本研究考察了不同浓度配比的混合无机盐(MgCl2和NaCl)汲取液对我国南方低浓度城市污水的浓缩性能,并对膜污染进行了考察,为FO用于城市污水资源化提供参考。
全文HTML
-
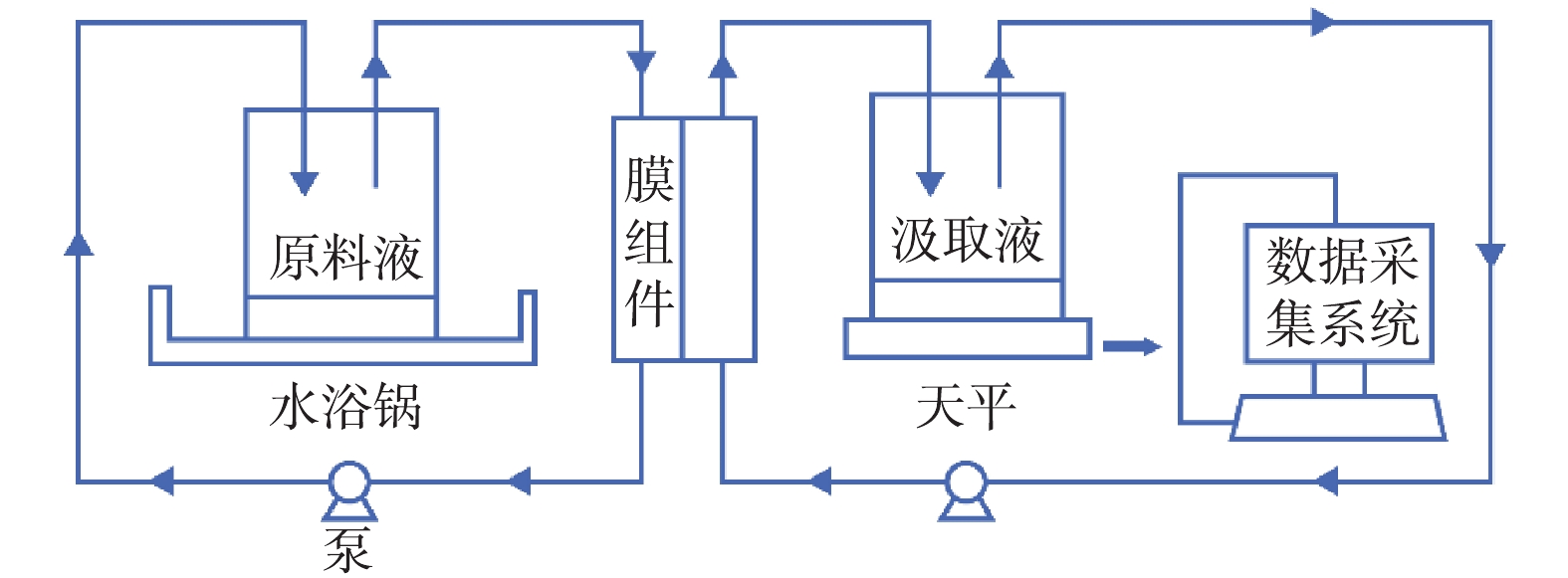
FO膜污水浓缩装置如图2所示。平板膜组件均采用错流操作模式,总面积为94 cm2,实际有效面积为74 cm2,流道深度为2 mm,膜面流速约为14 m·s−1。原料液和汲取液有效容积为1 L,汲取液装置放于电子分析天平上,通过连接计算机来实时记录汲取液质量的变化,从而计算出膜的水通量。通过电导率仪可以测定汲取液和原料液中的电导率,并通过电导率和汲取液浓度拟合曲线来计算汲取液浓度。原料液的温度通过水浴锅控制在(25±1) ℃。
-
FO膜采用HTI公司提供的CTA膜。膜的总厚度为115 μm,膜的孔径为0.3~1.0 nm[18],膜片密封保存于甘油中,在第1次使用前,用超纯水在最大流速下对新膜片进行冲洗,以彻底去除表面的保护层,然后将储存在超纯水中。
装置分正渗透膜实验和物理清洗2个部分。正渗透膜实验在温度为(25±1) ℃、膜面流速约为14 m·s−1,原料液和汲取液体积均为1 L的条件下进行。物理清洗指将污染后的膜片使用去离子水进行最大流量(3 L·min−1)清洗30 min。化学清洗使用0.5%次氯酸钠溶液在流量为3 L·min−1的情况下错流模式(该模式下水流在膜表面可形成较大的剪切力,有助于膜污染的清洗)冲洗30 min。实验结束后,将膜片储存于超纯水中,放置在冷藏柜中备用。
-
汲取液为NaCl和MgCl2溶液,浓度为1~4 mol·L−1。所用NaCl和MgCl2均为分析纯,溶液用水为去离子水。原料液为自配污水,水质参考南方城市污水,原因是南方城市污水较北方城市污水耗氧有机污染物的浓度(以COD计)含量低[19]。然后使用去离子水作为溶剂,其水质参数包括220 mg·L−1 COD、75.3 mg·L−1 TOC、25 mg·L−1氨氮、10.75 mg·L−1总磷、38 mg·L−1Na+、6.9 mg·L−1 K+、2 mg·L−1 Ca2+、17 mg·L−1 Mg2+、pH 7.2,电导率389 µS·cm−1,194 mg·L−1 TDS。
-
在考察NaCl和MgCl2汲取液的性能时,分别使用1、2、3、4 mol·L−1的MgCl2和NaCl作为汲取液,每个周期运行260 min,在相同运行模式下进行清水实验,观察传统无机盐汲取液清水水通量变化,选择合适的汲取液浓度。
在确定混合汲取液的最佳浓度配比时,以南方城市污水为原料液,选择总摩尔浓度为4 mol·L−1,浓度比分别为3∶1、2∶1、1∶1、2∶3、1∶2、1∶3的混合汲取液,在FO模式下,每个周期运行420 min,选择最佳的汲取液混合配比。
以上述实验中所得的最佳混合无机盐配比汲取液浓缩城市污水,确定适宜的污水浓缩倍数,探究各水质指标的浓缩效果。
对污染后的膜片进行SEM和EDS分析,观察膜污染的结构和主要的污染物质,用物理和化学两种手段对膜进行清洗,确定最佳的清洗方式。
-
FO水渗透通量通过电子天平实时采集原料液质量变化计算得出,为确保实验数据稳定可靠,装置开启数据稳定再开始计时,所得通量数据为测定后的平均通量。Jw根据式(1)进行计算。
式中:Jw为水通量,L·(m2·h)−1;Δm为∆t时间内原料液质量的变化,g;Am为正渗透膜有效面积,cm2。
正渗透膜盐返混通量根据式(2)进行计算。
式中:Js为盐的返混通量,g·(m2·h)−1;V0为0时刻原料液的体积,L;Vt为t时刻原料液的体积,L;C0为原料液的初始浓度,mg·L−1;Ct为t时刻原料液的浓度,mg·L−1;Am为正渗透膜有效面积,cm2。
正渗透出水为原料液时的污染物截留率根据式(3)进行计算。
式中:R为截留率;CP为汲取液中污染物最终质量,mg;Cf为原料液中污染物初始质量,mg。
-
TOC采用TOC分析仪测定;COD采用酸性重铬酸钾检测法测定;氨氮采用钠氏试剂分光光度法测定;总磷采用钼酸铵分光光度法[20]测定。
1.1. FO膜污水浓缩装置
1.2. FO膜和FO装置的运行
1.3. 实验用水
1.4. 实验内容和方法
1.5. 参数计算方法
1.6. 常规指标测量方法
-
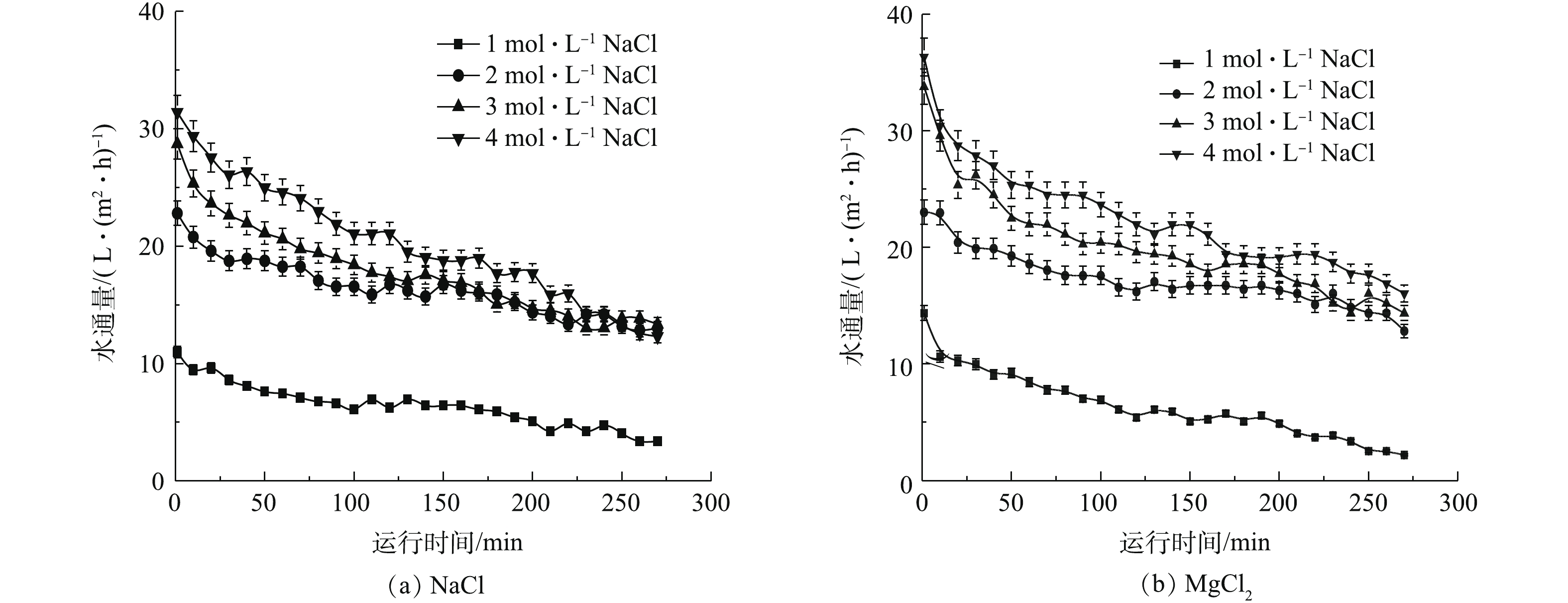
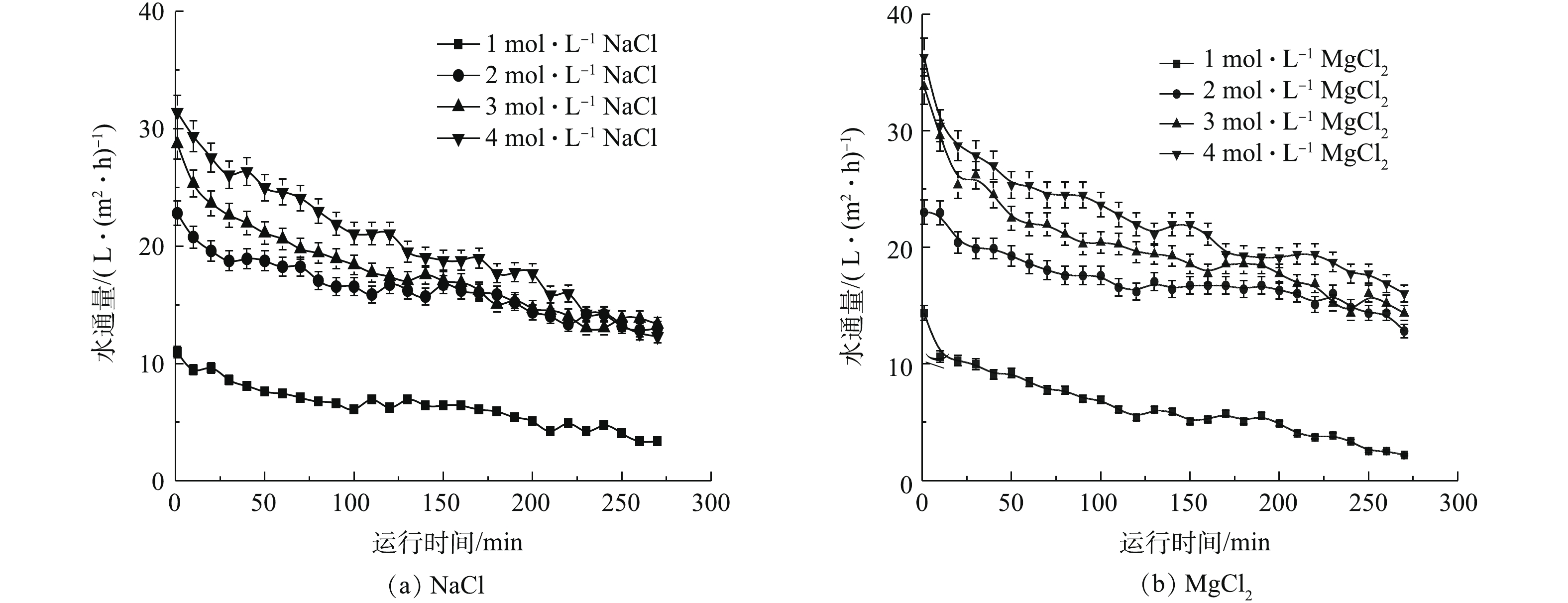
在进行传统无机盐汲取液清水通量比选时,以不同浓度的MgCl2和NaCl作为汲取液进行清水实验,运行260 min,实验结果如图3所示。由图3可知,当分别使用浓度为1、2、3、4 mol·L−1的MgCl2作为汲取液时,水通量分别可达到14、23、32、37 L·(m2·h)−1;当分别使用浓度为1、2、3、4 mol·L−1的NaCl作为汲取液时,水通量分别达到11、22、28、32 L·(m2·h)−1。结果表明,2种汲取液均表现出浓度越高,其对应的水通量越高的现象,MgCl2作为汲取液时其水通量高于NaCl。虽然NaCl相对便宜,来源广泛,但有返混通量较高的弱点。为降低MgCl2汲取液的使用成本,考虑混入适量的NaCl。
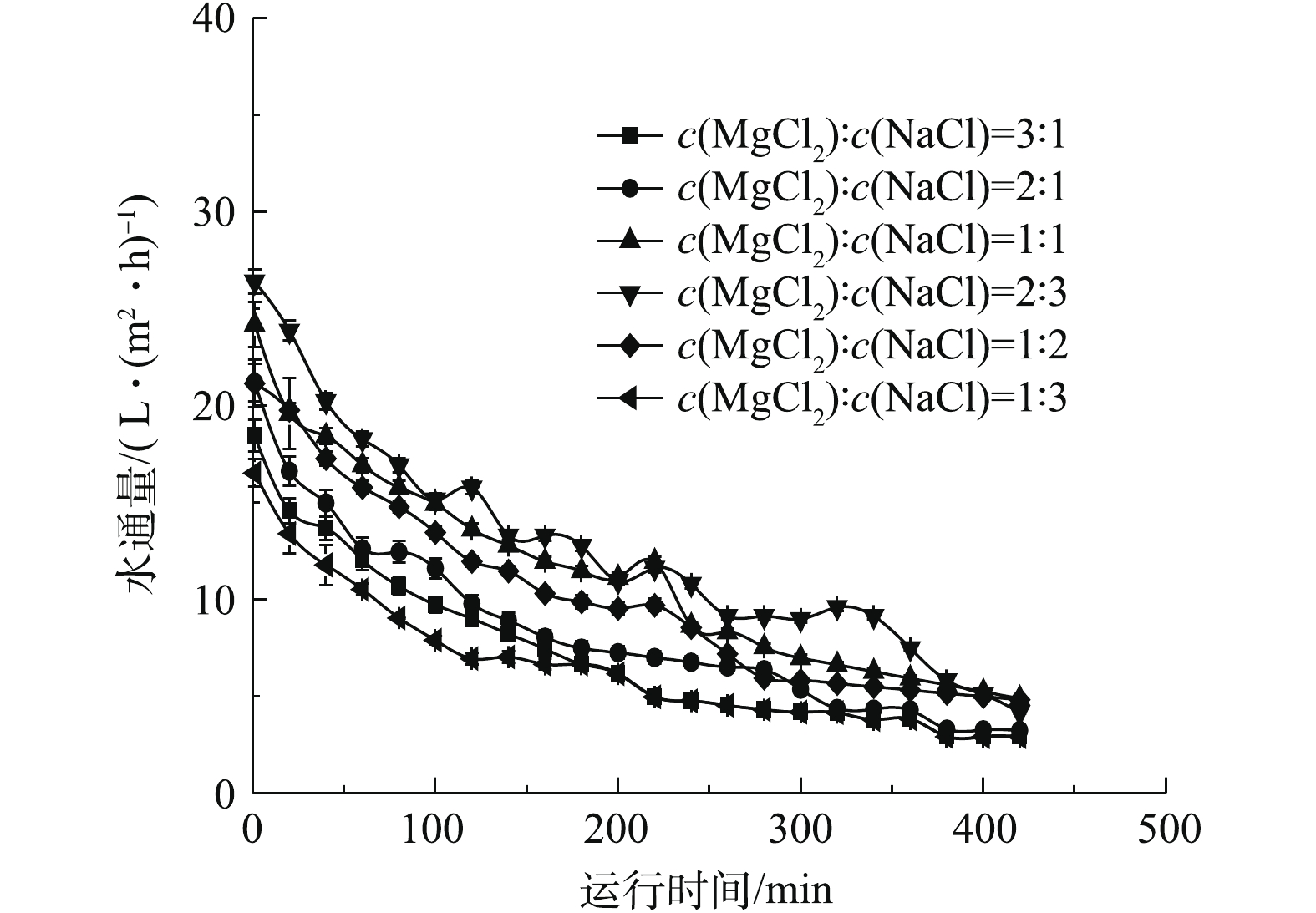
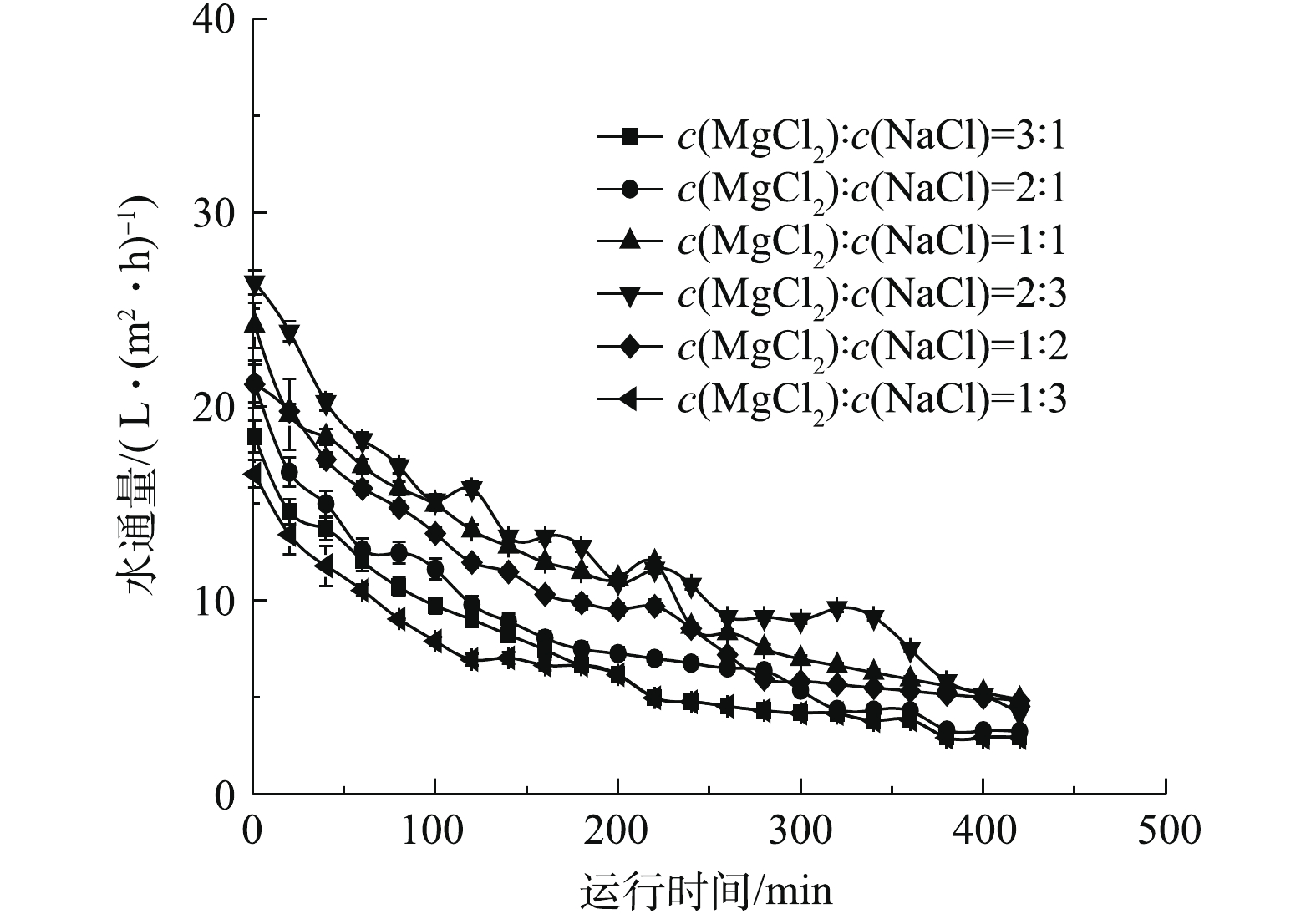
在进行不同配比的混合无机盐汲取液处理城市污水的性能比选时,以4 mol·L−1阳离子浓度为基准,分别使用MgCl2/NaCl(浓度比)为3∶1、2∶1、1∶1、2∶3、1∶2、1∶3的混合汲取液进行污水浓缩实验。结果如图4所示。由图4可知,在上述条件下,水通量分别可达18、22、24、27、23、16 L·(m2·h)−1。采用含有1.6 mol·L−1 MgCl2和2.4 mol·L−1 NaCl的汲取液时水通量达到最高,为27 L·(m2·h)−1。
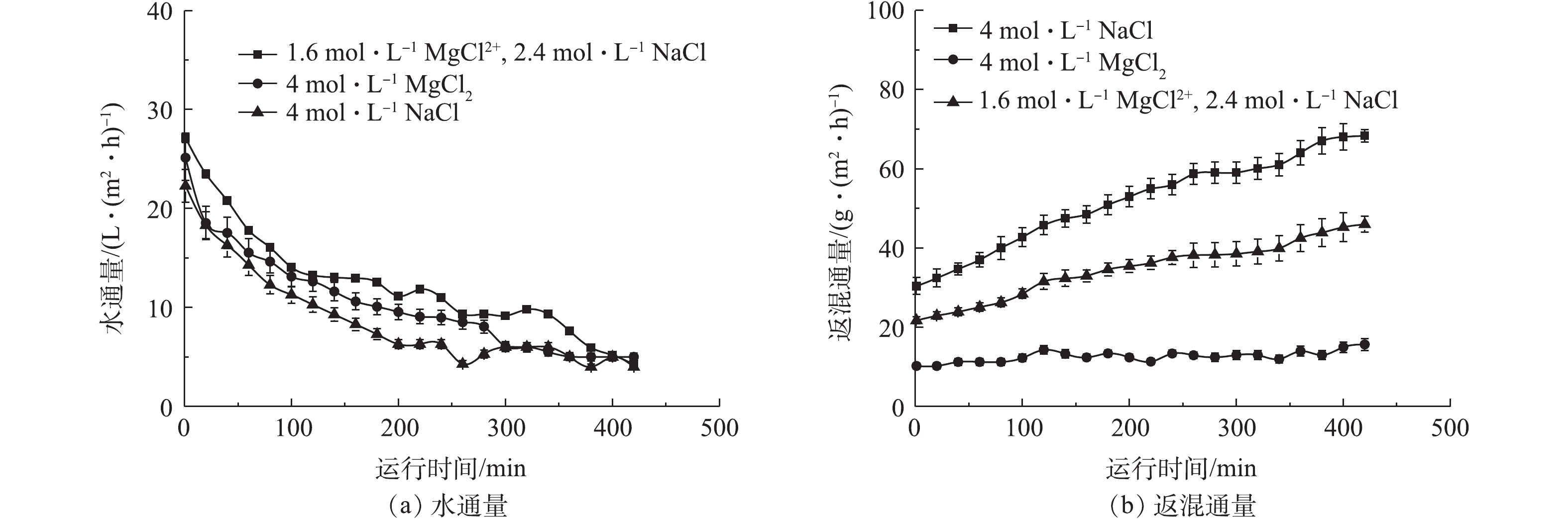
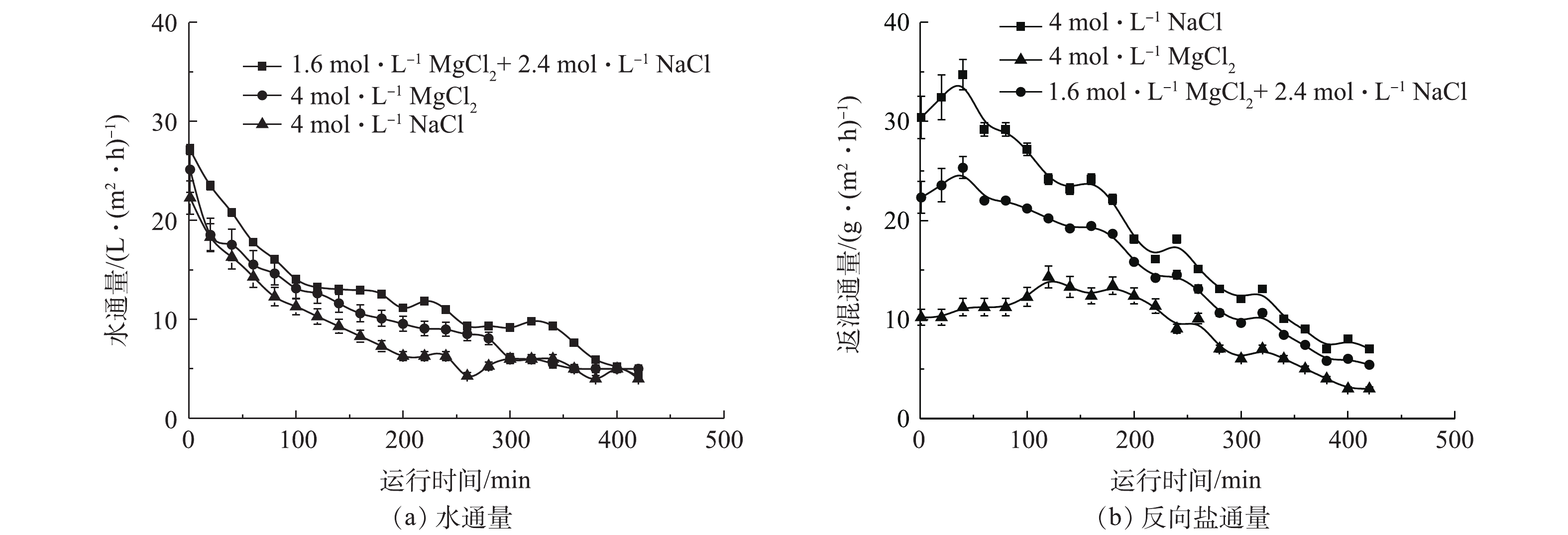
在进行混合无机盐和传统无机盐处理城市污水的性能比对时,分别使用1.6 mol·L−1 MgCl2+2.4 mol·L−1 NaCl混合汲取液、4 mol·L−1 MgCl2汲取液和4 mol·L−1 NaCl无机盐浓缩城市污水,结果如图5所示。由图5可知,水通量为Jw(1.6 mol·L−1 MgCl2和2.4 mol·L−1 NaCl)>Jw(4 mol·L−1 MgCl2)>Jw(4 mol·L−1 NaCl),分别为27、25、23 L·(m2·h)−1。返混通量为Js(4 mol·L−1 NaCl)>Js(1.6 mol·L−1 MgCl2+2.4 mol·L−1 NaCl)>Js(4 mol·L−1 MgCl2),分别为27、23、10 g·(m2·h)−1。NaCl作为汲取液时,因返混通量较大,膜两侧的渗透压下降较大而导致水通量变低。MgCl2作为汲取液时,Mg2+会返混至原料液侧,可能因Mg2+具有絮凝作用,会在FO膜表面形成结垢,加剧膜污染,最终导致水通量下降较快。而MgCl2和NaCl混合无机盐汲取液则表现出更高的水通量和较少的盐返混通量,这表明MgCl2和NaCl混合使用可以产生明显的协同作用。
本实验采用1.6 mol·L−1 MgCl2+2.4 mol·L−1 NaCl混合无机盐汲取液的水通量可以达到27 L·(m2·h)−1,仅次于刘志强等[21]在PRO模式下NaCl汲取液所产生的水通量。虽然PRO模式可以产生较高水通量,但支撑层对应原料液会使膜污染加剧,水通量下降迅速,整体膜系统运行不稳定,不适合处理实际生活污水。
刘彩虹[22]以4 mol·L−1NaCl为汲取液处理去离子水时的盐返混通量达到27 g·(m2·h)−1,本研究用4 mol·L−1混合无机盐汲取液处理城市污水,返混通量仅有23 g·(m2·h)−1,且水通量更高。
-
采用1.6 mol·L−1 MgCl2和2.4 mol·L−1 NaCl混合无机盐汲取液(浓度比为2∶3)浓缩城市污水,体积浓缩为2、3、4、5、6倍,结果如表1所示。浓缩液如果满足后续资源化处理,体积浓缩倍数应达到6倍以上(原料液中COD含量大于1 000 mg·L−1),至少运行420 min。
当体积浓缩为6倍时,各项水质指标的浓缩倍数普遍小于体积浓缩倍数,COD、总磷浓缩为4~6倍左右,TOC浓缩倍数为4~5倍,而氨氮浓缩不足4倍。原料液体积浓缩为6倍时,FO膜对TOC、COD、总磷、氨氮的平均截留率分别为96.3%、95.72%、99%、90.4% (表2)。与氨氮相比,FO膜对有机物和磷酸盐等具有高效的截留效果,原料液底部有白色沉淀生成。根据物料平衡定律,在原料液没有水分蒸发等能量损失的情况下,原料液相中减少的污染物一部分可能由FO膜进入汲取液侧,一部分以非溶液的形式附着在膜的表面形成污染层,还有一部分形成了白色沉淀。
-
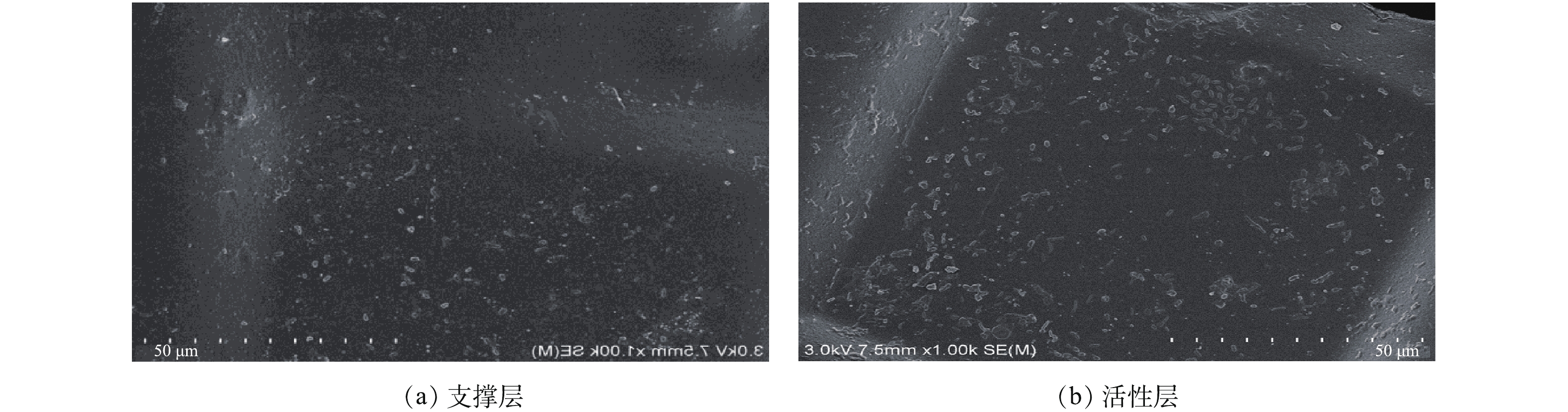
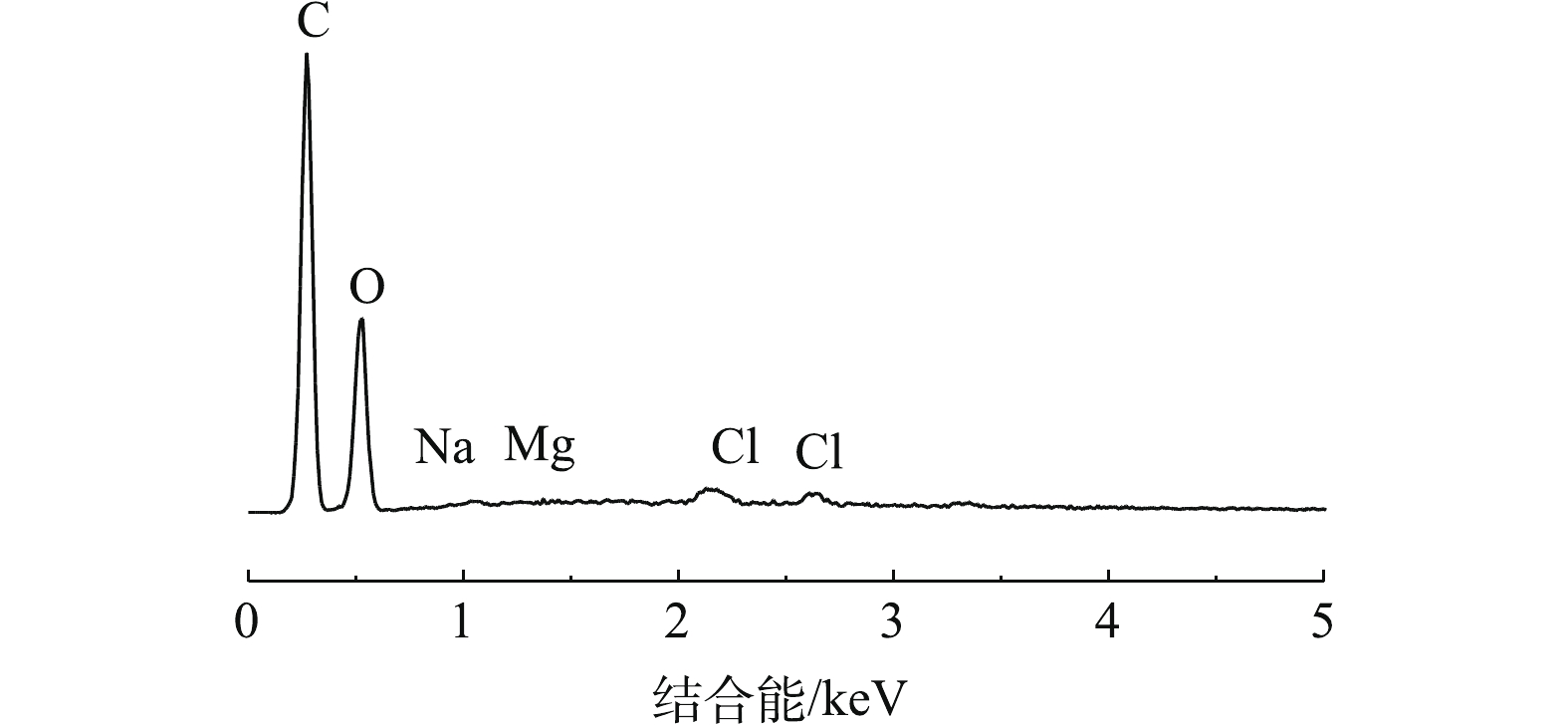
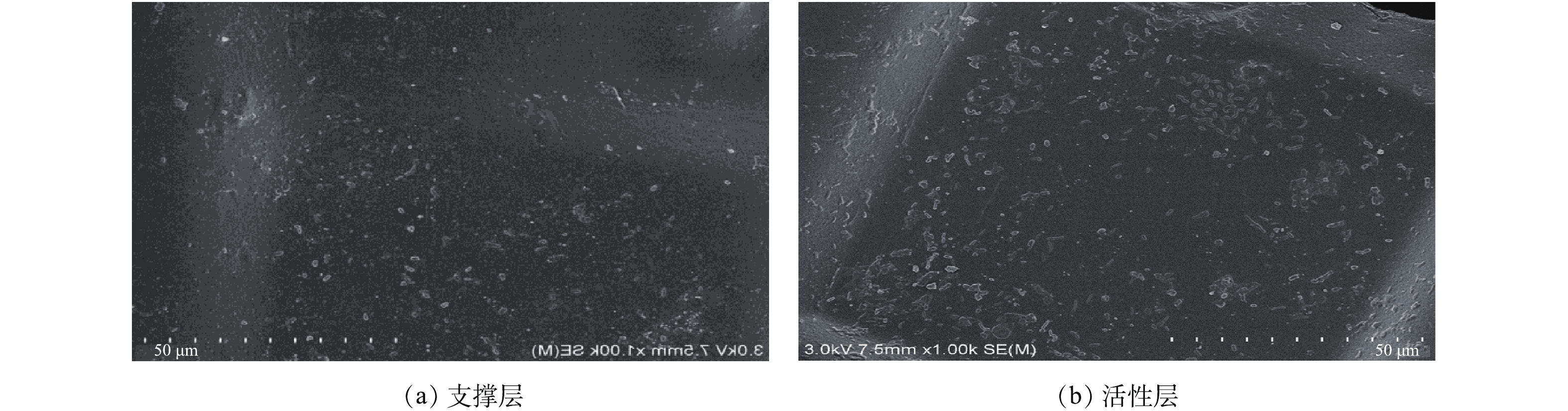
污染后的FO膜(2.2浓缩后的膜)的电镜扫描结果如图6所示。由图6可知,支撑层膜表面只有少许的沉淀物存在,活性层膜表面(面向原料液)附着大片污染物结垢。进一步对活性层表面的化学成分进行能谱分析,结果如图7所示。膜表面以C、O元素为主,而Na、Mg、Cl含量较低。C、O来源于原料液中的有机物和FO膜材质,Na、Mg、Cl则主要是由汲取液的返混造成的。这表明Na、Mg、Cl在活性层膜表面积聚较少,积聚物主要为原料液中的有机物,其形成的污染层增加了水力阻力,导致了膜的水通量下降。
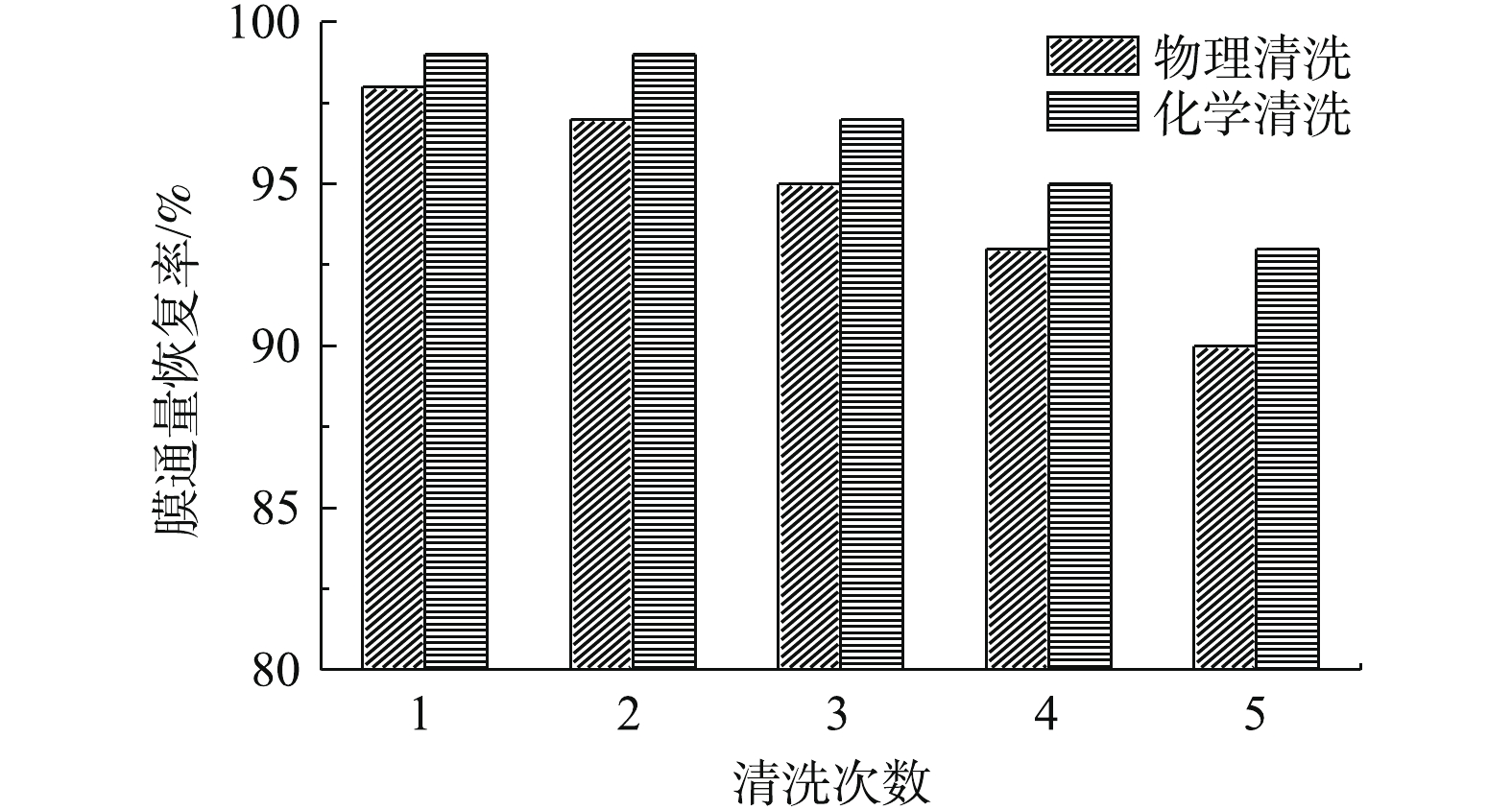
使用1.6 mol·L−1 MgCl2和2.4 mol·L−1 NaCl混合汲取液浓缩城市污水须耗时420 min,在此过程中膜污染逐渐形成。分别采用物理清洗(去离子水)和化学清洗(0.5%的次氯酸钠)在流量为3 L·min−1流速下进行清洗,水通量恢复率的变化结果如图8所示。在物理清洗5次之后,水通量恢复率从98%下降至90%;化学清洗5次后,水通量恢复率从99%下降至93%,速率随着清洗次数的增多而下降变快。物理清洗后恢复率下降幅度大于化学清洗下降幅度,化学清洗效率大于物理清洗效率。方舟等[23]关于膜清洗的研究结果表明,物理清洗后,普遍可以恢复到新膜水通量的90%左右;经化学清洗后,水通量可以恢复到新膜水通量的96%,以上研究结果和本研究的结果相似,即化学清洗后的水通量恢复率均高于物理清洗效率。但由于正渗透膜的不成熟性,水通量随着清洗次数的增多下降速率变快,不可逆膜污染累积增多,导致水通量下降迅速,所以膜材质也是未来正渗透领域研究重点之一。
2.1. 汲取液的比选
2.2. FO膜的浓缩效果
2.3. FO膜污染分析和清洗
-
1)选择混合无机盐汲取液既可以提供高渗透压又可以减少盐的返混通量。采用含有1.6 mol·L−1 MgCl2和2.4 mol·L−1 NaCl配制的混合液作为汲取液时,水通量较高,可达到27 L·(m2·h)−1。FO膜对污水中TOC、COD、总磷的去除率可高达96.3%、95.72%、99%。对氨氮的截留效率为90.4%。
2)正渗透浓缩南方城市污水时,体积浓缩液为6倍时,方可满足后续资源化处理。当体积浓缩为原来的6倍时,各项水质指标的浓缩倍数普遍小于体积浓缩倍数,COD、总磷等物质浓缩倍数在5倍左右,而氨氮浓缩倍数不足4倍。
3)活性层膜有大量污染物结垢,主要来源于原料液中的有机物,少量来源于汲取液返混的Na、Mg、Cl。FO膜污染较轻,采用次氯酸钠化学清洗效果优于去离子水物理清洗。





 下载:
下载: