-
榨菜生产加工过程中会产生大量废水,其水质成分复杂、盐度高、浓度高、难降解,对受纳水体水环境影响极大。高盐度对微生物有抑制作用,因此,利用传统生物法很难对榨菜废水进行高效处理[1]。传统的反渗透法、离子交换法和电渗析法只能去除盐度,对于榨菜废水的有机污染物很难去除,且成本较高。2009年,CAO等[2]提出了微生物脱盐燃料电池这一概念,为盐水淡化提供了新思路。微生物脱盐燃料电池(microbial desalination cell,MDC)系统是在微生物燃料电池(microbial fuel cell,MFC)的基础上联合了电渗析原理改进得到的。它是在阴极室和阳极室之间,用阳离子交换膜和阴离子交换膜分割出来的一个中间脱盐室,构造出的3室MDC。靠近阳极室的是阴离子交换膜,只允许阴离子通过;靠近阴极室的是阳离子交换膜,只允许阳离子通过。电池依靠阳极室中的产电菌,利用有机底物产生电子,电子通过外电路传导到阴极电极上,与电子受体接触,进而产生电流[3]。在产生的电场作用与浓度梯度作用下,中间脱盐室的Na+和Cl−分别通过阳离子交换膜与阴离子交换膜进入阴极室和阳极室,达到脱盐的目的。同时,中间脱盐室榨菜废水中的
NH+4 -N也可以在电场作用下,通过阳离子交换膜进入阴极室,达到去除高盐废水NH+4 -N的目的。有研究[4]表明,阴极是制约MDC产电功率的其中一个主要因素。空气阴极MDC的实际效果较为理想[5]。阳极有机底物也是影响MDC产电性能与运行效果的主要因素。JACOBSON等[6]指出,乙酸钠作为单一的阳极有机底物,对产电菌的影响效果最佳,阳极液进水乙酸钠浓度为4 g·L−1。在MEHANNA等[7]的研究中,阳极液进水乙酸钠浓度为2 g·L−1。在CAO等[2]的研究中,阳极液进水乙酸钠浓度为1.6 g·L−1。三者均没有对比阳极底物不同浓度对MDC产电与脱盐的影响,对3种情况下的COD去除率也没有对比研究,阳极COD没有得到合理的优化。LUO等[8]利用生活污水作为阳极液,可以有效替代人工配水来运行MDC,且效果较为理想。张慧超[9]研究的MDC处理人工配制高盐废水中,阳极液COD为800 mg·L−1,其产电性能与脱盐速率均较高。已有研究大多以人工配制高盐废水为MDC目标处理废水进行研究,而以实际高盐废水作为中间脱盐室进水却鲜有报道。
本研究以重庆涪陵榨菜厂的高盐高浓度榨菜废水为中间脱盐室进水,阳极液以生活污水为基础,通过投加乙酸钠,分别配制出COD较低、中等、较高3个水平(400、900、1 400 mg·L−1)的溶液,其中,400 mg·L−1 COD可以代表生活污水COD,900 mg·L−1 COD与文献报道较优值接近,1 400 mg·L−1COD则代表较高COD水平,考察较高COD对MDC的影响,阴极采用Pt/C空气阴极形式,同时运行3套间歇式MDC,对比3个浓度水平下的MDC多周期运行产电性能与脱盐差异。同时,运用高通量测序手段,研究阳极生物膜与脱盐室水体中微生物群落,进而解释实际高盐废水中
NH+4 -N的去除机理,为进一步处理高盐高浓度榨菜废水提供参考。 -
在实验中,脱盐室进水取自重庆市涪陵区榨菜处理厂,废水类型为厌氧池出水,阳极液以生活污水为基础,通过投加乙酸钠,分别配制出COD的3个水平(400、900、1 400 mg·L−1,其中1 mg·L−1乙酸钠≈0.78 mg·L−1 COD),阴极为Pt/C空气阴极形式,阴极液为超纯水(电导率为18.25 MΩ·cm),实验所用其他试剂均为分析纯,主要水质特征见表1。
Pt/C空气阴极电极材料为碳布(W1S1005,CeTech Co.,Ltd),有效面积为42 cm2,碳布处理包括2个步骤。第1步,将碳布非碳粉层一侧刷20%的聚四氟乙烯(PTFE)乳液(D-210C,DAIKIN),放入马弗炉(KSL-1100X-S,合肥科晶材料技术有限公司)中,在370 ℃条件下,熔烧15 min取出,重复上述步骤4次,得到4层扩散层的处理碳布。第2步,将碳布的碳粉层一侧用催化剂处理,将20%的Pt/C催化剂(Hispec3000,JM Inc.,USA)、去离子水、Nafion黏结剂(D-520,杜邦DuPont)以及异丙醇溶液按照一定比例混合均匀后,涂在碳粉层一侧,自然晾干24 h,得到处理过后的Pt/C空气阴极电极材料[10]。其中,Pt/C催化剂用量根据碳布有效面积来确定,浓度为1.5 mg·cm−2,单块碳布的Pt/C催化剂用量为63 mg。其余碳粉层处理材料用量根据Pt/C催化剂用量来确定,它们的浓度与用量见表2。
-
实验设置3套相同规格的3室立方体空气阴极MDC反应器,均由有机玻璃板制成,如图1所示。每套反应器的阳极室、脱盐室和阴极室尺寸均相同,有效容积均为260 mL。阳极室与脱盐室中间用阴离子交换膜(AMI-7001,Membranes International Inc.,USA)分隔开,阴极室与脱盐室中间用阳离子交换膜(CMI-7000,Membranes International Inc.,USA)分隔开,构成3个腔室。阳极电极材料为碳毡(PAN基碳纤维毡,北海炭素有限公司),有效面积为35 cm2,阴极电极材料为碳布(W1S1005,CeTech Co.,Ltd),有效面积为42 cm2,用钛丝将电极引出,再用铜导线与变阻箱(J2361,靖江市生桐无线电配件厂)串联,形成闭合回路。3个腔室的正上方玻璃板均留有直径为6 mm的进出水孔,用以更换腔室水体。阳极室下方放置磁力搅拌器(85-2恒温磁力搅拌器,金坛市城东新瑞仪器厂),阳极室内放置搅拌子,对阳极液进行连续搅拌。
将数据采集器用铜导线并联至电阻箱两端,用以采集反应器的输出电压。反应器开始启动时,阳极室内分别加入COD为400、900、1 400 mg·L−1的阳极液(以生活污水为基础,通过投加乙酸钠来配制)以及厌氧泥接种,脱盐室加入厌氧池出水,阴极室加入超纯水,均充满腔室,用胶布封住阳极室进出水孔,以保持厌氧状态。当输出电压低于50 mV时,更换阳极液,认为完成1个产电周期。在反应器启动阶段前几个周期,每次换水的同时更换厌氧泥,当连续3个周期内输出电压相差不大,周期时间接近即可认为启动成功。每个产电周期结束后,分别更换对应COD的阳极液来保证MDC稳定运行。所构成的3套MDC除阳极COD不同外,其余实验材料与条件无差别,3套MDC均为间歇式稳定运行。
-
反应器输出电压使用数据采集器(DAS,PISO-813u,Hongge Co. Ltd.,Taiwan)记录,每隔1 min记录1次,并保存在电脑中,初始外电阻设置为1 000 Ω。
电流的计算见式(1)。
式中:I为输出电流,A;V为输出电压,V;R为外电阻,Ω。
体积功率密度的计算方法见式(2)。
式中:PV为体积功率密度,W·m−3;I为输出电流,A;V为输出电压,V;VA为阳极室有效体积,m3。
电子利用效率(RCTE)的计算方法见式(3)。
式中:RCTE为电子利用效率;D0为榨菜废水中NaCl的初始浓度,mol·L−1;F为法拉第常数,取值96 485 C·mol−1;Vx为榨菜废水的初始体积,Vt为t时刻榨菜废水的体积;I为电流,A。
盐度与电导率采用电导率仪(FE-30K,Metter Toledo)测定,pH与DO采用便携式仪器 (Sension1,HACH Co.,USA) 测定,COD采用快速消解仪与紫外分光光度计(DRB200&DR5000,HACH Co.,USA)测定,
NH+4 -N采用纳氏试剂分光光度法测定,NO−3 -N采用氨基磺酸紫外分光光度法测定。 -
通过OMEGA Soil DNA试剂盒提取阳极生物膜样品、脱盐室水体样品中微生物DNA。使用细菌引物16S rRNA的5′-ACTCCTACGGGAGGCAGCAG-3′和5′- GGACTACHVGGGTWTCTAAT-3′338F_806R对提取的DNA进行PCR扩增,测序方式为PE300,将所有序列读数聚类到操作分类单位,OTU相似性阈值为97%。高通量测序服务由上海美吉生物平台(上海)提供。
-
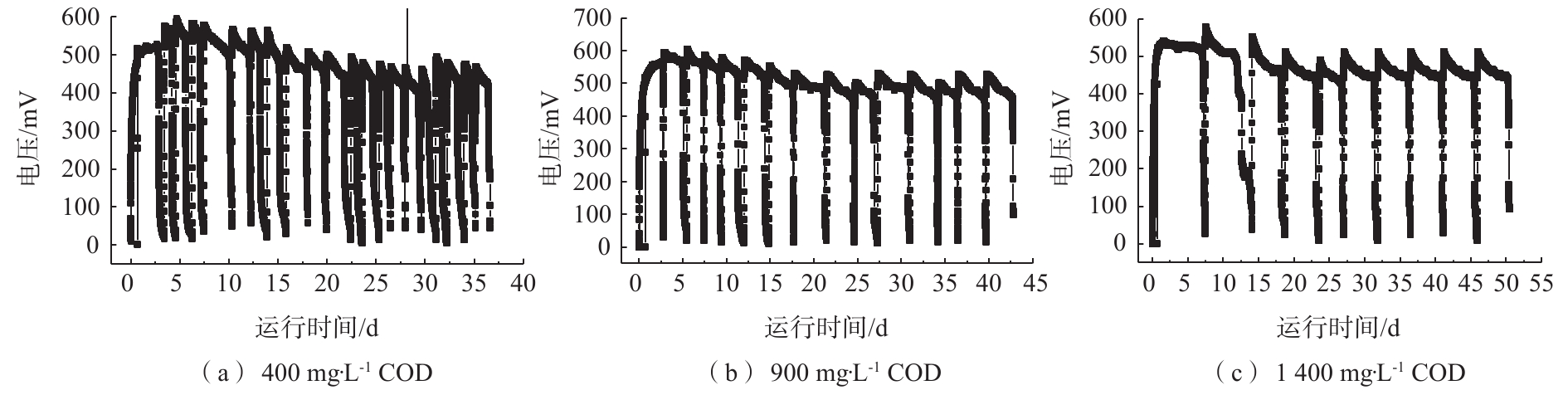
在外电阻为1 000 Ω的负载下,阳极不同COD的输出电压分别如图2所示。由此可见,阳极COD分别为400、900、1 400 mg·L−1的MDC产电周期存在明显差异,单个稳定产电周期时间依次约为1.5、2.5、5 d。此外,3个COD水平下的稳定产电周期的峰值电压存在一定差异,峰值电压依次为480、550、520 mV。GIL等[11]指出,峰值电压并不是随阳极有机底物浓度增大而持续增大,在阴极相同的情况下,电池的输出电压会受到阳极COD的限制。
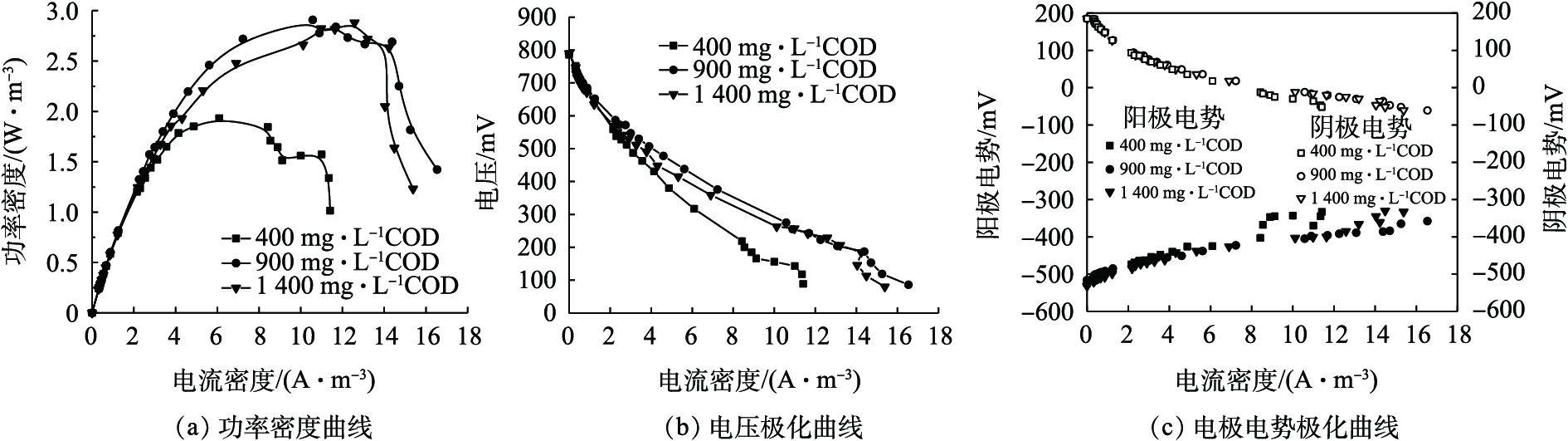
在电池稳定运行3个周期后,采用梯度改变外电阻的方法测量电池功率密度曲线与极化曲线,结果如图3所示。由图3(a)可知,阳极COD的3个水平的最大功率密度依次为1.93、2.91、2.82 W·m−3。MEHANNA等[12]开发的3室空气阴极MDC反应器在盐水浓度为20 g·L−1的条件下,存在 2.27 W·m−3的最高功率密度。本研究中400 mg·L−1 COD下的最大功率密度较低,但900 mg·L−1与1 400 mg·L−1 COD下的最大功率密度略高于已报道的数值。由图3(b)可知,3套系统的开路电压和内阻分别为786 mV和81.78 Ω(400 mg·L−1 COD)、788 mV和57.96 Ω(900 mg·L−1 COD)、790 mV和 66.38 Ω (1 400 mg·L−1 COD)。在开路电压基本相同时,电池的功率密度取决于系统的极化[13],系统的极化由阳极与阴极极化共同决定。由图3(c)可知,3套系统的阴极极化无明显差异,而阳极极化存在差异,其主要原因在于阳极COD不同。由图3(b)可知,3套系统的活化内阻无明显差异,但400 mg·L−1 COD下的欧姆内阻相比于900 mg·L−1 COD与1 400 mg·L−1 COD的要大。分析原因可能为,阳极液是以生活污水为基础通过投加乙酸钠配制的。在阳极底物浓度低时,溶液的离子强度与电导率较低,欧姆内阻受溶液离子强度影响较大[14],阳极室的欧姆内阻相对较大,此时欧姆内阻在系统内阻中占的比重较大,阳极极化严重,输出电压与功率密度均较小。由图3(b)还可以得到,900 mg·L−1 COD比1 400 mg·L−1 COD下的系统内阻反而要小,二者的欧姆内阻相近,但前者的传质内阻较小。原因可能为,阳极底物浓度高,物质堆积,在传输中受到的阻力较大[15],此时传质内阻在系统内阻中占的比重较大,从而系统内阻相对较大,输出电压与功率密度反而略有降低。
-
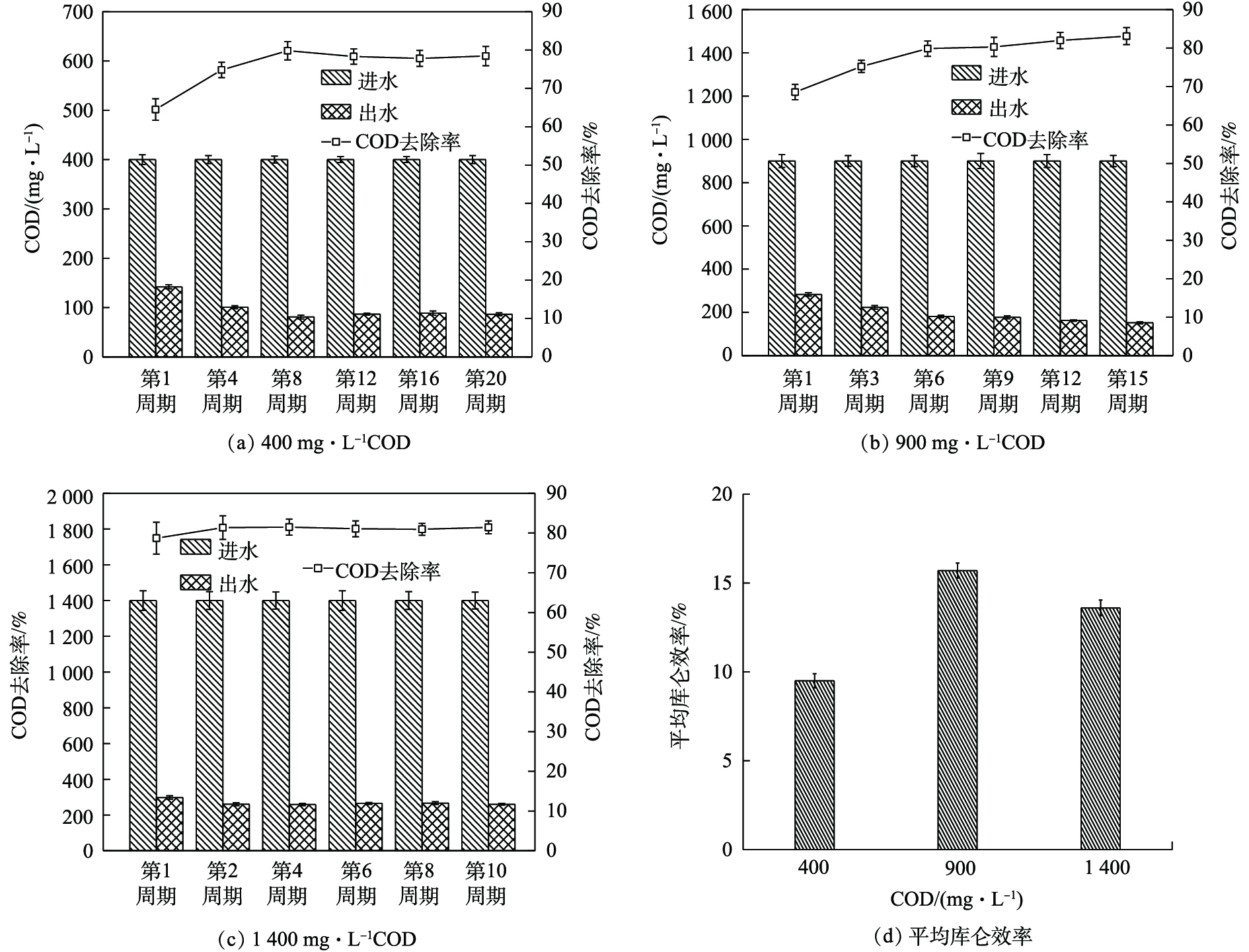
不同阳极COD下的COD去除率及库仑效率见图4。由图4(a)可知,每周期阳极进水COD为400 mg·L−1时,COD去除率由第1周期的(65±2.8)%逐步上升到稳定阶段(第16周期)的(78±2.1)%。由图4(b)可知,每周期阳极进水COD为900 mg·L−1时,COD去除率由第1周期的(68±2.0)%逐步上升到稳定阶段(第12周期)的(83±2.2)%。由图4(c)可知,每周期阳极进水COD为1 400 mg·L−1时,COD去除率由第1周期的(78±4.0)%逐步上升到稳定阶段(第8周期)的(81±1.9)%。张慧超[9]在曝气阴极MDC的一个换水周期内得到COD去除率为(76.9±4.0)%。本实验略高于此的原因可能是,
NO−3 -N在阳极发生了反硝化反应,消耗了部分COD。由图4(d)可知,不同COD下的平均库仑效率分别为(9.5±0.4)%、(15.7±0.5)%和(13.6±0.4)%。由此可见,单个产电周期的COD去除率随着运行时间的延长而不断增大并趋于稳定,但不同阳极COD下稳定周期的COD去除率与平均库仑效率存在差异,阳极进水COD为900 mg·L−1时的COD去除率与平均库仑效率相比于其他二者较高。分析原因可能为,运行初期,阳极电极碳毡表面产电微生物挂膜较少且活性较低[16],从而使COD去除率和库仑效率均较低。随着运行时间的延长,阳极生物膜日趋成熟,产电微生物活性较高,使COD去除率逐渐增大并趋于稳定,库仑效率显著提高。此外,当阳极生物膜成熟后,适宜的COD会使得产电微生物保持良好活性,COD去除率升高,库仑效率较高;而较低与较高的COD会抑制产电微生物的活性,使得COD去除率降低,库仑效率较低。同时,较高的COD会使得产电周期时间较长,非产电微生物在此过程中增殖较多,库仑效率反而降低。 -
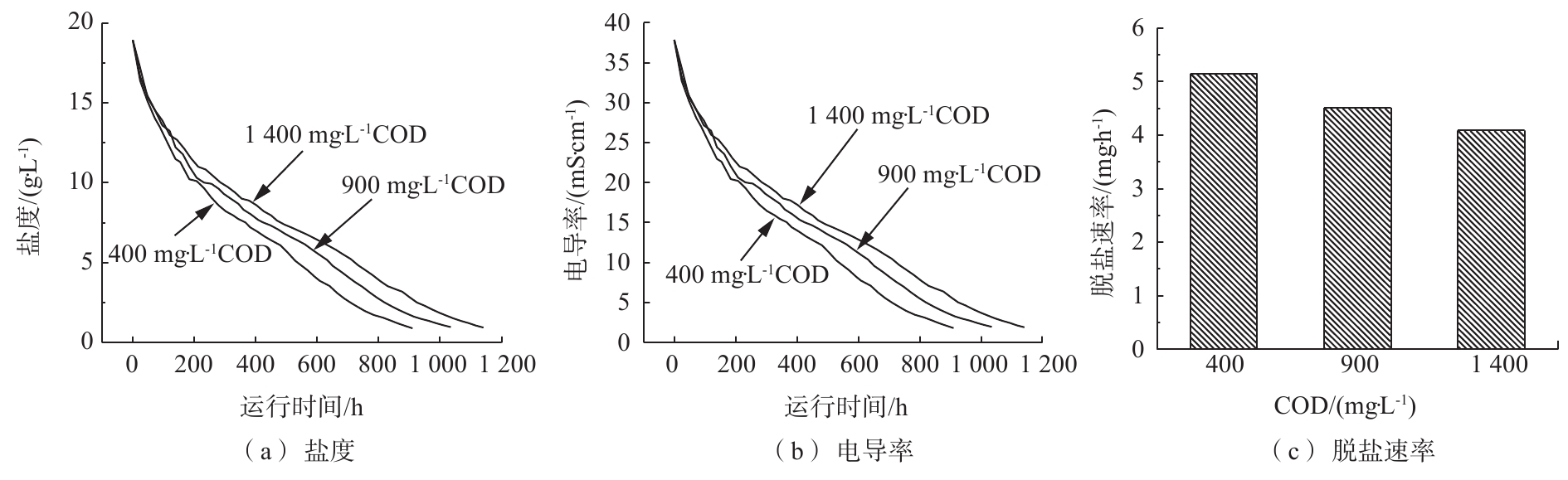
不同阳极COD下MDC脱盐室的盐度与电导率变化情况如图5(a)和图5(b)所示,盐度均下降到1 g·L−1时认为脱盐结束。由此可见,不同阳极COD下的脱盐率均可以达到95%以上,但脱除相同的盐度所需的时间差异较大,400、900、1 400 mg·L−1 COD下的脱盐时间依次为910.5、1 035、1 141 h。由图5(c)可知,400、900、1 400 mg·L−1 COD下的脱盐速率依次为5.15、4.51、4.09 mg·h−1。由此可见,阳极COD低时的脱盐周期短,脱盐速率较高。通过计算三者的电子利用效率(表征反应器利用电能驱动离子迁移的效率)可以发现,400 mg·L−1 COD下的电子利用效率高达111%,900 mg·L−1与1 400 mg·L−1 COD下的电子利用效率则分别为82.3%和63.25%。分析原因可能为,脱盐室内电导率的下降主要是受渗透作用与电场作用共同影响的[17]。脱盐室的Na+与Cl−在电场作用下分别迁移至阴极室与阳极室,当阳极电导率低于脱盐室电导率时,阳极室与脱盐室之间存在渗透压差,此时渗透作用与电场作用共同引起脱盐室内榨菜废水的电导率下降。900 mg·L−1与1 400 mg·L−1 COD下的外电路电流差别不大,但电子利用效率相差20%,可见在电场作用一定时,渗透作用对于脱盐的影响较大。在阳极COD较低时,溶液的离子强度与渗透压小,阳极室与脱盐室的渗透压差较大,渗透作用增强,因此,脱盐周期短,脱盐速率较高。此外,随着时间的延长,图5(a) 和图5(b)的折线斜率逐渐变小,脱盐速率逐渐变慢。LUO等[18]在研究微生物电解和脱盐电池中发现,当初始浓度为10 g·L−1的含盐水脱盐率达到98.8%时,其内阻由70~220 Ω上升为250~850 Ω,产氢速率及脱盐速率均下降。分析原因可能为,在脱盐过程中,脱盐室的离子强度与电导率持续下降,导致脱盐室的欧姆内阻变大,电流降低,电场作用下的离子迁移缓慢,且此时阳极室与脱盐室的电导率差较小,渗透作用减弱,脱盐速率缓慢。
-
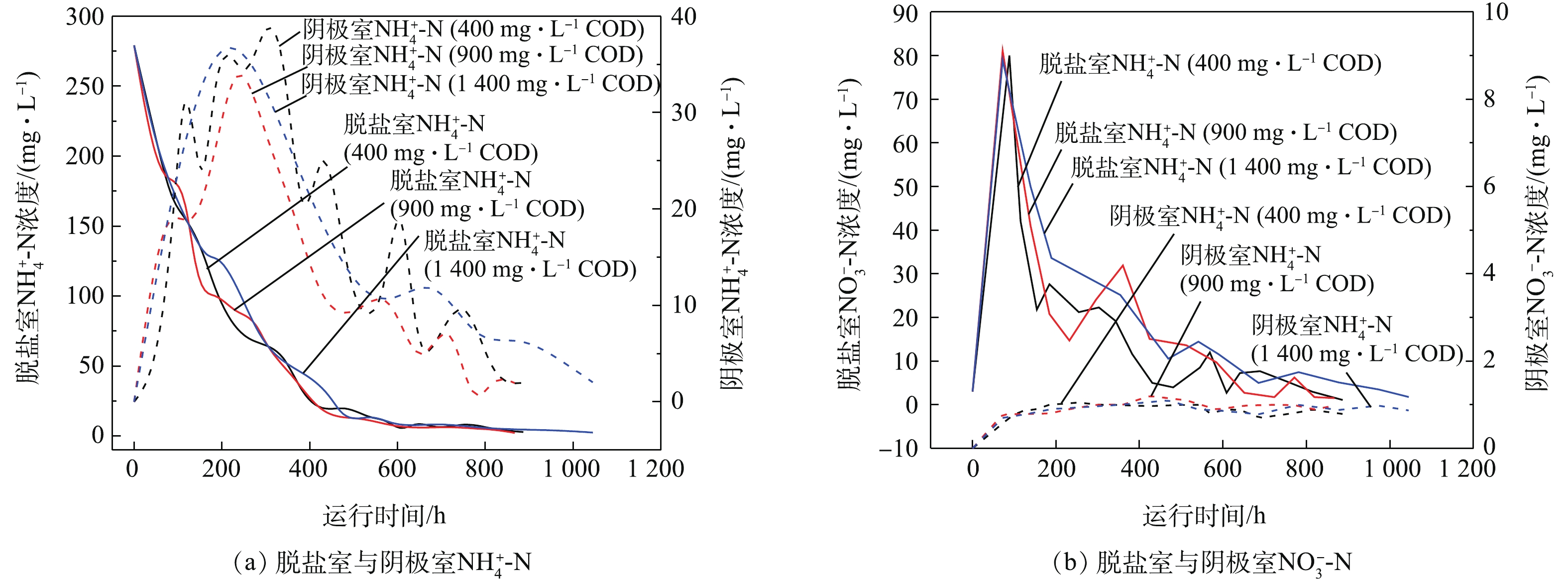
不同阳极COD下脱盐室与阴极室的
NH+4 -N变化情况如图6(a)所示。朱峰[19]研究了在微生物脱盐燃料电池的脱氮过程中,NH+4 通过阳离子交换膜转移到阴极室中,从而使得中间脱氮室中的NH+4 -N得以去除。但从图6(a)可知,不同阳极COD浓度下脱盐室NH+4 -N浓度的减小量均远大于因离子迁移导致的阴极室NH+4 -N浓度的增加量,说明脱盐室与阴极室的NH+4 -N可能存在其他途径的迁移与转化[20]。不同阳极COD下脱盐室与阴极室的
NO−3 -N变化情况如图6(b)所示,由此可见,不同阳极COD下脱盐室的NO−3 -N浓度,在电池启动初期,快速大幅提升至80 mg·L−1后又迅速降至40 mg·L−1,最后逐步降低。产生上述现象的原因可能为,脱盐室的NH+4 -N在启动初期,由于脱盐室DO浓度较高,发生了硝化反应,部分转化为了NO−3 -N,其余NH+4 -N继续迁移至阴极。脱盐室的NO−3 -N浓度存在陡降可能是,当NO−3 积累到一定离子强度后,与阳极室之间存在较大浓度差,在渗透作用下,NO−3 有快速的迁移。而后在浓度差较小时,脱盐室的NO−3 -N浓度逐渐降低,可能主要是由于NO−3 在电场作用下逐步迁移到阳极[21],同时脱盐室内也可能发生一定程度的反硝化。各反应器每周期的阳极液进水与出水NH+4 -N与NO−3 -N浓度基本保持不变。由图6(b)还可知,不同阳极COD下阴极室的NO−3 -N浓度始终保持在1.0 mg·L−1以下,可以认为迁移到阴极室的NH+4 -N并未转化为NO−3 -N。各反应器在整个脱盐周期内,3个腔室的NO−2 -N浓度均低于0.1 mg·L−1,因此不考虑NO2−-N的影响。基于不同阳极COD下3室的NH+4 -N、NO−3 -N变化情况基本类似,特选取阳极COD为400 mg·L−1下的1个产电周期进一步具体解释。由图7(a)可知,在1个产电周期内,脱盐室的
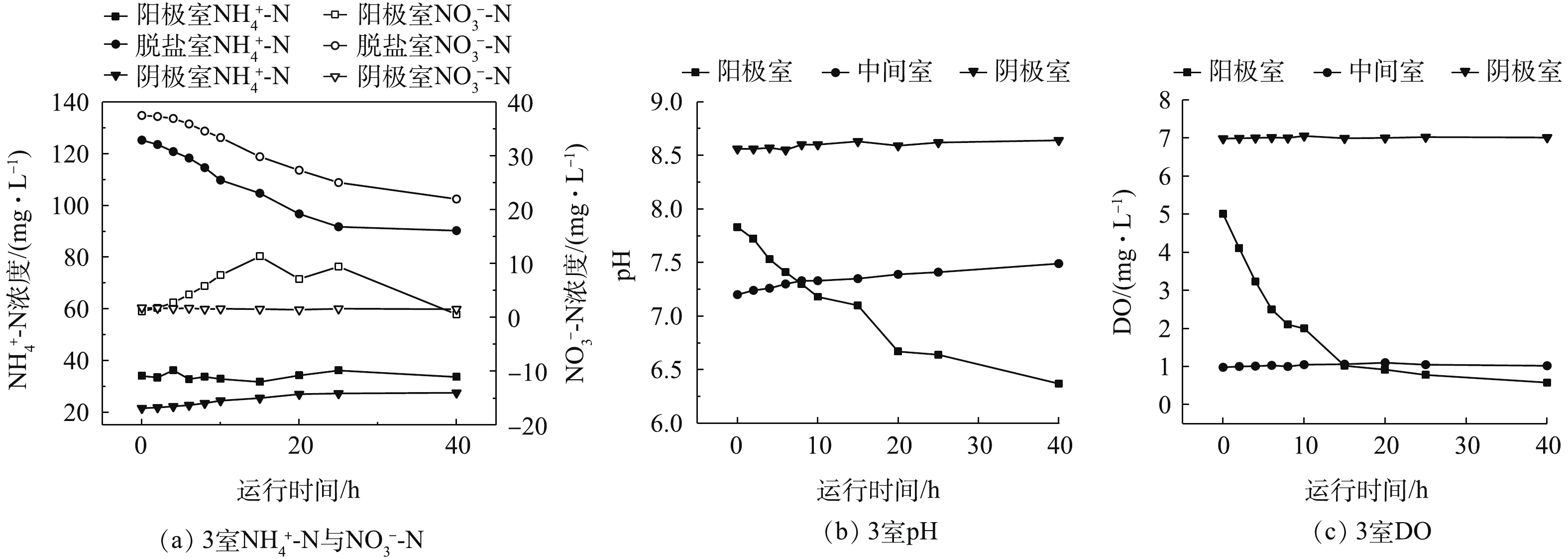
NH+4 -N浓度降低了35 mg·L−1,阴极室NH+4 -N浓度从21.5 mg·L−1上升到了27.5 mg·L−1,阴极室NO−3 -N浓度基本保持在1.0 mg·L−1以下,阳极室的NH+4 -N浓度始终保持在进水浓度34 mg·L−1左右。由图7(b)可知,阴极室的pH一直保持在8.5以上,属碱性环境。由此可以得到:脱盐室的NH+4 -N在电场作用下以NH+4 形式逐渐迁移到阴极室,但迁移的NH+4 -N没有硝化;阴极室的碱性环境会使NH+4 -N转化为NH3排出[22],但迁移量略大于排出量,使得阴极室NH+4 -N浓度呈小幅上涨趋势;阳极室NH+4 -N并未参与此过程,全程浓度基本不变。由图7(a)还可知,在启动初期,脱盐室中产生的
NO−3 -N浓度在此周期内减小了16 mg·L−1,而阳极室的NO−3 -N浓度2次呈先上升后下降的趋势,从起始的1.17 mg·L−1最终降低到0.98 mg·L−1,总减小量约为13 mg·L−1,略小于脱盐室中NO−3 -N浓度的减小量。由图7(c)还可知,阳极室的DO浓度从进水5.0 mg·L−1降至周期结束后的0.58 mg·L−1,利于反硝化进行[23]。由此可以得到,脱盐室的大部分NO−3 -N在电场作用下以NO−3 形式逐渐迁移到阳极室,同时脱盐室内的少部分NO−3 -N可能通过自身的反硝化被去除,二者存在差异可能是因为NO−3 的迁移速率大于脱盐室NO−3 的反硝化速率。当阳极室的DO浓度较小时,迁移到阳极的NO−3 -N又会在反硝化作用下被逐渐消耗完全。验证上述可能性还须对阳极生物膜与脱盐室水体中的微生物进行高通量测序分析。 -
1)微生物多样性分析。实验选取阳极COD为400 mg·L−1下的阳极生物膜及脱盐室水体的微生物,进行高通量测序分析,微生物多样性和丰度如表3所示。微生物测序中样本文库覆盖率均大于0.990,说明测序结果能够很好地代表样本的真实情况。阳极生物膜和脱盐室水体的OTU数目分别为527个和306个,Ace指数分别为541.77和331.97,Chao指数分别为546.01和345.14,阳极生物膜的微生物丰度较高。阳极生物膜和脱盐室水体的Shannon指数分别为3.68和3.21,Simpson指数分别为0.074 2和0.098 8,阳极生物膜的微生物多样性较高。二者的丰度与多样性存在差异,可能与阳极室和脱盐室微生物生长环境不同有关[24]。
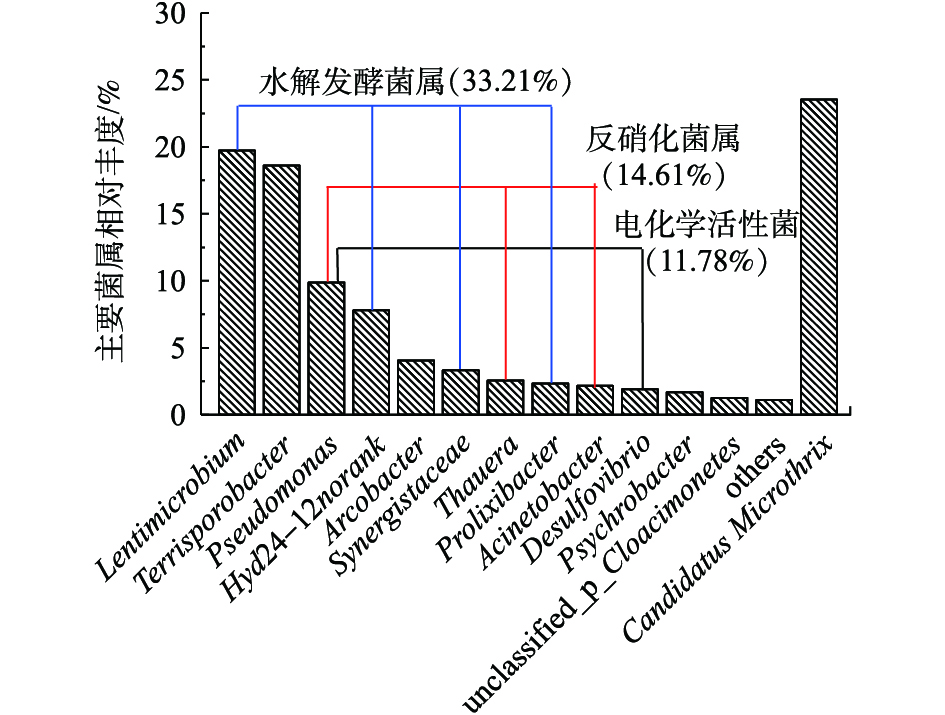
2)微生物属水平组成分析。实验将相对丰度大于1%的菌属作为主要菌属,阳极生物膜主要菌属如图8所示。阳极生物膜优势菌属为Lentimicrobium (19.73%)、Terrisporobacter (18.61%)、Pseudomonas (9.87%)。Lentimicrobium属于Bacteroidetes门下的严格厌氧菌属,Pseudomonas属于Proteobacteria门下的异养反硝化菌属,同时也是电化学活性微生物。在BES系统中,将能够产生的电子传递到细胞外的微生物称为电化学活性菌[25]。Pseudomonas被认为是最常见、产电效率最高的电化学活性菌之一,广泛存在于处理啤酒废水、养猪废水等MFC的厌氧生物阳极中[26]。Desulfovibrio是属于Desulfovibrionaceae (脱硫弧菌科)的菌属,具有硫酸盐还原作用,同时也是已报道的电化学活性微生物,在厌氧环境内具有产电作用[27]。由图8可知,阳极生物膜中共发现了2种电化学活性菌,分别是Pseudomonas (9.87%)和Desulfovibrio (1.91%),电化学活性菌总丰度为11.78%;其中,Pseudomonas是最主要的产电功能菌属,实现电池的产电功能。有研究表明,Lentimicrobium、Hyd24-12 norank、Synergistaceae、Prolixibacter、Thermovirga等是阳极常见的一些水解发酵菌属,具有水解发酵的作用[28-29]。由图8可知,阳极生物膜中共发现了4种水解发酵菌属,分别是Lentimicrobium (19.73%)、Hyd24-12 norank (7.80%)、Synergistaceae (3.33%)和Prolixibacter (2.34%);其中,Lentimicrobium是最主要的水解发酵菌属,水解发酵菌属总丰度为33.21%,可以认为水解发酵细菌是阳极生物膜的核心微生物[30]。有研究[31-32]表明,Pseudomonas、Thauera、Acinetobacter、Desulfomicrobium、Stenotrophomonas等是燃料电池中常见的反硝化菌属,具有反硝化功能,参与氮的转化。在阳极生物膜中发现了3种反硝化菌属,分别是Pseudomonas (9.87%)、Thauera (2.56%)和Acinetobacter (2.17%),其中Pseudomonas是丰度最高的反硝化菌属,反硝化菌属总丰度为14.61%,可以认为Pseudomonas、Thauera和Acinetobacter是阳极生物膜主要反硝化菌属,这可能也是阳极室
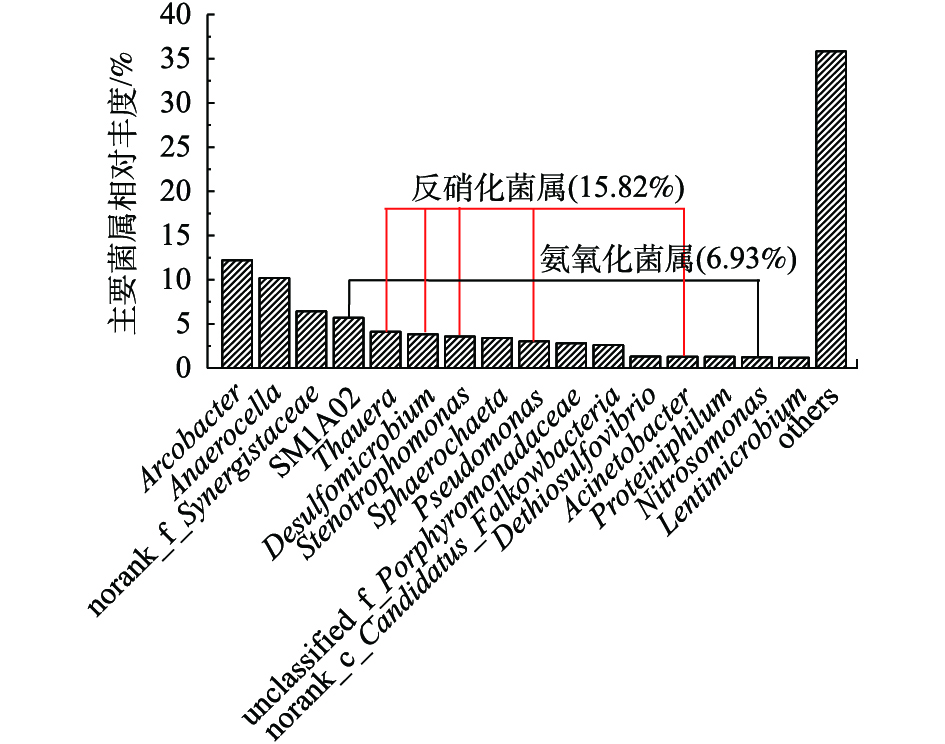
NO−3 -N能够快速去除的原因。实验将相对丰度大于1%的菌属作为主要菌属,脱盐室水体中的主要菌属如图9所示。脱盐室水体中微生物的优势菌属为Arcobacter(12.21%)、Anaerocella(10.19%)、norank_f_Synergistaceae(6.42%)。Arcobacter属于Proteobacteria门下的革兰氏阴性菌。TANG等[33]发现,SM1A02具有良好的硝化性能,被认为具有作为新型厌氧氨氧化菌株的潜力。YANG等[31]发现,在空气阴极微生物燃料电池中,Nitrosomonas具有良好的氨氧化功能,有利于氮的去除。由图9可知,脱盐室水体中发现了2种氨氧化菌属,分别是SM1A02(5.69%)和Nitrosomonas(1.24%),氨氧化菌属总丰度为6.93%。其中,SM1A02是最丰富的氨氧化菌属,可以认为SM1A02在氨氧化过程中起主要作用。这也就解释了图6(b)所示的反应初期中间脱盐室的
NO−3 -N快速积累现象。同时,脱盐室水体中还发现了5种反硝化菌属,它们分别为Thauera (4.11%)、Desulfomicrobium (3.82%)、Stenotrophomonas (3.57%)、Pseudomonas (3.02%)和Acinetobacter(1.29%),总丰度为15.82%。这就证明,脱盐室NO−3 -N出现陡降的原因不只是存在浓度差,还可能是当脱盐室的DO被大量消耗后出现了快速的反硝化反应。同时也解释了后期脱盐室NO−3 -N在逐渐迁移至阳极的过程中,脱盐室内部也存在一定的反硝化反应。 -
1)阳极COD不同的MDC的产电性能存在差异。在外电阻为1 000 Ω的负载下运行时,阳极COD分别为400、900、1 400 mg·L−1的MDC的输出电压依次为480、550、520 mV;产电周期依次约为1.5、2.5、5 d;最大功率密度依次为1.93、2.91、2.82 W·m−3。
2)阳极COD不同的MDC阳极的COD去除率及库仑效率存在差异。阳极COD分别为400、900、1 400 mg·L−1的MDC稳定产电周期内的COD去除率依次为(78±2.1)%、(83±2.2)%、(81±1.9)%;平均库仑效率依次为(9.5±0.4)%、(15.7±0.5)%、(13.6±0.4)%。因此,就产电性能、COD去除率和库仑效率而言,阳极COD为900 mg·L−1时效果更优。
3)阳极COD不同的MDC的脱盐性能存在差异。阳极COD分别为400、900、1 400 mg·L−1的MDC的脱盐率均可达95%以上,但脱盐速率和电子利用效率差异较大。三者的脱盐速率依次为5.15、4.51、4.09 mg·h−1;电子利用效率依次为111%、82.3%、63.25%。MDC脱盐主要受渗透作用与电场作用的影响,就脱盐性能而言,阳极COD为400 mg·L−1时效果更优。
4)不同阳极COD的MDC脱盐室的榨菜废水
NH+4 -N的去除途径基本相同。脱盐室的部分NH+4 -N转化为NO−3 -N后,通过自身的反硝化和以NO−3 形式迁移至阳极得以去除,剩余的大部分NH+4 -N以NH+4 形式迁移至阴极,在碱性环境下转化为NH3排出。微生物群落分析结果表明,水解发酵菌属(总丰度为33.21%)为MDC阳极的核心微生物群落。阳极生物膜中电化学活性菌(总丰度为11.78%)实现了电池的产电功能,反硝化菌属(总丰度为14.61%)的存在证明,脱盐室NO−3 -N迁移至阳极室后,进行反硝化得以去除。在脱盐室水体中检测到了氨氧化菌属(总丰度为6.93%)及反硝化菌属(总丰度为15.82%),这为脱盐室中NO−3 -N的快速产生和随后的浓度陡降提供了理论依据。
阳极COD对榨菜生产废水MDC产电、脱盐的影响及氨氮去除的微生物群落分析
Effect of anode COD on electricity generation and desalination of mustard production wastewater MDC and microbial community analysis under ammonia nitrogen removal
-
摘要: 构建了3室榨菜生产废水微生物脱盐燃料电池系统(microbial desalination cell,MDC),探讨了其阳极COD对榨菜废水MDC产电、脱盐的影响;通过微生物群落分析,探查了脱盐室
NH+4 -N的去除途径。结果表明:在产电性能方面,MDC阳极COD为900 mg·L−1时较400 mg·L−1与1 400 mg·L−1时更优,在1 000 Ω的外电阻负载下,其输出电压、最大功率密度、库仑效率分别为550 mV、2.91 W·m−3、(15.7±0.5)%;在脱盐方面,阳极COD为400 mg·L−1时,较其他2种情况更优,MDC的脱盐时间、脱盐速率、电子利用效率分别为910.5 h、5.15 mg·h−1、111%。阳极COD不同的MDC脱盐室,其NH+4 -N的去除途径基本相同。脱盐室部分NH+4 -N转化为NO−3 -N后,通过自身的反硝化或以NO3形式迁移至阳极得以去除,剩余的大部分NH+4 -N以NH+4 形式迁移至阴极,在碱性环境下转化为NH3并排出。高通量测序分析结果表明,水解发酵菌属(总丰度为33.21%)为MDC阳极的核心微生物群落。阳极生物膜中的电化学活性菌(总丰度为11.78%)可实现电池的产电功能,反硝化菌属(总丰度为14.61%)的存在证明,脱盐室盐室NO−3 -N迁移至阳极室后进行了反硝化并得以去除。在脱盐室水体中检测到了氨氧化菌属(总丰度为6.93%)及反硝化菌属(总丰度为15.82%),这也是脱盐室中NO−3 -N快速产生和随后浓度陡降的原因。Abstract: In this study, three-chamber microbial desalination cell (MDC) of mustard wastewater was constructed. The effects of anode chemical oxygen demand (COD) on electricity generation and desalination of mustard production wastewater MDC were investigated. AndNH+4 -N removal route in the desalination chamber was analyzed through the microbial community in it. The results show that the electricity generation performance of MDC at anode COD concentration of 900 mg·L−1 was better than at anode COD concentrations of 400 and 1 400 mg·L−1. Under the loading of 1 000 Ω external resistors, the output voltage, power density, and coulombic efficiency of MDC were 550 mV, 2.91 W·m−3 and (15.7±0.5)%, respectively. The desalination performance of MDC at anode COD concentration of 400 mg·L−1 was better than other two concentrations, MDC desalination time, desalination rate, and charge transfer efficiency were 910.5 h, 5.15 mg·h−1 and 111%, respectively. TheNH+4 -N removal route of the desalination chamber was basically same in MDC with different anode COD concentrations. Part ofNH+4 -N in the desalination chamber converted toNO−3 -N, which was removed by its own denitrification and the migration to the anode asNO−3 . Most of the remainingNH+4 -N migrated to the cathode asNH+4 , it converted to NH3 in an alkaline environment and emitted afterwards. The high-throughput sequencing analysis indicated that the hydrolysis fermentation bacteria (total abundance of 33.21%) were the anode core microbial community of MDC. The electrochemically active bacteria in the anode biofilm (total abundance of 11.78%) could achieve power generation of MDC. The genus of denitrifying (total abundance of 14.61%) was detected in the anode biofilm, which proved thatNO−3 -N in the desalination chamber could migrate to the anode chamber and the denitrification removal occurred afterwards. The genus of Ammonia (total abundance of 6.93%) and denitrifying (total abundance of 15.82%) were detected in the water of the desalination chamber, which was also the reason forNO−3 -N rapid production and its subsequent steep drop in the desalination chamber. -
表 1 厌氧池出水和生活污水水质
Table 1. Characteristics of anaerobic reactor effluent and domestic sewage
水质类型 盐度(以NaCl计) /(g·L−1) 电导率/(mS·cm−1) COD /(mg·L−1) NH+4 -N /(mg·L−1)NO−3 /(mg·L−1)NO−2 /(mg·L−1)pH 厌氧池出水 18.93±0.02 37.9±0.1 1 995±30 279.21±5.3 3.01±0.06 0.09±0.00 7.33±0.25 生活污水 — — 100±1.21 33.93±0.26 1.17±0.09 0.004±0.00 7.82±0.21 表 2 碳粉层其余处理材料浓度与用量
Table 2. Concentration and dosage of the remaining treatment materials in the toner layer
材料 浓度/(μL·mg −1) 用量/μL 去离子水 0.83 52.29 Nafion黏结剂 6.67 420.21 异丙醇 3.33 209.79 表 3 阳极生物膜及脱盐室水体的微生物多样性
Table 3. Microbial diversity of anode biofilm and water in desalination chamber
组别 多样性指标 丰度指标 覆盖率 Shannon指数 Simpson指数 OTU/个 Ace指数 Chao指数 阳极生物膜 3.68 0.074 2 527 541.77 546.01 0.998 脱盐室水体 3.21 0.098 8 306 331.97 345.14 0.997 -
[1] MCCARY P L, BAE J, KIM J. Domestic wastewater treatment as a net energy producer-can this be achieved[J]. Environment Science and Technology, 2011, 45(17): 7100-7106. doi: 10.1021/es2014264 [2] CAO X X, HUANG X, LIANG P, et al. A new method for water desalination using microbial desalination cells[J]. Environment Science Technology, 2009, 43(18): 7148-7152. doi: 10.1021/es901950j [3] 李宇斐. 微生物脱盐燃料电池用于盐水淡化的工艺研究[D]. 哈尔滨: 哈尔滨工业大学, 2012. [4] OH S, MIN B, LOGAN B E. Cathode performance as a factor in electricity generation in microbial fuel cells[J]. Environment Science Technology, 2004, 38(18): 4900-4904. doi: 10.1021/es049422p [5] ZHAO F, HARNISCH F, SCHRODER U, et al. Challenges and constraints of using oxygen cathodes in microbial fuel cells[J]. Environment Science Technology, 2006, 40(17): 5193-5199. doi: 10.1021/es060332p [6] JACOBSON K S, DREW D M, HE Z. Efficient salt removal in a continuously operated upflow microbial desalination cell with an air cathode[J]. Bioresource Technology, 2011, 102(1): 376-380. doi: 10.1016/j.biortech.2010.06.030 [7] MEHANNA M, KIELY P D, CALL D F, et al. Microbial electrodialysis cell for simultaneous water desalination and hydrogen gas production[J]. Environment Science Technology, 2010, 44(24): 9578-9583. doi: 10.1021/es1025646 [8] LUO H P, JENKINS P E, REN Z Y. Concurrent desalination and hydrogen generation using microbial electrolysis and desalination cells[J]. Environment Science Technology, 2011, 45(1): 340-344. doi: 10.1021/es1022202 [9] 张慧超. 生物阴极微生物脱盐燃料电池驱动电容法深度除盐性能研究[D]. 哈尔滨: 哈尔滨工业大学, 2015. [10] 温青, 刘智敏, 陈野, 等. 空气阴极生物燃料电池电化学性能[J]. 物理化学学报, 2008, 24(6): 1063-1067. doi: 10.3866/PKU.WHXB20080626 [11] GIL G C, CHANG I S, KIM B H, et al. Operational parameters affecting the performance of a mediator-less microbial fuel cell[J]. Biosensors and Bioelectronics, 2003, 18(4): 327-334. doi: 10.1016/S0956-5663(02)00110-0 [12] MEHANNA M, SAITO T, YAN J L, et al. Using microbial desalination cells to reduce water salinity prior to reverse osmosis[J]. Energy & Environmental Science, 2010, 3(8): 1114-1120. [13] ZHANG G D, WANG K, ZHAO Q L, et al. Effect of cathode types on long-term performance and anode bacterial communities in microbial fuel cells[J]. Bioresource Technology, 2012, 118: 249-256. doi: 10.1016/j.biortech.2012.05.015 [14] TREMOULI A, INTZES A, INTZES P, et al. Effect of periodic complete anolyte replacement on the long term performance of a four air cathodes single chamber microbial fuel cell[J]. Journal of Applied Electrochemistry, 2015, 45(7): 755-763. doi: 10.1007/s10800-015-0842-z [15] GHADGE A N, JADHAV D A, PRADHAN H, et al. Enhancing waste activated sludge digestion and power production using hypochlorite as catholyte in clayware microbial fuel cell[J]. Bioresource Technology, 2015, 182: 225-231. doi: 10.1016/j.biortech.2015.02.004 [16] 付国楷, 张林防, 郭飞, 等. 榨菜废水MFC多周期运行产电性能及COD降解[J]. 中国环境科学, 2017, 37(4): 1401-1407. doi: 10.3969/j.issn.1000-6923.2017.04.026 [17] 曲有朋. 连续流微生物脱盐燃料电池的构建及性能研究[D]. 哈尔滨: 哈尔滨工业大学, 2013. [18] LUO H P, XU P, REN Z Y. Long-term performance and characterization of microbial desalination cells in treating domestic wastewater[J]. Bioresource Technology, 2012, 120: 187-193. doi: 10.1016/j.biortech.2012.06.054 [19] 朱峰. 下流式微生物燃料电池及微生物脱氮电池的研究[D]. 苏州: 苏州大学, 2011. [20] LORENZO M D, SCOTT K, CURTIS T P, et al. Effect of increasing anode surface area on the performance of a single chamber microbial fuel cell[J]. Chemical Engineering Journal, 2010, 156: 40-48. doi: 10.1016/j.cej.2009.09.031 [21] 周昱宏. 微生物燃料电池处理含氮废水的研究[D]. 杭州: 浙江大学, 2018. [22] 丁阿强. 生物电极脱氮及其机理研究[D]. 杭州: 浙江大学, 2018. [23] 王佳, 荣宏伟, 张朝升, 等. 不同电极材料对阴极硝化耦合阳极反硝化微生物燃料电池性能的影响[J]. 环境工程学报, 2018, 12(2): 663-669. doi: 10.12030/j.cjee.201708036 [24] 成少安, 黄志鹏, 于利亮, 等. 微生物燃料电池处理高盐废水的研究进展[J]. 化工学报, 2018, 69(2): 546-554. [25] 孙敏. 微生物燃料电池的功能拓展和机理解析[D]. 合肥: 中国科学技术大学, 2009. [26] SOTRES A, TEY L, BONMATI A, et al. Microbial community dynamics in continuous microbial fuel cells fed with synthetic wastewater and pig slurry[J]. Bioelectrochemistry, 2016, 111: 70-82. doi: 10.1016/j.bioelechem.2016.04.007 [27] LEWIS A J, BOROLE A P. Understanding the impact of flow rate and recycle on the conversion of a complex biorefinery stream using a flow-through microbial electrolysis cell[J]. Biochemical Engineering Journal, 2016, 116: 95-104. doi: 10.1016/j.bej.2016.06.008 [28] MIAO Y, WANG Z, LIAO R, et al. Assessment of phenol effect on microbial community structure and function in an anaerobic denitrifying process treating high concentration nitrate wastewater[J]. Chemical Engineering Journal, 2017, 330: 757-763. doi: 10.1016/j.cej.2017.08.011 [29] KIRKEGAARD R H, DUEHOLM M S, MCILROY S J, et al. Genomic insights into members of the candidate phylum Hyd24-12 common in mesophilic anaerobic digesters[J]. ISME Journal, 2016, 10(10): 2352-2364. doi: 10.1038/ismej.2016.43 [30] ZHANG L F, FU G K, ZHANG Z. Electricity generation and microbial community in long-running microbial fuel cell for high-salinity mustard tuber wastewater treatment[J]. Bioelectrochemistry, 2019, 126: 20-28. doi: 10.1016/j.bioelechem.2018.11.002 [31] YANG N, ZHANG G Q, LI D P, et al. Complete nitrogen removal and electricity production in Thauera-dominated air-cathode single chambered microbial fuel cell[J]. Chemical Engineering Journal, 2018, 356: 506-515. [32] DONG J J, ZHANG Z M, YU Z D, et al. Evolution and functional analysis of extracellular polymeric substances during the granulation of aerobic sludge used to treat p-chloroaniline wastewater[J]. Chemical Engineering Journal, 2017, 330: 596-604. doi: 10.1016/j.cej.2017.07.174 [33] TANG C C, TIAN Y, HE Z W, et al. Performance and mechanism of a novel algal-bacterial symbiosis system based on sequencing batch suspended biofilm reactor treating domestic wastewater[J]. Bioresource Technology, 2018, 265: 422-431. doi: 10.1016/j.biortech.2018.06.033 期刊类型引用(3)
1. 李广,周铁,余运湧,李星雨. MDC和MEC及其耦合系统在水处理应用的研究进展. 煤炭与化工. 2023(01): 152-155 .  百度学术
百度学术
2. 董晓航,李广. 微生物脱盐燃料电池性能优化及水处理应用的研究进展. 环保科技. 2022(01): 59-64 .  百度学术
百度学术
3. 区丽华,卢家磊,吴圣哲,赵志淼,鲁仙,张饮江. 低温对大型海藻型微生物脱盐电池处理海产品暂养水的影响. 上海海洋大学学报. 2022(05): 1146-1157 .  百度学术
百度学术
其他类型引用(9)
-























 下载:
下载: