-
四环素(tetracycline,TC)是全球使用最广泛的一种抗生素,主要用于医疗、畜牧业和水产养殖[1]. 由于四环素难以被人类和动物代谢吸收,可进入水循环,严重污染水质及生态环境[2 − 3]. 在世界各地的河流、地下水和饮用水中均已检测到四环素,尤其在医院和制药废水中检测到的TC浓度高达100—500 mg∙L−1,威胁到人类生命安全和身体健康[4 − 6]. 目前,去除TC主要采取吸附法、高级氧化法、膜法和电化学法等[7 − 8]. 其中,吸附法因具有投资小、高效环保及能耗低等优点,被广泛应用于水污染处理[9]. 以农业废弃物为原料制备得到的生物炭,因其表面丰富的芳香结构和含氧官能团,可用于吸附水中多种有机污染物. 然而,由于生物炭比表面积小、孔隙不发达而导致对有机污染物的吸附能力有限,需要增加其表面活性位点来提升其吸附效能[10].
近年来,杂原子掺杂法在改善碳基材料吸附性能方面备受关注. 例如,Lu等[11]以纤维素、草酸铵和KHCO3/NaHCO3合成的氮掺杂生物炭具有层次化的多孔结构,其比表面积与孔体积约为原来的2倍,显著增强了对挥发性有机物甲苯的吸附. Li等[12]以玉米芯、尿素和K2CO3制备了氮掺杂生物炭(CPU-T)用于CO2的吸附,N的引入有助于超微孔的产生,进而增强生物炭表面CO2的分散. 因此生物炭上N的引入可有效提升有机污染物的吸附能力. 这是由于N具有孤对电子和较高的电负性(3.04),通过共轭作用增强sp2C中π电子的流动,产生更丰富的官能团及表面缺陷[13 − 14]. 对同样具有富电子特性的TC而言,主要可通过孔隙填充、氢键作用、π-π相互作用和范德华力等作用方式被碳基材料吸附去除[15 − 17]. 然而,含N官能团的引入能否促进生物炭对TC吸附以及吸附机制还有待研究.
本文以草酸铵((NH4)2C2O4)为氮源,碳酸氢钠(NaHCO3)为活化剂,制备了氮掺杂生物炭(BC-N),将其用于吸附水中的TC. 采用扫描电子显微镜(SEM)、N2吸附-脱附曲线和拉曼光谱仪等表征其理化性质. 通过吸附动力学、吸附热力学、傅里叶变换红外光谱仪(FTIR)和X射线光电子能谱仪(XPS)进一步研究了吸附机理. 本研究为高吸附性能生物炭材料的制备方法提供了一种新思路.
-
四环素(TC)、碳酸氢钠(NaHCO3)、草酸铵((NH4)2C2O4)、氯化钠(NaCl)、腐殖酸(HA)、磷酸钠(Na3PO4)、碳酸钠(Na2CO3),氢氧化钠(NaOH)和盐酸(HCl)均购自国药集团化学试剂有限公司. 实验用水为去离子水,所有试剂均为分析纯. 玉米芯产自湖北省宜昌市.
-
BC-N的制备过程如图1所示. 将玉米芯、(NH4)2C2O4和NaHCO3以1:3:3的质量比研磨混合移至坩埚内,再将其置于管式炉中,以N2为保护气,加热速率为10 ℃·min−1,保温1 h,在700 ℃下进行热解. 将制备好的样品自然冷却后,用去离子水洗涤至中性,在70 ℃烘箱内干燥8 h. 最后,将所制备得到的样品研磨至100目过筛,将其命名为BC-N. 只添加NaHCO3(1:3,W/W)的生物炭命名为BC-C. 不添加(NH4)2C2O4和NaHCO3的生物炭命名为BC.
-
采用JW-BK112型比表面积及孔径分析仪(BET,精微高博公司)测定样品的比表面积. 采用Ultima Ⅳ型X射线衍射仪(XRD,德国Bruker公司)分析材料的晶体结构性质. 生物炭样品的外观和形态采用XL30型扫描电子显微镜(SEM,荷兰Philips公司)进行分析. 采用JEMF200型场发射高分辨透射电子显微镜(TEM,JEOL公司)表征样品的形貌和结构. 采用Nexsa型X射线光电子能谱(XPS,赛默飞公司)确定样品表层元素组成及价态. 采用IS5型傅里叶变换红外光谱仪(FTIR,美国Nicolet公司)对生物炭表面基团进行分析. 采用DXR型激光共聚焦拉曼光谱仪(Raman,Thermo Scientific 公司)测定样品的缺陷和无序程度. 采用U-
3010 型紫外-可见分光光度计(UV-Vis,日本Hitachi公司)检测TC残留浓度. 生物炭的Zeta电位使用Zeta电位仪(Zetasizer Nano ZS-90英国Malvern公司)测定. -
在50 mL浓度为80 mg·L−1的TC溶液中加入10 mg吸附剂,采用NaOH和HCl控制溶液初始pH=7. 每隔一定时间取样2.5 mL,在
10000 r·min−1离心5 min. 通过紫外-可见分光光度计在357 nm处检测TC残留浓度,进一步计算不同间隔时间(t, min)下的吸附量(qt, mg·g−1). 在pH值的影响实验中,使用NaOH和HCl将溶液pH分别调为4—11. 在离子强度和腐殖酸的影响实验中,使用NaCl、Na3PO4、Na2CO3和HA将溶液离子浓度和HA浓度分别调至0.1、1、10、100 mg·L−1. 以纯水、城市污水二级出水(简称二级出水)、自来水和溪水为背景溶液,研究了水质对吸附量的影响. 二级出水取自湖北省宜昌市某城镇污水处理厂二级出水,自来水为实验室水龙头的水,溪水取自校园内小溪(水质参数见表1). 在吸附动力学实验中,将含有80 mg·L−1的TC溶液在298 K条件下连续搅拌720 min. 在吸附等温线和热力学实验中,TC溶液浓度梯度为40—120 mg·L−1,温度选择288、298、308 K. -
BC-N对TC的吸附量由式(1)计算:
式中,C0(mg·L−1)为初始时刻TC浓度;Ct(mg·L−1)为反应t时刻TC浓度;V(L)为含TC反应溶液体积;m(g)为生物炭质量.
动力学实验数据采用拟一级动力学、拟二级动力学模型和粒子内扩散模型式(2)—(4).
式中,qe(mg·g−1)和qt(mg·g−1)为平衡态和t时刻的TC吸附量;k1(min−1)为拟一级模型的速率常数;k2(g·mg−1·min−1)为拟二级模型的速率常数;kp(mg·g−1·min1/2)为粒子内模型的扩散速率常数;C是与边界层厚度相关的常数.
吸附等温线采用Langmuir和Freundlich模型拟合式(5)—(7):
式中,Ce(mg·L−1)为平衡时溶液中TC的浓度;qe(mg·L−1)为平衡时TC的吸附量;qm(mg·g−1)为最大吸附量;KL(L·g−1)为Langmuir方程的特征常数;KF和n为Freundlich方程常数.
吸附热力学公式如式(8)—(10):
式中,ΔG(kJ·mol−1)为吉布斯自由能;R(J·mol−1·K−1)为气体常数,8.314;T(K)为开氏温度;Kc为平衡常数;ΔS(kJ·mol−1·K−1)为熵变;ΔH(kJ·mol−1)为焓变.
-
通过SEM和TEM研究了BC 和 BC-N的形貌. 图2a和2b分别为BC和BC-N的SEM图,可以观察到BC和BC-N都为多孔结构.
相比于BC,BC-N更疏松多孔,可以观察到几十纳米到几微米范围内的许多中孔-大孔. 从图2c放大的TEM图像中可以观察到BC-N呈超薄碳纳米片层状结构. 丰富的中孔-大孔和超薄碳纳米片结构是BC-N在碳化过程中膨胀的气体(CO、CO2、NH3等)蚀刻了碳的内壁产生的[18]. 图2d元素分布分析表明,BC-N主要含有C、N、O且分布均匀. BC-N的HRTEM图像(图2e)显示出大量的石墨微晶,这些微晶主要构成无定形碳结构. 此外,在选区电子衍射(SAED)图案中可以清楚地检测到碳六方晶格衍射条纹(图2e插图),表明BC-N中的碳结构是高度石墨化的[19].
-
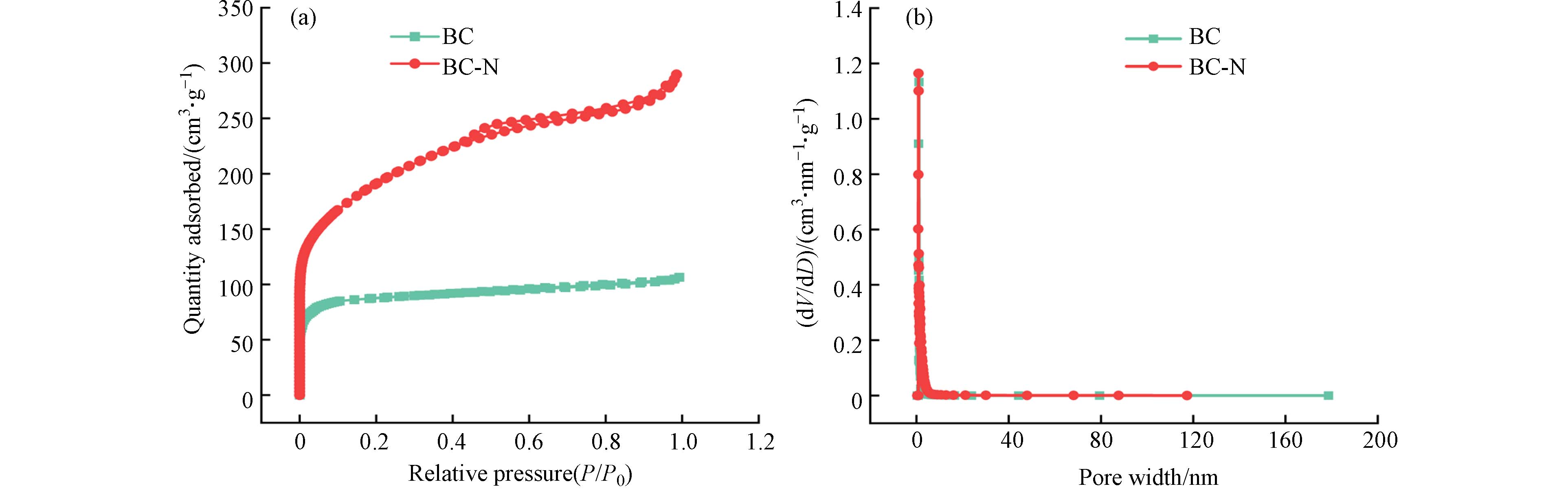
生物炭大的比表面积和孔隙的材料可为污染物提供更多的有效附着位点,更有利于污染物的吸附[20]. 测定了BC和BC-N两种样品的N2吸附-脱附曲线(图3). BC表现出典型的I型等温线,表明BC具有丰富的微孔结构[21]. BC-N的吸附-脱附等温线为Ⅱ型,且在P/P0<0.02的压力范围内对N2显示出更高的吸附量,在中等相对压力范围内则显示出滞回线,这说明BC-N中存在丰富的中孔和大孔[22].
与BC相比,BC-N的比表面积从310.7 m2·g−1增加到665.8 m2·g−1,孔体积从1.97 cm3·g−1提高到2.59 cm3·g−1(表2),这可能是由于(NH4)2C2O4起到了发泡剂的作用[18,23]. 同时,NaHCO3在碳化过程中分解并释放CO2,通过CO2鼓泡产生丰富的孔结构[24]. 综上所述,通过NaHCO3和(NH4)2C2O4二者协同成孔,能制备大比表面积的多孔生物炭BC-N.
-
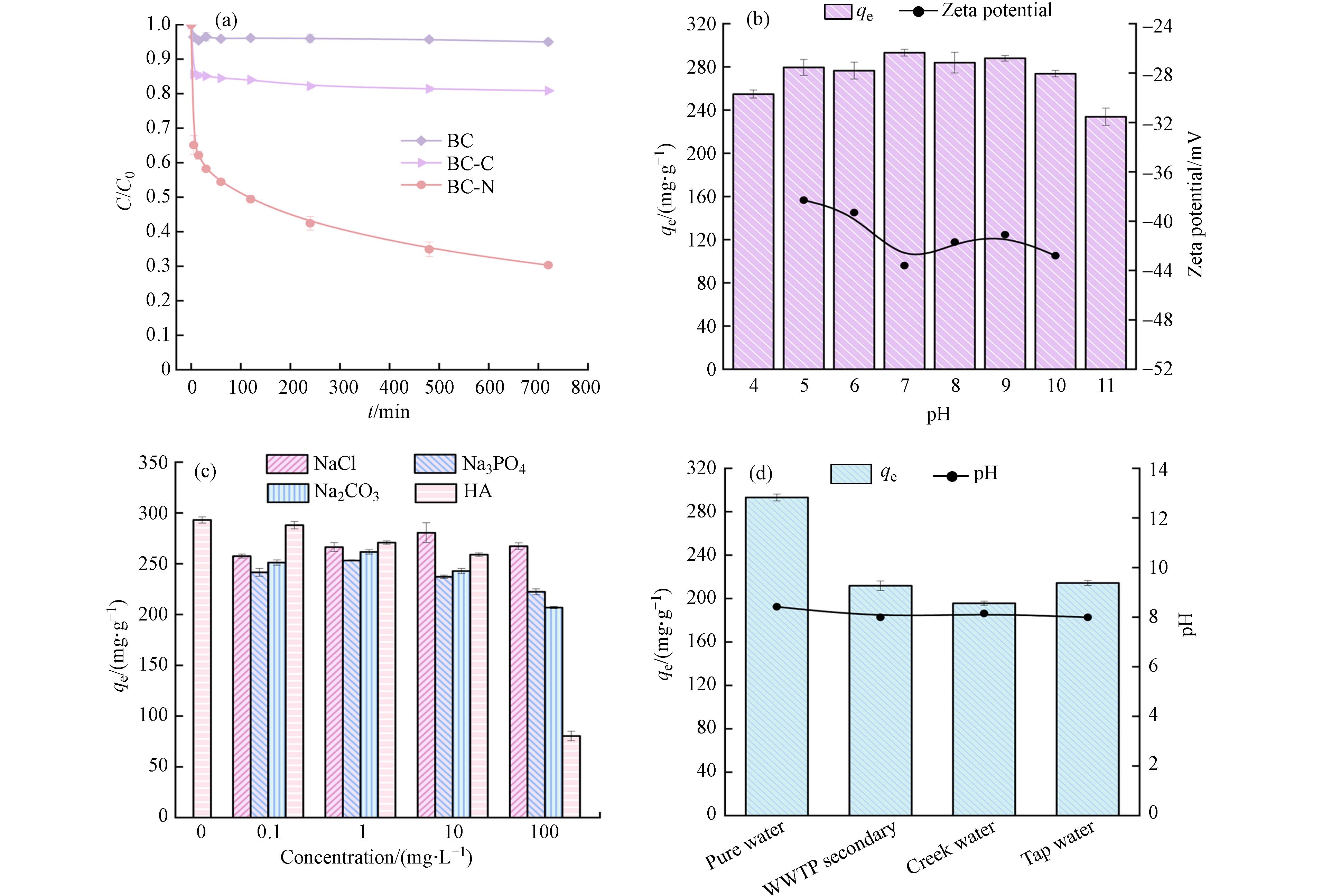
图4a为BC、BC-C和BC-N对TC的吸附性能,可以看出BC对TC的吸附效果十分有限(5%),BC-C对TC的吸附率为20%,而BC-N对TC的吸附率高达70%,说明需同时掺杂NaHCO3和(NH4)2C2O4才能有效增强对TC的吸附能力. 其中,与BC相比,BC-N对TC吸附量增加了15倍(293.1 mg·g−1),要高于Fe/Zn改性污泥生物炭对TC的最大吸附量(230.8 mg·g−1)[25]. 溶液pH是通过影响污染物的分子形态和吸附剂的表面电荷来调控生物炭吸附性能的重要因素[26]. 图4b显示BC-N在pH 4—11范围内对TC的吸附性能几乎不受溶液pH值影响,吸附量在228.11—295.3 mg·g−1. 由于在4—10的pH范围内,BC-N的Zeta电位均为负值(−37—−45),说明BC-N在此pH范围内表面带负电荷. TC是一种两性化合物,3.3<pH<7.7时,主要形态为H2TC0,7.7<pH<9.7之间时,TC主要形态为阴离子HTC−[27 − 28]. 而实验证明BC-N在pH 4—11范围内对TC均具有良好的吸附,说明除了静电排斥力以外,BC-N和TC之间还存在着化学吸附作用. 宽pH适用范围也预示BC-N具有良好的应用前景.
由图4c知,当分别加入0—100 mg·L−1的NaCl、Na3PO4、Na2CO3后,BC-N对TC的吸附量没有明显变化,表明溶液离子强度对BC-N吸附影响不大. 当腐殖酸(HA)浓度较低时(0.1—10 mg·L−1),对BC-N吸附TC的影响较小. 而当外加HA浓度为100 mg·L−1时,BC-N对TC的吸附出现明显抑制,这可能是由于HA的羟基与TC的氨基之间发生了竞争吸附[29 − 30]. 图4d为不同水质对BC-N吸附TC的影响. 可以观察到,相比于纯水,二级出水、自来水和溪水对TC的吸附有一定程度的抑制作用,吸附量分别为214.9、196.9、214.8 mg·g−1. 由于pH 4—11范围对BC-N吸附TC性能几乎不产生影响(图4b),而自来水、溪水和二级出水的pH在7.99—8.42范围,说明pH不是导致TC吸附量减少的主要原因. 此外,通过外加物质对吸附性能的影响实验(图4c),与外加离子(NaCl、Na3PO4、Na2CO3)相比,天然有机质(如HA)对TC吸附的影响更为强烈,高浓度HA的存在会明显抑制BC-N对TC的吸附. 不同水质的UV254即天然有机质含量大小为二级出水>溪水>自来水(表1),说明TC吸附量下降主要是由于天然有机质占据了BC-N表面吸附位点,降低了BC-N对TC的吸附,这与HA添加实验结果相符. 这意味着BC-N可能更适用于无有机质的制药工业废水中TC的去除.
-
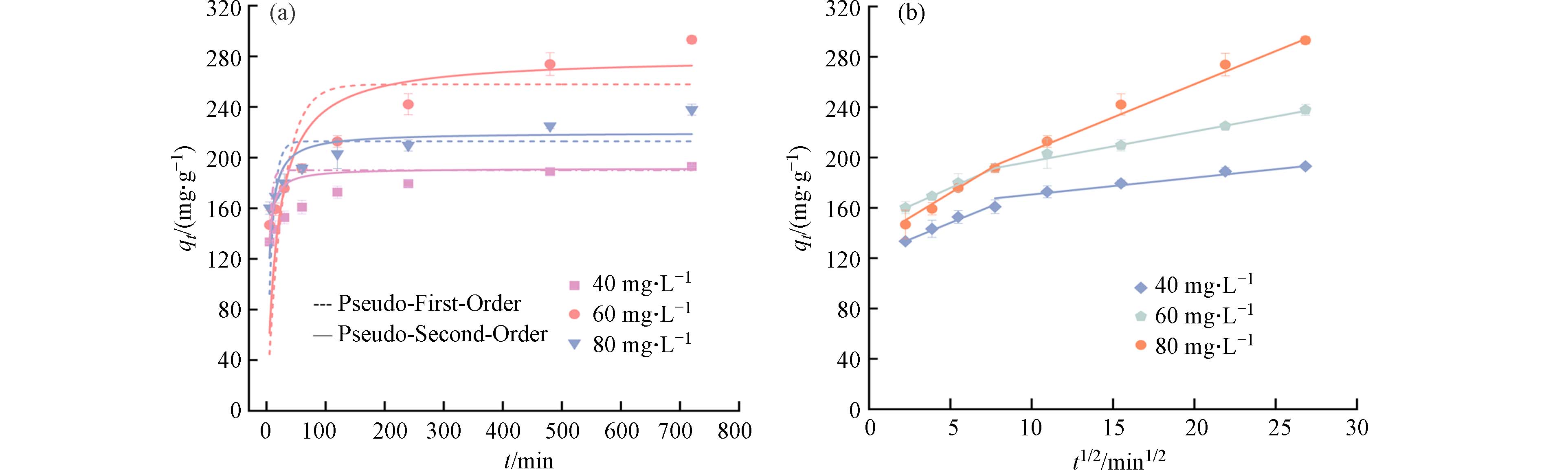
图5a显示了BC-N在不同TC浓度梯度(40、60、80 mg·L−1)下的吸附动力学结果. 可以观察到BC-N对TC的吸附量在60 min内迅速增加,此时BC-N表面吸附位点充足且TC浓度较高,与溶液中TC浓度差较大,吸附速率最快. 随着BC-N表面吸附位点被逐渐占据,在TC浓度差减小的情况下,BC-N的吸附速率逐渐降低后趋于平衡. 为了探究其吸附机制,使用拟一级动力学模型和拟二级动力学模型研究了这一过程. 表3显示,与拟一级动力学相比(R2=0.509—0.911),BC-N对TC的吸附更符合拟二级动力学(R2=0.810—0.951),表明吸附过程中的速率控制步骤主要为化学吸附[31].
作为推断反应类型和预测速率控制步骤的有效方法,颗粒内扩散模型被进一步应用于探索BC-N对TC的吸附控制步骤(图5b和表4)[32]. 由图5b可知,在3种TC浓度下均观察到双线性模式,表明BC-N对TC吸附过程分为两个阶段. 第一阶段为外扩散过程,陡峭的线表明吸附过程快速. TC被BC-N表面丰富的活性位点和较大的内部空间快速吸附,此时扩散速率最大. 第二阶段为内扩散阶段,TC进入BC-N孔道内部,随着孔道趋于狭窄,吸附位点减少,扩散阻力增大,吸附过程变得缓慢并逐渐达到平衡[33]. 此外,BC-N两个阶段的拟合方程的斜率大小均为Kd1>Kd2(表4),且这些线均没有穿过原点,即截距不为0(C≠0),表明有其他过程共同控制反应速率,颗粒内扩散过程不是唯一的限速步骤.
-
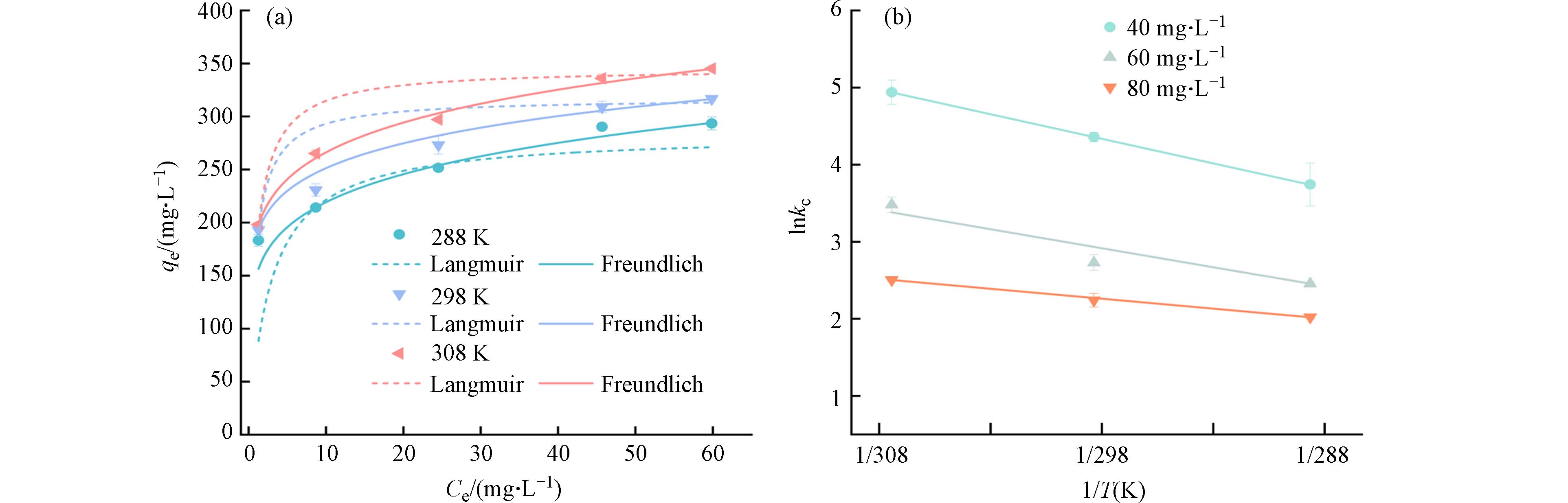
TC的吸附等温线如图6a所示,随TC浓度的增加,其平衡吸附量先迅速增加,后逐渐趋于平稳. 由表5得到,BC-N吸附TC的Freundlich模型的R2(0.972—0.999)高于Langmuir模型(0.698—0.980),表明Freundlich模型可以更好地描述与BC-N相关的吸附过程,属于多分子层吸附[34 − 35]. 通常使用因子(RL和1/n)来预测吸附难度[14]. Freundlich 模型中,1/n代表生物炭吸附作用的难易程度,0<1/n<1时,吸附容易发生. RL为分离常数,0<RL<1有利于吸附进行. 拟合结果显示,BC-N的RL(
0.0097 —0.0168 )和1/n(0.129—0.164)的值均大于0小于1,容易发生吸附行为. 说明BC-N对TC有较强的吸附力,可有效促进BC-N对TC的吸附,且吸附过程以化学吸附为主[35]. -
探究了分别在288 K、298 K、308 K时BC-N对TC的吸附行为. 如图6b所示,分别以1/T和lnkc为横纵坐标作图,所得直线的斜率和截距分别代表TC在BC-N上发生吸附反应时的焓变值(ΔH)和熵变值(ΔS). 再根据式(9)计算得到不同温度下的吉布斯自由能(ΔG). 其中,ΔG<0时,表示吸附过程是自发进行的. ΔH<0时,表示吸附过程是放热的,升高温度会抑制生物炭材料的吸附能力. ΔS<0时,表示吸附过程是混乱度减少的过程. BC-N对TC的ΔG、ΔH和ΔS如表6所示. 可以看出ΔG<0,说明BC-N对TC的吸附过程是自发进行的. |ΔG|随温度升高而增大,说明自发程度随温度升高而加剧,吸附驱动力也越大,更利于吸附进行[36]. ΔS>0,说明BC-N对TC的吸附是混乱度增加的过程,平衡向着吸附的方向移动,从而有利于吸附过程的进行[37]. ΔH>0,表明BC-N对TC的吸附为吸热过程,说明温度升高利于反应进行,这与吸附等温线的结论一致.
-
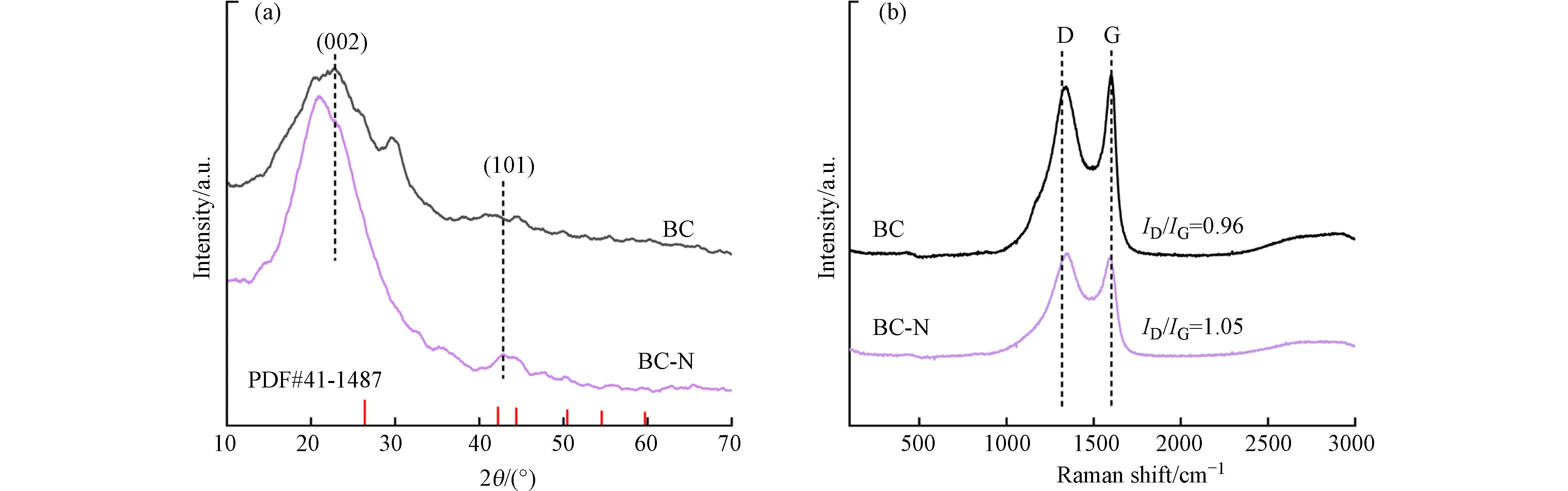
BC样品的X射线衍射(XRD)图显示在2θ≈23°存在一个石墨(002)平面的宽衍射峰(图7a)[38]. 与BC相比,BC-N在2θ≈21°出现了尖锐的石墨化峰,说明BC-N具有更高石墨化程度[39]. 同时,两样品的拉曼光谱(图7b)均在
1350 cm−1和1590 cm−1处出现无序碳(D)和石墨碳(G)的特征峰[40]. 与BC(0.96)相比,BC-N的ID/IG值增加到1.05,表明石墨化的BC-N上的N原子已整合到sp2碳网络中,并形成了更多缺陷位点[41]. 以上结果说明,与BC相比,具有石墨结构和缺陷位点的BC-N更易与富电子分子TC相互作用,产生更强的吸附能力[42]. -
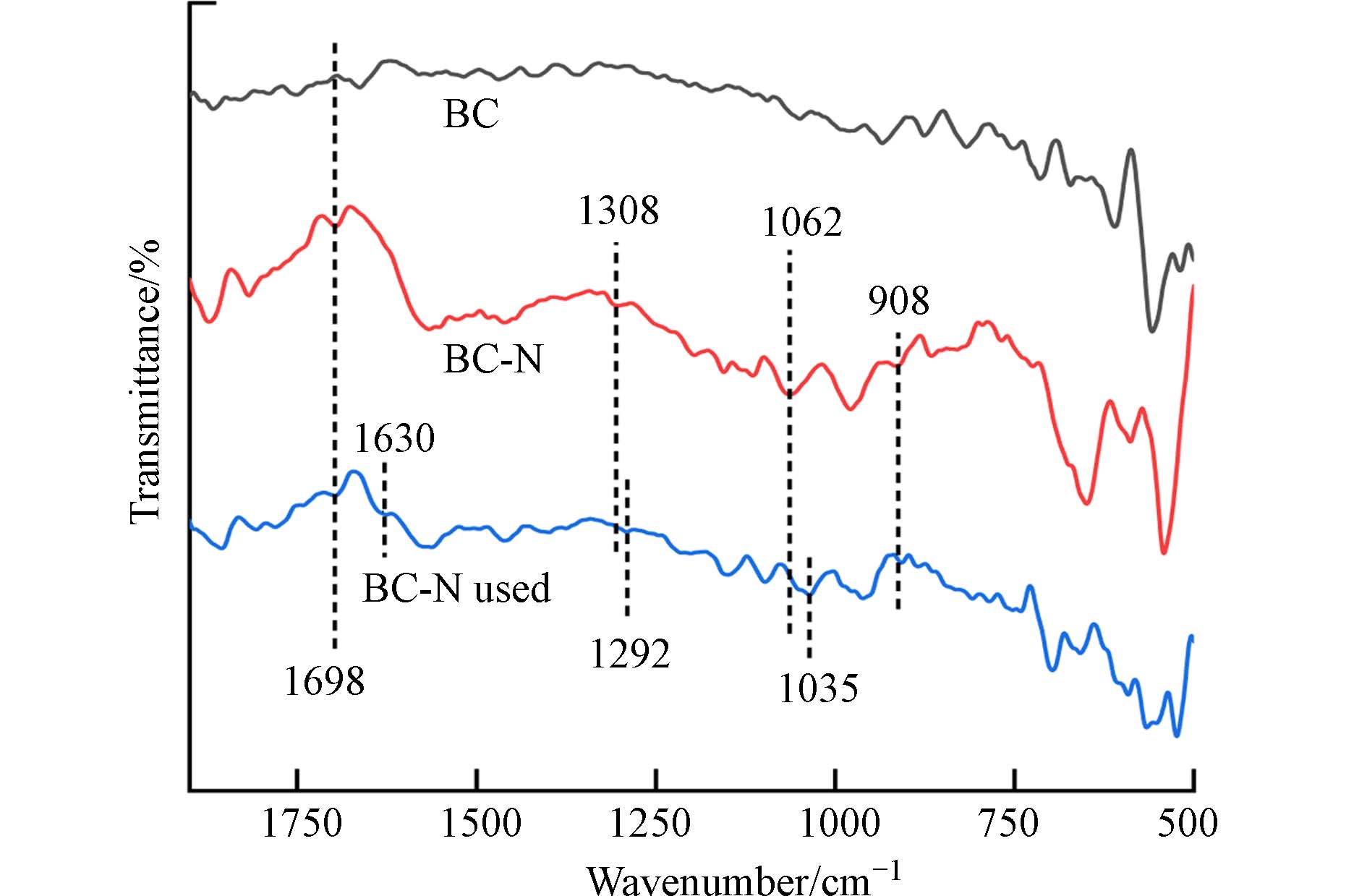
红外光谱图分析生物炭材料表面官能团的变化,有助于分析其吸附机制. 如图8所示,与BC相比,BC-N在908、
1308 、1062 、1698 cm−1处分别归属于生物炭上的N—H、C—N、C—O—C和C=N伸缩振动,表明N原子成功地嵌入了生物炭骨架中[6,43]. 与BC-N相比,吸附TC后的BC-N在1630 cm−1处出现新峰,这归属于TC酰胺(I 带)的C=O伸缩振动,说明TC已吸附在BC-N上[44]. 吸附TC后,BC-N上的1308 cm−1(C—N)、1062 cm−1(C—O—C)峰均发生红移,分别移动到1292 cm−1和1035 cm−1,这说明BC-N上的C—N、C—O—C键是吸附TC的主要作用位点[43,45]. -
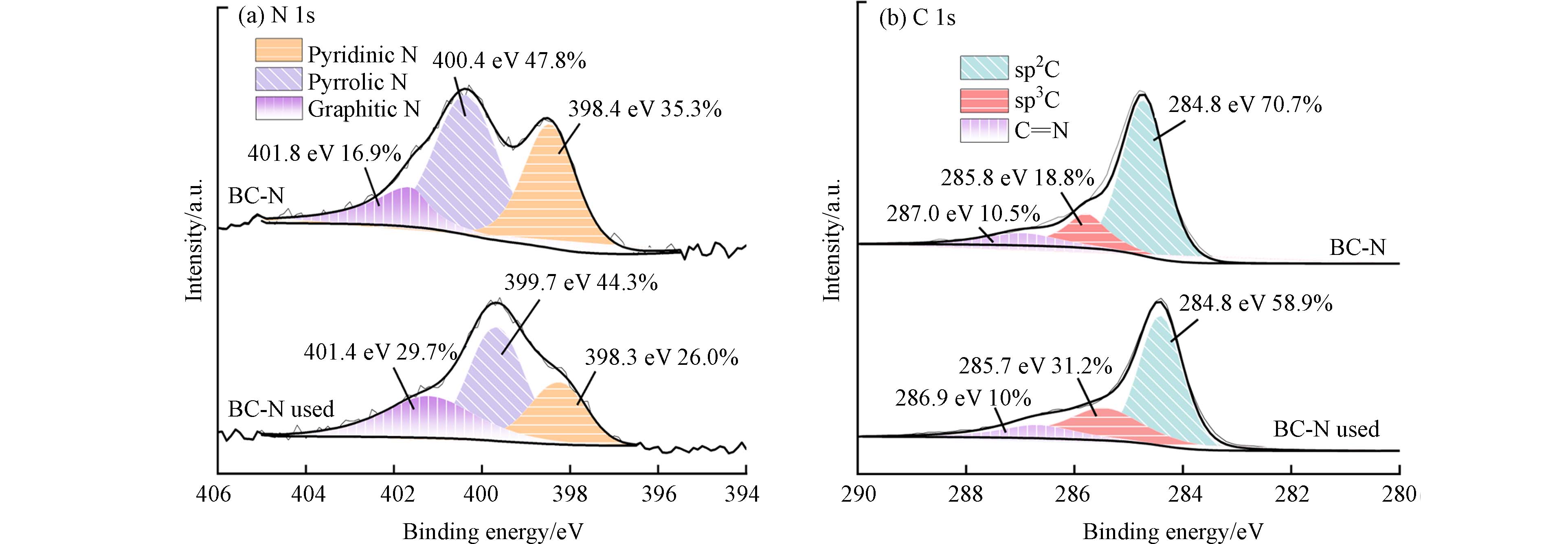
通过XPS扫描光谱探索生物炭样品的组成和化学状态. BC-N上的N在400.4、398.4、401.8 eV分别对应于吡咯N、吡啶N和石墨N(图9a) [46]. 在吸附TC后,吡啶N含量从35.3%明显下降到26%,吡咯N含量由47.8%下降至44.3%,这是由于吡咯N具有较强的亲电性,在TC亲核区域形成了较强的吸附. 石墨N含量由16.9%增加到29.7%,表明其仍具有高度石墨化结构,这与TEM结果一致[47]. C1s谱在284.8、285.8、287.0 eV分别对应于sp2C、sp3C和C=N(图9b),BC-N吸附TC后sp2C和C=N峰分别由70.7%和10.5%下降至58.9%和10.0%,而sp3C的峰由18.8%升高至31.2%,说明BC-N与TC发生了π-π相互作用[14,48]. 因此,结合FTIR结果,BC-N与TC之间的化学吸附主要是由石墨N介导的π-π相互作用.
-
本研究通过一步热解法制备了BC-N样品. 与BC相比,BC-N具有更高的比表面积(665.8 m2·g−1)、宽pH适应性(pH=4—11)和强抗干扰能力(NaCl、Na3PO4、Na2CO3、HA),可高效吸附水中的TC(293.1 mg·g−1). BC-N对TC的吸附过程遵循拟二级动力学和Freundlich等温线模型,吸附过程是以自发吸热的化学吸附为主. 通过TEM、XPS和FTIR的分析表明,BC-N与TC的化学吸附可能主要是由石墨N介导的π-π相互作用产生的. 本研究为开发一种制药工业废水中TC的生物炭基吸附技术提供了理论依据.
氮掺杂生物炭对水中四环素的吸附机理
Study on the adsorption mechanism of tetracycline in water by nitrogen-doped biochar
-
摘要: 如何通过增加表面活性位点数目来提高生物炭对有机污染物的吸附性能,是目前污染控制技术的研究热点. 通过一步热解法制备的氮掺杂分层多孔生物炭(BC-N)材料,可用于高效吸附去除水中四环素(Tetracycline,TC). 结果表明,与原始生物炭(BC)相比,含N官能团的引入使BC-N的比表面积和孔体积增加了约1倍,对TC的吸附量增加了15倍(293.1 mg·g−1). BC-N具有宽pH适应性(pH 4—11)和抗干扰能力. 由吸附动力学和热力学实验得到,BC-N对TC的吸附过程符合拟二级动力学和Freundlich吸附等温线模型,表明该吸附过程以自发吸热的化学吸附为主. X射线光电子能谱(XPS)和傅里叶变换红外光谱(FTIR)结果表明,BC-N与TC的化学吸附可能主要是由石墨N介导的π-π相互作用产生.Abstract: How to improve the adsorption performance of biochar to organic pollutants by increasing surface active sites is the research hotspot of pollution control technology. Nitrogen-doped layered porous biochar (BC-N) was prepared by one-step pyrolysis for adsorption and removal tetracycline (TC) from water. The results showed that the introduction of nitrogen-containing functional groups increased the specific surface area and pore volume of BC-N by about 1 times, and the adsorption capacity of TC increased by 15 times (293.1 mg·g−1), compared with the pristine biochar (BC). BC-N has wide pH adaptability (pH 4—11) and anti-interference capability. According to the adsorption kinetics and thermodynamics experiments, the adsorption process of BC-N on TC is the quasi-second-order kinetics and Freundlich adsorption isotherm model, which indicates that the adsorption process is dominated by spontaneous endothermic chemisorption. X-ray photoelectron spectroscopy (XPS) and Fourier transform infrared spectroscopy (FTIR) also shown that the chemisorption between BC-N and TC may be mainly due to the π-π interaction mediated by graphitic nitrogen.
-
Key words:
- biochar /
- nitrogen doping /
- tetracycline /
- adsorption capacity /
- adsorption mechanism.
-
邻苯二甲酸酯(phthalate esters,PAEs)作为增塑剂,被大量添加在塑料、涂料、化肥和化妆品等商品中. 根据信息处理服务公司(Information handling services,IHS)的一份报告,2014年全球生产和消费的增塑剂为840万吨,其中PAEs类占了70%[1]. 预计2017—2022年全球对PAEs的需求将以年均1.3%的速度增长[2]. 目前,PAEs在中国每年的生产量和消费量大约为130万吨,占全球总量的20%[3]. 鉴于PAEs不是通过稳定的化学键与产品结合,此类化合物很容易通过多种方式释放到环境中,例如工业和市政废水排放、固体废物处置和浸出、产品使用过程中的迁移和挥发[4-6]. 研究表明全球大多数人群均已暴露于PAEs中,并且已在人体血清和脂肪中发现PAEs的存在[7]. 人体暴露于PAEs的主要途径为食物和饮用水的摄入[8-9],其中饮用水作为每日必须摄入的介质,其中含有的PAEs对人体的影响近年来受到了广泛关注[5,10-11].
邻苯二甲酸二甲酯(dinethyl phthalate,DMP)、邻苯二甲酸二乙酯(diethyl phthalate,DEP)、邻苯二甲酸二丁酯(di-n-phthalate,DBP)、邻苯二甲酸丁苄酯(butylbenzyl phthalate,BBP)、邻苯二甲酸二(2-乙基己基)酯(di(2-ethylhexyl)phthalate,DEHP)和邻苯二甲酸二辛酯(di-n-octyl phthalate,DNOP)已被联合国列入优先管控污染物[12],DMP、DBP和DEHP也已被列入我国水环境优先控制污染物黑名单,但均未列入我国2017年和2020年出台的两批《优先控制化学品名录》中. 我国《地表水环境质量标准》(GB3838-2002)、《生活饮用水卫生标准》(GB 5749-2006)、《城市供水水质标准》(CJ/T206-2005)中也规定了部分PAEs的限值. DEHP由于存在最多的健康和环境问题,已被归类为国际癌症研究机构(IARC)确定的可能对人类致癌的物质[13]. 尽管近几年来,PAEs在各类饮用水环境中的检出引起了人们的重视,研究范围涉及水源水、自来水和瓶装水等样品,但针对江苏省沿江城市居民住宅自来水的研究几近空白.
本研究选取江苏省不同区域居民自来水中的PAEs作为研究对象,分析PAEs的污染特征,检验加热煮沸过程对自来水中的PAEs是否具有去除效果,评估经口摄入的人体健康风险,以期为全省饮用水健康安全管控提供科学支撑.
1. 材料与方法(Materials and methods)
1.1 样品的采集
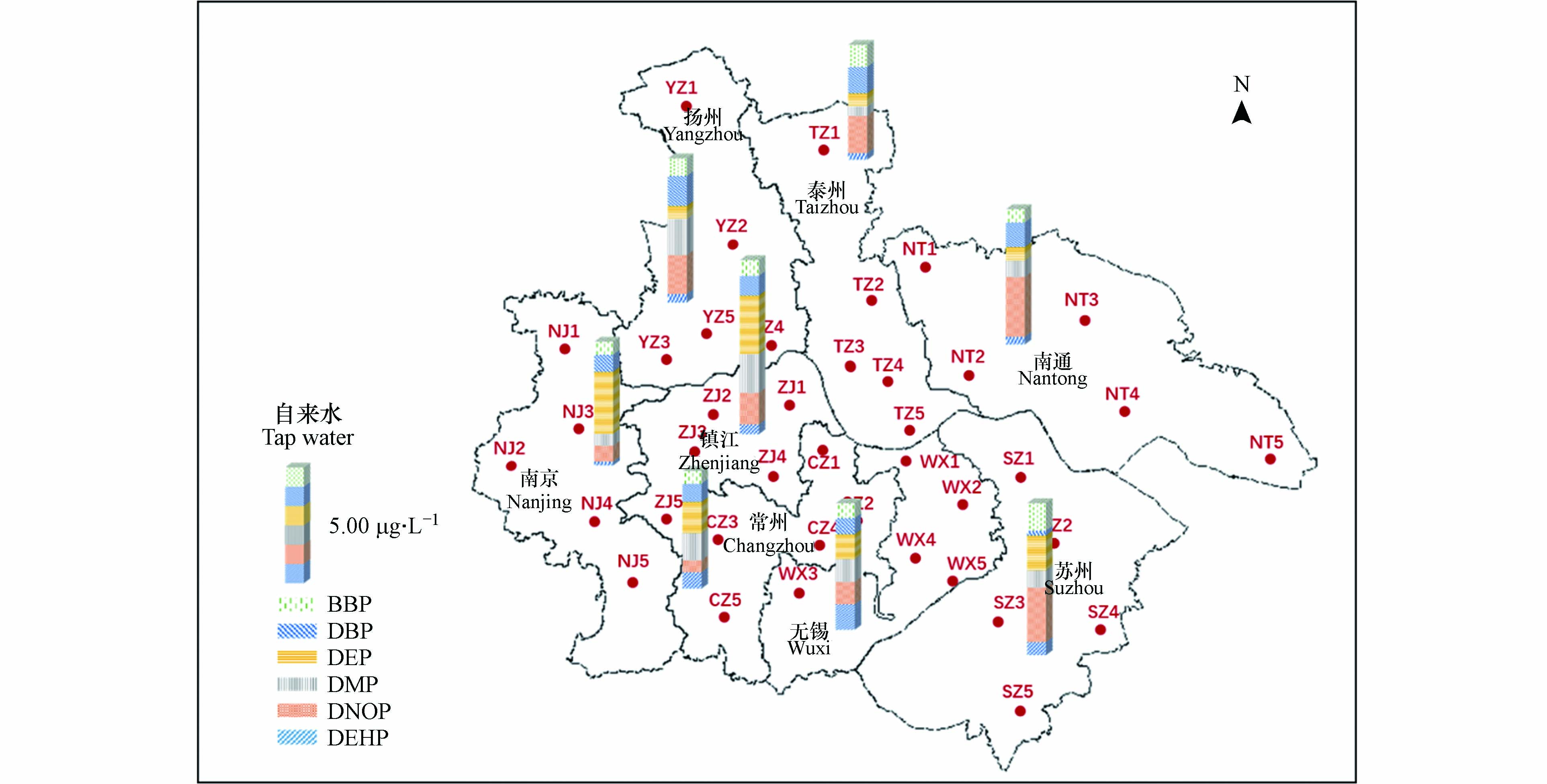
于2017年3月至4月,分别采集江苏省沿江8市(南京、无锡、常州、苏州、南通、扬州、镇江、泰州)居民住宅自来水,采样点位如图1所示. 每个城市选取5户居民进行取样(n=40),采样体积为2 L,所有水样均置于棕色玻璃瓶中,4 ℃避光保存,并于24 h内运回实验室分析. 为了研究加热煮沸过程对水中PAEs的去除效果,从每个城市选取两份水样在实验室煮沸,冷却至室温后保存待测(n=16).
1.2 仪器与试剂
超高效液相色谱/串联质谱(Waters Acquity/TQD),Masslynx工作站,ODS液相色谱柱(waters, BEH C18, 50 mm×2.1 mm, 1.7 μm);Milli-Q超纯水器(美国Millipore公司);HLB玻璃材质固相萃取柱(200mg/5cc,Waters,美国).
6种PAEs(DMP、DEP、DBP、BBP、DEHP和DNOP)混合标准品储备液,质量浓度为100 μg·mL−1(德国Dr. Ehrenstorfer公司),纯度在98.5%—99.5%之间;替代标准物氘代邻苯二甲酸二正丁酯(d4-DBP)和内标物氘代邻苯二甲酸二乙酯(d4-DEP),质量浓度均为100 μg·mL−1(美国Accustandard公司),实验用甲醇、正己烷、乙腈、丙酮等试剂均为农药级或LC-MS级.
1.3 样品的前处理
取1L水样,加入回收率指示物(d4-DBP),以10 mL·min -1的流速通过HLB固相萃取柱. 上样前依次用10 mL乙醚、5 mL乙腈和5 mL超纯水活化萃取柱. 水样过柱后,用高纯氮气吹干HLB小柱,再用体积95:5的乙醚-乙腈溶液进行洗脱,收集洗脱液,氮吹浓缩至近干,用乙腈定容至1 mL,加入内标化合物(d4-DEP)后置于进样瓶中,等待进样.
1.4 仪器分析
本研究采用超高效液相色谱/串联质谱仪(Waters Acquity/TQD)、BEH C18色谱柱(50 mm×2.1 mm,1.7 μm)对目标化合物进行定性和定量分析. 进样量为10 μL,流动相为水(A相,含0.2%甲酸)和甲醇(B相),流速为0.4 mL·min−1,色谱柱温度为40 ℃,流动相梯度设置如下: 0 min,A相比例为90%,保持2 min; 2—12 min,A相比例由90%降为0%,保持4 min; 16—18 min,A相比例恢复至60%. 质谱采用电喷雾离子源(ESI),正离子扫描方式,多离子反应监测(MRM)模式,监测条件见表1. 离子源温度120 ℃,毛细管电压4.0 kV,去溶剂温度400 ℃.
表 1 目标化合物的多反应监测条件Table 1. MRM parameters for target compounds化合物Compounds 母离子Precursor ions(m/z) 子离子Product ions (m/z) 解簇电压/VDeclustering potential 碰撞能量/VCollision energy DMP 195.3 163.0* 40 12 195.3 77.1 40 46 DEP 223.1 177.4* 50 25 223.1 149.3 50 12 BBP 313.3 91.3* 68 27 313.3 205.2 68 12 DBP 279.1 149.3* 72 20 279.1 205.2 72 12 DEHP 391.1 167.0* 84 18 391.1 149.0 84 32 DNOP 391.3 261.1* 60 10 391.3 149.0 60 20 1.5 质量保证与质量控制(QA/QC)
实验过程中发现采用液质联用分析PAEs时,存在较大的系统空白干扰,为解决该问题,参考已有研究方法并进行优化完善[14]:在液相输液泵和进样阀之间加入一根吸附分配柱,通过六通阀切换,流动相经过该分配柱后,进入定量环,将定量环中样品带入色谱柱进行分离分析; 由于色谱系统产生的干扰经过吸附分配柱后可以进行短暂的吸附保留,再进入色谱柱,而定量环中的样品则直接经过色谱柱被吸附保留. 因此,系统产生的干扰和目标化合物可以产生出峰时间差,从而减少误差干扰.
实验过程中避免使用塑料和橡胶器皿,所使用的玻璃容器均在马弗炉中400 ℃高温烘烤4 h后经正己烷、丙酮和乙腈清洗. 所有水样均添加回收率标样,每5份样品添加1个程序空白. 自来水中6种PAEs的加标回收率范围为86.5%—109%. 以3倍空白水样加标样测定结果的标准偏差计算各种物质的方法检出限(detection limit,DL),6种PAEs化合物的DL范围为0.1—0.5 μg·L−1.
1.6 健康风险评价
本研究采用美国环保署(USEPA)推荐的水环境健康风险评价模型,分别评估了通过饮用水途径暴露的DEHP致癌风险和∑PAEs非致癌风险. 通过饮用水摄入的日均PAEs剂量(CDI)可以通过公式(1)计算:
CDI=C×IR/BW (1) 式中, CDI为每天通过饮水摄入的PAEs平均剂量(mg·kg−1·d−1); C为饮用水中PAEs的含量(mg·L−1); IR为每日饮用水的摄入量(取2 L·d−1); BW为人均体重(取60 kg).
通过饮用水途径暴露的DEHP致癌风险(RDEHP)通过公式(2)计算:
RDEHP=CDI×SF (2) 式中,SF为经口摄入致癌斜率因子,DEHP的SF值为0.014 kg·d·mg−1.
PAEs非致癌风险采用危险指数(HI)进行评估,通过公式(3)计算:
HI=CDI/RfD (3) 式中,RfD为法规或指南中给出的PAEs非致癌危害的参考剂量(mg·kg−1·d−1),DEP、BBP、DBP、DNOP和DEHP的RfD分别为0.8、0.2、0.1、0.01、0.02 mg·kg−1·d−1,DMP缺少RfD参考剂量数据,HI小于1表示处于安全范围.
2. 结果与讨论(Results and discussion)
2.1 江苏城市饮用水中PAEs的含量与组成
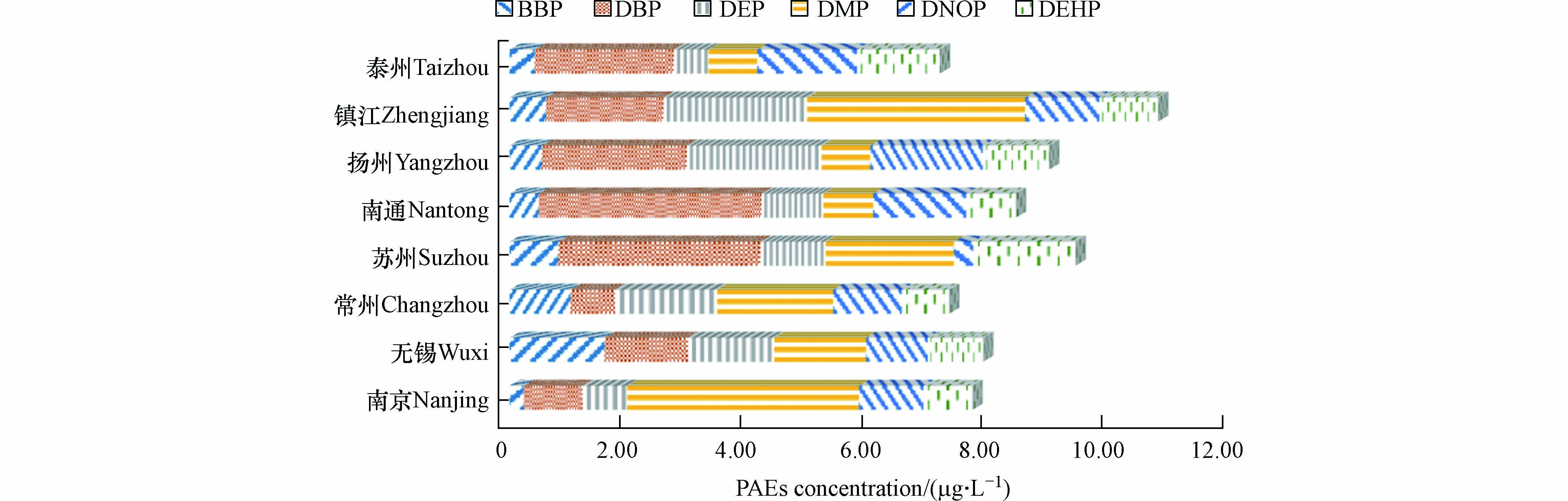
江苏省8个城市居民自来水水样中PAEs检出率为100%,PAEs含量如图2所示,∑PAEs检出范围为4.10—14.23 μg·L−1,平均值为(8.43±2.76)μg·L−1,其中镇江市自来水中∑PAEs含量最高,达到(10.76±2.10)μg·L−1,苏州市其次((9.39±2.08)μg·L−1),泰州市最低((7.14±3.39)μg·L−1).
DBP在所有水样中均有检出,且平均含量最高((2.10±1.65)μg·L−1),17.5%的自来水样品中DBP浓度超过《生活饮用水规范》(GB5749-2006)限值(3 μg·L−1). 所有自来水样品中DEHP浓度均未超过《生活饮用水规范》(GB5749-2006)与世界卫生组织(WHO)《饮用水水质准则》限值(8 μg·L−1)或美国瓶装水中的标准限值(6 μg·L−1)[15],说明江苏省部分城市居民自来水已受到PAEs污染,存在一定的潜在健康风险,该结论与我国其他已有研究结果相似[16-17]. 然而,根据美国环保署1997年出台的饮用水法规和健康建议,由于DEHP致癌性,美国对DEHP的最终管理目标是零暴露风险[18]. 同时有研究表明,长期饮用含有微量PAEs的水,即使其含量满足饮用水标准,也可能对人体健康造成危害[19-20]. 从组成成分来看,DBP和DMP是造成自来水中PAEs含量差异的最主要因素.
表2列出了全球其他国家和地区饮用水中PAEs的污染情况,本研究结果与沙特阿拉伯(0.2—30.8 μg·L−1)和墨西哥(0.6—45.1 μg·L−1)等国家瓶装水中PAEs的含量相近[5],比葡萄牙(0.02—0.35 μg·L−1)、法国(0.03—0.35 μg·L−1)和伊朗(0.07—0.52 μg·L−1)等西方国家自来水中浓度高近两个数量级[11,21-22],比我国天津市居民饮用水((2.41±0.39)μg·L−1)高一个数量级[23],但低于河南省的研究结果(0.24—82.2 μg·L−1)[24],这与河南饮用水取样点位受到污染河流水平扩散、垂直渗透和雨水溶解有关. 已有研究表明江苏居民自来水中PAEs来源广泛,包括水源水赋存、生产过程带入和塑料管道析出等[25].
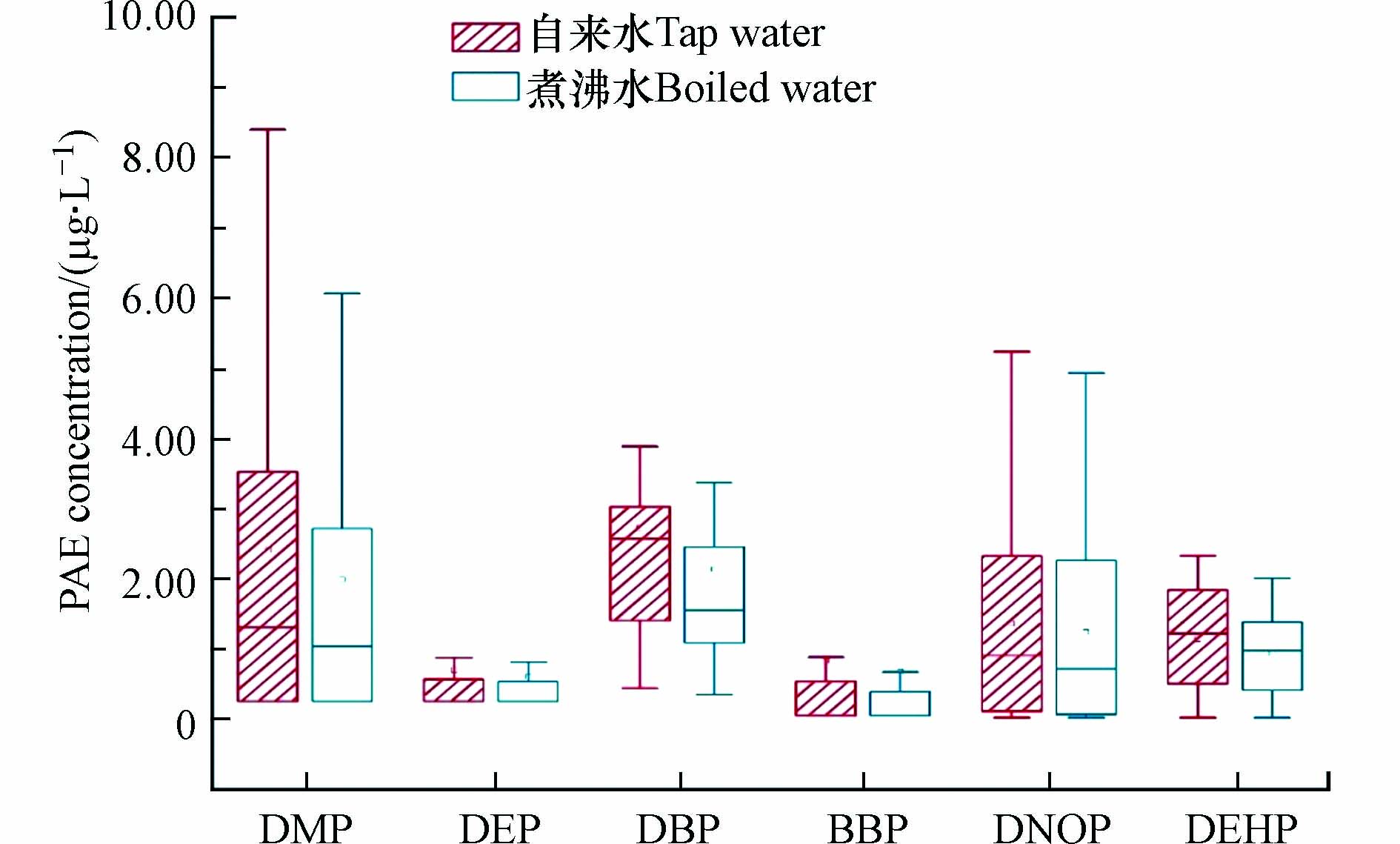
表 2 世界其他国家和地区自来水中PAEs含量Table 2. Concentrations of PAEs in other countries and regions around the world国家和地区Country and region BBP/(μg·L−1) DBP/(μg·L−1) DEP/(μg·L−1) DMP/(μg·L−1) DNOP/(μg·L−1) DEHP/(μg·L−1) ∑PAEs/(μg·L−1) 参考文献Reference 江苏省Jiangsu nd—7.39(0.71) 0.34—7.40(2.01) nd—6.41(1.40) nd—8.40(1.93) nd—5.23(1.23) nd—6.87(1.93) 4.10—14.23(8.43) 本研究 天津市Tianjin 0.44—0.71 0.38—0.68 — — — 1.10—1.78 1.92—2.78(2.41) [23] 河南省Henan nd 0.93 44.04 38.19 — 12.49 — [24] 武汉市Wuhan — 0.60 0.90 nd — — — [26] 葡萄牙Portugal 0.03 0.52 0.19 0.04 — 0.06 0.02—0.35 [21] 德国Germany 0.05 0.64 0.16 — — 0.06 0.02—0.60 [27] 西班牙Span nd nd—0.91 nd—0.38 nd—0.03 — nd 0.38—0.73 [10] 西班牙Span nd nd 0.19 nd — nd nd—0.19 [28] 法国France nd 0.04 0.03 nd — 0.35 — [22] 希腊Greece — 1.04 0.30 — — 0.93 0.30—1.04 [29] 捷克Czech 0.002 0.05 0.07 0.08 nd 0.66 — [30] 越南Vietnam 0.20—4.21 0.01—2.56 nd—2.57 nd—0.54 nd—1.93 1.01—14.50 2.10—18.00(11.2) [31] 伊朗Iran 0.05—0.15(0.10) nd—0.14(0.09) nd—0.09(0.05) 0.08—0.67(0.37) nd—0.11(0.01) nd—0.38(0.15) 0.07—0.52 [11] 注:nd,未检出,not detected;—,未参与检测,not included;( ),平均值,mean level 图3比较了自来水与煮沸后冷却至室温的水样中PAEs的浓度,结果与其他研究类似[32],加热或煮沸后的自来水中,PAEs含量有所下降,但下降程度有限,其中DBP平均降低程度最高(21.6%),其次是BBP(18.6%),DNOP最低(9.1%). 值得注意的是,有研究报道,若将开水立刻倒入塑料杯,高温会加速塑料中PAEs的析出,导致饮用水中PAEs含量显著升高[23].
2.2 PAEs健康风险评价
2.2.1 致癌风险评估
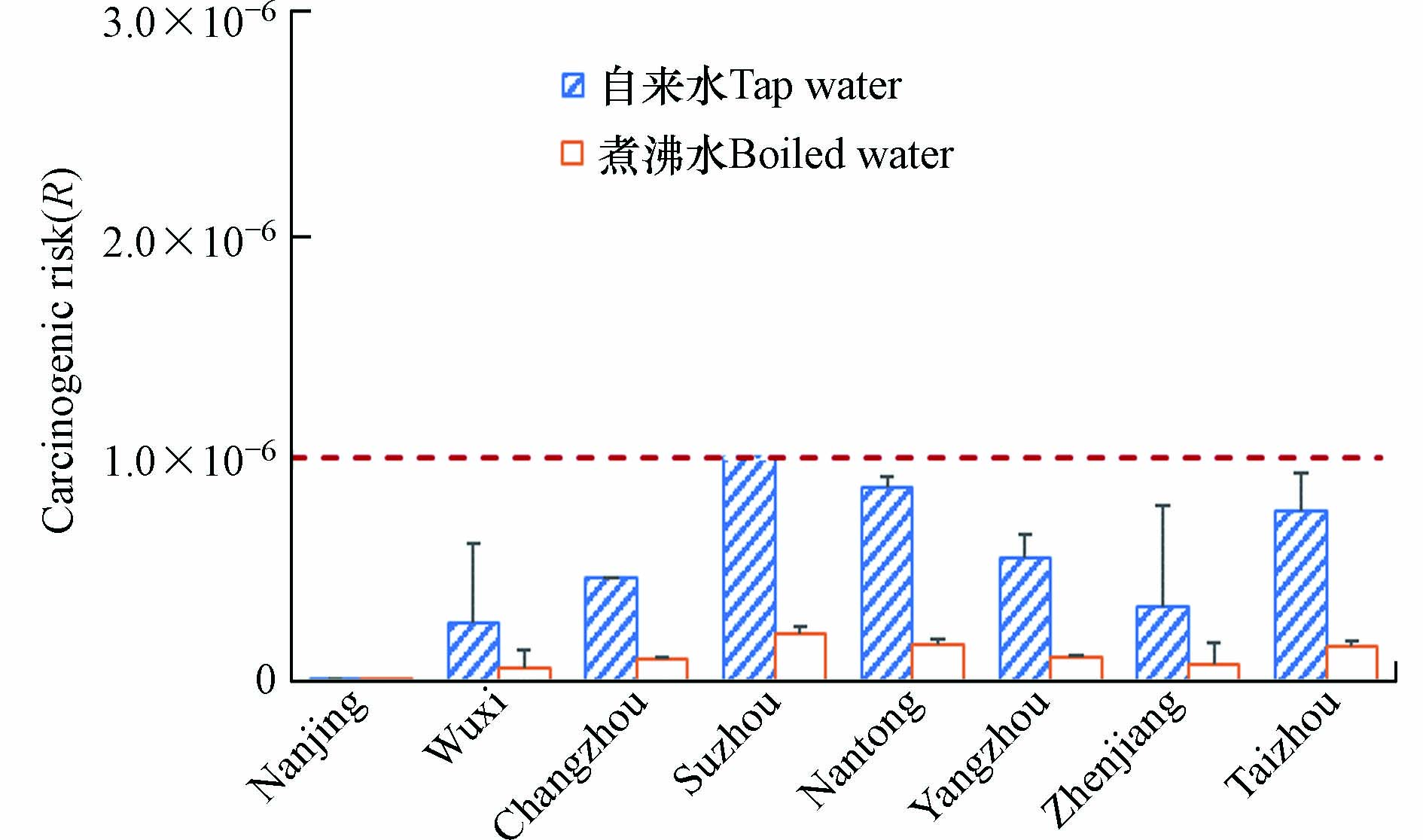
江苏省不同地区通过饮用水摄入导致的DEHP致癌风险如图4所示,所有自来水和煮沸冷却水中DEHP的致癌风险均低于USEPA推荐的健康风险可接受最大水平(1×10−6),其中苏州、南通和泰州水样中DEHP致癌风险较高. 煮沸后的自来水在一定程度上降低了DEHP的致癌风险,降幅达到78%. 但在高温情况下DEHP会从塑料包装中迁移至水体,导致DEHP的致癌风险有超过1×10−6的可能[23,33],另外随着储存时间的增加,水中DEHP的含量也会随之上升[22]. 因此,长期饮用存放在高温环境中的瓶装水,例如高温天气车内长时间放置的瓶装水,对人体健康危害极大,应引起高度重视.
2.2.2 非致癌风险评估
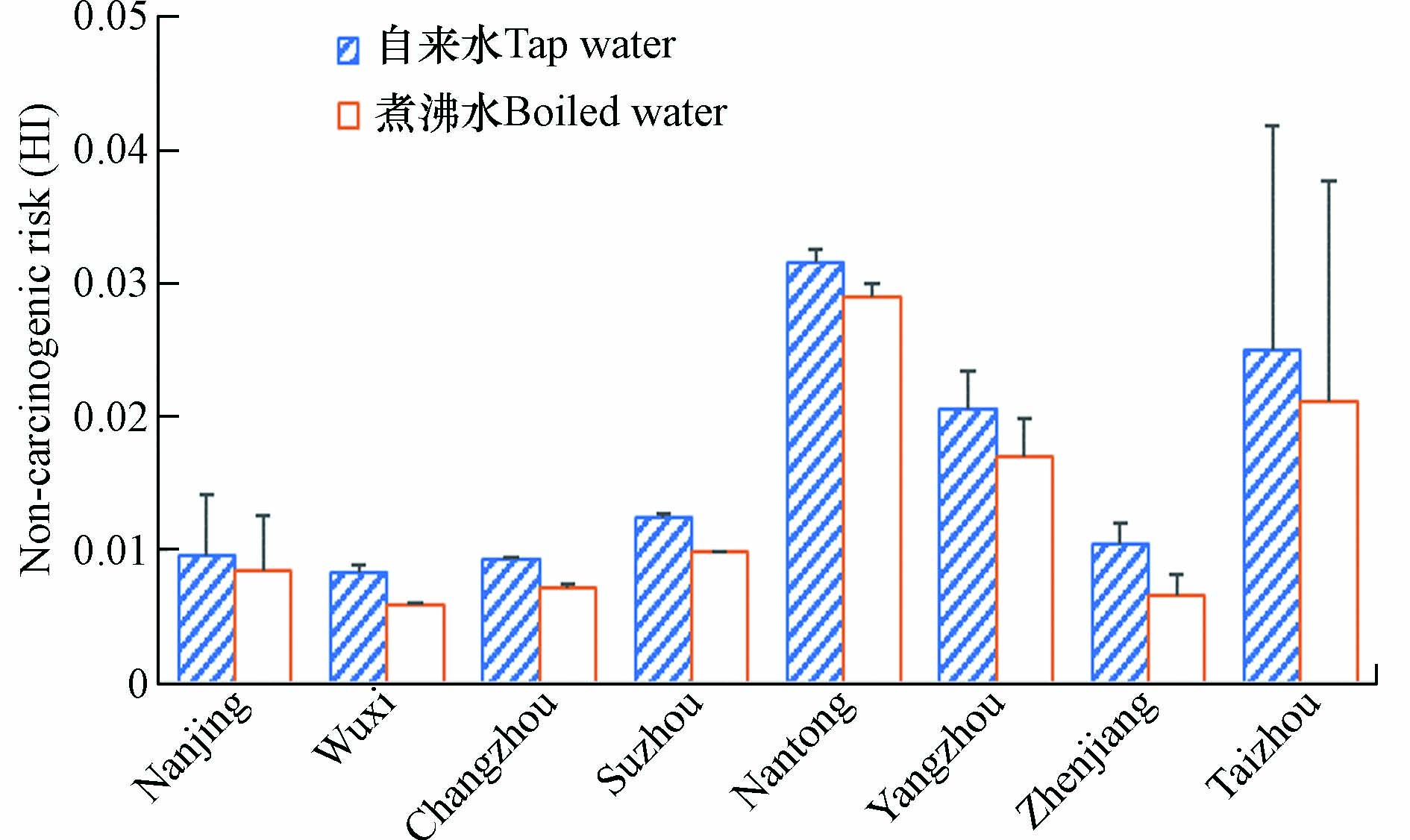
5种PAEs(DEP、BBP、DBP、DNOP和DEHP)的非致癌风险采用危险指数如图5和表3所示. 结果显示,江苏省8个城市自来水中∑PAEs的HI范围在8.26×10−3(无锡市)—3.25×10−2(南通市),均远小于1,表明江苏省不同地区自来水中PAEs摄入对人体造成的非致癌健康风险可忽略不计. 煮沸后的自来水PAEs非致癌风险与致癌风险变化情况类似,均有不同程度的降低,该结果与Wang[23]和Li[20]在天津市和黄海沿海城市的研究结果一致. DBP在自来水中占总非致癌风险的47.3%,而BBP和DEHP仅占1.60%和1.58%,该结果与天津市自来水中PAEs的非致癌风险占比(DEHP占比最大)有较大差别[23],主要原因是尽管DEHP毒性最大,但在江苏省8个城市自来水样中DEHP的含量相对较低,因此对∑PAEs非致癌风险贡献较小.
除了通过饮用水的暴露方式,PAEs还可以通过食物摄入和皮肤接触等途径对人体健康造成负面影响. 此外,自来水中可能存重金属、农药、消毒副产物和个人护理产品等多种污染物,它们之间的协同效应可能会对人体健康产生多重负面影响. 因此,建议进一步研究并持续监测这些化学物质在不同条件下的自来水和瓶装水中的赋存特征,以期更好地管控生态环境健康风险.
表 3 江苏省不同城市居民自来水中PAEs非致癌风险Table 3. Non-carcinogenic risks of PAEs in residential tap water from different cities in Jiangsu Province城市 City HIBBP HIDBP HIDEP HIDMP HIDNOP HIDEHP ∑HI 南京Nanjing 1.67×10−5 4.67×10−3 9.36×10−5 na 4.77×10−3 4.17×10−5 9.59×10−3 无锡Wuxi 1.27×10−3 4.72×10−3 2.66×10−4 na 1.07×10−3 9.36×10−4 8.26×10−3 常州Changzhou 1.67×10−5 2.48×10−3 1.23×10−4 na 5.02×10−3 1.64×10−3 9.28×10−3 苏州Suzhou 1.67×10−5 8.69×10−3 4.17×10−5 na 8.33×10−5 3.60×10−3 1.24×10−2 南通Nantong 1.67×10−5 1.58×10−2 4.17×10−5 na 1.26×10−2 3.09×10−3 3.15×10−2 扬州Yangzhou 3.97×10−4 1.15×10−2 4.17×10−5 na 6.66×10−3 1.97×10−3 2.06×10−2 镇江Zhenjiang 1.55×10−4 8.65×10−3 2.86×10−4 na 8.33×10−5 1.18×10−3 1.04×10−2 泰州Taizhou 3.24×10−4 1.60×10−2 4.17×10−5 na 5.91×10−3 2.73×10−3 2.50×10−2 注:na,无参考数据,no reference data 3. 结论(Conclusion)
(1)江苏省8个城市40份居民自来水中均检出了PAEs,检出范围为4.10—14.23 μg·L−1,其中镇江市自来水中PAEs的含量最高. 与其他国家和地区相比,本研究区域自来水中PAEs含量处于中等偏上水平,其污染来源有待进一步明确.
(2)与自来水相比,煮沸后冷却至室温的水样在一定程度上降低了PAEs浓度和此类化合物的致癌风险与非致癌风险.
(3)研究区域内DEHP致癌风险指数小于最大可接受风险水平(1×10−6),∑PAEs的非致癌风险指数远小于1,但部分水样中DBP含量超过《生活饮用水规范》(GB5749-2006)限值,存在潜在的生态环境健康风险.
-
图 4 (a)BC、BC-C和BC-N对TC的吸附性能,(b)pH对吸附性能和Zeta电位的影响,(c)离子强度和腐殖酸对吸附的影响,(d)不同水质对吸附的影响
Figure 4. (a)The adsorption performance of BC, BC-C, and BC-N on TC, (b) the influence of pH on adsorption performance and Zeta potential, (c) the influence of ion strength and humic acid on adsorption, and (d) the influence of different water quality on adsorption
表 1 3种水质的基本性质
Table 1. The basic properties of three types of water quality
二级出水WWTP secondary effects 溪水Creek water 自来水 Tap water DOC/(mg·L−1) 12.83 18.28 1.68 UV254/cm−1 0.062 0.052 0.016 SUVA254 4.83×10−3 2.84×10−3 9.52×10−3 TP/(mg·L−1) 0.148 0.047 0.012 TN/(mg·L−1) 4.93 3.15 1.79 pH 7.99 8.15 7.99 表 2 生物炭比表面积、平均孔径与孔容参数
Table 2. Specific surface area, average pore size and pore volume parameters of biochar
生物炭Biochar 比表面积/ (m2·g−1)Specific surface area 平均孔径/nmAverage Pore diameter 孔容/ (cm3·g−1)Pore volume BC 310.7 1.97 0.165 BC-N 665.8 2.59 0.448 表 3 BC-N吸附TC的动力学拟合参数
Table 3. Kinetic fitting parameters of TC adsorption by BC-N
C0/(mg·L−1) 拟一级动力学模型Pseudo first order kinetic model 拟二级动力学模型Pseudo second order kinetic model k1/(min−1) qe,1/(mg·g−1) R2 k2/(g·mg−1·min−1) qe,2/(mg·g−1) R2 40 0.2406 190.07 0.911 23.3×10−4 191.51 0.951 60 0.1136 212.90 0.509 11.1×10−4 219.80 0.810 80 0.0381 257.84 0.695 2.02×10−4 279.33 0.862 表 4 BC-N粒子内扩散模型拟合参数
Table 4. Fitting parameters of BC-N intra-particle diffusion model
C0/(mg·L−1) 第一阶段The first stage 第二阶段The second stage Kd1/(mg·g−1·min1/2) C/(mg·g−1) R2 Kd2/(mg·g−1·min1/2) C/(mg·g−1) R2 40 5.28 121.66 0.992 1.34 157.19 0.965 60 5.77 146.96 0.999 2.38 173.17 0.998 80 7.86 132.60 0.973 5.26 152.91 0.996 表 5 吸附等温线的拟合参数
Table 5. Fitting parameters of adsorption isotherms
T/K Langmuir 等温吸附模型Langmuir adsorption isotherm model Freundlich等温吸附模型Freundlich adsorption isotherm model qm /(mg·g−1) KL/(L·mg−1) R2 RL KF/(g·mg−1·min) 1/n R2 288 283.81 0.698 0.698 0.0168 150.27 0.164 0.972 298 317.28 1.213 0.980 0.0097 186.87 0.129 0.999 308 345.56 1.021 0.952 0.0115 190.82 0.145 0.999 表 6 BC-N 吸附TC的热力学参数
Table 6. Thermodynamic parameter for TC adsorption by BC-N
T/ K Kc ΔG/(kJ·mol−1) ΔH/(kJ·mol−1) ΔS/(J·mol−1·K−1) 288 7.53 −4.84 44.16 184.40 298 9.68 −23.97 308 12.23 −31.30 -
[1] WANG Q, LI X N, YANG Q X, et al. Evolution of microbial community and drug resistance during enrichment of tetracycline-degrading bacteria[J]. Ecotoxicology and Environmental Safety, 2019, 171: 746-752. doi: 10.1016/j.ecoenv.2019.01.047 [2] SINGH R, SINGH A P, KUMAR S, et al. Antibiotic resistance in major rivers in the world: A systematic review on occurrence, emergence, and management strategies[J]. Journal of Cleaner Production, 2019, 234: 1484-1505. doi: 10.1016/j.jclepro.2019.06.243 [3] JI L L, LIU F L, XU Z Y, et al. Adsorption of pharmaceutical antibiotics on template-synthesized ordered micro- and mesoporous carbons[J]. Environmental Science & Technology, 2010, 44(8): 3116-3122. [4] GUO J L, HUANG M H, GAO P, et al. Simultaneous robust removal of tetracycline and tetracycline resistance genes by a novel UiO/TPU/PSF forward osmosis membrane[J]. Chemical Engineering Journal, 2020, 398: 125604. doi: 10.1016/j.cej.2020.125604 [5] NIE Y, ZHAO C W, ZHOU Z Y, et al. Hydrochloric acid-modified fungi-microalgae biochar for adsorption of tetracycline hydrochloride: Performance and mechanism[J]. Bioresource Technology, 2023, 383: 129224. doi: 10.1016/j.biortech.2023.129224 [6] SHI Q Y, WANG W B, ZHANG H M, et al. Porous biochar derived from walnut shell as an efficient adsorbent for tetracycline removal[J]. Bioresource Technology, 2023, 383: 129213. doi: 10.1016/j.biortech.2023.129213 [7] PHOON B L, ONG C C, MOHAMED SAHEED M S, et al. Conventional and emerging technologies for removal of antibiotics from wastewater[J]. Journal of Hazardous Materials, 2020, 400: 122961. doi: 10.1016/j.jhazmat.2020.122961 [8] SCARIA J, ANUPAMA K V, NIDHEESH P V. Tetracyclines in the environment: An overview on the occurrence, fate, toxicity, detection, removal methods, and sludge management[J]. Science of the Total Environment, 2021, 771: 145291. doi: 10.1016/j.scitotenv.2021.145291 [9] PRIYA S S, RADHA K V. A review on the adsorption studies of tetracycline onto various types of adsorbents[J]. Chemical Engineering Communications, 2017, 204(8): 821-839. doi: 10.1080/00986445.2015.1065820 [10] 陈刚, 朱赫特, 陈浩然, 等. 镁改性水生植物生物炭吸附水中的微囊藻毒素-LR[J]. 环境化学, 2024, 43(1): 250-263. doi: 10.7524/j.issn.0254-6108.2022061602 CHEN G, ZHU H T, CHEN H R, et al. Adsorption of microcystin-LR by Mg-modified aquatic plant biochar in water[J]. Environmental Chemistry, 2024, 43(1): 250-263 (in Chinese). doi: 10.7524/j.issn.0254-6108.2022061602
[11] LU S Y, HUANG X L, TANG M H, et al. Synthesis of N-doped hierarchical porous carbon with excellent toluene adsorption properties and its activation mechanism[J]. Environmental Pollution, 2021, 284: 117113. doi: 10.1016/j.envpol.2021.117113 [12] LI H X, TANG M H, HUANG X L, et al. An efficient biochar adsorbent for CO2 capture: Combined experimental and theoretical study on the promotion mechanism of N-doping[J]. Chemical Engineering Journal, 2023, 466: 143095. doi: 10.1016/j.cej.2023.143095 [13] CHEN X, OH W D, HU Z T, et al. Enhancing sulfacetamide degradation by peroxymonosulfate activation with N-doped graphene produced through delicately-controlled nitrogen functionalization via tweaking thermal annealing processes[J]. Applied Catalysis B:Environmental, 2018, 225: 243-257. doi: 10.1016/j.apcatb.2017.11.071 [14] CHENG Y Z, WANG B Y, SHEN J M, et al. Preparation of novel N-doped biochar and its high adsorption capacity for atrazine based on π-π electron donor-acceptor interaction[J]. Journal of Hazardous Materials, 2022, 432: 128757. doi: 10.1016/j.jhazmat.2022.128757 [15] ZHAO J, DAI Y. Tetracycline adsorption mechanisms by NaOH-modified biochar derived from waste Auricularia auricula dregs [J]. Environmental Science and Pollution Research, 2022, 29(6): 9142-9152. doi: 10.1007/s11356-021-16329-5 [16] LIU H D, XU G R, LI G B. Preparation of porous biochar based on pharmaceutical sludge activated by NaOH and its application in the adsorption of tetracycline[J]. Journal of Colloid and Interface Science, 2021, 587: 271-278. doi: 10.1016/j.jcis.2020.12.014 [17] XIANG W, WAN Y S, ZHANG X Y, et al. Adsorption of tetracycline hydrochloride onto ball-milled biochar: Governing factors and mechanisms[J]. Chemosphere, 2020, 255: 127057. doi: 10.1016/j.chemosphere.2020.127057 [18] TANG M H, DENG J, LI M M, et al. 3D-interconnected hierarchical porous N-doped carbon supported ruthenium nanoparticles as an efficient catalyst for toluene and quinoline hydrogenation[J]. Green Chemistry, 2016, 18(22): 6082-6090. doi: 10.1039/C6GC01858K [19] SHENG Z H, SHAO L, CHEN J J, et al. Catalyst-free synthesis of nitrogen-doped graphene via thermal annealing graphite oxide with melamine and its excellent electrocatalysis[J]. ACS Nano, 2011, 5(6): 4350-4358. doi: 10.1021/nn103584t [20] 张婷. 基于废白土的凹凸棒土—炭复合材料的制备及其对重金属和抗生素污染吸附研究[D]. 西安: 西北大学, 2022. ZHANG T. Preparation of attapulgite-carbon composite based on spent bleaching earth and its adsorption effects on heavy metals and antibiotics[D]. Xi'an: Northwest University, 2022 (in Chinese).
[21] DING C F, LIU T Y, YAN X D, et al. An ultra-microporous carbon material boosting integrated capacitance for cellulose-based supercapacitors[J]. Nano-Micro Letters, 2020, 12(1): 63. doi: 10.1007/s40820-020-0393-7 [22] GUO B B, MA R G, LI Z C, et al. Hierarchical N-doped porous carbons for Zn-air batteries and supercapacitors[J]. Nano-Micro Letters, 2020, 12(1): 20. doi: 10.1007/s40820-019-0364-z [23] TANG M H, HUANG X L, PENG Y Q, et al. Hierarchical porous carbon as a highly efficient adsorbent for toluene and benzene[J]. Fuel, 2020, 270: 117478. doi: 10.1016/j.fuel.2020.117478 [24] CHEN W H, DU J T, LEE K T, et al. Pore volume upgrade of biochar from spent coffee grounds by sodium bicarbonate during torrefaction[J]. Chemosphere, 2021, 275: 129999. doi: 10.1016/j.chemosphere.2021.129999 [25] 张宏, 贺丹丹, 王九玲, 等. Fe/Zn改性市政污泥生物质炭对四环素的吸附性能研究[J]. 功能材料, 2022, 53(10): 10137-10145,10156. ZHANG H, HE D D, WANG J L, et al. Adsorption capacity of Fe/Zn modified municipal sludge biochar for tetracycline[J]. Journal of Functional Materials, 2022, 53(10): 10137-10145,10156 (in Chinese).
[26] NANDI B K, GOSWAMI A, PURKAIT M K. Adsorption characteristics of brilliant green dye on Kaolin[J]. Journal of Hazardous Materials, 2009, 161(1): 387-395. doi: 10.1016/j.jhazmat.2008.03.110 [27] 林冰峰, 陈志豪, 杨芳俐, 等. 锰铁氧体改性生物炭对四环素的吸附性能研究[J]. 农业环境科学学报, 2023, 42(7): 1585-1596. doi: 10.11654/jaes.2022-1222 LIN B F, CHEN Z H, YANG F L, et al. Adsorption performance of tetracycline by manganese ferrite-modified biochar[J]. Journal of Agro-Environment Science, 2023, 42(7): 1585-1596 (in Chinese). doi: 10.11654/jaes.2022-1222
[28] FOROUTAN R, PEIGHAMBARDOUST S J, LATIFI P, et al. Carbon nanotubes/β-cyclodextrin/MnFe2O4 as a magnetic nanocomposite powder for tetracycline antibiotic decontamination from different aqueous environments[J]. Journal of Environmental Chemical Engineering, 2021, 9(6): 106344. doi: 10.1016/j.jece.2021.106344 [29] DAIFULLAH A A M, GIRGIS B S, GAD H M H. A study of the factors affecting the removal of humic acid by activated carbon prepared from biomass material[J]. Colloids and Surfaces A:Physicochemical and Engineering Aspects, 2004, 235(1/2/3): 1-10. [30] 吴晨曦. 改性生物炭对水中有机物的吸附效能与机理研究[D]. 西安: 西安建筑科技大学, 2022. WU C X. Study on the efficiency and mechanism of modified biochar in adsorbing organic matter in water[D]. Xi'an: Xi'an University of Architecture and Technology, 2022 (in Chinese).
[31] TANG Y, CHEN Q M, LI W Q, et al. Engineering magnetic N-doped porous carbon with super-high ciprofloxacin adsorption capacity and wide pH adaptability[J]. Journal of Hazardous Materials, 2020, 388: 122059. doi: 10.1016/j.jhazmat.2020.122059 [32] TRAN H N, YOU S J, HOSSEINI-BANDEGHARAEI A, et al. Mistakes and inconsistencies regarding adsorption of contaminants from aqueous solutions: A critical review[J]. Water Research, 2017, 120: 88-116. doi: 10.1016/j.watres.2017.04.014 [33] EL-KHAIARY M I, MALASH G F. Common data analysis errors in batch adsorption studies[J]. Hydrometallurgy, 2011, 105(3/4): 314-320. [34] LIU W F, ZHANG J, ZHANG C L, et al. Sorption of norfloxacin by lotus stalk-based activated carbon and iron-doped activated alumina: Mechanisms, isotherms and kinetics[J]. Chemical Engineering Journal, 2011, 171(2): 431-438. doi: 10.1016/j.cej.2011.03.099 [35] CARABINEIRO S A C, THAVORN-AMORNSRI T, PEREIRA M F R, et al. Adsorption of ciprofloxacin on surface-modified carbon materials[J]. Water Research, 2011, 45(15): 4583-4591. doi: 10.1016/j.watres.2011.06.008 [36] 赵涛. 不同生物炭对水中磺胺类抗生素的吸附及机理研究[D]. 广州: 华南农业大学, 2016. ZHAO T. Absorption characteristics and mechanisms of sulfonamides in aquatic solutions by biochars derived from different biomass materials[D]. Guangzhou: South China Agricultural University, 2016 (in Chinese).
[37] TRAN H N, YOU S J, CHAO H P. Thermodynamic parameters of cadmium adsorption onto orange peel calculated from various methods: A comparison study[J]. Journal of Environmental Chemical Engineering, 2016, 4(3): 2671-2682. doi: 10.1016/j.jece.2016.05.009 [38] LI Y C, XING B, WANG X L, et al. Nitrogen-doped hierarchical porous biochar derived from corn stalks for phenol-enhanced adsorption[J]. Energy & Fuels, 2019, 33(12): 12459-12468. [39] WAN Y, HU Y, ZHOU W J. Catalytic mechanism of nitrogen-doped biochar under different pyrolysis temperatures: The crucial roles of nitrogen incorporation and carbon configuration[J]. The Science of the Total Environment, 2022, 816: 151502. doi: 10.1016/j.scitotenv.2021.151502 [40] FERRARI A C, BASKO D M. Raman spectroscopy as a versatile tool for studying the properties of graphene[J]. Nature Nanotechnology, 2013, 8(4): 235-246. doi: 10.1038/nnano.2013.46 [41] WANG H Z, GUO W Q, LIU B H, et al. Edge-nitrogenated biochar for efficient peroxydisulfate activation: An electron transfer mechanism[J]. Water Research, 2019, 160: 405-414. doi: 10.1016/j.watres.2019.05.059 [42] CHE H X, WEI G T, FAN Z D, et al. Super facile one-step synthesis of sugarcane bagasse derived N-doped porous biochar for adsorption of ciprofloxacin[J]. Journal of Environmental Management, 2023, 335: 117566. doi: 10.1016/j.jenvman.2023.117566 [43] MEI Y L, XU J, ZHANG Y, et al. Effect of Fe-N modification on the properties of biochars and their adsorption behavior on tetracycline removal from aqueous solution[J]. Bioresource Technology, 2021, 325: 124732. doi: 10.1016/j.biortech.2021.124732 [44] CAMINATI G, FOCARDI C, GABRIELLI G, et al. Spectroscopic investigation of tetracycline interaction with phospholipid Langmuir-Blodgett films[J]. Materials Science and Engineering: C, 2002, 22(2): 301-305. doi: 10.1016/S0928-4931(02)00217-5 [45] ZHANG H K, SONG X, ZHANG J, et al. Performance and mechanism of sycamore flock based biochar in removing oxytetracycline hydrochloride[J]. Bioresource Technology, 2022, 350: 126884. doi: 10.1016/j.biortech.2022.126884 [46] GUO D H, SHIBUYA R, AKIBA C, et al. Active sites of nitrogen-doped carbon materials for oxygen reduction reaction clarified using model catalysts[J]. Science, 2016, 351(6271): 361-365. doi: 10.1126/science.aad0832 [47] WEI M M, MARRAKCHI F, YUAN C, et al. Adsorption modeling, thermodynamics, and DFT simulation of tetracycline onto mesoporous and high-surface-area NaOH-activated macroalgae carbon[J]. Journal of Hazardous Materials, 2022, 425: 127887. doi: 10.1016/j.jhazmat.2021.127887 [48] WANG S, YUAN C, ZAFAR F F, et al. Facile synthesis of chlorella-derived autogenous N-doped porous biochar for adsorption on tetracycline[J]. Environmental Pollution, 2023, 330: 121717. doi: 10.1016/j.envpol.2023.121717 -






 下载:
下载: