-
零价纳米铁(NZVI)被广泛用于地下水污染物原位修复. 聚凝失稳和吸附沉降造成NZVI在地下多孔介质中迁移能力低,修复范围十分有限[1]. 通过改变材料的表面性质(如表面官能团能化、表面有机聚合物修饰)促进NZVI迁移是目前比较常见的方法[2,3]. Xu等利用羧甲基纤维素(CMC)改性NZVI后,提高分散性的同时也使得其在土壤环境中的迁移性增强[4]. Dong等发现CMC通过增加静电力和空间位阻效应提高迁移能力[5].
铁是地下水中的主要金属元素,地下含水层的砂介质表面通常覆盖着铁氧化合物,对微纳米颗粒的迁移沉降产生重要影响[1,2,6 − 9]. Zhuang和Jin[10]研究了两种噬菌体在针铁矿包裹的砂柱中的迁移,发现针铁矿的存在有利于噬菌体的附着. Wang等[11]观察到氧化铁涂层对羟基磷灰石纳米颗粒的迁移也有类似的影响. Zhang等[1]报道,在石英砂上涂覆氧化铁和氧化铝,大大增加了CNZVI在土壤中的滞留. Chen等也发现氧化铁抑制CNZVI的迁移[8].
腐殖酸(HA)由植物和动物物质分解产生的大分子组成,约占环境中所有天然有机物的60%,具有丰富的官能团. 一方面,HA可以通过增强纳米颗粒之间的静电斥力和空间位阻效应来促进胶体的迁移[12 − 15];另一方面,HA也可以使纳米颗粒之间发生桥接,导致表面改性的纳米颗粒显著聚集和沉积[16]. Liang等[17]发现HA通过减少PVP-NZVI和纯石英砂表面的黏附促进其迁移. Yang等[18]发现,在氧化铁砂作为介质情况下,HA和乳胶微球共注射可促进乳胶微球的迁移. 目前,HA与CNZVI在氧化铁砂作为介质条件下共注射对于CNZVI迁移影响的研究尚未发现.
含水层砂表面通常覆盖有铁锰等金属矿物质,提高纳米铁颗粒在该多孔介质中的迁移是目前亟待解决的问题. 结合以上研究现状,本实验围绕以下几点展开:(1)比较CNZVI在纯石英砂和氧化铁包覆砂中的迁移情况;(2)研究HA与CNZVI共注射对于其在纯石英砂和氧化铁包覆砂中迁移的影响;(3)确定HA浓度对于氧化铁包覆砂中CNZVI迁移的影响,探究影响机理.
-
CNZVI采用液相还原法制备[19 − 20]. 首先制备12.5 g·L−1CMC溶液,使用电动搅拌机持续搅拌3 h后,加入25 g·L−1的FeSO4·7H2O原液,[CMC]/[Fe2+]的物质的量比为1.54×10−3. 继续搅拌30 min后,以4 mL·min−1的速度加入硼氢化物溶液还原Fe2+,[BH4-]/[Fe2+]物质的量比为4.0. 为了保证反应完全,添加结束后继续搅拌30 min. 上述溶液均在水浴超声(昆山市超声仪器有限公司,KQ2200E)条件下,与真空泵联用进行脱气处理,反应过程中持续通氮气保护. NZVI的制备除去不加CMC外,其他步骤相同.
CNZVI的水动力粒径[21]和zeta电位利用ZetaSizer(马尔文仪器公司)测量[19]. 使用紫外分光光度计(吸收波长=508 nm)监测300 mg·L−1的CNZVI和NZVI20 min内在静置水中的沉降情况来评价其胶体稳定性[22]. 通过磁吸法从CNZVI溶液和NZVI溶液中分离出纳米颗粒,依次经过无水乙醇和超纯水洗涤后转移至培养皿内,在−80 ℃冰箱内预冻1 h后利用真空冷冻干燥机干燥并真空保存. 使用傅里叶红外光谱技术确认CMC包裹了NZVI,通过比对反应前后材料的X射线衍射图(XRD)确定产物成分;并用扫描电镜对CNZVI进行形貌分析[3].
-
柱实验背景溶液含1 mol·L−1NaCl,pH=7.6±0.1(使用Tris-HCL调节). 用背景溶液制备20、60、100 mg·L−1的HA(Sigma Aldrich公司,美国密苏里州圣路易斯)溶液,置于棕色蓝盖瓶内避光保存备用. 以上溶液在柱实验前均进行脱气处理.
-
石英砂大小在70—110目,对应粒径为0.14—0.22 mm[23]. 砂的清洗和氧化铁包裹采用前人的方法[23]. 简而言之,将干净石英砂浸泡在1.5 mol·L−1FeCl3中超声30 min,过滤掉多余的溶液后在35 ℃下风干2—3 h. 将风干后的石英砂浸泡在3 mol·L−1NH4OH中超声30 min,过滤掉多余溶液后放至烘箱,在60 ℃下干燥过夜. 用超纯水反复清洗去除多余的松散黏合涂层,直至上清液吸光度稳定后风干保存备用.
-
把300 mg·L−1的CNZVI溶液用背景溶液按1:1稀释,并添加HA溶液至20 mg·L−1,超声混合5 min,使用马尔文测定2 h内HA影响下CNZVI水动力粒径变化情况.
-
采用超声湿法在内径为1 cm的玻璃层析柱(C10/10)内填充3 cm厚的石英砂或氧化铁包覆石英砂[24],石英砂孔隙度为0.43,孔隙体积为1.01 mL. 填充完毕后以3 mL·min−1流速通背景溶液30 min以稳定系统.
在CNZVI注射过程中,持续通氮气搅拌,以避免氧气进入CNZVI溶液,并使纳米颗粒保持悬浮分散状态. 使用八通阀与蠕动泵联用进行共注射. 共注射的两种溶液流速分别为0.5 mL·min−1(总流速为1 mL·min−1,弥散系数为0.069 m2·d−1[23]),共注射10 min后,在1 mL·min−1流速下通入背景溶液10 min冲洗砂柱[25]. 在纯石英砂作为填充介质时,共注射的溶液为CNZVI和背景溶液或20 mg·L−1HA;氧化铁砂作为填充介质时,共注射的溶液为CNZVI和背景溶液或20、60、100 mg·L−1 HA,预实验结果显示HA的吸光度不到CNZVI的1%,因此HA对CNZVI在线测量的光信号干扰可以忽略不计[24]. 每个实验做3个重复以量化实验误差. 柱实验出水连接紫外流动池,用紫外分光光度计实时(10 s/次)测量508 nm下溶液吸光度变化情况,定量CNZVI流出浓度,绘制穿透曲线[18]. 通过计算CNZVI的沉积系数[19,26]和最大迁移距离[27],来判断不同条件下CNZVI的迁移能力.
基于砂柱流出的CNZVI浓度,通过公式(1)计算CNZVI的沉积系数(Kd)[28]
式中,v为液体流速,1 mL min−1;L为石英砂的填充高度,3 cm;ε为孔隙度,0.43;C/C0为初始穿透点的CNZVI浓度比值[29].
CNZVI的迁移能力可以用最大迁移距离LT来量化[27].
式中,
α 为碰撞效率. 由(2)和(3)式得(4). -
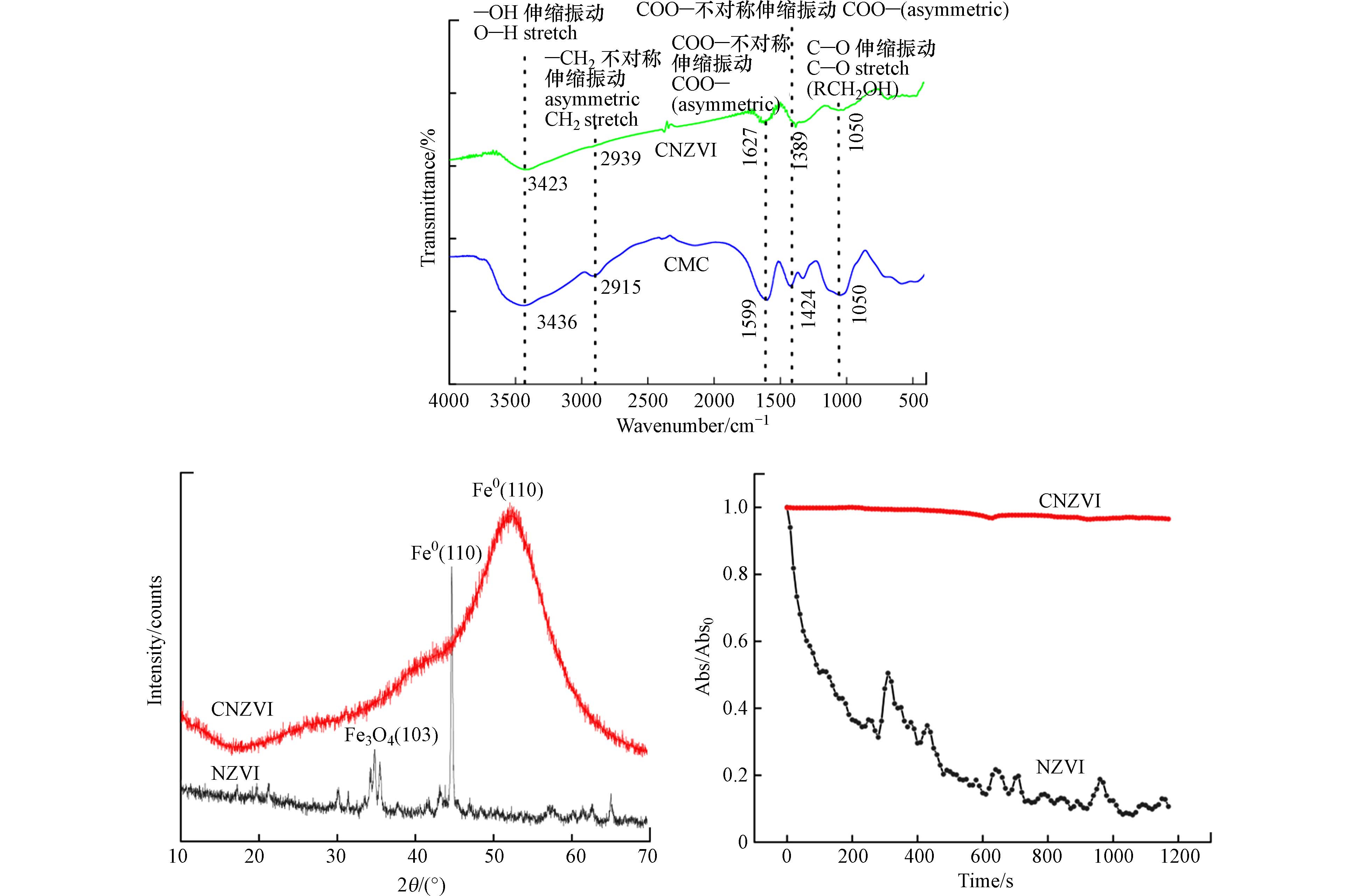
图1中上图为CNZVI的红外表征结果,根据羧基离子不对称伸缩振动波数和对称伸缩振动波数之差来判别羧基离子与金属离子之间的络合方式[30]. 二者之差为238 cm−1,在200—320 cm−1之间,因此CMC分子中的羧基离子与NZVI通过单齿配位体形式络合[20]. 羧酸基团改变了NZVI的表面性质,使其表面带有负电荷,为粒子之间提供稳定的静电斥力[31]. 图1中左图表征了NZVI和CNZVI的化学组成和矿物结构,两种材料都存在Fe(110),CNZVI的XRD中,峰Fe0对应的2θ=52.0°(卡片序号为:PDF#85-
1410 -Fe);NZVI的XRD中,峰Fe0对应的2θ=44.7°(卡片序号为:PDF#89-7194 -Fe). 这说明Fe0成功制备;NZVI表面检测到Fe3O4,表明其部分发生了氧化;CNZVI表面未检测到氧化铁,表明CMC成功包覆在CNZVI表面,且能有效阻止其发生氧化. 图1(右)为NZVI和CNZVI的沉降曲线,由图可见NZVI在0—100 s内光吸光度快速下降,而CNZVI在0—1200 s内吸光度基本稳定,这表明NZVI由于磁力和范德华力等作用发生团聚然后沉降,而CNZVI则由于表面CMC的排斥作用保证分散性减少聚凝沉降.由图2扫描电镜的结果可见,所制备CNZVI和NZVI呈单颗类球形,粒径在50—100 nm之间. 对比CNZVI和NZVI外表面,可见有明显的CMC将NZVI颗粒包覆,且包覆后的CNZVI分散性更好. CNZVI的水动力粒径稳定在(300±20)nm,zeta电位稳定在(−30±5)mV. 这是由于CMC的包覆作用,使得CNZVI表面带负电荷且性质稳定.
-
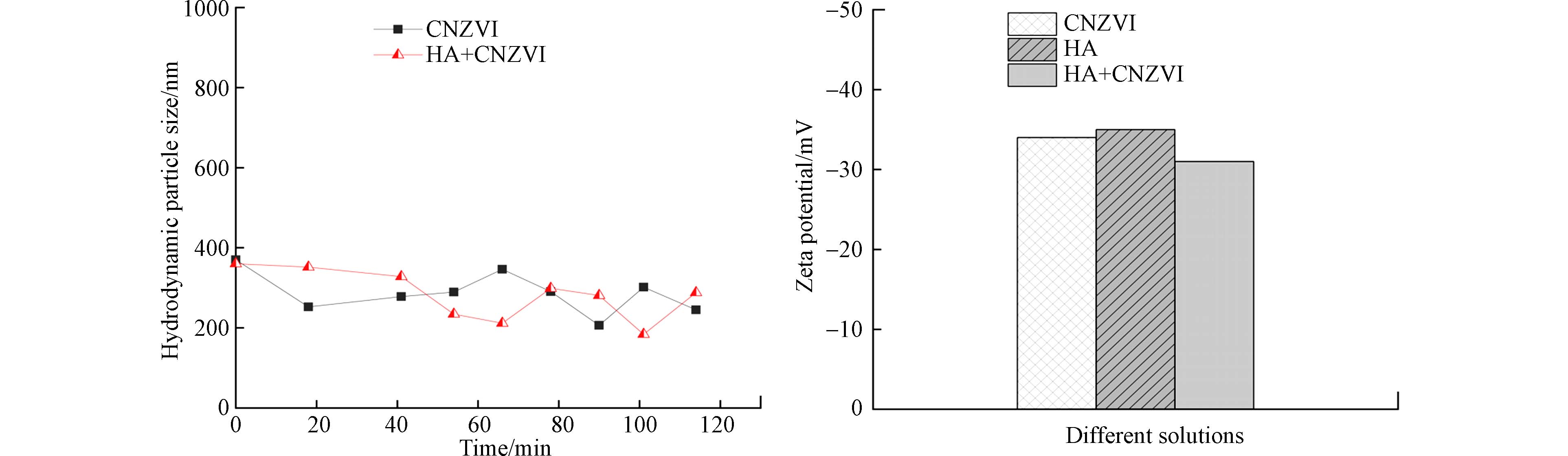
图3左图展示了CNZVI与背景溶液和HA溶液混合后粒径变化情况. 添加HA对CNZVI的粒径影响不明显,依然处于(300±20)nm范围内. 图3右图比较了HA对CNZVI电位的影响,添加HA使CNZVI的电位从−34 mV下降到−31 mV,表明HA可以吸附到CNZVI表面并降低其表面的zeta电位.
-
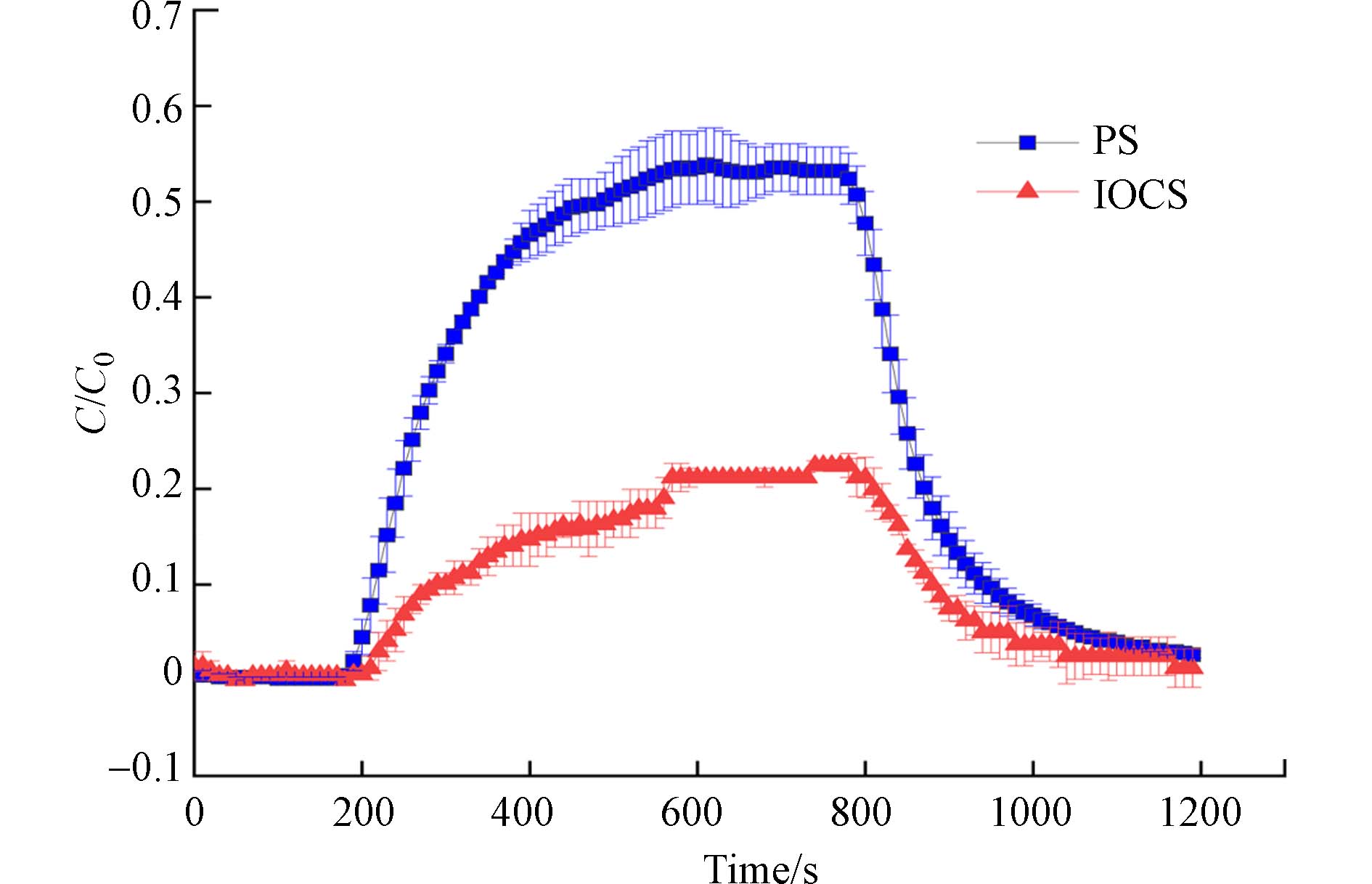
图4展示了CNZVI在纯石英砂和氧化铁包覆石英砂中的迁移突破曲线. 纯石英砂中CNZVI的最高相对出流浓度(C/C0)达到了0.55,而氧化铁包覆砂中仅为0.2,对应的沉降系数(Kd)从0.69增加到1.96,并且CNZVI在氧化铁砂中的迁移距离仅为在纯石英砂中迁移距离的32%. 表明氧化铁覆盖层能改变石英砂表面的电性,从而为CNZVI提供吸附点位. Zhang发现CMC也可作为纳米颗粒与氧化铁砂之间的桥接配体,这一机理可以解释本研究观察到的氧化铁促进CMC修饰的CNZVI沉降的现象[1]. 在纯石英砂和氧化铁包覆石英砂中CNZVI迁移的突破曲线均出现了拖尾现象,表明存在可逆吸附. 相比而言在纯石英砂中的拖尾更为明显,表明氧化铁覆盖提高了石英砂对CNZVI的吸附能力.
-
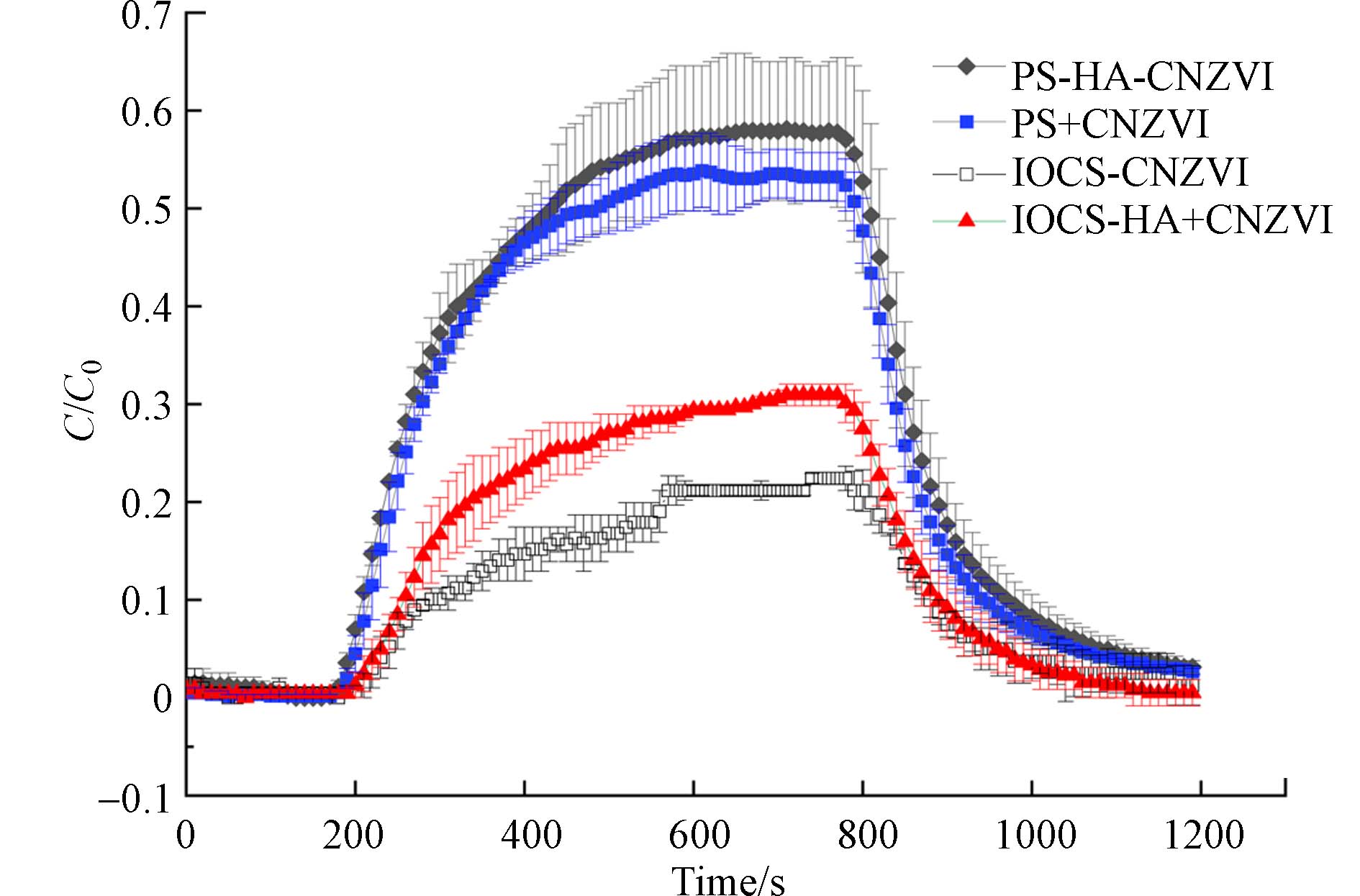
图5展示了在有或无HA作用下,CNZVI在纯石英砂和氧化铁包覆砂柱中迁移的突破曲线. 在纯石英砂中,与HA共注射使CNZVI的最高C/C0增加了5%(0.55—0.58),迁移距离是无HA条件下的1.1倍. 在氧化铁砂中,与HA共注射使CNZVI的最高C/C0增加了50%(0.2—0.3),迁移距离是无HA条件下的1.6倍.
CNZVI与HA混合后,电位变化不大(−34—−31 mV). 由图3可知,混合后0—120 min内,CNZVI的粒径也变化不大. 这表明HA虽然能在CNZVI表面发生吸附,但对其表面吸附性能的影响不显著. 因此,HA促进CNZVI的迁移可以归因于HA通过与CNZVI竞争在砂粒表面的沉积位点,通过静电斥力和空间位阻促进CNZVI的迁移[12,23]. 在纯石英砂中,HA与石英砂之间的负电排斥阻止了HA的竞争性沉降和对石英砂表面沉积点位的占据,HA促进CNZVI迁移能力并不明显.
-
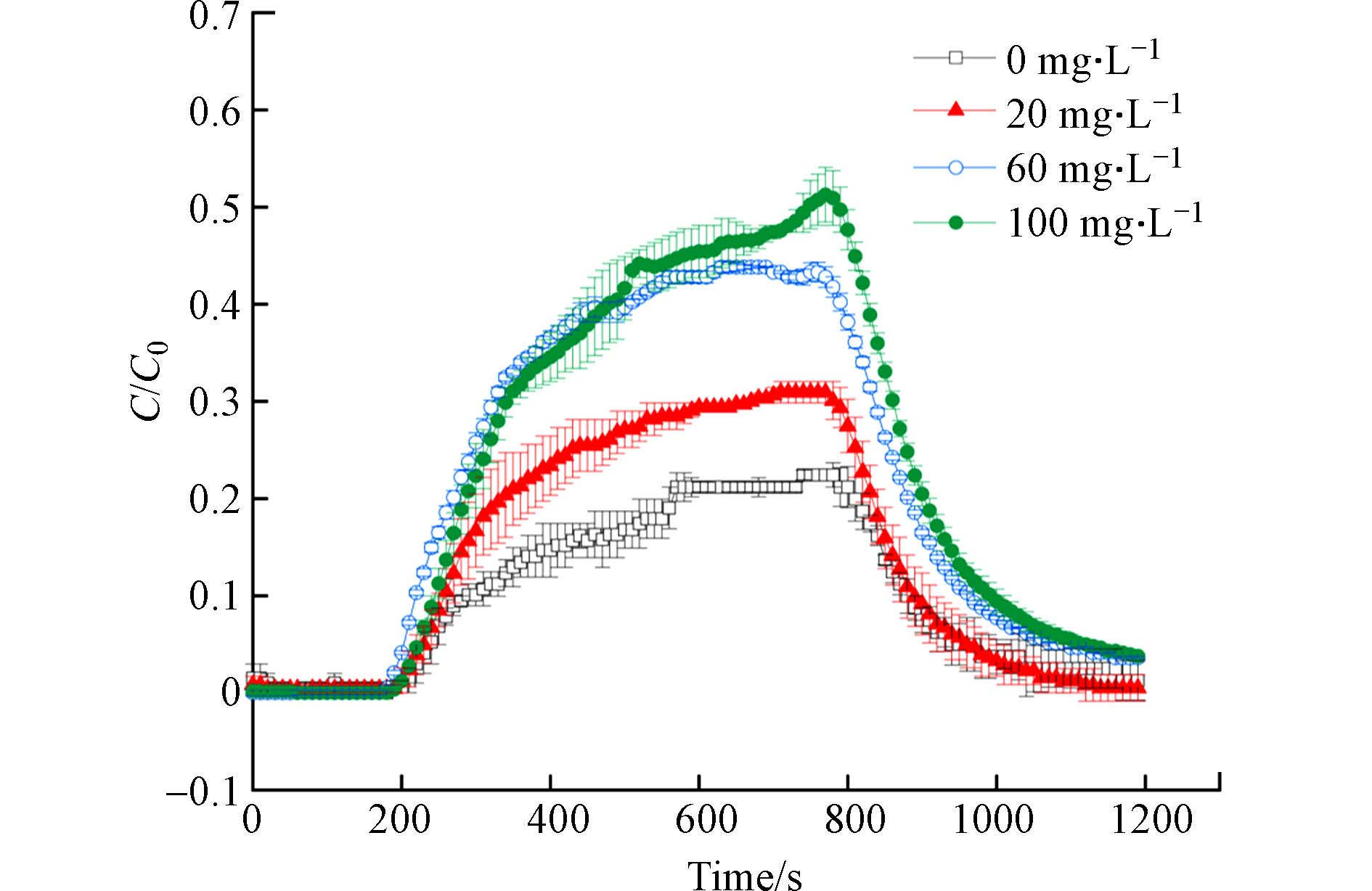
图6为HA对CNZVI迁移的影响的浓度效应. CNZVI的最高相对出流浓度和迁移距离均随HA浓度升高而升高:当HA浓度从0 mg·L−1升高至20 mg·L−1时,C/C0(0.2—0.3)和LT均显著提高了50%;从20 mg·L−1升高至60 mg·L−1时,C/C0显著提高了50%(0.3—0.45),LT提高了40%;从60—100 mg·L−1,C/C0平稳提高了11%(0.45—0.5),LT提高了2%. 表1列出了不同浓度HA影响下CNZVI在氧化铁砂表面的沉积系数,在0—60 mg·L−1的范围内,沉积系数下降了55%,而在60—100 mg·L−1,沉积系数下降了3%.
HA促进CNZVI迁移的能力随着HA浓度的提高而提高,并且在低浓度时更加明显. 在浓度达到60 mg·L−1后,HA的影响变小. 这表明HA占据氧化铁砂表面沉积位点的能力是有限的,这与Liang[17]对HA促进PVP—NZVI迁移的研究结果一致.
-
CNZVI是目前广泛应用的纳米修复剂,提高其迁移能力将有效扩大其修复区域,有助于其在污染场地修复中的推广应用. 天然地下含水层砂介质表面通常覆盖有铁锰氧化物,本文发现氧化铁覆盖使砂粒表面呈正电或者弱负电,提供了更多的沉积位点,导致CNZVI的低迁移能力. 对于这类多孔介质,本研究结果显示可以通过同步注射HA来促进CNZVI的迁移,HA通过与CNZVI之间的竞争吸附、静电斥力和空间位阻抑制CNZVI的沉积,促进其迁移. 且在一定浓度范围内其促进效果随HA浓度增加而提高. 该发现对于改善CNZVI在天然多孔介质中的迁移,提高其在土壤与地下水修复中的应用具有积极意义.
腐殖酸可提高羧甲基纤维素钠改性的零价纳米铁在氧化铁包覆石英砂中的迁移
Humic acid could enhance the transport of CMC modified nano zero-valent iron in iron oxide-coated quartz sand
-
摘要: 零价纳米铁(NZVI)作为在污染场地修复中广泛使用的纳米修复剂,其迁移能力低是制约修复效率的瓶颈. 本文利用羧甲基纤维素钠(CMC-Na)对NZVI进行改性得到CNZVI. 基于柱实验,研究了在纯石英砂(PS)和氧化铁包覆石英砂(IOPS)介质中,腐殖酸(HA)与CNZVI共注射对于提高CNZVI迁移能力的效果. 研究结果表明,氧化铁涂层通过改变砂粒表面电性增加CNZVI在砂粒表面的沉积位点,抑制其迁移. HA与CNZVI共注射之后,与其竞争在氧化铁砂表面的沉积位点,并且通过静电斥力和空间位阻抑制CNZVI在砂粒表面沉积,从而能有效提高CNZVI的迁移能力. HA浓度在0 mg·L−1到60 mg·L−1范围内,CNZVI迁移能力随着HA浓度的提高而显著提高. 反之,在纯石英砂介质中,HA对于CNZVI的迁移未产生显著影响,可能是因为纯石英砂与HA之间的负电排斥阻止了HA的竞争性沉降和对石英砂表面沉积点位的占据. 本研究结果表明,HA对于CNZVI迁移的提升效果受多孔介质表面物理化学性质的影响,在富含氧化铁的含水层中能更好地促进CNZVI的迁移.
-
关键词:
- 零价纳米铁(NZVI) /
- 氧化铁砂 /
- 腐殖酸 /
- 迁移
Abstract: Low mobility of nano zero-valent iron (NZVI) is a bottleneck restricting the application of NZVI, one of the most used nano-materials for environmental remediation. In this paper, NZVI was modified with sodium carboxymethyl cellulose (CMC-Na), and co-delivered with humic acid (HA) to explore the HA effect on promoting NZVI mobility in pure quartz sand (PS) and iron oxide-coated quartz sand (IOPS). The results showed that the iron oxide coating increased the deposition sites of CNZVI on the sand surface and lowered its mobility. The co-injected HA could promote CNZVI mobility via site competition and site blocking mechanisms in IOPS. The promoting effect increased with HA levels over the range of 0 to 60 mg-L−1 HA. Conversely, HA had insignificant effect on the CNZVI in PS, probably because the negative electric repulsion operating at the PS-HA interface prevented HA adsorption on the sand and the subsequent site blocking effect. These findings imply that the mobility promoting effect of HA relies on the physicochemical properties of the porous media surface, and HA could be a useful additive to promote CNZVI mobility in iron oxide-coated aquifer.-
Key words:
- nano zero-valent iron (NZVI) /
- iron oxide sand /
- humic acid /
- transport.
-
稀土元素 (REEs) 由于其特殊的物理和化学性质,过去的几十年中在地球化学、农业、冶金、电子、激光、核工业和超导体领域中的广泛使用[1-4]. 近年来REEs在越来越多的环境基质中被检测到[5-6]. 据报道,土壤中的REEs含量为 30.8—327.5 ng·kg−1,地表水中的REEs含量为0.17—160.06 μg·L−1 [7-12]. 沉积物和生物体中的REEs分别为 0.0002—9850 mg·kg−1 和 1.95—7.05 mg·kg−1 dw(干重)[13]. 有研究表明,环境基质中的REEs可以通过食物链进入人体[14-15],产生潜在的健康风险. 中国拥有全球最丰富的 REEs 资源,占全球97%的 REEs 供应量[16-17],这可能会导致中国与其他国家相比具有更高的 REEs 污染水平和潜在风险. 因此,研究中国稀土元素膳食暴露特征具有重要意义和代表性.
REEs的广泛使用不仅会污染环境,而且会在生物体积累. 已有毒理学研究表明REEs主要的靶器官包括脑、肝、肾、甲状腺和甲状旁腺[8]. 据报道,脑中高浓度的 Gd会引起神经毒性[18],其他REEs还会降低大脑的智力水平,最终导致记忆力减退[19]. 此外,REEs 还可以在人体骨骼中积累并最终导致基因毒性[20]. REEs还可以穿过胎盘和血脑屏障,进而在胎儿体内蓄积,从而导致出生缺陷[21]. 已有研究表明在有神经管缺陷的新生儿中发现的 Ce 和 La 的累积水平更高[22]. 在中国矿区,居民血液中REEs含量和当地土壤中 REEs浓度显著相关[23],表明在受污染的土壤中生长的植物能够积累REEs,REEs进一步通过食物网进入人体.
目前,国内对稀土元素的研究大多集中在矿区土壤、饮用水和农作物中[24-26]. 据报道,中国最大的重稀土生产区江西赣州,其尾矿土壤的稀土元素水平高达 3179 mg·kg−1 [27],溪水高达 4.46 mg·L−1,农田土壤高达 928 mg·kg−1 [28]. 在中国最大的轻稀土产区包头市,其水体和底泥中的稀土总浓度分别为3.8 mg·L−1和30461 mg·kg−1,远高于华北地区河流的平均值[21]. 此外,矿区蔬菜中的REEs含量为 1.24–2.03 mg·kg−1 [29-31]. 但是与居民健康直接相关的市售食品中稀土元素含量的研究较少. 对中国个别城市食品中稀土元素的调查表明,非矿区蔬菜中的REEs含量为 0.37—1162 μg·kg−1 [32-33].
本研究采集大型农贸市场、超市中具有代表性和适时性的常见蔬菜食品,调查了中国沿海地区日常食用蔬菜中REEs的残留水平和分布特征. 研究成果将有助于了解中国沿海地区居民通过蔬菜摄入REEs的含量,评估人类和生态系统面临的健康风险. 将获得的数据与全国各地其他研究的结果进行比较,也将有助于研究所调查环境中REEs随时间和地点的变化趋势.
1. 材料与方法(Materials and methods)
1.1 仪器与试剂
本实验所用到的高通量微波消解仪(MASTER40)及配套的微机控温加热板(ECH-20)购自上海新仪微波化学科技有限公司,电感耦合等离子体质谱仪(8900 Triple Quadrupole ICP-MS)购自安捷伦科技公司. 本实验用水为Millipore 净水系统 (Millipore D 24 UV)制备的超纯水. 优级纯硝酸(≥65%)和过氧化氢(30%)分别购自CNW(德国)和国药集团化学试剂有限公司. 三文鱼认证标准物质(GBW10210)购自坛墨质检. 此外,含有16种稀土元素的混合标准溶液购自安捷伦科技有限公司(Agilent ICP-MS-CAL-1-1).
1.2 样品采集
采样点位置如图1所示. 采样点的详细信息参考先前的研究[34]. 2018年4—9月,在我国沿海地区主要城市(大连、营口、秦皇岛、天津、青岛、苏州、舟山、上海、福州、泉州和广州)的超市和零售店,根据随机抽样原则采集本地出产且居民当季常食用的蔬菜类共105份,其中北方沿海地区47份,南方沿海地区58份,不同类别的蔬菜样本量如表1 所示. 采集的蔬菜覆盖居民经常食用的叶类蔬菜、根茎类蔬菜、瓜果类蔬菜、豆类蔬菜以及食用菌5大类. 采集的样品用聚乙烯真空袋包装,并立即用低温冰盒运输至实验室,并保存在–20 ℃冰箱直至进一步分析.
表 1 不同类别蔬菜品种及样本量Table 1. Sample species and sizes of different types of vegetables样品类别Sample 蔬菜品种及采样量Vegetables categories and sample volume 采集地点Sampling location 叶类蔬菜Leafy vegetables 菠菜Spinacia oleracea L.(3)、上海青Brassica chinensis L.(8)、卷心菜Brassica oleracea L.(4)、生菜Lactuca sativa var. ramosa Hort.(3)、娃娃菜Brassica campestris L.(3)、白菜Brassica pekinensis (Lour. ) Rupr.(1)、红苋菜Amaranthus mangostanus L.(2)、油麦菜Lactuca sativa var. longifoliaf. Lam(2)、芥菜Brassica juncea(1)和菜心Brassica campestris L. ssp. chinensis var.utilis Tsen et Lee(1) 大连、营口、青岛、苏州、上海、舟山、福州、广州 根茎类蔬菜Root stem vegetables 胡萝卜Daucus carota var. sativa Hoffm.(3)、洋葱Allium cepa L.(5)、白萝卜Raphanus sativus(4)、蒜薹Allium sativum L.(2)、山药Dioscoreae Rhizoma(1)、大蒜Allium sativum L.(1)、大葱Allium. fistulosum L.var.gigantum Makino(1)、藕Nelumbo nucifera Gaertn(1)、芹菜Apium graveolens L.(1)和毛茭白Zizania latifolia (Griseb. ) Stapf(1) 大连、营口、天津、青岛、苏州、上海、舟山 瓜果类蔬菜Melon vegetables 西红柿Lycopersicon esculentum(6)、茄子Solanum melongena L.(7)、黄瓜Cucumis sativus L.(6)、丝瓜Luffa aegyptiaca Miller(2)、甜椒Capsicum frutescens L. (syn. C. annuum L. )var. grossum Bailey.(4)、冬瓜Benincasa hispida (Thunb. ) Cogn.(1)、尖椒Capsicum frutescens L.(1)、西葫芦Cucurbita pepo L.(2)、苦瓜Momordica charantia L.(1)、秋葵Abelmoschus esculentus (L. ) Moench(1)和西蓝花Brassica oleracea var. italica Plenck(1) 大连、天津、青岛、苏州、上海、舟山、福州、广州 豆类蔬菜Legume vegetables 芸豆Phaseolus vulgaris(5)、扁豆Lablab purpureus (Linn. ) Sweet(1)、荷兰豆Pisum sativum L.(2)、豇豆Vigna unguiculata (Linn.) Walp.(2)、甜豌豆Lathyrus odoratus(1)、油豆角Phaseolus vulgaris Linn.(1) 营口、秦皇岛、天津、青岛、上海、舟山、泉州 食用菌Fungi vegetables 香菇Lentinula edodes(5)、花菇Lentinus edodes (Berk.)Sing(1)、杏鲍菇Pleurotus eryngii Quel.(3)、鸡腿菇Copyinds comatus (MUII. Fr)Gray(1)、口蘑Tricholoma gambosum(1)、金针菇F. velutipes(1)和白玉菇Hypsizygus marmoreus (Peck) H.E.Bigelow(1) 营口、秦皇岛、青岛、苏州、上海、舟山、泉州 1.3 样品处理与仪器分析
采集的蔬菜样品丢弃不可食用部分后,先用自来水冲洗以去除表面黏附的泥土,再用超纯水冲洗. 然后按食品类别将同一采样区域的每个样品中可食用部分混合制备同类蔬菜的混合样品,所有混合样品匀浆后冷冻干燥,共获得10个混合蔬菜样品.
蔬菜样品采用微波消解法进行前处理,步骤如下:取冻干后的蔬菜样品约 0.3 g(精度为 0.001 g)于聚四氟乙烯消解罐中. 先加入 8 mL HNO3进行预消解,预消解完成后在缓慢加入 2 mL H2O2,加盖密封后置于微波消解仪中进行消解. 微波消解程序如下:先在 10 min内将温度加热到 150 ℃,然后升至 180 ℃并保持 20 min. 消解完成后,将消解罐直接移到加热板上,在100 ℃下赶酸. 赶酸结束后,将消解液转移到容量瓶中,用超纯水洗涤消解罐3—4次,洗涤液一并移入容量瓶中,用超纯水稀释至 25 mL. 最后,用 0.45 µm 尼龙膜过滤,4 ℃保存用于仪器分析. 在每批消解样品的同时跟平行对照和空白对照. 稀土元素采用电感耦合等离子体质谱仪测定,测定结果以干重为单位,数据处理时除以相应的干重占比以转化为鲜重时的浓度.
1.4 质量保证与质量控制
消解罐在实验前一天于浓度为22%的硝酸中浸泡一夜,再用超纯水冲洗晾干后用于样品消解,实验所用到的玻璃和聚四氟器皿均采用该方法清洗. 此外,通过测定平行样品、空白样品以及菠菜标准物质(GBW10015a)进行实验内部质量控制. 待测元素的标准曲线范围为0.01—10 μg·L−1,标准曲线中各元素的相关系数均大于0.9998. 本次实验菠菜标准物质中稀土元素的回收率为85.4% —108.2%. 样品空白连续测定6次,计算其3倍标准偏差得到方法检出限(LOD). Y、La、Ce、Pr、Nd、Sm、Eu、Gd、Tb、Dy、Ho、Er和Yb的LOD分别为0.0019、0.0007、0.0016、0.0020、0.0017、0.0010、0.0015、0.0015、0.0010、0.0015、0.0009、0.0012、0.0019 μg·kg−1. 当检测元素的浓度低于 LOD(精确到±0.001 μg·kg−1)时,使用 LOD 的一半进行计算. 当某元素在所有样品中的检出率小于50%时,该元素视为未检出,不参与计算.
1.5 健康风险评价
蔬菜中的REEs主要经饮食摄入,本研究采用美国环保局推荐的健康风险评估方法US EPA(1989) [35]对蔬菜中REEs经饮食摄入对人体可能造成的健康风险进行评价. 并根据公式(1)计算其每日允许摄入量(EDI).
EDI=Cn×CRBW (1) 式中,EDI为稀土元素日摄入量,单位为μg·(kg·d)−1;Cn蔬菜样品中可食部分中稀土元素的含量,单位为μg·kg−1 fw;CR为蔬菜日消耗量,单位kg·d−1,根据国家统计局2021年公布的数据,对于北方沿海地区居民,CR取304 g·d−1,对于南方沿海地区居民,CR取279 g·d−1;BW为成年人平均体重,本研究中BW取标准体重60 kg.
2. 结果与讨论(Results and discussion)
2.1 蔬菜样品中稀土元素的分馏模式
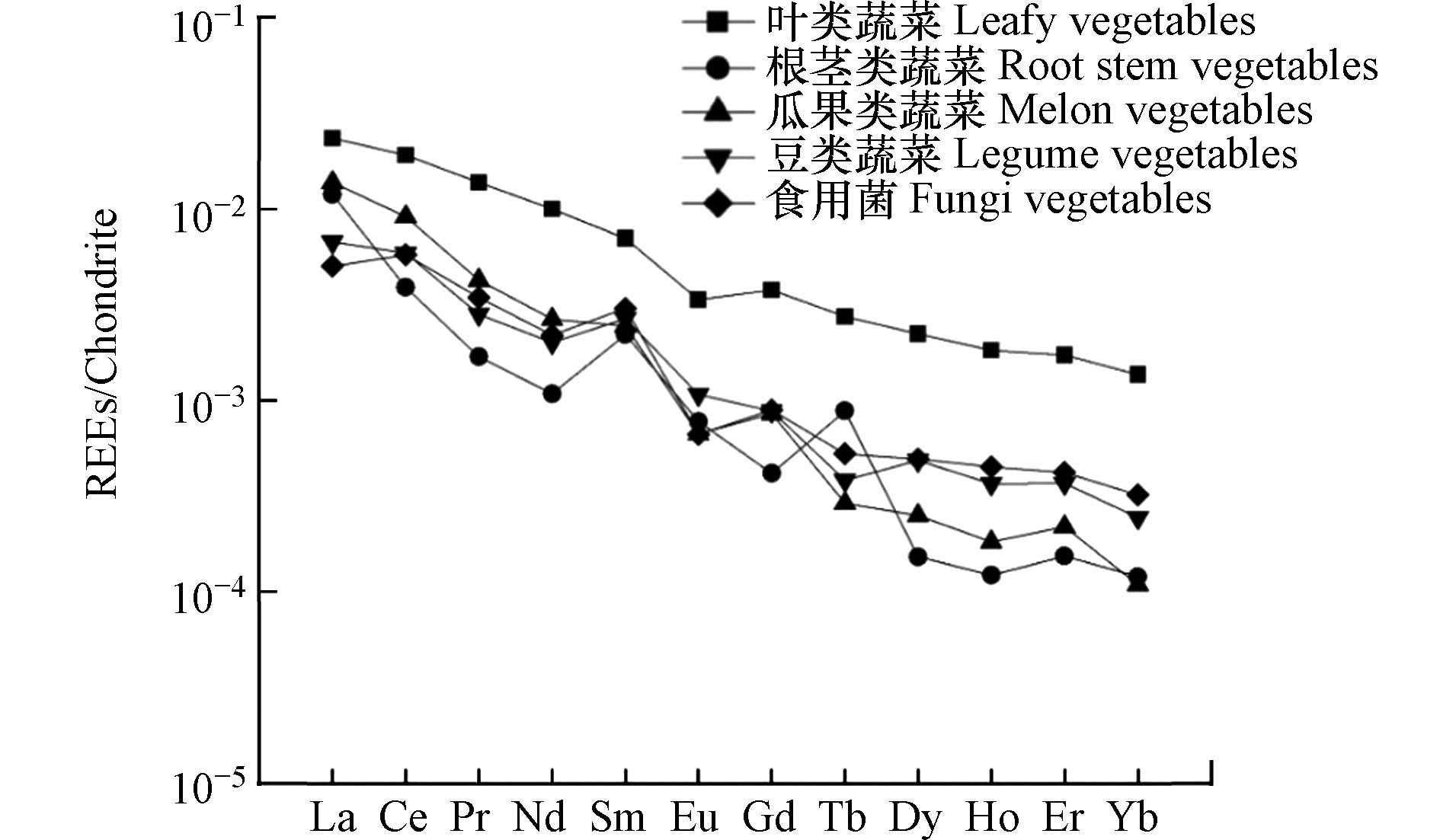
采用球粒陨石模型对不同种类蔬菜样品中REEs的浓度进行标准化,以获得我国东部沿海地区蔬菜样品中稀土元素的分馏模式,如图2所示. 从总体上看,5种蔬菜样品中REEs的分馏模式一致(均向右倾斜),表明不同蔬菜样品中REEs具有相似的分馏特征. 其中,LREEs(La to Eu)所在的曲线部分较陡,HREEs(Gd to Yb)所在的曲线部分较为平缓,表明LREEs和HREEs之间存在明显的分异. 我国沿海地区蔬菜样品中LREEs和HREEs的分布特征见表2. 具体来看,5种蔬菜样品中LREEs和HREEs含量的平均值分别为14.4 μg·kg−1 fw和2.2 μg·kg−1 fw,表明蔬菜样品中LREEs占比极大. 此外,沿海地区的LREE/HREE值在根茎类蔬菜和瓜果类蔬菜中具有显著不同,南方沿海地区的LREE/HREE值约为北方沿海地区的2倍.
表 2 我国沿海地区蔬菜样品中轻稀土元素和重稀土元素含量Table 2. Contents of LREEs and HREEs in vegetable samples from coastal areas of China样品名称Samples ΣREE/(μg·kg−1 fw) LREEs HREEs LREE/HREE 北方沿海 叶类蔬菜 55.16 45.84 9.32 4.92 根茎类蔬菜 6.50 5.87 0.63 9.35 瓜果类蔬菜 2.72 2.36 0.36 6.53 豆类蔬菜 4.41 3.79 0.63 6.03 食用菌 13.84 12.10 1.74 6.97 南方沿海 叶类蔬菜 21.69 18.15 3.54 5.12 根茎类蔬菜 11.14 10.60 0.54 19.71 瓜果类蔬菜 28.28 26.28 2.00 13.13 豆类蔬菜 16.67 14.25 2.42 5.89 食用菌 5.88 5.11 0.76 6.69 据王祖伟等[36]的研究报道,我国土壤中LREE/HREE值大于6,表明土壤对LREEs的富集能力更强. 蔬菜样品中LREE/HREE的平均值为8.43,并且具有与土壤中REEs一致的分馏规律,表明蔬菜样品中REEs累积水平很可能受生长地土壤环境的影响. 我国沿海地区的LREE/HREE值在根茎类蔬菜和瓜果类蔬菜中具有显著不同,可能是由于我国南方和北方耕作制度与土壤性质有明显差异所导致的,南北方气候的差异导致北方沿海地区种植的作物大多为一年一熟,而南方沿海地区种植的作物大多为一年二至三熟. 长期耕种,导致土壤酸化,使得土壤中大量REEs由不可利用态转化为可利用态,进而被农作物吸收,可能是造成该现象的主要原因.
2.2 不同种类蔬菜中稀土元素含量
本研究对蔬菜样品中15种稀土元素进行了检测,其中Tm和Lu在所测蔬菜水果中未检出,因此在实验数据中未列出. 不同种类蔬菜中稀土元素的含量如图3所示,北方沿海地区(ΣREE 为16.53 μg·kg−1 fw)与南方沿海地区(ΣREE 为16.73 μg·kg−1 fw)5种蔬菜样品中稀土元素残留水平相当. 其中,北方沿海地区叶类蔬菜REEs水平最高(ΣREE为55.16 μg·kg−1 fw),南方沿海瓜类蔬菜REEs最高(ΣREE为28.28 μg·kg−1 fw). 北方沿海地区出产蔬菜中稀土元素含量由高至低依次为叶类蔬菜>食用菌>根茎类蔬菜>豆类蔬菜>瓜果类蔬菜,南方沿海地区出产蔬菜中稀土元素含量由高至低依次为瓜果类蔬菜>叶类蔬菜>豆类蔬菜>根茎类蔬菜>食用菌. 此外,从表2所列的数据可以计算出2018年我国沿海地区出产蔬菜中稀土元素含量范围为2.72—55.16 μg·kg−1 fw,平均含量为 16.63 μg·kg−1 fw,整体处于较低水平. 其中叶菜类的稀土元素平均含量最高,为38.43 μg·kg−1 fw,其次是瓜果类蔬菜(15.50 μg·kg−1 fw)、豆类蔬菜(10.54 μg·kg−1 fw)和食用菌(9.86 μg·kg−1 fw),含量最低的是根茎类蔬菜(8.82 μg·kg−1 fw).
与2014第四次中国总膳食研究[37]的结果相比(蔬菜中稀土元素平均值为45.8 μg·kg−1 fw),表明REEs在蔬菜样品中的残留水平呈减少趋势. 与近年来已有研究报道的蔬菜中稀土元素水平相比,本研究所测的稀土元素水平低于福州市[32](141 μg·kg−1 fw)、包头市[29](390 μg·kg−1 fw)和自贡市(37 μg·kg−1 fw)[33]当地出产蔬菜中稀土元素的水平,也低于我国在2009-2010年开展的四省两市蔬菜样品中稀土含量水平(稀土元素均值为280 μg·kg−1 fw)[38],表明我国沿海地区食品中稀土含量水平相对比较低. 此外,将本次测得稀土元素水平与稀土矿区附近相比较,发现本研究所测的稀土元素水平也明显低于鄂西北地区[30](100 μg·kg−1 fw、赣南地区[31](843 μg·kg−1 fw)、山东地区[39](1555 μg·kg−1 fw)和江西[40]等地(3007 μg·kg−1 fw). 矿区土壤中稀土元素含量较高可能是导致该区蔬菜中稀土元素含量高的原因之一.
5种蔬菜对稀土元素的富集程度差异较大,这与蔬菜的生长环境以及自身对环境中稀土元素的吸收转运能力有关. 叶类蔬菜中稀土元素含量最高可能是由于其对稀土元素有与重金属相似的富集作用[39],即通过地下部分从土壤中吸收稀土元素以及地上部分从空气颗粒物中吸附稀土元素. 另外,叶类蔬菜同其他种类蔬菜相比具有更大的比表面积,稀土微肥的大量喷洒使用,使其更容易吸收更多的微肥而使得REEs含量增高. 根茎类蔬菜同其他种类蔬菜相比具有更大的地下面积有利于其从土壤中吸收稀土元素,但其稀土元素的含量最低,说明从土壤中吸收并转运稀土元素并非蔬菜样品中稀土元素的主要来源.
2.3 蔬菜样品中稀土元素的分布特征
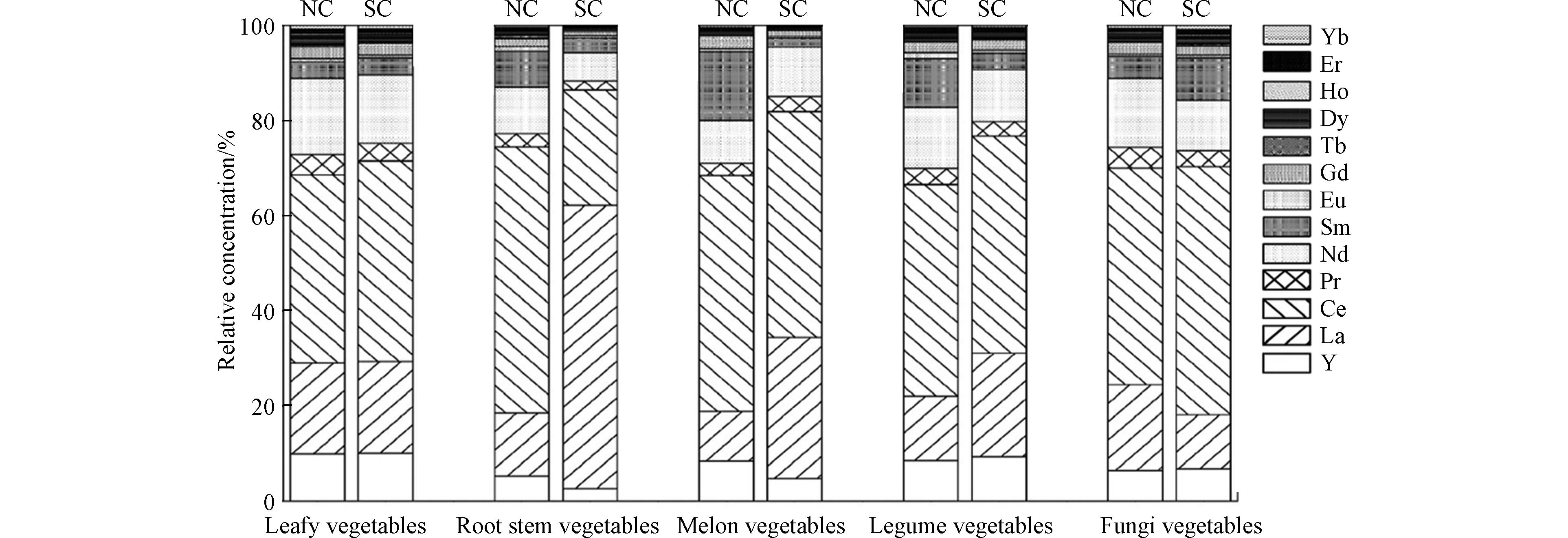
蔬菜样品中稀土元素的分布特征如图4所示,尽管沿海地区蔬菜样品中轻稀土元素均占主要比例(北方:86.68%,南方:88.85%),但是北方沿海地区和南方沿海地区不同蔬菜样品中LREEs与HREEs的分布模式差异较大,其中北方沿海地区叶类蔬菜中轻稀土和重稀土含量均具有较高水平,而南方沿海地区轻稀土含量最高的蔬菜是瓜果类蔬菜,重稀土含量最高的蔬菜是叶类蔬菜. 由图5可知,LREEs中含量最高的元素为Ce,占稀土元素构成的51.09%;其次是La,所占比例为24.24%,2者占稀土元素的比例为75.33%. 总体上看,叶类蔬菜和食用菌的稀土元素分布模式南北方差异较小,瓜果类蔬菜和豆类蔬菜的稀土元素分布模式南北方差异也较小,而根茎类蔬菜南北差异较大.
根据魏复盛等[41]对中国土壤中15种稀土元素含量的报道,全国土壤中稀土元素的累积水平ΣREE为179.1 mg·kg−1,其中La的含量为37.4 mg·kg−1,Ce的含量为64.7 mg·kg−1,La和Ce累计占ΣREE的57%以上. 蔬菜样品中稀土元素的分布特征与我国土壤的稀土构成基本一致,表明稀土元素特别是轻稀土更容易通过生物作用而富集在蔬菜等农作物体内,从而造成La和Ce在蔬菜样品中含量远高于其他元素. 从蔬菜样品的稀土元素构成中可以明显看出我国沿海地区LREEs水平显著高于HREEs,可能是由于LREEs是稀土农用的常用元素,使得更多的LREEs通过人为的方式进入到环境中,从而参与到蔬菜对稀土元素的吸收转运过程. 此外,相关性分析结果显示食品中轻、重稀土元素之间均具有正相关性(r=0.93),说明轻、重稀土元素之间具有协同促进的作用. 不同类别蔬菜中金属的累积分布特征存在明显差异,这可能与蔬菜本身特点及生长环境相关.
2.4 膳食暴露量评估
基于蔬菜中稀土元素的残留水平计算了我国沿海地区居民膳食暴露量,如表3所示. 东部沿海地区居民每日通过食用蔬菜摄入稀土的平均含量为0.41 μg·(kg·d)−1,其中北方沿海日均摄入稀土元素的总量为0.42 μg·(kg·d)−1,南方沿海每日平均摄入稀土元素的总量为0.39 μg·(kg·d)−1. 叶类蔬菜对稀土膳食贡献率最大,其次是瓜果类蔬菜,这两者膳食贡献率超过了65.08%,根茎类蔬菜的膳食贡献率很小,仅占10.49%. 北方沿海地区15种稀土元素每日摄入量的范围为0.001—0.178 μg·(kg·d)−1;南方沿海地区5种蔬菜样品的稀土元素日摄入稀土元素的范围为0.001—0.167 μg·(kg·d)−1;其中,Ce的摄入量最大,在北方和南方沿海地区,分别为0.178 μg·(kg·d)−1和0.167 μg·(kg·d)−1;其次是La,分别为0.075 μg·(kg·d)−1和0.109 μg·(kg·d)−1. 其他元素的日均摄入量相对较低. 已有研究表明居民稀土元素摄入70 μg·(kg·d)−1为安全剂量,亚临床损害剂量的临界值为100—110 μg·(kg·d)−1[42]. 我国沿海地区居民每日平均摄入稀土元素的总量为0.41 μg·(kg·d)−1,远低于不安全剂量和亚临床损害剂量. 与周新等[30](7.54 μg·(kg·d)−1)、袁丽娟等[31](10.36 μg·(kg·d)−1)对矿区的研究结果相比,也显著低于矿区稀土元素的EDI值,矿区因开采矿物带来的稀土元素的摄入风险较高.
表 3 我国东部沿海地区蔬菜中稀土元素水平以及日摄入值估算(EDI)Table 3. EDI contribution in vegetable samples from coastal areas of China元素Elements 浓度范围/(μg·kg−1 fw)Concentration range 平均浓度/(μg·kg−1 fw)Average concentration EDI(以体重计)/(μg·(kg·d)−1) 北方沿海 南方沿海 YLaCePrNdSmEuGdTbDyHoErYb 0.23—5.440.28—10.551.35—21.860.07—2.340.25—8.820.35—1.920.02—0.370.07—1.420.00—0.200.02—1.100.00—0.190.02—0.540.01—0.42 1.30±1.63.83±3.67.10±6.40.60±0.72.14±2.60.67±0.50.09±0.10.35±0.40.05±0.10.24±0.30.04±0.10.12±0.20.09±0.1 0.037 0.075 0.178 0.017 0.062 0.020 0.003 0.010 0.001 0.008 0.001 0.004 0.003 0.027 0.109 0.167 0.012 0.043 0.013 0.002 0.007 0.001 0.004 0.001 0.002 0.002 ∑REE 2.72—55.16 16.63±15.8 0.42 0.39 我国沿海地区五大类蔬菜食品中稀土元素含量水平低于我国其他地区,居民每日通过蔬菜摄入稀土元素的平均值远低于稀土元素摄入的安全剂量,表明正常饮食情况下居民通过食物摄入的稀土量是安全的,但对于食物高消费人群,低耐受的儿童群体等通过饮食的稀土摄入情况还需要进一步的研究. 稀土的暴露途径除了食品以外还有水、环境等,因而我国沿海地区居民的稀土摄入是否安全还需结合水、环境等的污染情况做出综合评价.
3. 结论(Conclusion)
我国沿海地区5种蔬菜样品中REEs的分馏模式一致,并与土壤中稀土元素的分馏模式相似,表明不同蔬菜样品中REEs具有相似的分馏特征,且很可能受生长地土壤环境的影响. 蔬菜样品中LREEs和HREEs含量的平均值分别为14.44 μg·kg−1 fw和2.19 μg·kg−1 fw,表明LREEs占总稀土元素含量的比重极大. 此外,不同种类的蔬菜对稀土元素的富集程度呈现较大差异,其中叶类蔬菜对稀土元素的富集最为显著,提示人们需加强对叶类蔬菜中稀土元素污染水平进行监测并对稀土微肥的使用进行管控. 基于蔬菜中稀土元素的残留水平计算的我国沿海地区居民膳食暴露量显示,东部沿海地区居民每日通过食用蔬菜摄入稀土的平均含量远低于不安全剂量和亚临床损害剂量,表明中国东部沿海地区日常蔬菜摄入对 REEs 的健康风险是可以接受的.
-
表 1 CNZVI与不同HA共注射时沉积系数
Table 1. Deposition coefficients of CNZVI when co-injected with different HA
HA浓度/(mg·L−1)HA concentration 沉积系数/%Deposition rate coefficient 0 1.958 20 1.248 60 0.883 100 0.859 -
[1] ZHANG M, HE F, ZHAO D Y, et al. Transport of stabilized iron nanoparticles in porous media: Effects of surface and solution chemistry and role of adsorption[J]. Journal of Hazardous Materials, 2017, 322: 284-291. doi: 10.1016/j.jhazmat.2015.12.071 [2] MONDAL A, DUBEY B K, ARORA M, et al. Porous media transport of iron nanoparticles for site remediation application: A review of lab scale column study, transport modelling and field-scale application[J]. Journal of Hazardous Materials, 2021, 403: 123443. [3] GONG L, SHI S S, LV N, et al. Sulfidation enhances stability and mobility of carboxymethyl cellulose stabilized nanoscale zero-valent iron in saturated porous media[J]. Science of the Total Environment, 2020, 718: 137427. doi: 10.1016/j.scitotenv.2020.137427 [4] XU W Q, LI Z J, SHI S S, et al. Carboxymethyl cellulose stabilized and sulfidated nanoscale zero-valent iron: Characterization and trichloroethene dechlorination[J]. Applied Catalysis B:Environmental, 2020, 262: 118303. [5] DONG H R, ZHAO F, ZENG G M, et al. Aging study on carboxymethyl cellulose-coated zero-valent iron nanoparticles in water: Chemical transformation and structural evolution[J]. Journal of Hazardous Materials, 2016, 312: 234-242. doi: 10.1016/j.jhazmat.2016.03.069 [6] LIU G S, ZHONG H A, AHMAD Z, et al. Transport of engineered nanoparticles in porous media and its enhancement for remediation of contaminated groundwater[J]. Critical Reviews in Environmental Science and Technology, 2020, 50(22): 2301-2378. doi: 10.1080/10643389.2019.1694823 [7] FAZELI SANGANI M, OWENS G, FOTOVAT A. Transport of engineered nanoparticles in soils and aquifers[J]. Environmental Reviews, 2019, 27(1): 43-70. [8] CHEN B, LV N, XU W F, et al. Transport of nanoscale zero-valent iron in saturated porous media: Effects of grain size, surface metal oxides, and sulfidation[J]. Chemosphere, 2023, 313: 137512. doi: 10.1016/j.chemosphere.2022.137512 [9] KIM S B, PARK S J, LEE C G, et al. Transport and retention of Escherichia coli in a mixture of quartz, Al-coated and Fe-coated sands[J]. Hydrological Processes, 2008, 22(18): 3856-3863. [10] ZHUANG J, JIN Y. Interactions between viruses and goethite during saturated flow: Effects of solution pH, carbonate, and phosphate[J]. Journal of Contaminant Hydrology, 2008, 98(1/2): 15-21. [11] WANG D J, BRADFORD S A, HARVEY R W, et al. Humic acid facilitates the transport of ARS-labeled hydroxyapatite nanoparticles in iron oxyhydroxide-coated sand[J]. Environmental Science & Technology, 2012, 46(5): 2738-2745. [12] JOHNSON R L, JOHNSON G O, NURMI J T, et al. Natural organic matter enhanced mobility of nano zerovalent iron[J]. Environmental Science & Technology, 2009, 43(14): 5455-5460. [13] PELLEY A J, TUFENKJI N. Effect of particle size and natural organic matter on the migration of nano- and microscale latex particles in saturated porous media[J]. Journal of Colloid and Interface Science, 2008, 321(1): 74-83. doi: 10.1016/j.jcis.2008.01.046 [14] MYLON S E, CHEN K L, ELIMELECH M. Influence of natural organic matter and ionic composition on the kinetics and structure of hematite colloid aggregation: Implications to iron depletion in estuaries[J]. Langmuir, 2004, 20(21): 9000-9006. doi: 10.1021/la049153g [15] WU Y N, DONG H R, TANG L, et al. Influence of humic acid and its different molecular weight fractions on sedimentation of nanoscale zero-valent iron[J]. Environmental Science and Pollution Research, 2020, 27(3): 2786-2796. doi: 10.1007/s11356-019-07140-4 [16] DONG H R, LO I M C. Influence of calcium ions on the colloidal stability of surface-modified nano zero-valent iron in the absence or presence of humic acid[J]. Water Research, 2013, 47(7): 2489-2496. doi: 10.1016/j.watres.2013.02.022 [17] LIANG B, XIE Y Y, FANG Z Q, et al. Assessment of the transport of polyvinylpyrrolidone-stabilised zero-valent iron nanoparticles in a silica sand medium[J]. Journal of Nanoparticle Research, 2014, 16(7): 2485. doi: 10.1007/s11051-014-2485-0 [18] YANG X Y, DENG S H, WIESNER M R. Comparison of enhanced microsphere transport in an iron-oxide-coated porous medium by pre-adsorbed and co-depositing organic matter[J]. Chemical Engineering Journal, 2013, 230: 537-546. [19] WU W P, HAN L, NIE X, et al. Effects of multiple injections on the transport of CMC-nZVI in saturated sand columns[J]. Science of the Total Environment, 2021, 784: 147160. doi: 10.1016/j.scitotenv.2021.147160 [20] HE F, ZHAO D Y, LIU J C, et al. Stabilization of Fe–Pd nanoparticles with sodium carboxymethyl cellulose for enhanced transport and dechlorination of trichloroethylene in soil and groundwater[J]. Industrial & Engineering Chemistry Research, 2007, 46(1): 29-34. [21] FATISSON J, GHOSHAL S, TUFENKJI N. Deposition of carboxymethylcellulose-coated zero-valent iron nanoparticles onto silica: Roles of solution chemistry and organic molecules[J]. Langmuir, 2010, 26(15): 12832-12840. [22] 赵凤. 羧甲基纤维素修饰纳米零价铁在水环境中的腐蚀老化研究[D]. 长沙: 湖南大学, 2017. ZHAO F. Aging study on carboxymethyl cellulose-coated zero-valent iron nanoparticles in aqueous environment[D]. Changsha: Hunan University, 2017 (in Chinese).
[23] YANG X, FLYNN R, von der KAMMER F, et al. Quantifying the influence of humic acid adsorption on colloidal microsphere deposition onto iron-oxide-coated sand[J]. Environmental Pollution, 2010, 158(12): 3498-3506. [24] YANG X Y, ZHANG Y M, CHEN F M, et al. Interplay of natural organic matter with flow rate and particle size on colloid transport: Experimentation, visualization, and modeling[J]. Environmental Science & Technology, 2015, 49(22): 13385-13393. [25] 唐章, 杨新瑶, 闫馨予, 等. 腐植酸和Cd2+对黏土胶粒在饱和多孔介质中迁移的影响[J]. 农业环境科学学报, 2019, 38(1): 111-116. doi: 10.11654/jaes.2018-0056 TANG Z, YANG X Y, YAN X Y, et al. Influence of humic acid and cadmium on the transport of clay colloids in saturated porous media[J]. Journal of Agro-Environment Science, 2019, 38(1): 111-116 (in Chinese). doi: 10.11654/jaes.2018-0056
[26] WANG C, BOBBA A D, ATTINTI R, et al. Retention and transport of silica nanoparticles in saturated porous media: Effect of concentration and particle size[J]. Environmental Science & Technology, 2012, 46(13): 7151-7158. [27] ELIMELECH M, GREGORY J, JIA X, et al. Transport of colloidal materials in ground water[M]//Particle Deposition and Aggregation. Amsterdam: Elsevier, 1995: 361-375. [28] 浦喆, 杨新瑶, 于丹, 等. 酸适应降低鼠伤寒沙门氏菌在天然土壤中迁移能力[J]. 农业环境科学学报, 2022, 41(12): 2705-2710. doi: 10.11654/jaes.2022-1185 PU Z, YANG X Y, YU D, et al. Acid adaptation reduces the transport ability of Salmonella typhimurium in natural soil[J]. Journal of Agro-Environment Science, 2022, 41(12): 2705-2710 (in Chinese). doi: 10.11654/jaes.2022-1185
[29] KRETZSCHMAR R, BARMETTLER K, GROLIMUND D, et al. Experimental determination of colloid deposition rates and collision efficiencies in natural porous media[J]. Water Resources Research, 1997, 33(5): 1129-1137. doi: 10.1029/97WR00298 [30] BIAN H, WAN J, MUHAMMAD T, et al. Computational study and optimization experiment of nZVI modified by anionic and cationic polymer for Cr(VI) stabilization in soil: Kinetics and response surface methodology (RSM)[J]. Environmental Pollution, 2021, 276: 116745. doi: 10.1016/j.envpol.2021.116745 [31] ELJAMAL R, ELJAMAL O, MAAMOUN I, et al. Enhancing the characteristics and reactivity of nZVI: Polymers effect and mechanisms[J]. Journal of Molecular Liquids, 2020, 315: 113714. doi: 10.1016/j.molliq.2020.113714 -







 下载:
下载: