-
微塑料是由塑料制品在紫外线、风力及物理破碎作用衍生而来的新型污染物,已受到国内外研究人员的广泛关注[1 − 2]. 近年来,在海洋、河流、湖泊、地下水甚至自来水中均发现了微塑料的存在[3]. 由于其粒径较小,容易被生物误吞,并通过食物链进入到人体[4]. 此外,微塑料由于具有较大的比表面积和疏水性,其还容易吸附环境中的有机污染物和重金属等,所形成的复合污染体会对各种生物产生不同程度的影响[5]. 因此,对环境中的微塑料进行治理尤为重要.
混凝是一种简单、稳定及低成本的处理技术. 然而,由于微塑料密度较低及其粒径变化较大,低剂量混凝剂的水解产物对其吸附架桥和卷扫能力较弱[6]. 为满足较高的微塑料去除效果,通常需投加较大剂量的混凝剂,由此不可避免会存在药剂和色度残留问题等[7]. 因此,为解决上述问题,有必要探索提高混凝过程对微塑料的去除效果的途径. 助凝剂是常用的强化混凝性能的材料之一,其可提高絮体的吸附和沉降能力,从而提高混凝剂对微塑料的去除效果[8]. 如Ma等[9]研究表明,在pH为7时,加入15 mg·L−1聚丙烯酰胺(PAM)后,5 mmol·L−1的AlCl3·6H2O对粒径< 0.5 mm的PE颗粒的去除效率从25.83%提高到45.34%. 但鉴于PAM水解单体的生物毒性,研究者们开始关注具有高生物亲和性和可降解性的天然聚合物,如淀粉、明胶、纤维素衍生物和微生物多糖等[10]. 其中,壳聚糖等多糖具有较高的离子电荷密度和较长的高分子链,还可对水中的微粒起到桥联作用,使其可作为助凝剂,提高传统混凝剂去除水中微粒的效率[11]. 如Huang等[12]研究发现,在常规剂量下,聚合氯化铝(PAC)与壳聚糖(CTS)的复配体系对纯水中PET微塑料的去除率为PAC体系的近3倍,CTS的加入可提升单一PAC混凝体系的电荷中和及吸附作用. Zhao等[13]研究表明,适度添加昆布多糖(LA)可使聚合氯化铝对天然有机物(NOM)的混凝效率提高15%—35%,且与PAM的助凝效果相当.
作为一种重要的藻类资源,LA是一种表面带负电荷的链状聚合物,其具有的线性大分子结构有利于产生架桥效应,与合成混凝剂共同使用过程中起到强化混凝的作用[14]. 此外,LA主要含有C、H和O,元素分布集中,较易预测其在混凝过程中的产物,从而分析其助凝机制[13]. 近年来,研究人员主要关注LA的医用功能[15],其在微塑料混凝中的应用研究较少,为了提高微塑料混凝治理中的生物安全性并保持较高的净化效率,本研究创新性地提出在微塑料混凝处理过程中使用LA作为聚合氯化铝铁(PAFC)的助凝剂.
本文重点研究了LA对PAFC混凝去除PE微塑料的强化性能,评价LA对PAFC混凝去除PE微塑料的强化效果,讨论PAFC及PAFC-LA等不同系统中可能存在的混凝机制,考察PAFC及PAFC-LA等不同系统对不同水质条件的适应性,为微塑料的混凝治理提供技术依据.
-
聚合氯化铝铁(PAFC)、昆布多糖(LA)、阳离子型聚丙烯酰胺(CPAM)、阴离子型聚丙烯酰胺(APAM)、海藻酸钠(SA)、壳聚糖(CTS)、腐殖酸(HA)、十六烷基三甲基溴化铵(CTAB)购自上海麦克林生化科技有限公司,盐酸(HCl)、氢氧化钠(NaOH)均购自西陇科学股份有限公司,氯化钠(NaCl)、硫酸钠(Na2SO4)、碳酸钠(Na2CO3)均购自国药化学试剂有限公司,所有试剂均为分析纯. 聚乙烯(PE)购自东莞华创塑化有限公司. 0.45 μm混合纤维素过滤膜购自天津金腾实验设备有限公司.
JSF-7200F型场发射扫描电镜,日本电子;Nicolet iS5型傅里叶变换红外光谱仪,美国赛默飞;Zetasizer Nano ZS90型纳米粒度仪,英国马尔文;ESCALAB 250Xi型X射线光电子能谱仪,美国赛默飞.
-
混凝剂在使用前均配制成溶液,每次实验的PE微塑料重量均为100 mg,CTAB作为分散剂,其投加量固定为100 mg·L−1;投加量影响实验中,采用氢氧化钠溶液将pH预先调至8(除pH影响实验外,均采用此值),微塑料尺寸为50—150 μm(除微塑料尺寸影响实验外,均采用此值),PAFC和LA投加量范围分别为0—250 mg·L−1和0—30 mg·L−1;微塑料尺寸影响实验中,PAFC和LA的投加量分别固定为150 mg·L−1和20 mg·L−1,以下实验均采用此值,所考察范围分别为300—500、150—300、50—150、<50 μm等;pH影响实验所考察的范围分别为3、5、7、8、9、11;腐殖酸(HA)影响实验中,HA的质量浓度为1、10、50 mg·L−1;离子共存实验中,Cl−、SO42-、CO32-的质量浓度分别为30、300 mg·L−1;在真实水环境混凝实验中,将微塑料均匀分散至所采集的湖水和自来水样中,其余实验条件与纯水环境一致. 所有混凝试验均在MY3000-6E型混凝试验搅拌仪进行(潜江梅宇仪器有限公司). 搅拌程序设置为快速搅拌(300 r·min−1)1 min和慢速搅拌(70 r·min−1)10 min,反应后静置沉淀30 min,所有实验均设置3组平行.
微塑料的定量方法尚未统一,重量法是一种相对准确的方法,具体测试过程如下[16],首先,将滤膜置于烘箱中60 °C下干燥,直至恒重,并将质量计为M1(g). 混凝实验完成后,取出溶液上层的微塑料,加入1 mol·L−1的盐酸以去除杂质,然后进行抽滤、干燥和称重,此时将有滤膜的微塑料质量计为M2(g). 微塑料的去除率η(%)如下式1计算.
-
SEM测试:取适量样品粘在导电胶上,然后喷金观察,测试过程中的加速电压为10 kV,工作距离为9.7 mm;FTIR测试:采用溴化钾压片法,波数测定范围为400—4000 cm−1;Zeta电位测试:取适量微塑料加入去离子水中,混匀后测定Zeta电位,当混凝沉淀后,测定上清液的Zeta电位;X 射线光电子能谱仪(XPS)测试:窄谱扫描时的通能为30 eV,步长为0.1 eV.
-
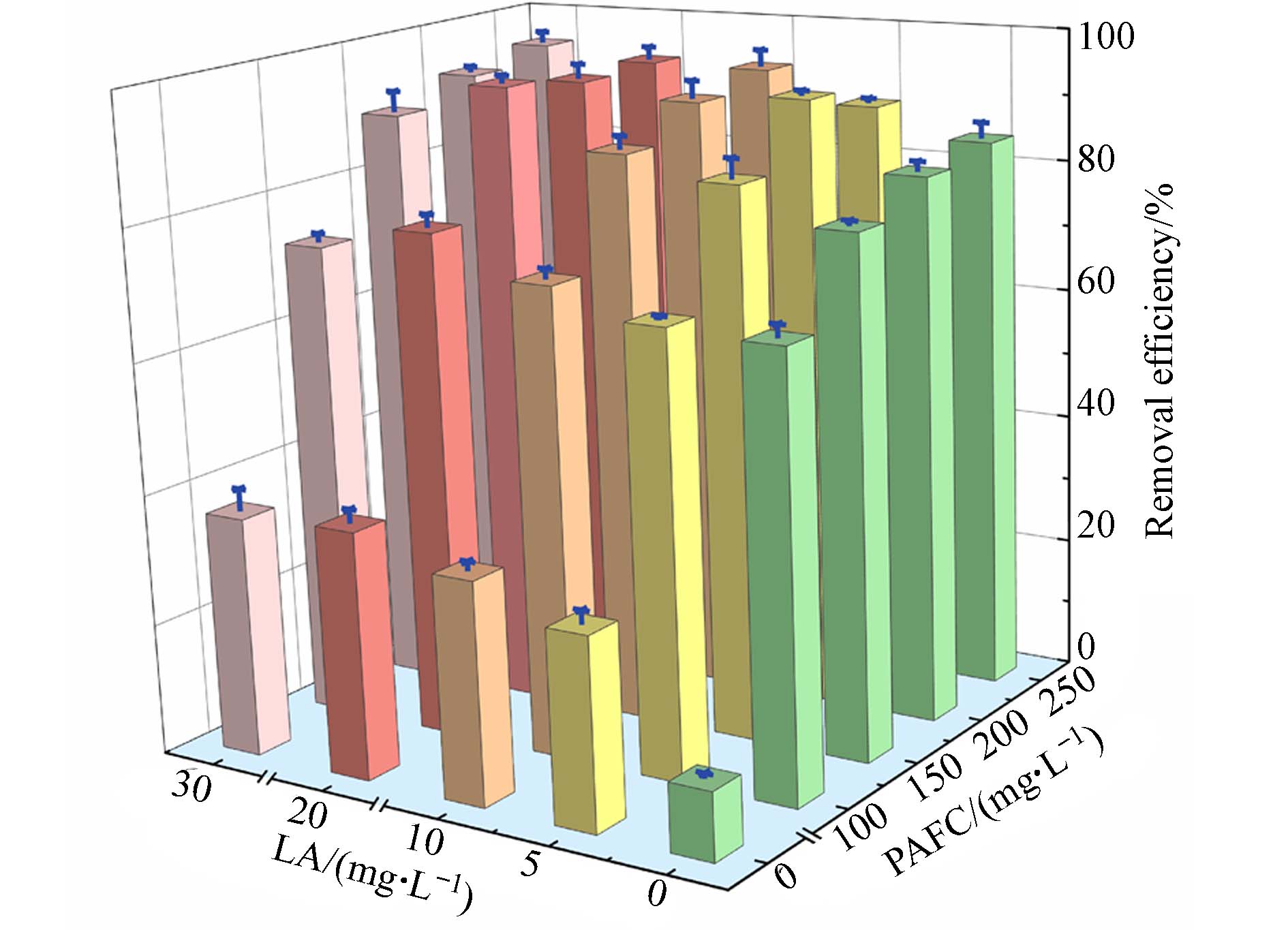
在混凝实验前考察PE微塑料的自沉效率,如图1所示,在未添加PAFC及LA的情况下,仅约10.3%的PE微塑料会自然沉降,这主要由于PE微塑料的密度低于水,这与Zhou等[16]研究结果基本一致. 因此,需进一步测试PAFC及LA对微塑料的混凝效果. 在PAFC的常规用量(0—100 mg·L−1)下,絮体数量较少且存在絮体上浮问题,从而影响水中PE微塑料的去除效果,这与先前研究报道的常规混凝剂用量的混凝效率不足的结果相一致[9]. 此外,在紧急情况下,使用大剂量的混凝剂是有必要的. 因此,本实验主要考察较大剂量(0—250 mg·L−1)的PAFC对PE微塑料的混凝效果.
如图1所示,单独使用PAFC进行混凝时,当药剂用量由100 mg·L−1增加至250 mg·L−1,对PE微塑料的去除效率从66.5%相应提高到84.5%,值得关注的是,随混凝剂用量继续增加,混凝效率的上升速率逐渐减缓,这表明单纯使用PAFC可去除水中的微塑料,但存在混凝剂用量较大且混凝效率受限等问题,这与之前的研究结果相一致[17]. 因此,为有效减少混凝剂用量且提高微塑料的去除效果,需在混凝过程中加入助凝剂. 此外,在PAFC-LA复配体系的混凝效果测试前,还考察单独使用LA的絮凝效果. 如图1所示,由于生物大分子所具备的吸附架桥等作用,当LA投加量为5 mg·L−1时,微塑料的去除率可达到29.0%,但进一步增加LA的药剂量,对微塑料的絮凝效果提升较为有限,如投加量增加到30 mg·L−1时,PE微塑料的去除率也仅为36.6%. 因此,单一的PAFC或LA均较难达到较好的微塑料去除效果.
如图1所示,在PAFC-LA体系中,LA的加入明显改善微塑料混凝效果,当PAFC投加量为100 mg·L−1时,20 mg·L−1的LA使微塑料的去除效率由66.5%提升至76.9%. 随着LA投加量进一步增加至30 mg·L−1,微塑料的去除效率略微下降. 因此,为达到最佳的PE微塑料去除效果,需要研究PAFC和LA的不同投加量下的混凝效果,如图1所示,微塑料的去除效果随着PAFC和LA投加量的增加而增加. 当PAFC和LA的投加量分别为150 mg·L−1和20 mg·L−1时,可达到较佳的去除率(95.2%),并大幅减小单一体系中的混凝剂用量,从而间接减少水中的药剂残留量. 但进一步增大PAFC用量,LA的助凝作用较为有限,此外,当水中LA浓度过高时,溶液中会出现浑浊或絮体上浮现象,从而导致微塑料的去除效率降低,这与Zhang等[6]研究结果一致. 以上结果表明,LA可增强PAFC混凝去除PE微塑料的效果,合适的PAFC和LA的浓度和配比可实现对微塑料的最佳去除效率.
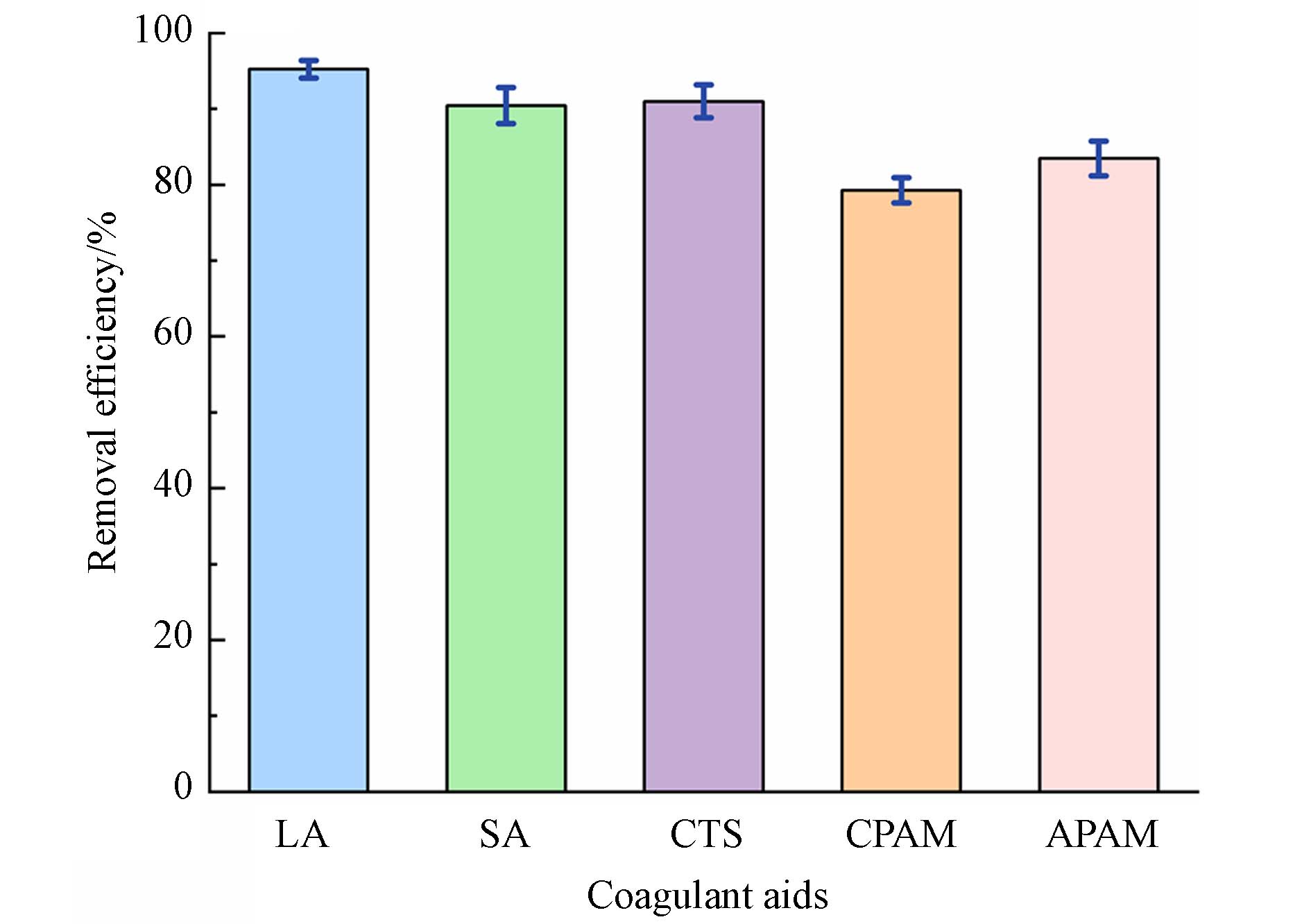
助凝剂的存在可能改善一种或几种混凝机制,提高污染物去除率[18]. 然而,不同助凝剂的特性可能导致助凝效果的差异[19]. 通过比较不同助凝剂与PAFC复配的去除性能,探索LA替代传统助凝剂的可行性,为微塑料的复配混凝系统的构建提供必要的技术依据. 助凝剂的投加量均为20 mg·L−1,五种复配体系的实验结果如图2所示,LA、SA、CTS等天然高分子絮凝剂与PAFC复配对微塑料的去除效率较高,分别达到95.2%、90.4%和91.0%,同等条件下,CAPM、APAM等人工合成高分子絮凝剂与PAFC复配的去除率为79.3%—83.5%,低于天然絮凝剂的助凝性能. 然而,有研究表明PAM与混凝剂复配对微塑料的去除效率高于SA及ASA[6]. 与其他研究的实验条件比较结果表明,微塑料去除效率的差异可能是由于微塑料种类及混凝剂种类等因素造成的. 如Zhang等[6]开展PAM、SA及ASA与PAC复配对PET微塑料的混凝性能研究,在PAC及助凝剂投加量分别为200 mg·L−1及100 mg·L−1时,三体系对PET微塑料的去除效率分别为91.5%、73.4%及77.6%. 因此,在PE微塑料的去除效果方面,PAFC与LA复配混凝体系具有较好的性能,从强化混凝效果角度考虑,LA替代传统助凝剂是可行的,有必要进一步探讨该体系对微塑料的混凝机理.
-
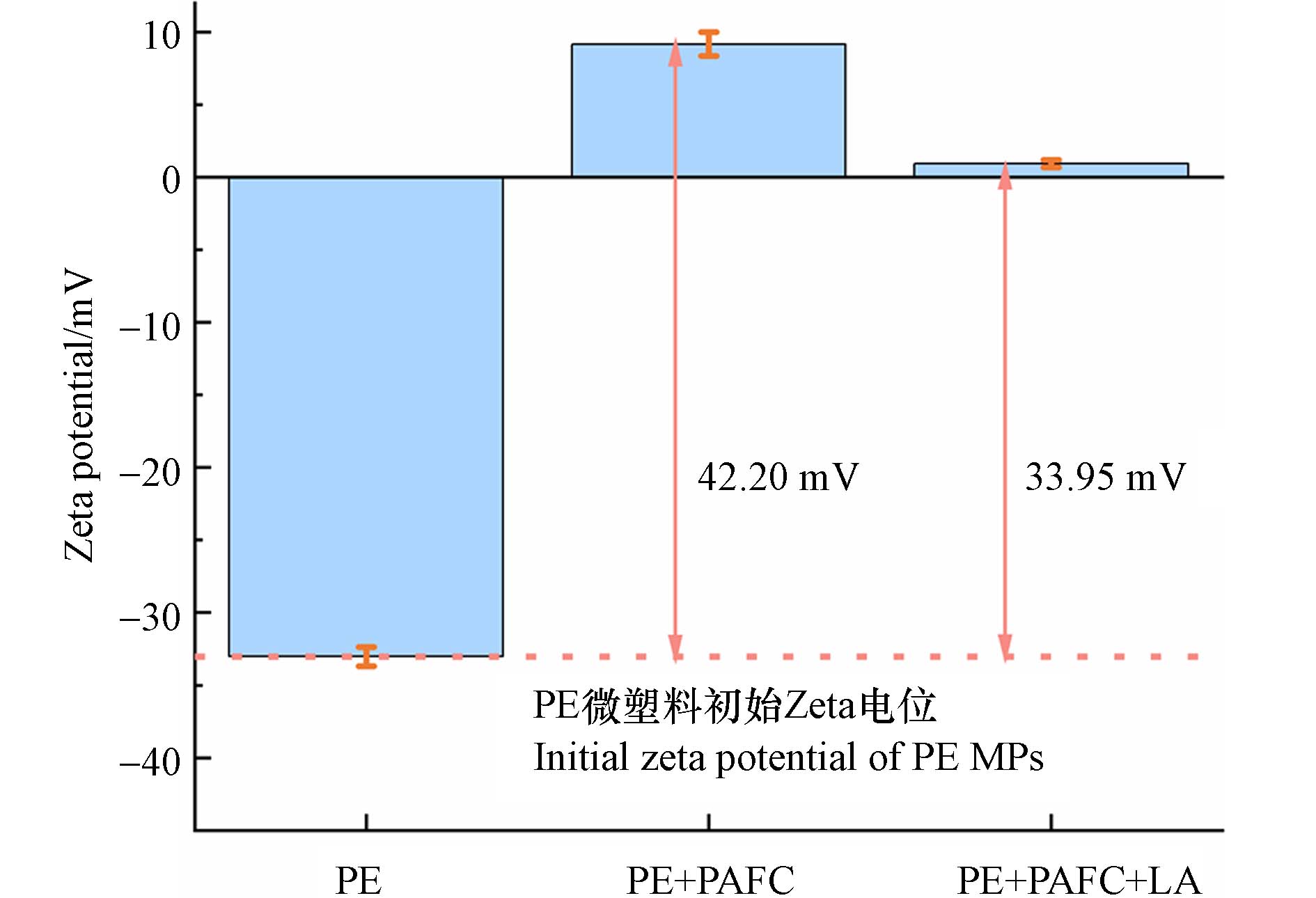
电荷中和是混凝过程的主要机理之一,无机金属混凝剂水解所形成的阳离子产物,可中和微塑料表面的负电荷,使水中微塑料脱稳[20]. 如图3所示,在混凝前,pH为8时的PE微塑料的Zeta电位测量值为−33.03 mV,其表面带有负电荷,此时微塑料由于相互间的静电斥力作用而保持稳定,因此,PE微塑料在水中沉降效率仅为10.3%. 投加聚合氯化铝铁后所形成的水解产物带正电荷,体系的Zeta电位迅速由初始的−33.03 mV上升至9.17 mV,微塑料颗粒间斥力大大减弱,更容易发生凝聚现象. 值得关注的是,在PAFC-LA混凝体系中,Zeta电位显著降低至0.92 mV,这可能是由于LA的含氧基团在碱性条件下发生去质子化而带负电荷,中和体系中净余的正电荷,从而使Zeta电位降低. 一般认为,体系中Zeta电位越接近于0,颗粒间排斥作用较弱,微塑料更易发生聚沉现象[16]. 以上分析结果表明,LA的加入可能改善了PAFC体系的电荷中和作用效果.
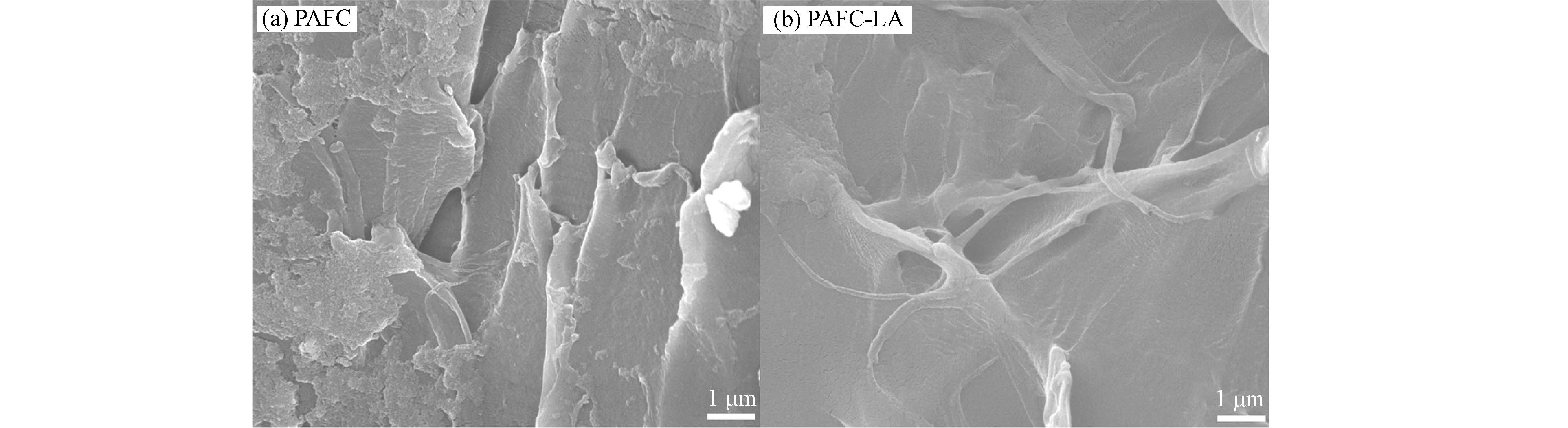
吸附架桥也是混凝的重要机理之一. 本实验采用SEM观察PAFC及PAFC-LA体系的絮体表面形貌. 如图4a所示,PAFC产生的絮体具有较高的聚集程度,且呈现堆叠形态,微塑料附着或结合于絮体中,这表明混凝剂水解过程中可能发生吸附架桥或卷扫捕集效应;当溶液中加入LA后,如图4b所示,复配混凝体系引起的絮体具有明显的支化结构,改善了单一PAFC产生絮体的堆叠状态,使形成的絮凝体得以完全扩展,提升絮体的吸附架桥能力,这其中的机制可能是LA中的—OH作为路易斯碱,可将孤对电子转移到PAFC的金属原子上,形成相对稳定的Fe/Al-LA复合体,通过此桥接作用,进一步强化絮体生长,形成桥联网络结构[13]. 即LA的负电荷官能团可通过静电引力作用与带正电的混凝剂水解产物发生吸附架桥作用,改善絮体的沉降性能,进一步提高PE微塑料的混凝效果.
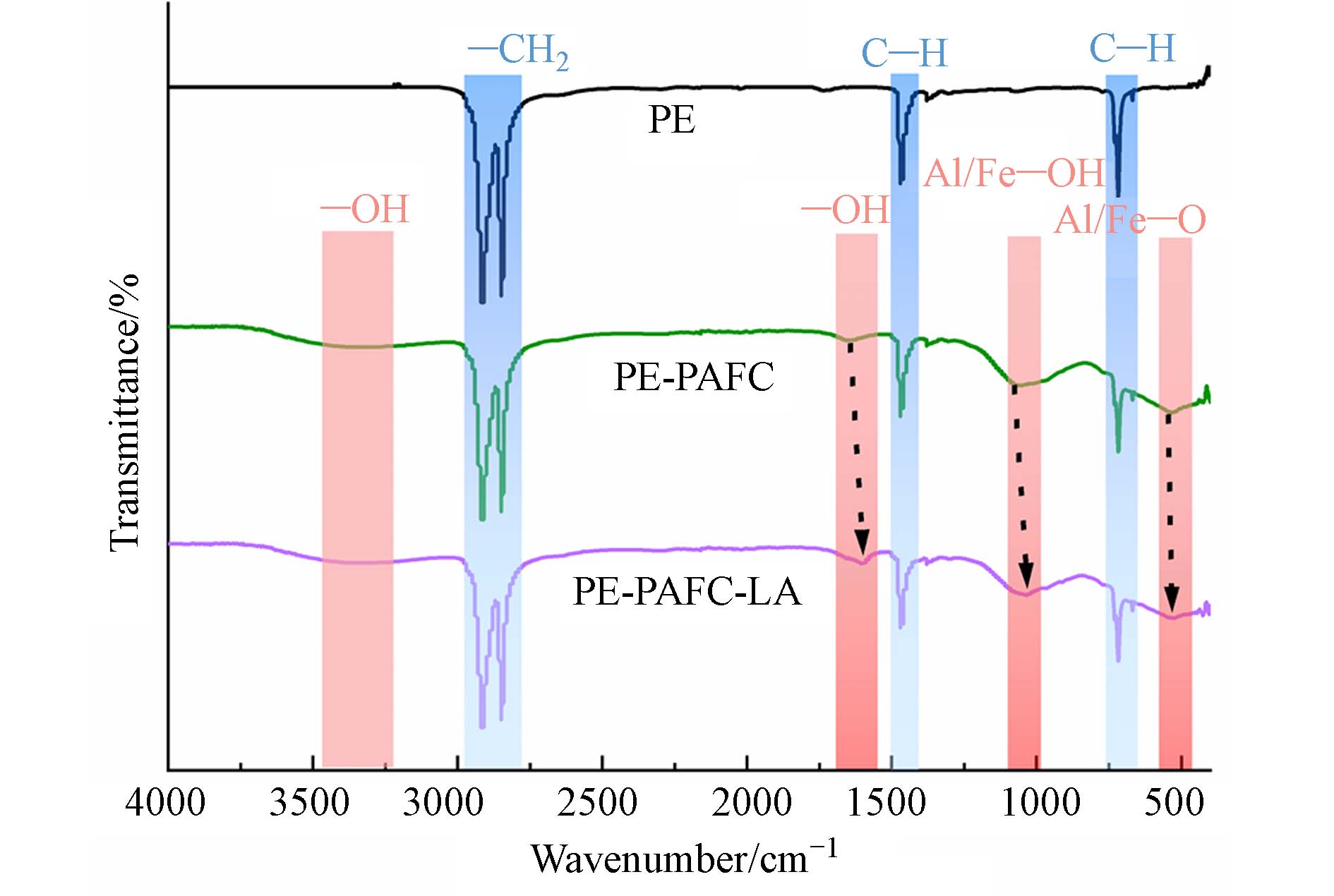
为进一步阐明PAFC-LA与PE微塑料的吸附架桥机制,通过FTIR分析了PE及絮凝体的表面官能团. 如图5所示,在PE微塑料的红外光谱图中,在2915 cm−1和2848 cm−1附近分别出现由 —CH2不对称和对称伸缩振动引起的吸收峰[21],而1471 cm−1和717 cm−1附近出现的吸收峰可归因于 C—H的弯曲振动和摇摆振动[22],以上四处PE微塑料的特征峰强在混凝后明显减弱,表明部分微塑料的表面被混凝剂水解产物所覆盖或被包裹至絮体中[23].
与PE微塑料的图谱相比,PAFC加入后所形成的絮凝体出现4处新的吸收峰,如在1638 cm−1和1057 cm−1附近出现了Al/Fe—OH中羟基弯曲振动引起的吸收峰[24],3250—3410 cm−1出现的宽峰可能与—OH的伸缩振动有关[25],以上吸收峰可能与聚合氯化铝铁的水解产物有关. 此外,在533 cm−1附近还出现Fe/Al—O弯曲振动引起的吸收峰[25]. 以上结果表明,聚合氯化铝铁充分参与混凝反应,含铝、铁化学键发生断裂并重组生成等羟基铝铁络合物,通过静电引力作用吸附表面带负电荷的微塑料颗粒,使PE微塑料脱稳沉降. 值得关注的是,在LA加入后,—OH、Al/Fe—OH及Fe/Al—O的峰形更为尖锐,且向低波数方向移动,这可能是LA中的—OH通过氢键或与絮体表面的铝、铁产生更为稳定的吸附架桥作用,进一步提升PAFC的混凝效果,这与SEM分析结果一致. Zhang等[6]研究也表明含有氨基和羟基的助凝剂,可将孤用电子对转移到金属离子的空轨道上形成稳定的配合物,从而提升PAC去除微塑料的能力.
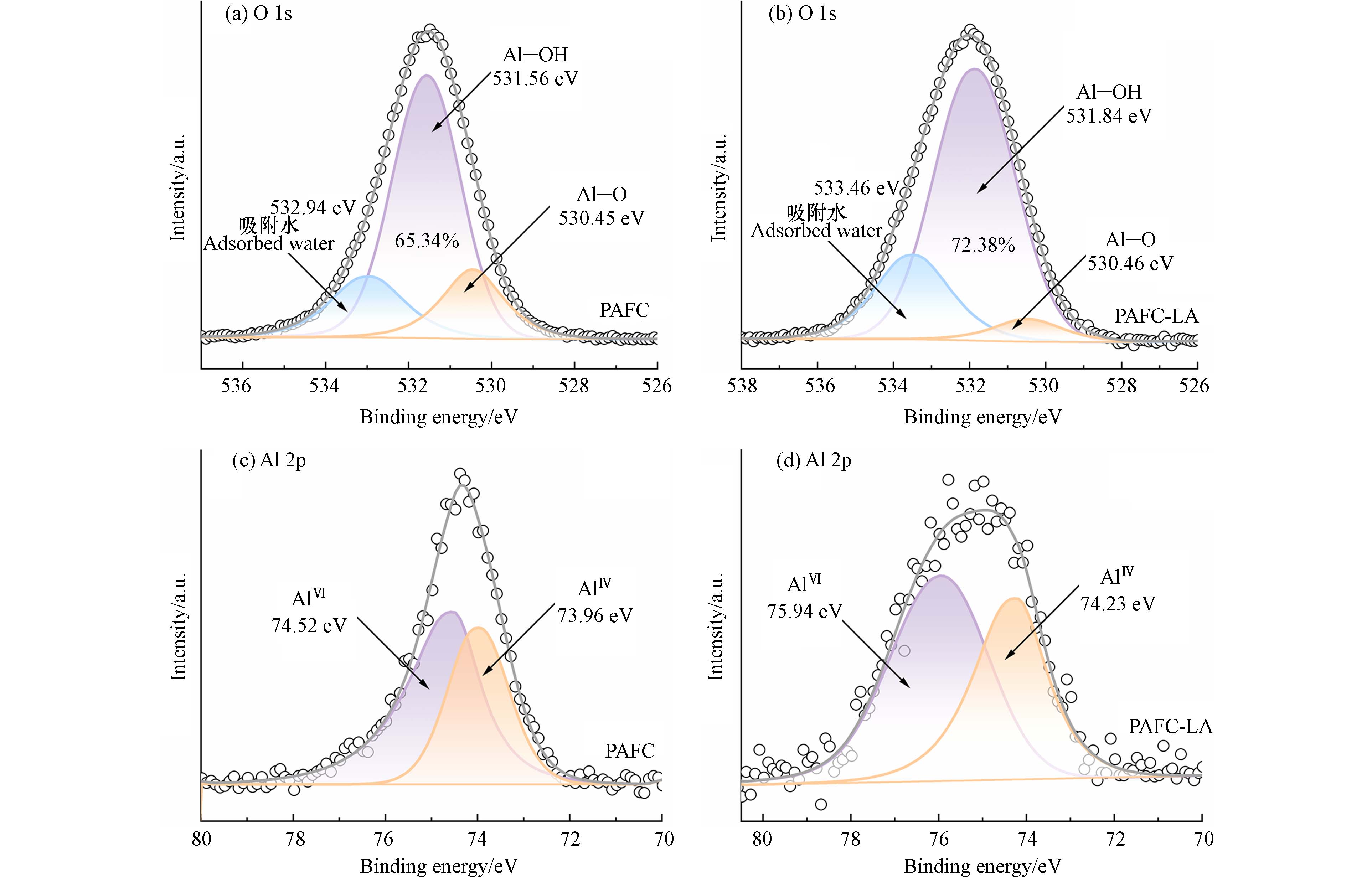
为进一步明确絮凝体中的铝及氧元素的化学态,采用XPS技术对干燥后的絮凝体进行分析,如图6a所示,530.45 eV、531.56 eV及532.94 eV的O 1s峰值分别归因于Al—O、Al—OH及吸附水[26],表明絮体中存在羟基铝离子等PAFC的水解产物,其可增强絮凝体与PE微塑料间静电吸附作用. 值得关注的是,如图6b所示,当加入LA后,Al—OH的含量由65.34%上升至72.38%,这可能由于LA的羟基与混凝剂中铝发生了作用,促进Al—OH的生成,增强PAFC对PE微塑料的吸附架桥效应,与FTIR分析结果一致. 如图6c所示,谱图中出现两处Al 2p的特征峰(74.52 eV,73.96 eV). 结合能为74.52 eV的峰可归因于六面体状态存在的Al[6,12],而73.96处的峰可归因于四面体形式存在的Al[6,12],絮体中六面体铝与四面体铝的比值在LA加入前后并未发生明显变化,表明LA存在并没有显著改变PAFC水解产物中铝的类型,这与Zhang等[6]研究结果一致. 如图6d所示,在PAFC-LA的体系中,AlⅥ的结合能位置发生明显的偏移,这可能是LA中的官能团与铝作用的结果,这与O 1s谱图结果一致. 由此可推断,LA的加入可改善PAFC的吸附架桥能力.
-
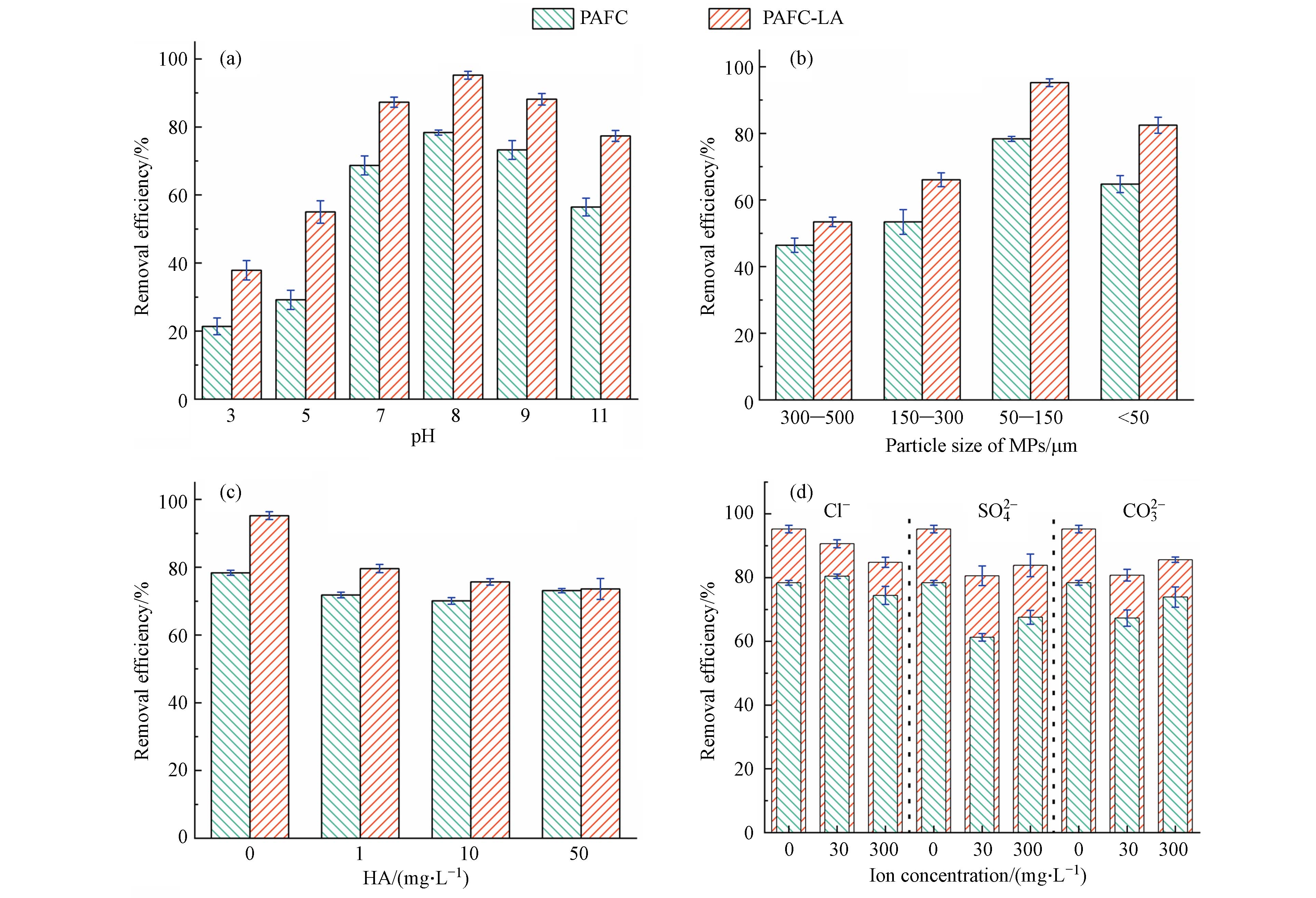
溶液pH会影响混凝剂的表面电荷和水解形态,从而影响其混凝效果[13]. 图7a对比了PAFC和PAFC-LA在酸性、中性和碱性条件下对PE微塑料的混凝去除率. 如图7a所示,随着pH值的变化,PAFC-LA对PE微塑料的混凝效果均优于单一PAFC体系,且两种体系的混凝效率均呈现先升高后降低趋势,在pH为8时,达到微塑料的最佳混凝效果,这表明两种混凝体系在不同pH下的混凝机理是一致的,LA的加入主要起到增强混凝效果的作用. 在酸性条件下(pH为3—5),体系中大量H+与混凝剂中的—OH发生反应,降低了水解产物的聚合程度[27],从而导致混凝效率降低,但LA由于其所具有的特殊的大分子结构,有效地弥补了对PAFC混凝效率的抑制. 在中性及弱碱性条件(pH为7—8)下,铝、铁的种类主要是低电荷多核络合离子或氢氧化物,可进一步对微塑料产生吸附架桥或卷扫捕集效应,此外,在该条件下,LA通过去质子化和解离作用产生了更多有效的吸附活性位点[13],且中和体系中多余的正电荷,从而以增强电中和和吸附架桥的形式进一步提高了PAFC对PE微塑料的去除能力. 在pH>8时,随着PAFC的水解程度进一步提高,Al(OH)3等水解产物逐渐增加,而Al(OH)2+及Fe(OH)2+等水解物种逐渐减少[28],减弱混凝体系对PE微塑料的电荷中和能力,因此,PAFC-LA对PE微塑料的去除率呈现下降趋势. 本实验微塑料去除效果最佳时所对应pH与其他研究成果较不一致,这可能是混凝剂和助凝剂的种类的不同所致,如He等[29]分别采用PAC和APAM作为混凝剂和助凝剂,在pH为7时,对PE微塑料的去除率最高.
在实际水体中,水中微塑料的颗粒大小差异较大,其中小粒径微塑料(粒径<500 μm)占比较多,而不同颗粒大小的微塑料去除效率通常也不一致. 因此,选用300—500 μm、150—300 μm、50—150 μm及<50 μm的PE微塑料作为研究对象. 结果如图7b所示,粒径对PAFC及PAFC-LA体系的混凝效率的影响趋势基本一致,且LA的加入提升PAFC对不同粒径微塑料的去除效率. PE微塑料的粒径为50—150 μm时,各体系均显示出较好的去除效果(78.4%及95.2%),且随着粒径进一步增大或减小时,PE微塑料去除效率均出现下降,Zhou等[16]研究也表明,对于<5000 μm的PE微塑料,粒径越小,其去除效率越高. 然而Shahi等[30]研究表明,对粒径为10—100 μm的微塑料,随着颗粒粒径的增大,其混凝去除效率随之升高. 与较大粒径微塑料相比,小粒径微塑料更难以克服水的表面张力,其沉降性能会受到抑制[16],这可能是50—150 μm的微塑料去除率高于<50 μm的微塑料的原因. 综上所述,过小或过大的微塑料粒径对PAFC的混凝沉降效果具有一定的抑制作用,但LA的加入提升其对PE微塑料的去除效率.
天然水体中广泛存在NOM,其表面存在丰富的官能团会影响无机混凝剂对微塑料的混凝性能[31]. HA是一种常见NOM,因此,本研究将其作为目标考察对象. 从图7c可以看出,在PAFC-LA体系中,HA的存在抑制PE微塑料的去除,当HA浓度从0 mg·L−1增加到50 mg·L−1时,PE的去除率由95.2 %下降至73.6%,这可能是由于HA表面富含官能团,可吸附在PE及LA的表面,占据其活性位点,从而阻碍了PE、LA与PAFC水解产物之间的相互作用,减弱了混凝体系吸附架桥能力[32]. 与之相反,由于单一PAFC混凝机制主要受电荷中和作用控制,因此,HA的存在对其去除微塑料的抑制作用较小,这与表征分析结果一致.
天然水体中通常含有多种离子,如碳酸根、硫酸根及氯离子等,这些离子可能会影响混凝性能[29]. 因此,有必要研究共存离子对复合体系混凝效果的影响. 如图7d所示,对于PAFC及PAFC-LA体系,PE的去除效率均随阴离子浓度的增加而降低,即阴离子的存在均抑制PE微塑料的去除. 据报道,水中的Cl−、SO42-会与带正电荷的羟基铝离子发生反应,而造成混凝体系中Al(OH)2+、Al(OH)2+等水解产物的减少[33]. 此外,CO32-的存在会促进混凝剂水解生成氢氧化物,同样会造成带正电荷羟基铝离子的减少,从而减弱混凝体系的电荷中和及吸附架桥作用,使PE微塑料的去除效率下降. Zhou等[16]在用PAC和氯化铁去除PE微塑料的实验中,也发现SO42-对混凝效果有负面影响,但与Zhang等[6]采用PAC去除PET的研究结果相反,不同的实验结果可能是混凝剂和微塑料的类型差异造成的. 值得关注的是,在不同的离子及浓度下,PAFC-LA对PE微塑料的去除效果均优于单一PAFC混凝体系,表明LA的加入提升复配混凝体系的吸附架桥能力,减弱了共存离子所带来的负面效应.
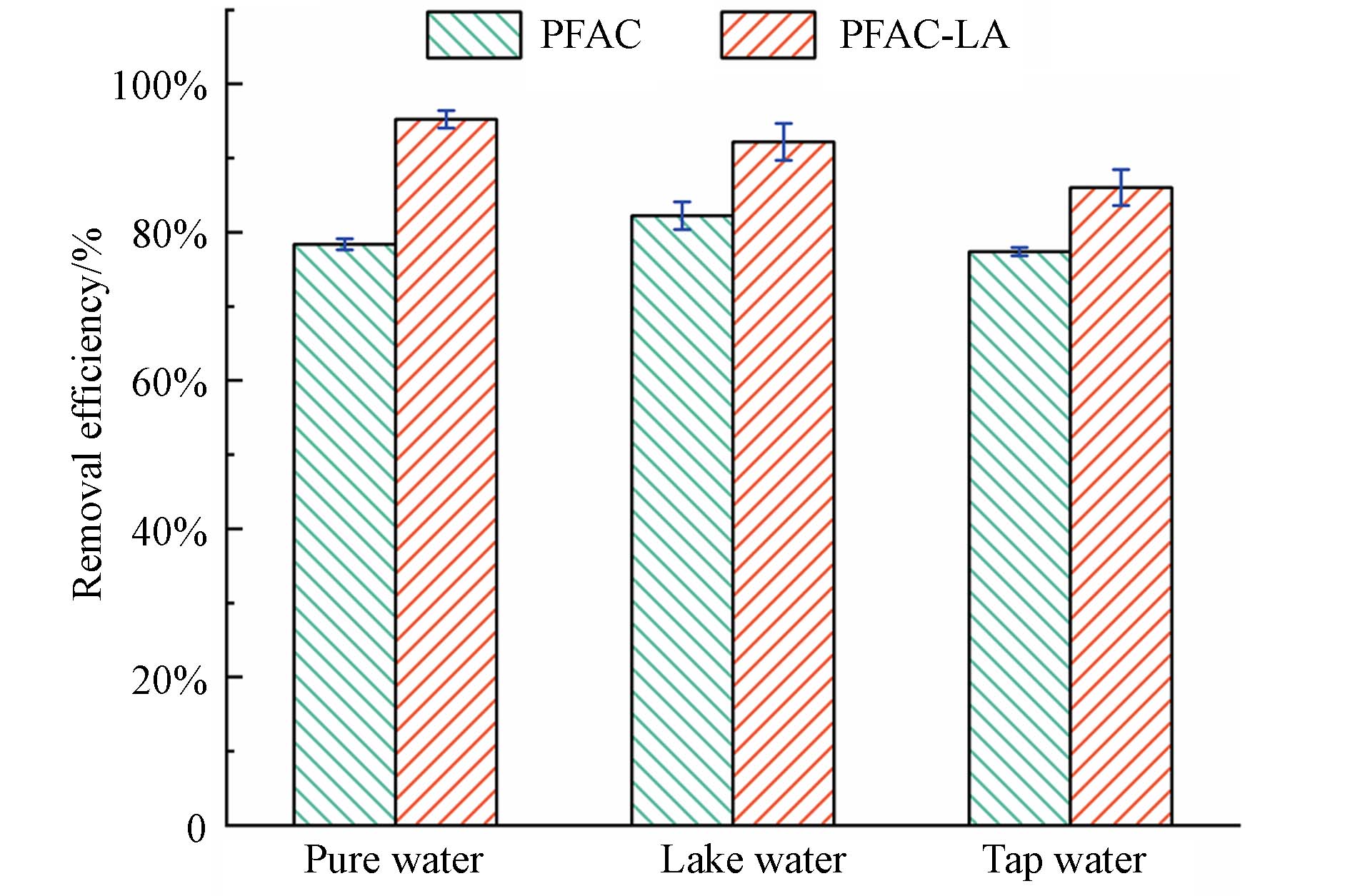
采集了两种真实水样,包括自来水(tap water)及湖水(lake water),与实验室纯水(pure water)进行对比,进一步评价PAFC及PAFC-LA混凝体系对PE微塑料的去除效果. 如图8所示,对于PAFC体系,湖水环境中的微塑料去除效果(82.2%)略优于纯水条件(78.4%),这可能由于湖水中存在多种悬浮物,在絮凝过程中被絮体捕集,从而增加絮凝体的质量,提高微塑性颗粒的沉降率[12]. 此外,由图7c可看出,HA等水体天然有机物对PAFC去除PE微塑料的影响较为有限,如HA为50 mg·L−1时,PAFC对PE微塑料的去除率仅由78.4%略微下降至73.1%,即吸附架桥作用可能不是PAFC对微塑料的主要混凝机理. 因此,在湖水环境中,PAFC对PE微塑料的去除效果出现略微上升现象. 与之相反,PAFC-LA体系在湖水中的混凝效率(92.2%)略低于纯水环境(95.2%). 这可能由于湖水中存在多种有机物,会阻碍了LA与PAFC水解产物之间的吸附架桥作用[32],如图7c也可看出,天然有机物对PAFC-LA的混凝性能影响较大,如HA为50 mg·L−1时,PAFC-LA混凝体系对PE微塑料的去除率由95.2%下降至73.6%. 同样,Gong等[34]研究也发现,在实际地表水中加入PS—COOH,由于地表水中存在NOMs,导致其去除效率降低. 因此,在吸附架桥作用受到较大抑制及絮体质量变大两种因素影响下,导致PAFC-LA在湖水环境的混凝效果出现略微下降趋势. 而对于自来水环境,PAFC及PAFC-LA混凝体系对PE的去除效果均出现了下降现象,这可能是由于自来水中存在阴离子,其会减少水中带正电荷羟基金属离子等水解物种的含量,造成混凝体系对微塑料的去除率出现下降趋势,与共存离子的实验结果一致. 但与Huang等[12]采用PAC-CTS去除PET微塑料的研究成果较不一致,这可能与微塑料及混凝剂的种类不同有关. 值得关注的是,不同环境下,PAFC-LA对PE的去除效果均优于单一PAFC,表明PAFC-LA复配体系能更好的适应水体中复杂的环境条件,对微塑料的治理具有更广阔的应用前景.
-
本研究测试LA在PAFC去除PE微塑料时的强化混凝性能,添加适量的LA可提高PAFC对PE微塑料的混凝效率,当PAFC和LA的投加量分别为150 mg·L−1和20 mg·L−1时,单一PAFC和PAFC-LA对PE微塑料的的去除率分别达到78.4%和95.2%. PAFC和PAFC-LA体系对PE微塑料的混凝机理是一致的,昆布多糖结构中的负电荷基团的桥联作用使PAFC的电荷中和和吸附架桥的作用得到改善,从而对PE微塑料表现出更优异的混凝效果. 此外,LA在较宽的pH、粒径、离子和腐殖酸共存下均发挥了良好的助凝效果. 综上所述,在混凝工艺中,LA在去除PE微塑料方面表现出较优异的应用潜力.
昆布多糖-聚合氯化铝铁复配去除水中聚乙烯微塑料
Removal of polyethylene microplastics from water by laminarin-polymeric aluminum iron chloride
-
摘要: 以昆布多糖(LA)作为一种新型助凝剂,考察了其在使用聚合氯化铝铁(PAFC)去除聚乙烯(PE)微塑料时的强化混凝性能,通过Zeta电位、扫描电镜(SEM)、傅里叶变换红外光谱(FTIR)、X射线光电子能谱(XPS)对混凝机理进行了研究,结果表明,添加适量的LA可提高PAFC对PE微塑料的混凝效率,当PAFC和LA的投加量分别为150 mg·L−1和20 mg·L−1时,单一PAFC和PAFC-LA对PE微塑料的的去除率分别达到78.4%和95.2%. PAFC和PAFC-LA对PE微塑料的混凝机理是一致的,LA的加入显著改善PAFC的电荷中和、吸附架桥和卷扫絮凝效果. 不同pH、微塑料粒径、共存离子、腐殖酸共存及真实水体效果测试实验表明,PAFC-LA复配混凝系统具有较好的环境适应性.Abstract: Laminarin (LA) was used as a novel coagulant aid to investigate its enhanced coagulation performance in the removal of polyethylene (PE) microplastics using polymeric aluminum ferric chloride (PAFC), and the coagulation mechanism was investigated by zeta potential, scanning electron microscopy (SEM), Fourier transform infrared spectroscopy (FTIR), and X-ray photoelectron spectroscopy (XPS). The results showed that the addition of the appropriate amount of LA could improve the coagulation efficiency of PAFC on PE microplastics. The removal rates of PE microplastics by single PAFC and PAFC-LA reached 78.4% and 95.2% when the dosages of PAFC and LA were 150 mg·L−1 and 20 mg·L−1, respectively. The coagulation mechanisms of PAFC and PAFC-LA on PE microplastics were consistent, and the addition of LA significantly improved the effects of charge neutralization, adsorption bridging and sweeping flocculation of PAFC. Effecting test experiments of pH, microplastic size, coexisting ions, humic acid coexistence and actual water showed that the PAFC-LA compound coagulation system had better environmental adaptability.
-
Key words:
- PAFC /
- laminarin /
- polyethylene /
- microplastics /
- mechanism.
-
-
[1] SUN J, PENG Z T, ZHU Z R, et al. The atmospheric microplastics deposition contributes to microplastic pollution in urban waters[J]. Water Research, 2022, 225: 119116. doi: 10.1016/j.watres.2022.119116 [2] SHOLOKHOVA A, DENAFAS G, MYKHAYLENKO V. Microplastics generation and concentration during mechanical-biological treatment of mixed municipal solid waste[J]. Environmental Research, 2022, 214(Pt 1): 113815. [3] LEUSCH F D, LU H C, PERERA K, et al. Analysis of the literature shows a remarkably consistent relationship between size and abundance of microplastics across different environmental matrices[J]. Environmental Pollution, 2023, 319: 120984. doi: 10.1016/j.envpol.2022.120984 [4] MERRILL G B, HERMABESSIERE L, ROCHMAN C M, et al. Microplastics in marine mammal blubber, melon, & other tissues: Evidence of translocation[J]. Environmental Pollution, 2023, 335: 122252. doi: 10.1016/j.envpol.2023.122252 [5] LV M J, ZHANG T, YA H B, et al. Effects of heavy metals on the adsorption of ciprofloxacin on polyethylene microplastics: Mechanism and toxicity evaluation[J]. Chemosphere, 2023, 315: 137745. doi: 10.1016/j.chemosphere.2023.137745 [6] ZHANG Y J, ZHOU G Y, YUE J P, et al. Enhanced removal of polyethylene terephthalate microplastics through polyaluminum chloride coagulation with three typical coagulant aids[J]. Science of the Total Environment, 2021, 800: 149589. doi: 10.1016/j.scitotenv.2021.149589 [7] LAPOINTE M, FARNER J M, HERNANDEZ L M, et al. Understanding and improving microplastic removal during water treatment: impact of coagulation and flocculation[J]. Environmental Science & Technology, 2020, 54(14): 8719-8727. [8] ZHANG Y T, ZHAO J H, LIU Z Y, et al. Coagulation removal of microplastics from wastewater by magnetic magnesium hydroxide and PAM[J]. Journal of Water Process Engineering, 2021, 43: 102250. doi: 10.1016/j.jwpe.2021.102250 [9] MA B W, XUE W J, HU C Z, et al. Characteristics of microplastic removal via coagulation and ultrafiltration during drinking water treatment[J]. Chemical Engineering Journal, 2019, 359: 159-167. doi: 10.1016/j.cej.2018.11.155 [10] OWODUNNI A A, ISMAIL S. Revolutionary technique for sustainable plant-based green coagulants in industrial wastewater treatment—a review[J]. Journal of Water Process Engineering, 2021, 42: 102096. doi: 10.1016/j.jwpe.2021.102096 [11] KARYAB H, GHASEMI M, GHOTBINIA F, et al. Efficiency of chitosan nanoparticle with polyaluminum chloride in dye removal from aqueous solutions: Optimization through response surface methodology (RSM) and central composite design (CCD)[J]. International Journal of Biological Macromolecules, 2023, 249: 125977. doi: 10.1016/j.ijbiomac.2023.125977 [12] HUANG L P, HE W T, ZHANG Y J, et al. Chitosan enhances poly aluminum chloride flocculation system removal of microplastics: Effective, stable, and pollution free[J]. Journal of Water Process Engineering, 2023, 54: 103929. doi: 10.1016/j.jwpe.2023.103929 [13] ZHAO S, ZHANG J G, YANG W H, et al. Application of laminarin as a novel coagulant aid to improve coagulation-ultrafiltration efficiency[J]. Environmental Research, 2023, 228: 115909. doi: 10.1016/j.envres.2023.115909 [14] ZOU Z J, GU Y Q, YANG W H, et al. A modified coagulation-ultrafiltration process for silver nanoparticles removal and membrane fouling mitigation: The role of laminarin[J]. International Journal of Biological Macromolecules, 2021, 172: 241-249. doi: 10.1016/j.ijbiomac.2021.01.034 [15] AN E K, HWANG J, KIM S J, et al. Comparison of the immune activation capacities of fucoidan and laminarin extracted from Laminaria japonica[J]. International Journal of Biological Macromolecules, 2022, 208: 230-242. doi: 10.1016/j.ijbiomac.2022.03.122 [16] ZHOU G Y, WANG Q G, LI J, et al. Removal of polystyrene and polyethylene microplastics using PAC and FeCl3 coagulation: Performance and mechanism[J]. Science of the Total Environment, 2021, 752: 141837. doi: 10.1016/j.scitotenv.2020.141837 [17] YAO J J, PENG Z X, CHEN W F, et al. Surface characteristics of polystyrene microplastics mainly determine their coagulation performances[J]. Marine Pollution Bulletin, 2023, 186: 114347. doi: 10.1016/j.marpolbul.2022.114347 [18] MORIWAKI H, KOMORI N, AKIYAMA Y. Interaction between nanoplastics and pectin, a water-soluble polysaccharide, in the presence of Fe(III) ion[J]. Journal of Environmental Chemical Engineering, 2022, 10(3): 108054. doi: 10.1016/j.jece.2022.108054 [19] ZHANG Y L, LI M, ZHANG G H, et al. Efficient treatment of the starch wastewater by enhanced flocculation-coagulation of environmentally benign materials[J]. Separation and Purification Technology, 2023, 307: 122788. doi: 10.1016/j.seppur.2022.122788 [20] LEE J, WANG J E, OH Y, et al. Highly efficient microplastics removal from water using in-situ ferrate coagulation: Performance evaluation by micro-Fourier-transformed infrared spectroscopy and coagulation mechanism[J]. Chemical Engineering Journal, 2023, 451: 138556. doi: 10.1016/j.cej.2022.138556 [21] HO T B C, NGUYEN T B, CHEN C W, et al. Influence of aging processes on PE microplastics with various oxidants: Morphology, chemical structure, and adsorption behavior toward tetracycline[J]. Environmental Technology & Innovation, 2023, 31: 103173. [22] NGUYEN T B, HO T B C, HUANG C P, et al. Adsorption of lead(II) onto PE microplastics as a function of particle size: influencing factors and adsorption mechanism[J]. Chemosphere, 2022, 304: 135276. doi: 10.1016/j.chemosphere.2022.135276 [23] WANG Q X, TIAN C H, SHI B Y, et al. Efficiency and mechanism of micro-and nano-plastic removal with polymeric Al-Fe bimetallic coagulants: Role of Fe addition[J]. Journal of Hazardous Materials, 2023, 448: 130978. doi: 10.1016/j.jhazmat.2023.130978 [24] CHENG Y, ZHANG S S, HUANG T L, et al. Effects of coagulants on the catalytic properties of iron-manganese co-oxide filter films for ammonium and manganese removal from surface water[J]. Journal of Cleaner Production, 2020, 242: 118494. doi: 10.1016/j.jclepro.2019.118494 [25] MA J Y, ZHANG R, XIA W, et al. Coagulation performance of Al/Fe based covalently bonded composite coagulants for algae removal[J]. Separation and Purification Technology, 2022, 285: 120401. doi: 10.1016/j.seppur.2021.120401 [26] LV M, CHEN F, ZHANG Z H, et al. Insights on enhanced antibiotic sulfamethoxazole removal by magnetic activated carbon-ballasted coagulation: Efficacy and floc properties[J]. Separation and Purification Technology, 2023, 315: 123643. doi: 10.1016/j.seppur.2023.123643 [27] CHENG Y, XU L J, LIU C L. Red mud-based polyaluminium ferric chloride flocculant: Preparation, characterisation, and flocculation performance[J]. Environmental Technology & Innovation, 2022, 27: 102509. [28] ZHOU L, ZHOU H J, YANG X Y. Preparation and performance of a novel starch-based inorganic/organic composite coagulant for textile wastewater treatment[J]. Separation and Purification Technology, 2019, 210: 93-99. doi: 10.1016/j.seppur.2018.07.089 [29] HE J S, ZHANG Y, NI F, et al. Understanding and characteristics of coagulation removal of composite pollution of microplastic and norfloxacin during water treatment[J]. Science of the Total Environment, 2022, 831: 154826. doi: 10.1016/j.scitotenv.2022.154826 [30] SHAHI N K, MAENG M, KIM D, et al. Removal behavior of microplastics using alum coagulant and its enhancement using polyamine-coated sand[J]. Process Safety and Environmental Protection, 2020, 141: 9-17. doi: 10.1016/j.psep.2020.05.020 [31] WANG W Y, YANG M, MA H F, et al. Removal behaviors and mechanism of polystyrene microplastics by coagulation/ultrafiltration process: Co-effects of humic acid[J]. Science of the Total Environment, 2023, 881: 163408. doi: 10.1016/j.scitotenv.2023.163408 [32] LIU B B, GAO Y, YUE Q Y, et al. The suitability and mechanism of polyaluminum-titanium chloride composite coagulant (PATC) for polystyrene microplastic removal: Structural characterization and theoretical calculation[J]. Water Research, 2023, 232: 119690. doi: 10.1016/j.watres.2023.119690 [33] GE F, ZHU L Z. Effects of coexisting anions on removal of bromide in drinking water by coagulation[J]. Journal of Hazardous Materials, 2008, 151(2/3): 676-681. [34] GONG Y Y, BAI Y, ZHAO D Y, et al. Aggregation of carboxyl-modified polystyrene nanoplastics in water with aluminum chloride: Structural characterization and theoretical calculation[J]. Water Research, 2022, 208: 117884. doi: 10.1016/j.watres.2021.117884 -




 下载:
下载: