-
重金属污染在环境科学领域一直受到广泛关注,作为一种常见且具有毒性的金属,铬(Cr)的污染情况与毒性危害也受到了一定程度的重视. 世界卫生组织及中国卫生部均规定饮用水中铬离子最高浓度为50 μg·L−1[1]. 我国地表水中铬离子含量区域性变化较大,整体浓度偏高. 如黄土高原中部地区地表水中铬离子浓度为22—185 μg·L−1,扬子江流域铬离子浓度有记录高达660 μg·L−1[1]. 相对于三价铬,六价铬具有更强的毒性,其在水体环境中大量存在时,会对水生生物产生较强的毒性效应. 六价铬已被证明对印度鲤鱼Labeorohita具有高毒性,会造成其代谢率与生化指标的明显变化,并在多个主要器官中富集 [2]. 因此,六价铬的水生生态效应已受到广泛关注.
塑料是一种对于人类至关重要的材料,产量逐年增加,2018年全球产量已达3.59亿吨,预测到2050年可能达330亿吨[3 − 4]. 然而塑料材料的广泛应用、大规模生产和其不易降解的特性导致大量塑料以碎片或颗粒形式被排放到自然环境中,在大气、土壤、水体等环境介质中均有微塑料检出. 微塑料通常被定义为直径小于5 mm的塑料颗粒,其实际粒径从几微米到几毫米不等[3]. Zhu等[5]研究表明,中国烟台、东莞、上海、南海和珠江等5座城市的大气中,<30 μm和30—100 μm的微塑料分别为61.6%和33.1%;在中国上海郊区菜园土中浅层土和深层土中微塑料的丰度分别为(78 ±12.9) items·kg−1和(62.5 ±12.97) items·kg−1;监测数据显示,我国渤海水域、黄海北部海域以及椒江、瓯江、闽江河口、太湖等河流湖泊淡水系统都不同程度地受到微塑料污染[6 − 10]. 微塑料往往以形状不规则的混合体形式存在于海洋或淡水水体中,由于其排放量大、污染范围广、难以完全去除等特点,被称为“海洋PM2.5”,它对水生生态系统造成的威胁难以忽视. 在鱼、虾、双壳类动物、浮游动物等生物体内已有微塑料检出,造成水生生物呼吸道阻塞、食道阻塞、组织炎症、生长迟缓、氧化应激与生殖并发症等生理危害[11 − 12].
环境中的污染物往往以混合物形式存在,微塑料与重金属常共存于水体环境中,微塑料颗粒较大的比表面积和较强的疏水性使其更加容易吸附和富集周围环境中的重金属,相互影响增加了生态环境及人体健康的风险,已有研究表明,微塑料可吸附水体中的重金属,对重金属毒性加重,对生态系统和机体产生消极影响[13 − 14]. 微塑料与汞、铜、铅等重金属的毒理学相互作用,对鱼类的发育、行为和生物积累量等造成影响[15 − 16]. 微塑料与重金属的联合毒性是当前环境科学中需要深入研究和关注的重要方向. 斑马鱼作为一种经典的水生模式生物,与人类基因高度同源,其胚胎透明且发育迅速,对外源性化合物较为敏感,污染物对斑马鱼胚胎的毒性和致畸作用在许多方面和人类相似,因此被广泛应用于环境科学研究[17]. 本研究以聚苯乙烯微塑料(PS)为代表,选用斑马鱼作为受试生物,对微塑料和六价铬的联合毒性进行了评估,为六价铬的生物毒性研究提供了新的视角. 研究结果有助于加深对环境污染的理解,为保护生态环境和人类健康提供科学支持.
-
聚苯乙烯微塑料(PS,粒径为1—50 μm)来自南京环境科学研究所. 使用扫描电镜、红外吸收光谱法观察分析PS微塑料. 本实验所使用的重铬酸钾、二甲亚砜、磷酸、硫酸、丙酮等其他试剂均来自南京化学实验试剂股份有限公司.
-
4月龄的AB系野生型斑马鱼成鱼购买于南京一树梨花生物科技有限公司(中国,南京). 购买的斑马鱼成鱼先在实验室条件下适应2周后再用于后续试验. 将斑马鱼雌鱼和雄鱼分开培养,系统中供应的水是通过仪器反渗透过滤后的自来水,水质参数由斑马鱼养殖系统监控,具体培养条件如下:水体温度为(26±1)℃,14 h/10 h光暗周期,培养体系中pH范围维持在7.2—7.4,添加适量海盐将养殖水电导率范围维持在450—550 μS·cm−1,溶解氧含量大于7 mg·L−1,每天喂食4次新鲜丰年虾,定期更换系统中的培养水,定期清洁消毒鱼缸保持缸内洁净以保证斑马鱼健康生长.
将斑马鱼雌鱼和雄鱼配对产卵以获得用于实验的胚胎,具体操作步骤如下所述. 前一天晚上将斑马鱼雌鱼和雄鱼按照数量比1:1的比例置于装有淡盐水的透明产卵盒中,并用隔板将雌鱼和雄鱼隔开,装有雌雄鱼的产卵盒置于恒温培养箱中方便控制温度和光照,关闭培养箱光照,次日早晨拿开隔板,打开培养箱光照,雌雄斑马鱼开始追逐产卵,产卵结束后收集斑马鱼胚胎置于产卵盒内的淡盐水中,待胚胎稳定后用E3培养基洗涤,清除粪便并吸出未成功受精和死亡的斑马鱼胚胎,排除胚胎因自身健康情况对实验造成的干扰.
-
Cr(Ⅵ)单独暴露组:准确称取重铬酸钾溶解于E3培养基中,并逐级稀释至Cr(Ⅵ)浓度分别0.1、0.6、6.0 mg·L−1作为低、中、高3个浓度组;
微塑料+Cr(Ⅵ)联合暴露组:参考文献,微塑料浓度设置为0.5 mg·L−1[18],Cr(Ⅵ)浓度分别为0.1、0.6、6.0 mg·L−1,PS微塑料需要助溶剂二甲亚砜(DMSO)以帮助分散,故在每组的暴露溶液中都加入了0.001%(体积分数)的DMSO以控制变量,DMSO在该浓度下对斑马鱼生长无明显影响. 以0.5 mg·L−1微塑料组为微塑料对照组,以只含0.001%DMSO组为溶剂对照组. 暴露溶液的组别和浓度如表1所示.
每个浓度组设置5个平行组,每个平行组采用当日成功受精的健康斑马鱼胚胎15颗. 为了确保受试斑马鱼胚胎的健康,将受精后的斑马鱼胚胎取出繁殖盒后恒温静置2 h,静置结束后挑出死亡或出现蛋白质凝固现象的胚胎弃用.
实验在六孔板中进行,每个孔内注入5 mL暴露溶液,将斑马鱼胚胎随机分配于六孔板内,置于恒温光照培养箱内培养. 在实验周期(7 d)内每天更换暴露溶液. 每天使用光学体式显微镜观察并记录受试斑马鱼胚胎/幼鱼的死亡数、孵化数和畸形,暴露24 h记录斑马鱼胚胎的自主运动次数(1 min);暴露72 h记录斑马鱼幼鱼的体长与心跳,暴露7 d分析斑马鱼幼鱼的行为学变化. 本研究将个体死亡定义为胚胎发生凝固或心跳停止,将畸形率定义为畸形个体数/生存个体数.
-
于暴露7 d后测试各实验组斑马鱼幼鱼的行为学变化,包括斑马鱼运动实验与光-暗选择实验两个部分,实验装置如图1所示. 已有研究证实,明暗周期性交替的环境会增加斑马鱼幼鱼的运动频率[16],故采用光-暗周期性变化来促进斑马鱼幼鱼的运动. 在8组暴露体系中每组随机挑选8只幼鱼,将其移至盛有培养基的96孔板内,适应20 min后,将孔板置于下置发光板的遮光盒内,每10 min转换明暗条件,持续40 min,实验总时长1 h. 记录光照条件下10 min时间间隔内斑马鱼幼鱼的运动时长.
将可拆卸96孔板条拆为单独的圆柱形透明小室,用黑色遮光胶带遮住每个圆柱小室的侧边,并用整条黑色遮光胶带将10个小室连接在一起并遮住其底面的一半,保证光线只能从小室底部的一半面积照入,即把每个小室分为光、暗两个部分. 将黑色遮光塑料板裁剪成略宽于小室内径的塑料条,将光、暗两个区域分隔开,并预先在装置中加入培养基. 在8组暴露体系中每组随机挑选10只幼鱼,转移至实验装置中(幼鱼起始时应被置于光照区域). 前20 分钟使斑马鱼幼鱼适应光照环境,适应结束后取走遮光塑料条,并记录后续10 min内斑马鱼幼鱼进入黑暗区域的频率与在黑暗区域内的停留时长.
-
用SPSS22.0软件进行单因素方差分析检验,评价各个暴露组与对照组之间生物学参数的统计学差异,结果以平均值±标准偏差(SD)表示. 显著差异用星号(*)表示为:*P<0.05,视为有统计学差异,**P<0.01,视为有高显著差异,***P<0.001,视为有极显著差异.
-
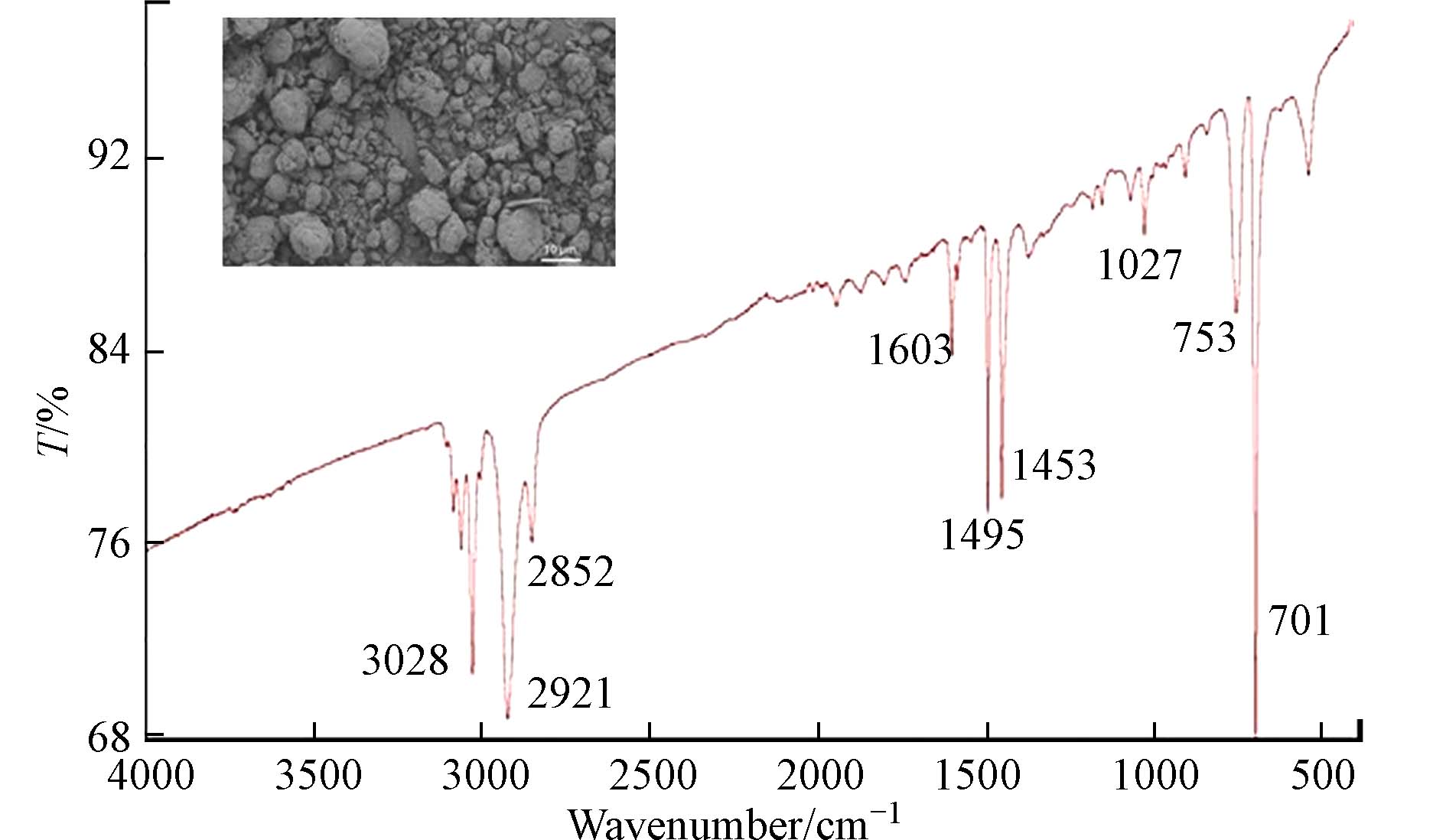
球磨前后PS微塑料的SEM图像见图2. 球磨后PS微塑料粒径为1—50 μm,颗粒表面可见更深的凹槽与裂纹,表明球磨后微塑料颗粒具有更大的比表面积. 球磨后PS微塑料IR图谱在
3028 cm−1处特征峰归属为芳香环C—H伸缩振动,2921 cm−1和2852 cm−1特征峰归属于CH2伸缩振动,1603 cm−1和1495 cm−1归属为芳香环特征峰,1453 cm−1为C=C特征峰,1027 cm−1为C—H弯曲振动特征峰,753 cm−1和701 cm−1分别归属为芳香环的C—H弯曲振动和面外弯曲振动特征峰. 该特征峰与Godoy等[19]研究结果相似. -
受试各组斑马鱼胚胎的孵化情况与Cr(Ⅵ)存在明显相关,其中72 h时的孵化率尤其体现了这种差异,故对72 h孵化率进行记录与分析,如图3A所示,溶剂对照组与对照组相比无显著差异,表明所选溶剂符合要求. 与对照组相比,暴露体系中有Cr(Ⅵ)存在时斑马鱼胚胎的72 h孵化率均明显降低,这表明Cr(Ⅵ)会导致斑马鱼胚胎的孵化延迟. 这种孵化延迟现象在已有研究中也有出现[20 − 21],认为孵化延迟是由于Cr(Ⅵ)引起的发育毒性造成的,而这种发育毒性主要涉及幼体机体炎症与氧化应激两个方面. 与Cr(L)组相比,MP+Cr(L)组斑马鱼胚胎孵化率显著下降,表明MP存在时加强了Cr(Ⅵ)对斑马鱼胚胎的孵化抑制作用,放大低浓度Cr(Ⅵ)对斑马鱼胚胎的孵化延迟效应. 对于含中浓度和高浓度Cr(Ⅵ)的暴露体系,PS微塑料的存在不会造成明显差异,这是由于中浓度和高浓度Cr(Ⅵ)的暴露体系中斑马鱼胚胎已基本无孵化.
各组的144 h累计死亡率如图3B所示,无论体系中是否存在PS微塑料,高浓度Cr(Ⅵ)组的累计死亡率都明显较高,且Cr(Ⅵ)对斑马鱼胚胎的致死毒性存在浓度依赖性. 除此之外,与Cr(L)组和Cr(M)组相比,MP+Cr(L)组与MP+Cr(M)组的累计死亡率更高,而MP+ Cr(H)组的累计死亡率却比Cr(H)组的累死亡率低. 考虑到MP组的累计死亡率与对照组并无明显差异,推测这可能是由于PS微塑料具有较大的比表面积,为Cr(Ⅵ)提供了较多的吸附位点,在吸附了Cr(Ⅵ)之后被斑马鱼摄入,增加了重金属Cr(Ⅵ)的生物可利用度;而在Cr(Ⅵ)浓度过高的情况下,微塑料的吸附位点可能已经饱和,减少斑马鱼对重金属Cr(Ⅵ)的摄入,从而减弱了重金属Cr(Ⅵ)的毒性.
各组斑马鱼幼鱼的体长如图3C所示,各组健康斑马鱼幼鱼的体长并无显著差异,均在
3100 —3300 μm之间. 这一结果说明,本研究中斑马鱼幼鱼的体长指标是相对稳定的,不会显著影响成功孵化的健康斑马鱼幼鱼的体长.综上可知,Cr(Ⅵ)显著延迟斑马鱼胚胎的孵化时间,且可通过造成胚胎无法孵化,降低了斑马鱼胚胎的存活率,但对其体长发育无显著影响. 而PS微塑料可以放大Cr(Ⅵ)的这种发育毒性,且影响程度与Cr(Ⅵ)的浓度呈相关性,即PS微塑料对Cr(Ⅵ)的毒性具有增强效应[19].
-
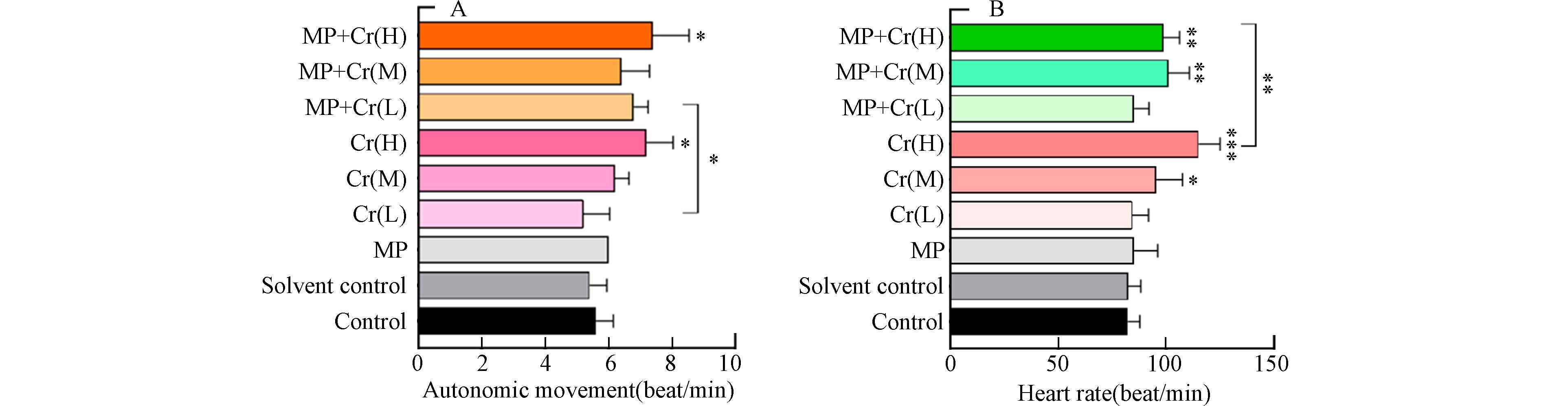
斑马鱼胚胎24 h自主运动频率易受温度、紫外线、抗生素和重金属等外界因素刺激,常用于表征斑马鱼的早期行为[22]. 各组斑马鱼胚胎在24 h时的自主运动情况(1 min)如图4A所示,Cr(H)与MP+Cr(H)两组的胚胎24 h自主运动显著高于其他各组,由此可以推测,高浓度的Cr(Ⅵ)会作为一种外界刺激促进胚胎的自主运动. 尽管PS微塑料的单独刺激未显著影响胚胎的自主运动,但对于Cr(Ⅵ)低浓度组,PS微塑料的存在提高了Cr(Ⅵ)对胚胎自主运动频率的刺激. PS微塑料作为能够接触到胚胎卵黄膜的颗粒物,可能通过物理接触对胚胎施加额外的刺激[12],增强Cr(Ⅵ)对24 h自主运动频率的影响. 在中浓度与高浓度组中,PS微塑料没有显示出此种可能存在的毒性增强效应.
各组斑马鱼幼鱼在72 h时的心率(1 min)如图4B所示,与对照组相比,MP组、Cr(L)组和MP+Cr(L)组的心率无显著变化,而Cr(M)组、Cr(H)组、MP+Cr(M)组和MP+Cr(H)组的心率则显著偏高. 其中,Cr(H)组偏高的程度最显著,该组幼鱼的心率也显著高于与之Cr(Ⅵ)浓度相同的MP+Cr(H)组. 这一结果说明Cr(Ⅵ)会威胁斑马鱼幼鱼的心血管健康,使之心率过速. 其中,这一效应在单独暴露于高浓度Cr(H)组中表现得最为明显. 这一结果与死亡率的结果比较相似,这可能是因为PS微塑料吸附重金属Cr(Ⅵ)进入斑马鱼体内后,引发了心脏附近较强烈的氧化应激反应,表现为心率加快,致使心脏附近产生的ROS无法及时清除而产生堆积,从而产生细胞损伤并进一步引发细胞凋亡,导致斑马鱼死亡. 在高浓度的Cr(Ⅵ)组中,微塑料的吸附位点可能已经饱和,减少了斑马鱼对重金属Cr(Ⅵ)的摄入,从而减弱了重金属Cr(Ⅵ)的毒性.
-
实验周期内每日观察的斑马鱼形态,其正常形态图像及畸形形态图像如图5所示,培养3 d后,随着斑马鱼胚胎发育程度升高与破膜游动的个体数逐渐增加,各类畸形个体也逐渐出现. 畸形类型包括发育异常、心包膜水肿、卵黄囊水肿、尾部畸形和身体弯曲等.
心包膜水肿与斑马鱼的内皮血管渗漏相关,常导致斑马鱼的心跳频率异常或心律不齐,而卵黄囊的异常发育可能导致斑马鱼胚胎的营养供应受损. 发育后期常出现多发性水肿,如心包膜水肿伴卵黄囊水肿,多发性水肿常伴随着斑马鱼眼部与鳍的异常发育,且最终常导致畸形个体的死亡. 尾部的螺旋畸形、钩状畸形或弯折畸形则会导致幼鱼游动能力与平衡能力的下降. 尽管对照组存在个别发育异常的偶然个体,畸形个体主要集中在体系中含Cr(Ⅵ)的暴露组中,且在各个浓度组均有分布. 有文献显示Cr(Ⅵ)会导致斑马鱼胚胎出现尾部钩状畸形、身体螺旋扭曲、中段90°弯折、器官缺少与水肿等畸形类型[20],这说明Cr(Ⅵ)的存在是畸形多发的重要诱因. Cr(Ⅵ)是一种显著的斑马鱼致畸原,主要影响斑马鱼胚胎的骨形成,可造成斑马鱼其他组织的畸形. 而这些发育异常可归因于Cr(Ⅵ)对DNA合成作用的抑制,进而导致对斑马鱼胚胎发育至关重要的基质金属蛋白酶(MMPs)调节失调[20].
整个实验周期内斑马鱼胚胎及幼鱼的累计畸形率如图5内插图所示,Cr(H)组的累计畸形率显著高于其他各组,有研究证明较高浓度的Cr(Ⅵ)会提高斑马鱼脊柱畸形、心包水肿与卵黄囊水肿的发生率,这一结果与本研究相符[20-21]. 该组的高畸形率很大程度上与其低孵化率相关,即高浓度Cr(Ⅵ)导致部分胚胎发育延迟,而发育延迟本身就是发育不良的一种体现,这些胚胎也就更容易发生发育异常畸形. Cr(H)组中的部分胚胎发育严重不良,始终未能破膜游动且畸形程度日益提高,而另一部分胚胎则可能因发育时间的延长而在破膜后出现折尾、尾部弯曲和身体弯曲等畸形现象. 值得注意的是,斑马鱼幼鱼的心率升高也可能与畸形率相关. Cr(H)组的累计畸形率最高,畸形类型也相对较高,其中就包括了相对较高的心包膜水肿畸形率,与斑马鱼内皮血管渗漏相关,心包膜水肿又常会导致斑马鱼的心跳频率异常,而Cr(H)组较高的心率则正是心跳异常的表现.与Cr(H)组一样具有高浓度Cr(Ⅵ)的MP+Cr(H)组相对于无MP存在时畸形率显著下降,可能PS微塑料对斑马鱼胚胎并无明显致畸毒性,反而能够通过降低卵黄膜水相暴露于Cr(Ⅵ)的程度或通过吸附Cr(Ⅵ)来降低Cr(Ⅵ)的致畸毒性[23].
-
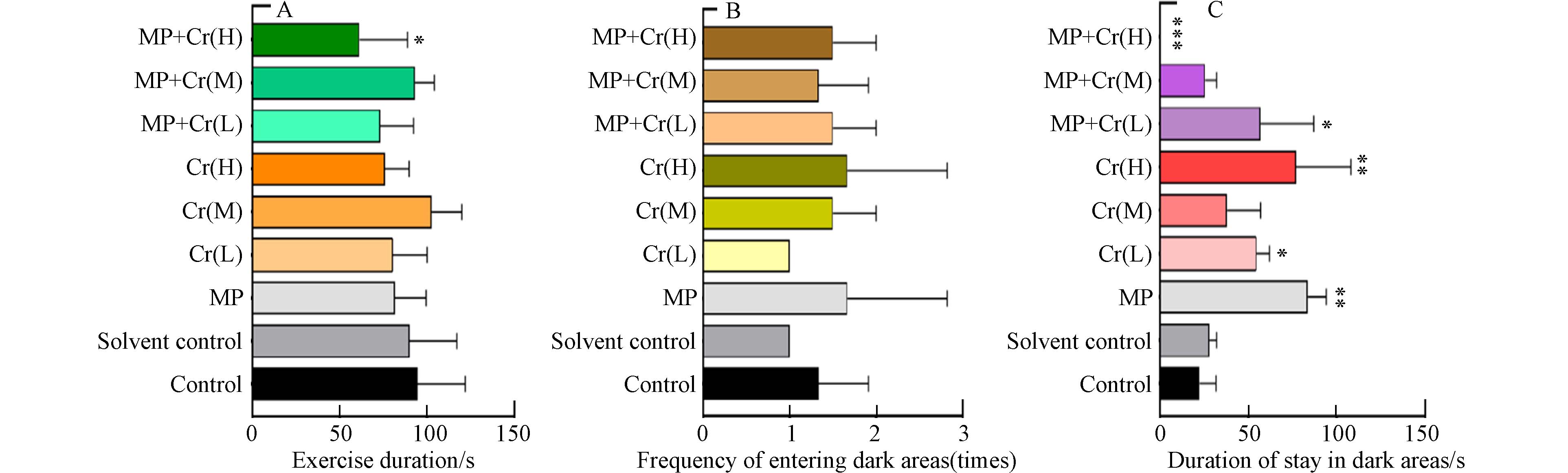
本研究挑选身体无畸形、能够自由游动并有积极躲避行为的暴露7 d的健康个体进行实验来观察斑马鱼的行为情况. 斑马鱼幼鱼在10 min内的运动时长如图6A所示,各组的平均运动时长分布在50—100 s之间. 除MP+Cr(H)组外,各组的斑马鱼幼鱼运动时长结果并无显著差异,这说明低中浓度下Cr(Ⅵ)和PS微塑料在运动时长这一指标方面对斑马鱼幼鱼并无明显的行为学毒性影响. 高浓度Cr(Ⅵ)和PS微塑料复合暴露时,对斑马鱼幼鱼的运动时长具有显著抑制作用.
斑马鱼游动进入黑暗区域频率降低、在黑暗区域游动距离与停留时间减少的现象被称为避暗行为,是斑马鱼出现焦虑样行为的表现之一[23]. 10 min内斑马鱼幼鱼进入黑暗区域的频率如图6B所示,各组的斑马鱼幼鱼进入黑暗区域的频率并无显著差异,这说明Cr(Ⅵ)和PS微塑料单一或复合暴露对斑马鱼幼鱼在黑暗区域的进入频率方面对斑马鱼幼鱼并无明显的行为学毒性影响. 但两者暴露或复合暴露显著改变了斑马鱼幼鱼在黑暗区域的停留时长(图6C),在MP组、Cr(L)组、Cr(H)组和MP+Cr(L)组中,斑马鱼幼鱼在黑暗区域的停留时间显著延长,而在MP+Cr(H)组显著下降.
由此可知,当Cr(Ⅵ)单独或与微塑料共存时,将不同程度地改变斑马鱼幼鱼的行为活动,当其浓度升高为6 mg·L−1,并与微塑料共存时,将造成斑马鱼幼鱼出现焦虑样行为. 已有研究表明,重金属Cr(Ⅵ)可诱发斑马鱼幼鱼产生行为学变化,出现焦虑样表现[21],而微塑料与其共存时,一定程度加重了幼鱼的焦虑样行为,因此,微塑料进入水体环境后,其与重金属对水生生物的联合毒性需引起重视.
-
本实验探究了PS微塑料存在下六价铬对斑马鱼胚胎的发育毒性及对幼鱼的行为学干扰,得到以下主要结论:0.5 mg·L−1PS微塑料存在下增强了Cr(Ⅵ)对斑马鱼胚胎的致死毒性、发育毒性和致畸毒性,这可能是由于PS微塑料具有较多的吸附位点,吸附Cr(Ⅵ)之后在斑马鱼胚胎内富集,从而增加了Cr(Ⅵ)的毒性效应;在行为学方面,PS微塑料和Cr(Ⅵ)联合暴露显著降低了其运动时长并改变其在黑暗区域停留时长,表现出一定的焦虑加重现象. 由此可知,PS微塑料确实能改变以六价铬为例的重金属对水生生物斑马鱼的毒性作用,这一结论说明微塑料这种在海洋和淡水环境中随处可见的颗粒污染物已经成为不可忽视的因素,为Cr(Ⅵ)与微塑料的生物毒性研究提供了科学依据.
聚苯乙烯微塑料和重金属铬对斑马鱼胚胎发育的联合毒性效应
Combined toxic effects of polystyrene microplastics and heavy metal chromium on embryonic development of zebrafish
-
摘要: 六价铬(Cr(Ⅵ))和塑料制品的大量应用,导致其广泛分布于周围环境中,对生态平衡造成了严重威胁, 但是对二者之间的联合毒性研究相对较少. 本研究采用斑马鱼胚胎作为受试生物,探究聚苯乙烯(PS)微塑料与六价铬共存时,对斑马鱼胚胎发育的干扰作用. 基于相关文献记载的环境微塑料浓度与Cr(Ⅵ)浓度制定了联合毒性实验方案,并对相关的生长发育及行为指标进行了分析,得出以下结论. 在PS微塑料的暴露浓度为0.5 mg·L−1的情况下,PS微塑料对Cr(Ⅵ)的斑马鱼胚胎毒性作用有一定程度的影响. PS微塑料增强了Cr(Ⅵ)对斑马鱼胚胎的致死毒性、发育毒性和致畸毒性,这可能是由于PS微塑料具有较多的吸附位点,吸附Cr(Ⅵ)之后在斑马鱼胚胎内富集,从而增加了Cr(Ⅵ)的毒性效应. PS微塑料和Cr(Ⅵ)联合暴露并未对斑马鱼幼鱼表现出明显的游泳行为干扰. 本研究证明了PS微塑料在水体环境中的存在改变了以铬为例的重金属对水生生物的毒性作用,为评估微塑料与重金属铬共存时的环境风险提供了参考.Abstract: The extensive utilization of hexavalent chromium (Cr(Ⅵ)) and plastic products, combined with the action of natural environment, has resulted in their ubiquitous presence in the surrounding environment, posing a grave risk to ecological equilibrium. However, there is relatively limited research on their combined toxicity. In this study, zebrafish embryos were used as test organisms to investigate the disruptive effects of coexistence between polystyrene (PS) microplastics and Cr(Ⅵ) on zebrafish embryonic development. Based on the concentrations of environmental microplastics and Cr(Ⅵ) reported in relevant literatures, a joint toxicity experiment plan was formulated, and relevant growth, development and behavioral indicators of zebrafish embryos were analyzed. The results showed that 0.5 mg·L−1 of PS microplastics have a certain degree of impact on the toxic effect of Cr(Ⅵ) on zebrafish embryos, enhancing the lethal toxicity, developmental toxicity, and teratogenicity of hexavalent chromium on zebrafish embryos. This might be attributed to the abundant adsorption sites of PS microplastics, which allow the accumulation of Cr(Ⅵ) within zebrafish embryos, thereby amplifying its toxic effects. The combined exposure of zebrafish larvae to PS and Cr(Ⅵ) did not induce noticeable disturbances in their swimming behavior. This study demonstrates that the presence of PS microplastics in aquatic environments alters the toxic effects of heavy metals, such as Cr(Ⅵ), on aquatic organisms, providing insights for assessing the environmental risks associated with coexistence of microplastics and chromium.
-
Key words:
- heavy metals /
- microplastic /
- combined toxicity /
- zebrafish embryos /
- development and behavior.
-
表 1 Cr(Ⅵ)单独暴露和Cr(Ⅵ)与微塑料联合暴露组别及浓度
Table 1. Groups and concentration of Cr(Ⅵ) single exposure and Cr(Ⅵ) combined exposure with microplastics
序号Serial number 组别Group DMSO/% MP浓度/(mg·L−1)MP concentration Cr(Ⅵ)浓度/(mg·L−1)Cr(Ⅵ) concentration 1 Control 0 0 0 2 Solvent control 0.001 0 0 3 MP 0.001 0.5 0 4 Cr(L) 0.001 0 0.1 5 Cr(M) 0.001 0 0.6 6 Cr(H) 0.001 0 6 7 MP+Cr(L) 0.001 0.5 0.1 8 MP+Cr(M) 0.001 0.5 0.6 9 MP+Cr(H) 0.001 0.5 6 -
[1] VAREDA J P, VALENTE A J M, DURÃES L. Assessment of heavy metal pollution from anthropogenic activities and remediation strategies: A review[J]. Journal of Environmental Management, 2019, 246: 101-118. doi: 10.1016/j.jenvman.2019.05.126 [2] VUTUKURU S S. Acute effects of hexavalent chromium on survival, oxygen consumption, hematological parameters and some biochemical profiles of the Indian major carp, Labeo rohita[J]. International Journal of Environmental Research and Public Health, 2005, 2(3/4): 456-462. [3] XU S, MA J, JI R, et al. Microplastics in aquatic environments: Occurrence, accumulation, and biological effects[J]. Science of the Total Environment, 2020, 703: 134699. doi: 10.1016/j.scitotenv.2019.134699 [4] ZHENG Y F, LI J X, CAO W, et al. Distribution characteristics of microplastics in the seawater and sediment: A case study in Jiaozhou Bay, China[J]. Science of the Total Environment, 2019, 674: 27-35. doi: 10.1016/j.scitotenv.2019.04.008 [5] ZHU X, HUANG W, FANG M Z, et al. Airborne microplastic concentrations in five megacities of northern and southeast China[J]. Environmental Science & Technology, 2021, 55(19): 12871-12881. [6] LIU M T, LU S B, SONG Y, et al. Microplastic and mesoplastic pollution in farmland soils in suburbs of Shanghai, China[J]. Environmental Pollution, 2018, 242: 855-862. doi: 10.1016/j.envpol.2018.07.051 [7] ZHANG W W, ZHANG S F, WANG J Y, et al. Microplastic pollution in the surface waters of the Bohai Sea, China[J]. Environmental Pollution, 2017, 231: 541-548. doi: 10.1016/j.envpol.2017.08.058 [8] ZHU L, BAI H Y, CHEN B J, et al. Microplastic pollution in North Yellow Sea, China: Observations on occurrence, distribution and identification[J]. Science of the Total Environment, 2018, 636: 20-29. doi: 10.1016/j.scitotenv.2018.04.182 [9] ZHAO S Y, ZHU L X, LI D J. Microplastic in three urban estuaries, China[J]. Environmental Pollution, 2015, 206: 597-604. doi: 10.1016/j.envpol.2015.08.027 [10] SU L, XUE Y G, LI L Y, et al. Microplastics in Taihu Lake, China[J]. Environmental Pollution, 2016, 216: 711-719. doi: 10.1016/j.envpol.2016.06.036 [11] CHEN G L, FENG Q Y, WANG J. Mini-review of microplastics in the atmosphere and their risks to humans[J]. Science of the Total Environment, 2020, 703: 135504. doi: 10.1016/j.scitotenv.2019.135504 [12] WONG J K H, LEE K K, TANG K H D, et al. Microplastics in the freshwater and terrestrial environments: Prevalence, fates, impacts and sustainable solutions[J]. Science of the Total Environment, 2020, 719: 137512. doi: 10.1016/j.scitotenv.2020.137512 [13] ESMAEILBEIGI M, KAZEMI A, GHOLIZADEH M, et al. Microplastics and heavy metals contamination in Atropus atropos and associated health risk assessment in the northwest of the Persian Gulf, Iran[J]. Regional Studies in Marine Science, 2023, 57: 102750. doi: 10.1016/j.rsma.2022.102750 [14] 廖苑辰, 王倩, 蒋小峰, 等. 聚苯乙烯微塑料和重金属镉对蚯蚓的联合毒性效应[J]. 生态毒理学报, 2022, 17(2): 216-226. LIAO Y C, WANG Q, JIANG X F, et al. Combined toxic effects of polystyrene microplastics and cadmium on earthworms[J]. Asian Journal of Ecotoxicology, 2022, 17(2): 216-226 (in Chinese).
[15] 石岩松, 王婧, 崔文杰, 等. 不同形态微塑料和汞对斑马鱼胚胎发育毒性联合作用研究[J]. 中国环境科学, 2023, 43(4): 1978-1984. SHI Y S, WANG J, CUI W J, et al. The combined development toxicity of microplastics with different shapes and mercury on Zebrafish embryos[J]. China Environmental Science, 2023, 43(4): 1978-1984 (in Chinese).
[16] SANTOS D, LUZIO A, FÉLIX L, et al. Microplastics and copper induce apoptosis, alter neurocircuits, and cause behavioral changes in zebrafish (Danio rerio) brain[J]. Ecotoxicology and Environmental Safety, 2022, 242: 113926. doi: 10.1016/j.ecoenv.2022.113926 [17] WANG H D, WANG Y Q, WANG Q N, et al. The combined toxic effects of polyvinyl chloride microplastics and di(2-ethylhexyl) phthalate on the juvenile zebrafish (Danio rerio)[J]. Journal of Hazardous Materials, 2022, 440: 129711. doi: 10.1016/j.jhazmat.2022.129711 [18] PRATA J C, Da COSTA J P, LOPES I, et al. A One Health perspective of the impacts of microplastics on animal, human and environmental health[J]. Science of the Total Environment, 2021, 777: 146094. doi: 10.1016/j.scitotenv.2021.146094 [19] GODOY V, BLÁZQUEZ G, CALERO M, et al. The potential of microplastics as carriers of metals[J]. Environmental Pollution, 2019, 255: 113363. doi: 10.1016/j.envpol.2019.113363 [20] SÁNCHEZ-OLIVARES M A, GAYTÁN-OYARZUN J C, MARTÍNEZ A J, et al. Toxicity and teratogenicity in zebrafish Danio rerio embryos exposed to chromium[J]. Latin American Journal of Aquatic Research, 2021, 49(2): 289-298. doi: 10.3856/vol49-issue2-fulltext-2561 [21] XU Y W, WANG L, ZHU J, et al. Chromium induced neurotoxicity by altering metabolism in zebrafish larvae[J]. Ecotoxicology and Environmental Safety, 2021, 228: 112983. doi: 10.1016/j.ecoenv.2021.112983 [22] 罗紫蝶, 郭少娟, 曾晨, 等. 镉暴露对斑马鱼胚胎发育的毒性效应研究[J]. 环境科学研究, 2022, 35(5): 1315-1322. LUO Z D, GUO S J, ZENG C, et al. Toxic effects of cadmium exposure on zebrafish embryo development[J]. Research of Environmental Sciences, 2022, 35(5): 1315-1322 (in Chinese).
[23] SARASAMMA S, AUDIRA G, JUNIARDI S, et al. Evaluation of the effects of carbon 60 nanoparticle exposure to adult zebrafish: A behavioral and biochemical approach to elucidate the mechanism of toxicity[J]. International Journal of Molecular Sciences, 2018, 19(12): 3853. doi: 10.3390/ijms19123853 -





 下载:
下载: