-
重金属是一类典型的环境污染物,广泛存在于土壤、淡水、空气等环境介质中,通过食物、饮水和吸烟等途径暴露后可在肝、脑、肾、心脏等重要器官中富集并长久滞留[1]. 目前,有关重金属毒性效应的研究已成为环境毒理学的重要组成部分,包括血液毒性、心血管疾病、神经毒性、肾毒性、癌症等[2]. 其中,重金属与免疫系统的相互作用可对人体健康产生不利影响,导致自身免疫性疾病和各种癌症的风险增加[3]. 有研究表明,重金属砷(As)、镉(Cd)和铅(Pb)可以上调特定炎症介质和标志物的表达,从而改变淋巴细胞功能,促进细胞因子和免疫球蛋白的产生[3]. 树突状细胞(Dendritic cell, DC)作为主要的抗原呈递细胞之一,在肿瘤微环境中发挥着免疫调控作用. 已有研究发现,As可以通过下调骨髓源性树突状细胞(Bone marrow-derived dendritic cell, BMDC)活化分子、促炎因子和T淋巴细胞辅助因子的表达进而引起免疫耐受反应[4]. Cd通过下调活化分子MHC II和CD40的表达,抑制IL-12p70的分泌进而抑制BMDC细胞的成熟[5]. Pb则可抑制BMDC细胞的发育,但同时又促进细胞分泌大量促炎因子,从而引起强烈的促炎反应[6 − 7]. 重金属是否影响DC细胞的吞噬、改变其抗原结合功能,尚不清楚;同时,不同重金属之间对DC细胞的毒性和功能影响存在怎样的差异,也亟需探讨.
本研究通过Alamar blue法测定BMDC细胞的活性,采用活性氧(Reactive oxygen species, ROS)和丙二醛检测试剂盒检测细胞膜的通透性,并利用流式细胞术检测BMDC细胞的凋亡、活化、吞噬以及抗原结合能力,最后通过荧光定量PCR检测BMDC细胞促炎/抗炎细胞因子的胞内表达水平. 结果表明,不同重金属对树突状细胞的功能改变存在差异.
-
C57BL/6N雌性小鼠(7周龄,体重20-23 g)购自北京维通利华有限公司(中国北京). 所用仪器包括多功能酶标仪(美国ThermoFisher Scientific)、流式细胞仪(美国ThermoFisher Scientific)、全自动荧光细胞计数仪(美国Celldrop)、荧光定量PCR仪(美国伯乐)、超微量分光光度计(美国DeNovix)和倒置显微镜(德国卡尔蔡司).
所用试剂括亚砷酸钠(NaAsO2,美国Sigma-Aldrich)、氯化镉(CdCl2,美国Sigma-Aldrich)、醋酸铅(Pb (CH3CO2)4,美国Sigma-Aldrich)、Alamar blue(美国Sigma-Aldrich)、红细胞裂解液(中国索莱宝)、小鼠细胞生长因子GM-CSF(美国MCE)、小鼠细胞生长因子IL-4(美国MCE)、FITC-dextran(美国Sigma-Aldrich)、OVA 257-264(中国强耀生物)、LPS(中国索莱宝)、MDA检测试剂盒(中国南京建成)和ROS检测试剂盒(中国碧云天). 小鼠流式抗体CD11c(APC)、H-2Kb(Brilliant Violet 421TM )、CD11c(APC/Cyanine7)、CD40(PE)、CD83(PE/Cyanine7)和CD86(APC)购自美国Biolegend公司,I-A/I-E (Super Bright 702)和H2Kb SINNFEKL(PE)购自赛默飞公司,CD16/32 [2.4G2]购自美国Elabscience公司.
-
首先,根据前人报道的方法,制备并培养骨髓来源的BMDC细胞[8]:用PBS将小鼠股骨和胫骨的骨髓细胞冲出后,经70 μm细胞筛过滤后,利用红细胞裂解液裂解其中的红细胞,随后将收集的剩余细胞铺于孔板中,用含20 ng·mL−1 GM-CSF、10 ng·mL−1 IL-4、10% 胎牛血清的RPMI 1640培养基重悬,在37 ℃、5% CO2培养箱中培养6 d,其中,在第3天时用新鲜的培养基进行半量换液,在第6天时重新铺板,从而得到实验所需BMDC细胞.
-
将培养第6天的BMDC细胞重新铺于96孔板中,培养24 h后,设置阴性对照组、As处理组(0.5、1、2、5、10、20 μmol·L−1 NaAsO2)、Cd处理组(0.5、1、2、5、10、20 μmol·L−1 CdCl2)、Pb处理组(5、10、20、50、100、200 μmol·L−1 Pb(CH3CO2)4),每组5个平行. 处理6、12、24 h后,更换100 μL新鲜的培养基,每孔加入4:1000(体积比)的Alamar blue染液,继续培养2 h后,在激发光530 nm、发射光590 nm条件下测量荧光值. 每个孔中BMDC细胞的存活率以对照组的百分比表示.
收集BMDC细胞并制备为单细胞悬液,采用凋亡检测试剂盒(中国ABclonal)区分早期凋亡和晚期凋亡细胞. 根据制造商的说明书,将5 μL PI和5 μL AnnexinV-FITC加入到100 μL含 1×104个细胞的缓冲液中,室温避光孵育15 min后加入400 μL 缓冲液终止染色,并在1 h内进行流式细胞术分析. PIlow和AnnexinVhigh细胞为早期凋亡细胞、PIhigh和AnnexinVhigh细胞为晚期凋亡细胞.
-
根据制造商的说明书(中国思科捷)对BMDC细胞进行DCFH-DA探针的装载,随后加入重金属或阳性对照Rosup对细胞进行刺激. 分别在第5 min、15 min、30 min、1 h、3 h、6 h取出细胞,使用488 nm激发波长,525 nm发射波长检测刺激前后荧光的强弱.
重金属处理BMDC细胞后,收集细胞并进行裂解,根据制造商说明书(南京建成)使BMDC细胞中的MDA与工作液充分反应,使用530 nm吸光度检测OD值,同时检测样本蛋白浓度,通过以下计算公式计算MDA含量(按每克蛋白算):
式中,C标准:标准品浓度,10 nmol·mL−1,Cpr:样本蛋白浓度,mg·mL−1.
-
在存在或不存在重金属As、Cd和Pb的情况下,用250 ng·mL−1脂多糖(Lipopolysaccharides, LPS)处理细胞24 h,LPS作为激活剂可诱导BMDC细胞的成熟. 为了确定BMDC细胞成熟活化相关表面标记物的表达,收集BMDC细胞并制备单细胞悬液后利用荧光染料偶联抗体进行流式细胞术分析:在4 °C下用封闭液CD16/32封闭15 min后进行离心,重悬后在4 °C下用CD11c- APC/Cyanine7、MHC II-Super Bright 702、CD40-PE、CD83-PE/Cyanine7和CD86-APC避光染色30 min;染色结束后,用PBS清洗一遍并重悬细胞,将得到的单细胞用流式细胞仪收集并通过FlowJo_V10软件分析数据.
-
BMDC细胞的吞噬能力通过荧光素结合葡聚糖(FITC-dextran)的摄取实验进行检测:在重金属As、Cd和Pb处理后,收集细胞并制备含1×106个细胞的单细胞悬液,在4 °C或37 °C下用1 mg·mL−1的FITC-dextran处理1 h,处理结束后将细胞用含0.1% BSA的预冷PBS清洗5次,之后通过流式细胞术测量细胞的荧光强度.
BMDC细胞的抗原结合能力通过对多肽OVA257-264的识别和结合进行检测:在重金属As、Cd、Pb处理BMDC细胞后,更换新鲜培养基,加入10 μg·mL−1 OVA257-264暴露12 h;收集细胞并制备单细胞悬液,在4 °C下用封闭液CD16/32封闭15 min后离心,重悬后在4 °C下进行CD11c-APC、H-2Kb-Brilliant Violet 421TM 和H2Kb SINNFEKL-PE抗体避光染色30 min,染色结束后用PBS清洗一遍并重悬细胞,通过流式细胞仪检测BMDC细胞表面OVA-peptide信号.
-
在本实验中,使用LPS作为激活剂来诱导BMDC细胞的成熟与活化:在存在或不存在重金属As、Cd和Pb的情况下,用250 ng·mL−1 LPS处理细胞6 h后收集BMDC细胞,根据制造商的说明书(中国思科捷),使用RNA快速提取试剂盒从BMDC细胞中提取总RNA;之后采用超微量分光光度计检测RNA浓度并计算反转录所需的体积,按照制造商的说明书(莫纳生物),使用逆转录混合液对提取的RNA进行反转录得到cDNA;最后在qRT-PCR仪器(Bio-Rad)上使用SYBR Green qPCR混合物测定Th1和Th2型细胞因子的基因表达. 表1中列出了用于12种细胞因子检测的PCR引物.
-
使用GraphPad Prism 8.0.2软件进行数据统计分析,使用t检验、单因素方差分析和多因素方差分析进行组间比较,当P < 0.05时具有统计学意义.
-
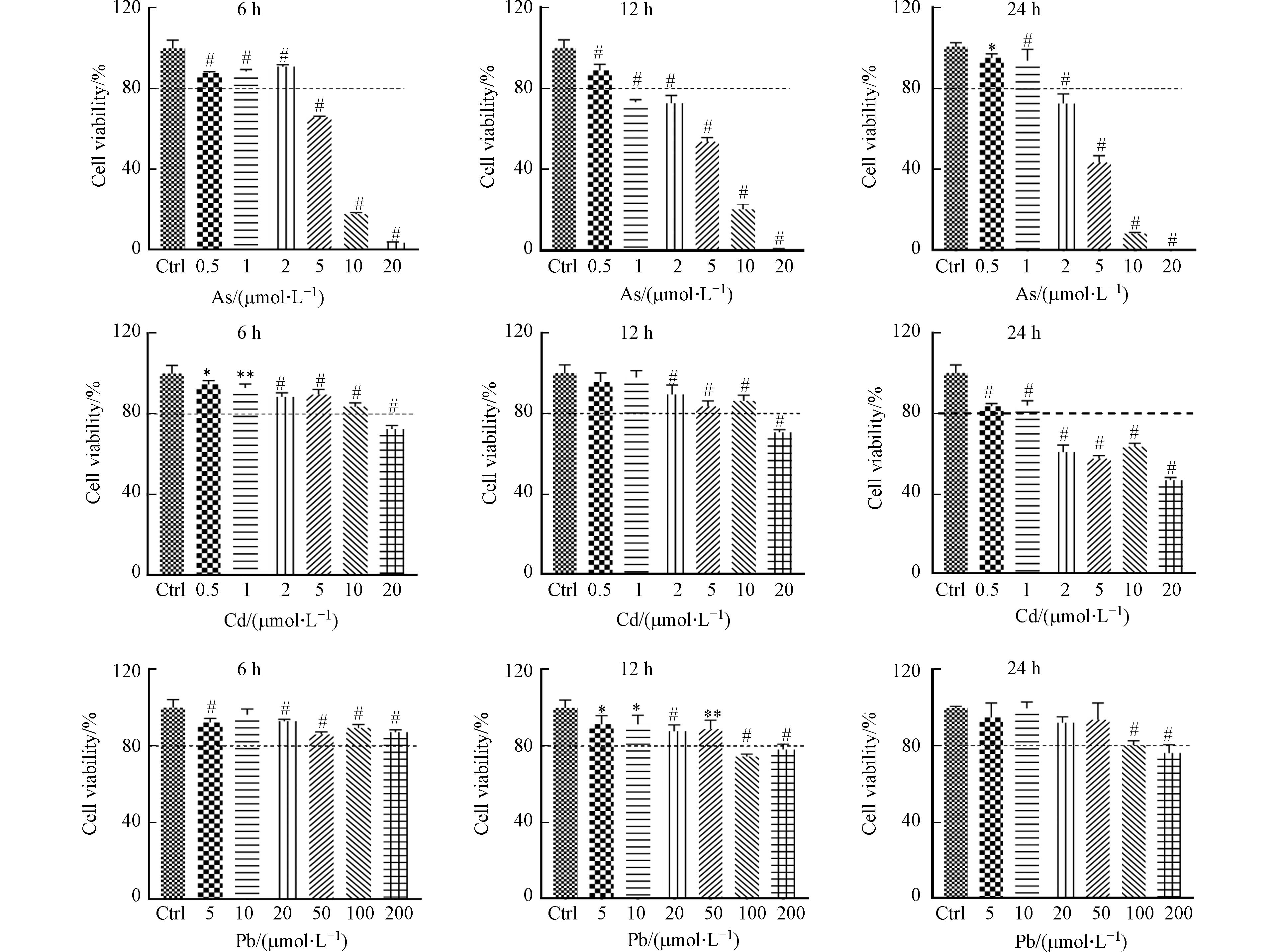
本研究中,首先检测了重金属对DC细胞的活力影响. 不同浓度As、Cd和Pb刺激BMDC细胞6、12、24 h后,通过Alamar blue法对细胞活力的分析发现,与对照组相比,3种重金属均抑制BMDC细胞的活力,且随着重金属浓度增加或处理时间延长,细胞活力逐渐减弱,呈现一定的浓度和时间依赖性(图1). 以12 h为例,观察到BMDC细胞在0.5 μmol·L−1和2 μmol·L−1的As处理、2 μmol·L−1和20 μmol·L−1的Cd处理以及20 μmol·L−1和100 μmol·L−1的Pb处理条件下,均出现20%细胞活力损失的分界线(图1). 前人研究发现高浓度的As、Cd和Pb暴露可引起免疫细胞细胞活力的显著下降[5, 9 − 10]. 在本研究中,进一步发现BMDC细胞对As、Cd、Pb等3种重金属的耐受能力不同,其中,低浓度的As即可引起细胞发生明显死亡. 因此,在下面的研究中,选用0.5、2 μmol·L−1的As,2、20 μmol·L−1的Cd以及20、100 μmol·L−1的Pb,并处理12 h作为暴露条件,考察重金属对BMDC细胞的活化和功能影响.
-
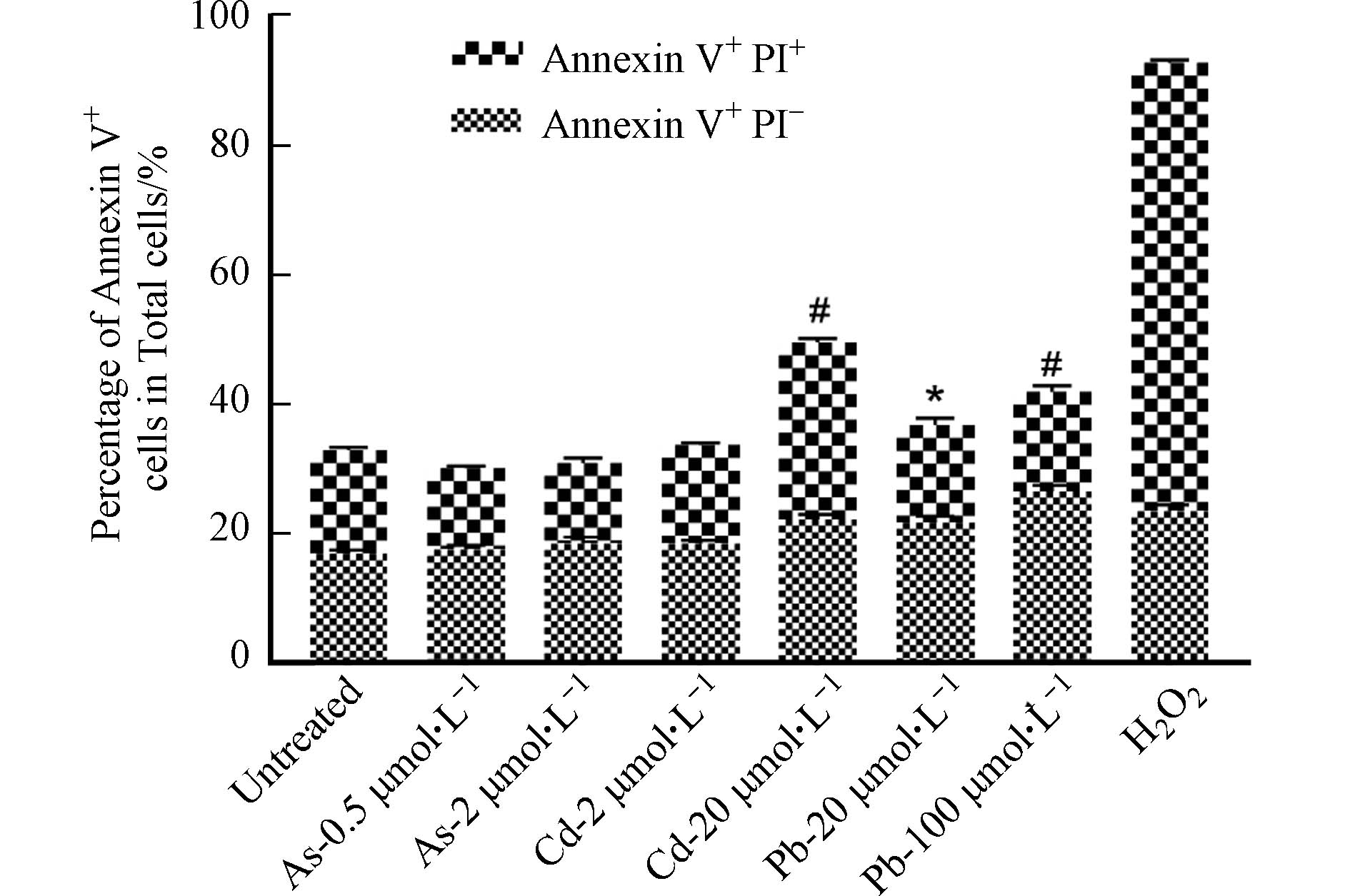
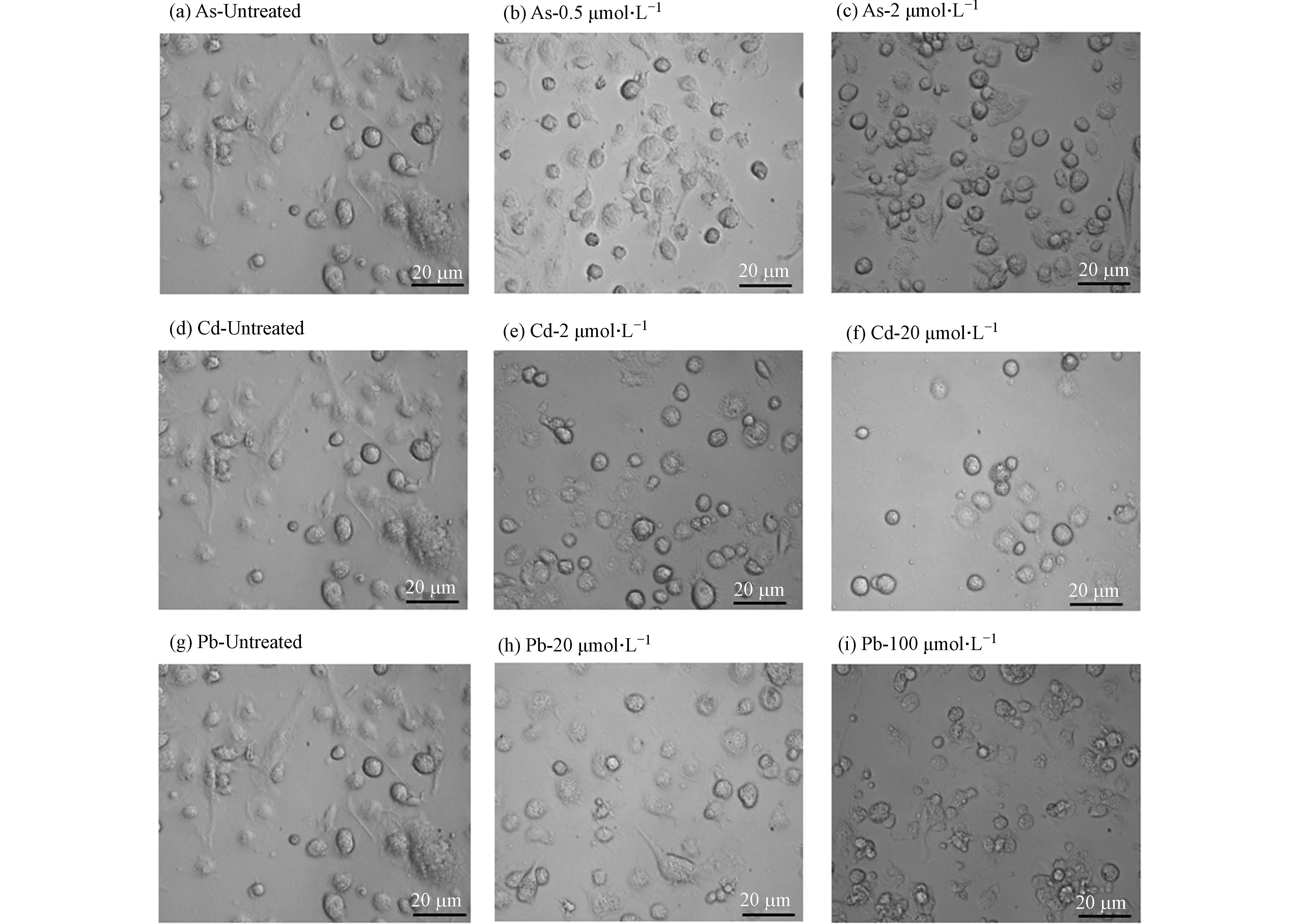
形态学观察发现,高、低浓度的As、Cd和Pb处理均可引发BMDC细胞突触结构减少,细胞失去正常的树突状形态,同时贴壁能力下降(图2). 形态学的改变往往与细胞存活或功能改变密切相关. 有研究表明,细胞受到重金属刺激后会发生氧化应激,同时激活多种死亡方式,如自噬、凋亡、坏死和铁死亡[11]. 因此,采用凋亡检测试剂盒检测其中最常见的细胞死亡——细胞凋亡的发生情况. 如图3所示,与对照组相比,0.5 μmol·L−1和2 μmol·L−1 As未引起细胞发生明显的凋亡,然而,20 μmol·L−1 Cd以及20、100 μmol·L−1 Pb暴露后细胞发生凋亡的比例均显著升高,其中,Cd主要引起细胞发生晚期凋亡,而Pb导致细胞发生早期凋亡. 这些结果表明,不同重金属可激活BMDC细胞不同的死亡方式.
-
DC细胞活化的主要标志包括主要组织相容性复合体(Major histocompatibility complex, MHC)(如MHC I和MHC II)的表达、共刺激和激活分子(如CD40、CD80、CD86)的上调、细胞因子(如IL-12、IL-6、TNF-α)的分泌增多以及吞噬抗原的能力增强[12 − 13]. 对经不同浓度重金属预处理12 h后的BMDC细胞,采用经典的活化手段——LPS刺激,研究重金属对BMDC细胞活化的影响. 与前面未经LPS刺激条件下的形态学改变结果相似,与对照组相比,重金属处理并经LPS活化的BMDC细胞,其贴壁细胞数目及典型的突触结构减少(图4).
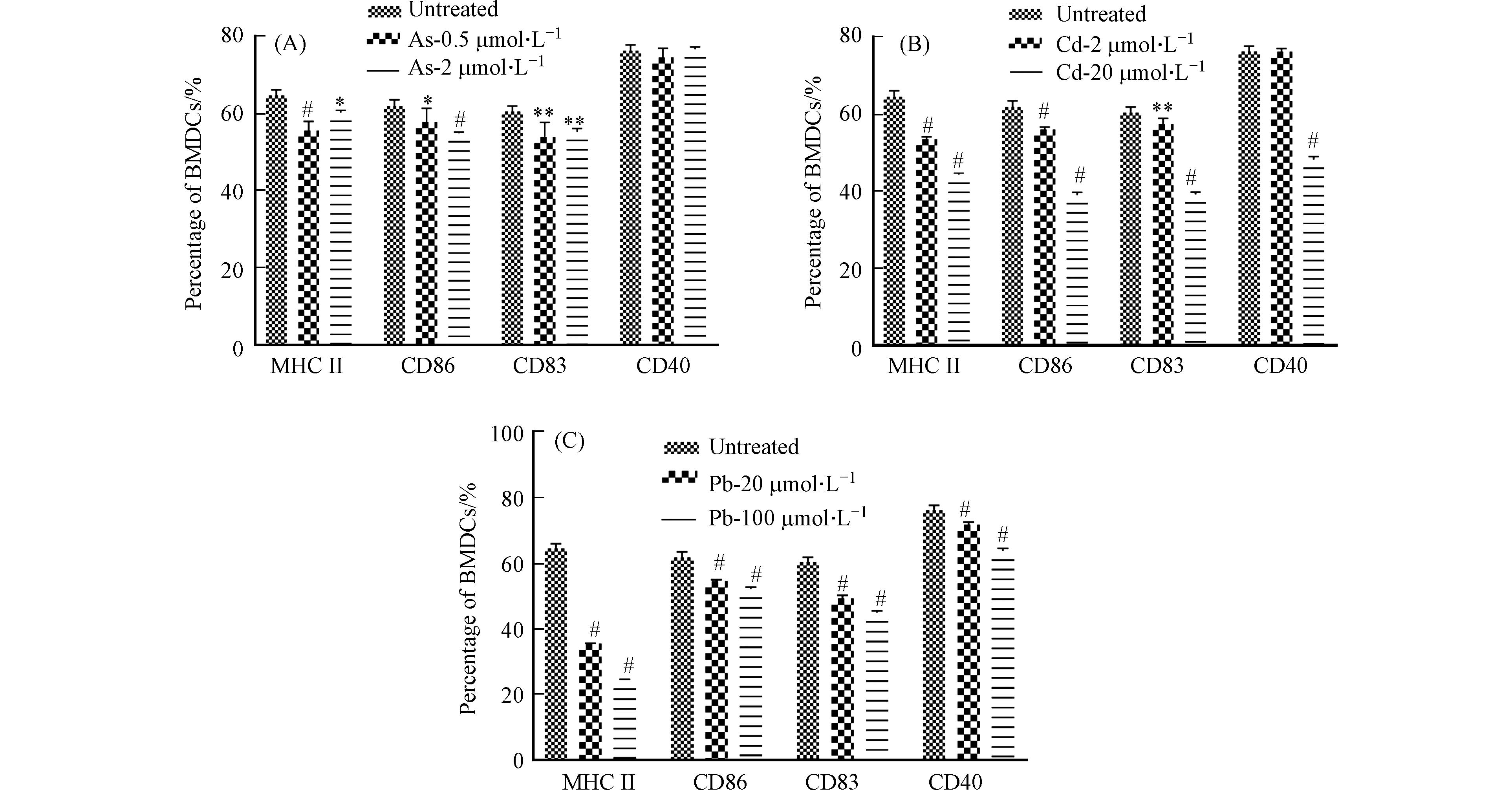
收集细胞并流式细胞术分析细胞的活化情况,即MHC II和共刺激分子CD86、CD83和CD40的表达情况. 结果发现,Cd和Pb处理组与对照组相比,浓度越高,细胞共刺激分子及MHC II表达越低. As处理组共刺激分子CD40无明显变化,CD86、CD83和MHC II表达降低(图5).
作为BMDC细胞的活化分子,MHC分子最主要的功能是参与抗原呈递,其中MHC I类分子介导的是内源性抗原的提呈过程,它们将内源性抗原片段提呈至细胞毒性T淋巴细胞;MHC II类分子则介导外源性抗原的提呈过程,它们提呈外源性抗原多肽分子至Th细胞[14]. 除此之外,BMDC细胞表面的B7蛋白(CD80和CD86)也可通过与T细胞表面的受体CD28或C2TLA4结合活化T细胞. CD40作为BMDC细胞的表面标记物,在T细胞活化及细胞因子的分泌过程中起重要的调节作用[15]. 已有研究发现,As可以下调LPS刺激的BMDC细胞的表型分子,Cd通过抑制关键表面分子MHC II和CD40的表达来抑制BMDC的成熟[4 − 5]. 这与本研究结果相似,表明重金属可抑制细胞的活化,但同时又提示三种重金属对细胞活化的影响存在差异性.
-
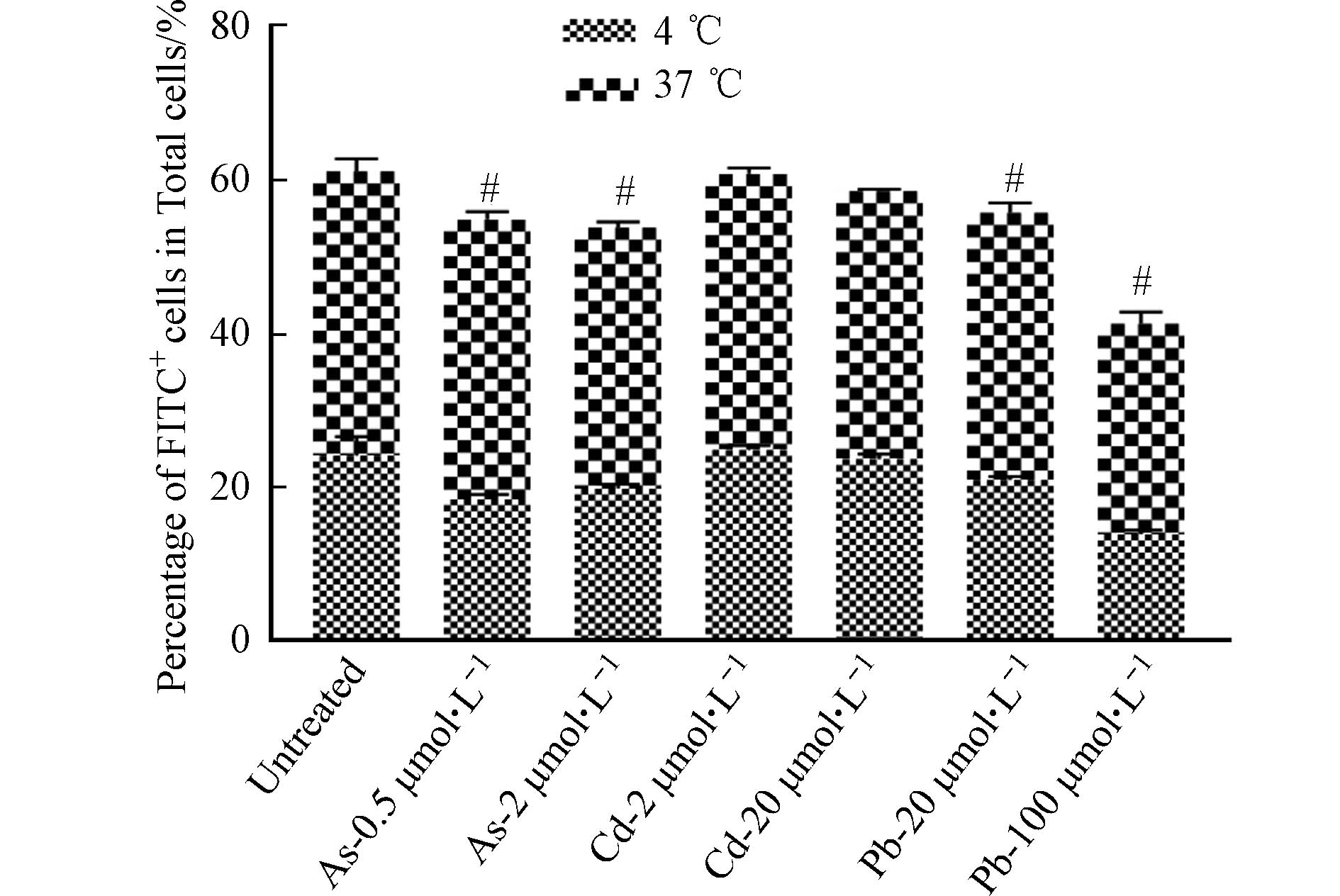
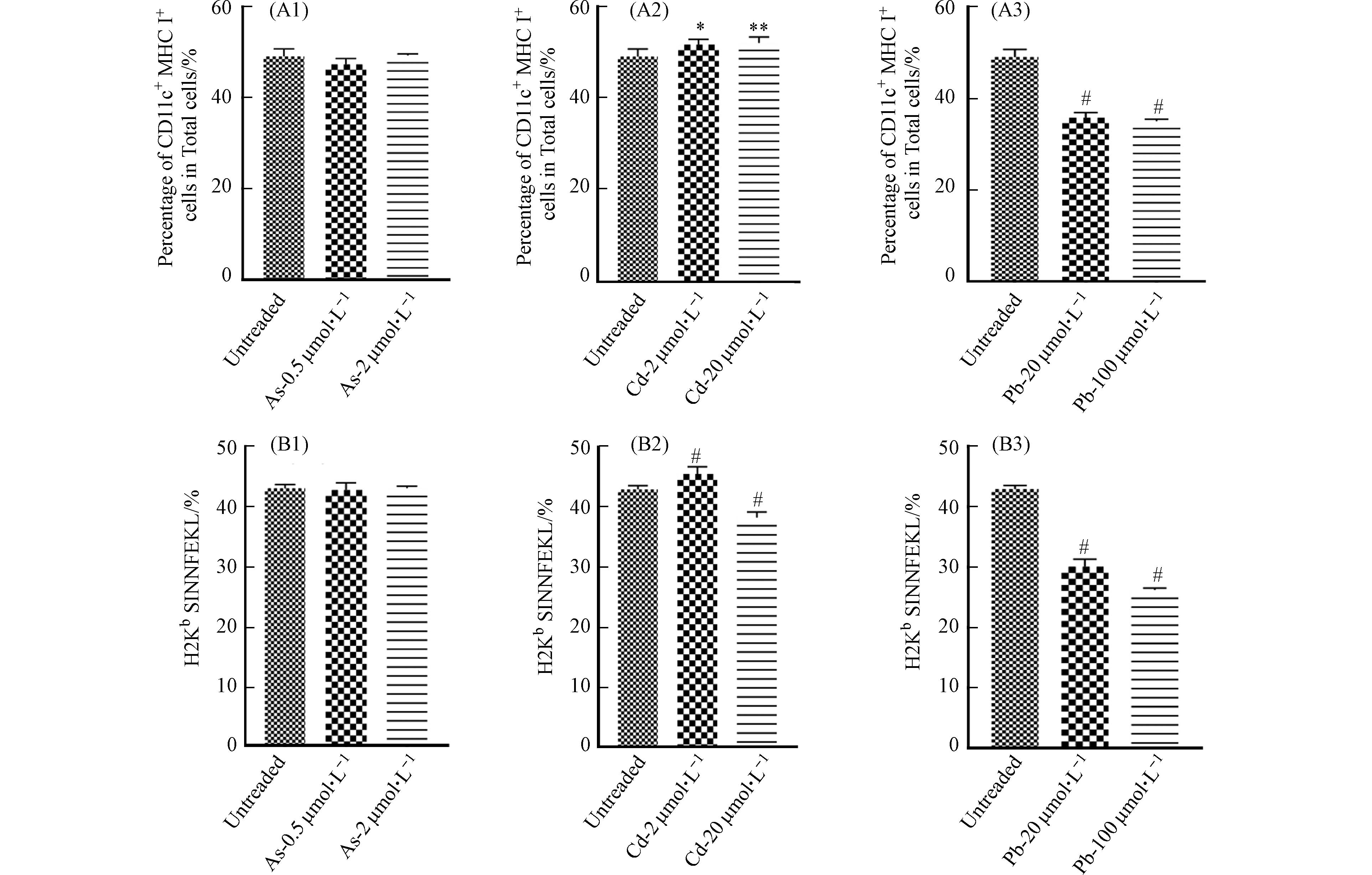
DC细胞作为主要的抗原呈递细胞,具有抗原识别、吞噬和提呈的功能. DC细胞通过胞饮作用、吞噬作用、受体介导的内吞作用等方式摄取抗原,并在细胞内将抗原加工后提呈给T细胞. 因此,DC细胞通过抗原提呈对T、B细胞具有直接或间接的激活作用,从而激发机体产生免疫应答[16]. 为了探讨重金属对DC细胞功能的影响,首先检测了在重金属暴露条件下BMDC细胞吞噬FITC标记葡聚糖的能力变化,以反映重金属对其吞噬能力的影响. 如图6所示,与对照组相比,As与Pb处理组dextran-FITC+细胞比例下降,表明细胞的吞噬能力下降,然而Cd并未引起相似的变化. 进一步对OVA257-264暴露12 h后的BMDC细胞表面OVA-peptide信号进行流式细胞术检测后发现,As对BMDC细胞的抗原结合能力无明显影响,低浓度Cd的处理可能会引起细胞发生应急反应,进而导致抗原结合能力升高,然而,高浓度的Cd与Pb可显著抑制BMDC细胞的抗原结合能力(图7).
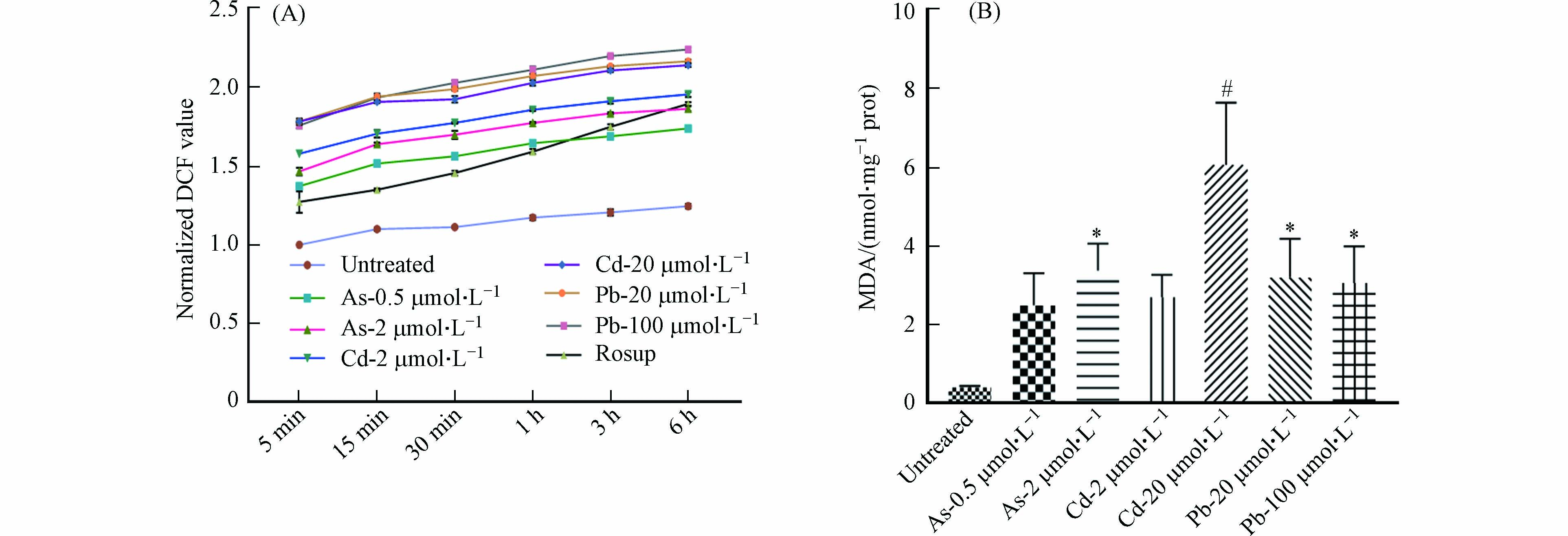
DC细胞抗原结合能力的改变可能与多种机制相关,包括细胞膜破坏或通透性的改变[17]. 因此,我们对细胞ROS与MDA的产生进行了检测. 结果发现,与对照组相比,As与Cd处理后的BMDC细胞中ROS与MDA水平均显著升高,且呈现一定的浓度依赖性;在Pb处理组,ROS水平有明显升高,但MDA的产生趋于稳定(图8). 因此,As可通过改变细胞膜的通透性抑制BMDC细胞的吞噬功能,但不影响细胞抗原结合能力. 经Pb以及高浓度Cd暴露后,BMDC细胞吞噬及抗原结合能力降低,可能与细胞产生氧自由基导致细胞膜通透性改变有关. 总之,重金属对DC细胞功能的影响具有差异化,可能受到不同毒性机制的调控.
-
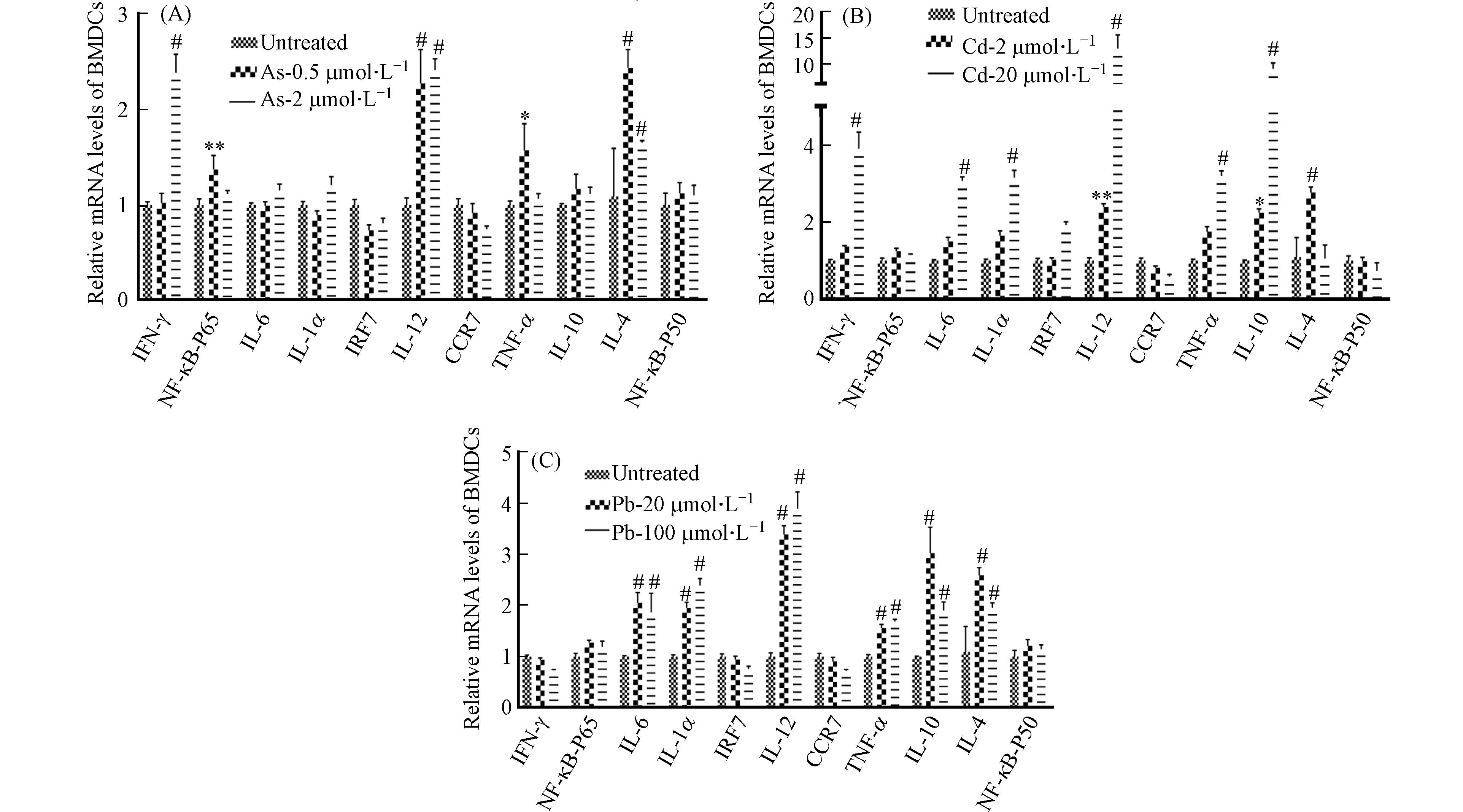
除抗原提呈功能外,DC细胞可分泌多种细胞因子(如IL-18、IL-1β、IL-12等Th1型促炎因子,IL-10、IL-4等Th2型抗炎因子)参与免疫和炎症反应[18 − 22]. 接下来采用RT-qPCR检测了BMDC细胞中Th1型促炎细胞因子(IFN-γ、NF-κB-p65、IL-6、IL-1α、IRF7、IL-12、CCR7、TNF-α)和Th2型抗炎细胞因子(IL-10、IL-4、NF-κB-P50)在重金属暴露后的表达水平的变化情况. 与前人的研究结果相似[6 − 7],发现Cd和Pb处理组中细胞因子IL-6、IL-1、TNF-α表达含量均显著升高,在高浓度Cd和Pb暴露条件下,其表达水平可升高2倍甚至更多,提示着Cd和Pb可诱导强烈的促炎反应(图9).
-
在重金属砷、镉和铅的暴露条件下,BMDC细胞活力降低,突触结构减少,表明3种重金属对BMDC细胞的存活具有明显的抑制作用,其中,镉和铅可进一步诱导BMDC细胞发生凋亡. 砷、镉和铅处理可显著降低BMDC细胞的活化分子表达水平,表明对BMDC细胞的活化具有抑制作用. 进一步研究发现,砷、镉和铅可改变BMDC细胞的吞噬能力以及抗原结合能力,其背后的机制可能是BMDC胞内ROS和MDA水平的改变. 此外,砷、镉和铅可改变BMDC细胞中多种促炎细胞因子的表达水平,提示重金属可能会通过DC细胞影响促炎反应. 综上所述,砷、镉和铅对DC细胞具有相似的毒性作用,但存在差异化的功能抑制作用.
重金属砷、镉和铅对树突状细胞的差异化功能损伤
Diverse effects of heavy metals on the functions of dendritic cells
-
摘要: 为了探讨重金属砷、镉和铅对树突状细胞的毒性作用和功能影响,以骨髓源性树突状细胞(Bone marrow-derived dendritic cell,BMDC)为研究对象,采用Alamar blue法测定BMDC细胞的活性,采用流式细胞术检测BMDC细胞的凋亡、活化、吞噬以及抗原结合能力,并对细胞活性氧和丙二醛进行测定;采用荧光定量PCR检测BMDC细胞促炎/抗炎细胞因子的胞内表达水平. 结果发现,3种重金属均可引起BMDC细胞活性降低(其中镉和铅可促进细胞凋亡)、导致细胞膜通透性改变并抑制细胞的活化;但3种重金属对BMDC细胞的功能影响存在差异,体现在砷可抑制BMDC细胞的吞噬功能,而铅和高浓度的镉则抑制BMDC细胞的抗原结合能力,同时促进促炎细胞因子的表达. 上述结果表明,不同重金属对树突状细胞具有相似的细胞毒性,但对其功能的影响存在差异,其中,砷主要影响未成熟树突状细胞的吞噬功能,铅和镉则主要影响成熟树突状细胞的抗原结合功能.Abstract: In order to investigate the toxic effects and functional inhibition of typical heavy metals on dendritic cells, bone marrow-derived dendritic cells (BMDCs) were treated with arsenic (As), cadmium (Cd), or lead (Pb). BMDCs were stained with Alamar Blue to examine cell viability. Flow cytometry was employed to investigate the apoptosis, cell activation, phagocytosis, antigen binding capacity, and the levels of cellular reactive oxygen species and malondialdehyde for BMDCs. By using RT-qPCR, the expression levels of pro- and anti-inflammatory cytokines in BMDCs were also determined. The results demonstrated that all three heavy metals reduced BMDC activity, in which Cd and Pb promoted the apoptosis of BMDCs. Exposure to As, Cd or Pb altered cell membrane permeability and prevented the activation of BMDCs. However, As, Cd and Pb showed varied effects on BMDC functions, in which As prevented the phagocytosis capability while Pb and high-dosed Cd prevented the antigen-binding capacity of BMDCs. In conclusion, As, Cd and Pb exhibited comparable cytotoxic effects on dendritic cells, but varied impacts on the functions of dendritic cells.
-
Key words:
- heavy metals /
- dendritic cells /
- cell activation /
- antigen recognition /
- phagocytosis
-
表 1 不同细胞因子的定量PCR引物序列
Table 1. Primers of qPCR for testing the expression of 12 cytokines
名称 5′端引物序列(5′ to 3′) 3′端引物序列(5′ to 3′) CCR7 TGTACGAGTCGGTGTGCTTC GGTAGGTATCCGTCATGGTCTTG IFN-γ ATGAACGCTACACACTGCATC CCATCCTTTTGCCAGTTCCTC TNF-α CCTGTAGCCCACGTCGTAG GGGAGTAGACAAGGTACAACCC IL-1α TTGGTTAAATGACCTGCAACA GAGCGCTCACGAACAGTTG IRF7 GAGACTGGCTATTGGGGGAG GACCGAAATGCTTCCAGGG IL-6 TCTAATTCATATCTTCAACCAAGAGG TGGTCCTTAGCCACTCCTTC IL-12 CTGTGCCTTGGTAGCATCTATG GCAGAGTCTCGCCATTATGATTC IL-10 GCTGGACAACATACTGCTAACC ATTTCCGATAAGGCTTGGCAA IL-4 CCCCAGCTAGTTGTCATCCTG CAAGTGATTTTTGTCGCATCCG NF-κB-P50 GGAGGCATGTTCGGTAGTGG CCCTGCGTTGGATTTCGTG NF-κB-P65 AGGCTTCTGGGCCTTATGTG TGCTTCTCTCGCCAGGAATAC β-actin GGCTGTATTCCCCTCCATCG CCAGTTGGTAACAATGCCATGT -
[1] FU Z S, XI S H. The effects of heavy metals on human metabolism[J]. Toxicology Mechanisms and Methods, 2020, 30(3): 167-176. doi: 10.1080/15376516.2019.1701594 [2] JAISHANKAR M, TSETEN T, ANBALAGAN N, et al. Toxicity, mechanism and health effects of some heavy metals[J]. Interdisciplinary Toxicology, 2014, 7(2): 60-72. doi: 10.2478/intox-2014-0009 [3] EBRAHIMI M, KHALILI N, RAZI S, et al. Effects of lead and cadmium on the immune system and cancer progression[J]. Journal of Environmental Health Science & Engineering, 2020, 18(1): 335-343. [4] LI J L, GUO Y Y, DUAN X X, et al. Heme oxygenase-1 (HO-1) assists inorganic arsenic-induced immune tolerance in murine dendritic cells[J]. Chemosphere, 2021, 264: 128452. doi: 10.1016/j.chemosphere.2020.128452 [5] CHAKRABORTY K, CHATTERJEE S, BHATTACHARYYA A. Modulation of phenotypic and functional maturation of murine bone-marrow-derived dendritic cells (BMDCs) induced by cadmium chloride[J]. International Immunopharmacology, 2014, 20(1): 131-140. doi: 10.1016/j.intimp.2014.02.015 [6] GAO D H, MONDAL T K, LAWRENCE D A. Lead effects on development and function of bone marrow-derived dendritic cells promote Th2 immune responses[J]. Toxicology and Applied Pharmacology, 2007, 222(1): 69-79. doi: 10.1016/j.taap.2007.04.001 [7] METRYKA E, CHIBOWSKA K, GUTOWSKA I, et al. Lead (Pb) exposure enhances expression of factors associated with inflammation[J]. International Journal of Molecular Sciences, 2018, 19(6): 1813. doi: 10.3390/ijms19061813 [8] MA J, HE P, ZHAO C F, et al. A designed α-GalCer analog promotes considerable Th1 cytokine response by activating the CD1d-iNKT axis and CD11b-positive monocytes/macrophages[J]. Advanced Science, 2020, 7(14): 2000609. doi: 10.1002/advs.202000609 [9] MACOCH M, MORZADEC C, FARDEL O, et al. Inorganic arsenic impairs differentiation and functions of human dendritic cells[J]. Toxicology and Applied Pharmacology, 2013, 266(2): 204-213. doi: 10.1016/j.taap.2012.11.008 [10] METRYKA E, KUPNICKA P, KAPCZUK P, et al. Lead (Pb) accumulation in human THP-1 monocytes/macrophages in vitro and the influence on cell apoptosis[J]. Biological Trace Element Research, 2021, 199(3): 955-967. doi: 10.1007/s12011-020-02215-7 [11] CHEN J F, JIN Z Q, ZHANG S Q, et al. Arsenic trioxide elicits prophylactic and therapeutic immune responses against solid tumors by inducing necroptosis and ferroptosis[J]. Cellular & Molecular Immunology, 2023, 20(1): 51-64. [12] GOTTSCHALK C, METTKE E, KURTS C. The role of invariant natural killer T cells in dendritic cell licensing, cross-priming, and memory CD8(+) T cell generation[J]. Frontiers in Immunology, 2015, 6: 379. [13] MERAD M, SATHE P, HELFT J, et al. The dendritic cell lineage: Ontogeny and function of dendritic cells and their subsets in the steady state and the inflamed setting[J]. Annual Review of Immunology, 2013, 31: 563-604. doi: 10.1146/annurev-immunol-020711-074950 [14] REYNISSON B, ALVAREZ B, PAUL S, et al. NetMHCpan-4.1 and NetMHCIIpan-4.0: Improved predictions of MHC antigen presentation by concurrent motif deconvolution and integration of MS MHC eluted ligand data[J]. Nucleic Acids Research, 2020, 48(W1): W449-W454. doi: 10.1093/nar/gkaa379 [15] RADHAKRISHNAN S, CELIS E, PEASE L R. B7-DC cross-linking restores antigen uptake and augments antigen-presenting cell function by matured dendritic cells[J]. Proceedings of the National Academy of Sciences of the United States of America, 2005, 102(32): 11438-11443. [16] TURNBULL E, MacPHERSON G. Immunobiology of dendritic cells in the rat[J]. Immunological Reviews, 2001, 184(1): 58-68. doi: 10.1034/j.1600-065x.2001.1840106.x [17] MORRIS G, GEVEZOVA M, SARAFIAN V, et al. Redox regulation of the immune response[J]. Cellular & Molecular Immunology, 2022, 19(10): 1079-1101. [18] PLANTINGA M, GUILLIAMS M, VANHEERSWYNGHELS M, et al. Conventional and monocyte-derived CD11b+ dendritic cells initiate and maintain T helper 2 cell-mediated immunity to house dust mite allergen[J]. Immunity, 2013, 38(2): 322-335. doi: 10.1016/j.immuni.2012.10.016 [19] LEPLINA O Y, TYRINOVA T V, TIKHONOVA M A, et al. Interferon alpha induces generation of semi-mature dendritic cells with high pro-inflammatory and cytotoxic potential[J]. Cytokine, 2015, 71(1): 1-7. doi: 10.1016/j.cyto.2014.07.258 [20] ARNOLD I C, MATHISEN S, SCHULTHESS J, et al. CD11c+ monocyte/macrophages promote chronic Helicobacter hepaticus-induced intestinal inflammation through the production of IL-23[J]. Mucosal Immunology, 2016, 9(2): 352-363. doi: 10.1038/mi.2015.65 [21] BANCHEREAU J, PASCUAL V, O'GARRA A. From IL-2 to IL-37: The expanding spectrum of anti-inflammatory cytokines[J]. Nature Immunology, 2012, 13(10): 925-931. doi: 10.1038/ni.2406 [22] AMON L, LEHMANN C H K, BARANSKA A, et al. Transcriptional control of dendritic cell development and functions[J]. International Review of Cell and Molecular Biology, 2019, 349: 55-151. -




 下载:
下载: