-
随着现代工业化和城镇化进程的加快,人类高强度的活动导致重金属被排放到环境中,造成了严峻的大气、土壤和水环境重金属污染问题[1-2]. 环境中的重金属污染具有蓄积性、持久性和不可逆性,其不仅会改变环境的组成和功能,还会影响农作物的生长,造成农产品的产量和品质的下降,甚至可能影响人体健康,因而越来越受到人们的重视[3]. 重金属污染已成为我国乃至全球重点关注的污染之一[4]. 其中,重金属铅和类金属砷均是毒性较大的重金属污染物[5-6]. 基于对铅和砷的生物学效应和人体健康损害的认识,美国环境保护署(USEPA)已将铅和砷列为毒性效应最强的重金属[7],同时国际癌症研究机构(IARC)也将砷列为I类人类致癌物,铅列为很可能的人类致癌物质(2A类)[8].
为了保护生态环境和人群健康,依据重金属的单一毒性效应,世界各国或组织颁布了不同介质中重金属的浓度限量值[9]. 然而很多研究表明,低于浓度限量值的重金属混合物仍会对生物体产生毒性效应,造成一定的损伤[10]. 重金属的复合污染已成为环境科学研究的热点之一. 砷和铅很容易受到人类活动的影响,共存于环境中,造成复合污染[11-12]. 共存的砷和铅很可能会发生相互作用,从而影响各自在动植物中的生物可利用性及其毒性效应[13]. 然而,目前针对砷和铅的复合毒性效应研究较少,已有的研究主要集中于砷或者铅单一毒性或者与其他污染物的复合毒性,而且铅对砷的毒性效应的影响研究缺乏[14-15]. 为此,本研究拟研究铅对砷毒性效应的影响,探讨砷和铅的复合毒性效应.
此外,毒代动力学过程可以反映重金属从生物体外到生物体内的浓度,决定了重金属在生物体内的残留量,关系到该重金属对生物体的毒性效应. 毒代动力学已被广泛应用于重金属毒性效应的研究. Gao等[16]采用毒代动力学方法阐释预暴露对重金属毒性效应的影响并将毒代动力学用于斑马鱼幼鱼和成鱼毒性敏感性差异的研究[17]. Huang等[18]也采用毒代动力学方法阐释了野生蚯蚓对镉具有更强耐受力的原因. 此外,暴露环境的物理(如温度)和化学(如盐度、pH)因素对重金属毒性效应的改变也与毒代动力学过程的变化密切相关[19]. 而环境中共存的重金属之间也可能会发生相互作用,改变生物体对重金属的吸收、转化、代谢和积累等毒代动力学过程,导致毒性效应的变化[20]. 因此,毒代动力学分析可成为重金属复合毒性效应形成机制研究的有力工具之一[21]. 据此,本研究将结合毒代动力学过程阐释铅对砷毒性效应影响形成的可能原因.
本研究将开展砷和铅对斑马鱼的复合毒性效应研究,重点关注铅对砷的斑马鱼毒性效应的影响,探讨砷和铅对斑马鱼的复合毒性效应,并利用毒代动力学过程分析方法阐释铅对砷的毒性效应影响的可能原因.
-
供试生物:实验用雌性斑马鱼(Danio rerio)为4月龄野生型AB品系,购买自国家斑马鱼资源中心.
实验试剂:醋酸铅((CH3COO)2Pb·3H2O,≥99.5%)和浓硝酸(HNO3,65.0%—68.0%)(国药上海化学试剂公司)、亚砷酸钠(NaAsO2,99%)(北京伊诺凯科技有限公司)、铅和砷标准溶液(浓度均为1000 μg·mL−1)(国家标准物质资源平台).
实验设备:Ymnl-48组织均研磨器(南京以马内利仪器设备公司)、MARS6微波消解系统(美国CEM公司)、Agilent 7700电感耦合等离子体串联质谱仪(ICP-MS,安捷伦科技有限公司)
-
野生成年斑马鱼购买后置于28 °C的流通式系统中养殖,光暗周期为14 h:10 h. 在开展暴露实验前,斑马鱼在一个装有15 L曝气水的玻璃水箱中驯化. 所有斑马鱼每天喂食2次新鲜孵化的丰年虫. 斑马鱼暴露实验开始前,分别开展铅和砷的96 h预暴露实验以确定暴露实验水溶液中重金属的浓度. 铅和砷预暴露实验结果表明,铅的96 h 10%致死浓度(LC10)为1.44 mg·L−1,砷的96 h 半数致死浓度(LC50)为32 mg·L−1. 本文主要研究铅对砷的毒性效应的影响,因此铅的浓度设为对斑马鱼无明显致死效应的水平(1.44 mg·L−1),而砷的浓度设为对斑马鱼产生一定致死效应的水平(20 mg·L−1). 斑马鱼暴露实验分为动力学吸收阶段实验和动力学消除阶段实验. 使用超纯水配制重金属铅、砷暴露母液,浓度分别为0.6 g·L−1和4 g·L−1,现用现配. 实验时用曝气水分别配制成1.44 mg·L−1铅和/或20 mg·L−1砷的暴露水溶液. 动力学吸收阶段实验设置3种暴露情形,即对照组、20 mg·L−1砷单独暴露组和1.44 mg·L−1铅+20 mg·L−1砷共同暴露组. 每种暴露情形共设置30个鱼缸,每个鱼缸中放入5条斑马鱼. 动力学吸收阶段实验的暴露时间为96 h,暴露开始后的8、24、48、72、96 h分别取样并记录斑马鱼死亡情况,每个时间点取3个平行样(即3个鱼缸). 动力学吸收阶段实验结束后,立即将3种暴露情形剩余的斑马鱼转移至对应不含砷的暴露水溶液中,即3种暴露情形变为对照、曝气水暴露和1.44 mg·L−1铅暴露,开始动力学消除阶段实验. 动力学消除阶段暴露开始后的1、2、3、5、7 d分别取样并记录斑马鱼死亡情况,每个时间点取3个平行样. 每天更换新鲜暴露水溶液,以维持暴露水溶液重金属浓度的稳定性.
-
重金属铅和砷的含量分析参照已报道的研究方法开展[22-23]. 暴露结束后对斑马鱼进行冰冻处死,将斑马鱼体表擦干后称重并收集在离心管中,全鱼样品磨碎后放入消解管中,加入10 mL浓硝酸并盖紧瓶盖后放入微波消解系统中消解2 h直至溶液清澈透明,然后用超纯水定容至10 mL. 消解后的全鱼样品以及暴露水溶液都经Whatman GF-C滤纸(0.22 μm孔径)过滤到离心管中. 铅和砷在暴露水溶液和斑马鱼体内的浓度通过ICP-MS在KED模式下测定,仪器的相对标准偏差控制在5%以内. 水溶液和斑马鱼体内重金属的含量分别以mg·L−1和mg·kg−1表示.
-
为模拟毒代动力学相关参数,吸收和消除速率常数ku和ke,本研究采用一级一室动力学模型对重金属的毒代动力学过程进行模拟. 使用Scientist® (Micromath, USA)软件包根据式(1)对实验数据进行拟合.
式中,Cb表示斑马鱼体内砷的浓度(mg·kg−1),Cw表示暴露水溶液中砷的浓度(mg·L−1),ku表示吸收速率常数(L·kg−1·d−1),ke表示消除速率常数(d−1).
评价砷在斑马鱼体内发生生物积累能力的指标——生物浓缩因子(bioconcentration factor, BCF)根据式(2)计算得到. 砷在斑马鱼体内的半衰期(t1/2)根据式(3)计算得到.
本研究中采用t-test方法对不同暴露实验组获得的吸收速率常数ku和消除速率常数ke进行统计分析比较. 使用单因素方差分析法(one-way ANOVA)对不同暴露实验组斑马鱼致死率进行统计分析比较. 所有的统计分析均使用Sigmaplot 12.3(Systat Software Incorporation, San Jose, CA, USA)进行.
-
通过对暴露实验开始和结束阶段水中砷和铅的化学分析可以发现,暴露水溶液更换前后水中砷和铅的浓度为各自理论加标浓度的89%、96%和85%、93%,表明暴露过程中水溶液的砷和铅的浓度均保持稳定,并且与各自理论加标浓度相接近. 一方面暴露实验过程中每天会更新加标水溶液,另一方面重金属性质稳定,短时间内不易发生代谢转化,因此,水中砷和铅的浓度与各自理论加标浓度接近. 在污染物毒代动力学的研究中,控制和维持暴露介质中污染物浓度的稳定性十分重要[24-25]. 其他许多关于污染物动力学的研究也均采用了换水或者被动加标的方法维持暴露实验过程中污染物浓度的稳定性,以便于毒代动力学研究的开展[26-28].
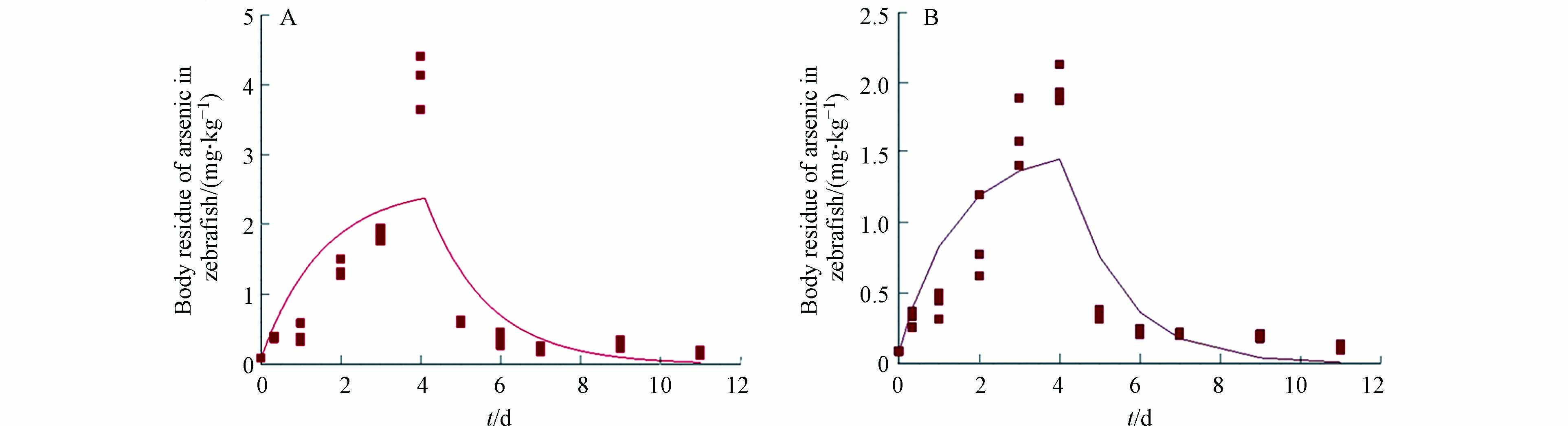
分析两种暴露实验情形下不同采样时间点的斑马鱼体内的重金属残留量可以发现,吸收阶段(0 d至4 d)斑马鱼体内的砷浓度均随着暴露时间的延长而显著升高,且砷在斑马鱼体内的积累呈现出先快后慢的现象;消除阶段(4 d至11 d)斑马鱼体内的砷浓度均逐步降低,且砷在斑马鱼体内的消除也呈现出先快后慢的现象(图1). 本研究结果与Chen等[29]报道的砷在青鳉鱼(Oryzias melastigma)吸收和消除现象类似. 斑马鱼暴露8 h后体内的砷浓度便发生显著性升高,说明斑马鱼在本研究条件下易于吸收和富集砷.
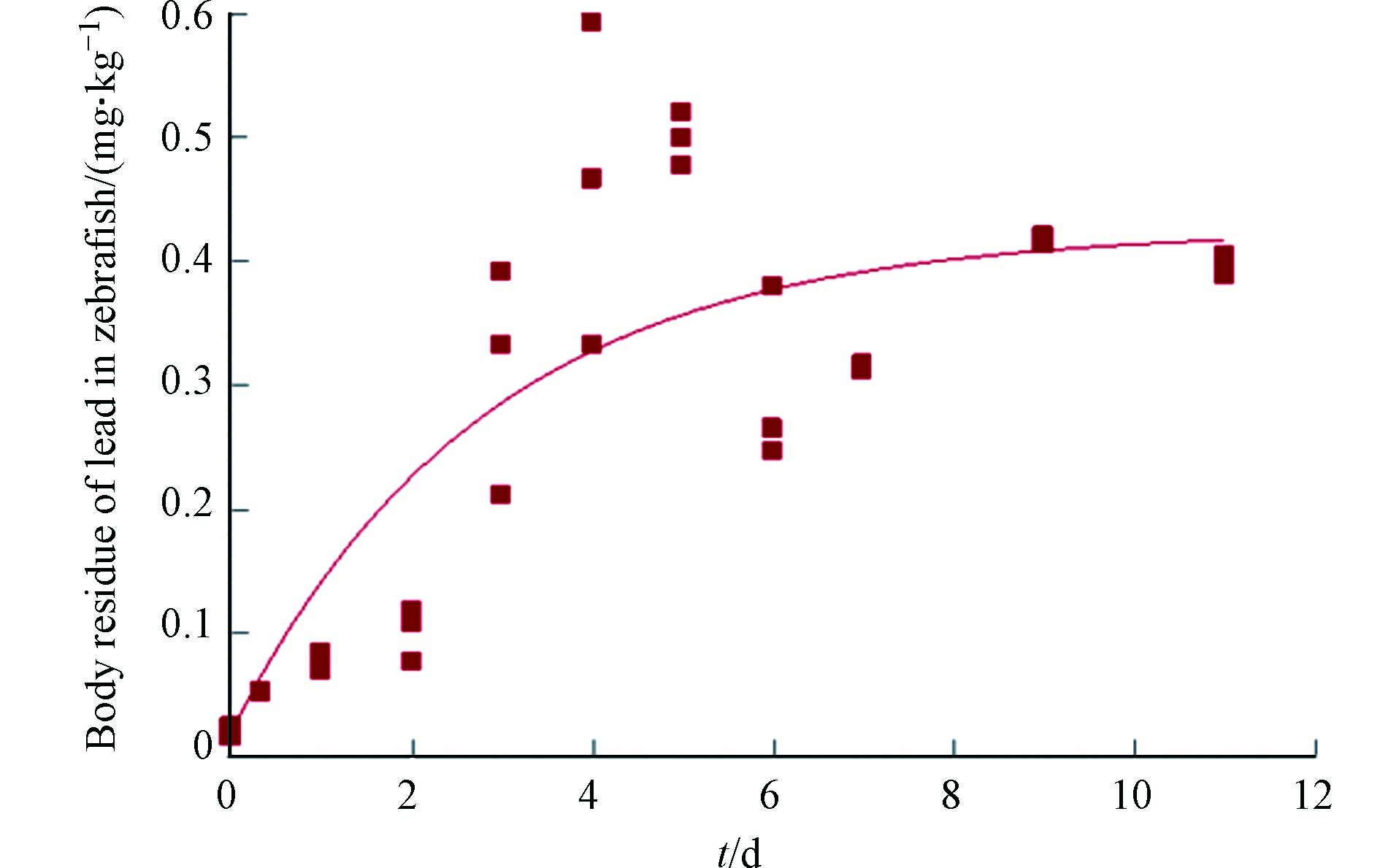
此外,在砷和铅共同暴露情形下,吸收阶段和消除阶段的暴露水溶液中均含有铅,因此,斑马鱼体内的铅的浓度随着暴露时间(包含吸收和消除暴露时间)的延长逐步升高直至基本维持稳定(图2). 与砷一样,铅在斑马鱼体内的富集也呈现出先快后慢的现象,而且暴露8 d左右斑马鱼体内的铅基本可以达到稳态,且稳态浓度约为0.4 mg·kg−1. 本研究关于铅在斑马鱼体内的动力学现象与Gao等[30]和Zhang等[31]的研究结果类似.
-
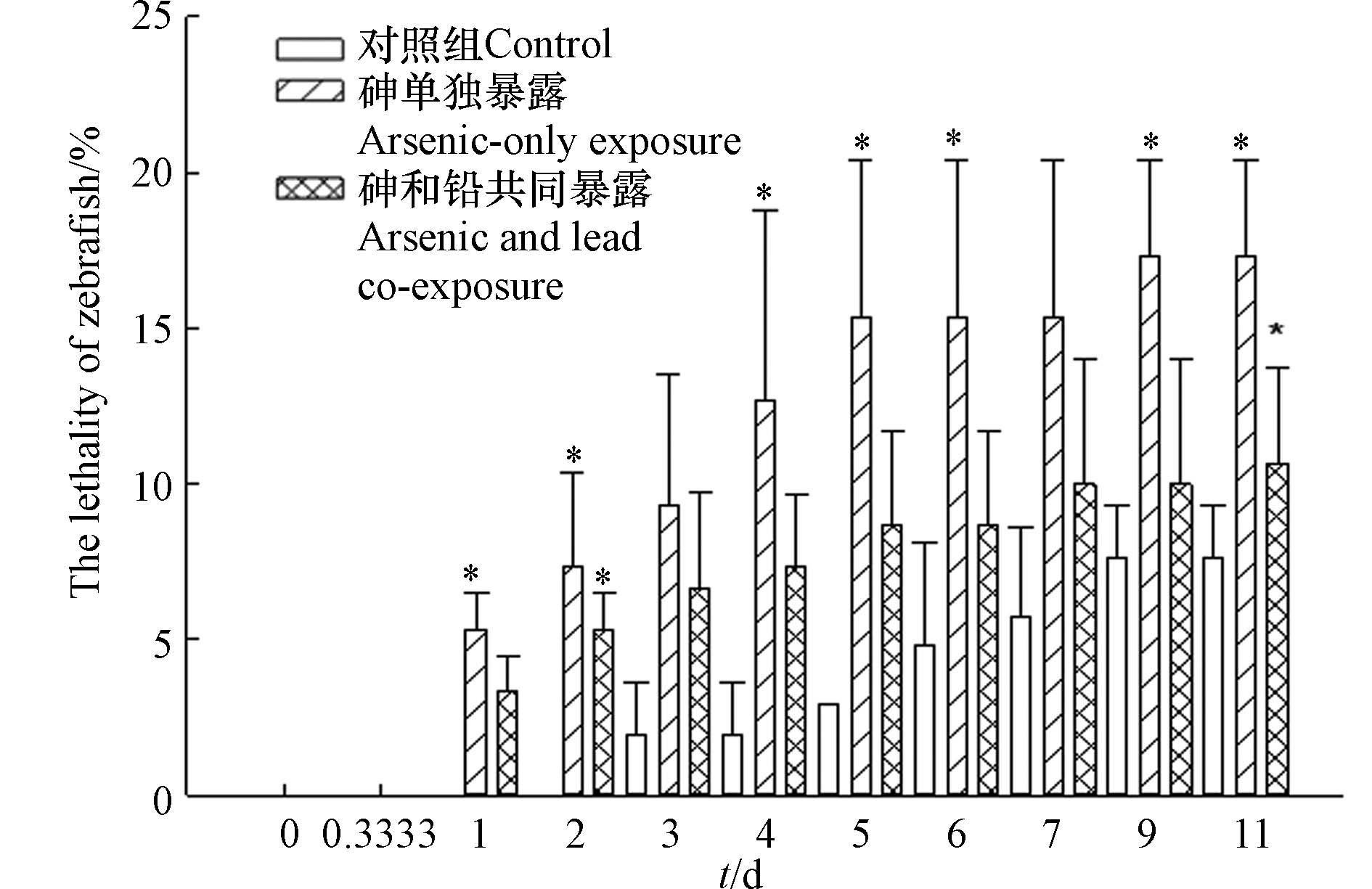
如图3所示,对照组中斑马鱼的致死率最高为7.6%,并且不同暴露时间的斑马鱼致死率并无显著性差异,满足毒性实验的质控要求. 砷单独暴露实验情形下,在吸收暴露阶段(0 d至4 d),斑马鱼的平均致死率升至12.7%,显著高于对照组(1.9%);在消除暴露阶段(4 d至11 d),斑马鱼平均致死率升至17.3%,但是不同时间点的致死率并无显著性差异. 吸收暴露实验阶段,斑马鱼暴露于含砷的水溶液中,导致斑马鱼致死率逐步提高,而将斑马鱼转移到清水中开展消除暴露实验后,斑马鱼不再受砷的污染胁迫,几乎不再发生死亡. 砷单独暴露时,斑马鱼暴露4 d的致死率为12.7%±6.1%,符合预先的动力学实验设计. 本研究中获得砷对斑马鱼的96 h-LC50为32 mg·L−1,与Liu等[32]报道的砷对斑马鱼的96 h-LC50(56 mg·L−1)以及Sarkar等[33]报道的三氧化二砷对斑马鱼的96 h-LC50(17.5 mg·L−1)的研究结果相接近. 砷和铅共同暴露实验情形下,在吸收暴露阶段,斑马鱼的平均致死率逐步升至7.3%;在消除暴露阶段,斑马鱼的平均致死率升至10.7%,但并未产生显著性变化. 吸收暴露阶段,斑马鱼暴露于含砷和铅的水中,导致斑马鱼致死率逐步升高. 然而,斑马鱼转移至只含铅的水中开展消除暴露实验后,斑马鱼的致死率变化不明显. 从消除暴露实验结果可见,铅的存在对斑马鱼并未造成明显的致死效应. 结果符合本研究中暴露实验设计,即铅不产生明显致死效应,探究铅对砷的毒性效应和毒代动力学的影响.
对比分析两种暴露情形斑马鱼的致死率可以发现,在同一暴露时间下(如暴露96 h时),砷单独暴露组的斑马鱼致死率(12.7%±6.1%)要显著高于对照组斑马鱼的致死率(1.9%±1.7%),略高于砷和铅共同暴露组斑马鱼的致死率(7.3%±2.3%),而砷和铅共同暴露组斑马鱼的致死率大多略高于对照组斑马鱼的致死率但并无显著性差异. 由此可见,本研究条件下,砷会对斑马鱼产生明显的致死效应,铅并未对斑马鱼造成明显的致死效应,但是铅与砷共存时斑马鱼的致死效应被减弱,说明铅的共存显著降低了砷对斑马鱼的毒性效应. 关于重金属间的复合毒性效应作用类型及形成机制的研究有很多,已报道的复合毒性作用类型既包括协同作用,也有拮抗作用,并且形成机制也各有差异. 氧化压力是重金属产生毒性效应的重要致毒机制之一[34-35],而低浓度的铅可能会激发生物体的抗氧化保护机制,如抗氧化酶活性的升高,减轻氧化压力[36],从而抑制砷的毒性效应. 有研究发现不同毒性单位配比的铅与镉以及铅与铬对斑马鱼胚胎的致死率和孵化率的复合毒性均表现为拮抗效应[37],这可能与铅激发了生物体的保护机制(抗氧化机制)相关,也与重金属之间可能存在的竞争相关. 重金属需要通过细胞膜进入细胞,而多种重金属共存时可能会在跨细胞膜转运时产生竞争,也可能改变细胞膜的通透性,从而影响重金属进入生物体过程. 镉与铬对斑马鱼胚胎的致死率和孵化率的协同毒性效应可能是由于镉与细胞表面膜蛋白的巯基、羰基、氨基等作用,改变细胞膜结构和稳定性,增强细胞膜通透性,导致重金属更加容易进入细胞[37]. 本研究中铅是否影响砷进入生物体的过程,从而减弱砷对斑马鱼的毒性效应,可以通过毒代动力学研究进一步明晰.
此外,有研究发现砷和镉共同暴露对钩虾的致死性呈现拮抗效应[38]. 该研究发现,与单一重金属暴露相比,砷和镉混合暴露会导致钩虾生物富集性下降,生物体内的重金属量降低,从而导致毒性效应降低. Vellinger等[39]进一步研究发现砷和镉混合暴露导致钩虾体内γ-谷氨酰半胱氨酸连接酶活性升高、谷胱甘肽(GSH)和金属硫蛋白(MT)含量增加,加快了重金属被排除生物体外的速率,增强了重金属代谢解毒过程. 本研究中铅是否加快了砷的消除速率以及降低了砷的生物富集性,从而降低了砷对斑马鱼的毒性效应,也可以通过毒代动力学研究进一步解释. 综合上述相关研究结果,开展重金属的毒代动力学过程研究可以进一步阐述本研究中铅减弱砷对斑马鱼的毒性效应的相关机制.
-
污染物在生物体内的毒代动力学过程直接影响着该污染物对生物体的毒性效应. 当生物体暴露于混合污染物中,其中一种污染物可能会影响其他污染物的吸收、生物转化、分配和消除,这些导致了污染物间的相互作用,很有可能改变污染物的毒性效应[40-42]. 因此,毒代动力学过程的研究能够在一定程度上解释复合毒性产生原因. 本研究采用一级一室动力学模型分别对两种暴露情形中砷的毒代动力学过程进行拟合,斑马鱼体内砷的毒代动力学拟合曲线如图1所示. 两组暴露情形拟合曲线的决定系数(R2)分别为0.66和0.77(表1),表明两组毒代动力学暴露实验中获得的砷的残留量数据均能够较好地进行一级动力学模拟[31].
Cui等[14]关于砷在鲫鱼肌肉中的动态变化的研究发现亚砷酸盐的吸收速率常数为0.041 g·g−1·d−1、消除速率常数为0.708 d−1,该结果与本研究中砷单独暴露实验组的结果类似. 对比两组暴露情形中砷的吸收速率常数和消除速率常数(表1)可以发现,铅的存在显著降低了斑马鱼对砷的吸收速率并加快了斑马鱼对砷的消除速率,因此导致砷和铅共同暴露组斑马鱼体内砷的残留量低于砷单独暴露组斑马鱼体内砷的残留量. 该结果正好验证了前述毒理实验结果,即铅的存在显著降低了砷对斑马鱼的毒性效应,砷和铅产生拮抗效应. 与此同时,砷单独暴露时斑马鱼对砷的生物浓缩因子也显著高于砷和铅共同暴露时斑马鱼对砷的生物浓缩因子. 该结果也进一步说明铅的存在降低了砷在斑马鱼体内富集的能力,削弱了砷对斑马鱼的毒性效应. 前期有许多研究也表明生物体中一种污染物会影响另一种污染物的毒代动力学过程,进而影响另一种污染物对该生物体的毒性效应. Broerse等[43]研究发现,镉的共存影响了芘在土壤中生活的弹尾目生物Folsomia candida体内的毒代动力学过程. 镉的存在降低了芘的吸收和消除速率,同时加快了芘发生生物转化为其羟基代谢产物,但是减慢了其羟基化代谢产物进一步的代谢. 可以看出,重金属镉的存在显著地影响了污染物芘的生物积累和代谢. Steevens和Benson[44]发现,甲基汞的吸收和消除速率明显受到共暴露的另一种污染物——毒死蜱的影响. 当底栖生物钩虾(Hyalella azteca)同时暴露于甲基汞和毒死蜱时,毒死蜱加速了生物体对甲基汞的吸收,但是减缓甲基汞的消除,使得更多的甲基汞被生物体积累,导致两种污染物间产生相互作用. 砷的化学性质与细胞内多种物质(磷酸酯、葡萄糖和甘油等)类似,导致砷可以通过多种运输通道进入细胞,如水通道蛋白(AQP)和己糖转运蛋白(HXT)[45]. 而ABC转运蛋白和多药耐药相关蛋白(MRP)是砷排出细胞的重要蛋白[45-46],其中ABC转运蛋白被认为是水生生物应对环境污染物的第一道防御机制[47]. 铅的存在可能会与AQP和HXT等运输通道发生相互作用,降低相关基因表达水平,阻碍斑马鱼对砷的吸收. 此外,低浓度铅的存在可能激活生物体防御机制,如增强ABC转运蛋白和MRP相关基因表达水平,加速斑马鱼对污染物的排出. 然而,铅是否是通过作用砷的转运通道来降低砷的吸收速率以及加快砷的消除速率还需深入展开研究.
-
本研究选用斑马鱼作为模式生物开展了铅和砷的复合毒性效应评价,发现本研究中铅单独暴露对斑马鱼未产生明显致死效应,而共同暴露时铅能够显著降低砷对斑马鱼的致死效应. 本研究进一步通过毒代动力学研究发现铅的存在既降低了斑马鱼对砷的吸收速率,又加快了斑马鱼对砷的消除速率,导致斑马鱼降低对砷的富集能力,从而削弱了砷对斑马鱼的毒性效应. 毒代动力学研究有力阐释了砷和铅对斑马鱼形成拮抗效应的原因. 本研究揭示了砷和铅的复合毒性及形成原因,充实了重金属的复合毒性基础数据.
铅对砷的毒性效应及毒代动力学过程的影响
The influence of lead on toxic effect of arsenic and its toxicokinetic process
-
摘要: 为探究铅对砷的毒性效应的影响及其原因,本研究选用斑马鱼作为模式生物开展了毒理实验,以评价砷和铅的复合毒性效应,分析斑马鱼体内重金属残留量,并采用一级一室动力学模型模拟了砷的毒代动力学过程. 毒理实验结果表明,铅对斑马鱼未产生明显致死效应,砷对斑马鱼的致死效应随暴露时间增长显著增强,而铅的共存能够显著降低砷对斑马鱼的致死性,砷和铅对斑马鱼的致死性呈现出拮抗效应. 毒代动力学结果表明,铅的存在显著加快了斑马鱼对砷的消除速率并减弱了吸收速率,可降低斑马鱼对砷的富集能力,从而削弱了砷对斑马鱼的毒性效应. 本研究揭示了砷和铅对斑马鱼的拮抗效应并从污染物毒代动力学的角度解释了复合毒性形成原因,充实了重金属的复合毒性效应基础数据,可提高重金属风险评估的准确性.Abstract: To explore the influence of lead on arsenic toxicity and its formation mechanism, zebrafish was selected as model organism to conduct toxicology test in this study. Joint toxicity of arsenic and lead was evaluated. Body residue of metals in zebrafish was analyzed and toxicokinetic process of arsenic was simulated by first order one compartment toxicokinetic model. The toxicology test results indicated lead did not generate lethal effect for zebrafish, but lethal effect caused by arsenic increased significantly with the increase of exposure time. However, the coexistence of lead can significantly reduce the lethality of arsenic to zebrafish. Arsenic and lead showed antagonistic effects on zebrafish lethality. The toxicokinetic results showed the presence of lead significantly accelerated the elimination rate and reduced the uptake rate of arsenic in zebrafish. Thus, the bioconcentration ability of arsenic in zebrafish was weakened and the toxic effect of arsenic on zebrafish was mitigated. This study revealed the antagonistic effect of arsenic and lead on zebrafish and explained the mechanism of joint toxicity from the perspective of toxicokinetic. It provides basic data of joint toxicity for metals and improved the accuracy of risk assessment of metals.
-
Key words:
- arsenic /
- lead /
- toxic effect /
- toxicokinetic /
- zebrafish.
-
地下水是维持人类生存和发展的一种最重要资源和生态环境因子[1]。近年来,我国经历了快速城市化和工业化,然而,污水的处理能力未能保持同步增长(尤其在农村地区)、农业化肥和农药过量使用、地下水超采严重等问题,已经引起地下水水化学特征发生改变[2-4]。众所周知,地下水水化学改变不仅能够干扰多种生态过程,同时也降低了地下水的使用价值[5]。因此,掌握地下水水化学的演化规律对于可持续利用地下水尤为重要[6-8]。
地下水水化学演化主要受控于自然因素和人类活动的综合影响。地下水水化学特征与自然因素(水文地质条件、包气带岩性、水岩交互作用和海水入侵)密切相关[9-10]。安乐生等研究发现,黄河三角洲浅层地下水化学特点形成的关键驱动因素是黄河入海流路变迁和海水入侵[11]。人类活动(如污水排放、农业施肥、地下水超采等)也严重影响了地下水水化学演化规律。Zhang等研究发现,地下水水化学特征受到了生活污水、工业污水和水岩交互作用的混合影响, 因此,为防止该地区地下水水质恶化,首先要控制污水的排放 [12]。郭高轩等研究表明,潮白河冲洪积扇不同深度地下水水化学具有分层分带特征,且在人类活动强烈区域,浅层地下水水质略差[13]。
中牟县位于郑州市东部新城区,地下水资源是该地区工农业生产的主要供水水源。近年来,随着人口的迅速增长和工业的高速发展、农业灌溉面积极速扩大,地下水的开采量日益增加。基于 2019 年对该地区地下水位统调工作发现,中牟县城一带已经形成一个较大的浅层地下水降落漏斗,并且研究区内人类活动强烈,存在农业面源污染、固体废弃物堆放场和工业污染等3类潜在污染来源,可能对地下水水化学特点构成一定影响。目前,针对该地区地下水水化学演化规律尚未开展深入研究工作,对该地区居民的健康饮水和社会经济可持续发展构成潜在威胁。
本研究针对郑州市中牟县地下水水化学演化机理开展研究,联合应用piper三线图、Gibbs图、离子比例系数法和多元统计技术等手段,识别研究区水化学特征,揭示该地区地下水水化学形成演化机制,探讨控制地下水水化学特征的主控因素,以期为快速城市化地区地下水的可持续开发利用提供科学依据。
1. 材料与方法(Materials and methods)
1.1 研究区概况
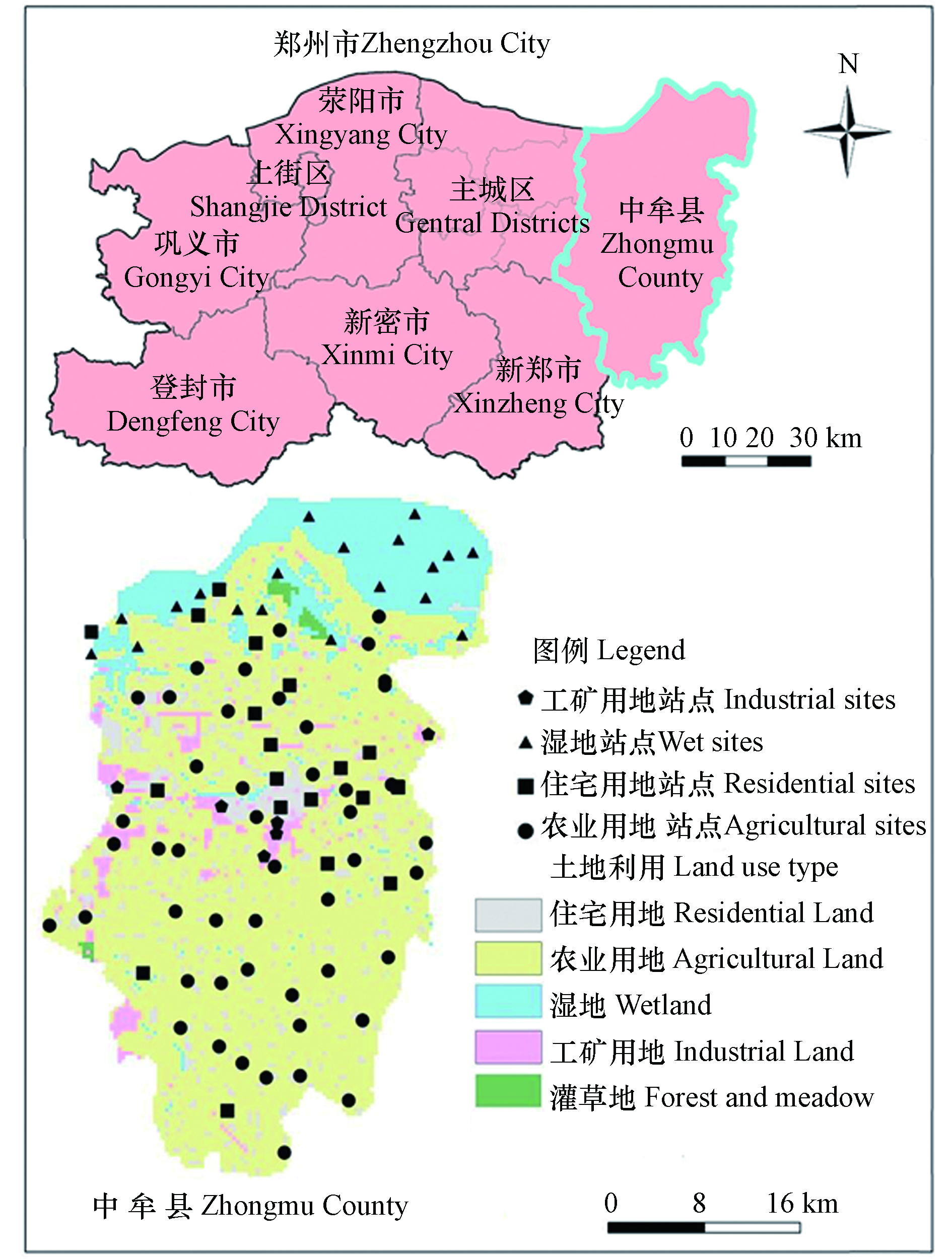
中牟县位于北纬34°26′—34°56′、东经113°46′—114°12′之间,地处中原腹地、河南省中部偏东,隶属郑州市。研究区属暖温带半干旱气候,具明显的大陆季风气候特征,四季分明。多年平均气温14.25℃,多年平均降雨量约为616 mm,年内降水多集中在7—9月,占全年降雨量的40%—48%. 多年平均蒸发量1769.8 mm,平均相对湿度66.3%。研究区总面积为917 km2,主要的土地利用类型为农业用地(68.7%)、居民区(9.2%)、工矿用地(4.3%)、水域(16.2%)(包括湿地和水体)和裸地(1.6%)(图1)。
1.2 水文地质条件
研究区地貌类型为黄河冲积平原,地下水类型主要为松散岩类孔隙水,其含水层分布广,厚度大,水量丰富,可分为浅层水(<80 m)和中深层水(80—400 m)。浅层含水层主要由山前冲洪积与黄河冲积的细砂层组成,深度主要为 40—60 m,该含水层组埋藏浅,其下为一组粉质粘土或粉土弱透水层,与下伏中深层含水层组相隔,厚25—45 m。浅层水易于开采,为农业用水主要开采层,井深25—55 m。中深层含水层组底板埋深310—350 m,其下为厚层粘土夹薄层砂或砂的透镜体,粘土层厚度一般15—40 m,具有很好的隔水性,属承压水类型。中深层水是目前城乡小型集中供水的主要开采层,井深一般在100—300 m 左右。其含水层岩性为中砂、细砂、粗砂等,厚30—80 m,导水系数125—390 m2·d−1,贮水系数4×10−3,单位涌水量3—5 m3·h−1·m−1。地下水主要的补给来源为大气降水、河道侧漏和灌溉回水,主要的排泄方式为人工开采。
1.3 样品采集
2020年6—8月采集郑州市中牟县地下水样品93组(图1),包括农业用地站点48个,湿地站点19个,住宅用地站点20个和工矿用地站点6个。采样点布设的原则主要依据不同的土地利用类型平均布设采样点,如果预布设站点区域内无地下水井,可以适当调整,但要保证2个采样点之间的距离大于1 km。地下水主要取自民井和农业灌溉井,采样井的深度范围是25—150 m。采样前抽水洗井10 min,用原水样清洗采样瓶3次,分别采集 1.5 L 和 0.5 L 水样各1瓶,用于分析阴阳离子。分析阳离子的水样加1∶1的
HNO−3 1.4 样品的测试
样品测试的指标包括pH、TDS、K+、Na +、Ca2+、Mg2+、
NH+4 NO−3 NO−2 SO2−4 CO2−3 HCO−3 1.5 研究方法
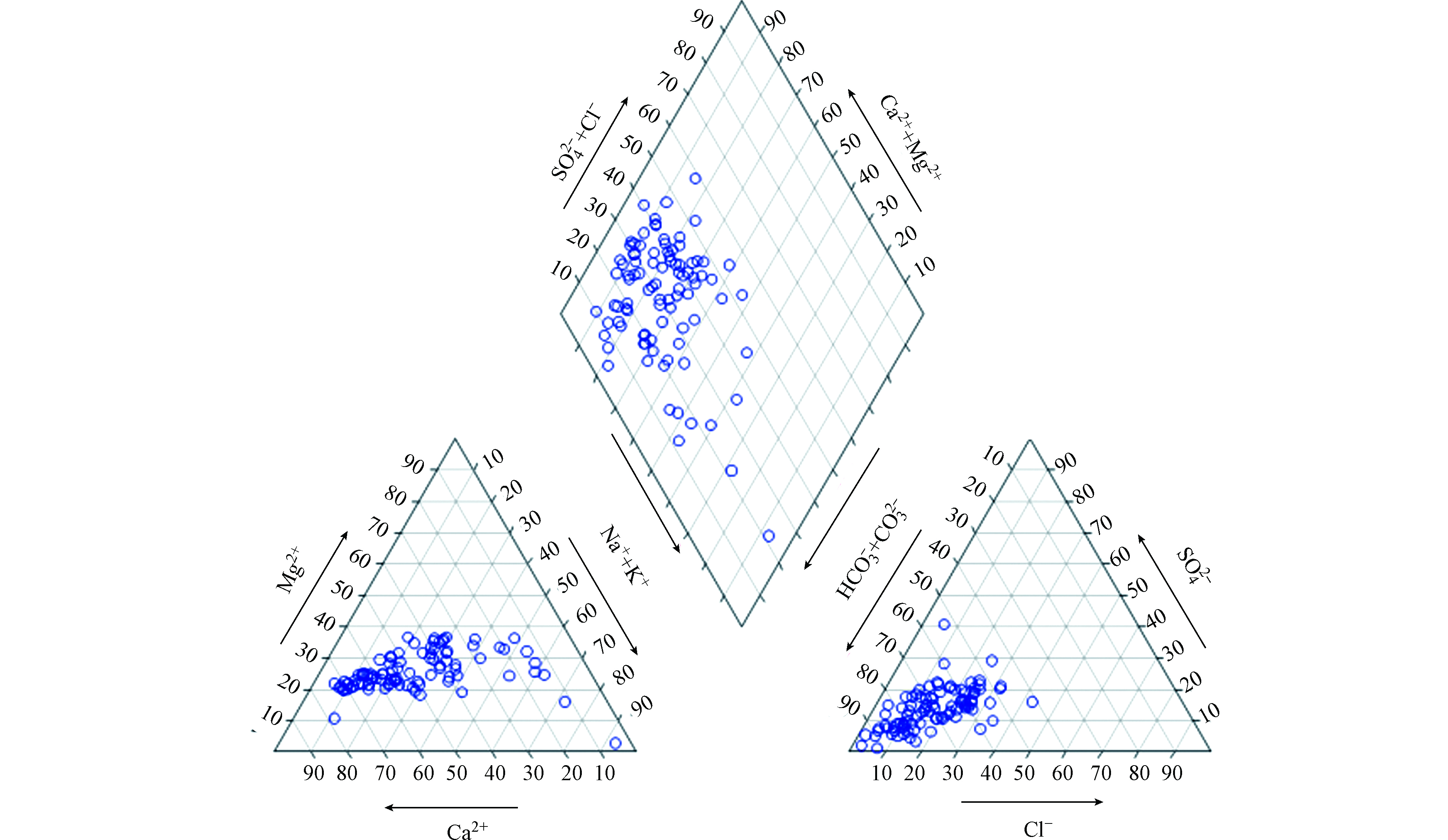
(1)水化学类型判定。本研究按照舒克列夫分类法,即阴阳离子毫克当量百分比大于25%时参与命名。对研究区采样点地下水化学类型定名,并绘制出了地下水化学类型Piper三线图。
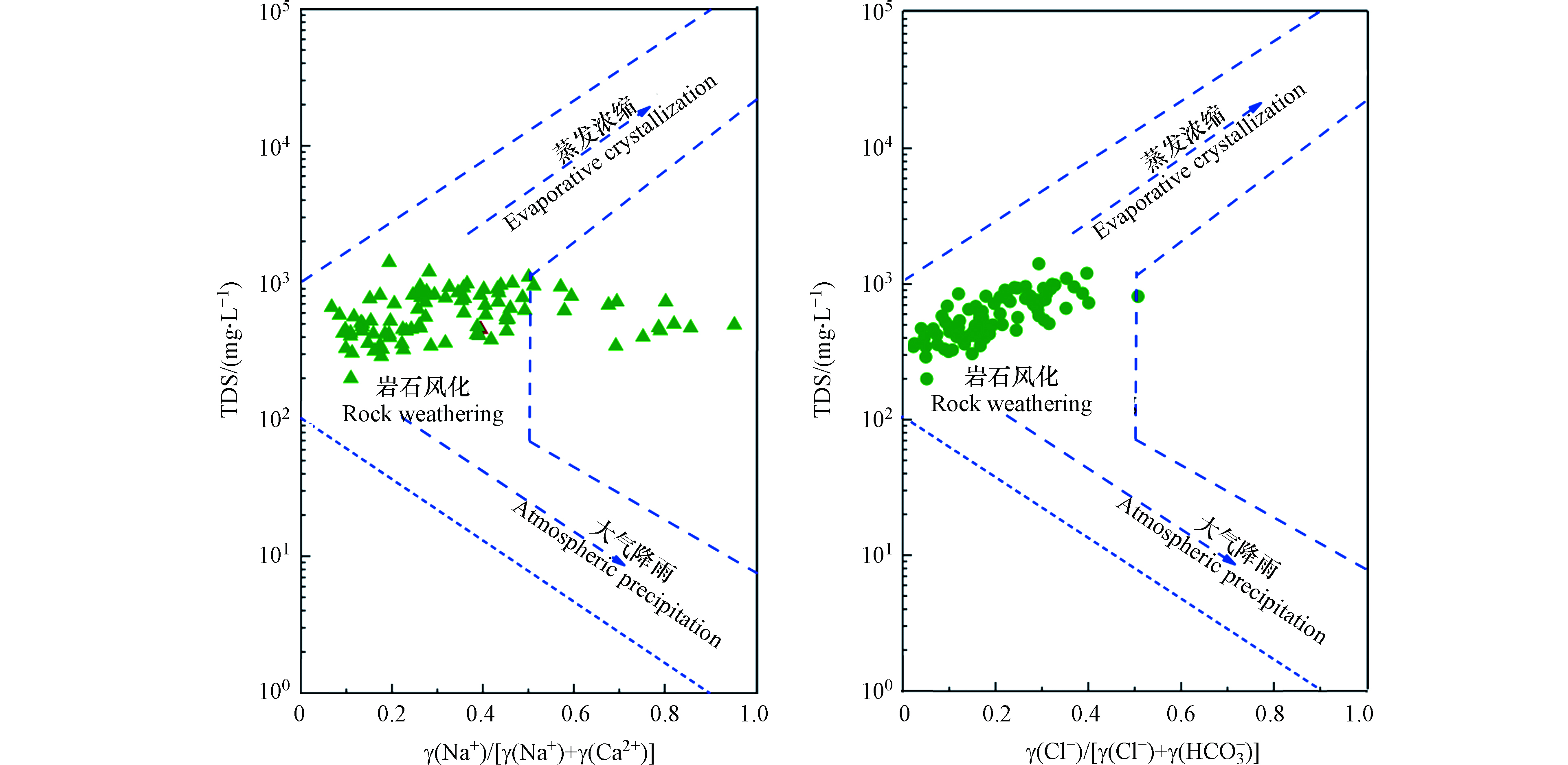
(2)地下水化学控制因素识别。选用Gibbs图识别地下水化学控制作用。通常情况下,水样位于 Gibbs 图右下角,表明其受大气降水作用影响较大,水样位于Gibbs 图左中部,表明岩石风化作用是该地区水化学的主要控制作用,而受蒸发结晶作用控制的水样将落于Gibbs 图右上角。
(3)离子来源识别。联合应用Ca2+/Na+ VS
HCO−3 HCO−3 HCO−3 HCO−3 (4)衬度系数方差。方差(Variance)用于刻画一个随机变量对其数学期望(均值)的离散程度。由于地下水各化学组分的绝对数值范围可能相差很大,无法进行方差的对比,为此,先求出每个样本每个变量(Xi)与该变量均值(
¯X Xi¯X 衬度系数方差(Vσi2)的计算公式如下:
Vσ2i=1n∑ni=1(Vi−¯Vi)2 (1) 式中,Vi是地下水第i个化学组分的衬度系数;
¯Vi 当Vσi2> 1时,说明该化学组分受人类活动影响强烈;当0.5<Vσi2<1时,说明该组分受中等强度的人类活动影响;当Vσi2<0.5时,说明该组分受人类活动影响较小。
此外,运用Spearman’s 秩相关系数分析了不同土地利用类型地下水水化学组分之间的相关关系。数据分析使用 R 语言(4.0.3)、Origin(2019b)和Arcgis 10.5。
2. 结果与讨论(Results and discussion)
2.1 地下水水化学特点
研究区pH值的范围介于6.71—8.51之间,均值为7.62,地下水为中性到弱碱性水,样品的超标率为1.1%(表1)。TDS 变化范围为200—1408 mg·L−1,均值为612 mg·L−1。地下水样品中
CO2−3 NH+4 HCO−3 SO2−4 NO−3 NO−2 NH+4 NO−3 表 1 研究区地下水水化学参数统计表Table 1. Descriptive statistics of groundwater hydrochemical parameters in the study area.均值Mean value 最小值Minimum value 最大值Maximum value 标准差Standard deviation 超标率/%Exceed standard rate 国标Ⅲ类Standard(Ⅲ) pH 7.62 6.71 8.51 0.26 1.1 6.5—8.5 TDS/(mg·L−1) 612 200 1408 231 3.2 1000 K+/(mg·L−1) 2.10 0.27 10.6 2.00 — — Na+/(mg·L−1) 69.5 6.72 208 48.5 1.1 200 Ca2+/(mg·L−1) 107 7.86 281 47.5 — — Mg2+/(mg·L−1) 36.1 2.90 87.0 16.6 — — HCO3−/(mg·L−1) 418 165 792 137 — — Cl−/(mg·L−1) 67.3 5.21 190 49.6 0 250 SO42-/(mg·L−1) 71.8 4.03 248 47.9 0 250 NO3−/(mg·L−1) 42.4 0.20 338 66.3 19.4 88.6 NH4+/(mg·L−1) 0.159 0.002 1.106 0.237 6.5 0.64 NO2−/(mg·L−1) 0.160 0.002 1.960 0.307 0 3.29 TH/(mg·L−1) 414 28.3 978 159 39.8 450 注:国标Ⅲ类指地下水质量标准Ⅲ类(GB/T14848-2017)[17]. Note: Standard is grade Ⅲ standard for groundwater quality in China (GB/T14848-2017)[17]. 2.2 地下水水化学类型
Piper三线图常用来表征地下水化学成分的演化规律[18]。由图2 可以看出,研究区地下水主要的水化学类型为HCO3-Ca(Mg)型,占总水样的46.2%。近年来,由于人类活动的干扰,地下水水化学类型趋于复杂化,出现了Cl型水(18.3%),Na型水(39.8%)和SO4型水(3.2%)。不同土地利用类型下地下水水化学类型有明显的区别。正如表2显示,在农业用地和工矿用地中,地下水主要的水化学类型是HCO3-Ca(Mg)型,但是,农业用地受到施肥的影响,水化学类型出现了Cl型水(20.8%)和SO4型水(6.25%)。住宅用地地下水主要的水化学类型是HCO3-Ca(Mg)型水(40.0%),并且Na型水出现的比例高达55.0%。此外,在湿地(郑州黄河湿地自然保护区)内,Na型水是地下水主要的水化学类型,占比高达89.5%,这主要与湿地地下水受到黄河水和污水处理厂回水混合影响有关。
表 2 研究区不同土地利用类型地下水水化学类型统计表Table 2. Statistic table of groundwater hydrochemistry type of different land use in the study area水化学类型Hydrochemical type 水化学类型出现比例/%Proportions of hydrochemical type 农业用地Agricultural land 住宅用地Residential Land 湿地Wetland 工矿用地Industrial land HCO3-Ca(Mg) 58.3 40.0 10.5 83.3 Cl型水 20.8 20.0 10.5 16.7 Na型水 20.8 55.0 89.5 0 SO4型水 6.25 0 0 0 2.3 地下水化学的控制因素及离子来源
2.3.1 地下水化学的控制因素
地下水化学组分的形成机制主要受控于大气降雨、岩石风化、蒸发浓缩和混合作用等[19]。正如图3显示,地下水采样点的离子含量投点绝大部分落于Gibbs图中间位置,表明岩石风化是研究区地下水水化学离子组分的主要控制因素。但是,研究区部分采样点,有向右上方区域偏移的趋势,说明蒸发-浓缩作用对研究区地下水的水化学组分也有一定的影响。此外,部分点位超出了岩石分化的控制边界,说明这些采样点的水化学组分受到人类活动的影响。
2.3.2 人类活动的影响
衬度系数方差可用于区分地下水化学组分的形成以天然条件演化作用为主,还是受人类活动影响较大。地下水化学组分的衬度系数方差越大,表明该组分受人类活动影响就越强烈[20]。由表3可见,整体上看,在不同土地利用类型中地下水中的Ca2+、Mg2+和
HCO−3 NH+4 NO−3 NO−2 SO2−4 SO2−4 2.3.3 地下水化学的离子来源
为了进一步探讨地下水化学组分的来源,联合应用Ca2+/Na+ VS
HCO−3 HCO−3 表 3 中牟县地下水化学成分衬度系数方差表Table 3. variance analysis of contrast coefficient of groundwater hydrochemical compositions in the Zhongmu County水化学组分Hydrochemical compositions 农业用地Agricultural land 住宅用地Residential land 湿地Wetland 工矿用地Industrial land SO42− 0.513 0.267 0.283 0.796 Cl− 0.644 0.517 0.189 1.798 NH4+ 2.855 4.751 0.353 1.359 NO2− 4.938 3.168 1.297 1.949 NO3− 1.520 1.980 0.428 3.789 HCO3− 0.151 0.045 0.065 0.049 Na+ 0.725 0.279 0.183 0.443 K+ 1.232 0.933 0.380 0.156 Ca2+ 0.161 0.418 0.067 0.167 Mg2+ 0.256 0.140 0.092 0.100 2.4 水化学指标相关性分析
地下水化学组分之间的相互关系可以反映各离子的物质来源[22]。在本研究中,对农业用地、住宅用地和湿地地下水水化学组分分别做了相关性分析(表4),结果表明,农业用地地下水水化学组分,除三氮(NH4+、NO3−和NO2−)外,其余水化学组分之间均表现出极显著的正相关关系,表征它们来自于共同的来源。地下水中TDS、K+、Na +、Ca2+、Mg2+和HCO3− 主要来自于地层岩石风化[23-24]。在该研究区,这些离子主要受控于硅酸盐岩风化作用控制。NH4+与Cl−、TDS、SO42-、K+、Na +、Mg2+和HCO3−之间表现出显著或极显著的正相关关系。众所周知,NH4+主要来自于生活污水和化肥[25-26],并且污水和化肥中也含有一定量的Cl−、SO42-、K+和Na+。由于这些地下水样品在农业地区,因此,地下水中NH4+主要来自于化肥。水环境中NO3−的来源包括生活污水、化肥、粪肥、大气降雨等[27-28]。值得注意的是NO3−和NH4+表现出极显著的负相关关系,首先说明二者来自于共同的污染源-化肥。其次,由于NH4+在氧化环境下极易发生硝化反应转化为NO3−[29],从而降低水环境中NH4+的浓度。在这个地区,地下水处于氧化环境(DO的均值约为5.02 mg·L−1),并且NO3−的平均浓度高达61.7 mg·L−1,而NH4+的平均浓度仅为0.085 mg·L−1,表明地下水中发生了强烈硝化作用,所以二者表现出极显著的负相关关系。
在住宅用地,地下水中TDS、Cl−、SO42-、K+、Ca2+、Mg2+和HCO3−均表现出极显著的正相关关系,表征它们主要来自于地层岩石风化。值得关注的是Na+与NH4+表现出显著的正相关关系,表明二者有共同的来源。正如前面分析,水环境中的Na+与NH4+可能来自于生活污水和化肥[26]。由于采样站点位于住宅用地,并且村庄四周密布农田,且存在垃圾填埋场。因此,污水管网的破损,垃圾填埋场的渗漏,以及农业的施肥都会对其造成影响。与农业用地相似,NO3−和NH4+表现出显著的负相关关系,表明二者主要来自于生活污水和化肥,且地下水中发生了硝化作用。
表 4 研究区农业用地地下水水化学组分的相关性分析Table 4. Correlation analysis of groundwater hydrochemistry component of agricultural land in the study areaTH TDS SO42− Cl− NH4+ NO2− NO3− HCO3− Na+ K+ Ca2+ Mg2+ 农业用地 TH 1 0.950** 0.713** 0.877** 0.267 0.347* 0.132 0.778** 0.699** 0.663** 0.928** 0.916** TDS 1 0.801 0.922** 0.320* 0.337* 0.186 0.776** 0.796** 0.666** 0.850** 0.939** SO42− 1 0.750** 0.325* 0.093 −0.029 0.606** 0.709** 0.630** 0.624** 0.719** Cl− 1 0.396** 0.262 0.102 0.710** 0.764** 0.616** 0.815** 0.853** NH4+ 1 0.168 −0.496** 0.506** 0.532** 0.393** 0.188 0.402** NO2− 1 0.321* 0.170 0.176 0.030 0.356* 0.303* NO3− 1 −0.292* −0.222 −0.125 0.253 −0.003 HCO3− 1 0.879** 0.668** 0.587** 0.895** Na+ 1 0.642** 0.496** 0.880** K+ 1 0.619** 0.646** Ca2+ 1 0.732** Mg2+ 1 住宅 TH 1 0.767** 0.674** 0.734** −0.363 0.139 0.438 0.465* −0.344 0.513* 0.958** 0.681** TDS 1 0.893** 0.890** −0.122 0.159 0.283 0.626** 0.241 0.598** 0.684** 0.624** SO42− 1 0.832** −0.111 0.197 0.314 0.448* 0.266 0.352 0.593** 0.653** Cl− 1 −0.158 0.158 0.229 0.472* 0.111 0.543* 0.695** 0.614** NH4+ 1 0.272 −0.543* 0.19 0.480* −0.133 −0.436 −0.016 NO2− 1 0.193 0.002 0.06 0.252 0.257 0.207 NO3− 1 −0.373 −0.441 0.065 0.487* 0.099 HCO3− 1 0.424 0.564** 0.333 0.43 Na+ 1 0.089 −0.445* 0.032 K+ 1 0.471* 0.460* Ca2+ 1 0.531* Mg2+ 1 湿地 TH 1 0.946** 0.639** 0.722** −0.031 0.217 0.421 0.786** 0.789** 0.298 0.883** 0.818** TDS 1 0.611** 0.736** 0.109 0.098 0.333 0.830** 0.918** 0.291 0.787** 0.823** SO42− 1 0.756** 0.053 0.14 0.379 0.16 0.416 0.077 0.685** 0.391 Cl− 1 0.213 0.225 0.235 0.302 0.600** −0.057 0.705** 0.505* NH4+ 1 0.2 −0.552* 0.055 0.176 −0.301 −0.175 0.048 NO2− 1 0.265 0.043 −0.021 0.108 0.157 0.219 NO3− 1 0.168 0.213 0.169 0.315 0.463* HCO3− 1 0.844* 0.396 0.565* 0.821* Na+ 1 0.281 0.591** 0.825* K+ 1 0.296 0.261 Ca2+ 1 0.556* Mg2+ 1 注:** 表示在 0.01 水平上线性相关,* 表示在 0.05 水平上线性相关. Note:** P<0.01; * P<0.05. 在湿地,水化学指标TDS、Cl−、
SO2−4 NH+4 NO−3 NO−3 NH+4 NO−3 NO−3 3. 结论(Conclusion)
(1)郑州市中牟县地下水pH的变化范围介于6.71—8.51之间,处于中性到弱碱性。地下水中阳离子的大小排序为Ca2+> Na+> Mg2+>K+>
NH+4 HCO−3 SO2−4 NO−3 NO−2 NO−3 (2)地下水水化学类型主要为HCO3-Ca(Mg)型,占总水样的46.2%。农业用地受到施肥的影响,水化学类型出现了Cl型水和SO4型水。而湿地受黄河水和污水处理厂回水补给的混合影响,导致主要的水化学类型改变为HCO3-Ca·Mg·Na型水。
(3)基于Gibbs模型分析表明,中牟县地下水水化学组分主要控制因素是岩石风化作用。人类活动对水化学组分也存在一定的影响。其中,三氮受人类活动影响强烈,而Na+、K+、
SO2−4 (4)基于相关性分析,在不同土地利用类型下,地下水水化学组分除三氮(NH4+、NO3−和NO2−)外,均表现出极显著或显著的正相关关系,表征它们来自于地层岩石风化。而NH4+和NO3−表现出显著的负相关关系,二者主要来自于化肥和生活污水。在农业用地和住宅用地中地下水可能发生强烈的硝化作用,但在湿地,地下水受到黄河河水的稀释,且地下水可能发生了反硝化作用。
(5)上述研究结果表明,生活污水和化肥是该地区地下水主要的污染源。因此,建议当地政府和环保部门要严格立法和监管,禁止生活污水的不达标排放。此外,农业管理者应该推广科学施肥策略(如测土配方施肥,因时和因作物施肥,施用缓释肥等)来提高肥料的利用率,防止过量施肥对地下水的污染。
-
表 1 砷单独暴露以及砷和铅共同暴露时斑马鱼体内砷的毒代动力学参数(n=3)
Table 1. Toxicokinetic parameters of arsenic in zebrafish in arsenic-only exposure and arsenic and lead co-exposure (n=3)
毒代动力学参数Toxicokinetic parameter 砷单独暴露Arsenic-only exposure 砷和铅共同暴露Arsenic and lead co-exposure ku/(L·kg−1·d−1) 0.0825±0.0170 0.0560±0.0089 ke/d−1 0.645±0.153 0.729±0.131 t1/2/d 8.4 12.4 BCF/(L·kg−1) 0.128 0.0768 R2 0.66 0.77 -
[1] 余涛, 蒋天宇, 刘旭, 等. 土壤重金属污染现状及检测分析技术研究进展 [J]. 中国地质, 2021, 48(2): 460-476. YU T, JIANG T Y, LIU X, et al. Research progress in current status of soil heavy metal pollution and analysis technology [J]. Geology in China, 2021, 48(2): 460-476(in Chinese).
[2] WU Y F, LI X, YU L, et al. Review of soil heavy metal pollution in China: Spatial distribution, primary sources, and remediation alternatives [J]. Resources, Conservation and Recycling, 2022, 181: 106261. doi: 10.1016/j.resconrec.2022.106261 [3] 黎森, 王敦球, 于焕云. 铅-砷交互作用影响小白菜生长及铅砷积累的效应研究 [J]. 生态环境学报, 2019, 28(1): 170-180. LI S, WANG D Q, YU H Y. Effect of Pb and As interaction on the growth and As and Pb accumulation of Brassica campestris L. [J]. Ecology and Environmental Sciences, 2019, 28(1): 170-180(in Chinese).
[4] QIN Y H, TAO Y Q. Pollution status of heavy metals and metalloids in Chinese lakes: Distribution, bioaccumulation and risk assessment [J]. Ecotoxicology and Environmental Safety, 2022, 248: 114293. doi: 10.1016/j.ecoenv.2022.114293 [5] FATOKI J O, BADMUS J A. Arsenic as an environmental and human health antagonist: A review of its toxicity and disease initiation [J]. Journal of Hazardous Materials Advances, 2022, 5: 100052. doi: 10.1016/j.hazadv.2022.100052 [6] FLORA G, GUPTA D, TIWARI A. Toxicity of lead: A review with recent updates [J]. Interdisciplinary Toxicology, 2012, 5(2): 47-58. doi: 10.2478/v10102-012-0009-2 [7] JONES E A, WRIGHT J M, RICE G, et al. Metal exposures in an inner-city neonatal population [J]. Environment International, 2010, 36(7): 649-654. doi: 10.1016/j.envint.2010.04.007 [8] World Health Organization. Agents Classified by the IARC Monographs, Volumes 1–132[EB/OL]. [2022-09-23]. [9] 汤亚云, 管凡荀, 高鹏飞, 等. 不同国家或组织动物源性食品中重金属限量标准的比较研究 [J]. 黑龙江畜牧兽医, 2022(14): 8-13+21. doi: 10.13881/j.cnki.hljxmsy.2021.04.0346 TANG Y Y, GUAN F X, GAO P F, et al. Comparative study on heavy metal limit standards of animal derived food in different countries or organizations [J]. Heilongjiang Animal Science and Veterinary Medicine, 2022(14): 8-13+21(in Chinese). doi: 10.13881/j.cnki.hljxmsy.2021.04.0346
[10] FOWLER B A, WHITTAKER M H, LIPSKY M, et al. Oxidative stress induced by lead, cadmium and arsenic mixtures: 30-day, 90-day, and 180-day drinking water studies in rats: An overview [J]. Biometals, 2004, 17(5): 567-568. doi: 10.1023/B:BIOM.0000045740.52182.9d [11] 钱学诗, 李勇, 钱壮壮, 等. 北亚热带东部次生阔叶林降水过程中的镉、铅、砷含量变化 [J]. 生态环境学报, 2022, 31(5): 979-989. QIAN X S, LI Y, QIAN Z Z, et al. Changes of cadmium, lead and arsenic contents during precipitation in the secondary broad-leaved forest in the eastern area of north subtropics, China [J]. Ecology and Environmental Sciences, 2022, 31(5): 979-989(in Chinese).
[12] 曲良, 谭海涛, 刘涛, 等. 北部湾铁山港附近海域水体和沉积物重金属分布特征及生态风险评价 [J]. 环境化学, 2023, 42(3): 757-768. doi: http://dx.doi.org/10.7524/j.issn.0254-6108.2022102606 QU L, TAN H T, LIU T, et al. Distribution characteristics and potential ecological risk of heavy metals in the seawater and sediment of Tieshan Port, Beibu Gulf [J]. Environmental Chemistry, 2023, 42(3): 757-768(in Chinese). doi: http://dx.doi.org/10.7524/j.issn.0254-6108.2022102606
[13] 杨小俊, 次仁德吉, 吴雪莲, 等. 铅—砷交互作用对青稞苗期生长及铅砷吸收积累的影响 [J]. 西南农业学报, 2022, 35(9): 2189-2196. YANG X J, CIRENDEJI, WU X L, et al. Effect of Pb-As interaction on highland barley growth and Pb-As uptake and accumulation at seedling stage [J]. Southwest China Journal of Agricultural Sciences, 2022, 35(9): 2189-2196(in Chinese).
[14] CUI D, ZHANG P, LI H P, et al. The dynamic changes of arsenic biotransformation and bioaccumulation in muscle of freshwater food fish crucian carp during chronic dietborne exposure [J]. Journal of Environmental Sciences, 2021, 100: 74-81. doi: 10.1016/j.jes.2020.07.005 [15] LIU X S, WANG J M, HUANG Y W. Quantifying the effect of nano-TiO2 on the toxicity of lead on C. dubia using a two-compartment modeling approach [J]. Chemosphere, 2021, 263: 127958. doi: 10.1016/j.chemosphere.2020.127958 [16] GAO Y F, XIE Z C, ZHU J X, et al. Understanding the effects of metal pre-exposure on the sensitivity of zebrafish larvae to metal toxicity: A toxicokinetics–toxicodynamics approach [J]. Ecotoxicology and Environmental Safety, 2021, 209: 111788. doi: 10.1016/j.ecoenv.2020.111788 [17] GAO Y F, ZHANG Y, FENG J F, et al. Toxicokinetic−toxicodynamic modeling of cadmium and lead toxicity to larvae and adult zebrafish [J]. Environmental Pollution, 2019, 251: 221-229. doi: 10.1016/j.envpol.2019.05.003 [18] HUANG C D, GE Y, SHEN Z Q, et al. Reveal the metal handling and resistance of earthworm Metaphire californica with different exposure history through toxicokinetic modeling [J]. Environmental Pollution, 2021, 289: 117954. doi: 10.1016/j.envpol.2021.117954 [19] WANG W X, TAN Q G. Applications of dynamic models in predicting the bioaccumulation, transport and toxicity of trace metals in aquatic organisms [J]. Environmental Pollution, 2019, 252: 1561-1573. doi: 10.1016/j.envpol.2019.06.043 [20] OLLSON C J, SMITH E, HERDE P, et al. Influence of co-contaminant exposure on the absorption of arsenic, cadmium and lead [J]. Chemosphere, 2017, 168: 658-666. doi: 10.1016/j.chemosphere.2016.11.010 [21] 冯剑丰, 高永飞, 朱景雪, 等. 毒代-毒效动力学模型及其在金属水生态风险评估中的应用研究进展 [J]. 环境工程, 2019, 37(11): 10-18,124. FENG J F, GAO Y F, ZHU J X, et al. Application of toxicokinetic-toxicodynamic models in aquatic ecological risk assessment for metals [J]. Environmental Engineering, 2019, 37(11): 10-18,124(in Chinese).
[22] 甘露菁, 荣菡, 杨丹, 等. 斑马鱼对铜、铅和镍的生物富集动力学研究 [J]. 中国食物与营养, 2019, 25(11): 25-29. GAN L J, RONG H, YANG D, et al. Bioaccumulation kinetics of Brachydanio rerio on copper, lead and nickel [J]. Food and Nutrition in China, 2019, 25(11): 25-29(in Chinese).
[23] 李欢, 张静丽, 张诗雨, 等. 四环素和砷对斑马鱼的联合毒性及机制 [J]. 中国环境科学, 2021, 41(7): 3371-3380. LI H, ZHANG J L, ZHANG S Y, et al. Combined toxicity and underlying mechanism of tetracycline and arsenic on zebrafish [J]. China Environmental Science, 2021, 41(7): 3371-3380(in Chinese).
[24] ADOLFSSON-ERICI M, ÅKERMAN G, JAHNKE A, et al. A flow-through passive dosing system for continuously supplying aqueous solutions of hydrophobic chemicals to bioconcentration and aquatic toxicity tests [J]. Chemosphere, 2012, 86(6): 593-599. doi: 10.1016/j.chemosphere.2011.10.024 [25] OECD. Test No. 417: Toxicokinetics, OECD Guidelines for the Testing of Chemicals, Section 4[M]. Paris: OECD Publishing, 2010. [26] CHEN X, LI H Z, ZHANG J J, et al. Does cadmium affect the toxicokinetics of permethrin in Chironomus dilutus at sublethal level? Evidence of enzymatic activity and gene expression [J]. Environmental Pollution, 2016, 218: 1005-1013. doi: 10.1016/j.envpol.2016.08.051 [27] 祁红学, 李慧珍, 游静. 被动加标在水生生态风险评价中的应用——以多氯联苯分配系数的测定为例 [J]. 生态毒理学报, 2015, 10(2): 45-55. QI H X, LI H Z, YOU J. Application of passive dosing in aquatic ecological risk assessment: A case study of measuring partition coefficients of polychlorinated biphenyls [J]. Asian Journal of Ecotoxicology, 2015, 10(2): 45-55(in Chinese).
[28] LI H Z, YOU J, WANG W X. Multi-compartmental toxicokinetic modeling of fipronil in tilapia: Accumulation, biotransformation and elimination [J]. Journal of Hazardous Materials, 2018, 360: 420-427. doi: 10.1016/j.jhazmat.2018.07.085 [29] CHEN L Z, SONG D D, ZHANG W, et al. The dynamic changes of arsenic bioaccumulation and antioxidant responses in the marine medaka Oryzias melastigma during chronic exposure [J]. Aquatic Toxicology, 2019, 212: 110-119. doi: 10.1016/j.aquatox.2019.05.001 [30] GAO Y F, KANG L L, ZHANG Y, et al. Toxicokinetic and toxicodynamic (TK-TD) modeling to study oxidative stress-dependent toxicity of heavy metals in zebrafish [J]. Chemosphere, 2019, 220: 774-782. doi: 10.1016/j.chemosphere.2018.12.197 [31] ZHANG Y, FENG J F, GAO Y F, et al. Physiologically based toxicokinetic and toxicodynamic (PBTK-TD) modelling of Cd and Pb exposure in adult zebrafish Danio rerio: Accumulation and toxicity [J]. Environmental Pollution, 2019, 249: 959-968. doi: 10.1016/j.envpol.2019.03.115 [32] LIU F J, GENTLES A, THEODORAKIS C W. Arsenate and perchlorate toxicity, growth effects, and thyroid histopathology in hypothyroid zebrafish Danio rerio [J]. Chemosphere, 2008, 71(7): 1369-1376. doi: 10.1016/j.chemosphere.2007.11.036 [33] SARKAR S, MUKHERJEE S, CHATTOPADHYAY A, et al. Low dose of arsenic trioxide triggers oxidative stress in zebrafish brain: Expression of antioxidant genes [J]. Ecotoxicology and Environmental Safety, 2014, 107: 1-8. doi: 10.1016/j.ecoenv.2014.05.012 [34] BYEON E, KANG H M, YOON C, et al. Toxicity mechanisms of arsenic compounds in aquatic organisms [J]. Aquatic Toxicology, 2021, 237: 105901. doi: 10.1016/j.aquatox.2021.105901 [35] 李梓萌, 李肖乾, 张文慧, 等. 重金属复合污染对生物影响的研究进展 [J]. 环境化学, 2021, 40(11): 3331-3343. doi: http://dx.doi.org/10.7524/j.issn.0254-6108.2021033107 LI Z M, LI X Q, ZHANG W H, et al. Research progress on the effects of heavy metal compound pollution on organisms [J]. Environmental Chemistry, 2021, 40(11): 3331-3343(in Chinese). doi: http://dx.doi.org/10.7524/j.issn.0254-6108.2021033107
[36] MUTHUSAMY S, PENG C, NG J C. Effects of binary mixtures of benzo[a]pyrene, arsenic, cadmium, and lead on oxidative stress and toxicity in HepG2 cells [J]. Chemosphere, 2016, 165: 41-51. doi: 10.1016/j.chemosphere.2016.08.137 [37] 邢胜男. 斑马鱼胚胎发育毒性试验评价重金属联合生物毒性[D]. 上海: 上海师范大学, 2016. XING S N. Evaluation of combined biotoxicity of heavy metals by zebrafish embryo development toxicity test[D]. Shanghai: Shanghai Normal University, 2016 (in Chinese).
[38] VELLINGER C, PARANT M, ROUSSELLE P, et al. Antagonistic toxicity of arsenate and cadmium in a freshwater amphipod (Gammarus pulex) [J]. Ecotoxicology, 2012, 21(7): 1817-1827. doi: 10.1007/s10646-012-0916-1 [39] VELLINGER C, GISMONDI E, FELTEN V, et al. Single and combined effects of cadmium and arsenate in Gammarus pulex (Crustacea, Amphipoda): Understanding the links between physiological and behavioural responses [J]. Aquatic Toxicology, 2013, 140/141: 106-116. doi: 10.1016/j.aquatox.2013.05.010 [40] MEHLER W T, DU J, LYDY M J, et al. Joint toxicity of a pyrethroid insecticide, cypermethrin, and a heavy metal, lead, to the benthic invertebrate Chironomus dilutus [J]. Environmental Toxicology and Chemistry, 2011, 30(12): 2838-2845. doi: 10.1002/etc.689 [41] LI X X, CUI X W, ZHANG X, et al. Combined toxicity and detoxification of lead, cadmium and arsenic in Solanum nigrum L. [J]. Journal of Hazardous Materials, 2020, 389: 121874. doi: 10.1016/j.jhazmat.2019.121874 [42] LIU X S, WANG J M, HUANG Y W. Understanding the role of nano-TiO2 on the toxicity of Pb on C. dubia through modeling—Is it additive or synergistic? [J]. Frontiers of Environmental Science & Engineering, 2022, 16(5): 59. [43] BROERSE M, OORSPRONG H, van GESTEL C A M. Cadmium affects toxicokinetics of pyrene in the collembolan Folsomia candida [J]. Ecotoxicology, 2012, 21(3): 795-802. doi: 10.1007/s10646-011-0839-2 [44] STEEVENS J A, BENSON W H. Toxicokinetic interactions and survival of Hyalella azteca exposed to binary mixtures of chlorpyrifos, dieldrin, and methyl mercury [J]. Aquatic Toxicology, 2001, 51(4): 377-388. doi: 10.1016/S0166-445X(00)00127-2 [45] GARBINSKI L D, ROSEN B P, CHEN J. Pathways of arsenic uptake and efflux [J]. Environment International, 2019, 126: 585-597. doi: 10.1016/j.envint.2019.02.058 [46] MILLER D S, SHAW J R, STANTON C R, et al. MRP2 and acquired tolerance to inorganic arsenic in the kidney of killifish (Fundulus heteroclitus) [J]. Toxicological Sciences, 2007, 97(1): 103-110. doi: 10.1093/toxsci/kfm030 [47] JEONG C B, KIM H S, KANG H M, et al. ATP-binding cassette (ABC) proteins in aquatic invertebrates: Evolutionary significance and application in marine ecotoxicology [J]. Aquatic Toxicology, 2017, 185: 29-39. doi: 10.1016/j.aquatox.2017.01.013 -




 下载:
下载: