-
电镀是工业产业链中的重要环节,在电子电器、装备制造等领域都有广泛应用. 近年来我国电镀行业发展迅速,且分布较为集中,主要位于长三角、珠三角、京津冀等制造业比较发达的地区[1]. 我国电镀加工中涉及最广的是镀锌、镀铜、镀镍、镀铬. 电镀行业使用大量强酸、强碱、重金属溶液,甚至铬酸酐、持久性有机污染物等有毒有害化学品,通过电镀液泄漏、三废排放等,将锌、铜、镍、铬等重金属和全氟化合物(perfluorinated compounds,PFASs)排入环境,危害生态系统安全[2 − 6]. 我国对电镀排放重金属的研究已久,尤其是电镀废水的处置以及对周边土壤和水体环境的影响. 卢然等搜集电镀地块调查报告和文献,分析地块中重金属、氰化物和有机物,结果发现土壤及地下水中超标因子主要为重金属[7]. 刘芸等使用化学品足迹法筛查电镀行业潜在高风险化学品,发现仅电镀一个行业在达标排放的情况下,就可能对区域生态环境产生风险[8],但缺乏对全国整体污染状况的分析.
全氟辛烷磺酸(perfluorooctane sulphonate,PFOS)是一类典型全氟化合物. 长久以来,PFOS及其盐类是电镀过程中普遍使用的铬雾抑制剂,旨在保护工人免受空气中高毒性的铬暴露. 然而,因其具有高持久性、远距离运输和生物积累的特点,对生态环境和人类健康构成巨大威胁[9 − 11],2009年被列入斯德哥尔摩公约. 全氟烷基醚磺酸盐(6:2 chlorinated polyfluorinated ether sulfonate,F-53B)在20世纪70年代首次合成,已有50多年使用历史[12 − 13]. 当前作为PFOS在电镀行业的替代品,其需求也在不断增加. F-53B被证实具有生物累积性[14]、难降解性[12],在污水、污泥、土壤、水体等多种环境中被广泛检出. 部分研究发现,F-53B的生物累积潜力可能高于PFOS[13 − 14]. 同时有迹象表明,F-53B可以在水生食物网中被生物放大[15],是目前为止发现最具生物持久性的全氟化合物[16]. 目前,针对电镀行业污染物排放的研究通常针对工业场地及周边区域展开,但缺乏对全国电镀污染物分布特征及风险评估的综合报道,尤其是针对全氟化合物的系统分析. 因此,本文通过对国内外文献的整体综述,阐述生产工艺、运行时间等对重金属及全氟化合物时空分布的影响,进而评估不同区域电镀行业带来的环境风险.
-
改革开放的深入和制造业的发展推动了电镀行业的进步. 从规模上看,我国已经成为电镀业大国. 长三角、珠三角、京津冀和长江经济带作为我国经济快速发展区,电镀分布较为集中,也是本文的重点研究区域. 本文研究区域还包含出经济快速发展区之外的其他地区,我国其他地区也存在部分电镀厂,但数量相比于经济快速发展区较少.
-
本文通过文献检索平台,搜集重金属相关文献48篇、全氟化合物相关文献22篇. 采用Meta(Meta-analysis)分析方法,统计了各个电镀厂的建厂年份、生产工艺、地理位置以及污染物浓度等信息,对所搜集的数据进行定量合并分析,结合风险评价方法研究电镀厂污染物对电镀场地内部及周边区域环境的影响. Meta分析是用于比较和综合针对同一科学问题研究结果的统计学方法,相比于一般的统计学方法,Meta分析可以通过异质性检验,提高结果的全面性、客观性和真实性[17 − 18].
-
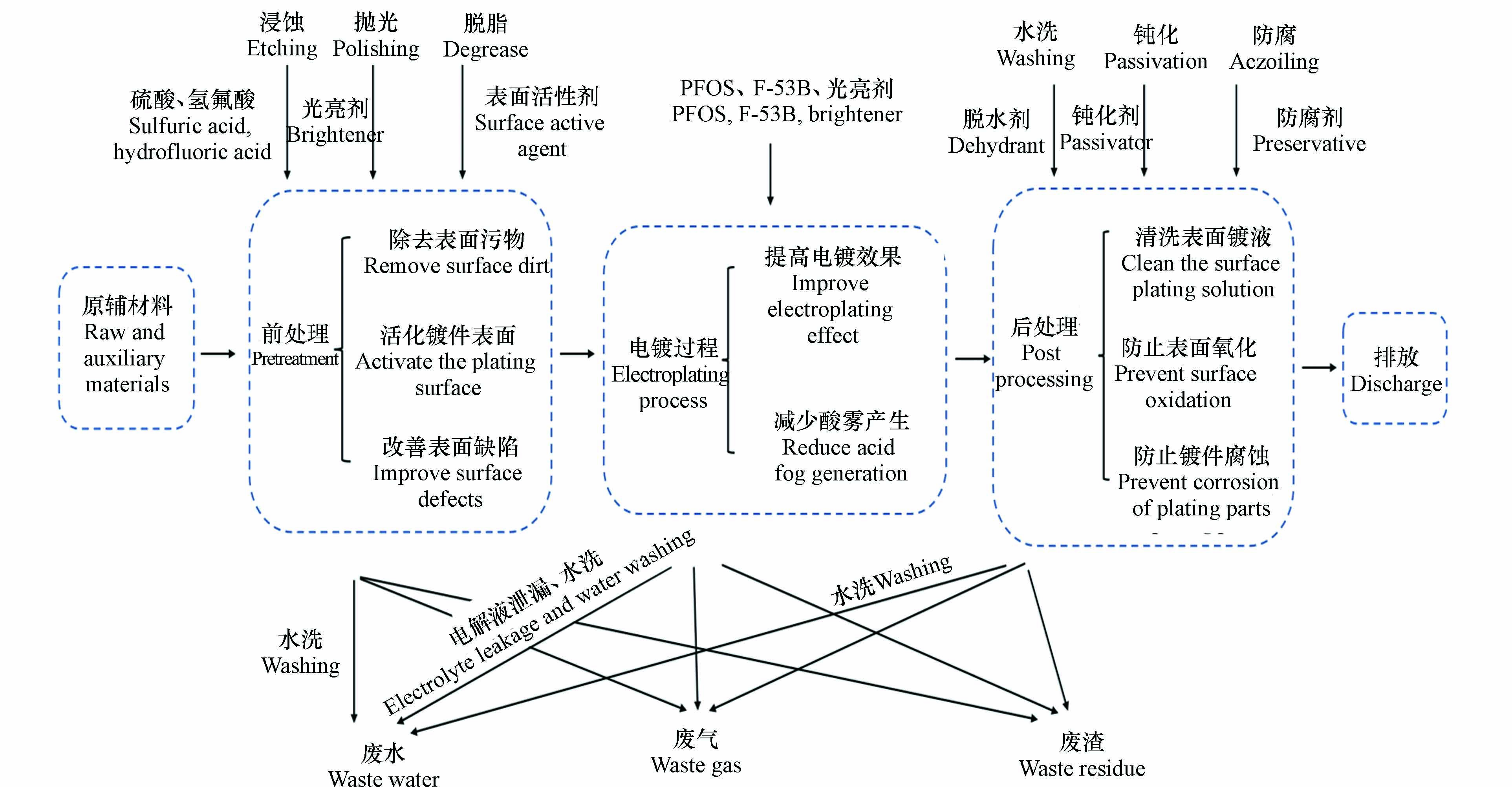
电镀是利用电解原理在金属或其它材料表面附着一层金属或合金的过程,从而增强硬度,提高耐磨性、防腐性、导电性、反光性等[19]. 电镀的主要工艺流程及污染物排放环节见图1.
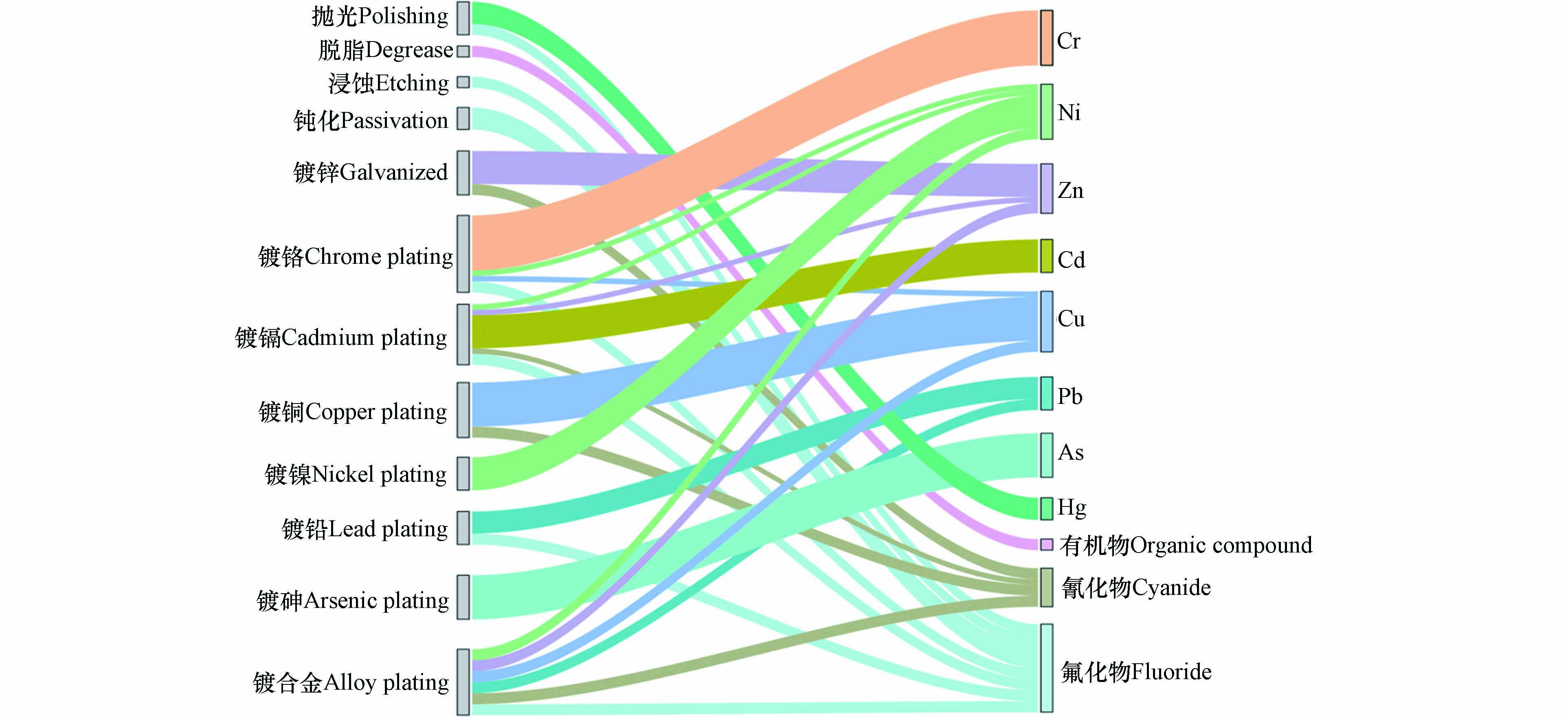
首先是电镀前处理,这个环节使用有机溶剂、清洗剂、乳化剂、表面活性剂等多种添加剂,从而达到去除镀件表面污染物、活化镀件表面和改善镀件表面缺陷的效果[20]. 其次是电镀环节,为了提高电镀效果、保护操作人员健康、保护机器设备、减少浪费,使用光亮剂、PFOS和F-53B等添加剂,这些添加剂中含有大量的氟化物. 在电镀加工过程中,不同的电镀工艺也会排放不同的重金属[21]. 最后是电镀后处理环节,主要包括脱水、钝化和防腐等工艺,此过程脱水剂、钝化剂以及保护剂中一般含一种或多种有机化合物[22]. 在电镀生产过程中会产生电镀废液、固体废弃物以及废气,其中含有大量重金属、全氟化合物、氰化物等. 氰化物在电镀过程中主要起到络合作用. 整个电镀过程中产生的废水经末端处理后排放到河流、土壤等环境介质中,造成环境与健康风险[7]. 企业管理不规范同样会导致电镀过程中电解液和电镀废水跑冒滴漏以及管道泄漏,或是电镀原辅料等随意堆放造成重金属、全氟化合物等污染[23]. 对电镀生产过程中可能产生的污染物进行分析,主要有重金属、有机物、氰化物和氟化物. 图2为不同电镀工艺产生的污染物及贡献示意图,可以看出各种重金属污染物主要来源于对应镀种,有机物主要来源于脱脂过程. 氟化物的来源较多,除脱脂、镀锌、镀铜、镀镍和镀砷外,其他工艺均有氟化物产生. 镀锌、镀镉、镀铜和镀合金中都有氰化物的产生. 原国家经济贸易委员会在2002年发布了第三批关于《淘汰落后生产能力、工艺和产品的目录》的第32号令,提出全面淘汰含氰电镀工艺的指令,目前我国电镀行业工艺大都为无氰工艺. 本文重点关注场地土壤中检出频率较高的重金属以及场地和周边区域中持久性有机污染物PFOS及其替代品F-53B.
为了控制重金属和全氟化合物的污染,掌握污染物的生产、使用、排放及影响是非常必要的. 蔡昂祖等人使用APCS-MLR对邯郸市某工业园区周边重金属进行源解析,发现电镀在内的工业源对土壤中重金属的贡献率达28.31%[24]. 刘胜然等利用PMF对珠三角某市土壤中重金属进行源解析,发现电镀聚集区工业源对Cr的贡献达66.4%,Cr是典型的电镀污染产物,说明土壤中的重金属与电镀行业有着密切联系[25]. 关于全氟化合物的报道也有很多,Li等对华北平原地下水中的PFASs进行源解析,发现金属电镀贡献为17.2%[26]. 对全国的研究发现,2010年我国主要工业来源的PFOS总排放量为70 t,金属电镀工业使用PFOS被确定为PFOS的最大污染源,排放量为35 t[27]. 上海一制造商为全国电镀厂提供F-53B,研究估算出2013年F-53B的年消耗量约为13.4 t,在2006—2015年期间保持稳定,约为每年10—14 t. 基于全国工业调查和统计数据,估算得出从2006年到2015年F-53B的累积环境排放量约为125 t[28]. 整体看出,电镀场地排放重金属和全氟化合物对周边环境的影响以及对新污染物的贡献不容忽视.
-
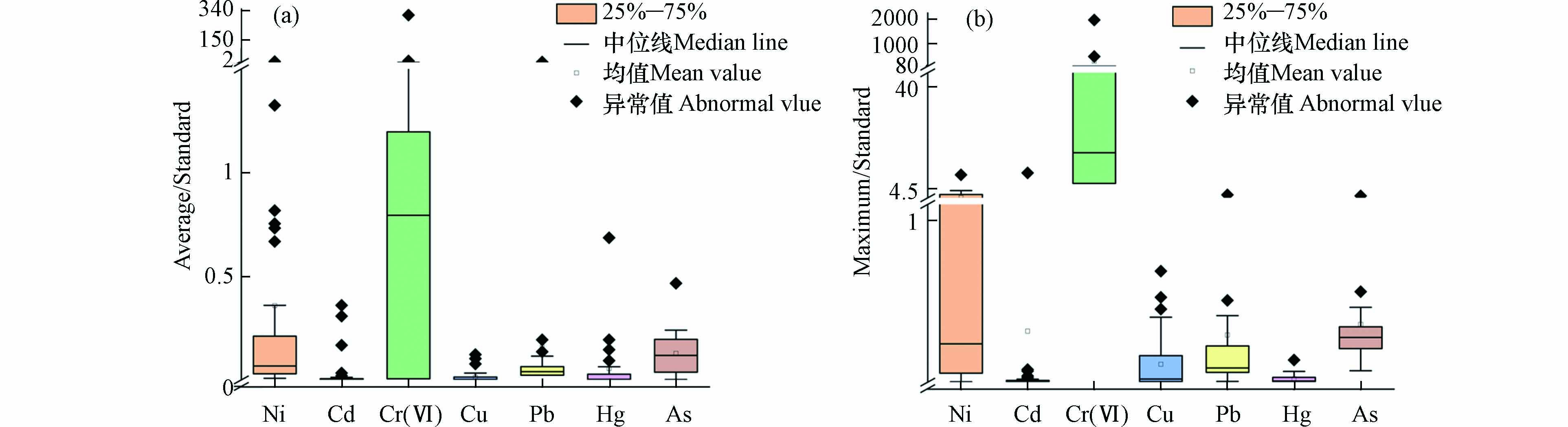
为探究全国电镀场地重金属污染状况及风险,本文对建厂年份、生产工艺、地理位置以及重金属浓度等进行统计分析[3 − 5,29 − 67]. 将电镀场地及周边土壤中7种重金属Ni、Cd、Cr(Ⅵ)、Cu、Pb、Hg和As的平均浓度与《土壤环境质量 建设用地土壤污染风险管控标准》(GB36600-—2018)中的第二类用地筛选值相比,比较值大于1即为超标,反之不超标,结果见图3(a). Ni、Cr(Ⅵ)和Pb都存在超标现象,且超标点位均为电镀场地内部采样点. Ni的筛选值为900 mg·kg−1,经对比结果为
0.0085 —6.93,有两个数据超标,浓度分别为1188 mg·kg−1[35]和6240 mg·kg−1[65],超标1.32倍和6.93倍,位于长三角和珠三角地区. 长三角电镀场地超标点位大多位于电镀车间和填埋场,造成这一现象的原因是电镀过程以及遗留的废液废渣. Cr(Ⅵ)的筛选值为5.7 mg·kg−1,结果范围为0.0007 —310存在7个超标数据,有两个点位浓度达到1770 mg·kg−1[65]和61 mg·kg−1[57],超标310倍和10.7倍. 超标电镀场地均位于珠三角地区,都存在镀铬工艺,与超标污染因子相符合. 检测均值为61 mg·kg−1的电镀厂主要工艺为镀铬、镀镍和镀铜,Cr(Ⅵ)的超标点位主要集中在电镀车间的深层土壤中,究其原因,土壤对Cr(Ⅵ)的吸附作用大小与地下水的pH有关,此电镀场地的地下水pH大都处于6.5—7.5之间,土壤对Cr(Ⅵ)的吸附量较小,且Cr(Ⅵ)易溶于水,还具有较强的迁移能力,电镀车间的岩土类型为全风化花岗岩,渗透性较好,有利于Cr(Ⅵ)向深部迁移[57]. Pb的筛选值为800 mg·kg−1,对比结果为0.0008 —4.17,存在1个超标数据,超标4.17倍,位于珠三角[65]. 其它4类重金属Cd、Cu、Hg、As均值浓度的计算结果分别为0.0004 —0.360、0.0001 —0.123、0.0007 —0.686和0.002—0.466,不存在超标现象.对比重金属最大浓度与标准中的第二类用地筛选值,结果见图3(b). Ni、Cd、Cr(Ⅵ)、Pb和As都存在超标现象. Ni元素的计算结果范围为0.002—9.24,存在17个点位超标,超标1.25—9.24倍,其中超标最严重的点位浓度达
8320 mg·kg−1[49],该电镀场地位于长三角苏州地区,主要为镀锌、镀铬、镀镍,企业规模较小,环境管理较为薄弱,且车间地面破损,含Ni废水下渗是造成Ni严重超mg·kg−1标的重要原因. Cd的筛选值为65 mg·kg−1,对比结果为0.0001 —9.94,存在1个点位超标,该电镀场地主要是镀铬、镀锌和镀镍,Cd的超标推测与局部填土有关,与电镀本身生产无直接关系[42]. Cr(Ⅵ)计算结果为0.0007 —1965,8个点位超标,其中2个点位浓度达到2573 mg·kg−1[57]和11200 mg·kg−1[54],超标451倍和1965倍. 超标最严重的电镀场地位于天津市,Cr(Ⅵ)的超标点位主要集中在电镀车间,重污染点位土壤pH呈现极强酸性(pH<4.5),根据其工艺及其他区域土壤pH的分析推测受到铬酸污染的影响,污染深度已达到7.0 m,同时造成地下水中铬的超标[52]. Pb元素计算范围为0.005—2.25,存在2个点位超标,超标1.14倍[67]和2.25[35]倍,超标最严重的电镀厂始建于1968年,由于建筑陈旧、设备落后、生产工艺较复杂、处理不规范等,遗留的废液废渣渗入土壤中导致重金属含量超标. As的筛选值为60 mg·kg−1,对比结果为0.07—1.88,存在1个点位超标,超标1.88倍,位于珠三角地区东莞市[67]. Cu和Hg元素计算结果为0.0003 —0.687和0.001—0.137,不存在超标现象. 无论从均值浓度还是最大浓度来看,Cr(Ⅵ)超标最为严重,其次是重金属Ni. Cr(Ⅵ)主要来源于电镀行业中的镀铬、铬钝化等工艺,分析发现超标电镀场地均存在镀铬工艺. Cr(Ⅵ)和Ni的污染整体上也与我国镀铬、镀镍的广泛分布有关.通过对电镀场地建厂年份分析发现,一般建厂时间越早的电镀场地检测出与生产工艺相关的重金属浓度越高,见图4. 例如,在1968年建立的电镀场地Cr检测的平均值达到
1324.5 mg·kg−1[35],1986年建立的电镀厂检测出Cr的平均值为503.55 mg·kg−1[29],而2000年建立的电镀厂土壤中Cr含量为72.2 mg·kg−1[44],浓度降幅明显. 这可能是由于建厂时间较早的电镀场地生产工艺较为落后,防护措施不到位,导致污染更加严重. 重金属的含量也与电镀厂的运行时间有关,长三角江苏某电镀厂于1974年建立,2009年停产,运行35年,在其场地内部Cr浓度平均值为665 mg·kg−1[46]. 珠三角东莞某电镀厂于1994至2013年间运行,运行19年,在电镀场地内部检测到Cr的平均浓度为107.25 mg·kg−1[43],明显低于江苏某电镀厂. 对于电镀场地土壤重金属污染的公开报道最早开始于2006年[37],2006—2010年间相关研究较少,2011—2022年,人们对电镀污染越来越重视,关于电镀重金属污染的研究报道也越来越多.不同地区重金属在不同调查时间的超标比例见图3. 整体看出珠三角和长三角地区的研究较多,京津冀、长江经济带和其他地区研究较少. 虽然各个地区都存在一定的超标,但超标较为严重的点位集中在珠三角、长三角地区,这与我国电镀厂的分布有很大关系. 通过图3还可以看出,在同一地区,各个重金属除个别超高或较低的数据外,随着时间的推移,检测出的重金属浓度都有所增加,例如长三角地区的As元素,除2012年比值为0.46较为异常[39],其他报道中2014年比值为0.063[60],2018年和2020年比值均为0.16[29 − 30],相对于2014年有所增加. 造成这一现象的原因是我国经济高速发展,电镀行业也进入快速发展时期,污染也随之加重.
-
潜在生态风险指数法能够定量反映重金属对生态环境的影响程度,综合评价土壤中重金属潜在的生态危害,是土壤环境质量评价应用最为公认的方法之一. 单个重金属的潜在生态风险指数
Eir 计算如下:式中,
Cif 为某一重金属的污染系数;Cis 为沉积物重金属实测含量(mg·kg−1);Cin 为第i种重金属评价的参比值;Eir 为某一重金属的潜在生态风险指数;Tir 为某一重金属的毒性系数,反映重金属的毒性水平及土壤对重金属污染的敏感程度;RI为多个重金属的潜在生态风险指数. 本文评价的参比值采用《中国土壤元素背景值》中不同地区的环境背景值[68]. 单个及多个重金属的潜在生态风险指数RI所对应的污染评价等级划分见表1.单因子潜在生态风险评价结果见图5. 从图5可以看出,As的所有
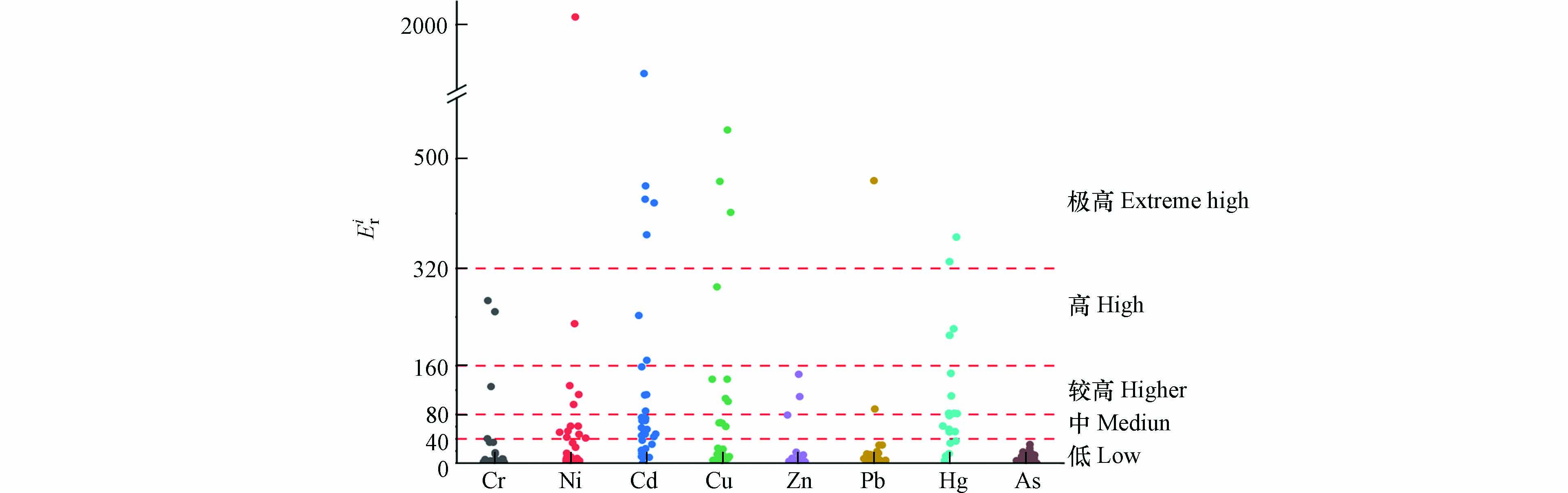
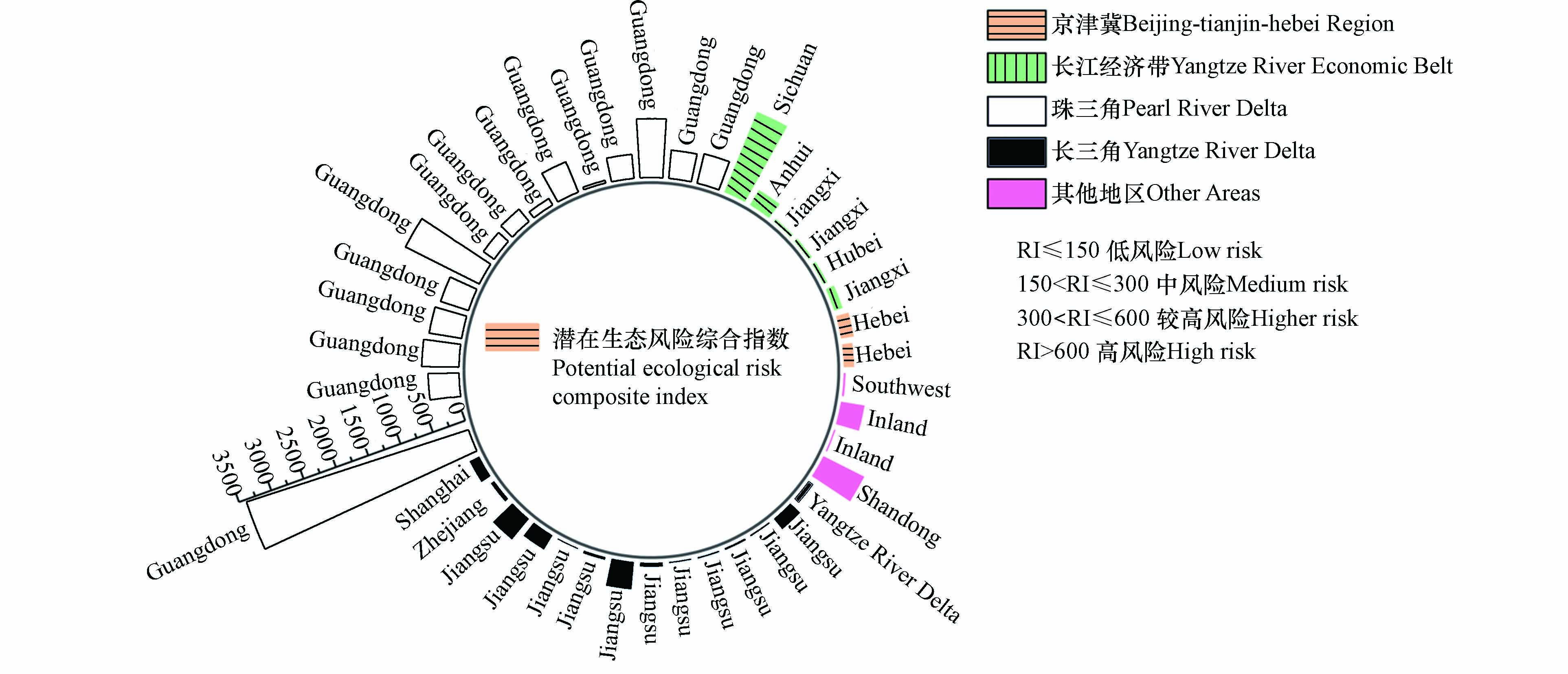
Eir 值均小于40,属于低生态风险等级. 其他重金属元素均存在一定风险. 单因子潜在生态风险指数最高值属于某电镀厂Ni元素,达到2166.67 ,远高于极高风险的界定值. Cd和Cu极高生态风险的电镀厂较多,占比16.13%和8.11%,其中Cd有80%位于珠三角地区,Cu有75%位于长三角地区. 对于Zn、Cr元素,建设用地土壤污染风险管控标准中没有提到其第二类用地筛选值,无法对其超标情况进行分析,但通过潜在生态风险评价结果可以看出Zn元素的计算结果为0.48—145.96,91.17%的电镀厂都属于低生态风险,对生态环境的危害相对较小. Cr中有88.5%的数据处于低生态风险范围,2.85%属于中生态风险等级,2.85%属于较高生态风险等级,5.71%属于高生态风险等级,最高潜在生态风险指数值为266.98,位于珠三角地区. 根据极高风险的比例大小排序,为Cd>Hg>Cu>Pb=Ni>Cr=Zn=As,根据各重金属元素Eir 平均值大小可知Eir 顺序为Cd>Hg>Ni>Cu>Cr>Pb>Zn>As,Cd和Hg的风险较高,均值为143.79和106.95,这与重金属超标分析的结果不一致,这可能是因为Cd和Hg在《土壤环境质量 建设用地土壤污染风险管控标准》中的第二类用地筛选值为65 mg·kg−1和38 mg·kg−1,而其不同地区背景值差异明显,分布范围分别为0.056—0.267 mg·kg−1和0.019—0.289 mg·kg−1.潜在生态风险综合评价结果见图6. 有41.46%的数据属于低生态风险等级,19.51%的数据属于中生态风险等级,26.83%的数据属于较高生态风险等级,12.19%的数据属于高生态风险等级及以上. 从图中可以看出京津冀和长三角地区电镀场地土壤重金属潜在生态风险指数较低,范围为153.01—188.08和17.09—408.39. 长江经济带四川某电镀场地土壤潜在生态风险指数较高,达到1261.82. 珠三角地区土壤重金属潜在生态风险指数普遍较高,位于中风险等级及以上的,珠三角占比为54.17%,最高达到3400.34. 单因子潜在生态风险和综合潜在生态风险指数结果结合来看,生态风险指数高的数据主要集中在珠三角、长三角,与超标指数分析结果一致.
-
研究表明,电镀行业排放的主要PFASs为PFOS和F-53B[10,67],其它全氟化合物如PFOA、PFBS、PFHxS、PFHpS、6:2 FTS由于无直接使用及检出较低[69],关注较少. 因此本文重点分析了作为铬雾抑制剂的PFOS和其替代物F-53B. 针对电镀污水、电镀场地周边地区以及非电镀场地周边地区环境介质中的PFOS以及F-53B的含量进行统计分析,结果见表2. 研究发现电镀污水中的PFOS和F-53B含量整体高于其它水体. 长三角浙江某电镀园区多个电镀车间使用大量含PFOS和F-53B的铬雾抑制剂,在电解槽中检出高浓度全氟化合物,进而导致污水处理厂进水中PFOS和F-53B浓度达到
5500000 ng·L−1和154500 ng·L−1,出水中浓度分别为795000 ng·L−1和985000 ng·L−1,比其他文献报道的污水中PFOS和F-53B浓度高约3—4个数量级. 据研究报道,现有的污水处理工艺对全氟化合物无明显的去除作用,甚至导致出水中更高的检出[69]. 污水处理厂出水的排放同时导致电镀园区周边水体中PFOS和F-53B含量大多高于普通地区的污染水平. 浙江电镀园区附近的地表水中检出浓度较高,PFOS和F-53B的含量为300—1500 ng·L−1[69]. 非电镀园区水体中PFOS和F-53B的含量在pg·L−1至ng·L−1水平,与文献报道中全球地表水中F-53B的浓度范围(0.01—77 ng·L−1)相当[70]. 值得关注的是在东北河流、南昌等地的非电镀园区水源中同样检测到高浓度的F-53B(<0.06—117.5 ng·L−1)[71],甚至高于电镀园区周边地区. 研究证明F-53B具有较强的远程运输潜力,从而在一些无直接污染源排放的地区被检出[72]. 相比之下,欧洲地表水(<LOD)、泰晤士河(0.01—0.08 ng·L−1)、莱茵河(0.02—0.38 ng·L−1)、韩国汉江(0.02—0.06 ng·L−1)检测出的F-53B浓度水平较低[73].对于电镀污水和电镀周边地区地表水的研究集中在珠三角和长三角地区. 在非电镀园区周边地区地表水的研究中,珠三角、长三角、京津冀的污染物含量明显高于其他地区污染物水平,其原因是作为我国重要的经济区,制造业较为发达,同样导致污染物的大量排放. 同时发现在同一地区随着年度的增长,PFOS和F-53B的含量也在增加. 在长三角地区电镀园区污水的研究中,2013年检测出F-53B的浓度为进水65—112 ng·L−1、出水43—78 ng·L−1[12],而在2020年F-53B的浓度为进水
154500 ng·L−1、出水985000 ng·L−1[69],检出浓度急速增加. 在电镀园区周边地区的研究中,针对F-53B,2016年、2019年和2020年的检出浓度分别为4.4—77ng·L−1[76]、<10—968ng·L−1[64]和300—1500 ng·L−1[69].针对珠三角、长三角和京津冀电镀发达地区的研究可以发现,2015年在珠三角电镀园区周边地区PFOS的检出量明显高于F-53B. 2019年在珠三角和长三角地区,PFOS的检出水平仍高于F-53B,但两者之间的差距相比于2015年大幅度降低,甚至在上海的某个电镀厂附近检测出的F-53B浓度水平高于PFOS. 2020年在长三角地区,两者的浓度水平相当. 造成这一现象的原因是由于PFOS的难降解性和极强的生物累积性,国家已逐步淘汰PFOS和较长链同质物,与此同时,F-53B作为PFOS的替代品,其生产和使用一直在增加. 关于土壤、沉积物和污泥中的PFOS和F-53B的浓度也有零星报道,见表3,可以看出电镀园区内部土壤中污染物的含量较高,PFOS浓度最高达到
3672.59 ng·g−1,F-53B达到837.15 ng·g−1 [89],远远高于电镀场地外部区域土壤中的含量,说明虽然污染物会在土壤中扩散,但通过扩散造成的土壤污染范围有限. -
暴露风险是评估污染物的暴露量和暴露类型,最终与污染物毒性评价结合起来评价污染物对人体健康带来的风险. 美国环境保护署(Environmental Protection Agency, EPA)推荐采用风险熵值(risk quotients, RQs)来评估PFASs对人体的健康风险. 具体公式如下:
式中,RQ≤1则无健康风险;1<RQ≤100表示潜在健康风险;100<RQ≤
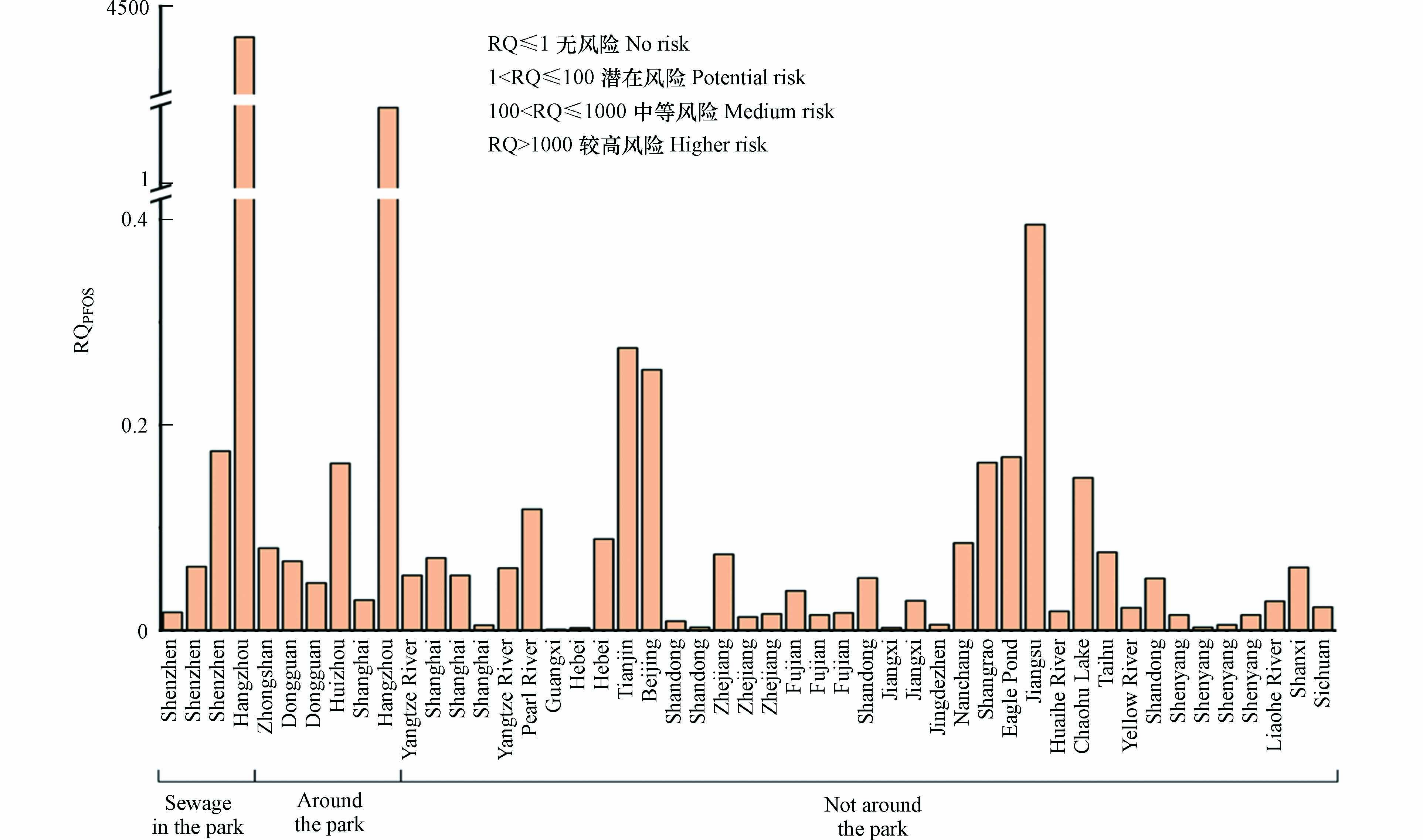
1000 则存在中等健康风险;1000 <RQ表示存在较高健康风险. 其中,健康参考指标PFOS=200 ng·L−1[91].通过计算得出相对指数值RQPFOS见图7. 从图7可以看出,大多数水源RQPFOS值均小于1,只有个别电镀园区内污水和电镀园区附近水源RQPFOS值大于1,存在健康风险. 健康风险最严重的数据位于电镀园区污水中,暴露风险RQPFOS高达
3975 ,存在较高健康风险. 另一个存在潜在健康风险的数据属于电镀园区周边地表水,计算得出RQPFOS值为7.5. 两个存在健康风险的检测结果均位于长三角杭州某电镀园区,此电镀园区污水中PFOS的检测结果比其他文献报道的污染物浓度约高3—4个数量级. 除两个健康风险较大的数据外,其他数据计算得出的RQPFOS均位于0—0.4之间,无健康风险. -
重金属和全氟化合物都是电镀生产中的特征污染物,它们通常不是单独存在,而是随着电镀过程共同排放到环境中,二者协同可能会产生更大的毒性,对环境和人体造成危害[92]. 重金属和全氟化合物之间存在相互影响,有研究发现,土壤对F-53B的吸附受Cu(Ⅱ)、Cr(Ⅵ)和硫酸盐的影响显著,在Cu(Ⅱ)、Cr(Ⅵ)和硫酸盐的存在下,F-53B的吸附能力普遍下降,说明这些离子可以促进F-53B在亚表面的迁移[93];Cr(Ⅵ)的存在有可能减少天然多孔介质中PFOS的吸附和抑制作用,特别是在污染场地,这将导致PFOS在土壤和地下水中的迁移增强,增加PFOS暴露潜力[94]. 全氟化合物对重金属的存在也有一定影响,F-53B可以影响土壤环境中Cr的形态,通过静电相互作用和络合作用促进不稳定Cr的存在,增加自然环境中Cr污染的风险[95]. 土壤性质会对重金属和全氟化合物的相互作用造成影响,研究发现在酸性条件下,细菌的等电点和细胞表面疏水性也会受到显著影响,这有利于PFOS和Cr(Ⅵ)结合物与细胞外基质蛋白通过氢键、静电和疏水相互作用[96];与F-53B单独污染相比,F-53B与Cr(Ⅵ)复合污染时,红黑土对F-53B和Cr(Ⅵ)的吸附量增大,黄土对F-53B和Cr(Ⅵ)的吸附量减小. 此外,土壤中铝和铁的含量与吸附动力学和等温线Kd值高度相关,表明这两种金属阳离子影响了F-53B和Cr(Ⅵ)的相互作用[95].
-
本文对全国电镀工业场地及周边区域环境中重金属和全氟化合物排放来源、赋存特征、时空变化趋势进行探究,可以看出由于生产工艺较复杂、处理不规范、跑冒滴漏等原因造成多地环境中重金属和全氟化合物污染严重,集中在长三角、珠三角、京津冀地区. 与《土壤环境质量 建设用地土壤污染风险管控标准》(GB36600—2018)建设用地第二类用地土壤污染风险筛选值对比,Ni和Cr(Ⅵ)超标较为严重,最大值超标倍数最高达9.24倍和1965倍,超标点位均位于电镀场地内部,尤其是电镀车间及废水处理区域. 利用潜在生态风险指数法对重金属进行风险评估,潜在生态风险指数
Eir 平均值大小顺序为Cd>Hg>Ni>Cu>Cr>Pb>Zn>As,Cd和Hg的风险较高,均值为143.79和106.95,这是因为各地背景值的差异导致与筛选值对比评估的结果不一致. 对于全氟化合物,污染浓度高的点位多集中于电镀园区污水和周边地表水中,对PFOS进行健康风险评估,园区周边和非园区周边地表水中仅有一个点位超标,PFOS整体健康风险较低. 通过对电镀场地建厂及采样年份分析发现,建厂时间较早的电镀场地检测出与生产工艺相关的重金属浓度较高,随着时间的推移,重金属浓度增长幅度降低. 在同一地区随着年度的增长,PFOS和F-53B的含量也在增加,但F-53B的增长速度远高于PFOS. 从已有报道可以看出,F-53B等新污染物普遍存在,但针对这些新污染物的相关标准还未健全. 因此亟需完善新污染物相关的法律法规,保障人体健康与生态环境安全.
电镀行业排放重金属及全氟化合物时空分布及风险评估
Spatial and temporal distribution and risk assessment of heavy metals and perfluorinated compounds from electroplating industry
-
摘要: 随着我国经济高速增长,电镀行业也进入快速发展期,电镀过程中产生的污染物日益受到关注. 本文对电镀过程中不同环节产生的污染物进行探究,识别出重金属、全氟化合物等特征污染物. 通过对全国不同地区电镀厂污染物排放的系统分析,阐明生产工艺、运行时间等对污染物时空分布的影响,发现检测出高浓度重金属、全氟辛烷磺酸(perfluorooctane sulphonate, PFOS)以及全氟烷基醚磺酸盐(6:2 chlorinated polyfluorinated ether sulfonate, F-53B)的电镀厂集中分布在长三角、珠三角和京津冀等经济区. 与《土壤环境质量 建设用地土壤污染风险管控标准》(GB36600—2018)建设用地第二类用地土壤污染风险筛选值对比,Ni和Cr(Ⅵ)超标较为严重,超标倍数最高达9.24倍和1965倍,超标点位均位于电镀场地内部,尤其是电镀车间及废水处理区域. 建厂时间越早的电镀厂因管理处置措施不完善等原因检测出的污染物浓度越高. 对于全氟化合物,电镀园区污水中PFOS和F-53B的含量较高,达到mg·L−1水平,非电镀园区水体中PFOS和F-53B的含量在pg·L−1至ng·L−1水平. 在同一地区随着年度的增长,PFOS和F-53B的含量也在增加,F-53B的增长速度远高于PFOS. 对重金属和PFOS进行风险评估,发现单个重金属的潜在生态风险指数
Eir 平均值排序为Cd>Hg>Ni>Cu>Cr>Pb>Zn>As,这与不同地区背景值差异有关. 地表水中PFOS的风险熵RQ值为0—7.5,存在健康风险的点位分布在电镀园区内部及周边,非电镀园区附近的地表水均无健康风险. 本研究可为电镀场地污染控制以及新污染物的防控提供支撑.Abstract: Along with the robust growth of the economy, electroplating industry has entered a rapid developing period, and the contaminants generated during electroplating process have drawn tremendous attention. In this paper, the pollutants produced in different links of electroplating process were investigated. The characteristic pollutants such as heavy metals and perfluorinated compounds were identified. The effects of production technologies and running time on the spatial and temporal distribution of pollutants were illustrated via systematic analysis. High levels of heavy metals, perfluorooctane sulphonate (PFOS), and perfluoroalkyl ether sulfonate (6:2 chlorinated polyfluorinated ether sulfonate, F-53B) were detected in electroplating plants concentrated in the economic zones, namely the Yangtze River Delta, the Pearl River Delta and the Beijing-Tianjin-Hebei. Compared with the risk screening values on heavy metals for soil contamination of the second type land in the "Soil Environmental Quality Risk Control Standard for Soil Contamination of Development Land" (GB36600—2018), Ni and Cr(Ⅵ) exceeded the standard seriously, with the maximum multiple of 9.24 times and 1965 times. The exceeding points were all located inside the electroplating sites, especially electroplating workshops and wastewater treatment areas. The earlier the electroplating plants were built, the higher the concentrations of pollutants were detected due to imperfect management and disposal measures. For perfluorinated compounds, the contents of PFOS and F-53B in the wastewater of electroplating park were relatively high, reaching the level of mg·L−1, while the contents of PFOS and F-53B in the water of non-electroplating park ranged from pg·L−1 to ng·L−1. In the same area, the content of PFOS and F-53B also increased with the annual increase, but the growth rate of F-53B was much higher than that of PFOS. Risk assessment of heavy metals and PFOS showed that the average value of potential ecological risk indexEir was Cd>Hg>Ni>Cu>Cr>Pb>Zn>As, which was related to the variations of background values in different regions. The RQ value of the risk entropy of PFOS in surface water ranged from 0 to 7.5. The points with health risks were distributed in and around the electroplating parks, the surface water not near the electroplating park did not show health risks. Insights gained from this study can provide support for electroplating site pollution control and prevention of new pollutants.-
Key words:
- electroplating /
- heavy metals /
- PFOS /
- F-53B /
- risk.
-
电镀是工业产业链中的重要环节,在电子电器、装备制造等领域都有广泛应用. 近年来我国电镀行业发展迅速,且分布较为集中,主要位于长三角、珠三角、京津冀等制造业比较发达的地区[1]. 我国电镀加工中涉及最广的是镀锌、镀铜、镀镍、镀铬. 电镀行业使用大量强酸、强碱、重金属溶液,甚至铬酸酐、持久性有机污染物等有毒有害化学品,通过电镀液泄漏、三废排放等,将锌、铜、镍、铬等重金属和全氟化合物(perfluorinated compounds,PFASs)排入环境,危害生态系统安全[2 − 6]. 我国对电镀排放重金属的研究已久,尤其是电镀废水的处置以及对周边土壤和水体环境的影响. 卢然等搜集电镀地块调查报告和文献,分析地块中重金属、氰化物和有机物,结果发现土壤及地下水中超标因子主要为重金属[7]. 刘芸等使用化学品足迹法筛查电镀行业潜在高风险化学品,发现仅电镀一个行业在达标排放的情况下,就可能对区域生态环境产生风险[8],但缺乏对全国整体污染状况的分析.
全氟辛烷磺酸(perfluorooctane sulphonate,PFOS)是一类典型全氟化合物. 长久以来,PFOS及其盐类是电镀过程中普遍使用的铬雾抑制剂,旨在保护工人免受空气中高毒性的铬暴露. 然而,因其具有高持久性、远距离运输和生物积累的特点,对生态环境和人类健康构成巨大威胁[9 − 11],2009年被列入斯德哥尔摩公约. 全氟烷基醚磺酸盐(6:2 chlorinated polyfluorinated ether sulfonate,F-53B)在20世纪70年代首次合成,已有50多年使用历史[12 − 13]. 当前作为PFOS在电镀行业的替代品,其需求也在不断增加. F-53B被证实具有生物累积性[14]、难降解性[12],在污水、污泥、土壤、水体等多种环境中被广泛检出. 部分研究发现,F-53B的生物累积潜力可能高于PFOS[13 − 14]. 同时有迹象表明,F-53B可以在水生食物网中被生物放大[15],是目前为止发现最具生物持久性的全氟化合物[16]. 目前,针对电镀行业污染物排放的研究通常针对工业场地及周边区域展开,但缺乏对全国电镀污染物分布特征及风险评估的综合报道,尤其是针对全氟化合物的系统分析. 因此,本文通过对国内外文献的整体综述,阐述生产工艺、运行时间等对重金属及全氟化合物时空分布的影响,进而评估不同区域电镀行业带来的环境风险.
1. 材料与方法(Materials and methods)
1.1 研究区域
改革开放的深入和制造业的发展推动了电镀行业的进步. 从规模上看,我国已经成为电镀业大国. 长三角、珠三角、京津冀和长江经济带作为我国经济快速发展区,电镀分布较为集中,也是本文的重点研究区域. 本文研究区域还包含出经济快速发展区之外的其他地区,我国其他地区也存在部分电镀厂,但数量相比于经济快速发展区较少.
1.2 数据来源及分析方法
本文通过文献检索平台,搜集重金属相关文献48篇、全氟化合物相关文献22篇. 采用Meta(Meta-analysis)分析方法,统计了各个电镀厂的建厂年份、生产工艺、地理位置以及污染物浓度等信息,对所搜集的数据进行定量合并分析,结合风险评价方法研究电镀厂污染物对电镀场地内部及周边区域环境的影响. Meta分析是用于比较和综合针对同一科学问题研究结果的统计学方法,相比于一般的统计学方法,Meta分析可以通过异质性检验,提高结果的全面性、客观性和真实性[17 − 18].
2. 电镀行业污染物排放环节识别(Identification of pollutant emission links in electroplating industry)
电镀是利用电解原理在金属或其它材料表面附着一层金属或合金的过程,从而增强硬度,提高耐磨性、防腐性、导电性、反光性等[19]. 电镀的主要工艺流程及污染物排放环节见图1.
首先是电镀前处理,这个环节使用有机溶剂、清洗剂、乳化剂、表面活性剂等多种添加剂,从而达到去除镀件表面污染物、活化镀件表面和改善镀件表面缺陷的效果[20]. 其次是电镀环节,为了提高电镀效果、保护操作人员健康、保护机器设备、减少浪费,使用光亮剂、PFOS和F-53B等添加剂,这些添加剂中含有大量的氟化物. 在电镀加工过程中,不同的电镀工艺也会排放不同的重金属[21]. 最后是电镀后处理环节,主要包括脱水、钝化和防腐等工艺,此过程脱水剂、钝化剂以及保护剂中一般含一种或多种有机化合物[22]. 在电镀生产过程中会产生电镀废液、固体废弃物以及废气,其中含有大量重金属、全氟化合物、氰化物等. 氰化物在电镀过程中主要起到络合作用. 整个电镀过程中产生的废水经末端处理后排放到河流、土壤等环境介质中,造成环境与健康风险[7]. 企业管理不规范同样会导致电镀过程中电解液和电镀废水跑冒滴漏以及管道泄漏,或是电镀原辅料等随意堆放造成重金属、全氟化合物等污染[23]. 对电镀生产过程中可能产生的污染物进行分析,主要有重金属、有机物、氰化物和氟化物. 图2为不同电镀工艺产生的污染物及贡献示意图,可以看出各种重金属污染物主要来源于对应镀种,有机物主要来源于脱脂过程. 氟化物的来源较多,除脱脂、镀锌、镀铜、镀镍和镀砷外,其他工艺均有氟化物产生. 镀锌、镀镉、镀铜和镀合金中都有氰化物的产生. 原国家经济贸易委员会在2002年发布了第三批关于《淘汰落后生产能力、工艺和产品的目录》的第32号令,提出全面淘汰含氰电镀工艺的指令,目前我国电镀行业工艺大都为无氰工艺. 本文重点关注场地土壤中检出频率较高的重金属以及场地和周边区域中持久性有机污染物PFOS及其替代品F-53B.
为了控制重金属和全氟化合物的污染,掌握污染物的生产、使用、排放及影响是非常必要的. 蔡昂祖等人使用APCS-MLR对邯郸市某工业园区周边重金属进行源解析,发现电镀在内的工业源对土壤中重金属的贡献率达28.31%[24]. 刘胜然等利用PMF对珠三角某市土壤中重金属进行源解析,发现电镀聚集区工业源对Cr的贡献达66.4%,Cr是典型的电镀污染产物,说明土壤中的重金属与电镀行业有着密切联系[25]. 关于全氟化合物的报道也有很多,Li等对华北平原地下水中的PFASs进行源解析,发现金属电镀贡献为17.2%[26]. 对全国的研究发现,2010年我国主要工业来源的PFOS总排放量为70 t,金属电镀工业使用PFOS被确定为PFOS的最大污染源,排放量为35 t[27]. 上海一制造商为全国电镀厂提供F-53B,研究估算出2013年F-53B的年消耗量约为13.4 t,在2006—2015年期间保持稳定,约为每年10—14 t. 基于全国工业调查和统计数据,估算得出从2006年到2015年F-53B的累积环境排放量约为125 t[28]. 整体看出,电镀场地排放重金属和全氟化合物对周边环境的影响以及对新污染物的贡献不容忽视.
3. 电镀场地重金属时空分布及环境风险(Spatial and temporal distribution of heavy metals in electroplating site and environmental risks)
3.1 土壤中重金属分布
为探究全国电镀场地重金属污染状况及风险,本文对建厂年份、生产工艺、地理位置以及重金属浓度等进行统计分析[3 − 5,29 − 67]. 将电镀场地及周边土壤中7种重金属Ni、Cd、Cr(Ⅵ)、Cu、Pb、Hg和As的平均浓度与《土壤环境质量 建设用地土壤污染风险管控标准》(GB36600-—2018)中的第二类用地筛选值相比,比较值大于1即为超标,反之不超标,结果见图3(a). Ni、Cr(Ⅵ)和Pb都存在超标现象,且超标点位均为电镀场地内部采样点. Ni的筛选值为900 mg·kg−1,经对比结果为
0.0085 —6.93,有两个数据超标,浓度分别为1188 mg·kg−1[35]和6240 mg·kg−1[65],超标1.32倍和6.93倍,位于长三角和珠三角地区. 长三角电镀场地超标点位大多位于电镀车间和填埋场,造成这一现象的原因是电镀过程以及遗留的废液废渣. Cr(Ⅵ)的筛选值为5.7 mg·kg−1,结果范围为0.0007 —310存在7个超标数据,有两个点位浓度达到1770 mg·kg−1[65]和61 mg·kg−1[57],超标310倍和10.7倍. 超标电镀场地均位于珠三角地区,都存在镀铬工艺,与超标污染因子相符合. 检测均值为61 mg·kg−1的电镀厂主要工艺为镀铬、镀镍和镀铜,Cr(Ⅵ)的超标点位主要集中在电镀车间的深层土壤中,究其原因,土壤对Cr(Ⅵ)的吸附作用大小与地下水的pH有关,此电镀场地的地下水pH大都处于6.5—7.5之间,土壤对Cr(Ⅵ)的吸附量较小,且Cr(Ⅵ)易溶于水,还具有较强的迁移能力,电镀车间的岩土类型为全风化花岗岩,渗透性较好,有利于Cr(Ⅵ)向深部迁移[57]. Pb的筛选值为800 mg·kg−1,对比结果为0.0008 —4.17,存在1个超标数据,超标4.17倍,位于珠三角[65]. 其它4类重金属Cd、Cu、Hg、As均值浓度的计算结果分别为0.0004 —0.360、0.0001 —0.123、0.0007 —0.686和0.002—0.466,不存在超标现象.对比重金属最大浓度与标准中的第二类用地筛选值,结果见图3(b). Ni、Cd、Cr(Ⅵ)、Pb和As都存在超标现象. Ni元素的计算结果范围为0.002—9.24,存在17个点位超标,超标1.25—9.24倍,其中超标最严重的点位浓度达
8320 mg·kg−1[49],该电镀场地位于长三角苏州地区,主要为镀锌、镀铬、镀镍,企业规模较小,环境管理较为薄弱,且车间地面破损,含Ni废水下渗是造成Ni严重超mg·kg−1标的重要原因. Cd的筛选值为65 mg·kg−1,对比结果为0.0001 —9.94,存在1个点位超标,该电镀场地主要是镀铬、镀锌和镀镍,Cd的超标推测与局部填土有关,与电镀本身生产无直接关系[42]. Cr(Ⅵ)计算结果为0.0007 —1965,8个点位超标,其中2个点位浓度达到2573 mg·kg−1[57]和11200 mg·kg−1[54],超标451倍和1965倍. 超标最严重的电镀场地位于天津市,Cr(Ⅵ)的超标点位主要集中在电镀车间,重污染点位土壤pH呈现极强酸性(pH<4.5),根据其工艺及其他区域土壤pH的分析推测受到铬酸污染的影响,污染深度已达到7.0 m,同时造成地下水中铬的超标[52]. Pb元素计算范围为0.005—2.25,存在2个点位超标,超标1.14倍[67]和2.25[35]倍,超标最严重的电镀厂始建于1968年,由于建筑陈旧、设备落后、生产工艺较复杂、处理不规范等,遗留的废液废渣渗入土壤中导致重金属含量超标. As的筛选值为60 mg·kg−1,对比结果为0.07—1.88,存在1个点位超标,超标1.88倍,位于珠三角地区东莞市[67]. Cu和Hg元素计算结果为0.0003 —0.687和0.001—0.137,不存在超标现象. 无论从均值浓度还是最大浓度来看,Cr(Ⅵ)超标最为严重,其次是重金属Ni. Cr(Ⅵ)主要来源于电镀行业中的镀铬、铬钝化等工艺,分析发现超标电镀场地均存在镀铬工艺. Cr(Ⅵ)和Ni的污染整体上也与我国镀铬、镀镍的广泛分布有关.通过对电镀场地建厂年份分析发现,一般建厂时间越早的电镀场地检测出与生产工艺相关的重金属浓度越高,见图4. 例如,在1968年建立的电镀场地Cr检测的平均值达到
1324.5 mg·kg−1[35],1986年建立的电镀厂检测出Cr的平均值为503.55 mg·kg−1[29],而2000年建立的电镀厂土壤中Cr含量为72.2 mg·kg−1[44],浓度降幅明显. 这可能是由于建厂时间较早的电镀场地生产工艺较为落后,防护措施不到位,导致污染更加严重. 重金属的含量也与电镀厂的运行时间有关,长三角江苏某电镀厂于1974年建立,2009年停产,运行35年,在其场地内部Cr浓度平均值为665 mg·kg−1[46]. 珠三角东莞某电镀厂于1994至2013年间运行,运行19年,在电镀场地内部检测到Cr的平均浓度为107.25 mg·kg−1[43],明显低于江苏某电镀厂. 对于电镀场地土壤重金属污染的公开报道最早开始于2006年[37],2006—2010年间相关研究较少,2011—2022年,人们对电镀污染越来越重视,关于电镀重金属污染的研究报道也越来越多.不同地区重金属在不同调查时间的超标比例见图3. 整体看出珠三角和长三角地区的研究较多,京津冀、长江经济带和其他地区研究较少. 虽然各个地区都存在一定的超标,但超标较为严重的点位集中在珠三角、长三角地区,这与我国电镀厂的分布有很大关系. 通过图3还可以看出,在同一地区,各个重金属除个别超高或较低的数据外,随着时间的推移,检测出的重金属浓度都有所增加,例如长三角地区的As元素,除2012年比值为0.46较为异常[39],其他报道中2014年比值为0.063[60],2018年和2020年比值均为0.16[29 − 30],相对于2014年有所增加. 造成这一现象的原因是我国经济高速发展,电镀行业也进入快速发展时期,污染也随之加重.
3.2 土壤污染风险评估
潜在生态风险指数法能够定量反映重金属对生态环境的影响程度,综合评价土壤中重金属潜在的生态危害,是土壤环境质量评价应用最为公认的方法之一. 单个重金属的潜在生态风险指数
Eir stringUtils.convertMath(!{formula.content}) stringUtils.convertMath(!{formula.content}) stringUtils.convertMath(!{formula.content}) 式中,
Cif Cis Cin Eir Tir 表 1 潜在生态风险指数法的污染评价等级划分Table 1. Classification of pollution assessment by potential ecological risk index methodEir Eir RI范围RI range 重金属污染物生态风险程度分级Classification of ecological risk of heavy metal pollutants Eir RI≤150 低 40< Eir 150<RI≤300 中 80 <Eir 300<RI≤600 较高 160< Eir RI>600 高 Eir 极高 单因子潜在生态风险评价结果见图5. 从图5可以看出,As的所有
Eir 2166.67 ,远高于极高风险的界定值. Cd和Cu极高生态风险的电镀厂较多,占比16.13%和8.11%,其中Cd有80%位于珠三角地区,Cu有75%位于长三角地区. 对于Zn、Cr元素,建设用地土壤污染风险管控标准中没有提到其第二类用地筛选值,无法对其超标情况进行分析,但通过潜在生态风险评价结果可以看出Zn元素的计算结果为0.48—145.96,91.17%的电镀厂都属于低生态风险,对生态环境的危害相对较小. Cr中有88.5%的数据处于低生态风险范围,2.85%属于中生态风险等级,2.85%属于较高生态风险等级,5.71%属于高生态风险等级,最高潜在生态风险指数值为266.98,位于珠三角地区. 根据极高风险的比例大小排序,为Cd>Hg>Cu>Pb=Ni>Cr=Zn=As,根据各重金属元素Eir Eir 潜在生态风险综合评价结果见图6. 有41.46%的数据属于低生态风险等级,19.51%的数据属于中生态风险等级,26.83%的数据属于较高生态风险等级,12.19%的数据属于高生态风险等级及以上. 从图中可以看出京津冀和长三角地区电镀场地土壤重金属潜在生态风险指数较低,范围为153.01—188.08和17.09—408.39. 长江经济带四川某电镀场地土壤潜在生态风险指数较高,达到1261.82. 珠三角地区土壤重金属潜在生态风险指数普遍较高,位于中风险等级及以上的,珠三角占比为54.17%,最高达到3400.34. 单因子潜在生态风险和综合潜在生态风险指数结果结合来看,生态风险指数高的数据主要集中在珠三角、长三角,与超标指数分析结果一致.
4. 电镀行业排放全氟化合物时空分布及环境风险(Spatial and temporal distribution of perflurorinated alkyl substances from electroplating industry and environmental risks)
4.1 PFOS和F-53B的时空分布
研究表明,电镀行业排放的主要PFASs为PFOS和F-53B[10,67],其它全氟化合物如PFOA、PFBS、PFHxS、PFHpS、6:2 FTS由于无直接使用及检出较低[69],关注较少. 因此本文重点分析了作为铬雾抑制剂的PFOS和其替代物F-53B. 针对电镀污水、电镀场地周边地区以及非电镀场地周边地区环境介质中的PFOS以及F-53B的含量进行统计分析,结果见表2. 研究发现电镀污水中的PFOS和F-53B含量整体高于其它水体. 长三角浙江某电镀园区多个电镀车间使用大量含PFOS和F-53B的铬雾抑制剂,在电解槽中检出高浓度全氟化合物,进而导致污水处理厂进水中PFOS和F-53B浓度达到
5500000 ng·L−1和154500 ng·L−1,出水中浓度分别为795000 ng·L−1和985000 ng·L−1,比其他文献报道的污水中PFOS和F-53B浓度高约3—4个数量级. 据研究报道,现有的污水处理工艺对全氟化合物无明显的去除作用,甚至导致出水中更高的检出[69]. 污水处理厂出水的排放同时导致电镀园区周边水体中PFOS和F-53B含量大多高于普通地区的污染水平. 浙江电镀园区附近的地表水中检出浓度较高,PFOS和F-53B的含量为300—1500 ng·L−1[69]. 非电镀园区水体中PFOS和F-53B的含量在pg·L−1至ng·L−1水平,与文献报道中全球地表水中F-53B的浓度范围(0.01—77 ng·L−1)相当[70]. 值得关注的是在东北河流、南昌等地的非电镀园区水源中同样检测到高浓度的F-53B(<0.06—117.5 ng·L−1)[71],甚至高于电镀园区周边地区. 研究证明F-53B具有较强的远程运输潜力,从而在一些无直接污染源排放的地区被检出[72]. 相比之下,欧洲地表水(<LOD)、泰晤士河(0.01—0.08 ng·L−1)、莱茵河(0.02—0.38 ng·L−1)、韩国汉江(0.02—0.06 ng·L−1)检测出的F-53B浓度水平较低[73].表 2 我国水环境中PFOS和F-53B总含量水平Table 2. Total content of PFOS and F-53B in China’s water environment研究区域Study area 采样地点Sampling location 采样时间Sampling time PFOS /(ng·L−1) F-53B /(ng·L−1) 数据来源Data sources 电镀园区污水 珠三角 深圳 2019 3.53 0.51 [74] 深圳 2019 12.4 2.37 [74] 深圳 2019 34.9 8.54 [74] 长三角 温州 2013 进水: 65—112 [12] 出水: 43—78 杭州 2020 进水: 5500000 进水: 154500 [69] 出水: 795000 出水: 985000 电镀园区周边地区 珠三角 中山 2015 <0.11—16.02 <0.01—0.35 [75] 东莞 2015 <0.11—13.47 ND [75] 东莞 2015 <0.11—9.22 <0.01—0.97 [75] 惠州 2015 <0.11—32.52 <0.01—0.32 [75] 长三角 浙江 2016 4.4—77 [76] 上海 2019 5.89 <10—968 [64] 杭州 2020 300— 1500 300— 1500 [69] 其他地区 山东 2016 0.59—5.7 [76] 非电镀园区周边地区 长三角 浙江 2013 8.5—14.8 31.6—77.3 [77] 浙江 2013 0.9—2.6 <0.56—5.1 [77] 浙江 2013 2.7—3.2 2.8—3.6 [77] 上海 2013 3.8—14.1 2.6—7 [77] 上海 2013 1.0—10.7 <0.56—6.7 [77] 上海 2013 0.8—1.0 1.0—2.3 [77] 长江 2016 0.39—12.12 0.12—12.94 [73] 江苏 2016 0.22—15.2 0.21—27.6 [73] 江苏 2016 0.258—79 0.17—1.83 [78] 珠三角 广东 2016 1.38—23.57 0.13—11.06 [73] 广东 2017 ND—0.307 [79] 广东 2018 0.0115 —0.09398 [79] 京津冀 河北 2013 0.4—0.5 <0.56 [77] 河北 2013 15.7—17.8 12.1—12.4 [77] 天津 2013 16.5—55 17.8—78.5 [77] 北京 2013—2014 ND—50.75 ND—6.93 [80] 河北 2016 <0.21—7.9 [81] 北京 2017 0.335 [82] 河北 2017 ND—36.9 [83] 长江经济带 江西 2016 0.31—0.52 0.84—3.58 [71] 江西 2016 <0.01—5.8 <0.06—0.41 [71] 景德镇 2016 <0.01—1.13 0.19—1.43 [71] 非电镀园区周边地区 长江经济带 南昌 2016 0.09—17.01 <0.06—117.5 [71] 上饶 2016 <0.01—32.65 0.1—0.49 [71] 鹰潭 2016 <0.01—33.75 <0.06—4.59 [71] 安徽 2016 1.96—29.7 0.69—52.2 [73] 四川 2019 1.11—4.54 0.051—2.48 [84] 其他地区 山东 2013 0.9—1.8 <0.56 [77] 山东 2013 0.5—0.6 <0.56 [77] 福建 2013 3.2—7.7 <0.56—0.8 [77] 福建 2013 2.4—3.0 <0.56 [77] 福建 2013 1.6—3.4 <0.56—2.0 [77] 沈阳 2013 0.9—3.0 <0.56—3.6 [77] 沈阳 2013 0.4—0.6 <0.56—1.1 [77] 沈阳 2013 1.1 <0.56 [77] 沈阳 2013 2.3—3.0 4.7—5.6 [77] 山东 2015 2.05—10.2 1.52—15.6 [85] 辽宁 2016 0.48—3.72 0.36—21.38 [73] 山东 2016 0.09—4.4 0.01—0.29 [73] 东北河流 2016 <0.21—51 [81] 辽宁 2016 2.26—5.66 0.24—2.29 [73] 山西 2017 0.05—12.27 0.02—8.37 [86] 广西 2018—2019 0.06—0.21 ND—0.06 [87] 山东 2019 ND—10.1 ND—2.59 [88] ND,未检出. ND,Not detected. 对于电镀污水和电镀周边地区地表水的研究集中在珠三角和长三角地区. 在非电镀园区周边地区地表水的研究中,珠三角、长三角、京津冀的污染物含量明显高于其他地区污染物水平,其原因是作为我国重要的经济区,制造业较为发达,同样导致污染物的大量排放. 同时发现在同一地区随着年度的增长,PFOS和F-53B的含量也在增加. 在长三角地区电镀园区污水的研究中,2013年检测出F-53B的浓度为进水65—112 ng·L−1、出水43—78 ng·L−1[12],而在2020年F-53B的浓度为进水
154500 ng·L−1、出水985000 ng·L−1[69],检出浓度急速增加. 在电镀园区周边地区的研究中,针对F-53B,2016年、2019年和2020年的检出浓度分别为4.4—77ng·L−1[76]、<10—968ng·L−1[64]和300—1500 ng·L−1[69].针对珠三角、长三角和京津冀电镀发达地区的研究可以发现,2015年在珠三角电镀园区周边地区PFOS的检出量明显高于F-53B. 2019年在珠三角和长三角地区,PFOS的检出水平仍高于F-53B,但两者之间的差距相比于2015年大幅度降低,甚至在上海的某个电镀厂附近检测出的F-53B浓度水平高于PFOS. 2020年在长三角地区,两者的浓度水平相当. 造成这一现象的原因是由于PFOS的难降解性和极强的生物累积性,国家已逐步淘汰PFOS和较长链同质物,与此同时,F-53B作为PFOS的替代品,其生产和使用一直在增加. 关于土壤、沉积物和污泥中的PFOS和F-53B的浓度也有零星报道,见表3,可以看出电镀园区内部土壤中污染物的含量较高,PFOS浓度最高达到
3672.59 ng·g−1,F-53B达到837.15 ng·g−1 [89],远远高于电镀场地外部区域土壤中的含量,说明虽然污染物会在土壤中扩散,但通过扩散造成的土壤污染范围有限.表 3 我国土壤、污泥环境中PFOS和F-53B总含量水平Table 3. Total content of PFOS and F-53B in soil and sludge environment in China研究区域Study area 样品类型Sample type 采样地点Sampling location 采样时间Sampling time PFOS/(ng·g−1) F-53B/(ng·g−1) 数据来源Data sources 电镀园区 长三角 土壤 宁波、杭州 2016 38.34— 3672.59 6.33—837.15 [89] 电镀园区周边 珠三角 土壤 中山 2015 0.37—14.95 0.04—10.77 [75] 东莞 2015 0.41—5.89 0.09—0.65 [75] 惠州 2015 0.37—4.54 0.02—209 [75] 非电镀园区周边 全国 污泥 20个省市污水处理厂 2010—2011 ND—218 0.02—209 [90] 注:ND(Not detected)为未检出. 4.2 PFOS健康风险评估
暴露风险是评估污染物的暴露量和暴露类型,最终与污染物毒性评价结合起来评价污染物对人体健康带来的风险. 美国环境保护署(Environmental Protection Agency, EPA)推荐采用风险熵值(risk quotients, RQs)来评估PFASs对人体的健康风险. 具体公式如下:
stringUtils.convertMath(!{formula.content}) 式中,RQ≤1则无健康风险;1<RQ≤100表示潜在健康风险;100<RQ≤
1000 则存在中等健康风险;1000 <RQ表示存在较高健康风险. 其中,健康参考指标PFOS=200 ng·L−1[91].通过计算得出相对指数值RQPFOS见图7. 从图7可以看出,大多数水源RQPFOS值均小于1,只有个别电镀园区内污水和电镀园区附近水源RQPFOS值大于1,存在健康风险. 健康风险最严重的数据位于电镀园区污水中,暴露风险RQPFOS高达
3975 ,存在较高健康风险. 另一个存在潜在健康风险的数据属于电镀园区周边地表水,计算得出RQPFOS值为7.5. 两个存在健康风险的检测结果均位于长三角杭州某电镀园区,此电镀园区污水中PFOS的检测结果比其他文献报道的污染物浓度约高3—4个数量级. 除两个健康风险较大的数据外,其他数据计算得出的RQPFOS均位于0—0.4之间,无健康风险.4.3 重金属与全氟化合物复合影响
重金属和全氟化合物都是电镀生产中的特征污染物,它们通常不是单独存在,而是随着电镀过程共同排放到环境中,二者协同可能会产生更大的毒性,对环境和人体造成危害[92]. 重金属和全氟化合物之间存在相互影响,有研究发现,土壤对F-53B的吸附受Cu(Ⅱ)、Cr(Ⅵ)和硫酸盐的影响显著,在Cu(Ⅱ)、Cr(Ⅵ)和硫酸盐的存在下,F-53B的吸附能力普遍下降,说明这些离子可以促进F-53B在亚表面的迁移[93];Cr(Ⅵ)的存在有可能减少天然多孔介质中PFOS的吸附和抑制作用,特别是在污染场地,这将导致PFOS在土壤和地下水中的迁移增强,增加PFOS暴露潜力[94]. 全氟化合物对重金属的存在也有一定影响,F-53B可以影响土壤环境中Cr的形态,通过静电相互作用和络合作用促进不稳定Cr的存在,增加自然环境中Cr污染的风险[95]. 土壤性质会对重金属和全氟化合物的相互作用造成影响,研究发现在酸性条件下,细菌的等电点和细胞表面疏水性也会受到显著影响,这有利于PFOS和Cr(Ⅵ)结合物与细胞外基质蛋白通过氢键、静电和疏水相互作用[96];与F-53B单独污染相比,F-53B与Cr(Ⅵ)复合污染时,红黑土对F-53B和Cr(Ⅵ)的吸附量增大,黄土对F-53B和Cr(Ⅵ)的吸附量减小. 此外,土壤中铝和铁的含量与吸附动力学和等温线Kd值高度相关,表明这两种金属阳离子影响了F-53B和Cr(Ⅵ)的相互作用[95].
5. 结论与展望(Conclusion and prospect)
本文对全国电镀工业场地及周边区域环境中重金属和全氟化合物排放来源、赋存特征、时空变化趋势进行探究,可以看出由于生产工艺较复杂、处理不规范、跑冒滴漏等原因造成多地环境中重金属和全氟化合物污染严重,集中在长三角、珠三角、京津冀地区. 与《土壤环境质量 建设用地土壤污染风险管控标准》(GB36600—2018)建设用地第二类用地土壤污染风险筛选值对比,Ni和Cr(Ⅵ)超标较为严重,最大值超标倍数最高达9.24倍和1965倍,超标点位均位于电镀场地内部,尤其是电镀车间及废水处理区域. 利用潜在生态风险指数法对重金属进行风险评估,潜在生态风险指数
Eir -
表 1 潜在生态风险指数法的污染评价等级划分
Table 1. Classification of pollution assessment by potential ecological risk index method
Eir Eir RI范围RI range 重金属污染物生态风险程度分级Classification of ecological risk of heavy metal pollutants Eir RI≤150 低 40< Eir 150<RI≤300 中 80 <Eir 300<RI≤600 较高 160< Eir RI>600 高 Eir 极高 表 2 我国水环境中PFOS和F-53B总含量水平
Table 2. Total content of PFOS and F-53B in China’s water environment
研究区域Study area 采样地点Sampling location 采样时间Sampling time PFOS /(ng·L−1) F-53B /(ng·L−1) 数据来源Data sources 电镀园区污水 珠三角 深圳 2019 3.53 0.51 [74] 深圳 2019 12.4 2.37 [74] 深圳 2019 34.9 8.54 [74] 长三角 温州 2013 进水: 65—112 [12] 出水: 43—78 杭州 2020 进水: 5500000 进水: 154500 [69] 出水: 795000 出水: 985000 电镀园区周边地区 珠三角 中山 2015 <0.11—16.02 <0.01—0.35 [75] 东莞 2015 <0.11—13.47 ND [75] 东莞 2015 <0.11—9.22 <0.01—0.97 [75] 惠州 2015 <0.11—32.52 <0.01—0.32 [75] 长三角 浙江 2016 4.4—77 [76] 上海 2019 5.89 <10—968 [64] 杭州 2020 300— 1500 300— 1500 [69] 其他地区 山东 2016 0.59—5.7 [76] 非电镀园区周边地区 长三角 浙江 2013 8.5—14.8 31.6—77.3 [77] 浙江 2013 0.9—2.6 <0.56—5.1 [77] 浙江 2013 2.7—3.2 2.8—3.6 [77] 上海 2013 3.8—14.1 2.6—7 [77] 上海 2013 1.0—10.7 <0.56—6.7 [77] 上海 2013 0.8—1.0 1.0—2.3 [77] 长江 2016 0.39—12.12 0.12—12.94 [73] 江苏 2016 0.22—15.2 0.21—27.6 [73] 江苏 2016 0.258—79 0.17—1.83 [78] 珠三角 广东 2016 1.38—23.57 0.13—11.06 [73] 广东 2017 ND—0.307 [79] 广东 2018 0.0115 —0.09398 [79] 京津冀 河北 2013 0.4—0.5 <0.56 [77] 河北 2013 15.7—17.8 12.1—12.4 [77] 天津 2013 16.5—55 17.8—78.5 [77] 北京 2013—2014 ND—50.75 ND—6.93 [80] 河北 2016 <0.21—7.9 [81] 北京 2017 0.335 [82] 河北 2017 ND—36.9 [83] 长江经济带 江西 2016 0.31—0.52 0.84—3.58 [71] 江西 2016 <0.01—5.8 <0.06—0.41 [71] 景德镇 2016 <0.01—1.13 0.19—1.43 [71] 非电镀园区周边地区 长江经济带 南昌 2016 0.09—17.01 <0.06—117.5 [71] 上饶 2016 <0.01—32.65 0.1—0.49 [71] 鹰潭 2016 <0.01—33.75 <0.06—4.59 [71] 安徽 2016 1.96—29.7 0.69—52.2 [73] 四川 2019 1.11—4.54 0.051—2.48 [84] 其他地区 山东 2013 0.9—1.8 <0.56 [77] 山东 2013 0.5—0.6 <0.56 [77] 福建 2013 3.2—7.7 <0.56—0.8 [77] 福建 2013 2.4—3.0 <0.56 [77] 福建 2013 1.6—3.4 <0.56—2.0 [77] 沈阳 2013 0.9—3.0 <0.56—3.6 [77] 沈阳 2013 0.4—0.6 <0.56—1.1 [77] 沈阳 2013 1.1 <0.56 [77] 沈阳 2013 2.3—3.0 4.7—5.6 [77] 山东 2015 2.05—10.2 1.52—15.6 [85] 辽宁 2016 0.48—3.72 0.36—21.38 [73] 山东 2016 0.09—4.4 0.01—0.29 [73] 东北河流 2016 <0.21—51 [81] 辽宁 2016 2.26—5.66 0.24—2.29 [73] 山西 2017 0.05—12.27 0.02—8.37 [86] 广西 2018—2019 0.06—0.21 ND—0.06 [87] 山东 2019 ND—10.1 ND—2.59 [88] ND,未检出. ND,Not detected. 表 3 我国土壤、污泥环境中PFOS和F-53B总含量水平
Table 3. Total content of PFOS and F-53B in soil and sludge environment in China
研究区域Study area 样品类型Sample type 采样地点Sampling location 采样时间Sampling time PFOS/(ng·g−1) F-53B/(ng·g−1) 数据来源Data sources 电镀园区 长三角 土壤 宁波、杭州 2016 38.34— 3672.59 6.33—837.15 [89] 电镀园区周边 珠三角 土壤 中山 2015 0.37—14.95 0.04—10.77 [75] 东莞 2015 0.41—5.89 0.09—0.65 [75] 惠州 2015 0.37—4.54 0.02—209 [75] 非电镀园区周边 全国 污泥 20个省市污水处理厂 2010—2011 ND—218 0.02—209 [90] 注:ND(Not detected)为未检出. -
[1] 2019年中国电镀行业发展现状和市场趋势分析 装饰性和高抗蚀性工艺技术不断发展[J]. 表面工程与再制造, 2019, 19(增刊1): 61-62. Analysis on the Development Status and Market Trend of Electroplating Industry in China in 2019;Decorative and highly corrosion-resistant technologies are constantly developing[J]. Surface Engineering & Remanufacturing, 2019, 19(Sup 1): 61-62 (in Chinese).
[2] HANG X S, WANG H Y, ZHOU J M, et al. Risk assessment of potentially toxic element pollution in soils and rice (Oryza sativa) in a typical area of the Yangtze River Delta[J]. Environmental Pollution, 2009, 157(8/9): 2542-2549. [3] 郭鹏然, 雷永乾, 周巧丽, 等. 电镀厂周边环境中重金属分布特征及人体健康暴露风险评价[J]. 环境科学, 2015, 36(9): 3447-3456. GUO P R, LEI Y Q, ZHOU Q L, et al. Distribution characteristics of heavy metals in environmental samples around electroplating factories and the health risk assessment[J]. Environmental Science, 2015, 36(9): 3447-3456 (in Chinese).
[4] 梁秀娟, 谢润楠, 罗艺丰, 等. 典型电镀城周边土壤重金属的污染特征研究[J]. 广州化工, 2020, 48(16): 107-110. LIANG X J, XIE R N, LUO Y F, et al. Study on pollution characteristics of heavy metals in soils surrounding the typical electroplating cities[J]. Guangzhou Chemical Industry, 2020, 48(16): 107-110 (in Chinese).
[5] 赵委托. 东莞地区电镀厂重金属污染与风险评价研究[D]. 武汉: 中国地质大学, 2016. ZHAO W T. Study on pollution and risk assessment of heavy metals surrounding electroplating plants in Dongguan[D]. Wuhan: China University of Geosciences, 2016 (in Chinese).
[6] LANER D, CREST M, SCHARFF H, et al. A review of approaches for the long-term management of municipal solid waste landfills[J]. Waste Management, 2012, 32(3): 498-512. doi: 10.1016/j.wasman.2011.11.010 [7] 卢然, 王宁, 伍思扬, 等. 电镀地块污染成因分析与源头防控对策[J]. 电镀与涂饰, 2020, 39(23): 1682-1686. LU R, WANG N, WU S Y, et al. Source analysis and control countermeasures of electroplating plot pollution[J]. Electroplating & Finishing, 2020, 39(23): 1682-1686 (in Chinese).
[8] 刘芸, 赵旭, 熊涵磊, 等. 化学品足迹法筛查电镀行业潜在高风险化学品[J]. 生态毒理学报, 2020, 15(3): 184-194. LIU Y, ZHAO X, XIONG H L, et al. Application of chemical footprint method in screening of potential high-risk chemicals in electroplating industry[J]. Asian Journal of Ecotoxicology, 2020, 15(3): 184-194 (in Chinese).
[9] CONDER J M, HOKE R A, de WOLF W, et al. Are PFCAs bioaccumulative? A critical review and comparison with regulatory criteria and persistent lipophilic compounds[J]. Environmental Science & Technology, 2008, 42(4): 995-1003. [10] GIESY J P, KANNAN K. Global distribution of perfluorooctane sulfonate in wildlife[J]. Environmental Science & Technology, 2001, 35(7): 1339-1342. [11] YOUNG C J, FURDUI V I, FRANKLIN J, et al. Perfluorinated acids in Arctic snow: New evidence for atmospheric formation[J]. Environmental Science & Technology, 2007, 41(10): 3455-3461. [12] WANG S W, HUANG J, YANG Y, et al. First report of a Chinese PFOS alternative overlooked for 30 years: Its toxicity, persistence, and presence in the environment[J]. Environmental Science & Technology, 2013, 47(18): 10163-10170. [13] LIU W, LI J W, GAO L C, et al. Bioaccumulation and effects of novel chlorinated polyfluorinated ether sulfonate in freshwater Alga Scenedesmus obliquus[J]. Environmental Pollution, 2018, 233: 8-15. doi: 10.1016/j.envpol.2017.10.039 [14] SHI Y L, VESTERGREN R, ZHOU Z, et al. Tissue distribution and whole body burden of the chlorinated polyfluoroalkyl ether sulfonic acid F-53B in crucian carp (Carassius carassius): Evidence for a highly bioaccumulative contaminant of emerging concern[J]. Environmental Science & Technology, 2015, 49(24): 14156-14165. [15] LIU Y W, RUAN T, LIN Y F, et al. Chlorinated polyfluoroalkyl ether sulfonic acids in marine organisms from Bohai Sea, China: Occurrence, temporal variations, and trophic transfer behavior[J]. Environmental Science & Technology, 2017, 51(8): 4407-4414. [16] SHI Y L, VESTERGREN R, XU L, et al. Human exposure and elimination kinetics of chlorinated polyfluoroalkyl ether sulfonic acids (Cl-PFESAs)[J]. Environmental Science & Technology, 2016, 50(5): 2396-2404. [17] GLASS G V. Primary, secondary, and meta-analysis of research[J]. Educational Researcher, 1976, 5(10): 3-8. doi: 10.3102/0013189X005010003 [18] 詹思延. 系统综述与Meta分析[M]. 北京: 人民卫生出版社, 2019. ZHAN S Y. Systematic review and meta-analysis[M]. Beijing: People's Medical Publishing House, 2019(in Chinese).
[19] 邹森. 清洁生产与电镀技术发展[J]. 建材与装饰, 2018(1): 169-170. ZOU S. Cleaner production and development of electroplating technology[J]. Construction Materials & Decoration, 2018(1): 169-170 (in Chinese).
[20] 赵旭, 胡小英, 刘芸, 等. 电镀行业有机污染物免疫毒性研究进展[J]. 毒理学杂志, 2021, 35(4): 346-350, 359. ZHAO X, HU X Y, LIU Y, et al. Research progress on immunotoxicity of organic pollutants in electroplating industry[J]. Journal of Toxicology, 2021, 35(4): 346-350, 359 (in Chinese).
[21] 刘玉兰. 某电镀行业地块土壤污染调查及原因分析[J]. 广东化工, 2020, 47(21): 110-112, 124. LIU Y L. Investigation and analysis of soil pollution in an electroplating industry[J]. Guangdong Chemical Industry, 2020, 47(21): 110-112, 124 (in Chinese).
[22] 孙威, 张莉, 吴小丽, 等. 电镀废水有机污染物去除技术初探[J]. 科技创新导报, 2017, 14(35): 104-105, 107. SUN W, ZHANG L, WU X L, et al. Preliminary study on removal technology of organic pollutants from electroplating wastewater[J]. Science and Technology Innovation Herald, 2017, 14(35): 104-105, 107 (in Chinese).
[23] 杨晓丽. 电镀工业园内企业污染防治措施分析探讨[J]. 皮革制作与环保科技, 2022, 3(6): 138-141. YANG X L. Analysis and discussion on pollution prevention and control measures of enterprises in electroplating industrial park[J]. Leather Manufacture and Environmental Technology, 2022, 3(6): 138-141 (in Chinese).
[24] 蔡昂祖. 邯郸市工业区周边土壤重金属来源解析及污染评估研究[D]. 邯郸: 河北工程大学, 2022. CAI A Z. Source apportionment and pollution assessment of heavy metals in industrial area soil in Handan[D]. Handan: Hebei University of Engineering, 2022 (in Chinese).
[25] 刘胜然. 典型城市单元的土壤重金属溯源方法与实证研究[D]. 长春: 吉林大学, 2019. LIU S R. Source analysis method and empirical study of heavy metals in soils of typical urbanized areas[D]. Changchun: Jilin University, 2019 (in Chinese).
[26] LI J, PENG G Y, XU X M, et al. Per- and polyfluoroalkyl substances (PFASs) in groundwater from a contaminated site in the North China Plain: Occurrence, source apportionment, and health risk assessment[J]. Chemosphere, 2022, 302: 134873. doi: 10.1016/j.chemosphere.2022.134873 [27] XIE S W, WANG T Y, LIU S J, et al. Industrial source identification and emission estimation of perfluorooctane sulfonate in China[J]. Environment International, 2013, 52: 1-8. doi: 10.1016/j.envint.2012.11.004 [28] TI B W, LI L, LIU J G, et al. Global distribution potential and regional environmental risk of F-53B[J]. Science of the Total Environment, 2018, 640/641: 1365-1371. doi: 10.1016/j.scitotenv.2018.05.313 [29] 曹静, 余节发. 安徽某退役电镀厂搬迁后土地污染与健康风险评估[J]. 化工设计通讯, 2020, 46(4): 228-229. CAO J, YU J F. Land pollution and health risk assessment after relocation of a decommissioned electroplating plant in Anhui Province[J]. Chemical Engineering Design Communications, 2020, 46(4): 228-229 (in Chinese).
[30] 陈洁. 场地重金属健康风险评价: 苏州市某电镀遗留场地重金属健康风险评价[D]. 苏州: 苏州科技大学, 2018. CHEN J. Health risk assessment of heavy metals in the site— Health risk assessment of heavy metals in electroplating left site in Suzhou[D]. Suzhou: Suzhou University of Science and Technology, 2018 (in Chinese).
[31] 陈志良, 周建民, 蒋晓璐, 等. 典型电镀污染场地重金属污染特征与环境风险评价[J]. 环境工程技术学报, 2014, 4(1): 80-85. CHEN Z L, ZHOU J M, JIANG X L, et al. Pollution characteristics and environmental risk assessment of heavy metals in typical electroplating contaminated site[J]. Journal of Environmental Engineering Technology, 2014, 4(1): 80-85 (in Chinese).
[32] 常家华, 杨世利, 余江. 典型企业场地土壤重金属污染及风险水平研究[J]. 东北师大学报(自然科学版), 2019, 51(1): 154-160. CHANG J H, YANG S L, YU J. Study on pollution state and risk level of heavy metals in soil of typical enterprise sites[J]. Journal of Northeast Normal University (Natural Science Edition), 2019, 51(1): 154-160 (in Chinese).
[33] 杭小帅, 王火焰, 周健民, 等. 电镀厂附近土壤重金属污染特征及其对微生物与酶活性的影响[J]. 农业环境科学学报, 2010, 29(11): 2133-2138. HANG X S, WANG H Y, ZHOU J M, et al. Heavy metal contamination characteristics and its impacts on microbial and enzymatic activities in the soil surrounding an electroplating factory[J]. Journal of Agro-Environment Science, 2010, 29(11): 2133-2138 (in Chinese).
[34] 甘文君, 何跃, 张孝飞, 等. 电镀厂污染土壤重金属形态及淋洗去除效果[J]. 生态与农村环境学报, 2012, 28(1): 82-87. GAN W J, HE Y, ZHANG X F, et al. Speciation analysis of heavy metals in soils polluted by electroplating and effect of washing to the removal of the pollutants[J]. Journal of Ecology and Rural Environment, 2012, 28(1): 82-87 (in Chinese).
[35] 陈洁, 施维林, 张一梅, 等. 电镀厂遗留场地污染分析及健康风险空间分布评价[J]. 环境工程, 2018, 36(4): 153-159. CHEN J, SHI W L, ZHANG Y M, et al. Pollution analysis and spatial distribution of health risk in electroplating abandoned site[J]. Environmental Engineering, 2018, 36(4): 153-159 (in Chinese).
[36] 杜丹丹. 电镀场地土壤重金属元素Cr、Zn、Cu形态分析及土壤修复[D]. 济南: 山东大学, 2017. DU D D. The curing stabilization of heavy metals Cr, Cu, Zn in the electroplating site and the soil repair[D]. Jinan: Shandong University, 2017 (in Chinese).
[37] 刘杰, 钟雪梅, 梁延鹏, 等. 电镀废水污染水稻田土壤中重金属的形态分析[J]. 农业环境科学学报, 2006, 25(2): 398-401. LIU J, ZHONG X M, LIANG Y P, et al. Fractionations of heavy metals in paddy soils contaminated by electroplating wastewater[J]. Journal of Agro-Environment Science, 2006, 25(2): 398-401 (in Chinese).
[38] 张毅, 王伟民, 王伟, 等. 电镀企业搬迁场地土壤环境质量调查及评价[C]//“第四届重金属污染防治及风险评价研讨会”暨重金属污染防治专业委员会2014年学术年会论文集. 盐城, 2014: 68-74. ZHANG Y, WANG W M, WANG W, et al. Investigation and evaluation of soil environmental quality in the relocation site of electroplating enterprises [C]. "The Fourth Symposium on Heavy Metal Pollution Control and Risk Assessment" and Proceedings of the Annual Conference of Heavy Metal Pollution Control Committee. Yancheng: 2014, 2014: 68-74(in Chinese)
[39] 刘媛. 电镀企业搬迁后场地调查及其环境影响评价[J]. 岩矿测试, 2012, 31(4): 638-644. LIU Y. Environmental survey and impact assessment on the relocation site of an electroplate factory[J]. Rock and Mineral Analysis, 2012, 31(4): 638-644 (in Chinese).
[40] 吴克华, 周飞. 电镀企业遗留场地调查及生态修复研究[J]. 中国资源综合利用, 2018, 36(11): 26-28, 32. WU K H, ZHOU F. Investigation of the remaining sites of electroplating enterprises and research on ecological restoration[J]. China Resources Comprehensive Utilization, 2018, 36(11): 26-28, 32 (in Chinese).
[41] 麻井彪, 姜延花, 李培辰, 等. 电镀污染土壤中七种重金属潜在生态风险评估[C]//2018中国环境科学学会科学技术年会论文集(第三卷). 合肥, 2018: 509-516. MA J B, JIANG Y H, LI P C, et al Potential ecological risk assessment of seven heavy metals in electroplating contaminated soil [C] Proceedings of 2018 Annual Conference of Science and Technology of Chinese Academy of Environmental Sciences (Volume III). Hefei: 2018: 509-516(in Chinese)
[42] 刘志杰, 张家伟. 电镀行业企业场地土壤污染调查及成因分析[J]. 广东化工, 2018, 45(6): 167-169. LIU Z J, ZHANG J W. Site investigation and reasons of pollution in a electroplating plant[J]. Guangdong Chemical Industry, 2018, 45(6): 167-169 (in Chinese).
[43] 孔莹莹. 东莞市某电镀厂重金属污染场地风险评估[D]. 兰州: 西北师范大学, 2020. KONG Y Y. Risk assessment of heavy metal contaminated site in an electroplating plant in Dongguan[D]. Lanzhou: Northwest Normal University, 2020 (in Chinese).
[44] 马宁, 高先萍, 秦勇军, 等. 工业场地再开发前的污染辨识与风险评估: 以电镀企业遗留场地为例[J]. 资源与产业, 2017, 19(3): 48-52. MA N, GAO X P, QIN Y J, et al. Identification of pollution and risk assessment of industrial sites before redevelopment based on a case study on remained sites by electroplating factory[J]. Resources & Industries, 2017, 19(3): 48-52 (in Chinese).
[45] 吴江涛, 于芳芳, 谭镇. 惠城区典型电镀企业搬迁遗留地重金属污染防治调查及防控建议[J]. 广东化工, 2018, 45(13): 49-50, 105. WU J T, YU F F, TAN Z. Pollution survey and prevention and control suggestions of typical electroplating enterprises in Huicheng district[J]. Guangdong Chemical Industry, 2018, 45(13): 49-50, 105 (in Chinese).
[46] 甘文君, 何跃, 张孝飞, 等. 秸秆生物炭修复电镀厂污染土壤的效果和作用机理初探[J]. 生态与农村环境学报, 2012, 28(3): 305-309. GAN W J, HE Y, ZHANG X F, et al. Effects and mechanisms of straw biochar on remediation contaminated soil in electroplating factory[J]. Journal of Ecology and Rural Environment, 2012, 28(3): 305-309 (in Chinese).
[47] 廉晶晶, 罗泽娇, 靳孟贵. 某厂电镀车间场地土壤与地下水污染特征[J]. 地质科技情报, 2013, 32(2): 150-155. LIAN J J, LUO Z J, JIN M G. Contamination characteristics of soil and groundwater in electroplating plant[J]. Geological Science and Technology Information, 2013, 32(2): 150-155 (in Chinese).
[48] 周鼎, 周建民, 彭晓春, 等. 某电镀搬迁场地土壤重金属污染健康风险评估[J]. 湖南农业大学学报(自然科学版), 2014, 40(3): 321-324. ZHOU D, ZHOU J M, PENG X C, et al. Health risk assessments of soil polluted by heavy metals at a site of relocated electroplating[J]. Journal of Hunan Agricultural University (Natural Sciences), 2014, 40(3): 321-324 (in Chinese).
[49] 倪碧珩, 施维林, 陈洁, 等. 某电镀厂地块重金属污染特征与健康风险空间分布评价[J]. 环境工程技术学报, 2022, 12(3): 878-885. NI B H, SHI W L, CHEN J, et al. Pollution characteristics and spatial distribution evaluation of the health risk of heavy metals in an electroplating plant site[J]. Journal of Environmental Engineering Technology, 2022, 12(3): 878-885 (in Chinese).
[50] 雒寒梦. 某电镀厂对土壤、地下水的污染程度及健康风险评价[D]. 石家庄: 河北地质大学, 2017. LUO H M. Pollution degree and health risk assessment of soil and groundwater in an electroplating factory[D]. Shijiazhuang: Hebei GEO University, 2017 (in Chinese).
[51] 王辉, 刘国良, 许建军. 某电镀厂重金属污染土壤治理措施探讨[C]//2013中国环境科学学会学术年会论文集(第五卷). 昆明, 2013: 1832-1835. WANG H, LIU G L, XU J J. Discussion on the treatment measures of heavy metal contaminated soil in an electroplating factory [C] Proceedings of the 2013 Annual Academic Conference of the Chinese Academy of Environmental Sciences (Volume V). Kunming: 2013: 1832-1835(in Chinese)
[52] 张湘文, 吴代赦, 黄庭, 等. 南昌市进贤县电镀厂周边表层土壤重金属污染特征及健康风险评价[C]//第九届重金属污染防治技术及风险评价研讨会论文集. 武汉, 2019: 34-46. ZHANG X W, WU D S, HUANG T, et al Heavy metal pollution characteristics and health risk assessment of topsoil around Jinxian electroplating plant in Nanchang [C] Proceedings of the 9th Symposium on Heavy Metal Pollution Control Technology and Risk Assessment. Wuhan: 2019: 34-46(in Chinese)
[53] 张磊, 展漫军, 杭静, 等. 南京市某电镀企业搬迁遗留场地调查及风险评估[J]. 环境监测管理与技术, 2015, 27(6): 33-36. ZHANG L, ZHAN M J, HANG J, et al. Environmental site investigation and health risk assessment for the remaining site of A relocated electroplating factory in Nanjing[J]. The Administration and Technique of Environmental Monitoring, 2015, 27(6): 33-36 (in Chinese).
[54] 蒋旭, 王婷婷, 林广宇. 天津市某典型电镀场地重金属污染特征及健康风险评价[C]//中国环境科学学会2019年科学技术年会——环境工程技术创新与应用分论坛论文集(一). 西安, 2019: 276-283. JIANG X, WANG T T, LIN G Y. Heavy metal pollution characteristics and health risk assessment of a typical electroplating site in Tianjin [C] Proceedings of the 2019 Science and Technology Annual Meeting of Chinese Academy of Environmental Sciences — Environmental Engineering Technology Innovation and Application Sub Forum (I). Xi’an: 2019: 276-283(in Chinese)
[55] 殷伟庆, 郭蕾, 黄莹, 等. 土壤中氰化物的快速测定: 以江苏镇江电镀园区土壤监测为例[J]. 干旱环境监测, 2014, 28(2): 70-74. YIN W Q, GUO L, HUANG Y, et al. The rapid determination of cyanide in soil by flow injection technique[J]. Arid Environmental Monitoring, 2014, 28(2): 70-74 (in Chinese).
[56] 耿治鹏, 宋颉, 王春林, 等. 污染场地土壤重金属污染空间特征分析: 以某搬迁电镀厂为例[J]. 环境工程技术学报, 2023, 13(1): 295-302. GENG Z P, SONG J, WANG C L, et al. Spatial characteristics of soil heavy metal pollution in polluted sites: Taking a relocated electroplating factory as an example[J]. Journal of Environmental Engineering Technology, 2023, 13(1): 295-302 (in Chinese).
[57] 侯文隽, 龚星, 詹泽波, 等. 粤港澳大湾区丘陵地带某电镀场地重金属污染特征与迁移规律分析[J]. 环境科学, 2019, 40(12): 5604-5614. HOU W J, GONG X, ZHAN Z B, et al. Heavy metal contamination and migration in correspondence of an electroplating site on the hilly lands of the Guangdong-Hong Kong-Macau greater bay area, China[J]. Environmental Science, 2019, 40(12): 5604-5614 (in Chinese).
[58] 厉炯慧, 翁珊, 方婧, 等. 浙江海宁电镀工业园区周边土壤重金属污染特征及生态风险分析[J]. 环境科学, 2014, 35(4): 1509-1515. LI J H, WENG S, FANG J, et al. Heavy metal pollution characteristics and ecological risk analysis for soil around Haining electroplating industrial park[J]. Environmental Science, 2014, 35(4): 1509-1515 (in Chinese).
[59] 王古月. 镇江绿色化工新材料产业园土壤重金属污染现状及其风险[D]. 镇江: 江苏大学, 2018. WANG G Y. Pollution status and risk assessment of heavy metals in soils of chemical new material industrial park in Zhenjiang[D]. Zhenjiang: Jiangsu University, 2018 (in Chinese).
[60] 朱伟, 张毅, 王伟民, 等. 重金属污染场地土壤环境调查及环境影响评价方法探讨——以上坊电镀厂地块为例[C]. “第四届重金属污染防治及风险评价研讨会”暨重金属污染防治专业委员会2014年学术年会论文集. 盐城: 2014: 254-260. ZHU W, ZHANG Y, WANG W M, et al. Discussion on soil environment and environmental impact assessment method of heavy metal polluted site: A case study of Shangfang Electroplating Plant plot [C]. "The Fourth Symposium on Heavy Metal Pollution Prevention and Risk Assessment" and the Proceedings of the Annual Conference of Heavy Metal Pollution Prevention and Control Committee 2014. Yancheng: 2014: 254-260(in Chinese).
[61] 黄珊. 重金属污染土壤风险评价及化学淋洗研究[D]. 重庆: 重庆大学, 2013. HUANG S. Research of heavy metals pollution soil risk evaluation and chemical leaching[D]. Chongqing: Chongqing University, 2013 (in Chinese).
[62] 李红艳, 黄雷, 张时伟, 等. 珠三角地区电镀厂土壤重金属形态分析[J]. 安徽农业科学, 2016, 44(36): 95-99. doi: 10.3969/j.issn.0517-6611.2016.36.035 LI H Y, HUANG L, ZHANG S W, et al. Speciation analysis of heavy metals in the soil of electroplating factories of the Pearl River Delta[J]. Journal of Anhui Agricultural Sciences, 2016, 44(36): 95-99 (in Chinese). doi: 10.3969/j.issn.0517-6611.2016.36.035
[63] ZHAO L, DING Z L, SIMA J K, et al. Development of phosphate rock integrated with iron amendment for simultaneous immobilization of Zn and Cr(VI) in an electroplating contaminated soil[J]. Chemosphere, 2017, 182: 15-21. doi: 10.1016/j.chemosphere.2017.05.004 [64] XIAO L, GUAN D S, CHEN Y J, et al. Distribution and availability of heavy metals in soils near electroplating factories[J]. Environmental Science and Pollution Research, 2019, 26(22): 22596-22610. doi: 10.1007/s11356-019-04706-0 [65] ZHANG W H, ZHUANG L W, TONG L Z, et al. Electro-migration of heavy metals in an aged electroplating contaminated soil affected by the coexisting hexavalent chromium[J]. Chemosphere, 2012, 86(8): 809-816. doi: 10.1016/j.chemosphere.2011.11.042 [66] LIU J, ZHANG X H, TRAN H, et al. Heavy metal contamination and risk assessment in water, paddy soil, and rice around an electroplating plant[J]. Environmental Science and Pollution Research, 2011, 18(9): 1623-1632. doi: 10.1007/s11356-011-0523-3 [67] 陶亮, 万开, 刘承帅, 等. 场地土壤重金属污染健康风险评价及固化处置: 以东莞市某电镀厂搬迁场地为例[J]. 生态环境学报, 2015, 24(10): 1710-1717. TAO L, WAN K, LIU C S, et al. The health risk assessment and curing treatment of site soils contaminated by heavy metals: Application in one electroplating factory relocation field in Dongguan city, China[J]. Ecology and Environmental Sciences, 2015, 24(10): 1710-1717 (in Chinese).
[68] 中国环境监测总站. 中国土壤元素背景值[M]. 北京: 中国环境科学出版社, 1990. China Environmental Monitoring Station. Background Values of Soil Elements in China[M]. Beijing: China Environmental Science Press, 1990(in Chinese).
[69] QU Y X, HUANG J, WILLAND W, et al. Occurrence, removal and emission of per- and polyfluorinated alkyl substances (PFASs) from chrome plating industry: A case study in Southeast China[J]. Emerging Contaminants, 2020, 6: 376-384. doi: 10.1016/j.emcon.2020.10.001 [70] MUNOZ G, LIU J X, VO DUY S, et al. Analysis of F-53B, Gen-X, ADONA, and emerging fluoroalkylether substances in environmental and biomonitoring samples: A review[J]. Trends in Environmental Analytical Chemistry, 2019, 23: e00066. doi: 10.1016/j.teac.2019.e00066 [71] WANG Q, SONG X, WEI C L, et al. Distribution, source identification and health risk assessment of PFASs in groundwater from Jiangxi Province, China[J]. Chemosphere, 2022, 291: 132946. doi: 10.1016/j.chemosphere.2021.132946 [72] GEBBINK W A, BOSSI R, RIGÉT F F, et al. Observation of emerging per- and polyfluoroalkyl substances (PFASs) in Greenland marine mammals[J]. Chemosphere, 2016, 144: 2384-2391. doi: 10.1016/j.chemosphere.2015.10.116 [73] PAN Y T, ZHANG H X, CUI Q Q, et al. Worldwide distribution of novel perfluoroether carboxylic and sulfonic acids in surface water[J]. Environmental Science & Technology, 2018, 52(14): 7621-7629. [74] 齐观景. 电镀企业排放及周边水环境中典型全氟及多氟烷基化合物的环境风险评估[D]. 哈尔滨: 哈尔滨工业大学, 2020. QI G J. Environmental risk assessment of typical per-and polyfluoroalkyl substances in electroplating factories discharge wastewater and surrounding aquaic environment[D]. Harbin: Harbin Institute of Technology, 2020 (in Chinese).
[75] 李闯修. F-53B和OBS等多/全氟化合物在典型区域的污染特征研究[D]. 青岛: 青岛理工大学, 2016. LI C X. Contamination characteristics of F-53B, OBS and other poly-and per fluoroalky substances in typical areas[D]. Qingdao: Qingdao Technology University, 2016 (in Chinese).
[76] LIN Y F, RUAN T, LIU A F, et al. Identification of novel hydrogen-substituted polyfluoroalkyl ether sulfonates in environmental matrices near metal-plating facilities[J]. Environmental Science & Technology, 2017, 51(20): 11588-11596. [77] WANG T, VESTERGREN R, HERZKE D, et al. Levels, isomer profiles, and estimated riverine mass discharges of perfluoroalkyl acids and fluorinated alternatives at the mouths of Chinese Rivers[J]. Environmental Science & Technology, 2016, 50(21): 11584-11592. [78] WEI C L, WANG Q, SONG X, et al. Distribution, source identification and health risk assessment of PFASs and two PFOS alternatives in groundwater from non-industrial areas[J]. Ecotoxicology and Environmental Safety, 2018, 152: 141-150. doi: 10.1016/j.ecoenv.2018.01.039 [79] WANG Q, TSUI M M P, RUAN Y F, et al. Occurrence and distribution of per- and polyfluoroalkyl substances (PFASs) in the seawater and sediment of the South China Sea coastal region[J]. Chemosphere, 2019, 231: 468-477. doi: 10.1016/j.chemosphere.2019.05.162 [80] WANG Y, SHI Y L, CAI Y Q. Spatial distribution, seasonal variation and risks of legacy and emerging per- and polyfluoroalkyl substances in urban surface water in Beijing, China[J]. Science of the Total Environment, 2019, 673: 177-183. doi: 10.1016/j.scitotenv.2019.04.067 [81] CHEN H, HAN J B, ZHANG C, et al. Occurrence and seasonal variations of per- and polyfluoroalkyl substances (PFASs) including fluorinated alternatives in rivers, drain outlets and the receiving Bohai Sea of China[J]. Environmental Pollution, 2017, 231: 1223-1231. doi: 10.1016/j.envpol.2017.08.068 [82] LI Y, FENG X M, ZHOU J, et al. Occurrence and source apportionment of novel and legacy poly/perfluoroalkyl substances in Hai River Basin in China using receptor models and isomeric fingerprints[J]. Water Research, 2020, 168: 115145. doi: 10.1016/j.watres.2019.115145 [83] ZHAO Z, CHENG X H, HUA X, et al. Emerging and legacy per- and polyfluoroalkyl substances in water, sediment, and air of the Bohai Sea and its surrounding rivers[J]. Environmental Pollution, 2020, 263: 114391. doi: 10.1016/j.envpol.2020.114391 [84] 宋娇娇, 汪艺梅, 孙静, 等. 沱江流域典型及新兴全氟/多氟化合物的污染特征及来源解析[J]. 环境科学, 2022, 43(9): 4522-4531. SONG J J, WANG Y M, SUN J, et al. Pollution characteristics and source apportionment of typical and emerging per- and polyfluoroalkylated substances in Tuojiang River Basin[J]. Environmental Science, 2022, 43(9): 4522-4531 (in Chinese).
[85] PAN Y T, ZHANG H X, CUI Q Q, et al. First report on the occurrence and bioaccumulation of hexafluoropropylene oxide trimer acid: An emerging concern[J]. Environmental Science & Technology, 2017, 51(17): 9553-9560. [86] 周健. 新型全氟化合物在黄土高原水环境中的污染特征及在植物中富集转化机制研究[D]. 杨凌: 西北农林科技大学, 2020. ZHOU J. The pollution characteristics of emerging per-and polyfluoroalkyl substances in water environment in the loess plateau and mechanism of bioaccumulation and transformation in plants[D]. Yangling: Northwest A & F University, 2020 (in Chinese).
[87] 肖少可. 传统和替代全氟化合物在北部湾的空间分布、生物富集及营养级迁移[D]. 南宁: 广西大学, 2021. XIAO S K. Spatial distribution, bioaccumulation and trophic transfer of legacy and alternative per-and polyfluoroalkyl substances in the Beibu Gulf[D]. Nanning: Guangxi University, 2021 (in Chinese).
[88] 孙琳婷. 全(多)氟化合物在典型氟工业园区河流中的污染特征研究[D]. 北京: 中国科学院大学, 2020. SUN L T. Study on pollution characteristics of perfluorinated (polyfluorinated) compounds in rivers of typical fluorine industrial park[D]. Beijing: University of Chinese Academy of Sciences, 2020 (in Chinese).
[89] 曲映溪, 姜新舒, 刘立全, 等. 典型电镀厂土壤中全/多氟烷基化合物的污染特征及风险评估[J]. 能源环境保护, 2020, 34(1): 88-91. QU Y X, JIANG X S, LIU L Q, et al. Poly-and perfluoroalkyl substances in soil in a typical electroplating plant of China: Contamination characteristic and risk assessment[J]. Energy Environmental Protection, 2020, 34(1): 88-91 (in Chinese).
[90] RUAN T, LIN Y F, WANG T, et al. Identification of novel polyfluorinated ether sulfonates as PFOS alternatives in municipal sewage sludge in China[J]. Environmental Science & Technology, 2015, 49(11): 6519-6527. [91] U. S. Environmental Protection Agency. 2009. Provisory Health Advisory for Perfluorooctanoic Acid (PFOA) and Perfluorooctane Sulfonate (PFOS) [EB/OL]. [2009-01-08]. [92] LI J, ZHENG T T, YUAN D, et al. Probing the single and combined toxicity of PFOS and Cr(Ⅵ) to soil bacteria and the interaction mechanisms[J]. Chemosphere, 2020, 249: 126039. doi: 10.1016/j.chemosphere.2020.126039 [93] WEI C L, SONG X, WANG Q, et al. Influence of coexisting Cr(Ⅵ) and sulfate anions and Cu(II) on the sorption of F-53B to soils[J]. Chemosphere, 2019, 216: 507-515. doi: 10.1016/j.chemosphere.2018.10.098 [94] HUANG D D, KHAN N A, WANG G C, et al. The Co-Transport of PFAS and Cr(Ⅵ) in porous media[J]. Chemosphere, 2022, 286: 131834. doi: 10.1016/j.chemosphere.2021.131834 [95] RUAN J Q, TANG T H, ZHANG M, et al. Interaction mechanism between chlorinated polyfluoroalkyl ether potassium sulfonate (F–53B) and chromium on different types of soil surfaces[J]. Environmental Pollution, 2022, 311: 119820. doi: 10.1016/j.envpol.2022.119820 [96] LI J, ZHENG T T, LIU C G. Soil acidification enhancing the growth and metabolism inhibition of PFOS and Cr(Ⅵ) to bacteria involving oxidative stress and cell permeability[J]. Environmental Pollution, 2021, 275: 116650. doi: 10.1016/j.envpol.2021.116650 期刊类型引用(2)
1. 张艳娟,张锟. 竹皮活性炭高效吸附工业废水中高质量浓度铬离子的热力学和动力学研究. 当代化工. 2024(10): 2359-2364 .  百度学术
百度学术
2. 何晨,刘宇,倪东梅,张艺馨. 基于文献计量的我国新污染物研究态势分析. 化工安全与环境. 2024(12): 79-86 .  百度学术
百度学术
其他类型引用(1)
-








 下载:
下载: