-
多环芳烃(polycyclic aromatic hydrocarbons,PAHs)是一类全球普遍存在的半挥发性有机污染物[1 − 3]. 研究表明,大气中的PAHs组分的致突变活性在大气污染物各组分中占比为35%—82%,且主要来自人为源[4 − 5]. 煤炭在当前我国能源消费结构中仍处于重要地位,但煤炭燃烧也是造成我国雾霾频发的重要因素之一[6 − 8]. 在煤炭燃烧过程中,会通过低温挥发和高温自由基缩合反应等途径生成和释放PAHs[9 − 11]. 认清燃煤电厂PAHs的排放特征是其污染控制及环境影响评价的基础和前提,但对于燃煤电厂烟气排放过程PAHs在细颗粒物中的迁移转化行为尚缺乏系统的研究.
特征比值法常被用来解析环境中PAHs的来源,但是由于PAHs异构体具有较大的内源变异性,且其降解转化和大气迁移过程也会改变PAHs的分子组成,使分析结果具有较大不确定性[12 − 14]. 单体稳定同位素分析法已普遍应用于环境痕迹调查,研究者通过分析不同燃烧源(如木材、甘蔗的燃烧、柴油车和汽油车尾气)PAHs的单体同位素值构建了人为源PAHs单体同位素数据库[15 − 18],并探讨了13C生成途径,为其环境来源解析提供了有力证据. 研究表明,与PAHs特征比值较大的差异性不同,PAHs单体同位素比值(δ13C)受生物降解及光降解的作用不明显[19],表明出较强的源解析能力. 前期研究表明,燃煤电厂排放烟气中PAHs的含量和组成与锅炉类型、燃烧条件(如给煤性质、锅炉负荷、操作条件等)以及污染物控制过程等因素密不可分;燃煤产物(如飞灰、底灰、脱硫石膏等)中PAHs的赋存特征受其物化性质(包括粒径、残留碳和矿物种类)等因素控制[20 − 22]. 本次对安徽淮南3家粉煤炉电厂排放烟气中的可吸入颗粒物(PM2.5–10、PM1–2.5、PM1)中PAHs的含量、组成及PAHs单体同位素值进行了系统研究.
-
样品采集于安徽淮南3家燃煤电厂(HPA、HPB和HPC)的燃煤机组烟囱(图1). 根据不同的粉煤炉类型和大气污染控制设施条件将燃煤机组分别命名为HPA-1、HPA-2、HPA-3、HPB-1、HPB-2、HPC-1(表1). 其中HPA-1、HPA-2、HPA-3的运行条件为亚临界,HPB-1、HPB-2的运行条件为亚临界,HPC-1的运行条件为超临界. 所有粉煤炉均安装了静电除尘器(electrostatic precipitators,ESPs);此外,HPA-3、HPB-2、HPC-1安装了湿法烟气脱硫(wet flue-gas desulfurization,WFGD)系统. 粉煤炉中燃烧温度范围是1200—1500 ℃,在ESPs处温度大幅下降(130—180 ℃),在WFGD处为80—90 ℃.
-
采样前将石英滤膜置于500 ℃高温条件下煅烧12 h,将XAD-2聚苯乙烯合成树脂置于丙酮和二氯甲烷中浸泡48 h. 选用改进型撞击式颗粒物采样器,采样时采样探头方向与烟气流动方向一致,控制采样器流量为18.7 L·min–1. 采集的可吸入颗粒物样品按粒径分为PM2.5–10、PM1–2.5、PM1. 为防止烟气冷凝,烟枪以及PMs撞击器温度需保持120 ℃. 采样后,用预焙铝箔包装聚氨酯泡沫基板并将其密封于聚乙烯袋中,并置于温度20 ℃、相对湿度约35%的恒定条件下保存72 h,然后称重. 为保证结果的可重复性,将不同类型的样品以3份平行样的形式收集保存.
-
采用索氏提取法对样品中PAHs进行萃取,将蒽-d10、芘-d10、1-硝基芘-d9加标到提取器中,于200 mL二氯甲烷中萃取48 h,浓缩萃取液,将溶剂交换至正己烷,然后进行色谱分离. 先用10 mL正己烷洗脱色谱柱,再用15 mL正己烷和二氯甲烷(7:3,体积比)混合液洗脱PAHs. 最后氮吹至1 mL,并溶于异辛烷. 加入内标(萘-d8、二氢苊-d10、蒽-d10、䓛-d12、苝-d12).
采用气相色谱-质谱联用仪(Shimadzu GC-MS-QP 2010)测定PAHs. 选择离子监测模式,电子轰击模式(70 eV)下进行定量分析. 色谱条件为:载气(高纯He)流速为1 mL·min–1;柱温初始为60 ℃(保持3 min),以5 ℃·min–1的速率升至200 ℃,继续以2 ℃·min–1的速率升至260 ℃(保持5 min),最后以5 ℃·min–1的速率升至290 ℃(保持3 min). 离子源温度是210 ℃,进样口温度为280 ℃;无分流自动进样1 μL. 用于通过m/z峰面积与相应的内标的m/z峰面积统一化,并利用响应因子进行定量分析. 本次分析的16种美国优控PAHs分别为:萘(Nap),苊(Acy),二氢苊(Ace),芴(Flu),蒽(Ant),菲(Phe),荧蒽(Fla),芘(Pyr),苯并[a]蒽(BaA),䓛(Chr),苯并[b]荧蒽(BbF),苯并[k]荧蒽(BkF),苯并[a]芘(BaP),二苯并[a,h]蒽(DahA),茚并[1,2,3,-cd]芘(InP),苯并[g,h,i]芘(BghiP).
-
以二氯甲烷(15 mL)为流动相,流量为1.3 mL·min–1,用薄层色谱板进一步纯化,浓缩至1 mL. 采用Agilent 6890 GC和Isoprime IRMS进行同位素分析,色谱柱为DB-XLB(30 m×0.25 mm×0.25 µm),载气(高纯He)流速为1 mL·min–1. PAHs单体化合物经气相色谱流出并通过氧化铜燃烧器(900 ℃)生成CO2. 比较δ13C和二氧化碳(99.996%,δ13CVPDB = –35.4 ℃),并于每次运行开始时用作参考混入质谱仪,以分析单个PAHs化合物的C值. 同位素组成成分用δ13C表示,以VPDB标准,用下式计算:
为提高实验的准确性,每个样品同位素测试平行样3份,结果的标准偏差在0.1—0.5 ℃范围内,准确度在±0.3 ℃范围内.
-
为确保PAHs浓度定量的准确性,每5个样品需做1组平行样、分析空白和加标回收. 加标回收率为蒽-d10:83%(68%—103%)、芘-d10:84%(范围:81%—115%). 仪器检测限值定义为校准标准的最低浓度与程序空白中发现的信噪比的3倍. 实验数据的统计处理使用SPSS16.0软件. 方差分析试验用于6个燃煤机组之间PAHs浓度的平均值进行比较. 通过t-test检验了不同粒度颗粒物之间PAHs浓度的平均差异,显著性水平设定为P=0.05.
-
在6个燃煤机组中,同一大气污染控制设施下,机组容量为600 MW的HPB-1(PAHs:5.28 μg·m−3)相较于300 MW的HPA-1(7.45 μg·m−3)和HPA-2(6.45 μg·m−3)以及机组容量为600 MW的HPB-2(3.59 μg·m−3)和HPC-1(2.86 μg·m−3)相较于300 MW的HPA-3(PAHs:4.52 μg·m−3)烟气中PAHs的含量都明显较低(表2),这说明大机组比小机组燃烧效率更高. 此外, HPB-1排放烟气中PAHs含量明显高于同为600 MW的HPB-2和HPC-1,说明湿式脱硫对于去除烟气中的PAHs具有一定作用.
不同机组烟气中PAHs的组成也存在明显的差异性,高分子量PAHs化合物(如BbF、BaP、InP和BghiP)在机组容量较小的粉煤炉(即HPA-1和HPA-2)中的含量更高(图2);此外,超临界粉煤炉中高分子量PAHs的含量明显低于亚临界粉煤炉. 这可以表明相对较低热效率燃烧促进了这些PAHs化合物的产生.
-
PAHs在PM2.5-10中的浓度分数为19.6%—22.4%,在PM1-2.5中为30.0%—33.0%,在PM1中为46.6%—49.6%(表2). 不难看出,PAHs在这3种不同粒度的可吸入颗粒物中的浓度分数表现出总含量随着粒度的减少而增大的趋势,推测可能是因为颗粒越细,在燃烧室的停留时间久越短且具有的表面积也越大. 而这些细小颗粒物很大一部分可以直达人体肺泡[23 − 25],威胁生命健康,所以针对燃煤电厂细颗粒物排放的控制十分重要.
由表2可以看出,粒径对PAHs化学分布影响显著. 高分子量PAHs趋于富集在较细的颗粒物上. 例如与PM2.5-10结合的多是4环PAHs,占比高达35.8%,其次是5环和3环PAHs;而当粒度减少到PM1-2.5时,5环PAHs的比例从16.2%—27.2%增加到22%—29.5%,6环PAHs从6.1%—13.8%增加到10.1%—15.6%. 一般情况下,细小颗粒结合的有机物可以通过挥发或吸附转移到大的粒子中,但PAHs却不是如此,吸附在细小颗粒物中高分子量PAHs不太可能转移到粗颗粒物,反而低分子量PAHs更容易在粗细颗粒之间达到分配平衡,导致高分子量PAHs在细颗粒物相对富集[26].
-
PAHs特征比值用来示踪其来源的原理是假设PAHs异构体在传输和迁移过程中被稀释程度类似,以保持异构体相对比值从源到受体不变[12]. 如图3所示,大部分PAHs特征比值在不同粒度的特征比率变化趋势并不显著,显示其在PAHs源解析的应用潜力. 但PM2.5-10中BaA/(BaA+Chr)(0.43—0.64)和InP/(InP+BghiP)(0.40—0.57)表现出一定的差异性,表明锅炉类型和大气污染控制设施对其有一定的影响.
然而一些研究表明,不同来源的PAHs的特征比值表现不一致,例如Rogge报道的柴油燃烧排气值为0.35—0.7[27],另一些研究报道燃煤、柴油燃烧和木材燃烧源InP/(InP+BghiP)值分别为0.56、0.37和0.62[28-29];还有研究发现不同木材燃烧排放PAHs的InP/(InP+BghiP)比值范围为0.42—0.51[30]. 这说明不同人为源PAHs特征比值具有源内变异性和源间相似性,可能会受到不同燃煤性质、锅炉类型和燃烧条件影响. 由此可见通过PAHs特征比值的方法来判断来源有一定的局限性. 但大多数PAHs特征比率的变化较小,一定程度上说明PAHs特征比值可应用于燃煤电厂排放PAHs的来源.
-
原煤和烟气颗粒物中PAHs单体稳定同位素值(δ13C)分别为−26.5‰—−24.2‰和−30.4‰—−27.6‰,说明燃烧过程中PAHs同位素发生了分馏. 前人研究表明,煤热解产物中PAHs更加富集13C,此外,δ13C值随着热解温度的升高而降低,这主要是因为12C—12C化学键相较于13C—13C键的化学能垒较低从而更容易通过化学重排反应生成[31]. 因此粉煤炉高温燃烧条件下PAHs的分子结构重组更倾向于形成新的12C—12C化学键而非13C—12C键. 燃煤机组HPA-1、HPA-2排放的PAHs的δ13C同位素相对更重,说明更高的燃烧效率导致PAHs结构演变(缩合)程度更深. 没有证据表明烟气脱污过程(静电除尘和湿式脱硫)PAHs会发生显著分馏行为. 原煤与烟气颗粒物中δ13C值具有相似的变化趋势,即低分子量PAHs如Phe、Ant更易富集13C,而高分子量PAHs如BaP、InP、BghiP中13C含量则相对较低(表3),这表明粉煤炉燃烧过程烟气中的高分子量PAHs主要是通过化学重排反应产生的,而低分子量PAHs在一定程度上来自于原煤受热挥发.
通过与文献所报告的汽油或柴油排放、甘蔗和生物质燃烧的数据进行比较,发现不同来源PAHs单体同位素值具有显著差别,例如秸秆燃烧源(−25.4‰—−22.9‰)[32]、C3植物燃烧源(−28.8‰—−28.0‰)、C4植物燃烧源(−16.6‰—−15.8‰)[30]和燃煤源(−31.2‰—−22.0‰)[31],尽管存在一定的数据重叠. 但对于不同工艺过程产生PAHs的δ13C值难以进行有效的区分,例如煤气化过程中的BaA及BkF的δ13C值分别为−28.4‰、−28.8‰,而煤燃烧过程中芘的δ13C值为−28.7‰[31].
-
PAHs的质量浓度与粉煤炉种类和燃烧条件并没有呈现显著的相关性. ESPs对气相PAHs的去除效率较低,WFGD系统能够有效去除高分子量PAHs. PAHs单体化合物在不同粒度之间表现出明显不同的富集和分离行为. 低分子量PAHs易在细颗粒物和粗颗粒物间平衡,高分子量PAHs因挥发和吸附慢而更易与细颗粒物结合. PAHs的特征比值对于示踪燃煤电厂源有一定的指示意义,但也受到大气污染控制设施的影响. 相比于特征比值法,PAHs单体同位素分析法由于其稳定性及不易被降解,可以有效追踪粉煤炉高温燃烧条件下PAHs的分子结构重组过程. 因此,PAHs单体同位素分析法对于区别不同人为源,如生物质燃烧、车辆尾气排放、煤炭燃烧等表现出较大的潜力,但对于工艺过程如炼焦、煤气化和煤炭燃烧尚难进行有效示踪.
粉煤炉电厂烟气颗粒物中多环芳烃的赋存特征及源解析意义
Occurrence of polycyclic aromatic hydrocarbons in inhalable particulate matters emitted from pulverized coal boilers of coal-fired power plant and source apportionment implications
-
摘要: 针对安徽淮南3家粉煤炉燃煤机组排放的烟气,分析了可吸入颗粒物(PM2.5–10、PM1–2.5、PM1)中多环芳烃(PAHs)的浓度和组成及PAHs单体同位素的值. 研究表明,烟气颗粒物中PAHs排放浓度主要受锅炉类型、燃烧参数和大气污染控制设施等因素的影响. 细颗粒物易富集PAHs,且对高分子量PAHs的富集程度更高. 不同粒度颗粒物中PAHs特征比值的变化幅度较小,但对不同燃煤源排放的PAHs仍有较大的不确定性. PAHs单体碳同位素值有效区别燃煤锅炉源、生物质燃烧和车辆尾气排放源,但对于粉煤炉的不同燃烧过程指示不明显.Abstract: The concentrations, distributions, and stable carbon isotope compositions of polycyclic aromatic hydrocarbons (PAHs) in inhalable particulate matters (PM2.5–10, PM1–2.5, and PM1) emitted from three pulverized coal boilers of coal-fired power plants (CFPPs) in Anhui, China were investigated. Results indicate that PAH concentrations and distributions in PM2.5–10, PM1–2.5, and PM1 were affected by the boiler type and operating conditions of air pollution control devices. The fine particles tended to enrich high molecular weight PAHs compared to coarse particles. The diagnostic ratios of PAHs varied insignificantly among different boilers, suggesting a potential to trace CFPP-based combustion sources in the environment. However, they can not be used to trace emission sources from different types of coal boilers of CFPPs due to their large variations. The stable carbon isotope compositions of PAHs showed significant variations among the emission sources of CFPPs, biomass burning, and vehicle exhaust. They varied insignificantly in the processes of PAH formation during coal combustion from pulverized coal boilers and the subsequent transfer of flue gas.
-
全氟和多氟化合物(per- and polyfluoroalkyl substances,PFASs)是一类氢原子完全或部分被氟取代的人工合成有机化合物[1]. 由于其独特的物理化学性质,PFASs在工业和消费品中具有多种用途,例如纺织品、食品包装、化妆品、和消防泡沫等[2]. 然而,接触PFASs可能会造成激素分泌、生殖、免疫、代谢以及胎儿生长发育等方面的毒理作用[3]. 根据全球许多研究,PFASs已在地表水、土壤、沉积物、动物、空气、灰尘等基质中被发现[4],它们在各环境介质中的普遍存在引起了越来越多的关注. PFASs的环境持久性和生物累积性导致其最终在动物、植物和人体内蓄积. 太湖作为长三角地区的重要水源地,其污染状况一直备受关注. 太湖流域包括江苏、浙江等几个人口密集、工业发达的地区,PFASs生产及纺织处理、金属电镀、消防、半导体等相关产业分布密集[5-6],PFASs生产使用量及其环境排放潜力较大. 目前已经有少量研究报道了太湖地表水和沉积物中PFASs的污染特征[7-10],但其关注的目标PFASs化合物种类较少,尤其是关于一些新型PFASs还鲜有报道. 目前,国内外持久性有机污染物(POPs)履约行动力度逐渐加强,对一些库存PFASs例如全氟辛基磺酸(PFOS)等使用、生产的限制管控和替代不断强化,世界范围内的许多区域出现了PFOS等管控目标污染水平的逐年降低,也伴随着各种新型短链以及杂原子取代型PFASs环境污染水平的逐渐升高. 因此在环境监测中将更多的新型PFASs纳入分析目标更有利于对PFASs污染的全面准确认识.
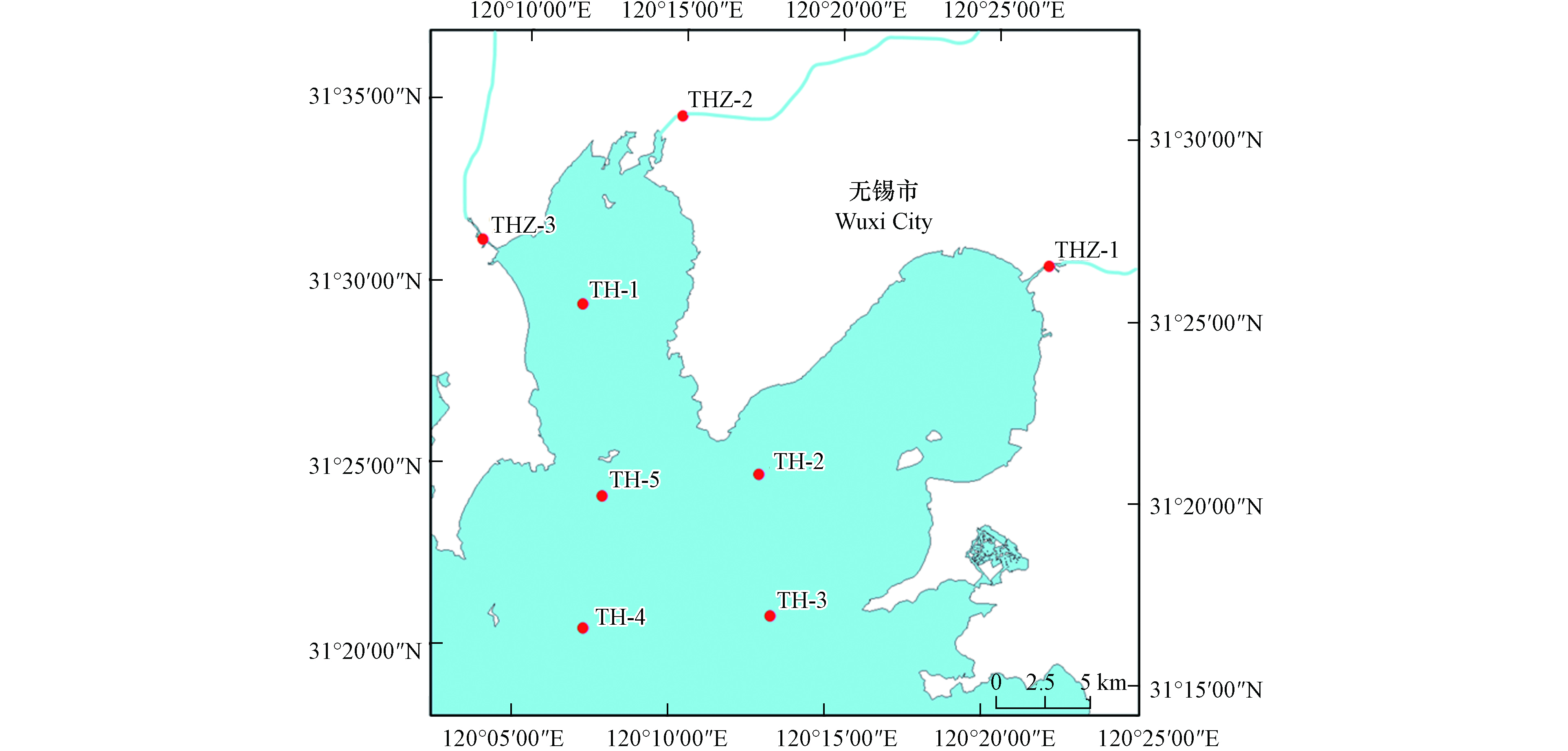
梅梁湾是太湖污染最严重的地区[9-10]. 因此,本研究选取靠近无锡市的太湖梅梁湾为研究区域,设置5个湖体采样点和3个河流入湖口采样点,采集地表水和沉积物样品,对其中的包括多种新型PFASs在内的32种PFASs目标物进行分析测定. 在此基础上研究PFASs组成特征和PFASs在地表水和沉积物两相之间的分配,并从生态和人体健康两方面对PFASs进行了风险评估,以期全面了解该区域PFASs的污染状况和风险,为污染预防管控和治理提供基础数据.
1. 实验部分(Experimental section)
1.1 试剂和材料
甲醇(色谱纯)购自德国Merck公司;乙酸铵(色谱纯)购自美国Thermo Fisher Scientific公司;氨水(色谱纯,~50% V/V)和冰醋酸(色谱纯,>99.8%)均购自美国Alfa Aesar公司;超纯水(电阻率>18.2 MΩ·cm)经Milli-Q(美国,Milipore公司)系统制得. 弱阴离子交换吸附剂填料的Oasis WAX固相萃取小柱(150 mg,6 cm3)购自美国Waters公司.
包含30种PFASs的PFAC30PAR标准品和10:2氯代多氟醚磺酸(10:2 Cl-PFESA)标准品以及质量标记的内标液MPFAC-MXA(包括13C4-PFBA、13C4-PFOA、13C2-PFDA、13C2-PFDoDA、18O2-PFHxS和13C4-PFOS)均购自惠灵顿实验室(Guelph,ON,Canada). 全氟壬烯氧基苯磺酸(OBS)标准品是从凯尔氟新材料有限公司(Kaierfu New Material Co.,Ltd.)的商业产品(95%,工业级)中纯化而来的. 32种PFASs混标储备液(100 ng·mL−1)采用甲醇配制,置于4 ℃的冰箱中保存.
1.2 样品采集和前处理
2021年6月,在江苏省无锡市太湖梅梁湾布设了5个湖体采样点(TH1—5),以及3个无锡市主要河流入湖口采样点(THZ1—3,望虞河、梁溪河、直湖港河)(如图1所示),采集了地表水和沉积物样品. 水样使用不锈钢水桶采集,沉积物则采用不锈钢抓泥斗. 所有样品均收集在聚丙烯(PP)采样瓶中,寄到实验室前均暂存于冰箱,两天内运送到实验室,水样置于4 ℃的冰箱中冷藏保存,沉积物样品在−20 ℃下冷冻保存直至处理.
水样经0.7 μm玻璃纤维滤膜抽滤后,准确量取400 mL,加入2 ng的MPFAC-MXA,然后经固相萃取净化处理. 固相萃取小柱Oasis WAX依次用4 mL 1%的氨水-甲醇溶液、4 mL甲醇和8 mL超纯水进行活化. 之后上样,该过程流速控制在3 mL·min−1. 上样完成后依次加入4 mL 2.5 mmol·L−1的醋酸铵-冰醋酸缓冲液和8 mL超纯水清洗WAX小柱. 待清洗液流干后,WAX小柱真空泵抽干1.5 h,最后用4 mL甲醇和4 mL 0.1%的氨水-甲醇溶液洗脱待测物,将合并后的洗脱液氮吹定容至1 mL,以4500 r·min−1的转速离心10 min后,取上清液转移至进样小瓶待测.
沉积物经真空冷冻干燥后,研磨过筛. 准确称取0.5 g沉积物置于15 mL聚丙烯离心管,加入2 ng 的MPFAC-MXA,充分涡旋振荡混匀后老化30 min. 加入10 mL甲醇,50 ℃水浴超声提取30 min,混匀后用摇床以250 r·min−1速度振荡提取16 h,离心(4500 r·min−1)后收集上清液;残留部分加入5 mL甲醇进行二次提取,摇床30 min(250 r·min−1),离心10 min(4500 r·min−1),合并上清液. 氮吹至约1 mL,离心(4500 r·min−1)10 min,取上清液加超纯水稀释至50 mL,用活化好的WAX小柱富集净化(净化过程与水样一致),洗脱液氮吹定容至1 mL,离心(4500 r·min−1)后取上清液进样分析.
1.3 仪器分析
样品分析采用配有二元梯度泵、自动进样器和柱温箱的高效液相色谱HPLC(Ultimate 3000,Thermo Fisher Scientific)与配有ESI源的三重四极杆质谱(API 3200,Applied Biosystems/MDS SCIEX)串联仪器进行. 使用Acclaim 120 C18色谱柱(5 μm,4.6 mm×150 mm,Thermo Fisher Scientific,USA)分离PFASs,柱温25 ℃. 流动相A为甲醇,B为50 mmol·L−1乙酸铵,梯度洗脱程序为:0 min流动相A比例为72%,4 min内增加到95%,在此状态下保持3 min,最后在0.1 min内恢复到72%,并维持2.9 min,分析总时长为10 min. 流速为1 mL·min−1,进样量为10 μL. 质谱在ESI负离子模式下使用多反应监测(MRM)模式运行,气帘气压20 psi,碰撞气压6 psi,离子源喷雾电压−1000 V,温度350 ℃,雾化气60 psi,辅助雾化气40 psi,PFASs详细的质谱参数和离子对见表1.
表 1 PFASs的离子对和质谱参数Table 1. Mass transitions and parameters of mass spectrometry化合物Compound 名称 Name 母离子Q1 子离子Q3 解簇电压/ VDP 入口电压/ VEP 碰撞入口电压/ VCEP 碰撞能量/ eVCE 碰撞出口电压/ VCXP PFCAs 全氟烷基羧酸 PFBA 全氟丁酸 212.8 168.8 −15.5 −10.0 −15.0 −16.2 −4.7 PFPeA 全氟戊酸 262.8 218.9 −21.5 −10.0 −19.2 −15.5 −5.8 PFHxA 全氟己酸 312.8 269.0 −18.7 −10.0 −19.5 −15.6 −7.8 PFHpA 全氟庚酸 362.8 319.0 −23.0 −10.0 −20.0 −13.0 −9.0 PFOA 全氟辛酸 412.8 369.0* −16.5 −10.0 −21.7 −15.2 −10.4 412.8 168.8 −20.6 −10.0 −40.0 −24.5 −4.4 PFNA 全氟壬酸 462.8 419.1 −31.4 −10.0 −43.2 −19.1 −12.1 PFDA 全氟癸酸 512.8 469.1 −24.4 −10.0 −37.0 −24.0 −7.4 PFUnDA 全氟十一酸 562.8 519.1 −23.4 −10.0 −50.2 −30.0 −8.5 PFDoDA 全氟十二酸 612.8 569.0 −24.0 −10.0 −40.3 −25.6 −9.2 PFTrDA 全氟十三酸 662.8 619.0 −33.4 −10.0 −40.7 −24.0 −10.3 PFTeDA 全氟十四酸 712.8 669.0 −52.9 −10.0 −38.1 −21.1 −11.2 PFSAs 全氟烷基磺酸 PFBS 全氟丁基磺酸 298.8 79.9* −71.2 −10.0 −29.8 −51.2 −3.5 298.8 99.0 −70.2 −10.0 −31.0 −40.0 −5.1 PFPeS 全氟戊基磺酸 348.8 79.9* −72.0 −10.0 −26.4 −63.0 −3.4 348.8 99.0 −72.8 −10.0 −93.3 −42.5 −5.0 PFHxS 全氟己基磺酸 398.8 79.9* −75.3 −10.0 −44.2 −66.0 −3.1 398.8 99.0 −72.6 −10.0 −30.2 −51.4 −2.0 PFHpS 全氟庚基磺酸 448.8 79.9* −81.0 −10.0 −46.0 −75.0 −3.6 448.8 99.0 −85.0 −10.0 −40.0 −56.1 −2.0 PFOS 全氟辛基磺酸 498.8 79.9* −89.1 −10.0 −34.0 −86.1 −3.4 498.8 99.0 −82.0 −10.0 −56.1 −62.7 −2.0 PFNS 全氟壬基磺酸 548.8 79.9* −90.6 −10.0 −34.0 −92.1 −3.3 548.8 99.0 −94.6 −10.0 −31.5 −75.8 −2.0 PFDS 全氟癸基磺酸 599.3 79.9* −97.0 −10.0 −21.3 −76.0 −3.6 599.3 99.0 −98.2 −10.0 −36.1 −81.0 −2.0 Cl-PFESAs 氯代多氟醚磺酸 6:2 Cl-PFESA 6:2氯代多氟醚磺酸 530.6 351.0* −66.0 −10.0 −40.0 −41.6 −9.8 530.6 83.0 −56.0 −10.0 −38.0 −50.6 −1.6 8:2 Cl-PFESA 8:2氯代多氟醚磺酸 631.0 451.2* −31.0 −10.0 −35.5 −35.0 −7.0 631.0 83.2 −75.0 −10.0 −52.9 −53.0 −4.3 10:2 Cl-PFESA 10:2氯代多氟醚磺酸 731.1 551.1 −90.1 −10.0 −32.5 −33.6 −8.6 731.1 83.1 −91.5 −10.0 −64.6 −70.7 −1.5 FTSs 氟调聚磺酸 4:2 FTS 4:2氟调聚磺酸 326.8 81.0 −50.1 −10.0 −31.8 −46.4 −4.0 326.8 307.0 −51.5 −10.0 −22.5 −32.7 −8.9 6:2 FTS 6:2氟调聚磺酸 426.8 81.0 −54.4 −10.0 −35.2 −61.0 −4.0 426.8 407.0 −55.2 −10.0 −28.2 −39.0 −6.1 8:2 FTS 8:2氟调聚磺酸 526.9 81.0 −65.9 −10.0 −37.9 −73.2 −4.0 526.9 506.9 −71.0 −10.0 −33.9 −43.2 −15.0 FSAs 全氟磺酰胺 FBSA 全氟丁基磺酰胺 297.8 77.9 −46.7 −10.0 −23.9 −39.8 −3.8 FHxSA 全氟己基磺酰胺 397.8 77.9 −60.0 −10.0 −31.8 −47.2 −4.3 FOSA 全氟辛基磺酰胺 497.8 77.9 −74.1 −10.0 −33.9 −60.0 −4.5 N-MeFOSAA N-甲基全氟-1-辛烷磺酰胺基乙酸 569.7 419.2 −50.5 −10.0 −31.2 −31.9 −6.4 569.7 511.8 −42.1 −10.0 −29.1 −32.0 −7.9 N-EtFOSAA N-乙基全氟-1-辛烷磺酰胺基乙酸 583.8 419.2 −47.2 −10.0 −34.0 −33.0 −5.3 583.8 525.9 −44.0 −10.0 −31.2 −32.2 −8.3 NaDONA 4,8-二氧杂-3-氢-全氟壬酸 377.0 85.0* −25.0 −10.0 −27.0 −48.9 −4.9 377.0 251.0 −21.0 −10.0 −26.0 −18.8 −7.0 HFPO-DA 六氟环氧丙烷二聚体 329.0 285.0 −11.0 −10.0 −18.5 −11.8 −7.9 OBS 全氟壬烯氧基苯磺酸 603.1 172.0* −87.1 −10.0 −49.5 −52.6 −4.2 602.5 108.0 −82.2 −10.0 −41.5 −85.9 −2.5 602.5 465.0 −101.9 −10.0 −32.2 −49.0 −6.3 IS 内标 13C4−PFBA 13C标记全氟丁酸 216.9 171.9 −24.0 −10.0 −12.6 −13.5 −4.8 13C4−PFOA 13C标记全氟辛酸 416.8 372.1 −25.4 −10.0 −20.7 −13.5 −5.5 13C2−PFDA 13C标记全氟癸酸 515.0 470.0 −22.3 −7.0 −26.2 −18.2 −13.2 13C2−PFDoDA 13C标记全氟十二酸 614.8 570.0 −25.6 −10.0 −33.1 −22.0 −9.4 18O2−PFHxS 18O标记全氟己基磺酸 403.0 102.9 −81.2 −9.0 −40.9 −48.0 −2.5 13C4−PFOS 13C标记全氟辛基磺酸 502.8 79.9 −91.8 −10.0 −44.4 −78.3 −3.6 *定量离子quantification ion. 1.4 质量保证与控制
在整个实验过程中,完全避免使用含PFASs材料制成的容器和试剂. 在实验前,对所有使用的实验用品和试剂进行分析,确保其浓度始终低于根据信噪比(S/N)为3确定的仪器检出限,方法检出限(LOD)按照400 mL水,0.5 g沉积物计算. 另外,在每10个样品中加入程序空白,检查背景污染;并在测定20个样品后测定标准质控,检查信号漂移. 使用内标法对目标物进行定量,标准曲线系列浓度为0.05、0.1、0.2、0.5、1.0、2.0、5.0、10、20、50 ng·mL−1. 使用1/x2加权回归,所有PFASs目标物的相关系数均>0.99. 分析过程中如果标准品测定值与其真实值的偏差超过±20%,须重新构建标准曲线. 进行加标回收实验以评估整个方法的准确性和精密度,将PFASs标准品加入到地表水和沉积物样品中并采用与实际样品相同的提取和净化步骤进行处理. 大部分PFASs的平均基质加标回收率(n=3)在80%至120%之间(表2).
表 2 PFASs的加标回收率和检出限(LODs)Table 2. The spike recoveries and limits of detection (LODs) of PFASs化合物Compound 地表水Water 沉积物Sediment 回收率/%Recovery 相对标准偏差/%RSD 方法检出限/(ng·L−1)LOD 回收率/%Recovery 相对标准偏差/%RSD 方法检出限/ (ng·g−1)LOD PFBA 92.9±6.9 7.4 0.23 98.3±4.4 4.5 0.09 PFPeA 101.0±8.5 8.4 0.14 92.9±7.8 8.3 0.06 PFHxA 101.7±9.5 9.3 0.09 101.3±9.3 9.1 0.03 PFHpA 110.5±8.5 7.6 0.12 98.3±8.1 8.2 0.05 PFOA 104.7±10.5 9.9 0.36 92.0±7.3 7.0 0.14 PFNA 103.4±7.7 7.4 0.18 100.1±10 10.0 0.07 PFDA 102.9±9.5 9.3 0.17 109.9±6.6 6.0 0.07 PFUnDA 92.2±7.2 7.6 0.18 91.5±7.4 8.1 0.07 PFDoDA 95.2±12.3 12.8 0.20 92.3±4.1 4.4 0.08 PFTrDA 97.5±9.3 9.4 0.28 96.5±10.9 11.3 0.11 PFTeDA 102.7±10.9 9.5 0.68 102.9±12.1 11.8 0.27 PFBS 105.1±12.3 11.6 0.07 102.6±4.6 4.4 0.03 PFPeS 109.6±9.1 8.3 0.09 98.3±3.0 3.0 0.04 PFHxS 99.0±9.6 9.7 0.08 93.7±4.5 4.8 0.03 PFHpS 99.1±8.7 8.7 0.06 95.1±3.9 4.1 0.03 PFOS 99.2±8.7 7.3 0.07 99.6±7.1 6.3 0.03 PFNS 89.1±7.7 8.4 0.07 98.4±4.8 4.9 0.03 PFDS 80.7±4.1 5.1 1.36 94.2±5.5 5.7 0.55 6:2 Cl-PFESA 86.9±6.1 7.0 0.20 96.8±4.5 4.5 0.08 8:2 Cl-PFESA 75.4±6.1 8.0 0.12 84.1±8.8 10.5 0.05 10:2 Cl-PFESA 78.3±7.5 9.5 0.27 77.3±4.6 5.6 0.11 4:2 FTS 154.3±11 6.9 0.79 94.1±8.5 7.3 0.32 6:2 FTS 124.7±15 11.7 0.50 119.9±8.5 6.9 0.20 8:2 FTS 115.3±3.4 2.9 0.28 112.6±6.0 5.1 0.11 FBSA 90.8±6.9 7.6 0.05 82.2±3.4 4.2 0.02 FHxSA 78.4±2.1 2.7 0.03 72.6±5.1 7.1 0.01 FOSA 97.0±8.5 8.8 0.03 78.7±3.1 3.9 0.01 NaDONA 104.6±7.5 7.2 0.19 96.0±4.3 4.5 0.08 HFPO-DA 107.9±7.8 7.3 1.58 70.9±3.7 4.4 0.63 N-MeFOSAA 92.0±9.0 9.8 0.68 108.8±7 6.4 0.27 N-EtFOSAA 100.3±10.6 10.5 0.71 104.8±2.0 1.9 0.29 OBS 100.9±4.5 4.4 0.36 131.0±4.9 3.7 0.14 1.5 数据处理
沉积物-水分配系数(Kd,单位L·kg−1)常用于评估污染物在沉积物中的吸附能力[11],计算公式如下:
Kd=Csediment/Cwater×1000 其中,Csediment代表沉积物中目标物浓度(ng·g−1干重),Cwater代表水样目标物浓度(ng·L−1).
进一步地,沉积物有机碳归一化分配系数(Koc,单位L·kg−1)计算如下[11]:
Koc=Kd/foc 其中,foc为沉积物有机质含量(%),采用配备有固体附件SSM-5000A的TOC分析仪(Shimadzu,Japan)测定.
文献中常用用风险商(RQs)来评价化合物对水生生物的潜在影响[12-13],计算公式如下所示:
RQ=MEC/PNEC 这里MEC是地表水中所测得的化合物的最大浓度(ng·L−1);PNEC是预测的化合物的无效应浓度(ng·L−1),其数值按下面公式进行计算:
PNEC=(EC50orLC50)/f 其中,最低中位数有效浓度EC50或LC50(mg·L−1)基于模型操作(ECOSAR™软件,EPA)得出[13];f是安全系数,根据欧洲水框架指令, f一般取1000. RQ小于0.1表示化合物对水生生物风险较低,在0.1到1之间属于中等程度风险,大于1表示风险较高.
太湖作为重要的饮用水水源地,且采样点TH-2为无锡市自来水厂沙渚取水口,饮用水摄入是附近居民暴露PFASs的可能途径,参照先前报道[10, 12],以湖水PFASs浓度代替当地居民饮用水浓度,评估人群通过饮用水对PFASs的单位体重日摄入量(EDI)(以体重计,ng·(kg·d)−1),计算公式如下[12]:
EDI=(C×IR)/BW 其中,C为目标PFASs的平均浓度(ng·L−1),IR为每天饮用水摄入量(L·d−1),BW为平均体重(kg). IR和BW的成人和儿童数据引自中国人群暴露参数手册[14].
采用IBM PASW统计18.0(SPSS Inc.,1993—2007)进行统计分析,统计显著性阈值为P<0.05. 低于LOD的值被指定为LOD/2. 沉积物的浓度均为干重(dw)浓度.
2. 结果与讨论 (Results and discussion)
2.1 地表水中PFASs的污染特征
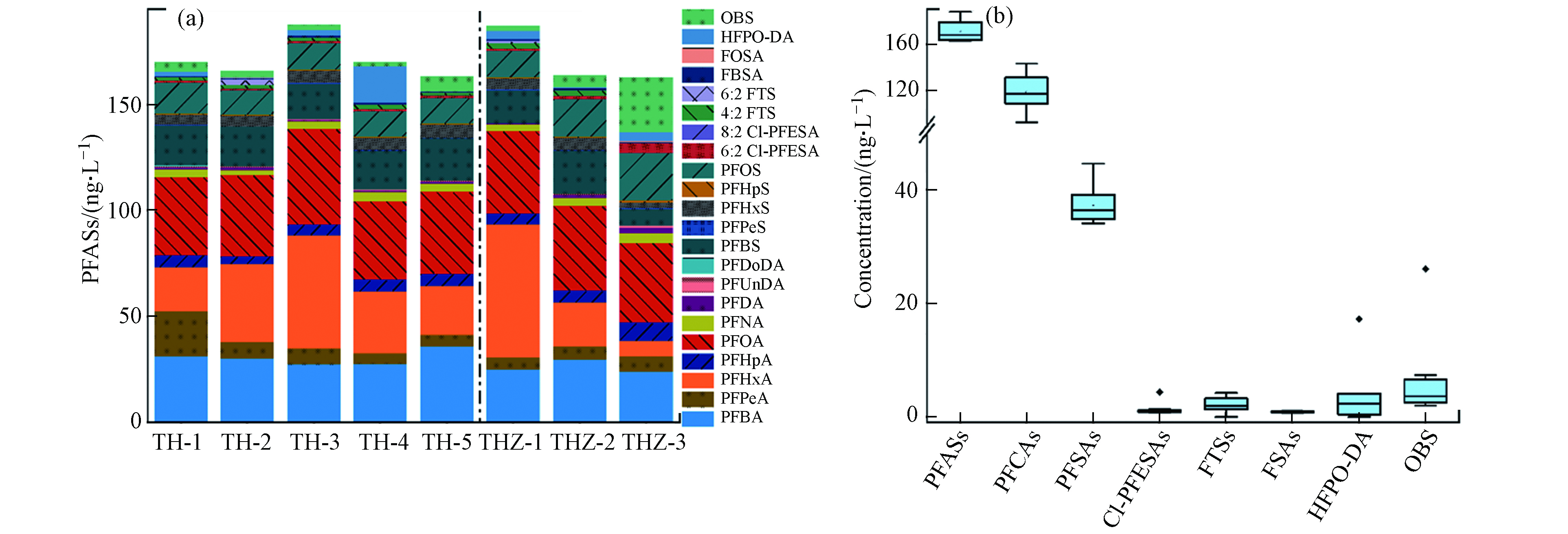
太湖梅梁湾地表水中共检出22种PFASs,其中15种PFASs的检出率为100%,主要包括C4—10 PFCAs、C4—8 PFSAs、6:2 Cl-PFESA、FBSA和OBS(图2a),说明PFASs应用的广泛性和污染的普遍性,尤其是新型PFASs的广泛检出值得进一步关注. 根据文献报道,全氟丁基磺酰胺(FBSA)是全氟丁基磺酸(PFBS)的前体物,它可能来自新的全氟丁基类替代品或其他短链全氟烷基类产品[15]. 然而,FBSA在环境中并不常见,此次在太湖梅梁湾地表水中检出浓度范围为0.65—1.05 ng·L−1(平均值0.82),可能与当地的食品包装、纺织、农药等[6]工业生产有关. 另外,OBS和Cl-PFESA是两种被忽视40余年的新型PFASs,在PFOS被公约限制后被认为是其主要替代品. 其中OBS在中国作为消防泡沫助剂和石油工业采油助剂被大量使用,其已经被证明具有与PFOS相似的急性毒性[16]和生物蓄积性[17]. 因此,这种新型PFAS在太湖梅梁湾中的普遍检出(2.01—26.06 ng·L−1,平均值6.67)需引起重视. 6:2 Cl-PFESA主要应用于金属电镀领域,虽然其检出浓度(范围0.73—4.25 ng·L−1,平均值1.38)并不高,但由于具有很强的生物蓄积性[18],所以其对水生生物和当地人群的影响不可忽略.
水样中∑PFASs范围为162.82—187.62 ng·L−1(平均值171.34,中位值167.82),此浓度与之前测得的∑PFASs:96.2—330 ng·L−1(平均值147)相当[7, 9]. 与其他湖泊相比,太湖梅梁湾∑PFASs要高于同位于华东地区的淡水湖—巢湖(平均值14.46 ng·L−1)[19],以及北京城区地表水(∑PFASs范围2.88—309.23 ng·L−1,平均值46.14)[13],同样高于北美五大湖[20],但远低于位于武汉氟化学工业生产基地附近的汤逊湖(∑PFASs范围4570—11890 ng·L−1,平均值9850)[21].
通过浓度组成分布(图2a)可以发现,地表水中以传统PFASs为主,主要是中短链PFCAs和PFSAs,其具有较高的水溶性和解离度,更容易赋存在水中,所以在地表水中占比大. 所有目标PFASs中,以平均值计算,太湖梅梁湾地表水中主要化合物浓度和贡献分别为:PFOA(39.13 ng·L−1,23%)、PFHxA(31.71 ng·L−1,19%)、PFBA(28.80 ng·L−1,17%)、PFBS(16.93 ng·L−1,10%)和PFOS(14.49 ng·L−1,8%). ∑PFCAs和∑PFSAs两者之和占比约为90%,而且∑PFCAs始终高于∑PFSAs浓度(图2b),说明PFCAs相比于PFSAs亲水性更强. 地表水中均以中短链PFASs为主,且C4-8 PFCAs是最主要的PFASs,这与前人研究一致[22]. 在测得的10种PFCAs同系物中,除PFHxA和PFOA外,其浓度大致随着碳链的增加而降低. 其中,PFBA、PFHxA、PFOA是最重要的PFCAs,这在一定程度上可能反映了短链PFASs对长链PFASs的替代结果.
由图1和图2a可知,太湖梅梁湾湖体和河流入湖口水样中检出的主要PFASs种类总体一致,说明这些物质可随水流迁移;其中TH-1点位PFASs组成特征与入湖口THZ-2和THZ-3相似,而TH-2和TH-3与入湖口THZ-1的组成特征相似,说明入湖河流对太湖梅梁湾湖体中PFASs污染有一定影响. 另外,采用Kruskal-Waillis检验对不同采样点之间的∑PFASs浓度差异进行统计学分析,显示入湖河流和湖体间没有显著性差异,这说明两者具有相似的污染来源;河流经过城市,纳污量大,这在一定程度上预示着人类活动对水产养殖可能存在影响. 该区域属于长三角地区,经济发达,工业密集,多种PFASs的检出与其周边完备的生产体系有很大联系. 根据以前的报道,太湖梅梁湾地区大多数PFASs直接来自于人类活动,如工业生产和家庭使用,而不是通过间接或远距离运输[23]. 另外,太湖梅梁湾本身较为封闭,所以PFASs浓度相对较高.
2.2 沉积物PFASs的污染特征
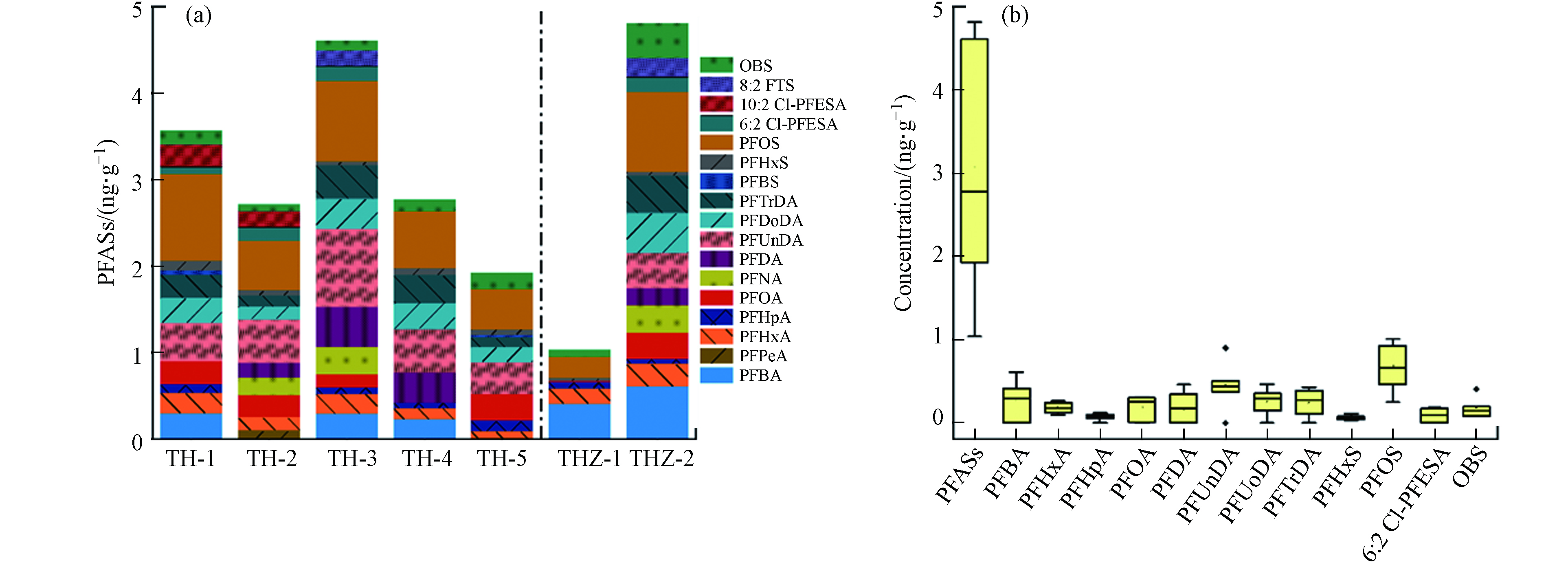
太湖梅梁湾地表水中的PFASs通过分配作用吸附在沉积物中,入湖河流与湖体沉积物中PFASs浓度水平与组成如图3a所示. 检出的17种PFASs中,只有PFHxA、PFHxS、PFOS和OBS的检出率在90%以上. 以平均值计算,太湖梅梁湾沉积物中主要化合物对∑PFASs贡献由大到小为:PFOS(21%),PFUnDA(14%),PFBA(9%),PFDoDA(8%),PFTrDA(7%),PFOA(6%),可以看出除PFBA外,其余均为中长链PFAAs,体现出其更高的亲脂性,更易于在沉积物中累积. 特别是PFDoDA和PFTrDA在地表水中未检出或浓度很低,说明相比于地表水来说,其更易吸附在沉积物中. 如图3b所示,PFOS作为沉积物中浓度最高的PFASs,其浓度范围在0.25—1.01 ng·g−1 dw(平均值0.69),与文献报道浓度相近[7]. 在太湖梅梁湾地表水中普遍检出的两种新型PFASs,OBS和6:2 Cl-PFESA在沉积物中的平均浓度分别为0.17 ng·g−1 dw和0.10 ng·g−1 dw.
总体来看,太湖梅梁湾沉积物中PFASs浓度处于较低水平(<5 ng·g−1 dw),∑PFASs浓度范围为1.04—4.81 ng·g−1 dw(平均值3.06),与之前测得太湖沉积物浓度相似:0.62—5.55 ng·g−1 dw(平均值2.15)[7],1.11—8.21 ng·g−1 dw(平均值2.42)[8]. 太湖梅梁湾∑PFASs浓度与渤海周边河流沉积物∑PFASs浓度(平均值3.34 ng·g−1 dw)持平,但高于渤海中海底沉积物∑PFASs浓度(范围0.37—4.18 ng·g−1 dw,平均值0.98 ng·g−1 dw)[11].
2.3 PFASs在沉积物-水中的分配
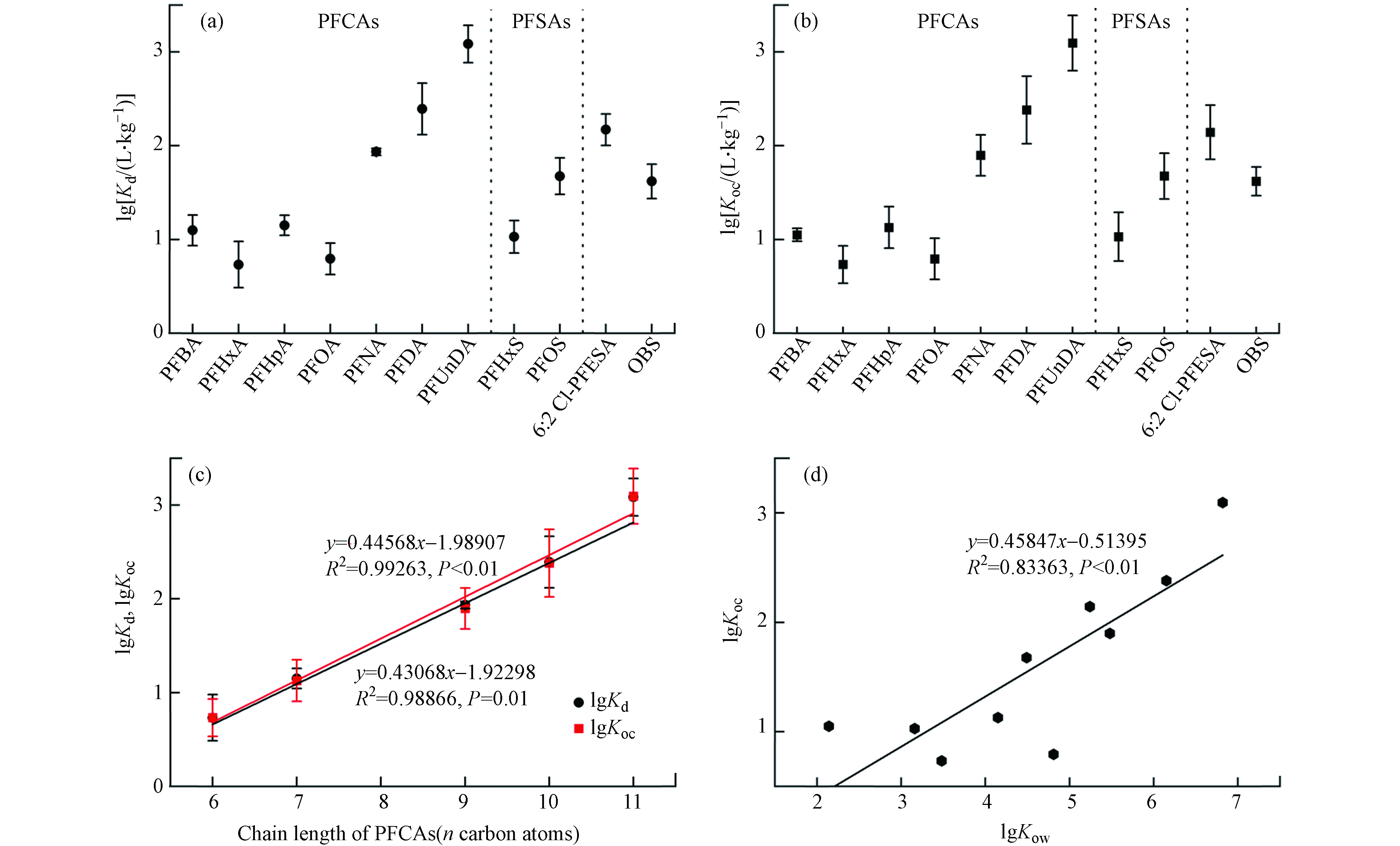
水和沉积物中PFASs的浓度低于LOD值的指定为LOD/2,计算了太湖梅梁湾两种介质中检出率高于40%的PFASs的沉积物-水分配系数(Kd)和沉积物有机碳归一化分配系数(Koc). 如图4a和b所示,太湖梅梁湾中PFOS的lg Kd(0.74—3.77)始终高于具有相同碳链长的PFOA(0.17—3.19),同样PFOS的lg Koc值也高于PFOA. 该结果与多数先前报道结果相似,即PFSAs的lg Kd值比具有相同碳数的PFCAs高0.71—0.76个对数单位[24]. 太湖梅梁湾中4种磺酸类化合物的lg Kd值顺序为:PFHxS(0.82—1.34,平均值:1.08)<OBS(1.42—1.85,1.66)<PFOS(1.29—1.86,1.70)<6:2 Cl-PFESA(1.56—2.32,2.05).
众所周知,疏水相互作用是PFASs分配到沉积物中的关键因素. 6:2 Cl-PFESA的醚键和更大的分子体积可以增加其疏水性[25],这是其Kd值高于PFOS的主要原因. 另外,OBS的Kd值与PFOS的Kd和Koc值非常接近,表明两种化合物在水和沉积物之间的分配特征相似. 相关研究表明,全氟烷基链长是影响PFASs沉积物吸附的主要因素,其lg Kd值通常随全氟碳链长度的增加而增加[26],这与图4c呈现的结果基本吻合. PFASs的Kd值在不同采样点之间的差异可能是因为Kd值受PFASs的理化性质以及多种环境因素(例如沉积物的有机碳含量、pH、水温和盐度)的影响[26]. 本研究中,PFASs的辛醇-水分配系数(Kow)来源于EPA EPIWEB 4.1,图4d中lg Koc与lg Kow呈正相关(R2 = 0.83363,P < 0.01),表明疏水性更高的PFASs能够更有效地从水相分配到沉积物中.
2.4 风险评估
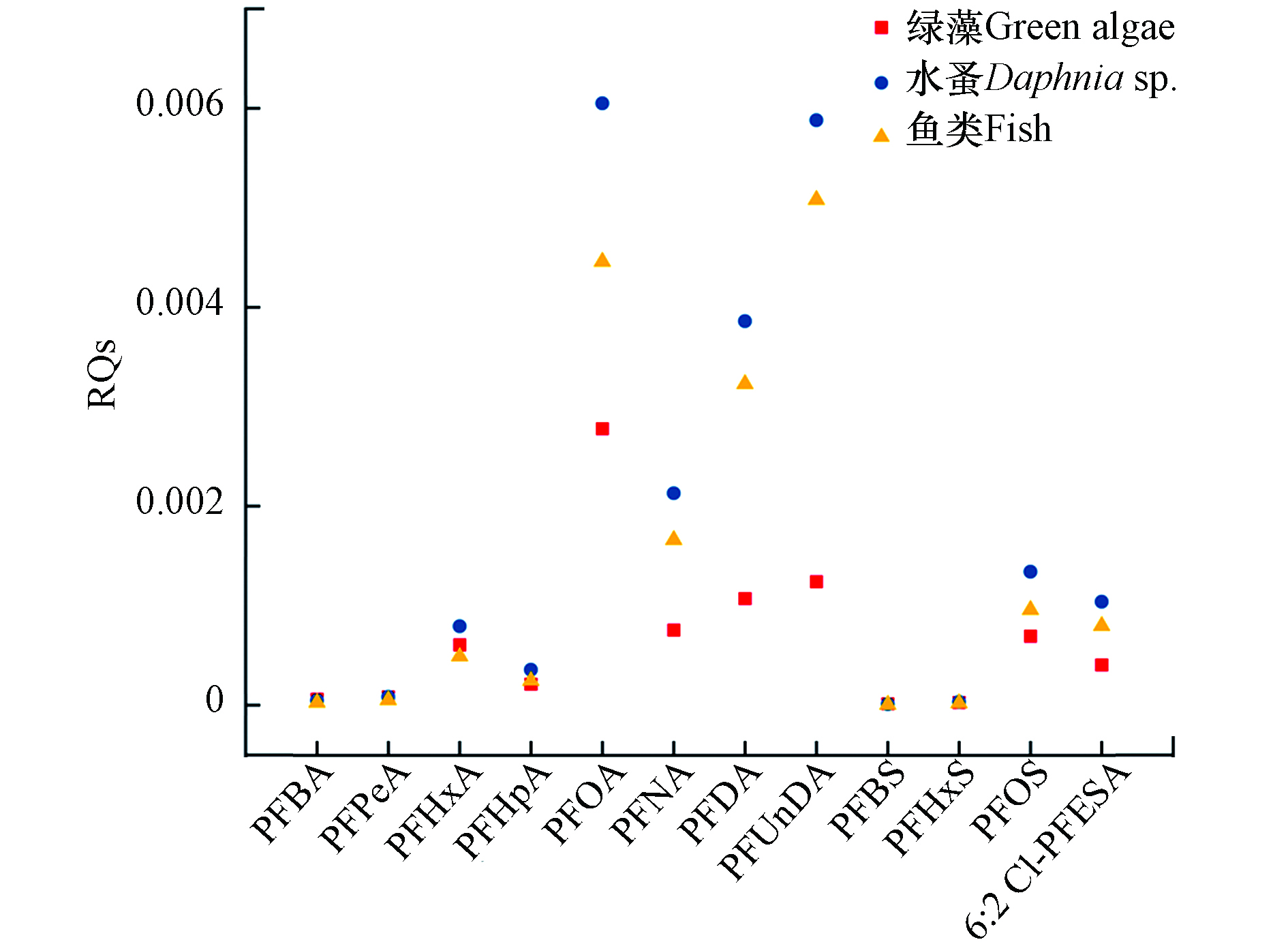
近年来大量毒理学研究报道了PFASs可对水生生物造成不良影响,本研究利用目前可获得的数据,对该区域水生环境中PFASs环境风险进行评估. 有研究提出了中国水环境中PFOA和PFOS的最大基准浓度(CMC)和持续基准浓度(CCC)[27]:CMC分别为45.54 mg·L−1和3.78 mg·L−1;CCC分别为3.52 mg·L−1和0.25 mg·L−1. 本研究中PFOA(36.80—45.05 ng·L−1)和PFOS(11.36—22.67 ng·L−1)的浓度均远低于上述值,说明太湖梅梁湾中PFOS和PFOA对水生生物风险较低. 另外,本文采用风险商(RQs)进行PFASs的生态风险评价. 选取地表水中检出率比较高的PFASs,计算了它们对于绿藻、水蚤和鱼类的RQs,发现其均低于0.1(图5),说明这些化合物对当地的水生生物风险较低. 但部分PFASs,如PFOA、PFUnDA等的RQs较高,其对水生生物的生物蓄积性和毒性仍需长期监控.
有文献[28]根据相对来源贡献推测出我国PFOA和PFOS的饮用水健康指导值分别为85 ng·L−1和47 ng·L−1;即将实施的《生活饮用水卫生标准(GB 5749—2022)》[29]规定了生活饮用水中PFOA和PFOS的限值分别为80 ng·L−1和40 ng·L−1,太湖梅梁湾水环境中PFOA和PFOS均低于上述健康指导值和国家标准. 然而,目前我国尚缺乏对许多新型PFASs的阈值和标准,因此进一步的系统研究很有必要.
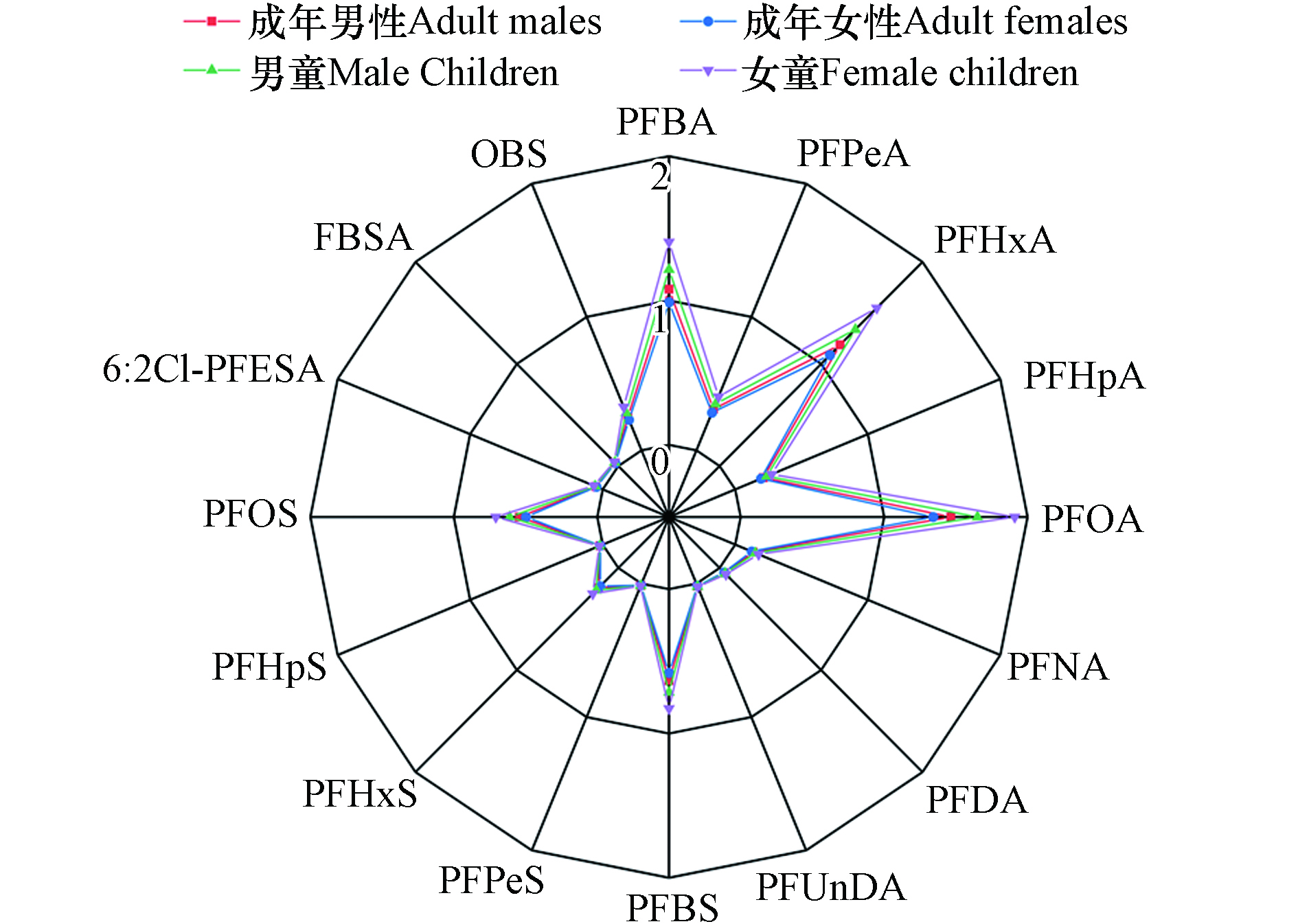
图6显示了通过饮用水估计的成年和儿童PFASs的每日摄入量(EDI). 成年男性、成年女性和男童、女童∑PFASs的EDIs分别为6.42、5.87 ng·(kg·d)−1和7.22、8.36 ng·(kg·d)−1,单个PFAS在不同人群中的EDI均小于2 ng·(kg·d)−1.
在成人群体中,男性的EDI值略高于女性;而女童的EDI高于男童,说明具有更高的暴露风险. 儿童的EDI高于成年人,主要是因为他们的单位体重耗水量较高,这表明摄入PFASs可能会对儿童造成更严重的危害[30]. PFOA的EDI对∑PFASs的EDI贡献最大,其次是PFBA、PFHxA、PFBA、PFBS和PFOS等. 该地区PFOA的EDI(1.34—1.91 ng·(kg·d)−1)和PFOS的EDI(0.50—0.71 ng·(kg·d)−1)高于其它水源地[30-31]. 成年人通过饮用水摄入PFOS的量低于通过太湖鲫鱼估计的EDI(16.4 ng·(kg·d)−1),但通过饮用水摄入PFOA的量高于通过太湖鲫鱼估计的EDI值(0.531 ng·(kg·d)−1)[32],可能会导致人类暴露PFOA的潜在健康风险. 本研究中PFOA和PFOS的EDI比欧洲食品安全局规定的每日可耐受摄入量(1500 ng·(kg·d)−1和150 ng·(kg·d)−1)[33]低很多,这意味着饮用水中的PFOA和PFOS对居民几乎无害. 然而,其他暴露途径(如食物或空气)未被考虑在内,由于PFASs的持久性、生物积累和长期健康影响,当地居民通过与水接触的累积不应被忽视. 因此,持续监测是必要的,以避免因接触PFASs而导致的不良健康效应.
3. 结论(Conclusion)
PFASs在太湖梅梁湾地表水和沉积物样品中的普遍检出,表明了PFASs在该地区的广泛应用,一些新型PFASs在地表水和沉积物中的检出尤其应该引起重视. 地表水中∑PFASs为162.82—187.62 ng·L−1(平均值171.34),主要以C4—8 PFCAs、PFBS等中短链化合物为主;沉积物中∑PFASs为1.04—4.81 ng·g−1干重(平均值3.06),以中长链化合物为主,PFOS贡献升高. PFASs在地表水和沉积物之间的分配与其疏水性及碳链长度有很大关系,并可能受到环境因素的影响. 虽然生态风险和人体健康风险评估的结果表明PFASs具有较低风险,但作为当地饮用水源,长期暴露的危害值得进一步关注.
-
表 1 本实验采样的基本信息
Table 1. Basic information of sampling
参数Parameter 粉煤炉类型Pulverized coal furnace type HPA-1 HPA-2 HPA-3 HPB-1 HPB-2 HPC-1 运行条件 亚临界 亚临界 亚临界 亚临界 亚临界 超临界 燃煤机组容量/MW 300 300 300 600 600 600 大气污染控制设施 ESPs ESPs ESPs+WFGD ESPs ESPs+WFGD ESPs+WFGD 烟气流速/(m·s–1) 8.7 11.4 9.3 9.8 7.9 10.1 烟气温度/℃ 69.4 67.2 72.3 74.5 68.5 73.5 表 2 不同采样点烟气颗粒物中PAHs的含量
Table 2. PAHs concentrations in particulate matters of flue gas at different sampling sites
PAHs PM2.5-10/(µg·m−3) PM1-2.5/(µg·m−3) PM1/(µg·m−3) 1 2 3 4 5 6 1 2 3 4 5 6 1 2 3 4 5 6 Nap 0.43 0.29 0.32 0.27 0.22 0.17 0.31 0.29 0.36 0.25 0.25 0.15 0.28 0.17 0.23 0.18 0.13 0.13 Acy 0.34 0.32 0.28 0.23 0.26 0.18 0.48 0.47 0.24 0.26 0.24 0.21 0.45 0.53 0.23 0.28 0.23 0.19 Ace 0.25 0.23 0.19 0.15 0.17 0.13 0.15 0.16 0.12 0.13 0.15 0.13 0.19 0.21 0.13 0.21 0.18 0.13 Flu 0.29 0.18 0.17 0.14 0.14 0.12 0.3 0.29 0.17 0.18 0.12 0.14 0.28 0.31 0.15 0.18 0.13 0.18 Ant 0.31 0.31 0.16 0.19 0.20 0.12 0.33 0.31 0.16 0.18 0.18 0.13 0.31 0.26 0.18 0.19 0.15 0.19 Phe 0.17 0.19 0.11 0.16 0.15 0.09 0.26 0.25 0.14 0.15 0.12 0.11 0.26 0.23 0.20 0.21 0.19 0.14 Fla 0.93 1.0 0.89 0.87 0.61 0.45 1.4 1.3 0.93 0.88 0.82 0.48 2.0 1.8 1.4 1.8 1.1 0.72 Pyr 0.77 0.87 0.69 0.58 0.38 0.28 1.3 1.3 0.86 0.96 0.64 0.46 1.6 1.7 0.91 1.4 0.78 0.58 BaA 0.5 0.36 0.43 0.44 0.37 0.32 0.96 0.96 0.57 0.83 0.48 0.37 1.9 1.7 1.1 1.2 0.87 0.67 Chr 0.47 0.47 0.22 0.29 0.28 0.18 0.93 1.1 0.61 0.94 0.49 0.32 1.4 1.6 1.0 1.2 1.0 0.59 BbF 0.63 0.51 0.25 0.38 0.16 0.19 1.1 1.0 0.51 0.71 0.41 0.28 1.6 1.2 1.3 1.2 0.66 0.56 BkF 0.47 0.37 0.19 0.33 0.18 0.16 0.63 0.68 0.34 0.34 0.21 0.17 0.97 0.96 0.54 0.69 0.37 0.27 BaP 0.41 0.31 0.13 0.29 0.13 0.10 0.95 0.94 0.39 0.54 0.34 0.26 1.7 1.6 1.2 1.2 0.74 0.53 DahA 0.52 0.35 0.16 0.23 0.12 0.11 0.64 0.45 0.33 0.42 0.17 0.18 0.78 0.94 0.49 0.74 0.52 0.39 InP 0.55 0.38 0.16 0.29 0.11 0.14 0.74 0.74 0.38 0.69 0.28 0.21 1.2 1.1 0.63 1.1 0.58 0.35 BghiP 0.41 0.31 0.17 0.44 0.11 0.12 0.79 0.63 0.31 0.56 0.24 0.22 1.4 1.3 0.87 1.3 0.68 0.48 总含量 7.45 6.45 4.52 5.28 3.59 2.86 11.27 10.87 6.42 8.02 5.14 3.82 16.32 15.61 10.56 13.08 8.31 6.10 注:1:HPA-1,2:HPA-2,3:HPA-3,4:HPB-1,5:HPB-2,6:HPC-1 表 3 原料煤和烟气颗粒物中单体PAHs同位素(δ13C, ‰)组成
Table 3. Molecular isotopic compositions (δ13C, ‰) of individual PAHs in raw coal and particulate matters
PAHs Coal HPA-1 HPA-2 HPA-3 HPB-1 HPB-2 HPC-1 Phe −24.6 −27.8 −27.6 −28.1 −27.8 −28.2 −28.2 Ant −24.2 −28.1 −27.8 −28.0 −28.0 −28.3 −28.2 Fla −25.2 −28.4 −28.4 −28.4 −28.6 −28.5 −28.7 Pyr −25.3 −28.3 −28.5 −28.5 −28.3 −28.4 −28.6 BaA −25.4 −28.5 −28.3 −28.7 −28.5 −28.6 −28.7 Chr −25.3 −28.6 −28.4 −28.6 −28.5 −28.5 −29.1 BkF −25.4 −28.3 −28.2 −28.6 −28.7 −28.7 −29.3 BaP −26.2 −29.0 −28.7 −29.5 −29.4 −29.4 −29.7 InP −26.2 −29.2 −29.0 −29.9 −30.0 −30.1 −30.4 BghiP −26.5 −29.5 −29.4 −30.0 −29.8 −30.0 −30.2 -
[1] ZHANG Y X, TAO S, SHEN H Z, et al. Inhalation exposure to ambient polycyclic aromatic hydrocarbons and lung cancer risk of Chinese population[J]. Proceedings of the National Academy of Sciences of the United States of America, 2009, 106(50): 21063-21067. [2] SHEN H Z, TAO S, LIU J F, et al. Global lung cancer risk from PAH exposure highly depends on emission sources and individual susceptibility[J]. Scientific Reports, 2014, 4: 6561. doi: 10.1038/srep06561 [3] LV M, LUAN X L, LIAO C Y, et al. Human impacts on polycyclic aromatic hydrocarbon distribution in Chinese intertidal zones[J]. Nature Sustainability, 2020, 3(10): 878-884. doi: 10.1038/s41893-020-0565-y [4] RAVINDRA K, SOKHI R, van GRIEKEN R. Atmospheric polycyclic aromatic hydrocarbons: Source attribution, emission factors and regulation[J]. Atmospheric Environment, 2008, 42(13): 2895-2921. doi: 10.1016/j.atmosenv.2007.12.010 [5] PATROLECCO L, ADEMOLLO N, CAPRI S, et al. Occurrence of priority hazardous PAHs in water, suspended particulate matter, sediment and common eels (Anguilla anguilla) in the urban stretch of the River Tiber (Italy)[J]. Chemosphere, 2010, 81(11): 1386-1392. doi: 10.1016/j.chemosphere.2010.09.027 [6] MU Q, LAMMEL G, GENCARELLI C N, et al. Regional modelling of polycyclic aromatic hydrocarbons: WRF-Chem-PAH model development and East Asia case studies[J]. Atmospheric Chemistry and Physics, 2017, 17(19): 12253-12267. doi: 10.5194/acp-17-12253-2017 [7] WANG R W, HUANG Q, CAI J W, et al. Seasonal variations of atmospheric polycyclic aromatic hydrocarbons (PAHs) surrounding Chaohu Lake, China: Source, partitioning behavior, and lung cancer risk[J]. Atmospheric Pollution Research, 2021, 12(5): 101056. doi: 10.1016/j.apr.2021.101056 [8] XIAO Q Y, GENG G N, XUE T, et al. Tracking PM2.5 and O3 pollution and the related health burden in China 2013-2020[J]. Environmental Science & Technology, 2022, 56(11): 6922-6932. [9] LIU G R, ZHENG M H, LV P, et al. Estimation and characterization of polychlorinated naphthalene emission from coking industries[J]. Environmental Science & Technology, 2010, 44(21): 8156-8161. [10] ROSS A B, BARTLE K D, HALL S, et al. Formation and emission of polycyclic aromatic hydrocarbon soot precursors during coal combustion[J]. Journal of the Energy Institute, 2011, 84(4): 220-226. [11] SHEN G F, TAO S, CHEN Y C, et al. Emission characteristics for polycyclic aromatic hydrocarbons from solid fuels burned in domestic stoves in rural China[J]. Environmental Science & Technology, 2013, 47(24): 14485-14494. [12] TOBISZEWSKI M, NAMIEŚNIK J. PAH diagnostic ratios for the identification of pollution emission sources[J]. Environmental Pollution, 2012, 162: 110-119. doi: 10.1016/j.envpol.2011.10.025 [13] 夏琳琳, 魏建峰, 杨琦玲, 等. 安徽燃煤电厂多环芳烃的历史排放量及影响因素分析[J]. 环境化学, 2022, 41(8): 2606-2613. doi: 10.7524/j.issn.0254-6108.2021041702 XIA L L, WEI J F, YANG Q L, et al. The historical emissions of polycyclic aromatic hydrocarbons(PAHs)from coal-fired power plants in Anhui and influencing factors[J]. Environmental Chemistry, 2022, 41(8): 2606-2613 (in Chinese). doi: 10.7524/j.issn.0254-6108.2021041702
[14] HAN J, LIANG Y S, ZHAO B, et al. Polycyclic aromatic hydrocarbon (PAHs) geographical distribution in China and their source, risk assessment analysis[J]. Environmental Pollution, 2019, 251: 312-327. doi: 10.1016/j.envpol.2019.05.022 [15] 袁晶晶, 笪春年, 王儒威, 等. 淮南燃煤电厂烟气中颗粒相和气相中多环芳烃的赋存特征[J]. 环境化学, 2018, 37(6): 1382-1390. doi: 10.7524/j.issn.0254-6108.2017090201 YUAN J J, DA C N, WANG R W, et al. Occurence of polycyclic aromatic hydrocarbons in PM10-and gaseous phases of flue gases emitted from Huainan coal-fired power plant[J]. Environmental Chemistry, 2018, 37(6): 1382-1390 (in Chinese). doi: 10.7524/j.issn.0254-6108.2017090201
[16] 倪秀峰, 王儒威, 王继忠, 等. 燃煤电厂排放PAHs的气粒分配机制和排放通量[J]. 中国环境科学, 2021, 41(1): 49-55. doi: 10.3969/j.issn.1000-6923.2021.01.006 NI X F, WANG R W, WANG J Z, et al. Studies on the gas-particle partitioning mechanism of polycyclic aromatic hydrocarbons(PAHs) and emission amount from coal-fired power plants[J]. China Environmental Science, 2021, 41(1): 49-55 (in Chinese). doi: 10.3969/j.issn.1000-6923.2021.01.006
[17] GAO P, LI H B, WILSON C P, et al. Source identification of PAHs in soils based on stable carbon isotopic signatures[J]. Critical Reviews in Environmental Science and Technology, 2018, 48(13/14/15): 923-948. [18] 吴健, 沙晨燕, 李大雁, 等. 稳定碳同位素技术在多环芳烃源解析中的应用进展[J]. 环境科学与技术, 2021, 44(3): 170-179. doi: 10.19672/j.cnki.1003-6504.2021.03.023 WU J, SHA C Y, LI D Y, et al. Application of stable carbon isotopic ratio measurement in source identification of polycyclic aromatic hydrocarbons[J]. Environmental Science & Technology, 2021, 44(3): 170-179 (in Chinese). doi: 10.19672/j.cnki.1003-6504.2021.03.023
[19] BOSCH C, ANDERSSON A, KRUSÅ M, et al. Source apportionment of polycyclic aromatic hydrocarbons in central European soils with compound-specific triple isotopes (δ13C, Δ14C, and δ2H)[J]. Environmental Science & Technology, 2015, 49(13): 7657-7665. [20] 倪秀峰, 王儒威, 蔡飞旋, 等. 燃煤电厂和垃圾焚烧电厂燃烧产物中卤代多环芳烃的赋存特征和毒性风险[J]. 环境科学, 2021, 42(4): 1660-1667. doi: 10.13227/j.hjkx.202007298 NI X F, WANG R W, CAI F X, et al. Emission characteristics and toxicity effects of halogenated polycyclic aromatic hydrocarbons from coal-fired and waste incineration power plants[J]. Environmental Science, 2021, 42(4): 1660-1667 (in Chinese). doi: 10.13227/j.hjkx.202007298
[21] WANG R W, LIU G J, SUN R Y, et al. Emission characteristics for gaseous- and size-segregated particulate PAHs in coal combustion flue gas from circulating fluidized bed (CFB) boiler[J]. Environmental Pollution, 2018, 238: 581-589. doi: 10.1016/j.envpol.2018.03.051 [22] WANG R W, CAI J W, CAI F X, et al. Construction of a regional inventory to characterize polycyclic aromatic hydrocarbon emissions from coal-fired power plants in Anhui, China from 2010 to 2030[J]. Environmental Pollution, 2021, 272: 115972. doi: 10.1016/j.envpol.2020.115972 [23] SUN S, SCHILLER J H, GAZDAR A F. Lung cancer in never smokers—a different disease[J]. Nature Reviews Cancer, 2007, 7(10): 778-790. doi: 10.1038/nrc2190 [24] SHEN H Z, TAO S, CHEN Y L, et al. Urbanization-induced population migration has reduced ambient PM2.5 concentrations in China[J]. Science Advances, 2017, 3(7): e1700300. doi: 10.1126/sciadv.1700300 [25] ZHANG Q, JIANG X J, TONG D, et al. Transboundary health impacts of transported global air pollution and international trade[J]. Nature, 2017, 543(7647): 705-709. doi: 10.1038/nature21712 [26] WANG R W, LIU G J, ZHANG J M. Variations of emission characterization of PAHs emitted from different utility boilers of coal-fired power plants and risk assessment related to atmospheric PAHs[J]. Science of the Total Environment, 2015, 538: 180-190. doi: 10.1016/j.scitotenv.2015.08.043 [27] ROGGE W F, HILDEMANN L M, MAZUREK M A, et al. Sources of fine organic aerosol. 2. Noncatalyst and catalyst-equipped automobiles and heavy-duty diesel trucks[J]. Environmental Science & Technology, 1993, 27(4): 636-651. [28] RAVINDRA K, BENCS L, WAUTERS E, et al. Seasonal and site-specific variation in vapour and aerosol phase PAHs over Flanders (Belgium) and their relation with anthropogenic activities[J]. Atmospheric Environment, 2006, 40(4): 771-785. doi: 10.1016/j.atmosenv.2005.10.011 [29] KAVOURAS I G, LAWRENCE J, KOUTRAKIS P, et al. Measurement of particulate aliphatic and polynuclear aromatic hydrocarbons in Santiago de Chile: Source reconciliation and evaluation of sampling artifacts[J]. Atmospheric Environment, 1999, 33(30): 4977-4986. doi: 10.1016/S1352-2310(99)00281-2 [30] GUILLON A, Le MÉNACH K, FLAUD P M, et al. Chemical characterization and stable carbon isotopic composition of particulate Polycyclic Aromatic Hydrocarbons issued from combustion of 10 Mediterranean woods[J]. Atmospheric Chemistry and Physics, 2013, 13(5): 2703-2719. doi: 10.5194/acp-13-2703-2013 [31] McRAE C, SUN C G, SNAPE C E, et al. δ13C values of coal-derived PAHs from different processes and their application to source apportionment[J]. Organic Geochemistry, 1999, 30(8): 881-889. doi: 10.1016/S0146-6380(99)00072-8 [32] BALLENTINE D C, MACKO S A, TUREKIAN V C, et al. Compound specific isotope analysis of fatty acids and polycyclic aromatic hydrocarbons in aerosols: Implications for biomass burning[J]. Organic Geochemistry, 1996, 25(1/2): 97-104. -




 下载:
下载: