-
自从抗生素被发现、生产和使用以来,全世界每年至少生产1×105—2×105 t抗生素[1],因其对病原微生物具有良好的抑制作用[2],抗生素被大量应用在医疗等许多方面[3]. 目前,抗生素种类和数量剧增,仅中国一年抗生素的用量就有1.62×105 t,产出达到2.48×105 t,进入环境的抗生素质量甚至超过了5 t[4],造成环境中抗生素被大量检出,如盐酸四环素在黄浦江的上游支流中被检测出,浓度达34.25—211.82 ng·L−1[5],在苏州市某一湖泊中也检测出,浓度达3.27—547 ng·L−1[6];在香港的维多利亚湾β-内酰胺类抗生素最高被检测出493 ng·L−1[7]. 进入环境中的抗生素不仅会对环境中微生物造成危害,也会影响植物根系的伸长,阻碍种子的发芽生长[8],甚至还会通过食物链等途径进入动物甚至人体,对动物及人类肠道菌群产生影响,更为严重还会导致人体产生抗药性和体重变化等其它危害[9].
环境中残留的抗生素不是以单个形式存在,常以混合物的形式存在,不同抗生素之间在环境中很可能会出现协同或拮抗作用[10],给生态环境及人体健康带来更大潜在的风险[11],如王桂祥等[12]发现,环境浓度下的恩诺沙星和磺胺甲恶唑的协同作用会使普通小球藻产生更强的氧化损伤. 因此,研究抗生素及其混合污染物的毒性作用具有重要的环境意义.
中药因对细菌和病毒等微生物产生良好的抑菌效果,而被大量使用[13],同时,也产生了大量药渣,其中含有黄酮、生物碱、多酚、萜类等成分[14]也随之进入环境中,抑制微生物的生长. 刘海席[15]研究发现,中药提取物盐酸小檗碱在1.47—23.44 mg·L−1浓度范围,对桃褐腐菌(Monilinnia fructioncola)的抑菌作用随浓度的升高而增强. 无论是进入环境还是在人体中的中药都很有可能会对环境中残留的或者通过食物链等途径进入生物体甚至人体的抗生素的抑菌作用产生影响,如氢青蒿素和氟康唑联合使用恢复了氟康唑对耐药性白色念珠菌的抑菌作用,并与氟康唑产生了较强的协同作用[16]. 因此,考察抗生素与中药联合抑菌作用具有重要的实际意义.
大肠杆菌(Escherichia coli, E. coli)常存在于人和动物肠道中,伴随粪便排出,在自然环境中广泛传播[17],和人体是互利共生的关系,多数不会给身体带来危害,反而可以抑制肠道致病菌和其他病原体的繁殖[18]. 因其具有生长速度快、培养方法简单等优点,也常被作为一种模式生物. 尹孝仁等[19]发现诺氟沙星和多粘菌素E对E. coli出现协同作用. 曾范利等[20]发现鱼腥草、黄芩和五倍子联用时,对E. coli抑菌效果为协同或加和作用. 这都说明E. coli作为指示生物来反映抗生素和中药抑菌效果的可行性. 抗生素与中药的联合抑菌效果虽已有前人进行研究[21],而定量评估其潜在的风险是关键,而目前大多数研究都缺乏对联合抑菌作用强度的定量表征.
此外,盐酸四环素作为世界上使用非常广泛的广谱抗生素,也是污水中检出最为频繁的抗生素之一[22];氨卡西林钠是作为β-内酰胺类的广谱抗生素,具有抗菌谱广、药效高和价格便宜等特点[23],在临床医疗上被广泛的使用. 虽然这两种抗生素降解速率都很快,但是由于使用量大、频率高,仍可能在环境中造成假持久性污染[24],对生态及人体造成威胁. 因此,本文选择β-内酰胺类抗生素(氨苄西林钠(ampicillin sodium,AMP))、四环素类抗生素(盐酸四环素(tetracycline hydrochloride,TET))和中药提取成分(盐酸小檗碱(berberine chloride hydrate,BCH))作为目标污染物,应用直接均分射线法(direct equipartition ray,EquRay)和均匀设计射线法(uniform design ray,UD-Ray)[25],分别设计了3种药物的3个二元(AMP-BCH、AMP-TET、TET-BCH)及1个三元混合物体系(AMP-BCH-TET);利用时间微板毒性分析法(time-dependent microplate toxicity analysis method,t-MTA)[26]测定并分析3种药物及其混合物体系对E. coli的时间、浓度和组分比依赖抑菌毒性;应用拟合归零法进一步对混合物组分间的相互作用类型及强度进行分析,并测定药物作用前后E. coli细胞的核酸溶出量和电镜扫描的细胞形态,以探讨可能的作用机理. 研究结果可为评价抗生素和中药的混合物毒性及环境生态风险等研究提供参考.
-
实验用药物均购于国药集团化学试剂有限公司,其理化性质见表1,储备液均采用mili-Q水配制,置于棕色瓶储备,放4 ℃冰箱保存. 实验所用主要仪器见参考文献[27].
-
实验菌种为菌株号ATCC8739大肠埃希氏菌(Escherichia coli,E. coli),购自上海鲁微科技有限公司,E. coli的活化过程,培养基成分和制备见参考文献[28]. 将营养肉汤培养基(nutrient broth,NB)培养至对数生长期的E. coli菌液接入2倍MHB培养基(mueller-hinton broth,MHB),使其OD600值在0.08—0.1,备用.
-
在微板孔上设计防边缘效应组(200 μL mili-Q水)、空白对照组(100 μL mili-Q水+ 100 μL备用菌)和实验组(100 μL药+100 μL备用菌). 样品微板由实验组、防边缘效应组和空白对照组组成,实验组设计12个浓度梯度,每种药或混合物射线设计3块样品微板,同步设计一块由空白对照组和防边缘效应组组成的阴性对照板. 将所有微板置于(37±1)℃生化恒温培养箱中培养,分别在暴露时间0.25、2、4、8、12 h取出,用酶标仪测定微板各孔中菌的OD600值. 经实验同步测定,在12 h,空白对照组的菌都处于对数生长期,生长状态良好. 具体操作过程见文献[29]. 药物及其混合物体系对E. coli的抑菌性计算公式如下:
式中, I0 为空白对照的 OD600 平均值,I为各浓度梯度的 OD600 平均值;x为为抗生素对E. coli 的生长抑制率.
-
为有效地研究混合物组分对E. coli毒性相互作用,分别采用直接均分和均匀设计射线法设计3种药物的二元(AMP-TET、AMP-BCH、TET-BCH)及三元 (AMP-BCH-TET) 混合物体系,每种混合物体系共有5条射线(R1、R2、R3、R4、R5),每条射线有12个浓度梯度. 二元及三元混合物的各组分浓度比 (pi) 如表2所示.
-
Weibull函数能较好拟合不同暴露时间点的“S”型浓度-效应关系[30],函数表达式如(2)所示. 同步用APTox软件处理数据[31],并绘制时间-浓度-效应曲线(time-concentration-effect curve,t-CRC).
式中,E为效应( 0 ≤ E ≤1) ;C为单个药物或者混合物浓度;α 和 β为模型参数.
-
拟合归零法是以实验数据拟合CRC数据归零为基础,将实验效应、置信区间以及用浓度加和模型(concentration addition,CA) [32]预测的CRC数据投影到实验效应的拟合曲线上. 本文将拟合归零法加入时间变量,以实测数据的拟合曲线与CA预测曲线间的偏差视作混合物的浓度加和偏离指数(deviation from CA model,dCA),绘制拟合归零法的三维曲面形式. 根据95%置信区间(observed confident interval,OCI)绘制dOCI曲面,即为置信曲面. 用dCA曲面与置信曲面相对位置来判别混合物的相互作用类型,当dCA曲面在dOCI曲面上方为协同作用,下方为拮抗作用,中间为加和作用. 再用dCA值的大小表示相互作用的强度大小,当dCA>0时,dCA越大则协同强度越强;当dCA<0时,dCA的绝对值越大则拮抗强度越强. 以dOCI对实验所得数据结果是否在上下95%置信区间内进行界定,加强了评判效应强度的准确性[32]. dCA和dOCI的表达式见(3)和(4).
式中,EOBS为实际拟合效应;EPRE,CA为CA预测效应;EPRE,OCI为上下95%置信区间的拟合效应.
-
为反映药物及其混合物的对E.coli作用前后细胞遗传物质的受损程度,测定在12 h-EC50条件下3种药物及其混合物的代表射线(AMP、BCH、TET、AMP-BCH-R5、AMP-TET-R5、TET-BCH-R5和AMP-BCH-TET-R5)作用E. coli前后随时间变化的核酸溶出量.
取1.2节40 mL备用菌液至离心管中,离心(15 min,8000 r·min−1)后,舍弃上清液取菌体,用PBS缓冲液(0.1 mol·L−1,pH=7.4)冲洗3次,之后将菌体转移到100 mL锥形瓶中,备用. 随后进行实验组及空白组设置:将等体积等浓度(12 h-EC50)的3种药物及其代表体系加入锥形瓶为实验组,同时设与之等体积mili-Q水为空白对照组,两组都加入等量的备用菌体,实验组和空白对照组均设置3组平行,在生化恒温培养箱(37 ℃、170 r·min−1)中培养;最后进行核酸溶出量测定:在暴露时间为0.25、2、4、8、12 h时,用移液枪吸取锥形瓶中的溶液,离心(15 min,8000 r·min−1)后,收集上清液,采用紫外分光光度计测定吸光度(OD260),以OD260值表示胞外核酸含量[33].
-
为进一步分析AMP、TET、BCH及其混合物体系作用E.coli的抑制机理及迫害效果,应用电镜扫描技术,分析在12 h-EC50条件下3种药物及其混合物体系的代表射线(AMP、BCH、TET、AMP-BCH-R5、AMP-TET-R5、TET-BCH-R5和AMP-BCH-TET-R5) 作用E.coli前后细胞形态结构变化.
实验组及空白组设置:取1.2节20 mL备用菌液和20 mL不同梯度药物加入锥形瓶中为实验组,再将同体积备用菌液和mili-Q水加入另一锥形瓶中为空白对照组,实验组和空白对照组均设计3组平行. 将实验组和对照组都放入生化培养箱(37 ℃、170 r·min−1、12 h)中培养,取培养后的混合液离心(15 min,8000 r·min−1),收集菌体,之后用PBS缓冲液(0.1 mol·L−1,pH=7.4)冲洗3次,再用戊二醛溶液(20 mL,2.5%)浸没,过夜固定. 接着再用PBS缓冲液冲洗菌体3次后,用乙醇溶液(30%、50%、80%、90%和100%)脱水,经冷冻干燥和喷金处理后,最用扫描电镜观察细胞形态[34].
-
采用时间微板毒性分析法(time-dependent microplate toxicity analysis method,t-MTA)对单个药物不同暴露时间的E. coli抑菌性进行测定,并用Weibull函数拟合浓度-效应数据,结果见表3. 除0.25 h外,其余暴露时间的浓度-效应数据拟合效果良好(RMSE<0.10,r>0.90). 为全面得出3种药物对E. coli的在不同暴露时间抑菌毒性强弱关系,以半数效应浓度(EC50)的负对数(pEC50)作为抑菌毒性作用的指标,在0.25—2 h,3种药物对E. coli的抑菌毒性均较低,在4—12 h,各药物在不同暴露时间的抑菌毒性各不相同,毒性强弱也随时间变化而变化,在12 h时,抑菌毒性的强弱顺序为:TET>BCH>AMP.
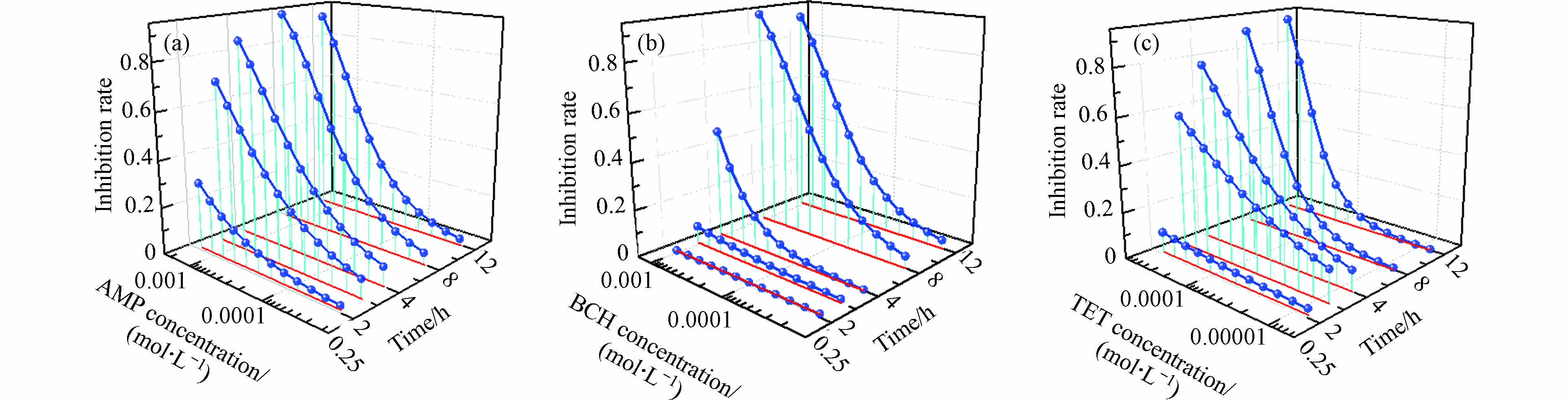
3种药物的t-CRC如图1所示. 由图1可知,3种药物对E. coli的t-CRC均为“S”型,具有明显的时间依赖抑菌性,但各药物的抑菌性变化规律迥异. 在0.25 h时,除AMP表现出急性抑菌性外,BCH和TET均无明显的急性抑菌性;在2 h时,AMP和TET的t-CRC明显弯曲,表明这两种药物的抑菌性随浓度升高逐渐增大,但BCH的t-CRC弯曲不明显,仅仅表现出轻微抑菌作用;在4—12 h时,3种药物的t-CRC表现为更明显的弯曲状态,说明抑菌作用明显. 在0—12 h,3种药物的t-CRC随浓度的升高在不同程度上逐渐攀升,说明这3种药物对E. coli的抑菌作用具有浓度依赖性, AMP、BCH和TET对E. coli的最大抑菌率分别为0.9296、0.9298和0.9103.
-
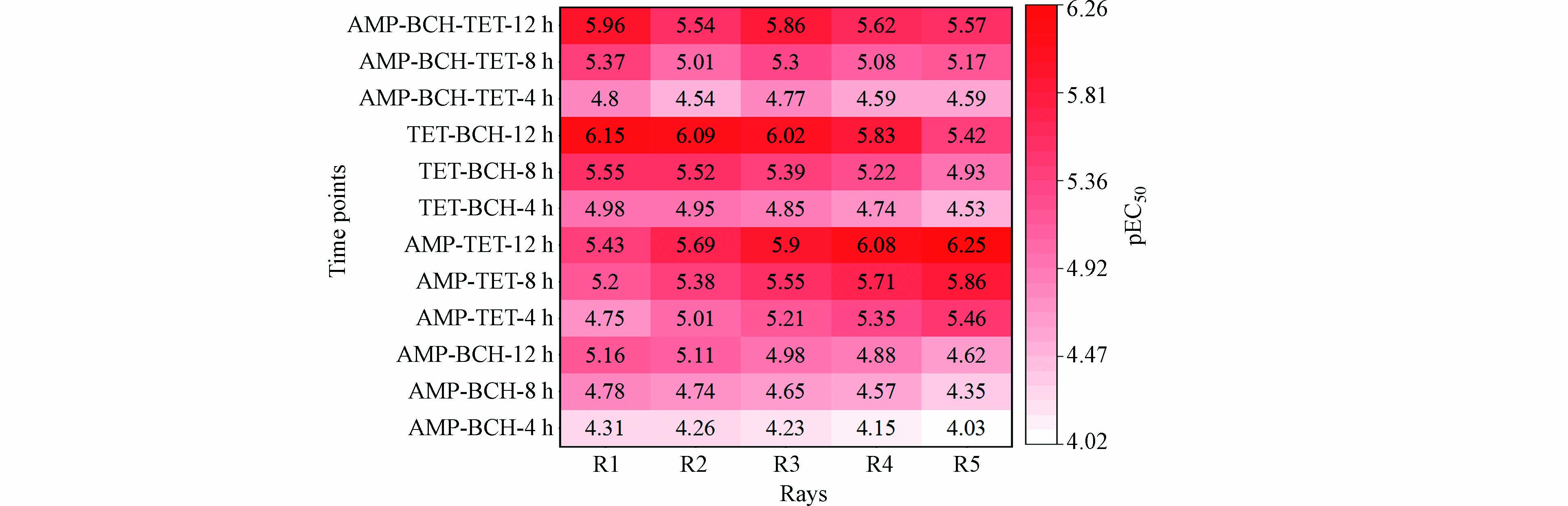
同样用Weibull函数对实验结果数据进行拟合,得各混合物射线在各暴露时间的pEC50值,绘制其随时间及组分变化的热图,如图2所示. 从时间来看,3种药物的二元混合物体系均具有时间依赖抑菌性. 4—12 h,3组二元混合物的抑菌毒性随暴露时间的增加都在不断增强,增幅明显,在同一二元混合物射线中,各暴露点抑菌毒性顺序为:12 h-pEC50>8 h-pEC50>4 h-pEC50. 在最终暴露时间点(12 h),AMP-BCH、AMP-TET和TET-BCH各射线的抑菌毒性达到最大,最大值分别为5.16、6.25和6.15,均远高于3种药物单独抑菌毒性.
从组分比来看,3种药物的二元混合物体系均具有组分比依赖抑菌性. 对于AMP-BCH体系,AMP组分的减少及BCH组分的增加都会使同一时间节点(4、8、12 h)的抑菌毒性逐渐减弱(R1>R2>R3>R4>R5);对于AMP-TET体系,TET组分的增加,AMP组分的减少反而会使同一时间节点的抑菌毒性逐渐增强(R1<R2<R3<R4<R5);对于TET-BCH体系,抑菌毒性随时间变化规律与AMP-BCH相似,TET组分的减少和BCH组分的增加使同一时间的抑菌毒性逐渐减弱( R1>R2>R3>R4>R5). 综上,说明在4、8、12 h, 3种药物的各二元体系的抑菌毒性与TET组分正相关,与BCH组分负相关,而AMP组分在AMP-TET中呈负相关,在AMP-BCH中则呈正相关.
为了直观说明各二元混合物的时间依赖抑菌性和浓度依赖抑菌性,对3种药物的所有二元混合体系共15条射线的实验数据进行t-CRC拟合,拟合结果如图3所示. 首先由图3可知,t-CRC最终呈“S”型,各二元混合物对E. coli的抑菌性随时间的增加而逐渐增大,呈现明显的时间依赖性,验证了图2的结论. 其次,在短暴露时间段 (0.25—2 h),抑菌性均较低,无急性抑菌性,说明BCH和TET组分的单独加入,减弱、消除或掩盖了AMP的急性抑菌性;在长暴露时间段 (4—12 h),抑菌性均随混合物浓度的升高而变大,说明二元混合物都具有浓度依赖抑菌性,最高抑菌率达0.9999,抑菌效果明显.
综上, AMP、BCH、TET的二元混合物体系对E. coli均有较好的抑菌毒性作用,并明显强于单个药物;二元混合物的抑菌毒性和暴露时间、浓度及组分比密切相关,且均具有时间、浓度和组分比依赖抑菌性.
-
采用Weibull函数拟合AMP-BCH-TET三元混合物浓度-效应数据,除0.25 h外,均可良好拟合(RMSE<0.10,r>0.90),根据拟合结果得三元混合物的在各暴露时间的pEC50值,其随时间及组分变化的热图,如图2所示. 从图2来看,AMP-BCH-TET对E. coli的抑菌性具有明显的时间依赖性,且抑菌作用大于单个药物. 三元混合物对E. coli的抑菌性与暴露时间正相关(4 h-pEC50<8 h-pEC50<2 h-pEC50). 随着目标药物与E. coli接触时间延长,5条射线对E. coli的pEC50值不断增大,其12 h-pEC50值(5.54—5.96)明显大于单个药物.
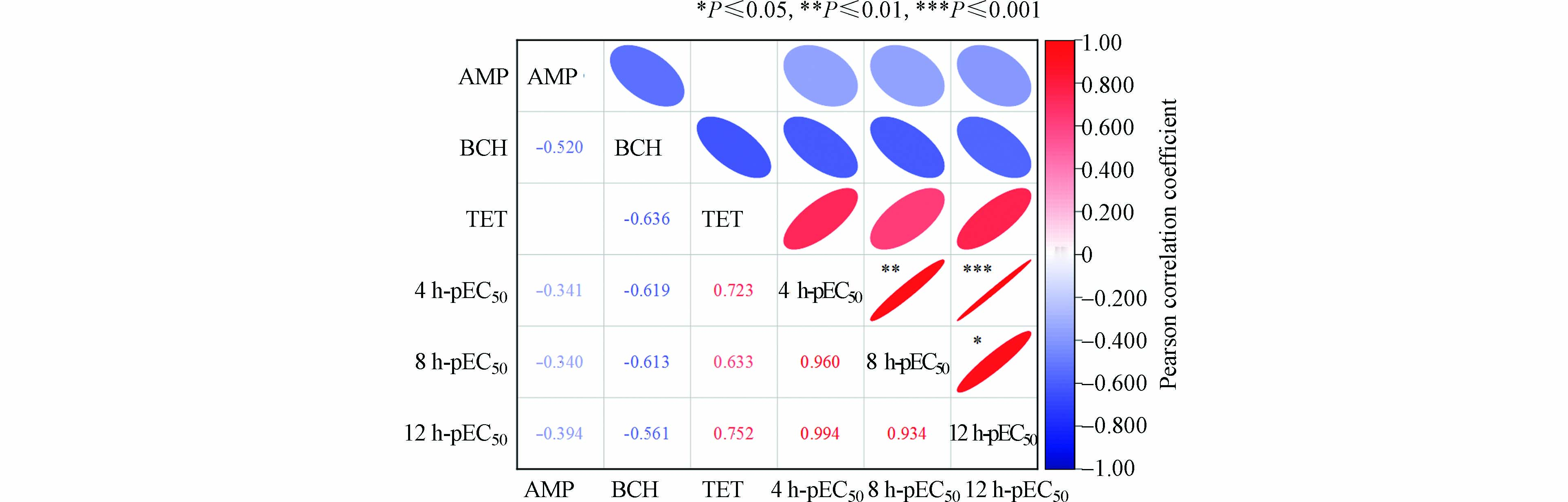
从组分比来看,三元混合物的组分比依赖性无法从图2中清晰看出,因此为进一步探究三元混合物在不同暴露时间点的抑菌毒性与组分比的相关性,用Pearson相关系数检验变量间相关性的强弱,结果如图4所示. 在AMP-BCH-TET混合物体系中,虽然4 h-pEC50、8 h-pEC50、12 h-pEC50值与TET正相关,与AMP和BCH负相关,但Pearson相关系数r<0.9,显著系数P>0.05 ,AMP与TET相关系数极小,这说明二者间无显著相关性;三元混合物的4 h-pEC50、8 h-pEC50、12 h-pEC50相互显著正相关,其中4 h-pEC50与12 h-pEC50极显著正相关(r=0.994,P≤0.001),4 h-pEC50与8 h-pEC50非常显著正相关(r = 0.960,0.001<P≤0.01),8 h-pEC50与12 h-pEC50显著正相关(r=0.934,0.01<P≤0.05),这也说明三元混合物的抑菌毒性有显著的时间依赖性.
为进一步直观说明三元混合物的时间及浓度依赖抑菌性,将AMP-BCH-TET对E. coli的t-CRC进行绘制,结果如图5所示. 首先,三元混合物的t-CRC最终呈“S”型,抑菌性随时间的增加逐渐增大,说明具有时间依赖性,这与图2的结论一致. 其次,在0.25 h,t-CRC无明显起伏,说明无急性抑菌性,这也说明对于AMP,其他两种组分的单独或混合加入都会使其急性抑菌性减弱、消失或被掩盖;在2—12 h,t-CRC在低浓度区域增加趋势微弱,而在中、高浓度区域出现了大幅度的攀升,与抑菌毒性变化基本相同,并且随着浓度的增加,抑菌性明显增强,具有明显的浓度依赖抑菌性,最大抑菌率为0.9999,抑菌效果明显.
综上所述,AMP-BCH-TET的抑菌毒性远大于单个药物,且均具有显著的时间依赖抑菌性和浓度依赖抑菌性,但无组分比依赖抑菌性,三元混合物的 4 h-pEC50、8 h-pEC50、12 h-pEC50之间呈正相关.
-
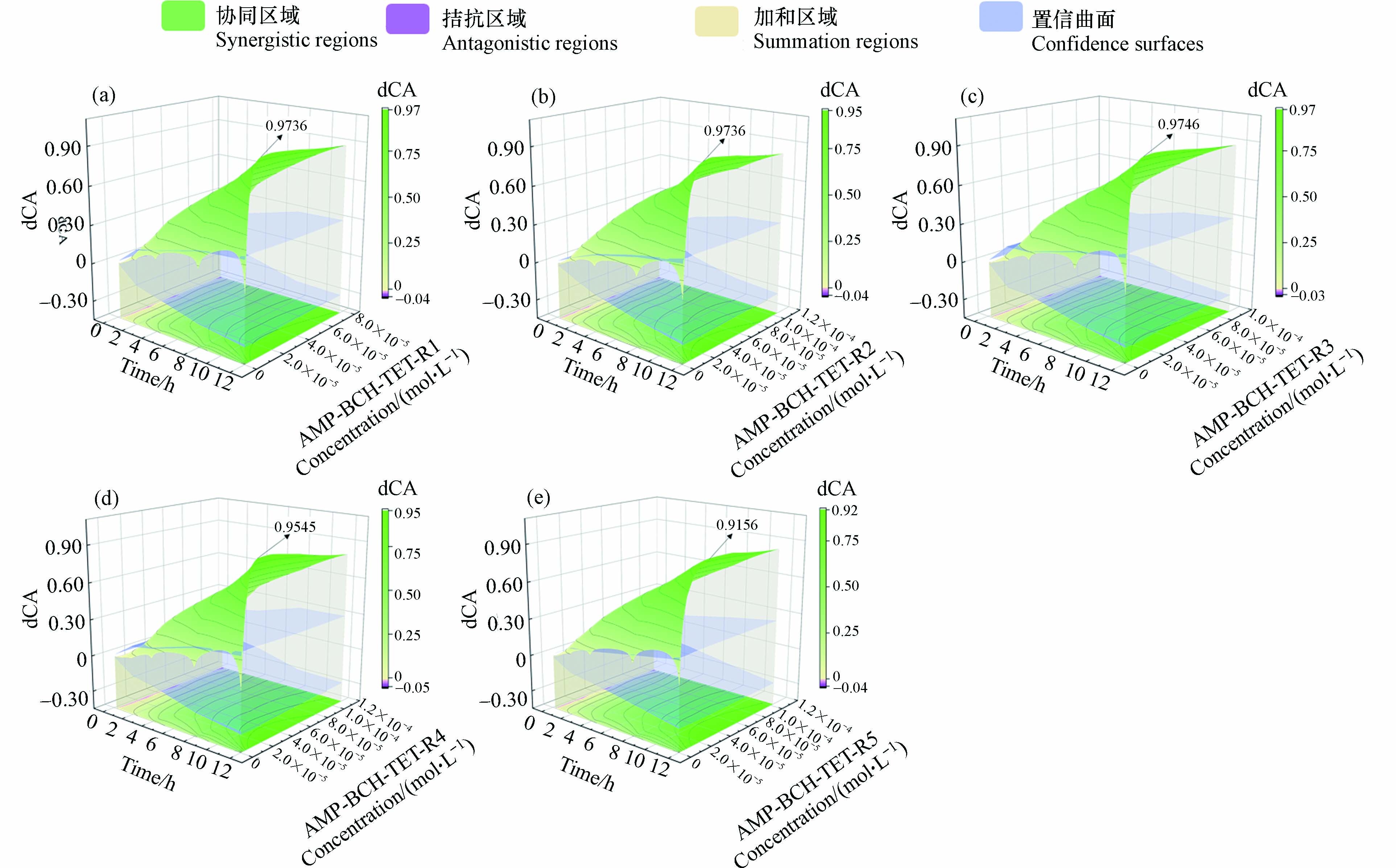
为了分析3种药物的二元混合物的联合作用类型以及联合作用强度与时间和浓度之间的关系,采用dCA曲面与dOCI曲面的上下关系来描述三元混合物的联合作用类型,用dCA值定量表征混合物之间的联合作用强度,3种药物的二元混合物的dCA值随时间和浓度变化情况如图6所示,其绿色颜色越深表示组分间相互作用强度越强.
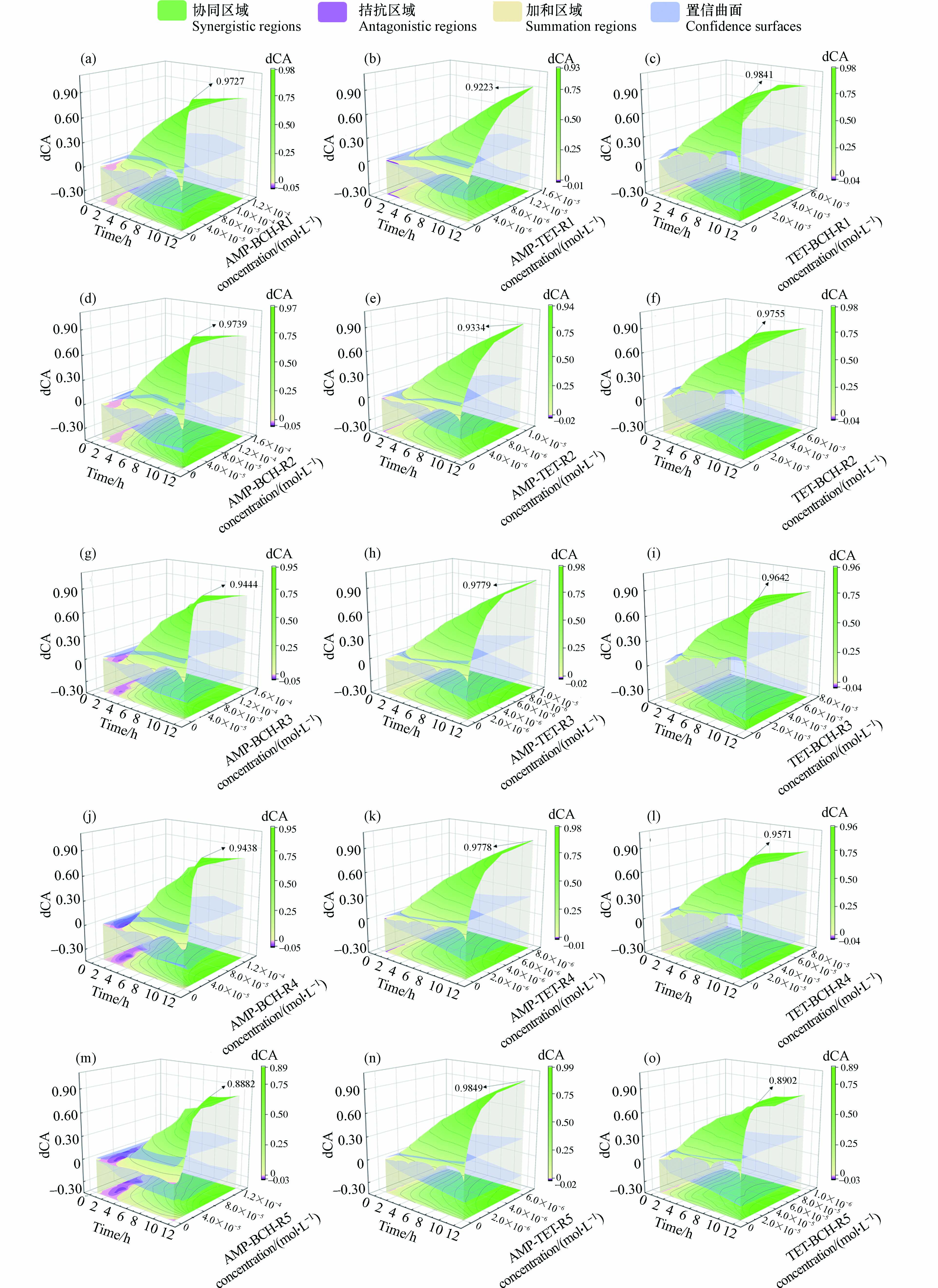
由图6知,AMP-BCH、AMP-TET和TET-BCH的所有射线对E. coli的联合作用均为协同作用,其强度均随时间和浓度的变化而变化. 在短暴露时间(0.25—2 h)的低浓度时,所有混合射线的dCA曲面均位于dOCI上下曲面之内,且dCA曲面由淡紫色逐渐转变为绿色,组分间的协同作用趋势明显增强;在较长的暴露时间内(4—12 h),dCA曲面已逐渐与dOCI上曲面产生了相交,并大幅度地高出dOCI的上曲面,绿色颜色加深,组分间的协同强度不断增强. 在所有二元体系中,在12 h且浓度分别为1.904×10−5、6.64×10−6、1.46×10−5 mol·L−1时,最大协同强度分别为0.9739、0.9849和0.9841.
此外,TET-BCH体系的协同曲面更大且无紫色区域,说明 TET-BCH的协同作用强度增加范围较为明显,这可能是由于BCH为脂多糖拮抗剂,可以从源头阻断脂多糖/TLR4信号通路,且TET会深度抑制菌体内部核糖体的工作性能,进而使转运RNA对肽链间的衔接程序紊乱,从而减少了肽链间的结合位点,进一步延缓了蛋白质的“建设”进度. 2种药物的双重抑菌机制,使其协同强度更为明显. 混合物体系的强协同作用可为解决耐药菌的问题提供解决思路和有效方法.
-
AMP-BCH-TET的dCA结果变化情况如图7所示. 由图7可知,dCA曲面图整体均为绿色, dCA曲面大多在置信曲面的上方,随时间和浓度的增加,绿色逐渐加深,即该三元混合物的5条射线组分间相互作用大多为协同作用,且协同作用强度整体呈增大趋势. 在同一暴露时间,dCA随混合物浓度的增加而增加;在同一药物浓度下,dCA随着时间的延长而增大. 当混合物浓度较低且暴露时间为0.25 h时,dCA曲面在dOCI面内向上攀升,绿色曲面大范围地扩增,无紫色曲面出现,即协同趋势逐渐显现;当混合物浓度较高且暴露时间为4—12 h时,dCA曲面与dOCI上曲面产生相交线,且dCA曲面大面积超越dOCI上曲面,绿色区域的颜色不断加深,dCA大小随混合物浓度和暴露时间的增大而不断增大,协同强度逐步增强. 三元混合物的5条射线,都为协同作用,其联合抑菌毒性强于单个药物,其中,AMP-BCH-TET-R3在暴露时间12 h且混合物浓度2.24×10−5mol·L−1时,达到最大协同作用强度(0.9746).
-
核酸作为生命体的重要遗传物质,承担着储存信息、合成蛋白质和转运氨基酸等重要功能,若核酸大量泄露,则生命体的正常活动必将受损[35]. 故通过核酸溶出量的变化,能够反映出细胞遗传物质的受损程度. 选取3种药物及每个混合物体系中抑菌效果较好且混合物相互作用较为明显的代表射线作用于E. coli,相对于空白对照组的核酸溶出量影响结果如图8所示,实验数据以平均值±标准差表示,以单因素方差分析法比较不同组之间的差异,并用最小显著差法多重比较判断分析实验组和空白组之间差异显著性. 当P<0.05时,认为具有统计学意义.
从图8可知,E. coli细胞在BCH、TET、AMP-BCH、AMP-TET和TET-BCH作用下,核酸溶出量随暴露时间的延长均呈现上升趋势,且所有实验组的核酸溶出量较空白对照组均存在极显著性差(P<0.01). 在AMP作用下,E. coli核酸溶出量随暴露时间的延长,变化规律不明显. 由图1可知AMP具有急性抑菌性,但在0.25 h也存在核酸溶出量大于AMP的无急性抑菌性的实验组,所以0.25 h 的E. coli的核酸溶出量与不是药物急性抑菌性的必要条件. 由AMP与TET、BCH的二元及三元混合物体系对应的t-CRC可知,它们对E. coli都无急性抑菌性,说明TET和BCH的单独或混合添加,掩盖、减少或湮灭了AMP的急性抑菌性. BCH和TET对E. coli的核酸溶出量随时间的延长在逐步增加. 在AMP-TET作用下,12 h核酸溶出量大于两个单个药物,两个单个药物的联用相较单个药物提高了12 h核酸溶出量,而随时间延长而增加,核酸溶出量增加的趋势相比两个单个药物都有了明显的攀升,说明该混合物体系也提高了核酸溶出量的溶出速率. 而在AMP-BCH和TET-BCH作用下,12 h核酸溶出量大于单个药物,但核酸溶出量的溶出速率却没有明显提升. 在AMP-BCH-TET的作用下,随时间延长E. coli细胞的核酸溶出量却逐渐减少,但核酸溶出量依旧大于单个药物,说明3个药物的联用增加了核酸溶出量的溶出. 这可能是由于三种药物的主要作用位点各不相同,它们分别对细胞壁、蛋白质和菌丝的形成进行抑制[36-37],而这最终的结果都会导致细胞膜破裂或通透性改变,从而加剧了细胞内核酸的溶出.
综上所述,AMP、TET、BCH组成的混合物体系的核酸溶出量整体大于单个药物,组分间的强协同作用强度和抑菌毒性整体也高于单个药物,这说明混合物对E. coli的高抑菌毒性和组分间的强协同作用强度都与核酸溶出量有关.
-
通过电镜扫描能够直观地反映细胞形态的变化,且正常细胞结构是生命体活动的必要条件,当细胞结构受损时,其生存也将受到威胁,故通过观察细胞形态的变化能够反映出目标药物对受试生物的迫害. Lee等[38]通过对比李斯特菌(Listeria monocytogenes)在马尾藻(Myagropsis myagroides)提取物作用前后的变化,发现药物不仅影响了菌体的完整形态,而且会导致穿孔破裂,最终殒命. 3种药物及其混合物代表射线对细胞形态的影响结果如图9所示.
由图9可知,E. coli细胞在milli-Q水(阳性对照组)和MHB(阴性对照组)作用后,两者形态相似且菌体完整,形态规则,表面平滑,而在3种药物及其混合物代表射线作用后,形态变化显著,细胞结构形态出现了不同形式的改变. 在AMP作用后,细胞难以维持基本形态,内溶物大量溢出,其作用机制是抑制E. coli细胞壁的合成,使细胞壁缺失而使细胞膨胀、破裂和溶解[39];在BCH作用后,细胞膜发育不全且表面极为粗糙并皱缩,细胞间的粘稠性变高,景春娥等[40]等研究表明,BCH可抑制体外阪崎克罗诺杆菌(Microbial Pathogenesis )生物膜生成,从而抑制细菌生长;在TET作用后,细胞出现了断裂和大面积的凹陷,根据汤淼等[41]研究表明. TET可进入细胞内部影响蛋白质的合成,进而可能影响了细胞形态. 对于二元混合物,在AMP-BCH作用后,有凹陷和粘连物,且大小不一,部分延续了BCH的作用特点;在AMP-TET作用后,有凹陷和孔洞出现,且有少部分细胞变长,说明AMP-TET比单个药物加剧了对细胞膜的破坏,致使细胞质大量泄露,这也解释了2.6节AMP-TET组核酸溶出量最高的现象;在TET-BCH作用后,大部分细胞变为短杆状,部分呈现球状,表现与单个药物不同的作用特征. 在AMP-BCH-TET作用后,E. coli细胞显著变长,少部分在菌体中部出现断裂,形态明显改变. 整体来说,二元及三元混合物对E. coli细胞形态的变化比单个药物更大,这从细胞形态上解释了混合物体系的高抑菌毒性、强协同作用强度和高核酸溶出量产生的原因.
-
(1) AMP、BCH和TET对E. coli均产生了明显的时间和浓度依赖抑菌性,12 h,3种药物抑菌性大小关系为:TET>BCH>AMP,仅AMP具有急性抑菌性. 这表明暴露时间和浓度是影响3种药物抑菌毒性作用的重要因素.
(2) 3种药物的混合物体系对E. coli均具有明显的时间和浓度依赖抑菌性. 二元混合物体系具有组分比依赖抑菌性,而三元体系无明显的依赖性. 所有混合物体系均无急性抑菌作用,说明BCH和TET组分的单独或混合加入,减少、掩盖或削弱了AMP的急性抑菌性. 二元和三元混合物抑菌毒性作用明显强于单个药物的,最高抑菌率可达0.9999.
(3) 3种药物的二元和三元混合物体系对E. coli的联合抑菌作用类型整体均为协同,强度随时间和浓度的增大而增大,最大协同作用强度分别为0.9849和0.9746.
(4) 在AMP、BCH、TET及其混合物体系作用下,E. coli的核酸含量均高于空白对照组,且有极显著性差异,二元及三元混合物作用后的核酸溶出量整体高于单个药物的,说明混合物会导致胞内DNA等大分子物质产生更严重的泄漏和细胞损伤;药物作用后E. coli细胞严重受损,出现了破裂、皱缩、黏连、凹陷、变长、孔洞、内溶物外泄和大小不一等现象,且部分混合物对细胞形态的作用相比单个药物有不同表现形式,对细胞形态的破坏更为严重. 这都说明3种药物的混合物导致的高核酸溶出量和更严重的细胞损伤是产生强协同作用强度和高抑菌毒性的原因之一.
抗生素与中药对大肠杆菌的联合抑菌作用及机理
Combined antibacterial action and mechanism of antibiotics and traditional Chinese medicine on Escherichia coli
-
摘要: 为研究抗生素和中药对环境及生物体中菌群的联合毒性作用,以2种常用抗生素氨苄西林钠(ampicillin sodium,AMP) 、盐酸四环素(tetracycline hydrochloride,TET)和1种中药提取物盐酸小檗碱 (berberine chloride hydrate,BCH)为目标污染物,以大肠杆菌(Escherichia coli,E. coli)为指示生物,分别应用直接均分射线法和均匀设计射线法设计3个二元(AMP-BCH、AMP-TET、BCH-TET)及1个三元混合物体系(AMP-TET-BCH),共20条射线,采用以96孔微板为实验载体的时间微板毒性分析法(time-dependent microplate toxicity analysis method,t-MTA)对3种药物及其混合物体系的毒性进行系统测定. 运用拟合归零法分析混合物毒性相互作用类型及强度,选取抑菌作用明显的代表性混合物射线进行暴露前后E. coli核酸溶出量以及电镜扫描分析. 结果表明,AMP、TET、BCH及其混合物体系对E. coli的浓度效应曲线为“S”型且时间和浓度依赖抑菌性明显,仅AMP具有明显的急性抑菌性二元混合物体系具有明显的组分比依赖性,而三元混合物体系无明显的组分比依赖性;暴露时间不同,3种药物及其混合物体系的抑菌毒性(半数效应浓度的负对数值(pEC50))也不同,整体上随暴露时间的增加而增加,在同一暴露时间二元和三元混合物体系的抑菌毒性大于单个药物,其中毒性最强为AMP-TET-R5(pEC50=6.25);混合物体系联合抑菌作用均为协同作用,其中协同作用强度最强也为AMP-TET-R5 (dCA=0.9849),且受时间、浓度和组分比影响;混合物体系可以通过破坏细胞形态和结构来抑制E. coli的生长,其中混合物体系的核酸溶出量整体高于单个药物的,且E. coli被作用后的细胞形态和结构的变化比单个药物作用后破坏的更为严重.Abstract: To investigate the combined toxic effects of antibiotics and Chinese herbal medicines on the microbial flora in the environment and organisms, two commonly used antibiotics, ampicillin sodium (AMP) and tetracycline hydrochloride (TET), and one Chinese herbal medicine extract, berberine chloride hydrate (BCH), were selected as target contaminants, and their three binary (AMP-BCH, AMP-TET, BCH-TET) and one ternary mixture (AMP-TET-BCH) systems were designed by using the direct equipartition ray and uniform design ray methods, respectively. The time-dependent microplate toxicity analysis method (t-MTA) with 96-well microplates was used to systematically determine the toxicity of the three drugs and the mixture system to Escherichia coli (E. coli). The return-to-zero fitting method was used to analyze the types and strengths of toxic interactions in the mixtures, and representative rays with significant toxicity interactions were chosen for the analysis of the nucleic acid content of E. coli before and after exposed to drugs, as well as scanning electron microscopy mechanistic experiments. The results showed that the concentration-effect curves of AMP, TET, BCH and their mixture systems on E.coli were "S" shaped with significant time- and concentration- dependent inhibition. Only AMP had a significant acute inhibition. The binary mixture system had a significant component-ratio dependence, while the ternary mixture system did not have. The inhibition toxicity (negative logarithm of the half-effect concentration (pEC50)) of the three drugs and their mixture systems differed and increased with increasing of exposure time. At the same exposure time, the inhibition toxicity of the binary and ternary mixture systems was stronger than that of the individual drugs, AMP-TET-R5 with pEC50 = 6.25 was the strongest toxicity. The inhibition of the mixture systems was all synergistic with the highest synergistic intensity in AMP-TET-R5 (dCA=0.9849), which was influenced by time, concentration and fraction. The mixture system could inhibit the growth of E. coli by disrupting cell morphology and structure. The nucleic acid dissolution of E. coli after exposed to the mixture systems was overall higher, and the changes in cell morphology and structure were more severely disrupted than those exposed to the individual drugs.
-
自从抗生素被发现、生产和使用以来,全世界每年至少生产1×105—2×105 t抗生素[1],因其对病原微生物具有良好的抑制作用[2],抗生素被大量应用在医疗等许多方面[3]. 目前,抗生素种类和数量剧增,仅中国一年抗生素的用量就有1.62×105 t,产出达到2.48×105 t,进入环境的抗生素质量甚至超过了5 t[4],造成环境中抗生素被大量检出,如盐酸四环素在黄浦江的上游支流中被检测出,浓度达34.25—211.82 ng·L−1[5],在苏州市某一湖泊中也检测出,浓度达3.27—547 ng·L−1[6];在香港的维多利亚湾β-内酰胺类抗生素最高被检测出493 ng·L−1[7]. 进入环境中的抗生素不仅会对环境中微生物造成危害,也会影响植物根系的伸长,阻碍种子的发芽生长[8],甚至还会通过食物链等途径进入动物甚至人体,对动物及人类肠道菌群产生影响,更为严重还会导致人体产生抗药性和体重变化等其它危害[9].
环境中残留的抗生素不是以单个形式存在,常以混合物的形式存在,不同抗生素之间在环境中很可能会出现协同或拮抗作用[10],给生态环境及人体健康带来更大潜在的风险[11],如王桂祥等[12]发现,环境浓度下的恩诺沙星和磺胺甲恶唑的协同作用会使普通小球藻产生更强的氧化损伤. 因此,研究抗生素及其混合污染物的毒性作用具有重要的环境意义.
中药因对细菌和病毒等微生物产生良好的抑菌效果,而被大量使用[13],同时,也产生了大量药渣,其中含有黄酮、生物碱、多酚、萜类等成分[14]也随之进入环境中,抑制微生物的生长. 刘海席[15]研究发现,中药提取物盐酸小檗碱在1.47—23.44 mg·L−1浓度范围,对桃褐腐菌(Monilinnia fructioncola)的抑菌作用随浓度的升高而增强. 无论是进入环境还是在人体中的中药都很有可能会对环境中残留的或者通过食物链等途径进入生物体甚至人体的抗生素的抑菌作用产生影响,如氢青蒿素和氟康唑联合使用恢复了氟康唑对耐药性白色念珠菌的抑菌作用,并与氟康唑产生了较强的协同作用[16]. 因此,考察抗生素与中药联合抑菌作用具有重要的实际意义.
大肠杆菌(Escherichia coli, E. coli)常存在于人和动物肠道中,伴随粪便排出,在自然环境中广泛传播[17],和人体是互利共生的关系,多数不会给身体带来危害,反而可以抑制肠道致病菌和其他病原体的繁殖[18]. 因其具有生长速度快、培养方法简单等优点,也常被作为一种模式生物. 尹孝仁等[19]发现诺氟沙星和多粘菌素E对E. coli出现协同作用. 曾范利等[20]发现鱼腥草、黄芩和五倍子联用时,对E. coli抑菌效果为协同或加和作用. 这都说明E. coli作为指示生物来反映抗生素和中药抑菌效果的可行性. 抗生素与中药的联合抑菌效果虽已有前人进行研究[21],而定量评估其潜在的风险是关键,而目前大多数研究都缺乏对联合抑菌作用强度的定量表征.
此外,盐酸四环素作为世界上使用非常广泛的广谱抗生素,也是污水中检出最为频繁的抗生素之一[22];氨卡西林钠是作为β-内酰胺类的广谱抗生素,具有抗菌谱广、药效高和价格便宜等特点[23],在临床医疗上被广泛的使用. 虽然这两种抗生素降解速率都很快,但是由于使用量大、频率高,仍可能在环境中造成假持久性污染[24],对生态及人体造成威胁. 因此,本文选择β-内酰胺类抗生素(氨苄西林钠(ampicillin sodium,AMP))、四环素类抗生素(盐酸四环素(tetracycline hydrochloride,TET))和中药提取成分(盐酸小檗碱(berberine chloride hydrate,BCH))作为目标污染物,应用直接均分射线法(direct equipartition ray,EquRay)和均匀设计射线法(uniform design ray,UD-Ray)[25],分别设计了3种药物的3个二元(AMP-BCH、AMP-TET、TET-BCH)及1个三元混合物体系(AMP-BCH-TET);利用时间微板毒性分析法(time-dependent microplate toxicity analysis method,t-MTA)[26]测定并分析3种药物及其混合物体系对E. coli的时间、浓度和组分比依赖抑菌毒性;应用拟合归零法进一步对混合物组分间的相互作用类型及强度进行分析,并测定药物作用前后E. coli细胞的核酸溶出量和电镜扫描的细胞形态,以探讨可能的作用机理. 研究结果可为评价抗生素和中药的混合物毒性及环境生态风险等研究提供参考.
1. 材料与方法(Materials and methods)
1.1 材料与主要仪器
实验用药物均购于国药集团化学试剂有限公司,其理化性质见表1,储备液均采用mili-Q水配制,置于棕色瓶储备,放4 ℃冰箱保存. 实验所用主要仪器见参考文献[27].
表 1 3种药物的理化性质及其储备液浓度Table 1. Physicochemical properties of the three drugs and their stock solution concentrations名称Name 简称Abbreviation 分子式Molecular formula 分子量Molecular weight CAS-RN 纯度Purity 储备液/(mol·L−1)Stock solution 氨苄西林钠Ampicillin sodium AMP C16H18N3NaO4S 371.380 69-52-3 ≥98% 3.45×10−3 盐酸四环素Tetracycline hydrochloride TET C22H25ClN2O8 480.900 64-75-5 ≥98% 1.04×10−3 盐酸小檗碱Berberine chloride hydrate BCH C20H18ClNO4 371.814 141433-60-5 ≥97% 2.15×10−3 1.2 菌种与培养方法
实验菌种为菌株号ATCC8739大肠埃希氏菌(Escherichia coli,E. coli),购自上海鲁微科技有限公司,E. coli的活化过程,培养基成分和制备见参考文献[28]. 将营养肉汤培养基(nutrient broth,NB)培养至对数生长期的E. coli菌液接入2倍MHB培养基(mueller-hinton broth,MHB),使其OD600值在0.08—0.1,备用.
1.3 时间毒性微板分析法
在微板孔上设计防边缘效应组(200 μL mili-Q水)、空白对照组(100 μL mili-Q水+ 100 μL备用菌)和实验组(100 μL药+100 μL备用菌). 样品微板由实验组、防边缘效应组和空白对照组组成,实验组设计12个浓度梯度,每种药或混合物射线设计3块样品微板,同步设计一块由空白对照组和防边缘效应组组成的阴性对照板. 将所有微板置于(37±1)℃生化恒温培养箱中培养,分别在暴露时间0.25、2、4、8、12 h取出,用酶标仪测定微板各孔中菌的OD600值. 经实验同步测定,在12 h,空白对照组的菌都处于对数生长期,生长状态良好. 具体操作过程见文献[29]. 药物及其混合物体系对E. coli的抑菌性计算公式如下:
x=I0−II0 (1) 式中, I0 为空白对照的 OD600 平均值,I为各浓度梯度的 OD600 平均值;x为为抗生素对E. coli 的生长抑制率.
1.4 混合物设计
为有效地研究混合物组分对E. coli毒性相互作用,分别采用直接均分和均匀设计射线法设计3种药物的二元(AMP-TET、AMP-BCH、TET-BCH)及三元 (AMP-BCH-TET) 混合物体系,每种混合物体系共有5条射线(R1、R2、R3、R4、R5),每条射线有12个浓度梯度. 二元及三元混合物的各组分浓度比 (pi) 如表2所示.
表 2 混合物体系各物质组分浓度比(pi)Table 2. Concentration ratio of each substance component of the mixture system (pi)AMP-BCH AMP-TET 射线Ray pAMP pBCH 射线Ray pAMP pTET R1 8.959×10−1 1.041×10−1 R1 9.187×10−1 8.127×10−2 R2 7.750×10−1 2.250×10−1 R2 8.189×10−1 1.811×10−1 R3 6.326×10−1 3.674×10−1 R3 6.933×10−1 3.067×10−1 R4 4.626×10−1 5.374×10−1 R4 5.306×10−1 4.694×10−1 R5 2.562×10−1 7.438×10−1 R5 3.114×10−1 6.886×10−1 TET-BCH AMP-BCH-TET 射线Ray pTET pBCH 射线Ray pAMP pBCH pTET R1 7.920×10−1 2.080×10−1 R1 2.546×10−1 2.831×10−1 4.623×10−1 R2 6.037×10−1 3.963×10−1 R2 3.724×10−1 4.709×10−1 1.567×10−1 R3 4.323×10−1 5.677×10−1 R3 5.388×10−1 8.558×10−2 3.757×10−1 R4 2.758×10−1 7.242×10−1 R4 5.909×10−1 2.326×10−1 4.314×10−1 R5 1.322×10−1 8.678×10−1 R5 4.943×10−1 2.871×10−1 2.186×10−1 1.5 浓度-效应曲线拟合
Weibull函数能较好拟合不同暴露时间点的“S”型浓度-效应关系[30],函数表达式如(2)所示. 同步用APTox软件处理数据[31],并绘制时间-浓度-效应曲线(time-concentration-effect curve,t-CRC).
E=1⁄(1+exp(−α−βlgC)) (2) 式中,E为效应( 0 ≤ E ≤1) ;C为单个药物或者混合物浓度;α 和 β为模型参数.
1.6 混合物联合抑菌作用类型判别及强度定量分析
拟合归零法是以实验数据拟合CRC数据归零为基础,将实验效应、置信区间以及用浓度加和模型(concentration addition,CA) [32]预测的CRC数据投影到实验效应的拟合曲线上. 本文将拟合归零法加入时间变量,以实测数据的拟合曲线与CA预测曲线间的偏差视作混合物的浓度加和偏离指数(deviation from CA model,dCA),绘制拟合归零法的三维曲面形式. 根据95%置信区间(observed confident interval,OCI)绘制dOCI曲面,即为置信曲面. 用dCA曲面与置信曲面相对位置来判别混合物的相互作用类型,当dCA曲面在dOCI曲面上方为协同作用,下方为拮抗作用,中间为加和作用. 再用dCA值的大小表示相互作用的强度大小,当dCA>0时,dCA越大则协同强度越强;当dCA<0时,dCA的绝对值越大则拮抗强度越强. 以dOCI对实验所得数据结果是否在上下95%置信区间内进行界定,加强了评判效应强度的准确性[32]. dCA和dOCI的表达式见(3)和(4).
dCA=EOBS−EPRE,CA (3) dOCI=EOBS−EPRE,OCI (4) 式中,EOBS为实际拟合效应;EPRE,CA为CA预测效应;EPRE,OCI为上下95%置信区间的拟合效应.
1.7 核酸溶出量的测定
为反映药物及其混合物的对E.coli作用前后细胞遗传物质的受损程度,测定在12 h-EC50条件下3种药物及其混合物的代表射线(AMP、BCH、TET、AMP-BCH-R5、AMP-TET-R5、TET-BCH-R5和AMP-BCH-TET-R5)作用E. coli前后随时间变化的核酸溶出量.
取1.2节40 mL备用菌液至离心管中,离心(15 min,8000 r·min−1)后,舍弃上清液取菌体,用PBS缓冲液(0.1 mol·L−1,pH=7.4)冲洗3次,之后将菌体转移到100 mL锥形瓶中,备用. 随后进行实验组及空白组设置:将等体积等浓度(12 h-EC50)的3种药物及其代表体系加入锥形瓶为实验组,同时设与之等体积mili-Q水为空白对照组,两组都加入等量的备用菌体,实验组和空白对照组均设置3组平行,在生化恒温培养箱(37 ℃、170 r·min−1)中培养;最后进行核酸溶出量测定:在暴露时间为0.25、2、4、8、12 h时,用移液枪吸取锥形瓶中的溶液,离心(15 min,8000 r·min−1)后,收集上清液,采用紫外分光光度计测定吸光度(OD260),以OD260值表示胞外核酸含量[33].
1.8 细胞形态观察
为进一步分析AMP、TET、BCH及其混合物体系作用E.coli的抑制机理及迫害效果,应用电镜扫描技术,分析在12 h-EC50条件下3种药物及其混合物体系的代表射线(AMP、BCH、TET、AMP-BCH-R5、AMP-TET-R5、TET-BCH-R5和AMP-BCH-TET-R5) 作用E.coli前后细胞形态结构变化.
实验组及空白组设置:取1.2节20 mL备用菌液和20 mL不同梯度药物加入锥形瓶中为实验组,再将同体积备用菌液和mili-Q水加入另一锥形瓶中为空白对照组,实验组和空白对照组均设计3组平行. 将实验组和对照组都放入生化培养箱(37 ℃、170 r·min−1、12 h)中培养,取培养后的混合液离心(15 min,8000 r·min−1),收集菌体,之后用PBS缓冲液(0.1 mol·L−1,pH=7.4)冲洗3次,再用戊二醛溶液(20 mL,2.5%)浸没,过夜固定. 接着再用PBS缓冲液冲洗菌体3次后,用乙醇溶液(30%、50%、80%、90%和100%)脱水,经冷冻干燥和喷金处理后,最用扫描电镜观察细胞形态[34].
2. 结果与讨论(Results and discussion)
2.1 单个药物对E. coli的抑菌作用
采用时间微板毒性分析法(time-dependent microplate toxicity analysis method,t-MTA)对单个药物不同暴露时间的E. coli抑菌性进行测定,并用Weibull函数拟合浓度-效应数据,结果见表3. 除0.25 h外,其余暴露时间的浓度-效应数据拟合效果良好(RMSE<0.10,r>0.90). 为全面得出3种药物对E. coli的在不同暴露时间抑菌毒性强弱关系,以半数效应浓度(EC50)的负对数(pEC50)作为抑菌毒性作用的指标,在0.25—2 h,3种药物对E. coli的抑菌毒性均较低,在4—12 h,各药物在不同暴露时间的抑菌毒性各不相同,毒性强弱也随时间变化而变化,在12 h时,抑菌毒性的强弱顺序为:TET>BCH>AMP.
表 3 3种药物的Weibull函数拟合结果及其统计量Table 3. Fitting results of Weibull function for 3 drugs and their statistics药物 Drug 时间/h Time α β RMSE r EC50/(mol·L−1) pEC50 AMP 0.25 3.41 1.63 0.023 0.9683 ∞ 0.00 2 4.17 1.45 0.037 0.9831 7.44×10−4 3.13 4 5.26 1.68 0.060 0.9728 4.48×10−4 3.35 8 6.89 2.14 0.075 0.9696 4.07×10−4 3.39 12 7.42 2.39 0.124 0.9417 5.52×10−4 3.26 BCH 0.25 0.13 12 0.057 -0.8805 ∞ 0.00 2 0.14 0.92 0.036 0.5397 ∞ 0.00 4 8.04 2.87 0.074 0.8824 1.18×10−3 2.93 8 7.33 2.14 0.075 0.9697 2.53×10−4 3.60 12 7.46 2.24 0.108 0.9496 3.21×10−4 3.49 TET 0.25 0.01 0.73 0.017 0.5919 ∞ 0.00 2 2.95 0.95 0.067 0.9067 3.23×10−4 3.49 4 5.3 1.5 0.074 0.9519 1.67×10−4 3.78 8 8.74 2.46 0.109 0.9229 1.99×10−4 3.70 12 13.36 3.8 0.142 0.8863 2.44×10−4 3.61 3种药物的t-CRC如图1所示. 由图1可知,3种药物对E. coli的t-CRC均为“S”型,具有明显的时间依赖抑菌性,但各药物的抑菌性变化规律迥异. 在0.25 h时,除AMP表现出急性抑菌性外,BCH和TET均无明显的急性抑菌性;在2 h时,AMP和TET的t-CRC明显弯曲,表明这两种药物的抑菌性随浓度升高逐渐增大,但BCH的t-CRC弯曲不明显,仅仅表现出轻微抑菌作用;在4—12 h时,3种药物的t-CRC表现为更明显的弯曲状态,说明抑菌作用明显. 在0—12 h,3种药物的t-CRC随浓度的升高在不同程度上逐渐攀升,说明这3种药物对E. coli的抑菌作用具有浓度依赖性, AMP、BCH和TET对E. coli的最大抑菌率分别为0.9296、0.9298和0.9103.
2.2 3种药物的混合物对E. coli的联合抑菌作用分析
2.2.1 3种药物的二元混合物对E. coli的联合抑菌毒性分析
同样用Weibull函数对实验结果数据进行拟合,得各混合物射线在各暴露时间的pEC50值,绘制其随时间及组分变化的热图,如图2所示. 从时间来看,3种药物的二元混合物体系均具有时间依赖抑菌性. 4—12 h,3组二元混合物的抑菌毒性随暴露时间的增加都在不断增强,增幅明显,在同一二元混合物射线中,各暴露点抑菌毒性顺序为:12 h-pEC50>8 h-pEC50>4 h-pEC50. 在最终暴露时间点(12 h),AMP-BCH、AMP-TET和TET-BCH各射线的抑菌毒性达到最大,最大值分别为5.16、6.25和6.15,均远高于3种药物单独抑菌毒性.
从组分比来看,3种药物的二元混合物体系均具有组分比依赖抑菌性. 对于AMP-BCH体系,AMP组分的减少及BCH组分的增加都会使同一时间节点(4、8、12 h)的抑菌毒性逐渐减弱(R1>R2>R3>R4>R5);对于AMP-TET体系,TET组分的增加,AMP组分的减少反而会使同一时间节点的抑菌毒性逐渐增强(R1<R2<R3<R4<R5);对于TET-BCH体系,抑菌毒性随时间变化规律与AMP-BCH相似,TET组分的减少和BCH组分的增加使同一时间的抑菌毒性逐渐减弱( R1>R2>R3>R4>R5). 综上,说明在4、8、12 h, 3种药物的各二元体系的抑菌毒性与TET组分正相关,与BCH组分负相关,而AMP组分在AMP-TET中呈负相关,在AMP-BCH中则呈正相关.
为了直观说明各二元混合物的时间依赖抑菌性和浓度依赖抑菌性,对3种药物的所有二元混合体系共15条射线的实验数据进行t-CRC拟合,拟合结果如图3所示. 首先由图3可知,t-CRC最终呈“S”型,各二元混合物对E. coli的抑菌性随时间的增加而逐渐增大,呈现明显的时间依赖性,验证了图2的结论. 其次,在短暴露时间段 (0.25—2 h),抑菌性均较低,无急性抑菌性,说明BCH和TET组分的单独加入,减弱、消除或掩盖了AMP的急性抑菌性;在长暴露时间段 (4—12 h),抑菌性均随混合物浓度的升高而变大,说明二元混合物都具有浓度依赖抑菌性,最高抑菌率达0.9999,抑菌效果明显.
综上, AMP、BCH、TET的二元混合物体系对E. coli均有较好的抑菌毒性作用,并明显强于单个药物;二元混合物的抑菌毒性和暴露时间、浓度及组分比密切相关,且均具有时间、浓度和组分比依赖抑菌性.
2.2.2 3种药物的三元混合物对E. coli 的联合抑菌作用分析
采用Weibull函数拟合AMP-BCH-TET三元混合物浓度-效应数据,除0.25 h外,均可良好拟合(RMSE<0.10,r>0.90),根据拟合结果得三元混合物的在各暴露时间的pEC50值,其随时间及组分变化的热图,如图2所示. 从图2来看,AMP-BCH-TET对E. coli的抑菌性具有明显的时间依赖性,且抑菌作用大于单个药物. 三元混合物对E. coli的抑菌性与暴露时间正相关(4 h-pEC50<8 h-pEC50<2 h-pEC50). 随着目标药物与E. coli接触时间延长,5条射线对E. coli的pEC50值不断增大,其12 h-pEC50值(5.54—5.96)明显大于单个药物.
从组分比来看,三元混合物的组分比依赖性无法从图2中清晰看出,因此为进一步探究三元混合物在不同暴露时间点的抑菌毒性与组分比的相关性,用Pearson相关系数检验变量间相关性的强弱,结果如图4所示. 在AMP-BCH-TET混合物体系中,虽然4 h-pEC50、8 h-pEC50、12 h-pEC50值与TET正相关,与AMP和BCH负相关,但Pearson相关系数r<0.9,显著系数P>0.05 ,AMP与TET相关系数极小,这说明二者间无显著相关性;三元混合物的4 h-pEC50、8 h-pEC50、12 h-pEC50相互显著正相关,其中4 h-pEC50与12 h-pEC50极显著正相关(r=0.994,P≤0.001),4 h-pEC50与8 h-pEC50非常显著正相关(r = 0.960,0.001<P≤0.01),8 h-pEC50与12 h-pEC50显著正相关(r=0.934,0.01<P≤0.05),这也说明三元混合物的抑菌毒性有显著的时间依赖性.
为进一步直观说明三元混合物的时间及浓度依赖抑菌性,将AMP-BCH-TET对E. coli的t-CRC进行绘制,结果如图5所示. 首先,三元混合物的t-CRC最终呈“S”型,抑菌性随时间的增加逐渐增大,说明具有时间依赖性,这与图2的结论一致. 其次,在0.25 h,t-CRC无明显起伏,说明无急性抑菌性,这也说明对于AMP,其他两种组分的单独或混合加入都会使其急性抑菌性减弱、消失或被掩盖;在2—12 h,t-CRC在低浓度区域增加趋势微弱,而在中、高浓度区域出现了大幅度的攀升,与抑菌毒性变化基本相同,并且随着浓度的增加,抑菌性明显增强,具有明显的浓度依赖抑菌性,最大抑菌率为0.9999,抑菌效果明显.
综上所述,AMP-BCH-TET的抑菌毒性远大于单个药物,且均具有显著的时间依赖抑菌性和浓度依赖抑菌性,但无组分比依赖抑菌性,三元混合物的 4 h-pEC50、8 h-pEC50、12 h-pEC50之间呈正相关.
2.3 3种药物的混合物体系对E. coli的联合抑菌作用类型及强度分析
2.3.1 3种药物的二元混合物对E. coli 的联合抑菌作用类型及强度分析
为了分析3种药物的二元混合物的联合作用类型以及联合作用强度与时间和浓度之间的关系,采用dCA曲面与dOCI曲面的上下关系来描述三元混合物的联合作用类型,用dCA值定量表征混合物之间的联合作用强度,3种药物的二元混合物的dCA值随时间和浓度变化情况如图6所示,其绿色颜色越深表示组分间相互作用强度越强.
由图6知,AMP-BCH、AMP-TET和TET-BCH的所有射线对E. coli的联合作用均为协同作用,其强度均随时间和浓度的变化而变化. 在短暴露时间(0.25—2 h)的低浓度时,所有混合射线的dCA曲面均位于dOCI上下曲面之内,且dCA曲面由淡紫色逐渐转变为绿色,组分间的协同作用趋势明显增强;在较长的暴露时间内(4—12 h),dCA曲面已逐渐与dOCI上曲面产生了相交,并大幅度地高出dOCI的上曲面,绿色颜色加深,组分间的协同强度不断增强. 在所有二元体系中,在12 h且浓度分别为1.904×10−5、6.64×10−6、1.46×10−5 mol·L−1时,最大协同强度分别为0.9739、0.9849和0.9841.
此外,TET-BCH体系的协同曲面更大且无紫色区域,说明 TET-BCH的协同作用强度增加范围较为明显,这可能是由于BCH为脂多糖拮抗剂,可以从源头阻断脂多糖/TLR4信号通路,且TET会深度抑制菌体内部核糖体的工作性能,进而使转运RNA对肽链间的衔接程序紊乱,从而减少了肽链间的结合位点,进一步延缓了蛋白质的“建设”进度. 2种药物的双重抑菌机制,使其协同强度更为明显. 混合物体系的强协同作用可为解决耐药菌的问题提供解决思路和有效方法.
2.3.2 3种药物的三元混合物对E. coli 的联合抑菌作用类型及强度分析
AMP-BCH-TET的dCA结果变化情况如图7所示. 由图7可知,dCA曲面图整体均为绿色, dCA曲面大多在置信曲面的上方,随时间和浓度的增加,绿色逐渐加深,即该三元混合物的5条射线组分间相互作用大多为协同作用,且协同作用强度整体呈增大趋势. 在同一暴露时间,dCA随混合物浓度的增加而增加;在同一药物浓度下,dCA随着时间的延长而增大. 当混合物浓度较低且暴露时间为0.25 h时,dCA曲面在dOCI面内向上攀升,绿色曲面大范围地扩增,无紫色曲面出现,即协同趋势逐渐显现;当混合物浓度较高且暴露时间为4—12 h时,dCA曲面与dOCI上曲面产生相交线,且dCA曲面大面积超越dOCI上曲面,绿色区域的颜色不断加深,dCA大小随混合物浓度和暴露时间的增大而不断增大,协同强度逐步增强. 三元混合物的5条射线,都为协同作用,其联合抑菌毒性强于单个药物,其中,AMP-BCH-TET-R3在暴露时间12 h且混合物浓度2.24×10−5mol·L−1时,达到最大协同作用强度(0.9746).
2.4 3种药物及其混合物代表射线作用E. coli 的核酸溶出量
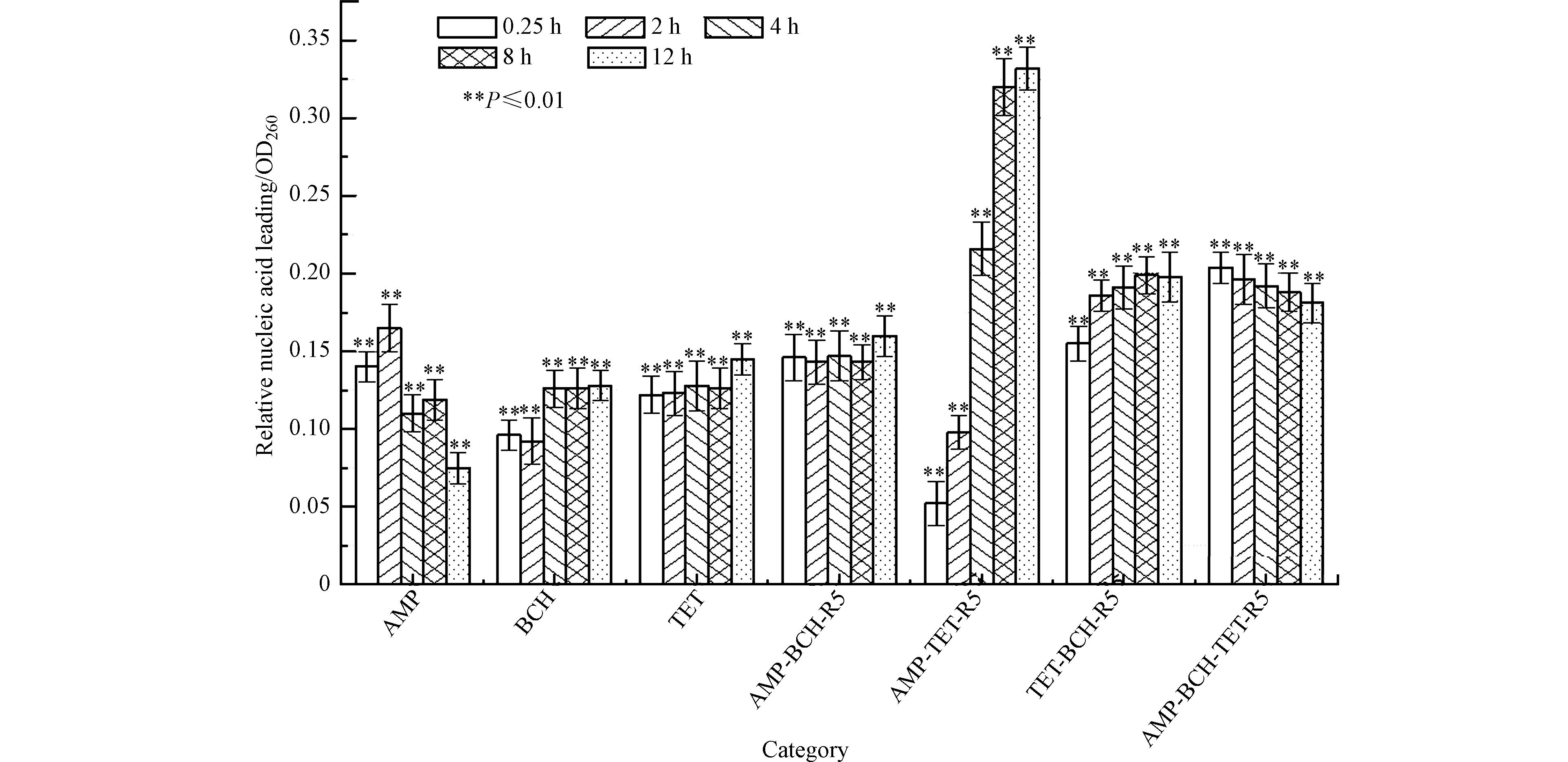
核酸作为生命体的重要遗传物质,承担着储存信息、合成蛋白质和转运氨基酸等重要功能,若核酸大量泄露,则生命体的正常活动必将受损[35]. 故通过核酸溶出量的变化,能够反映出细胞遗传物质的受损程度. 选取3种药物及每个混合物体系中抑菌效果较好且混合物相互作用较为明显的代表射线作用于E. coli,相对于空白对照组的核酸溶出量影响结果如图8所示,实验数据以平均值±标准差表示,以单因素方差分析法比较不同组之间的差异,并用最小显著差法多重比较判断分析实验组和空白组之间差异显著性. 当P<0.05时,认为具有统计学意义.
从图8可知,E. coli细胞在BCH、TET、AMP-BCH、AMP-TET和TET-BCH作用下,核酸溶出量随暴露时间的延长均呈现上升趋势,且所有实验组的核酸溶出量较空白对照组均存在极显著性差(P<0.01). 在AMP作用下,E. coli核酸溶出量随暴露时间的延长,变化规律不明显. 由图1可知AMP具有急性抑菌性,但在0.25 h也存在核酸溶出量大于AMP的无急性抑菌性的实验组,所以0.25 h 的E. coli的核酸溶出量与不是药物急性抑菌性的必要条件. 由AMP与TET、BCH的二元及三元混合物体系对应的t-CRC可知,它们对E. coli都无急性抑菌性,说明TET和BCH的单独或混合添加,掩盖、减少或湮灭了AMP的急性抑菌性. BCH和TET对E. coli的核酸溶出量随时间的延长在逐步增加. 在AMP-TET作用下,12 h核酸溶出量大于两个单个药物,两个单个药物的联用相较单个药物提高了12 h核酸溶出量,而随时间延长而增加,核酸溶出量增加的趋势相比两个单个药物都有了明显的攀升,说明该混合物体系也提高了核酸溶出量的溶出速率. 而在AMP-BCH和TET-BCH作用下,12 h核酸溶出量大于单个药物,但核酸溶出量的溶出速率却没有明显提升. 在AMP-BCH-TET的作用下,随时间延长E. coli细胞的核酸溶出量却逐渐减少,但核酸溶出量依旧大于单个药物,说明3个药物的联用增加了核酸溶出量的溶出. 这可能是由于三种药物的主要作用位点各不相同,它们分别对细胞壁、蛋白质和菌丝的形成进行抑制[36-37],而这最终的结果都会导致细胞膜破裂或通透性改变,从而加剧了细胞内核酸的溶出.
综上所述,AMP、TET、BCH组成的混合物体系的核酸溶出量整体大于单个药物,组分间的强协同作用强度和抑菌毒性整体也高于单个药物,这说明混合物对E. coli的高抑菌毒性和组分间的强协同作用强度都与核酸溶出量有关.
2.5 3种药物及其混合物代表射线对E. coli细胞形态的影响
通过电镜扫描能够直观地反映细胞形态的变化,且正常细胞结构是生命体活动的必要条件,当细胞结构受损时,其生存也将受到威胁,故通过观察细胞形态的变化能够反映出目标药物对受试生物的迫害. Lee等[38]通过对比李斯特菌(Listeria monocytogenes)在马尾藻(Myagropsis myagroides)提取物作用前后的变化,发现药物不仅影响了菌体的完整形态,而且会导致穿孔破裂,最终殒命. 3种药物及其混合物代表射线对细胞形态的影响结果如图9所示.
 图 9 3种药物及其混合物代表射线作用E. coli前后细胞形态的变化Figure 9. Changes in cell morphology before and after the action of representative rays of three drugs and their mixtures on E. coli注:(倍数:10000,加速电压:5KV);(a)、(b)、(c)分别为AMP、BCH、TET组,(d)、(e)、(f)、(g)分别为AMP-BCH、AMP-TET、TET-BCH、AMP-BCH-TET的R5射线组, (h)、(i)分别为阳性和阴性对照组Note: (Multiplier:10000,Acceleration voltage:5KV);(a), (b) and (c) are AMP, BCH and TET groups respectively, (d), (e), (f) and (g) are R5 ray groups for AMP-BCH, AMP-TET, TET-BCH and AMP-BCH-TET respectively, (h) and (i) are positive and negative control groups respectively
图 9 3种药物及其混合物代表射线作用E. coli前后细胞形态的变化Figure 9. Changes in cell morphology before and after the action of representative rays of three drugs and their mixtures on E. coli注:(倍数:10000,加速电压:5KV);(a)、(b)、(c)分别为AMP、BCH、TET组,(d)、(e)、(f)、(g)分别为AMP-BCH、AMP-TET、TET-BCH、AMP-BCH-TET的R5射线组, (h)、(i)分别为阳性和阴性对照组Note: (Multiplier:10000,Acceleration voltage:5KV);(a), (b) and (c) are AMP, BCH and TET groups respectively, (d), (e), (f) and (g) are R5 ray groups for AMP-BCH, AMP-TET, TET-BCH and AMP-BCH-TET respectively, (h) and (i) are positive and negative control groups respectively由图9可知,E. coli细胞在milli-Q水(阳性对照组)和MHB(阴性对照组)作用后,两者形态相似且菌体完整,形态规则,表面平滑,而在3种药物及其混合物代表射线作用后,形态变化显著,细胞结构形态出现了不同形式的改变. 在AMP作用后,细胞难以维持基本形态,内溶物大量溢出,其作用机制是抑制E. coli细胞壁的合成,使细胞壁缺失而使细胞膨胀、破裂和溶解[39];在BCH作用后,细胞膜发育不全且表面极为粗糙并皱缩,细胞间的粘稠性变高,景春娥等[40]等研究表明,BCH可抑制体外阪崎克罗诺杆菌(Microbial Pathogenesis )生物膜生成,从而抑制细菌生长;在TET作用后,细胞出现了断裂和大面积的凹陷,根据汤淼等[41]研究表明. TET可进入细胞内部影响蛋白质的合成,进而可能影响了细胞形态. 对于二元混合物,在AMP-BCH作用后,有凹陷和粘连物,且大小不一,部分延续了BCH的作用特点;在AMP-TET作用后,有凹陷和孔洞出现,且有少部分细胞变长,说明AMP-TET比单个药物加剧了对细胞膜的破坏,致使细胞质大量泄露,这也解释了2.6节AMP-TET组核酸溶出量最高的现象;在TET-BCH作用后,大部分细胞变为短杆状,部分呈现球状,表现与单个药物不同的作用特征. 在AMP-BCH-TET作用后,E. coli细胞显著变长,少部分在菌体中部出现断裂,形态明显改变. 整体来说,二元及三元混合物对E. coli细胞形态的变化比单个药物更大,这从细胞形态上解释了混合物体系的高抑菌毒性、强协同作用强度和高核酸溶出量产生的原因.
3. 结论(Conclusion)
(1) AMP、BCH和TET对E. coli均产生了明显的时间和浓度依赖抑菌性,12 h,3种药物抑菌性大小关系为:TET>BCH>AMP,仅AMP具有急性抑菌性. 这表明暴露时间和浓度是影响3种药物抑菌毒性作用的重要因素.
(2) 3种药物的混合物体系对E. coli均具有明显的时间和浓度依赖抑菌性. 二元混合物体系具有组分比依赖抑菌性,而三元体系无明显的依赖性. 所有混合物体系均无急性抑菌作用,说明BCH和TET组分的单独或混合加入,减少、掩盖或削弱了AMP的急性抑菌性. 二元和三元混合物抑菌毒性作用明显强于单个药物的,最高抑菌率可达0.9999.
(3) 3种药物的二元和三元混合物体系对E. coli的联合抑菌作用类型整体均为协同,强度随时间和浓度的增大而增大,最大协同作用强度分别为0.9849和0.9746.
(4) 在AMP、BCH、TET及其混合物体系作用下,E. coli的核酸含量均高于空白对照组,且有极显著性差异,二元及三元混合物作用后的核酸溶出量整体高于单个药物的,说明混合物会导致胞内DNA等大分子物质产生更严重的泄漏和细胞损伤;药物作用后E. coli细胞严重受损,出现了破裂、皱缩、黏连、凹陷、变长、孔洞、内溶物外泄和大小不一等现象,且部分混合物对细胞形态的作用相比单个药物有不同表现形式,对细胞形态的破坏更为严重. 这都说明3种药物的混合物导致的高核酸溶出量和更严重的细胞损伤是产生强协同作用强度和高抑菌毒性的原因之一.
-
表 1 3种药物的理化性质及其储备液浓度
Table 1. Physicochemical properties of the three drugs and their stock solution concentrations
名称Name 简称Abbreviation 分子式Molecular formula 分子量Molecular weight CAS-RN 纯度Purity 储备液/(mol·L−1)Stock solution 氨苄西林钠Ampicillin sodium AMP C16H18N3NaO4S 371.380 69-52-3 ≥98% 3.45×10−3 盐酸四环素Tetracycline hydrochloride TET C22H25ClN2O8 480.900 64-75-5 ≥98% 1.04×10−3 盐酸小檗碱Berberine chloride hydrate BCH C20H18ClNO4 371.814 141433-60-5 ≥97% 2.15×10−3 表 2 混合物体系各物质组分浓度比(pi)
Table 2. Concentration ratio of each substance component of the mixture system (pi)
AMP-BCH AMP-TET 射线Ray pAMP pBCH 射线Ray pAMP pTET R1 8.959×10−1 1.041×10−1 R1 9.187×10−1 8.127×10−2 R2 7.750×10−1 2.250×10−1 R2 8.189×10−1 1.811×10−1 R3 6.326×10−1 3.674×10−1 R3 6.933×10−1 3.067×10−1 R4 4.626×10−1 5.374×10−1 R4 5.306×10−1 4.694×10−1 R5 2.562×10−1 7.438×10−1 R5 3.114×10−1 6.886×10−1 TET-BCH AMP-BCH-TET 射线Ray pTET pBCH 射线Ray pAMP pBCH pTET R1 7.920×10−1 2.080×10−1 R1 2.546×10−1 2.831×10−1 4.623×10−1 R2 6.037×10−1 3.963×10−1 R2 3.724×10−1 4.709×10−1 1.567×10−1 R3 4.323×10−1 5.677×10−1 R3 5.388×10−1 8.558×10−2 3.757×10−1 R4 2.758×10−1 7.242×10−1 R4 5.909×10−1 2.326×10−1 4.314×10−1 R5 1.322×10−1 8.678×10−1 R5 4.943×10−1 2.871×10−1 2.186×10−1 表 3 3种药物的Weibull函数拟合结果及其统计量
Table 3. Fitting results of Weibull function for 3 drugs and their statistics
药物 Drug 时间/h Time α β RMSE r EC50/(mol·L−1) pEC50 AMP 0.25 3.41 1.63 0.023 0.9683 ∞ 0.00 2 4.17 1.45 0.037 0.9831 7.44×10−4 3.13 4 5.26 1.68 0.060 0.9728 4.48×10−4 3.35 8 6.89 2.14 0.075 0.9696 4.07×10−4 3.39 12 7.42 2.39 0.124 0.9417 5.52×10−4 3.26 BCH 0.25 0.13 12 0.057 -0.8805 ∞ 0.00 2 0.14 0.92 0.036 0.5397 ∞ 0.00 4 8.04 2.87 0.074 0.8824 1.18×10−3 2.93 8 7.33 2.14 0.075 0.9697 2.53×10−4 3.60 12 7.46 2.24 0.108 0.9496 3.21×10−4 3.49 TET 0.25 0.01 0.73 0.017 0.5919 ∞ 0.00 2 2.95 0.95 0.067 0.9067 3.23×10−4 3.49 4 5.3 1.5 0.074 0.9519 1.67×10−4 3.78 8 8.74 2.46 0.109 0.9229 1.99×10−4 3.70 12 13.36 3.8 0.142 0.8863 2.44×10−4 3.61 -
[1] WISE R. Antimicrobial resistance: Priorities for action [J]. Journal of Antimicrobial Chemotherapy, 2002, 49(4): 585-586. doi: 10.1093/jac/49.4.585 [2] 杜实之. 环境中抗生素的残留、健康风险与治理技术综述 [J]. 环境科学与技术, 2021, 44(9): 37-48. DU S Z. Research progress on antibiotic pollution, health risks and treatment technology in environments [J]. Environmental Science & Technology, 2021, 44(9): 37-48(in Chinese).
[3] 江静, 周清时. 水环境中抗生素的污染现状与分析方法 [J]. 广州化工, 2021, 49(22): 20-21,24. JIANG J, ZHOU Q S. Pollution status and analysis method of antibiotics in water environment [J]. Guangzhou Chemical Industry, 2021, 49(22): 20-21,24(in Chinese).
[4] 张东伟. 湖北典型湖库水体中抗生素残留现状及沉积物抗性基因污染特征研究[D]. 十堰: 湖北医药学院, 2022: 10-11. ZHANG D W. Research on the status of antibiotic residues in typical lakes and reservoirs in Hubei and the pollution characteristics of sediment resistance genes[D]. Shiyan: Hubei University of Medicine, 2022: 10-11 (in Chinese)
[5] CHEN K, ZHOU J L. Occurrence and behavior of antibiotics in water and sediments from the Huangpu River, Shanghai, China [J]. Chemosphere, 2014, 95: 604-612. doi: 10.1016/j.chemosphere.2013.09.119 [6] 杨俊, 王汉欣, 吴韵斐, 等. 苏州市水环境中典型抗生素污染特征及生态风险评估 [J]. 生态环境学报, 2019, 28(2): 359-368. YANG J, WANG H X, WU Y F, et al. Occurrence, distribution and risk assessment of typical antibiotics in the aquatic environment of Suzhou city [J]. Ecology and Environmental Sciences, 2019, 28(2): 359-368(in Chinese).
[7] BINH MINH T, LEUNG H W, LOI I H, et al. Antibiotics in the Hong Kong metropolitan area: Ubiquitous distribution and fate in Victoria Harbour [J]. Marine Pollution Bulletin, 2009, 58(7): 1052-1062. doi: 10.1016/j.marpolbul.2009.02.004 [8] 李经纬, 刘小燕, 王美欢, 等. 抗生素在水环境中的分布及其毒性效应研究进展 [J]. 广州化工, 2016, 44(17): 10-13. doi: 10.3969/j.issn.1001-9677.2016.17.004 LI J W, LIU X Y, WANG M H, et al. Research progress on distribution and toxicity effects of antibiotics in water environment [J]. Guangzhou Chemical Industry, 2016, 44(17): 10-13(in Chinese). doi: 10.3969/j.issn.1001-9677.2016.17.004
[9] KEERTHISINGHE T P, WANG F, WANG M J, et al. Long-term exposure to TET increases body weight of juvenile zebrafish as indicated in host metabolism and gut microbiome [J]. Environment International, 2020, 139: 105705. doi: 10.1016/j.envint.2020.105705 [10] 葛会林, 罗金辉, 智霞, 等. 环境中的抗生素与毒物兴奋效应综述 [J]. 热带作物学报, 2015, 36(9): 1719-1725. GE H L, LUO J H, ZHI X, et al. A review on hormesis and antibiotics in the environment [J]. Chinese Journal of Tropical Crops, 2015, 36(9): 1719-1725(in Chinese).
[11] YUAN J L, NI M, LIU M, et al. Occurrence of antibiotics and antibiotic resistance genes in a typical estuary aquaculture region of Hangzhou Bay, China [J]. Marine Pollution Bulletin, 2019, 138: 376-384. doi: 10.1016/j.marpolbul.2018.11.037 [12] 王桂祥, 张琼, 匡少平, 等. 环境浓度下的混合抗生素对普通小球藻的联合毒性 [J]. 生态毒理学报, 2019, 14(2): 122-128. WANG G X, ZHANG Q, KUANG S P, et al. The joint toxicity of mixed antibiotics on Chlorella vulgaris at normal environmental concentration [J]. Asian Journal of Ecotoxicology, 2019, 14(2): 122-128(in Chinese).
[13] 瞿礼萍, 唐健元, 张磊, 等. 我国中药注册分类的历史演变、现状与问题 [J]. 中国中药杂志, 2022, 47(2): 562-568. doi: 10.19540/j.cnki.cjcmm.20210817.601 QU L P, TANG J Y, ZHANG L, et al. Category of Chinese medicine registration: Historical evolution, current status, and problems [J]. China Journal of Chinese Materia Medica, 2022, 47(2): 562-568(in Chinese). doi: 10.19540/j.cnki.cjcmm.20210817.601
[14] 张相鑫, 陈进超, 孙佳静. 中药药渣作为畜禽饲料或饲料添加剂的研究进展 [J]. 饲料工业, 2017, 38(22): 57-60. ZHANG X X, CHEN J C, SUN J J. Research progress of Chinese medicine residues as animal feed or feed additives [J]. Feed Industry, 2017, 38(22): 57-60(in Chinese).
[15] 刘海席. 盐酸小檗碱防治桃褐腐菌—剂型制备及耐药性研究[D]. 北京: 北京化工大学, 2010: 25-26. LIU H X. Control of peach brown rot with berberine-preparation of dosage forms and assay for drug resistance[D]. Beijing: Beijing University of Chemical Technology, 2010: 25-26. (in Chinese)
[16] LI H, CHEN H S, SHI W N, et al. A novel use for an old drug: Resistance reversal in Candida albicans by combining dihydroartemisinin with fluconazole [J]. Future Microbiology, 2021, 16: 461-469. doi: 10.2217/fmb-2020-0148 [17] JANG J, HUR H G, SADOWSKY M J, et al. Environmental Escherichia coli: Ecology and public health implications-a review [J]. Journal of Applied Microbiology, 2017, 123(3): 570-581. doi: 10.1111/jam.13468 [18] 高珊, 张楠, 敬海明, 等. 秀丽隐杆线虫毒性研究实验室生物安全风险评估及控制 [J]. 毒理学杂志, 2015, 29(2): 148-152. GAO S, ZHANG N, JING H M, et al. Biological safety risk assessment and control of Caenorhabditis elegans toxicity research laboratory [J]. Journal of Toxicology, 2015, 29(2): 148-152(in Chinese).
[19] 尹孝仁, 朴胜春, 姜成哲, 等. 诺氟沙星和几种抗生素的联合应用效果的研究 [J]. 延边农学院学报, 1995, 17(3): 133-138. YIN X R, PIAO S C, JIANG C Z, et al. Synergistic effects of norfloxacin in combination with other antibacterial [J]. Journal of Agricultural Science Yanbian University, 1995, 17(3): 133-138(in Chinese).
[20] 曾范利, 吴胜奎, 孙江洋, 等. 5种中药对大肠杆菌的抑菌作用 [J]. 经济动物学报, 2018, 22(3): 172-176. ZENG F L, WU S K, SUN J Y, et al. Combined antibacterial effect of five traditional medicines against Escherichia coli [J]. Journal of Economic Animal, 2018, 22(3): 172-176(in Chinese).
[21] LI J M, FENG S S, LIU X, et al. Effects of traditional Chinese medicine and its active ingredients on drug-resistant bacteria [J]. Frontiers in Pharmacology, 2022, 13: 837907. doi: 10.3389/fphar.2022.837907 [22] 王盈盈, 余静, 曾红杰, 等. 磁性吸附剂CeO2/MZFS去除水中盐酸四环素 [J]. 环境科学学报, 2020, 40(9): 3250-3258. WANG Y Y, YU J, ZENG H J, et al. Adsorption of tetracycline hydrochloride by magnetic adsorbent CeO2/MZFS [J]. Acta Scientiae Circumstantiae, 2020, 40(9): 3250-3258(in Chinese).
[23] 顾桂秋. 氨苄西林钠生产新工艺及产品澄清度研究[D]. 天津: 天津大学, 2003. GU G Q. A study on the new manufacturing technology of ampicillin sodium and the clarity of the production[D]. Tianjin: Tianjin University, 2003 (in Chinese).
[24] GAO W, LI Y L, XIE W M, et al. Photocatalytic degradation of oxytetracycline using zeolite imidazole framework-8 (ZIF-8) as an effective catalyst [J]. Nano, 2022, 17(6): 2250042. doi: 10.1142/S1793292022500424 [25] LIU S S, XIAO Q F, ZHANG J, et al. Uniform design ray in the assessment of combined toxicities of multi-component mixtures [J]. Science Bulletin, 2016, 61(1): 52-58. doi: 10.1007/s11434-015-0925-6 [26] ZHANG J, LIU S S, YU Z Y, et al. The time-dependent hormetic effects of 1-alkyl-3-methylimidazolium chloride and their mixtures on Vibrio qinghaiensis sp.-Q67 [J]. Journal of Hazardous Materials, 2013, 258/259: 70-76. doi: 10.1016/j.jhazmat.2013.02.057 [27] ZHANG J, LIU S S, LIU H L. Effect of ionic liquid on the toxicity of pesticide to Vibrio-qinghaiensis sp.-Q67 [J]. Journal of Hazardous Materials, 2009, 170(2/3): 920-927. [28] 骆纵纵, 张瑾, 周娜娜, 等. 3种青霉素类抗生素对大肠杆菌的时间毒性微板分析法建立及其联合抑菌作用 [J]. 生态毒理学报, 2022, 17(2): 189-199. LUO Z Z, ZHANG J, ZHOU N N, et al. Establishment of time-dependent microplate toxicity analysis method for combined antibacterial effects of three penicillin antibiotics to Escherichia coli [J]. Asian Journal of Ecotoxicology, 2022, 17(2): 189-199(in Chinese).
[29] ZHANG J, TAO M T, SONG C C, et al. Time-dependent synergism of five-component mixture systems of aminoglycoside antibiotics to Vibrio qinghaiensis sp.-Q67 induced by a key component [J]. RSC Advances, 2020, 10(21): 12365-12372. doi: 10.1039/D0RA00915F [30] HUANG P, WANG Y, LIU S S, et al. SAHmap: Synergistic-antagonistic heatmap to evaluate the combined synergistic effect of mixtures of three pesticides on multiple endpoints of Caenorhabditis elegans [J]. Environmental Pollution, 2022, 315: 120378. doi: 10.1016/j.envpol.2022.120378 [31] 刘树深, 张瑾, 张亚辉, 等. APTox: 化学混合物毒性评估与预测 [J]. 化学学报, 2012, 70(14): 1511-1517. doi: 10.6023/A12050175 LIU S S, ZHANG J, ZHANG Y H et al. APTox: Assessment and prediction on toxicity of chemical mixtures [J]. Acta Chimica Sinica, 2012, 70(14): 1511-1517(in Chinese). doi: 10.6023/A12050175
[32] 刘树深. 化学混合物毒性评估与预测方法[M]. 北京: 科学出版社, 2017: 57-68. LIU S S. Assessment and prediction of toxicity of chemical mixtures[M]. Beijing: Science Press, 2017: 57-68(in Chinese).
[33] CHEN C Z, COOPER S L. Interactions between dendrimer biocides and bacterial membranes [J]. Biomaterials, 2002, 23(16): 3359-3368. doi: 10.1016/S0142-9612(02)00036-4 [34] 姬曼, 金良韵, 赵君朋. 一种游离细胞扫描电镜的样品制备方法 [J]. 电子显微学报, 2019, 38(1): 72-74. JI M, JIN L Y, ZHAO J P. A sample preparation technique for scanning electron microscope of free cell [J]. Journal of Chinese Electron Microscopy Society, 2019, 38(1): 72-74(in Chinese).
[35] 于海燕. 生物基两亲分子的性质研究及在药物控释中的应用[D]. 东营: 中国石油大学(华东), 2016. YU H Y. Characterization of biological amphiphilic molecules and its application in controlled release[D]. Dongying: China University of Petroleum (Huadong), 2016. (in Chinese)
[36] 马娟, 周猛, 俞小军, 等. 抗生素在污水生物脱氮除磷中的抑制效应 [J]. 中国抗生素杂志, 2019, 44(2): 179-185. MA J, ZHOU M, YU X J, et al. Inhibitory effects of antibiotics on biological nitrogen and phosphorus removal in wastewater treatment [J]. Chinese Journal of Antibiotics, 2019, 44(2): 179-185(in Chinese).
[37] 易玉玲, 宋瑱, 雍江堰, 等. 盐酸小檗碱对白色念珠菌菌态转换的影响研究 [J]. 微生物学杂志, 2019, 39(3): 51-57. YI Y L, SONG Z, YONG J Y, et al. Study of berberine hydrochloride on yeast-to-hyphae conversion of Candida albicans [J]. Journal of Microbiology, 2019, 39(3): 51-57(in Chinese).
[38] LEE S Y, KIM K B W R, LIM S I, et al. Antibacterial mechanism of Myagropsis myagroides extract on Listeria monocytogenes [J]. Food Control, 2014, 42: 23-28. doi: 10.1016/j.foodcont.2014.01.030 [39] 刘焕奇, 张友民, 潘宗海, 等. 掌控累加、协同、拮抗是关键: 家畜临床常用药物及其配伍禁忌 [J]. 中国动物保健, 2008, 10(5): 93-98. LIU H Q, ZHANG Y M, PAN Z H, et al. Control of cumulative, synergistic and antagonistic is the key——commonly used drugs and their contraindications in livestock clinical practice [J]. China Animal Health, 2008, 10(5): 93-98(in Chinese).
[40] 景春娥, 李萍, 杜欣军, 等. 盐酸小檗碱对体外阪崎克罗诺杆菌生物膜的抑制作用 [J]. 食品研究与开发, 2016, 37(17): 134-138. doi: 10.3969/j.issn.1005-6521.2016.17.033 JING C E, LI P, DU X J, et al. In vitro activity of berberine hydrochloride against Cronobacter sakazakii biofilms [J]. Food Research and Development, 2016, 37(17): 134-138(in Chinese). doi: 10.3969/j.issn.1005-6521.2016.17.033
[41] 汤淼, 曾鸿鹄, 王大力, 等. 四环素对费氏弧菌产生生毒物兴奋效应(Hormesis)的时间关系和机制 [J]. 环境化学, 2015, 34(11): 1981-1987. doi: 10.7524/j.issn.0254-6108.2015.11.2015051403 TANG M, ZENG H H, WANG D L, et al. Time dependence and mechanism of tetracycline Hormesis effects to Vibrio fischeri [J]. Environmental Chemistry, 2015, 34(11): 1981-1987(in Chinese). doi: 10.7524/j.issn.0254-6108.2015.11.2015051403
期刊类型引用(3)
1. 代碧雅,张瑾,马添翼,张静,桂一心. 三种有机杀虫剂对蛋白核小球藻的联合毒性作用及机理. 环境化学. 2025(02): 677-689 .  本站查看
本站查看
2. 桂一心,张瑾,张颖,曾健平,陈如荔. 3种N-DBPs对青海弧菌Q67的联合毒性作用及贡献度. 中国环境科学. 2024(05): 2742-2753 .  百度学术
百度学术
3. 王啸宇,张瑾,曾健平,洪桂云,张颖,赵远帆. 氨化菌分离鉴定及其对草甘膦-镉的联合毒性响应. 环境科学与技术. 2023(12): 124-133 .  百度学术
百度学术
其他类型引用(1)
-






 DownLoad:
DownLoad: