-
六溴环十二烷(HBCDs)是一种广泛使用的添加型阻燃剂. HBCDs在我国主要用于保温建筑材料发泡聚苯乙烯(EPS)和挤塑聚苯乙烯(XPS)的阻燃. 由于HBCDs具有持久性有机污染物(POPs)的特征,联合国环境规划署(UNEP)在2013年将其列入《关于持久性有机污染物的斯德哥尔摩公约》,在全球范围内禁止其生产和使用. 2016年,我国环保部等部委联合发布公告[1],自2016年12月26日起,禁止HBCDs的生产、使用和进出口,用于建筑行业的EPS和XPS享有五年的豁免权,延长至2021年12月25日. 添加HBCDs的阻燃材料在整个生命周期内会不断释放HBCDs,进入环境介质,对人体健康造成不利影响[2-5]. HBCDs停止生产和使用后,已经生产和使用的含有HBCDs的保温板材、装饰材料、纺织材料等将会在相当长的时间内成为HBCDs的污染来源.
极地地区地处偏远、气候严寒,远离工业生产和人类活动,其环境中的POPs等污染物的来源相对单一. 在全球蒸馏效应的作用下,POPs从温暖的中低纬度地区经过长距离大气迁移(LRAT)[6-9],最后沉降、汇集在高纬度的南北极或青藏高原等寒冷地区. 温暖地区的海洋环境中的POPs也会随着洋流迁移到高纬度地区[10]. 未曾使用过POPs的极地地区的环境介质和生物体内发现了POPs[11-14],为这些理论提供了证据支持.
近些年来,极地地区陆续被人类以工业生产、科学研究、旅游考察等方式开发利用,人类足迹遍布南极、北极和青藏高原,人类活动对当地生态环境的影响也开始显现. 本文分析了南极菲尔德斯半岛(Fildes Peninsula)和阿德利岛(Ardley Island)的环境和生物样品中HBCDs的污染水平和空间分布,探讨了其可能的来源,旨在为POPs的长距离大气传输及人类活动对南极环境的影响提供证据.
-
南设得兰群岛(South Shetland Islands)位于南极洲边缘的南极半岛的北部. 乔治王岛(King George Island)是南设得兰群岛中最大的岛屿,是南极科学考察站最密集的区域. 采样区域位于中国南极长城站所在的乔治王岛西部的菲尔德斯半岛、长城湾和阿德利岛. 样品分两批采集,第一批为2009—2010年南极夏季,在9个采样点(A1—A9)采集了土壤、苔藓(Sanionia uncinata)、地衣(Usnea aurantiaco-atra)、粪土、海洋沉积物等5种共24个环境和生物样品;第二批为2010—2011年南极夏季,在采样点A9采集了海草(Fucus distichus)、褐藻(Palmaria decipiens)、端足(Gammaridea)、南极蛤(Laternula marilina)、海星(Diplasterias brucei)、帽贝(Nacella concinna)、南极鳕鱼(Dissostichus eleginoides)和鱼肝脏等8种共43个生物样品. 第一批样品,采集后置于聚乙烯袋中,在-18 ℃下密封、避光保存,运输至实验室,进行冷冻干燥、研磨、过16目筛后分析. 第二批样品在南极长城站冷冻干燥处理后放入聚乙烯袋中,密封、避光在-18 ℃下保存,运输至实验室后,研磨、过16目筛后分析.
-
液相色谱-三重四极杆串联质谱仪(HPLC-MSMS)(Alliance 2695,Waters;Micromass Quattro Premier XE,Micromass);加速溶剂萃取仪(ASE 300,Dionex);总有机碳(TOC)分析仪(OI Analytical);液相色谱柱(Zorbax ODS,150 mm×3.0 mm,5.0 μm,Agilent).
农残级二氯甲烷(DCM)和正己烷购自Fisher;HPLC级甲醇和乙腈购自J. T. Baker;硅胶购自Merck;分析纯无水Na2SO4、浓H2SO4和NaOH购自北京化工厂;α-,β-,γ-HBCD(100 mg·L−1,纯度> 98%)购自AccuStandard;13C12-γ-HBCD(50 mg·L−1,纯度> 98%)和d18-γ-HBCD(50 mg·L−1,纯度> 98%)购自Wellington Laboratories.
-
样品处理和仪器分析在前期建立的方法[15]的基础上略有改动,简述如下. 土壤、粪土、沉积物取样量约10 g,地衣、苔藓约5 g,水生生物样品取样量约0.5—1 g. 样品与无水Na2SO4混匀后放入ASE萃取池中,加入替代物10 ng 13C12-γ-HBCD,用正己烷:二氯甲烷(1:1,V/V)提取. 土壤、粪土、沉积物提取后加入铜粉除硫,其余样品加入酸性硅胶除脂. 提取液浓缩至2 mL左右,转入复合硅胶柱净化,得到含有目标物的淋洗液,经浓缩和溶剂置换后,加入10 ng进样内标d18-γ-HBCD后分析.
HPLC流动相流速0.4 mL·min−1,梯度洗脱程序为:甲醇、乙腈、水的初始体积比为3:3:4,10 min内线性变为7:3:0,保持13 min后,在0.1 min内变为初始比例并保持6.9 min. 质谱用大气压化学负离子源(APCI−),离子监测模式为多反应监测(MRM). α-,β-,γ-HBCD监测离子为640.6→79.0 m/z、81.0 m/z;13C12-γ-HBCD监测离子为652.6→79.0 m/z、81.0 m/z;d18-γ-HBCD监测离子为657.6→79.0 m/z、81.0 m/z. 离子源温度:120 ℃,电晕针放电电流:3.0 μA,碰撞能量11 eV.
-
在南极采样的运输空白(无水Na2SO4,2个)和在实验室进行前处理的过程空白(无水Na2SO4,每10个样品检测一次)中均未检出HBCDs. 样品进行HPLC-MSMS分析时,每10个样品重复检测一次质控样品(10 ng·mL−1的α-,β-,γ-HBCD混合物标准品),检测结果的相对标准偏差(RSD)<20%(n = 7). 空白样品的3倍信噪比(S/N)为方法检出限(MDLs),α-,β-,γ-HBCD的检出限分别为0.2、0.08、0.08 ng·g−1;替代内标的回收率为77% ± 16%(n = 67).
-
菲尔德斯半岛和阿德利岛的采样信息和样品检测结果见表1. 土壤、粪土和海洋沉积物样品中全部检出HBCDs,浓度范围分别为7.10—792(平均157)pg·g−1 dw、113—181(平均151)pg·g−1 dw和41 pg·g−1 dw. 苔藓和地衣样品也全部检出,浓度范围分别为102—951(平均353)pg·g−1 dw和23.4—106(平均44.8)pg·g−1 dw. 褐藻和海草中HBCDs的浓度分别为<LOD—5977(平均1732)pg·g−1 dw和<LOD—4082(平均838)pg·g−1 dw,平均值高于苔藓、地衣、土壤、粪土和海洋沉积物样品. 水生动物样品中HBCDs浓度以脂肪重计算. 帽贝的检出率较高,10个样品有9个检出,浓度范围为<LOD—15.4(平均6.17)ng·g−1 lw;80%的海星样品检出了HBCDs,浓度范围为<LOD—43.3(平均15.0)ng·g−1 lw;60%的端足检出了HBCDs,浓度范围为<LOD—43.8(平均14.5)ng·g−1 lw;南极蛤的HBCDs浓度范围为<LOD—37.8(平均18.9)ng·g−1 lw;鱼肉样品HBCDs浓度范围为<LOD—10.2(平均2.46)ng·g−1 lw.
一些研究报导了HBCDs生产工厂附近、工业区、农业区和城市等不同区域土壤中HBCDs的污染状况[15-19]. 在HBCDs生产或使用的工厂附近,土壤中HBCDs浓度通常达到数百到数千ng·g−1 dw;城市商业区和住宅区的浓度约为几十ng·g−1 dw;农业区或偏远地区的浓度水平通常较低. 关于极地地区土壤中HBCDs的研究报导十分有限,一项关于青藏高原土壤[20]的研究中,未检出HBCDs. 本研究发现,南极菲尔德斯半岛和阿德利岛土壤中HBCDs的最高浓度为792 pg·g−1 dw,略低于农业区和偏远地区,平均污染水平与我国崇明岛的农业土壤[21]、我国西部四川省的土壤[22]、重庆郊区的土壤[23]和印度尼西亚、柬埔寨等国家的对照区土壤[19]的污染水平相当.
苔藓和地衣在高山、极地等地区分布广泛,是良好的大气中持久性有机污染物的生物指示物,被广泛用于偏远地区大气中多环芳烃(PAHs)、有机氯农药(OCPs)、多氯代二苯并二噁英和呋喃(PCDD/Fs)、多氯联苯(PCBs)、多溴二苯醚(PBDEs)等POPs的研究[24-25]. 然而,苔藓和地衣中HBCDs的研究非常少见. Zhu等 [20]对青藏高原的苔藓和地衣的研究发现,62%的地衣样品中检出了HBCDs,平均浓度为 0.14 ng·g−1 dm. Kim 等[14]研究发现,南设得兰群岛的苔藓中HBCDs浓度为 0.63—960 pg·g−1 dw,地衣中的浓度为 0.1—21.1 pg·g−1 dw. 本研究的苔藓和地衣样品全部检出了HBCDs,浓度范围分别为102—951 pg·g−1 dw 和23.4—106 pg·g−1 dw,与青藏高原和南设得兰群岛的水平相当.
海洋生物样品中,鱼、海星、甲壳动物端足、软体动物南极蛤和帽贝中HBCDs总的检出率为68%,平均浓度在2.46—18.9 ng·g−1 lw(0.17—0.82 ng·g−1 dw)之间,各类样品的污染水平相近. Kim等[26]对与南极巴顿半岛(Barton Peninsula)和麦克斯韦尔海湾(Maxwell Bay)的海洋生物研究发现,帽贝中HBCDs的浓度为0.15—20.7 ng·g−1 lw,端足为0.291—0.449 ng·g−1 lw,南极鳕鱼和冰鱼为3.73 ng·g−1 lw,与本研究结果在同一浓度水平. Zhu等[13]对青藏高原的湖泊和河流中鱼类的研究发现,鱼肉中HBCDs的检出率为66%,平均浓度为2.12 ng·g−1 lw,与本研究的浓度水平相近. Tomy等[11]对北极海洋食物网的研究发现,虾样品中HBCDs平均浓度为1.9 ng·g−1 lw,蛤为未检出至1.4 ng·g−1 lw,低于本研究中南极蛤和帽贝的平均水平. 总体上看,极地海洋动物中HBCDs的污染水平与一些大陆周边海域和淡水生物相比,如挪威峡湾的水生生物、日本沿海水域的贻贝[27-29]、北海的海星[3]、荷兰Scheldt河口和中国淡水中的虾[30-31]和挪威峡湾的鱼类[32],低2—3个数量级. 水生植物样品褐藻和海草的分析结果在意料之外,本研究的67个样品中,前4个高浓度结果均来自水生植物-3个褐藻样品(5977 pg·g−1 dw、2977 pg·g−1 dw、2724 pg·g−1 dw)和1个海草样品(4082 pg·g−1 dw),褐藻样品之间和海草样品之间的浓度差异达到3个数量级,目前还不清楚造成这种差异的原因,也未见相关的文献报导.
-
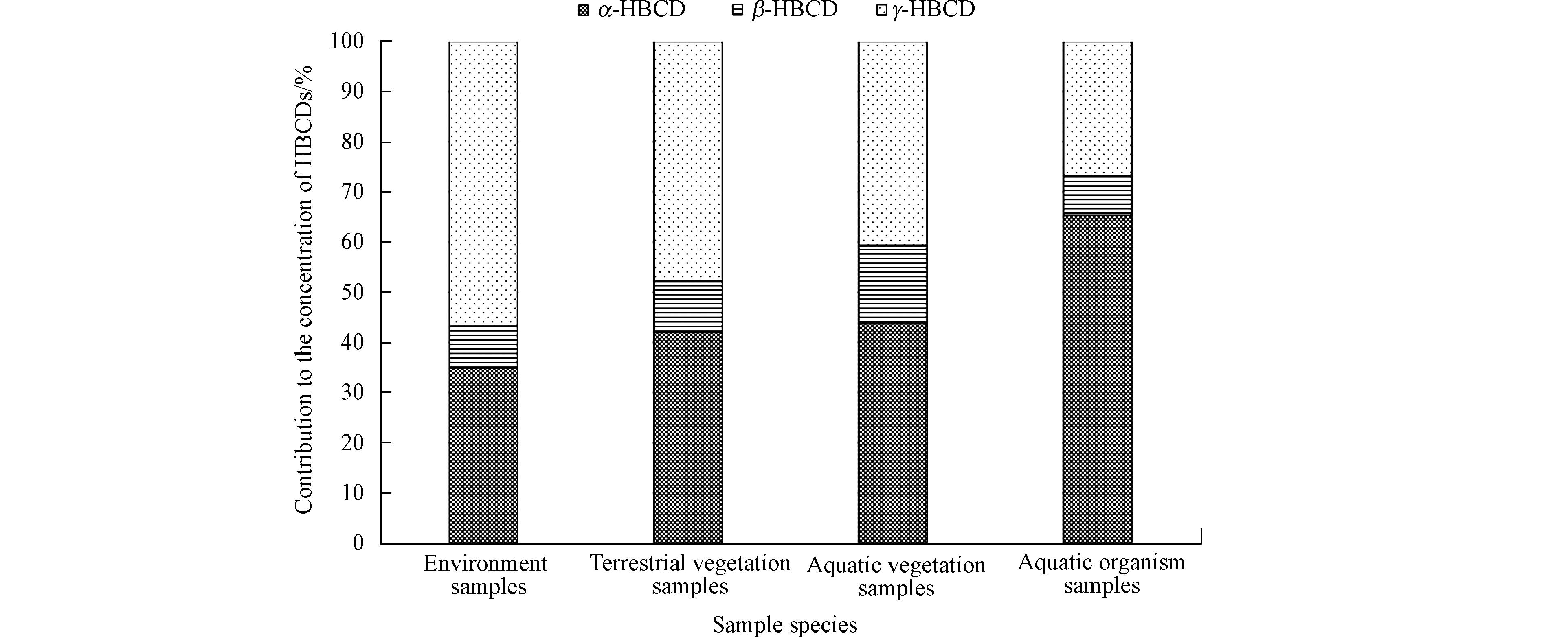
HBCDs是一种人工合成的工业品. 技术型HBCDs中γ-HBCD是主体,约占75%—89%,α-、β-HBCD的比例较低[33]. 3种异构体的结构和性质不同,在生产加工和环境迁移中会发生异构体重排、组织特异性吸收等过程,使其组成比例发生变化. HBCDs有较高的辛醇-水分配系数(lgKow = 5.6)[2],亲脂性强,容易吸附在环境有机质、富集在生物体的脂肪组织中. 在本文中,将已检出的样品分为4组,土壤、粪土和海洋沉积物(n = 11)为环境样品组,苔藓和地衣(n = 13)为陆生植物组,海草和褐藻(n = 7)为水生植物组,端足、南极蛤、海星、帽贝和鱼(n = 21)为水生动物组. 各组样品中α-、β-、γ-HBCD的异构体浓度取平均值,绘制如图1所示的异构体组成图. 对4类样品中HBCDs浓度和TOC/lw进行Spearman相关性分析,结果列于表2.
由图1可见,γ-HBCD的比例从环境样品到陆生植物、水生植物、水生动物逐渐递减,而α-HBCD 则正相反,环境样品中比例最低,陆生植物样品和水生植物样品中比例逐渐增加,水生动物样品中比例最高. 环境样品中γ-、α-、β-HBCD异构体的平均组成为57%、35%和8%,与技术型HBCDs的比例最接近. 环境样品中ƩHBCDs浓度与γ-HBCD浓度显著相关(r = 0.96,P<0.001). 而水生动物样品的平均组成与HBCDs产品差异较大,γ-、α-、β-HBCD分别占27%、65%和8%,ƩHBCDs浓度与α-HBCD浓度显著相关(r = 0.63,P = 0.002). 陆生植物和水生植物中γ-HBCD的比例居中,分别为48%和41%,2类样品中ƩHBCDs浓度与γ-HBCD浓度均为显著相关(r = 0.92,P<0.001;r = 0.86,P= 0.014). 这一结果与Eguchi[19]、Li[15]、Braune[34]、Haukås[28]等对环境和水生动物的研究结果一致.
表2给出了HBCDs浓度与TOC/lw的相关性分析结果. 结果表明,环境样品、陆生植物样品、水生植物样品的总有机碳浓度/脂肪浓度与HBCDs和3种异构体的浓度没有显著相关性,而水生动物样品中α-HBCD 浓度与脂肪含量显著相关(r = 0.47,P = 0.033). 这说明,总有机碳浓度/脂肪浓度对环境样品、陆生植物、水生植物中HBCDs的污染水平影响不显著. 而对于水生动物来说,脂肪更容易富集HBCDs,污染水平可能会更高. 这一研究结果与文献报导的在生物脂肪中发现高浓度的HBCDs[35-37]的结果一致.
-
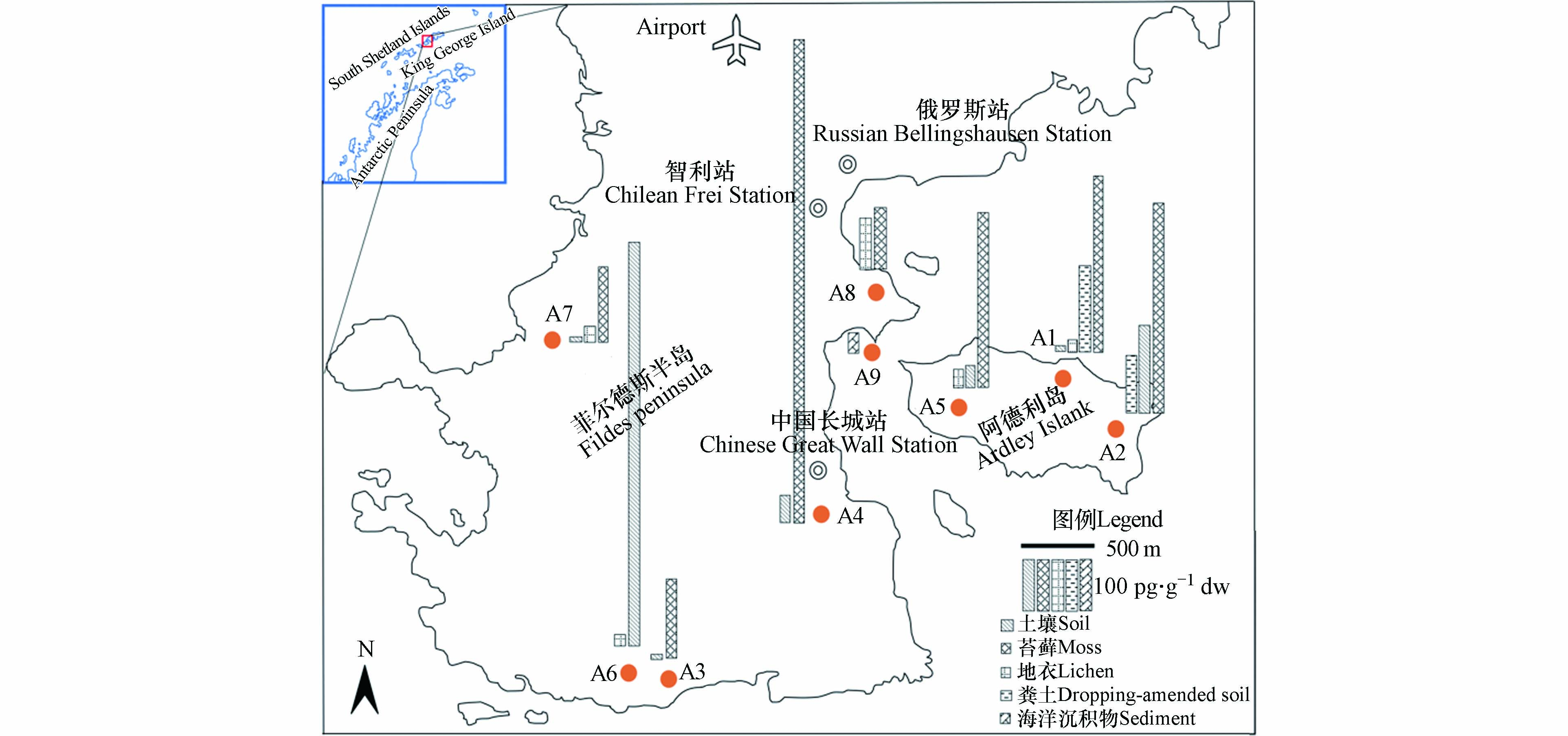
HBCDs在菲尔德斯半岛和阿德利岛的空间分布见图2. 由图2可见,5种样品中,苔藓的污染水平较高,最高浓度(951 pg·g−1 dw)位于长城站附近的A4采样点,半岛的其他3个点A3、A7、A8的浓度略低于阿德利岛的3个采样点浓度. 对于土壤样品,菲尔德斯半岛南端的A6采样点浓度(792 pg·g−1 dw)明显高于其他采样点. 对于地衣样品,菲尔德斯半岛和阿德利岛两个采样区域的浓度差异不大,均低于110 pg·g−1 dw.
南北极、青藏高原等偏远的极地地区远离人类活动,环境中POPs等污染物主要来自长距离大气传输等的输入,浓度水平通常较低[38−40]. 本文的研究结果显示,菲尔德斯半岛和阿德利岛的HBCDs整体污染水平较低,然而,在空间分布上仍然存在着明显的差异. 菲尔德斯半岛从北向南依次建有机场、俄罗斯科考站、智利科考站和中国长城站等人工建筑和设施,是人类活动较频繁的区域. 半岛上各采样点的苔藓样品中,HBCDs的浓度差异较大,紧临长城科考站的A4采样点,HBCDs浓度处于较高水平,其他点较低. 而HBCDs在阿德利岛上的分布与菲尔德斯半岛不同,3个采样点的苔藓样品中HBCDs的浓度十分接近,没有明显差异. 这可能与阿德利岛的位置相对独立、没有机场、科考站等人工设施,人类活动影响较少有关.
作为重要的添加型阻燃剂,HBCDs在上个世纪80年代后期开始工业化生产并在建材、家居用品、纺织材料、电子电器等产品中广泛使用. HBCDs在室内空气、灰尘和车内空气中的大量检出[4-5, 41-42],证实了这些阻燃产品在使用过程中会不断向环境释放HBCDs,成为重要的污染来源. 科考站附近苔藓中HBCDs浓度较高,表明科考站的人类活动,如HBCDs阻燃建筑材料和家居用品等的使用造成了HBCDs的污染水平升高.
-
HBCDs在南极菲尔德斯半岛和阿德利岛的环境样品、陆生植物、水生植物、水生动物样品中全部检出. γ-HBCD所占比例从环境样品到陆生植物、水生植物和水生动物样品呈现逐渐下降的趋势. 水生动物样品中α-HBCD浓度与脂肪含量显著正相关. HBCDs在南极环境中以低浓度水平普遍存在和差异性空间分布,为HBCDs的长距离大气传输提供了证据,同时也表明,当地的人类活动是HBCDs的来源之一.
致谢 感谢国家海洋局极地考察办公室在第26次、第27次南极科学考察期间给予的帮助.
六溴环十二烷(HBCDs)在南极菲尔德斯半岛和阿德利岛的分布
Distribution of hexabromocyclododecanes (HBCDs) in Fildes Peninsula and Ardley Island, Antarctica
-
摘要: 2016年,六溴环十二烷(HBCDs)开始在全球禁止使用后,用它加工生产的阻燃材料的释放可能是其重要的污染来源. 本文用液相色谱-三重四极杆串联质谱分析了南极菲尔德斯半岛和阿德利岛的环境和生物样品中的α-,β-,γ-HBCD. HBCDs在土壤、粪土(企鹅粪土层)和海洋沉积物中全部检出,浓度范围为7.10—792 pg·g−1 dw(干重)。其中,苔藓和地衣中的浓度范围为23.4—951 pg·g−1 dw,海草和褐藻中浓度范围为<LOD(检出限)—5977 pg·g−1 dw,水生动物样品浓度为<LOD—43.8 ng·g−1 lw(脂肪重). γ-HBCD的比例从环境样品到陆生植物、水生植物、水生动物样品逐渐递减. 水生动物样品中α-HBCD浓度与脂肪含量显著相关. 中国长城站附近的苔藓样品中HBCDs浓度较高,表明人类活动可能是HBCDs的重要来源.Abstract: The release from flame retardant materials containing hexabromocyclododecanes (HBCDs) may be the important sources since HBCDs have been phased out globally in 2016. In this study, α-, β-, γ-HBCD in the environment and biota samples from Fildes Peninsula and Ardley Island in Antarctica were investigated using a high performance liquid chromatography coupled to a triple quadrupole mass spectrometer (HPLC-MSMS). Total HBCD concentrations were in ranges of 7.10—792 pg·g−1 dw (dry weight) in soil, dropping-amended soil and sediment samples, 23.4—951 pg·g−1 dw in moss and lichen samples, <LOD—5977 pg·g−1 dw in sea grass and brown seaweed samples, and <LOD—43.8 ng·g−1 lw (lipid weight) in aquatic organism samples, respectively. A decreasing trend of γ-HBCD contribution was observed from environment samples to terrestrial vegetation samples, aquatic vegetation samples, and aquatic organism samples. The concentrations of α-HBCD in aquatic organism samples were significantly correlated with the lipid contents. High HBCD contamination was found in the moss sample collected from the site near the Chinese Great Wall Station, which indicated that anthropogenic activities might be the important in of HBCDs in the local environment.
-
Key words:
- HBCDs /
- Antarctica /
- soil /
- biota.
-
六溴环十二烷(HBCDs)是一种广泛使用的添加型阻燃剂. HBCDs在我国主要用于保温建筑材料发泡聚苯乙烯(EPS)和挤塑聚苯乙烯(XPS)的阻燃. 由于HBCDs具有持久性有机污染物(POPs)的特征,联合国环境规划署(UNEP)在2013年将其列入《关于持久性有机污染物的斯德哥尔摩公约》,在全球范围内禁止其生产和使用. 2016年,我国环保部等部委联合发布公告[1],自2016年12月26日起,禁止HBCDs的生产、使用和进出口,用于建筑行业的EPS和XPS享有五年的豁免权,延长至2021年12月25日. 添加HBCDs的阻燃材料在整个生命周期内会不断释放HBCDs,进入环境介质,对人体健康造成不利影响[2-5]. HBCDs停止生产和使用后,已经生产和使用的含有HBCDs的保温板材、装饰材料、纺织材料等将会在相当长的时间内成为HBCDs的污染来源.
极地地区地处偏远、气候严寒,远离工业生产和人类活动,其环境中的POPs等污染物的来源相对单一. 在全球蒸馏效应的作用下,POPs从温暖的中低纬度地区经过长距离大气迁移(LRAT)[6-9],最后沉降、汇集在高纬度的南北极或青藏高原等寒冷地区. 温暖地区的海洋环境中的POPs也会随着洋流迁移到高纬度地区[10]. 未曾使用过POPs的极地地区的环境介质和生物体内发现了POPs[11-14],为这些理论提供了证据支持.
近些年来,极地地区陆续被人类以工业生产、科学研究、旅游考察等方式开发利用,人类足迹遍布南极、北极和青藏高原,人类活动对当地生态环境的影响也开始显现. 本文分析了南极菲尔德斯半岛(Fildes Peninsula)和阿德利岛(Ardley Island)的环境和生物样品中HBCDs的污染水平和空间分布,探讨了其可能的来源,旨在为POPs的长距离大气传输及人类活动对南极环境的影响提供证据.
1. 材料与方法(Materials and methods)
1.1 样品的采集和制备
南设得兰群岛(South Shetland Islands)位于南极洲边缘的南极半岛的北部. 乔治王岛(King George Island)是南设得兰群岛中最大的岛屿,是南极科学考察站最密集的区域. 采样区域位于中国南极长城站所在的乔治王岛西部的菲尔德斯半岛、长城湾和阿德利岛. 样品分两批采集,第一批为2009—2010年南极夏季,在9个采样点(A1—A9)采集了土壤、苔藓(Sanionia uncinata)、地衣(Usnea aurantiaco-atra)、粪土、海洋沉积物等5种共24个环境和生物样品;第二批为2010—2011年南极夏季,在采样点A9采集了海草(Fucus distichus)、褐藻(Palmaria decipiens)、端足(Gammaridea)、南极蛤(Laternula marilina)、海星(Diplasterias brucei)、帽贝(Nacella concinna)、南极鳕鱼(Dissostichus eleginoides)和鱼肝脏等8种共43个生物样品. 第一批样品,采集后置于聚乙烯袋中,在-18 ℃下密封、避光保存,运输至实验室,进行冷冻干燥、研磨、过16目筛后分析. 第二批样品在南极长城站冷冻干燥处理后放入聚乙烯袋中,密封、避光在-18 ℃下保存,运输至实验室后,研磨、过16目筛后分析.
1.2 主要仪器、试剂和标准品
液相色谱-三重四极杆串联质谱仪(HPLC-MSMS)(Alliance 2695,Waters;Micromass Quattro Premier XE,Micromass);加速溶剂萃取仪(ASE 300,Dionex);总有机碳(TOC)分析仪(OI Analytical);液相色谱柱(Zorbax ODS,150 mm×3.0 mm,5.0 μm,Agilent).
农残级二氯甲烷(DCM)和正己烷购自Fisher;HPLC级甲醇和乙腈购自J. T. Baker;硅胶购自Merck;分析纯无水Na2SO4、浓H2SO4和NaOH购自北京化工厂;α-,β-,γ-HBCD(100 mg·L−1,纯度> 98%)购自AccuStandard;13C12-γ-HBCD(50 mg·L−1,纯度> 98%)和d18-γ-HBCD(50 mg·L−1,纯度> 98%)购自Wellington Laboratories.
1.3 样品处理和仪器分析
样品处理和仪器分析在前期建立的方法[15]的基础上略有改动,简述如下. 土壤、粪土、沉积物取样量约10 g,地衣、苔藓约5 g,水生生物样品取样量约0.5—1 g. 样品与无水Na2SO4混匀后放入ASE萃取池中,加入替代物10 ng 13C12-γ-HBCD,用正己烷:二氯甲烷(1:1,V/V)提取. 土壤、粪土、沉积物提取后加入铜粉除硫,其余样品加入酸性硅胶除脂. 提取液浓缩至2 mL左右,转入复合硅胶柱净化,得到含有目标物的淋洗液,经浓缩和溶剂置换后,加入10 ng进样内标d18-γ-HBCD后分析.
HPLC流动相流速0.4 mL·min−1,梯度洗脱程序为:甲醇、乙腈、水的初始体积比为3:3:4,10 min内线性变为7:3:0,保持13 min后,在0.1 min内变为初始比例并保持6.9 min. 质谱用大气压化学负离子源(APCI−),离子监测模式为多反应监测(MRM). α-,β-,γ-HBCD监测离子为640.6→79.0 m/z、81.0 m/z;13C12-γ-HBCD监测离子为652.6→79.0 m/z、81.0 m/z;d18-γ-HBCD监测离子为657.6→79.0 m/z、81.0 m/z. 离子源温度:120 ℃,电晕针放电电流:3.0 μA,碰撞能量11 eV.
1.4 质量控制
在南极采样的运输空白(无水Na2SO4,2个)和在实验室进行前处理的过程空白(无水Na2SO4,每10个样品检测一次)中均未检出HBCDs. 样品进行HPLC-MSMS分析时,每10个样品重复检测一次质控样品(10 ng·mL−1的α-,β-,γ-HBCD混合物标准品),检测结果的相对标准偏差(RSD)<20%(n = 7). 空白样品的3倍信噪比(S/N)为方法检出限(MDLs),α-,β-,γ-HBCD的检出限分别为0.2、0.08、0.08 ng·g−1;替代内标的回收率为77% ± 16%(n = 67).
2. 结果与讨论(Results and discussion)
2.1 HBCDs的总体水平
菲尔德斯半岛和阿德利岛的采样信息和样品检测结果见表1. 土壤、粪土和海洋沉积物样品中全部检出HBCDs,浓度范围分别为7.10—792(平均157)pg·g−1 dw、113—181(平均151)pg·g−1 dw和41 pg·g−1 dw. 苔藓和地衣样品也全部检出,浓度范围分别为102—951(平均353)pg·g−1 dw和23.4—106(平均44.8)pg·g−1 dw. 褐藻和海草中HBCDs的浓度分别为<LOD—5977(平均1732)pg·g−1 dw和<LOD—4082(平均838)pg·g−1 dw,平均值高于苔藓、地衣、土壤、粪土和海洋沉积物样品. 水生动物样品中HBCDs浓度以脂肪重计算. 帽贝的检出率较高,10个样品有9个检出,浓度范围为<LOD—15.4(平均6.17)ng·g−1 lw;80%的海星样品检出了HBCDs,浓度范围为<LOD—43.3(平均15.0)ng·g−1 lw;60%的端足检出了HBCDs,浓度范围为<LOD—43.8(平均14.5)ng·g−1 lw;南极蛤的HBCDs浓度范围为<LOD—37.8(平均18.9)ng·g−1 lw;鱼肉样品HBCDs浓度范围为<LOD—10.2(平均2.46)ng·g−1 lw.
表 1 南极菲尔德斯半岛和阿德利岛采样信息和样品中HBCDs浓度Table 1. The sampling details and concentrations of HBCDs in the samples from Fildes Peninsula and Ardley Island编号No. 采样点Sampling sites 经纬度Longitude and latitude 样品类型Species 检出数/样品数Detection number/Sample number TOC/lw/% α-HBCD β-HBCD γ-HBCD ƩHBCDs 回收率/%Recovery A1 灯塔 62°12'37"S58°55'37"W 土壤 1/1 7.11 n.d. n.d. 7.10 7.10 71 粪土 2/2 54.3 ± 2.30 58.9 ± 26.7 12.0 ± 2.30 98.4 ± 12.2 169 ± 16.8 54 ± 3 苔藓 2/2 2.44 ± 0.11 173 ± 245 31.0 ± 43.8 145 ± 60.5 349 ± 350 65 ± 13 地衣 1/1 1.45 n.d. n.d. 27.1 27.1 97 A2 阿德利岛 62º12'50"S58º55'13"W 粪土 1/1 34.0 29.6 n.d. 83.6 113 82 土壤 1/1 6.85 44.3 20.0 108 173 62 苔藓 1/1 2.43 188 77.0 142 407 83 A3 碧玉滩 62º13'48"S 土壤 1/1 0.48 n.d. n.d. 9.60 9.60 72 58º59'07"W 苔藓 1/1 2.71 92.5 n.d. 65.3 158 61 A4 八达岭 62º13'12"S 土壤 1/1 0.33 n.d. 11.3 51.0 62.3 65 58º57'48"W 苔藓 1/1 1.68 407 97.3 447 951 55 A5 月牙湖 62º12'45"S58º56'26"W 土壤 1/1 20.0 15.8 n.d. 27.1 42.9 62 苔藓 1/1 2.40 46.4 42.2 254 343 64 地衣 1/1 0.96 n.d. n.d. 36.9 36.9 71 A6 香蕉山 62º13'45"S 土壤 1/1 2.45 347 78.4 367 792 98 58º59'29"W 地衣 1/1 1.21 n.d. n.d. 23.4 23.4 91 A7 海豹湾 62º12'30"S58º59'59"W 土壤 1/1 0.40 n.d. n.d. 11.8 11.8 94 地衣 1/1 2.95 n.d. n.d. 30.7 30.7 57 苔藓 1/1 1.47 72.4 17.0 54.8 144 66 A8 半边山 62º12'19"S 地衣 1/1 2.01 61.0 9.90 34.9 106 68 58º57'17"W 苔藓 1/1 1.34 70.0 n.d. 53.0 123 93 A9 长城湾 62º12'35"S58º57'24"W 海洋沉积物 1/1 1.32 n.d. n.d. 41.0 41.0 53 海草 2/5 4.68 ± 1.64 549 ± 1229 154 ± 343 135 ± 246 838 ± 1814 92 ± 13 褐藻 5/7 0.49 ± 0.15 631 ± 897 250 ± 321 852 ± 1394 1732 ± 2277 85 ± 13 端足 3/5 3.41 ± 2.32 8.77 ± 19.6 4.36 ± 7.98 1.39 ± 3.12 14.5 ± 18.1 83 ± 11 南极蛤 1/2 2.24 ± 0.41 5.99 ± 8.48 1.89 ± 2.68 11.0 ± 15.6 18.9 ± 26.7 95 ± 18 海星 4/5 4.61 ± 2.11 9.26 ± 19.1 n.d. 5.72 ± 11.2 15.0 ± 18.9 82 ± 22 帽贝 9/10 13.5 ± 3.50 5.47 ± 4.96 n.d. 0.70 ± 1.63 6.17 ± 4.33 71 ± 15 鱼肉 3/8 8.17 ± 2.99 0.58 ± 1.63 0.56 ± 1.59 1.32 ± 2.14 2.46 ± 3.85 83 ± 5 鱼肝脏 1/1 5.88 8.75 n.d. 3.19 11.9 82 注:土壤、粪土、海洋沉积物、苔藓、地衣、海草、褐藻样品中HBCDs的浓度单位为pg·g−1 dw,其他样品浓度单位为ng·g−1 lw;样品数量>1的浓度数据和回收率数据为平均值±标准偏差(SD);ƩHBCDs为α-、β-、γ-HBCD浓度之和;n.d.,未检出. Note: The unit of HBCD concentration was pg·g−1 dw in soil, dropping-amended soil, sediment moss, lichen, sea grass and brown seaweed samples, and ng·g−1 lw in other samples; Concentrations and recoveries were expressed as mean ± SD when the sample number>1; ƩHBCDs means the sum of α-、β- and γ-HBCD; n.d.,not detected. 一些研究报导了HBCDs生产工厂附近、工业区、农业区和城市等不同区域土壤中HBCDs的污染状况[15-19]. 在HBCDs生产或使用的工厂附近,土壤中HBCDs浓度通常达到数百到数千ng·g−1 dw;城市商业区和住宅区的浓度约为几十ng·g−1 dw;农业区或偏远地区的浓度水平通常较低. 关于极地地区土壤中HBCDs的研究报导十分有限,一项关于青藏高原土壤[20]的研究中,未检出HBCDs. 本研究发现,南极菲尔德斯半岛和阿德利岛土壤中HBCDs的最高浓度为792 pg·g−1 dw,略低于农业区和偏远地区,平均污染水平与我国崇明岛的农业土壤[21]、我国西部四川省的土壤[22]、重庆郊区的土壤[23]和印度尼西亚、柬埔寨等国家的对照区土壤[19]的污染水平相当.
苔藓和地衣在高山、极地等地区分布广泛,是良好的大气中持久性有机污染物的生物指示物,被广泛用于偏远地区大气中多环芳烃(PAHs)、有机氯农药(OCPs)、多氯代二苯并二噁英和呋喃(PCDD/Fs)、多氯联苯(PCBs)、多溴二苯醚(PBDEs)等POPs的研究[24-25]. 然而,苔藓和地衣中HBCDs的研究非常少见. Zhu等 [20]对青藏高原的苔藓和地衣的研究发现,62%的地衣样品中检出了HBCDs,平均浓度为 0.14 ng·g−1 dm. Kim 等[14]研究发现,南设得兰群岛的苔藓中HBCDs浓度为 0.63—960 pg·g−1 dw,地衣中的浓度为 0.1—21.1 pg·g−1 dw. 本研究的苔藓和地衣样品全部检出了HBCDs,浓度范围分别为102—951 pg·g−1 dw 和23.4—106 pg·g−1 dw,与青藏高原和南设得兰群岛的水平相当.
海洋生物样品中,鱼、海星、甲壳动物端足、软体动物南极蛤和帽贝中HBCDs总的检出率为68%,平均浓度在2.46—18.9 ng·g−1 lw(0.17—0.82 ng·g−1 dw)之间,各类样品的污染水平相近. Kim等[26]对与南极巴顿半岛(Barton Peninsula)和麦克斯韦尔海湾(Maxwell Bay)的海洋生物研究发现,帽贝中HBCDs的浓度为0.15—20.7 ng·g−1 lw,端足为0.291—0.449 ng·g−1 lw,南极鳕鱼和冰鱼为3.73 ng·g−1 lw,与本研究结果在同一浓度水平. Zhu等[13]对青藏高原的湖泊和河流中鱼类的研究发现,鱼肉中HBCDs的检出率为66%,平均浓度为2.12 ng·g−1 lw,与本研究的浓度水平相近. Tomy等[11]对北极海洋食物网的研究发现,虾样品中HBCDs平均浓度为1.9 ng·g−1 lw,蛤为未检出至1.4 ng·g−1 lw,低于本研究中南极蛤和帽贝的平均水平. 总体上看,极地海洋动物中HBCDs的污染水平与一些大陆周边海域和淡水生物相比,如挪威峡湾的水生生物、日本沿海水域的贻贝[27-29]、北海的海星[3]、荷兰Scheldt河口和中国淡水中的虾[30-31]和挪威峡湾的鱼类[32],低2—3个数量级. 水生植物样品褐藻和海草的分析结果在意料之外,本研究的67个样品中,前4个高浓度结果均来自水生植物-3个褐藻样品(5977 pg·g−1 dw、2977 pg·g−1 dw、2724 pg·g−1 dw)和1个海草样品(4082 pg·g−1 dw),褐藻样品之间和海草样品之间的浓度差异达到3个数量级,目前还不清楚造成这种差异的原因,也未见相关的文献报导.
2.2 HBCDs异构体的组成和相关性分析
HBCDs是一种人工合成的工业品. 技术型HBCDs中γ-HBCD是主体,约占75%—89%,α-、β-HBCD的比例较低[33]. 3种异构体的结构和性质不同,在生产加工和环境迁移中会发生异构体重排、组织特异性吸收等过程,使其组成比例发生变化. HBCDs有较高的辛醇-水分配系数(lgKow = 5.6)[2],亲脂性强,容易吸附在环境有机质、富集在生物体的脂肪组织中. 在本文中,将已检出的样品分为4组,土壤、粪土和海洋沉积物(n = 11)为环境样品组,苔藓和地衣(n = 13)为陆生植物组,海草和褐藻(n = 7)为水生植物组,端足、南极蛤、海星、帽贝和鱼(n = 21)为水生动物组. 各组样品中α-、β-、γ-HBCD的异构体浓度取平均值,绘制如图1所示的异构体组成图. 对4类样品中HBCDs浓度和TOC/lw进行Spearman相关性分析,结果列于表2.
由图1可见,γ-HBCD的比例从环境样品到陆生植物、水生植物、水生动物逐渐递减,而α-HBCD 则正相反,环境样品中比例最低,陆生植物样品和水生植物样品中比例逐渐增加,水生动物样品中比例最高. 环境样品中γ-、α-、β-HBCD异构体的平均组成为57%、35%和8%,与技术型HBCDs的比例最接近. 环境样品中ƩHBCDs浓度与γ-HBCD浓度显著相关(r = 0.96,P<0.001). 而水生动物样品的平均组成与HBCDs产品差异较大,γ-、α-、β-HBCD分别占27%、65%和8%,ƩHBCDs浓度与α-HBCD浓度显著相关(r = 0.63,P = 0.002). 陆生植物和水生植物中γ-HBCD的比例居中,分别为48%和41%,2类样品中ƩHBCDs浓度与γ-HBCD浓度均为显著相关(r = 0.92,P<0.001;r = 0.86,P= 0.014). 这一结果与Eguchi[19]、Li[15]、Braune[34]、Haukås[28]等对环境和水生动物的研究结果一致.
表2给出了HBCDs浓度与TOC/lw的相关性分析结果. 结果表明,环境样品、陆生植物样品、水生植物样品的总有机碳浓度/脂肪浓度与HBCDs和3种异构体的浓度没有显著相关性,而水生动物样品中α-HBCD 浓度与脂肪含量显著相关(r = 0.47,P = 0.033). 这说明,总有机碳浓度/脂肪浓度对环境样品、陆生植物、水生植物中HBCDs的污染水平影响不显著. 而对于水生动物来说,脂肪更容易富集HBCDs,污染水平可能会更高. 这一研究结果与文献报导的在生物脂肪中发现高浓度的HBCDs[35-37]的结果一致.
表 2 4类样品中HBCD异构体浓度与TOC/lw的Spearman相关性分析Table 2. Spearman correlation analysis between the concentrations of HBCD isomers and TOC/lw in the four sample species样品种类Sample species 变量Variables TOC/lw α-HBCD β-HBCD γ-HBCD ƩHBCDs 环境样品(n = 11) TOC/lw 1 0.60 0.09 0.35 0.41 α-HBCD 1 0.75** 0.87** 0.93** β-HBCD 1 0.84** 0.85** γ-HBCD 1 0.96** ƩHBCDs 1 陆生植物(n = 13) TOC/lw 1 0.18 0.14 0.37 0.31 α-HBCD 1 0.77** 0.71** 0.92** β-HBCD 1 0.74** 0.84** γ-HBCD 1 0.92** ƩHBCDs 1 水生植物(n = 7) TOC/lw 1 0.45 0.59 0.39 0.39 α-HBCD 1 0.82* 0.60 0.81* β-HBCD 1 0.82* 0.85* γ-HBCD 1 0.86* ƩHBCDs 1 水生动物(n = 21) TOC/lw 1 0.47* −0.53* −0.22 0.35 α-HBCD 1 −0.42 −0.66** 0.63** β-HBCD 1 0.30 −0.04 γ-HBCD 1 −0.18 ƩHBCDs 1 * 置信度(双测)为 0.05 时,显著相关;** 置信度(双测)为 0.01 时,显著相关. * Significant correlation at the 0.05 level (two-tailed); **Significant correlation at the 0.01 level (two-tailed). 2.3 HBCDs在菲尔德斯半岛和阿德利岛的分布和可能的来源
HBCDs在菲尔德斯半岛和阿德利岛的空间分布见图2. 由图2可见,5种样品中,苔藓的污染水平较高,最高浓度(951 pg·g−1 dw)位于长城站附近的A4采样点,半岛的其他3个点A3、A7、A8的浓度略低于阿德利岛的3个采样点浓度. 对于土壤样品,菲尔德斯半岛南端的A6采样点浓度(792 pg·g−1 dw)明显高于其他采样点. 对于地衣样品,菲尔德斯半岛和阿德利岛两个采样区域的浓度差异不大,均低于110 pg·g−1 dw.
南北极、青藏高原等偏远的极地地区远离人类活动,环境中POPs等污染物主要来自长距离大气传输等的输入,浓度水平通常较低[38−40]. 本文的研究结果显示,菲尔德斯半岛和阿德利岛的HBCDs整体污染水平较低,然而,在空间分布上仍然存在着明显的差异. 菲尔德斯半岛从北向南依次建有机场、俄罗斯科考站、智利科考站和中国长城站等人工建筑和设施,是人类活动较频繁的区域. 半岛上各采样点的苔藓样品中,HBCDs的浓度差异较大,紧临长城科考站的A4采样点,HBCDs浓度处于较高水平,其他点较低. 而HBCDs在阿德利岛上的分布与菲尔德斯半岛不同,3个采样点的苔藓样品中HBCDs的浓度十分接近,没有明显差异. 这可能与阿德利岛的位置相对独立、没有机场、科考站等人工设施,人类活动影响较少有关.
作为重要的添加型阻燃剂,HBCDs在上个世纪80年代后期开始工业化生产并在建材、家居用品、纺织材料、电子电器等产品中广泛使用. HBCDs在室内空气、灰尘和车内空气中的大量检出[4-5, 41-42],证实了这些阻燃产品在使用过程中会不断向环境释放HBCDs,成为重要的污染来源. 科考站附近苔藓中HBCDs浓度较高,表明科考站的人类活动,如HBCDs阻燃建筑材料和家居用品等的使用造成了HBCDs的污染水平升高.
3. 结论(Conclusion)
HBCDs在南极菲尔德斯半岛和阿德利岛的环境样品、陆生植物、水生植物、水生动物样品中全部检出. γ-HBCD所占比例从环境样品到陆生植物、水生植物和水生动物样品呈现逐渐下降的趋势. 水生动物样品中α-HBCD浓度与脂肪含量显著正相关. HBCDs在南极环境中以低浓度水平普遍存在和差异性空间分布,为HBCDs的长距离大气传输提供了证据,同时也表明,当地的人类活动是HBCDs的来源之一.
致谢 感谢国家海洋局极地考察办公室在第26次、第27次南极科学考察期间给予的帮助.
-
表 1 南极菲尔德斯半岛和阿德利岛采样信息和样品中HBCDs浓度
Table 1. The sampling details and concentrations of HBCDs in the samples from Fildes Peninsula and Ardley Island
编号No. 采样点Sampling sites 经纬度Longitude and latitude 样品类型Species 检出数/样品数Detection number/Sample number TOC/lw/% α-HBCD β-HBCD γ-HBCD ƩHBCDs 回收率/%Recovery A1 灯塔 62°12'37"S58°55'37"W 土壤 1/1 7.11 n.d. n.d. 7.10 7.10 71 粪土 2/2 54.3 ± 2.30 58.9 ± 26.7 12.0 ± 2.30 98.4 ± 12.2 169 ± 16.8 54 ± 3 苔藓 2/2 2.44 ± 0.11 173 ± 245 31.0 ± 43.8 145 ± 60.5 349 ± 350 65 ± 13 地衣 1/1 1.45 n.d. n.d. 27.1 27.1 97 A2 阿德利岛 62º12'50"S58º55'13"W 粪土 1/1 34.0 29.6 n.d. 83.6 113 82 土壤 1/1 6.85 44.3 20.0 108 173 62 苔藓 1/1 2.43 188 77.0 142 407 83 A3 碧玉滩 62º13'48"S 土壤 1/1 0.48 n.d. n.d. 9.60 9.60 72 58º59'07"W 苔藓 1/1 2.71 92.5 n.d. 65.3 158 61 A4 八达岭 62º13'12"S 土壤 1/1 0.33 n.d. 11.3 51.0 62.3 65 58º57'48"W 苔藓 1/1 1.68 407 97.3 447 951 55 A5 月牙湖 62º12'45"S58º56'26"W 土壤 1/1 20.0 15.8 n.d. 27.1 42.9 62 苔藓 1/1 2.40 46.4 42.2 254 343 64 地衣 1/1 0.96 n.d. n.d. 36.9 36.9 71 A6 香蕉山 62º13'45"S 土壤 1/1 2.45 347 78.4 367 792 98 58º59'29"W 地衣 1/1 1.21 n.d. n.d. 23.4 23.4 91 A7 海豹湾 62º12'30"S58º59'59"W 土壤 1/1 0.40 n.d. n.d. 11.8 11.8 94 地衣 1/1 2.95 n.d. n.d. 30.7 30.7 57 苔藓 1/1 1.47 72.4 17.0 54.8 144 66 A8 半边山 62º12'19"S 地衣 1/1 2.01 61.0 9.90 34.9 106 68 58º57'17"W 苔藓 1/1 1.34 70.0 n.d. 53.0 123 93 A9 长城湾 62º12'35"S58º57'24"W 海洋沉积物 1/1 1.32 n.d. n.d. 41.0 41.0 53 海草 2/5 4.68 ± 1.64 549 ± 1229 154 ± 343 135 ± 246 838 ± 1814 92 ± 13 褐藻 5/7 0.49 ± 0.15 631 ± 897 250 ± 321 852 ± 1394 1732 ± 2277 85 ± 13 端足 3/5 3.41 ± 2.32 8.77 ± 19.6 4.36 ± 7.98 1.39 ± 3.12 14.5 ± 18.1 83 ± 11 南极蛤 1/2 2.24 ± 0.41 5.99 ± 8.48 1.89 ± 2.68 11.0 ± 15.6 18.9 ± 26.7 95 ± 18 海星 4/5 4.61 ± 2.11 9.26 ± 19.1 n.d. 5.72 ± 11.2 15.0 ± 18.9 82 ± 22 帽贝 9/10 13.5 ± 3.50 5.47 ± 4.96 n.d. 0.70 ± 1.63 6.17 ± 4.33 71 ± 15 鱼肉 3/8 8.17 ± 2.99 0.58 ± 1.63 0.56 ± 1.59 1.32 ± 2.14 2.46 ± 3.85 83 ± 5 鱼肝脏 1/1 5.88 8.75 n.d. 3.19 11.9 82 注:土壤、粪土、海洋沉积物、苔藓、地衣、海草、褐藻样品中HBCDs的浓度单位为pg·g−1 dw,其他样品浓度单位为ng·g−1 lw;样品数量>1的浓度数据和回收率数据为平均值±标准偏差(SD);ƩHBCDs为α-、β-、γ-HBCD浓度之和;n.d.,未检出. Note: The unit of HBCD concentration was pg·g−1 dw in soil, dropping-amended soil, sediment moss, lichen, sea grass and brown seaweed samples, and ng·g−1 lw in other samples; Concentrations and recoveries were expressed as mean ± SD when the sample number>1; ƩHBCDs means the sum of α-、β- and γ-HBCD; n.d.,not detected. 表 2 4类样品中HBCD异构体浓度与TOC/lw的Spearman相关性分析
Table 2. Spearman correlation analysis between the concentrations of HBCD isomers and TOC/lw in the four sample species
样品种类Sample species 变量Variables TOC/lw α-HBCD β-HBCD γ-HBCD ƩHBCDs 环境样品(n = 11) TOC/lw 1 0.60 0.09 0.35 0.41 α-HBCD 1 0.75** 0.87** 0.93** β-HBCD 1 0.84** 0.85** γ-HBCD 1 0.96** ƩHBCDs 1 陆生植物(n = 13) TOC/lw 1 0.18 0.14 0.37 0.31 α-HBCD 1 0.77** 0.71** 0.92** β-HBCD 1 0.74** 0.84** γ-HBCD 1 0.92** ƩHBCDs 1 水生植物(n = 7) TOC/lw 1 0.45 0.59 0.39 0.39 α-HBCD 1 0.82* 0.60 0.81* β-HBCD 1 0.82* 0.85* γ-HBCD 1 0.86* ƩHBCDs 1 水生动物(n = 21) TOC/lw 1 0.47* −0.53* −0.22 0.35 α-HBCD 1 −0.42 −0.66** 0.63** β-HBCD 1 0.30 −0.04 γ-HBCD 1 −0.18 ƩHBCDs 1 * 置信度(双测)为 0.05 时,显著相关;** 置信度(双测)为 0.01 时,显著相关. * Significant correlation at the 0.05 level (two-tailed); **Significant correlation at the 0.01 level (two-tailed). -
[1] 环境保护部, 外交部, 国家发展和改革委员会等. 关于《<关于持久性有机污染物的斯德哥尔摩公约>新增列六溴环十二烷修正案》生效的公告 [EB/OL] .[2022-9-5]. https://www.mee.gov.cn/gkml/hbb/bgg/201612/t20161228_378327.htm. [2] COVACI A, GERECKE A C, LAW R J, et al. Hexabromocyclododecanes (HBCDs) in the environment and humans: A review [J]. Environmental Science & Technology, 2006, 40(12): 3679-3688. [3] MORRIS S, ALLCHIN C R, ZEGERS B N, et al. Distribution and fate of HBCD and TBBPA brominated flame retardants in North Sea estuaries and aquatic food webs [J]. Environmental Science & Technology, 2004, 38(21): 5497-5504. [4] ABDALLAH M A E, HARRAD S. Modification and calibration of a passive air sampler for monitoring vapor and particulate phase brominated flame retardants in indoor air: Application to car interiors [J]. Environmental Science & Technology, 2010, 44(8): 3059-3065. [5] ABDALLAH M A E, HARRAD S, COVACI A. Hexabromocyclododecanes and tetrabromobisphenol-A in indoor air and dust in Birmingham, UK: Implications for human exposure [J]. Environmental Science & Technology, 2008, 42(18): 6855-6861. [6] MUIR D C G, BACKUS S, DEROCHER A E, et al. Brominated flame retardants in polar bears (Ursus maritimus) from Alaska, the Canadian Arctic, East Greenland, and Svalbard [J]. Environmental Science & Technology, 2006, 40(2): 449-455. [7] VERREAULT J, GEBBINK W A, GAUTHIER L T, et al. Brominated flame retardants in glaucous gulls from the Norwegian Arctic: More than just an issue of polybrominated diphenyl ethers [J]. Environmental Science & Technology, 2007, 41(14): 4925-4931. [8] MILJETEIG C, STRØM H, GAVRILO M V, et al. High levels of contaminants in Ivory gull Pagophila eburnea eggs from the Russian and Norwegian Arctic [J]. Environmental Science & Technology, 2009, 43(14): 5521-5528. [9] VORKAMP K, RIGÉT F F, BOSSI R, et al. Temporal trends of hexabromocyclododecane, polybrominated diphenyl ethers and polychlorinated biphenyls in ringed seals from East Greenland [J]. Environmental Science & Technology, 2011, 45(4): 1243-1249. [10] de WIT C A, HERZKE D, VORKAMP K. Brominated flame retardants in the Arctic environment—trends and new candidates [J]. Science of the Total Environment, 2010, 408(15): 2885-2918. doi: 10.1016/j.scitotenv.2009.08.037 [11] TOMY G T, PLESKACH K, OSWALD T, et al. Enantioselective bioaccumulation of hexabromocyclododecane and congener-specific accumulation of brominated diphenyl ethers in an eastern Canadian Arctic marine food web [J]. Environmental Science & Technology, 2008, 42(10): 3634-3639. [12] VORKAMP K, BOSSI R, RIGÉT F F, et al. Novel brominated flame retardants and dechlorane plus in Greenland air and biota [J]. Environmental Pollution, 2015, 196: 284-291. doi: 10.1016/j.envpol.2014.10.007 [13] ZHU N L, FU J J, GAO Y, et al. Hexabromocyclododecane in alpine fish from the Tibetan Plateau, China [J]. Environmental Pollution, 2013, 181: 7-13. doi: 10.1016/j.envpol.2013.05.050 [14] KIM J T, CHOI Y J, BARGHI M, et al. Occurrence and distribution of old and new halogenated flame retardants in mosses and lichens from the South Shetland Islands, Antarctica [J]. Environmental Pollution, 2018, 235: 302-311. doi: 10.1016/j.envpol.2017.12.080 [15] LI H H, ZHANG Q H, WANG P, et al. Levels and distribution of hexabromocyclododecane (HBCD) in environmental samples near manufacturing facilities in Laizhou Bay area, East China [J]. Journal of Environmental Monitoring, 2012, 14(10): 2591-2597. doi: 10.1039/c2em30231d [16] REMBERGER M, STERNBECK J, PALM A, et al. The environmental occurrence of hexabromocyclododecane in Sweden [J]. Chemosphere, 2004, 54(1): 9-21. doi: 10.1016/S0045-6535(03)00758-6 [17] JEON J W, KIM C S, KIM H J, et al. Spatial distribution, source identification, and anthropogenic effects of brominated flame retardants in nationwide soil collected from South Korea [J]. Environmental Pollution, 2021, 272: 116026. doi: 10.1016/j.envpol.2020.116026 [18] WU M H, HAN T, XU G, et al. Occurrence of Hexabromocyclododecane in soil and road dust from mixed-land-use areas of Shanghai, China, and its implications for human exposure [J]. Science of the Total Environment, 2016, 559: 282-290. doi: 10.1016/j.scitotenv.2016.03.166 [19] EGUCHI A, ISOBE T, RAMU K, et al. Soil contamination by brominated flame retardants in open waste dumping sites in Asian developing countries [J]. Chemosphere, 2013, 90(9): 2365-2371. doi: 10.1016/j.chemosphere.2012.10.027 [20] ZHU N L, SCHRAMM K W, WANG T, et al. Lichen, moss and soil in resolving the occurrence of semi-volatile organic compounds on the southeastern Tibetan Plateau, China [J]. Science of the Total Environment, 2015, 518/519: 328-336. doi: 10.1016/j.scitotenv.2015.03.024 [21] MENG X Z, DUAN Y P, YANG C, et al. Occurrence, sources, and inventory of hexabromocyclododecanes (HBCDs) in soils from Chongming Island, the Yangtze River Delta (YRD) [J]. Chemosphere, 2011, 82(5): 725-731. doi: 10.1016/j.chemosphere.2010.10.091 [22] 李红华, 商红涛, 王璞, 等. 四川省部分地区土壤中六溴环十二烷的分布特征 [J]. 环境化学, 2014, 33(9): 1439-1444. doi: 10.7524/j.issn.0254-6108.2014.09.013 LI H H, SHANG H T, WANG P, et al. Distribution of hexabromocyclododecane (HBCD) in surface soils from some regions of Sichuan Province in China [J]. Environmental Chemistry, 2014, 33(9): 1439-1444(in Chinese). doi: 10.7524/j.issn.0254-6108.2014.09.013
[23] LU J F, HE M J, YANG Z H, et al. Occurrence of tetrabromobisphenol a (TBBPA) and hexabromocyclododecane (HBCD) in soil and road dust in Chongqing, Western China, with emphasis on diastereoisomer profiles, particle size distribution, and human exposure [J]. Environmental Pollution, 2018, 242: 219-228. doi: 10.1016/j.envpol.2018.06.087 [24] 张淑娟, 杨瑞强. 苔藓和地衣在指示偏远地区大气持久性有机污染物中的应用 [J]. 环境化学, 2014, 33(1): 37-45. doi: 10.7524/j.issn.0254-6108.2014.01.021 ZHANG S J, YANG R Q. Application of lichens and mosses as biomonitors of atmospheric POPs pollution in remote areas: A review [J]. Environmental Chemistry, 2014, 33(1): 37-45(in Chinese). doi: 10.7524/j.issn.0254-6108.2014.01.021
[25] HARMENS H, FOAN L, SIMON V, et al. Terrestrial mosses as biomonitors of atmospheric POPs pollution: A review [J]. Environmental Pollution, 2013, 173: 245-254. doi: 10.1016/j.envpol.2012.10.005 [26] KIM J T, CHOI Y J, BARGHI M, et al. Occurrence, distribution, and bioaccumulation of new and legacy persistent organic pollutants in an ecosystem on King George Island, maritime Antarctica [J]. Journal of Hazardous Materials, 2021, 405: 124141. doi: 10.1016/j.jhazmat.2020.124141 [27] HAUKÅS M, HYLLAND K, NYGÅRD T, et al. Diastereomer-specific bioaccumulation of hexabromocyclododecane (HBCD) in a coastal food web, Western Norway [J]. Science of the Total Environment, 2010, 408(23): 5910-5916. doi: 10.1016/j.scitotenv.2010.08.026 [28] HAUKÅS M, HYLLAND K, BERGE J A, et al. Spatial diastereomer patterns of hexabromocyclododecane (HBCD) in a Norwegian fjord [J]. Science of the Total Environment, 2009, 407(22): 5907-5913. doi: 10.1016/j.scitotenv.2009.08.024 [29] UENO D, ISOBE T, RAMU K, et al. Spatial distribution of hexabromocyclododecanes (HBCDs), polybrominated diphenyl ethers (PBDEs) and organochlorines in bivalves from Japanese coastal waters [J]. Chemosphere, 2010, 78(10): 1213-1219. doi: 10.1016/j.chemosphere.2009.12.058 [30] JANÁK K, COVACI A, VOORSPOELS S, et al. Hexabromocyclododecane in marine species from the Western Scheldt Estuary: Diastereoisomer- and enantiomer-specific accumulation [J]. Environmental Science & Technology, 2005, 39(7): 1987-1994. [31] WU J P, GUAN Y T, ZHANG Y, et al. Trophodynamics of hexabromocyclododecanes and several other non-PBDE brominated flame retardants in a freshwater food web [J]. Environmental Science & Technology, 2010, 44(14): 5490-5495. [32] KÖPPEN R, BECKER R, ESSLINGER S, et al. Enantiomer-specific analysis of hexabromocyclododecane in fish from Etnefjorden (Norway) [J]. Chemosphere, 2010, 80(10): 1241-1245. doi: 10.1016/j.chemosphere.2010.06.019 [33] LAW R J, KOHLER M, HEEB N V, et al. Hexabromocyclododecane challenges scientists and regulators [J]. Environmental Science & Technology, 2005, 39(13): 281A-287A. [34] BRAUNE B M, MALLORY M L, GILCHRIST H G, et al. Levels and trends of organochlorines and brominated flame retardants in Ivory Gull eggs from the Canadian Arctic, 1976 to 2004 [J]. Science of the Total Environment, 2007, 378(3): 403-417. doi: 10.1016/j.scitotenv.2007.03.003 [35] LAW R J, BERSUDER P, ALLCHIN C R, et al. Levels of the flame retardants hexabromocyclododecane and tetrabromobisphenol A in the blubber of harbor porpoises (Phocoena phocoena) stranded or bycaught in the U.K., with evidence for an increase in HBCD concentrations in recent years [J]. Environmental Science & Technology, 2006, 40(7): 2177-2183. [36] STAPLETON H M, DODDER N G, KUCKLICK J R, et al. Determination of HBCD, PBDEs and MeO-BDEs in California Sea lions (Zalophus californianus) stranded between 1993 and 2003 [J]. Marine Pollution Bulletin, 2006, 52(5): 522-531. doi: 10.1016/j.marpolbul.2005.09.045 [37] JOHNSON-RESTREPO B, ADAMS D H, KANNAN K. Tetrabromobisphenol A (TBBPA) and hexabromocyclododecanes (HBCDs) in tissues of humans, dolphins, and sharks from the United States [J]. Chemosphere, 2008, 70(11): 1935-1944. doi: 10.1016/j.chemosphere.2007.10.002 [38] WANG P, ZHANG Q H, WANG T, et al. PCBs and PBDEs in environmental samples from King George Island and Ardley Island, Antarctica [J]. RSC Advances, 2012, 2(4): 1350-1355. doi: 10.1039/C1RA00462J [39] ZHANG Q H, CHEN Z J, LI Y M, et al. Occurrence of organochlorine pesticides in the environmental matrices from King George Island, west Antarctica [J]. Environmental Pollution, 2015, 206: 142-149. doi: 10.1016/j.envpol.2015.06.025 [40] YANG R Q, WANG Y W, LI A, et al. Organochlorine pesticides and PCBs in fish from lakes of the Tibetan Plateau and the implications [J]. Environmental Pollution, 2010, 158(6): 2310-2316. doi: 10.1016/j.envpol.2010.02.004 [41] CHEN D, HALE R C, la GUARDIA M J, et al. Hexabromocyclododecane flame retardant in Antarctica: Research stations as sources [J]. Environmental Pollution, 2015, 206: 611-618. doi: 10.1016/j.envpol.2015.08.024 [42] CORSOLINI S, METZDORFF A, BARONI D, et al. Legacy and novel flame retardants from indoor dust in Antarctica: Sources and human exposure [J]. Environmental Research, 2021, 196: 110344. doi: 10.1016/j.envres.2020.110344 -






 DownLoad:
DownLoad: