-
纳米银(AgNPs)由于优良的物理、化学和生物特性,被广泛应用到航空、医学、农业、工业等领域,是目前使用量最多的纳米材料. 其产量巨大,据估计目前全球AgNPs年产量在500—1000 t之间[1]. 随着AgNPs产品的大量使用,其在生产、运输、使用及后期处理中不可避免地会流入环境中,导致环境中AgNPs含量不断增加[2]. 现有分析技术还很难检测AgNPs在环境中的真实浓度,Giese通过建模估算了AgNPs流入到不同环境中的范围值(表1)[1],发现AgNPs含量在环境中不断增加. 土壤和水体是AgNPs汇集的主要场所[3-4]. Sun等预计欧盟污水处理厂污泥中AgNPs含量在(0.008—0.01)mg·kg−1之间,自然和城市土壤中AgNPs每年增加量为(0.91—1.8)ng·kg−1[5]. Deycard等报道污水中可能检测出的AgNPs含量在(6.9±2.0)mg·kg−1[6]. 环境中的AgNPs会通过食物链进入生物体产生毒害作用,已经在许多动物体中广泛研究,包括软体、甲壳、鱼类、鸟类和哺乳类动物等. 同时如本文中所讨论的AgNPs理化性质、环境、涂层等因素都会影响其毒性作用.
目前国内外文献关于AgNPs毒性的研究进展主要从生物种类(如微生物、植物、动物等)、生物个体(如小鼠、斑马鱼、水蚤、昆虫等)或者特定环境(如水、土壤等)等角度总结,其中涉及到对无脊椎和脊椎动物的毒性[7-9]. 而无脊椎动物种类数占动物总种类数的95%,是生态系统的重要组成. 由此,AgNPs的扩大生产和广泛应用更易对无脊椎动物构成严重危害. 相较于脊椎动物,蚯蚓、秀丽隐杆线虫、贻贝、水蚤等无脊椎动物具有生理特征代表性、便于获取和培养、繁殖周期短、饲养成本低、无伦理限制等特点[10-14],已被广泛应用于AgNPs生态毒性测试. 研究性文献中因实验对象、暴露时间、毒性指标、AgNPs的理化性质、暴露浓度等差异,对这些研究结果很难进行比较分析,AgNPs的毒性机制也仍不清晰.
本文主要从累积效应、急性毒性、生长发育毒性、组织病症、生殖毒性、遗传毒性和回避行为等方面总结了AgNPs对无脊椎动物的影响. 除此之外,AgNPs的理化特性、表面涂层、暴露途径、环境[15-18]等因素都可以影响AgNPs对无脊椎动物的毒性. 从无脊椎动物所获得的AgNPs毒性效应,可用于推测AgNPs对生态系统的影响以及对脊椎等其他动物体可能产生的毒性. 但迄今还未见AgNPs对无脊椎动物毒性效应的研究综述. 本文通过阅读大量国内外文献,较为系统地总结了AgNPs对无脊椎动物的影响,并对未来研究方向及重点做了进一步展望.
-
生物累积是纳米材料致毒的前期行为,是对生物产生危害的一种机制[19]. AgNPs在环境和生物之间可以进行迁移转化,使其在无脊椎动物体内的累积作用研究尤为必要[20-21]. 由于研究所用的受试生物、培养环境、粒径、表面涂层、暴露时间以及浓度不同,很难通过生物累积量来判断各类无脊椎动物对AgNPs生物累积能力高低. 但可以看出,不同无脊椎动物对AgNPs都具有一定程度的生物累积能力. 通常,消化系统是无脊椎动物积累AgNPs最高的部位. Li等研究显示AgNPs暴露组威廉环毛蚓体内的Ag主要分布在消化系统,且消化系统中的Ag含量占整个威廉环毛蚓中总Ag的68.9%, AgNPs在消化系统中的高积累可能是土壤中释放的高浓度AgNPs被肠道上皮细胞吸收所造成,肠粘膜中的一些关键受体(如Na+、K+、ATP酶)、与肠道及其微生物群落相关的特定氧化还原和溶质条件可能会促进AgNPs的摄取;此外,Ag在消化系统中的高积累可能还与无脊椎动物的解毒策略有关,AgNPs在肠细胞中可以与金属硫蛋白(MT)结合,产生的Ag-MT复合物被隔离在溶酶体中,阻碍了AgNPs向机体其他部位的转移[22].
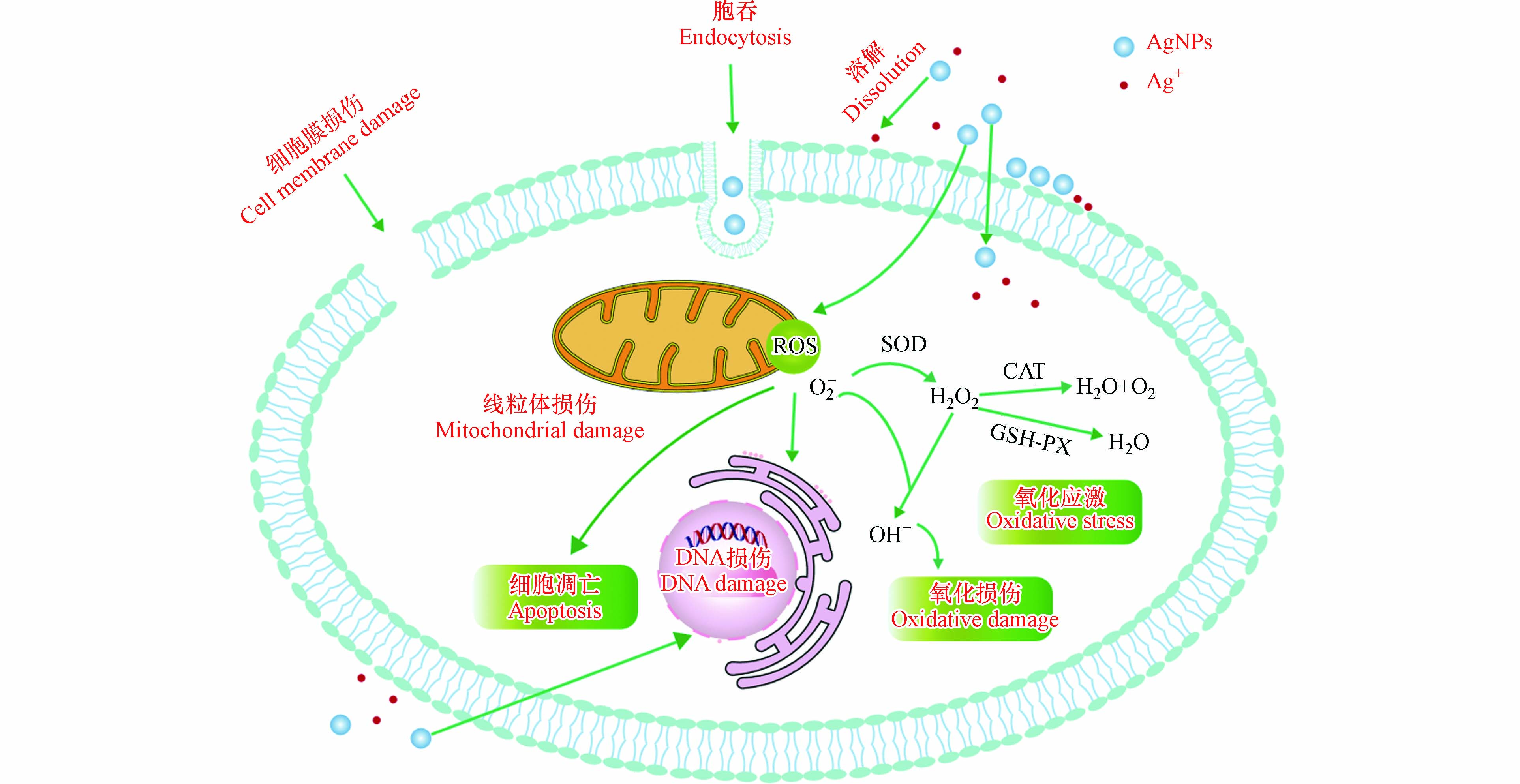
Cozzari 等研究表明,沙蚕从水溶性银中累积Ag的效率高于AgNPs [23]. 同样,Bao等研究了AgNPs及硝酸银对淡水蜗牛不同组织的银负荷,结果发现,蜗牛从硝酸银中累积的银含量高于AgNPs [24]. 造成这种现象的原因,可能是由于摄取途径的不同,硝酸银主要通过质子耦合通道、质子泵、吞噬和胞饮作用等非特异性摄取途径大量积累,AgNPs则主要是通过内吞途径来积累[25](图1),并且由于AgNPs容易聚集并形成生物电晕,也降低了其生物累积量[26]. 但是Cong等研究了硝酸银和AgNPs对沙蚕的生物累积,发现沙蚕对于两种形式的银负荷没有差异[27]. 这表明不同的无脊椎动物,对于两种形式银的累积差异,至今仍没有统一的定论. 表2 集中列出了AgNPS对无脊椎动物的生物累积。
-
(1)急性毒性和生长发育毒性
AgNPs对无脊椎动物的急性毒性结果,可以用来直接快速、直观的判断AgNPs毒性的强弱. 急性毒性测试指标主要为半数有效浓度(50% effect concentration,EC50)和半数致死浓度(50% lethal concentration,LC50)(表3). 有研究表明,AgNPs对无脊椎动物的急性毒性在很大程度上是因为AgNPs颗粒的溶解[38]. Ivask等将大型溞的EC50标准化为溶解的Ag+,发现AgNPs的溶解校正EC50值与AgNO3相似,这就表明AgNPs的急性毒性是由释放的Ag+引起的,但10 nm的AgNPs急性毒性却高于Ag+,原因可能是由于10 nm及更小的AgNPs颗粒与细胞相互作用后在细胞外表面或细胞内部溶解,从而更具生物利用度 [39].
急性毒性试验只是初步了解AgNPs对无脊椎动物的毒性高低. 在自然环境中,无脊椎动物会长期暴露在含有AgNPs的环境中. 有研究报道,在长期接触下,AgNPs会影响无脊椎动物的生长发育[40]. Zhao等发现,AgNPs可以显著抑制大型溞的体长,造成抑制的原因可能是因为食物质量的下降,水中AgNPs和藻类在大型溞肠道结合,导致大型溞对食物吸收率下降,从而影响大型溞的生长发育[41]. Mehennaoui等研究了不同粒径AgNPs对淡水钩虾生长发育的影响,结果发现10 nm AgNPs比60 nm AgNPs更具有抑制效果,可能因为小粒径的AgNPs在动物内部溶解,并释放出更有抑制效果的Ag+,研究指出对于生长发育的抑制,可能是因为淡水钩虾甲壳上有关吸附的感官被破坏;另一种假设是生物体运动量的减少,更加有利于防御机制的能量再分配[30]. 但AgNPs并非只对无脊椎动物的生长发育产生抑制效果,Mackevica等发现,大型溞在低浓度(10 μg·L−1)AgNPs暴露下,反而促进了其生长发育[42].
(2)组织病症
组织病症相较于死亡率和体重的变化对低水平AgNPs暴露更敏感[22]. 有研究发现,蜗牛经AgNPs食物相暴露14 d后,其胃肠道、肾脏、消化腺以及足出现不同程度组织学形态变化. 蜗牛胃肠道出现明显的黏膜损伤与细胞死亡脱落,肾脏组织细胞出现不规则排列、部分细胞脱落,消化小管排列疏松、细胞质内出现较多圆形空泡、部分基底破损、组织细胞部分糜烂脱落,足组织胶原蛋白原纤维排列疏松、细胞间隙增宽并出现较多嗜碱性颗粒团块[17]. AgNPs对消化腺的损害,会使蜗牛消化食物的能力下降,从而对蜗牛的生长发育产生影响[55]. Chen等也发现,400 mg·L−1AgNPs对家蚕组织结构的损害,家蚕的基底膜被破坏,杯状细胞扩张,柱状细胞变形,此外还观察到异常的细胞结构和许多片状结构的出现,这表明AgNPs会对组织产生不良影响,并可能对主要靶器官,例如对家蚕的消化器官产生有害影响[56].
(3)生殖毒性
AgNPs会诱导无脊椎动物生殖细胞的凋亡,从而抑制其繁殖. Luo等发现秀丽隐杆线虫捕食暴露于1、5、10 μg·mL−1AgNPs的大肠杆菌后,其性腺细胞凋亡的数量显著增加,性腺减数分裂区的生殖细胞死亡率显著增加[57]. 但也有研究发现,在低浓度AgNPs暴露下,大型溞的繁殖得到了促进,推测可能是因为AgNPs具有优良的灭菌性能;而随着AgNPs浓度的提高,大型溞的产溞数显著减少,则是因为高浓度时AgNPs毒性较大,对大型溞的机体造成了不可逆的损伤,从而对大型溞的繁殖产生了不良影响[28];另一种推测是因为AgNPs抑制了大型溞的摄食,导致其能量储备减少,进一步影响了大型溞的繁殖[58]. 氧化应激是AgNPs诱导生殖毒性的主要机制,Lim等对秀丽隐杆线虫中氧化应激及其信号通路进行研究,发现AgNPs会导致野生型(N2)秀丽隐杆线虫中活性氧自由基(reactive oxygen species,ROS)增加,低氧诱导结合蛋白(HIF-1)、谷胱甘肽S转移酶(glutathione s-transferase,GST)的激活以及繁殖潜力下降,其中PMK-1 p38丝裂原活化蛋白激酶(MAPK)在AgNPs诱导的氧化应激中起重要作用[59].
(4)遗传毒性
遗传毒性是化学毒性测试和风险评估中重要的毒性终点之一[60]. AgNPs的遗传毒性机制,目前认为主要是以下两种:第一种是通过诱导ROS增加,干扰DNA复制、转录、抑制相关蛋白质,还会导致嘧啶和嘌呤衍生的氧化损伤;第二种是AgNPs直接进入细胞作用于细胞器(例如,纺锤体、着丝粒等)[61],抑制复制、转录,导致染色体丢失,断裂[62],见图1. Choi等研究了AgNPs对赤子爱胜蚓的遗传毒性,发现AgNPs会引起赤子爱胜蚓DNA损伤, AgNPs暴露可以使细胞内ROS增加,引起细胞氧化应激,最终导致DNA损伤[63]. 同样,Alaraby等通过彗星实验发现,AgNPs对果蝇产生遗传毒性是因为氧化应激所引起的DNA损伤[64]. Botelho等研究发现,不同浓度和不同时间AgNPs暴露增加了片脚甲壳动物Parhyale hawaiensis的微核、核芽和核异常的比例[65]. AgNPs不仅会对亲代产生毒性效应,对其子代也会造成损害. 目前已有研究观察到AgNPs对土壤线虫繁殖的多代效应,Wamucho等发现秀丽隐杆线虫多代暴露于AgNPs会诱导未暴露子代的表观遗传变化[66]. 同样,Pakrashi发现,AgNPs不仅对大型溞母体产生毒害,而且使母体中AgNPs约1%—2%的总累积Ag转移到新生水蚤中,这就表明AgNPs可能会对水蚤的繁殖产生更持久的不利影响[67].
(5)回避行为
回避行为是动物遇到不利环境的逃避反应,它是一个生态相关的测量结点,用来快速判断污染物的毒性强弱. 回避试验装置简单,操作便捷,反应快速,周期短,是一种很好地检测AgNPs毒性的方法. 目前,人们已经做过蚯蚓、秀丽隐杆线虫、土鳖虫等无脊椎动物的回避试验,通过测定一定浓度AgNPs对无脊椎动物个体行为的影响程度来判定其毒性大小[68]. Brami等研究了蚯蚓对AgNPs的回避试验,发现蚯蚓对AgNPs回避行为比繁殖等传统终点更为敏感,在最低浓度(12.5 mg·kg−1)时就可以观察到回避现象,但目前还不清楚回避行为是由AgNPs释放的Ag+触发,还是AgNPs触发[10]. 在现有文献中主要用以下3种机制来解释土壤无脊椎动物的回避行为:第一种是污染物使土壤中微生物群发生变化,导致土壤无脊椎动物适口性的改变(如:AgNPs以及Ag+会改变微生物群落结构);第二种是土壤无脊椎动物具有化学和机械感受器,金属颗粒的神经毒性作用或生物化学感觉器敏感性可以使它们主动避开有害环境或移动到更有利的环境;第三种是由于污染物进入到土壤无脊椎动物体内,引起土壤无脊椎动物的不适,从而引起回避行为[69-71].
-
目前,关于AgNPs对无脊椎动物的毒性机制仍不是十分清晰. 根据现有研究总结其可能的机制如图1所示. AgNPs暴露后,释放Ag+,离子与颗粒通过内吞等方式进入细胞,在细胞内产生大量ROS,ROS与细胞膜表面蛋白结合,破坏细胞膜的完整性,从而导致细胞膜损伤[72]. 线粒体是AgNPs诱导氧化应激的主要靶细胞器之一,线粒体中高水平的ROS导致线粒体损伤,最终导致细胞凋亡[73]. 细胞内ROS的增加,会导致氧化应激并破坏细胞成分,造成氧化型DNA损伤,链断裂,核酸修饰,脂质过氧化,蛋白质变性,抗氧化酶的激活以及抗氧化分子的消耗;此外,AgNPs诱导的ROS通过激活细胞信号传递,触发炎症反应[72-73].
Bao等发现,蜗牛暴露于AgNPs后,足部和消化道在Ag浓度很低的情况下也会诱发显著的氧化应激,其中过氧化氢酶(catalase,CAT)和过氧化物酶(peroxidase,POD)活性较对照组酶活显著增加,这些氧化应激可能是由于AgNPs与生物体细胞的接触触发的[24]. Pan等研究发现,AgNPs对原生动物嗜热四膜虫的毒性是由于高活性氧水平引起的,从而导致了脂质过氧化和线粒体功能障碍,为了对抗氧化胁迫,嗜热四膜虫激活了抗氧化系统,增加了谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-PX)和其他抗氧化剂的活性[74]. Chen研究了家蚕中AgNPs的毒性机制,表明ROS的增加诱导了肌醇加氧酶(MIOX)基因表达下调,影响线粒体形态并导致氧化损伤,且AgNPs也会抑制超氧化物歧化酶(superoxide dismutase,SOD)活性,引起持续的氧化应激,从而诱导细胞凋亡[56]. Ahamde等研究了AgNPs在果蝇中的毒性机制,发现经AgNPs暴露后,细胞内产生大量ROS,导致膜损伤、氧化应激以及线粒体损伤,最终导致细胞凋亡;此外,还发现氧化应激导致细胞周期检查点蛋白p53和细胞信号蛋白p38上调,这两种蛋白参与DNA损伤和凋亡等多种过程,是评估遗传毒性的分子标记,说明氧化应激诱导了DNA损伤[75].
-
AgNPs的理化性质、表面涂层、环境、暴露途径等因素都可以影响AgNPs对无脊椎动物的毒性(图2). 表4集中汇总了部分AgNPs对无脊椎动物毒性的影响因素.
-
AgNPs的理化性质,包括AgNPs的尺寸、形貌、晶型、表面特性等[84]. AgNPs的理化性质对无脊椎动物的毒性有很大影响. 目前普遍认为AgNPs粒径越小其毒性越强,AgNPs粒径在20—80 nm的毒性效应主要由其溶解释放的Ag+引起,而粒径较小的AgNPs颗粒(10 nm)更容易被生物体利用,毒性效应更大[39]. Hou等使用40 nm和110 nm AgNPs对大型溞做了毒性研究,结果发现,40 nm AgNPs比110 nm AgNPs的LC50值更低,这可能是由于40 nm AgNPs的溶解速率比110 nm AgNPs快,小粒径AgNPs颗粒比表面积更高,生成焓更高[44]. Moon等使用AgNPs颗粒、纳米银线、纳米银板分别对秀丽隐杆线虫进行毒性测试,结果发现AgNPs颗粒和纳米银板对秀丽隐杆线虫的生长和繁殖具有抑制现象,而纳米银线的影响却微乎其微,其中AgNPs颗粒毒性最大,从侧面也说明AgNPs颗粒在毒性水平上起着重要作用,AgNPs颗粒毒性大于纳米银线及纳米银板可能是因为球形更容易在消化道中溶解[79].
-
为了提高AgNPs的性能,可以使用不同的表面涂层. 目前比较常用的表面涂层有PVP、CIT、聚乙烯醇(polyvinyl alcohol,PVA)[85-87]等. 使用PEG可以降低AgNPs颗粒表面能,从而增加其胶体稳定性[88];CIT具有低分子量,并通过静电斥力保护AgNPs;亲水性的PVP具有空间稳定性[89]. 不同表面涂层AgNPs对无脊椎动物毒性大小也不一样. Hou等通过大型溞的急性毒性实验,发现CIT-AgNPs的LC50比PVP-AgNPs的LC50更低,说明CIT包覆的AgNPs毒性更大,这可能是因为PVP涂层的稳定性使Ag能够被完整的封装,减少了Ag+的释放,因而AgNPs毒性降低[44].
-
由于生态系统中物理化学等变量的变化,生物体对AgNPs的可变敏感性正受到越来越多的关注[43]. 例如环境中不同的光照、盐度、pH、温度、暴露介质等,都可能影响AgNPs对无脊椎动物的毒性. Lish等研究了AgNPs在不同环境条件下对卤虫无节幼体的急性毒性效应,发现环境条件可以改变AgNPs的稳定性,使其稳定性下降,导致更多的Ag+释放,从而导致其毒性的改变[83]. Conine等则是研究了不同湖泊水中AgNPs对水蚤的毒性效应,发现颗粒物C:N和C:P比率、总溶解有机碳(dissolved organic carbon,DOC)、总溶解磷(total dissolved phosphate,TDP),都会影响AgNPs的浓度,从而对水蚤产生毒性影响,C:N是影响水蚤存活率的最大因素[43]. 在土壤暴露中,通过活性污泥的加入,可以使部分AgNPs转变成AgS,而AgS具有高的化学稳定性,从而降低了AgNPs的毒性;并且由于活性污泥中含有丰富的食物,导致蚯蚓的体重增加了34%—176%[90].
-
AgNPs不同的暴露途径对无脊椎动物的毒性也不同. Wang研究了水体暴露和饮食暴露两种途径下AgNPs对大型溞生长、繁殖、生物累积等指标的影响. 发现在生长和繁殖实验中,水体暴露下的AgNPs会刺激大型溞的繁殖和蜕皮,在高浓度下会显著抑制大型溞的繁殖和蜕皮,而饮食暴露下的AgNPs在所有浓度下都会显著抑制大型溞的繁殖和生长;在生物累积实验中,水体暴露下AgNPs在最低浓度时,在大型溞体内累积量达到最高,之后随AgNPs暴露浓度增加而累积量减少;饮食暴露下,大型溞体内Ag+ 量随着AgNPs暴露浓度增加而增加[28]. 同样,Qing研究了土壤相暴露和食物相暴露下AgNPs对蜗牛毒性的影响,发现食物相中AgNPs的毒性大于土壤相中AgNPs的毒性;在相同AgNPs浓度下,食物相导致蜗牛消化腺中脂质过氧化物(lipid hydroperoxide,LPO)含量,CAT和SOD活性极显著增加,分别是土壤相的1.5、1.7、2.5倍[17].
-
由于AgNPs材料的优良特性,使其被广泛应用到农、工、医等各种领域,而AgNPs的毒性问题,一直是人们关心的重点. 到目前为止,国内外已有很多关于AgNPs毒性的文献,相关实验结果并不一致甚至自相矛盾. 本文结合文献中的相关研究结果,总结了AgNPs对无脊椎动物的毒性效应及其影响因素. AgNPs可以在环境和生物链中迁移转化,最终累积到无脊椎动物体内,对无脊椎动物造成毒性损害,影响无脊椎动物的生长发育、破坏无脊椎动物的组织结构以及损害其系统功能. AgNPs引起细胞氧化应激,会造成无脊椎动物DNA损伤、线粒体损坏、染色体畸变以及细胞凋亡. 此外,AgNPs的理化性质、表面涂层、环境、暴露途径等因素,都会影响AgNPs对无脊椎动物的毒性大小. 最后基于目前的研究提出一些展望,为AgNPs对无脊椎动物毒性的研究提供新的思路.
(1) AgNPs与AgNPs溶解Ag+之间的毒性没有研究清楚,是AgNPs溶解Ag+所引起的毒性,还是AgNPs与Ag+共同引起的毒性,这方面在无脊椎动物毒性机制中需要更深层的研究.
(2) 生物制备AgNPs具有反应条件温和,绿色环保,成本低等优点,已经成为近些年研究的热点. 随着生物合成法技术的成熟与完善,环境中生物AgNPs日益增多. 无脊椎动物是生物类群和生态系统的重要组成部分,后续应加强生物AgNPs对无脊椎动物的毒性效应研究.
(3) 随着AgNPs被释放到环境中,会与环境中其他污染物相互作用. 可能会影响AgNPs在环境中的理化性质和生物学活性. 因此有必要加强AgNPs与其他污染物的联合效应及其共存特性研究.
(4) 尽管目前关于AgNPs对无脊椎动物毒性的研究在逐渐增多,但大多数研究只考虑了对无脊椎动物的急性毒性试验. 因此,需要更多的研究来确定无脊椎动物体内低浓度AgNPs颗粒的长期影响,隔代影响,以便进行适当的安全评估和识别生物标志物.
(5) 目前AgNPs的试验生物以水生无脊椎动物为主,如:水蚤、大型溞、贻贝等,后续应加深对陆生无脊椎动物的影响研究,为AgNPs在土壤中的评价提供依据.
(6) 需要建立评价AgNPs对无脊椎动物单一和复合污染毒性的标准方法,以完善AgNPs的生态毒性安全评价系统,进而便于政府规范AgNPs的生产和使用.
纳米银对无脊椎动物毒性效应的研究进展
Research advances on silver nanoparticles toxic effects in invertebrates
-
摘要: 纳米银(AgNPs)因优良的抗菌特性,已成为全球使用量最多的纳米材料. 随着AgNPs使用量的增多,其不可避免流入环境中,对生态系统造成危害. 无脊椎动物是动物类群重要的组成部分,本文主要从累积效应、急性毒性、生长发育毒性、组织病症、生殖毒性、遗传毒性和回避行为等方面总结了AgNPs对无脊椎动物的影响和潜在毒性机制,介绍了AgNPs对无脊椎动物毒性的影响因素,分析了AgNPs关于无脊椎动物毒性研究的不足并对研究趋势进行了展望. 本文旨在为AgNPs对无脊椎动物的毒性研究以及AgNPs的安全生产和合理使用提供参考.Abstract: Silver nanoparticles (AgNPs) have become the most frequently used nanomaterials in the world due to their excellent antimicrobial properties. With the increasing use of AgNPs, they are inevitably released into the environment and may produce negative effects on the ecosystem. Invertebrates are an important part of animal taxa. This paper summarized the effects of AgNPs on invertebrates including bioaccumulation, acute toxicity, growth and development toxicity, histopathology, reproductive toxicity, genotoxicity and avoidance behavior, as well as their potential toxicity mechanism. The factors influencing AgNPs toxicity in invertebrates were introduced. Finally, the deficiencies of AgNPs in invertebrate toxicity and the research trend were discussed. This review aimed to provide references for toxicity studies of AgNPs on invertebrates and the safe production and reasonable use of AgNPs.
-
Key words:
- silver nanoparticles /
- invertebrate /
- toxic effect /
- influencing factor.
-
多溴联苯醚(PBDEs)是一种广泛使用的溴代阻燃剂. 据统计,截至2020年,全球PBDEs的总产量已达约200万吨[1].PBDEs的大量生产和使用,使其不可避免地被释放至天然环境中[2-4]. 水体是PBDEs污染的主要环境介质之一,全球多数地区的水体,甚至南北极海洋,均有PBDEs检出[5-6]. 作为全球主要的PBDEs生产国 [1],我国也面临着严峻的水体PBDEs污染形势. 目前,我国华东、华北、华南地区的多数湖泊、河流、海洋均受到了不同程度的PBDEs污染,检出浓度为0.007—43.000 ng·L-1[2]. 水中的PBDEs不但可进入水生生物体内,产生神经发育毒性和内分泌干扰效应,还具备较高的生物放大系数(0.06)和生物蓄积潜力,可通过鱼、贝类等水生食物进入人体,增加神经发育障碍、生殖功能受损和遗传变异的风险[7-9]. 因此,PBDEs的监管对保障水环境安全具有重要意义. 发展水体PBDEs的高灵敏检测方法十分必要.
PBDEs在水体中的赋存浓度通常为痕量或超痕量水平,因此在对其进行检测时需要对样品进行富集等前处理. 固相微萃取(SPME)是一种新型、绿色的样品前处理技术[10]. 与液-液萃取、固相萃取等传统方法相比,SPME技术无需大量有机溶剂,灵敏度更高,且集采样、富集、浓缩、解吸于一体,极大地简化了前处理过程[11],已在多种有机污染物的分析检测中显示了优异的应用性能[12].SPME的技术关键是其涂层. 现有的商用涂层多以石英纤维为基底、机械性能较差,涂层材料热稳定性较低,对PBDEs这类高沸点污染物的分析性能不佳. 因此,亟需开发新型、稳定、可高效富集PBDEs的SPME涂层[13].
共价有机骨架(COF)是一类由C、N、O、H、B等有机元素共价整合而成,具有周期性骨架和有序纳米孔结构的结晶多孔聚合物[14]. 自2005年首次被报道以来,COF已在气体存储、催化、传感、吸附等领域广泛应用[15]. 这类材料比表面积大、孔径范围宽、官能团丰富、热稳定性和化学稳定性好,是理想的SPME涂层材料[12].
本研究采用水热法合成了酮胺型COF材料(TpBD),用硅酮胶黏附法在刻蚀的钢丝表面制得SPME涂层,并对其进行了结构表征. 研究了TpBD涂层对PBDEs的萃取性能,探讨了萃取温度、萃取时间、搅拌速度、解吸温度、解吸时间等条件对萃取过程影响. 优化了萃取条件,建立了基于TpBD涂层的PBDEs分析方法,并在实际水体样品中验证了检测方法的适用性.
1. 实验部分(Experimental section)
1.1 化学试剂
2,4,4′-三溴联苯醚(BDE-28,97.9%)、2,2′,4,4′-四溴联苯醚(BDE-47,100.0%)、2,2′,4,4′,5-五溴联苯醚(BDE-99,99.1%)、2,2′,4,4′,6-五溴联苯醚(BDE-100,100.0%)、2,2’,3,4,4’,5’-六溴联苯醚(BDE-138,97.9%)、2,2’,4,4’,5,5’-六溴联苯醚(BDE-153,98.6%)均购自美国AccuStandard公司,其理化性质如表1所示[16]. 6种PBDEs的混合标准溶液配制于异丙醇(99.8%,美国Tedia)中,于4 ℃避光保存. 联苯胺(98.0%)和1,3,5-三甲苯(98.0%)购自上海阿拉丁生化科技股份有限公司. 三醛基间苯三酚(97.0%)和1,4-二氧六环(99.5%)购自上海麦克林生化科技有限公司. 乙酸(99.5%)购自南京化学试剂有限公司. 中性硅酮胶购自陶氏有机硅有限公司. 甲苯(99.5%)购自上海凌峰化学试剂有限公司.
表 1 PBDEs的理化性质Table 1. Physico-chemical properties of PBDEs.同类物Congeners 分子式Molecular formula lg KOW a 蒸气压/(Pa, 25 ℃)Vapor pressure 水溶解度/(mg·L−1, 25 ℃)Aqueous solubility 分子直径/nm bMolecular diameter BDE-28 C12H7Br3O 5.94 2.19×10−3 0.070 0.989 BDE-47 C12H6Br4O 6.55 2.50×10−4 0.002 0.998 BDE-100 C12H5Br5O 6.86 2.86×10−5 0.040 1.078 BDE-99 C12H5Br5O 7.13 6.82×10−5 0.009 0.995 BDE-153 C12H4Br6O 7.62 5.80×10−6 0.001 1.078 BDE-138 C12H4Br6O 7.91 1.58×10−6 0.001 0.995 注:a正辛醇-水分配系数;b由GaussView 5.0计算. a n-octanol-water partition coefficient; b calculated by GaussView 5.0. 1.2 TpBD涂层的制备
1.2.1 涂层基底的预处理
本研究选用不锈钢丝作为自制SPME纤维的涂层基底. 不锈钢丝的预处理过程如下:将直径为0.15 mm、长度为10 cm的不锈钢丝依次浸泡在氢氟酸、甲醇、纯水中超声20 min、晾干,以提高基底表面粗糙度.
1.2.2 TpBD粉末的制备
TpBD的制备方法参考文献[17]. 分别称取63.0 mg三醛基间苯三酚和82.8 mg联苯胺,溶于均三甲苯/1,4-二氧六环的混合溶液(1:1,V:V),边搅拌边滴加1.50 mL乙酸溶液(9.00 mol·L−1). 超声5 min后,将上述混合液转移至高压釜的聚四氟乙烯内衬中,于120 ℃水热反应72 h.反应完成后,过滤、收集暗红色固体,并以丙酮为溶剂对材料进行12 h索氏提取,除去材料孔道中残留的反应物. 最后,将材料于60 ℃真空干燥12 h,即得TpBD粉末.
1.2.3 TpBD涂层的制备
将预处理后的不锈钢丝插入甲苯稀释的硅酮胶溶液、迅速抽出钢丝,重复数次,在钢丝表面形成均匀硅酮胶层. 用滤纸吸去硅酮胶层表面多余溶液后,将钢丝置于TpBD粉末中旋转,再于120 ℃烘箱中干燥20 min,获得涂覆均匀的TpBD涂层. 最后,将涂层长度截至1 cm.
1.3 TpBD涂层的表征
采用D8 ADVANCE型X射线衍射仪(XRD,德国Bruker)测定涂层材料的XRD图谱. 利用QUANTA FEG 250场发射环境扫描电子显微镜(SEM,美国FEI)观察涂层的微观形貌. 采用ASAP 2020型比表面积和孔径测定仪(美国Micromeritics)测定涂层材料的孔径分布和孔体积. 通过Pyris1 DSC热分析仪(TGA,美国Perkinelmer)对材料进行热重分析. 利用Nicolet 6700型傅立叶红外光谱仪(FTIR,美国Thermo)测定材料的FTIR光谱.
1.4 PBDEs的SPME分析过程
在40.00 mL具有聚四氟乙烯垫片的玻璃样品瓶(美国Supelco)中加入30.00 mL的PBDEs溶液,将SPME涂层插入溶液中进行萃取. 萃取温度和搅拌速度由加热磁力搅拌器(美国Scilogex)控制. 萃取完成后,将涂层置于气相色谱(GC,6890N,美国Agilent)进样口进行热解吸,并利用电子捕获检测器(ECD)测定PBDEs浓度. GC-ECD具体检测条件如下:分离色谱柱为TG-5MS毛细管柱(30 m×0.32 mm×0.25 μm,美国Thermo);载气为1.60 mL·min−1高纯氮(≥99.999%,南京天泽气体有限公司);柱温初始温度为80 ℃,保持1 min,再以20 ℃·min−1升至280 ℃,保持5 min,最后以2 ℃·min−1升至300 ℃,保持2 min;检测器温度为310 ℃[18].
2. 结果与讨论(Result and Discussion)
2.1 TpBD涂层的表征结果
图1为TpBD涂层材料的表征结果. 在XRD图谱中(图1a),2θ=3.42°(100)处的强尖峰体现了TpBD的高结晶度;2θ=26.35°(001)处的宽峰来源于TpBD中芳香结构的π-π堆积[19-20]. FTIR图谱(图1b)中也出现了TpBD的特征峰,包括芳香C=C在1573 cm−1和1450 cm−1处的振动峰,以及C—N在1284 cm−1处的振动峰,说明形成了β-酮胺连接的骨架结构[21]. 氮气吸附-脱附等温线测定结果(图1c)显示,所合成材料的BET比表面积达695.56 m2·g−1,孔体积为0.50 cm3·g−1,主要孔径分布在0.54—2.34 nm 之间,与文献报道的TpBD孔结构一致[17]. 以上结果证实TpBD的正确合成.TGA图谱表明(图1d),TpBD材料在30—360 ℃范围内无明显失重(低于10%),说明TpBD具有良好的热稳定性,适用于PBDEs等高沸点污染物的分析.
图2为TpBD粉末及涂层的SEM图.TpBD呈球状颗粒(图2a和b),直径在10 μm以内,与文献报道的形貌一致[17].图2c和d显示,在TpBD涂层中,TpBD粉末均匀分布于不锈钢丝基底表面,涂层厚度约为50 μm.
2.2 TpBD涂层萃取条件的优化
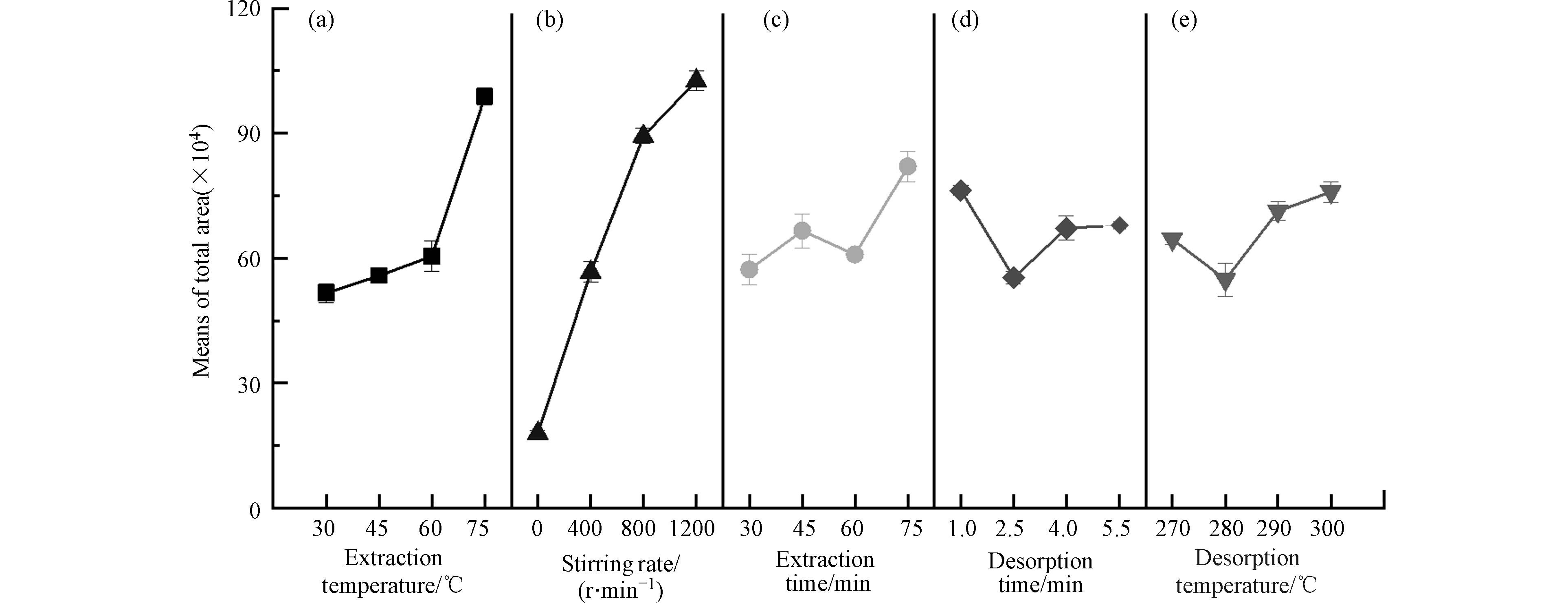
利用正交实验(L16(45)),对TpBD涂层萃取PBDEs的条件进行优化[22]. 其中PBDEs加标浓度为50.00 ng·L−1,所考察萃取条件因素包括萃取温度(30、45、60、75 ℃)、萃取时间(30、45、60、75 min)、搅拌速度(0、400、800、1200 r·min−1)、解吸温度(270、280、290、300 ℃)和解吸时间(1.0、2.5、4.0、5.5 min),以每个因素每个水平下萃取PBDEs的峰面积总和作为正交实验结果的响应值(图3)[23].
表2为正交实验的极差分析和方差分析结果. 可以看出,萃取温度和搅拌速度对TpBD涂层的萃取效率具有显著影响(P<0.05). 萃取温度的升高可以提高PBDEs的扩散速率,进而提高萃取效率. 如图3a所示,当萃取温度由30 ℃升至75 ℃时,TpBD涂层的萃取效率持续提高(图3a),故取75 ℃为最优萃取温度.图3b为搅拌速度对萃取效率的影响. 随着搅拌速度的提高,PBDEs的扩散加快[24],涂层的萃取效率也提高,因此选择1200 r·min−1为最优搅拌速度.图3c—e为其它因素对萃取过程的影响. 综合考虑萃取效率和分析速度,取最优萃取时间为45 min,解吸时间为1.0 min,解吸温度为290 ℃.
表 2 正交实验的极差分析和方差分析结果Table 2. Results of range analysis and analysis of variance (ANOVA) for the orthogonal experiments.条件Conditions 方差分析 Analysis of variance (ANOVA) 极距(×105)Polar distance 方差和(×1011)Sum of variance 组间自由度Degree of freedom between groups 组内自由度Degree of freedom within the group F P 萃取温度/℃ 4.722 5.656 3 44 4.011 0.013* 萃取时间/min 2.479 6.812 3 44 0.842 0.478 搅拌速度/(r·min−1) 8.462 2.541 3 44 26.911 0.000* 解吸温度/℃ 2.110 6.928 3 44 0.582 0.630 解吸时间/min 2.096 6.960 3 44 0.513 0.676 注:* P<0.05. 2.3 TpBD涂层的萃取性能
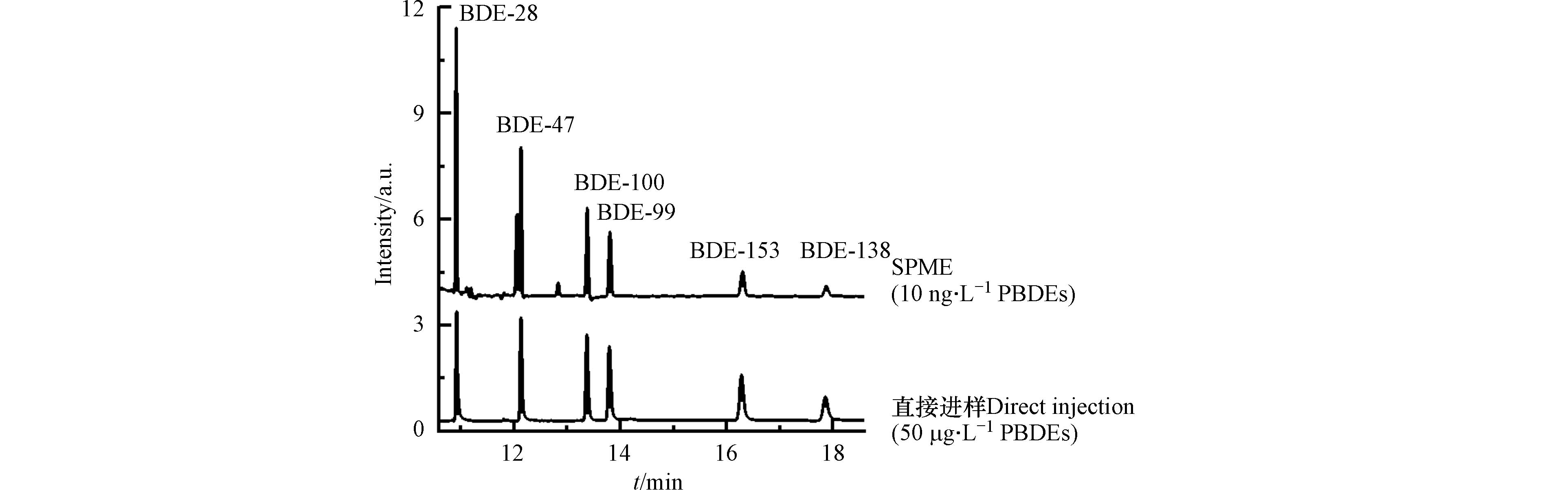
首先考察了TpBD涂层对PBDEs的萃取效率. 如图4所示,TpBD涂层可高效萃取水中的PBDEs,其对所测试6种PBDEs的富集倍数高达1970—3820(表3). 在相同萃取条件下,TpBD涂层的萃取效率是商用100 μm PDMS(聚二甲基硅氧烷)涂层的1.2—2.0倍,85 μm PA(聚丙烯酸酯)涂层的1.8—10.7倍,65 μm PDMS/DVB(聚二甲基硅氧烷/二乙烯基苯)涂层的3.2—11.9倍,50/30 μm DVB/CAR/PDMS(二乙烯基苯/羧基/聚二甲基硅氧烷)涂层的6.0—39.5倍.TpBD涂层的高萃取效率一方面源于其较高的比表面积和较强的表面疏水性,可通过疏水作用吸附PBDEs[25]. 与此相一致,实验发现除BDE-28之外,其余5种PBDEs在TpBD涂层上的富集倍数(表3)随其疏水性(表1)的增强而增大. 另一方面,TpBD富含芳香结构(见XRD和FTIR表征结果),因此能与PBDEs的苯环发生π-π相互作用,进而增强对PBDEs的富集. Li等[21]和Gao等[26]的研究也指出,π-π相互作用是TpBD吸附双酚A、四溴双酚A等芳香性污染物的重要机制. 此外,TpBD具有发达的孔道结构,其中孔径在1.00—1.36 nm之间的孔含量尤为丰富(图1c). 这些孔道的尺寸与PBDEs分子的大小(1.00 nm左右,表1)接近,因而可通过孔填充效应引起的吸附势能叠加,进一步促进TpBD涂层对PBDEs的富集[27-28].
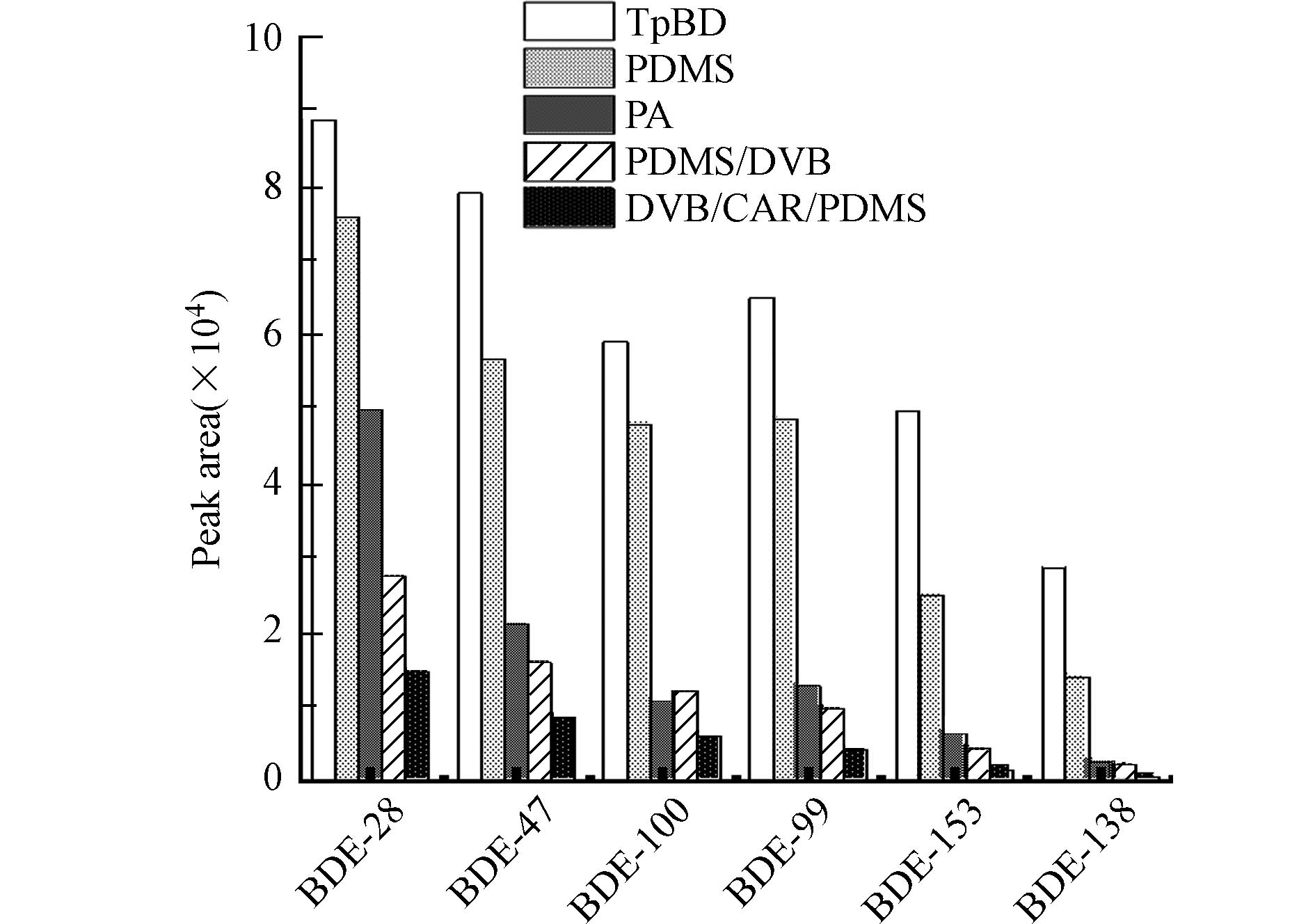 图 4 TpBD涂层和商业涂层对PBDEs的萃取效率Figure 4. Comparison of extraction efficiency of PBDEs between TpBD coated fiber and commercial fibers.PBDEs浓度为10.00 ng·L−1,萃取温度75 ℃,搅拌速度1200 r·min−1,萃取时间45 min,解吸时间1 min,解吸温度290 ℃PBDEs concentrations of 10.00 ng·L−1, extraction temperature of 75 ℃, stirring rate of 1200 r·min−1, extraction time of 45 min, desorption time of 1 min, desorption temperature of 290 ℃.表 3 基于TpBD涂层的SPME-GC/ECD方法对PBDEs的分析性能Table 3. Analytical performance of the SPME-GC/ECD method based on TpBD coated fiber
图 4 TpBD涂层和商业涂层对PBDEs的萃取效率Figure 4. Comparison of extraction efficiency of PBDEs between TpBD coated fiber and commercial fibers.PBDEs浓度为10.00 ng·L−1,萃取温度75 ℃,搅拌速度1200 r·min−1,萃取时间45 min,解吸时间1 min,解吸温度290 ℃PBDEs concentrations of 10.00 ng·L−1, extraction temperature of 75 ℃, stirring rate of 1200 r·min−1, extraction time of 45 min, desorption time of 1 min, desorption temperature of 290 ℃.表 3 基于TpBD涂层的SPME-GC/ECD方法对PBDEs的分析性能Table 3. Analytical performance of the SPME-GC/ECD method based on TpBD coated fiber同类物Congeners 线性范围/(ng·L−1)Linear range 相关系数Regressioncoefficient 检出限(S/N=3)/(ng·L−1) LOD 定量限(S/N=10)/(ng·L−1) LOQ 日内萃取重复性(n=5)/% Intra-day repeatability 日间萃取重复性(n=3)/% Inter-day repeatability 制备重复性(n=3)/% Fiber-to-fiber reproducibility 富集倍数Enhancement factor BDE-28 1.00—50.00 0.999 0.16 0.52 14.7 8.7 8.0 2990 BDE-47 1.00—50.00 0.998 0.20 0.66 14.1 11.3 7.6 2750 BDE-100 1.00—50.00 0.992 0.30 1.00 13.4 12.0 7.2 1970 BDE-99 1.00—50.00 0.996 0.24 0.80 8.2 9.1 9.7 2560 BDE-153 1.00—50.00 0.995 0.40 1.34 10.3 12.9 6.3 2790 BDE-138 2.00—50.00 0.994 0.45 1.50 13.9 13.5 13.1 3820 除萃取效率外,稳定性也是SPME涂层的重要性能参数.TpBD在360 ℃时的热失重仅为10%(图1d),表明其具有优秀的热稳定性. 为进一步探究TpBD涂层的化学稳定性,将其依次浸入0.10 mol·L−1盐酸溶液(pH 1)、0.01 mol·L−1氢氧化钠溶液(pH 12)、极性溶剂甲醇和非极性溶剂正己烷中,分别浸渍12 h[29],对比浸渍处理前后涂层对PBDEs的萃取效果. 如图5所示,各项浸渍处理对TpBD涂层的萃取性能均没有显著影响,处理前后涂层萃取效率的相对标准偏差(RSD)为1.0%—14.6%.
 图 5 酸、碱和溶剂处理对TpBD涂层萃取效率的影响Figure 5. Effect of acid/base or solvent treatments on extraction efficiency of PBDEs by TpBD coated fiberPBDEs浓度为10.00 ng·L−1,萃取温度75 ℃,搅拌速度1200 r·min−1,萃取时间45 min,解吸时间1 min,解吸温度290 ℃PBDEs concentrations of 10.00 ng·L−1, extraction temperature of 75 ℃, stirring rate of 1200 r·min−1, extraction time of 45 min, desorption time of 1 min, desorption temperature of 290 ℃.
图 5 酸、碱和溶剂处理对TpBD涂层萃取效率的影响Figure 5. Effect of acid/base or solvent treatments on extraction efficiency of PBDEs by TpBD coated fiberPBDEs浓度为10.00 ng·L−1,萃取温度75 ℃,搅拌速度1200 r·min−1,萃取时间45 min,解吸时间1 min,解吸温度290 ℃PBDEs concentrations of 10.00 ng·L−1, extraction temperature of 75 ℃, stirring rate of 1200 r·min−1, extraction time of 45 min, desorption time of 1 min, desorption temperature of 290 ℃.图5表明,TpBD涂层在较宽的pH范围内(1—12)具有良好的稳定性,且对极性和非极性有机溶剂均具有较高的耐受性. 此外,重复使用实验显示,TpBD涂层在使用100次之后萃取效率没有明显降低,说明其具有较长的使用寿命.
2.4 基于TpBD涂层的SPME/GC-ECD方法对PBDEs的分析性能
利用TpBD涂层,在优化的萃取条件下建立了所测试6种PBDEs的分析方法. 该方法测定PBDEs标准样品的色谱图如图6所示,方法的线性范围、检出限、精密度、重现性等分析参数列于表3. 结果表明,BDE-28、BDE-47、BDE-100、BDE-99和BDE-153在1.00—50.00 ng·L−1,BDE-138在2.00—50.00 ng·L−1范围内具有良好的线性(R2 > 0.992). 方法对PBDEs的检出限为0.16—0.45 ng·L−1,优于文献报道的其它自制SPME涂层,如石墨烯溶胶-凝胶涂层(0.2—5.3 ng·L−1)[30]、蚀刻的不锈钢丝(0.2—0.6 ng·L−1)[22]和基于四氧化三铁纳米粒子涂层的竹炭纤维(0.25—0.62 ng·L−1)[31]. 此外,该方法还具有良好的重复性,同批次涂层日内多次萃取的RSD为8.2%—14.7%(n=5),日间多次萃取的RSD为8.7%—13.5%(n=3);3批次涂层萃取的RSD为7.2%—13.1%.
为了验证所建立方法的实际应用性,采用该方法分析了某废旧电器拆解污染场地地下水中的PBDEs浓度. 如表4所示,在实际污染水样中检测出了4种PBDEs(BDE-100、BDE-99、BDE-153和BDE-138),浓度范围为0.25—4.26 ng·L−1;其它2种PBDEs的浓度低于本方法检出限. 我们进一步开展了实际水样的加标回收实验(水样3#,加标浓度5.00 ng·L−1),测得回收率为81.1%—106.5%,RSD低于12.5%(n=3). 这些结果表明,基于TpBD涂层的SPME/GC-ECD方法可用于检测实际环境水样中的PBDEs.
表 4 基于TpBD涂层的SPME-GC/ECD方法对实际水样中PBDEs的分析结果Table 4. Analytical results for the determination of PBDEs in real water samples同类物Congeners 1#水样 2#水样 3#水样 4#水样 5#水样 6#水样 加标回收率(n=3)/%Recoveries BDE-28 NDa ND ND ND ND ND 97.6 ± 8.1 BDE-47 ND ND ND ND ND ND 90.8 ± 9.8 BDE-100 0.93 0.32 ND ND ND ND 106.5 ± 11.8 BDE-99 2.45 0.71 0.38 0.25 ND 0.31 96.3 ± 10.6 BDE-153 2.20 0.64 ND ND ND ND 83.7 ± 12.2 BDE-138 4.26 1.05 0.54 ND ND ND 81.1 ± 12.5 注:a 未检出. a not detected. 3. 结论(Conclusion)
本研究通过水热法合成TpBD型COF,以不锈钢丝为基底,利用物理黏附法制得基于TpBD材料的SPME涂层,并将其应用于萃取和检测水体中的PBDEs. 研究结果显示,TpBD涂层具有优越的PBDEs萃取性能,其萃取效率是商用涂层的1.2—39.5倍. 这是因为TpBD具有较高的比表面积和表面疏水性,还可与PBDEs产生π-π作用和孔填充作用,能高效富集水体中的PBDEs. 此外,TpBD涂层还具有良好的热稳定性和化学稳定性,使用寿命较长. 基于该涂层的PBDEs检测方法线性范围较宽、检出限低、精密度和重现性好,在实际环境水样的分析中具有良好的应用潜能.
-
环境Environment 浓度单位Concentration unit 2017年 2030年 2050年 污水处理出水 ng·L−1 1.224—103.788 2.120—211.239 6.496—472.948 污水处理污泥 μg·kg−1 32.423—2730.256 62.254—4553.974 187.964—11669.229 地表水 ng·L−1 0.035—2.789 0.063—6.258 0.134—12.896 海水 ng·L−1 0.000—0.000 0.000—0.000 0.000—0.000 沉积物(淡水) μg·kg−1 0.025—33.671 0.043—50.715 0.118—160.683 农业土壤 ng·kg−1 0.236—67.727 0.526—100.645 2.223—219.630 天然土壤 ng·kg−1 0.584—167.456 1.301—48.845 5.497—543.034 城市土壤 ng·kg−1 0.934—267.929 2.082—398.152 8.795—868.855 污泥处理土壤 ng·kg−1 20.085—1661.164 27.211—2122.734 88.785—5249.632 空气 ng·m−3 0.001—0.495 0.002—0.734 0.005—1.608 注:此表格数据来源Giese文章. Note: This table was obtained by collating data from Giese’s paper 表 2 AgNPs对无脊椎动物的生物累积
Table 2. Bioaccumulation of AgNPs in invertebrates
受试生物Tested organism 培养环境Cultivation environment 粒径/nmSize 涂层Coating 暴露时长Exposure duration 暴露浓度Exposure concentration 生物累积量Bioaccumulation 文献Refs. 大型溞(Daphnia magna) M4 9.15±3.45 CIT 24 h 120 μg·L−1 126.7 μg·g−1 [21] 大型溞(Daphnia magna) M7 21.73±0.94 CIT 14 d 12 μg·L−1 2.77 μg·g−1 [28] 大型溞(Daphnia magna) M7 20—30 CIT 21 d 19.23 μg·L−1 (1.37±0.69 )ng·D.magna−1 [16] 粉正蚓(Lumbricus rubellus) 土壤 38.2±4.5 PVP 28 d 250 mg·kg−1 50 mg·kg−1 [29] 威廉环毛蚓(Pheretima guillemi ) 土壤 22.6±7.8 PVP 28 d 7.2 mg·kg−1 (0.9 ±0.1) mg·kg−1 [22] 淡水钩虾(Gammarus fossarum) Volvic 40 CIT 15 d 5 μg·L−1 (2.09 ± 0.19) μg·L−1 [30] 白玉蜗牛(Achatina fulica) 土壤 57.6±2.5 无 14 d 20—50 mg·kg−1 3—245.7 mg·kg−1 [17] 海蠕虫(Capitella teleta) 沉积物 13.9±3.17 CIT 14 d 100 μg·g−1 (215± 92) μg·g−1 [31] 蛤蜊(Scrobicularia plana) 池塘水 40—50 乳酸 10 d 10 μg·L−1 (228 ± 64) ng·g−1 [32] 秀丽隐杆线虫(Caenorhabditis elegans) 土壤 30—50 PVP 5 d 10 μg·L−1 1.15 μg·g−1 [33] 石牡蛎(Saccostrea glomerata) 人工海水 20±5 吐温20 7 d 125 μg·L−1 (1.42 ± 0.03) μg·g−1 [34] 沙蚕(Nereis diversicolor) 沉积物 <100 PVP 10 d 50 μg·g−1 (8.56 ± 6.63) μg·g−1 [35] 杜氏阔沙蚕(Platynereis dumerilii) 人工海水 13.1±3.7 腐殖酸 24 h 200 μg·L−1 (28 ± 5) μg·g−1 [36] 贻贝(Mytilus galloprovincialis) SW 5.08±2.03 PVP/PEI 21 d 10 μg·L−1 0.73 μg·g−1 [37] 培养环境:M4-Elendt M4培养基,M7-Elendt M7 培养基,Volvic-矿泉水,SW-自然过滤海水. 涂层:CIT-柠檬酸盐,PVP-聚乙烯比咯烷酮,PEI-聚乙烯亚胺. 表中单个暴露浓度仅是用于该生物累积量所对应的暴露浓度. Cultivation environment: M4-elendt M4 medium, M7-elendt M7 medium, Volvic-mineral water, SW-naturally filtered seawater. Coating: CIT-citrate, PVP-polyvinyl pyrrolidone, PEI-polyethyleneimine. The single exposure concentration in the table is only used for the exposure concentration corresponding to the bioaccumulation. 表 3 AgNPs对无脊椎动物急性毒性数据
Table 3. Acute toxicity data of AgNPs to invertebrates
受试生物Tested organism 培养环境Cultivation environment 粒径/nmSize 涂层Coating 暴露时长Exposure duration EC50/LC50 文献Refs. 大型溞(Daphnia magna) AFW 47.7±8 CIT 48 h EC50 = 0.141 mg·L−1 [39] 水蚤(Daphnia) 实验湖水 30—50 PVP 24 h LC50 = (34—292) μg·L−1 [43] 大型溞(Daphnia magna) BBM 45.2±0.2 PVP 24 h LC50 = 24.97 μg·L−1 [44] 大型溞(Daphnia magna) M4 8.6±3 CIT 48 h EC50 = (110±9.3) μg·L−1 [45] 大型溞(Daphnia magna) ASTM 3—8 烷烃 24 h EC50 = 13.64 μg·L−1 [46] 盔形溞(Daphnia galeata) MHW 56.6±10.1 PVP 48 h EC50 = 35.51(CI:34.06—37.02) μg·L−1 [47] 隆线蚤(Daphnia carinata) ASTM 30 络氨酸 48 h LC50 = 35.48(CI: 29.02—42.19) μg·L−1 [48] 大型溞(Daphnia magna) M7 21.73±0.94 CIT 48 h LC50 = 34.27 μg·L−1 [28] 大型溞(Daphnia magna) M7 50±0.5 CIT 48 h LC50 = 0.078 mg·L−1 [49] 硬壳蛤(Mercenaria mercenaria) ASW 21.5±0.1 CIT 24 h LC50=1050(CI: 900—1360) μg·L−1 [50] 夹杂带丝蚓(Lumbriculus variegatum) 水 15.16±3.06 吐温20 96 h LC50 = 0.51(CI: 0.45—0.56) mg·L−1 [51] 盐卤虫(Artemia salina) ASW <100 PVP 72 h EC50 = (10.7±1.3) mg·L−1 [52] 埃及伊蚊(Aedes aegypti) 水 22.3—34.4 生物合成 48 h LC50 = 44.77 mg·L−1 [53] 埃及伊蚊(Aedes aegypti) 水 25.9—28.9 生物合成 24 h LC50 = 37.87(CI: 4.91—158.15) mg·L−1 [54] 培养环境:AFW-OECD 202人工淡水,BBM-Bold’s Basal Medium 培养基,M4-Elendt M4培养基,ASTM-美国材料与试验协会培养基,MHW-中等硬度水,M7-Elendt M7 培养基, ASW-人造海水. 涂层:CIT-柠檬酸盐,PVP-聚乙烯比咯烷酮. CI:为95%置信区间,未标注CI的则在原文献中没有标出置信区间. Cultivation environment: AFW-OECD 202 artificial fresh water, BBM-bold's basal medium, M4-elendt M4 medium, ASTM-american society for testing and materials medium, MHW-medium hard water, M7-elendt M7 medium, ASW-artificial seawater. Coating: CIT-citrate, PVP- polyvinyl pyrrolidone. CI: 95% Confidence intervals. Unlabeled CI were not marked with confidence intervals in the original literature. 表 4 AgNPs对无脊椎动物毒性的主要影响因素
Table 4. Main influencing factors of AgNPs toxicity to invertebrates
受试生物Tested organism 影响因素Influencing factor 结果Result 文献Refs. 黄粉虫(Tenebrio molitor) 涂层 CIT涂层摄取和消除效率低于石蜡和PVP涂层 [76] 粉正蚓(Lumbricus rubellus) 涂层 毒性:BSA>PVP>Chit [29] 淡水钩虾(Gammarus fossarum) 涂层 毒性:CIT>PEG [77] 端足虫(Hyalella-azteca) 涂层 毒性:CIT>PVP [78] 大型溞(Daphnia magna) 涂层、粒径 毒性:40 nm>110 nm;CIT>PVP [44] 大型溞(Daphnia magna) 粒径 毒性:10 nm>20 nm>40 nm>60 nm>80 nm [39] 铜锈环棱螺(Bellamya aeruginosa) 粒径 毒性:40 nm、80 nm>20 nm [24] 秀丽隐杆线虫(Caenorhabditis elegans) 形貌 毒性:纳米银颗粒>纳米银板>纳米银线 [79] 盔形溞(Daphnia galeata) 形貌 毒性:纳米银板>纳米银颗粒>纳米银线 [47] 大型溞(Daphnia magna) 环境 富磷食物、藻类可以降低纳米银毒性 [80] 水蚤(Daphnia) 环境 纳米银毒性随天然有机物的增加而下降 [81] 土壤线蚓(Enchytraeus crypticus) 环境 乙酰半胱氨酸可以降低纳米银毒性 [82] 盐卤虫(Artemia salina) 环境 温度升高、盐度下降提高纳米银毒性 [83] 贻贝(Mytilus galloprovincialis) 环境 银积累量,秋季高于春季 [37] 大型蚤(Daphnia magna) 途径 毒性:饮食途径>水体途径 [28] 白玉蜗牛(Achatina fulica) 途径 毒性:饮食途径>土壤途径 [17] 涂层:CIT-柠檬酸盐,PVP-聚乙烯比咯烷酮,BSA-牛血清白蛋白,Chit-壳聚糖,PEG-聚乙二醇. Coating: CIT-citrate, PVP- polyvinyl pyrrolidone, BSA-bovine albumin, Chit-chitosan, PEG-polyethylene glycol. -
[1] GIESE B, KLAESSIG F, PARK B, et al. Risks, release and concentrations of engineered nanomaterial in the environment [J]. Scientific Reports, 2018, 8: 1565. doi: 10.1038/s41598-018-19275-4 [2] 杨亚宁. 环境中离子强度对纳米银物化特性及其毒理学效应的影响[D]. 合肥: 中国科学技术大学, 2019. YANG Y N. Effects of ionic strength on physicochemical and toxicological properties of silver nanoparticles in the environment[D]. Hefei: University of Science and Technology of China, 2019(in Chinese).
[3] NOWACK B. Evaluation of environmental exposure models for engineered nanomaterials in a regulatory context [J]. NanoImpact, 2017, 8: 38-47. doi: 10.1016/j.impact.2017.06.005 [4] DOOLETTE C L, MCLAUGHLIN M J, KIRBY J K, et al. Bioavailability of silver and silver sulfide nanoparticles to lettuce (Lactuca sativa): Effect of agricultural amendments on plant uptake [J]. Journal of Hazardous Materials, 2015, 300: 788-795. doi: 10.1016/j.jhazmat.2015.08.012 [5] SUN T Y, GOTTSCHALK F, HUNGERBÜHLER K, et al. Comprehensive probabilistic modelling of environmental emissions of engineered nanomaterials [J]. Environmental Pollution, 2014, 185: 69-76. doi: 10.1016/j.envpol.2013.10.004 [6] DEYCARD V N, SCHÄFER J, PETIT J C J, et al. Inputs, dynamics and potential impacts of silver (Ag) from urban wastewater to a highly turbid estuary (SW France) [J]. Chemosphere, 2017, 167: 501-511. doi: 10.1016/j.chemosphere.2016.09.154 [7] COURTOIS P, RORAT A, LEMIERE S, et al. Ecotoxicology of silver nanoparticles and their derivatives introduced in soil with or without sewage sludge: A review of effects on microorganisms, plants and animals [J]. Environmental Pollution, 2019, 253: 578-598. doi: 10.1016/j.envpol.2019.07.053 [8] TORTELLA G R, RUBILAR O, DURÁN N, et al. Silver nanoparticles: Toxicity in model organisms as an overview of its hazard for human health and the environment [J]. Journal of Hazardous Materials, 2020, 390: 121974. doi: 10.1016/j.jhazmat.2019.121974 [9] DU J, TANG J H, XU S D, et al. A review on silver nanoparticles-induced ecotoxicity and the underlying toxicity mechanisms [J]. Regulatory Toxicology and Pharmacology, 2018, 98: 231-239. doi: 10.1016/j.yrtph.2018.08.003 [10] BRAMI C, GLOVER A R, BUTT K R, et al. Effects of silver nanoparticles on survival, biomass change and avoidance behaviour of the endogeic earthworm Allolobophora chlorotica [J]. Ecotoxicology and Environmental Safety, 2017, 141: 64-69. doi: 10.1016/j.ecoenv.2017.03.015 [11] 李文华. 纳米银致秀丽线虫神经毒性效应研究[D]. 南京: 东南大学, 2020. LI W H. Study on neurotoxic effects of silver nanoparticles in Caenorhabditis elegans[D]. Nanjing: Southeast University, 2020(in Chinese).
[12] SMÉKALOVÁ M, PANÁČEK A, JANČULA D, et al. Culture medium mediated aggregation and re-crystallization of silver nanoparticles reduce their toxicity [J]. Applied Materials Today, 2018, 12: 198-206. doi: 10.1016/j.apmt.2018.05.004 [13] AUCLAIR J, PEYROT C, WILKINSON K J, et al. The geometry of the toxicity of silver nanoparticles to freshwater mussels [J]. Comparative Biochemistry and Physiology Part C:Toxicology & Pharmacology, 2021, 239: 108841. [14] 王晓科, 石清清, 邓代莉, 等. 基于土壤模式生物的纳米材料毒理研究进展 [J]. 生态毒理学报, 2018, 13(3): 31-41. WANG X K, SHI Q Q, DENG D L, et al. Review on toxicology of nanomaterials based on soil model organisms [J]. Asian Journal of Ecotoxicology, 2018, 13(3): 31-41(in Chinese).
[15] 彭宇旭. 枸杞多糖减少纳米银引起秀丽隐杆线虫损伤的实验研究[D]. 武汉: 华中师范大学, 2020. PENG Y X. Lycium barbarum polysaccharides reduce the damage of nanosilver to c. elegans[D]. Wuhan: Central China Normal University, 2020(in Chinese).
[16] SAKKA Y, SKJOLDING L M, MACKEVICA A, et al. Behavior and chronic toxicity of two differently stabilized silver nanoparticles to Daphnia magna [J]. Aquatic Toxicology, 2016, 177: 526-535. doi: 10.1016/j.aquatox.2016.06.025 [17] 卿婷. 白玉蜗牛对土壤和食物相纳米银的生物富集与毒性响应规律[D]. 湘潭: 湘潭大学, 2021. QING T. The bioaccumulation and toxicity response of silver nanoparticles in the terrestrial snail Achatina fulica under soil and food exposures[D]. Xiangtan: Xiangtan University, 2021(in Chinese).
[18] DUROUDIER N, CARDOSO C, MEHENNAOUI K, et al. Changes in protein expression in mussels Mytilus galloprovincialis dietarily exposed to PVP/PEI coated silver nanoparticles at different seasons [J]. Aquatic Toxicology, 2019, 210: 56-68. doi: 10.1016/j.aquatox.2019.02.010 [19] 秦捷, 隋铭皓, 袁博杰, 等. 纳米银在水环境中的行为及毒性效应 [J]. 四川环境, 2017, 36(6): 155-160. doi: 10.3969/j.issn.1001-3644.2017.06.026 QIN J, SUI M H, YUAN B J, et al. The behavior and effects of silver nanoparticles in the aquatic environment [J]. Sichuan Environment, 2017, 36(6): 155-160(in Chinese). doi: 10.3969/j.issn.1001-3644.2017.06.026
[20] 衣俊, 黄俊, 程金平. 纳米银在水环境中的环境行为和毒性效应研究进展 [J]. 生态毒理学报, 2015, 10(1): 101-109. YI J, HUANG J, CHENG J P. Review of environmental behavior and toxicity of silver nanoparticles in the aquatic environment [J]. Asian Journal of Ecotoxicology, 2015, 10(1): 101-109(in Chinese).
[21] 胡奕. 纳米银的大型蚤毒性效应与生物累积[D]. 杭州: 浙江大学, 2017. HU Y. Toxicity and bioaccumulation of AgNPs to Daphnia magna[D]. Hangzhou: Zhejiang University, 2017(in Chinese).
[22] LI M, RUAN L Y, DANG F, et al. Metabolic response of earthworms (Pheretima guillemi) to silver nanoparticles in sludge-amended soil [J]. Environmental Pollution, 2022, 300: 118954. doi: 10.1016/j.envpol.2022.118954 [23] COZZARI M, ELIA A C, PACINI N, et al. Bioaccumulation and oxidative stress responses measured in the estuarine ragworm (Nereis diversicolor) exposed to dissolved, nano- and bulk-sized silver [J]. Environmental Pollution, 2015, 198: 32-40. doi: 10.1016/j.envpol.2014.12.015 [24] BAO S P, HUANG J L, LIU X W, et al. Tissue distribution of Ag and oxidative stress responses in the freshwater snail Bellamya aeruginosa exposed to sediment-associated Ag nanoparticles [J]. Science of the Total Environment, 2018, 644: 736-746. doi: 10.1016/j.scitotenv.2018.07.011 [25] KHAN F R, MISRA S K, BURY N R, et al. Inhibition of potential uptake pathways for silver nanoparticles in the estuarine snail Peringia ulvae [J]. Nanotoxicology, 2015, 9(4): 493-501. doi: 10.3109/17435390.2014.948519 [26] WESTMEIER D, CHEN C Y, STAUBER R H, et al. The bio-Corona and its impact on nanomaterial toxicity [J]. European Journal of Nanomedicine, 2015, 7(3): 153-168. [27] CONG Y, BANTA G T, SELCK H, et al. Toxicity and bioaccumulation of sediment-associated silver nanoparticles in the estuarine polychaete, Nereis (Hediste) diversicolor [J]. Aquatic Toxicology, 2014, 156: 106-115. doi: 10.1016/j.aquatox.2014.08.001 [28] 王娜. 不同暴露途径下纳米银对大型溞的毒性效应[D]. 徐州: 中国矿业大学, 2021. WANG N. Toxic effects of AgNPs on Daphnia magna under different exposure routes[D]. Xuzhou: China University of Mining and Technology, 2021(in Chinese).
[29] MAKAMA S, PIELLA J, UNDAS A, et al. Properties of silver nanoparticles influencing their uptake in and toxicity to the earthworm Lumbricus rubellus following exposure in soil [J]. Environmental Pollution, 2016, 218: 870-878. doi: 10.1016/j.envpol.2016.08.016 [30] MEHENNAOUI K, CAMBIER S, MINGUEZ L, et al. Sub-chronic effects of AgNPs and AuNPs on Gammarus fossarum (Crustacea Amphipoda): From molecular to behavioural responses [J]. Ecotoxicology and Environmental Safety, 2021, 210: 111775. doi: 10.1016/j.ecoenv.2020.111775 [31] RAMSKOV T, FORBES V E, GILLILAND D, et al. Accumulation and effects of sediment-associated silver nanoparticles to sediment-dwelling invertebrates [J]. Aquatic Toxicology, 2015, 166: 96-105. doi: 10.1016/j.aquatox.2015.07.002 [32] BUFFET P E, PAN J F, POIRIER L, et al. Biochemical and behavioural responses of the endobenthic bivalve Scrobicularia plana to silver nanoparticles in seawater and microalgal food [J]. Ecotoxicology and Environmental Safety, 2013, 89: 117-124. doi: 10.1016/j.ecoenv.2012.11.019 [33] CHAN C Y S, CHIU J M. Chronic effects of coated silver nanoparticles on marine invertebrate larvae: A proof of concept study [J]. PLoS One, 2015, 10(7): e0132457. doi: 10.1371/journal.pone.0132457 [34] CARRAZCO-QUEVEDO A, RÖMER I, SALAMANCA M J, et al. Bioaccumulation and toxic effects of nanoparticulate and ionic silver in Saccostrea glomerata (rock oyster) [J]. Ecotoxicology and Environmental Safety, 2019, 179: 127-134. doi: 10.1016/j.ecoenv.2019.04.032 [35] CONG Y, BANTA G T, SELCK H, et al. Toxic effects and bioaccumulation of nano-, micron- and ionic-Ag in the polychaete, Nereis diversicolor [J]. Aquatic Toxicology (Amsterdam, Netherlands), 2011, 105(3/4): 403-411. [36] GARCÍA-ALONSO J, RODRIGUEZ-SANCHEZ N, MISRA S K, et al. Toxicity and accumulation of silver nanoparticles during development of the marine polychaete Platynereis dumerilii [J]. Science of the Total Environment, 2014, 476/477: 688-695. doi: 10.1016/j.scitotenv.2014.01.039 [37] DUROUDIER N, KATSUMITI A, MIKOLACZYK M, et al. Cell and tissue level responses in mussels Mytilus galloprovincialis dietarily exposed to PVP/PEI coated Ag nanoparticles at two seasons [J]. Science of the Total Environment, 2021, 750: 141303. doi: 10.1016/j.scitotenv.2020.141303 [38] JO H J, CHOI J W, LEE S H, et al. Acute toxicity of Ag and CuO nanoparticle suspensions against Daphnia magna: The importance of their dissolved fraction varying with preparation methods [J]. Journal of Hazardous Materials, 2012, 227/228: 301-308. doi: 10.1016/j.jhazmat.2012.05.066 [39] IVASK A, KURVET I, KASEMETS K, et al. Size-dependent toxicity of silver nanoparticles to bacteria, yeast, algae, crustaceans and mammalian cells in vitro [J]. PLoS One, 2014, 9(7): e102108. doi: 10.1371/journal.pone.0102108 [40] MEYER J N, LORD C A, YANG X Y, et al. Intracellular uptake and associated toxicity of silver nanoparticles in Caenorhabditis elegans [J]. Aquatic Toxicology, 2010, 100(2): 140-150. doi: 10.1016/j.aquatox.2010.07.016 [41] ZHAO C M, WANG W X. Importance of surface coatings and soluble silver in silver nanoparticles toxicity to Daphnia magna [J]. Nanotoxicology, 2012, 6(4): 361-370. doi: 10.3109/17435390.2011.579632 [42] MACKEVICA A, SKJOLDING L M, GERGS A, et al. Chronic toxicity of silver nanoparticles to Daphnia magna under different feeding conditions [J]. Aquatic Toxicology, 2015, 161: 10-16. doi: 10.1016/j.aquatox.2015.01.023 [43] CONINE A L, REARICK D C, XENOPOULOS M A, et al. Variable silver nanoparticle toxicity to Daphnia in boreal lakes [J]. Aquatic Toxicology, 2017, 192: 1-6. doi: 10.1016/j.aquatox.2017.09.004 [44] HOU J, ZHOU Y, WANG C J, et al. Toxic effects and molecular mechanism of different types of silver nanoparticles to the aquatic crustacean Daphnia magna [J]. Environmental Science & Technology, 2017, 51(21): 12868-12878. [45] HU Y, CHEN X J, YANG K, et al. Distinct toxicity of silver nanoparticles and silver nitrate to Daphnia magna in M4 medium and surface water [J]. Science of the Total Environment, 2018, 618: 838-846. doi: 10.1016/j.scitotenv.2017.08.222 [46] RIBEIRO F, GALLEGO-URREA J A, JURKSCHAT K, et al. Silver nanoparticles and silver nitrate induce high toxicity to Pseudokirchneriella subcapitata, Daphnia magna and Danio rerio [J]. Science of the Total Environment, 2014, 466/467: 232-241. doi: 10.1016/j.scitotenv.2013.06.101 [47] CUI R X, CHAE Y, AN Y J. Dimension-dependent toxicity of silver nanomaterials on the cladocerans Daphnia magna and Daphnia galeata [J]. Chemosphere, 2017, 185: 205-212. doi: 10.1016/j.chemosphere.2017.07.011 [48] LEKAMGE S, MIRANDA A F, ABRAHAM A, et al. The toxicity of silver nanoparticles (AgNPs) to three freshwater invertebrates with different life strategies: Hydra vulgaris, Daphnia carinata, and Paratya australiensis [J]. Frontiers in Environmental Science, 2018, 6: 152. doi: 10.3389/fenvs.2018.00152 [49] 陆梦甜. 脂质体包封银(AgNPs、Ag+)对大型溞的毒性效应研究[D]. 徐州: 中国矿业大学, 2019. LU M T. Toxic effects of liposome-encapsulated silver (AgNPs, Ag+) on Daphnia magna[D]. Xuzhou: China University of Mining and Technology, 2019(in Chinese).
[50] JASSIM A Y, WANG J J, CHUNG K W, et al. Comparative assessment of the fate and toxicity of chemically and biologically synthesized silver nanoparticles to juvenile clams [J]. Colloids and Surfaces B:Biointerfaces, 2022, 209: 112173. doi: 10.1016/j.colsurfb.2021.112173 [51] LITTLE S, JOHNSTON H J, STONE V, et al. Acute waterborne and chronic sediment toxicity of silver and titanium dioxide nanomaterials towards the oligochaete, Lumbriculus variegatus [J]. NanoImpact, 2021, 21: 100291. doi: 10.1016/j.impact.2020.100291 [52] AN H J, SARKHEIL M, PARK H S, et al. Comparative toxicity of silver nanoparticles (AgNPs) and silver nanowires (AgNWs) on saltwater microcrustacean, Artemia salina [J]. Comparative Biochemistry and Physiology Part C:Toxicology & Pharmacology, 2019, 218: 62-69. [53] NASIR S, WALTERS K F A, PEREIRA R M, et al. Larvicidal activity of acetone extract and green synthesized silver nanoparticles from Allium sativum L. (Amaryllidaceae) against the dengue vector Aedes aegypti L. (Diptera: Culicidae) [J]. Journal of Asia-Pacific Entomology, 2022, 25(3): 101937. doi: 10.1016/j.aspen.2022.101937 [54] ELUMALAI D, HEMAVATHI M, DEENADHAYALAN N, et al. A novel approach for synthesis of silver nanoparticles using Pila virens shell and its mosquito larvicidal activity [J]. Toxicology Reports, 2021, 8: 1248-1254. doi: 10.1016/j.toxrep.2021.06.018 [55] DUMMEE V, TANHAN P, KRUATRACHUE M, et al. Histopathological changes in snail, Pomacea canaliculata, exposed to sub-lethal copper sulfate concentrations [J]. Ecotoxicology and Environmental Safety, 2015, 122: 290-295. doi: 10.1016/j.ecoenv.2015.08.010 [56] CHEN L, MENG X, GU J, et al. Silver nanoparticle toxicity in silkworms: Omics technologies for a mechanistic understanding [J]. Ecotoxicology and Environmental Safety, 2019, 172: 388-395. doi: 10.1016/j.ecoenv.2019.01.055 [57] LUO X, ZHANG Y J, FU X L, et al. Effects of environmental factor fulvic acid on AgNPs food chain delivery and bioavailability [J]. Comparative Biochemistry and Physiology Part C:Toxicology & Pharmacology, 2022, 258: 109369. [58] VÖLKER C, BOEDICKER C, DAUBENTHALER J, et al. Comparative toxicity assessment of nanosilver on three Daphnia species in acute, chronic and multi-generation experiments [J]. PLoS One, 2013, 8(10): e75026. doi: 10.1371/journal.pone.0075026 [59] LIM D, ROH J Y, EOM H J, et al. Oxidative stress-related PMK-1 P38 MAPK activation as a mechanism for toxicity of silver nanoparticles to reproduction in the nematode Caenorhabditis elegans [J]. Environmental Toxicology and Chemistry, 2012, 31(3): 585-592. doi: 10.1002/etc.1706 [60] NAIR P M G, PARK S Y, LEE S W, et al. Differential expression of ribosomal protein gene, gonadotrophin releasing hormone gene and Balbiani ring protein gene in silver nanoparticles exposed Chironomus riparius [J]. Aquatic Toxicology, 2011, 101(1): 31-37. doi: 10.1016/j.aquatox.2010.08.013 [61] 李婷竹. 不同特性纳米银制备及遗传毒性定量研究[D]. 南京: 东南大学, 2017. LI T Z. Study on preparation and genotoxicity of silver nanoparticles with different characteristics[D]. Nanjing: Southeast University, 2017(in Chinese).
[62] CYPRIYANA P J J, S S, ANGALENE J L A, et al. Overview on toxicity of nanoparticles, it's mechanism, models used in toxicity studies and disposal methods - A review [J]. Biocatalysis and Agricultural Biotechnology, 2021, 36: 102117. doi: 10.1016/j.bcab.2021.102117 [63] CHOI J S, PARK J W. Molecular characterization and toxicological effects of citrate-coated silver nanoparticles in a terrestrial invertebrate, the earthworm (Eisenia fetida) [J]. Molecular & Cellular Toxicology, 2015, 11(4): 423-431. [64] ALARABY M, ROMERO S, HERNÁNDEZ A, et al. Toxic and genotoxic effects of silver nanoparticles in Drosophila [J]. Environmental and Molecular Mutagenesis, 2019, 60(3): 277-285. doi: 10.1002/em.22262 [65] BOTELHO M T, de ARRUDA ROCHA CAMPOS PASSOS M J, TREVIZANI T H, et al. Genotoxic effects of silver nanoparticles on a tropical marine amphipod via feeding exposure [J]. Mutation Research/Genetic Toxicology and Environmental Mutagenesis, 2022, 881: 503527. doi: 10.1016/j.mrgentox.2022.503527 [66] WAMUCHO A, HEFFLEY A, TSYUSKO O V. Epigenetic effects induced by silver nanoparticles in Caenorhabditis elegans after multigenerational exposure [J]. Science of the Total Environment, 2020, 725: 138523. doi: 10.1016/j.scitotenv.2020.138523 [67] PAKRASHI S, TAN C, WANG W X. Bioaccumulation-based silver nanoparticle toxicity in Daphnia magna and maternal impacts [J]. Environmental Toxicology and Chemistry, 2017, 36(12): 3359-3366. doi: 10.1002/etc.3917 [68] 卜春红, 高大文. 蚯蚓回避反应在生态毒理研究中的应用进展[J]. 农业环境科学学报, 2006, 25(S2): 799-804. BU C H, GAO D W. Application progress of earthworm avoidance response test in ecotoxicity research[J]. Journal of Agro-Environment Science, 2006, 25(Sup 2): 799-804(in Chinese).
[69] GONZÁLEZ-ALCARAZ M N, MALHEIRO C, CARDOSO D N, et al. Soil moisture influences the avoidance behavior of invertebrate species in anthropogenic metal(loid)-contaminated soils [J]. Environmental Pollution, 2019, 248: 546-554. doi: 10.1016/j.envpol.2019.01.105 [70] SAHA S, CHUKWUKA A V, MUKHERJEE D, et al. Behavioral and physiological toxicity thresholds of a freshwater vertebrate (Heteropneustes fossilis) and invertebrate (Branchiura sowerbyi), exposed to zinc oxide nanoparticles (nZnO): A General Unified Threshold model of Survival (GUTS) [J]. Comparative Biochemistry and Physiology Part C:Toxicology & Pharmacology, 2022, 262: 109450. [71] ZIDAR P, KOS M, ILIČ E, et al. Avoidance behaviour of isopods (Porcellio scaber) exposed to food or soil contaminated with Ag- and CeO2- nanoparticles [J]. Applied Soil Ecology, 2019, 141: 69-78. doi: 10.1016/j.apsoil.2019.05.011 [72] 王秀娟, 薛玉英, 唐萌. 纳米银的体内毒性及毒作用机制研究进展 [J]. 生态毒理学报, 2018, 13(1): 50-60. doi: 10.7524/AJE.1673-5897.20170424002 WANG X J, XUE Y Y, TANG M. Research progress on internal toxicity and the toxic mechanism of silver nanoparticles [J]. Asian Journal of Ecotoxicology, 2018, 13(1): 50-60(in Chinese). doi: 10.7524/AJE.1673-5897.20170424002
[73] MANKE A, WANG L Y, ROJANASAKUL Y. Mechanisms of nanoparticle-induced oxidative stress and toxicity [J]. BioMed Research International, 2013, 2013: 942916. [74] PAN Y B, LIN S J, ZHANG W J. Epigenetic effects of silver nanoparticles and ionic silver in Tetrahymena thermophila [J]. Science of the Total Environment, 2021, 768: 144659. doi: 10.1016/j.scitotenv.2020.144659 [75] AHAMED M, POSGAI R, GOREY T J, et al. Silver nanoparticles induced heat shock protein 70, oxidative stress and apoptosis in Drosophila melanogaster [J]. Toxicology and Applied Pharmacology, 2010, 242(3): 263-269. doi: 10.1016/j.taap.2009.10.016 [76] KHODAPARAST Z, van GESTEL C A M, PAPADIAMANTIS A G, et al. Toxicokinetics of silver nanoparticles in the mealworm Tenebrio molitor exposed via soil or food [J]. Science of the Total Environment, 2021, 777: 146071. doi: 10.1016/j.scitotenv.2021.146071 [77] MEHENNAOUI K, CAMBIER S, SERCHI T, et al. Do the pristine physico-chemical properties of silver and gold nanoparticles influence uptake and molecular effects on Gammarus fossarum (Crustacea Amphipoda)? [J]. Science of the Total Environment, 2018, 643: 1200-1215. doi: 10.1016/j.scitotenv.2018.06.208 [78] KUSI J, MAIER K J. Evaluation of silver nanoparticle acute and chronic effects on freshwater amphipod (Hyalella azteca) [J]. Aquatic Toxicology, 2022, 242: 106016. doi: 10.1016/j.aquatox.2021.106016 [79] MOON J, KWAK J I, AN Y J. The effects of silver nanomaterial shape and size on toxicity to Caenorhabditis elegans in soil media [J]. Chemosphere, 2019, 215: 50-56. doi: 10.1016/j.chemosphere.2018.09.177 [80] CONINE A L, FROST P C. Variable toxicity of silver nanoparticles to Daphnia magna: Effects of algal particles and animal nutrition [J]. Ecotoxicology (London, England), 2017, 26(1): 118-126. doi: 10.1007/s10646-016-1747-2 [81] GAO J, POWERS K, WANG Y, et al. Influence of Suwannee River humic acid on particle properties and toxicity of silver nanoparticles [J]. Chemosphere, 2012, 89(1): 96-101. doi: 10.1016/j.chemosphere.2012.04.024 [82] MENDONÇA M C P, RODRIGUES N P, SCOTT-FORDSMAND J J, et al. The toxicity of silver nanomaterials (NM 300K) is reduced when combined with N-Acetylcysteine: Hazard assessment on Enchytraeus crypticus [J]. Environmental Pollution, 2020, 256: 113484. doi: 10.1016/j.envpol.2019.113484 [83] ASADI DOKHT LISH R, JOHARI S A, SARKHEIL M, et al. On how environmental and experimental conditions affect the results of aquatic nanotoxicology on brine shrimp (Artemia salina): A case of silver nanoparticles toxicity [J]. Environmental Pollution, 2019, 255: 113358. doi: 10.1016/j.envpol.2019.113358 [84] 许志珍, 赵鹏, 张元宝, 等. 人工纳米材料对典型生物的毒性效应研究进展 [J]. 安全与环境学报, 2017, 17(2): 786-792. XU Z Z, ZHAO P, ZHANG Y B, et al. Research progress review in the toxic effects of the engineering nanomaterials on the typical organisms [J]. Journal of Safety and Environment, 2017, 17(2): 786-792(in Chinese).
[85] LIU H Q, WANG X X, WU Y Z, et al. Toxicity responses of different organs of zebrafish (Danio rerio) to silver nanoparticles with different particle sizes and surface coatings [J]. Environmental Pollution, 2019, 246: 414-422. doi: 10.1016/j.envpol.2018.12.034 [86] GHETAS H A, ABDEL-RAZEK N, SHAKWEER M S, et al. Antimicrobial activity of chemically and biologically synthesized silver nanoparticles against some fish pathogens [J]. Saudi Journal of Biological Sciences, 2022, 29(3): 1298-1305. doi: 10.1016/j.sjbs.2021.11.015 [87] 刘艳娥. 分散剂在纳米银制备中的影响 [J]. 山东化工, 2015, 44(3): 90-91,97. doi: 10.3969/j.issn.1008-021X.2015.03.030 LIU Y E. The impact of the dispersant in the preparation of silver nanoparticles [J]. Shandong Chemical Industry, 2015, 44(3): 90-91,97(in Chinese). doi: 10.3969/j.issn.1008-021X.2015.03.030
[88] JU-NAM Y, LEAD J R. Manufactured nanoparticles: An overview of their chemistry, interactions and potential environmental implications [J]. Science of the Total Environment, 2008, 400(1/2/3): 396-414. [89] BURKOWSKA-BUT A, SIONKOWSKI G, WALCZAK M. Influence of stabilizers on the antimicrobial properties of silver nanoparticles introduced into natural water [J]. Journal of Environmental Sciences, 2014, 26(3): 542-549. doi: 10.1016/S1001-0742(13)60451-9 [90] COURTOIS P, RORAT A, LEMIERE S, et al. Medium-term effects of Ag supplied directly or via sewage sludge to an agricultural soil on Eisenia fetida earthworm and soil microbial communities [J]. Chemosphere, 2021, 269: 128761. doi: 10.1016/j.chemosphere.2020.128761 期刊类型引用(1)
1. 艾军伟,何经纬,马敏剑,杨志军,刘芳. 季鏻盐抗菌剂的结构优化及其在抗菌聚碳酸酯中的应用研究. 塑料工业. 2024(11): 159-167 .  百度学术
百度学术
其他类型引用(0)
-






 DownLoad:
DownLoad: