-
砷(arsenic)是一种广泛存在于自然界中的有毒有害元素[1]. 人体砷暴露主要来源于受污染的食物和水的摄入. 长期的砷暴露会带来癌症、皮肤病、血管疾病、糖尿病等健康风险[2-4]. 砷的毒性具有形态依赖性,其形态主要包括无机态的砷酸盐(arsenate, As(Ⅴ))、亚砷酸盐(arsenite, As(Ⅲ)),以及有机态的一甲基砷酸盐(monomethylated arsenic, MMA)、二甲基砷酸盐(dimethylated arsenic, DMA)、砷甜菜碱(arsenobetaine, AsB)、砷胆碱(arsenocholine, AsC)、砷糖和砷脂等[5]. 世界卫生组织国际癌症研究机构公布的致癌物清单中,砷和无机砷化合物为一类致癌物, MMA和DMA为潜在的致癌物质;无机砷可以抑制酶的活性,因此比有机砷具有更大的毒性[6];As(Ⅲ)的易迁移性、活性和毒性都远远高于As(Ⅴ),而AsB、AsC、砷糖等有机砷几乎没有毒性[7]. 因此,需结合砷形态来科学地评估食品中砷的健康风险.
寿司(sushi)是一种起源于日本,以海苔卷和米饭为主要原料,结合生鱼片、肉松、芥末、甜虾等配料而制成的吃食[8]. 食品添加剂联合专家委员会(JECFA)第72次会议相关数据显示,海藻、鱼类、贝类、香菇和食用真菌、稻米和米制品及一些肉制品中总砷含量较高[9],是人类膳食砷摄入的主要来源. 海苔作为寿司的主要原料之一,是传统的海产加工品,由新鲜条斑紫菜(Pyropia yezoensis)经清洗、切割、干燥和调味而成. 海藻中砷的含量和形态因种类不同而存在差异,如褐藻(Hijiki)是一种广泛用于亚洲烹饪的可食用海藻,总砷含量高且大多数是无机形式[10]. 此外,水稻由于容易吸收和积累砷,对人类健康构成重大威胁[11]. 鉴于寿司主要食材即是海苔和米饭,可能存在一定的砷污染和人体健康危害问题,然而目前对寿司中砷人体暴露风险的研究仍缺乏.
本实验在南京市场随机选购20份寿司产品,分别测定海苔、米饭以及整个寿司卷中总砷的含量,并采用高效液相色谱-电感耦合等离子体质谱联用技术测定代表性样品中砷的形态,旨在揭示食用寿司的人体健康危害.
-
于2021年8月份在南京市场购买不同品牌、不同实体店的新鲜寿司样品共20份. 所购买的寿司样品主要来自南京市栖霞区、玄武区、秦淮区,分属于15家不同品牌的寿司店,在一定程度上能代表南京市场所售卖寿司的整体状况. 所购买的寿司包含的主要食材有:海苔、米饭、肉松、黄瓜、胡萝卜、大根条、香酥丝等. 考虑到寿司在制作过程中会在米饭中添加少许寿司醋等以调味,本研究中将添加调味剂的寿司米整体作为米饭样品. 根据实验需要,采购时部分样品单独从店家购买了原材料海苔和所用米饭.
-
本实验从市场购买的寿司为新鲜即食食品,在4 h内将所采集的样品带回实验室,编号装入自封袋,从每份寿司中随机选取3小段,分别剥离海苔、寿司米、寿司馅,确保各成分剥离完全,米饭中不沾有海苔和馅料. 各个成分利用万分之一天平称量鲜重后,立即放入–20 ℃冰箱冷冻24 h,再放入真空冷冻干燥机中干燥72 h,利用食物磨碎机磨成粉末.
-
利用USEPA 3050B方法消解样品[12],具体流程为:取寿司样品、米饭样品干重约0.5 g、取海苔样品约0.1 g于50 mL消解管中,首先加入10 mL 50%硝酸溶液(65%优级纯浓硝酸与超纯水体积比1:1 配制),利用石墨炉消解仪在105 ℃下消解,待剩余溶液体积为2—3 mL时,补加5 mL 50%硝酸溶液,继续在105 ℃下消解至近干后,取出消解管,在通风橱内冷却至室温,加入2 mL 30%优级纯过氧化氢溶液,待反应平稳后,继续在105 ℃下消解,直至溶液剩余2 mL左右,取出冷却至室温并用超纯水定容至30 mL. 消解液过0.45 μm滤膜至10 mL塑料离心管中,使用电感耦合等离子体质谱仪(ICP-MS, NexION300X, PerkinElmer, USA)测定消解样中砷的含量. 用1000 mg·L−1的多元素储备液配置标准曲线溶液,以In(0.05 mg·L−1)为内标,确保 ICP-MS 信号的稳定性.
为确保数据的可靠性,当标准曲线的R2>0.9995时,才接受该标准曲线用于实验样品的测定,每个样品,平行消解3 份,3次平行消解测定的砷含量的相对标准偏差小于5%. 对于QA/QC,实验过程中采用大米标准物质GBW10010a(中国地质科学院地球物理地球化学勘查研究所)进行消解和提取,砷含量为0.08±0.01 mg·kg−1,As回收率为86.61%±5.55%. 此外,在每批次消解时,另做3个消解空白,结果证明消解空白中砷含量接近于零,排除人为污染对实验结果造成的影响.
-
部分寿司样品从店家采购到单独的食材(海苔卷和米饭),选取其中的S02、S06、S12、S14样品进行砷形态提取分析(n=3). 将研磨均匀的样品,分别称取1.000 g的米饭和寿司样品粉末,称取0.100 g的海苔样品粉末于50 mL离心管中,准确记录质量,加入20 mL 甲醇/水(3:1, V/V)溶液,55 ℃条件下超声提取1 h;然后在4000 r·min−1下,离心10 min,取上清液到50 mL刻度管中;再次向样品中加入10 mL甲醇/水(1:1, V/V)的溶液,按照第一次的提取条件,重复操作1次,离心后取出上清液,再重复一次后续操作. 合并3次提取的上清液,用超纯水定容到50 mL,过0.22 µm滤膜到进样瓶中,在−80 ℃冰箱保存. 本实验选用的砷形态分离柱为阴离子交换柱(PRP-X100, 250 mm × 4.1 mm, 10 µm, Hamilton, UK),并配有保护柱(Hamilton, UK),以分析样品不同形态砷的质量分数. 流动相由1%的碳酸氢铵和5%的甲醇溶液组成,pH采用浓氨水调至8.72,流速为1.5 mL·min−1. 根据砷形态混合标液分离色谱图出峰情况,该流动相能很好地实现不同砷形态的分离.
-
本研究采用健康风险评价模型评估食用寿司的砷暴露风险,无机砷的人体平均日摄入量(DI)的计算公式为:DI=C×I/W,其中C表示样品中无机砷含量(mg·kg−1),I表示寿司的每日平均摄入量(g),W为人体体重(kg),本研究中成人体重以60 kg计算.
-
本研究中,使用Excel软件进行砷含量、平均值、标准偏差等数值的计算,数据以平均值±标准差表示(
¯x±s ),所有数据采用SigmaPlot 12.5、Origin 2021处理并作图,使用SPSS软件进行相关性分析和t检验分析. -
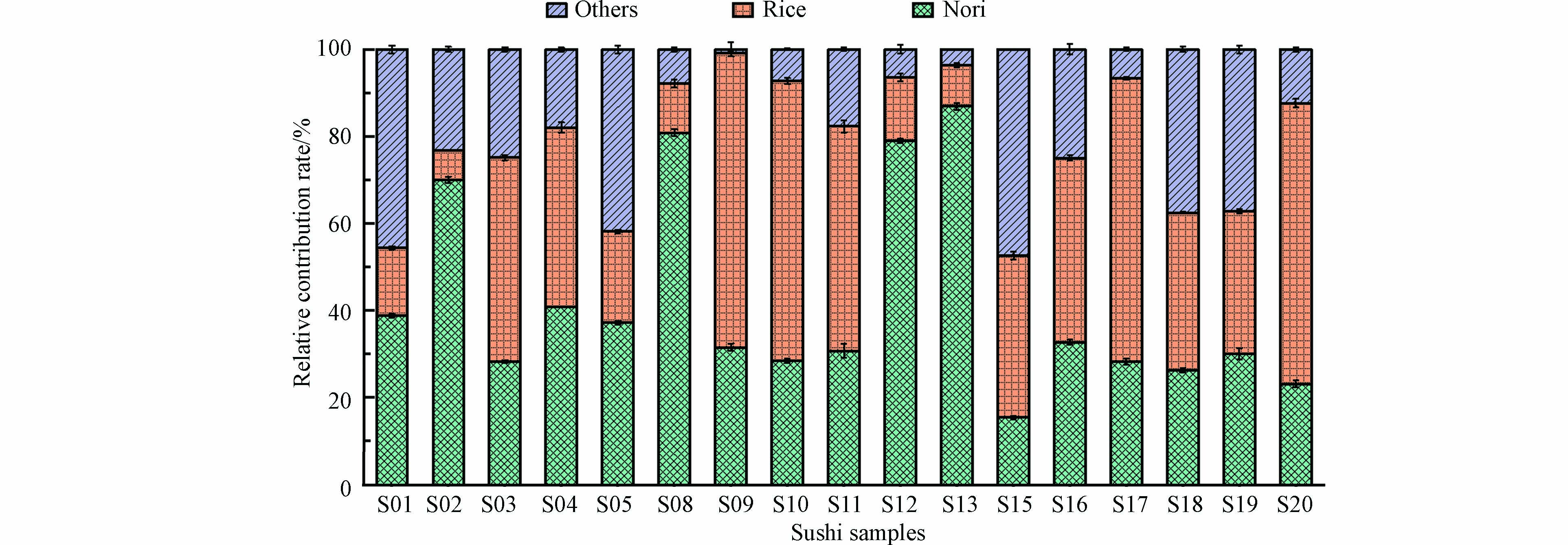
图1显示了从南京市场采集得到的20种寿司样品中海苔、米饭和其他馅料所占的鲜重相对比例. 可见,从寿司卷上面剥离下来的海苔鲜重仅占整个寿司鲜重的2.20%—5.38%,从寿司卷上面剥离下来的米饭鲜重占整个寿司鲜重的45.64%—87.31%,剩余其他馅料占整个寿司鲜重的8.67%—52.16%,海苔、米饭和其他馅料占寿司鲜重的平均值分别为3.31%±0.88%、69.48%±9.57%、27.20%±10.10%. 显然,在所采集的不同品牌的寿司样品中,米饭均是最主要的成分,而海苔所占比例最小.
-
图2显示了从南京市场采集得到的20种寿司样品、各寿司中的海苔和米饭样品中砷的含量. 由图2可见,不同样品中砷的含量存在着显著差异. 由图2(A)可得,海苔样品中砷含量为3.14—27.18 mg·kg−1,平均值为(9.67±6.65)mg·kg−1. 虽然海水中砷浓度较低且均匀(1—5 µg·L−1)[13],但由于近海海域受到不同程度的重金属污染,加上藻类对包括砷元素在内的微量元素具有特异性吸收作用,导致海藻类制品重金属污染问题受到广泛关注[14]. 已有研究发现紫菜中总砷含量很高,为14.0—42.1 mg·kg−1[15],与本研究中测得的海苔样品总As含量相似. 然而,除褐藻(Hijiki)之外的海藻,JECFA报告显示无机砷占总砷的比例不到15%,无机砷含量通常低于2 mg·kg−1[16]. 欧盟对藻类饲料中总砷限量为40 mg·kg−1,但对食用藻类中总砷含量限值未作明确规定.
由图2(B)可得米饭样品中砷含量为0.10—0.85 mg·kg−1,平均值为(0.31±0.22)mg·kg−1. 我国食品中污染物限量国家标准GB 2762—2017《食品安全国家标准 食品中污染物限量》规定,米饭中无机砷限量为0.20 mg·kg−1[17]. 由于稻米中砷(尤其是无机砷)的过度积累,米饭成为人体砷摄入的主要来源,大约占我国人群无机砷平均摄入量的60%[18-19]. 相关文献报道称米饭中的总砷含量为0.09—0.33 mg·kg−1,在砷污染地区种植的水稻,其籽粒中砷可达到1.50 mg·kg−1,甚至更高[11]. 本研究测得经过烹饪的熟米中总砷含量有11组样品低于 0.2 mg·kg−1,属于正常范围内. 可能受米饭中添加不同调味剂的影响,部分样品中总砷含量接近甚至超过0.3 mg·kg−1.
对寿司整体进行总砷含量测定,由图2(C)可得,寿司样品中总砷含量为0.34—1.57 mg·kg−1,平均值为(0.63±0.27)mg·kg−1. 显然如图2(D)所示,海苔样品中的总砷含量远高于米饭以及寿司样品中的总砷含量. 本研究所采集的寿司样品其馅料占一定比重,但馅料的鲜重受水分含量较多的黄瓜、胡萝卜、大根条等果蔬影响,对各个寿司样品其馅料进行砷含量测定,馅料样品中总砷含量为0.04—0.12 mg·kg−1,均值为(0.06±0.03)mg·kg−1,相较于海苔和米饭总砷含量要低的多. 由于市售寿司的馅料种类复杂多样,其砷含量受馅料成分影响,故寿司馅料在本研究中不做重点分析.
结合不同组分在寿司样品中的相对重量比以及不同组分砷含量,舍弃掉S06、S07、S14海苔和米饭砷贡献率超过100%的3组样品,剩余17组样品不同组分对寿司总砷含量贡献值如图3所示,海苔、米饭和其他成分对寿司总砷浓度贡献均值分别为41.68%±22.43%、36.96%±21.15%、21.36%±15.58%,即海苔在寿司中相对重量占比虽然最小,但对寿司总砷含量起主要贡献作用.
-
将4种形态As标准储备液稀释成浓度为1、2、5、10、20 µg·L−1的砷化合物混合标准溶液,在确立的实验条件下进行分析,以各种砷形态的峰面积对浓度进行线性回归,得出4种砷化物的质量浓度(x)与峰面积(y)的线性关系. 如表1所示,4种砷形态的线性相关系数均在0.9990以上. 20 µg·L−1砷化合物混合标准溶液色谱图如图4A所示,显然As(Ⅲ)、DMA、MMA、As(Ⅴ)能很好地实现分离,各形态峰到达最大值点的时刻分别为2.82、4.51、9.69、27.23 min,并且各峰尖锐,峰形较为对称.
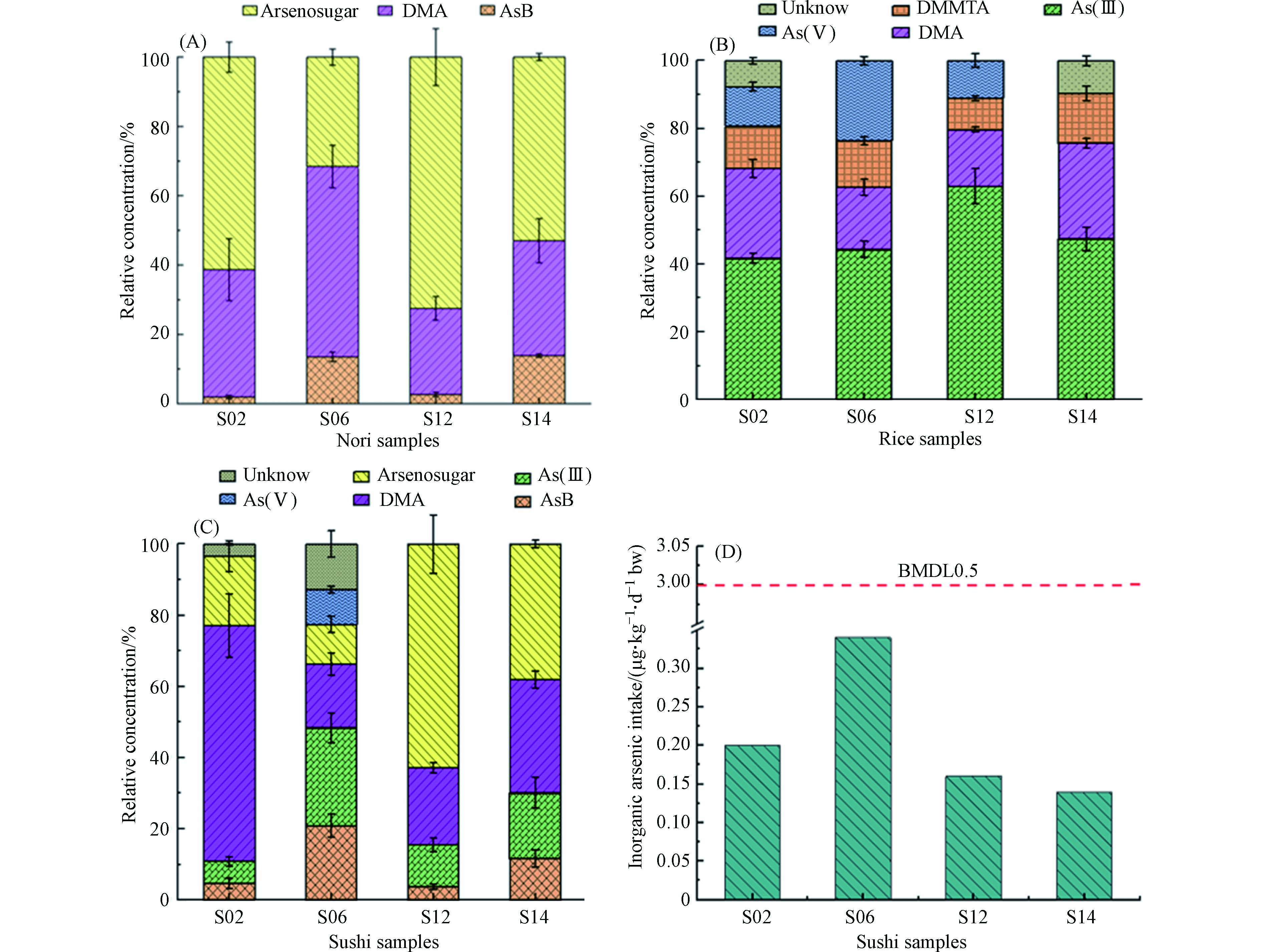
采用建立的上述方法对S02、S06、S12、S14样品(海苔、米饭、寿司)的砷形态进行测定,结果如表2、3、4所示. 4个海苔样品提取液色谱图均出现3个峰,出峰时间分别为2.16、4.51、24.2 min,其中仅第2个峰出峰时间与砷形态标准物质DMA吻合(图4B),另外2个出峰位置与4种砷标准物质出峰时间均不吻合. 研究表明,对于包括条斑紫菜在内的藻类,海水中的砷酸盐很容易通过磷通道跨膜运输被吸收到植物体内,吸收之后,藻类会通过还原和甲基化作用快速解毒砷酸盐,从而转化为砷糖、DMA、甲基砷化合物等[20]. 以往对紫菜砷形态的分析鉴定出在As(Ⅴ)前出峰的砷形态为砷糖-OH(arsenosugar-OH)[21],基于此,判定本研究在24.2 min左右出峰的砷为砷糖-OH. 此外,以往研究发现,利用HPLC-ICP-MS分离和鉴定砷形态时,2.00 min左右会出现AsC、AsB、As(Ⅲ)[21],鉴于AsC是砷甜菜碱的代谢前体,能被快速吸收并转化为AsB[22],故判定2.16 min出峰的砷为AsB. 基于以上形态判定,发现海苔样品中含有AsB、DMA、砷糖-OH这3种形态砷,未检测出无机砷. 本研究方法As形态提取的回收率在67.0%—86.4%(表2),无机砷总量明显低于藻类调味品无机砷限量国际标准0.5 mg·kg−1[17]. 各形态砷在海苔样品可提取总砷含量中占比如图5(A)所示,砷甜菜碱(AsB)、二甲基砷酸盐(DMA)、砷糖-OH占比分别为8.02%±6.57%、37.40%±12.70%和54.59%±17.31%,这些都是毒性极低甚至无毒的有机砷[22],且已有实验证明,小鼠食用紫菜消化的总砷只有0.12%—0.78%在肌肉/器官中积累,约65%—77%都通过粪便排除,不会存在砷健康风险[23].
米饭样品提取液色谱图均出现4个峰,其中第1、第2和第4个峰分别与标准物质As(Ⅲ)、DMA和As(Ⅴ)的出峰时间吻合,而在14.5 min出现的峰与砷标准物质均不吻合(图4C). 研究发现稻田土壤中除存在无机砷(如无机三价砷和五价砷)与甲基砷(如一甲基砷和二甲基砷)外,还广泛存在着巯基砷化合物,包含无机巯基砷和甲基巯基砷,其中二甲基一巯基砷(DMMTA)具有高毒性,是土壤孔隙水中主要的甲基巯基砷形态,且会在水稻籽粒中积累,对食品安全和人体健康构成威胁[24]. 最新研究发现,在大米中除了As(Ⅲ)、DMA和As(Ⅴ),还广泛存在DMMTA,其浓度为DMA的46.6%—74.5%,代表着米饭总砷含量的8.74%—13.6%. [25]. 因此,判定14.5 min出现的峰为DMMTA. 基于此,大米中砷存在形态有As(Ⅲ)、DMA、DMMTA、As(Ⅴ),其中As(Ⅲ)、DMA含量较高,As形态提取的回收率均大于90%(表3). 各形态砷在米饭样品可提取总砷含量占比如图5(B)所示,低毒性的DMA以及高毒性的As(Ⅲ)、DMMTA、As(V)占比分别为22.44%±5.79%、49.15%±9.52%、12.48%±2.36%、11.59±9.65%. 米饭样品中无机砷含量在43.31—88.87 µg·kg−1,均低于米饭无机砷限量国际标准0.20 mg·kg−1.
整个寿司样品包含了海苔和米饭的特征砷形态,具体来说,寿司中含有AsB、DMA、砷糖-OH、As(Ⅲ)、As(Ⅴ)等6种形态砷(图4D),As形态提取的回收率在47.0%—88.0%(表4),各形态砷在寿司样品可提取总砷含量占比如图5(C)所示,AsB、DMA、砷糖-OH、As(Ⅲ)、As(Ⅴ)这5种砷形态占比分别为10.32%±7.91%、34.40%±22.04%、32.87%±22.87%、15.94%±9.19%、2.44%±4.87%,DMA和砷糖是寿司样品最主要的砷形态. 由于继承了海苔和米饭中的砷形态特征,虽然海苔中砷总量特别高,但是寿司中可能产生毒害作用的无机砷,均主要继承自米饭,占寿司砷含量较大部分的有机砷均继承自海苔样品,且不同样品间各种形态有机砷含量相对高低与海苔样品保持一致.
-
目前,已有大量研究针对不同砷富集食品构成的潜在健康风险进行评估,如分析食用药用真菌(39科82属164个物种)中总砷和不同形态砷含量[26];分析不同种类蔬菜的As污染特征[27];测定中国市场生熟鸡肉中砷的浓度,并进行砷形态分布研究等[28];旨在评估人体从该类食品中摄入无机砷相关的癌症风险. 对本研究中S02、S06、S12、S14样品进行食用寿司的相关癌症风险评估,结合砷形态化合物检测回收率数据,4组样品中无机砷含量分别取各自最高值0.10、0.17、0.08、0.07 mg·kg−1,以每日成人摄入一份寿司为准,南京市寿司一份大约为300 g左右鲜重,根据实验室称量的寿司含水率数据,寿司每日平均摄入干重取120 g,估算得到成人食用该4组寿司导致的每天无机砷摄入量为0.20、0.34、0.16、0.14 µg·kg−1·d−1 bw, 平均为(0.21±0.09) µg·kg−1·d−1. 世界卫生组织规定的肺癌发病率增加0.5%的基准剂量(BMDL0.5)为3 µg·kg−1·d−1 bw [29]. 基于此安全限制,食用寿司导致的无机砷摄入量远低于BMDL0.5,表明食用寿司带来砷摄入的健康风险较低. 市场销售寿司虽然由于原材料海苔导致砷总量较高,但无机砷含量较低,因此健康风险较低.
-
(1)南京市场所采集的不同品牌的寿司样品中,米饭均是寿司的最主要成分,达到整个寿司的近70%,而海苔所占重量比极低,不超过5%,这符合市场大部分普通寿司的相对重量比情况.
(2)南京市场销售的寿司不同样品中砷的含量存在着差异,总体趋势是海苔总砷含量近乎是米饭总砷含量的30倍,导致海苔和米饭对寿司总砷含量的贡献率不同,海苔在寿司中相对重量占比虽然非常小,但对寿司总砷含量起主要贡献作用.
(3)市售寿司海苔中含有AsB、DMA、砷糖-OH共3种形态砷,未检测出无机砷;米饭中含有As(Ⅲ)、DMA、DMMTA、As(Ⅴ)等5种形态砷,其中As(Ⅲ)、DMA含量较高;继承自海苔和米饭的砷形态,寿司中相应地主要含AsB、DMA、砷糖-OH、As(Ⅲ)、As(Ⅴ)等形态砷,且有毒的砷形态主要来自于米饭,近乎无毒的有机砷主要来自海苔.
(4)采用砷摄入量评估模型评估人体食用寿司导致的无机砷摄入量显示,食用寿司带来的健康风险较低,市面上销售的寿司可以安全食用.
市售寿司中砷的人体健康风险
Human health risk of arsenic in commercial sushi
-
摘要: 砷是一种在自然界中广泛存在的有毒有害污染物,摄入受污染的食物是人体砷暴露的重要途径. 食品添加剂联合专家委员会(Joint FAO/WHO Expert Committee on Food Additives,JECFA)第72次会议指出,海苔、米饭和米制品是总砷含量较高的食物. 寿司是一种日本传统美食,近年来颇受中国大众喜爱,其主要食材即是海苔和米饭,可能存在一定的砷污染和人体健康危害问题. 本研究从我国南京市20家店面采集了共20份寿司样品,测定样品中总砷含量,并对部分样品进行砷形态分析,进而评估市售寿司中砷的人体健康风险. 对寿司进行食物成分分类,发现海苔、米饭和其他馅料的鲜重在整个寿司中的重量占比平均值分别为3.31%±0.88%、69.48%±9.57%、27.20%±10.10%;海苔、米饭和整个寿司样品(n = 20)中总砷的含量分别为3.14—27.18、0.10—0.85、0.34—1.57 mg·kg−1,平均值分别为(9.67±6.65)、(0.31±0.22)、(0.63±0.27)mg·kg−1. 对4份寿司及对应成分海苔和米饭进行砷形态分析,发现海苔中砷主要为低毒的砷甜菜碱(arsenobetaine,AsB)、二甲基砷酸盐(dimethylated arsenic,DMA)、砷糖(arsenosugar),占比分别为8.02%±6.57%、37.40%±12.70%和54.59%±17.31%,未检测出高毒性的无机砷;米饭中除了含有低毒性的DMA(22.44%±5.79%)外,含有高毒性的亚砷酸盐(arsenite,As(Ⅲ),49.15%±9.52%)、二甲基一巯基砷(dimethylated monothioarsenate,DMMTA,12.48%±2.36%)和砷酸盐(arsenate,As(Ⅴ),11.59%±9.65%);整个寿司样品包含了海苔和米饭的特征砷形态,包括AsB(10.32%±7.91%)、DMA(34.40%±22.04%)、砷糖(32.87%±22.87%)、As(Ⅲ)(15.94%±9.19%)、As(Ⅴ)(2.44%±4.87%)等. 基于寿司中砷含量和形态,成人每天通过食用寿司导致的无机砷摄入量平均为( 0.21±0.09) μg·kg−1·d−1 bw,远低于世界卫生组织规定的BMDL0.5的基准剂量3 μg·kg−1·d−1 bw,表明食用寿司的癌症风险较低. 本研究对南京市场销售的寿司样品进行砷含量、砷形态测定以及开展健康风险评价,对理解食用寿司导致的砷暴露和健康风险具有重要意义.Abstract: Arsenic (As) is a toxic element that exists widely in the environment, with food consumption being an important route of human As exposure. According to the Joint FAO/WHO Expert Committee on Food Additives (JECFA) No. 72, nori, rice, and rice products tend to contain high As concentrations. Sushi is a traditional Japanese food, which has gained popularity in the Chinese population in recent years. With nori and rice being the main ingredients, sushi may contain a considerable amount of As and pose health risk to human health. In this study, a total of 20 sushi samples were collected from 20 stores in Nanjing, China. Total As concentration and species in samples (n = 20 and 4) were measured to assess the health risk associated with sushi consumption. Dividing sushi into different ingredients, we observed that nori, rice, and other fillings contributed to 3.31%±0.88%, 69.48%±9.57%, and 27.20%±10.10% of fresh weight of sushi, respectively. Arsenic concentrations in the nori, rice, and the whole sushi samples were 3.14—27.18, 0.10—0.85, 0.34—1.57 mg·kg−1, with average of (9.67±6.65), (0.31±0.22), (0.63±0.27) mg·kg−1, respectively. Speciation analysis showed that As in the nori mainly occurred as low toxicity arsenobetaine (AsB), dimethylated arsenic (DMA), and arsenosugar, which contributed to 8.02%±6.57%, 37.40%±12.70%, and 54.59%±17.31% of total As, with inorganic As being not detected. In addition to DMA (22.44%±5.79%), the rice contained high toxicity arsenite (As(Ⅲ), 49.15%±9.52%), dimethylated monothioarsenate (DMMTA, 12.48%±2.36%), and arsenate (As(Ⅴ), 11.59%±9.65%). Consisting of nori and rice, sushi contained all As species observed in nori and rice, including AsB (10.32%±7.91%), DMA (34.40%±22.04%), arsenosugar (32.87%±22.87%), As(Ⅲ) (15.94% ± 9.19%), and As(Ⅴ) (2.44%±4.87%). Based on As concentration and species, health risk associated with sushi consumption was assessed. The estimated daily intake of inorganic As for adults was averagely (0.21±0.09) µg·kg−1·d−1 bw, which was far lower than the BMDL0.5 baseline dose of 3 µg·kg−1·d−1 bw proposed by the World Health Organization, indicating that eating sushi had a low cancer risk. In this study, As concentration, As species, and health risk of sushi samples collected from Nanjing market were studied, advancing our understanding of As exposure and health risk associated with sushi consumption.
-
Key words:
- sushi /
- nori /
- rice /
- arsenic /
- health risk assessment.
-
砷(arsenic)是一种广泛存在于自然界中的有毒有害元素[1]. 人体砷暴露主要来源于受污染的食物和水的摄入. 长期的砷暴露会带来癌症、皮肤病、血管疾病、糖尿病等健康风险[2-4]. 砷的毒性具有形态依赖性,其形态主要包括无机态的砷酸盐(arsenate, As(Ⅴ))、亚砷酸盐(arsenite, As(Ⅲ)),以及有机态的一甲基砷酸盐(monomethylated arsenic, MMA)、二甲基砷酸盐(dimethylated arsenic, DMA)、砷甜菜碱(arsenobetaine, AsB)、砷胆碱(arsenocholine, AsC)、砷糖和砷脂等[5]. 世界卫生组织国际癌症研究机构公布的致癌物清单中,砷和无机砷化合物为一类致癌物, MMA和DMA为潜在的致癌物质;无机砷可以抑制酶的活性,因此比有机砷具有更大的毒性[6];As(Ⅲ)的易迁移性、活性和毒性都远远高于As(Ⅴ),而AsB、AsC、砷糖等有机砷几乎没有毒性[7]. 因此,需结合砷形态来科学地评估食品中砷的健康风险.
寿司(sushi)是一种起源于日本,以海苔卷和米饭为主要原料,结合生鱼片、肉松、芥末、甜虾等配料而制成的吃食[8]. 食品添加剂联合专家委员会(JECFA)第72次会议相关数据显示,海藻、鱼类、贝类、香菇和食用真菌、稻米和米制品及一些肉制品中总砷含量较高[9],是人类膳食砷摄入的主要来源. 海苔作为寿司的主要原料之一,是传统的海产加工品,由新鲜条斑紫菜(Pyropia yezoensis)经清洗、切割、干燥和调味而成. 海藻中砷的含量和形态因种类不同而存在差异,如褐藻(Hijiki)是一种广泛用于亚洲烹饪的可食用海藻,总砷含量高且大多数是无机形式[10]. 此外,水稻由于容易吸收和积累砷,对人类健康构成重大威胁[11]. 鉴于寿司主要食材即是海苔和米饭,可能存在一定的砷污染和人体健康危害问题,然而目前对寿司中砷人体暴露风险的研究仍缺乏.
本实验在南京市场随机选购20份寿司产品,分别测定海苔、米饭以及整个寿司卷中总砷的含量,并采用高效液相色谱-电感耦合等离子体质谱联用技术测定代表性样品中砷的形态,旨在揭示食用寿司的人体健康危害.
1. 材料与方法(Materials and methods)
1.1 寿司样品采集
于2021年8月份在南京市场购买不同品牌、不同实体店的新鲜寿司样品共20份. 所购买的寿司样品主要来自南京市栖霞区、玄武区、秦淮区,分属于15家不同品牌的寿司店,在一定程度上能代表南京市场所售卖寿司的整体状况. 所购买的寿司包含的主要食材有:海苔、米饭、肉松、黄瓜、胡萝卜、大根条、香酥丝等. 考虑到寿司在制作过程中会在米饭中添加少许寿司醋等以调味,本研究中将添加调味剂的寿司米整体作为米饭样品. 根据实验需要,采购时部分样品单独从店家购买了原材料海苔和所用米饭.
1.2 样品制备和前处理
本实验从市场购买的寿司为新鲜即食食品,在4 h内将所采集的样品带回实验室,编号装入自封袋,从每份寿司中随机选取3小段,分别剥离海苔、寿司米、寿司馅,确保各成分剥离完全,米饭中不沾有海苔和馅料. 各个成分利用万分之一天平称量鲜重后,立即放入–20 ℃冰箱冷冻24 h,再放入真空冷冻干燥机中干燥72 h,利用食物磨碎机磨成粉末.
1.3 砷含量分析
利用USEPA 3050B方法消解样品[12],具体流程为:取寿司样品、米饭样品干重约0.5 g、取海苔样品约0.1 g于50 mL消解管中,首先加入10 mL 50%硝酸溶液(65%优级纯浓硝酸与超纯水体积比1:1 配制),利用石墨炉消解仪在105 ℃下消解,待剩余溶液体积为2—3 mL时,补加5 mL 50%硝酸溶液,继续在105 ℃下消解至近干后,取出消解管,在通风橱内冷却至室温,加入2 mL 30%优级纯过氧化氢溶液,待反应平稳后,继续在105 ℃下消解,直至溶液剩余2 mL左右,取出冷却至室温并用超纯水定容至30 mL. 消解液过0.45 μm滤膜至10 mL塑料离心管中,使用电感耦合等离子体质谱仪(ICP-MS, NexION300X, PerkinElmer, USA)测定消解样中砷的含量. 用1000 mg·L−1的多元素储备液配置标准曲线溶液,以In(0.05 mg·L−1)为内标,确保 ICP-MS 信号的稳定性.
为确保数据的可靠性,当标准曲线的R2>0.9995时,才接受该标准曲线用于实验样品的测定,每个样品,平行消解3 份,3次平行消解测定的砷含量的相对标准偏差小于5%. 对于QA/QC,实验过程中采用大米标准物质GBW10010a(中国地质科学院地球物理地球化学勘查研究所)进行消解和提取,砷含量为0.08±0.01 mg·kg−1,As回收率为86.61%±5.55%. 此外,在每批次消解时,另做3个消解空白,结果证明消解空白中砷含量接近于零,排除人为污染对实验结果造成的影响.
1.4 砷形态提取分析
部分寿司样品从店家采购到单独的食材(海苔卷和米饭),选取其中的S02、S06、S12、S14样品进行砷形态提取分析(n=3). 将研磨均匀的样品,分别称取1.000 g的米饭和寿司样品粉末,称取0.100 g的海苔样品粉末于50 mL离心管中,准确记录质量,加入20 mL 甲醇/水(3:1, V/V)溶液,55 ℃条件下超声提取1 h;然后在4000 r·min−1下,离心10 min,取上清液到50 mL刻度管中;再次向样品中加入10 mL甲醇/水(1:1, V/V)的溶液,按照第一次的提取条件,重复操作1次,离心后取出上清液,再重复一次后续操作. 合并3次提取的上清液,用超纯水定容到50 mL,过0.22 µm滤膜到进样瓶中,在−80 ℃冰箱保存. 本实验选用的砷形态分离柱为阴离子交换柱(PRP-X100, 250 mm × 4.1 mm, 10 µm, Hamilton, UK),并配有保护柱(Hamilton, UK),以分析样品不同形态砷的质量分数. 流动相由1%的碳酸氢铵和5%的甲醇溶液组成,pH采用浓氨水调至8.72,流速为1.5 mL·min−1. 根据砷形态混合标液分离色谱图出峰情况,该流动相能很好地实现不同砷形态的分离.
1.5 人体健康风险评估
本研究采用健康风险评价模型评估食用寿司的砷暴露风险,无机砷的人体平均日摄入量(DI)的计算公式为:DI=C×I/W,其中C表示样品中无机砷含量(mg·kg−1),I表示寿司的每日平均摄入量(g),W为人体体重(kg),本研究中成人体重以60 kg计算.
1.6 数据处理
本研究中,使用Excel软件进行砷含量、平均值、标准偏差等数值的计算,数据以平均值±标准差表示(
¯x±s 2. 结果与讨论(Results and discussion)
2.1 寿司样品各成分鲜重占比
图1显示了从南京市场采集得到的20种寿司样品中海苔、米饭和其他馅料所占的鲜重相对比例. 可见,从寿司卷上面剥离下来的海苔鲜重仅占整个寿司鲜重的2.20%—5.38%,从寿司卷上面剥离下来的米饭鲜重占整个寿司鲜重的45.64%—87.31%,剩余其他馅料占整个寿司鲜重的8.67%—52.16%,海苔、米饭和其他馅料占寿司鲜重的平均值分别为3.31%±0.88%、69.48%±9.57%、27.20%±10.10%. 显然,在所采集的不同品牌的寿司样品中,米饭均是最主要的成分,而海苔所占比例最小.
2.2 寿司及其海苔和米饭中砷的含量
图2显示了从南京市场采集得到的20种寿司样品、各寿司中的海苔和米饭样品中砷的含量. 由图2可见,不同样品中砷的含量存在着显著差异. 由图2(A)可得,海苔样品中砷含量为3.14—27.18 mg·kg−1,平均值为(9.67±6.65)mg·kg−1. 虽然海水中砷浓度较低且均匀(1—5 µg·L−1)[13],但由于近海海域受到不同程度的重金属污染,加上藻类对包括砷元素在内的微量元素具有特异性吸收作用,导致海藻类制品重金属污染问题受到广泛关注[14]. 已有研究发现紫菜中总砷含量很高,为14.0—42.1 mg·kg−1[15],与本研究中测得的海苔样品总As含量相似. 然而,除褐藻(Hijiki)之外的海藻,JECFA报告显示无机砷占总砷的比例不到15%,无机砷含量通常低于2 mg·kg−1[16]. 欧盟对藻类饲料中总砷限量为40 mg·kg−1,但对食用藻类中总砷含量限值未作明确规定.
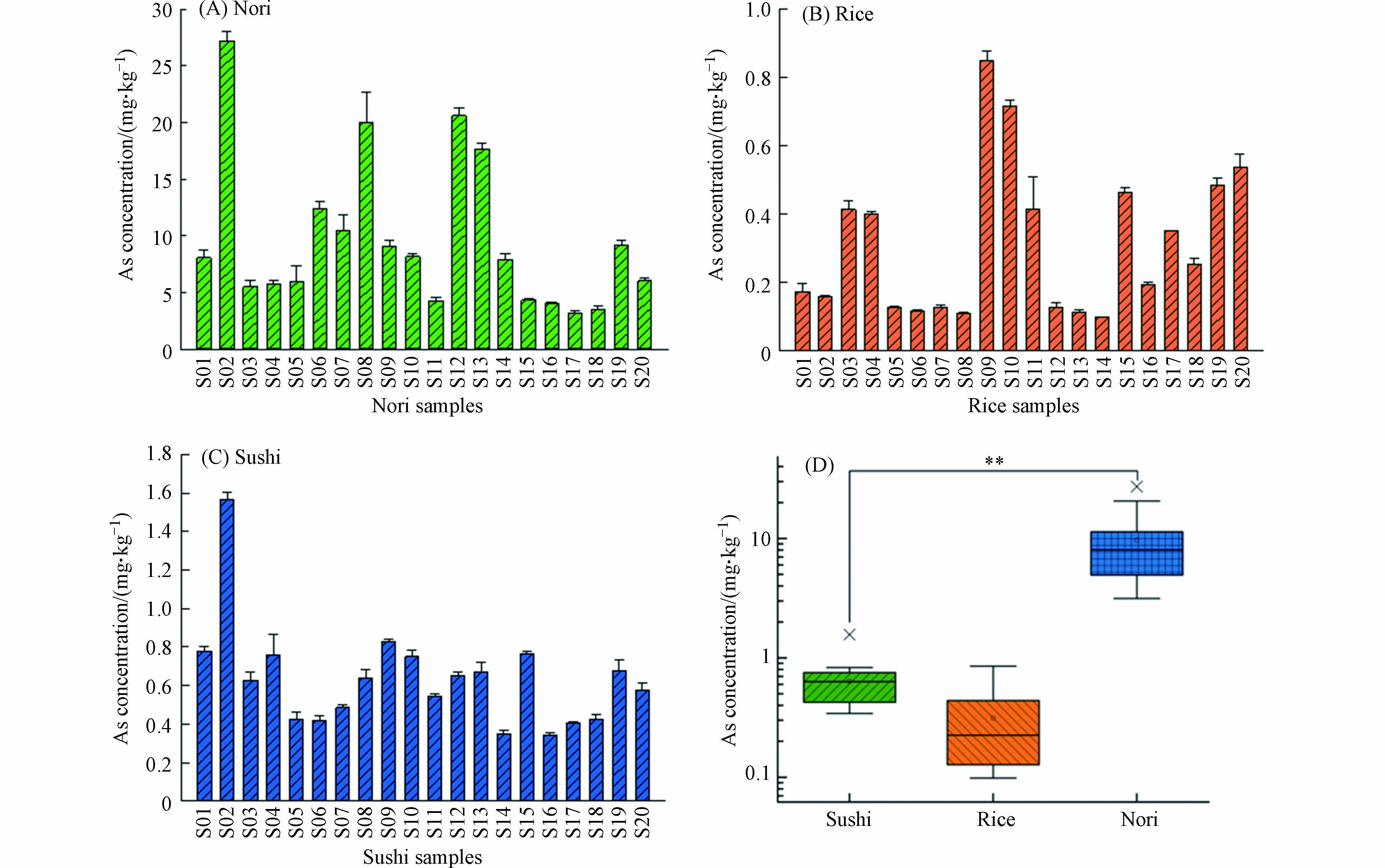 图 2 市售寿司样品中海苔(A)、米饭(B)以及寿司整体(C)中砷的含量以及各组分砷含量的对比(D)Figure 2. Arsenic concentration in the nori (A), rice (B), and sushi (C) samples sold in market and comparison of each component (D)(图D箱体代表数据的25%—75%分布,箱中实线为数据的平均值,箱体两端的误差线分别代表数据5%和95%,“×”表示超出5%—95%范围的数据点,“**”表示两组数据在0.01级别(双尾),相关性显著)(Boxes in Figure D extend from the 25th to the 75th percentile; solid lines in the box represent the mean value; error bars represent the 5th and 95th percentiles, while “×” represent the outliers, “**” represents two groups of data at 0.01 level (double-tailed) with significant correlation)
图 2 市售寿司样品中海苔(A)、米饭(B)以及寿司整体(C)中砷的含量以及各组分砷含量的对比(D)Figure 2. Arsenic concentration in the nori (A), rice (B), and sushi (C) samples sold in market and comparison of each component (D)(图D箱体代表数据的25%—75%分布,箱中实线为数据的平均值,箱体两端的误差线分别代表数据5%和95%,“×”表示超出5%—95%范围的数据点,“**”表示两组数据在0.01级别(双尾),相关性显著)(Boxes in Figure D extend from the 25th to the 75th percentile; solid lines in the box represent the mean value; error bars represent the 5th and 95th percentiles, while “×” represent the outliers, “**” represents two groups of data at 0.01 level (double-tailed) with significant correlation)由图2(B)可得米饭样品中砷含量为0.10—0.85 mg·kg−1,平均值为(0.31±0.22)mg·kg−1. 我国食品中污染物限量国家标准GB 2762—2017《食品安全国家标准 食品中污染物限量》规定,米饭中无机砷限量为0.20 mg·kg−1[17]. 由于稻米中砷(尤其是无机砷)的过度积累,米饭成为人体砷摄入的主要来源,大约占我国人群无机砷平均摄入量的60%[18-19]. 相关文献报道称米饭中的总砷含量为0.09—0.33 mg·kg−1,在砷污染地区种植的水稻,其籽粒中砷可达到1.50 mg·kg−1,甚至更高[11]. 本研究测得经过烹饪的熟米中总砷含量有11组样品低于 0.2 mg·kg−1,属于正常范围内. 可能受米饭中添加不同调味剂的影响,部分样品中总砷含量接近甚至超过0.3 mg·kg−1.
对寿司整体进行总砷含量测定,由图2(C)可得,寿司样品中总砷含量为0.34—1.57 mg·kg−1,平均值为(0.63±0.27)mg·kg−1. 显然如图2(D)所示,海苔样品中的总砷含量远高于米饭以及寿司样品中的总砷含量. 本研究所采集的寿司样品其馅料占一定比重,但馅料的鲜重受水分含量较多的黄瓜、胡萝卜、大根条等果蔬影响,对各个寿司样品其馅料进行砷含量测定,馅料样品中总砷含量为0.04—0.12 mg·kg−1,均值为(0.06±0.03)mg·kg−1,相较于海苔和米饭总砷含量要低的多. 由于市售寿司的馅料种类复杂多样,其砷含量受馅料成分影响,故寿司馅料在本研究中不做重点分析.
结合不同组分在寿司样品中的相对重量比以及不同组分砷含量,舍弃掉S06、S07、S14海苔和米饭砷贡献率超过100%的3组样品,剩余17组样品不同组分对寿司总砷含量贡献值如图3所示,海苔、米饭和其他成分对寿司总砷浓度贡献均值分别为41.68%±22.43%、36.96%±21.15%、21.36%±15.58%,即海苔在寿司中相对重量占比虽然最小,但对寿司总砷含量起主要贡献作用.
2.3 寿司及其海苔和米饭砷形态
将4种形态As标准储备液稀释成浓度为1、2、5、10、20 µg·L−1的砷化合物混合标准溶液,在确立的实验条件下进行分析,以各种砷形态的峰面积对浓度进行线性回归,得出4种砷化物的质量浓度(x)与峰面积(y)的线性关系. 如表1所示,4种砷形态的线性相关系数均在0.9990以上. 20 µg·L−1砷化合物混合标准溶液色谱图如图4A所示,显然As(Ⅲ)、DMA、MMA、As(Ⅴ)能很好地实现分离,各形态峰到达最大值点的时刻分别为2.82、4.51、9.69、27.23 min,并且各峰尖锐,峰形较为对称.
表 1 4种砷化物的质量浓度与峰面积的线性关系Table 1. Linear relation between mass concentration and peak area of four arsenic species砷形态Arsenic species 线性方程Linear regression equation 相关系数R2Correlation coefficient 亚砷酸盐As(Ⅲ) y=610.65x-139.35 0.9991 二甲基砷酸DMA y=1137.51x-222.29 0.9995 一甲基砷酸MMA y=941.02x+39.89 0.9997 砷酸盐As(Ⅴ) y=579.71x-105.93 0.9996 采用建立的上述方法对S02、S06、S12、S14样品(海苔、米饭、寿司)的砷形态进行测定,结果如表2、3、4所示. 4个海苔样品提取液色谱图均出现3个峰,出峰时间分别为2.16、4.51、24.2 min,其中仅第2个峰出峰时间与砷形态标准物质DMA吻合(图4B),另外2个出峰位置与4种砷标准物质出峰时间均不吻合. 研究表明,对于包括条斑紫菜在内的藻类,海水中的砷酸盐很容易通过磷通道跨膜运输被吸收到植物体内,吸收之后,藻类会通过还原和甲基化作用快速解毒砷酸盐,从而转化为砷糖、DMA、甲基砷化合物等[20]. 以往对紫菜砷形态的分析鉴定出在As(Ⅴ)前出峰的砷形态为砷糖-OH(arsenosugar-OH)[21],基于此,判定本研究在24.2 min左右出峰的砷为砷糖-OH. 此外,以往研究发现,利用HPLC-ICP-MS分离和鉴定砷形态时,2.00 min左右会出现AsC、AsB、As(Ⅲ)[21],鉴于AsC是砷甜菜碱的代谢前体,能被快速吸收并转化为AsB[22],故判定2.16 min出峰的砷为AsB. 基于以上形态判定,发现海苔样品中含有AsB、DMA、砷糖-OH这3种形态砷,未检测出无机砷. 本研究方法As形态提取的回收率在67.0%—86.4%(表2),无机砷总量明显低于藻类调味品无机砷限量国际标准0.5 mg·kg−1[17]. 各形态砷在海苔样品可提取总砷含量中占比如图5(A)所示,砷甜菜碱(AsB)、二甲基砷酸盐(DMA)、砷糖-OH占比分别为8.02%±6.57%、37.40%±12.70%和54.59%±17.31%,这些都是毒性极低甚至无毒的有机砷[22],且已有实验证明,小鼠食用紫菜消化的总砷只有0.12%—0.78%在肌肉/器官中积累,约65%—77%都通过粪便排除,不会存在砷健康风险[23].
表 2 海苔样品中砷形态化合物检测结果(µg·kg−1)Table 2. Test results of arsenic speciation in nori samples (µg·kg−1)样品Sample As(Ⅲ) As(Ⅴ) AsB DMA MMA 砷糖-OH Arsenosugar-OH 总砷 Total arsenic 回收率/%Recovery S02海苔 ND ND 457.9 8498.6 ND 14196.3 27175.5 85.2 S06海苔 ND ND 1117.7 4540.5 ND 2609.9 12347.1 67.0 S12海苔 ND ND 408.8 3756.8 ND 10980.0 20598.9 73.5 S14海苔 ND ND 953.7 2279.1 ND 3640.6 7957.9 86.4 米饭样品提取液色谱图均出现4个峰,其中第1、第2和第4个峰分别与标准物质As(Ⅲ)、DMA和As(Ⅴ)的出峰时间吻合,而在14.5 min出现的峰与砷标准物质均不吻合(图4C). 研究发现稻田土壤中除存在无机砷(如无机三价砷和五价砷)与甲基砷(如一甲基砷和二甲基砷)外,还广泛存在着巯基砷化合物,包含无机巯基砷和甲基巯基砷,其中二甲基一巯基砷(DMMTA)具有高毒性,是土壤孔隙水中主要的甲基巯基砷形态,且会在水稻籽粒中积累,对食品安全和人体健康构成威胁[24]. 最新研究发现,在大米中除了As(Ⅲ)、DMA和As(Ⅴ),还广泛存在DMMTA,其浓度为DMA的46.6%—74.5%,代表着米饭总砷含量的8.74%—13.6%. [25]. 因此,判定14.5 min出现的峰为DMMTA. 基于此,大米中砷存在形态有As(Ⅲ)、DMA、DMMTA、As(Ⅴ),其中As(Ⅲ)、DMA含量较高,As形态提取的回收率均大于90%(表3). 各形态砷在米饭样品可提取总砷含量占比如图5(B)所示,低毒性的DMA以及高毒性的As(Ⅲ)、DMMTA、As(V)占比分别为22.44%±5.79%、49.15%±9.52%、12.48%±2.36%、11.59±9.65%. 米饭样品中无机砷含量在43.31—88.87 µg·kg−1,均低于米饭无机砷限量国际标准0.20 mg·kg−1.
表 3 米饭样品中砷形态化合物检测结果(µg·kg−1)Table 3. Test results of arsenic speciation in rice samples (µg·kg−1)样品Sample As(Ⅲ) DMA DMMTA As(Ⅴ) iAs Unknow 总砷Total arsenic 回收率/%Recovery S02米饭 60.5 38.4 17.9 16.9 77.4 11.2 158.3 91.5 S06米饭 50.4 20.8 15.5 26.8 77.2 ND 116.4 97.5 S12米饭 75.6 20.0 11.1 13.3 88.9 ND 127.0 94.5 S14米饭 43.3 25.8 13.4 ND 43.3 8.8 98.4 92.8 整个寿司样品包含了海苔和米饭的特征砷形态,具体来说,寿司中含有AsB、DMA、砷糖-OH、As(Ⅲ)、As(Ⅴ)等6种形态砷(图4D),As形态提取的回收率在47.0%—88.0%(表4),各形态砷在寿司样品可提取总砷含量占比如图5(C)所示,AsB、DMA、砷糖-OH、As(Ⅲ)、As(Ⅴ)这5种砷形态占比分别为10.32%±7.91%、34.40%±22.04%、32.87%±22.87%、15.94%±9.19%、2.44%±4.87%,DMA和砷糖是寿司样品最主要的砷形态. 由于继承了海苔和米饭中的砷形态特征,虽然海苔中砷总量特别高,但是寿司中可能产生毒害作用的无机砷,均主要继承自米饭,占寿司砷含量较大部分的有机砷均继承自海苔样品,且不同样品间各种形态有机砷含量相对高低与海苔样品保持一致.
表 4 寿司样品中砷形态化合物检测结果(µg·kg−1)Table 4. Test results of arsenic speciation in sushi samples (µg·kg−1)样品 Sample AsB As(Ⅲ) DMA 砷糖-OH Arsenosugar-OH As(Ⅴ) iAs Unknow 总砷Total arsenic 回收率/%Recovery S02寿司 35.2 45.0 488.2 143.6 ND 45.0 24.6 1567.7 47.0% S06寿司 57.4 75.2 49.0 30.6 26.7 101.9 35.0 416.4 61.1% S12寿司 19.3 58.9 109.0 315.3 ND 58.9 ND 654.6 76.8% S14寿司 36.2 57.2 98.2 117.7 ND 57.2 ND 351.3 88.0% 注:ND, 未检出. ND, not detected. 2.4 健康风险评价
目前,已有大量研究针对不同砷富集食品构成的潜在健康风险进行评估,如分析食用药用真菌(39科82属164个物种)中总砷和不同形态砷含量[26];分析不同种类蔬菜的As污染特征[27];测定中国市场生熟鸡肉中砷的浓度,并进行砷形态分布研究等[28];旨在评估人体从该类食品中摄入无机砷相关的癌症风险. 对本研究中S02、S06、S12、S14样品进行食用寿司的相关癌症风险评估,结合砷形态化合物检测回收率数据,4组样品中无机砷含量分别取各自最高值0.10、0.17、0.08、0.07 mg·kg−1,以每日成人摄入一份寿司为准,南京市寿司一份大约为300 g左右鲜重,根据实验室称量的寿司含水率数据,寿司每日平均摄入干重取120 g,估算得到成人食用该4组寿司导致的每天无机砷摄入量为0.20、0.34、0.16、0.14 µg·kg−1·d−1 bw, 平均为(0.21±0.09) µg·kg−1·d−1. 世界卫生组织规定的肺癌发病率增加0.5%的基准剂量(BMDL0.5)为3 µg·kg−1·d−1 bw [29]. 基于此安全限制,食用寿司导致的无机砷摄入量远低于BMDL0.5,表明食用寿司带来砷摄入的健康风险较低. 市场销售寿司虽然由于原材料海苔导致砷总量较高,但无机砷含量较低,因此健康风险较低.
3. 结论(Conclusion)
(1)南京市场所采集的不同品牌的寿司样品中,米饭均是寿司的最主要成分,达到整个寿司的近70%,而海苔所占重量比极低,不超过5%,这符合市场大部分普通寿司的相对重量比情况.
(2)南京市场销售的寿司不同样品中砷的含量存在着差异,总体趋势是海苔总砷含量近乎是米饭总砷含量的30倍,导致海苔和米饭对寿司总砷含量的贡献率不同,海苔在寿司中相对重量占比虽然非常小,但对寿司总砷含量起主要贡献作用.
(3)市售寿司海苔中含有AsB、DMA、砷糖-OH共3种形态砷,未检测出无机砷;米饭中含有As(Ⅲ)、DMA、DMMTA、As(Ⅴ)等5种形态砷,其中As(Ⅲ)、DMA含量较高;继承自海苔和米饭的砷形态,寿司中相应地主要含AsB、DMA、砷糖-OH、As(Ⅲ)、As(Ⅴ)等形态砷,且有毒的砷形态主要来自于米饭,近乎无毒的有机砷主要来自海苔.
(4)采用砷摄入量评估模型评估人体食用寿司导致的无机砷摄入量显示,食用寿司带来的健康风险较低,市面上销售的寿司可以安全食用.
-
表 1 4种砷化物的质量浓度与峰面积的线性关系
Table 1. Linear relation between mass concentration and peak area of four arsenic species
砷形态Arsenic species 线性方程Linear regression equation 相关系数R2Correlation coefficient 亚砷酸盐As(Ⅲ) y=610.65x-139.35 0.9991 二甲基砷酸DMA y=1137.51x-222.29 0.9995 一甲基砷酸MMA y=941.02x+39.89 0.9997 砷酸盐As(Ⅴ) y=579.71x-105.93 0.9996 表 2 海苔样品中砷形态化合物检测结果(µg·kg−1)
Table 2. Test results of arsenic speciation in nori samples (µg·kg−1)
样品Sample As(Ⅲ) As(Ⅴ) AsB DMA MMA 砷糖-OH Arsenosugar-OH 总砷 Total arsenic 回收率/%Recovery S02海苔 ND ND 457.9 8498.6 ND 14196.3 27175.5 85.2 S06海苔 ND ND 1117.7 4540.5 ND 2609.9 12347.1 67.0 S12海苔 ND ND 408.8 3756.8 ND 10980.0 20598.9 73.5 S14海苔 ND ND 953.7 2279.1 ND 3640.6 7957.9 86.4 表 3 米饭样品中砷形态化合物检测结果(µg·kg−1)
Table 3. Test results of arsenic speciation in rice samples (µg·kg−1)
样品Sample As(Ⅲ) DMA DMMTA As(Ⅴ) iAs Unknow 总砷Total arsenic 回收率/%Recovery S02米饭 60.5 38.4 17.9 16.9 77.4 11.2 158.3 91.5 S06米饭 50.4 20.8 15.5 26.8 77.2 ND 116.4 97.5 S12米饭 75.6 20.0 11.1 13.3 88.9 ND 127.0 94.5 S14米饭 43.3 25.8 13.4 ND 43.3 8.8 98.4 92.8 表 4 寿司样品中砷形态化合物检测结果(µg·kg−1)
Table 4. Test results of arsenic speciation in sushi samples (µg·kg−1)
样品 Sample AsB As(Ⅲ) DMA 砷糖-OH Arsenosugar-OH As(Ⅴ) iAs Unknow 总砷Total arsenic 回收率/%Recovery S02寿司 35.2 45.0 488.2 143.6 ND 45.0 24.6 1567.7 47.0% S06寿司 57.4 75.2 49.0 30.6 26.7 101.9 35.0 416.4 61.1% S12寿司 19.3 58.9 109.0 315.3 ND 58.9 ND 654.6 76.8% S14寿司 36.2 57.2 98.2 117.7 ND 57.2 ND 351.3 88.0% 注:ND, 未检出. ND, not detected. -
[1] 陈保卫, LE X C. 中国关于砷的研究进展 [J]. 环境化学, 2011, 30(11): 1936-1943. CHEN B W, LE X C. Recent progress in arsenic research in China [J]. Environmental Chemistry, 2011, 30(11): 1936-1943(in Chinese).
[2] NAUJOKAS M F, ANDERSON B, AHSAN H, et al. The broad scope of health effects from chronic arsenic exposure: Update on a worldwide public health problem [J]. Environmental Health Perspectives, 2013, 121(3): 295-302. doi: 10.1289/ehp.1205875 [3] ANETOR J I, WANIBUCHI H, FUKUSHIMA S. Arsenic exposure and its health effects and risk of cancer in developing countries: Micronutrients as host defence [J]. Asian Pacific Journal of Cancer Prevention:APJCP, 2007, 8(1): 13-23. [4] RAI P K, LEE S S, ZHANG M, et al. Heavy metals in food crops: Health risks, fate, mechanisms, and management [J]. Environment International, 2019, 125: 365-385. doi: 10.1016/j.envint.2019.01.067 [5] 胥佳佳, 冯鑫, 汤静, 等. 超声辅助提取-高相液相色谱-电感耦合等离子体质谱法测定香菇中6种形态砷化合物 [J]. 食品科学, 2016, 37(24): 216-221. doi: 10.7506/spkx1002-6630-201624034 XU J J, FENG X, TANG J, et al. Arsenic speciation analysis of Lentinus edodes by ultrasonic-assisted extraction-high performance liquid chromatography-inductively coupled plasma mass spectrometry [J]. Food Science, 2016, 37(24): 216-221(in Chinese). doi: 10.7506/spkx1002-6630-201624034
[6] ALEXANDER J, BENFORD D, BOOBIS A, et al. Scientific opinion on arsenic in food. EFSA panel on contaminants in the food chain (CONTAM)[J]. EFSA Journal, 2009, 7(10: 1351): 1-198. [7] 张维, 齐丽娟, 宁钧宇, 等. 砷的健康危害评估 [J]. 毒理学杂志, 2021, 35(5): 367-372,378. doi: 10.16421/j.cnki.1002-3127.2021.05.002 ZHANG W, QI L J, NING J Y, et al. Health hazard assessment of arsenic [J]. Journal of Toxicology, 2021, 35(5): 367-372,378(in Chinese). doi: 10.16421/j.cnki.1002-3127.2021.05.002
[8] 刘蕊芬. 中日两国饮食疗法(药膳)的源流与异同的研究[D]. 广州: 广州中医药大学, 2007. LIU R F. Study on the origin of and similarities and differences between Chinese and Japanese dietotherapy[D]. Guangzhou: Guangzhou University of Chinese Medicine, 2007(in Chinese).
[9] JECFA (Joint FAO/WHO Expert Committee on Food Additives). Safety evaluation of certain food additives and contaminants. WHO Food Additives Series No. 63, Prepared by the Seventy-second Meeting of JECFA[R]. World Health Organization, Geneva, 2011. [10] TAYLOR V, GOODALE B, RAAB A, et al. Human exposure to organic arsenic species from seafood [J]. Science of the Total Environment, 2017, 580: 266-282. doi: 10.1016/j.scitotenv.2016.12.113 [11] FRANSISCA Y, SMALL D M, MORRISON P D, et al. Assessment of arsenic in Australian grown and imported rice varieties on sale in Australia and potential links with irrigation practises and soil geochemistry [J]. Chemosphere, 2015, 138: 1008-1013. doi: 10.1016/j.chemosphere.2014.12.048 [12] U. S. EPA. Method 3050B: Acid Digestion of Sediments, Sludges, and Soils[S]. 1996. [13] CAUMETTE G, KOCH I, REIMER K J. Arsenobetaine formation in plankton: A review of studies at the base of the aquatic food chain [J]. Journal of Environmental Monitoring, 2012, 14(11): 2841-2853. doi: 10.1039/c2em30572k [14] YANG G D, ZHENG J P, CHEN L, et al. Speciation analysis and characterisation of arsenic in lavers collected from coastal waters of Fujian, south-eastern China [J]. Food Chemistry, 2012, 132(3): 1480-1485. doi: 10.1016/j.foodchem.2011.12.006 [15] 王亚, 张春华, 葛滢. 高效液相色谱-氢化物发生-原子荧光光谱法检测紫菜中的砷形态 [J]. 分析试验室, 2013, 32(5): 34-38. doi: 10.13595/j.cnki.issn1000-0720.2013.0125 WANG Y, ZHANG C H, GE Y. Determination of arsenic speciation in Porphyra using HPLC-(UV)-HG-AFS [J]. Chinese Journal of Analysis Laboratory, 2013, 32(5): 34-38(in Chinese). doi: 10.13595/j.cnki.issn1000-0720.2013.0125
[16] MOLIN M, ULVEN S M, MELTZER H M, et al. Arsenic in the human food chain, biotransformation and toxicology - Review focusing on seafood arsenic [J]. Journal of Trace Elements in Medicine and Biology, 2015, 31: 249-259. doi: 10.1016/j.jtemb.2015.01.010 [17] 国家卫生和计划生育委员会, 国家食品药品监督管理总局. 食品安全国家标准 食品中污染物限量: GB 2762—2017[S]. 北京: 中国标准出版社, 2017. National Health and Family Planning Commission of the People's Republic of China, China Food and Drug Administration. National Food Safety Standard. Maximum Levels of Contaminants in Food: GB 2762—2017[S]. Beijing: Standards Press of China, 2017(in Chinese).
[18] SUN S K, XU X J, TANG Z, et al. A molecular switch in sulfur metabolism to reduce arsenic and enrich selenium in rice grain [J]. Nature Communications, 2021, 12: 1392. doi: 10.1038/s41467-021-21282-5 [19] MAWIA A M, HUI S Z, ZHOU L, et al. Inorganic arsenic toxicity and alleviation strategies in rice [J]. Journal of Hazardous Materials, 2021, 408: 124751. doi: 10.1016/j.jhazmat.2020.124751 [20] BORAK J, HOSGOOD H D. Seafood arsenic: Implications for human risk assessment [J]. Regulatory Toxicology and Pharmacology, 2007, 47(2): 204-212. doi: 10.1016/j.yrtph.2006.09.005 [21] 黄东仁. 福建省紫菜中砷的形态及含量[J]. 中国渔业质量与标准, 2015, 5(1): 52-60. HUANG D R. Arsenic speciations and their contents in Porphyra in Fujian Province[J]. Chinese Fishery Quality and Standards, 2015, 5(1): 52-60(in Chinese). HUANG D R. Arsenic speciations and their contents in Porphyra in Fujian Province[J]. Chinese Fishery Quality and Standards, 2015, 5(1): 52-60(in Chinese).
[22] YANG G D, XIE W Y, ZHU X, et al. Effect of arsenite-oxidizing bacterium B. laterosporus on arsenite toxicity and arsenic translocation in rice seedlings [J]. Ecotoxicology and Environmental Safety, 2015, 120: 7-12. doi: 10.1016/j.ecoenv.2015.05.023 [23] WU Y C, ZHANG H, WANG K T, et al. Metabolic and residual characteristic of different arsenic species contained in laver during mouse digestion [J]. Science of the Total Environment, 2021, 793: 148434. doi: 10.1016/j.scitotenv.2021.148434 [24] DAI J, CHEN C, GAO A X, et al. Dynamics of dimethylated monothioarsenate (DMMTA) in paddy soils and its accumulation in rice grains [J]. Environmental Science & Technology, 2021, 55(13): 8665-8674. [25] DAI J, TANG Z, GAO A X, et al. Widespread occurrence of the highly toxic dimethylated monothioarsenate (DMMTA) in rice globally [J]. Environmental Science & Technology, 2022, 56(6): 3575-3586. [26] ZHANG J, BARAŁKIEWICZ D, WANG Y Z, et al. Arsenic and arsenic speciation in mushrooms from China: A review [J]. Chemosphere, 2020, 246: 125685. doi: 10.1016/j.chemosphere.2019.125685 [27] 程家丽, 任硕, 刘婷婷, 等. 2001—2017年我国部分地区蔬菜中砷和重金属累积特征及膳食暴露风险 [J]. 中国食品卫生杂志, 2018, 30(2): 187-193. doi: 10.13590/j.cjfh.2018.02.013 CHENG J L, REN S, LIU T T, et al. Accumulation and dietary exposure risk of arsenic and heavy metals in the vegetables from some areas of China, 2001-2017 [J]. Chinese Journal of Food Hygiene, 2018, 30(2): 187-193(in Chinese). doi: 10.13590/j.cjfh.2018.02.013
[28] ZHAO D, WANG J Y, YIN D X, et al. Arsanilic acid contributes more to total arsenic than roxarsone in chicken meat from Chinese markets [J]. Journal of Hazardous Materials, 2020, 383: 121178. doi: 10.1016/j.jhazmat.2019.121178 [29] JECFA (Joint FAO/WHO Expert Committee on Food Additives). Evaluation of certain contaminants in food[Z]. 2017. -







 下载:
下载: