-
四溴双酚A(TBBPA)是一种被广泛应用于电子电气产品生产的阻燃剂添加物. 在废弃电子产品或电器的拆解和回收过程中,添加型的TBBPA及重金属(包括铜、镉、锌等)易进入土壤环境中造成复合污染[1-3]. Wang等[1]的研究表明,电子垃圾回收站土壤中TBBPA、铜(Cu)、镉(Cd)、和锌(Zn)浓度分别高达0.65、2968、2088、11.5 mg·kg−1. 同时污染会向周边农田和河流底泥扩散,危害农业生产安全[4-5].
有研究报道了TBBPA在土壤、底泥、水体等环境中易发生生物降解转化作用,但较难发生彻底矿化[6]. 在厌氧微生物作用下,TBBPA脱溴形成双酚A(BPA),BPA在好氧条件下容易发生C链氧化断裂和苯环开环等反应,最终彻底矿化为CO2 [7-10]. 硝化污泥中的TBBPA降解和代谢则主要包括四个方面:1)经还原脱溴形成BPA;2)经氧化断裂形成各类极性代谢产物;3)经原位取代形成硝基衍生物;4)经甲基化生成持久性更强的甲基醚衍生物[11]. 在好氧土壤环境中TBBPA主要以生成极性代谢产物和甲基醚衍生物为主,其中甲基醚衍生物的生物毒性要低于TBBPA母体和其极性产物,是蚯蚓对抗TBBPA毒性的重要手段[12-13]. 此外,基于14C放射性示踪技术的研究发现土壤和底泥中30%—70%TBBPA会形成不可提取的结合残留,从而降低其环境暴露风险[6, 13-14].
有研究表明重金属可以通过直接或间接作用影响有机污染物的生物降解和吸附等行为:1)重金属离子可以和有机物上的羟基或氨基等活性官能团发生络合作用,直接影响有机污染物的形态和化学结构[15-17];2)重金属离子与土壤有机质发生络合或吸附作用,进而影响溶解态有机质团聚或竞争有机质上的吸附位,间接影响土壤中有机污染物的吸附行为 [18-21];3)重金属刺激或抑制土壤微生物活动,间接影响有机污染物的生物降解转化过程[22-25]. TBBPA作为一种含两个酚羟基且常与重金属同时进入土壤环境的污染物,有必要深入研究重金属离子对TBBPA降解转化行为的影响,以正确评价TBBPA在土壤环境的持久性和生物有效性.
因此,通过14C放射性示踪技术,研究了3种重金属(Cu、Cd和Zn)在不同浓度水平对两种典型土壤(乌栅土和红壤)中14C-TBBPA降解转化、矿化、不可提取态残留形成等环境行为的影响.
-
本研究采用的乌栅土和红壤两种土壤分别来自于中国科学院常熟农业生态实验站和江西省南昌市市郊林地. 两种土壤的pH值、有机碳含量和对应受试重金属本底浓度等信息详见表1和表2. 为保证实验中土壤微生物活性,实验开始前将土壤水分保持在最大持水量培养一周时间,然后再经自然风干后过20目筛(<1 mm)备用.
14C标记的TBBPA是14C-苯酚合成而来,合成步骤包括:1)14C-苯酚经缩合反应生成14C-BPA;2)14C-BPA经溴离子卤化反应生成14C-TBBPA,最终产品的比活度为1.48 GBq·mmol−1,纯度>99% [13]. 由于合成的14C-TBBPA比活度较高而化学浓度较低,因此实验中需将14C-TBBPA与非标记的TBBPA(购自Sigma公司,纯度为99%)混合使用,以达到实验所需的化学浓度. 14C-苯酚购自ARC公司(American Radiolabeled Chemicals Inc., US). 重金属均为相应的二价阳离子氯化物,采购自Sigma公司.
-
实验为基于灭菌处理、重金属处理和重金属浓度水平等3个影响因子的两两正交设置. 土壤灭菌的方式采用121 °C湿热灭菌法,重金属种类的选择参考了电子产品中典型的Cu(Ⅱ)、Zn(Ⅱ)和Cd(Ⅱ). 综合考虑实验用土中各重金属的浓度背景和离子强度效应关系研究需要,实验中重金属摩尔浓度水平分别为0、500、6000 μmol·kg−1干土重,换算为各离子浓度为31.7 mg·kg−1和381.2 mg·kg−1的Cu、32.7 mg·kg−1和392.3 mg·kg−1的Zn以及56.2 mg·kg−1和674.5 mg·kg−1的Cd. Cu和Zn处理的低浓度处理低于农业用地土壤污染风险标准,高浓度处理则介于农用地污染风险标准和居住用地污染风险标准,即对农产品存在风险但不对人类健康产生直接风险. 本实验用Cd浓度水平过高,仅作为与其他两种重金属做效应对比,其对应污染浓度水平的实验设置详见“1.3 实验二设置:低浓度水平Cd2+对TBBPA归趋的影响”.
实验将2 mL 14C-TBBPA的甲醇溶液(化学浓度=711.7 μg·mL−1;放射性浓度=6.39 MBq·mL−1)加入1 kg风干的受试土壤中,使土壤中TBBPA浓度达到0.9 mg·kg−1和3.7 kBq·g−1干土重. 混合均匀后,取0.5 g左右混合后土壤测定其混合均匀度为96% ± 4%(n = 15). 土壤培养实验在100 mL玻璃试管中进行,其内含4 g混合有14C-TBBPA的土壤,在加水培养前土壤静置过夜待其中甲醇完全挥发. 然后,加入重金属离子溶液至土壤含水达到60%最大持水量和相应的重金属浓度水平. 最后,试管采用橡胶塞和封口膜密封,在24 °C恒温恒湿条件下开始密闭培养. 密闭培养期间由14C-TBBPA彻底矿化而产生的14CO2则通过悬挂在橡胶塞底部的小瓶中的1 mL 1 mol·L−1NaOH溶液进行吸收. 培养过程中每24 h打开塞子10 min以补充实验中消耗的空气和氧气. 土壤样品在第60 d被破坏性取出,冻干后待后续处理.
-
本实验主要研究较低浓度水平下Cd2+对TBBPA归趋动力学的影响. 实验同时设置了Na+作为离子对照组. 实验中Cd摩尔浓度分别为0、5、20、100、500 μmol·kg−1,浓度水平涵盖略高于农业用地风险标准值到略低于工业用地风险标准. 对于Na对照组浓度设置包括0、10、40、200、1000 μmol·kg−1,用于保证二者添加的离子强度基本相同. 实验培养设置与实验一相同,动力学研究的采样时间分别设置在第0、6、12、18、30、60 d.
-
土壤样品逐步经过纯水提取和有机溶剂提取以表征其中TBBPA及其衍生物的生物可利用性[26],提取方法主要包括:1)在水土比为10:1条件下,用MiliQ超纯水提取3次,所有提取液中14C含量即为水可提取态TBBPA及其衍生物;2)在有机溶剂:土壤为4:1条件下,用色谱级甲醇提取3次,所有提取液中14C含量即为有机可提取态TBBPA及其衍生物;3)有机溶剂提取后土壤中剩余的14C-TBBPA称为不可提取态残留.
样品分析参考以往的研究[13],利用高效液相色谱(Agilent HPLC series 1100 system)联用14C液体闪烁计数检测器(RAMONA Star; Raytest, Straubenhardt, Germany)对有机可提取态14C-TBBPA中的母体化合物及其代谢产物进行定性定量分析;利用液体闪烁计数仪(LS6500, Beckman Coulter, USA)对所有液体样品进行定量分析. 固体样品通过氧化燃烧仪(OX-500; Zinsser Analytic, Germany)制备成液体样品后进行定量分析.
-
数据显著性分析方法为T检验或单因素方差分析(ANOVA),采用SPSS软件进行分析.
-
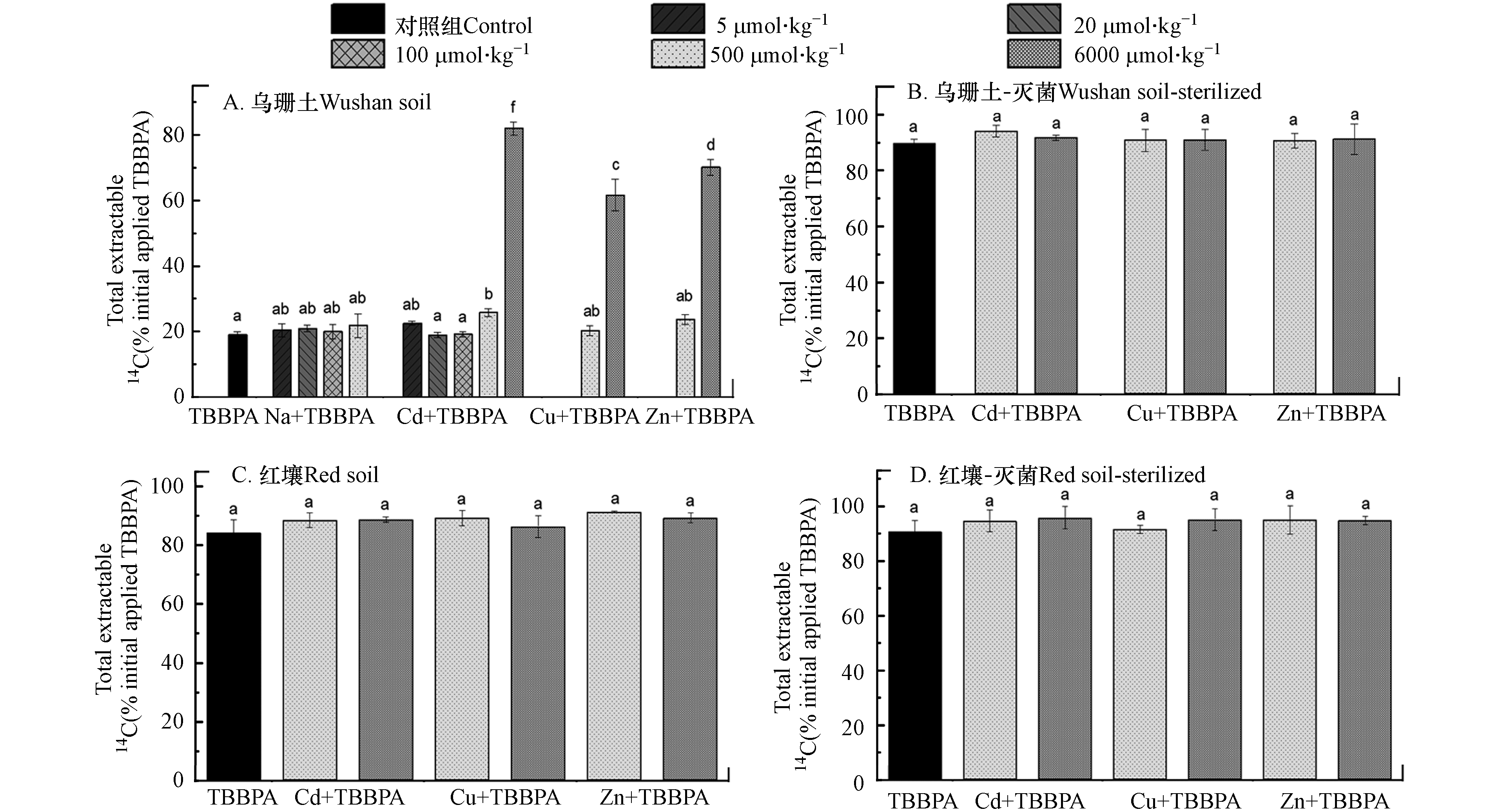
经过60 d培养,乌栅土和红壤中TBPPA分别有7.2% ± 0.5%和0.5% ± 0.1%被彻底矿化为CO2(图1). 有研究报道在某砂质土壤中培养143 d,19.6%的TBBPA被矿化,而经活性污泥处理31 d 后17%的TBBPA被矿化 [27-28]. 本实验中TBBPA在红壤中的矿化率远低于乌栅土和以往研究,这可能是由于红壤中碳氮等营养元素含量过低,不利于微生物生长进而影响了其对TBBPA的降解转化. 总体而言,TBBPA属于典型的持久性污染物,在土壤环境中较难被矿化.
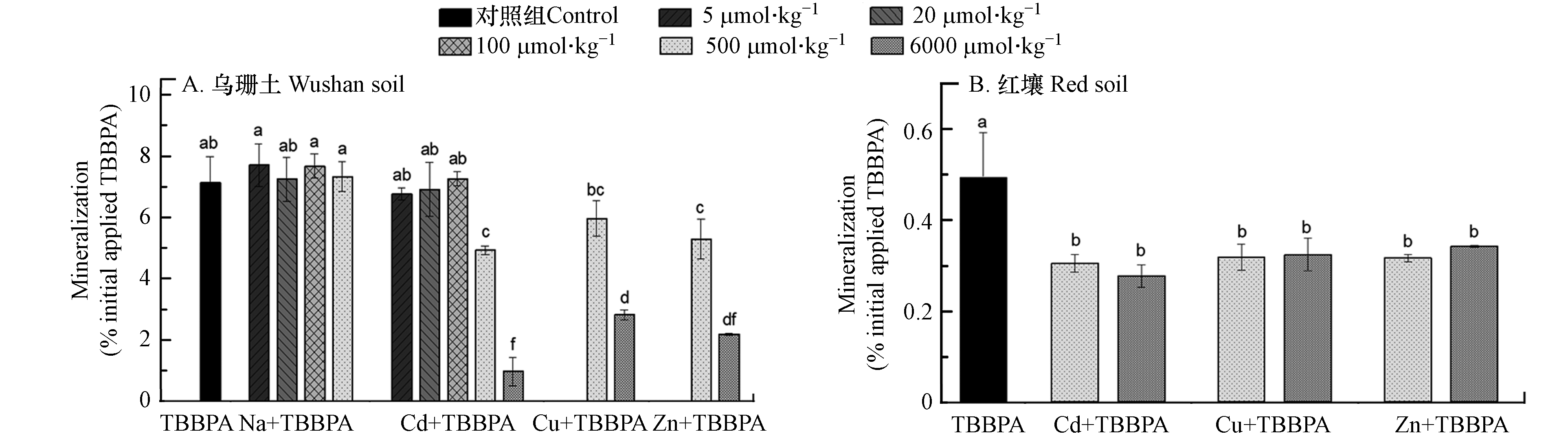
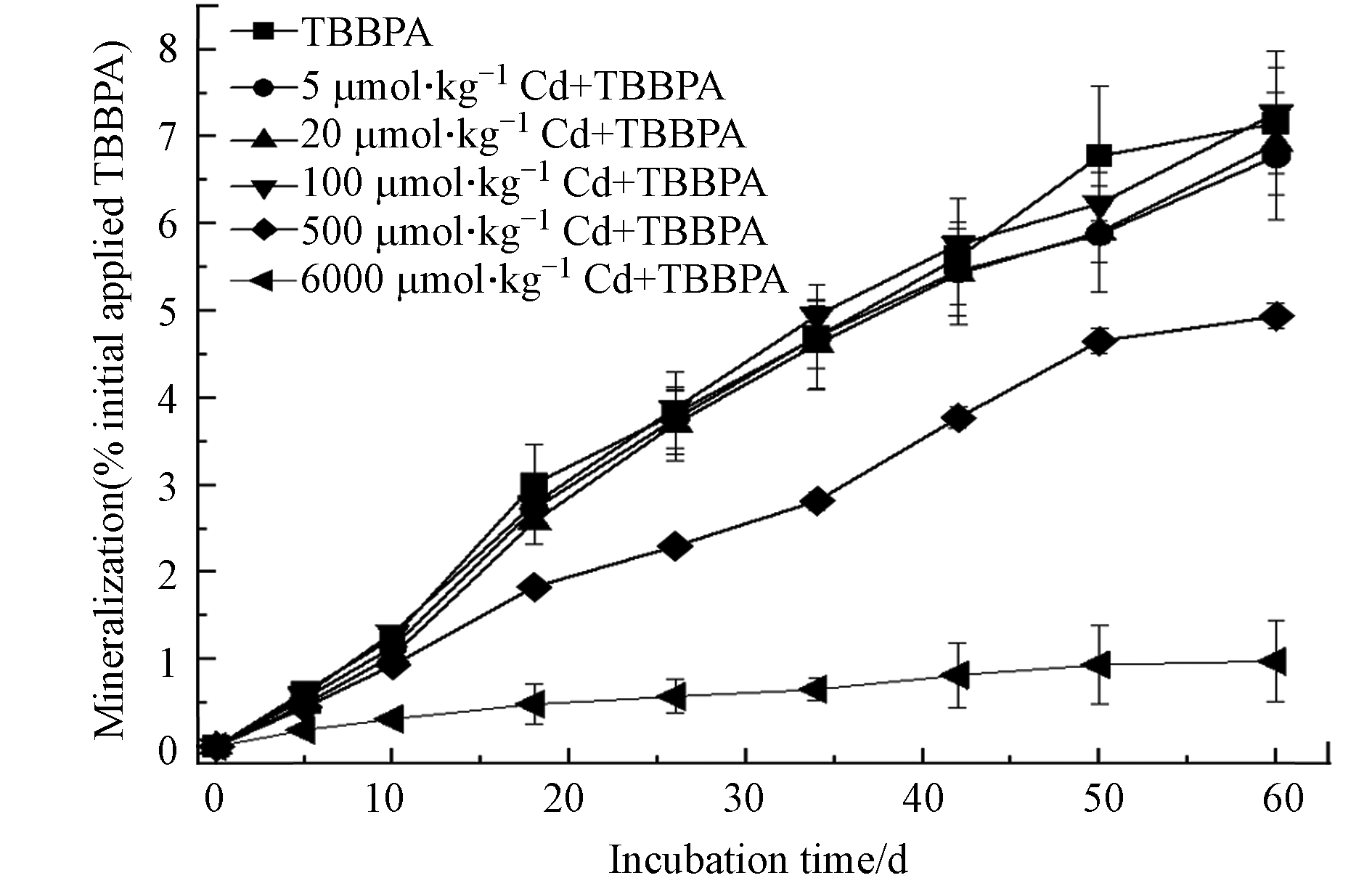
同时,重金属还会进一步抑制土壤中TBBPA的矿化作用,且抑制效应随重金属浓度增加而变得显著(P<0.05). 以Cd(Ⅱ)为例,当乌栅土中Cd浓度低于100 μmol·kg−1时(低于国家建设用地筛选值),其对TBBPA的矿化不产生显著影响(P>0.05;图2);当高于500 μmol·kg−1时(介于农业用地风险标准值到工业用地风险标准之间),其对TBBPA的矿化影响逐步显著(P<0.05). 当土壤中重金属摩尔浓度水平达到6000 μmol·kg−1时,Cu、Zn、Cd对乌栅土中矿化作用分别降低了60%、69%、86%;对红壤中矿化作用分别降低了34%、30%、44%. 在红壤中较低的抑制作用可能是由于红壤中的不定形铁与重金属离子发生离子交换作用,从而降低重金属有效性[29-31]. 尽管相同摩尔浓度水平下,Cd相较于Cu和Zn对TBBPA具有更强的抑制作用,而真实土壤环境中Cu和Zn含量通常高出Cd浓度2—3个数量级,如将6000 μmol·kg−1 Cu和Zn处理组对比100 μmol·kg−1 Cd处理组,Cu和Zn抑制作用则远高于Cd. Gu等发现,50 mg·kg−1 Cu条件下BPA(TBBPA的代谢产物)在污泥中的降解率下降75%以上,可能与一定浓度的Cu对微生物的毒性作用有关[32]. 而Wang等发现,高浓度Cu(10 mg·kg−1)会对BDE-47微生物降解产生抑制作用,低浓度Cu(2 mg·kg−1)则产生促进作用[33]. 因此,在真实的重金属-有机复合污染浓度水平,Cu和Zn对TBBPA降解转化的影响应更得到重视.
-
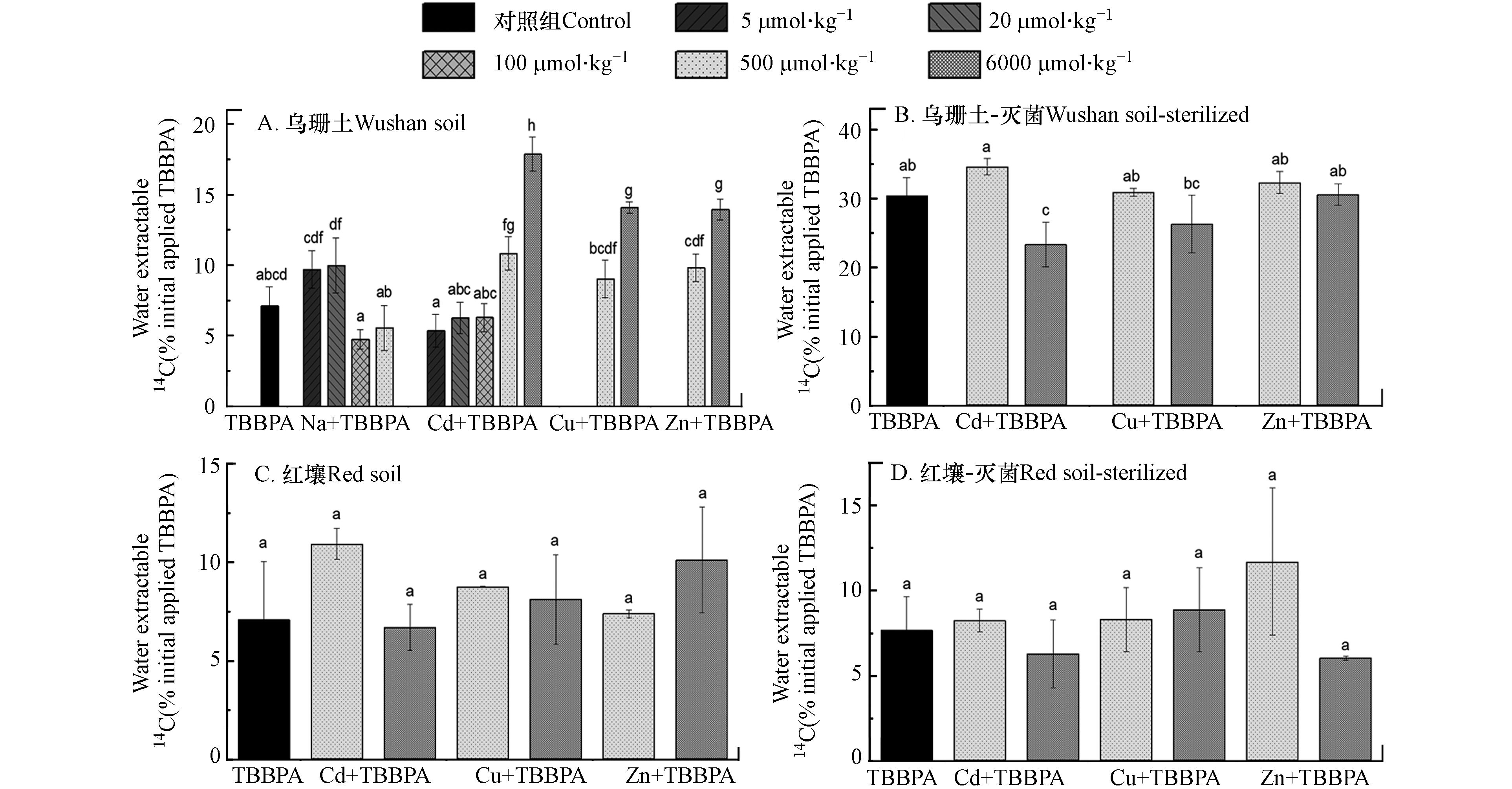
不同重金属对土壤中可提取态14C(包括水可提取态、有机提取态和可提取母体TBBPA)分布影响如图3至图5所示. 经过60d培养,乌栅土中可提取态14C残留仅为初始投加量19.1% ± 1.0%(图3),其中水可提取态为7.1% ± 1.3%(占总可提取态的37%;图4),TBBPA母体残留为7.8% ± 0.5%(图5);红壤中可提取态14C残留为初始投加量84.3% ± 4.3%,其中水可提取态为7.1% ± 3.0%,仅占总可提取态的8.4%. 相较于乌栅土,红壤中TBBPA的生物可给性潜力巨大,容易在长期老化过程中逐步释放. 土壤经灭菌处理后,90%以上TBBPA及其衍生产物均以可提取态存在,不同土壤中水可提取态变化差异巨大,其中乌栅土中水可提取态上升了4.3倍,而红壤中水可提取态未发生显著变化. 这表明红壤中TBBPA的“消散”主要由吸附作用主导,而乌栅土中则由微生物降解转化作用主导.
在重金属存在情况下,通过络合或竞争土壤吸附电位等作用,有机物在环境中的“消散”会受到抑制[34-35]. 本研究结果显示乌栅土中可提取态TBBPA及其衍生产物随着重金属浓度增加均大幅上升(P<0.01). 以Cd(Ⅱ)为例,当乌栅土中Cd浓度低于100 μmol·kg−1时,其对TBBPA及其衍生产物残留不产生显著影响(P>0.05;图3和图4);当高于500 μmol·kg−1时,其对TBBPA的矿化影响逐步显著(P<0.05);浓度达到6000 μmol·kg−1时,土壤中可提取态14C残留上升了3.3倍((19.1% ± 1.0%)→(82.0% ± 2.0%)),其中水可提取态上升了1.5倍,TBBPA母体残留上升了0.6倍. 而对于Cu(Ⅱ)和Zn(Ⅱ),仅当其浓度达到6000 μmol·kg−1时,才对TBBPA及其衍生产物残留产生显著影响,分别使得土壤中可提取态14C残留上升了2.2倍和2.7倍,低于Cd(Ⅱ)的影响,类似的规律同样体现在对TBBPA矿化作用影响中. 土壤中有机物的可提取态通常被认为是污染物在土壤中生物有效性的重要指标,尤其是水可提取态[13,26]. 对比灭菌乌栅土处理组实验结果(图5和图6),重金属可能通过抑制微生物对TBBPA的吸附和富集吸收等过程, 导致TBBPA及其转化产物在土壤中的可提取残留增加,进一步提升TBBPA在土壤中的生物可利用性. Chen等[36]发现,在食土蚯蚓存在条件下,10 mg·kg−1 Cd会略微增加TBBPA在土壤中的可提取态,但对TBBPA在蚯蚓体内富集效率却不显著,这可能与Cd浓度较低有关. Ma等[37]发现,在纯菌培养条件下,当Cu(Ⅱ)浓度水平达到10 μmol·L−1时即可显著抑制TBBPA生物不可提取态残留的形成. 此外,当Cd浓度为500 μmol·kg−1时, TBBPA母体残留增加了0.1—0.9倍,且随着时间的延长影响逐步加剧(图5). 结合重金属对TBBPA矿化的抑制,表明重金属会抑制TBBPA生物降解,从而增强TBBPA的环境持久性. Huang等[38]发现,500—1500 mg·kg−1 Cu对菲和多氯联苯的土壤降解具有显著抑制作用,且随重金属浓度增加而增强. 而多数纯菌降解研究表明,重金属会对微生物产生毒性从而降低有机污染物的生物降解过程[33,37].
-
乌栅土经过60 d的培养,其中>75% TBBPA被转化为毒性更小且持久性更强的不可提取态残留,通过与灭菌组对照(仅9.8% ± 2.0%)相比可知,不可提取态残留形成的关键因素是土壤微生物对TBBPA的降解转化作用(图6). 而对于微生物活性较低的红壤,仅有14.2% ± 3.2%的TBBPA形成了不可提取态残留,灭菌后不可提取态残留降低至5.4% ± 0.1%.
土壤重金属对不可提取态残留的影响规律与其对矿化作用和“消散”过程的影响是一致的,即仅当未灭菌的乌栅土中Cd浓度大于500 μmol·kg−1或Cu、Zn浓度大于6000 μmol·kg−1时,会对不可提取态残留的形成会出现显著的抑制作用,而对灭菌土壤和红壤却基本无显著影响.
-
本文研究了Cd、Cu、Zn等二价重金属对乌栅土和红壤中TBBPA降解转化、不可提取态残留形成和矿化作用的影响. 结果表明,TBBPA在乌珊土和红壤中的归趋差异较大,在有机质含量较高的乌珊土中TBBPA主要形成不可提取态残留(约75%),而在有机质含量较低的红壤中主要以可提取态残留存在(约80%),表明红壤中TBBPA具有更强的环境效应和持久性;较高浓度重金属(>500 μmol·kg−1)会对土壤中TBBPA生物降解、矿化和不可提取态残留产生抑制作用,在工业用地重金属浓度背景下,Cu和Zn即能显著增加TBBPA在土壤环境中的持久性和生物有效性. 因此,对真实土壤环境中TBBPA的持久性和有效性评价应充分考虑土壤重金属的影响,尤其是电子产品回收站和废弃点等易存在重金属超标的复合污染场地.
不同重金属对土壤中四溴双酚A环境归趋的影响
Effect of different heavy metals on the fate of TBBPA in two kinds of soil
-
摘要: 四溴双酚A(TBBPA)和重金属的复合污染情况常见于电子电器拆解厂或回收站周边土壤,而重金属对TBBPA在土壤环境中的降解、转化和残留的影响尚不清晰. 本研究利用14C标记的TBBPA来探索不同浓度水平重金属(Cu、Cd和Zn)对两种土壤(红壤和乌栅土)中TBBPA降解转化、矿化、不可提取态残留形成等环境行为的影响. 经60 d培养,乌栅土中92.2% ± 0.5%的TBBPA被转化为不可提取态残留或代谢产物,其中7.2% ± 0.8%被彻底矿化为CO2;灭菌作用极大地抑制了乌栅土中TBBPA不可提取态残留的形成(由77.2%降至9.9%),表明土壤微生物在不可提取态残留的形成中起到关键作用. 而红壤中仅有9.9% ± 0.5%的TBBPA被转化成不可提取态残留,<0.5%被矿化为CO2,与灭菌对照组无显著差异. 当土壤重金属(>500 μmol·kg−1)存在时,乌栅土中TBBPA矿化和不可提取态残留形成率分别降低14%—78%和31%—86%,而可提取态TBBPA(即生物可利用态)增加0.5—4.4倍,其中水溶态残留增加0.3—1.5倍,进而增加TBBPA在土壤中的持久性和生物有效性. 随着重金属浓度增加,其对TBBPA降解转化的抑制效果也显著增强,在相同摩尔浓度下,不同重金属的抑制效应强度为Cd>Cu≈Zn;而在工业用地土壤重金属背景浓度范围内,Cu和Zn的抑制效应则远高于Cd. 本研究结果为正确评价重金属和TBBPA复合污染土壤中TBBPA的环境行为和风险提供了理论支撑.Abstract: The co-exist of tetrabromobisphenol A (TBBPA) and heavy metals is common in electrical and electronic dismantling plants or recycling stations, but the effect of heavy metals on the degradation and transformation of TBBPA in soil environment is still unknown. Therefore, we used 14C-labeled TBBPA to explore the effects of heavy metals (Cu, Cd and Zn) on the transformation, mineralization and bound residue formation of TBBPA in different soils with different heavy metal concentrations level. After 60 days of incubation, 92.2% ± 0.5% of TBBPA was converted into bound residues or metabolites, and only 7.2% ± 0.8% of TBBPA was mineralized into CO2. Sterilization greatly inhibited the formation of TBBPA bound residues (from 77.2% to 9.9%) in Wushan soil, indicating that soil microorganisms played a key role in the formation of TBBPA bound residues. Moreover, only 9.9% ± 0.5% of TBBPA was converted into bound residues in red soil, and less than 0.5% was mineralized, which was not significantly different from the sterilized control. With the presence of heavy metals (>500 μmol·kg−1), the mineralization and bound residues formation of TBBPA decreased by 14%—78% and 31%—86%, respectively. While, the extractable TBBPA (bioavailability) increased by 0.5—4.4 times, and the water-soluble residual increased by 0.3—1.5 times, resulting the increase of persistence and bioavailability of TBBPA in soil. With the increase of the concentration of heavy metals, the inhibition effect on TBBPA degradation and transformation was also significantly enhanced. Cd shown stronger effect than Zn and Cu under the same molar concentration. However, considering the background concentration of heavy metals in industrial land, the inhibition effect of Cu and Zn on TBBPA degradation and transformation was much higher than that of Cd. Our study provided theoretical support for correctly evaluating the persistence and effectiveness of TBBPA in heavy metal co-contaminated sites, such as electronic product recycling stations and waste sites.
-
Key words:
- TBBPA /
- heavy metal /
- environmental fate /
- co-contamination
-
四环素(TC)常被用作饲料添加剂应用于畜牧业及水产养殖业[1-2],因在动物体内吸收率较低,常以原药和代谢产物的形式随粪尿排出体外,造成水体及土壤环境污染[3]. 目前,常规的处理工艺无法有效去除废水中抗生素,因此导致TC能够在不同的水源甚至饮用水中被检测到[4-5]. TC在地表水中的浓度可达μg∙L−1级别[6],尽管浓度较低,但同样能增强细菌耐药性,从而对生态环境和人类健康造成潜在威胁[7-8].
地表水中的可溶性有机物可通过光化学反应产生H2O2[9],而水体中H2O2与有机污染物的氧化还原反应有密切关系,能够影响化学物质的降解转化和生态效应[10]. 水中的Cu2+、Fe2+等过渡金属离子可催化H2O2分解为∙OH(E0=2.80 V)[11],而自然水体的沉淀物中广泛存在过渡金属氧化物,能够缓慢的释放出金属离子催化H2O2产生活性物质形成类Fenton反应降解水中有机物[12]. 水合氧化铁(HFO)广泛分布于沉积物和土壤中[13],具有很强的亲水性、较高的表面羟基密度和电子传输[14] 等特性. 现有关于HFO对水中污染物的去除研究多集中于吸附作用方面[15-16],鲜有关于水合氧化铁在水环境中催化H2O2降解抗生素污染物方面的报道.
本研究以HFO为材料,模拟其催化H2O2降解TC反应过程,优化反应条件并探索HFO/H2O2体系的潜在氧化机制,同时采用超高效液相色谱串联质谱(LC-TOF-MS/MS)的分析结果,鉴定TC代谢转化产物并提出了TC可能的降解途径. 研究结果可为探讨自然水体中HFO催化降解TC提供理论参考,也可为含TC废水处理提供技术支撑.
1. 材料与方法(Materials and methods)
1.1 试剂与材料
盐酸四环素纯度>98%,购自于上海源叶生物科技有限公司;六水合氯化铁(FeCl3∙6H2O),分析纯,购自于天津市科密欧化学试剂有限公司;过氧化氢(H2O2),质量分数30%,购自于上海沃凯生物技术有限公司;乙腈和甲醇,色谱级,购自于美国Merck公司;氢氧化钠、盐酸、苯醌、硫代硫酸钠、叔丁醇等均为分析纯,购自于西陇化工股份有限公司;实验用水均为超纯水.
1.2 实验方法
1.2.1 催化剂的制备
水合氧化铁(HFO)的制备方法参考文献 [17] 并做修改,在磁力搅拌下,将10.0 g的FeCl3∙6H2O溶解在100 mL超纯水中,然后用1 mol∙L−1的NaOH溶液将FeCl3∙6H2O溶液的pH值调至7.0. 形成的悬浮液连续搅拌1 h,并在室温下陈化24 h,然后通过离心(4500 r·min−1,5 min)法收集沉淀的水合氧化铁颗粒,然后用超纯水洗涤3次,去除残留离子. 最后,将水合氧化铁冷冻干燥,在玛瑙研钵中研磨,并通过200目筛,收集并存储在棕色玻璃瓶中备用.
1.2.2 催化剂的表征
ESCALAB 250Xi 型X-射线衍射仪测试样品的X射线衍射(XRD)谱图; Tristar II 3020M全自动比表面积和孔隙分析仪测定样品的比表面积和孔径; JES-FA200电子顺磁共振波谱仪(EPR)测试反应体系中产生的自由基种类; Nicolette iS50傅立叶红外-拉曼光谱仪测试样品红外光谱(FTIR); Cary Eclipse荧光分光光度计测试样品的三维荧光光谱(3D EMM).
1.2.3 TC催化降解及影响因素实验
配制50 mL初始pH6.5的四环素溶液(40 mg∙L−1),分别加入HFO、H2O2和HFO/H2O2(其中HFO为20 mg,H2O2为5 mmol∙L−1),在25 ℃的水浴温度下以150 r∙min−1速率震荡,反应一定时间后取样,样品用0.2 mol∙L−1的硫代硫酸钠溶液(甲醇:水 体积比为 1:1)稀释1倍,终止反应,样品经10000 r∙min−1离心10 min后取上清液过0.22 μm水相滤膜过滤后用UPLC测定.
探讨H2O2浓度的影响,将实验中H2O2浓度分别设置为0、0.5、1、2、5、10 mmol∙L−1;探讨初始pH影响时用0.1 mol∙L−1的NaOH或HCl调节溶液pH值分别为2、3、5、6.5、9、10;比较共存离子的影响时在HFO/H2O2反应体系中分别添加25 mmol∙L−1和50 mmol∙L−1的不同离子(Na+、Ca2+、Mg2+、
NO−3 HCO−3 SO2−4 1.2.4 自由基淬灭实验
为研究催化反应体系中的活性氧种类,分别使用叔丁醇(TBA)和苯醌(BQ)作为羟基自由基(∙OH)和超氧自由基(∙O2-)的抑制剂,采用电子自旋共振谱(EPR)验证体系中∙OH和∙O2-,∙OH和∙O2-自由基的捕获剂是100 mmol∙L−1 DMPO.
1.2.5 四环素的测定
使用Waters UPLC-VWD型超高效液相色谱检测溶液中TC. 色谱柱为ACQUITY UPLC BEH C18反相柱(100 mm × 2.1 mm i.d.,1.7 μm),检测波长为254 nm,进样量为10 μL,柱温40 ℃,流动相A为1‰甲酸,流动相B为乙腈. 梯度设置:95.0% A(0 min)、5.0% A(2.5 min)、95.0% A(3.51 min)、95.0% A(5 min),流速为0.30 mL∙min−1.
1.3 数据处理与分析
剩余率:η=1−T=Ct/C0 (1) 一级速率常数计算式为:ln(Ct/C0)=kt (2) 式中,C0和Ct分别代表四环素的起始质量浓度和t时刻的质量浓度,单位mg∙L−1.
所有数据均以3次重复的平均值±标准偏差表示,并使用Origin 8.5绘制数据. 使用SPSS 21.0软件对数据进行统计分析.
2. 结果与讨论 (Results and discussion)
2.1 HFO的表征
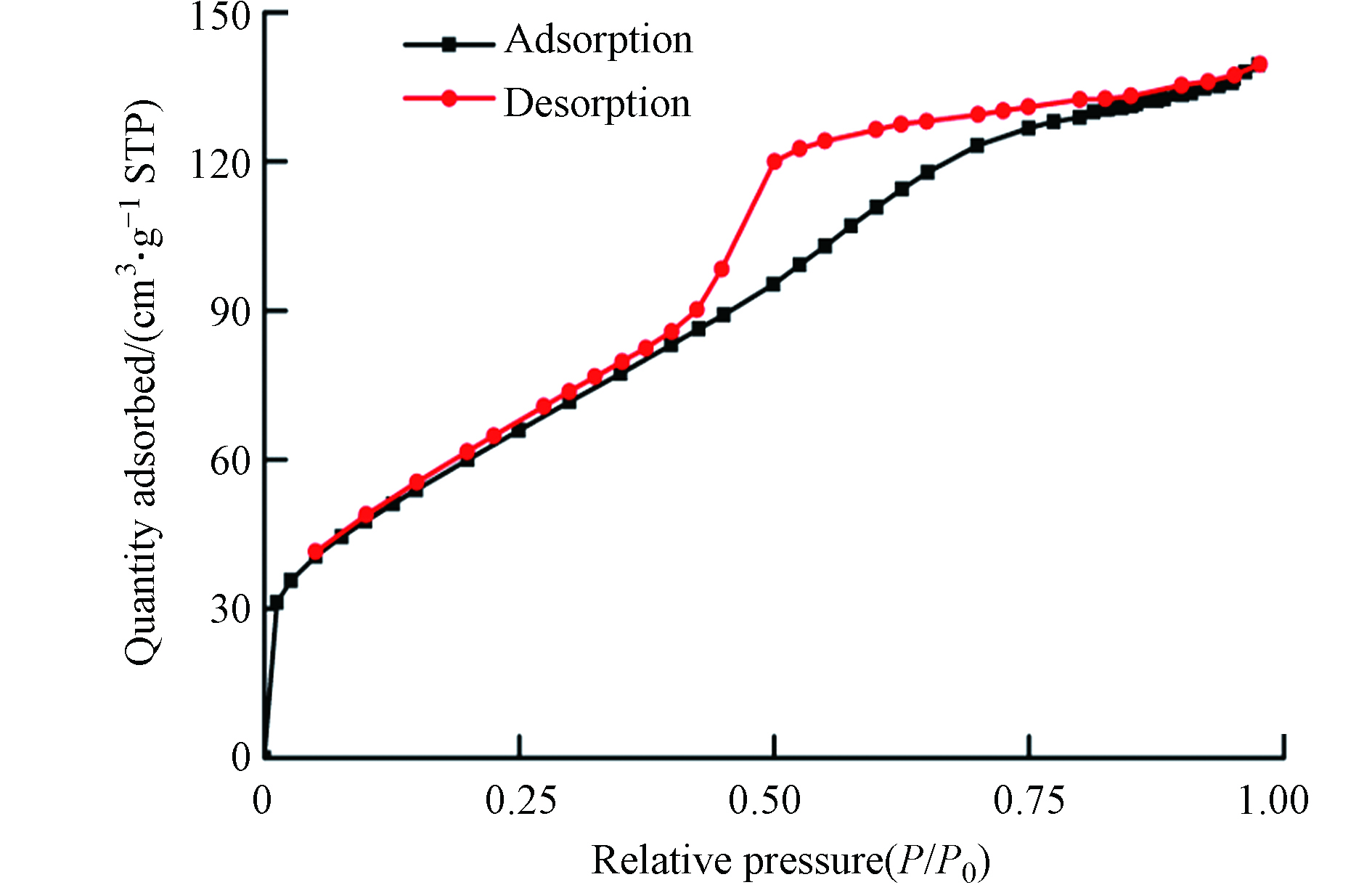
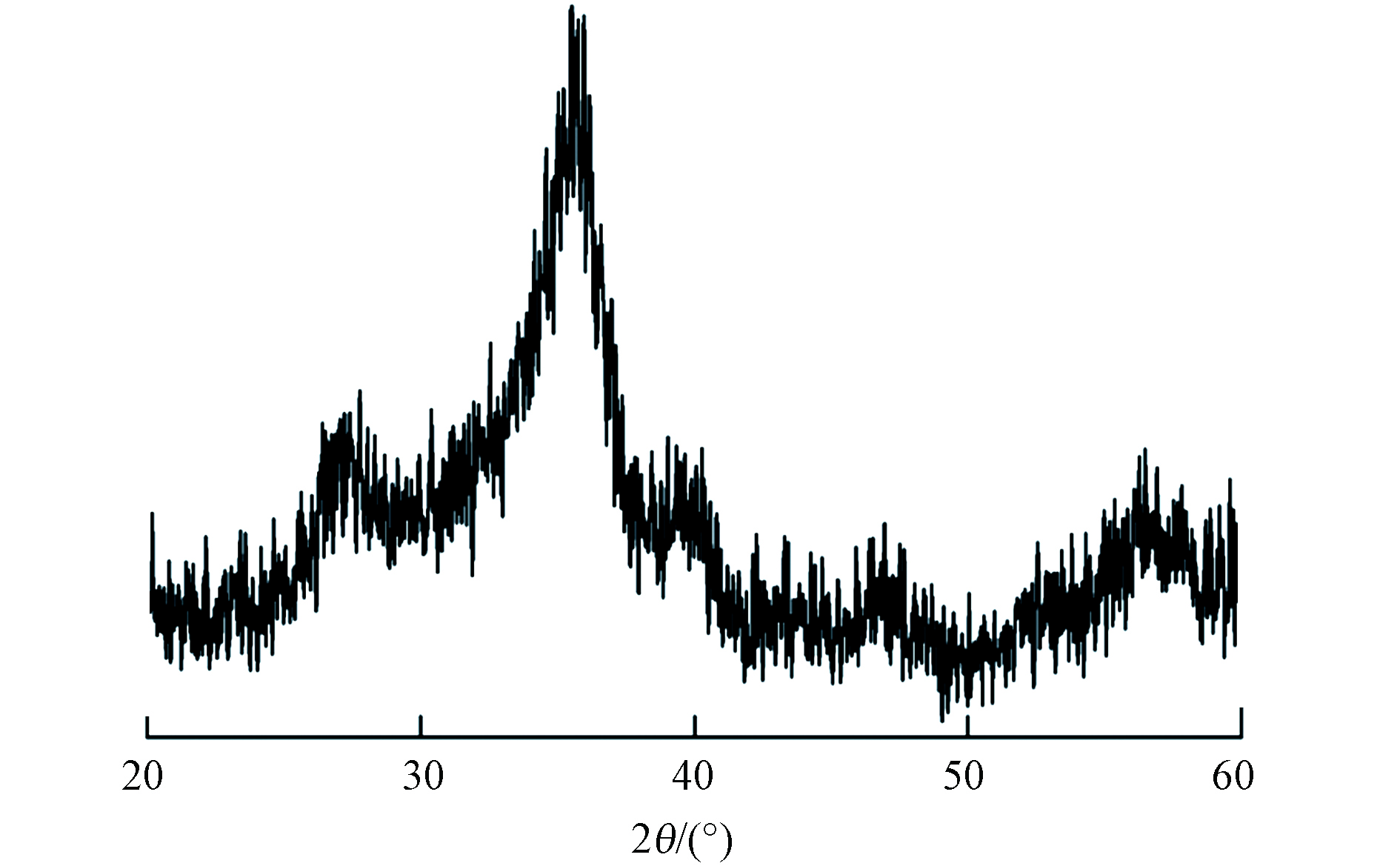
HFO的XRD图谱如图1所示. 图1中未出现较强的衍射特征峰,这表明水合氧化铁不具有晶体结构. 水合氧化铁在36.4º处出现1个宽峰,出峰位置与水铁矿相似 (JCPDS No. 29-0712)[18] ,表明合成的水合氧化铁为无定形铁氧化物.
HFO的氮气吸附解吸曲线如图2所示. HFO的N2吸附-脱附曲线属于V型等温线并具有H4型滞后回环,表明合成的样品中主要存在的是介孔结构[19]. 水合氧化铁的比表面积,孔体积和孔径分别为226.796 m2∙g−1、0.167 cm3∙g−1和3.495 nm. 由上述数据可知,水合氧化铁的孔隙结构较为发达,拥有较高的比表面积,可提供更多的Fe活性位点,有利于催化H2O2降解污染物.
2.2 不同反应体系下TC的降解速率
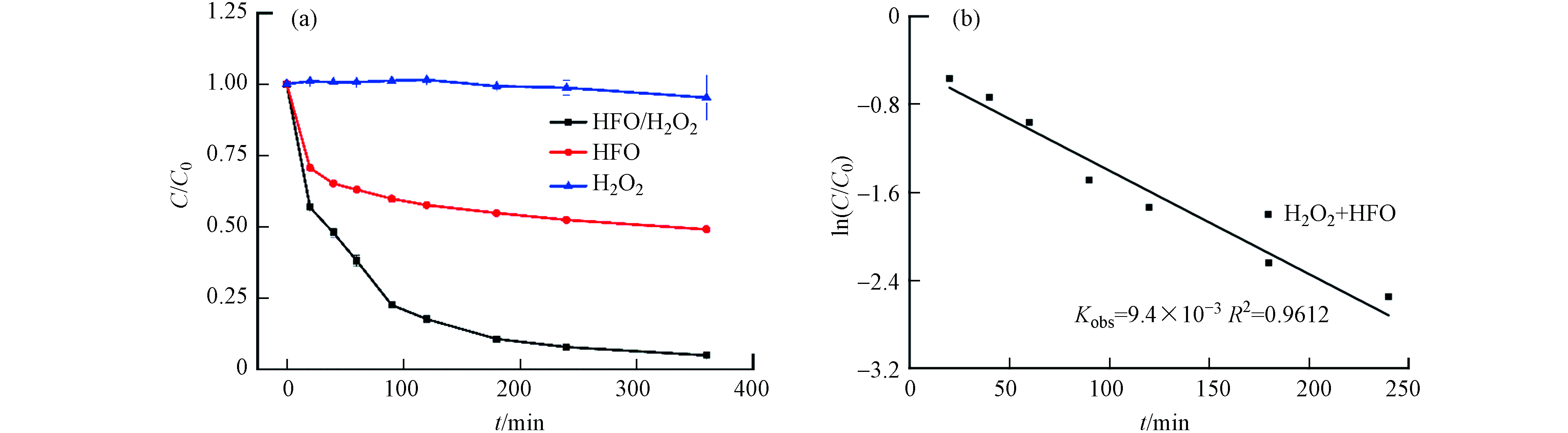
不同反应体系(H2O2、HFO和H2O2/HFO)下TC的降解动态如图3(a)所示. 当H2O2单独存在时,0—6 h内TC浓度几乎不变,这表明仅仅使用H2O2难以直接降解TC. 单独加入HFO时,四环素去除率为54%. 这可能是因为催化剂和TC发生了吸附反应. 在H2O2/HFO体系下,TC的去除率可达97%,这表明HFO可有效地催化H2O2氧化降解TC. 在实验中采用拟一级动力学拟合HFO/H2O2体系的降解数据,如图3(b)所示,与该模型相对吻合(R2>0.9),相对应的表观速率常数为9.4×10−3 min−1,这表明HFO可以有效催化激活H2O2生成自由基,促进TC的降解.
2.3 H2O2浓度对TC降解的影响
H2O2浓度会直接影响自由基的生成,进而影响TC的降解效率[20]. 不同H2O2浓度对TC降解的影响见图4.
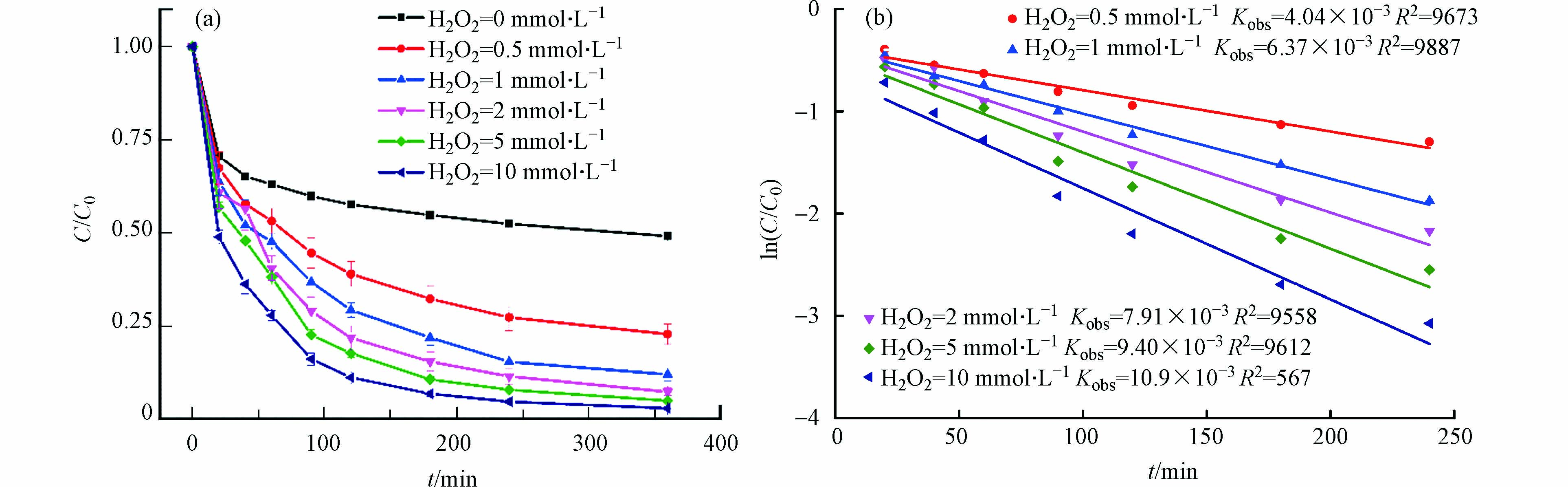
H2O2的浓度从0 mmol∙L−1增加到10 mmol∙L−1时,TC的去除率从54%增加到98%. 采用拟一级动力学模型拟合HFO催化不同浓度H2O2降解四环素的过程,结果见图4(b). 当H2O2的浓度从0.5 mmol∙L−1增加到10 mmol∙L−1时,其相对应的表观速率常数从4.04×10−3 min−1增加到10.9×10−3 min−1,这表明随着H2O2浓度增加促进了TC的降解速率. 这主要是由于随着H2O2浓度的增加,HFO能够催化H2O2产生更多的自由基降解TC.
2.4 溶液初始pH值对TC降解的影响
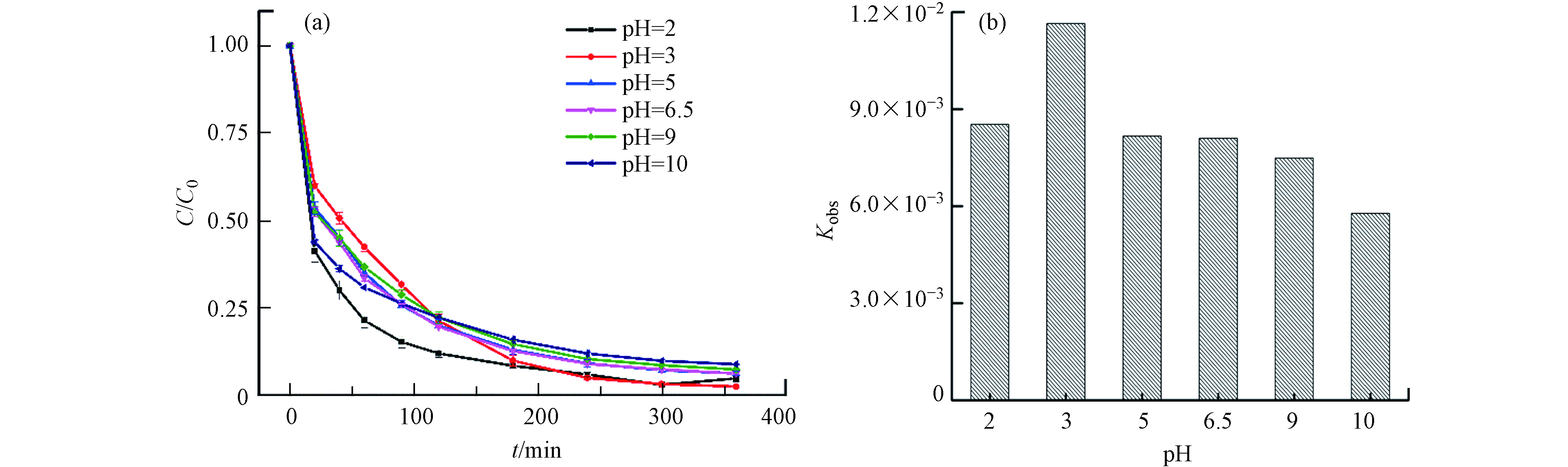
溶液初始pH值对TC降解速率的影响如图5所示,在酸性条件下,TC具有更高的降解速率和去除率. 这可以归因于,在酸性条件下,HFO催化剂表面更容易溶解出Fe(Ⅱ)和Fe(Ⅲ)催化H2O2生成自由基降解TC. 由图5(a)可知,初始pH值在2—10之间时催化剂对TC都具有良好的降解效果,降解效率都在90%之上. 可见HFO催化H2O2对TC的降解有着较好的pH适应性.
2.5 共存离子对TC降解的影响
由于在实际水体中含有大量的阴离子和阳离子,因此在实验中研究了共存Na+、Ca2+、Mg2+、
NO−3 HCO−3 SO2−4 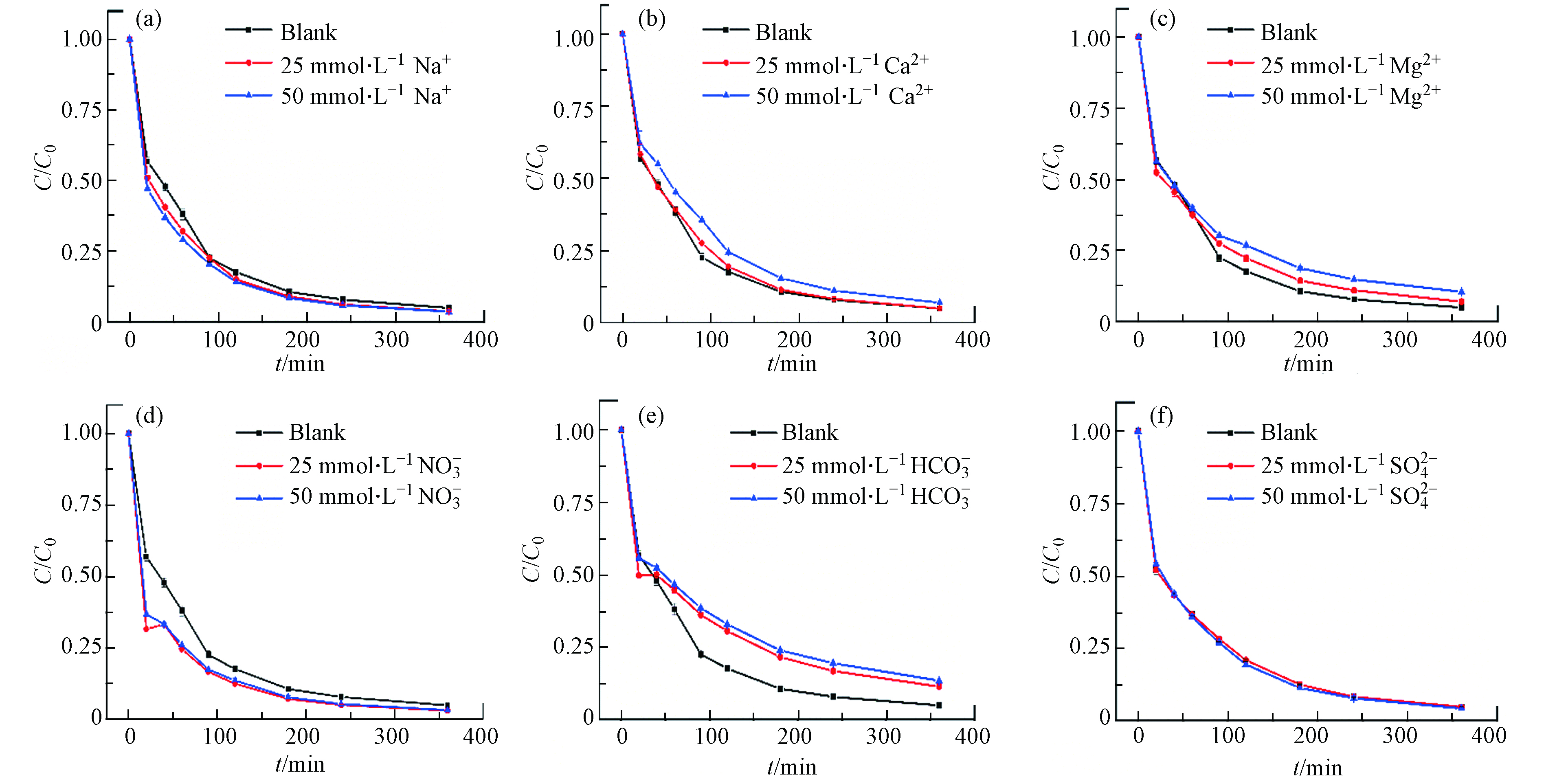 图 6 无机盐离子(a) Na+,(b) Ca2+,(c) Mg2+,(d) NO3-,(e) HCO3-,(f) SO42-对HFO催化H2O2降解四环素的影响Figure 6. Effect of inorganic salt ions on HFO catalytic degradation of tetracycline by H2O2.(实验条件:催化剂投加量 为 0.4 g∙L−1;pH = 6.5;[TC]= 40 mg∙L−1;[H2O2]= 5 mmol∙L−1)(Dosage 0.4 g∙L−1; pH = 6.5; [TC] = 40 mg∙L−1;[H2O2] = 5 mmol∙L−1)
图 6 无机盐离子(a) Na+,(b) Ca2+,(c) Mg2+,(d) NO3-,(e) HCO3-,(f) SO42-对HFO催化H2O2降解四环素的影响Figure 6. Effect of inorganic salt ions on HFO catalytic degradation of tetracycline by H2O2.(实验条件:催化剂投加量 为 0.4 g∙L−1;pH = 6.5;[TC]= 40 mg∙L−1;[H2O2]= 5 mmol∙L−1)(Dosage 0.4 g∙L−1; pH = 6.5; [TC] = 40 mg∙L−1;[H2O2] = 5 mmol∙L−1)Na+、Ca2+、
NO−3 SO2−4 HCO−3 HCO−3 HCO−3 CO−3 2.6 三维荧光光谱分析
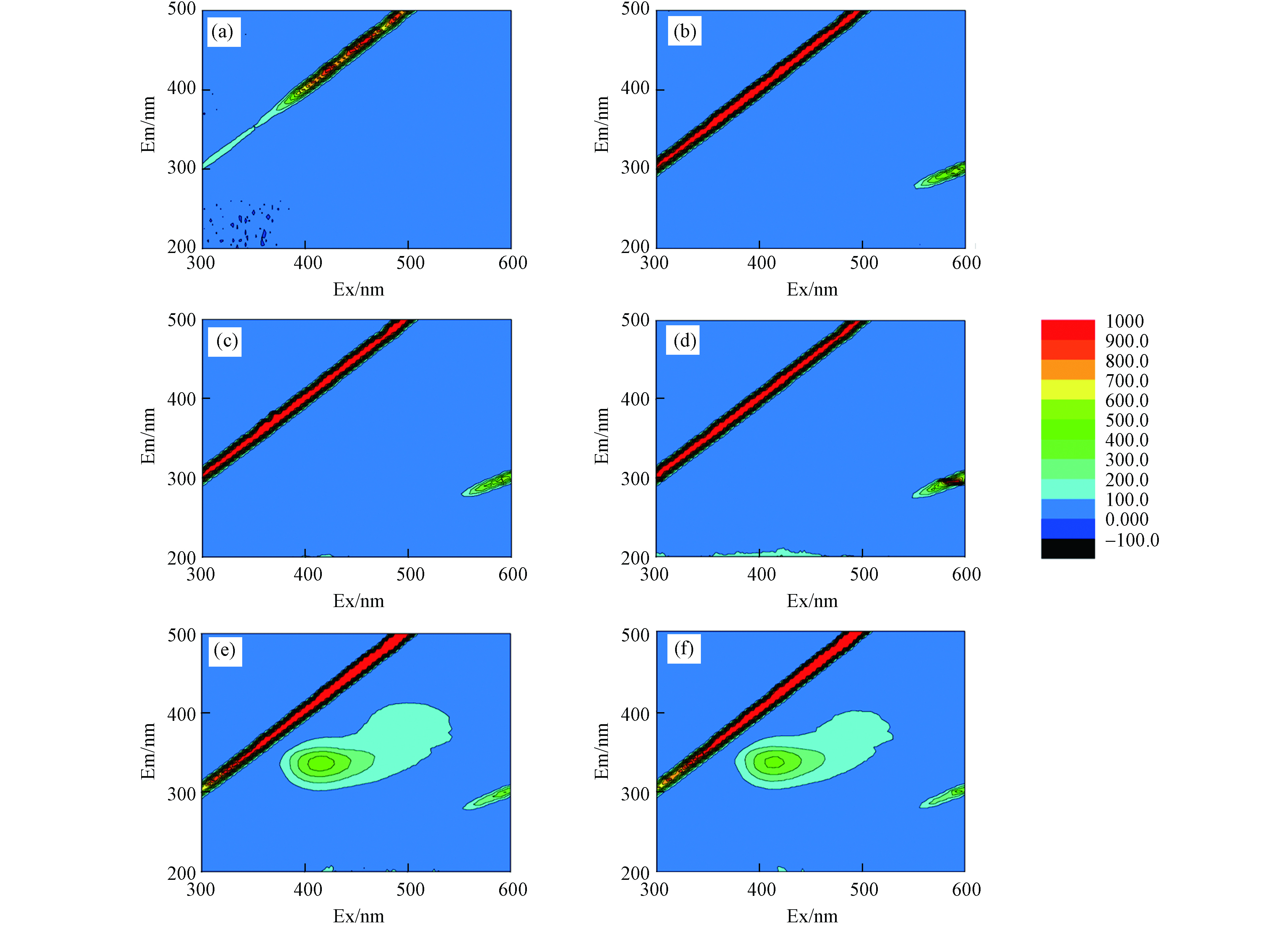
采用荧光光谱技术检测分析了四环素在不同体系(TC、H2O2/TC、HFO/TC和H2O2/HFO/TC)反应后的三维荧光特征及其指纹特征. 在实验中收集了6个样品(M1-M6),M1:初始TC溶液的三维荧光光谱、M2:HFO/TC体系在黑暗中振荡6 h后,离心取上清液测定的三维荧光光谱、M3:H2O2/TC体系在黑暗中震荡4 h后,离心取上清液测定的三维荧光光谱、M4:H2O2/TC体系在黑暗中振荡6 h后,离心取上清液测定的三维荧光光谱、M5:HFO/H2O2/TC体系在黑暗中震荡4 h后,离心取上清液测定的三维荧光光谱、M6:HFO/H2O2/TC体系在黑暗中振荡6 h后,离心取上清液测定的三维荧光光谱. M1-M6的三维荧光如图7所示.
Shi等 [22] 研究表明在三维荧光中,TC的存在会起到荧光淬灭作用. 如图7(a)、(b)、(c)和(d)所示,在TC、HFO/TC和H2O2/TC体系中均未检测到荧光信号,这表明在TC、HFO/TC和H2O2/TC体系中TC分子均没有被完全去除. 由图7(e)和(f)可知,在HFO/H2O2体系中,出现了一个对应于类腐殖酸区域的荧光峰(λEX/λEM=(305—330 nm)/(430—450 nm) )[23],且峰强度随着反应的进行而减弱,表明TC及其降解产物在HFO/H2O2体系中不断被降解.
2.7 催化降解后HFO的FTIR分析
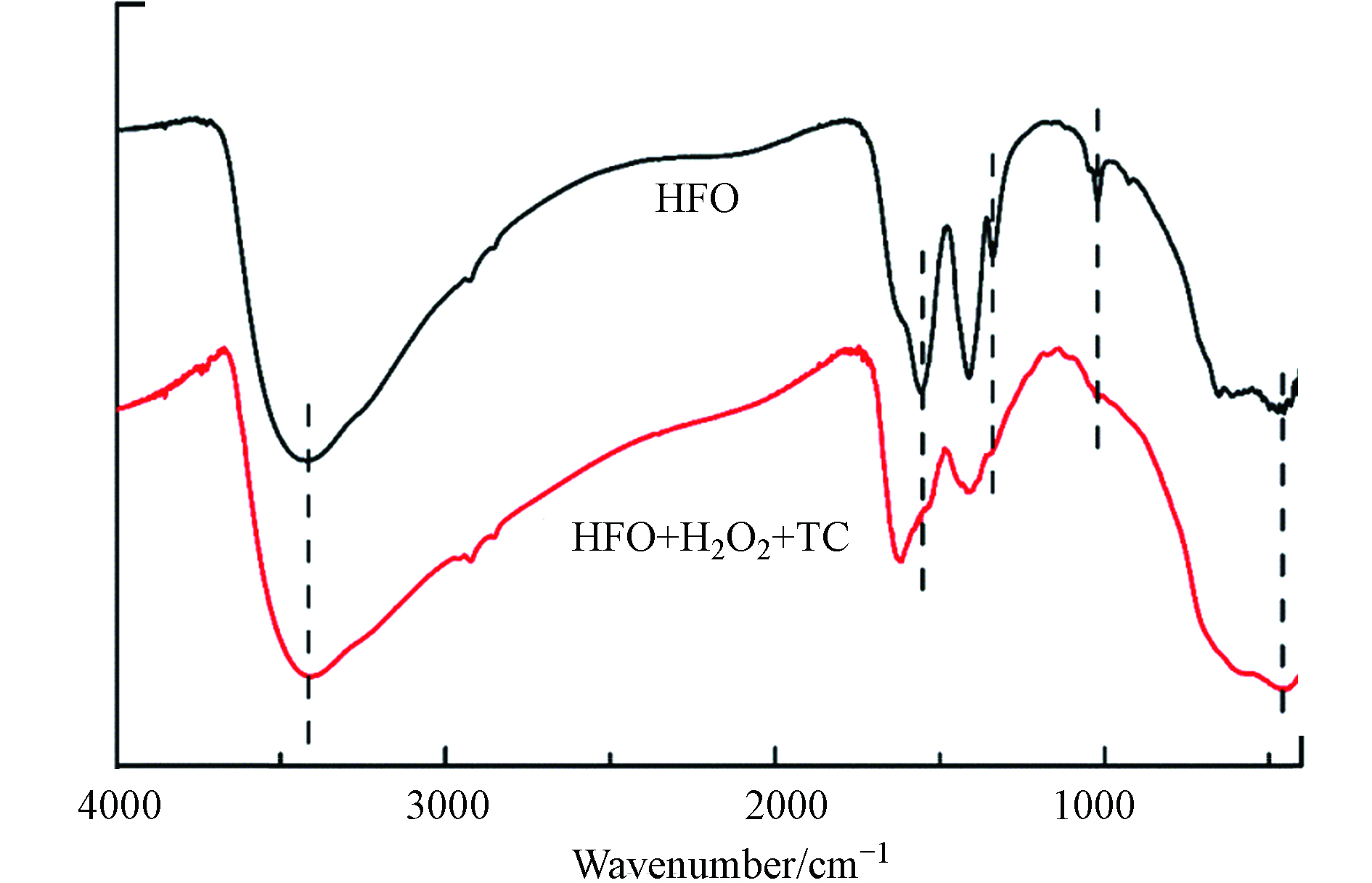
图8为HFO在催化反应前后的FTIR图谱. 由图8可知,HFO的红外光谱中出现了—OH(3405 cm−1、1629 cm−1)这表明了羟基的存在. 444 cm−1处为Fe—O键伸缩振动峰,1023 cm−1处为Fe—OH键伸缩振动峰[24]. HFO在催化过程中,Fe—O的出峰位置从444 cm−1迁移到463 cm−1,Fe—OH的吸收峰消失,这表明Fe—O和Fe—OH官能团参与了催化作用. 在3405 cm−1处的羟基伸缩振动峰移至3416 cm−1,这表明在催化反应过程中羟基参与了反应.
2.8 催化反应前后HFO的XPS分析
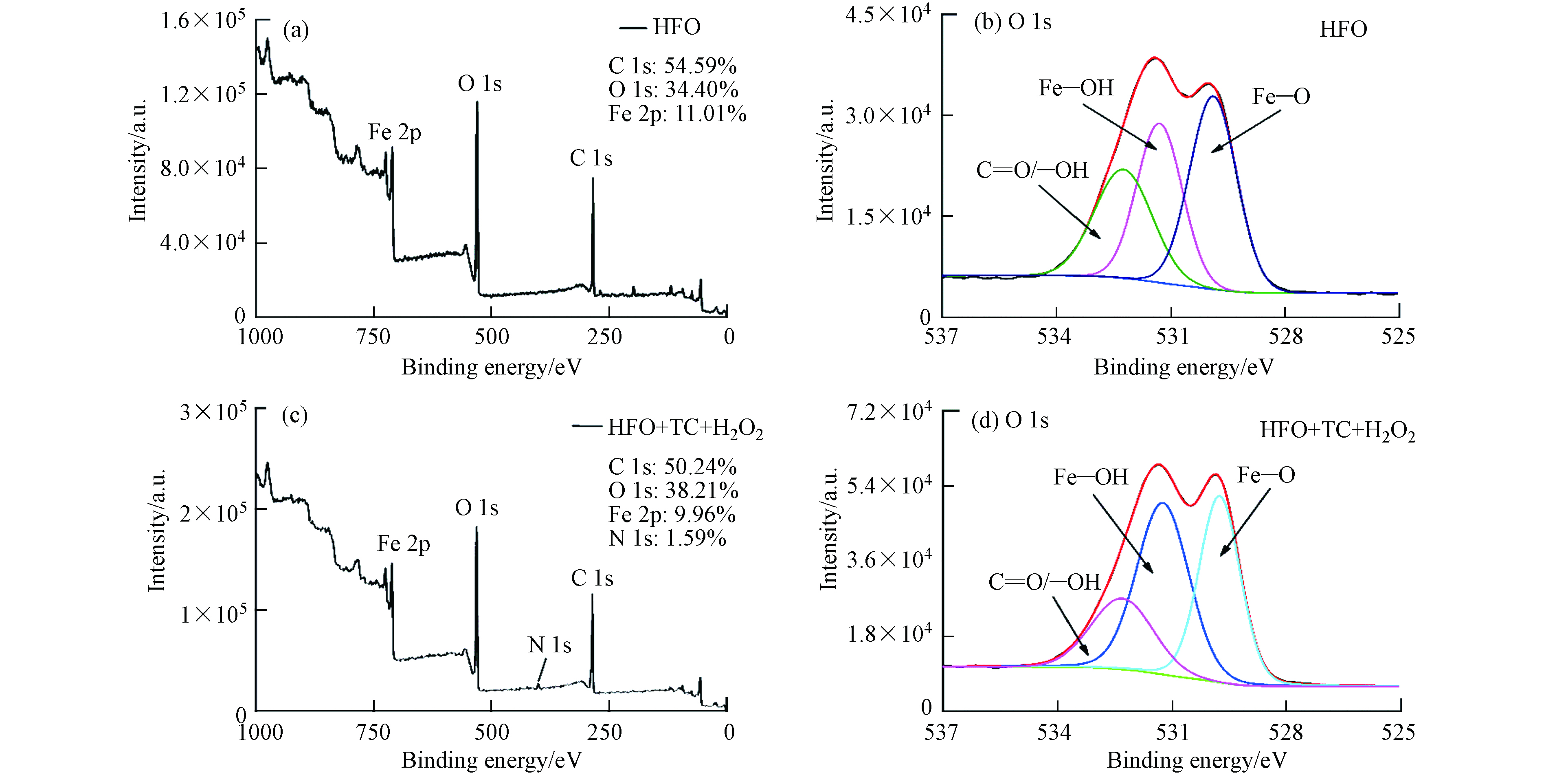
图9为HFO催化反应前后的XPS分析结果. 由图9(a)和(c)可知,HFO的全扫描能谱中出现了C 1s、O 1s和Fe 2p的3个能区,而HFO催化后的全扫描能谱中出现了C 1s、O 1s、Fe 2p和N1s的4个能区,这表明HFO在催化过程中吸附了一定量的TC及其降解产物. 图9(b)和(d)为HFO催化前后O 1s的高分辨扫描能谱,其中530 eV、531 eV和532 eV处的3个主峰分别对应Fe—O、Fe—OH和C=O/OH的结合能[25]. 其中催化后Fe—OH峰面积从32%增加值43%,Fe—O的峰面积从40%降低到37%,这表明HFO在催化过程中部分Fe—O官能团转变成Fe—OH官能团,铁主要分布在HFO的表面.
2.9 循环次数对HFO降解TC效果的影响
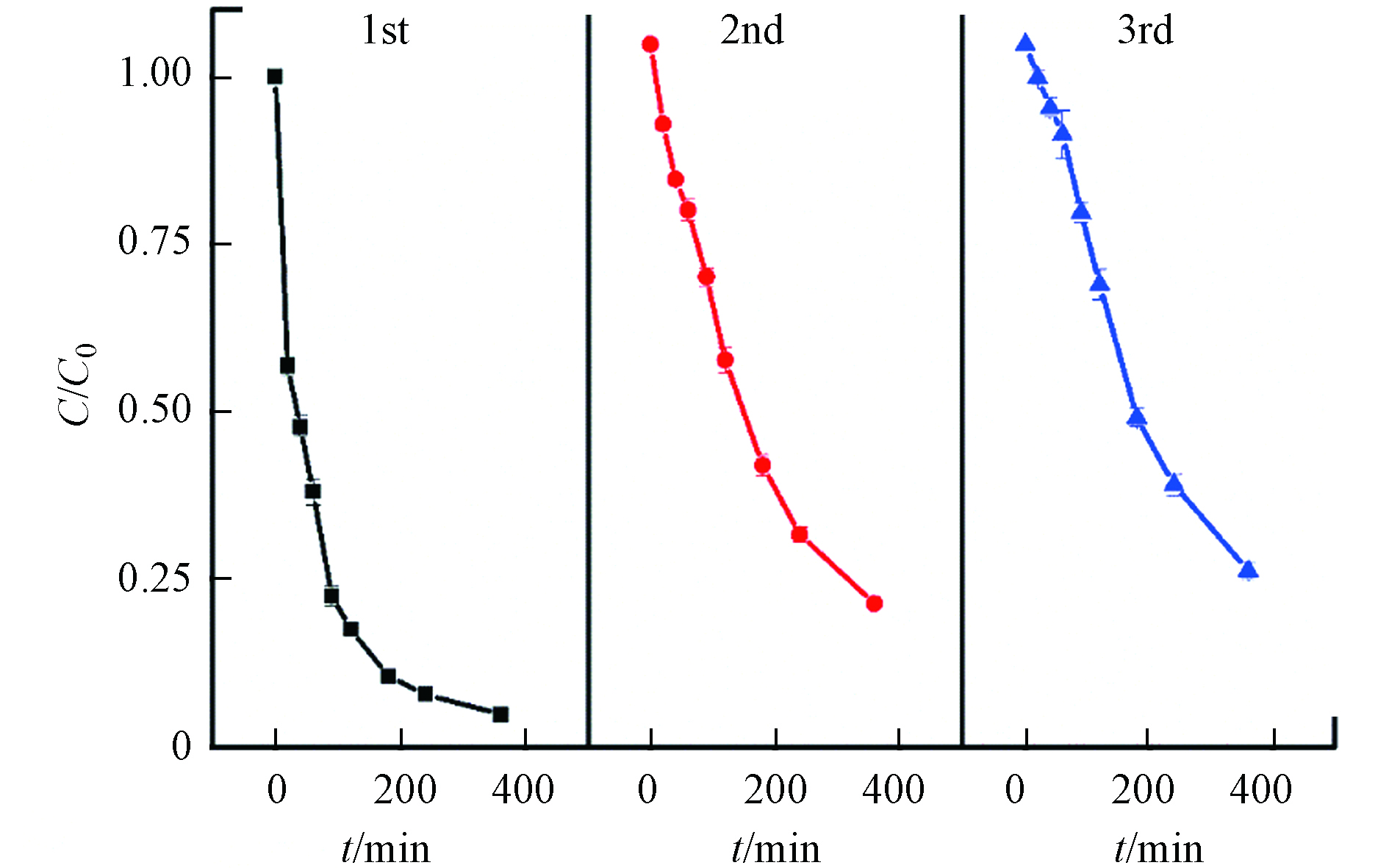
催化剂的稳定性和可重复利用性对其在实际应用中至关重要. 通过连续反应3次循环实验评估HFO在黑暗处催化H2O2降解TC的效率,以验证HFO的可重复利用性,结果如图10所示. 经过3次循环实验后,在360 min内对TC的降解速率逐渐降低,表明HFO上的某些催化活性位点可能会随Fe的浸出而损失[26]. HFO经历3次循环后,TC在360 min内的去除率分别为95%、80%和75%. 因此,在HFO/H2O2具有可重复应用的潜力.
2.10 活性氧化物质的鉴定
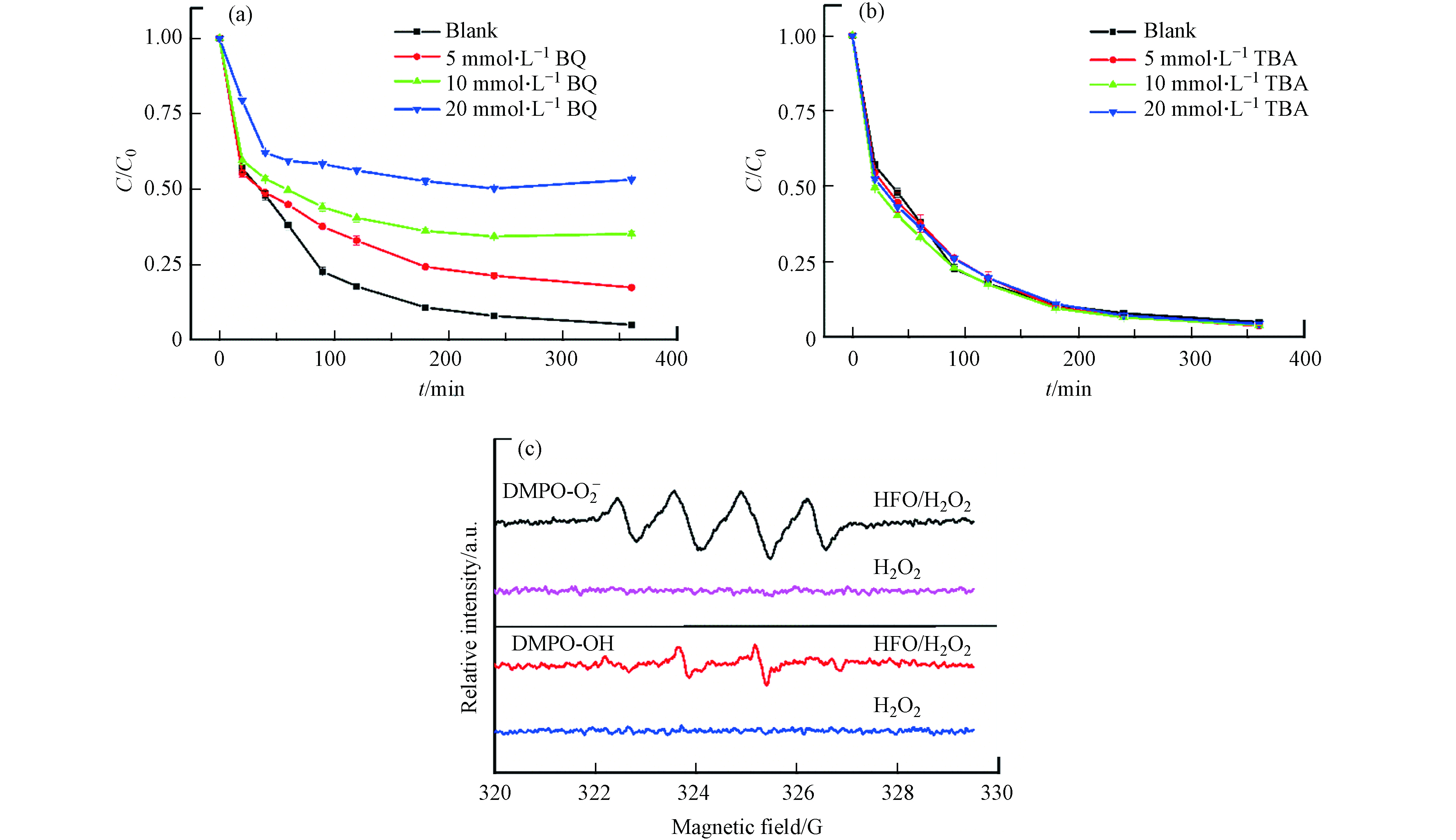
通过自由基淬灭实验和电子自旋共振波谱仪测定反应体系中的主要自由基. 在淬灭实验中分别使用苯醌(BQ)和叔丁醇(TBA)对类Fenton反应过程中产生的∙O2-和∙OH进行淬灭[27]. 如图11(a)所示,当反应溶液中分别添加5、10、20 mmol∙L−1的苯醌时,在360 min内,TC的降解率从95%分别下降到82%、64%和46%. 但是当添加5、10、20 mmol∙L−1的叔丁醇时,在360 min内,TC的降解率几乎没有下降,说明HFO/H2O2反应体系中产生的主要活性物质是∙O2-[28].
为了进一步确认反应机理,通过EPR检测反应体系中的活性物质,采用DMPO作为∙OH和∙
O−2 O−2 O−2 O−2 2.11 TC降解途径
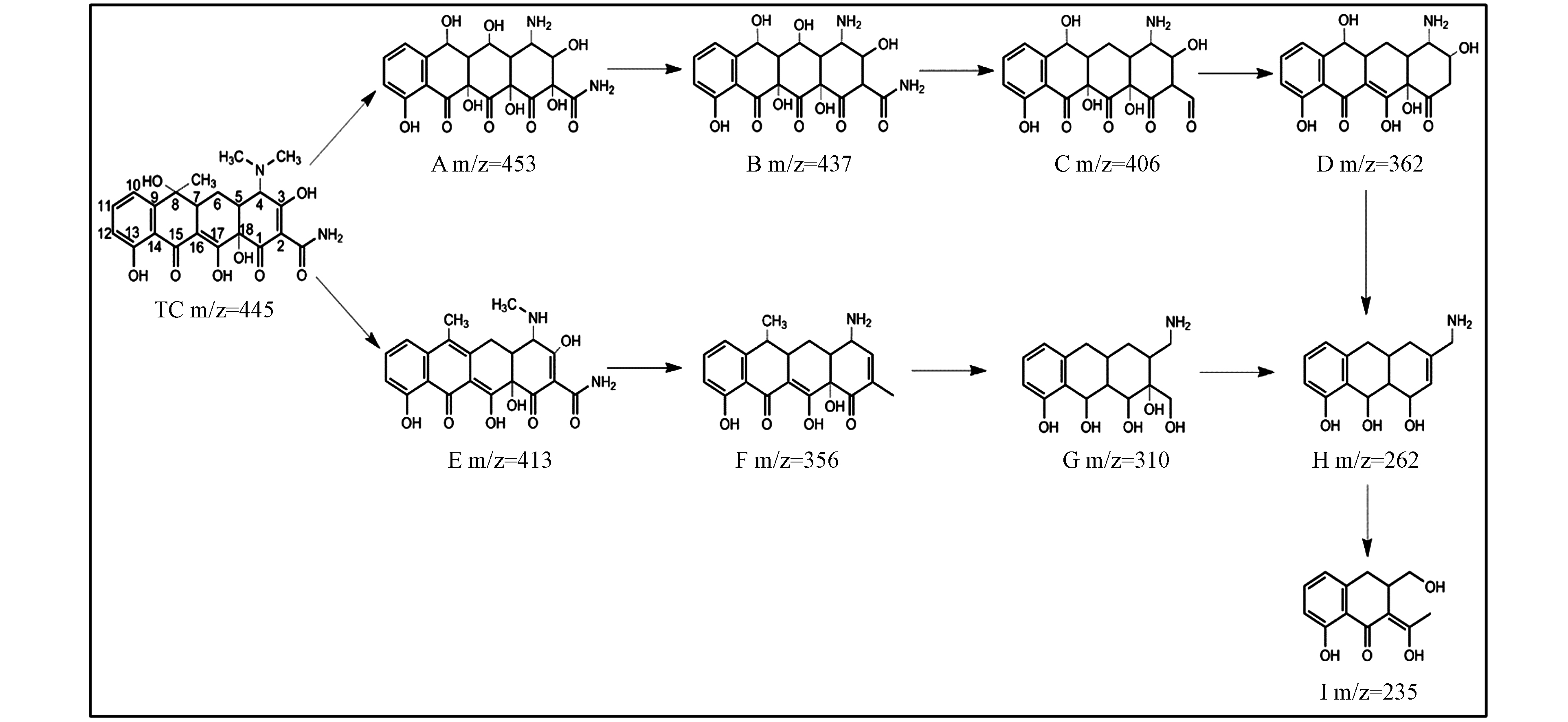
利用LC-TOF-MS共检测到9种TC的中间降解产物,质荷比(m/z)分别为:A(m/z=453)、B(m/z=437)、C(m/z=406)、D(m/z=362)、E(m/z=413)、F(m/z=356)、G(m/z=310)、H(m/z=262)和I(m/z=235). 根据分子量、理论分子量和文献报道,推测HFO/H2O2降解TC中间产物的结构和反应路径如图12所示.
TC降解途径Ⅰ,TC上碳碳双键羟基化,生成产物A(m/z=453)[30],通过A脱羟基形成产物B(m/z=437),通过C—N键断裂和脱羟基形成产物C(m/z=406),通过去甲基化作用将产物 C 进一步转化为产物 D(m/z =362)[31],通过开环、去甲基化和去羟基将产物D转化为产物H(m/z=262),然后产物H通过开环和加羟基化为产物I(m/z=235)[32],最后产物I被转化为小分子物质并进一步氧化为H2O和CO2. 降解途径Ⅱ,TC去甲基和羟基生成产物E(m/z=413)[33],通过E去甲基、脱羟基和NH2形成产物F(m/z =356),F通过开环和C=C双键的氢加成变成产物G(m/z=310),G通过脱C18上的羧基(—C—OH)和羟基生产H(m/z=262),最后再进一步通过开环和加羟基化为产物I(m/z=235)[32],最后产物I被转化为小分子物质并进一步氧化为H2O和CO2.
3. 结论 (Conclusion)
HFO/H2O2体系在H2O2的浓度为5 mmol∙L−1,催化剂为0.4 mg∙L−1,pH=3,温度25 ℃的反应条件下可在180 min内去除水中90%的TC. 在pH为2—10的范围内和共存离子存在时,HFO都可有效的催化H2O2降解水体中的TC,HFO/H2O2体系降解TC的主要活性物质是∙O2-. TC降解过程中出现了9种中间产物,说明TC主要是通过羟基化、去甲基、去酰胺基和开环等途径被降解成小分子化合物. 本研究揭示了HFO对TC催化降解作用,说明自然界存在的HFO在TC降解和代谢过程中起到重要作用.
-
表 1 土壤基本理化性质
Table 1. Physical and chemical properties of soil
种类Soil pH 最大持水量/ %Water holding capacity (dry soil weight) CEC / (cmol·kg−1) 全氮/ %Total nitrogen 有机质碳/ %Organic carbon 红壤 5.3 49.08 9.4 0.112 0.397 乌栅土 7.34 72.86 20.3 0.234 2.37 表 2 土壤重金属浓度及相应污染风险标准(mg·kg−1)
Table 2. Soil heavy metal concentrations and corresponding pollution risk criteria
重金属类型Heavy metal 红壤Red soil 乌栅土Wushan soil 农业地风险值aStandard for agricultural land 居住地风险值bStandard for residential land 工业地风险值bStandard for industrial land Cu 43.9 29.9 100 2000 18000 Zn 90.7 100 200 3500c 10000c Cd 0.046 0.183 0.3 20 65 备注:a 参考《土壤环境质量 农用地土壤污染风险管控标准(试行)》(GB15618—2018)农用地筛选值. According to the risk value of agricultural land in " Soil environmental quality Risk control standard for soil contamination of agricultural land. (Trial)" (GB15618-2018). b 参考《土壤环境质量 建设用地土壤污染风险管控标准(试行)》(GB36600—2018)中的居住一类用地风险筛选值和二类工业用地风险筛选值. According to the risk value of residential land and industrial land in “Soil environmental quality Risk control standard for soil contamination of development land. (Trial)” (GB36600-2018). c 参考《北京市场地土壤环境风险评价筛选值》(DB11/T 811—2011)中的居住地风险筛选值. According to the risk value of residential land in “Screening Levels for Soil Environmental Risk Assessment of Sites” (DB11/T 811 -- 2011). -
[1] WANG J X, LIU L L, WANG J F, et al. Distribution of metals and brominated flame retardants (BFRs) in sediments, soils and plants from an informal e-waste dismantling site, South China [J]. Environmental Science and Pollution Research, 2015, 22(2): 1020-1033. doi: 10.1007/s11356-014-3399-1 [2] WU Y Y, LI Y Y, KANG D, et al. Tetrabromobisphenol A and heavy metal exposure via dust ingestion in an e-waste recycling region in Southeast China [J]. Science of the Total Environment, 2016, 541: 356-364. doi: 10.1016/j.scitotenv.2015.09.038 [3] LAW R J, ALLCHIN C R, de BOER J, et al. Levels and trends of brominated flame retardants in the European environment [J]. Chemosphere, 2006, 64(2): 187-208. doi: 10.1016/j.chemosphere.2005.12.007 [4] 夏炎, 韩伟立, 马安德. 广东省农耕土壤中四溴双酚A与六溴环十二烷的含量调查及其蓄积水平估算 [J]. 环境化学, 2017, 36(6): 1328-1334. XIA Y, HAN W L, MA A D. Contents, distribution and composition of tetrabromobisphenol A and hexabromocyclododecane in agricultural soils of Guangdong [J]. Environmental Chemistry, 2017, 36(6): 1328-1334(in Chinese).
[5] 吴玉丽, 肖羽堂, 王冠平, 等. 多溴联苯醚、六溴环十二烷和四溴双酚A在环境中污染现状的研究进展 [J]. 环境化学, 2021, 40(2): 384-403. WU Y L, XIAO Y T, WANG G P, et al. Research progress on status of environmental pollutions of polybrominated diphenyl ethers, hexabromocyclodocane, and tetrabromobisphenol A: A review [J]. Environmental Chemistry, 2021, 40(2): 384-403(in Chinese).
[6] 蔡蕊, 王文姬, 许航, 等. 四溴双酚A在土壤中的降解转化及残留研究进展 [J]. 环境化学, 2021, 40(1): 102-110. CAI R, WANG W J, XU H, et al. Degradation, transformation, and residue formation of tetrabromobisphenol A ( TBBPA) in soil: A review [J]. Environmental Chemistry, 2021, 40(1): 102-110(in Chinese).
[7] VOORDECKERS J W, FENNELL D E, JONES K, et al. Anaerobic biotransformation of tetrabromobisphenol A, tetrachlorobisphenol A, and bisphenol A in estuarine sediments [J]. Environmental Science & Technology, 2002, 36(4): 696-701. [8] HU F, PAN L, XIU M, JIN Q, et al. Bioaccumulation and detoxification responses in the scallop Chlamys farreri exposed to tetrabromobisphenol A (TBBPA) [J]. Environmental Toxicology and Pharmacology, 2015, 39(3): 997-1007. doi: 10.1016/j.etap.2015.03.006 [9] LIU J, WANG Y F, JIANG B Q, et al. Degradation, metabolism, and bound-residue formation and release of Tetrabromobisphenol A in soil during sequential anoxic-oxic incubation [J]. Environmental Science & Technology, 2013, 47(15): 8348-8354. [10] 杨书娴, 胡星. 新型好氧W1-2菌株降解四溴双酚A的性能 [J]. 上海大学学报(自然科学版), 2022, 28(1): 57-66. YANG S X, HU X. Degradation characteristics of biodegradation of tetrabromobisphenol A by the novel arerobic strain W1-2 [J]. Journal of Shanghai University (Natural Science Edition), 2022, 28(1): 57-66(in Chinese).
[11] LI F J, WANG J J, NASTOLD P, et al. Fate and metabolism of tetrabromobisphenol A in soil slurries without and with the amendment with the alkylphenol degrading bacterium Sphingomonas sp. strain TTNP3 [J]. Environmental Pollution (Barking, Essex:1987), 2014, 193: 181-188. doi: 10.1016/j.envpol.2014.06.030 [12] GU J Q, CHEN X, WANG Y F, et al. Bioaccumulation, physiological distribution, and biotransformation of tetrabromobisphenol a (TBBPA) in the geophagous earthworm Metaphire guillelmi - hint for detoxification strategy [J]. Journal of Hazardous Materials, 2020, 388: 122027. doi: 10.1016/j.jhazmat.2020.122027 [13] GU J Q, JING Y Y, MA Y N, et al. Effects of the earthworm Metaphire guillelmi on the mineralization, metabolism, and bound-residue formation of tetrabromobisphenol A (TBBPA) in soil [J]. The Science of the Total Environment, 2017, 595: 528-536. doi: 10.1016/j.scitotenv.2017.03.273 [14] SUN F F, KOLVENBACH B A, NASTOLD P, et al. Degradation and metabolism of tetrabromobisphenol A (TBBPA) in submerged soil and soil-plant systems. [J]. Environmental Science & Technology, 2014, 48(24): 14291-14299. [15] SCHRÖEDER P, LYUBENOVA L, HUBER C. Do heavy metals and metalloids influence the detoxification of organic xenobiotics in plants? [J]. Environmental Science and Pollution Research International, 2009, 16(7): 795-804. doi: 10.1007/s11356-009-0168-7 [16] TAN Y Y, GUO Y, GU X Y, et al. Effects of metal cations and fulvic acid on the adsorption of ciprofloxacin onto goethite [J]. Environmental Science and Pollution Research, 2015, 22(1): 609-617. doi: 10.1007/s11356-014-3351-4 [17] ZHAO Y P, TAN Y Y, GUO Y, et al. Interactions of tetracycline with Cd (II), Cu (II) and Pb (II) and their cosorption behavior in soils [J]. Environmental Pollution, 2013, 180: 206-213. doi: 10.1016/j.envpol.2013.05.043 [18] LU M, ZHANG Z Z, WANG J X, et al. Interaction of heavy metals and Pyrene on their fates in soil and tall fescue (Festuca arundinacea) [J]. Environmental Science & Technology, 2014, 48(2): 1158-1165. [19] LUO L, ZHANG S Z, CHRISTIE P. New insights into the influence of heavy metals on phenanthrene sorption in soils [J]. Environmental Science & Technology, 2010, 44(20): 7846-7851. [20] ZHANG W H, ZHENG J, ZHENG P, et al. The roles of humic substances in the interactions of phenanthrene and heavy metals on the bentonite surface [J]. Journal of Soils and Sediments, 2015, 15(7): 1463-1472. doi: 10.1007/s11368-015-1112-8 [21] 孔颖, 左翔之, 易鹏, 等. 天然有机质的性质分析及其与土壤矿物和外源污染物相互作用研究进展 [J]. 环境化学, 2021, 40(9): 2715-2726. KONG Y, ZUO X Z, YI P, et al. Research progress on analysis of the properties of natural organic matter and its interaction with soil minerals and exogenous pollutants [J]. Environmental Chemistry, 2021, 40(9): 2715-2726(in Chinese).
[22] ZHANG H, DANG Z, YI X Y, et al. Evaluation of dissipation mechanisms for pyrene by maize (Zea Mays L. ) in cadmium co-contaminated soil [J]. Global Nest Journal, 2009, 11(4): 487-496. [23] WANG Y H, LI M J, LIU Z W, et al. Interactions between Pyrene and heavy metals and their fates in a soil-maize (Zea mays L. ) system: Perspectives from the root physiological functions and rhizosphere microbial community [J]. Environmental Pollution, 2021, 287: 117616. doi: 10.1016/j.envpol.2021.117616 [24] 陆雅婕, 吴笛, 尹颖, 等. 重金属和溴代阻燃剂复合污染对小白菜的生物效应 [J]. 南京大学学报(自然科学), 2018, 54(1): 196-204. LU Y J, WU D, YIN Y, et al. Combined effect of heavy metals and bromine flame retardants for pakchoi [J]. Journal of Nanjing University (Natural Science), 2018, 54(1): 196-204(in Chinese).
[25] 陈欣瑶, 杨惠子, 陈楸健, 等. 重金属胁迫下不同区域土壤的生态功能稳定性与其微生物群落结构的相关性 [J]. 环境化学, 2017, 36(2): 356-364. CHEN X Y, YANG H Z, CHEN Q J, et al. Correlation between microbial community structure and soil ecosystem functional stability under heavy metal stress [J]. Environmental Chemistry, 2017, 36(2): 356-364(in Chinese).
[26] YU X S, LIU Y, LOU J, et al. Determination of water- and methanol-extractable pentachlorophenol in soils using vortex-assisted liquid-liquid extraction and gas chromatography [J]. Chinese Journal of Analytical Chemistry, 2015, 43(9): 1389-1394. doi: 10.1016/S1872-2040(15)60861-1 [27] LI F J, JIANG B Q, NASTOLD P, et al. Enhanced transformation of tetrabromobisphenol A by nitrifiers in nitrifying activated sludge [J]. Environmental Science & Technology, 2015, 49(7): 4283-4292. [28] LI F J, WANG J J, JIANG B Q, et al. Fate of tetrabromobisphenol A (TBBPA) and formation of ester- and ether-linked bound residues in an oxic sandy soil [J]. Environmental Science & Technology, 2015, 49(21): 12758-12765. [29] 郭碧林, 陈效民, 景峰, 等. 外源Cd胁迫对红壤性水稻土微生物量碳氮及酶活性的影响 [J]. 农业环境科学学报, 2018, 37(9): 1850-1855. GUO B L, CHEN X M, JING F, et al. Effects of exogenous cadmium on microbial biomass and enzyme activity in red paddy soil [J]. Journal of Agro-Environment Science, 2018, 37(9): 1850-1855(in Chinese).
[30] HE G H, WU J C, LIU Q, et al. Microbial and enzyme properties of acidic red soils under aluminum stress [J]. Fresenius Environmental Bulletin, 2012, 21(9): 2818-2825. [31] HAO S F, WANG P Y, GE F, et al. Enhanced Lead (Pb) immobilization in red soil by phosphate solubilizing fungi associated with tricalcium phosphate influencing microbial community composition and Pb translocation in Lactuca sativa L[J]. Journal of Hazardous Materials, 2022, 424(Pt D): 127720. [32] GU Y, SUN X B, LIU Y D. Biosorption and biodegradation of bisphenol A in an activated sludge system [J]. Research on Chemical Intermediates, 2016, 42(5): 4289-4301. doi: 10.1007/s11164-015-2274-0 [33] WANG M Q, YIN H, PENG H, et al. Degradation of 2, 2', 4, 4'-tetrabromodiphenyl ether by Pycnoporus sanguineus in the presence of copper ions [J]. Journal of Environmental Sciences, 2019, 83: 133-143. doi: 10.1016/j.jes.2019.03.020 [34] TONG F, GU X Y, GU C, et al. Insights into tetrabromobisphenol A adsorption onto soils: Effects of soil components and environmental factors [J]. Science of The Total Environment, 2015, 536: 582-588. doi: 10.1016/j.scitotenv.2015.07.063 [35] LI J H, ZHOU B X, SHAO J H, et al. Influence of the presence of heavy metals and surface-active compounds on the sorption of bisphenol A to sediment [J]. Chemosphere, 2007, 68(7): 1298-1303. doi: 10.1016/j.chemosphere.2007.01.045 [36] CHEN X, GU X Y, ZHAO X P, et al. Species-dependent effects of earthworms on the fates and bioavailability of tetrabromobisphenol A and cadmium coexisted in soils [J]. The Science of the Total Environment, 2019, 658: 1416-1422. doi: 10.1016/j.scitotenv.2018.12.196 [37] MA Y N, ZHAO Y Y, WANG Y F, et al. Effects of Cu2+ and humic acids on degradation and fate of TBBPA in pure culture of Pseudomonas sp strain CDT [J]. Journal of Environmental Sciences, 2017, 62: 60-67. doi: 10.1016/j.jes.2017.07.012 [38] HUANG Z L, JIANG L F, LU W S, et al. Elsholtzia splendens promotes phenanthrene and polychlorinated biphenyl degradation under Cu stress through enrichment of microbial degraders [J]. Journal of Hazardous Materials, 2022, 438: 129492. doi: 10.1016/j.jhazmat.2022.129492 -







 下载:
下载: